Композиции твердых растворов и их применение при сердечно-сосудистом заболевании - RU2674982C2
Код документа: RU2674982C2
Чертежи
Описание
Настоящая заявка с частичным продолжением в соответствии с § 120 раздела 35 Сводов законов США испрашивает приоритет обычной патентной заявки США 13/365824, поданной 3 февраля 2012 года, заявки с частичным продолжением, которая испрашивает приоритет патентной заявки PCT/GB2011/052115, поданной 31 октября 2011 года, международной патентной заявки, которая испрашивает приоритет заявки GB 1018289.7, поданной 29 октября 2010 года, и испрашивает приоритет патентной заявки США 13/365828, поданной 3 февраля 2012 года, и испрашивает приоритет заявки GB 1113730.4, поданной 10 августа 2011 года, заявки GB 1113729.6, поданной 10 августа 2011 года, заявки GB 1113728.8, поданной 10 августа 2011 года, и заявки GB 1101937.9, поданной 4 февраля 2011 года, и эта заявка с частичным продолжением в соответствии с § 119 раздела 35 Сводов законов США испрашивает приоритет предварительной патентной заявки США 61/752309, поданной 14 февраля 2013 года, и предварительной патентной заявки США 61/752356, поданной 14 января 2013 года, содержание каждой из которых включено в настоящий документ посредством ссылки во всей своей полноте.
Липиды образуют обширную группу природных гидрофобных или амфифильных молекул, которые включают жирные кислоты, глицеролипиды, глицерофосфолипиды, сфинголипиды, сахаролипиды и поликетиды, стероидные липиды и пренольные липиды. Основными биологическими функциями липидов являются накопление энергии, участие в качестве структурных компонентов в формировании клеточных мембран и в качестве важных сигнальных молекул в клеточной сигнализации. В связи с этими фундаментальными функциями липидов, все клетки используют липиды и зависят от них. В одном процессе, предназначенном для транспортировки липидов в клетки, принимают участие аполипопротеины. Аполипопротеины представляют собой белки, которые связывают липиды с образованием липопротеинов, которые являются средствами для транспортировки липидов, в том числе триглицеридов и холестерина, через лимфатическую и кровеносную систему. Липидные компоненты липопротеинов сами по себе не растворимы в воде. Однако в силу их амфипатических свойств, аполипопротеины и другие амфипатические молекулы (такие как, например, фосфолипиды) могут окружать липиды, создавая частицу липопротеина, которая сама по себе растворима в воде и, в результате этого, может переноситься путем циркуляции жидкостей на основе воды, то есть крови и лимфы и других подобных жидкостей организма.
Существуют пять основных групп липопротеиновых частиц, и плотность липопротеина и тип аполипопротеинов, которые липопротеин содержит, определяет поведение частицы и ее влияние на метаболизм. Хиломикроны представляют собой самые крупные липопротеиновые частицы, и эти частицы переносят триглицериды из кишечного тракта в печень, скелетные мышцы и жировую ткань. Частицы липопротеина очень низкой плотности (VLDL) представляют собой крупный обогащенный триглицеридом липопротеин, секретируемый печенью, который транспортирует триглицериды в жировую ткань и мышцы. Липопротеиновые частицы третьей группы представляют собой частицы липопротеина средней плотности (IDL), промежуточного вида между VLDL и липопротеина низкой плотности (LDL). Частицы IDL образуются, когда липопротеинлипаза удаляет триглицериды из частиц VLDL в капиллярах и возвращает эти более мелкие частицы в кровоток. Частицы IDL теряют большую часть их триглицеридов, но они сохраняют холестериловые эфиры. Некоторые из частиц IDL быстро захватываются печенью, другие остаются в кровотоке, где они подвергаются последующему гидролизу триглицеридов и превращаются в LDL. Частицы LDL переносят холестерин из печени в клетки организма, где эти частицы связывают рецепторы LDL, которые затем эндоцитозируются в форму везикул посредством образования ямок, окаймленных клатрином. После сбрасывания каймы из клатрина, везикулы наконец доставляют LDL к лизосомам, где эфиры холестерина гидролизуются. Последняя группа липопротеиновых частиц представляет собой частицы липопротеина высокой плотности (HDL), которые собирают холестерин из тканей организма и доставляют его обратно в печень.
Высокие уровни липидов, например, холестерина, и/или липопротеиновых частиц, например, VLDL, IDL, и/или LDL, могут оказывать вредные воздействия на сердечно-сосудистую систему. Например, в качестве главного внеклеточного переносчика холестерина, LDL играет важную физиологическую роль в функции клеток и регуляции метаболических путей. Клетки имеют сложные механизмы обратной связи, которые обеспечивают соответствующее снабжение холестерином и предотвращают его избыточное накопление в крови. Однако при патологических состояниях, например, при гиперлипидемии, окислительном стрессе и/или генетических нарушениях, специфические компоненты LDL окисляются или же модифицируются, в результате чего транспорт холестерина с помощью такого модифицированного LDL отклоняется от его физиологических мишеней, и он накапливается в крови.
Одним последствием этого накопления является отложение больших количеств холестерина и/или LDL на стенках кровеносных сосудов, которое вызывает ответную воспалительную реакцию. В ответ на это воспаление, моноциты крови прилипают к эндотелию, мигрируют в субэндотелиальное пространство и дифференцируются в макрофаги. Макрофаги, в свою очередь, поглощают отложения холестерина и модифицированный LDL в результате фагоцитоза с помощью фагоцитарных рецептором, которые отличаются от рецепторов LDL. Однако только адаптивных механизмов, опосредованных макрофагами, не достаточно для переработки неконтролируемого отложения холестерина и/или LDL, наблюдаемого при патологических состояниях. В результате, загруженные липидами макрофаги превращаются в "пенистые клетки" или "пенящиеся клетки", имеющие фенотип M1. Как осаждение холестерина/LDL, так и сопутствующие опосредованные пенистыми клетками провоспалительные ответные реакции на стенках кровеносных сосудах, приводят к развитию атеросклеротических поражений. При отсутствии лечения, это накопление липидов и провоспалительная ответная реакция приводит к прогрессированию поражений, которые в конечном итоге приводят к сердечно-сосудистому заболеванию.
Другим последствием значительного накопления холестерина/LDL в крови является образование агрегатов LDL или агломератов LDL. Обладая высокой молекулярной массой, агломераты LDL инициируют воспалительную реакцию таким же образом, как ее вызывают патогены, такие как вирусы или бактерии. Воспалительная реакция запускает процесс поглощения агломератов макрофагами, который превращает эти клетки в пенистые клетки, имеющие фенотип M1, и высвобождение молекул, индуцирующих воспаление. И снова, при отсутствии лечения, накопление липидов и ответная провоспалительная реакция могут приводить к сердечно-сосудистому заболеванию.
Попытки лечения сердечно-сосудистого заболевания путем контролирования уровней липидов и/или липопротеинов в крови привели к ограниченному успеху. Например, несмотря на то, что введение статинов снижает риск возникновения сердечно-сосудистых заболеваний у ряда индивидуумов, тем не менее, эти терапевтические соединения не снижают уровень триглицеридов. В этом случае, индивидуумам с риском возникновения сердечно-сосудистых заболеваний, которые характеризуются опасными высокими уровнями триглицеридов, могут быть введены терапевтические соединения другого класса, называемые фибратами. Однако, несмотря на то, что фибраты снижают уровень триглицеридов и LDL, тем не менее, они не влияют на уровень HDL, липопротеиновую частицу, по поводу которой известно, что она препятствует возникновению сердечно-сосудистого заболевания. И наконец, комбинированные терапии с применением статинов и фибратов, несмотря на то, что они являются эффективными, тем не менее, вызывают значительное увеличение риска возникновения миопатии и рабдомиолиза, и, поэтому, могут применяться только при очень тщательным медицинском наблюдении. Следовательно, с учетом этих проблем, существует явная необходимость в улучшенных соединениях и композициях для применения при лечении сердечно-сосудистых заболеваний, в том числе заболеваний, связанных с высоким уровнем липидов и/или липопротеинов.
В настоящем изобретении раскрываются фармацевтические композиции твердых растворов. Описанные в изобретении фармацевтические композиции приготавливают способом, который дает возможность получить систему доставки липид-адъювант, позволяющую доставить терапевтическое соединение, обладающее активностью в отношении модулирования уровней липидов и/или липопротеинов, таким образом, чтобы оно оказывало более эффективное терапевтическое действие при лечении сердечно-сосудистого заболевания.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Аспекты настоящего изобретения раскрывают, помимо всего прочего, фармацевтическую композицию твердого раствора, включающую терапевтическое соединение, один или более твердых при комнатной температуре липидов. Раскрытая в изобретении фармацевтическая композиция твердого раствора может дополнительно включать один или более жидких при комнатной температуре липидов, один или более стабилизаторов, один или более нейтрализаторов или любую их комбинацию. Терапевтическое соединение может обладать активностью по нормализации уровней липидов.
Другие аспекты настоящего изобретения раскрывают, помимо всего прочего, способ приготовления раскрытой в изобретении фармацевтической композиции твердого раствора. Раскрытый в изобретении способ включает стадии a) контактирования раскрытого в изобретении терапевтического соединения с одним или более жидкими при комнатной температуре липидами при условиях, которые способствуют растворению терапевтического соединения в липидах; и b) контактирования раствора соединение/липид с одним или более твердыми при комнатной температуре липидами при условиях, которые способствуют образованию композиции твердого раствора. В аспектах этого способа, для того чтобы получить раствор, применяют нагревания для растворения терапевтического соединения в одном или более жидких при комнатной температуре липидах. В других аспектах этого способа, стадия (a) включает контактирование раскрытого в изобретении терапевтического соединения с одним или более жидкими при комнатной температуре липидами и/или одним или более стабилизаторами и/или одним или более нейтрализаторами при условиях, которые способствуют растворению терапевтического соединения в липидах.
Другие аспекты настоящего изобретения раскрывают способ лечения индивидуума, страдающего сердечно-сосудистым заболеванием, где способ включает стадию введения индивидууму, если он в этом нуждается, раскрытую в изобретении фармацевтическую композицию твердого раствора, где введение приводит в результате к уменьшению интенсивности симптома, связанного с сердечно-сосудистым заболеванием, вследствие чего происходит лечение индивидуума.
Другие аспекты настоящего изобретения раскрывают применение раскрытой в изобретении фармацевтической композиции твердого раствора в производстве лекарственного препарата для лечения сердечно-сосудистого заболевания.
Другие аспекты настоящего изобретения раскрывают описанную в изобретении фармацевтическую композицию твердого раствора для применения при лечении сердечно-сосудистого заболевания.
Другие аспекты настоящего изобретения раскрывают применение раскрытой в изобретении фармацевтической композиции твердого раствора для лечения сердечно-сосудистого заболевания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
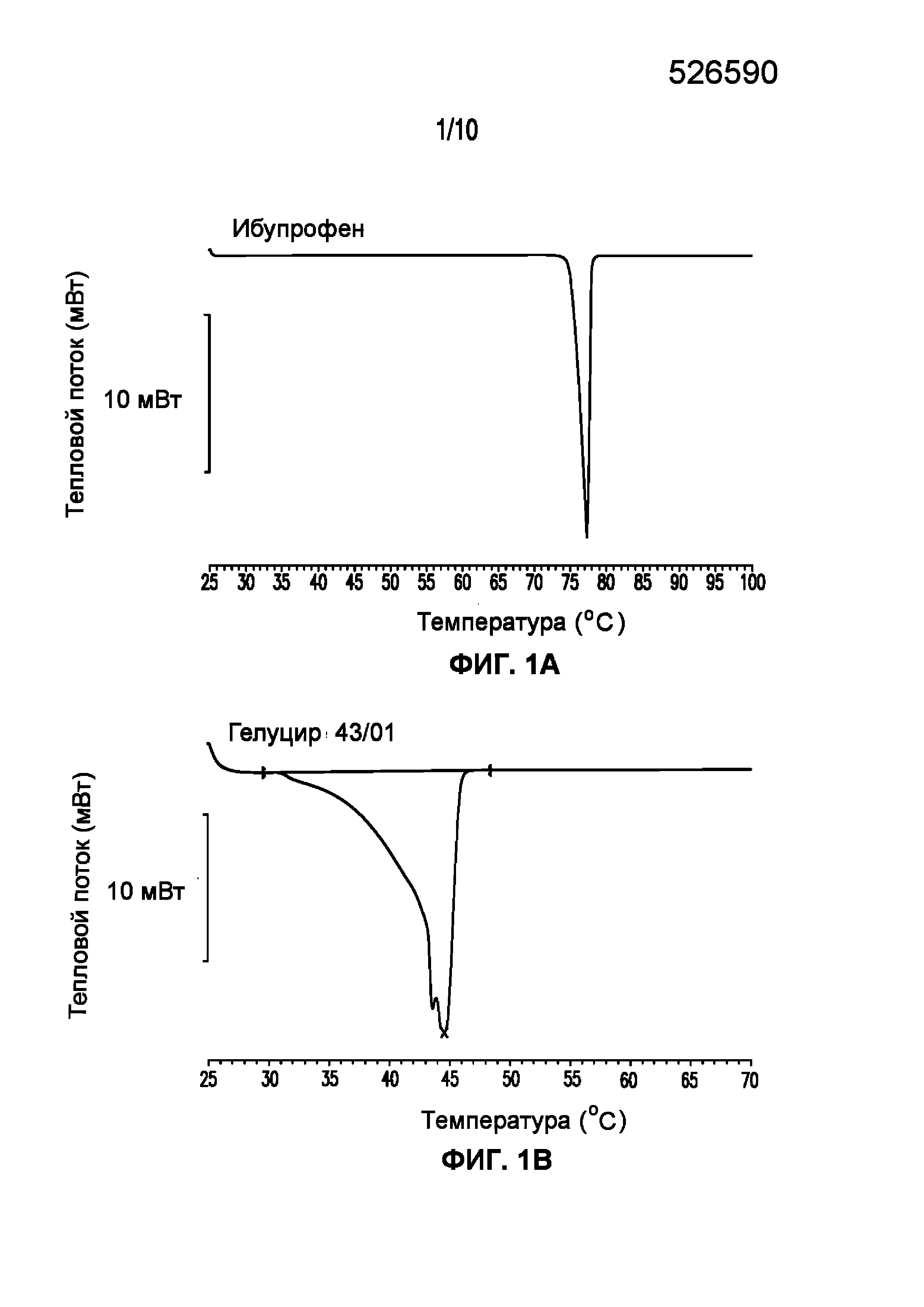
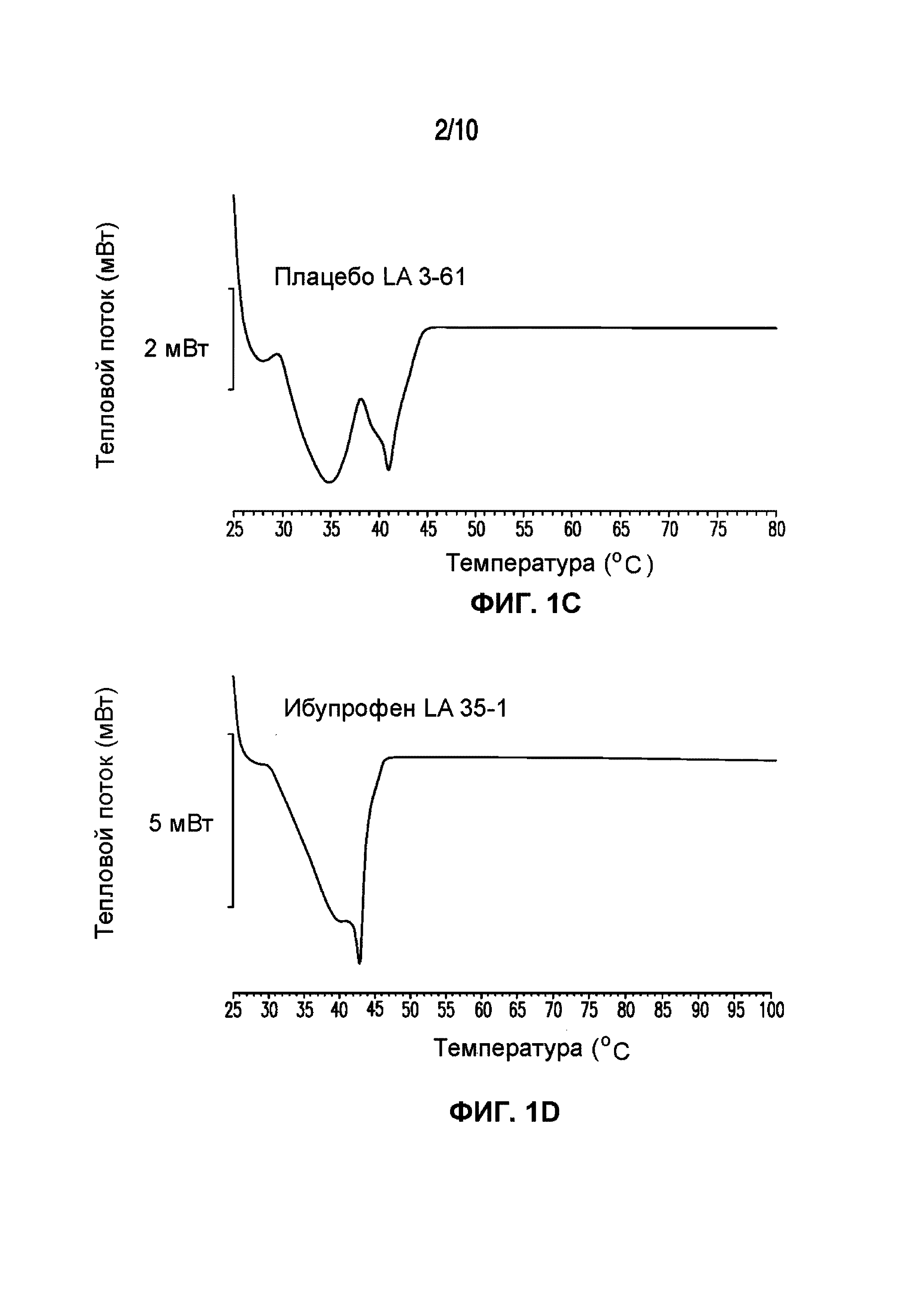
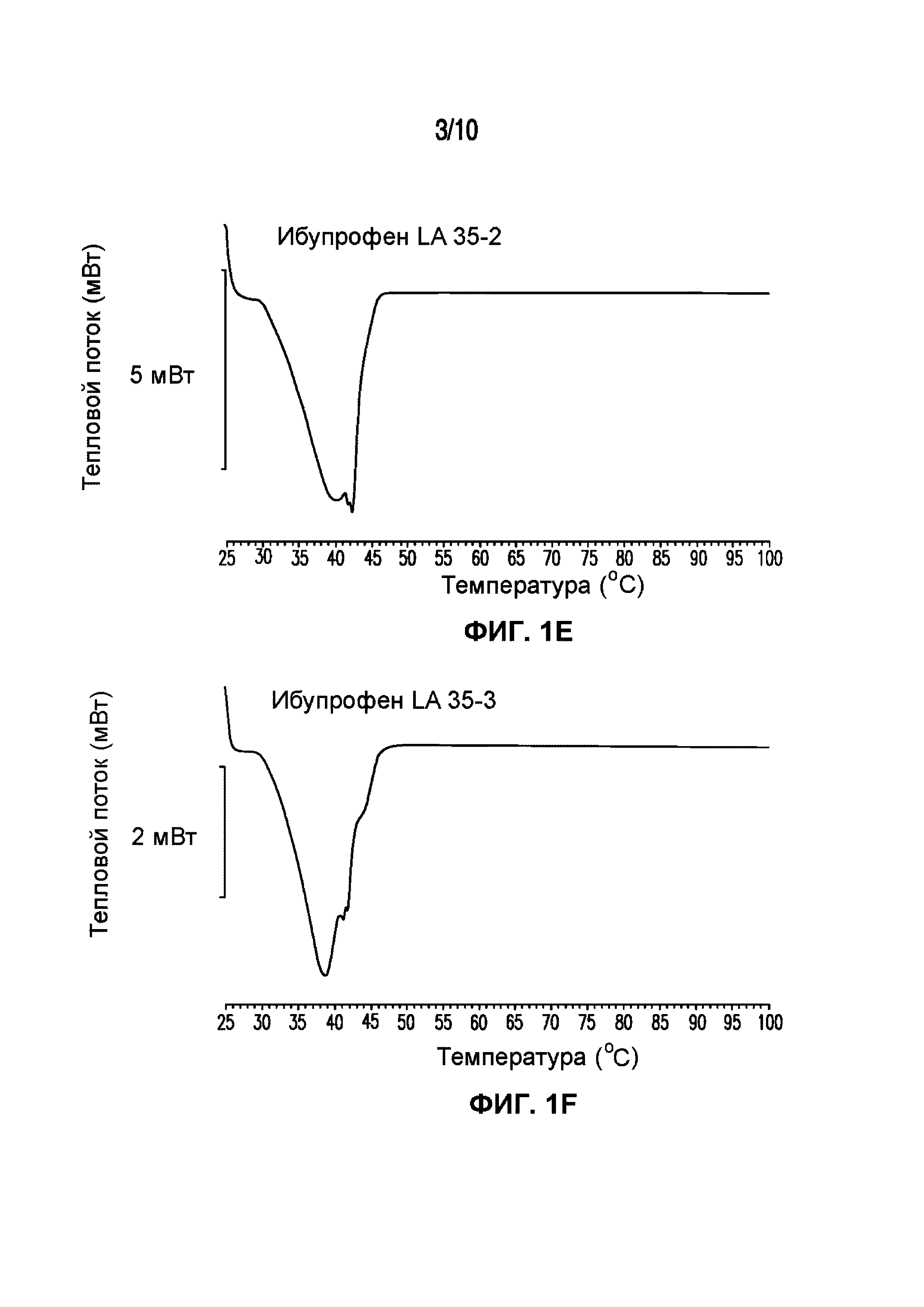
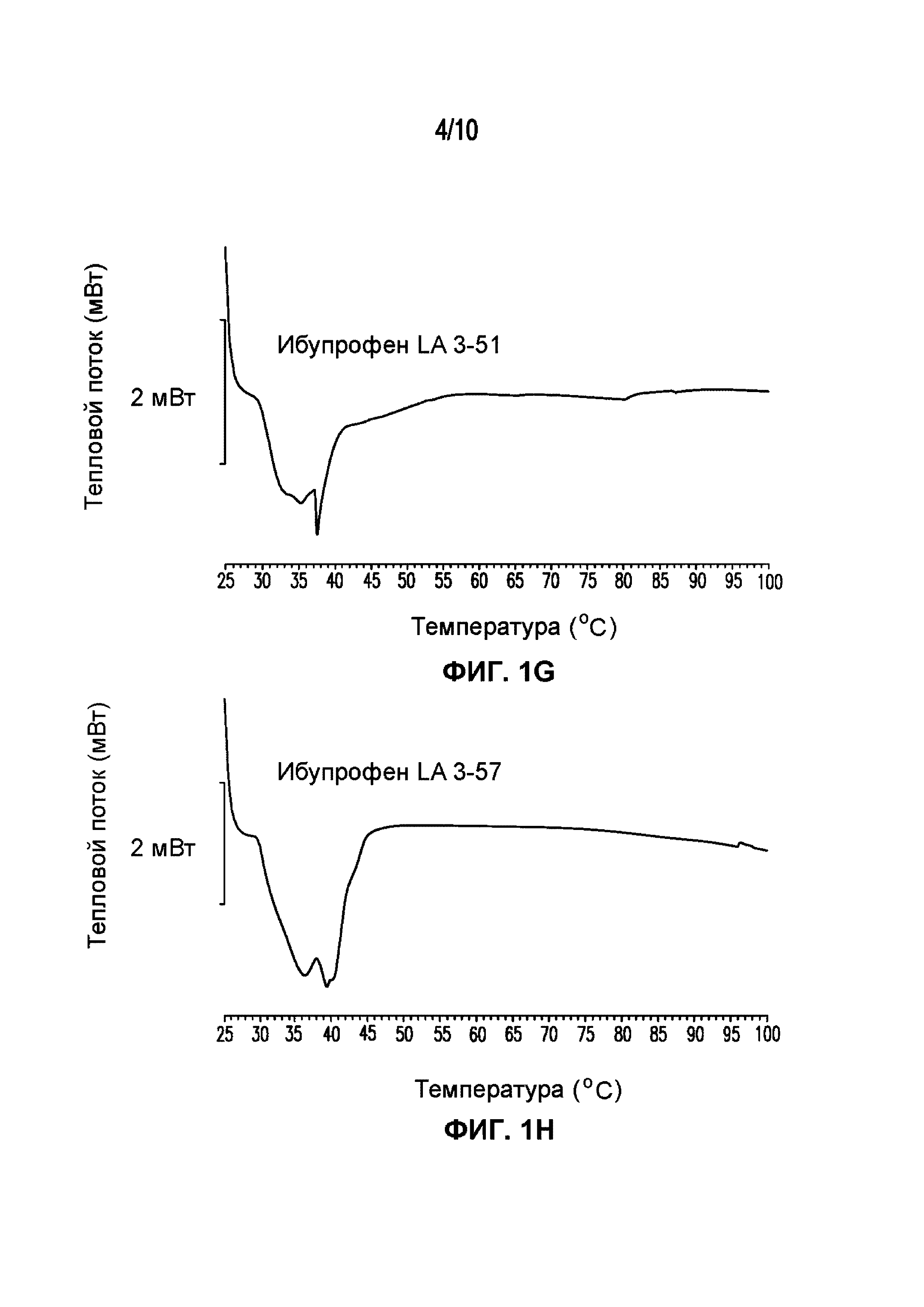
На фигуре 1 представлены кривые дифференциальной сканирующей калориметрии (ДСК) раскрытых в изобретении композиций твердых растворов, включающих ибупрофен. Фигура 1A представляет собой кривую ДСК отдельно взятого ибупрофена, характеризующегося температурой плавления в диапазоне от 75°C до 78°C; фигура 1B представляет собой кривую ДСК отдельно взятого GELUCIE® 43/01, характеризующегося температурой плавления в диапазоне от 41°C до 45°C; фигура 1С представляет собой кривую ДСК среды, включающей GELUCIE® 43/01, MAISINE® 35-1 и ПЭГ 400, характеризующейся температурой плавления в диапазоне от 32°C до 38°C и от 41°C до 45°C; фигура 1D представляет собой кривую ДСК композиции ибупрофена LA 35-1, характеризующейся температурой плавления в диапазоне от 32°C до 44°C; фигура 1E представляет собой кривую ДСК композиции ибупрофена LA 35-2, характеризующейся температурой плавления в диапазоне от 32°C до 43°C; фигура 1F представляет собой кривую ДСК композиции ибупрофена LA 35-1, характеризующейся температурой плавления в диапазоне от 32°C до 42°C; фигура 1G представляет собой кривую ДСК композиции ибупрофена LA 35-1, характеризующейся температурой плавления в диапазоне от 32°C до 38°C; фигура 1H представляет собой кривую ДСК композиции ибупрофена LA 35-1, характеризующейся температурой плавления в диапазоне от 32°C до 42°C.
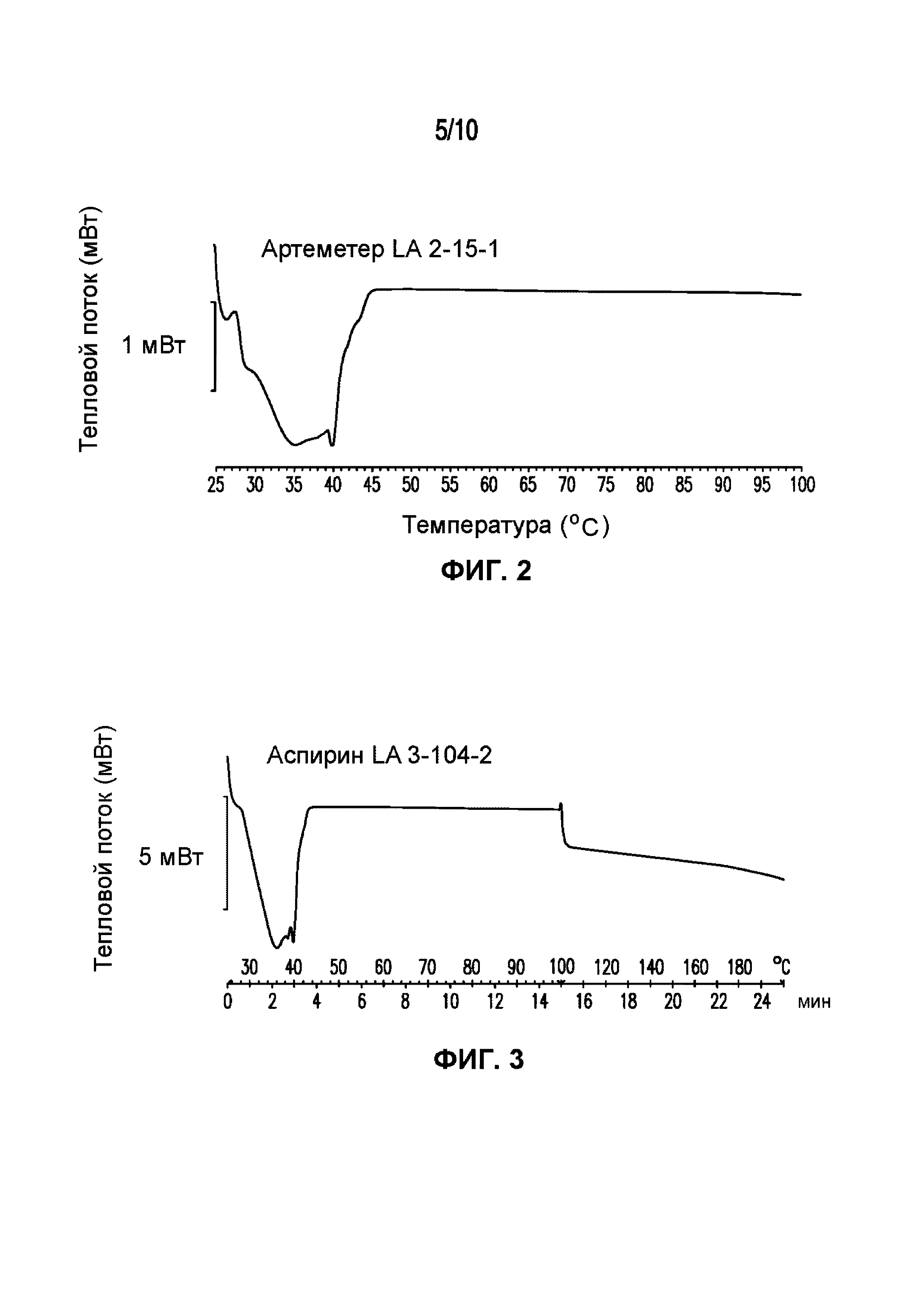
На фигуре 2 представлена кривая ДСК композиции артеметера LA 2-15-1, характеризующейся температурой плавления в диапазоне от 35°C до 40°C.
На фигуре 3 представлена кривая ДСК композиции аспирина LA 3-86-3, характеризующейся температурой плавления в диапазоне от 35°C до 40°C.
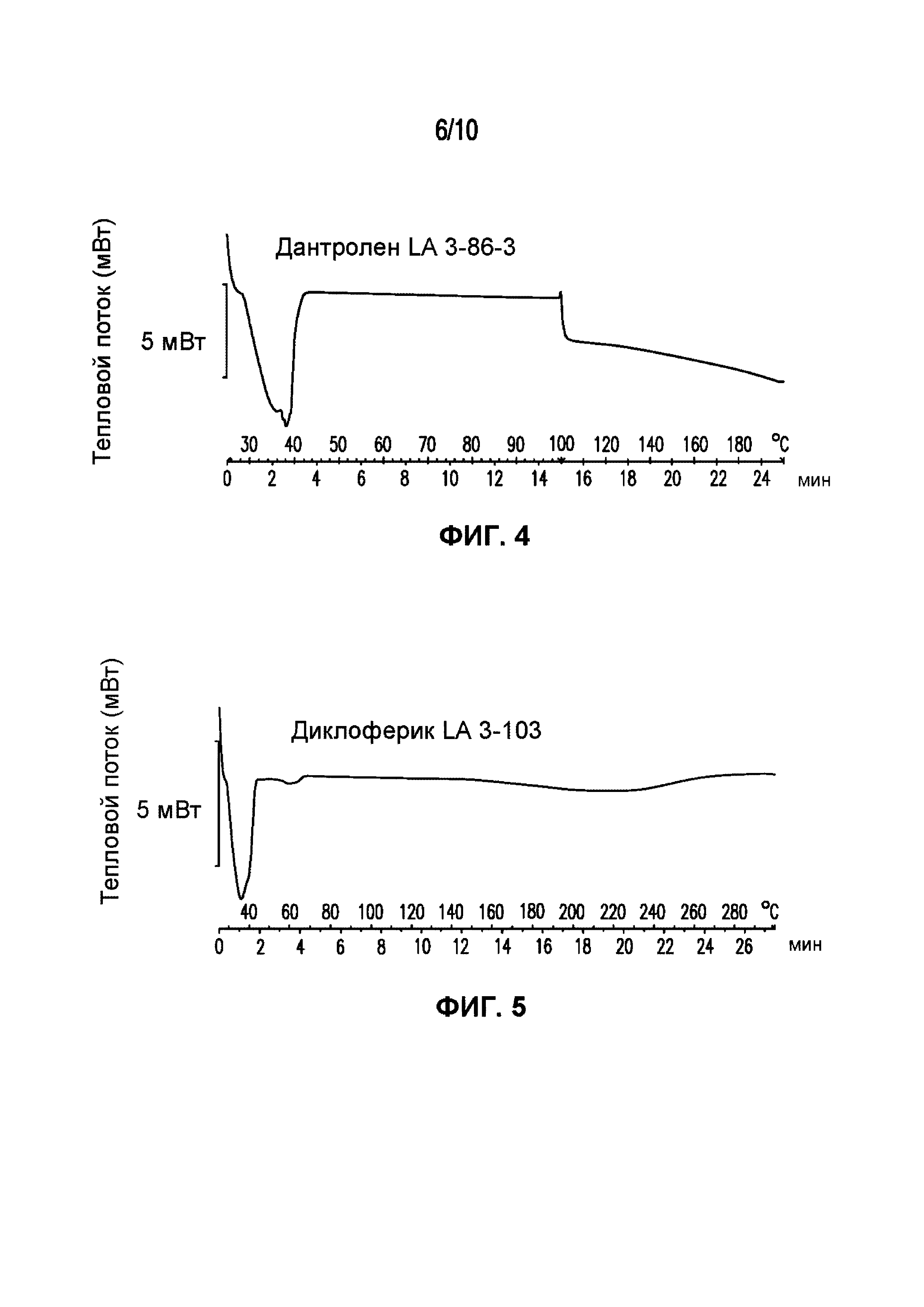
На фигуре 4 представлена кривая ДСК композиции дантролена LA 3-104-2, характеризующейся температурой плавления в диапазоне от 34°C до 39°C.
На фигуре 5 представлена кривая ДСК композиции диклофенака LA 3-103, характеризующейся температурой плавления в диапазоне от 35°C до 40°C.
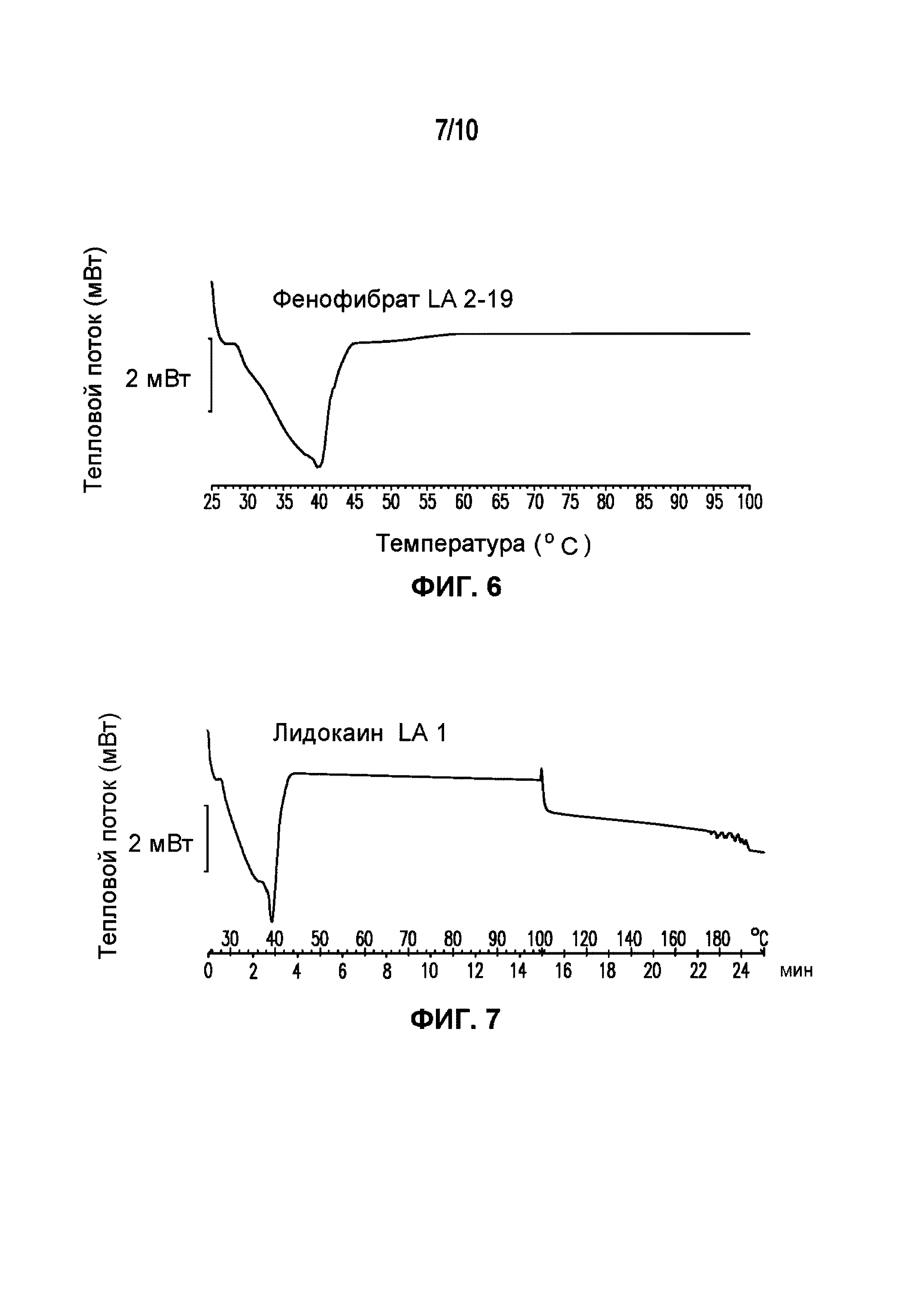
На фигуре 6 представлена кривая ДСК композиции фенофибрата LA 2-19, характеризующейся температурой плавления в диапазоне от 34°C до 39°C.
На фигуре 7 представлена кривая ДСК композиции лидокаина LA 3-101-2, характеризующейся температурой плавления в диапазоне от 34°C до 40°C.
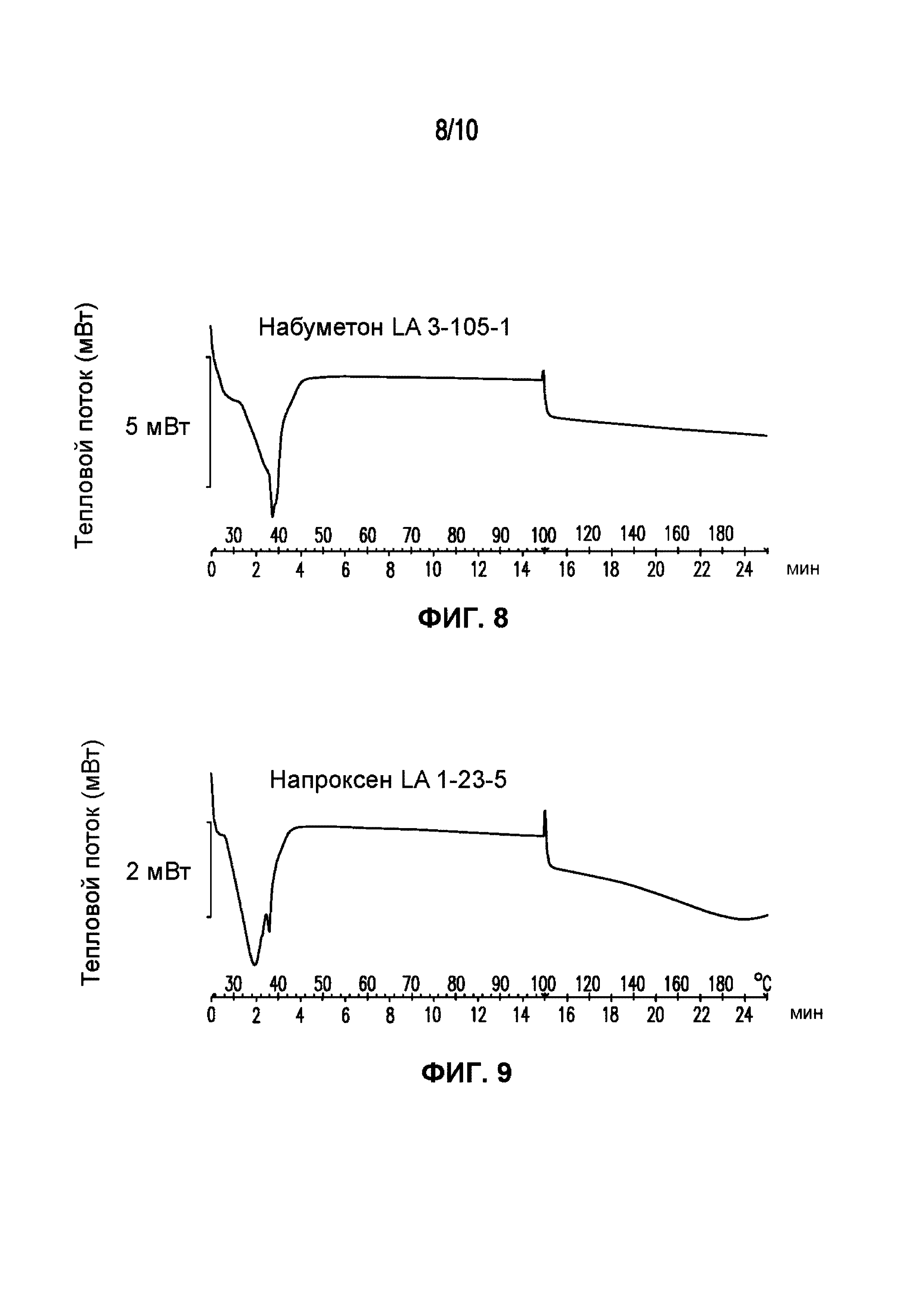
На фигуре 8 представлена кривая ДСК композиции набуметона LA 3-105-1, характеризующейся температурой плавления в диапазоне от 35°C до 40°C.
На фигуре 9 представлена кривая ДСК композиции напроксена LA 1-23-5, характеризующейся температурой плавления в диапазоне от 30°C до 39°C.
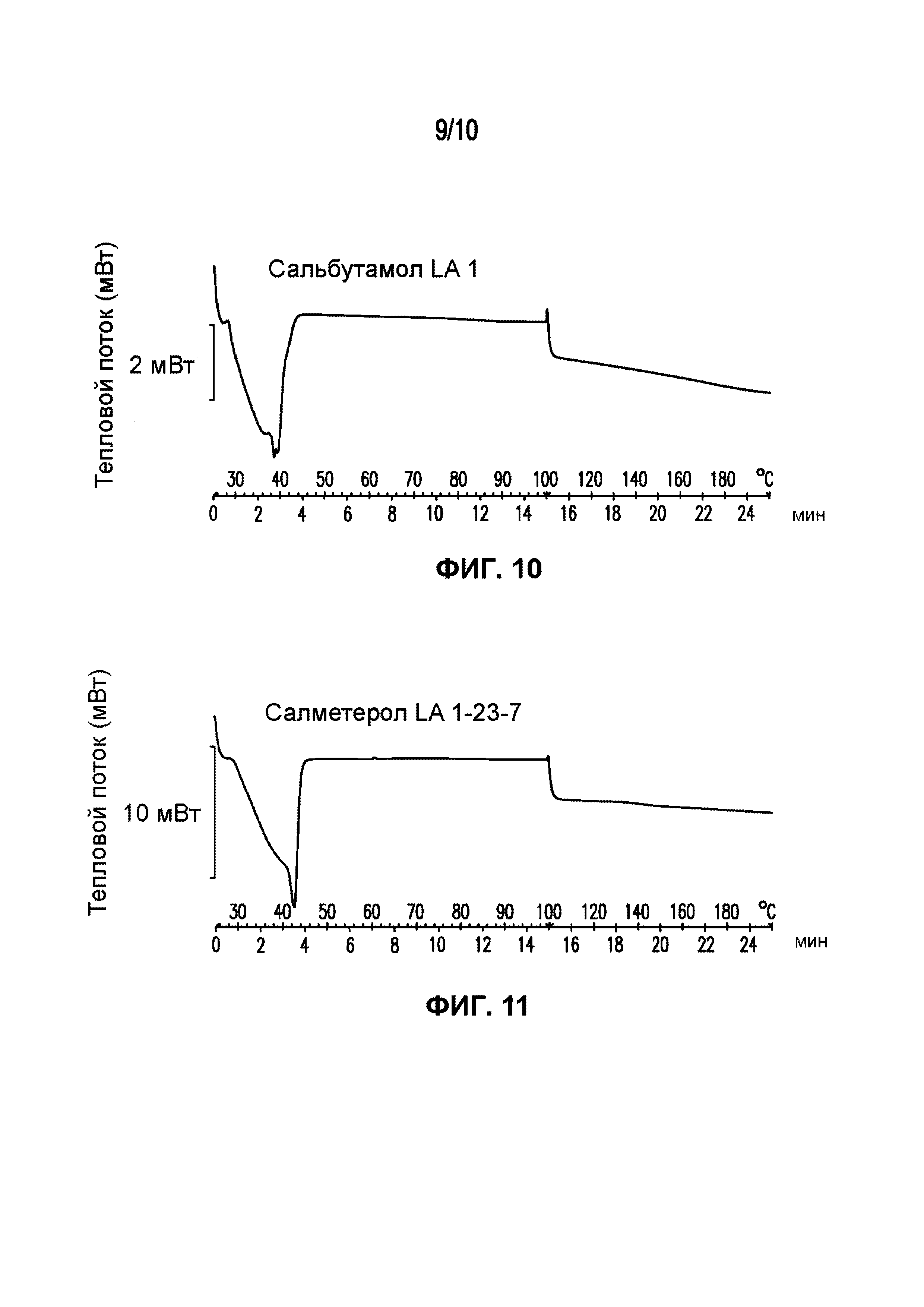
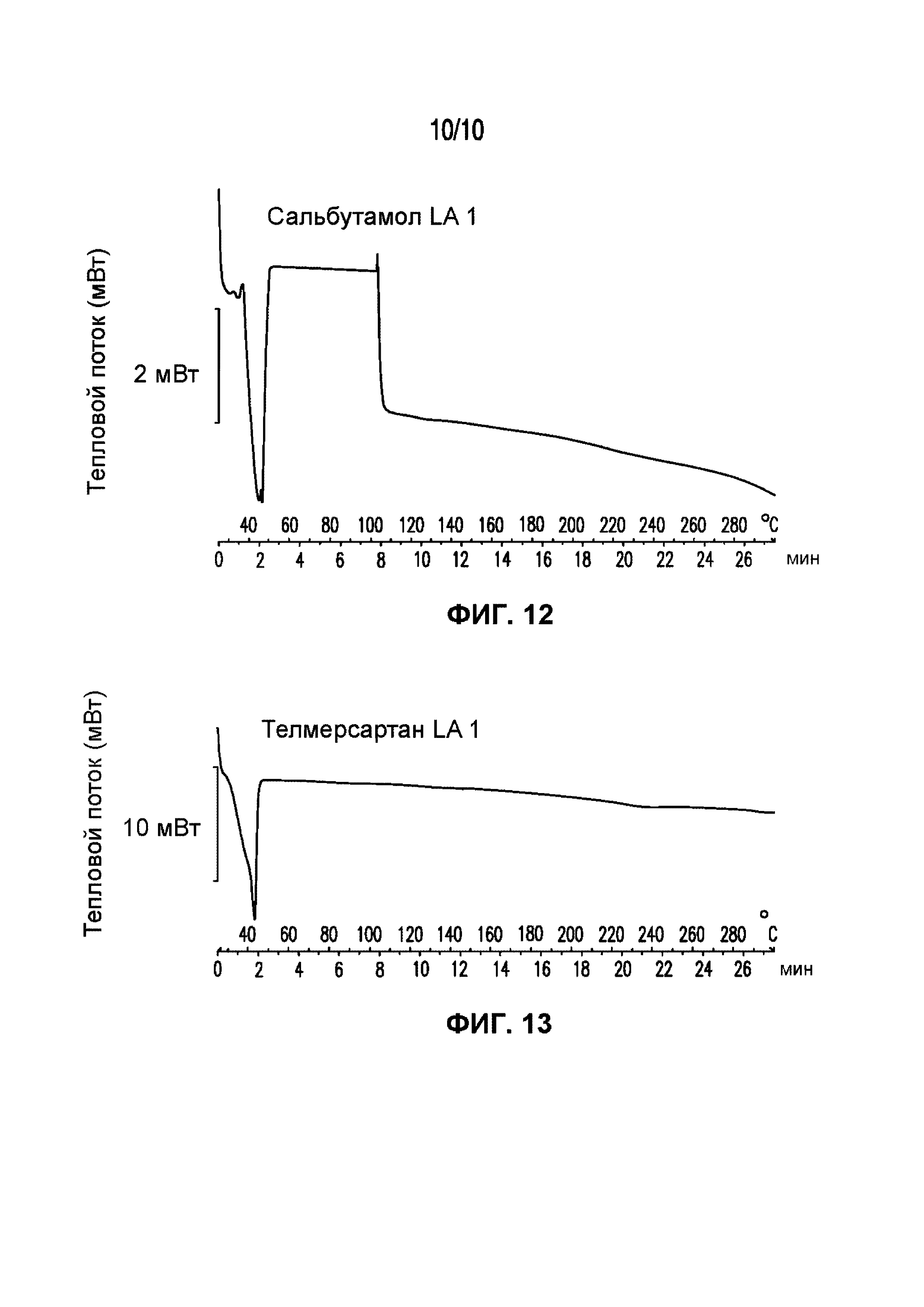
На фигуре 10 представлена кривая ДСК композиции сальбутамола LA 1, характеризующейся температурой плавления в диапазоне от 32°C до 40°C.
На фигуре 11 представлена кривая ДСК композиции салметерола LA 1-23-7, характеризующейся температурой плавления в диапазоне от 34°C до 43°C.
На фигуре 12 представлена кривая ДСК композиции симвастатина LA 3-83-3, характеризующейся температурой плавления в диапазоне от 32°C до 43°C.
На фигуре 13 представлена кривая ДСК композиции телмисартана LA 1, характеризующейся температурой плавления в диапазоне от 34°C до 43°C.
ОПИСАНИЕ
Настоящее изобретение раскрывает композиции твердых растворов, применяемых для получения лекарственных форм большого числа терапевтических соединений. Композиции твердых растворов представляют собой твердые кристаллические вещества, включающие матрицу из материала растворителя (который может быть твердым при нормальных температурах) и растворенные вещества, молекулы которых расположены случайным образом и не в упорядоченном положении. Раскрытые в изобретении фармацевтические композиции твердых растворов выполняют функцию системы доставки, которая позволяет более эффективно доставить или таргетировать раскрытое в изобретение терапевтическое соединение в конкретный тип клеток, ткань, орган или область тела способом, который более эффективно нормализует уровни липидов. Это модулирование позволяет улучшить результаты лечения сердечно-сосудистого заболевания.
Например, раскрытая в изобретении фармацевтическая композиция может облегчить доставку раскрытого в изобретении терапевтического соединения в макрофаги. Макрофаги существуют на пересечении двух фундаментальных путей, являясь главными клетками в иммунной системе, а также в липидном метаболизме. Что касается иммунной системы, то большинство патогенов имеют компонент поверхности, содержащий липид, который макрофаг распознает и затем поглощает. Один возможный механизм, который позволяет достигать этого селективного поиска тканей-мишеней, заключается в том, что раскрытые в изобретении фармацевтические композиции могут предназначаться для использования преимуществ активности хиломикронов. Хиломикроны представляют собой относительно крупные липопротеиновые частицы, имеющие диаметр от 75 нм до 1200 нм. Включая в себя триглицериды (85-92%), фосфолипиды (6-12%), холестерин (1-3%) и аполипопротеины (1-2%), хиломикроны переносят липиды пищи из кишечника в другие места в организме. Хиломикроны представляют собой одну из пяти основных групп липопротеинов, при этом другие группы образуют VLDL, IDL, липопротеины низкой плотности (LDL), липопротеины высокой плотности (HDL), которые позволяют жирам и холестерину передвигаться внутри раствора на водной основе кровотока.
В процессе пищеварения, жирные кислоты и холестерин подвергаются обработке в желудочно-кишечном тракте в результате воздействия панкреатических соков, включающих липазы, и эмульгированию с помощью солей желчных кислот с образованием мицелл. Эти мицеллы обеспечивают абсорбцию липида в виде свободных жирных кислот абсорбирующими клетками тонкого кишечника, называемыми энтероцитами. В результате попадания в энтероциты, триглицериды и холестерин объединяются в образующиеся хиломикроны. Образующиеся хиломикроны состоят в основном из триглицеридов (85%) и содержат некоторое количество холестерина и холестериновых эфиров. Основной компонент аполипопротеина представляет собой аполипопротеин B-48 (APOB48). Эти образующиеся хиломикроны высвобождаются в результате экзоцитоза из энтероцитов в млечные капилляры, лимфатические сосуды, берущие начало в ворсинках тонкого кишечника, и затем секретируются в кровоток в месте соединения грудного лимфатического протока с левой подключичной веной.
При циркуляции в лимфе и крови, хиломикроны обмениваются компонентами с HDL. HDL служит донором аполипопротеина C-II (APOC2) и аполипопротеина E (APOE) для образующегося хиломикрона и таким образом превращает его в зрелый хиломикрон (часто называемый просто "хиломикроном"). APOC2 является кофактором активности липопротеинлипазы (LPL). Как только запасы триглицеридов распределены, хиломикрон возвращает APOC2 в HDL (но сохраняет APOE), и в результате становится остаточным хиломикроном, имеющим в этот момент размер только 30-50 нм. APOB48 и APOE имеют важное значение для идентификации остаточного хиломикрона в печени при эндоцитозе и распаде на липопротеины (VLDL, LDL и HDL). Эти липопротеины подвергаются обработке и хранятся компетентными клетками, включающими, например, гепациты, адипоциты и макрофаги. Таким образом, не приводя в качестве доказательства какую-либо теорию, тем не менее, можно предположить, что при пероральном введении, раскрытая в изобретении фармацевтическая композиция может превращаться в мицеллу при нахождении в желудочно-кишечном тракте, абсорбироваться энтероцитами и объединяться в возникающие хиломикроны, оставаться связанной с остаточными хиломикронами, захваченными печенью, и, в конечном счете, может загружаться в макрофаги, которые присутствуют в воспаленных тканях.
В качестве другого примера, раскрытая в изобретении фармацевтическая композиция может облегчать доставку раскрытого в изобретении терапевтического соединения в дендритные клетки. Один возможный механизм, который позволяет достигать этого селективного поиска тканей-мишеней, заключается в том, что раскрытые в изобретении фармацевтические композиции могут предназначаться для использования преимуществ эндоцитической/фагоцитической активности дендритных клеток. Дендритные клетки представляют собой иммуноциты, образующие часть иммунной системы млекопитающего. Главной функцией дендритных клеток является переработка антигенного материала и передача его на поверхность для других клеток иммунной системы. Таким образом, дендритные клетки функционируют как антиген представляющие клетки, которые действуют в качестве мессенджеров между врожденным и приобретенным иммунитетом. Дендритные клетки присутствуют в тканях, находящихся в контакте с внешней средой, таких как, например, кожа (где существует специальный тип дендритных клеток, называемый клетками Лангерганса) и внутренняя поверхность носа, легких, желудка и кишечника. Эти клетки можно также обнаружить в незрелом состоянии в крови. После активации, они мигрируют в лимфатические узлы, где они взаимодействуют с Т-клетками и В-клетками и в результате инициируют и формируют адаптивную ответную иммунную реакцию. Известно, что дендритные клетки подвергают эндоцитозу и фагоцитозу липидные частицы в качестве части их процессов мониторинга состояния окружающей среды и представления антигена. Не приводя в качестве доказательства какую-либо теорию, тем не менее, можно предположить, что при местном или ингаляционном введении, раскрытая в изобретении фармацевтическая композиция может проникать в кожу или внутреннюю поверхность носа, легких, желудка и кишечника, подвергаться эндоцитозу/фагоцитозу под воздействием дендритных клеток и, в конечном счете, загружаться в Т-клетки и/или В-клетки, которые присутствуют в воспаленных тканях.
Помимо таргетированной доставки раскрытого в изобретении терапевтического соединения, раскрытая в изобретении фармацевтическая композиция твердого раствора обладает преимуществом, связанным с различными температурами плавления разнообразных используемых липидов. Путем подбора типов и количеств добавляемых липидов, может быть приготовлена раскрытая в изобретении фармацевтическая композиция, которая является практически твердым веществом при комнатной температуре, но плавится, когда ее температура достигает температуры человеческого тела, как в случае, например, после ее проглатывания. Получающаяся расплавленная композиция легко образует мицеллы, которые абсорбируются кишечником, объединяются в хиломикроны и, в конечном счете, абсорбируются макрофагами или поглощаются дендритными клетками, как описано выше.
Аспекты настоящего изобретения раскрывают, помимо прочего, композицию твердого раствора. Раскрытую в изобретении композицию твердого раствора обычно вводят в виде фармацевтически приемлемой композиции. Используемый в изобретении термин "фармацевтически приемлемая" относится к любому молекулярному образованию или композиции, которая не вызывает побочного, аллергического или другого неблагоприятного или нежелательного ответного действия при введении индивидууму. Используемый в изобретении термин "фармацевтически приемлемая композиция" является синонимом "фармацевтической композиции" и означает терапевтически эффективную концентрацию активного ингредиента, такого как, например, любого из раскрытых в изобретении терапевтических соединений. Раскрытую в изобретении фармацевтическую композицию применяют в медицинских и ветеринарных целях. Фармацевтическая композиция может быть введена индивидууму только сама по себе, или в комбинации с другими дополнительными активными ингредиентами, средствами, лекарственными средствами или гормонами.
Для того чтобы влиять на фармакодинамику раскрытого в изобретении терапевтического соединения, композиция твердого раствора должна обладать тремя характерными особенностями. Во-первых, по меньшей мере, один липид в композиции твердого раствора должен быть получен, по меньшей мере, из одной жирной кислоты, в которой длина углеродной цепи составляет более 12 и менее 24 углеродных атомов и, поэтому, она подходит для абсорбции на протяжении путей энтероцитов. Жирные кислоты с длиной цепи меньше чем C12-C24 не образуют матрицу липид-лекарственное средство, и, поэтому, лекарственное средство поглощается организмом в результате обычного процесса абсорбции. Жирные кислоты с длиной цепи больше чем C12-C24, хотя и образуют матрицы липид-лекарственное средство, но не могут быть абсорбированы, и лекарственное средство вымывается из композиции твердого раствора и удаляется из организма через желудочно-кишечный тракт.
Во-вторых, терапевтическое соединение само по себе должно обладать липофильностью, которая позволяет ему образовывать матрицу твердого раствора с C12-C24 липидом. Как будет указано ниже, эта липофильность может быть присущей для терапевтического соединения (составы растворимого в липиде лекарственного средства), или могут быть использованы некоторые добавки, которые позволяют получать широкий спектр растворимых в липиде лекарственных средств в матрице (составы лекарственного средства в форме свободной кислоты/свободного основания, составы солевой формы лекарственного средства и комбинированные составы лекарственного средства).
В-третьих, терапевтическое соединение само по себе должно влиять на биологию некоторых типов клеток, которые подвергают контакту с композицией твердого раствора с липид-адъювантными свойствами, и которые, в конце концов, циркулирует в организме. Такие структуры включают хиломикрон, частицы LDL и частицы HDL. Подвергаемые контактированию типы клеток могут включать макрофаги, дендритные клетки и липоциты и раковые клетки. Ткани, которые имеют высокое поверхностное содержание липидов, могут также быть преимущественными мишенями. Они включают нервные ткани и мозг.
Настоящее изобретение раскрывает четыре общих типа композиций твердых растворов, а именно: составы растворимого в липиде лекарственного средства, составы лекарственного средства в форме свободной кислоты/свободного основания, составы солевой формы лекарственного средства и комбинированные составы лекарственного средства. Композиции твердых растворов, приготовленные с использованием состава растворимого в липиде лекарственного средства, требуют только липидный компонент для введения раскрытого в изобретении терапевтического соединения в композицию твердого раствора. Не приводя в качестве доказательства какую-либо теорию, тем не менее, можно предположить, что растворимые в липидах лекарственные средства обычно будут растворяться в липиде при нагревании. При охлаждении, можно полагать, что липидный компонент и лекарственное средство будут образовывать матрицы липид-лекарственное средство, сформированные так, что лекарственное средство заключено в липидную оболочку. Так как имеют место только гидрофобные взаимодействия, то отсутствует упорядоченное расположение этих матриц липид-лекарственное средство, что приводит к композиции твердого раствора (то есть отсутствует кристаллизация в классическую твердую форму).
Обычно, в составе растворимого в липиде лекарственного средства используют терапевтические соединения, имеющие величину logP приблизительно 3,0 или более. Не ограничивающие примеры включают артемизинин, такой как артеэфир, артеметер, артемизинин, артесунат и дигидроартемизинин; фибрат, такой как безафибрат, ципрофибрат, клофибрат, фенофибрат и гемфиброзил; и статин, такой как аторвастатин, флувастатин, ловастатин, питавастатин, правастатин, розувастатин и симвастатин.
В составе растворимого в липиде лекарственного средства не используется или не требуется поверхностно-активное вещество. Кроме того, в составе растворимого в липиде лекарственного средства не используется или не требуется растворитель не на основе липида.
Композиции твердых растворов, приготовленных с использованием состава лекарственного средства в форме свободной кислоты/свободного основания, требуют наличия стабилизатора помимо липидного компонента для введения раскрытого в изобретении терапевтического соединения в композицию твердого раствора. Терапевтическое соединение в форме свободной кислоты или свободного основания может растворяться в липиде при нагревании, но при охлаждении до комнатной температуры будет кристаллизоваться с образованием классической твердой композиции. Это происходит из-за термодинамических свойства этих смесей сохранять на более низком уровне энергию твердой фазы. Для приготовления композиции твердого раствора необходимо добавлять стабилизатор для стабилизации лекарственного средства и предотвращения перехода твердого раствора в классическую твердую фазу при охлаждении. Не приводя в качестве доказательства какую-либо теорию, тем не менее, можно предположить, что стабилизатор заключает в оболочку матрицы липид-лекарственное средство при их образовании. Эта оболочка препятствует взаимодействиям между матрицами и тем самым предотвращает упорядочения, необходимые для образования кристаллической матрицы твердофазной композиции. По этой причине, переход в твердую фазу не происходит и образуется композиция твердого раствора. Таким образом, стабилизаторы представляют собой соединение, которое обеспечивает термодинамический барьер для перехода в классическую твердую фазу или пролонгирует этот переход в такой степени, что он не происходит. Примеры стабилизаторов включают жидкие полиэтиленгликоли, диметиловый эфир изосорбида, моноэтиловый эфир диэтиленгликоля (2-(2-этоксиэтокси)этанол), моногидраты спиртов.
Обычно, в составе лекарственного средства в форме свободной кислоты/свободного основания используют терапевтические соединения, имеющие величину logP от приблизительно 2,2 до приблизительно 3,0. Не ограничивающие примеры включают нестероидное противовоспалительное лекарственное средство (NSAID) и эфир аминобензойной кислоты. NSAID включает салицилатное производное, парааминофенольное производное, производное пропионовой кислоты, производное уксусной кислоты, производное эноловой кислоты (оксикам), производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (COX), селективный ингибитор циклооксигеназы 1 (COX 1), селективный ингибитор циклооксигеназы 2 (COX 2). Эфир аминобензойной кислоты включает амилокаин, бензокаин, бутакаин, бутамбен, хлорпрокаин, диметокаин, лидокаин, меприлкаин, метабутетамин, метабутоксикаин, ортокаин, прилокаин, пропоксикаин, прокаин (новокаин), проксиметакаин, ризокаин и тетракаин.
Композиции твердых растворов, приготовленных с использованием состава солевой формы лекарственного средства, требуют наличия нейтрализатора помимо липидного компонента для введения раскрытого в изобретении терапевтического соединения в композицию твердого раствора. Солевая форма терапевтического соединения может растворяться в липиде при нагревании, но при охлаждении до комнатной температуры будет кристаллизоваться с образованием классической твердой композиции. Это происходит из-за термодинамических свойства этих смесей сохранять на более низком уровне энергию твердой фазы. Для приготовления композиции твердого раствора необходимо добавлять нейтрализатор для нейтрализации солевой формы лекарственного средства и предотвращения перехода твердого раствора в классическую твердую фазу при охлаждении. Не приводя в качестве доказательства какую-либо теорию, тем не менее, можно предположить, что нейтрализатор удаляет заряды, присутствующие на солевых формах лекарственных средств. Эта нейтрализация препятствует ионным взаимодействиям между матрицами и тем самым предотвращает упорядочения, необходимые для образования кристаллической матрицы твердофазной композиции. По этой причине, переход в твердую фазу не происходит и образуется композиция твердого раствора. Таким образом, нейтрализаторы представляют собой соединение, которое обеспечивает термодинамический барьер для перехода в классическую твердую фазу или пролонгирует этот переход в такой степени, что он не происходит.
Нейтрализаторы включают жирные кислоты для лекарственных средств в форме солей присоединения основания и триэтиламин для лекарственных средств в форме солей присоединения кислоты. Степень нейтрализации зависит от количества нейтрализатора, добавляемого к составу. Для полной нейтрализации, к составу добавляют один эквивалент нейтрализатора. Для частичной нейтрализации, добавляют меньше одного эквивалента нейтрализатора. Частичная нейтрализация предпочтительна при приготовлении состава с замедленным высвобождением. После введения, часть лекарственного средства моментально становится доступной для организма (мгновенная биодоступность), в то время как биодоступность другой части замедляется до тех пор, пока эта часть не будет нейтрализована с помощью нейтрализатора. Нейтрализатор может быть также добавлен в избыточном количестве, то есть в количестве более чем один эквивалент. Кроме нейтрализации солевой формы лекарственного средства, избыточные количества нейтрализатора могут также позволять корректировать температуру плавления композиции твердого раствора.
Обычно, в составе солевой формы лекарственного средства используют терапевтические соединения, имеющие величину logP приблизительно 2,2 или менее. Не ограничивающие примеры включают антагонисты рецептора рианодина, такие как азумолен и дантролен; и антагонисты рецепторов ангиотензина II, такие как азилсартан, кандесартан, эпросартан, ирбесартан, лосартан, олмесартан, телмисартан и валсартан.
Композиции твердых растворов могут также включать различные комбинации растворимых в липиде лекарственных средств, лекарственных средств в форме свободной кислоты/свободного основания и солевых форм лекарственных средств. В зависимости от используемых лекарственных средств, такие составы, помимо липидного компонента и лекарственного средства, могут также включать стабилизатор, нейтрализатор или и тот и другой.
Аспекты настоящего изобретения раскрывают, помимо прочего, терапевтическое соединение. Терапевтическое соединение представляет собой соединение, которое оказывает фармакологическое действие или другое непосредственное действие при постановке диагноза, курсе лечения, уменьшении отрицательных последствий, терапии или предотвращении заболевания, или воздействует на структуру или любую функцию организма человека или животных. Раскрытое в изобретении терапевтическое соединение может быть использовано в форме фармацевтически приемлемой соли, сольвата или сольвата соли, например гидрохлорида. Кроме того, раскрытое в изобретении терапевтическое соединение может быть получено в виде рацематов или в виде индивидуальных энантиомеров, включающих R- или S-энантиомер. Так, раскрытое в изобретение терапевтическое соединение может включать только R-энантиомер, только S-энантиомер или комбинацию и R-энантиомера и S-энантиомера терапевтического соединения. Раскрытое в изобретении терапевтическое соединение обладает действием по нормализации уровней липидов. Используемый в изобретении термин "нормализует уровни липидов" относится к действию, которое снижает уровень липида или липопротеина, который является опасно высоким, до нормального или неопасного уровня, повышает уровень липида или липопротеина до уровня, который является благоприятным для индивидуума, или осуществляет и то и другое. Например, терапевтическое соединение, обладающее действием по нормализации уровней липидов может понизить уровень холестерина и/или LDL, который является опасно высоким, до нормального или неопасного уровня, повысить уровень HDL до уровня, который является благоприятным для индивидуума, или осуществить и то и другое.
Липидные и липопротеиновые нарушения являются обычным явлением для всех слоев населения, и их рассматривают в качестве поддающегося изменению фактора риска для сердечно-сосудистого заболевания, вследствие того, что они оказывают влияние на атеросклероз. В связи с тем, что в исследованиях было показано, что высокие уровни частиц LDL вызывают проблемы со здоровьем и сердечно-сосудистое заболевание, их часто в разговорной речи называют частицами "плохого холестерина". Это в отличие от частиц HDL, которые часто называют частицами "хорошего холестерина" или "здорового холестерина", так как высокие уровни HDL взаимосвязаны с нормальным состоянием сердечно-сосудистой системы. Считают, что высокие уровни HDL снижают уровни LDL благодаря действию в качестве поглотителя избыточных уровней триглицеридов в LDL.
В одном варианте осуществления, раскрытое в изобретении терапевтическое соединение обладает антигиперлипидемическим действием. В аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает антигиперлипидемическим действием, способным понижать уровни VLDL, IDL, LDL или их комбинации. В другом аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает антигиперлипидемическим действием, способным понижать уровни VLDL, IDL, LDL или их комбинации, например, по меньшей мере, на 10%, по меньшей мере, на 15%, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 35%, по меньшей мере, на 40%, по меньшей мере, на 45%, по меньшей мере, на 50%, по меньшей мере, на 55%, по меньшей мере, на 60%, по меньшей мере, на 65%, по меньшей мере, на 70%, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90% или, по меньшей мере, на 95%. В еще одних аспектах варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает антигиперлипидемическим действием, способным понижать уровни VLDL, IDL, LDL или их комбинации на величину в диапазоне, например, от приблизительно 10% до приблизительно 100%, от приблизительно 20% до приблизительно 100%, от приблизительно 30% до приблизительно 100%, от приблизительно 40% до приблизительно 100%, от приблизительно 50% до приблизительно 100%, от приблизительно 60% до приблизительно 100%, от приблизительно 70% до приблизительно 100%, от приблизительно 80% до приблизительно 100%, от приблизительно 10% до приблизительно 90%, от приблизительно 20% до приблизительно 90%, от приблизительно 30% до приблизительно 90%, от приблизительно 40% до приблизительно 90%, от приблизительно 50% до приблизительно 90%, от приблизительно 60% до приблизительно 90%, от приблизительно 70% до приблизительно 90%, от приблизительно 10% до приблизительно 80%, от приблизительно 20% до приблизительно 80%, от приблизительно 30% до приблизительно 80%, от приблизительно 40% до приблизительно 80%, от приблизительно 50% до приблизительно 80% или от приблизительно 60% до приблизительно 80%, от приблизительно 10% до приблизительно 70%, от приблизительно 20% до приблизительно 70%, от приблизительно 30% до приблизительно 70%, от приблизительно 40% до приблизительно 70% или от приблизительно 50% до приблизительно 70%.
В другом варианте осуществления, раскрытое в изобретение терапевтическое соединение повышает уровень HDL. В аспекте этого варианта осуществления, раскрытое в изобретение терапевтическое соединение повышает уровень HDL, например, по меньшей мере, на 2%, по меньшей мере, на 3%, по меньшей мере, на 10%, по меньшей мере, на 12%, по меньшей мере, на 15%, по меньшей мере, на 17%, по меньшей мере, на 20%, по меньшей мере, на 22%, по меньшей мере, на 25%, по меньшей мере, на 27%, по меньшей мере, на 30%, по меньшей мере, на 32%, по меньшей мере, на 35%, по меньшей мере, на 37%, по меньшей мере, на 40%, по меньшей мере, на 42%, по меньшей мере, на 45% или, по меньшей мере, на 47%. В еще одних аспектах варианта осуществления, раскрытое в изобретение терапевтическое соединение повышает уровень HDL на величину в диапазоне, например, от приблизительно 2% до приблизительно 100%, от приблизительно 10% до приблизительно 50%, от приблизительно 15% до приблизительно 50%, от приблизительно 20% до приблизительно 50%, от приблизительно 25% до приблизительно 50%, от приблизительно 30% до приблизительно 50%, от приблизительно 35% до приблизительно 50%, от приблизительно 40% до приблизительно 50%, от приблизительно 2% до приблизительно 45%, от приблизительно 10% до приблизительно 45%, от приблизительно 15% до приблизительно 45%, от приблизительно 20% до приблизительно 45%, от приблизительно 25% до приблизительно 45%, от приблизительно 30% до приблизительно 45%, от приблизительно 35% до приблизительно 45%, от приблизительно 2% до приблизительно 40%, от приблизительно 10% до приблизительно 40%, от приблизительно 15% до приблизительно 40%, от приблизительно 20% до приблизительно 40%, от приблизительно 25% до приблизительно 40%, или от приблизительно 30% до приблизительно 40%, от приблизительно 2% до приблизительно 35%, от приблизительно 10% до приблизительно 35%, от приблизительно 15% до приблизительно 35%, от приблизительно 20% до приблизительно 35% или от приблизительно 25% до приблизительно 35%.
При отложении холестерина и/или липопротеинов, таких как LDL, на стенках кровеносных сосудов, может быть вызвана ответная иммунная реакция, которая далее приводит к хронической воспалительной реакции. Такое хроническое воспаление может, в конечном счете, ослаблять и повреждать кровеносные сосуды, вызывая их перфорацию. Таким образом, одним важным результатом модулирования уровней липида или липопротеина является уменьшение или устранение хронического воспаления. Простагландины опосредуют местную ответную воспалительную реакцию и принимают участие во всех воспалительных функциях через воздействие на простагландиновые рецепторы и опосредование сигнального пути воспаления, включающего хемотаксис (макрофаги, нейтрофилы и эозинофилы), вазодилатацию и алгезию. Однако PG-опосредованная ответная воспалительная реакция является самоограничивающейся (разрешающейся). Главным фактором разрешения является простагландин, называемый 15dPGJ2, который представляет собой эндогенный агонист сигнального пути гамма-рецептора, активируемого пролифератором пероксисом (PPAR-γ). PPARγ сигнальный путь 1) индуцирует апоптоз макрофагов M1, вследствие чего снижаются уровни Th1 провоспалительных цитокинов и 2) промотирует дифференцировку моноцитов в макрофаги M2. Макрофаги M2 продуцируют и высвобождают Th2 провоспалительные цитокины.
В одном варианте осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно снижать уровни индуцирующего воспаление простагландина. В другом аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно снижать уровни индуцирующего воспаление простагландина, высвобождающегося из сенсорного нейрона, например, по меньшей мере, на 10%, по меньшей мере, на 15%, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 35%, по меньшей мере, на 40%, по меньшей мере, на 45%, по меньшей мере, на 50%, по меньшей мере, на 55%, по меньшей мере, на 60%, по меньшей мере, на 65%, по меньшей мере, на 70%, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90% или, по меньшей мере, на 95%. В еще одних аспектах варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно снижать уровни индуцирующего воспаление простагландина, высвобождающегося из сенсорного нейрона, на величину в диапазоне, например, от приблизительно 10% до приблизительно 100%, от приблизительно 20% до приблизительно 100%, от приблизительно 30% до приблизительно 100%, от приблизительно 40% до приблизительно 100%, от приблизительно 50% до приблизительно 100%, от приблизительно 60% до приблизительно 100%, от приблизительно 70% до приблизительно 100%, от приблизительно 80% до приблизительно 100%, от приблизительно 10% до приблизительно 90%, от приблизительно 20% до приблизительно 90%, от приблизительно 30% до приблизительно 90%, от приблизительно 40% до приблизительно 90%, от приблизительно 50% до приблизительно 90%, от приблизительно 60% до приблизительно 90%, от приблизительно 70% до приблизительно 90%, от приблизительно 10% до приблизительно 80%, от приблизительно 20% до приблизительно 80%, от приблизительно 30% до приблизительно 80%, от приблизительно 40% до приблизительно 80%, от приблизительно 50% до приблизительно 80%, или от приблизительно 60% до приблизительно 80%, от приблизительно 10% до приблизительно 70%, от приблизительно 20% до приблизительно 70%, от приблизительно 30% до приблизительно 70%, от приблизительно 40% до приблизительно 70% или от приблизительно 50% до приблизительно 70%.
В другом варианте осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, практически аналогичным действию 15dPGJ2. В аспектах этого варианта осуществления, раскрытое в изобретение терапевтическое соединение имеет противовоспалительную активность, которая составляет, например, по меньшей мере, 5%, по меньшей мере, 15%, по меньшей мере, 25%, по меньшей мере, 50%, по меньшей мере, 55%, по меньшей мере, 60%, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90% или, по меньшей мере, 95% от активности, наблюдаемой для 15dPGJ2. В другом аспекте этого варианта осуществления, раскрытое в изобретение терапевтическое соединение имеет противовоспалительную активность, которая составляет величину в диапазоне, например, от приблизительно 5% до приблизительно 100%, от приблизительно 50% до приблизительно 100%, от приблизительно 60% до приблизительно 100%, от приблизительно 70% до приблизительно 100%, от приблизительно 80% до приблизительно 100%, от приблизительно 25% до приблизительно 90%, от приблизительно 50% до приблизительно 90%, от приблизительно 60% до приблизительно 90%, от приблизительно 70% до приблизительно 90%, от приблизительно 80% до приблизительно 90%, от приблизительно 25% до приблизительно 80%, от приблизительно 50% до приблизительно 80%, от приблизительно 60% до приблизительно 80%, от приблизительно 70% до приблизительно 80%, от приблизительно 25% до приблизительно 70%, от приблизительно 50% до приблизительно 70%, от приблизительно 25% до приблизительно 60%, от приблизительно 50% до приблизительно 60%, или от приблизительно 25% до приблизительно 50% от активности, наблюдаемой для 15dPGJ2.
Рецепторы, активируемые пролифератором пероксисом (PPAR) представляют собой группу белков ядерных рецепторов, которые выполняют функции факторов транскрипции, регулирующих экспрессию генов. Известно, что все PPAR гетеродимеризуются с ретиноидным X рецептором (RXR) и связываются со специфическими участками на ДНК генов-мишеней, называемыми элементами гормонального ответа пролифератора пероксисом (PPRE). PPAR играют важную роль в регуляции клеточной дифференцировки, развития и метаболизма (углевода, липида, белка), и в онкогенезе у высших организмов. Семейство включает трех представителей, PPAR-α, PPAR-γ и PPAR-δ (также называемый, как PPAR-β). PPAR-α экспрессируется в печени, почках, сердце, мышцах, жировой ткани, а также в других тканях. PPAR-δ экспрессируется во многих тканях, но значительно в мозге, жировой ткани и коже. PPAR-γ включает три альтернативно-сплайсированные формы, каждую с различным характером экспрессии. PPAR-γ1 экспрессируется практически во всех тканях, включая сердце, мышцы, толстую кишку, почки, поджелудочную железу и селезенку. PPAR-γ2 экспрессируется в основном в жировой ткани. PPAR-γ3 экспрессируется в макрофагах, толстом кишечнике и белой жировой ткани. Эндогенные лиганды для PPAR включают свободные жирные кислоты и эйкозаноиды. PPAR-γ активируется PGJ2 (простагландином), в то время как PPAR-α активируется лейкотриеном B4.
Считают, что начальное продуцирование частиц HDL печенью инициируется в результате активации сигнальных путей PPAR. Поэтому, агонисты PPAR, которые таргетированы на типы клеток, вовлеченные в процесс превращения липидов (макрофаги, адипоциты и гепатоциты) через нормальный механизм абсорбции липидов, будут селективно повышать уровни благоприятного HDL и тем самым нормализовать липидные профили крови и оказывать лечебное действие на сердечно-сосудистое заболевание.
В одном варианте осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно стимулировать все сигнальные пути PPAR. Такое терапевтическое соединение включает пан-агонист PPAR. В других вариантах осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое стимулирует один или два сигнальных пути PPAR. Такое терапевтическое соединение включает селективный агонист PPAR.
В другом варианте осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно стимулировать сигнальный путь PPAR-α. В аспектах этого варианта осуществления, раскрытое в изобретении терапевтическое соединение стимулирует сигнальный путь PPAR-α, например, по меньшей мере, на 5%, по меньшей мере, на 15%, по меньшей мере, на 25%, по меньшей мере, на 50%, по меньшей мере, на 60%, по меньшей мере, на 70%, по меньшей мере, на 80% или, по меньшей мере, на 90%. В другом аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение стимулирует сигнальный путь PPAR-α на величину в диапазоне, например, от приблизительно 5% до приблизительно 100%, от приблизительно 50% до приблизительно 100%, от приблизительно 60% до приблизительно 100%, от приблизительно 70% до приблизительно 100%, от приблизительно 80% до приблизительно 100%, от приблизительно 25% до приблизительно 90%, от приблизительно 50% до приблизительно 90%, от приблизительно 60% до приблизительно 90%, от приблизительно 70% до приблизительно 90%, от приблизительно 80% до приблизительно 90%, от приблизительно 25% до приблизительно 80%, от приблизительно 50% до приблизительно 80%, от приблизительно 60% до приблизительно 80%, от приблизительно 70% до приблизительно 80%, от приблизительно 25% до приблизительно 70%, от приблизительно 50% до приблизительно 70%, от приблизительно 25% до приблизительно 60%, от приблизительно 50% до приблизительно 60% или от приблизительно 25% до приблизительно 50%.
В другом варианте осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно стимулировать сигнальный путь PPAR-δ. В аспектах этого варианта осуществления, раскрытое в изобретении терапевтическое соединение стимулирует сигнальный путь PPAR-δ, например, по меньшей мере, на 5%, по меньшей мере, на 15%, по меньшей мере, на 25%, по меньшей мере, на 50%, по меньшей мере, на 60%, по меньшей мере, на 70%, по меньшей мере, на 80% или, по меньшей мере, на 90%. В другом аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение стимулирует сигнальный путь PPAR-δ на величину в диапазоне, например, от приблизительно 5% до приблизительно 100%, от приблизительно 50% до приблизительно 100%, от приблизительно 60% до приблизительно 100%, от приблизительно 70% до приблизительно 100%, от приблизительно 80% до приблизительно 100%, от приблизительно 25% до приблизительно 90%, от приблизительно 50% до приблизительно 90%, от приблизительно 60% до приблизительно 90%, от приблизительно 70% до приблизительно 90%, от приблизительно 80% до приблизительно 90%, от приблизительно 25% до приблизительно 80%, от приблизительно 50% до приблизительно 80%, от приблизительно 60% до приблизительно 80%, от приблизительно 70% до приблизительно 80%, от приблизительно 25% до приблизительно 70%, от приблизительно 50% до приблизительно 70%, от приблизительно 25% до приблизительно 60%, от приблизительно 50% до приблизительно 60% или от приблизительно 25% до приблизительно 50%.
В другом варианте осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно стимулировать сигнальный путь PPARγ. Раскрытые в изобретении терапевтические соединения способны связываться со всеми изоформами PPAR-γ, или способны селективно связываться с одним из PPAR-γ1, PPAR-γ2, PPAR-γ3, или с любой их комбинацией из двух. В аспектах этого варианта осуществления, раскрытое в изобретении терапевтическое соединение стимулирует сигнальный путь PPARγ, например, по меньшей мере, на 5%, по меньшей мере, на 15%, по меньшей мере, на 25%, по меньшей мере, на 50%, по меньшей мере, на 60%, по меньшей мере, на 70%, по меньшей мере, на 80% или, по меньшей мере, на 90%. В другом аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение стимулирует сигнальный путь PPARγ на величину в диапазоне, например, от приблизительно 5% до приблизительно 100%, от приблизительно 50% до приблизительно 100%, от приблизительно 60% до приблизительно 100%, от приблизительно 70% до приблизительно 100%, от приблизительно 80% до приблизительно 100%, от приблизительно 25% до приблизительно 90%, от приблизительно 50% до приблизительно 90%, от приблизительно 60% до приблизительно 90%, от приблизительно 70% до приблизительно 90%, от приблизительно 80% до приблизительно 90%, от приблизительно 25% до приблизительно 80%, от приблизительно 50% до приблизительно 80%, от приблизительно 60% до приблизительно 80%, от приблизительно 70% до приблизительно 80%, от приблизительно 25% до приблизительно 70%, от приблизительно 50% до приблизительно 70%, от приблизительно 25% до приблизительно 60%, от приблизительно 50% до приблизительно 60% или от приблизительно 25% до приблизительно 50%.
Макрофаги активируются и поляризуются в отличающиеся фенотипы, экспрессирующие уникальные поверхностные молекулы клетки и секретирующие дискретные наборы цитокинов и хемокинов. Классический фенотип M1 поддерживает провоспалительные Th1 ответы, обусловленные цитокинами, такими как, например, интерлейкин-6 (IL-6), IL-12 и IL-23, в то время как альтернативный фенотип M2 обычно поддерживает противовоспалительные процессы, обусловленные IL-10. Клетки M2 могут быть дополнительно классифицированы на субпопуляции M2a, M2b, и M2c, на основе типа стимуляции и последующей экспрессии поверхностных молекул и цитокинов.
В еще одном варианте осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно промотировать разрешение фенотипического изменения M1 в M2. В аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно индуцировать апоптоз макрофагов M1. В другом аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно промотировать дифференцировку макрофагов M2. В еще одном аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно индуцировать апоптоз макрофагов M1 и промотировать дифференцировку макрофагов M2.
В еще одном варианте осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно модулировать Th1 и Th2 цитокины. В аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно снижать уровни интерферон-гамма (IFNγ), фактора некроза опухолей альфа (TNF-α), IL-12 или их комбинации, высвобождаемых из клеток Th1. В другом аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно снижать уровни IFNγ, TNF-α, IL-12 или их комбинации, высвобождаемых из клеток Th1, например, по меньшей мере, на 10%, по меньшей мере, на 20%, по меньшей мере, на 30%, по меньшей мере, на 40%, по меньшей мере, на 50%, по меньшей мере, на 60%, по меньшей мере, на 70%, по меньшей мере, на 80% или, по меньшей мере, на 90%. В еще одних аспектах варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно снижать уровни IFNγ, TNF-α, IL-12 или их комбинации, высвобождаемых из клеток Th1, на величину в диапазоне, например, от приблизительно 5% до приблизительно 100%, от приблизительно 10% до приблизительно 100%, от приблизительно 20% до приблизительно 100%, от приблизительно 30% до приблизительно 100%, от приблизительно 40% до приблизительно 100%, от приблизительно 50% до приблизительно 100%, от приблизительно 60% до приблизительно 100%, от приблизительно 70% до приблизительно 100%, от приблизительно 80% до приблизительно 100%, от приблизительно 10% до приблизительно 90%, от приблизительно 20% до приблизительно 90%, от приблизительно 30% до приблизительно 90%, от приблизительно 40% до приблизительно 90%, от приблизительно 50% до приблизительно 90%, от приблизительно 60% до приблизительно 90%, от приблизительно 70% до приблизительно 90%, от приблизительно 10% до приблизительно 80%, от приблизительно 20% до приблизительно 80%, от приблизительно 30% до приблизительно 80%, от приблизительно 40% до приблизительно 80%, от приблизительно 50% до приблизительно 80% или от приблизительно 60% до приблизительно 80%, от приблизительно 10% до приблизительно 70%, от приблизительно 20% до приблизительно 70%, от приблизительно 30% до приблизительно 70%, от приблизительно 40% до приблизительно 70% или от приблизительно 50% до приблизительно 70%.
В другом аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно повышать уровни IL-10, высвобождаемого из клеток Th2. В другом аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно повышать уровни IL-10, высвобождаемого из клеток Th2, например, по меньшей мере, на 10%, по меньшей мере, на 15%, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 35%, по меньшей мере, на 40%, по меньшей мере, на 45%, по меньшей мере, на 50%, по меньшей мере, на 55%, по меньшей мере, на 60%, по меньшей мере, на 65%, по меньшей мере, на 70%, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90% или, по меньшей мере, на 95%. В еще одних аспектах варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно повышать уровни IL-10, высвобождаемого из клеток Th2, на величину в диапазоне, например, от приблизительно 5% до приблизительно 100%, от приблизительно 10% до приблизительно 100%, от приблизительно 20% до приблизительно 100%, от приблизительно 30% до приблизительно 100%, от приблизительно 40% до приблизительно 100%, от приблизительно 50% до приблизительно 100%, от приблизительно 60% до приблизительно 100%, от приблизительно 70% до приблизительно 100%, от приблизительно 80% до приблизительно 100%, от приблизительно 10% до приблизительно 90%, от приблизительно 20% до приблизительно 90%, от приблизительно 30% до приблизительно 90%, от приблизительно 40% до приблизительно 90%, от приблизительно 50% до приблизительно 90%, от приблизительно 60% до приблизительно 90%, от приблизительно 70% до приблизительно 90%, от приблизительно 10% до приблизительно 80%, от приблизительно 20% до приблизительно 80%, от приблизительно 30% до приблизительно 80%, от приблизительно 40% до приблизительно 80%, от приблизительно 50% до приблизительно 80%, или от приблизительно 60% до приблизительно 80%, от приблизительно 10% до приблизительно 70%, от приблизительно 20% до приблизительно 70%, от приблизительно 30% до приблизительно 70%, от приблизительно 40% до приблизительно 70% или от приблизительно 50% до приблизительно 70%.
В другом аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно снижать уровни IFNγ, TNF-α, IL-12 или их комбинации, высвобождаемых из клеток Th1, и повышать уровни IL-10, высвобождаемого из клеток Th2. В другом аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно снижать уровни IFNγ, TNF-α, IL-12 или их комбинации, высвобождаемых из клеток Th1, например, по меньшей мере, на 10%, по меньшей мере, на 15%, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 35%, по меньшей мере, на 40%, по меньшей мере, на 45%, по меньшей мере, на 50%, по меньшей мере, на 55%, по меньшей мере, на 60%, по меньшей мере, на 65%, по меньшей мере, на 70%, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90% или, по меньшей мере, на 95%, и способно повышать уровни IL-10, высвобождаемого из клеток Th2, например, по меньшей мере, на 10%, по меньшей мере, на 15%, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 35%, по меньшей мере, на 40%, по меньшей мере, на 45%, по меньшей мере, на 50%, по меньшей мере, на 55%, по меньшей мере, на 60%, по меньшей мере, на 65%, по меньшей мере, на 70%, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90% или, по меньшей мере, на 95%. В еще одних аспектах варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно снижать уровни IFNγ, TNF-α, IL-12 или их комбинации, высвобождаемых из клеток Th1, на величину в диапазоне, например, от приблизительно 5% до приблизительно 100%, от приблизительно 10% до приблизительно 100%, от приблизительно 20% до приблизительно 100%, от приблизительно 30% до приблизительно 100%, от приблизительно 40% до приблизительно 100%, от приблизительно 50% до приблизительно 100%, от приблизительно 60% до приблизительно 100%, от приблизительно 70% до приблизительно 100%, от приблизительно 80% до приблизительно 100%, от приблизительно 10% до приблизительно 90%, от приблизительно 20% до приблизительно 90%, от приблизительно 30% до приблизительно 90%, от приблизительно 40% до приблизительно 90%, от приблизительно 50% до приблизительно 90%, от приблизительно 60% до приблизительно 90%, от приблизительно 70% до приблизительно 90%, от приблизительно 10% до приблизительно 80%, от приблизительно 20% до приблизительно 80%, от приблизительно 30% до приблизительно 80%, от приблизительно 40% до приблизительно 80%, от приблизительно 50% до приблизительно 80%, или от приблизительно 60% до приблизительно 80%, от приблизительно 10% до приблизительно 70%, от приблизительно 20% до приблизительно 70%, от приблизительно 30% до приблизительно 70%, от приблизительно 40% до приблизительно 70% или от приблизительно 50% до приблизительно 70%, и способно повышать уровни IL-10, высвобождаемого из клеток Th2, на величину в диапазоне, например, от приблизительно 10% до приблизительно 100%, от приблизительно 20% до приблизительно 100%, от приблизительно 30% до приблизительно 100%, от приблизительно 40% до приблизительно 100%, от приблизительно 50% до приблизительно 100%, от приблизительно 60% до приблизительно 100%, от приблизительно 70% до приблизительно 100%, от приблизительно 80% до приблизительно 100%, от приблизительно 10% до приблизительно 90%, от приблизительно 20% до приблизительно 90%, от приблизительно 30% до приблизительно 90%, от приблизительно 40% до приблизительно 90%, от приблизительно 50% до приблизительно 90%, от приблизительно 60% до приблизительно 90%, от приблизительно 70% до приблизительно 90%, от приблизительно 10% до приблизительно 80%, от приблизительно 20% до приблизительно 80%, от приблизительно 30% до приблизительно 80%, от приблизительно 40% до приблизительно 80%, от приблизительно 50% до приблизительно 80%, или от приблизительно 60% до приблизительно 80%, от приблизительно 10% до приблизительно 70%, от приблизительно 20% до приблизительно 70%, от приблизительно 30% до приблизительно 70%, от приблизительно 40% до приблизительно 70% или от приблизительно 50% до приблизительно 70%.
В другом варианте осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно снижать уровни индуцирующих воспаление молекул. В аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно снижать уровни вещества P (SP), генетически родственного кальцитонину пептида (CGRP), глутамата или их комбинации. В другом аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно снижать уровни SP, CGRP, глутамата или их комбинации, высвобождаемых из сенсорного нейрона, например, по меньшей мере, на 10%, по меньшей мере, на 15%, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 35%, по меньшей мере, на 40%, по меньшей мере, на 45%, по меньшей мере, на 50%, по меньшей мере, на 55%, по меньшей мере, на 60%, по меньшей мере, на 65%, по меньшей мере, на 70%, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90% или, по меньшей мере, на 95%. В еще одних аспектах варианта осуществления, раскрытое в изобретении терапевтическое соединение обладает противовоспалительным действием, которое способно снижать уровни SP, CGRP, глутамата или их комбинации, высвобождаемых из сенсорного нейрона, на величину в диапазоне, например, от приблизительно 10% до приблизительно 100%, от приблизительно 20% до приблизительно 100%, от приблизительно 30% до приблизительно 100%, от приблизительно 40% до приблизительно 100%, от приблизительно 50% до приблизительно 100%, от приблизительно 60% до приблизительно 100%, от приблизительно 70% до приблизительно 100%, от приблизительно 80% до приблизительно 100%, от приблизительно 10% до приблизительно 90%, от приблизительно 20% до приблизительно 90%, от приблизительно 30% до приблизительно 90%, от приблизительно 40% до приблизительно 90%, от приблизительно 50% до приблизительно 90%, от приблизительно 60% до приблизительно 90%, от приблизительно 70% до приблизительно 90%, от приблизительно 10% до приблизительно 80%, от приблизительно 20% до приблизительно 80%, от приблизительно 30% до приблизительно 80%, от приблизительно 40% до приблизительно 80%, от приблизительно 50% до приблизительно 80%, или от приблизительно 60% до приблизительно 80%, от приблизительно 10% до приблизительно 70%, от приблизительно 20% до приблизительно 70%, от приблизительно 30% до приблизительно 70%, от приблизительно 40% до приблизительно 70% или от приблизительно 50% до приблизительно 70%.
Раскрытое в изобретении терапевтическое соединение может иметь величину log P, указывающую на то, что соединение растворимо в органическом растворителе. Используемый в изобретении термин "величина log P" относится к десятичному логарифму коэффициента распределения (P) для соединения и является критерием липофильности. Обычно, P определяется как отношение концентраций неионизированного соединения в двух фазах смеси из двух несмешивающихся растворителей при равновесии. Таким образом, log P=Log 10 (P), где P=[растворенное вещество в несмешивающемся растворителе 1]/[растворенное вещество в несмешивающемся растворителе 2]. По отношению к органической и водной фазам, величина log P соединения является постоянной для данной пары водного и органического растворителей, и ее значение может быть определено эмпирически одним из нескольких методов межфазного распределения, известных любому специалисту в этой области, включающих например, метод встряхиваемой колбы, метод ВЭЖХ и метод исследования поверхности раздела между двумя несмешивающимися растворами электролитов (ITIES).
В аспектах этого варианта осуществления, раскрытое в изобретении терапевтическое соединение может иметь значение log P, указывающее на то, что соединение является практически растворимым в органическом растворителе. В аспектах этого варианта осуществления, раскрытое в изобретении терапевтическое соединение может иметь значение log P, указывающее на то, что соединение, например, по меньшей мере, на 50% растворимо в органическом растворителе, по меньшей мере, на 60% растворимо в органическом растворителе, по меньшей мере, на 70% растворимо в органическом растворителе, по меньшей мере, на 80% растворимо в органическом растворителе или, по меньшей мере, на 90% растворимо в органическом растворителе. В аспектах этого варианта осуществления, раскрытое в изобретении терапевтическое соединение может иметь значение log P, указывающее на то, что соединение может быть, например, от приблизительно 50% до приблизительно 100% растворимо в органическом растворителе, от приблизительно 60% до приблизительно 100% растворимо в органическом растворителе, от приблизительно 70% до приблизительно 100% растворимо в органическом растворителе, от приблизительно 80% до приблизительно 100% растворимо в органическом растворителе или от приблизительно 90% до приблизительно 100% растворимо в органическом растворителе.
В аспектах этого варианта осуществления, раскрытое в изобретении терапевтическое соединение может иметь значение log P, например, более чем 1,1, более чем 1,2, более чем 1,4, более чем 1,6, более чем 1,8, более чем 2,0, более чем 2,2, более чем 2,4, более чем 2,6, более чем 2,8, более чем 3,0, более чем 3,2, более чем 3,4 или более чем 3,6. В другом аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение может иметь значение log P в диапазоне, например, от 1,8 до 4,0, от 2,0 до 4,0, от 2,1 до 4,0, от 2,2 до 4,0 или от 2,3 до 4,0, от 2,4 до 4,0, от 2,5 до 4,0, от 2,6 до 4,0 или от 2,8 до 4,0. В другом аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение может иметь значение log P в диапазоне, например, от 3,0 до 4,0 или от 3,1 до 4,0, от 3,2 до 4,0, от 3,3 до 4,0, от 3,4 до 4,0, от 3,5 до 4,0 или от 3,6 до 4,0. В еще одних аспектах этого варианта осуществления, раскрытое в изобретении терапевтическое соединение может иметь значение log P в диапазоне, например, от 2,0 до 2,5, от 2,0 до 2,7, от 2,0 до 3,0 или от 2,0 до 2,5.
Раскрытое в изобретении терапевтическое соединение может иметь участок полярной поверхности, который является гидрофобным. Используемый в изобретении термин "участок полярной поверхности" относится к суммарной поверхности над всеми полярными атомами в структуре соединения и является критерием гидрофобности. Обычно, эти полярные атомы включают, например, кислород, азот и присоединенные к ним водороды. В аспектах этого варианта осуществления, раскрытое в изобретении терапевтическое соединение может иметь участок полярной поверхности размером, например, менее чем 8,0 нм2, менее чем 7,0 нм2, менее чем 6,0 нм2, менее чем 5,0 нм2, менее чем 4,0 нм2 или менее чем 3,0 нм2. В другом аспекте этого варианта осуществления, раскрытое в изобретении терапевтическое соединение может иметь участок полярной поверхности, например, от 3,0 нм2 до 6,5 нм2, от 3,0 нм2 до 6,0 нм2, от 3,0 нм2 до 5,5 нм2, от 3,0 нм2 до 5,0 нм2, от 3,0 нм2 до 4,5 нм2, от 3,5 нм2 до 6,5 нм2, от 3,5 нм2 до 6,0 нм2, от 3,5 нм2 до 5,5 нм2, от 3,5 нм2 до 5,0 нм2, от 3,5 нм2 до 4,5 нм2, от 4,0 нм2 до 6,5 нм2, от 4,0 нм2 до 6,0 нм2, от 4,0 нм2 до 5,5 нм2 или от 4,0 нм2 до 5,0 нм2, от 4,0 нм2 до 4,5 нм2 или от 4,5 нм2 до 5,5 нм2. В еще одних аспектах варианта осуществления, раскрытое в изобретении терапевтическое соединение может иметь участок полярной поверхности, например, от 2,0 нм2 до 6,5 нм2, от 2,0 нм2 до 6,0 нм2, от 2,0 нм2 до 5,5 нм2, от 2,0 нм2 до 5,0 нм2, от 2,0 нм2 до 4,5 нм2, от 2,5 нм2 до 6,5 нм2, от 2,5 нм2 до 6,0 нм2, от 2,5 нм2 до 5,5 нм2, от 2,5 нм2 до 5,0 нм2 или от 2,5 нм2 до 4,5 нм2.
Раскрытое в изобретении терапевтическое соединение может представлять собой нестероидное противовоспалительное лекарственное средство (NSAID). NSAID образуют большую группу терапевтических соединений с болеутоляющими, противовоспалительными и жаропонижающими свойствами. NSAID снижают воспаление за счет блокирования циклооксигеназы. NSAID включают, без ограничения, ацеклофенак, ацеметацин, актирит, алкофенак, алминопрофен, амфенак, алоксипирин, аминофеназон, антрафенин, аспирин, азапропазон, бенорилат, беноксапрофен, бензидамин, бутибуфен, целекоксиб, хлортеноксацин, холин салицилат, клометацин, декскетопрофен, диклофенак, дифлунизал, эморфазон, эпиризол, этодолак, эторикоксиб, феклобузон, фелбинак, фенбуфен, фенклофенак, флурбипрофен, глафенин, гидроксилэтил салицилат, ибупрофен, индометацин, индопрофен, кетопрофен, кеторолак, лактил фенетидин, локсопрофен, люмиракоксиб, мефенамовую кислоту, мелоксикам, метамизол, метиазиновую кислоту, мофебутазон, мофезолак, набуметон, напроксен, нифеназон, нифлумовую кислоту, оксаметацин, фенацетин, пипебузон, пранопрофен, пропифеназон, проквазон, протизиновую кислоту, рофекоксиб, салициламид, салсалат, сулиндак, супрофен, тиарамид, тиноридин, толфенамовую кислоту, валдекоксиб и зомепирак.
NSAID могут быть классифицированы на основе их химической структуры или механизма действия. Неограничивающие примеры NSAID включают салицилатное производное, п-аминофенольное производное, производное пропионовой кислоты, производное уксусной кислоты, производное эноловой кислоты, производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (COX), селективный ингибитор циклооксигеназы 1 (COX 1) и селективный ингибитор циклооксигеназы 2 (COX 2). NSAID может представлять собой профен. Примеры подходящего салицилатного производного включают, без ограничения, ацетилсалициловую кислоту (аспирин), дифлунизал и салсалат. Примеры подходящего п-аиминофенольного производного включают, без ограничения, Парацетамол и фенацетин. Примеры подходящего производного пропионовой кислоты включают, без ограничения, алминопрофен, беноксапрофен, декскетопрофен, фенопрофен, флурбипрофен, Ибупрофен, индопрофен, кетопрофен, локсопрофен, напроксен, оксапрозин, пранопрофен и супрофен. Примеры подходящего производного уксусной кислоты включают, без ограничения, ацеклофенак, ацеметацин, актирит, алкофенак, амфенак, клометацин, диклофенак, этодолак, фелбинак, фенклофенак, индометацин, кеторолак, метиазиновую кислоту, мофезолак, набуметон, напроксен, оксаметацин, сулиндак и зомепирак. Примеры подходящего производного эноловой кислоты (оксикама) включают, без ограничения, дроксикам, изоксикам, лорноксикам, мелоксикам, пироксикам и теноксикам. примерыподходящего производного фенамовой кислоты включают, без ограничения, флуфенамовую кислоту, мефенамовую кислоту, меклофенамовую кислоту и толфенамовую кислоту. Примеры подходящих селективных ингибиторов COX-2 включают, без ограничения, целекоксиб, эторикоксиб, фирококсиб, люмиракоксиб, мелоксикам, парацетамол (ацетоминофен), парекоксиб, рофекоксиб и валдекоксиб.
Раскрытое в изобретении терапевтическое соединение может представлять собой агонист PPARα. Примеры подходящего агониста PPARα включают, без ограничения, пириниксик (WY 14643), GW6471, и фибрат.
Раскрытое в изобретении терапевтическое соединение представляет собой агонист PPARβ/δ. Примеры подходящего агониста PPARβ/δ включают, без ограничения, тетрадецилтиоуксусную кислоту (TTA), GSK0660, GSK3787, GW501516 (GW-501,516, GW1516, GSK-516 и эндуробол), GW0742 и GW610742X.
Раскрытое в изобретении терапевтическое соединение может представлять собой агонист PPARγ. Примеры примеры подходящего агониста PPARγ включают, без ограничения, примеры подходящего агониста PPARγ, тиазолидиндионы, такие как росиглитазон, пиоглитазон и троглитазон и T0070907. Другие подходящие агонисты PPARγ описаны в патентном документе Masson and Caumont-Bertrand, PPAR Agonist Compounds, Preparation and Uses, US 2011/0195993, содержание которого приводится в настоящем изобретении путем ссылки на него.
Раскрытое в изобретении терапевтическое соединение может представлять собой глитазар (двойной агонист α и γ PPAR). Примеры подходящего глитазара включают, без ограничения, алеглитазар, мураглитазар, сароглитазар и тесаглитазар.
Раскрытое в изобретении терапевтическое соединение может представлять собой иммуносупрессивное лекарственное средство. Примеры подходящего иммуносупрессивного лекарственного средства включают, без ограничения, азатиоприн и микофеноловую кислоту.
Раскрытое в изобретении терапевтическое соединение может представлять собой лекарственное средство, способствующее выведению мочевой кислоты. Примеры подходящего лекарственного средства, способствующего выведению мочевой кислоты, включают, без ограничения, бензбромарон.
Раскрытое в изобретении терапевтическое соединение может представлять собой агликон. Примеры подходящего лекарственного средства агликон включают, без ограничения, пицеатаннол, пиносилвин, птеростилбен и ресвератрол.
Раскрытое в изобретении терапевтическое соединение может представлять собой каннабидиол. Примеры подходящего лекарственного средства, способствующего выведению мочевой кислоты, включают, без ограничения, фитоканнабиноид, эндоканнабиноид и синтетический каннабиноид. Фитоканнабиноид включает тетрагидроканнабинол (такой как, например, дельта-9-тетрагидроканнабинол (δ9-THC, THC) и дельта-8-тетрагидроканнабинол (δ8-THC)), каннабидиол, каннабинол, каннабигерол, тетрагидроканнабиварин, каннабидиварин и каннабихромен. Эндоканнабиноид включает арахидоноилэтаноламин (анандамид или AEA), 2-арахидоноилглицерин (2-AG), 2-арахидоноилглицериновый эфир (ноладиновый эфир), N-арахидоноил-допамин (NADA), виродгамин (OAE) и лизофосфатидилинозитол (LPI). Синтетический каннабиноид включает дронабинол (маринол), набилон (цесамет), сативекс, римонабант (SR141716), JWH-018, JWH-073, CP-55940, диметилгептилпиран, HU-210, HU-331, SR144528, WIN 55,212-2, JWH-133, левонантрадол (нантродолум) и AM-2201.
Раскрытое в изобретении терапевтическое соединение может представлять собой средство, связывающее ядерный рецептор. Примеры подходящего средства, связывающего ядерный рецептор, включают, без ограничения, средство, связывающее рецептор ретиноевой кислоты (RAR), средство, связывающее ретиноидный X рецептор (RXR), средство, связывающее печеночный рецептор Х (LXR) и средство, связывающее витамин D.
Раскрытое в изобретении терапевтическое соединение может представлять собой антагонист рецепторов ангиотензина II. Примеры подходящего антагониста рецепторов ангиотензина II включают, без ограничения, азилсартан, кандесартан, эпросартан, ирбесартан, лосартан, олмесартан, телмисартан и валсартан.
Раскрытое в изобретении терапевтическое соединение может представлять собой ингибитор ацетилхолинэстеразы (ACE). Примеры подходящего ингибитора ACE включают, без ограничения, сульфгидрилсодержащее средство, дикарбоксилатсодержащее средство, фосфонатсодержащее средство, касокинин и лактокинин. Сульфгидрилсодержащее средство включает каптоприл (капотен) и зофеноприл. Дикарбоксилатсодержащее средство включает эналаприл (вазотек/ренитек), рамиприл (алтаце/прилаце/рамаце/рамивин/ триатек/тритаце), хинаприл (аккуприл), периндоприл (коверсил/ацеон), лизиноприл (листрил/лоприл/новатек/принивил/ зестрил), беназеприл (лотензин), имидаприл (танатрил), зофеноприл (зофекард) и трандолаприл (мавик/одрик/гоптен). Фосфонатсодержащее средство включает фосиноприл (фоситен/ моноприл).
Раскрытое в изобретении терапевтическое соединение может представлять собой ингибитор фосфодиэстеразы (PDE). Примеры подходящего ингибитора фосфодиэстеразы включают, без ограничения, селективный ингибитор PDE 1, селективный ингибитор PDE 2, селективный ингибитор PDE 3, селективный ингибитор PDE 4, селективный ингибитор PDE 5 и селективный ингибитор PDE 10. Селективный ингибитор PDE 1 включает випроцетин. Селективный ингибитор PDE 2 включает BAY 60-7550 (2-[(3,4-диметоксифенил)метил]-7-[(1R)-1-гидроксиэтил]-4-фенилбутил]-5-метилимидазо[5,1-f][1,2,4]триазин-4(1H)-он), EHNA (эритро-9-(2-гидрокси-3-нонил)аденин), оксиндол и PDP (9-(6-фенил-2-оксогекс-3-ил)-2-(3,4-диметоксибензил)-пурин-6-он). Селективный ингибитор PDE3 включает анагрелид, цилостазол, эноксимон, инамринон и милринон. Селективный ингибитор PDE4 включает дротаверин, ибудиласт, лутеолин, месембрин, пикламиласт, рофлумиласт и ролипрам. Селективный ингибитор PDE5 включает аванафил, дипиридамол, икариин, 4-метилпиперазин, пиразолопиримидин-7-1, силденафил, тадалафил, уденафил и варденафил. Селективный ингибитор PDE10 включает папаверин.
Раскрытое в изобретении терапевтическое соединение может представлять собой фибрат. Фибраты образуют класс амфипатических карбоновых кислот, способных модифицировать уровень липидов. Эти терапевтические соединения применяют при ряде метаболических нарушений. Одним неограничивающим применением является их использование в качестве антигиперлипидемического средства, которое может понижать уровни, например, триглицеридов и LDL, а также повышать уровни HDL. Примеры подходящего фибрата включают, без ограничения, безафибрат, ципрофибрат, клофибрат, гемфиброзил и фенофибрат.
Раскрытое в изобретении терапевтическое соединение может представлять собой статин. Статины (или ингибиторы HMG-CoA редуктазы) образуют класс терапевтических соединений, применяемых для понижения уровней LDL и/или холестерина путем ингибирования фермента HMG-CoA редуктазы, которая играет главную роль в продукции холестерина в печени. Для компенсации пониженной доступности холестерина, повышается синтез печеночных рецепторов LDL, что приводит к повышенному выведению частиц LDL из крови. Примеры подходящего статина включают, без ограничения, аторвастатин, флувастатин, ловастатин, питавастатин, правастатин, розувастатин и симвастатин.
Раскрытое в изобретении терапевтическое соединение может представлять собой токотриенол. Токотриенолы образуют другой класс ингибиторов HMG-CoA редуктазы, и они могут применяться для снижения уровней LDL и/или холестерина путем индуцирования активации печеночного рецептора LDL или снижения уровней LDL в плазме. Примеры подходящего токотриенола включают, без ограничения, γ-токотриенол и δ-токотриенол.
Раскрытое в изобретении терапевтическое соединение может представлять собой ниацин. Ниацины образуют класс терапевтических соединений, способных модифицировать уровни липидов. Например, ниацин может понижать LDL путем ингибирования печеночной диацилглицерол-ацилтрансферазы 2, уменьшать синтез триглицеридов и секрецию VLDL через рецептор HM74 и HM74A или GPR109A. Эти терапевтические соединения применяют при ряде метаболических нарушений. Одним неограничивающим применением является для его использования в качестве антигиперлипидемического средства, которое может ингибировать распад жиров в жировой ткани. Так как ниацин блокирует распад жиров, он вызывает увеличение содержания свободных жирных кислот в крови и, вследствие этого, снижает секрецию липопротеинов очень низкой плотности (VLDL) и холестерина печенью. Путем снижения уровней VLDL, ниацин может также повышать уровень HDL в крови. Примеры подходящего ниацина включают, без ограничения, аципимокс, ниацин, никотинамид и витамин B3.
Раскрытое в изобретении терапевтическое соединение может представлять собой секвестрант желчных кислот. Секвестранты желчных кислот (называемые также смолами) образуют класс терапевтических соединений, применяемых для связывания конкретных компонентов желчи в желудочно-кишечном тракте. Они нарушают печеночно-кишечную рециркуляцию желчных кислот путем секвестирования их и предотвращения их реабсорбции из кишок. Секвестранты желчных кислот особенно эффективны для снижения LDL и холестерина путем секвестирования содержащих холестерин желчных кислот, высвобождающихся в кишечнике, и предотвращения их реабсорбции из кишечника. Кроме того, секвестранты желчных кислот могут также повышать уровни HDL. Примеры подходящего секвестранта желчных кислот включают, без ограничения, холестирамин, колесевелам и колестипол.
Раскрытое в изобретении терапевтическое соединение может представлять собой ингибитор абсорбции холестерина. Ингибиторы абсорбции холестерина образуют класс терапевтических соединений, которые ингибируют абсорбцию холестерина из кишечника. Пониженная абсорбция холестерина приводит к повышенной регуляции LDL-рецепторов на поверхности клеток и повышенному усвоению LDL-холестерина в этих клетках, таким образом понижая уровни LDL в плазме крови. Примеры подходящего ингибитора абсорбции холестерина включают, без ограничения, эзетимид, фитостерол, стерол и станол.
Раскрытое в изобретении терапевтическое соединение может представлять собой ингибитор абсорбции жира. Ингибиторы абсорбции жира образуют класс терапевтических соединений, которые ингибируют абсорбцию жира из кишечника. Пониженная абсорбция жира уменьшает калорийность потребляемой пищи. В одном аспекте, ингибитор абсорбции жира ингибирует липазу поджелудочной железы, фермент, который разрушает триглицериды в кишечнике. Примеры подходящего ингибитора абсорбции жира включают, без ограничения орлистат.
Раскрытое в изобретении терапевтическое соединение может представлять собой симпатомиметический амин. Симпатомиметические амины образуют класс терапевтических соединений, которые имитируют действия трансмиттерных веществ симпатической нервной системы, таких как катехоламины, эпинефрин (адреналин), норэпинефрин (норадреналин) и/или допамин. Симпатомиметический амин может действовать в качестве α-адренергического агониста, β-адренергического агониста, допаминергического агониста, ингибитора моноаминоксидазы (MAO) и ингибитора COMT. Такие терапевтические соединения применяют, помимо прочего, для лечения задержки очередного сердечного сокращения, низкого кровяного давления или даже для отсрочки преждевременных родов. Примеры подходящего симпатомиметического амина включают, без ограничения, кленбутерол, сальбутамол, эфедрин, псевдоэфедрин, метамфетамин, амфетамин, фенилэфрин, изопротеренол, добутамин, метилфенидат, лисдексамфетамин, катин, катинон, меткатинон, кокаин, бензилпиперазин (BZP), метилендиоксипировалерон (MDPV), 4-метиламинорекс, пемолин, фенметразин и пропилгекседрин. α-Адренергический агонист включает фенилеприн, пропилгекседрин и псевдоэфедрин. β-Адренергический агонист включает кленбутерол, добутамин, эфедрин, изопротеренол и сальбутамол. Допаминергический/норэпинефринергический агонист включает кокаин (ингибитор обратного захвата допамина (DA)/норэпинефрина (NE)), лисдексамфетамин (ингибитор обратного захвата 5HT/DA/NE), метилфенидат (ингибитор обратного захвата DA/NE) и метилендиоксипировалерон (ингибитор обратного захвата DA/NE). Средство, высвобождающее нейротрансмиттер, включает амфетамин (средство, высвобождающее DA/NE), бензилпиперазин (средство, высвобождающее DA/NE), катин (средство, высвобождающее DA/NE), катинон (средство, высвобождающее DA/NE), метамфетамин (средство, высвобождающее DA/NE), меткатинон (средство, высвобождающее DA/NE), 4-метиламинорекс (средство, высвобождающее DA/NE), пемолин, фенметразин (средство, высвобождающее DA/NE) и фенетиламин (средство, высвобождающее DA/NE).
Раскрытое в изобретении терапевтическое соединение может представлять собой антагонист рецептора рианодина. Примеры антагониста рецептора рианодина включают, без ограничения, азумолен и дантролен.
Раскрытое в изобретении терапевтическое соединение может представлять собой противоопухолевое лекарственное средство. Примеры подходящего противоопухолевого лекарственного средства включают, без ограничения, алкилирующее средство, антиметаболит, растительный алкалоид и терпеноид, ингибитор топоизомеразы и цитотоксический антибиотик. Алкилирующее средство включает карбоплатин, хлорамбуцил, цисплатин, циклофосфамид, ифосфамид, оксалиплатин и мехлорэтамин. Антиметаболит включает азатиоприн и меркаптопурин. Растительный алкалоид и терпеноид включают алкалоид барвинка, такой как винкристин, винбластин, винорелбин и виндезин, подофиллотоксин, такой как этопозид и тенипозид, и таксан, такой как доцетаксел и ортатаксел. Ингибитор топоизомеразы включает ингибитор топоизомеразы типа I, такой как камптотецины, такие, например, как экзатекан, иринотекан, луртотекан, топотекан, BNP 1350, CKD 602, DB 67 (AR67) и ST 1481, и ингибитор типа II, такой как эпидофиллотоксин, такой, например, как амсакрин, этопозид, этопозида фосфат и тенипозид. Цитотоксический антибиотик включает актиномицин, такой как актиномицин D, бацитрацин, колистин (полимиксин E) и полимиксин B, антрацендион, такой как митоксантрон и пиксантрон, и антрациклин, такой как блеомицин, доксорубицин (адриамицин), даунорубицин (дауномицин), эпирубицин, идарубицин, митомицин, пликамицин и валрубицин.
Раскрытое в изобретении терапевтическое соединение может представлять собой метформин, куркумин, глицирретиновую кислоту или 6- шогаол.
Раскрытое в изобретении терапевтическое соединение может представлять собой антибиотик. Примеры подходящего симпатомиметического амина включают, без ограничения, изониазид, рифампицин, пиразинамид и этамбутол.
Раскрытое в изобретении терапевтическое соединение может представлять собой противоглистное лекарственное средство. Примеры подходящего противоглистного лекарственного средства включают, без ограничения, абамектин, аминоацетонитрил, такой как монепантел, бензимидазол, диэтилкарбамазин, ивермектин, левамизол, никлозамид, октадепсипептид, такой как эмодепсид, фосфоновую кислоту (метрифонат), празиквантел, спироиндол, такой как дерквантел и сурамин, пирантела памоат. Бензимидазол включает альбендазол, фербендазол, флубендазол, мебендазол, тиабендазол и триклабендазол.
Раскрытое в изобретении терапевтическое соединение может представлять собой противомалярийное лекарственное средство. Примеры подходящего противомалярийного лекарственного средства включают, без ограничения, амодиахин, артемизинин, атоваквон, хлорохин, клиндамицин, доксициклин, галофантрин, мефлохин, примахин, прогуанил, пириметамин, хинин и относящееся к нему лекарственное средство, такое как хинимакс и хинидин, руфигаллол и сульфонамид, такой как сульфадоксин и сульфаметоксипиридазин. Артемизинин включает артеэфир, артеметер, артемизинин, артесунат и дигидроартемизинин.
Раскрытое в изобретении терапевтическое соединение может представлять собой антигиперлипидемическое средство. Существует несколько классов антигиперлипидемических средств (называемых также гиполипидемическими средствами). Они могут различаться как по их воздействию на холестериновый профиль, так и по побочным эффектам. Например, некоторые из них могут понижать липопротеин низкой плотности (LDL), в то время как другие могут в основном повышать липопротеин высокой плотности (HDL). В клиническом аспекте, выбор средства будет зависеть от холестеринового профиля индивидуума, кардиоваскулярных факторов риска индивидуума и/или функционирования печени и почек индивидуума. Примеры подходящего антигиперлипидемического средства включают, без ограничения, антагонист рецепторов ангиотензина II, ингибитор ACE, ингибитор фосфодиэстеразы, фибрат, статин, токотриенол, ниацин, секвестранты желчных кислот (смолу), ингибитор абсорбции холестерина, ингибитор липазы поджелудочной железы и симпатомиметический амин.
Раскрытое в изобретении терапевтическое соединение может представлять собой эфир терапевтического соединения. Эфир терапевтического соединения повышает значение logP относительно значения logP терапевтического соединения, которое не было подвергнуто превращению в эфир. Эфирная группа может быть присоединена к терапевтическому соединению, например, по карбоксильной или гидроксильной функциональной группе, присутствующей в терапевтическом соединении. Эфир терапевтического соединения может обладать повышенной гидрофобностью и по этой причине может растворяться в меньшем объеме раскрываемого в изобретении растворителя. В некоторых случаях, эфир терапевтического соединения может быть объединен непосредственно с описанным в изобретении вспомогательным веществом, в результате чего отпадает необходимость в использовании растворителя. Эфир терапевтического соединения дает возможность получать раскрытую в изобретении фармацевтическую композицию в тех ситуациях, когда неэтерифицированная форма этого же терапевтического соединения не смешивается с раскрытым в изобретении растворителем. Эфир терапевтического соединения может, при этом, быть доставлен так, что он более эффективно ингибирует ответную провоспалительную реакцию при условии, что соединение объединено с описанным в изобретении липидом. В одном варианте осуществления, терапевтическое соединение может быть подвергнуто взаимодействию с этиловым эфиром для образования этилового эфира терапевтического соединения.
Раскрытая в изобретении фармацевтическая композиция твердого раствора может включать терапевтическое соединение в количестве, достаточном для традиционного введения индивидууму. В аспектах этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать терапевтическое соединение в количестве, например, по меньшей мере, 5 мг, по меньшей мере, 10 мг, по меньшей мере, 15 мг, по меньшей мере, 20 мг, по меньшей мере, 25 мг, по меньшей мере, 30 мг, по меньшей мере, 35 мг, по меньшей мере, 40 мг, по меньшей мере, 45 мг, по меньшей мере, 50 мг, по меньшей мере, 55 мг, по меньшей мере, 60 мг, по меньшей мере, 65 мг, по меньшей мере, 70 мг, по меньшей мере, 75 мг, по меньшей мере, 80 мг, по меньшей мере, 85 мг, по меньшей мере, 90 мг, по меньшей мере, 95 мг или, по меньшей мере, 100 мг. В другом аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать терапевтическое соединение в количестве, например, по меньшей мере, 5 мг, по меньшей мере, 10 мг, по меньшей мере, 20 мг, по меньшей мере, 25 мг, по меньшей мере, 50 мг, по меньшей мере, 75 мг, по меньшей мере, 100 мг, по меньшей мере, 200 мг, по меньшей мере, 300 мг, по меньшей мере, 400 мг, по меньшей мере, 500 мг, по меньшей мере, 600 мг, по меньшей мере, 700 мг, по меньшей мере, 800 мг, по меньшей мере, 900 мг, по меньшей мере, 1000 мг, по меньшей мере, 1100 мг, по меньшей мере, 1200 мг, по меньшей мере, 1300 мг, по меньшей мере, 1400 мг или, по меньшей мере, 1500 мг. В еще одних аспектах варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать терапевтическое соединение в количестве, например, от приблизительно 5 мг до приблизительно 100 мг, от приблизительно 10 мг до приблизительно 100 мг, от приблизительно 50 мг до приблизительно 150 мг, от приблизительно 100 мг до приблизительно 250 мг, от приблизительно 150 мг до приблизительно 350 мг, от приблизительно 250 мг до приблизительно 500 мг, от приблизительно 350 мг до приблизительно 600 мг, от приблизительно 500 мг до приблизительно 750 мг, от приблизительно 600 мг до приблизительно 900 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 850 мг до приблизительно 1200 мг или от приблизительно 1000 мг до приблизительно 1500 мг. В еще одних аспектах этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать терапевтическое соединение в количестве, например, от приблизительно 10 мг до приблизительно 250 мг, от приблизительно 10 мг до приблизительно 500 мг, от приблизительно 10 мг до приблизительно 750 мг, от приблизительно 10 мг до приблизительно 1000 мг, от приблизительно 10 мг до приблизительно 1500 мг, от приблизительно 50 мг до приблизительно 250 мг, от приблизительно 50 мг до приблизительно 500 мг, от приблизительно 50 мг до приблизительно 750 мг, от приблизительно 50 мг до приблизительно 1000 мг, от приблизительно 50 мг до приблизительно 1500 мг, от приблизительно 100 мг до приблизительно 250 мг, от приблизительно 100 мг до приблизительно 500 мг, от приблизительно 100 мг до приблизительно 750 мг, от приблизительно 100 мг до приблизительно 1000 мг, от приблизительно 100 мг до приблизительно 1500 мг, от приблизительно 200 мг до приблизительно 500 мг, от приблизительно 200 мг до приблизительно 750 мг, от приблизительно 200 мг до приблизительно 1000 мг, от приблизительно 200 мг до приблизительно 1500 мг, от приблизительно 5 мг до приблизительно 1500 мг, от приблизительно 5 мг до приблизительно 1000 мг или от приблизительно 5 мг до приблизительно 250 мг.
В другом аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать терапевтическое соединение в количестве, например, менее чем приблизительно 90% по массе, менее чем приблизительно 80% по массе, менее чем приблизительно 70% по массе, менее чем приблизительно 65% по массе, менее чем приблизительно 60% по массе, менее чем приблизительно 55% по массе, менее чем приблизительно 50% по массе, менее чем приблизительно 45% по массе, менее чем приблизительно 40% по массе, менее чем приблизительно 35% по массе, менее чем приблизительно 30% по массе, менее чем приблизительно 25% по массе, менее чем приблизительно 20% по массе, менее чем приблизительно 15% по массе, менее чем приблизительно 10% по массе, менее чем приблизительно 5% по массе или менее чем приблизительно 1% по массе. В другом аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать терапевтическое соединение в количестве, например, приблизительно от 1% до 90% по массе, приблизительно от 1% до 80% по массе, приблизительно от 1% до 75% по массе, приблизительно от 1% до 70% по массе, приблизительно от 1% до 65% по массе, приблизительно от 1% до 60% по массе, приблизительно от 1% до 55% по массе, приблизительно от 1% до 50% по массе, приблизительно от 1% до 45% по массе, приблизительно от 1% до 40% по массе, приблизительно от 1% до 35% по массе, приблизительно от 1% до 30% по массе, приблизительно от 1% до 25% по массе, приблизительно от 1% до 20% по массе, приблизительно от 1% до 15% по массе, приблизительно от 1% до 10% по массе, приблизительно от 1% до 5% по массе, приблизительно от 2% до 50% по массе, приблизительно от 2% до 40% по массе, приблизительно от 2% до 30% по массе, приблизительно от 2% до 20% по массе, приблизительно от 2% до 10% по массе, приблизительно от 4% до 50% по массе, приблизительно от 4% до 40% по массе, приблизительно от 4% до 30% по массе, приблизительно от 4% до 20% по массе, приблизительно от 4% до 10% по массе, приблизительно от 6% до 50% по массе, приблизительно от 6% до 40% по массе, приблизительно от 6% до 30% по массе, приблизительно от 6% до 20% по массе, приблизительно от 6% до 10% по массе, приблизительно от 8% до 50% по массе, приблизительно от 8% до 40% по массе, приблизительно от 8% до 30% по массе, приблизительно от 8% до 20% по массе, приблизительно от 8% до 15% по массе или приблизительно от 8% до 12% по массе.
В другом аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать терапевтическое соединение в количестве, например, от приблизительно 0,1% до приблизительно 45% по массе, от приблизительно 0,1% до приблизительно 40% по массе, от приблизительно 0,1% до приблизительно 35% по массе, от приблизительно 0,1% до приблизительно 30% по массе, от приблизительно 0,1% до приблизительно 25% по массе, от приблизительно 0,1% до приблизительно 20% по массе, от приблизительно 0,1% до приблизительно 15% по массе, от приблизительно 0,1% до приблизительно 10% по массе, от приблизительно 0,1% до приблизительно 5% по массе, от приблизительно 1% до приблизительно 45% по массе, от приблизительно 1% до приблизительно 40% по массе, от приблизительно 1% до приблизительно 35% по массе, от приблизительно 1% до приблизительно 30% по массе, от приблизительно 1% до приблизительно 25% по массе, от приблизительно 1% до приблизительно 20% по массе, от приблизительно 1% до приблизительно 15% по массе, от приблизительно 1% до приблизительно 10% по массе, от приблизительно 1% до приблизительно 5% по массе, от приблизительно 5% до приблизительно 45% по массе, от приблизительно 5% до приблизительно 40% по массе, от приблизительно 5% до приблизительно 35% по массе, от приблизительно 5% до приблизительно 30% по массе, от приблизительно 5% до приблизительно 25% по массе, от приблизительно 5% до приблизительно 20% по массе, от приблизительно 5% до приблизительно 15% по массе, от приблизительно 5% до приблизительно 10% по массе, от приблизительно 10% до приблизительно 45% по массе, от приблизительно 10% до приблизительно 40% по массе, от приблизительно 10% до приблизительно 35% по массе, от приблизительно 10% до приблизительно 30% по массе, от приблизительно 10% до приблизительно 25% по массе, от приблизительно 10% до приблизительно 20% по массе, от приблизительно 10% до приблизительно 15% по массе, от приблизительно 15% до приблизительно 45% по массе, от приблизительно 15% до приблизительно 40% по массе, от приблизительно 15% до приблизительно 35% по массе, от приблизительно 15% до приблизительно 30% по массе, от приблизительно 15% до приблизительно 25% по массе, от приблизительно 15% до приблизительно 20% по массе, от приблизительно 20% до приблизительно 45% по массе, от приблизительно 20% до приблизительно 40% по массе, от приблизительно 20% до приблизительно 35% по массе, от приблизительно 20% до приблизительно 30% по массе, от приблизительно 20% до приблизительно 25% по массе, от приблизительно 25% до приблизительно 45% по массе, от приблизительно 25% до приблизительно 40% по массе, от приблизительно 25% до приблизительно 35% по массе или от приблизительно 25% до приблизительно 30% по массе.
Конечная концентрация раскрытого в изобретении терапевтического соединения в раскрытой в изобретении фармацевтической композиции может составлять любую из требуемых концентраций. В аспекте этого варианта осуществления, конечная концентрация терапевтического соединения в фармацевтической композиции может представлять собой терапевтически эффективное количество. В другом аспекте этого варианта осуществления, конечная концентрация терапевтического соединения в фармацевтической композиции может составлять, например, по меньшей мере, 0,00001 мг/мл, по меньшей мере, 0,0001 мг/мл, по меньшей мере, 0,001 мг/мл, по меньшей мере, 0,01 мг/мл, по меньшей мере, 0,1 мг/мл, по меньшей мере, 1 мг/мл, по меньшей мере, 10 мг/мл, по меньшей мере, 25 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 200 мг/мл, по меньшей мере, 500 мг/мл, по меньшей мере, 700 мг/мл, по меньшей мере, 1000 мг/мл или, по меньшей мере, 1200 мг/мл. В другом аспекте этого варианта осуществления, концентрация раскрытого в изобретении терапевтического соединения в растворе может составлять, например, не более 1000 мг/мл, не более 1100 мг/мл, не более 1200 мг/мл, не более 1300 мг/мл, не более 1400 мг/мл, не более 1500 мг/мл, не более 2000 мг/мл, не более 2000 мг/мл или не более 3000 мг/мл. В другом аспекте этого варианта осуществления, конечная концентрация терапевтического соединения в фармацевтической композиции может составлять величину в диапазоне, например, от приблизительно 0,00001 мг/мл до приблизительно 3000 мг/мл, от приблизительно 0,0001 мг/мл до приблизительно 3000 мг/мл, от приблизительно 0,01 мг/мл до приблизительно 3000 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 3000 мг/мл, от приблизительно 1 мг/мл до приблизительно 3000 мг/мл, от приблизительно 250 мг/мл до приблизительно 3000 мг/мл, от приблизительно 500 мг/мл до приблизительно 3000 мг/мл, от приблизительно 750 мг/мл до приблизительно 3000 мг/мл, от приблизительно 1000 мг/мл до приблизительно 3000 мг/мл, от приблизительно 100 мг/мл до приблизительно 2000 мг/мл, от приблизительно 250 мг/мл до приблизительно 2000 мг/мл, от приблизительно 500 мг/мл до приблизительно 2000 мг/мл, от приблизительно 750 мг/мл до приблизительно 2000 мг/мл, от приблизительно 1000 мг/мл до приблизительно 2000 мг/мл, от приблизительно 100 мг/мл до приблизительно 1500 мг/мл, от приблизительно 250 мг/мл до приблизительно 1500 мг/мл, от приблизительно 500 мг/мл до приблизительно 1500 мг/мл, от приблизительно 750 мг/мл до приблизительно 1500 мг/мл, от приблизительно 1000 мг/мл до приблизительно 1500 мг/мл, от приблизительно 100 мг/мл до приблизительно 1200 мг/мл, от приблизительно 250 мг/мл до приблизительно 1200 мг/мл, от приблизительно 500 мг/мл до приблизительно 1200 мг/мл, от приблизительно 750 мг/мл до приблизительно 1200 мг/мл, от приблизительно 1000 мг/мл до приблизительно 1200 мг/мл, от приблизительно 100 мг/мл до приблизительно 1000 мг/мл, от приблизительно 250 мг/мл до приблизительно 1000 мг/мл, от приблизительно 500 мг/мл до приблизительно 1000 мг/мл, от приблизительно 750 мг/мл до приблизительно 1000 мг/мл, от приблизительно 100 мг/мл до приблизительно 750 мг/мл, от приблизительно 250 мг/мл до приблизительно 750 мг/мл, от приблизительно 500 мг/мл до приблизительно 750 мг/мл, от приблизительно 100 мг/мл до приблизительно 500 мг/мл, от приблизительно 250 мг/мл до приблизительно 500 мг/мл, от приблизительно 0,00001 мг/мл до приблизительно 0,0001 мг/мл, от приблизительно 0,00001 мг/мл до приблизительно 0,001 мг/мл, от приблизительно 0,00001 мг/мл до приблизительно 0,01 мг/мл, от приблизительно 0,00001 мг/мл до приблизительно 0,1 мг/мл, от приблизительно 0,00001 мг/мл до приблизительно 1 мг/мл, от приблизительно 0,001 мг/мл до приблизительно 0,01 мг/мл, от приблизительно 0,001 мг/мл до приблизительно 0,1 мг/мл, от приблизительно 0,001 мг/мл до приблизительно 1 мг/мл, от приблизительно 0,001 мг/мл до приблизительно 10 мг/мл или от приблизительно 0,001 мг/мл до приблизительно 100 мг/мл.
Аспекты настоящего изобретения раскрывают, помимо всего прочего, один или более липидов. Липид может быть определен в широком смысле как гидрофобная или амфифильная малая молекула. Амфифильная природа некоторых липидов позволяет им образовывать такие структуры, как везикулы, липосомы или мембраны, в водной среде. Неограничивающие примеры липидов включают жирные кислоты, глицеролипиды, фосфолипиды, сфинголипиды, стероидные липиды, пренольные липиды, сахаролипиды и поликетиды.
Липид, применяемый в раскрытых в изобретении фармацевтических композициях может представлять собой фармацевтически приемлемую жирную кислоту. Жирная кислота включает карбоновую кислоту с длинной неразветвленной углеводородной цепью, которая может быть либо насыщенной, либо ненасыщенной. Такое строение позволяет жирной кислоте иметь полярный гидрофильный конец и неполярный гидрофобный конец, который нерастворим в воде. Большинство природных жирных кислот имеют углеводородную цепь с четным числом углеродных атомов, обычно от 4 до 24 углеродов, и к ним могут быть присоединены функциональные группы, содержащие кислород, галогены, азот и серу. Синтетические или неприродные жирные кислоты могут иметь углеводородную цепь с любым числом углеродных атомов от 3 до 40 углеродов. В случае наличия двойной связи, может наблюдаться либо цис-, либо транс- геометрический изомеризм, который в значительной степени влияет на конфигурацию молекулы. Цис-двойные связи позволяют цепи жирной кислоты изгибаться, эффект, который проявляется тем больше, чем больше двойных связей присутствуют в цепи. Большинство природных жирных кислот имеют цис-конфигурацию, хотя транс-форма обязательно присутствует в некоторых природных и частично гидрированных жирах и маслах. Примеры of жирные кислоты включают, без ограничения, каприловую кислоту (8:0), пеларгоновую кислоту (9:0), каприновую кислоту (10:0), ундециловую кислоту (11:0), лауриновую кислоту (12:0), тридециловую кислоту (13:0), миристиновую кислоту (14:0), миристолеиновую кислоту (14:1), пентадециловую кислоту (15:0), пальмитиновую кислоту (16:0), пальмитолеиновую кислоту (16:1), сапиеновую кислоту (16:1), маргариновую кислоту (17:0), стеариновую кислоту (18:0), олеиновую кислоту (18:1), элаидиновую кислоту (18:1), вакценовую кислоту (18:1), линолевую кислоту (18:2), линоэлаидиновую кислоту (18:2), α-линоленовую кислоту (18:3), γ-линоленовую кислоту (18:3), стеаридоновую кислоту (18:4), нонадециловую кислоту (19:0), арахидиновую кислоту (20:0), эйкозеновую кислоту (20:1), дигомо-γ-линоленовую кислоту (20:3), мидовую кислоту (20:3), арахидоновую кислоту (20:4), эйкозапентаеновую кислоту (20:5), генэйкозановую кислоту (21:0), бегеновую кислоту (22:0), эруковую кислоту (22:1), докозагексаеновую кислоту (22:6), трикоциловую кислоту (23:0), лигноцериновую кислоту (24:0), нервоновую кислоту (24:1), пентакоциловую кислоту (25:0), церотиновую кислоту (26:0), карбоцериновую кислоту (27:0), монтановую кислоту (28:0), нонакоциловую кислоту (29:0), мелиссиновую кислоту (30:0), гентриаконтановую кислоту (31:0), лацериновую кислоту (32:0), псилластеариновую кислоту (33:0), геддовую кислоту (34:0), церопластовую кислоту (35:0) и гексатриаконтановую кислоту (36:0).
В одном варианте осуществления, липид может представлять собой фармацевтически приемлемую насыщенную или ненасыщенную жирную кислоту. В аспектах этого варианта осуществления, насыщенная или ненасыщенная жирная кислота включает, например, по меньшей мере, 8, по меньшей мере, 10, по меньшей мере, 12, по меньшей мере, 14, по меньшей мере, 16, по меньшей мере, 18, по меньшей мере, 20, по меньшей мере, 22, по меньшей мере, 24, по меньшей мере, 26, по меньшей мере, 28 или, по меньшей мере, 30 углеродных атомов. В другом аспекте этого варианта осуществления, насыщенная или ненасыщенная жирная кислота включает, например, от 4 до 24 углеродных атомов, от 6 до 24 углеродных атомов, от 8 до 24 углеродных атомов, от 10 до 24 углеродных атомов, от 12 до 24 углеродных атомов, от 14 до 24 углеродных атомов или от 16 до 24 углеродных атомов, от 4 до 22 углеродных атомов, от 6 до 22 углеродных атомов, от 8 до 22 углеродных атомов, от 10 до 22 углеродных атомов, от 12 до 22 углеродных атомов, от 14 до 22 углеродных атомов или от 16 до 22 углеродных атомов, от 4 до 20 углеродных атомов, от 6 до 20 углеродных атомов, от 8 до 20 углеродных атомов, от 10 до 20 углеродных атомов, от 12 до 20 углеродных атомов, от 14 до 20 углеродных атомов или от 16 до 20 углеродных атомов. В случае наличия ненасыщенности, жирная кислота может иметь, например, 1 или более, 2 или более, 3 или более, 4 или более, 5 или более, или 6 или более двойных связей.
Липид, применяемый в раскрытых в изобретении фармацевтических композициях, может представлять собой фармацевтически приемлемый твердый жир. Называемый также "твердым липидом при комнатной температуре" или просто "жиром", твердый жир включает любую жирную кислоту, которая находится в твердом состоянии при нормальной комнатной температуре, такой, как например, приблизительно 20°C. Жиры состоят из широкой группы соединений, которые обычно растворимы в органических растворителях и обычно нерастворимы в воде. Примеры смесей фармацевтически приемлемых твердых жиров включают, без ограничения, смесь одного или более раскрытых в изобретении глицеролипидов, смесь одного или более раскрытых в изобретении гликолевых эфиров жирных кислот, смесь одного или более раскрытых в изобретении сложных эфиров простого полиэфира жирной кислоты, смесь одного или более раскрытых в изобретении глицеридов.
Твердый жир, применяемый в раскрытых в изобретении фармацевтических композициях, может представлять собой фармацевтически приемлемый глицеролипид. Глицеролипиды состоят в основном из моно-, ди- и тризамещенных глицеринов. Одну группу глицеролипидов образуют глицериды, в которых одна, две или все три гидроксильных группы глицерина каждая этерифицирована с помощью раскрытой в изобретении жирной кислоты с образованием моноглицеридов, диглицеридов и триглицеридов, соответственно. В этих соединениях, каждая из гидроксильных групп глицерина может быть этерифицирована одной и той же жирной кислотой или различными жирными кислотами. Кроме того, глицериды могут быть подвергнуты ацетилированию с получением ацетилированных моноглицеридов, ацетилированных диглицеридов и ацетилированных триглицеридов. В аспектах этого варианта осуществления, моноглицерид может включать насыщенную или ненасыщенную жирную кислоту с длиной углеродной цепи C12-C24. В другом аспекте этого варианта осуществления, диглицерид может включать одну насыщенную или ненасыщенную жирную кислоту с длиной углеродной цепи C12-C24или две насыщенных или ненасыщенных жирных кислоты, каждая из которой имеет длину углеродной цепи C12-C24. В еще одних аспектах варианта осуществления, триглицерид может включать одну насыщенную или ненасыщенную жирную кислоту с длиной углеродной цепи C12-C24,две насыщенных или ненасыщенных жирных кислоты, каждая из которой имеет длину углеродной цепи C12-C24, или три насыщенных или ненасыщенных жирных кислоты, каждая из которой имеет длину углеродной цепи C12-C24.
В аспектах этого варианта осуществления, смесь фармацевтически приемлемых липидов включает смесь моно-, ди- и/или триглицеридов, имеющую температуру плавления, например, приблизительно 33°C, приблизительно 34°C, приблизительно 35°C, приблизительно 36°C, приблизительно 37°C, приблизительно 38°C, приблизительно 39°C, приблизительно 40°C, приблизительно 41°C, приблизительно 42°C, приблизительно 43°C, приблизительно 44°C, приблизительно 45°C, приблизительно 46°C, приблизительно 47°C, приблизительно 48°C, приблизительно 49°C, приблизительно 50°C. В аспектах этого варианта осуществления, смесь фармацевтически приемлемых липидов включает смесь моно-, ди- и/или триглицеридов, имеющую температуру плавления, например, от приблизительно 30°C до приблизительно 44°C, от приблизительно 30°C до приблизительно 45°C, от приблизительно 30°C до приблизительно 46°C, от приблизительно 30°C до приблизительно 47°C, от приблизительно 30°C до приблизительно 48°C, от приблизительно 30°C до приблизительно 49°C, от приблизительно 30°C до приблизительно 50°C, от приблизительно 32°C до приблизительно 44°C, от приблизительно 32°C до приблизительно 45°C, от приблизительно 32°C до приблизительно 46°C, от приблизительно 32°C до приблизительно 47°C, от приблизительно 32°C до приблизительно 48°C, от приблизительно 32°C до приблизительно 49°C, от приблизительно 32°C до приблизительно 50°C, от приблизительно 34°C до приблизительно 44°C, от приблизительно 34°C до приблизительно 45°C, от приблизительно 34°C до приблизительно 46°C, от приблизительно 34°C до приблизительно 47°C, от приблизительно 34°C до приблизительно 48°C, от приблизительно 34°C до приблизительно 49°C, от приблизительно 34°C до приблизительно 50°C, от приблизительно 36°C до приблизительно 44°C, от приблизительно 36°C до приблизительно 45°C, от приблизительно 36°C до приблизительно 46°C, от приблизительно 36°C до приблизительно 47°C, от приблизительно 36°C до приблизительно 48°C, от приблизительно 36°C до приблизительно 49°C, от приблизительно 36°C до приблизительно 50°C, от приблизительно 38°C до приблизительно 44°C, от приблизительно 38°C до приблизительно 45°C, от приблизительно 38°C до приблизительно 46°C, от приблизительно 38°C до приблизительно 47°C, от приблизительно 38°C до приблизительно 48°C, от приблизительно 38°C до приблизительно 49°C, от приблизительно 38°C до приблизительно 50°C, от приблизительно 40°C до приблизительно 44°C, от приблизительно 40°C до приблизительно 45°C, от приблизительно 40°C до приблизительно 46°C, от приблизительно 40°C до приблизительно 47°C, от приблизительно 40°C до приблизительно 48°C, от приблизительно 40°C до приблизительно 49°C, от приблизительно 40°C до приблизительно 50°C, от приблизительно 42°C до приблизительно 44°C, от приблизительно 42°C до приблизительно 45°C, от приблизительно 42°C до приблизительно 46°C, от приблизительно 42°C до приблизительно 47°C, от приблизительно 42°C до приблизительно 48°C, от приблизительно 42°C до приблизительно 49°C или от приблизительно 42°C до приблизительно 50°C.
В другом аспекте этого варианта осуществления, смесь фармацевтически приемлемых липидов включает смесь эфиров ПЭГ жирных кислот, имеющую температуру плавления, например, приблизительно 33°C, приблизительно 34°C, приблизительно 35°C, приблизительно 36°C, приблизительно 37°C, приблизительно 38°C, приблизительно 39°C, приблизительно 40°C, приблизительно 41°C, приблизительно 42°C, приблизительно 43°C, приблизительно 44°C, приблизительно 45°C, приблизительно 46°C, приблизительно 47°C, приблизительно 48°C, приблизительно 49°C, приблизительно 50°C. В аспектах этого варианта осуществления, смесь фармацевтически приемлемых липидов включает смесь эфиров ПЭГ жирных кислот, имеющую температуру плавления, например, от приблизительно 30°C до приблизительно 44°C, от приблизительно 30°C до приблизительно 45°C, от приблизительно 30°C до приблизительно 46°C, от приблизительно 30°C до приблизительно 47°C, от приблизительно 30°C до приблизительно 48°C, от приблизительно 30°C до приблизительно 49°C, от приблизительно 30°C до приблизительно 50°C, от приблизительно 32°C до приблизительно 44°C, от приблизительно 32°C до приблизительно 45°C, от приблизительно 32°C до приблизительно 46°C, от приблизительно 32°C до приблизительно 47°C, от приблизительно 32°C до приблизительно 48°C, от приблизительно 32°C до приблизительно 49°C, от приблизительно 32°C до приблизительно 50°C, от приблизительно 34°C до приблизительно 44°C, от приблизительно 34°C до приблизительно 45°C, от приблизительно 34°C до приблизительно 46°C, от приблизительно 34°C до приблизительно 47°C, от приблизительно 34°C до приблизительно 48°C, от приблизительно 34°C до приблизительно 49°C, от приблизительно 34°C до приблизительно 50°C, от приблизительно 36°C до приблизительно 44°C, от приблизительно 36°C до приблизительно 45°C, от приблизительно 36°C до приблизительно 46°C, от приблизительно 36°C до приблизительно 47°C, от приблизительно 36°C до приблизительно 48°C, от приблизительно 36°C до приблизительно 49°C, от приблизительно 36°C до приблизительно 50°C, от приблизительно 38°C до приблизительно 44°C, от приблизительно 38°C до приблизительно 45°C, от приблизительно 38°C до приблизительно 46°C, от приблизительно 38°C до приблизительно 47°C, от приблизительно 38°C до приблизительно 48°C, от приблизительно 38°C до приблизительно 49°C, от приблизительно 38°C до приблизительно 50°C, от приблизительно 40°C до приблизительно 44°C, от приблизительно 40°C до приблизительно 45°C, от приблизительно 40°C до приблизительно 46°C, от приблизительно 40°C до приблизительно 47°C, от приблизительно 40°C до приблизительно 48°C, от приблизительно 40°C до приблизительно 49°C, от приблизительно 40°C до приблизительно 50°C, от приблизительно 42°C до приблизительно 44°C, от приблизительно 42°C до приблизительно 45°C, от приблизительно 42°C до приблизительно 46°C, от приблизительно 42°C до приблизительно 47°C, от приблизительно 42°C до приблизительно 48°C, от приблизительно 42°C до приблизительно 49°C или от приблизительно 42°C до приблизительно 50°C.
В другом аспекте этого варианта осуществления, смесь фармацевтически приемлемых липидов включает смесь моно-, ди- и/или триглицеридов и эфиров ПЭГ жирных кислот, имеющую температуру плавления, например, приблизительно 33°C, приблизительно 34°C, приблизительно 35°C, приблизительно 36°C, приблизительно 37°C, приблизительно 38°C, приблизительно 39°C, приблизительно 40°C, приблизительно 41°C, приблизительно 42°C, приблизительно 43°C, приблизительно 44°C, приблизительно 45°C, приблизительно 46°C, приблизительно 47°C, приблизительно 48°C, приблизительно 49°C, приблизительно 50°C. В аспектах этого варианта осуществления, смесь фармацевтически приемлемых липидов включает смесь моно-, ди- и/или триглицеридов и эфиров ПЭГ жирных кислот, имеющую температуру плавления, например, от приблизительно 30°C до приблизительно 44°C, от приблизительно 30°C до приблизительно 45°C, от приблизительно 30°C до приблизительно 46°C, от приблизительно 30°C до приблизительно 47°C, от приблизительно 30°C до приблизительно 48°C, от приблизительно 30°C до приблизительно 49°C, от приблизительно 30°C до приблизительно 50°C, от приблизительно 32°C до приблизительно 44°C, от приблизительно 32°C до приблизительно 45°C, от приблизительно 32°C до приблизительно 46°C, от приблизительно 32°C до приблизительно 47°C, от приблизительно 32°C до приблизительно 48°C, от приблизительно 32°C до приблизительно 49°C, от приблизительно 32°C до приблизительно 50°C, от приблизительно 34°C до приблизительно 44°C, от приблизительно 34°C до приблизительно 45°C, от приблизительно 34°C до приблизительно 46°C, от приблизительно 34°C до приблизительно 47°C, от приблизительно 34°C до приблизительно 48°C, от приблизительно 34°C до приблизительно 49°C, от приблизительно 34°C до приблизительно 50°C, от приблизительно 36°C до приблизительно 44°C, от приблизительно 36°C до приблизительно 45°C, от приблизительно 36°C до приблизительно 46°C, от приблизительно 36°C до приблизительно 47°C, от приблизительно 36°C до приблизительно 48°C, от приблизительно 36°C до приблизительно 49°C, от приблизительно 36°C до приблизительно 50°C, от приблизительно 38°C до приблизительно 44°C, от приблизительно 38°C до приблизительно 45°C, от приблизительно 38°C до приблизительно 46°C, от приблизительно 38°C до приблизительно 47°C, от приблизительно 38°C до приблизительно 48°C, от приблизительно 38°C до приблизительно 49°C, от приблизительно 38°C до приблизительно 50°C, от приблизительно 40°C до приблизительно 44°C, от приблизительно 40°C до приблизительно 45°C, от приблизительно 40°C до приблизительно 46°C, от приблизительно 40°C до приблизительно 47°C, от приблизительно 40°C до приблизительно 48°C, от приблизительно 40°C до приблизительно 49°C, от приблизительно 40°C до приблизительно 50°C, от приблизительно 42°C до приблизительно 44°C, от приблизительно 42°C до приблизительно 45°C, от приблизительно 42°C до приблизительно 46°C, от приблизительно 42°C до приблизительно 47°C, от приблизительно 42°C до приблизительно 48°C, от приблизительно 42°C до приблизительно 49°C или от приблизительно 42°C до приблизительно 50°C.
Раскрытая в изобретении фармацевтическая композиция твердого раствора может включать фармацевтически приемлемый твердый при комнатной температуре липид (твердый жир) в количестве, достаточном для образования раскрытой в изобретении композиции твердого раствора. В другом аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать фармацевтически приемлемый твердый при комнатной температуре липид (твердый жир) в количестве, например, по меньшей мере, 10% по массе, по меньшей мере, 20% по массе, по меньшей мере, 30% по массе, по меньшей мере, 35% по массе, по меньшей мере, 40% по массе, по меньшей мере, 45% по массе, по меньшей мере, 50% по массе, по меньшей мере, 55% по массе, по меньшей мере, 60% по массе, по меньшей мере, 65% по массе, по меньшей мере, 70% по массе, по меньшей мере, 75% по массе, по меньшей мере, 80% по массе, по меньшей мере, 85% по массе, по меньшей мере, 90% по массе, по меньшей мере, 95% по массе или, по меньшей мере, 99% по массе. В другом аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать фармацевтически приемлемый твердый при комнатной температуре липид (твердый жир) в количестве, например, от приблизительно 30% до приблизительно 99% по массе, от приблизительно 35% до приблизительно 99% по массе, от приблизительно 40% до приблизительно 99% по массе, от приблизительно 45% до приблизительно 99% по массе, от приблизительно 50% до приблизительно 99% по массе, от приблизительно 30% до приблизительно 98% по массе, от приблизительно 35% до приблизительно 98% по массе, от приблизительно 40% до приблизительно 98% по массе, от приблизительно 45% до приблизительно 98% по массе, от приблизительно 50% до приблизительно 98% по массе, от приблизительно 30% до приблизительно 95% по массе, от приблизительно 35% до приблизительно 95% по массе, от приблизительно 40% до приблизительно 95% по массе, от приблизительно 45% до приблизительно 95% по массе или от приблизительно 50% до приблизительно 95% по массе. В еще одних аспектах варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать фармацевтически приемлемый твердый при комнатной температуре липид (твердый жир) в количестве, например, от приблизительно 70% до приблизительно 97% по массе, от приблизительно 75% до приблизительно 97% по массе, от приблизительно 80% до приблизительно 97% по массе, от приблизительно 85% до приблизительно 97% по массе, от приблизительно 88% до приблизительно 97% по массе, от приблизительно 89% до приблизительно 97% по массе, от приблизительно 90% до приблизительно 97% по массе, от приблизительно 75% до приблизительно 96% по массе, от приблизительно 80% до приблизительно 96% по массе, от приблизительно 85% до приблизительно 96% по массе, от приблизительно 88% до приблизительно 96% по массе, от приблизительно 89% до приблизительно 96% по массе, от приблизительно 90% до приблизительно 96% по массе, от приблизительно 75% до приблизительно 93% по массе, от приблизительно 80% до приблизительно 93% по массе, от приблизительно 85% до приблизительно 93% по массе, от приблизительно 88% до приблизительно 93% по массе, от приблизительно 89% до приблизительно 93% по массе или от приблизительно 90% до приблизительно 93% по массе.
Производимые промышленностью смеси фармацевтически приемлемых глицеролипидов включают, без ограничения, масло какао, смеси стеарата ПЭГ-6 и пальмитостеарата этиленгликоля и стеарата ПЭГ-32 (TEFOSE® 1500; TEFOSE® 63), смеси трицетеарет-4 фосфата и пальмитостеарата этиленгликоля и пальмитостеарата диэтиленгликоля (SEDEFOS® 75), смеси глицеролмоностеарата и стеарата ПЭГ-75 (GELOT®), смеси цетилового спирта и этоксилированных жирных спиртов (seteth-2-, steareth-20) (EMULCIRE®), смеси насыщенных C10-C18 триглицеридов, имеющих температуру плавления приблизительно 33°C (GELUCIRE® 33/01), смеси насыщенных C10-C18 триглицеридов, имеющих температуру плавления приблизительно 39°C (GELUCIRE® 39/01), смеси насыщенных C10-C18 триглицеридов, имеющих температуру плавления приблизительно 43°C (GELUCIRE® 43/01), смеси глицеролмоностеарата 40-55 (тип I) и диглицеридов (GELEOL® моно и диглицериды) и смеси триглицеридов со средней длиной цепи (LABRAFAC® Lipophile WL 1349).
Твердый жир, применяемый в раскрытых в изобретении фармацевтических композициях, может представлять собой фармацевтически приемлемый гликолевый эфир жирной кислоты. Фармацевтически приемлемый гликолевый эфир жирной кислоты может представлять собой моноэфир гликоля, диэфир гликоля или триэфир гликоля. Гликолевый эфир жирной кислоты включают, без ограничения, этиленгликолевый эфир жирной кислоты, диэтиленгликолевый эфир жирной кислоты, пропиленгликолевый эфир жирной кислоты и дипропиленгликолевый эфир жирной кислоты. Неограничивающие примеры гликолевых эфиров жирных кислот включают, например, каприлат этиленгликоля, пеларгонат этиленгликоля, капрат этиленгликоля, ундецелат этиленгликоля, лаурат этиленгликоля, тридецилат этиленгликоля, миристат этиленгликоля, миристолат этиленгликоля, пентадецилат этиленгликоля, пальмитат этиленгликоля, пальмитолеат этиленгликоля, сапиенат этиленгликоля, маргарат этиленгликоля, стеарат этиленгликоля, пальмитостеарат этиленгликоля, олеат этиленгликоля, элаидат этиленгликоля, вакцинат этиленгликоля, линолеат этиленгликоля, линоэлаидат этиленгликоля, α-линоленат этиленгликоля, γ-линоленат этиленгликоля, стеаридонат этиленгликоля, каприлокапрат этиленгликоля, дикаприлокапрат этиленгликоля, дикаприлат этиленгликоля, дипеларгонат этиленгликоля, дикапрат этиленгликоля, диундецелат этиленгликоля, дилаурат этиленгликоля, дитридецилат этиленгликоля, димиристат этиленгликоля, димиристолат этиленгликоля, дипентадецилат этиленгликоля, дипальмитат этиленгликоля, дипальмитолеат этиленгликоля, дисапиенат этиленгликоля, димаргарат этиленгликоля, дистеарат этиленгликоля, дипальмитостеарат этиленгликоля, диолеат этиленгликоля, диэлаидат этиленгликоля, дивакцинат этиленгликоля, дилинолеат этиленгликоля, дилиноэлаидат этиленгликоля, ди-α-линоленат этиленгликоля, ди-γ-линоленат этиленгликоля, дистеаридонат этиленгликоля, дикаприлокапрат этиленгликоля, дидикаприлокапрат этиленгликоля, каприлат пропиленгликоля, пеларгонат пропиленгликоля, капрат пропиленгликоля, ундецилат пропиленгликоля, лаурат пропиленгликоля, тридецилат пропиленгликоля, миристат пропиленгликоля, миристолат пропиленгликоля, пентадецилат пропиленгликоля, пальмитат пропиленгликоля, пальмитолеат пропиленгликоля, сапиенат пропиленгликоля, маргарат пропиленгликоля, стеарат пропиленгликоля, пальмитостеарат пропиленгликоля, олеат пропиленгликоля, элаидат пропиленгликоля, вакцинат пропиленгликоля, линолеат пропиленгликоля, линоэлаидат пропиленгликоля, α-линоленат пропиленгликоля, γ-линоленат пропиленгликоля, стеаридонат пропиленгликоля, каприлокапрат пропиленгликоля, дикаприлокапрат пропиленгликоля, дикаприлат пропиленгликоля, дипеларгонат пропиленгликоля, дикапрат пропиленгликоля, диундецилат пропиленгликоля, дилаурат пропиленгликоля, дитридецилат пропиленгликоля, димиристат пропиленгликоля, димиристолат пропиленгликоля, дипентадецилат пропиленгликоля, дипальмитат пропиленгликоля, дипальмитолеат пропиленгликоля, дисапиенат пропиленгликоля, димаргарат пропиленгликоля, дистеарат пропиленгликоля, дипальмитостеарат пропиленгликоля, диолеат пропиленгликоля, диэлаидат пропиленгликоля, дивакцинат пропиленгликоля, дилинолеат пропиленгликоля, дилиноэлаидат пропиленгликоля, ди-α-линоленат пропиленгликоля, ди-γ-линоленат пропиленгликоля, дистеаридонат пропиленгликоля, дикаприлокапрат пропиленгликоля, дидикаприлокапрат пропиленгликоля или любую их комбинацию.
Производимые промышленностью фармацевтически приемлемые гликолевые эфиры жирных кислот включают, без ограничения, монопальмитостеарат пропиленгликоля (MONOSTEOL®), дикаприлокапрат пропиленгликоля (LABRAFAC® PG), монолауран пропиленгликоля (тип I) (LAUROGLYCOL® FCC), монолауран пропиленгликоля (тип II) (LAUROGLYCOL® 90), монокаприлат пропиленгликоля (тип I) (CAPRYOL® PGMC) и монокаприлат пропиленгликоля (тип II) (CAPRYOL® 90).
Твердый жир, применяемый в раскрытых в изобретении фармацевтических композициях, может представлять собой фармацевтически приемлемый простой полиэфир сложного эфира жирной кислоты. Фармацевтически приемлемый простой полиэфир сложного эфира жирной кислоты может представлять собой простой полиэфир сложного моноэфира жирной кислоты, простой полиэфир сложного диэфира жирной кислоты или простой полиэфир сложного триэфира жирной кислоты. Простой полиэфир сложного эфира жирной кислоты включает, без ограничения, ПЭГ сложный эфир жирной кислоты, ПЭГ глицерил жирной кислоты, ПЭГ глицерид сложного эфира жирной кислоты, ППГ сложный эфир жирной кислоты, ППГ глицерил жирной кислоты и ППГ глицерид сложного эфира жирной кислоты. Молекулярные массы ПЭГ или ППГ могут составлять, например, 5-20000. Неограничивающие примеры простого полиэфира сложного эфира жирной кислоты включают, например, ПЭГ каприлат, ПЭГ пеларгонат, ПЭГ капрат, ПЭГ ундецилат, ПЭГ лаурат, ПЭГ тридецилат, ПЭГ миристат, ПЭГ миристолат, ПЭГ пентадецилат, ПЭГ пальмитат, ПЭГ пальмитолеат, ПЭГ сапиенат, ПЭГ маргарат, ПЭГ стеарат, ПЭГ польмитостеарат, ПЭГ олеат, ПЭГ элаидат, ПЭГ вакцинат, ПЭГ линолеат, ПЭГ линоэлаидат, ПЭГ α-линоленат, ПЭГ γ-линоленат, ПЭГ стеаридонат, ПЭГ каприлокапрат, ПЭГ дикаприлокапрат, ПЭГ глицерил каприлат, ПЭГ глицерил пеларгонат, ПЭГ глицерил капрат, ПЭГ глицерил ундецилат, ПЭГ глицерил лаурат, ПЭГ глицерил тридецилат, ПЭГ глицерил миристат, ПЭГ глицерил миристолат, ПЭГ глицерил пентадецилат, ПЭГ глицерил пальмитат, ПЭГ глицерил пальмитолеат, ПЭГ глицерил сапиенат, ПЭГ глицерил маргарат, ПЭГ глицерил стеарат, ПЭГ глицерил пальмитостеарат, ПЭГ глицерил олеат, ПЭГ глицерил элаидат, ПЭГ глицерил вакцинат, ПЭГ глицерил линолеат, ПЭГ глицерил линоэлаидат, ПЭГ глицерил α-линоленат, ПЭГ глицерил γ-линоленат, ПЭГ глицерил стеаридонат, ПЭГ глицерил каприлокапрат, ПЭГ глицерил дикаприлокапрат, каприлоил ПЭГ глицерид, пеларгоноил ПЭГ глицерид, капроил ПЭГ глицерид, ундецилоил ПЭГ глицерид, лауроил ПЭГ глицерид, тридецилоил ПЭГ глицерид, миристоил ПЭГ глицерид, миристолоил ПЭГ глицерид, пентадециклоил ПЭГ глицерид, пальмитоил ПЭГ глицерид, пальмитолеоил ПЭГ глицерид, сапиеноил ПЭГ глицерид, маргароил ПЭГ глицерид, стеароил ПЭГ глицерид, пальмитостеароил ПЭГ глицерид, олеоил ПЭГ глицерид, элаидоил ПЭГ глицерид, вакциноил ПЭГ глицерид, линолеоил ПЭГ глицерид, линоэлаидоил ПЭГ глицерид, α-линоленоил ПЭГ глицерид, γ-линоленоил ПЭГ глицерид, стеаридоноил ПЭГ глицерид, каприлокапроил ПЭГ глицерид, дикаприлокапроил ПЭГ глицерид, ППГ каприлат, ППГ пеларгонат, ППГ капрат, ППГ ундецилат, ППГ лаурат, ППГ тридецилат, ППГ миристат, ППГ миристолат, ППГ пентадецилат, ППГ пальмитат, ППГ пальмитолеат, ППГ сапиенат, ППГ маргарат, ППГ стеарат, ППГ пальмитостеарат, ППГ олеат, ППГ элаидат, ППГ вакцинат, ППГ линолеат, ППГ линоэлаидат, ППГ α-линоленат, ППГ γ-линоленат, ППГ стеаридонат, ППГ каприлокапрат, ППГ дикаприлокапрат, ППГ глицерил каприлат, ППГ глицерил пеларгонат, ППГ глицерил капрат, ППГ глицерил ундецилат, ППГ глицерил лаурат, ППГ глицерил тридецилат, ППГ глицерил миристат, ППГ глицерил миристолат, ППГ глицерил пентадецилат, ППГ глицерил пальмитат, ППГ глицерил пальмитолеат, ППГ глицерил сапиенат, ППГ глицерил маргарат, ППГ глицерил стеарат, ППГ глицерил пальмитостеарат, ППГ глицерил олеат, ППГ глицерил элаидат, ППГ глицерил вакцинат, ППГ глицерил линолеат, ППГ глицерил линоэлаидат, ППГ глицерил α-линоленат, ППГ глицерил γ-линоленат, ППГ глицерил стеаридонат, ППГ глицерил каприлокапрат, ППГ глицерил дикаприлокапрат, каприлоил ППГ глицерид, пеларгоноил ППГ глицерид, капроил ППГ глицерид, ундецилоил ППГ глицерид, лауроил ППГ глицерид, тридецилоил ППГ глицерид, миристоил ППГ глицерид, миристолоил ППГ глицерид, пентадециклоил ППГ глицерид, пальмитоил ППГ глицерид, пальмитолеоил ППГ глицерид, сапиеноил ППГ глицерид, маргароил ППГ глицерид, стеароил ППГ глицерид, пальмитостеароил ППГ глицерид, олеоил ППГ глицерид, элаидоил ППГ глицерид, вакциноил ППГ глицерид, линолеоил ППГ глицерид, линоэлаидоил ППГ глицерид, α-линоленоил ППГ глицерид, γ-линоленоил ППГ глицерид, стеаридоноил ППГ глицерид, каприлокапроил ППГ глицерид, дикаприлокапроил ППГ глицерид или любую их комбинацию.
Выпускаемые промышленностью фармацевтически приемлемые простые полиэфиры сложного эфира жирной кислоты включают, без ограничения, каприлокапроил макрогол-8 глицериды (LABRASOL®), ПЭГ-8 воск (APIFIL®), лауроил макрогол-32 глицериды (GELUCIRE 44/14), стеароил макрогол-32 глицериды (GELUCIRE 50,13), линолеоил макрогол-6 глицериды (LABRAFIL® M2125CS), олеоил макрогол-6 глицериды (LABRAFIL® M1944CS) и лауроил макрогол-6 глицериды (LABRAFIL® M2130CS).
Другой липид, применяемый в раскрытых в изобретении фармацевтических композициях, может представлять собой фармацевтически приемлемый жидкий при комнатной температуре липид. Называемый также "жидким жиром", жидкий при комнатной температуре липид включает любую жирную кислоту, которая является жидкой при нормальной комнатной температуре, такой как, например, приблизительно 20°C. Жидкий при комнатной температуре липид включает обширную группу соединений, которые обычно растворимы в органических растворителях и обычно не растворимы в воде. Примеры смесей фармацевтически приемлемых жидких при комнатной температуре липидоы включают, без ограничения, смесь одной или более раскрытых в изобретении жирных кислот, смесь одного или более частично гидролизованного жира и смесь одного или более частично гидрированного жира.
Фармацевтически приемлемый жидкий при комнатной температуре липид включает фармацевтически приемлемый частично гидрированный жир. Процесс гидрирования добавляет атомы водорода к ненасыщенному липиду, удаляет двойные связи и позволяет получить частично или полностью насыщенный липид. Частичное гидрирование является химическим процессом, а не ферментативным, в результате которого происходит превращение части цис-изомеров в тран-ненасыщенные липиды вместо их полного гидрирования. На первой стадии реакции, добавляется один водород, при этом другой координационно ненасыщенный углерод образует связь с катализатором. Вторая стадия представляет собой добавление водорода к оставшемуся углероду с образованием насыщенной жирной кислоты. Первая стадия является обратимой, вследствие чего водород реадсорбируется на катализаторе и повторно образуется двойная связь. Промежуточное соединение только с одним добавленным водородом не содержит двойной связи и может свободно вращаться. Благодаря этому, может повторно образовываться двойная связь либо в форме цис-, либо в форме транс-, из которых транс- является предпочтительной, независимо от исходного материала.
Раскрытая в изобретении фармацевтическая композиция может включать жидкий при комнатной температуре липид в количестве, достаточном для растворения раскрытого в изобретении терапевтического соединения. В другом аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать жидкий при комнатной температуре липид в количестве, например, менее чем приблизительно 90% по массе, менее чем приблизительно 80% по массе, менее чем приблизительно 70% по массе, менее чем приблизительно 65% по массе, менее чем приблизительно 60% по массе, менее чем приблизительно 55% по массе, менее чем приблизительно 50% по массе, менее чем приблизительно 45% по массе, менее чем приблизительно 40% по массе, менее чем приблизительно 35% по массе, менее чем приблизительно 30% по массе, менее чем приблизительно 25% по массе, менее чем приблизительно 20% по массе, менее чем приблизительно 15% по массе, менее чем приблизительно 10% по массе, менее чем приблизительно 5% по массе или менее чем приблизительно 1% по массе. В другом аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать жидкий при комнатной температуре липид в количестве в диапазоне, например, приблизительно от 1% до 90% по массе, приблизительно от 1% до 80% по массе, приблизительно от 1% до 70% по массе, приблизительно от 1% до 60% по массе, приблизительно от 1% до 50% по массе, приблизительно от 1% до 40% по массе, приблизительно от 1% до 30% по массе, приблизительно от 1% до 20% по массе, приблизительно от 1% до 10% по массе, приблизительно от 2% до 50% по массе, приблизительно от 2% до 40% по массе, приблизительно от 2% до 30% по массе, приблизительно от 2% до 20% по массе, приблизительно от 2% до 10% по массе, приблизительно от 4% до 50% по массе, приблизительно от 4% до 40% по массе, приблизительно от 4% до 30% по массе, приблизительно от 4% до 20% по массе, приблизительно от 4% до 10% по массе, приблизительно от 6% до 50% по массе, приблизительно от 6% до 40% по массе, приблизительно от 6% до 30% по массе, приблизительно от 6% до 20% по массе, приблизительно от 6% до 10% по массе, приблизительно от 8% до 50% по массе, приблизительно от 8% до 40% по массе, приблизительно от 8% до 30% по массе, приблизительно от 8% до 20% по массе, приблизительно от 8% до 15% по массе или приблизительно от 8% до 12% по массе.
Примеры фармацевтически приемлемых жидких при комнатной температуре липидов включают моноглицериды, в том числе, без ограничения, глицерина мономиристолеат, глицерина монопальмитолеат, глицерина моносапиенат, глицерина моноолеат, глицерина моноэлаидат, глицерина моновакценат, глицерина монолинолеат, глицерина монолиноэлаидат, глицерина монолиноленат, глицерина моностеаридонат, глицерина моноэйкозеноат, глицерина мономеадат, глицерина моноарахидонат, глицерина моноэйкозапентаеноат, глицерина моноэрукат, глицерина монодокозагексаеноат и глицерина мононервонат.
Производимые промышленностью фармацевтически приемлемые жидкие при комнатной температуре липиды включают, без ограничения, глицерил дибегенат (COMPRITOL® 888), глицерина дибегенат (COMPRITOL® E ATO), глицерина дипальмитостеарат (Biogapress Vegetal BM297ATO), глицерина дистеарат (тип I) (PRECIROL® ATO 5) и глицерина монолинолеат (MAISINE™ 35-1).
Аспекты настоящего изобретения раскрывают, помимо всего прочего, стабилизатор. Стабилизатор представляет собой соединение, которое взаимодействует со свободной кислотой или основанием, присутствующими на раскрытом в изобретении терапевтическом соединении, для экранирования зарядов, тем самым препятствуя ионным взаимодействиям между матрицами терапевтическое соединение/липид и предотвращая их конфигурации, необходимые для образования кристаллических матриц твердофазной композиции. Следовательно, стабилизатор предотвращает термодинамический переход композиции в классическую твердую фазу или растягивает во времени этот переход в такой степени, что он не происходит. Примеры стабилизаторов включают жидкий полимер гликоля, одноатомный спирт, диметиловый эфир изосорбида и моноэтиловый эфир диэтиленгликоля (2-(2-этоксиэтокси)этанол) (TRANSCUTOL®).
Раскрытая в изобретении фармацевтическая композиция может включать стабилизатор в количестве, достаточном для стабилизации свободной кислоты или основания, присутствующих на раскрытом в изобретении терапевтическом соединении. В другом аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать стабилизатор в количестве, например, менее чем приблизительно 40% по массе, менее чем приблизительно 35% по массе, менее чем приблизительно 30% по массе, менее чем приблизительно 25% по массе, менее чем приблизительно 20% по массе, менее чем приблизительно 19% по массе, менее чем приблизительно 18% по массе, менее чем приблизительно 17% по массе, менее чем приблизительно 16% по массе, менее чем приблизительно 15% по массе, менее чем приблизительно 14% по массе, менее чем приблизительно 13% по массе, менее чем приблизительно 12% по массе, менее чем приблизительно 11% по массе, менее чем приблизительно 10% по массе, менее чем приблизительно 9% по массе, менее чем приблизительно 8% по массе, менее чем приблизительно 7% по массе, менее чем приблизительно 6% по массе, менее чем приблизительно 5% по массе, менее чем приблизительно 4% по массе, менее чем приблизительно 3% по массе, менее чем приблизительно 2% по массе или менее чем приблизительно 1%. В другом аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать стабилизатор в количестве, например, от приблизительно 1% до приблизительно 5% по массе, от приблизительно 1% до приблизительно 7% по массе, от приблизительно 1% до приблизительно 10% по массе, от приблизительно 1% до приблизительно 12% по массе, от приблизительно 1% до приблизительно 15% по массе, от приблизительно 1% до приблизительно 18% по массе, от приблизительно 1% до приблизительно 20% по массе, от приблизительно 2% до приблизительно 5% по массе, от приблизительно 2% до приблизительно 7% по массе, от приблизительно 2% до приблизительно 10% по массе, от приблизительно 2% до приблизительно 12% по массе, от приблизительно 2% до приблизительно 15% по массе, от приблизительно 2% до приблизительно 18% по массе, от приблизительно 2% до приблизительно 20% по массе, от приблизительно 3% до приблизительно 5% по массе, от приблизительно 3% до приблизительно 7% по массе, от приблизительно 3% до приблизительно 10% по массе, от приблизительно 3% до приблизительно 12% по массе, от приблизительно 3% до приблизительно 15% по массе, от приблизительно 3% до приблизительно 18% по массе, от приблизительно 3% до приблизительно 20% по массе, от приблизительно 4% до приблизительно 5% по массе, от приблизительно 4% до приблизительно 7% по массе, от приблизительно 4% до приблизительно 10% по массе, от приблизительно 4% до приблизительно 12% по массе, от приблизительно 4% до приблизительно 15% по массе, от приблизительно 4% до приблизительно 18% по массе, от приблизительно 4% до приблизительно 20% по массе, от приблизительно 5% до приблизительно 7% по массе, от приблизительно 5% до приблизительно 10% по массе, от приблизительно 5% до приблизительно 12% по массе, от приблизительно 5% до приблизительно 15% по массе, от приблизительно 5% до приблизительно 18% по массе, от приблизительно 5% до приблизительно 20% по массе, от приблизительно 6% до приблизительно 7% по массе, от приблизительно 6% до приблизительно 10% по массе, от приблизительно 6% до приблизительно 12% по массе, от приблизительно 6% до приблизительно 15% по массе, от приблизительно 6% до приблизительно 18% по массе, от приблизительно 6% до приблизительно 20% по массе, от приблизительно 7% до приблизительно 10% по массе, от приблизительно 7% до приблизительно 12% по массе, от приблизительно 7% до приблизительно 15% по массе, от приблизительно 7% до приблизительно 18% по массе, от приблизительно 7% до приблизительно 20% по массе, от приблизительно 8% до приблизительно 10% по массе, от приблизительно 8% до приблизительно 12% по массе, от приблизительно 8% до приблизительно 15% по массе, от приблизительно 8% до приблизительно 18% по массе, от приблизительно 8% до приблизительно 20% по массе, от приблизительно 9% до приблизительно 10% по массе, от приблизительно 9% до приблизительно 12% по массе, от приблизительно 9% до приблизительно 15% по массе, от приблизительно 9% до приблизительно 18% по массе, от приблизительно 9% до приблизительно 20% по массе, от приблизительно 10% до приблизительно 12% по массе, от приблизительно 10% до приблизительно 15% по массе, от приблизительно 10% до приблизительно 18% по массе или от приблизительно 10% до приблизительно 20% по массе.
Раскрытый в изобретении стабилизатор не является растворителем, так как он используется в количестве, которое не приводит к существенному растворению растворяемого вещества. По этой причине, количество стабилизатора, используемое в раскрытой в изобретении композиции твердого раствора, приводит к не более чем 85% растворению раскрытого в изобретении терапевтического соединения. В аспектах этого варианта осуществления, количество стабилизатора, используемое в раскрытой в изобретении композиции твердого раствора, приводит к, например, не более чем 80%, не более чем 75%, не более чем 70%, не более чем 65%, не более чем 60%, не более чем 55%, не более чем 50%, не более чем 45%, не более чем 40%, не более чем 35%, не более чем 30%, не более чем 25%, не более чем 20%, не более чем 15%, не более чем 10% или не более чем 5% растворению раскрытого в изобретении терапевтического соединения.
В одном варианте осуществления, полимер гликоля может включать фармацевтически приемлемый полимер ПЭГ. Полимеры ПЭГ, также называемые полимерами полиэтиленоксида (PEO) или полимерами полиоксиэтилена (POE), получают полимеризацией оксида этилена и они производятся промышленностью с широким диапазоном молекулярных масс от 100 г/моль до 10000000 г/моль. Полимеры ПЭГ с низкой молекулярной массой представляют собой жидкости или низкоплавкие твердые вещества, тогда как полимеры ПЭГ с высокой молекулярной массой являются твердыми веществами. В аспекте этого варианта осуществления, полимер ПЭГ, используемый в качестве стабилизатора, является жидким полимером ПЭГ. В аспектах этого варианта осуществления, полимер ПЭГ имеет молекулярную массу, например, не более чем 100 г/моль, не более чем 200 г/моль, не более чем 300 г/моль, не более чем 400 г/моль, не более чем 500 г/моль, не более чем 600 г/моль, не более чем 700 г/моль, не более чем 800 г/моль, не более чем 900 г/моль или не более чем 1000 г/моль.
Полимер ПЭГ включают, без ограничения, ПЭГ 100, ПЭГ 200, ПЭГ 300, ПЭГ 400, ПЭГ 500, ПЭГ 600, ПЭГ 700, ПЭГ 800, ПЭГ 900, ПЭГ 1000, ПЭГ 1100, ПЭГ 1200, ПЭГ 1300, ПЭГ 1400, ПЭГ 1500, ПЭГ 1600, ПЭГ 1700, ПЭГ 1800, ПЭГ 1900, ПЭГ 2000, ПЭГ 2100, ПЭГ 2200, ПЭГ 2300, ПЭГ 2400, ПЭГ 2500, ПЭГ 2600, ПЭГ 2700, ПЭГ 2800, ПЭГ 2900, ПЭГ 3000, ПЭГ 3250, ПЭГ 3350, ПЭГ 3500, ПЭГ 3750, ПЭГ 4000, ПЭГ 4250, ПЭГ 4500, ПЭГ 4750, ПЭГ 5000, ПЭГ 5500, ПЭГ 6000, ПЭГ 6500, ПЭГ 7000, ПЭГ 7500, ПЭГ 8000, ПЭГ 8500, ПЭГ 9000, ПЭГ 9500, ПЭГ 10000, ПЭГ 11000, ПЭГ 12000, ПЭГ 13000, ПЭГ 14000, ПЭГ 15000, ПЭГ 16000, ПЭГ 17000, ПЭГ 18000, ПЭГ 19000 или ПЭГ 20000.
В другом варианте осуществления, полимер гликоля может включать фармацевтически приемлемый полимер полипропиленгликоля (ППГ). Полимеры ППГ, называемые также полимерами полипропилен оксида (ППО) или полимерами полиоксипропилена (ПОП), получают полимеризацией оксида пропилена и они производятся промышленностью с широким диапазоном молекулярных масс от 100 г/моль до 10000000 г/моль. Полимеры ППГ с низкой молекулярной массой представляют собой жидкости или низкоплавкие твердые вещества, тогда как полимеры ППГ с высокой молекулярной массой являются твердыми веществами. В аспекте этого варианта осуществления, Полимер ППГ, используемый в качестве стабилизатора, является жидким полимером ППГ. В аспектах этого варианта осуществления, полимер ППГ имеет молекулярную массу, например, не более чем 100 г/моль, не более чем 200 г/моль, не более чем 300 г/моль, не более чем 400 г/моль, не более чем 500 г/моль, не более чем 600 г/моль, не более чем 700 г/моль, не более чем 800 г/моль, не более чем 900 г/моль или не более чем 1000 г/моль.
Полимер ППГ включает, без ограничения, ППГ 100, ППГ 200, ППГ 300, ППГ 400, ППГ 500, ППГ 600, ППГ 700, ППГ 800, ППГ 900, ППГ 1000, ППГ 1100, ППГ 1200, ППГ 1300, ППГ 1400, ППГ 1500, ППГ 1600, ППГ 1700, ППГ 1800, ППГ 1900, ППГ 2000, ППГ 2100, ППГ 2200, ППГ 2300, ППГ 2400, ППГ 2500, ППГ 2600, ППГ 2700, ППГ 2800, ППГ 2900, ППГ 3000, ППГ 3250, ППГ 3350, ППГ 3500, ППГ 3750, ППГ 4000, ППГ 4250, ППГ 4500, ППГ 4750, ППГ 5000, ППГ 5500, ППГ 6000, ППГ 6500, ППГ 7000, ППГ 7500, ППГ 8000, ППГ 8500, ППГ 9000, ППГ 9500, ППГ 10000, ППГ 11000, ППГ 12000, ППГ 13000, ППГ 14000, ППГ 15000, ППГ 16000, ППГ 17000, ППГ 18000, ППГ 19000 или ППГ 20000.
В качестве стабилизатора может быть также использован одноатомный спирт. В аспектах этого варианта осуществления, одноатомный спирт может представлять, например, С2-4 спирт, С1-4 спирт, С1-5 спирт, С1-7 спирт, С1-10 спирт, С1-15 спирт или С1-20 спирт. Примеры одноатомного спирта включают, без ограничения, метанол, этанол, пропанол, бутанол, пентанол и 1-гексадеканол.
Аспекты настоящего изобретения раскрывают, помимо всего прочего, нейтрализатор. Нейтрализатор представляет собой соединение, которое взаимодействует с раскрытом в изобретении терапевтическим соединением в его солевой форме для нейтрализации ионных зарядов, образующихся при растворении терапевтического соединения, тем самым препятствуя ионным взаимодействиям между матрицами терапевтическое соединение/липид и предотвращая их конфигурации, необходимые для образования кристаллических матриц твердофазной композиции. Следовательно, нейтрализатор предотвращает термодинамический переход композиции в классическую твердую фазу или растягивает во времени этот переход в такой степени, что он не происходит. Примеры нейтрализатора включают раскрытые в изобретении жирные кислоты для лекарственных средств в форме солей присоединения основания и ацетат натрия или триэтаноламин для лекарственных средств в форме солей присоединения кислоты.
Используемое количество нейтрализатора зависит от требуемой степени нейтрализации заряда. Для полной нейтрализации, к составу добавляют один эквивалент нейтрализатора по отношению к терапевтическому соединению. Для частичной нейтрализации, добавляют меньше одного эквивалента нейтрализатора. Частичная нейтрализация предпочтительна при приготовлении состава с замедленным высвобождением. После введения, часть терапеватического средства мгновенно становится доступной для организма (мгновенная биодоступность), в то время как биодоступность другой части задерживается до тех пор, пока терапевтическое соединение нейтрализовано в результате действия нейтрализатора. Нейтрализатор может быть также добавлен в избыточном количестве, то есть в количестве более чем один эквивалент по отношению к терапевтическому соединению. Кроме нейтрализации солевой формы лекарственного средства, избыточные количества нейтрализатора могут также позволять корректировать температуру плавления композиции твердого раствора.
В аспектах этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать нейтрализатор в количестве, например, по меньшей мере, 5 мг, по меньшей мере, 10 мг, по меньшей мере, 15 мг, по меньшей мере, 20 мг, по меньшей мере, 25 мг, по меньшей мере, 30 мг, по меньшей мере, 35 мг, по меньшей мере, 40 мг, по меньшей мере, 45 мг, по меньшей мере, 50 мг, по меньшей мере, 55 мг, по меньшей мере, 60 мг, по меньшей мере, 65 мг, по меньшей мере, 70 мг, по меньшей мере, 75 мг, по меньшей мере, 80 мг, по меньшей мере, 85 мг, по меньшей мере, 90 мг, по меньшей мере, 95 мг или, по меньшей мере, 100 мг. В другом аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать нейтрализатор в количестве, например, по меньшей мере, 5 мг, по меньшей мере, 10 мг, по меньшей мере, 20 мг, по меньшей мере, 25 мг, по меньшей мере, 50 мг, по меньшей мере, 75 мг, по меньшей мере, 100 мг, по меньшей мере, 200 мг, по меньшей мере, 300 мг, по меньшей мере, 400 мг, по меньшей мере, 500 мг, по меньшей мере, 600 мг, по меньшей мере, 700 мг, по меньшей мере, 800 мг, по меньшей мере, 900 мг, по меньшей мере, 1000 мг, по меньшей мере, 1100 мг, по меньшей мере, 1200 мг, по меньшей мере, 1300 мг, по меньшей мере, 1400 мг или, по меньшей мере, 1500 мг. В еще одних аспектах варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать нейтрализатор в количестве, например, от приблизительно 5 мг до приблизительно 100 мг, от приблизительно 10 мг до приблизительно 100 мг, от приблизительно 50 мг до приблизительно 150 мг, от приблизительно 100 мг до приблизительно 250 мг, от приблизительно 150 мг до приблизительно 350 мг, от приблизительно 250 мг до приблизительно 500 мг, от приблизительно 350 мг до приблизительно 600 мг, от приблизительно 500 мг до приблизительно 750 мг, от приблизительно 600 мг до приблизительно 900 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 850 мг до приблизительно 1200 мг или от приблизительно 1000 мг до приблизительно 1500 мг. В еще одних аспектах этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать нейтрализатор в количестве, например, от приблизительно 10 мг до приблизительно 250 мг, от приблизительно 10 мг до приблизительно 500 мг, от приблизительно 10 мг до приблизительно 750 мг, от приблизительно 10 мг до приблизительно 1000 мг, от приблизительно 10 мг до приблизительно 1500 мг, от приблизительно 50 мг до приблизительно 250 мг, от приблизительно 50 мг до приблизительно 500 мг, от приблизительно 50 мг до приблизительно 750 мг, от приблизительно 50 мг до приблизительно 1000 мг, от приблизительно 50 мг до приблизительно 1500 мг, от приблизительно 100 мг до приблизительно 250 мг, от приблизительно 100 мг до приблизительно 500 мг, от приблизительно 100 мг до приблизительно 750 мг, от приблизительно 100 мг до приблизительно 1000 мг, от приблизительно 100 мг до приблизительно 1500 мг, от приблизительно 200 мг до приблизительно 500 мг, от приблизительно 200 мг до приблизительно 750 мг, от приблизительно 200 мг до приблизительно 1000 мг, от приблизительно 200 мг до приблизительно 1500 мг, от приблизительно 5 мг до приблизительно 1500 мг, от приблизительно 5 мг до приблизительно 1000 мг или от приблизительно 5 мг до приблизительно 250 мг.
В другом аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать нейтрализатор в количестве, например, менее чем приблизительно 90% по массе, менее чем приблизительно 80% по массе, менее чем приблизительно 70% по массе, менее чем приблизительно 65% по массе, менее чем приблизительно 60% по массе, менее чем приблизительно 55% по массе, менее чем приблизительно 50% по массе, менее чем приблизительно 45% по массе, менее чем приблизительно 40% по массе, менее чем приблизительно 35% по массе, менее чем приблизительно 30% по массе, менее чем приблизительно 25% по массе, менее чем приблизительно 20% по массе, менее чем приблизительно 15% по массе, менее чем приблизительно 10% по массе, менее чем приблизительно 5% по массе или менее чем приблизительно 1% по массе. В другом аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать нейтрализатор в количестве, например, приблизительно от 1% до 90% по массе, приблизительно от 1% до 80% по массе, приблизительно от 1% до 75% по массе, приблизительно от 1% до 70% по массе, приблизительно от 1% до 65% по массе, приблизительно от 1% до 60% по массе, приблизительно от 1% до 55% по массе, приблизительно от 1% до 50% по массе, приблизительно от 1% до 45% по массе, приблизительно от 1% до 40% по массе, приблизительно от 1% до 35% по массе, приблизительно от 1% до 30% по массе, приблизительно от 1% до 25% по массе, приблизительно от 1% до 20% по массе, приблизительно от 1% до 15% по массе, приблизительно от 1% до 10% по массе, приблизительно от 1% до 5% по массе, приблизительно от 2% до 50% по массе, приблизительно от 2% до 40% по массе, приблизительно от 2% до 30% по массе, приблизительно от 2% до 20% по массе, приблизительно от 2% до 10% по массе, приблизительно от 4% до 50% по массе, приблизительно от 4% до 40% по массе, приблизительно от 4% до 30% по массе, приблизительно от 4% до 20% по массе, приблизительно от 4% до 10% по массе, приблизительно от 6% до 50% по массе, приблизительно от 6% до 40% по массе, приблизительно от 6% до 30% по массе, приблизительно от 6% до 20% по массе, приблизительно от 6% до 10% по массе, приблизительно от 8% до 50% по массе, приблизительно от 8% до 40% по массе, приблизительно от 8% до 30% по массе, приблизительно от 8% до 20% по массе, приблизительно от 8% до 15% по массе или приблизительно от 8% до 12% по массе.
В другом аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может включать нейтрализатор в количестве, например, от приблизительно 0,1% до приблизительно 45% по массе, от приблизительно 0,1% до приблизительно 40% по массе, от приблизительно 0,1% до приблизительно 35% по массе, от приблизительно 0,1% до приблизительно 30% по массе, от приблизительно 0,1% до приблизительно 25% по массе, от приблизительно 0,1% до приблизительно 20% по массе, от приблизительно 0,1% до приблизительно 15% по массе, от приблизительно 0,1% до приблизительно 10% по массе, от приблизительно 0,1% до приблизительно 5% по массе, от приблизительно 1% до приблизительно 45% по массе, от приблизительно 1% до приблизительно 40% по массе, от приблизительно 1% до приблизительно 35% по массе, от приблизительно 1% до приблизительно 30% по массе, от приблизительно 1% до приблизительно 25% по массе, от приблизительно 1% до приблизительно 20% по массе, от приблизительно 1% до приблизительно 15% по массе, от приблизительно 1% до приблизительно 10% по массе, от приблизительно 1% до приблизительно 5% по массе, от приблизительно 5% до приблизительно 45% по массе, от приблизительно 5% до приблизительно 40% по массе, от приблизительно 5% до приблизительно 35% по массе, от приблизительно 5% до приблизительно 30% по массе, от приблизительно 5% до приблизительно 25% по массе, от приблизительно 5% до приблизительно 20% по массе, от приблизительно 5% до приблизительно 15% по массе, от приблизительно 5% до приблизительно 10% по массе, от приблизительно 10% до приблизительно 45% по массе, от приблизительно 10% до приблизительно 40% по массе, от приблизительно 10% до приблизительно 35% по массе, от приблизительно 10% до приблизительно 30% по массе, от приблизительно 10% до приблизительно 25% по массе, от приблизительно 10% до приблизительно 20% по массе, от приблизительно 10% до приблизительно 15% по массе, от приблизительно 15% до приблизительно 45% по массе, от приблизительно 15% до приблизительно 40% по массе, от приблизительно 15% до приблизительно 35% по массе, от приблизительно 15% до приблизительно 30% по массе, от приблизительно 15% до приблизительно 25% по массе, от приблизительно 15% до приблизительно 20% по массе, от приблизительно 20% до приблизительно 45% по массе, от приблизительно 20% до приблизительно 40% по массе, от приблизительно 20% до приблизительно 35% по массе, от приблизительно 20% до приблизительно 30% по массе, от приблизительно 20% до приблизительно 25% по массе, от приблизительно 25% до приблизительно 45% по массе, от приблизительно 25% до приблизительно 40% по массе, от приблизительно 25% до приблизительно 35% по массе или от приблизительно 25% до приблизительно 30% по массе.
Раскрытая в изобретении фармацевтическая композиция может необязательно включать фармацевтически приемлемый носитель, который облегчает переработку активного ингредиента в фармацевтически приемлемые композиции. Используемый в изобретении термин "фармацевтически приемлемый носитель" является синонимом "фармакологического носителя" и означает любой носитель, который практически не обладает длительным или постоянным вредным воздействием при введении, и включает в себя такие термины, как "фармакологически приемлемые среда, стабилизатор, разбавитель, добавка, вспомогательное вещество или наполнитель". Такой носитель обычно смешивают с активным соединением или растворяют активное соединение в нем или заключают в него, и такой носитель может представлять собой твердое, полутвердое или жидкое вещество. Подразумевается, что активные ингредиенты могут быть растворены или могут быть введены в виде суспензии в требуемый носитель и разбавитель. Может быть использован любой из множества фармацевтически приемлемых носителей, включая, без ограничения, водные среды, такие как, например, вода, физиологический раствор, глицин, гиалуроновая кислота и другие подобные среды; твердые носители, такие как, например, маннит, лактоза, крахмал, стеарат магния, сахарин натрия, тальк, целлюлоза, сахароза, карбонат магния и другие подобные вещества; растворители; дисперсионные среды; покрытия; антибактериальные и противогрибковые средства; изотонические и замедляющие абсорбцию средства или другие неактивные ингредиенты. Выбор фармакологически приемлемого носителя может зависеть от способа введения. За исключением тех случаев, когда какой-либо фармацевтически приемлемый носитель не совместим с активным ингредиентом, для его использования в фармацевтически приемлемых композициях нет ограничений. Неограничивающие примеры конкретного применения таких фармацевтических носителей можно найти в следующих монографиях и справочниках: Pharmaceutical Dosage Forms and Drug Delivery Systems (Howard C. Ansel et al., eds., Lippincott Williams & Wilkins Publishers, 7th ed. 1999); REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY (Alfonso R. Gennaro ed., Lippincott, Williams & Wilkins, 20th ed. 2000); Goodman & Gilman's The Pharmacological Basis of Therapeutics (Joel G. Hardman et al., eds., McGraw-Hill Professional, 10th ed. 2001); and Handbook of Pharmaceutical Excipients (Raymond C. Rowe et al., APhA Publications, 4th edition 2003). Эти протоколы представляют собой общепринятые методики, и любые их модификации могут быть осуществлены любым специалистом в этой области и исходя из идеи настоящего изобретения.
Раскрытая в изобретении фармацевтическая композиция может необязательно включать, без ограничения, другие фармацевтически приемлемые компоненты (или фармацевтические компоненты), в том числе, без ограничения, буферы, консерванты, вещества, регулирующие тоничность, соли, антиоксиданты, вещества, корректирующие осмоляльность, физиологические вещества, фармакологические вещества, объемообразующие вещества, эмульгаторы, увлажняющие средства, подсластители или ароматизаторы и другие подобные вещества. Для приготовления раскрытой в изобретении фармацевтической композиции могут быть использованы различный буферы и средства для корректировки рН, при условии, что полученный препарат будет фармацевтически приемлемым. Такие буферы включают, без ограничения, ацетатные буферы, цитратные буферы, фосфатные буферы, нейтральный забуференный физиологический раствор, забуференный фосфатом физиологический раствор и боратные буферы. Подразумевается, что, в случае необходимости, для корректировки рН композиции могут быть использованы кислоты и основания. Фармацевтически приемлемые антиоксиданты включают, без ограничения, метабисульфит натрия, тиосульфат натрия, ацетилцистеин, бутилированный гидроксианизол и бутилированный гидрокситолуол. Подходящие консерванты включают, без ограничения, бензалконий хлорид, хлорбутанол, тимеросал, ацетат фенилртути, нитрат фенилртути, стабилизированная оксихлорсодерожащая композиция и хелатообразующие соединения, такие как, например, диэтилентриаминпентауксусная кислота (DTPA) или DTPA-бисамид, кальций DTPA и CaNaDTPA-бисамид. Вещества, регулирующие тоничность, применяемые в фармацевтической композиции включают, без ограничения, соли, такие как, например, хлорид натрия, хлорид калия, маннит или глицерин и другие фармацевтически приемлемые вещества, регулирующие тоничность. Фармацевтическая композиция может быть приготовлена в виде соли, и соль может быть образована многими кислотами, включая, но этим не ограничивая, хлористоводородную, серную, уксусную, молочную, винную, яблочную, янтарную и другие кислоты. Соли, как правило, более растворимы в водных или других протонных растворителях, чем соответствующие формы свободного основания. Подразумевается, что эти и другие вещества, известные в области фармакологии, могут быть включены в фармацевтическую композицию.
В одном варианте осуществления, раскрытая в изобретении фармацевтическая композиция является твердой при комнатной температуре. В аспектах этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция может быть приготовлена так, чтобы быть твердой при температуре, например, приблизительно 35°C или ниже, приблизительно 34°C или ниже, приблизительно 33°C или ниже, приблизительно 32°C или ниже, приблизительно 31°C или ниже, приблизительно 30°C или ниже, приблизительно 29°C или ниже, приблизительно 28°C или ниже, приблизительно 27°C или ниже, приблизительно 26°C или ниже, приблизительно 25°C или ниже, приблизительно 24°C или ниже, приблизительно 23°C или ниже, приблизительно 22°C или ниже, приблизительно 21°C или ниже, приблизительно 20°C или ниже, приблизительно 19°C или ниже, приблизительно 18°C или ниже, приблизительно 17°C или ниже, приблизительно 16°C или ниже, приблизительно 15°C или ниже, приблизительно 14°C или ниже, приблизительно 13°C или ниже, приблизительно 12°C или ниже, приблизительно 11°C или ниже, приблизительно 10°C или ниже, приблизительно 9°C или ниже, приблизительно 8°C или ниже, приблизительно 7°C или ниже, приблизительно 6°C или ниже, приблизительно 5°C или ниже, приблизительно 4°C или ниже, приблизительно 3°C или ниже, приблизительно 2°C или ниже, приблизительно 1°C или ниже или приблизительно 0°C или ниже.
В другом аспекте этого варианта осуществления, раскрытая фармацевтическая композиция имеет температуру плавления, например, 5°C или выше, 10°C или выше, 15°C или выше, 16°C или выше, 17°C или выше, 18°C или выше, 19°C или выше, 20°C или выше, 21°C или выше, 22°C или выше, 23°C или выше, 24°C или выше, 25°C или выше, 26°C или выше, 27°C или выше, 28°C или выше, 29°C или выше, 30°C или выше, 31°C или выше, 32°C или выше, 33°C или выше, 34°C или выше, 35°C или выше, 36°C или выше или 37°C или выше. В другом аспекте этого варианта осуществления, раскрытая фармацевтическая композиция имеет температуру плавления в диапазоне, например, от приблизительно 5°C до приблизительно 24°C, от приблизительно 10°C до приблизительно 24°C, от приблизительно 22°C до приблизительно 24°C, от приблизительно 23°C до приблизительно 25°C, от приблизительно 24°C до приблизительно 26°C, от приблизительно 25°C до приблизительно 27°C, от приблизительно 26°C до приблизительно 28°C, от приблизительно 27°C до приблизительно 29°C, от приблизительно 28°C до приблизительно 30°C, от приблизительно 29°C до приблизительно 31°C, от приблизительно 30°C до приблизительно 32°C, от приблизительно 31°C до приблизительно 33°C, от приблизительно 32°C до приблизительно 34°C, от приблизительно 33°C до приблизительно 35°C, от приблизительно 34°C до приблизительно 36°C или от приблизительно 35°C до приблизительно 37°C. В другом аспекте этого варианта осуществления, раскрытая фармацевтическая композиция имеет температуру плавления в диапазоне, например, от приблизительно 22°C до приблизительно 26°C, от приблизительно 24°C до приблизительно 28°C, от приблизительно 26°C до приблизительно 30°C, от приблизительно 28°C до приблизительно 32°C, от приблизительно 30°C до приблизительно 34°C, от приблизительно 32°C до приблизительно 36°C или от приблизительно 34°C до приблизительно 38°C.
Аспекты настоящего изобретения раскрывают, помимо всего прочего, способ приготовления раскрытой в изобретении фармацевтической композиции твердого раствора. В одном варианте осуществления, раскрытый в изобретении способ включает стадии a) контактирования раскрытого в изобретении терапевтического соединения с одним или более жидкими при комнатной температуре липидами при условиях, которые способствуют растворению терапевтического соединения в одном или более липидах; и b) контактирования раствора соединение/липид с одним или более раскрытыми в изобретении твердыми при комнатной температуре липидами при условиях, которые способствуют образованию композиции твердого раствора.
В одном варианте осуществления, раскрытый в изобретении способ включает стадии a) контактирования раскрытого в изобретении терапевтического соединения с одним или более жидкими при комнатной температуре липидами и одним или более стабилизаторами при условиях, которые способствуют растворению терапевтического соединения в одном или более липидах; и b) контактирования раствора соединение/липид с одним или более раскрытыми в изобретении твердыми при комнатной температуре липидами при условиях, которые способствуют образованию композиции твердого раствора.
В одном варианте осуществления, раскрытый в изобретении способ включает стадии a) контактирования раскрытого в изобретении терапевтического соединения с одним или более жидкими при комнатной температуре липидами и одним или более нейтрализаторами при условиях, которые способствуют растворению терапевтического соединения в одном или более липидах; и b) контактирования раствора соединение/липид с одним или более раскрытыми в изобретении твердыми при комнатной температуре липидами при условиях, которые способствуют образованию композиции твердого раствора.
В одном варианте осуществления, раскрытый в изобретении способ включает стадии a) контактирования раскрытого в изобретении терапевтического соединения с одним или более жидкими при комнатной температуре липидами, одним или более стабилизаторами и одним или более нейтрализаторами при условиях, которые способствуют растворению терапевтического соединения в одном или более липидах; и b) контактирования раствора соединение/липид с одним или более раскрытыми в изобретении твердыми при комнатной температуре липидами при условиях, которые способствуют образованию композиции твердого раствора.
Раскрытый в изобретении способ осуществляют при условиях, которые способствуют растворению терапевтического соединения в других компонентах. В аспектах этого варианта осуществления, раскрытый в изобретении способ может быть осуществлен при температуре, достаточной для растворения терапевтического соединения в одном или более жидких при комнатной температуре липидах, и/или одном или более стабилизаторах, и/или одном или более нейтрализаторах с получением раствора. В другом аспекте этого варианта осуществления, раскрытый в изобретении способ включает нагревание смеси, содержащей раскрытое в изобретении терапевтическое соединение, до температуры, например, приблизительно 40°C, приблизительно 45°C, приблизительно 50°C, приблизительно 55°C, приблизительно 60°C, приблизительно 65°C, приблизительно 70°C или приблизительно 75°C. В еще одних аспектах варианта осуществления, раскрытый в изобретении способ включает нагревание смеси, содержащей раскрытое в изобретении терапевтическое соединение, до температуры, например, по меньшей мере, 40°C, по меньшей мере, 45°C, по меньшей мере, 50°C, по меньшей мере, 55°C, по меньшей мере, 60°C, по меньшей мере, 65°C, по меньшей мере, 70°C или, по меньшей мере, 75°C. В еще одних аспектах этого варианта осуществления, раскрытый в изобретении способ включает нагревание смеси, содержащей раскрытое в изобретении терапевтическое соединение, до температуры, например, не более 40°C, не более 45°C, не более 50°C, не более 55°C, не более 60°C, не более 65°C, не более 70°C или не более 75°C. В другом аспекте этого варианта осуществления, раскрытый в изобретении способ включает нагревание смеси, содержащей раскрытое в изобретении терапевтическое соединение, до температуры, например, от приблизительно 40°C до приблизительно 45°C, от приблизительно 40°C до приблизительно 50°C, от приблизительно 40°C до приблизительно 55°C, от приблизительно 40°C до приблизительно 60°C, от приблизительно 40°C до приблизительно 65°C, от приблизительно 40°C до приблизительно 70°C, от приблизительно 40°C до приблизительно 75°C, от приблизительно 45°C до приблизительно 50°C, от приблизительно 45°C до приблизительно 55°C, от приблизительно 45°C до приблизительно 60°C, от приблизительно 45°C до приблизительно 65°C, от приблизительно 45°C до приблизительно 70°C, от приблизительно 45°C до приблизительно 75°C, от приблизительно 50°C до приблизительно 55°C, от приблизительно 50°C до приблизительно 60°C, от приблизительно 50°C до приблизительно 65°C, от приблизительно 50°C до приблизительно 70°C, от приблизительно 50°C до приблизительно 75°C, от приблизительно 55°C до приблизительно 60°C, от приблизительно 55°C до приблизительно 65°C, от приблизительно 55°C до приблизительно 70°C, от приблизительно 55°C до приблизительно 75°C, от приблизительно 60°C до приблизительно 65°C, от приблизительно 60°C до приблизительно 70°C, от приблизительно 60°C до приблизительно 75°C, от приблизительно 65°C до приблизительно 70°C, от приблизительно 65°C до приблизительно 75°C или от приблизительно 70°C до приблизительно 75°C.
В другом аспекте этого варианта осуществления, раскрытый в изобретении способ может быть осуществлен при температуре, достаточной для введения одного или более твердых при комнатной температуре липидов в раствор, содержащий терапевтическое соединение. В другом аспекте этого варианта осуществления, раскрытый в изобретении способ включает нагревание смеси, содержащей раскрытое в изобретении терапевтическое соединение, до температуры, например, приблизительно 40°C, приблизительно 45°C, приблизительно 50°C, приблизительно 55°C, приблизительно 60°C, приблизительно 65°C, приблизительно 70°C или приблизительно 75°C, для введения одного или более твердых при комнатной температуре липидов. В еще одних аспектах варианта осуществления, раскрытый в изобретении способ включает нагревание смеси, содержащей раскрытое в изобретении терапевтическое соединение, до температуры, например, по меньшей мере, 40°C, по меньшей мере, 45°C, по меньшей мере, 50°C, по меньшей мере, 55°C, по меньшей мере, 60°C, по меньшей мере, 65°C, по меньшей мере, 70°C или, по меньшей мере, 75°C, для введения одного или более твердых при комнатной температуре липидов. В еще одних аспектах этого варианта осуществления, раскрытый в изобретении способ включает нагревание смеси, содержащей раскрытое в изобретении терапевтическое соединение, до температуры, например, не более 40°C, не более 45°C, не более 50°C, не более 55°C, не более 60°C, не более 65°C, не более 70°C или не более 75°C, для введения одного или более твердых при комнатной температуре липидов. В другом аспекте этого варианта осуществления, раскрытый в изобретении способ включает нагревание смеси, содержащей раскрытое в изобретении терапевтическое соединение, до температуры, например, от приблизительно 40°C до приблизительно 45°C, от приблизительно 40°C до приблизительно 50°C, от приблизительно 40°C до приблизительно 55°C, от приблизительно 40°C до приблизительно 60°C, от приблизительно 40°C до приблизительно 65°C, от приблизительно 40°C до приблизительно 70°C, от приблизительно 40°C до приблизительно 75°C, от приблизительно 45°C до приблизительно 50°C, от приблизительно 45°C до приблизительно 55°C, от приблизительно 45°C до приблизительно 60°C, от приблизительно 45°C до приблизительно 65°C, от приблизительно 45°C до приблизительно 70°C, от приблизительно 45°C до приблизительно 75°C, от приблизительно 50°C до приблизительно 55°C, от приблизительно 50°C до приблизительно 60°C, от приблизительно 50°C до приблизительно 65°C, от приблизительно 50°C до приблизительно 70°C, от приблизительно 50°C до приблизительно 75°C, от приблизительно 55°C до приблизительно 60°C, от приблизительно 55°C до приблизительно 65°C, от приблизительно 55°C до приблизительно 70°C, от приблизительно 55°C до приблизительно 75°C, от приблизительно 60°C до приблизительно 65°C, от приблизительно 60°C до приблизительно 70°C, от приблизительно 60°C до приблизительно 75°C, от приблизительно 65°C до приблизительно 70°C, от приблизительно 65°C до приблизительно 75°C или от приблизительно 70°C до приблизительно 75°C, для введения одного или более твердых при комнатной температуре липидов.
Аспекты настоящего изобретения раскрывают, помимо всего прочего, контактирование раскрытого в изобретении терапевтического соединения с одним или более липидами. В аспектах этого варианта осуществления, один или более липидов включают один, два, три, четыре или пять раскрытых в изобретении различных липидов. В другом аспекте этого варианта осуществления, один или более липидов включают два или более, три или более, четыре или более или пять или более раскрытых в изобретении различных липидов. В еще одних аспектах варианта осуществления, один или более липидов включают от приблизительно одного до приблизительно пяти раскрытых в изобретении различных липидов, от приблизительно двух до приблизительно пяти раскрытых в изобретении различных липидов, от приблизительно трех до приблизительно пяти раскрытых в изобретении различных липидов, от приблизительно одного до приблизительно четырех раскрытых в изобретении различных липидов, от приблизительно двух до приблизительно четырех раскрытых в изобретении различных липидов или от приблизительно двух до приблизительно трех раскрытых в изобретении различных липидов.
В другом аспекте этого варианта осуществления, один или более липидов включают один или более твердых при комнатной температуре липидов и один или более жидких при комнатной температуре липидов. В аспектах этого варианта осуществления, один или более липидов включают один, два, три, четыре или пять раскрытых в изобретении различных твердых жиров и один, два, три, четыре или пять раскрытых в изобретении различных жидких при комнатной температуре липидов. В другом аспекте этого варианта осуществления, один или более липидов включают два или более, три или более, четыре или более или пять или более раскрытых в изобретении различных твердых при комнатной температуре липидов и два или более, три или более, четыре или более или пять или более раскрытых в изобретении жидких при комнатной температуре липидов. В еще одних аспектах варианта осуществления, один или более липидов включают от приблизительно одного до приблизительно пяти раскрытых в изобретении различных твердых жиров, от приблизительно двух до приблизительно пяти раскрытых в изобретении различных твердых при комнатной температуре липидов, от приблизительно трех до приблизительно пяти раскрытых в изобретении различных твердых при комнатной температуре липидов, от приблизительно одного до приблизительно четырех раскрытых в изобретении различных твердых при комнатной температуре липидов, от приблизительно двух до приблизительно четырех раскрытых в изобретении различных твердых при комнатной температуре липидов или от приблизительно двух до приблизительно трех раскрытых в изобретении различных твердых при комнатной температуре липидов и от приблизительно одного до приблизительно пяти раскрытых в изобретении различных жидких при комнатной температуре липидов, от приблизительно двух до приблизительно пяти раскрытых в изобретении различных жидких при комнатной температуре липидов, от приблизительно трех до приблизительно пяти раскрытых в изобретении различных жидких при комнатной температуре липидов, от приблизительно одного до приблизительно четырех раскрытых в изобретении различных жидких при комнатной температуре липидов, от приблизительно двух до приблизительно четырех раскрытых в изобретении различных жидких при комнатной температуре липидов или от приблизительно двух до приблизительно трех раскрытых в изобретении различных жидких при комнатной температуре липидов.
В аспектах этого варианта осуществления, в раскрытом в изобретении способе может использоваться твердый при комнатной температуре липид и жидкий при комнатной температуре липид при соотношении твердый липид:жидкий липид, например, по меньшей мере, 1:1, по меньшей мере, 2:1, по меньшей мере, 3:1, по меньшей мере, 4:1, по меньшей мере, 5:1, по меньшей мере, 6:1, по меньшей мере, 7:1, по меньшей мере, 8:1, по меньшей мере, 9:1, по меньшей мере, 10:1, по меньшей мере, 15:1 или, по меньшей мере, 20:1. В другом аспекте этого варианта осуществления, в раскрытом в изобретении способе может использоваться твердый при комнатной температуре липид и жидкий при комнатной температуре липид при соотношении твердый липид:жидкий липид, например, от приблизительно 1:1 до приблизительно 20:1, от приблизительно 5:1 до приблизительно 20:1, от приблизительно 2:1 до приблизительно 15:1, от приблизительно 5:1 до приблизительно 15:1, от приблизительно 4:1 до приблизительно 12:1 или от приблизительно 6:1 до приблизительно 10:1.
В аспектах этого варианта осуществления, в раскрытом в изобретении способе может использоваться множество твердых при комнатной температуре липидов и множество жидких при комнатной температуре липидов при соотношении суммарное количество твердых липидов:суммарное количество жидких липидов, например, по меньшей мере, 1:1, по меньшей мере, 2:1, по меньшей мере, 3:1, по меньшей мере, 4:1, по меньшей мере, 5:1, по меньшей мере, 6:1, по меньшей мере, 7:1, по меньшей мере, 8:1, по меньшей мере, 9:1, по меньшей мере, 10:1, по меньшей мере, 15:1 или, по меньшей мере, 20:1. В другом аспекте этого варианта осуществления, в раскрытом в изобретении способе может использоваться множество твердых при комнатной температуре липидов и множество жидких при комнатной температуре липидов при соотношении суммарное количество твердых липидов:суммарное количество жидких липидов, например, от приблизительно 1:1 до приблизительно 20:1, от приблизительно 5:1 до приблизительно 20:1, от приблизительно 2:1 до приблизительно 15:1, от приблизительно 5:1 до приблизительно 15:1, от приблизительно 4:1 до приблизительно 12:1 или от приблизительно 6:1 до приблизительно 10:1.
Контактирование терапевтического соединения и одного или более липидов может включать, например, перемешивание, инверсию, обработку ультразвуком или встряхивание. Смешение может быть проведено в течение, например, по меньшей мере, 1 секунды, по меньшей мере, 5 секунд, по меньшей мере, 10 секунд, по меньшей мере, 20 секунд, по меньшей мере, 30 секунд, по меньшей мере, 45 секунд, по меньшей мере, 60 секунд или более, до тех пор пока терапевтическое соединение полностью не растворится в смеси липид/полимер гликоля.
Аспекты настоящего изобретения раскрывают, помимо всего прочего, контактирование раствора соединение/липид с одним или более раскрытыми в изобретении полимерами гликоля.
Раскрытый в изобретении способ осуществляют при условиях, которые способствуют отвердеванию композиции твердого раствора. В аспектах этого варианта осуществления, способ может быть осуществлен при температуре, достаточной для охлаждения композиции до температуры, при которой раствор затвердевает.
В конкретных вариантах осуществления, для снижения температуры после образования раскрытой в изобретении фармацевтической композиции может быть использована стадия быстрого охлаждения. Например, стадия быстрого охлаждения может быть использована при подходах, когда применяют температуры выше, чем комнатная температура, для обеспечения полного растворения терапевтического соединения в фармацевтически приемлемом растворителе и/или для того чтобы раствор, содержащий терапевтическое соединение, мог образовать фармацевтическую композицию. В аспектах этого варианта осуществления, стадия быстрого охлаждения позволяет понизить температуру, например, на приблизительно 30°C через 20 минут, на приблизительно 25°C через 20 минут, на приблизительно 20°C через 20 минут, на приблизительно 15°C через 20 минут, на приблизительно 30°C через 15 минут, на приблизительно 25°C через 15 минут, на приблизительно 20°C через 15 минут, на приблизительно 15°C через 15 минут, на приблизительно 30°C через 10 минут, на приблизительно 25°C через 10 минут, на приблизительно 20°C через 10 минут, на приблизительно 15°C через 10 минут, на приблизительно 30°C через 5 минут, на приблизительно 25°C через 5 минут, на приблизительно 20°C через 5 минут, на приблизительно 15°C через 5 минут. В другом аспекте этого варианта осуществления, стадия быстрого охлаждения позволяет понизить температуру, например, на величину от приблизительно 20°C до приблизительно 30°C через 20 минут, на величину от приблизительно 20°C до приблизительно 30°C через 15 минут, на величину от приблизительно 20°C до приблизительно 30°C через 10 минут, на величину от приблизительно 20°C до приблизительно 30°C через 5 минут, на величину от приблизительно 15°C до приблизительно 25°C через 20 минут, на величину от приблизительно 15°C до приблизительно 25°C через 15 минут, на величину от приблизительно 15°C до приблизительно 25°C через 10 минут, на величину от приблизительно 15°C до приблизительно 25°C через 5 минут, на величину от приблизительно 10°C до приблизительно 20°C через 20 минут, на величину от приблизительно 10°C до приблизительно 20°C через 15 минут, на величину от приблизительно 10°C до приблизительно 20°C через 10 минут или на величину от приблизительно 10°C до приблизительно 20°C через 5 минут.
В еще одних аспектах этого варианта осуществления, стадия быстрого охлаждения позволяет понизить температуру со скоростью, например, приблизительно 2,0°C/минута, приблизительно 1,9°C/минута, приблизительно 1,8°C/минута, приблизительно 1,7°C/минута, приблизительно 1,6°C/минута, приблизительно 1,5°C/минута, приблизительно 1,4°C/минута, приблизительно 1,3°C/минута, приблизительно 1,2°C/минута, приблизительно 1,1°C/минута, приблизительно 1,0°C/минута, приблизительно 0,9°C/минута, приблизительно 0,8°C/минута, приблизительно 0,7°C/минута, приблизительно 0,6°C/минута, приблизительно 0,5°C/минута, приблизительно 0,4°C/минута, приблизительно 0,3°C/минута, приблизительно 0,2°C/минута или приблизительно 0,1°C/минута. В еще одних аспектах варианта осуществления, стадия быстрого охлаждения позволяет понизить температуру со скоростью, например, от приблизительно 0,1°C до приблизительно 0,4°C/минута, от приблизительно 0,2°C до приблизительно 0,6°C/минута, от приблизительно 0,4°C до приблизительно 0,8°C/минута, от приблизительно 0,6°C до приблизительно 1,0°C/минута, от приблизительно 0,8°C до приблизительно 1,2°C/минута, от приблизительно 1,0°C до приблизительно 1,4°C/минута, от приблизительно 1,2°C до приблизительно 1,6°C/минута, от приблизительно 1,4°C до приблизительно 1,8°C/минута, от приблизительно 1,6°C до приблизительно 2,0°C/минута, от приблизительно 0,1°C до приблизительно 0,5°C/минута, от приблизительно 0,5°C до приблизительно 1,0°C/минута, от приблизительно 1,0°C до приблизительно 1,5°C/минута, от приблизительно 1,5°C до приблизительно 2,0°C/минута, от приблизительно 0,5°C до приблизительно 1,5°C/минута или от приблизительно 1,0°C до приблизительно 2,0°C/минута.
Раскрытый в изобретении состав позволяет сформировать твердый раствор липидов и терапевтического соединения. Такие составы не образуют липосомальных эмульсий и/или мицелярных частиц и/или многофазных композиций другого типа. Кроме того, такие составы не требуют применения гидрофильного растворителя, такого как, например, вода или забуферированный раствор. По этой причине, раскрытую в изобретении фармацевтическую композицию готовят без применения гидрофильного растворителя. В одном варианте осуществления, раскрытая в изобретении фармацевтическая композиция не включает фармацевтически приемлемый гидрофильный растворитель.
Количество терапевтического соединения, жидкого при комнатной температуре липида, твердого при комнатной температуре липида (твердого жира), стабилизатора и нейтрализатора, используемых в раскрытом изобретением способе, может представлять собой любое требуемое количество. Факторы, принимаемые во внимание при определении количества каждого используемого компонента, включают, без ограничения, требуемое конечное количество терапевтического соединения в фармацевтической композиции, требуемая концентрация терапевтического соединения в растворе, гидрофобность терапевтического соединения, липофильность терапевтического соединения, требуемое конечное количество фармацевтической композиции и условия, используемые для получения фармацевтической композиции твердого раствора.
В одном варианте осуществления, фармацевтическая композиция включает одно и более терапевтических соединений, твердые при комнатной температуре липиды или твердые жиры и один или более жидких при комнатной температуре липидов, но не включает фармацевтически приемлемый гидрофильный растворитель.
В одном варианте осуществления, фармацевтическая композиция включает одно и более терапевтических соединений, твердые при комнатной температуре липиды или твердые жиры и один или более жидких при комнатной температуре липидов и один или более стабилизаторов, но не включает фармацевтически приемлемый гидрофильный растворитель. В аспектах этого варианта осуществления, фармацевтическая композиция твердого раствора включает терапевтическое соединение, твердый при комнатной температуре липид или твердый жир, жидкий при комнатной температуре липид и жидкий полимер гликоля и/или одноатомный спирт, и/или диметиловый эфир изосорбида, и/или моноэтиловый эфир диэтиленгликоля (2-(2-этоксиэтокси)этанол), но не включает фармацевтически приемлемый гидрофильный растворитель. В другом аспекте этого варианта осуществления, фармацевтическая композиция твердого раствора включает терапевтическое соединение, смесь триглицеридов, смесь моноглицеридов и жидкий полимер ПЭГ и/или С1-C5 одноатомный спирт, и/или диметиловый эфир изосорбида, и/или моноэтиловый эфир диэтиленгликоля (2-(2-этоксиэтокси)этанол), но не включает фармацевтически приемлемый гидрофильный растворитель. В еще одних аспектах варианта осуществления, фармацевтическая композиция включает терапевтическое соединение, GELUCIRE®43/01 (Gattefosse), воскообразное твердое вещество (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающее смесь насыщенных C10-C18 триглицеридов, MAISINE® 35-1 (Gattefosse), глицерил монолинолеат и жидкий полимер ПЭГ и/или С1-C5 одноатомный спирт, и/или диметиловый эфир изосорбида, и/или моноэтиловый эфир диэтиленгликоля (2-(2-этоксиэтокси)этанол), но не включает фармацевтически приемлемый гидрофильный растворитель.
В аспектах этого варианта осуществления, композиция твердого раствора включает от приблизительно 1% до приблизительно 55% по массе терапевтического соединения, от приблизительно 40% до приблизительно 90% по массе твердого при комнатной температуре липида или твердого жира, от приблизительно 1% до приблизительно 10% по массе жидкого при комнатной температуре липида и от приблизительно 1% до приблизительно 5% стабилизатора. В аспектах этого варианта осуществления, композиция твердого раствора включает от приблизительно 1% до приблизительно 55% по массе терапевтического соединения, от приблизительно 40% до приблизительно 90% по массе твердого при комнатной температуре липида или твердого жира, от приблизительно 1% до приблизительно 10% по массе жидкого при комнатной температуре липида и от приблизительно 1% до приблизительно 5% жидкого полимера гликоля и/или одноатомного спирта, и/или диметилового эфира изосорбида, и/или моноэтилового эфира диэтиленгликоля (2-(2-этоксиэтокси)этанола). В другом аспекте этого варианта осуществления, композиция твердого раствора включает от приблизительно 5% до приблизительно 50% по массе терапевтического соединения, от приблизительно 40% до приблизительно 70% по массе твердого при комнатной температуре липида или твердого жира, от приблизительно 1% до приблизительно 7% по массе жидкого при комнатной температуре липида и от приблизительно 1% до приблизительно 3% жидкого полимера гликоля и/или одноатомного спирта, и/или диметилового эфира изосорбида, и/или моноэтилового эфира диэтиленгликоля (2-(2-этоксиэтокси)этанола).
В одном варианте осуществления, фармацевтическая композиция включает одно или более терапевтических соединений, один или более твердых при комнатной температуре липидов или твердых жиров, один или более жидких при комнатной температуре липидов и один или более нейтрализаторов, но не включает фармацевтически приемлемый гидрофильный растворитель. В другом аспекте этого варианта осуществления, фармацевтическая композиция твердого раствора включает терапевтическое соединение, твердый при комнатной температуре липид или твердый жир, жидкий при комнатной температуре липид и жирную кислоту, но не включает фармацевтически приемлемый гидрофильный растворитель. В еще одних аспектах варианта осуществления, фармацевтическая композиция твердого раствора включает терапевтическое соединение, смесь триглицеридов, смесь моноглицеридов и С16-C18 жирную кислоту, но не включает фармацевтически приемлемый гидрофильный растворитель. В еще одних аспектах этого варианта осуществления, фармацевтическая композиция включает терапевтическое соединение, GELUCIRE®43/01 (Gattefosse), воскообразное твердое вещество (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающее смесь насыщенных C10-C18 триглицеридов, MAISINE® 35-1 (Gattefosse), глицерил монолинолеат и стеариновую кислоту, но не включает фармацевтически приемлемый гидрофильный растворитель.
В аспектах этого варианта осуществления, композиция твердого раствора включает от приблизительно 1% до приблизительно 55% по массе терапевтического соединения, от приблизительно 30% до приблизительно 70% по массе твердого при комнатной температуре липида или твердого жира, от приблизительно 1% до приблизительно 10% по массе жидкого при комнатной температуре липида и от приблизительно 1% до приблизительно 55% нейтрализатора. В другом аспекте этого варианта осуществления, композиция твердого раствора включает от приблизительно 1% до приблизительно 55% по массе терапевтического соединения, от приблизительно 30% до приблизительно 70% по массе твердого при комнатной температуре липида или твердого жира, от приблизительно 1% до приблизительно 10% по массе жидкого при комнатной температуре липида и от приблизительно 1% до приблизительно 55% жирной кислоты. В еще одних аспектах варианта осуществления, композиция твердого раствора включает от приблизительно 5% до приблизительно 50% по массе терапевтического соединения, от приблизительно 30% до приблизительно 60% по массе твердого при комнатной температуре липида или твердого жира, от приблизительно 1% до приблизительно 7% по массе жидкого при комнатной температуре липида и от приблизительно 5% до приблизительно 50% жирной кислоты.
В другом аспекте этого варианта осуществления, фармацевтическая композиция твердого раствора включает одно и более терапевтических соединений, один или более твердых при комнатной температуре липидов или твердых жиров, один или более жидких при комнатной температуре липидов и триэтаноламин, но не включает фармацевтически приемлемый гидрофильный растворитель. В еще одних аспектах варианта осуществления, фармацевтическая композиция твердого раствора включает терапевтическое соединение, смесь триглицеридов, смесь моноглицеридов и триэтаноламин, но не включает фармацевтически приемлемый гидрофильный растворитель. В еще одних аспектах этого варианта осуществления, фармацевтическая композиция включает терапевтическое соединение, GELUCIRE®43/01 (Gattefosse), воскообразное твердое вещество (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающее смесь насыщенных C10-C18 триглицеридов, MAISINE® 35-1 (Gattefosse), глицерил монолинолеат и триэтаноламин, но не включает фармацевтически приемлемый гидрофильный растворитель.
В аспектах этого варианта осуществления, композиция твердого раствора включает от приблизительно 1% до приблизительно 55% по массе терапевтического соединения, от приблизительно 30% до приблизительно 70% по массе твердого при комнатной температуре липида или твердого жира, от приблизительно 1% до приблизительно 10% по массе жидкого при комнатной температуре липида и от приблизительно 1% до приблизительно 55% триэтаноламина. В другом аспекте этого варианта осуществления, композиция твердого раствора включает от приблизительно 5% до приблизительно 50% по массе терапевтического соединения, от приблизительно 30% до приблизительно 60% по массе твердого при комнатной температуре липида или твердого жира, от приблизительно 1% до приблизительно 7% по массе жидкого при комнатной температуре липида и от приблизительно 5% до приблизительно 50% триэтаноламина.
В одном варианте осуществления, фармацевтическая композиция включает одно или более терапевтических соединений, твердые при комнатной температуре липиды или твердые жиры, один или более жидких при комнатной температуре липидов, один или более стабилизаторов и один или более нейтрализаторов, но не включает фармацевтически приемлемый гидрофильный растворитель.
Аспекты настоящего изобретения раскрывают, помимо всего прочего, способ лечения индивидуума, страдающего сердечно-сосудистым заболеванием. В одном варианте осуществления, способ включает стадию введения индивидууму, если это ему необходимо, раскрытую в изобретении фармацевтическую композицию, где введение облегчает симптом, связанный с сердечно-сосудистым заболеванием, вследствие чего происходит лечение индивидуума.
Аспекты настоящего изобретения раскрывают, помимо всего прочего, лечение индивидуума, страдающего от сердечно-сосудистого заболевания. Используемый в изобретении термин "лечение" относится к ослаблению или устранению у индивидуума клинического симптома сердечно-сосудистого заболевания; или к отсрочке или предотвращению у индивидуума возникновения клинического симптома сердечно-сосудистого заболевания. Например, термин "лечение" может означать ослабление симптома состояния, характеризующегося сердечно-сосудистым заболеванием, например, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 35%, по меньшей мере, на 40%, по меньшей мере, на 45%, по меньшей мере, на 50%, по меньшей мере, на 55%, по меньшей мере, на 60%, по меньшей мере, на 65%, по меньшей мере, на 70%, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95% или, по меньшей мере, на 100%. Конкретные симптомы, связанные с сердечно-сосудистым заболеванием, хорошо известны и могут быть определены любым специалистом в данной области с учетом факторов, включающих, без ограничения, локализацию сердечно-сосудистого заболевания, причину сердечно-сосудистого заболевания, тяжесть сердечно-сосудистого заболевания и/или ткань или орган, пораженный сердечно-сосудистым заболеванием. Специалистам в данной области известны соответствующие симптомы или признаки, связанные с конкретным типом сердечно-сосудистого заболевания, и им известно, как определить, является ли индивидуум потенциальным кандидатом для описанного в изобретении лечения.
Сердечно-сосудистое заболевание представляет собой любое из ряда специфических заболеваний, которые поражают непосредственно сердце и/или систему кровеносных сосудов, в частности, вены и артерии, ведущие к сердцу и от сердца. Известные и/или сопутствующие причины сердечно-сосудистого заболевания включают, без ограничения, опасные для здоровья соотношения двух самых малых по размеру липопротеинов LDL и HDL, гиперлипидемию, повышенные уровни глюкозы в крови, верхнюю границу нормы кровяного давления и высокое кровяное давление, повышенные уровни LP-PLA2, липопротеина(а) и гипергомоцистеинемии. Симптомы сердечно-сосудистой нарушения, поражающего сердце, включают, без ограничения, боль в груди, ощущение дискомфорта в груди и боль в одной или в обеих руках, в одном или в обоих плечах, в шее, в челюсти или в спине, одышку, головокружение, учащенное сердцебиение, тошноту, аномальное сердцебиение, ощущение усталости и/или инфаркт миокарда. Симптомы сердечно-сосудистого нарушения, поражающего мозг, включают, без ограничения, внезапное онемение или ослабление мышц лица, одной или обеих рук или одной или обеих ног, внезапную путаницу или затруднение речи или понимания речи, внезапную проблему со зрением в одном или обоих глазах, внезапное головокружение, трудности при ходьбе или потерю равновесия или координации, и/или внезапную сильную головную боль по неизвестной причине. Симптомы сердечно-сосудистого нарушения, поражающего одну или обе ноги, таз, одну или обе руки и/или плечо, включают, без ограничения, боль в мышцах, мышечную судорогу, ощущение холода в одной или обеих ногах и/или в пальцах ног, в одной или обеих руках и/или в пальцах рук, и/или онемение или слабость в одной или обеих ногах и/или пальцах ног, в одной или обеих руках и/или в пальцах рук.
Существует более чем 60 видов сердечно-сосудистого заболевания, включающих, без ограничения, гиперлипидемию, коронарную болезнь сердца, атеросклероз, заболевание периферических сосудов, кардиомиопатию, васкулит, воспалительное заболевание сердца, ишемическую болезнь сердца, застойную сердечную недостаточность, гипертензивную кардиопатию, порок клапана сердца, артериальную гипертензию, инфаркт миокарда, диабетические сердечные состояния, аневризму, эмболию, расслоение, псевдоаневризму, сосудистую патологию, каверному, тромбоз, варикоз вены и инсульт.
В одном варианте осуществления, сердечно-сосудистое заболевание включает гиперлипидемию. Гиперлипидемия (или гиперлипопротеинемия) относится к состоянию, характеризующемуся аномально повышенными уровенями липидов и/или липопротеинов в крови. Гиперлипидемии могут быть отнесены к наследственным (или первичным), когда они вызваны конкретными генетическими аномалиями, к приобретенным (или вторичным), когда они являются следствием другого основного заболевания, или к идиопатическим, при неизвестной этиологии. Гиперлипидемии могут быть также классифицированы на основании того, уровни каких типов липидов и/или липопротеинов являются повышенными. Не ограничивающие примеры гиперлипидемии включает дислипидемию, гиперхолестеринeмию, гиперглицеридемию, гипертриглицеридемию, гиперлипопротеинемию и гиперхиломикронемия и комбинированную гиперлипидемию. Гиперлипопротеинемия включают, например, гиперлипопротеинемию типа Ia, гиперлипопротеинемию типа Ib, гиперлипопротеинемию типа Ic, гиперлипопротеинемию типа IIa, гиперлипопротеинемию типа IIb гиперлипопротеинемию типа III, гиперлипопротеинемию типа IV и гиперлипопротеинемию типа V.
В другом варианте осуществления, сердечно-сосудистое заболевание включает ишемическую болезнь сердца. Ишемическая болезнь сердца относится к состоянию, характеризующемуся недостаточностью коронарного кровообращения, обеспечивающего надлежащий приток крови к сердечной мышце и окружающей ткани. Обычно вызывается сужением или закупоркой коронарной артерии, например, вследствие атеросклеротического заболевания коронарной артерии, коронароспазма и/или стеноза венечных сосудов. Боль в груди и инфаркт миокарда являются общими симптомами и состояниями, вызванными ишемической болезнью сердца.
В другом варианте осуществления, сердечно-сосудистое заболевание включает окклюзивное заболевание сосудов (VOD). VOD относится к состоянию, характеризующемуся обструкцией кровеносного сосуда. VOD включает, без ограничения, атеросклероз, заболевания периферических сосудов и стеноз.
В аспекте этого варианта осуществления, VOD включает атеросклероз. Атеросклероз относится к состояние, характеризующемуся накоплением холестерин и жировых отложений (называемых бляшками) на внутренних стенках артерий. Эти бляшки могут ограничивать приток крови к сердечной мышце путем механической закупорки артерии или приводя к аномальному тонусу и функции артерии. Разрыв атеросклеротической бляшки является наиболее распространенной причиной ишемии.
В аспекте этого варианта осуществления, VOD включает заболевание периферических сосудов (PVD). Заболевание периферических сосудов (PVD), также известное как заболевание периферических артерий (PAD) или окклюзионное заболевание периферических артерий (PAOD), относится к состоянию, характеризующемуся нарушением проходимости крупных артерий, но не в дуге аорты коронарной сосудистой системы или в головном мозге. PVD может быть результатом атеросклероза, воспалительных процессов, приводящих к стенозу, эмболии или образования тромба. Это вызывает либо острую, либо хроническую ишемию. PVD также включает разновидность заболеваний, классифицируемых как микрососудистые заболевания, связанные с эпизодическим сужением артерий, такие как, например, феномен Рейно, или расширением артерий, такие как, например, сосудистый спазм. Симптомы PVD включают, без ограничения, боль, слабость, онемение или судороги мышц вследствие снижения кровотока, нарывы, раны или язвы, которые медленно заживают или совсем не заживают, синюшность или бледность конечности, чувство холода в конечности, снижение роста волос и ногтей на пораженной конечности и пальцах. У приблизительно 20% пациентов с легкой формой PAD заболевание может протекать бессимптомно.
В другом варианте осуществления, сердечно-сосудистое заболевание включает кардиомиопатию. Кардиомиопатия относится к состоянию, характеризующемуся ухудшением функции миокарда. Симптомы и признаки могут имитировать симптомы и признаки практически любой формы заболевания сердца, и они включают боль в груди и аномалии ЭКГ. Легкая форма кардиомиопатии часто протекает бессимптомно. Более тяжелый случай связан с сердечной недостаточностью, аритмией, системной эмболизацией и/или внезапной сердечной смертью. Кардиомиопатия может быть классифицирована функционально как характеризующаяся расширением, гипертрофией или сужением.
Кардиомиопатия может быть классифицирована как внешняя или внутренняя. Внешняя кардиомиопатия относится к кардиомиопатии, при которой основная патологии находится за пределами самого миокарда. Например, внешняя кардиомиопатия может быть вызванарушением обмена веществ/отложения гликогена, эндокринным расстройством, нервномышечным расстройством, нарушением питания, воспалением, токсическим воздействием (в том числе, лекарственных препаратов и спирта), ишемией и/или инфекцией (в том числе, гепатитом С). Неограничивающие примеры внешней кардиомиопатии включают акромегалию, алкогольную кардиомиопатию, амилоидоз, болезнь Шагаса, химиотерапию, диабетическую кардиомиопатию, гемохроматоз, гипертензивную кардиомиопатию, гипертиреоз, воспалительную кардиомиопатию, ишемическую кардиомиопатию, мышечную дистрофию, клапанную кардиомиопатию, кардиомиопатию, вторичную по отношению к системному метаболическому заболеванию, кардиомиопатию, вторичную по отношению к системному алиментарному заболеванию, ишемической болезни сердца и врожденному пороку сердца.
Внутренняя кардиомиопатия относится к кардиомиопатии, при которой наличие слабости в мышцах сердца нельзя объяснить внешними причинами, то есть, происхождение ее неизвестно. Внутренние кардиомиопатии включают различные болезненные состояния неясного происхождения и могут быть подразделены на генетические, смешанные или приобретенные. Не ограничивающие примеры внутренних кардиомиопатий включают дилатационную кардиомиопатию (DCM), гипертрофическую кардиомиопатию (HCM или HOCM), аритмогенную кардиомиопатию правого желудочка (ARVC), рестриктивную кардиомиопатию (RCM), некомпактную кардиомиопатию, изолированную желудочковую некомпактную митохондриальную миопатию, кардиомиопатию Такоцубо и эндокардит Леффлера.
В другом варианте осуществления, сердечно-сосудистое заболевание включает васкулит. Васкулит образует разнообразную группу заболеваний, характеризующихся воспалением стенки сосудов, в том числе, лимфатических сосудов и кровеносных сосудов, таких как вены (флебит), артерии (артериит) и капилляры, вседствтие миграции лейкоцитов и возникшего повреждения. Воспаление может поражать кровеносный сосуд любого размера в любой части тела. Оно может поражать артерии и/или вены. Воспаление может быть очаговым, что означает поражение только одного места внутри сосуда, или оно может быть обширным, с участками воспаления, рассеянными по всему конкретному органу или ткани, или даже поражать более чем одну систему органов в организме. Васкулит включают, без ограничения, болезнь Бюргера (облитерирующий тромбангиит), церебральный васкулит (васкулит центральной нервной системы), артериит Черджа-Стросса, криоглобулинемию, эссенциальный криоглобулинемический васкулит, гигантоклеточный (темпоральный) артериит, васкулит игрока в гольф, болезнь Шенлейна-Генохо, лейкоцитокластический васкулит (аллергический васкулит), болезнь Кавасаки, микроскопический полиартериит/полиангиит, узелковый полиартериит, ревматическую полимиалгию (ПМР), ревматоидный васкулит, артериит Такаясу, тромбофлебит, гранулематоз Вегенера и васкулит, который является вторичным по отношению к заболеваниям соединительной ткани, таким как системная красная волчанка (SLE), ревматоидный артрит (RA), рецидивирующий полихондрит, болезнь Бехчета или другие заболевания соединительной ткани, васкулит, который является вторичным по отношению к вирусной инфекции.
В другом варианте осуществления, сердечно-сосудистое заболевание включает воспалительное заболевание сердца. Воспалительное заболевание сердца относится к состояние, характеризующемуся воспалением сердечной мышцы и/или тканей, окружающих ее. Не ограничивающие примеры воспалительного заболевания сердца включают эндокардит, воспалительную кардиомегалию и миокардит.
В другом варианте осуществления, сердечно-сосудистое заболевание включает ишемическую болезнь сердца. Ишемическая болезнь сердца или ишемия миокарда относится к состоянию, характеризующемуся пониженным кровоснабжением сердечной мышцы, как правило, вследствие сужения или закупорки коронарной артерии. Симптомы ишемической болезни сердца включают боль в груди при физической нагрузке, в холодную погоду или при эмоциональных ситуациях, острую боль в груди, острый коронарный синдром, нестабильную стенокардию, инфаркт миокарда, сердечную недостаточность, затруднение дыхания или отек конечностей.
В другом варианте осуществления, сердечно-сосудистое заболевание включает застойную сердечную недостаточность. Застойная сердечной недостаточность, или сердечная недостаточность с застойными явлениями, относится к состоянию, характеризующемуся нарушениями сердечной деятельности, которые не могут быть результатом какого-либо структурного или функционального сердечного нарушения, которое ухудшает способность сердца наполняться кровью или прокачивать достаточное количество крови через весь организм.
В другом варианте осуществления, сердечно-сосудистое заболевание включает гипертоническую болезнь сердца. Гипертоническая болезнь сердца относится к состоянию, характеризующемуся высоким кровяным давлением, особенно локализованным высоким кровяным давлением. Условия, которые могут быть причиной гипертонической болезнью сердца, включают, без ограничения, гипертрофию левого желудочка, ишемическую болезнь сердца, застойную сердечную недостаточность, гипертензивную кардиомиопатию и сердечную аритмию.
В другом варианте осуществления, сердечно-сосудистое заболевание включает порок клапана сердца. Порок клапана сердца относится к состоянию, характеризующемуся дисфункцией одного или более клапанов сердца. Основные сердечные клапаны, которые могут быть поражены пороком клапана сердца, включают, без ограничения, трехстворчатый клапан сердца, правый аортальный клапан, митральный клапан и левый аортальный клапан.
Композицию или соединение вводят индивидууму. Индивидуум обычно представляет собой человека. Обычно, любой индивидуум, который является потенциальным кандидатом для традиционного лечения сердечно-сосудистого заболевания, является потенциальным кандидатом и для раскрытого в изобретении лечения сердечно-сосудистого заболевания. Обследование перед проведением лечения обычно включает ознакомление с историей болезни и медицинский осмотр, и, кроме того, получение от пациента полного информированного согласия, в котором раскрыты все релевантные риски и положительные результаты методики лечения.
Раскрытая в изобретении фармацевтическая композиция может включать терапевтическое соединение в терапевтически эффективном количестве. Используемый в изобретении термин "эффективное количество" является синонимом терминов "терапевтически эффективное количество, "эффективная доза" или "терапевтически эффективная доза", и когда он используется в отношении лечения сердечно-сосудистого заболевания, этот термин означает минимальную дозу раскрытого в изобретении терапевтического соединения, необходимую для достижения требуемого терапевтического эффекта, и включает дозу, достаточную для ослабления симптома, связанного с сердечно-сосудистым заболеванием. Эффективность раскрытого в изобретении терапевтического соединения при лечении сердечно-сосудистого заболевания определяется путем обнаружения улучшения у индивидуума, судя по одному или более клиническим симптомам и/или физиологическим показателям, связанным с этим состоянием. На улучшение состояния при сердечно-сосудистом заболевании может также указывать уменьшение необходимости в параллельно проводимой терапии.
Соответствующее эффективное количество раскрытого в изобретении терапевтического соединения, которое вводится индивидууму при конкретном сердечно-сосудистом заболевании, может быть определено любым специалистом в данной области с учетом факторов, включающих, без ограничения, тип сердечно-сосудистого заболевания, локализацию сердечно-сосудистого заболевания, причину сердечно-сосудистого заболевания, тяжесть сердечно-сосудистого заболевания, степень требуемого облегчения, продолжительность требуемого облегчения, используемое конкретное терапевтическое соединение, скорость экскреции используемого терапевтического соединения, фармакодинамику используемого терапевтического соединения, свойства других соединений, включенных в композицию, конкретный способ введения, конкретные характеристики, историю болезни и факторы риска пациента, такие как, например, возраст, масса тела, общее состояние здоровья и другие подобные показатели или их комбинация. Кроме того, когда используют повторное введение терапевтического соединения, эффективное количество терапевтического соединения будет дополнительно зависеть от факторов, включающих, без ограничения, частоту введения, период полувыведения терапевтического соединения или любую их комбинацию. Для обычного специалиста в этой области в этой области является известным, что эффективное количество раскрытого в изобретении терапевтического соединения может быть определено путем экстраполяции данных in vitro исследований и данных изучения in vivo введения на животных моделях перед введением людям.
В аспектах этого варианта осуществления, терапевтически эффективное количество раскрытого в изобретении терапевтического соединения облегчает симптом, связанный с сердечно-сосудистым заболеванием например, по меньшей мере, на 10%, по меньшей мере, на 15%, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 35%, по меньшей мере, на 40%, по меньшей мере, на 45%, по меньшей мере, на 50%, по меньшей мере, на 55%, по меньшей мере, на 60%, по меньшей мере, на 65%, по меньшей мере, на 70%, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95% или, по меньшей мере, на 100%. В другом аспекте этого варианта осуществления, терапевтически эффективное количество раскрытого в изобретении терапевтического соединения облегчает симптом, связанный с сердечно-сосудистым заболеванием, например, не более чем на 10%, не более чем на 15%, не более чем на 20%, не более чем на 25%, не более чем на 30%, не более чем на 35%, не более чем на 40%, не более чем на 45%, не более чем на 50%, не более чем на 55%, не более чем на 60%, не более чем на 65%, не более чем на 70%, не более чем на 75%, не более чем на 80%, не более чем на 85%, не более чем на 90%, не более чем на 95% или не более чем 100%. В еще одних аспектах варианта осуществления, терапевтически эффективное количество раскрытого в изобретении терапевтического соединения облегчает симптом, связанный с сердечно-сосудистым заболеванием, например, на от приблизительно 10% до приблизительно 100%, на от приблизительно 10% до приблизительно 90%, на от приблизительно 10% до приблизительно 80%, на от приблизительно 10% до приблизительно 70%, на от приблизительно 10% до приблизительно 60%, на от приблизительно 10% до приблизительно 50%, на от приблизительно 10% до приблизительно 40%, на от приблизительно 20% до приблизительно 100%, на от приблизительно 20% до приблизительно 90%, на от приблизительно 20% до приблизительно 80%, на от приблизительно 20% до приблизительно 20%, на от приблизительно 20% до приблизительно 60%, на от приблизительно 20% до приблизительно 50%, на от приблизительно 20% до приблизительно 40%, на от приблизительно 30% до приблизительно 100%, на от приблизительно 30% до приблизительно 90%, на от приблизительно 30% до приблизительно 80%, на от приблизительно 30% до приблизительно 70%, на от приблизительно 30% до приблизительно 60% или на от приблизительно 30% до приблизительно 50%.
В еще одних аспектах варианта осуществления, терапевтически эффективное количество раскрытого в изобретении терапевтического соединения обычно составляет величину в диапазоне от приблизительно 0,001 мг/кг/сутки до приблизительно 100 мг/кг/сутки. В аспектах этого варианта осуществления, эффективное количество раскрытого в изобретении терапевтического соединения может составлять, например, по меньшей мере, 0,001 мг/кг/сутки, по меньшей мере, 0,01 мг/кг/сутки, по меньшей мере, 0,1 мг/кг/сутки, по меньшей мере, 1,0 мг/кг/сутки, по меньшей мере, 5,0 мг/кг/сутки, по меньшей мере, 10 мг/кг/сутки, по меньшей мере, 15 мг/кг/сутки, по меньшей мере, 20 мг/кг/сутки, по меньшей мере, 25 мг/кг/сутки, по меньшей мере, 30 мг/кг/сутки, по меньшей мере, 35 мг/кг/сутки, по меньшей мере, 40 мг/кг/сутки, по меньшей мере, 45 мг/кг/сутки или, по меньшей мере, 50 мг/кг/сутки. В другом аспекте этого варианта осуществления, эффективное количество раскрытого в изобретении терапевтического соединения может составлять величину в диапазоне, например, от приблизительно 0,001 мг/кг/сутки до приблизительно 10 мг/кг/сутки, от приблизительно 0,001 мг/кг/сутки до приблизительно 15 мг/кг/сутки, от приблизительно 0,001 мг/кг/сутки до приблизительно 20 мг/кг/сутки, от приблизительно 0,001 мг/кг/сутки до приблизительно 25 мг/кг/сутки, от приблизительно 0,001 мг/кг/сутки до приблизительно 30 мг/кг/сутки, от приблизительно 0,001 мг/кг/сутки до приблизительно 35 мг/кг/сутки, от приблизительно 0,001 мг/кг/сутки до приблизительно 40 мг/кг/сутки, от приблизительно 0,001 мг/кг/сутки до приблизительно 45 мг/кг/сутки, от приблизительно 0,001 мг/кг/сутки до приблизительно 50 мг/кг/сутки, от приблизительно 0,001 мг/кг/сутки до приблизительно 75 мг/кг/сутки или от приблизительно 0,001 мг/кг/сутки до приблизительно 100 мг/кг/сутки. В еще одних аспектах варианта осуществления, эффективное количество раскрытого в изобретении терапевтического соединения может составлять величину в диапазоне, например, от приблизительно 0,01 мг/кг/сутки до приблизительно 10 мг/кг/сутки, от приблизительно 0,01 мг/кг/сутки до приблизительно 15 мг/кг/сутки, от приблизительно 0,01 мг/кг/сутки до приблизительно 20 мг/кг/сутки, от приблизительно 0,01 мг/кг/сутки до приблизительно 25 мг/кг/сутки, от приблизительно 0,01 мг/кг/сутки до приблизительно 30 мг/кг/сутки, от приблизительно 0,01 мг/кг/сутки до приблизительно 35 мг/кг/сутки, от приблизительно 0,01 мг/кг/сутки до приблизительно 40 мг/кг/сутки, от приблизительно 0,01 мг/кг/сутки до приблизительно 45 мг/кг/сутки, от приблизительно 0,01 мг/кг/сутки до приблизительно 50 мг/кг/сутки, от приблизительно 0,01 мг/кг/сутки до приблизительно 75 мг/кг/сутки или от приблизительно 0,01 мг/кг/сутки до приблизительно 100 мг/кг/сутки. В еще одних аспектах этого варианта осуществления, эффективное количество раскрытого в изобретении терапевтического соединения может составлять величину в диапазоне, например, от приблизительно 0,1 мг/кг/сутки до приблизительно 10 мг/кг/сутки, от приблизительно 0,1 мг/кг/сутки до приблизительно 15 мг/кг/сутки, от приблизительно 0,1 мг/кг/сутки до приблизительно 20 мг/кг/сутки, от приблизительно 0,1 мг/кг/сутки до приблизительно 25 мг/кг/сутки, от приблизительно 0,1 мг/кг/сутки до приблизительно 30 мг/кг/сутки, от приблизительно 0,1 мг/кг/сутки до приблизительно 35 мг/кг/сутки, от приблизительно 0,1 мг/кг/сутки до приблизительно 40 мг/кг/сутки, от приблизительно 0,1 мг/кг/сутки до приблизительно 45 мг/кг/сутки, от приблизительно 0,1 мг/кг/сутки до приблизительно 50 мг/кг/сутки, от приблизительно 0,1 мг/кг/сутки до приблизительно 75 мг/кг/сутки или от приблизительно 0,1 мг/кг/сутки до приблизительно 100 мг/кг/сутки.
В другом аспекте этого варианта осуществления, эффективное количество раскрытого в изобретении терапевтического соединения может составлять величину в диапазоне, например, от приблизительно 1 мг/кг/сутки до приблизительно 10 мг/кг/сутки, от приблизительно 1 мг/кг/сутки до приблизительно 15 мг/кг/сутки, от приблизительно 1 мг/кг/сутки до приблизительно 20 мг/кг/сутки, от приблизительно 1 мг/кг/сутки до приблизительно 25 мг/кг/сутки, от приблизительно 1 мг/кг/сутки до приблизительно 30 мг/кг/сутки, от приблизительно 1 мг/кг/сутки до приблизительно 35 мг/кг/сутки, от приблизительно 1 мг/кг/сутки до приблизительно 40 мг/кг/сутки, от приблизительно 1 мг/кг/сутки до приблизительно 45 мг/кг/сутки, от приблизительно 1 мг/кг/сутки до приблизительно 50 мг/кг/сутки, от приблизительно 1 мг/кг/сутки до приблизительно 75 мг/кг/сутки или от приблизительно 1 мг/кг/сутки до приблизительно 100 мг/кг/сутки. В еще одних аспектах варианта осуществления, эффективное количество раскрытого в изобретении терапевтического соединения может составлять величину в диапазоне, например, от приблизительно 5 мг/кг/сутки до приблизительно 10 мг/кг/сутки, от приблизительно 5 мг/кг/сутки до приблизительно 15 мг/кг/сутки, от приблизительно 5 мг/кг/сутки до приблизительно 20 мг/кг/сутки, от приблизительно 5 мг/кг/сутки до приблизительно 25 мг/кг/сутки, от приблизительно 5 мг/кг/сутки до приблизительно 30 мг/кг/сутки, от приблизительно 5 мг/кг/сутки до приблизительно 35 мг/кг/сутки, от приблизительно 5 мг/кг/сутки до приблизительно 40 мг/кг/сутки, от приблизительно 5 мг/кг/сутки до приблизительно 45 мг/кг/сутки, от приблизительно 5 мг/кг/сутки до приблизительно 50 мг/кг/сутки, от приблизительно 5 мг/кг/сутки до приблизительно 75 мг/кг/сутки или от приблизительно 5 мг/кг/сутки до приблизительно 100 мг/кг/сутки.
Дозирование может осуществляться в виде разовой дозы или в виде кумулятивной дозы (последовательное дозирование), и оно может быть легко определено любым специалистом в этой области. Например, лечение сердечно-сосудистого заболевания может включать разовое введение эффективной дозы раскрытой в изобретении фармацевтической композиции. В качестве варианта, лечение сердечно-сосудистого заболевания может включать многоразовое введение эффективной дозы фармацевтической композиции, осуществляемое в течение временных интервалов, таких как, например, один раз в день, два раза в день, три раза в день, один раз в несколько дней или один раз в неделю. Временные интервалы введения могут изменяться от индивидуума к индивидууму в зависимости от таких факторов, как тяжесть симптомов у индивидуума. Например, эффективная доза раскрытой в изобретении фармацевтической композиции может быть введена индивидууму один раз в день в течение неопределенного периода времени или до тех пор, когда индивидуум больше не будет нуждаться в лечении. Для обычного специалиста в этой области является очевидным, что состояние индивидуума может постоянно контролироваться на протяжении всего курса лечения и что эффективное количество раскрытой в изобретении фармацевтической композиции, которую вводят индивидууму, может быть соответственно скорректировано.
В одном варианте осуществления, после введения индивидууму, фармацевтическая композиция, включающая раскрытое в изобретении терапевтическое соединение, позволяет в результате достигать биораспределения терапевтического соединения, которое отличается от биораспределения терапевтического соединения, включенного в такую же фармацевтическую композицию, но не содержащую раскрытого в изобретении вспомогательного вещества.
В другом варианте осуществления, после введения индивидууму, терапевтическое соединение раскрытой в изобретении фармацевтической композиции доставляется в макрофаг. Макрофаги являются одними из ключевых типов клеток, которые, как считается, принимают участие в регуляции ответной воспалительной реакции. Достигаемый высокий уровень присутствующего в макрофагах терапевтического соединения, обладающего действием, которое нормализует уровень липидов, и/или противовоспалительным действием, обеспечивает в клиническом аспекте лечение сердечно-сосудистого заболевания. В аспекте этого варианта осуществления, после введения индивидууму, терапевтически эффективное количество терапевтического соединения раскрытой в изобретении фармацевтической композиции преимущественно доставляется в макрофаг. В другом аспекте этого варианта осуществления, после введения индивидууму, терапевтическое соединение раскрытой в изобретении фармацевтической композиции в основном доставляется в макрофаг. В еще одном аспекте этого варианта осуществления, после введения индивидууму, количество терапевтического соединения раскрытой в изобретении фармацевтической композиции, доставляемое в макрофаг, составляет, например, по меньшей мере, 5%, по меньшей мере, 10%, по меньшей мере, 15%, по меньшей мере, 20%, по меньшей мере, 25%, по меньшей мере, 30%, по меньшей мере, 35%, по меньшей мере, 40%, по меньшей мере, 45%, по меньшей мере, 50%, по меньшей мере, 55%, по меньшей мере, 60%, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95% или, по меньшей мере, 100% от суммарного количества терапевтического соединения, содержащегося в веденной фармацевтической композиции. В еще одних аспектах этого варианта осуществления, после введения индивидууму, количество терапевтического соединения раскрытой в изобретении фармацевтической композиции, доставляемой в макрофаг, составляет величину в диапазоне, например, от приблизительно 5% до приблизительно 100%, от приблизительно 10% до приблизительно 100%, от приблизительно 15% до приблизительно 100%, от приблизительно 20% до приблизительно 100%, от приблизительно 25% до приблизительно 100%, от приблизительно 30% до приблизительно 100%, от приблизительно 35% до приблизительно 100%, от приблизительно 40% до приблизительно 100%, от приблизительно 45% до приблизительно 100%, от приблизительно 50% до приблизительно 100%, от приблизительно 5% до приблизительно 90%, от приблизительно 10% до приблизительно 90%, от приблизительно 15% до приблизительно 90%, от приблизительно 20% до приблизительно 90%, от приблизительно 25% до приблизительно 90%, от приблизительно 30% до приблизительно 90%, от приблизительно 35% до приблизительно 90%, от приблизительно 40% до приблизительно 90%, от приблизительно 45% до приблизительно 90%, от приблизительно 50% до приблизительно 90%, от приблизительно 5% до приблизительно 80%, от приблизительно 10% до приблизительно 80%, от приблизительно 15% до приблизительно 80%, от приблизительно 20% до приблизительно 80%, от приблизительно 25% до приблизительно 80%, от приблизительно 30% до приблизительно 80%, от приблизительно 35% до приблизительно 80%, от приблизительно 40% до приблизительно 80%, от приблизительно 45% до приблизительно 80%, от приблизительно 50% до приблизительно 80%, от приблизительно 5% до приблизительно 70%, от приблизительно 10% до приблизительно 70%, от приблизительно 15% до приблизительно 70%, от приблизительно 20% до приблизительно 70%, от приблизительно 25% до приблизительно 70%, от приблизительно 30% до приблизительно 70%, от приблизительно 35% до приблизительно 70%, от приблизительно 40% до приблизительно 70%, от приблизительно 45% до приблизительно 70%, или от приблизительно 50% до приблизительно 70% от суммарного количества терапевтического соединения, содержащегося в веденной фармацевтической композиции.
В другом варианте осуществления, после введения индивидууму, раскрытая в изобретении фармацевтическая композиция уменьшает раздражение желудка. В аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция существенно уменьшает раздражение желудка. В еще одном варианте осуществления, после введения индивидууму, раскрытая в изобретении фармацевтическая композиция уменьшает раздражение желудка в отличие от такой же раскрытой в изобретении фармацевтической композиции, но не содержащей фармацевтически приемлемого вспомогательного вещества. В аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция существенно уменьшает раздражение желудка в отличие от такой же раскрытой в изобретении фармацевтической композиции, но не содержащей фармацевтически приемлемого вспомогательного вещества. В другом аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция уменьшает раздражение желудка, например, по меньшей мере, на 5%, по меньшей мере, на 10%, по меньшей мере, на 15%, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 35%, по меньшей мере, на 40%, по меньшей мере, на 45%, по меньшей мере, на 50%, по меньшей мере, на 55%, по меньшей мере, на 60%, по меньшей мере, на 65%, по меньшей мере, на 70%, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95% или, по меньшей мере, на 100%. В еще одних аспектах варианта осуществления, раскрытая в изобретении фармацевтическая композиция уменьшает раздражение желудка на величину в диапазоне, например, от приблизительно 5% до приблизительно 100%, от приблизительно 10% до приблизительно 100%, от приблизительно 15% до приблизительно 100%, от приблизительно 20% до приблизительно 100%, от приблизительно 25% до приблизительно 100%, от приблизительно 30% до приблизительно 100%, от приблизительно 35% до приблизительно 100%, от приблизительно 40% до приблизительно 100%, от приблизительно 45% до приблизительно 100%, от приблизительно 50% до приблизительно 100%, от приблизительно 5% до приблизительно 90%, от приблизительно 10% до приблизительно 90%, от приблизительно 15% до приблизительно 90%, от приблизительно 20% до приблизительно 90%, от приблизительно 25% до приблизительно 90%, от приблизительно 30% до приблизительно 90%, от приблизительно 35% до приблизительно 90%, от приблизительно 40% до приблизительно 90%, от приблизительно 45% до приблизительно 90%, от приблизительно 50% до приблизительно 90%, от приблизительно 5% до приблизительно 80%, от приблизительно 10% до приблизительно 80%, от приблизительно 15% до приблизительно 80%, от приблизительно 20% до приблизительно 80%, от приблизительно 25% до приблизительно 80%, от приблизительно 30% до приблизительно 80%, от приблизительно 35% до приблизительно 80%, от приблизительно 40% до приблизительно 80%, от приблизительно 45% до приблизительно 80%, от приблизительно 50% до приблизительно 80%, от приблизительно 5% до приблизительно 70%, от приблизительно 10% до приблизительно 70%, от приблизительно 15% до приблизительно 70%, от приблизительно 20% до приблизительно 70%, от приблизительно 25% до приблизительно 70%, от приблизительно 30% до приблизительно 70%, от приблизительно 35% до приблизительно 70%, от приблизительно 40% до приблизительно 70%, от приблизительно 45% до приблизительно 70%, или от приблизительно 50% до приблизительно 70%.
В другом варианте осуществления, после введения индивидууму, раскрытая в изобретении фармацевтическая композиция уменьшает раздражение в кишечнике. В аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция существенно уменьшает раздражение в кишечнике. В еще одном варианте осуществления, после введения индивидууму, раскрытая в изобретении фармацевтическая композиция уменьшает раздражение в кишечнике в отличие от такой же раскрытой в изобретении фармацевтической композиции, но не содержащей фармацевтически приемлемого вспомогательного вещества. В аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция существенно уменьшает раздражение в кишечнике в отличие от такой же раскрытой в изобретении фармацевтической композиции, но не содержащей фармацевтически приемлемого вспомогательного вещества. В другом аспекте этого варианта осуществления, раскрытая в изобретении фармацевтическая композиция уменьшает раздражение в кишечнике, например, по меньшей мере, на 5%, по меньшей мере, на 10%, по меньшей мере, на 20%, по меньшей мере, на 30%, по меньшей мере, на 40%, по меньшей мере, на 50%, по меньшей мере, на 60%, по меньшей мере, на 70%, по меньшей мере, на 80%, по меньшей мере, на 90% или, по меньшей мере, на 100% в отличие от такой же раскрытой в изобретении фармацевтической композиции, но не содержащей фармацевтически приемлемого вспомогательного вещества. В еще одних аспектах варианта осуществления, раскрытая в изобретении фармацевтическая композиция уменьшает раздражение в кишечнике, например, от приблизительно 5% до приблизительно 100%, от приблизительно 10% до приблизительно 100%, от приблизительно 15% до приблизительно 100%, от приблизительно 20% до приблизительно 100%, от приблизительно 25% до приблизительно 100%, от приблизительно 30% до приблизительно 100%, от приблизительно 35% до приблизительно 100%, от приблизительно 40% до приблизительно 100%, от приблизительно 45% до приблизительно 100%, от приблизительно 50% до приблизительно 100%, от приблизительно 5% до приблизительно 90%, от приблизительно 10% до приблизительно 90%, от приблизительно 15% до приблизительно 90%, от приблизительно 20% до приблизительно 90%, от приблизительно 25% до приблизительно 90%, от приблизительно 30% до приблизительно 90%, от приблизительно 35% до приблизительно 90%, от приблизительно 40% до приблизительно 90%, от приблизительно 45% до приблизительно 90%, от приблизительно 50% до приблизительно 90%, от приблизительно 5% до приблизительно 80%, от приблизительно 10% до приблизительно 80%, от приблизительно 15% до приблизительно 80%, от приблизительно 20% до приблизительно 80%, от приблизительно 25% до приблизительно 80%, от приблизительно 30% до приблизительно 80%, от приблизительно 35% до приблизительно 80%, от приблизительно 40% до приблизительно 80%, от приблизительно 45% до приблизительно 80%, от приблизительно 50% до приблизительно 80%, от приблизительно 5% до приблизительно 70%, от приблизительно 10% до приблизительно 70%, от приблизительно 15% до приблизительно 70%, от приблизительно 20% до приблизительно 70%, от приблизительно 25% до приблизительно 70%, от приблизительно 30% до приблизительно 70%, от приблизительно 35% до приблизительно 70%, от приблизительно 40% до приблизительно 70%, от приблизительно 45% до приблизительно 70%, или от приблизительно 50% до приблизительно 70% в отличие от такой же раскрытой в изобретении фармацевтической композиции, но не содержащей фармацевтически приемлемого вспомогательного вещества.
Раскрытая в изобретении фармацевтическая композиция может быть также введена индивидууму в комбинации с другими терапевтическими соединениями с целью повышения суммарного терапевтического эффекта лечения. Использование нескольких соединений для лечения по показанию врача может увеличить положительное воздействие, уменьшая при этом побочные эффекты.
Аспекты настоящего изобретения могут быть также описаны, как изложено ниже:
1. Фармацевтическая композиция твердого раствора, включающая: a) терапевтическое соединение, которое обладает противовоспалительным действием; b) твердый при комнатной температуре липид; и c) жидкий при комнатной температуре липид.
2. Фармацевтическая композиция твердого раствора по варианту осуществления 1, где композиция дополнительно включает стабилизатор.
3. Фармацевтическая композиция твердого раствора по варианту осуществления 1 или 2, где композиция дополнительно включает нейтрализатор.
4. Фармацевтическая композиция твердого раствора по вариантам осуществления 1-3, где фармацевтическая композиция твердого раствора не включает поверхностно-активного вещества.
5. Фармацевтическая композиция твердого раствора по вариантам осуществления 1-4, где фармацевтическая композиция твердого раствора не включает гидрофильного растворителя.
6. Фармацевтическая композиция по вариантам осуществления 1-5, где действие, которое нормализует уровни липидов, имеет противогиперлипидемическое действие.
7. Фармацевтическая композиция по варианту осуществления 6, где противогиперлипидемическое действие снижает уровни VLDL, IDL, LDL или их комбинации, по меньшей мере, на 10%.
8. Фармацевтическая композиция по варианту осуществления 7, где противогиперлипидемическое действие повышает уровень HDL, например, по меньшей мере, на 2%.
9. Фармацевтическая композиция по вариантам осуществления 1-8, где действие, которое нормализует уровни липидов, уменьшает уровень воспаления, индуцированного простагландином.
10. Фармацевтическая композиция по варианту осуществления 9, где уровень воспаления, индуцированного простагландином, уменьшается, по меньшей мере, на 10%.
11. Фармацевтическая композиция по вариантам осуществления 1-10, где действие, которое нормализует уровень липидов, стимулирует сигнальный путь PPAR.
12. Фармацевтическая композиция по варианту осуществления 11, где сигнальный путь PPAR стимулируется, по меньшей мере, на 10%.
13. Фармацевтическая композиция по вариантам осуществления 1-12, где действие, которое нормализует уровни липидов, индуцирует апоптоз макрофагов М1, промотирует дифференцировку макрофагов М2 или осуществляет и то и другое.
14. Фармацевтическая композиция по вариантам осуществления 1-13, где действие, которое нормализует уровни липидов, понижает уровни интерферона-гамма (IFNγ), фактора некроза опухолей альфа (TNF-α), интерлейкина-12 (IL-12) или их комбинации, высвобождаемых из клеток Th1, повышает уровни IL-10, высвобождаемого из клеток Th2, или осуществляет и то и другое.
15. Фармацевтическая композиция по варианту осуществления 14, где уровни IFNγ, TNF-α, IL-12 или их комбинации, высвобождаемых из клеток Th1, снижаются, по меньшей мере, на 10%.
16. Фармацевтическая композиция по варианту осуществления 14, где уровни IL-10, высвобождаемого из клеток Th2, повышаются, по меньшей мере, на 10%.
17. Фармацевтическая композиция по вариантам осуществления 1-16, где действие, которое нормализует уровень липидов, понижает уровень молекул, индуцирующих воспаление.
18. Фармацевтическая композиция по варианту осуществления 17, где молекула, индуцирующая воспаление, включает вещество P (SP), кальцитонин-ген-связанный пептид (CGRP), глутамат или их комбинацию.
19. Фармацевтическая композиция твердого раствора по вариантам осуществления 1-18, где терапевтическое соединение имеет значение logP 3,0 или более.
20. Фармацевтическая композиция твердого раствора по вариантам осуществления 1-18, где терапевтическое соединение имеет значение logP от приблизительно 2,2 до приблизительно 3,0.
21. Фармацевтическая композиция твердого раствора по вариантам осуществления 1-18, где терапевтическое соединение имеет значение logP приблизительно 2,0 или менее.
22. Фармацевтическая композиция по вариантам осуществления 1-21, где терапевтическое соединение имеет участок полярной поверхности, который является гидрофобным.
23. Фармацевтическая композиция по вариантам осуществления 1-22, где терапевтическое соединение имеет участок полярной поверхности, который составляет менее чем 8,0 нм2.
24. Фармацевтическая композиция по вариантам осуществления 1-22, где терапевтическое соединение имеет участок полярной поверхности, который составляет менее чем 6,0 нм2.
25. Фармацевтическая композиция по вариантам осуществления 1-24, где терапевтическое соединение включает нестероидное противовоспалительно лекарственное средство (NSAID).
26. Фармацевтическая композиция по варианту осуществления 25, где NSAID включает салицилатное производное, п-аминофенольное производное, производное пропионовой кислоты, производное уксусной кислоты, производное эноловой кислоты, производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (COX), селективный ингибитор циклооксигеназы 1 (COX 1), селективный ингибитор циклооксигеназы 2 (COX 2) или их комбинацию.
27. Фармацевтическая композиция по вариантам осуществления 1-26, где терапевтическое соединение включает агонист PPARα, агонист PPARβ/δ, агонист PPARγ или глитазар.
28. Фармацевтическая композиция по вариантам осуществления 1-27, где терапевтическое соединение включает иммуносупрессивное лекарственное средство, средство, способствующее выведению мочевой кислоты, агликон или каннабидиол.
29. Фармацевтическая композиция по вариантам осуществления 1-28, где терапевтическое соединение включает антагонист рецептора рианодина.
30. Фармацевтическая композиция по варианту осуществления 29, где антагонист рецептора рианодина представляет собой азумолен или дантролен.
31. Фармацевтическая композиция по вариантам осуществления 1-30, где терапевтическое соединение включает средство, связывающее ядерный рецептор.
32. Фармацевтическая композиция по варианту осуществления 31, где средство, связывающее ядерный рецептор, включает средство, связывающее рецептор ретиноевой кислоты (RAR), средство, связывающее ретиноидный X рецептор (RXR), средство, связывающее печеночный рецептор Х (LXR), средство, связывающее витамин D или их комбинацию.
33. Фармацевтическая композиция по вариантам осуществления 1-34, где терапевтическое соединение включает антигиперлипидемическое средство.
34. Фармацевтическая композиция по варианту осуществления 33, где антигиперлипидемическое средство включает антагонист рецептора ангиотензина II, ингибитор ACE, ингибитор фосфодиэстеразы, фибрат, статин, токотриенол, ниацин, секвестранты желчных кислот (смолу), ингибитор абсорбции холестерина, ингибитор липазы поджелудочной железы, симпатомиметический амин или их комбинацию.
35. Фармацевтическая композиция по варианту осуществления 34, где антагонист рецептора ангиотензина II включает азилсартан, кандесартан, эпросартан, ирбесартан, лосартан, олмесартан, телмисартан и валсартан.
36. Фармацевтическая композиция по варианту осуществления 34, где ингибитор ACE включает сульфгидрилсодержащее средство, дикарбоксилатсодержащее средство, фосфонатсодержащее средство, касокинин и лактокинин.
37. Фармацевтическая композиция по варианту осуществления 34, где ингибитор фосфодиэстеразы включает селективный ингибитор PDE 1, селективный ингибитор PDE 2, селективный ингибитор PDE 3, селективный ингибитор PDE 4, селективный ингибитор PDE 5 или селективный ингибитор PDE 10.
38. Фармацевтическая композиция по варианту осуществления 34, где фибрат включает безафибрат, ципрофибрат, клофибрат, гемфиброзил, фенофибрат или их комбинацию.
39. Фармацевтическая композиция по варианту осуществления 34, где статин включает аторвастатин, флувастатин, ловастатин, питавастатин, правастатин, розувастатин, симвастатин или их комбинацию.
40. Фармацевтическая композиция по варианту осуществления 34, где ниацин включает аципимокс, ниацин, никотинамид, витамин B3 или их комбинацию.
41. Фармацевтическая композиция по варианту осуществления 34, где секвестрант желчных кислот включает холестирамин, колесевелам, колестирол или их комбинацию.
42. Фармацевтическая композиция по варианту осуществления 34, где ингибитор абсорбции холестерина включает эзетиниб, фитостерол, стерол, станол или их комбинацию.
43. Фармацевтическая композиция по варианту осуществления 34, где ингибитор абсорбции жира включает орлистат
44. Фармацевтическая композиция по варианту осуществления 34, где симпатомиметический амин включает кленбутерол, сальбутамол, эфедрин, псевдоэфедрин, метамфетамин, амфетамин, фенилэфрин, изопротеренол, добутамин, метилфенидат, лисдексамфетамин, катин, катинон, меткатинон, кокаин, бензилпиперазин (BZP), метилендиоксипировалерон (MDPV), 4-метиламинорекс, пемолин, фенметразин, пропилгекседрин или их комбинацию.
45. Фармацевтическая композиция по вариантам осуществления 1-44, где терапевтическое соединение включает противоопухолевое лекарственное средство.
46. Фармацевтическая композиция по варианту осуществления 45, где противоопухолевое лекарственное средство включает алкилирующее средство, антиметаболит, растительный алкалоид и терпеноид, ингибитор топоизомеразы или цитотоксический антибиотик.
47. Фармацевтическая композиция по вариантам осуществления 1-46, где терапевтическое соединение включает метформин, куркумин, глицирретиновую кислоту или 6-шогаол.
48. Фармацевтическая композиция по вариантам осуществления 1-46, где терапевтическое соединение включает антибиотик.
49. Фармацевтическая композиция по варианту осуществления 48, где антибиотик включает изониазид, рифампицин, пиразинамид или этамбутол.
50. Фармацевтическая композиция по вариантам осуществления 1-49, где терапевтическое соединение включает противоглистное лекарственное средство.
51. Фармацевтическая композиция по варианту осуществления 50, где противоглистное лекарственное средство включает абамектин, аминоацетонитрил, такой как монепантел, бензимидазол, диэтилкарбамазин, ивермектин, левамизол, никлозамид, октадепсипептид, такой как эмодепсид, фосфоновую кислоту (метрифонат), празиквантел, спироиндол, такой как дерквантел, или сурамин, пирантела памоат.
52. Фармацевтическая композиция по вариантам осуществления 1-51, где терапевтическое соединение включает противомалярийное лекарственное средство.
53. Фармацевтическая композиция по варианту осуществления 52, где противомалярийное лекарственное средство включает амодиахин, артемизинин, атоваквон, хлорохин, клиндамицин, доксициклин, галофантрин, мефлохин, примахин, прогуанил, пириметамин, хинин и относящееся к нему лекарственное средство, такое как хинимакс и хинидин, руфигаллол и сульфонамид, такой как сульфадоксин или сульфаметоксипиридазин.
54. Фармацевтическая композиция по варианту осуществления 53, где артемизинин включает артеэфир, артеметер, артемизинин, артесунат или дигидроартемизинин.
55. Фармацевтическая композиция по вариантам осуществления 1-54, где терапевтическое соединение включает эфир терапевтического соединения.
56. Фармацевтическая композиция по вариантам осуществления 1-55, где терапевтическое соединение включает эфир терапевтического соединения по вариантам осуществления 35-54.
57. Фармацевтическая композиция по вариантам осуществления 1-56, где терапевтическое соединение присутствует в количестве менее чем приблизительно 90% по массе, менее чем приблизительно 80% по массе, менее чем приблизительно 70% по массе, менее чем приблизительно 65% по массе, менее чем приблизительно 60% по массе, менее чем приблизительно 55% по массе, менее чем приблизительно 50% по массе, менее чем приблизительно 45% по массе, менее чем приблизительно 40% по массе, менее чем приблизительно 35% по массе, менее чем приблизительно 30% по массе, менее чем приблизительно 25% по массе, менее чем приблизительно 20% по массе, менее чем приблизительно 15% по массе, менее чем приблизительно 10% по массе, менее чем приблизительно 5% по массе или менее чем приблизительно 1% по массе или приблизительно от 1% до 90% по массе, приблизительно от 1% до 80% по массе, приблизительно от 1% до 75% по массе, приблизительно от 1% до 70% по массе, приблизительно от 1% до 65% по массе, приблизительно от 1% до 60% по массе, приблизительно от 1% до 55% по массе, приблизительно от 1% до 50% по массе, приблизительно от 1% до 45% по массе, приблизительно от 1% до 40% по массе, приблизительно от 1% до 35% по массе, приблизительно от 1% до 30% по массе, приблизительно от 1% до 25% по массе, приблизительно от 1% до 20% по массе, приблизительно от 1% до 15% по массе, приблизительно от 1% до 10% по массе, приблизительно от 1% до 5% по массе, приблизительно от 2% до 50% по массе, приблизительно от 2% до 40% по массе, приблизительно от 2% до 30% по массе, приблизительно от 2% до 20% по массе, приблизительно от 2% до 10% по массе, приблизительно от 4% до 50% по массе, приблизительно от 4% до 40% по массе, приблизительно от 4% до 30% по массе, приблизительно от 4% до 20% по массе, приблизительно от 4% до 10% по массе, приблизительно от 6% до 50% по массе, приблизительно от 6% до 40% по массе, приблизительно от 6% до 30% по массе, приблизительно от 6% до 20% по массе, приблизительно от 6% до 10% по массе, приблизительно от 8% до 50% по массе, приблизительно от 8% до 40% по массе, приблизительно от 8% до 30% по массе, приблизительно от 8% до 20% по массе, приблизительно от 8% до 15% по массе или приблизительно от 8% до 12% по массе.
58. Фармацевтическая композиция по вариантам осуществления 1-57, где терапевтическое соединение присутствует в количестве от приблизительно 0,1% до приблизительно 45% по массе, от приблизительно 0,1% до приблизительно 40% по массе, от приблизительно 0,1% до приблизительно 35% по массе, от приблизительно 0,1% до приблизительно 30% по массе, от приблизительно 0,1% до приблизительно 25% по массе, от приблизительно 0,1% до приблизительно 20% по массе, от приблизительно 0,1% до приблизительно 15% по массе, от приблизительно 0,1% до приблизительно 10% по массе, от приблизительно 0,1% до приблизительно 5% по массе, от приблизительно 1% до приблизительно 45% по массе, от приблизительно 1% до приблизительно 40% по массе, от приблизительно 1% до приблизительно 35% по массе, от приблизительно 1% до приблизительно 30% по массе, от приблизительно 1% до приблизительно 25% по массе, от приблизительно 1% до приблизительно 20% по массе, от приблизительно 1% до приблизительно 15% по массе, от приблизительно 1% до приблизительно 10% по массе, от приблизительно 1% до приблизительно 5% по массе, от приблизительно 5% до приблизительно 45% по массе, от приблизительно 5% до приблизительно 40% по массе, от приблизительно 5% до приблизительно 35% по массе, от приблизительно 5% до приблизительно 30% по массе, от приблизительно 5% до приблизительно 25% по массе, от приблизительно 5% до приблизительно 20% по массе, от приблизительно 5% до приблизительно 15% по массе, от приблизительно 5% до приблизительно 10% по массе, от приблизительно 10% до приблизительно 45% по массе, от приблизительно 10% до приблизительно 40% по массе, от приблизительно 10% до приблизительно 35% по массе, от приблизительно 10% до приблизительно 30% по массе, от приблизительно 10% до приблизительно 25% по массе, от приблизительно 10% до приблизительно 20% по массе, от приблизительно 10% до приблизительно 15% по массе, от приблизительно 15% до приблизительно 45% по массе, от приблизительно 15% до приблизительно 40% по массе, от приблизительно 15% до приблизительно 35% по массе, от приблизительно 15% до приблизительно 30% по массе, от приблизительно 15% до приблизительно 25% по массе, от приблизительно 15% до приблизительно 20% по массе, от приблизительно 20% до приблизительно 45% по массе, от приблизительно 20% до приблизительно 40% по массе, от приблизительно 20% до приблизительно 35% по массе, от приблизительно 20% до приблизительно 30% по массе, от приблизительно 20% до приблизительно 25% по массе, от приблизительно 25% до приблизительно 45% по массе, от приблизительно 25% до приблизительно 40% по массе, от приблизительно 25% до приблизительно 35% по массе или от приблизительно 25% до приблизительно 30% по массе.
59. Фармацевтическая композиция по вариантам осуществления 1-58, где фармацевтически приемлемый твердый при комнатной температуре липид представляет собой фармацевтически приемлемый глицеролипид, фармацевтически приемлемый гликолевый эфир жирной кислоты, фармацевтически приемлемый простой полиэфир сложного эфира жирной кислоты, смесь фармацевтически приемлемых липидов или любую их комбинацию.
60. Фармацевтическая композиция по вариантам осуществления 1-59, где фармацевтически приемлемые глицеролипиды представляют собой масло какао, смеси стеарата ПЭГ-6 и пальмитостеарата этиленгликоля и стеарата ПЭГ-32 (TEFOSE® 1500; TEFOSE® 63), смеси трицетеарет-4 фосфата и пальмитостеарата этиленгликоля и пальмитостеарата диэтиленгликоля (SEDEFOS® 75), смеси глицеролмоностеарата и стеарата ПЭГ-75 (GELOT®), смеси цетилового спирта и этоксилированных жирных спиртов (seteth-2-, steareth-20) (EMULCIRE®), смеси насыщенных C10-C18 триглицеридов, имеющих температуру плавления приблизительно 33°C (GELUCIRE® 33/01), смеси насыщенных C10-C18 триглицеридов, имеющих температуру плавления приблизительно 39°C (GELUCIRE® 39/01), смеси насыщенных C10-C18 триглицеридов, имеющих температуру плавления приблизительно 43°C (GELUCIRE® 43/01), смеси глицеролмоностеарата 40-55 (тип I) и диглицеридов (GELEOL® моно и диглицериды) и смеси триглицеридов со средней длиной цепи (LABRAFAC® Lipophile WL 1349).
61. Фармацевтическая композиция по вариантам осуществления 1-60, где фармацевтически приемлемый гликолевый эфир жирной кислоты представляют собой этиленгликолевый эфир жирной кислоты, диэтиленгликолевый эфир жирной кислоты, пропиленгликолевый эфир жирной кислоты и дипропиленгликолевый эфир жирной кислоты, каприлат этиленгликоля, пеларгонат этиленгликоля, капрат этиленгликоля, ундецелат этиленгликоля, лаурат этиленгликоля, тридецилат этиленгликоля, миристат этиленгликоля, миристолат этиленгликоля, пентадецилат этиленгликоля, пальмитат этиленгликоля, пальмитолеат этиленгликоля, сапиенат этиленгликоля, маргарат этиленгликоля, стеарат этиленгликоля, пальмитостеарат этиленгликоля, олеат этиленгликоля, элаидат этиленгликоля, вакцинат этиленгликоля, линолеат этиленгликоля, линоэлаидат этиленгликоля, α-линоленат этиленгликоля, γ-линоленат этиленгликоля, стеаридонат этиленгликоля, каприлокапрат этиленгликоля, дикаприлокапрат этиленгликоля, дикаприлат этиленгликоля, дипеларгонат этиленгликоля, дикапрат этиленгликоля, диундецелат этиленгликоля, дилаурат этиленгликоля, дитридецилат этиленгликоля, димиристат этиленгликоля, димиристолат этиленгликоля, дипентадецилат этиленгликоля, дипальмитат этиленгликоля, дипальмитолеат этиленгликоля, дисапиенат этиленгликоля, димаргарат этиленгликоля, дистеарат этиленгликоля, дипальмитостеарат этиленгликоля, диолеат этиленгликоля, диэлаидат этиленгликоля, дивакцинат этиленгликоля, дилинолеат этиленгликоля, дилиноэлаидат этиленгликоля, ди-α-линоленат этиленгликоля, ди-γ-линоленат этиленгликоля, дистеаридонат этиленгликоля, дикаприлокапрат этиленгликоля, дидикаприлокапрат этиленгликоля, каприлат пропиленгликоля, пеларгонат пропиленгликоля, капрат пропиленгликоля, ундецилат пропиленгликоля, лаурат пропиленгликоля, тридецилат пропиленгликоля, миристат пропиленгликоля, миристолат пропиленгликоля, пентадецилат пропиленгликоля, пальмитат пропиленгликоля, пальмитолеат пропиленгликоля, сапиенат пропиленгликоля, маргарат пропиленгликоля, стеарат пропиленгликоля, пальмитостеарат пропиленгликоля, олеат пропиленгликоля, элаидат пропиленгликоля, вакцинат пропиленгликоля, линолеат пропиленгликоля, линоэлаидат пропиленгликоля, α-линоленат пропиленгликоля, γ-линоленат пропиленгликоля, стеаридонат пропиленгликоля, каприлокапрат пропиленгликоля, дикаприлокапрат пропиленгликоля, дикаприлат пропиленгликоля, дипеларгонат пропиленгликоля, дикапрат пропиленгликоля, диундецилат пропиленгликоля, дилаурат пропиленгликоля, дитридецилат пропиленгликоля, димиристат пропиленгликоля, димиристолат пропиленгликоля, дипентадецилат пропиленгликоля, дипальмитат пропиленгликоля, дипальмитолеат пропиленгликоля, дисапиенат пропиленгликоля, димаргарат пропиленгликоля, дистеарат пропиленгликоля, дипальмитостеарат пропиленгликоля, диолеат пропиленгликоля, диэлаидат пропиленгликоля, дивакцинат пропиленгликоля, дилинолеат пропиленгликоля, дилиноэлаидат пропиленгликоля, ди-α-линоленат пропиленгликоля, ди-γ-линоленат пропиленгликоля, дистеаридонат пропиленгликоля, дикаприлокапрат пропиленгликоля, дидикаприлокапрат пропиленгликоля, монопальмитостеарат пропиленгликоля (MONOSTEOL®), дикаприлокапрат пропиленгликоля (LABRAFAC® PG), монолауран пропиленгликоля (тип I) (LAUROGLYCOL® FCC), монолауран пропиленгликоля (тип II) (LAUROGLYCOL® 90), монокаприлат пропиленгликоля (тип I) (CAPRYOL® PGMC), монокаприлат пропиленгликоля (тип II) (CAPRYOL® 90) или любую их комбинацию.
62. Фармацевтическая композиция по вариантам осуществления 1-61, где фармацевтически приемлемый простой полиэфир сложного эфира жирной кислоты представляет собой ПЭГ сложный эфир жирной кислоты, ПЭГ глицерил жирной кислоты, ПЭГ глицерид сложного эфира жирной кислоты, ППГ сложный эфир жирной кислоты, ППГ глицерил жирной кислоты или ППГ глицерид сложного эфира жирной кислоты
63. Фармацевтическая композиция по вариантам осуществления 1-62, где фармацевтически приемлемый твердый при комнатной температуре липид присутствует в количестве, достаточном для образования композиции твердого раствора.
64. Фармацевтическая композиция по вариантам осуществления 1-63, где фармацевтически приемлемый твердый при комнатной температуре липид присутствует в количестве, по меньшей мере, 10% по массе, по меньшей мере, 20% по массе, по меньшей мере, 30% по массе, по меньшей мере, 35% по массе, по меньшей мере, 40% по массе, по меньшей мере, 45% по массе, по меньшей мере, 50% по массе, по меньшей мере, 55% по массе, по меньшей мере, 60% по массе, по меньшей мере, 65% по массе, по меньшей мере, 70% по массе, по меньшей мере, 75% по массе, по меньшей мере, 80% по массе, по меньшей мере, 85% по массе, по меньшей мере, 90% по массе, по меньшей мере, 95% по массе или, по меньшей мере, 99% по массе или от приблизительно 30% до приблизительно 99% по массе, от приблизительно 35% до приблизительно 99% по массе, от приблизительно 40% до приблизительно 99% по массе, от приблизительно 45% до приблизительно 99% по массе, от приблизительно 50% до приблизительно 99% по массе, от приблизительно 30% до приблизительно 98% по массе, от приблизительно 35% до приблизительно 98% по массе, от приблизительно 40% до приблизительно 98% по массе, от приблизительно 45% до приблизительно 98% по массе, от приблизительно 50% до приблизительно 98% по массе, от приблизительно 30% до приблизительно 95% по массе, от приблизительно 35% до приблизительно 95% по массе, от приблизительно 40% до приблизительно 95% по массе, от приблизительно 45% до приблизительно 95% по массе или от приблизительно 50% до приблизительно 95% по массе или от приблизительно 70% до приблизительно 97% по массе, от приблизительно 75% до приблизительно 97% по массе, от приблизительно 80% до приблизительно 97% по массе, от приблизительно 85% до приблизительно 97% по массе, от приблизительно 88% до приблизительно 97% по массе, от приблизительно 89% до приблизительно 97% по массе, от приблизительно 90% до приблизительно 97% по массе, от приблизительно 75% до приблизительно 96% по массе, от приблизительно 80% до приблизительно 96% по массе, от приблизительно 85% до приблизительно 96% по массе, от приблизительно 88% до приблизительно 96% по массе, от приблизительно 89% до приблизительно 96% по массе, от приблизительно 90% до приблизительно 96% по массе, от приблизительно 75% до приблизительно 93% по массе, от приблизительно 80% до приблизительно 93% по массе, от приблизительно 85% до приблизительно 93% по массе, от приблизительно 88% до приблизительно 93% по массе, от приблизительно 89% до приблизительно 93% по массе или от приблизительно 90% до приблизительно 93% по массе.
65. Фармацевтическая композиция по вариантам осуществления 1-64, где фармацевтически приемлемый жидкий при комнатной температуре липид представляет собой моноглицерид.
66. Фармацевтическая композиция по варианту осуществления 65, где моноглицерид представляет собой глицерина мономиристолеат, глицерина монопальмитолеат, глицерина моносапиенат, глицерина моноолеат, глицерина моноэлаидат, глицерина моновакценат, глицерина монолинолеат, глицерина монолиноэлаидат, глицерина монолиноленат, глицерина моностеаридонат, глицерина моноэйкозеноат, глицерина мономеадат, глицерина моноарахидонат, глицерина моноэйкозапентаеноат, глицерина моноэрукат, глицерина монодокозагексаеноат, глицерина мононервонат, глицерил дибегенат (COMPRITOL® 888), глицерина дибегенат (COMPRITOL® E ATO), глицерина дипальмитостеарат (Biogapress Vegetal BM297ATO), глицерина дистеарат (тип I) (PRECIROL® ATO 5) и глицерина монолинолеат (MAISINE™ 35-1).
67. Фармацевтическая композиция по вариантам осуществления 1-66, где фармацевтически приемлемый жидкий при комнатной температуре липид присутствует в количестве, достаточном для растворения терапевтического соединения.
68. Фармацевтическая композиция по вариантам осуществления 1-67, где фармацевтически приемлемый жидкий при комнатной температуре липид присутствует в количестве менее чем приблизительно 90% по массе, менее чем приблизительно 80% по массе, менее чем приблизительно 70% по массе, менее чем приблизительно 65% по массе, менее чем приблизительно 60% по массе, менее чем приблизительно 55% по массе, менее чем приблизительно 50% по массе, менее чем приблизительно 45% по массе, менее чем приблизительно 40% по массе, менее чем приблизительно 35% по массе, менее чем приблизительно 30% по массе, менее чем приблизительно 25% по массе, менее чем приблизительно 20% по массе, менее чем приблизительно 15% по массе, менее чем приблизительно 10% по массе, менее чем приблизительно 5% по массе или менее чем приблизительно 1% по массе или приблизительно от 1% до 90% по массе, приблизительно от 1% до 80% по массе, приблизительно от 1% до 70% по массе, приблизительно от 1% до 60% по массе, приблизительно от 1% до 50% по массе, приблизительно от 1% до 40% по массе, приблизительно от 1% до 30% по массе, приблизительно от 1% до 20% по массе, приблизительно от 1% до 10% по массе, приблизительно от 2% до 50% по массе, приблизительно от 2% до 40% по массе, приблизительно от 2% до 30% по массе, приблизительно от 2% до 20% по массе, приблизительно от 2% до 10% по массе, приблизительно от 4% до 50% по массе, приблизительно от 4% до 40% по массе, приблизительно от 4% до 30% по массе, приблизительно от 4% до 20% по массе, приблизительно от 4% до 10% по массе, приблизительно от 6% до 50% по массе, приблизительно от 6% до 40% по массе, приблизительно от 6% до 30% по массе, приблизительно от 6% до 20% по массе, приблизительно от 6% до 10% по массе, приблизительно от 8% до 50% по массе, приблизительно от 8% до 40% по массе, приблизительно от 8% до 30% по массе, приблизительно от 8% до 20% по массе, приблизительно от 8% до 15% по массе или приблизительно от 8% до 12% по массе.
69. Фармацевтическая композиция по вариантам осуществления 1-68, где стабилизатор представляет собой жидкий полимер гликоля, одноатомный спирт, диметиловый эфир изосорбида и моноэтиловый эфир диэтиленгликоля (2-(2-этоксиэтокси)этанол) (TRANSCUTOL®).
70. Фармацевтическая композиция по варианту осуществления 69, где жидкий полимер гликоля представляет собой жидкий полимер ПЭГ и/или жидкий полимер ППГ.
71. Фармацевтическая композиция по варианту осуществления 70, где одноатомный спирт представляет собой этанол, пропанол, бутанол, пентанол или 1-гексадеканол.
72. Фармацевтическая композиция по вариантам осуществления 1-71, где фармацевтически приемлемый стабилизатор присутствует в количестве, достаточном для стабилизации свободной кислоты или основания, присутствующих в терапевтическом соединении.
73. Фармацевтическая композиция по вариантам осуществления 1-72, где фармацевтически приемлемый стабилизатор присутствует в количестве менее чем приблизительно 40% по массе, менее чем приблизительно 35% по массе, менее чем приблизительно 30% по массе, менее чем приблизительно 25% по массе, менее чем приблизительно 20% по массе, менее чем приблизительно 19% по массе, менее чем приблизительно 18% по массе, менее чем приблизительно 17% по массе, менее чем приблизительно 16% по массе, менее чем приблизительно 15% по массе, менее чем приблизительно 14% по массе, менее чем приблизительно 13% по массе, менее чем приблизительно 12% по массе, менее чем приблизительно 11% по массе, менее чем приблизительно 10% по массе, менее чем приблизительно 9% по массе, менее чем приблизительно 8% по массе, менее чем приблизительно 7% по массе, менее чем приблизительно 6% по массе, менее чем приблизительно 5% по массе, менее чем приблизительно 4% по массе, менее чем приблизительно 3% по массе, менее чем приблизительно 2% по массе или менее чем приблизительно 1% или от приблизительно 1% до приблизительно 5% по массе, от приблизительно 1% до приблизительно 7% по массе, от приблизительно 1% до приблизительно 10% по массе, от приблизительно 1% до приблизительно 12% по массе, от приблизительно 1% до приблизительно 15% по массе, от приблизительно 1% до приблизительно 18% по массе, от приблизительно 1% до приблизительно 20% по массе, от приблизительно 2% до приблизительно 5% по массе, от приблизительно 2% до приблизительно 7% по массе, от приблизительно 2% до приблизительно 10% по массе, от приблизительно 2% до приблизительно 12% по массе, от приблизительно 2% до приблизительно 15% по массе, от приблизительно 2% до приблизительно 18% по массе, от приблизительно 2% до приблизительно 20% по массе, от приблизительно 3% до приблизительно 5% по массе, от приблизительно 3% до приблизительно 7% по массе, от приблизительно 3% до приблизительно 10% по массе, от приблизительно 3% до приблизительно 12% по массе, от приблизительно 3% до приблизительно 15% по массе, от приблизительно 3% до приблизительно 18% по массе, от приблизительно 3% до приблизительно 20% по массе, от приблизительно 4% до приблизительно 5% по массе, от приблизительно 4% до приблизительно 7% по массе, от приблизительно 4% до приблизительно 10% по массе, от приблизительно 4% до приблизительно 12% по массе, от приблизительно 4% до приблизительно 15% по массе, от приблизительно 4% до приблизительно 18% по массе, от приблизительно 4% до приблизительно 20% по массе, от приблизительно 5% до приблизительно 7% по массе, от приблизительно 5% до приблизительно 10% по массе, от приблизительно 5% до приблизительно 12% по массе, от приблизительно 5% до приблизительно 15% по массе, от приблизительно 5% до приблизительно 18% по массе, от приблизительно 5% до приблизительно 20% по массе, от приблизительно 6% до приблизительно 7% по массе, от приблизительно 6% до приблизительно 10% по массе, от приблизительно 6% до приблизительно 12% по массе, от приблизительно 6% до приблизительно 15% по массе, от приблизительно 6% до приблизительно 18% по массе, от приблизительно 6% до приблизительно 20% по массе, от приблизительно 7% до приблизительно 10% по массе, от приблизительно 7% до приблизительно 12% по массе, от приблизительно 7% до приблизительно 15% по массе, от приблизительно 7% до приблизительно 18% по массе, от приблизительно 7% до приблизительно 20% по массе, от приблизительно 8% до приблизительно 10% по массе, от приблизительно 8% до приблизительно 12% по массе, от приблизительно 8% до приблизительно 15% по массе, от приблизительно 8% до приблизительно 18% по массе, от приблизительно 8% до приблизительно 20% по массе, от приблизительно 9% до приблизительно 10% по массе, от приблизительно 9% до приблизительно 12% по массе, от приблизительно 9% до приблизительно 15% по массе, от приблизительно 9% до приблизительно 18% по массе, от приблизительно 9% до приблизительно 20% по массе, от приблизительно 10% до приблизительно 12% по массе, от приблизительно 10% до приблизительно 15% по массе, от приблизительно 10% до приблизительно 18% по массе или от приблизительно 10% до приблизительно 20% по массе.
74. Фармацевтическая композиция по вариантам осуществления 1-73, где фармацевтически приемлемый стабилизатор не используется в качестве растворителя.
75. Фармацевтическая композиция по вариантам осуществления 1-74, где фармацевтически приемлемый стабилизатор приводит к не более чем 85%, не более чем 80%, не более чем 75%, не более чем 70%, не более чем 65%, не более чем 60%, не более чем 55%, не более чем 50%, не более чем 45%, не более чем 40%, не более чем 35%, не более чем 30%, не более чем 25%, не более чем 20%, не более чем 15%, не более чем 10% или не более чем 5% растворению терапевтического соединения.
76. Фармацевтическая композиция по вариантам осуществления 1-75, где фармацевтически приемлемый нейтрализатор присутствует в количестве, достаточном для нейтрализации ионных зарядов, образующихся при растворении терапевтического соединения.
77. Фармацевтическая композиция по вариантам осуществления 1-76, где фармацевтически приемлемый нейтрализатор присутствует в количестве одного эквивалента по отношению к терапевтическому соединению.
78. Фармацевтическая композиция по вариантам осуществления 1-77, где фармацевтически приемлемый нейтрализатор присутствует в количестве менее чем один эквивалент по отношению к терапевтическому соединению.
79. Фармацевтическая композиция по вариантам осуществления 1-78, где фармацевтически приемлемый нейтрализатор присутствует в количестве более чем один эквивалент по отношению к терапевтическому соединению.
80. Фармацевтическая композиция по вариантам осуществления 1-79, где нейтрализатор присутствует в количестве менее чем приблизительно 90% по массе, менее чем приблизительно 80% по массе, менее чем приблизительно 70% по массе, менее чем приблизительно 65% по массе, менее чем приблизительно 60% по массе, менее чем приблизительно 55% по массе, менее чем приблизительно 50% по массе, менее чем приблизительно 45% по массе, менее чем приблизительно 40% по массе, менее чем приблизительно 35% по массе, менее чем приблизительно 30% по массе, менее чем приблизительно 25% по массе, менее чем приблизительно 20% по массе, менее чем приблизительно 15% по массе, менее чем приблизительно 10% по массе, менее чем приблизительно 5% по массе или менее чем приблизительно 1% по массе или приблизительно от 1% до 90% по массе, приблизительно от 1% до 80% по массе, приблизительно от 1% до 75% по массе, приблизительно от 1% до 70% по массе, приблизительно от 1% до 65% по массе, приблизительно от 1% до 60% по массе, приблизительно от 1% до 55% по массе, приблизительно от 1% до 50% по массе, приблизительно от 1% до 45% по массе, приблизительно от 1% до 40% по массе, приблизительно от 1% до 35% по массе, приблизительно от 1% до 30% по массе, приблизительно от 1% до 25% по массе, приблизительно от 1% до 20% по массе, приблизительно от 1% до 15% по массе, приблизительно от 1% до 10% по массе, приблизительно от 1% до 5% по массе, приблизительно от 2% до 50% по массе, приблизительно от 2% до 40% по массе, приблизительно от 2% до 30% по массе, приблизительно от 2% до 20% по массе, приблизительно от 2% до 10% по массе, приблизительно от 4% до 50% по массе, приблизительно от 4% до 40% по массе, приблизительно от 4% до 30% по массе, приблизительно от 4% до 20% по массе, приблизительно от 4% до 10% по массе, приблизительно от 6% до 50% по массе, приблизительно от 6% до 40% по массе, приблизительно от 6% до 30% по массе, приблизительно от 6% до 20% по массе, приблизительно от 6% до 10% по массе, приблизительно от 8% до 50% по массе, приблизительно от 8% до 40% по массе, приблизительно от 8% до 30% по массе, приблизительно от 8% до 20% по массе, приблизительно от 8% до 15% по массе или приблизительно от 8% до 12% по массе.
81. Фармацевтическая композиция по вариантам осуществления 1-80, где нейтрализатор присутствует в количестве от приблизительно 0,1% до приблизительно 45% по массе, от приблизительно 0,1% до приблизительно 40% по массе, от приблизительно 0,1% до приблизительно 35% по массе, от приблизительно 0,1% до приблизительно 30% по массе, от приблизительно 0,1% до приблизительно 25% по массе, от приблизительно 0,1% до приблизительно 20% по массе, от приблизительно 0,1% до приблизительно 15% по массе, от приблизительно 0,1% до приблизительно 10% по массе, от приблизительно 0,1% до приблизительно 5% по массе, от приблизительно 1% до приблизительно 45% по массе, от приблизительно 1% до приблизительно 40% по массе, от приблизительно 1% до приблизительно 35% по массе, от приблизительно 1% до приблизительно 30% по массе, от приблизительно 1% до приблизительно 25% по массе, от приблизительно 1% до приблизительно 20% по массе, от приблизительно 1% до приблизительно 15% по массе, от приблизительно 1% до приблизительно 10% по массе, от приблизительно 1% до приблизительно 5% по массе, от приблизительно 5% до приблизительно 45% по массе, от приблизительно 5% до приблизительно 40% по массе, от приблизительно 5% до приблизительно 35% по массе, от приблизительно 5% до приблизительно 30% по массе, от приблизительно 5% до приблизительно 25% по массе, от приблизительно 5% до приблизительно 20% по массе, от приблизительно 5% до приблизительно 15% по массе, от приблизительно 5% до приблизительно 10% по массе, от приблизительно 10% до приблизительно 45% по массе, от приблизительно 10% до приблизительно 40% по массе, от приблизительно 10% до приблизительно 35% по массе, от приблизительно 10% до приблизительно 30% по массе, от приблизительно 10% до приблизительно 25% по массе, от приблизительно 10% до приблизительно 20% по массе, от приблизительно 10% до приблизительно 15% по массе, от приблизительно 15% до приблизительно 45% по массе, от приблизительно 15% до приблизительно 40% по массе, от приблизительно 15% до приблизительно 35% по массе, от приблизительно 15% до приблизительно 30% по массе, от приблизительно 15% до приблизительно 25% по массе, от приблизительно 15% до приблизительно 20% по массе, от приблизительно 20% до приблизительно 45% по массе, от приблизительно 20% до приблизительно 40% по массе, от приблизительно 20% до приблизительно 35% по массе, от приблизительно 20% до приблизительно 30% по массе, от приблизительно 20% до приблизительно 25% по массе, от приблизительно 25% до приблизительно 45% по массе, от приблизительно 25% до приблизительно 40% по массе, от приблизительно 25% до приблизительно 35% по массе или от приблизительно 25% до приблизительно 30% по массе.
82. Способ лечения индивидуума, страдающего сердечно-сосудистым заболеванием, где способ включает стадию: введения индивидууму, если ему это необходимо, фармацевтической композиции по вариантам осуществления 1-81, где введение приводит в результате к уменьшению интенсивности симптома, связанного с сердечно-сосудистым заболеванием, вследствие чего происходит лечение индивидуума.
83. Применение фармацевтической композиции по вариантам осуществления 1-81 в производстве лекарственного препарата для лечения сердечно-сосудистого заболевания.
84. Применение фармацевтической композиции по вариантам осуществления 1-81 для лечения сердечно-сосудистого заболевания.
85. Способ по варианту осуществления 82 или применение по варианту осуществления 83 или 84, где сердечно-сосудистое заболевание связано с гиперлипидемией, коронарной болезнью сердца, атеросклерозом, заболеванием периферических кровеносных сосудов, окклюзивным заболеванием сосудов, кардиомиопатей, васкулитом, воспалительным заболеванием сердца, ишемической болезнью сердца, сердечной недостаточностью с застойными явлениями, гипертонической болезнью сердца, пороком клапана сердца, гипертензией, инфарктом миокарда, диабетичсескими сердечными состояниями, аневризмой, эмболией, расслоением, псевдоаневризмой, сосудистой патологией, каверномой, тромбозом, варикозом вен или инсультом.
86. Способ или применение по варианту осуществления 85, где гиперлипидемия представляет собой дислипидемию, гиперхолестеринемию, гиперглицеридемию, гипертриглицеридемию, гиперлипопротеинемию или гиперхиломикронемию и комбинированную гиперлипидемию.
87. Способ или применение по варианту осуществления 86, где гиперлипопротеинемия представляет собой гиперлипопротеинемию типа Ia, гиперлипопротеинемию типа Ib, гиперлипопротеинемию типа Ic, гиперлипопротеинемию типа IIa, гиперлипопротеинемию типа IIb гиперлипопротеинемию типа III, гиперлипопротеинемию типа IV и гиперлипопротеинемию типа V.
88. Способ или применение по варианту осуществления 85, где окклюзивное заболевание сосудов (VOD) представляет собой атеросклероз, заболевание периферических сосудов и стеноз.
89. Способ или применение по варианту осуществления 85, где кардиомиопатия представляет собой внешнюю кардиомиопатию или внутреннюю кардиомиопатию.
90. Способ или применение по варианту осуществления 89, где внешняя кардиомиопатия представляет собой акромегалию, алкогольную кардиомиопатию, амилоидоз, болезнь Шагаса, химиотерапию, диабетическую кардиомиопатию, гемохроматоз, гипертензивную кардиомиопатию, гипертиреоз, воспалительную кардиомиопатию, ишемическую кардиомиопатию, мышечную дистрофию, клапанную кардиомиопатию, кардиомиопатию, вторичную по отношению к системному метаболическому заболеванию, кардиомиопатию, вторичную по отношению к системному алиментарному заболеванию, ишемической болезни сердца и врожденному пороку сердца.
91. Способ или применение по варианту осуществления 89, где внутренняя кардиомиопатия представляет собой дилатационную кардиомиопатию (DCM), гипертрофическую кардиомиопатию (HCM или HOCM), аритмогенную кардиомиопатию правого желудочка (ARVC), рестриктивную кардиомиопатию (RCM), некомпактную кардиомиопатию, изолированную желудочковую некомпактную митохондриальную миопатию, кардиомиопатию Такоцубо и эндокардит Леффлера.
92. Способ или применение по варианту осуществления 85, где васкулит представляет собой болезнь Бюргера (облитерирующий тромбангиит), церебральный васкулит (васкулит центральной нервной системы), артериит Черджа-Стросса, криоглобулинемию, эссенциальный криоглобулинемический васкулит, гигантоклеточный (темпоральный) артериит, васкулит игрока в гольф, болезнь Шенлейна-Генохо, лейкоцитокластический васкулит (аллергический васкулит), болезнь Кавасаки, микроскопический полиартериит/полиангиит, узелковый полиартериит, ревматическую полимиалгию (ПМР), ревматоидный васкулит, артериит Такаясу, тромбофлебит, гранулематоз Вегенера и васкулит, который является вторичным по отношению к заболеваниям соединительной ткани, или васкулит, который является вторичным по отношению к вирусной инфекции.
93. Способ или применение по варианту осуществления 92, где васкулит, который является вторичным по отношению к заболеваниям соединительной ткани, представляет собой системную красную волчанку (SLE), ревматоидный артрит (RA), рецидивирующий полихондрит, болезнь Бехчета.
94. Способ или применение по варианту осуществления 85, где воспалительное заболевание сердца представляет собой эндокардит, воспалительную кардиомегалию и миокардит.
95. Способ по вариантам осуществления 82 или 85-94 или применение по вариантам осуществления 83-94, где после введения индивидууму, фармацевтическая композиция, включающая терапевтическое соединение по вариантам осуществления 1-81, позволяет в результате достигать биораспределения терапевтического соединения, которое отличается от биораспределения терапевтического соединения, включенного в такую же фармацевтическую композицию, но не содержащую фармацевтически приемлемого вспомогательного вещества.
96. Способ по вариантам осуществления 82 или 85-95 или применение по вариантам осуществления 83-95, где после введения индивидууму, количество терапевтического соединения фармацевтической композиции по вариантам осуществления 1-81, доставляемое в макрофаг, составляет, по меньшей мере, 5% от суммарного количества терапевтического соединения, содержащегося в веденной фармацевтической композиции.
97. Способ по вариантам осуществления 82 или 85-96 или применение по вариантам осуществления 83-96, где после введения индивидууму, фармацевтическая композиция по вариантам осуществления 1-81 уменьшает раздражение в кишечнике, по меньшей мере, на 5% в отличие от фармацевтической композиции по вариантам осуществления 1-81, но не содержащей фармацевтически приемлемого вспомогательного вещества.
98. Способ по вариантам осуществления 82 или 85-97 или применение по вариантам осуществления 83-97, где после введения индивидууму, фармацевтическая композиция по вариантам осуществления 1-81 уменьшает раздражение желудка, по меньшей мере, на 5% в отличие от фармацевтической композиции по вариантам осуществления 1-81, но не содержащей фармацевтически приемлемого вспомогательного вещества.
ПРИМЕРЫ
Следующие неограничивающие примеры приводятся только с целью иллюстрации, для того чтобы облегчить более полное понимание раскрываемого предмета изобретения. Эти примеры не следует истолковывать в качестве ограничения любого из вариантов осуществления, описанных в настоящем изобретении, включая примеры, относящиеся к фармацевтическим композициям, способам приготовления фармацевтических композиций или способам или применениям лечения аномальных уровней липидов или заболевания, связанного с аномальными уровнями липидов.
Пример 1
Дифференциальная сканирующая калориметрия
Этот пример иллюстрирует приготовление раскрытой в изобретении фармацевтической композиции твердого раствора, включающей терапевтическое соединение.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора использовали следующую общую методику. Смешивали вместе все ингредиенты, кроме твердого при комнатной температуре липида. Эту смесь нагревали до температуры в диапазоне от приблизительно 50°C до приблизительно 60°C при перемешивании, для того чтобы растворить терапевтическое соединение и в результате получить раствор. Затем к раствору добавляли твердый при комнатной температуре липид, и смесь перемешивали до тех пор, пока не растворялся липид. Смесь затем отверждали путем охлаждения до комнатной температуры. Типичные составы, содержащие различные терапевтические соединения, приведены в таблице 1.
Смесь затем отверждали путем охлаждения до комнатной температуры. Отвержденные композиции затем оценивали по внешнему виду и с помощью дифференциальной сканирующей калориметрии (ДСК).
В процессе анализа с помощью ДСК, наблюдалась общая тенденция, заключавшаяся в том, что состав, который после отверждения был матовым на вид, образовывал классическую твердую композицию с кристаллической структурой, в то время как состав, который после отверждения был прозрачным на вид, образовывал композицию твердого раствора с аморфной структурой. Кроме того, отвержденные композиции, которые были прозрачными на вид, затем переплавляли, и при этом не происходило выпадения в осадок фазы, что являлось доказательством наличия композиции твердого раствора с аморфной структурой.
С помощью анализа внешнего вида и результатов переплавления было оценено большое число составов на их способность образовывать композицию твердого раствора. Состав, который не образовывал твердое вещество или образовывал матовое на вид твердое вещество, далее не анализировали и отбрасывали. Аналогично, далее не анализировали и отбрасывали составы, если после переплавления отвержденных прозрачных на вид композиций происходило выпадения в осадок фазы. Составы, которые образовывали прозрачное на вид твердое вещество, затем анализировали методом ДСК.
Данные для типичных составов ибупрофена, отверждающихся с прозрачным внешним видом, приведены на фигуре 1. Анализ методом ДСК показал, что индивидуальные компоненты характеризуются острыми четко выраженными пиками. Например, ибупрофен обладал четко выраженной температурой плавления в диапазоне от 75°C до 78°C (фигура 1А). Аналогично, твердый при комнатной температуре липид или твердый жир, такой как GELUCIRE® 43/01, имел четко выраженную температуру плавления в диапазоне от 41°C до 45°C (фигура 1В). Эти острые четко выраженные пики в диапазоне температур плавления являются признаком того, что композиция находится в классической твердой переходной фазе, имеющей четко выраженную кристаллическую структуру. MAISINE® 35-1 и ПЭГ 400 являются жидкостями при комнатной температуре и, поэтому, имеют температуру плавления ниже 20°C. Например, MAISINE® 35-1 имеет температуру плавления в диапазоне от приблизительно 14°C до приблизительно 16°C, а ПЭГ 400 имеет температуру плавления в диапазоне от приблизительно 4°C до приблизительно 8°C.
Неожиданно было обнаружено, что, когда среду, включающую твердый при комнатной температуре липид (твердый жир), жидкий при комнатной температуре липид и стабилизатор, исследовали методом ДСК, появляется новый пик температуры плавления. Например, помимо пика от 41°C до 45°C для GELUCIRE® 43/01, методом ДСК обнаруживали новый расширенный диапазон температуры плавления от приблизительно 32°C до приблизительно 38°C (фигура 1C). Этот температурный диапазон отличался от диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01, от 14°C до 16°C для MAISINE® 35-1 и от 4°C до 8°C для ПЭГ 400. Эти результаты указывают на то, что часть композиции превращалась в фазу твердого раствора, а не в классическую твердую фазу.
Неожиданно было обнаружено, что состав, включающий терапевтическое соединение с этой средой, характеризовался широким диапазоном плавления с температурой плавления, отличающейся от температур плавления индивидуальных компонентов (фигуры 1D-1H). Более того, не было обнаружено пиков, относящихся ни к отдельно взятому терапевтическому соединению, ни к отдельно взятому твердому жиру. Например, ибупрофен имеет диапазон температуры плавления от 75°C до 78°C, GELUCIRE® 43/01 имеет температуру плавления от 41°C до 45°C, MAISINE® 35-1 имеет температуру плавления от 14°C до 16°C и ПЭГ400 имеет температуру плавления от 4°C до 8°C. Однако состав, включающий эти компоненты, дает в результате композицию с температурой плавления в диапазоне от 35°C до 40°C, в зависимости от используемых количеств и соотношений. В случае классической смешанной фазы четко различимых твердых компонентов, должен был бы проявиться каждый индивидуальный пик, то есть, от 75°C до 78°C для ибупрофена, и от 41°C до 45°C для GELUCIRE® 43/01. Но этого не наблюдалось, эти пики полностью исчезали. Присутствие единственного нового пика температуры плавления и одновременное исчезновение пиков температур плавления индивидуальных компонентов для отвержденной композиции указывает на то, что образовывалась новая структура твердого раствора терапевтического соединения и твердого при комнатной температуре липида (твердого жира).
Пример 2
Фармацевтические композиции твердых растворов, включающие артеметер
Этот пример иллюстрирует, как приготовить раскрытую в изобретении фармацевтическую композицию, включающую артеметер.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием артеметера, применяли следующий метод. Приблизительно 1,0 г GELUCIRE® 43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, и приблизительно 0,5 мл трибутирина (в качестве жидкого при комнатной температуре липида) добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 40°C до приблизительно 50°C при перемешивании до тех пор, пока не были смешены все компоненты смеси. Приблизительно 40 мг артеметера добавляли к приблизительно 0,8 мл этой объединенной смеси и перемешивали до растворения. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 35°C до приблизительно 40°C (фигура 2). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse) и от 86°C до 90°C для артеметера. Трибутирин представляет собой жидкость при комнатной температуре и, в силу этого, имеет температуру плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий артеметер.
Пример 3
Фармацевтические композиции твердых растворов, включающие аспирин
Этот пример иллюстрирует, как приготовить раскрытую в изобретении фармацевтическую композицию, включающую аспирин.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием аспирина, применяли следующий метод. Приблизительно 120 мг аспирина и приблизительно 0,5 мл диметилового эфира изосорбида (в качестве стабилизатороа) добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 1,0 г GELUCIRE® 43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 35°C до приблизительно 40°C (фигура 3). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse) и от 138°C до 140°C для аспирина. Диметиловый эфир изосорбида представляет собой жидкость при комнатной температуре и, в силу этого, имеет температуру плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий аспирин.
Пример 4
Фармацевтические композиции твердых растворов, включающие дантролен
Этот пример иллюстрирует, как приготовить раскрытую в изобретении фармацевтическую композицию, включающую дантролен.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием дантролена, применяли следующий метод. Добавляли приблизительно 232,7 мг стеариновой кислоты (в качестве нейтрализатора) в реакционный сосуд и нагревали до температуры в диапазоне от приблизительно 70°C до приблизительно 75°C при перемешивании до расплавления. Добавляли приблизительно 250,2 мг дантролена и 20 мл диметилового эфира изосорбида (в качестве стабилизатора) к расплавленной стеариновой кислоте и перемешивали до тех пор, пока не достигалась однородная консистенция. Приблизительно 20,02 г GELUCIRE® 43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 34°C до приблизительно 39°C (фигура 4). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse), 70°C для стеариновой кислоты и от 279°C до 280°C для дантролена. Диметиловый эфир изосорбида представляет собой жидкость при комнатной температуре и, в силу этого, имеет температуру плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий дантролен.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием дантролена, применяли следующий метод. Добавляли приблизительно 309,8 мг стеариновой кислоты (в качестве нейтрализатора) в реакционный сосуд и нагревали до температуры в диапазоне от приблизительно 70°C до приблизительно 75°C при перемешивании до расплавления. Добавляли приблизительно 59,6 мг натриевой соли дантролена к расплавленной стеариновой кислоте и перемешивали до тех пор, пока не достигалась однородная консистенция. Добавляли приблизительно 0,75 мл диметилового эфира изосорбида (в качестве стабилизатора) и перемешивали смесь до тех пор, пока не растворялись все компоненты. Приблизительно 760,3 мг GELUCIRE® 43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы. Состав отверждали в твердое вещество, прозрачное на вид, которое переплавлялось без образования осадка фазы. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий дантролен.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием дантролена, применяли следующий метод. Добавляли приблизительно 250,2 мг стеариновой кислоты (в качестве нейтрализатора) в реакционный сосуд и нагревали до температуры в диапазоне от приблизительно 70°C до приблизительно 75°C при перемешивании до расплавления. Добавляли приблизительно 50,3 мг натриевой соли дантролена к расплавленной стеариновой кислоте и перемешивали до тех пор, пока не достигалась однородная консистенция. Добавляли 5,0 мл диметилового эфира изосорбида (в качестве стабилизатора) и перемешивали смесь до тех пор, пока не растворялись все компоненты. Приблизительно 5,0 г GELUCIRE® 43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы. Состав отверждали в твердое вещество, прозрачное на вид, которое переплавлялось без образования осадка фазы. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий дантролен.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием дантролена, применяли следующий метод. Добавляли приблизительно 225,0 мг стеариновой кислоты (в качестве нейтрализатора) в реакционный сосуд и нагревали до температуры в диапазоне от приблизительно 70°C до приблизительно 75°C при перемешивании до расплавления. Добавляли приблизительно 25,1 мг натриевой соли дантролена к расплавленной стеариновой кислоте и перемешивали до тех пор, пока не достигалась однородная консистенция. Добавляли 2,0 мл диметилового эфира изосорбида (в качестве стабилизатора) и перемешивали смесь до тех пор, пока не растворялись все компоненты. Приблизительно 2,07 г GELUCIRE® 43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы. Состав отверждали в твердое вещество, прозрачное на вид, которое переплавлялось без образования осадка фазы. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий дантролен.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием дантролена, применяли следующий метод. Добавляли приблизительно 224,9 мг стеариновой кислоты (в качестве нейтрализатора) в реакционный сосуд и нагревали до температуры в диапазоне от приблизительно 70°C до приблизительно 75°C при перемешивании до расплавления. Добавляли приблизительно 25,1 мг натриевой соли дантролена к расплавленной стеариновой кислоте и перемешивали до тех пор, пока не достигалась однородная консистенция. Добавляли приблизительно 0,75 мл диметилового эфира изосорбида (в качестве стабилизатора) и перемешивали смесь до тех пор, пока не растворялись все компоненты. Приблизительно 304,1 мг GELUCIRE® 43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы. Состав отверждали в твердое вещество, прозрачное на вид, которое переплавлялось без образования осадка фазы. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий дантролен.
Пример 5
Фармацевтические композиции твердых растворов, включающие диклофенак
Этот пример иллюстрирует, как приготовить раскрытую в изобретении фармацевтическую композицию, включающую диклофенак.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием диклофенака, применяли следующий метод. Приблизительно 119 мг диклофенака, приблизительно 1,0 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида) и приблизительно 0,3 мл диметилового эфира изосорбида (в качестве стабилизатора) добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 1,0 г GELUCIRE® 43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 35°C до приблизительно 40°C (фигура 5). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse) и от 157°C до 158°C для диклофенака. MAISINE® 35-1 и диметиловый эфир изосорбида представляют собой жидкости при комнатной температуре и, в силу этого, имеют температуру плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий диклофенак.
Пример 6
Фармацевтические композиции твердых растворов, включающие фенофибрат
Этот пример иллюстрирует, как приготовить раскрытую в изобретении фармацевтическую композицию, включающую фенофибрат.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием фенофибрата, применяли следующий метод. Приблизительно 400 мг фенофибрата и 4,0 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 45°C до приблизительно 55°C при перемешивании до тех пор, пока не были смешены все компоненты смеси. Приблизительно 0,76 мл диметилового эфира изосорбида (в качестве стабилизатора) добавляли к этой смеси и перемешивали до тех пор, пока не происходило смешение. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 34°C до приблизительно 39°C (фигура 6). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse) и от 80°C до 85°C для фенофибрата. Диметиловый эфир изосорбида представляет собой жидкость при комнатной температуре и, в силу этого, имеет температуру плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий фенофибрат.
Пример 7
Фармацевтические композиции твердых растворов, включающие гемфиброзил
Этот пример иллюстрирует, как приготовить раскрытую в изобретении фармацевтическую композицию, включающую гемфиброзил.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием гемфиброзила, применяли следующий метод. Приблизительно 1 г гемфиброзила, приблизительно 0,9 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида) и приблизительно 0,4 мл ПЭГ 400 (в качестве стабилизатора) добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 1,9 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы. Состав отверждали в твердое вещество, прозрачное на вид, которое переплавлялось без образования осадка фазы. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий гемфиброзил.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием гемфиброзила, применяли следующий метод. Приблизительно 1 г гемфиброзила и 7,5 г масла какао, воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 34°C до 38°C и включающего смесь насыщенных C16-C18 триглицеридов, добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока не были смешены все компоненты смеси. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы. Состав отверждали в твердое вещество, прозрачное на вид, которое переплавлялось без образования осадка фазы. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий гемфиброзил.
Пример 8
Фармацевтические композиции твердых растворов, включающие ибупрофен
Этот пример иллюстрирует, как приготовить раскрытую в изобретении фармацевтическую композицию, включающую Ибупрофен.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием ибупрофена, применяли следующий метод. Приблизительно 1 г натриевой соли ибупрофена, приблизительно 0,9 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида) и приблизительно 0,4 мл ПЭГ 400 добавляли в реакционный сосуд, нагретый до температуры в диапазоне от приблизительно 50°C до приблизительно 60°C, при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 1,9 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 32°C до приблизительно 44°C (фигура 1D). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse) и от 75°C до 78°C для ибупрофена. MAISINE® 35-1 и ПЭГ 400 представляют собой жидкости при комнатной температуре и, в силу этого, имеют температуру плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий ибупрофен.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием ибупрофена, применяли следующий метод. Приблизительно 1 г натриевой соли ибупрофена, приблизительно 0,5 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида) и приблизительно 0,4 мл ПЭГ 400 добавляли в реакционный сосуд, нагретый до температуры в диапазоне от приблизительно 50°C до приблизительно 60°C, при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 2,3 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 32°C до приблизительно 43°C (фигура 1E). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse) и от 75°C до 78°C для ибупрофена. MAISINE® 35-1 и ПЭГ 400 представляют собой жидкости при комнатной температуре и, в силу этого, имеют температуру плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий ибупрофен.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием ибупрофена, применяли следующий метод. Приблизительно 1 г натриевой соли ибупрофена, приблизительно 0,2 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида) и приблизительно 0,4 мл ПЭГ 400 добавляли в реакционный сосуд, нагретый до температуры в диапазоне от приблизительно 50°C до приблизительно 60°C, при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 2,6 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 32°C до приблизительно 42°C (фигура 1F). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse) и от 75°C до 78°C для ибупрофена. MAISINE® 35-1 и ПЭГ 400 представляют собой жидкости при комнатной температуре и, в силу этого, имеют температуру плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий ибупрофен.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием ибупрофена, применяли следующий метод. Приблизительно 5 г натриевой соли ибупрофена, приблизительно 9,5 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида) и приблизительно 1,0 мл ПЭГ 400 добавляли в реакционный сосуд, нагретый до температуры в диапазоне от приблизительно 50°C до приблизительно 60°C, при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 4,0 GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 32°C до приблизительно 38°C (фигура 1G). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse) и от 75°C до 78°C для ибупрофена. MAISINE® 35-1 и ПЭГ 400 представляют собой жидкости при комнатной температуре и, в силу этого, имеют температуру плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий ибупрофен.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием ибупрофена, применяли следующий метод. Приблизительно 5 г натриевой соли ибупрофена, приблизительно 6,5 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида) и приблизительно 1,5 мл ПЭГ 400 добавляли в реакционный сосуд, нагретый до температуры в диапазоне от приблизительно 50°C до приблизительно 60°C, при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 6,5 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 32°C до приблизительно 42°C (фигура 1H). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse) и от 75°C до 78°C для ибупрофена. MAISINE® 35-1 и ПЭГ 400 представляют собой жидкости при комнатной температуре и, в силу этого, имеют температуру плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий ибупрофен.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием ибупрофена, применяли следующий метод. Приблизительно 1 г натриевой соли ибупрофена, приблизительно 0,9 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида), приблизительно 0,4 мл ПЭГ 400 и приблизительно 0,3 мл пропиленгликоля добавляли в реакционный сосуд, нагретый до температуры в диапазоне от приблизительно 50°C до приблизительно 60°C, при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 1,9 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы. Состав отверждали в твердое вещество, прозрачное на вид, которое переплавлялось без образования осадка фазы. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий ибупрофен.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием ибупрофена, применяли следующий метод. Приблизительно 5 г ибупрофена в форме свободной кислоты, приблизительно 5 г натриевой соли ибупрофена, приблизительно 8 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида), приблизительно 3 мл ПЭГ 400 и приблизительно 1 мл пропиленгликоля добавляли в реакционный сосуд, нагретый до температуры в диапазоне от приблизительно 50°C до приблизительно 60°C, при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 19 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы. Состав отверждали в твердое вещество, прозрачное на вид, которое переплавлялось без образования осадка фазы. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий ибупрофен.
Пример 9
Фармацевтические композиции твердых растворов, включающие лидокаин
Этот пример иллюстрирует, как приготовить раскрытую в изобретении фармацевтическую композицию, включающую лидокаин.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием лидокаина, применяли следующий метод. Приблизительно 200 мг лидокаина в форме основания и приблизительно 2,0 мл диметилового эфира изосорбида (в качестве стабилизатора) добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 8,8 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 34°C до приблизительно 40°C (фигура 7). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse) и от 66°C до 69°C дляr лидокаина. Диметиловый эфир изосорбида представляет собой жидкость при комнатной температуре и, в силу этого, имеет температуру плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий лидокаин.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием лидокаина, применяли следующий метод. Приблизительно 250,1 мг лидокаина в форме основания и приблизительно 1,74 мл диметилового эфира изосорбида (в качестве стабилизатора) добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 8,72 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием лидокаина, применяли следующий метод. Приблизительно 500,4 мг лидокаина в форме основания и приблизительно 1,74 мл диметилового эфира изосорбида (в качестве стабилизатора) добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 8,5 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием лидокаина, применяли следующий метод. Приблизительно 250,4 мг лидокаина в форме основания и приблизительно 0,87 мл диметилового эфира изосорбида (в качестве стабилизатора) добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока не были смешены все компоненты смеси. Отдельно, приблизительно 250,1 мг прилокаин HCl в форме основания, 0,13 мл триэтаноламина (в качестве нейтрализатора) и приблизительно 0,87 мл диметилового эфира изосорбида (в качестве стабилизатора) добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока не были смешены все компоненты смеси. Смеси лидокаина и прилокаина объединяли и нагревали до температуры в диапазоне от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока все компоненты не растворялись. Приблизительно 8,49 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Пример 10
Фармацевтические композиции твердых растворов, включающие набуметон
Этот пример иллюстрирует, как приготовить раскрытую в изобретении фармацевтическую композицию, включающую набуметон.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием набуметона, применяли следующий метод. Приблизительно 126 мг набуметона и приблизительно 0,5 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида), добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 1,0 г GELUCIRE® 43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 35°C до приблизительно 40°C (фигура 8). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse) и от 80°C до 81°C для набуметона. MAISINE® 35-1 представляет собой жидкость при комнатной температуре и, в силу этого, имеет температуру плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий набуметон.
Пример 11
Фармацевтические композиции твердых растворов, включающие напроксен
Этот пример иллюстрирует, как приготовить раскрытую в изобретении фармацевтическую композицию, включающую напроксен.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием напроксена, применяли следующий метод. Приблизительно 250,1 мг напроксена и приблизительно 0,75 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида), добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 750,9 мг GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы. Состав отверждали в твердое вещество, прозрачное на вид. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий напроксен.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием напроксена, применяли следующий метод. Приблизительно 650,5 мг напроксена и приблизительно 1,2 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида), добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 1,234 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 30°C до приблизительно 39°C (фигура 9). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse) и от153°C до 154°C для напроксена. MAISINE® 35-1 представляет собой жидкость при комнатной температуре и, в силу этого, имеет температуру плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий напроксен.
Пример 12
Фармацевтические композиции твердых растворов, включающие пентоксифиллин
Этот пример иллюстрирует, как приготовить раскрытую в изобретении фармацевтическую композицию, включающую пентоксифиллин.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием пентоксифиллина, применяли следующий метод. Приблизительно 208 мг пентоксифиллина, приблизительно 1,0 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида) и приблизительно 0,2 мл диметилового эфира изосорбида (в качестве стабилизатора) добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 1,0 г GELUCIRE® 43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы. Состав отверждали в твердое вещество, прозрачное на вид, которое переплавлялось без образования осадка фазы. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий пентоксифиллин.
Пример 13
Фармацевтические композиции твердых растворов, включающие сальбутамол
Этот пример иллюстрирует, как приготовить раскрытую в изобретении фармацевтическую композицию, включающую сальбутамол.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием сальбутамола, применяли следующий метод. Приблизительно 61 мг сальбутамола, приблизительно 0,6 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида), 1,0 мл диметилового эфира изосорбида (в качестве стабилизатора) и приблизительно 1,0 мл абсолютного этанола (в качестве стабилизатора) добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 10 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 32°C до приблизительно 40°C (фигура 10). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse) и от 157°C до 158°C для сальбутамола. MAISINE® 35-1, диметиловый эфир изосорбида и абсолютный этанол представляют собой жидкости при комнатной температуре и, в силу этого, все они имеют температуры плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий сальбутамол.
Пример 14
Фармацевтические композиции твердых растворов, включающие салметерол
Этот пример иллюстрирует, как приготовить раскрытую в изобретении фармацевтическую композицию, включающую салметерол.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием салметерола, применяли следующий метод. Приблизительно 11 мг салметерола ксинафоата, приблизительно 1,0 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида) и приблизительно 1,0 мл абсолютного этанола (в качестве стабилизатора) добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 2,04 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 34°C до приблизительно 43°C (фигура 11). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse) и от 137°C до138°C для салметерола. MAISINE® 35-1 и абсолютный этанол представляют собой жидкости при комнатной температуре и, в силу этого, имеют температуру плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий салметерол.
Пример 15
Фармацевтические композиции твердых растворов, включающие симвастатин
Этот пример иллюстрирует, как приготовить раскрытую в изобретении фармацевтическую композицию, включающую симвастатин.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием симвастатина, применяли следующий метод. Приблизительно 200 мг симвастатина и приблизительно 2,5 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида) добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 5 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 32°C до приблизительно 42°C (фигура 12). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse) и от 135°C до 138°C для симвастатина. MAISINE® 35-1 и абсолютный этанол представляют собой жидкости при комнатной температуре и, в силу этого, имеют температуру плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий симвастатин.
Пример 16
Фармацевтические композиции твердых растворов, включающие телмисартан
Этот пример иллюстрирует, как приготовить раскрытую в изобретении фармацевтическую композицию, включающую телмисартан.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием телмисартана, применяли следующий метод. Приблизительно 60,1 мг телмисартанаа и приблизительно 2,0 мл диметилового эфира изосорбида (в качестве стабилизатора) добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 2,03 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы. Состав отверждали в твердое вещество, прозрачное на вид, которое переплавлялось без образования осадка фазы. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий телмисартан.
Для приготовления раскрытой в изобретении фармацевтической композиции твердого раствора с использованием телмисартана, применяли следующий метод. Приблизительно 160,2 мг телмисартана, приблизительно 1,0 мл MAISINE® 35-1 (Gattefosse), глицерил монолинолеата (в качестве жидкого при комнатной температуре липида) и приблизительно 1,0 мл абсолютного этанола (в качестве стабилизатора) добавляли в реакционный сосуд и нагревали в диапазоне температур от приблизительно 50°C до приблизительно 60°C при перемешивании до тех пор, пока все компоненты смеси не растворялись. Приблизительно 2,03 г GELUCIRE®43/01 (Gattefosse), воскообразного твердого вещества (в качестве твердого при комнатной температуре липида) с температурой плавления от 41°C до 45°C, включающего смесь насыщенных C10-C18 триглицеридов, добавляли к этому раствору до тех пор, пока он не смешивался. Нагретую смесь затем охлаждали до температуры в диапазоне от приблизительно 37°C до приблизительно 40°C и разливали порциями в формы и охлаждали до комнатной температуры. В качестве варианта, смесь может быть охлаждена до комнатной температуры и затем соответственно повторно нагрета до температуры в диапазоне от приблизительно 40°C до приблизительно 45°C для разлива порциями в формы.
Состав отверждали в твердое вещество, прозрачное на вид. Кроме того, метод ДСК показал наличие нового широкого диапазона температур плавления от приблизительно 34°C до приблизительно 43°C (фигура 13). Этот температурный диапазон отличался от температурного диапазона для отдельно взятых индивидуальных компонентов: от 41°C до 45°C для GELUCIRE® 43/01 (Gattefosse) и от 261°C до 263°C для телмисартана. MAISINE® 35-1 и абсолютный этанол представляют собой жидкости при комнатной температуре и, в силу этого, имеют температуру плавления ниже 20°C. Эти результаты указывают, что образовывался раскрытый в изобретении состав твердого раствора, включающий телмисартан.
Пример 17
Эксперимент по поглощению макрофагами
Этот пример иллюстрирует, что раскрытая в изобретении фармацевтическая композиция твердого раствора преимущественно целенаправленно доставляет терапевтическое соединение в иммунную систему.
Культуры моноцитов клеточной линии U937 культивировали в среде RPMI-1640 с добавлением 10% фетальной телячьей сыворотки (FCS) до тех пор, пока клетки не образовывали монослой с 90% конфлюэнтностью. Эти клетки затем обрабатывали форболмиристацетатом (PMA) и инкубировали при 37°C в инкубаторе в 5% двуокиси углерода до тех пор, пока клетки не дифференцировались в макрофаги. Монослои макрофагов промывали свежей средой, и затем добавляли 3 мл одного из следующих испытуемых растворов: А) раскрытый в изобретении состав твердого раствора, включающий ибупрофен, Gelucire® 43/01 (Gattefosse), MAISINE® 35-1 (Gattefosse) и ПЭГ 400; Б) раскрытый в изобретении жидкий состав, включающий ибупрофен, рапсовое масло и этанол; С) ибупрофен в форме свободной кислоты; и D) среду без терапевтического соединения. После инкубации в течение 45 минут, надосадочные жидкости испытуемого раствора удаляли и сохраняли для анализа, а клетки затем промывали несколько раз в забуференном фосфатом физиологическом растворе (PBS) и лизировали, используя два цикла замораживание-размораживание. Концентрацию терапевтического соединения, присутствующего в испытуемом растворе, надосадочную жидкость испытуемого раствора и фракции клеточного лизата анализировали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Процент терапевтического соединения, поглощенного макрофагами, рассчитывали по следующей формуле: % адсорбированного терапевтического соединения =100 × (масса соединения, извлеченного из клеточного лизата)/(масса соединения, доставленного в испытуемом растворе - масса соединения, извлеченная из надосадочной жидкости испытуемого раствора). Результаты приведены в таблице 1. Эти результаты показывают, что среднее поглощение терапевтического соединения макрофагами увеличивается на 550% или более при использовании заявленных в изобретении составов фармацевтических композиций по сравнению с композициями, которые не приготавливали этим способом.
Пример 18
Экспериментальная модель эрозии желудка на животном
Для оценки того, уменьшает ли раскрытая в изобретении фармацевтическая композиция раздражение желудка, были проведены эксперименты с использованием экспериментальной модели эрозии желудка на крысах.
Крысы линии Sprague-Dawley были разделены на семь опытных групп, содержащих по пять животных в каждой. После голодания в течение ночи, животных подвергали одной из семи различных обработок. Группа А представляла собой контрольную группу, в которой каждой крысе перорально вводили только 1% метилцеллюлоза/0,5% полисорбат 80 в качестве плацебо. Группа В представляла собой контрольную группу, в которой каждой крысе перорально вводили только растворитель/вспомогательное вещество (принудительно 10% этанол и 90% рапсового масла) в качестве плацебо. Группа C представляла собой контрольную группу, в которой каждой крысе перорально вводили 150 мг/кг аспирина. Группа D представляла собой контрольную группу, в которой каждой крысе перорально вводили 100 мг/кг ибупрофена, суспендированного в 1% метилцеллюлоза/0,5% полисорбат 80. Группа E представляла собой группу эксперимента, в которой каждой крысе вводили раскрытую в изобретении фармацевтическую композицию (BC1054-100), включающую 100 мг/кг ибупрофена, 10% этанола и 90% рапсового масла. Группа F представляла собой контрольную группу, в которой каждой крысе перорально вводили 100 мг/кг ибупрофена, суспендированного в 1% метилцеллюлоза/0,5% полисорбат 80. Группа G представляла собой группу эксперимента, в которой каждой крысе вводили раскрытую в изобретении фармацевтическую композицию (BC1054-200), включающую 200 мг/кг ибупрофена, 10% этанола и 90% рапсового масла. Через 4 часа после обработки, животных умерщвляли, и проводили оценку их желудков с точки зрения степени кровоизлияния и тяжести эрозионных повреждений слизистой оболочки. Раздражение желудка оценивали в баллах следующим образом: 0 - отсутствии поражений; 1 - гиперемия; 2 - одно или два небольших повреждения; 3 - более чем два незначительных повреждения или тяжелые поражения; и 4 - очень тяжелые поражения. Показатель, составляющей 50% или более по сравнению с группой С (контрольной группой, обработанной аспирином), показатель которой принимали за 100%, считали указывающим на раздражение желудка.
Результаты приведены в таблице 4. В группе D (контрольной группе, обработанной 100 мг/кг ибупрофена) и группе F (контрольной группе, обработанной 200 мг/кг ибупрофена) возникали поражения желудка, тяжесть которых составляла 75% и 95%, соответственно, от тяжести поражения, возникающего в группе C (контрольной группе, обработанной аспирином). При этом, в группа E (группе эксперимента, обработанной BC1054-100) и группе G (группе эксперимента, обработанной BC1054-200), возникали поражения желудка, тяжесть которых составляла 20% и 40%, соответственно, от тяжести поражения, возникающего в группе C (контрольной группе, обработанной аспирином). Эти результаты показывают, что раскрытая в изобретении фармацевтическая композиция уменьшает степень поражения слизистой оболочки и раздражения желудка, которую может вызвать терапевтическое соединение.
Пример 19
Экспериментальная модель воспалительного заболевания кишечника на животном
Для оценки эффективности раскрытой в изобретении фармацевтической композиции при лечении воспалительного заболевания кишечника, были проведены эксперименты с использованием экспериментальной модели индуцированного тринитробензолсульфоновой кислотой (TNBS) колита на мышах.
Самцов мышей линии C57BI/6 (в возрасте 6-7 недель) разделяли на семь опытных групп, содержащих, по меньшей мере, по десять животных в каждой. В день 0, вызывали колит у мышей из групп B-G путем прямого введения в прямую кишку 100 мкл TNBS (4 мг) в 50% этаноле при анестезии изофлураном. Животных подвергали либо один раз, либо три раза в день в период от дня -1 до 5-го дня одной из семи различных обработок. Контрольная группа А представляла собой группу, в котором каждой мыши перорально вводили только этанол в качестве плацебо. Контрольная группа B представляла собой группу, в котором каждой мыши перорально вводили только 1% метилцеллюлозу в качестве плацебо. Контрольная группа C представляла собой группу, в котором каждой мыши перорально вводили только растворитель/вспомогательное вещество (принудительно 10% этанол и 90% рапсового масла) в качестве плацебо. Контрольная группа D представляла собой группу, в которой каждой мыши перорально вводили 3 мг/кг преднизолона. Контрольная группа E представляла собой группу, в которой каждой мыши перорально вводили 20 мг/кг ибупрофена, суспендированного в 1% метилцеллюлозе (1 мл/кг) (без вспомогательного вещества). Группа F представляла собой группу эксперимента, в которой каждой мыши вводили раскрытую в изобретении фармацевтическую композицию (BC1054-20), содержащую 20 мг/кг ибупрофена, 10% этанола и 90% рапсового масла. Группа G представляла собой группу эксперимента, в которой каждой мыши вводили раскрытую в изобретении фармацевтическую композицию (BC1054-30), содержащую 30 мг/кг ибупрофена, 10% этанола и 90% рапсового масла. Всех животных каждый день взвешивали и оценивали визуально наличие диареи и/или кровянистого стула. На 3-й день и на 5-й день у всех животных оценивали тяжесть колита с использованием видео-эндоскопии и по полученным изображениям визуально оценивали слепым методом тяжесть колита в баллах от 0 до 4 следующим образом: 0 - нормальное состояние; 1 - потеря васкулярности; 2 - потеря васкулярности и хрупкость; 3 - хрупкость и эрозии; и 4 - изъязвления и кровотечение. После эндоскопии на 5-й день животных умерщвляли, удаляли толстую кишку и измеряли ее длину и массу. Получали образцы сыворотки, и толстую кишку фиксировали в 10% формалине. Собирали дополнительный кусочек ткани толстой кишки, взвешивали его и быстро замораживали в жидком азоте.
Результаты этих экспериментов приведены в таблице 5. Группа B (контрольная группа, подвергнутая обработке TNBS) показала статистически значимое различие в изменении средней массы по сравнению с группой А (контрольная группа, подвергнутая обработке этанолом), все остальные сравнимые группы не показали никакой разницы в изменении средней массы. Группа B (контрольная группа, подвергнутая обработке TNBS) показала статистически значимое уменьшение средней длины толстой кишки по сравнению с группой А (контрольная группа, подвергнутая обработке этанолом). Кроме того, группа D (контрольная группа, подвергнутая обработке преднизолоном), группа F (группа эксперимента, подвергнутая обработке BC1054-20) и группа G (группа эксперимента, подвергнутая обработке BC1054-30) все показали статистически значимое увеличение средней длины толстой кишки по сравнению с группой B (контрольной группой, подвергнутой обработке TNBS). Несмотря на то, что группа B (контрольная группа, подвергнутая обработке TNBS) показала статистически значимое увеличение средней массы толстой кишки по сравнению с группой А (контрольной группой, подвергнутой обработке этанолом), тем не менее, все сравнения остальных групп не показали никакого различия в средней массе толстой кишки. Что касается оценки в баллах колита на основе эндоскопии, то группа D (контрольная группа, подвергнутая обработке преднизолоном) показала статистически значимое уменьшение средних баллов по оценку колита как на 3-й день, так и на 5-ый день, по сравнению с группой B (контрольной группой, подвергнутой обработке TNBS). Аналогичным образом, как группа F (группа эксперимента, подвергнутая обработке BC1054-20), так и группа G (группа эксперимента, подвергнутая обработке BC1054-30) показали статистически значимое снижение среднего оценки колита на 5-й день по сравнению с группой B (контрольной группой, подвергнутой обработке TNBS)). Эти результаты указывают на то, что раскрытая в изобретении фармацевтическая композиция была эффективной при лечении воспалительного заболевания кишечника.
Пример 20
Экспериментальная модель системного артрита на животном
Для оценки эффективности раскрытой в изобретении фармацевтической композиции при лечении артрита, были проведены эксперименты с использованием экспериментальной модели индуцированного антителами α-коллагена (ACAIA) артрита у мышей, которая имитирует системный артрит, такой как ревматоидный артрит.
Самцы мышей линии BALB/с были разделены на восемь групп, каждая из которых содержала по 10 животных. Для того чтобы индуцировать симптомы артрита, мышам из всех восьми групп внутривенно вводили 200 мкл раствора антител, включающего 2 мг коктейля из четырех моноклональных антител α-коллагена II (ARTHRITOMAB™, MD Biosciences) на день исследования 0 (день начала исследования), и затем внутрибрюшинно вводили 200 мкл раствора, содержащего 100 мкг липополисахарида (LPS) на день 3-ий день исследования. Каждую группу подвергали ежедневной контрольной или испытуемой обработке, применяемой в дни исследования 0-11 следующим образом: группу мышей 1 (1M) подвергали пероральной обработке препаратом плацебо, содержащим 1% метилцеллюлозы, вводимым три раза в день; группу мышей 2 (2М) подвергали внутрибрюшинной обработке препаратом, использующегося в качестве положительного контроля, содержащим 10 мг/кг этанерцепта (ENBREL®, Wyeth), вводимым один раз в день; группу мышей 3 (3M) подвергали пероральной обработке в дозе 20 мг/кг испытуемой жидкой композицией, содержащей ибупрофен и рапсовое масло (BC1054 LF-RO), один раз в день; группу мышей 4 (4М) подвергали пероральной обработке в дозе 20 мг/кг испытуемой жидкой композицией, содержащей ибупрофен и рапсовое масло (BC1054 LF-RO), три раза в день; группу мышей 5 (5M) подвергали пероральной обработке в дозе 20 мг/кг испытуемой жидкой композицией, содержащей ибупрофен и глицерил монолинолеат (MAISINE® 35-1, Gattefosse) (BC1054 LF-МА), три раза в день; группу мышей 6 (6M) подвергали пероральной обработке в дозе 20 мг/кг испытуемой жидкой композицией, содержащей ибупрофен и теобромное масло (BC1054 LF-К), три раза в день; группу мышей 7 (7M) подвергали пероральной обработке контрольным препаратом 1, содержащим 20 мг/кг ибупрофена, три раза в день; и группу мышей 8 (8M) подвергали пероральной обработке в дозе 20 мг/кг испытуемым твердым составом, содержащим ибупрофен и воскообразное твердое вещество, имеющее температуру плавления в интервале от 37°С до 41°С и включающего смесь насыщенных С10-С18 триглицеридов (Gelucire® 39/01, Gattefosse) (BC1054 LF-GE), три раза в день (таблица 6). Вводимую дозу рассчитывали на основе предположения, что масса каждого животного составляла, в среднем, 20 грамм. Каждой мыши вводили фиксированный объем в размере 100 мкл, за исключением получающих положительный контроль животных (2М), которым вводили 200 мкл.
Для всех мышей постоянно проводили наблюдение развития артрита и клинические обследования, начиная с 0 дня исследования, незадолго до индуцирования артрита, и затем в дни исследования 3-7, 9, 10 и 12 (день окончания исследования). Для оценки развития артрита, проводилась как оценка артрита в баллах, так и измерения толщины лапы (плетизмография). Оценка артрита в баллах основывалась на визуальной оценке артритных реакций с использованием шкалы баллов от 0 до 4 в порядке возрастания тяжести, где 0 баллов указывал на отсутствие артритной реакции; 1 балл указывал на легкое, но определяемое, покраснение и отек лодыжки/запястья или на явное покраснение и отек, ограниченные отдельными пальцами, независимо от количества пораженных пальцев; 2 балла указывали на покраснение и отек лодыжки/запястья от умеренных до тяжелых; 3 балла указывали на покраснение и отек всей лапы, включая пальцы; и 4 балла указывали на максимальное воспаление конечности с вовлечением нескольких суставов. Толщину лапы измеряли для обеих задних лап выше подушечки лапы и ниже пяточной кости с помощью циферблатного штангенциркуля (Kroeplin, Munich, Germany). Были определены средние значения измеренной толщины лапы и, когда это требовалось, применяли дисперсионный анализ ANOVA с процедурой множественных сравнений по критерию Тьюки для определения значимости эффектов лечения.
Клинические обследования включали регистрацию изменений массы тела, состояния кожи, меха, глаз, слизистых оболочек, возникновения выделений секрета и экскреций (например, диареи) и автономной активности (например, слезотечения, слюнотечения, пилоэрекции, изменения размера зрачка, необычного способа дыхания). Также регистрировались изменения в походке, осанке и в реакции на обращение, а также наличие аномального поведения, тремора, судорог, комы и спячки. Сыворотку собирали по окончанию исследования.
Заболеваемость артритом увеличивалась во всех группах, начиная с 3 дня. В группе животных 1М пик заболеваемости приходился на 7-й день с артритными реакциями у 9 из 10 животных, которые оставались относительно неизменными до конца исследования. В группе мышей 2М, обработанных этанерцептом, пик заболеваемости приходился на 6-ой день с признаками заболевания у 9 из 10 животных, но этот показатель снижался до 1 из 10 животных на 12-ый день. Пик заболеваемости артритом в группе животных 3М и группе животных 4М, подвергавшихся обработке BC1054 LS-RO один раз или три раза в день, проявлялся на 7-ой день (9 из 10 и 7 из 10 животных, соответственно), и этот показатель уменьшался до 4 из 10 мышей в обеих группах на 12-ый день. Заболеваемость артритом достигала максимума на 6-й день в группе животных 5М, подвергавшихся обработке BC1054 LS-MA, с проявлением у 8 из 10 животных, и заболеваемость колебалась от 6 до 8 животных до конца исследования. На 6-ой день, артрит проявлялся у 9 из 10 животных группы 6М, подвергавшихся обработке BC1054 SF-TO, но этот показатель также колебался и в конечном итоге составлял 7 из 10 животных на 12-ый день. В группы животных 7М, подвергавшихся обработке ибупрофеном, пик заболеваемости артритом был зафиксирован на 6 день у 8 из 10 животных, и этот показатель оставался относительно неизменным до конца исследования. В группе мышей 8M, подвергавшихся обработке BC1054 LS-GE, пик заболеваемости приходился на 6-й день у 9 из 10 животных, проявляющих признаки артрита, но этот показатель уменьшался до 4 из 10 животных на 12-ый день.
Клинические признаки, связанные с введением липополисахаридов (LPS), развивались во всех группах после стимуляции LPS на 3-ий день. Они исчезали во всех группах на 12-ый день. В процессе этого исследования не было смертельных случаев или случаев существенного различия в массе тела между группой животных, подвергнутых обработке плацебо, и группой животных, подвергнутых обработке испытуемыми композициями.
Результаты измерений средней толщины лапы приведены в таблице 7. Средняя толщина задней лапы в группе животных 1М (подвергнутых обработке плацебо) составляла 1,72±0,01 на день 0. Толщина увеличивалась и достигала максимума на 9-й день, составляя 2,33±0,15, и в конечном итоге составляла 2,17±0,11 на 12-ый день. В группе мышей 2М, подвергнутой обработке этанерцептом, среднее значение толщины лапы составляло 1,70±0,02 на день 0. Оно увеличивалось, достигая максимума 1,96±0,05 на 6-й день и затем снижалось до 1,77±0,02 на 12-ый день. Обработка этанерцептом приводила в результате к значительному уменьшению объема лапы по сравнению с группой мышей для положительного контроля на 9-ый, 10-ый и 12-ый день. В группе 3М, которую подвергали обработке BC1054 LS-RO один раз в день, толщина задней лапы составляла 1,71±0,02 на день 0. На 7-ый день отек в этой группе достигал своего максимума, составляя 1,96±0,05, и затем оставался относительно неизменным. Наблюдались значительные уменьшения среднего значения отека лапы на 6-ой и 9-ый дни после введения BC1054 LS-RO. Средняя толщина задней лапы в группе 4М, которая получила BC1054 LS-RO три раза в день, увеличилась до 1,97±0,08 на 10-ый день (от 1,70±0,03 в день 0), начиная с 10-го дня, величина объемов лап оставалась относительно постоянной до конца исследования. Введение три раза в день BC1054 LS-RO приводило к значительному уменьшению средней толщины лапы по сравнению с обработанными плацебо мышами (группа 1M) на 6-ой, 7-ой и 9-ый день. Группа мышей 5М, подвергавшаяся обработке BC1054 LS-МA, имела максимальное значение объема лапы на 7-й день (1,97±0,05 при 1,69±0,02 на день 0), эта группа имела значительно более низкие результаты измерений на 6-й день и 9-й день по сравнению с группой животных 1M, подвергавшихся обработке плацебо. В группе животных 6М, подвергавшихся обработке BC1054 LS-ТО, средняя толщина задней лапы составляла 1,74±0,01 на день 0. Она увеличилась до максимального значения 2,05±0,10 на 7-й день и затем уменьшалась до 1,94±0,06 на 12-ый день. Не было зарегистрировано никаких существенных различий между группой животных (группой 6M), обработанных BC1054 LS-TО, и контрольной группой животных (группой 1М), получавших плацебо. В группе (группе 7М), которая получила ибупрофен, толщина задней лапы составляла 1,71±0,02 на день 0. На 7-ой день размер опухоли в этой группе был максимальным 2,15±0,10, и затем уменьшался до 2,02±0,08 на 12-ый день. Не отмечалось никаких существенных различий при сравнении этой группы с контрольной группой 1М. Группа животных 8M, подвергавшаяся обработке BC1054 LS-GE, характеризовалась незначительным увеличением толщины задней лапы от 1,72±0,02 на день 0 до 1,85±0,06 на 7-й день, и она оставалась относительно постоянной, составляя 1,77±0,03, на 12-ый день. Введение BC1054 LS-GE приводило к значительному уменьшению отека лапы у животных (группы 8М) по сравнению с контрольной группой (группой 1M), в которой вводили плацебо, на 6-ой, 7-ой, 9-ый, 10-ый и 12-ый дни.
Принимая во внимание приведенные выше результаты, можно констатировать проявление значительной противоартритной активности в группе животных 3М, которым вводили один раз в день BC1054 LS-RO, в группе животных 4M, которым вводили три раза в день BC1054 LS-RO, в группе животных 5M, которым вводили три раза в день BC1054 LS-МА, и в группе животных 8M, которым вводили три раза в день BC1054SF-GE.
Пример 21
Описание конкретных случаев лечения сердечно-сосудистого заболевания
Мужчине в возрасте 49 лет с диагнозом гиперхолестеринемии (LDL 4,35 ммоль/л) был проведен курс лечения с помощью раскрытой в изобретении фармацевтической композиции (BC1054), содержащей 20 мг/кг ибупрофена, 10% этанола и 90% рапсового масла (600 мг два раза в день) в течение 7 дней. Через 5 дней лечения, уровни LDL у пациента нормализовались до 3,89 ммоль/л. Нормализация уровня LDL сохранялась в течение 2 месяцев после прекращения приема BC1054, что было определено при заключительном обследовании.
Мужчине в возрасте 60 лет с недавно диагностированной гиперхолестеринемией (LDL 4,31 ммоль/л) был проведен курс лечения с помощью раскрытой в изобретении фармацевтической композиции (BC1054), содержащей 20 мг/кг ибупрофена, 10% этанола и 90% рапсового масла (стандартная начальная доза 1200 мг) с целью снижения уровня LDL до диапазона нормальных значений. Через 5 дней лечения, уровни LDL пациента снизились до 3,36 ммоль/л. Пациент находился под наблюдением в течение 1 месяца и уровень LDL оставался в пределах диапазона нормальных значений, несмотря на то, что дальнейший прием фармацевтической композиции BC1054 не производился.
Пример 22
Лечение сердечно-сосудистого заболевания
У женщины в возрасте 62 лет диагностирован повышенный уровень холестерина. Врач определяет, что повышенный уровень холестерина связан с гиперхолестеринемией. Женщине предписывают курс лечения путем перорального введения два раза в день описанной в изобретении фармацевтической композиции, включающей ибупрофен. В качестве варианта, женщине предписывают пероральное введение три раза в день описанной в изобретении фармацевтической композиции, включающей агонист PPAR-γ. В качестве варианта, женщине предписывают пероральное введение два раза в день описанной в изобретении фармацевтической композиции, содержащей гемфиброзил. Состояние женщины постоянно контролируют, и после примерно 1 недели исследуемого лечения, в крови обнаруживают снижение уровня холестерина. Обследования, проведенные через один и три месяца, показывают, что уровень холестерина в крови у женщины по-прежнему находится в пределах нормы. Это ослабление симптома гиперхолестеринемии указывает на успешные результаты лечения с помощью описанной в изобретении фармацевтической композиции. Аналогичный способ перорального введения раскрытой в изобретении фармацевтической композиции может быть использован для лечения пациента, страдающего от других форм такого нарушения, например, дислипидемии, гиперхолестеринемии, гиперглицеридемии, гипертриглицеридемии, гиперхиломикронемии, комбинированной гиперлипидемии и гиперлипопротеинемии, в том числе гиперлипопротеинемии, которая представляет собой гиперлипопротеинемию типа Ia, гиперлипопротеинемию типа Ib, гиперлипопротеинемию типа Ic, гиперлипопротеинемию типа IIa, гиперлипопротеинемию типа IIb, гиперлипопротеинемию типа III, гиперлипопротеинемию типа IV и гиперлипопротеинемию тип V. Аналогичным образом, любое из терапевтических соединений, такое как, например, нестероидное противовоспалительное лекарственное средство (NSAID), такое как производное салициловой кислоты, производное п-аминофенола, производное пропионовой кислоты, производное уксусной кислоты, производное эноловой кислоты, производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (COX), селективный ингибитор циклооксигеназы 1 (COX 1), селективный ингибитор циклооксигеназы 2 (COX-2); агонист PPARγ; средство, связывающее ядерный рецептор; или антигиперлипидемическое средство, такое как фибрат, статин, токотриенол, ниацин, секвестранты желчных кислот, ингибитор абсорбции холестерина, ингибитор липазы поджелудочной железы или симпатомиметической амин, может быть включено в фармацевтическую композицию и введено пациенту, как описано выше.
Мужчина в возрасте 58 лет жалуется на боли в груди, одышка и головокружение. Врач определяет, что затруднение дыхания является следствием атеросклероза. Мужчине предписано пероральное введение два раза в день описанной в изобретении фармацевтической композиции, включающей ибупрофен. В качестве варианта, мужчине предписано пероральное введение три раза в день описанной в изобретении фармацевтической композиции, включающей агонист PPAR-γ. В качестве варианта, мужчине предписано пероральное введение два раза в день описанной в изобретении фармацевтической композиции, включающей гемфиброзил. Состояние мужчины постоянно контролируют, и примерно через 3 недели лечения, у мужчины наблюдается улучшение функции дыхания, и он не испытывает заметного головокружения. Обследования, проведенные через два и три месяца, показывают, что мужчина по-прежнему сохраняет улучшенную функцию дыхания, у него отсутствуют головокружение и боли в груди. Это ослабление симптомов атеросклероза указывает на успешные результаты лечения с помощью раскрытой в изобретении фармацевтической композиции. Аналогичный способ перорального введения раскрытой в изобретении фармацевтической композиции может быть использован для лечения пациента, страдающего от другой формы окклюзионного заболевания сосудов, такой как, например, заболевания периферических сосудов или стеноза. Аналогичным образом, любое из терапевтических соединений, такое как, например, нестероидное противовоспалительное лекарственное средство (NSAID), такое как производное салициловой кислоты, производное п-аминофенола, производное пропионовой кислоты, производное уксусной кислоты, производное эноловой кислоты, производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (COX), селективный ингибитор циклооксигеназы 1 (COX 1), селективный ингибитор циклооксигеназы 2 (COX-2); агонист PPARγ; средство, связывающее ядерный рецептор; или антигиперлипидемическое средство, такое как фибрат, статин, токотриенол, ниацин, секвестранты желчных кислот, ингибитор абсорбции холестерина, ингибитор липазы поджелудочной железы или симпатомиметической амин, может быть включено в фармацевтическую композицию и введено пациенту, как описано выше.
Мужчина в возрасте 67 лет, страдающий алкоголизмом, жалуется на ощущение давления на грудь и онемение в левом плече. Врач определяет, что давление и онемение является следствием алкогольной кардиомиопатии. Мужчине предписано пероральное введение два раза в день описанной в изобретении фармацевтической композиции, включающей ибупрофен. В качестве варианта, мужчине предписано пероральное введение три раза в день описанной в изобретении фармацевтической композиции, включающей агонист PPAR-γ. В качестве варианта, мужчине предписано пероральное введение два раза в день описанной в изобретении фармацевтической композиции, включающей гемфиброзил. Состояние мужчины постоянно контролируют, и примерно через 3 недели лечения, у мужчины наблюдается уменьшение онемения. Обследования, проведенные через два и три месяца, показывают, что мужчина по-прежнему отмечает улучшение ощущения в плече и давно не испытывает ощущения давления на грудную клетку. Это ослабление симптомов алкогольной кардиомиопатии указывает на успешные результаты лечения с помощью раскрытой в изобретении фармацевтической композиции. Аналогичный способ перорального введения раскрытой в изобретении фармацевтической композиции может быть использован для лечения пациента, страдающего от кардиомиопатии, такой как, например, внешняя кардиомиопатии, такая как акромегалии, амилоидоз, болезнь Шагаса, химиотерапия, диабетическая кардиомиопатия, гемохроматоз, гипертоническая кардиомиопатия, гипертиреоз, воспалительная кардиомиопатия, ишемическая кардиомиопатия, мышечная дистрофия, клапанная кардиомиопатия, кардиомиопатия, вторичная по отношению к системному метаболическому заболеванию, кардиомиопатия, вторичная к системному алиментарному заболеванию, болезнь коронарных артерий или врожденный порок сердца; или внутренняя кардиомиопатия, такая как дилатационная кардиомиопатия (DCM), гипертрофическая кардиомиопатия (HCM или HOCM), аритмогенная правожелудочковая кардиомиопатия (ARVC), рестриктивная кардиомиопатия (RCM), некомпактная кардиомиопатия, изолированная желудочковая некомпактная митохондриальная миопатия, кардиомиопатия Такоцубо или эндокардит Лоеффлера. Аналогичным образом, любое из терапевтических соединений, такое как, например, нестероидное противовоспалительное лекарственное средство (NSAID), такое как производное салициловой кислоты, производное п-аминофенола, производное пропионовой кислоты, производное уксусной кислоты, производное эноловой кислоты, производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (COX), селективный ингибитор циклооксигеназы 1 (COX 1), селективный ингибитор циклооксигеназы 2 (COX-2); агонист PPARγ; средство, связывающее ядерный рецептор; или антигиперлипидемическое средство, такое как фибрат, статин, токотриенол, ниацин, секвестранты желчных кислот, ингибитор абсорбции холестерина, ингибитор липазы поджелудочной железы или симпатомиметической амин, может быть включено в фармацевтическую композицию и введено пациенту, как описано выше.
Женщина в возрасте 73 лет жалуется на мышечные судороги и ощущение холода в нижней части правой ноги. Врач определяет, что симптомы являются следствием артериита бедренной артерии. Женщине предписано пероральное введение два раза в день описанной в изобретении фармацевтической композиции, включающей ибупрофен. В качестве варианта, женщине предписано пероральное введение три раза в день описанной в изобретении фармацевтической композиции, включающей агонист PPAR-γ. В качестве варианта, женщине предписано пероральное введение два раза в день описанной в изобретении фармацевтической композиции, включающей гемфиброзил. Состояние женщины постоянно контролируют, и примерно через 3 недели лечения, у женщины наблюдается уменьшение мышечных судорог и ощущения холода в нижней части ноги. Обследования, проведенные через два и три месяца, показывают, что у женщины по-прежнему отсутствуют мышечные судороги и ощущения холода. Это ослабление симптомов артериита указывает на успешные результаты лечения с помощью раскрытой в изобретении фармацевтической композиции. Аналогичный способ перорального введения раскрытой в изобретении фармацевтической композиции может быть использован для лечения пациента, страдающего от какого-либо типа васкулита, такого как, например, болезнь Бюргера, артериит, церебральный васкулит, артериит Чарга-Стросса, криоглобулинемия, эссенциальный криоглобулинемический васкулит, гигантоклеточный артериит, васкулит игрока в гольф, пурпура Геноха, аллергический васкулит, болезнь Кавасаки, флебит, микроскопический полиартрит/полиангиит, узелковый полиартрит, ревматическая полимиалгия (PMR), ревматоидный васкулит, артериит Такаясу, тромбофлебит, гранулематоз Вегенера, васкулит, вторичный по отношению к вирусной инфекции, или васкулит, вторичный по отношению к нарушению соединительной ткани, включая системную красную волчанку (SLE), ревматоидный артрит (RA), рецидивирующий полихондрит и болезнь Бехчета. Аналогичным образом, любое из терапевтических соединений, такое как, например, нестероидное противовоспалительное лекарственное средство (NSAID), такое как производное салициловой кислоты, производное п-аминофенола, производное пропионовой кислоты, производное уксусной кислоты, производное эноловой кислоты, производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (COX), селективный ингибитор циклооксигеназы 1 (COX 1), селективный ингибитор циклооксигеназы 2 (COX-2); агонист PPARγ; средство, связывающее ядерный рецептор; или антигиперлипидемическое средство, такое как фибрат, статин, токотриенол, ниацин, секвестранты желчных кислот, ингибитор абсорбции холестерина, ингибитор липазы поджелудочной железы или симпатомиметической амин, может быть включено в фармацевтическую композицию и введено пациенту, как описано выше.
Мужчина в возрасте 37 лет жалуется на боли в груди. Врач определяет, что эта боль является следствием эндокардита. Мужчине предписано пероральное введение два раза в день описанной в изобретении фармацевтической композиции, включающей ибупрофен. В качестве варианта, мужчине предписано пероральное введение три раза в день описанной в изобретении фармацевтической композиции, включающей агонист PPAR-γ. В качестве варианта, мужчине предписано пероральное введение два раза в день описанной в изобретении фармацевтической композиции, включающей гемфиброзил. Состояние мужчины постоянно контролируют, и примерно через 1 неделю лечения, у мужчины наблюдается уменьшение боли в груди. Обследования, проведенные через один и три месяца, человек показывают, что у мужчины по-прежнему отсутствует ощущение боли в груди. Это ослабление симптома эндокардита указывает на успешные результаты лечения с помощью раскрытой в изобретении фармацевтической композиции. Аналогичный способ перорального введения раскрытой в изобретении фармацевтической композиции может быть использован для лечения пациента, страдающего от другого типа воспалительного заболевания сердца, такого как, например, воспалительная кардиомегалия или миокардит. Аналогичным образом, любое из терапевтических соединений, такое как, например, нестероидное противовоспалительное лекарственное средство (NSAID), такое как производное салициловой кислоты, производное п-аминофенола, производное пропионовой кислоты, производное уксусной кислоты, производное эноловой кислоты, производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (COX), селективный ингибитор циклооксигеназы 1 (COX 1), селективный ингибитор циклооксигеназы 2 (COX-2); агонист PPARγ; средство, связывающее ядерный рецептор; или антигиперлипидемическое средство, такое как фибрат, статин, токотриенол, ниацин, секвестранты желчных кислот, ингибитор абсорбции холестерина, ингибитор липазы поджелудочной железы или симпатомиметической амин, может быть включено в фармацевтическую композицию и введено пациенту, как описано выше.
Женщина в возрасте 59 лет жалуется на одышку и у нее диагностируют высокое кровяное давление. Врач определяет, что скованность в суставах и отеки являются следствием гипертонической болезни. Женщине предписано пероральное введение два раза в день описанной в изобретении фармацевтической композиции, включающей ибупрофен. В качестве варианта, женщине предписано пероральное введение три раза в день описанной в изобретении фармацевтической композиции, включающей агонист PPAR-γ. В качестве варианта, женщине предписано пероральное введение два раза в день описанной в изобретении фармацевтической композиции, включающей гемфиброзил. Состояние женщины постоянно контролируют, и примерно через 3 недели лечения, у женщины наблюдается улучшение дыхания, и ее кровяное давление приходит в норму. Обследования, проведенные через два и три месяца, показывают, что женщина продолжает нормально дышать и ее кровяное давление находится в пределах нормы. Это ослабление гипертонического симптом указывает на успешные результаты лечения с помощью раскрытой в изобретении фармацевтической композиции. Аналогичный способ перорального введения раскрытой в изобретении фармацевтической композиции может быть использован для лечения пациента, страдающего от сердечно-сосудистого заболевания, такого как, например, коронарное заболевание сердца, ишемическая болезнь сердца, застойная сердечная недостаточность, гипертоническая болезнь сердца, порок клапана сердца, артериальная гипертензия, инфаркт миокарда, сердечные состояния, связанные с диабетом, аневризма; эмболия, расслоение, псевдоаневризма, сосудистая патология, сосудистый невус, тромбоз, варикоз вен или инсульт. Аналогичным образом, любое из терапевтических соединений, такое как, например, нестероидное противовоспалительное лекарственное средство (NSAID), такое как производное салициловой кислоты, производное п-аминофенола, производное пропионовой кислоты, производное уксусной кислоты, производное эноловой кислоты, производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (COX), селективный ингибитор циклооксигеназы 1 (COX 1), селективный ингибитор циклооксигеназы 2 (COX-2); агонист PPARγ; средство, связывающее ядерный рецептор; или антигиперлипидемическое средство, такое как фибрат, статин, токотриенол, ниацин, секвестранты желчных кислот, ингибитор абсорбции холестерина, ингибитор липазы поджелудочной железы или симпатомиметической амин, может быть включено в фармацевтическую композицию и введено пациенту, как описано выше.
В заключение, следует иметь в виду, что, несмотря на то, что аспекты настоящего изобретения иллюстрируются путем ссылки на конкретные варианты осуществления, тем не менее, для специалистов в данной области техники является очевидным, что эти раскрытые варианты осуществления являются только иллюстрацией сущности раскрытого предмета изобретения. Поэтому, следует иметь в виду, что раскрытый предмет изобретения никоим образом не ограничивается описанными в настоящем изобретении конкретной методикой, протоколом и/или реагентом и так далее. В связи с этим, могут быть сделаны различные модификации или изменения или альтернативных конфигураций раскрытого предмета изобретения в соответствии с идеями изобретения без отступления от сущности настоящего изобретения. И наконец, используемая в изобретении терминология предназначена только для описания конкретных вариантов осуществления, а не для ограничения объема настоящего изобретения, который определяется исключительно только формулой изобретения. Соответственно, настоящее изобретение не ограничивается тем, что конкретно продемонстрировано и описано.
В настоящем изобретении описаны конкретные варианты осуществления, в том числе наилучший способ осуществления изобретения, известный его авторам. Несомненно, что, после ознакомления с приведенным выше описанием, для специалистов в данной области будет очевидна возможность внесения изменений в эти описанные варианты осуществления. Авторы изобретения предполагают, что квалифицированные специалисты могут вносить такие изменения, когда это целесообразно, и авторы не исключают того, что настоящее изобретение может быть осуществлено иначе, чем конкретно описано в настоящем изобретении. Соответственно, это изобретение включает все модификации и эквиваленты предмета изобретения, изложенного в пунктах прилагаемой формулы изобретения, в соответствии с действующим законодательством. Кроме того, любая комбинация описанных выше вариантов осуществления со всеми возможными их изменениями входит в объем изобретения, если в изобретении не указано иное или если это явно не противоречит контексту. Объединение в группы альтернативных вариантов осуществления, элементов или стадий настоящего изобретения не должно истолковываться в качестве ограничений. Каждый представитель группы может быть указан и заявлен по отдельности или в любой комбинации с другими раскрытыми в изобретении представителями группы. Предполагается, что один или несколько представителей группы могут быть включены или удалены из группы из соображений удобства и/или патентоспособности. Когда производится такое включение или удаление, то считают, что описание содержит группу, модифицированную так, что она удовлетворяет письменному описанию всех групп Маркуша, используемых в приложенной формуле изобретения.
Если не указано иное, то все используемые в настоящем изобретении и формуле изобретения числа, выражающие характеристику, предмет, количество, параметр, свойство, термин и так далее, следует воспринимать во всех случаях в качестве модифицированных с помощью термина "приблизительно". Используемый в изобретении термин "приблизительно" означает, что численно определяемые характеристика, предмет, количество, параметр, свойство или термин, охватывают диапазон плюс или минус десять процентов выше и ниже указанного значения для характеристики, предмета, количества, параметра, свойства или термина. Соответственно, если не указано иное, то числовые параметры, приведенные в описании и прилагаемой формуле изобретения, являются приближенными значениями, которые могут изменяться. По крайней мере, и не в качестве попытки ограничить применение теории эквивалентов к объему формулы изобретения, каждое указание в числовой форме должно, по меньшей мере, истолковываться в свете количества приведенных значащих цифр и с применением обычных методов округления. Несмотря на то, что числовые диапазоны и значения, устанавливающие широкие границы объема изобретения, являются приближенными, тем не менее, числовые диапазоны и значения, установленные в конкретных примерах, приводятся как можно точнее. Однако любой численный диапазон или значение по своей природе содержит определенные ошибки, являющиеся неизбежным результатом стандартного отклонения, обнаруживаемого при их соответствующих тестовых измерениях. Перечисление в изобретении числовых диапазонов значений предназначено лишь для того, чтобы кратко индивидуально обозначить каждое отдельное численное значение, находящееся внутри диапазона. Если не указано иное, то каждое отдельное значение числового диапазона включено в объем настоящего изобретения, как если бы оно было индивидуально указано в изобретении.
Следует считать, что формы единственного числа, используемые в контексте описания настоящего изобретения (в частности, в контексте следующей далее формулы изобретения), охватывают как единственное, так и множественное число, если не указано иное в настоящем изобретении или это явно не противоречит контексту. Все описанные в изобретении способы могут быть осуществлены в любом подходящем порядке, если не указано иное или это явно не противоречит контексту. Использование любых примеров или пояснительных слов (например, "такой как") в настоящем изобретении предназначено только для лучшего раскрытия настоящего изобретения, и они не ограничивают объем настоящего изобретения, если не заявлено иное. Ни одна формулировка в настоящем изобретении не должно истолковываться как указание на любой незаявленный элемент, необходимый для практического осуществления изобретения.
Раскрытые в изобретении конкретные варианты осуществления могут быть дополнительно ограничены в формуле изобретения путем использования формулировок "состоящий из" или "состоящий в основном из". Использование в формуле изобретения, которая была зарегистрирована или в которую были внесены поправки, связывающего термина "состоящий из" исключает какой-либо элемент, стадию или ингредиент, не указанные в формуле изобретения. Связывающий термин "состоящий в основном из" ограничивает объем формулы изобретения в отношении указанных материалов или стадий и тех параметров, которые существенно не влияют на основную и новую характеристику (характеристики). Поэтому, заявленные варианты осуществления настоящего изобретения по существу или в явном виде описаны и включены в настоящее изобретение.
Содержание патентов, патентных публикаций и других публикаций, на которые ссылаются и которые указаны в тексте, приводится в настоящем изобретении путем ссылки на них, с целью описания и раскрытия, например, композиций и методик, описанных в таких публикациях, которые могут быть использованы в связи с настоящим изобретением. Эти публикации приводятся исключительно для их раскрытия до даты регистрации настоящей заявки. В этом отношении, ничто не должно быть истолковано в качестве признания того, что авторы изобретения не имеют права относить к более ранней дате такое изобретение ввиду предшествующего изобретения или по любой другой причине. Все констатации, касающиеся даты или представлений, так же как и содержания этих документов, основываются на информации, доступной для заявителей, и они не представляют собой какого-либо подтверждения в правильности дат или содержания этих документов.
Реферат
Изобретение относится к фармацевтической промышленности, а именно к композиции твердого раствора, обладающей способностью нормализовать липидный уровень. Фармацевтическая композиция твердого раствора, обладающая способностью нормализовать липидный уровень. Применение фармацевтической композиции твердого раствора в производстве лекарственного препарата и для лечения сердечнососудистого заболевания (варианты). Способ лечения индивидуума, страдающего сердечнососудистым заболеванием, где способ включает стадии: введения индивидууму, если это ему необходимо, фармацевтической композиции твердого раствора, где введение приводит в результате к уменьшению интенсивности симптома, связанного с сердечнососудистым заболеванием, вследствие чего происходит лечение индивидуума. Вышеописанная композиция является монофазной композицией твердого раствора. 4 н. и 14 з.п. ф-лы, 13 ил., 7 табл., 22 пр.

Комментарии