Стабильные жидкие препараты вируса осповакцины - RU2704485C2
Код документа: RU2704485C2
Чертежи

























Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области стабильных жидких препаратов, предназначенных для хранения вирусов группы оспы в жидком состоянии, в частности, вирусов осповакцины. Оно относится к жидким препаратам, содержащим: а) вирус группы оспы, в частности, вирус осповакцины, б) фармацевтически приемлемый буфер, в) одновалентную соль, г) фармацевтически приемлемый дисахарид или сахароспирт и д) фармацевтически приемлемый хелатор, где рН препарата составляет от 6,5 до 8,5.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Вирусы группы оспы представляют собой сложные оболочечные вирусы, имеющие диаметр, составляющий от 200 до 300 нм, что принципиально отличает их по их необычной морфологии, их большому ДНК-геному и их цитоплазматичекому сайту репликации. Геном нескольких членов ортопоксвирусов, включая два штамма вируса осповакцины (VV): штамм вируса осповакцины Copenhagen (GOEBEL et al., 1990, Virol. 179, 247-266 и 517-563; JOHNSON et al., 1993, Virol. 196, 381-401), штамм Wyeth (OSBORNE JD et al. Vaccine. 2007 Dec 17; 25(52):8807-32) и модифицированный штамм вируса осповакцины Ankara (MVA) (ANTOINE et al., 1998, Virol. 244:365-396), был картирован и секвенирован. VV имеет геном на основе двухцепочечной ДНК из примерно 192 т.п.н. (тысяч пар нуклеотидов), кодирующий примерно 200 белков, из которых приблизительно 100 участвуют в сборке вируса. MVA представляет собой сильно ослабленый штамм вируса осповакцины, полученный посредством более чем 500 серийных пассирований штамма Ankara вируса осповакцины на фибробластах эмбрионов курицы (MAYR et al., 1975, Infection 3:6-16). Вирус MVA был депонирован в Национальной коллекции культур микроорганизмов (CNCM) под № депонирования I-721. Определение полной последовательности генома MVA и сравнение с геномом VV Copenhagen обеспечивает точную идентификацию изменений, которые произошли в вирусном геноме, и определение нескольких делеций (от I до VII) и многочисленных мутаций, приводящих к фрагментированным ORF (открытая рамка считывания) (ANTOINE et al., 1998, Virology 244:365-396).
MVA используется в качестве профилактической вакцины против натуральной оспы, и рекомбинантный MVA в настоящее время является темой многих доклинических и клинических исследований для профилактической и терапевтической вакцинации против многих типов мишеней, включая рак (а именно: меланома, немелкоклеточная карцинома легкого, почечно-клеточная карцинома, рак предстательной железы, колоректальный рак), вирусные (а именно: гепатит В и С, ВИЧ (вирус иммунодефицита человека)), бактериальные (а именно: туберкулез) и паразитарные заболевания (а именно: малярия) (см. GOMEZ et al. Current Gene Therapy, 2008, 8:97-120).
Онколитические вирусы осповакцины также находятся в доклинической и клинической разработке (см. KIRN et al. Nat Rev Cancer, 2009 Jan, 9(1):64-71).
В обоих случаях используется живой вирус осповакцины.
Профилактическая или терапевтическая вакцина на основе живого вируса осповакцины обычно не вводится пациенту сразу после производства и очистки, и, таким образом, должна храниться в течение суток, недель или даже месяцев без потери ее эффективности.
Подобно всем живым вирусам, живые вирусы осповакцины имеют природную нестабильность, которая дополнительно усиливается тем фактом, что вирус осповакцины является оболочечным вирусом (известно, что оболочечные вирусы являются менее стабильными, чем безоболочечные вирусы, см. BURKE CJ et al. Crit Rev Ther Drug Carrier Syst. 1999, 16(1): 1-83; и REXROAD et al. Cell Preservation Technology. June 2002, 1(2):91-104), имеют большой размер (форма кирпича от 200 до 300 нм), большой геном, и известно то, что они являются особенно чувствительными к повреждению УФ (ультрафиолет), см. LYTLE et al. J. Virol. 2005, 79(22): 14244). Кроме того, оболочка вируса осповакцины является даже более сложной, чем оболочка других оболочечных вирусов. Стабилизация вируса осповакцины, таким образом, является особым вызовом.
Предпринимались попытки стабилизировать вирус осповакцины. В большинстве случаев был предложен лиофилизированный препарат (BURKE CJ et al. Crit Rev Ther Drug Carrier Syst. 1999, 16(1):1-83). В самом деле, в то время как проведение лиофилизации может индуцировать некоторую потерю вирусного титра, сразу после лиофилизации низкая температура и отсутствие движения и взаимодействия между соединениями в лиофилизированном состоянии делает лиофилизированные вирусы, в общем, более стабильными, чем вирусы в жидком состоянии. Например, в ЕР1418942 раскрыты препараты вируса осповакцины для лиофилизации, содержащие по существу чистый вирус осповакцины, дисахарид, фармацевтически приемлемый полимер и буфер, который не является фосфатным буфером. В WO 2014/053571 раскрыты другие лиофилизированные препараты MVA, содержащие поливинилпирролидон (PVP) или его производные, по меньшей мере один сахар (в частности, сахарозу), по меньшей мере две разные аминокислоты (в частности, натрия глутамат и L-аргинин), по меньшей мере две фармацевтически приемлемые соли (в частности, NaCl, Na2HPO4 и KH2PO4), где по меньшей мере одна из указанных солей представляет собой фосфатную соль и, возможно, фармацевтически приемлемый буфер (в частности, Tris).
Однако лиофилизация является дорогостоящей, требует специфического оборудования, и лиофилизированные препараты должны быть растворены перед введением. Кроме того, лиофилизация включает стадию замораживания, которая может приводить к некоторой агрегации вируса, в частности, при высоких титрах вируса, что не подходит для инъекционного введения. Таким образом, было бы очень полезным иметь стабильные доступные жидкие препараты вируса осповакцины.
Предыдущие попытки стабилизировать вирус осповакцины в жидком состоянии не были очень успешными, так как в большинстве случаев наблюдали log потери, превосходящий 1 log10 после меньше, чем 1 часа при 50°С (см. BURKE CJ et al. Crit Rev Ther Drug Carrier Syst. 1999, 16(1):1-83).
Evans et al раскрыли стабильные жидкие препараты аденовируса (безоболочечный ДНК-вирус), буферизованные при рН от 6 до 8, содержащие соль (обычно NaCl), сахар (в большинстве случаев сахароза), ингибитор свободнорадикального окисления (а именно: EDTA (этилендиаминтетрауксусная кислота), этанол или комбинация EDTA/этанол), неионное поверхностно-активное вещество и двухвалентные соли (см. EVANS et al. J Pharm Sci. 2004 Oct, 93(10): 2458-75 и US 7456009). Предпочтительные препараты обычно также содержат гистидин. Параметры, идентифицированные как существенные для стабильности, включают присутствие ингибитора свободнорадикального окисления (в частности, EDTA, этанол, комбинация EDTA/этанол и/или гистидин) и присутствие неионного поверхностно-активного вещества. Присутствие двухвалентных солей также идентифицируется как важное для увеличения стабильности аденовируса.
Польза неионных поверхностно-активных веществ для цели стабилизации также была описана для вируса папилломы (см. SHI et al. J Pharm Sci. 2005 Jul, 94(7): 1538-51). В US 2007/0161085 протестированы разные жидкие препараты для стабилизации вируса гриппа (оболоченый РНК-вирус). Самые стабильные препараты включали аргинин и желатин. В данном исследовании было показано то, что EDTA не имеет влияния на стабильность вируса гриппа. Обнаружили то, что полезным является небольшое количество поверхностно-активного вещества, помимо аргинина и желатина.
US 7914979 относится к препарату для стабилизации оболочечного вируса ньюкаслской болезни, содержащему невосстанавливающий сахарид, такой как сахароза. Предпочтительные композиции также содержат аминокислоту, выбранную из лизина и аргинина. В отличие от этого, показано то, что EDTA имеет отрицательное влияние на стабильность и предпочтительно отсутствует в препарате.
В WO 2014/029702 тестировали разные типы препаратов для стабилизации четырех собачьих вирусов: двух маленьких и средних безоболочечных вирусов (собачий парвовирус и собачий аденовирус типа 2) и двух оболочечных вирусов из семейства парамиксовирусов (вирус собачьей чумы и вирус собачьего парагриппа). Результаты показывают то, что оболочечные вирусы сложнее стабилизировать, чем безоболочечные вирусы, и что оптимальный препарат значительно варьирует, в зависимости от типа вируса, даже для двух оболочечных вирусов того же самого семейства парамиксовирусов (вируса собачьей чумы и вируса собачьего парагриппа). Кроме того, в Примере 1 показано то, что, в то время как сахароза, в частности, в концентрации 17-25%, и аминокислоты (такие как аргинин и метионин) являются эффективными стабилизаторами, ловушки свободных радикалов (такие как EDTA) значимо не изменяют профиль стабильности, хотя они и могут в некоторой степени способствовать стабильности.
Приведенное выше описание предшествующего уровня техники ясно иллюстрирует то, что разработка стабильного жидкого препарата для конкретного вируса является сложной задачей, так как в данной области известны многие кандидаты стабилизаторов, и так как их стабилизирующий эффект значительно варьирует, в зависимости от конкретного вируса, подлежащего стабилизации. Кроме того, как объясняется выше, вирус осповакцины, из-за его оболочечной природы, его большого размера и его ДНК-генома, является особенно сложным для стабилизации, а именно: в жидком состоянии.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В контексте настоящего изобретения авторы изобретения идентифицировали подходящие жидкие препараты для поддержания стабильности вируса осповакцины в жидком состоянии при примерно 5°С (т.е. 5°С плюс/минус 3°С) или более. Существенными элементами таких препаратов являются присутствие фармацевтически приемлемого буфера, одновалентной соли, фармацевтически приемлемого дисахарида или сахароспирта, фармацевтически приемлемого хелатора; и рН от 6,5 до 8,5. Дополнительное присутствие С2-С3 спирта дополнительно улучшает стабильность жидких препаратов.
В первом аспекте настоящее изобретение, таким образом, относится к жидкому препарату, содержащему, по существу состоящему или состоящему из следующих:
а) вирус группы оспы, в частности, вирус осповакцины,
б) фармацевтически приемлемый буфер,
в) одновалентная соль,
г) фармацевтически приемлемый дисахарид или сахароспирт и
д) фармацевтически приемлемый хелатор, где рН препарата составляет от 6,5 до 8,5.
Авторы изобретения также неожиданно обнаружили то, что присутствие хелатора, такого как EDTA, защищает вирус осповакцины от повреждения УФ. Настоящее изобретение, таким образом, также относится к применению хелатора для стабилизации вируса группы оспы, в частности, вируса осповакцины, против повреждения УФ.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1. Полезный эффект присутствия одновалентной соли. Потери инфективности MVA-MUC1 через 7, 14 или 28 суток при 37°С в препарате, содержащем 10 мМ Tris-HCl, 5% сахарозу (масс./об.), 10 мМ Na глутамат, рН 8,0, с 0 мМ или 50 мМ NaCl. Инфекционный вирус измеряли в бляшкообразующих единицах (БОЕ)/мл, и потери инфективности выражаются в log(БОЕ/мл).
Фиг. 2. Полезный эффект присутствия EDTA или EDTA/EtOH. Потери инфективности MVA-HCV в контрольном препарате DS, содержащем 10 мМ Tris-HCl, 5% сахарозу (масс./об.), 10 мМ Na глутамат, 50 мМ NaCl, рН 7,5; в контрольном препарате DS2, содержащем 20 мМ Tris-HCl, 10% сахарозу (масс./об.), 5 мМ Na глутамат, 75 мМ NaCl, рН 7,5; или в препаратах, содержащих 20 мМ Tris-HCl, 10% сахарозу (масс./об.), 5 мМ Na глутамат, 75 мМ NaCl, рН 7,5, и разные концентрации EDTA (50, 250, 500 и 1000 мкМ) и возможно 1% EtOH (об./об.) через 7, 14 или 28 суток при +37°С. Инфекционный вирус измеряли в инфекционных геномах (ИГ)/мл, и потери инфективности выражаются в log(ИГ/мл).
Фиг. 3. Полезный эффект присутствия EtOH или EDTA/EtOH. Потери инфективности MVA-HCV в контрольном препарате DS, содержащем 10 мМ Tris-HCl, 5% сахарозу (масс./об.), 10 мМ Na глутамат, 50 мМ NaCl, рН 7,5; в контрольном препарате DS2, содержащем 20 мМ Tris-HCl, 10% сахарозу (масс./об.), 5 мМ Na глутамат, 75 мМ NaCl, рН 7,5; или в препаратах, содержащих 20 мМ Tris-HCl, 10% сахарозу (масс./об.), 5 мМ Na глутамат, 75 мМ NaCl, рН 7,5, и разные концентрации EtOH (0,5; 1; 2 или 4% об./об.) и возможно EDTA (50 или 1000 мкМ) через 7, 14 или 28 суток при +37°С. Инфекционный вирус измеряли в инфекционных геномах (ИГ)/мл, и потери инфективности выражаются в log(ИГ/мл).
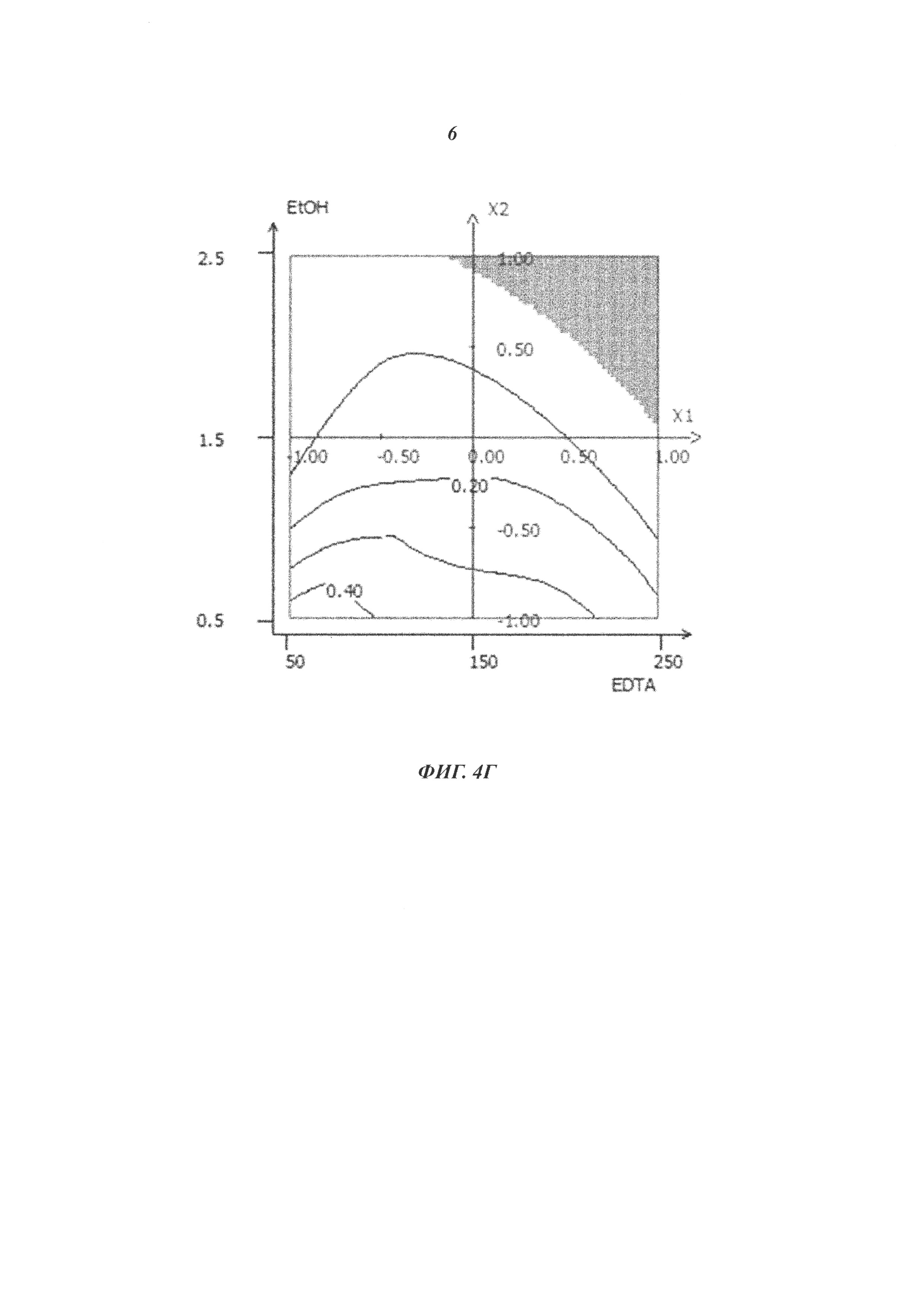
Фиг. 4. Полезный эффект присутствия EDTA/EtOH. Потери инфективности MVA-HCV в контрольном препарате DS, содержащем 10 мМ Tris-HCl, 5% сахарозу (масс./об.), 10 мМ Na глутамат, 50 мМ NaCl, рН 7,5; в контрольном препарате DS2, содержащем 20 мМ Tris-HCl, 10% сахарозу (масс./об.), 2,5 мМ Na глутамат, 75 мМ NaCl, рН 7,5; или в препаратах, содержащих 20 мМ Tris-HCl, 10% сахарозу (масс./об.), 2,5 мМ Na глутамат, 75 мМ NaCl, рН 7,5, и разные концентрации EDTA (50, 150 или 250 мкМ) и EtOH (0,5; 1,5 или 2,5% об./об.) (А) через 7, 14 или 28 суток при +37°С; (Б) через 28 суток или 2, 3 или 6 месяцев при +25°С; или (В) через 35 суток или 3, 6, 12, 18 или 24 месяца при 5°С. Инфекционный вирус измеряли в инфекционных геномах (ИГ)/мл, и потери инфективности выражаются в log(ИГ/мл). (Г) Кривые целесообразности для концентраций EDTA (мкМ) и EtOH (%) на основе объединенного анализа потерь инфективности через 7 суток при +37°С; потерь инфективности через 28 суток при +37°С и потерь инфективности через 24 месяца при +5°С Представляются кривые, представляющие значения концентраций EDTA и EtOH, для которых получено конкретное значение целесообразности. Предпочтительными являются концентрации EDTA и EtOH, приводящие к большим значениям целесообразности.
Фиг. 5. Полезный эффект низких концентраций Na глутамата. Потери инфективности MVA-HCV в контрольном препарате DS, содержащем 10 мМ Tris-HCl, 5% сахарозу (масс./об.), 10 мМ Na глутамат, 50 мМ NaCl, рН 7,5; в контрольном препарате DS2, содержащем 10 мМ Tris-HCl, 5% сахарозу (масс./об.), 0 мМ Na глутамат, 50 мМ NaCl, рН 7,5; или в препаратах, содержащих 20 мМ Tris-HCl, 10% сахарозу (масс./об.), от 0 до 10 мМ Na глутамата, 75 мМ NaCl, 150 мкМ EDTA и 0,5% об./об. EtOH, рН 7,5, (А) через 7, 14 или 28 суток при +37°С; (Б) через 28 суток или 3, 6 или 12 месяцев при +25°С; (В) через 2, 3, 6, 12, 18, 24 или 30 месяцев при +5°С. Инфекционный вирус измеряли в инфекционных геномах (ИГ)/мл, и потери инфективности выражаются в log(ИГ/мл).
Фиг. 6. Полезный эффект сахарозы. Потери инфективности MVA-MUC1 в препаратах, содержащих 10 мМ Tris-HCl, 10 мМ Na глутамат, 50 мМ NaCl, рН 8,0, и варьирующие количества сахарозы (1,25; 2,5; 5; 7,5 и 10% (масс./об.)) через 7 или 14 суток при +37°С. Инфекционный вирус измеряли в бляшкообразующих единицах (БОЕ)/мл, и потери инфективности выражаются в log(БОЕ/мл).
Фиг. 7. Отсутствие полезного эффекта и даже вредный эффект полисорбата. (А) и (Б) Потери инфективности MVA-HPV в контрольном препарате DS, содержащем 10 мМ Tris-HCl, 5% сахарозу (масс./об.), 10 мМ Na глутамат, 50 мМ NaCl, рН 7,5; или в препаратах, содержащих 5, 10 или 20 мМ Tris-HCl, 5% сахарозу (масс./об.), 5 мМ Na глутамат, 50 или 75 мМ NaCl, рН 7,5, и разные концентрации полисорбата 80 (0,005; 0,02 или 1% об./об.) или полисорбат 40 (1% об./об.) (А) через 3, 7, 28 или 60 суток при +25°С; или (Б) через 1, 2, 3, 6, 12, 18 или 24 месяца при +5°С. Инфекционный вирус измеряли в инфекционных геномах (ИГ)/мл, и потери инфективности выражаются в log(ИГ/мл). (В) Потери инфективности штамма Wyeth вируса осповакцины (VV), продуцированного в непрерывной линии клеток человека и очищенного способом, который включает по меньшей мере одну стадию обработки по меньшей мере одной протеазой, через 7, 14, 21 или 28 суток при +37°С, в контрольном препарате, содержащем 30 мМ Tris-HCl, 10% сахарозу (масс./об.), или в препарате, дополнительно содержащем 150 мкг/мл полисорбата 80.
Фиг. 8. Отсутствие полезного эффекта MgCl2 и скорее вредный эффект при высокой концентрации. (А) Потери инфективности MVA-MUC1 в препаратах, содержащих 10 мМ Tris-HCl, 5% сахарозу (масс./об.), 10 мМ Na глутамат, 50 мМ NaCl, рН 8,0, и варьирующие количества MgCl2 (0 М, 0,5 М или 1 М) через 14 суток при +37°C. Инфекционный вирус измеряли в бляшкообразующих единицах (БОЕ)/мл, и потери инфективности выражаются в log(БОЕ/мл). (Б) Потери инфективности штамма Wyeth вируса осповакцины (VV), продуцированного в непрерывной линии клеток человека и очищенного способом, который включает по меньшей мере одну стадию обработки по меньшей мере одной протеазой, через 7 или 14 суток при +37°С, в контрольном препарате, содержащем 30 мМ Tris-HCl, 10% сахарозу (масс./об.), или в препарате, дополнительно содержащем 1000 мМ MgCl2.
Фиг. 9. Отсутствие полезного эффекта и скорее вредный эффект аргинина. (А) Потери инфективности MVA-MUC1 в препаратах, содержащих 10 мМ Tris-HCl, 5% сахарозу (масс./об.), 10 мМ Na глутамат, 50 мМ NaCl, рН 8,0, и варьирующие количества аргинина (0, 30, 50, 100 или 200 мМ), через 3, 7, 14 или 28 суток при +37°С. Инфекционный вирус измеряли в бляшкообразующих единицах (БОЕ)/мл, и потери инфективности выражаются в log(БОЕ/мл). (Б) Потери инфективности штамма Wyeth вируса осповакцины (VV), продуцированного в непрерывной линии клеток человека и очищенного способом, который включает по меньшей мере одну стадию обработки по меньшей мере одной протеазой через 7, 14, 21 или 28 суток при +37°С, в контрольном препарате, содержащем 30 мМ Tris-HCl, 10% сахарозу (масс./об.), или в препарате, дополнительно содержащем 50 мМ аргинин.
Фиг. 10. Отсутствие полезного эффекта смеси аминокислот. Потери инфективности MVA-MUC1 в препаратах, содержащих 10 мМ Tris-HCl, 5% сахарозу (масс./об.), 10 мМ Na глутамат, 50 мМ NaCl, рН 8,0, и варьирующие количества смеси аминокислот (0 или 1% (масс./об.)) через 3, 7, 14 или 28 суток при +37°С. Инфекционный вирус измеряли в бляшкообразующих единицах (БОЕ)/мл, и потери инфективности выражаются в log(БОЕ/мл).
Фиг. 11. Отсутствие полезного эффекта гистидина. Потери инфективности MVA-HPV в контрольном препарате DS, содержащем 10 мМ Tris-HCl, 5% сахарозу (масс./об.), 10 мМ Na глутамат, 50 мМ NaCl, рН 7,5; или в препарате, содержащем 20 мМ Tris-HCl, 10% сахарозу (масс./об.), 5 мМ глутамат Na, 75 мМ NaCl и 10 мМ гистидин, рН 7,5, (А) через 3, 7, 14, 28 или 60 суток при +25°С; или (Б) через 1, 2, 3, 6, 12, 18 или 24 месяца при +5°С. Инфекционный вирус измеряли в инфекционных геномах (ИГ)/мл, и потери инфективности выражаются в log(ИГ/мл).
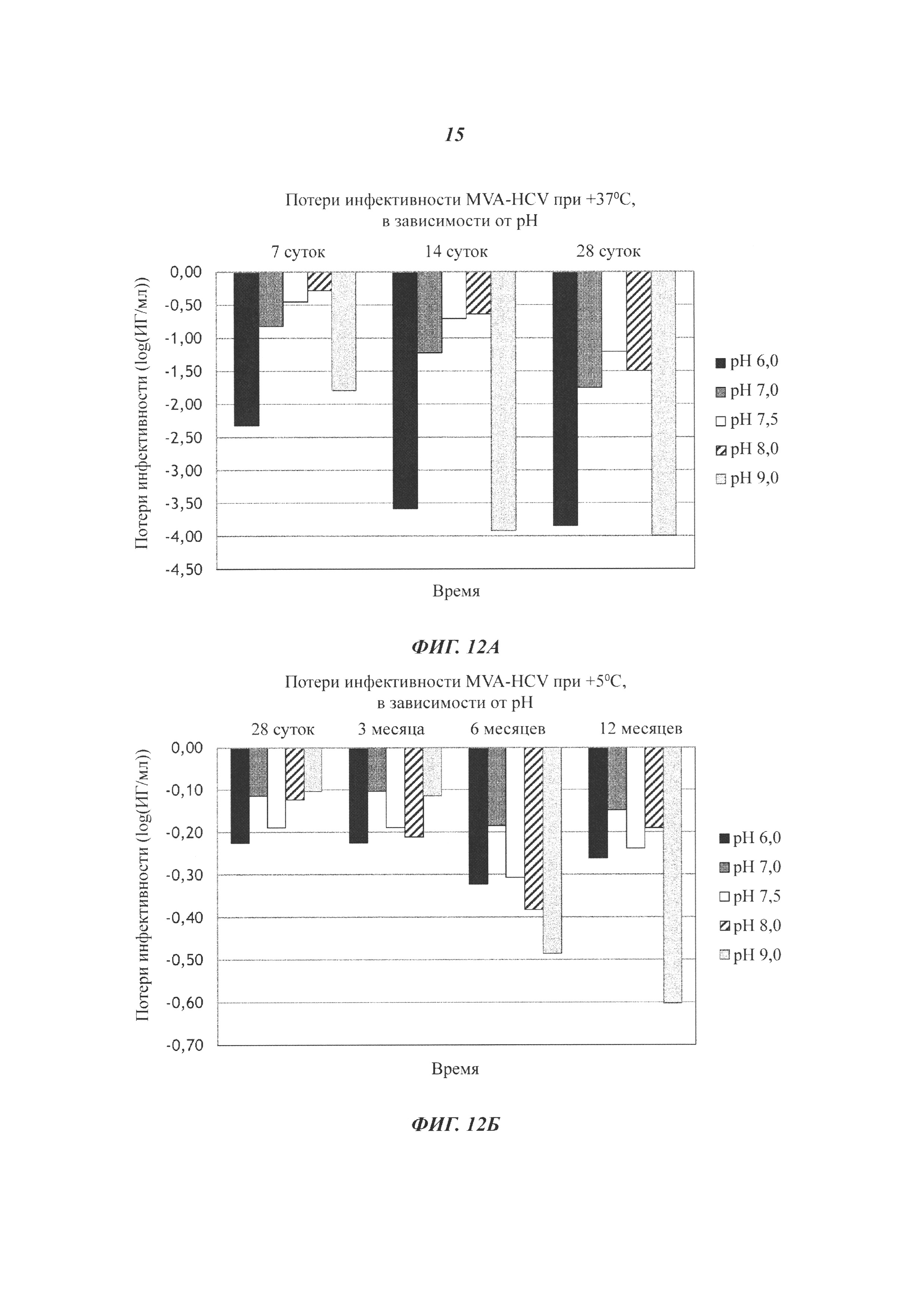
Фиг. 12. Эффект рН. Потери инфективности MVA-HCV в препаратах, содержащих 20 мМ Tris-HCl, 10% сахарозу (масс./об.), 5 мМ Na глутамат, 75 мМ NaCl, 150 мкМ EDTA и 0,5% (об./об.) EtOH, с варьирующими значениями рН (6,0; 7,0; 7,5; 8,0 и 9,0) (А) через 7, 14 или 28 суток при +37°С; или (Б) через 28 суток или 3, 6 или 12 месяцев при +5°С. Инфекционный вирус измеряли в инфекционных геномах (ИГ)/мл, и потери инфективности выражаются в log(ИГ/мл).
Фиг. 13. Эффект концентрации вируса. Потери инфективности MVA-HCV при разных исходных концентрациях (1,0×108 БОЕ/мл; 5,0×107 БОЕ/мл; 1,0×107 БОЕ/мл или 5,0×106 БОЕ/мл) в контрольном препарате DS, содержащем 10 мМ Tris-HCl, 5% сахарозу (масс./об.), 10 мМ Na глутамат, 50 мМ NaCl, рН 7,5; или в препарате (Inv), содержащем 20 мМ Tris-HCl, 10% сахарозы (масс./об.), 2,5 мМ Na глутамат, 75 мМ NaCl, 150 мкМ EDTA, 0,5% (об./об.) EtOH, рН 7,5 (А) через 7, 14 или 28 суток при +37°С; (Б) через 28 суток или 3, или 7 месяцев при +25°С; или (В) через 2, 6, 12 или 18 месяцев при 5°С. Инфекционный вирус измеряли в инфекционных геномах (ИГ)/мл, и потери инфективности выражаются в log(ИГ/мл).
Фиг. 14. Подтверждение оптимизированного препарата согласно изобретению на 3 отличных вирусах MVA, экспрессирующих отличные гетерологичные гены. Потери инфективности MVA-HCV, MVA-MUC1 и MVA-HPV в контрольном препарате DS, содержащем 10 мМ Tris-HCl, 5% сахарозы (масс./об.), 10 мМ Na глутамат, 50 мМ NaCl, рН 7,5 для MVA-HPV и рН 8,0 для MVA-HCV и MVA-MUC1; или в препарате, содержащем 20 мМ Tris-HCl, 10% сахарозы (масс./об.), 5 мМ Na глутамат, 75 мМ NaCl, 150 мкМ EDTA, 0,5% (об./об.) EtOH, рН 7,5 (А) через 7, 14 или 28 суток при +37°С; (Б) через 28 суток или 2, 3 или 6 месяцев при +25°С; или (В) через 2, 3, 6, 12, 18, 24 или 30 месяцев при +5°С. Инфекционный вирус измеряли в инфекционных геномах (ИГ)/мл, и потери инфективности выражаются в log(ИГ/мл).
Фиг. 15. Подтверждение оптимизированного препарата согласно изобретению на разных штаммах вирусов осповакцины, продуцированных/очищенных разными способами. (А) Потери инфективности MVA-HCV, продуцированного в клетках куриных эмбрионов (MVA-HCV/CEC) или в клетках сделанной бессмертной линии клеток птиц (MVA-HCV/линия клеток птиц); или MVA-FCU1, продуцированного в клетках куриных эмбрионов (MVA-FCU1/CEC), и Copenhagen-FCU1, продуцированного в клетках куриных эмбрионов (Copenhagen-FCU1/CEC); в контрольном лекарственном веществе (10 мМ Tris-HCl, 10 мМ Na глутамат, 5% сахароза (масс./об.), 50 мМ NaCl, рН 7,5) или приготовленных в оптимизированном препарате согласно изобретению (20 мМ Tris-HCl, 5 мМ Na глутамат, 10% сахарозы (масс./об.), 75 мМ NaCl, 150 мкМ EDTA, 0,5% EtOH, рН 7,5) через 7, 14, 21 или 28 суток при +37°С. (Б) Потери инфективности штамма Wyeth вируса осповакцины (VV), продуцированного в непрерывной линии клеток человека и очищенного способом, который включает по меньшей мере одну стадию обработки по меньшей мере одной протеазой в контрольном лекарственном веществе (30 мМ Tris-HCl, 10% сахароза (масс./об.), рН 7,5) или приготовленного в двух оптимизированных препаратах согласно изобретению (30 мМ Tris-HCl, 10% сахароза (масс./об.), 200 или 500 мМ NaCl, 150 мкМ EDTA, 0,5% EtOH, рН 7,5) через 7, 14, 21 или 28 суток при +37°С.
Фиг. 16. Замена исходно протестированных стабилизаторов другими соединениями из того же самого семейства или из другого семейства. (А)
Потери инфективности MVA-MUC1 в разных препаратах, определенных в Таблице 19, через 7, 14, 21 или 28 суток при +37°С. Инфекционный вирус измеряли в инфекционных геномах (ИГ)/мл, и потери инфективности выражаются в log(ИГ/мл). (Б) и (В) Статистический анализ влияния замены вновь протестированного эквивалента-кандидата исходно протестированным стабилизатором или другим вновь протестированным эквивалентом-кандидатом через 14 (Б) или 28 (В) суток при +37°С, с использованием программы NemrodW®. Каждая линия представляет изменение от препарата, содержащего эквивалент-кандидат Y, до препарата, содержащего исходно протестированный стабилизатор X, или другого вновь протестированного эквивалента-кандидата (от Y до X), и ассоциированный столбик и значение. Когда значение является положительным, это означает то, что исходно протестированный стабилизатор или другой вновь протестированный кандидат X лучше стабилизирует MVA-MUC1, чем эквивалент-кандидат Y. В отличие от этого отрицательное значение означает то, что эквивалент-кандидат Y лучше стабилизирует MVA-MUC1, чем исходно протестированный стабилизатор или другой эквивалент-кандидат X. Чем выше абсолютное значение, тем сильнее эффект замены Y на X. В частности, считается, что данная замена имеет значимое влияние на стабильность MVA-MUC1, когда столбик превышает пунктирную линию. (Г) Потери инфективности MVA-MUC1 в разных препаратах, определенных в Таблице 19, после 28, 90 и 180 суток при +5°С. Инфекционный вирус измеряли в инфекционных геномах (ИГ)/мл, и потери инфективности выражаются в log(ИГ/мл).
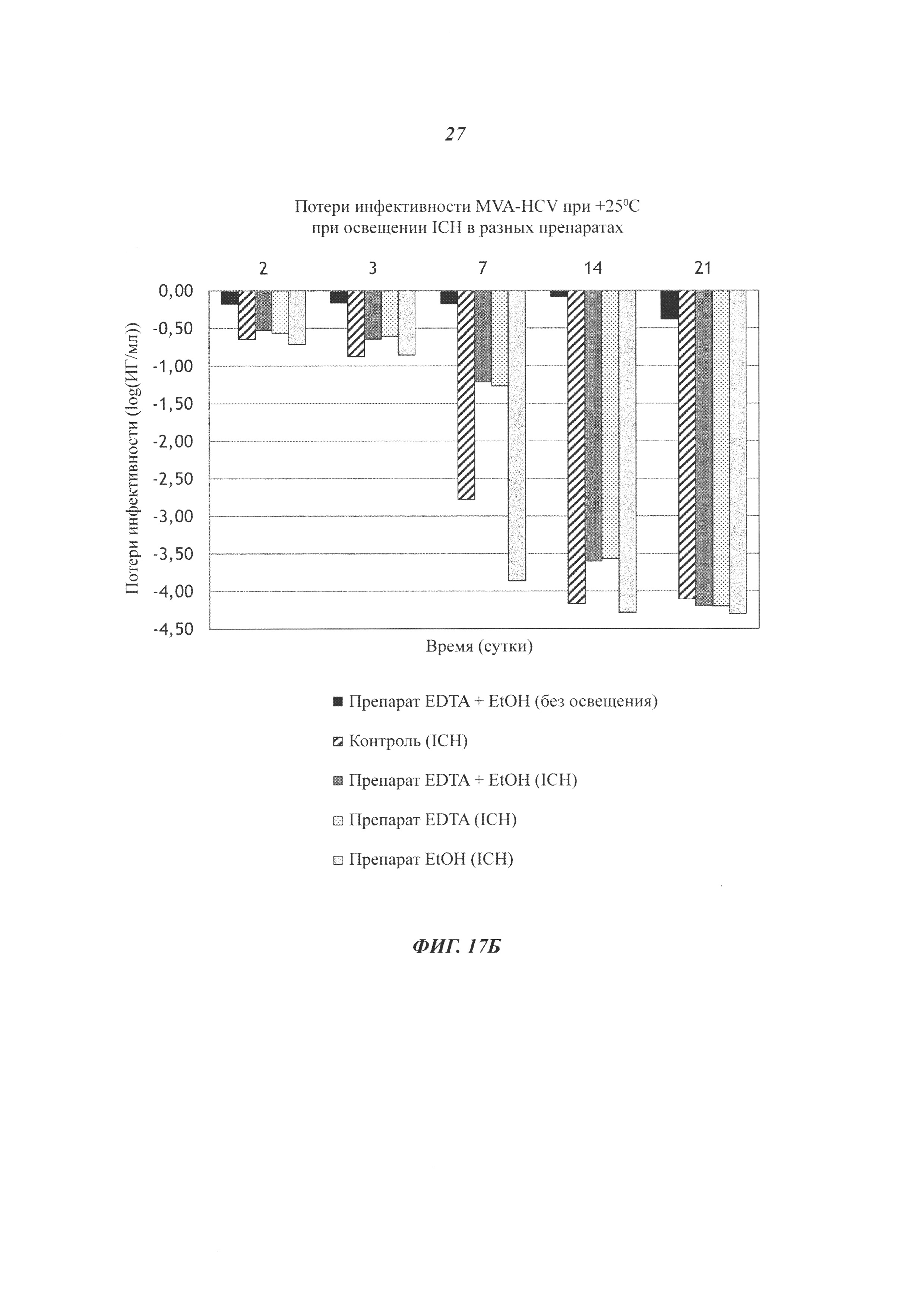
Фиг. 17. Защита вируса MVA против повреждения УФ посредством оптимизированного препарата. (А) Потери инфективности MVA-HCV в контрольном препарате, содержащем 10 мМ Tris-HCl, 5% сахарозы (масс./об.), 10 мМ Na глутамат, 50 мМ NaCl, рН 7,5; или в оптимизированном препарате, содержащем 20 мМ Tris-HCl, 10% сахарозы (масс./об.), 5 мМ Na глутамат, 75 мМ NaCl, 150 мкМ EDTA и 0,5% (об./об.) EtOH, рН 7,5, через 1, 2, 3, 7, 14, 21 или 28 суток при +25°С в отсутствие света, под светом PSM (имитация УФ света 320-400 нм согласно ISO (Международная организация по стандартизации) 10977) или под светом ICH (тестирование фотостабильности ICH Q1B новых лекарственных веществ и продуктов). (Б) Потери инфективности MVA-HCV в контрольном препарате, содержащем 20 мМ Tris-HCl, 10% сахарозы (масс./об.), 5 мМ Na глутамат, 75 мМ NaCl, рН 7,5; или в препаратах, содержащих 20 мМ Tris-HCl, 10% сахарозы (масс./об.), 5 мМ Na глутамат, 75 мМ NaCl и 150 мкМ EDTA и/или 0,5% (об./об.) EtOH, рН 7,5, через 2, 3, 7, 9, 14 или 21 сутки при +25°С в отсутствие света или под светом ICH (тестирование фотостабильности ICH Q1B новых лекарственных веществ и продуктов). Инфекционный вирус измеряли в инфекционных геномах (ИГ)/мл, и потери инфективности выражаются в log(ИГ/мл).
Фиг. 18. Стабилизирующий эффект нескольких препаратов с варьирующими концентрациями ингредиентов. Потери инфективности MVA-MUC1 в нескольких препаратах с варьирующими концентрациями ингредиентов (см. Таблицу 20) через 7, 14, 21 или 28 суток при +37°С. Инфекционный вирус измеряли в инфекционных геномах (ИГ)/мл, и потери инфективности выражаются в log(ИГ/мл).
Фиг. 19. Стабилизирующий эффект на вирус ложной коровьей оспы. Потери инфективности вируса ложной коровьей оспы в контрольной композиции, содержащей 10 мМ Tris-HCl, 5% сахарозы (масс./об.), 10 мМ Na глутамат, 50 мМ NaCl, рН 8,0), или в препарате согласно изобретению, содержащем 20 мМ Tris-HCl, 10% сахарозы (масс./об.), 5 мМ Na глутамат, 75 мМ NaCl, 150 мкМ EDTA, 0,5% (об./об.) EtOH, рН 7,5, через 7, 14, 21 или 28 суток при +37°С. Инфекционный вирус измеряли в инфекционных геномах (ИГ)/мл, и потери инфективности выражаются в log(ИГ/мл).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Стабильный жидкий препарат
Как объясняется выше, авторы изобретения идентифицировали жидкие препараты, подходящие для поддержания стабильности вируса группы оспы, в частности, вируса осповакцины, в жидком состоянии примерно при +5°С или более. Такие препараты должны содержать фармацевтически приемлемый буфер, одновалентную соль, фармацевтически приемлемый дисахарид или сахароспирт, фармацевтически приемлемый хелатор и иметь рН от 6,5 до 8,5.
Настоящее изобретение, таким образом, относится к жидкому препарату, содержащему, по существу состоящему или состоящему из следующих:
а) вирус группы оспы, в частности, вирус осповакцины,
б) фармацевтически приемлемый буфер,
в) одновалентная соль,
г) фармацевтически приемлемый дисахарид или сахароспирт и
д) фармацевтически приемлемый хелатор, где рН препарата составляет от 6,5 до 8,5.
Жидкий препарат согласно изобретению представляет собой водный препарат.
Подразумевается, что термины «содержащий» и «содержат(жит)» означают то, что вещества, продукты, препараты, композиции и способы включают упоминаемые компоненты или стадии, но не исключая других. Фраза «по существу состоящий из» или «по существу состоят(ит) из», при использовании для определения продуктов, препаратов, композиций и способов, будет означать исключение других компонентов или стадий какой-либо существенной значимости. Таким образом, например, препарат, по существу состоящий из перечисленных компонентов, не исключал бы следовых примесей и фармацевтически приемлемых носителей. Фразы «состоящий из» или «состоят(ит) из» будут означать исключение более чем следовых элементов других компонентов или стадий.
Стабильность
Препараты согласно изобретению представляют собой жидкость, которая имеет преимущество в том, что нет необходимости в дорогих и времязатратных способах лиофилизации, и что они могут вводиться непосредственно, без необходимости предшествующего растворения.
Стабилизация биологического материала, такого как вирусы, в частности, в жидком состоянии, не является прямолинейной из-за способности вирусов взаимодействовать со всеми компонентами препарата, а также с контейнером, что увеличивает риски потери вирусного титра.
Однако согласно настоящему изобретению предложены вирусные препараты, которые являются стабильными в жидком состоянии и позволяют преодолевать данные проблемы. В частности:



Титры инфекционного вируса осповакцины в сутки 0 и в любую последующую дату можно определять либо путем измерения числа инфекционных геномов (ИГ) на мл (ИГ/мл), либо посредством применения бляшечного анализа на клетках BHK-21 (титр инфекционного вируса группы оспы, в частности, вируса осповакцины, затем выражается в бляшкообразующих единицах (БОЕ) на мл (БОЕ/мл). Измерение числа инфекционных геномов на мл (ИГ/мл) может быть предпочтительным, так как этот способ является более быстрым и более точным. Подробные протоколы для измерения числа инфекционных геномов (ИГ) на мл (ИГ/мл) или для бляшечного анализа на клетках BHK-21 раскрываются в Примерах
Вирус группы оспы
Препараты согласно данному изобретению содержат вирус группы оспы.
Указанный вирус группы оспы может быть выбран из следующих семейств: ортопоксвирус (например, вирус осповакцины, вирус коровьей оспы), парапоксвирус (например, вирус коровьего папулезного стоматита, вирус контагиозного пустулезного дерматита, вирус ложной коровьей оспы), суипоксвирус (например, вирус оспы свиней), ятапоксвирус (например, вирус Яба-подобного заболевания), авипоксвирус (например, вирус оспы кур и канарипоксвирус) и лепорипоксвирус (например, вирус миксомы). Указанный вирус группы оспы, в частности, может быть выбран из ортопоксвирусов (например, вируса осповакцины, вируса коровьей оспы) и парапоксвирусов (например, вируса коровьего папулезного стоматита, вируса контагиозного пустулезного дерматита, вируса ложной коровьей оспы). Особенно предпочтительными вирусами группы оспы являются вирус осповакцины и вирус ложной коровьей оспы.
В предпочтительном воплощении указанный вирус группы оспы представляет собой ортопоксвирус и, более предпочтительно, - вирус осповакцины (VV).
Авторы изобретения наблюдали то, что стабильность вируса осповакцины в жидком состоянии возрастает с концентрацией частиц вируса осповакцины в препарате (см. Пример 4). В результате, вирус группы оспы (в частности, вирус осповакцины, а именно: вирус осповакцины MVA, Wyeth или Copenhagen) предпочтительно присутствует в жидких препаратах согласно изобретению с титром по меньшей мере 107 БОЕ/мл, предпочтительно 2×107 БОЕ/мл, по меньшей мере 3×107 БОЕ/мл, по меньшей мере 4×107 БОЕ/мл, более предпочтительно по меньшей мере 5×107 БОЕ/мл или даже по меньшей мере 108 БОЕ/мл. Поскольку стабильность вируса группы оспы (в частности, вируса осповакцины) возрастает с концентрацией частиц вируса группы оспы (в частности, вируса осповакцины) в препарате, нет конкретного ограничения относительно максимальной концентрации частиц вируса группы оспы (в частности, вируса осповакцины) в препарате. Однако, по практическим причинам, вирус группы оспы (в частности, вирус осповакцины) обычно будет содержаться в жидких препаратах согласно изобретению с титром самое большее 1012 БОЕ/мл, самое большее 1011 БОЕ/мл или даже самое большее 1010 БОЕ/мл. В частности, вирус группы оспы (в частности, вирус осповакцины) может содержаться в жидких препаратах согласно изобретению с титром от 107 БОЕ/мл до 1012 БОЕ/мл, от 107 БОЕ/мл до 1011 БОЕ/мл, от 107 БОЕ/мл до 1010 БОЕ/мл, от 107 БОЕ/мл до 5×109 БОЕ/мл, от 107 БОЕ/мл до 109 БОЕ/мл, от 107 БОЕ/мл до 5×108 БОЕ/мл, от 107 БОЕ/мл до 108 БОЕ/мл, от 2×107 БОЕ/мл до 1012 БОЕ/мл, от 2×107 БОЕ/мл до 1011 БОЕ/мл, от 2×107 БОЕ/мл до 1010 БОЕ/мл, от 2×107 БОЕ/мл до 5×109 БОЕ/мл, от 2×107 БОЕ/мл до 109 БОЕ/мл, от 2×107 БОЕ/мл до 5×108 БОЕ/мл, от 2×107 БОЕ/мл до 108 БОЕ/мл, от 3×107 БОЕ/мл до 1012 БОЕ/мл, от 3×107 БОЕ/мл до 1011 БОЕ/мл, от 3×107 БОЕ/мл до 1010 БОЕ/мл, от 3×107 БОЕ/мл до 5×109 БОЕ/мл, от 3×107 БОЕ/мл до 109 БОЕ/мл, от 3×107 БОЕ/мл до 5×108 БОЕ/мл, от 3×107 БОЕ/мл до 108 БОЕ/мл, 4×107 БОЕ/мл до 1012 БОЕ/мл, от 4×107 БОЕ/мл до 1011 БОЕ/мл, от 4×107 БОЕ/мл до 1010 БОЕ/мл, от 4×107 БОЕ/мл до 5×109 БОЕ/мл, от 4×107 БОЕ/мл до 109 БОЕ/мл, от 4×107 БОЕ/мл до 5×108 БОЕ/мл, от 4×107 БОЕ/мл до 108 БОЕ/мл, 5×107 БОЕ/мл до 1012БОЕ/мл, от 5×107 БОЕ/мл до 1011 БОЕ/мл, от 5×107 БОЕ/мл до 1010 БОЕ/мл, в частности, от 5×107 БОЕ/мл до 5×109 БОЕ/мл, от 5×107 БОЕ/мл до 109 БОЕ/мл, от 5×107 БОЕ/мл до 5×108 БОЕ/мл, от 5×107 БОЕ/мл до 108 БОЕ/мл, от 108 БОЕ/мл до 1012 БОЕ/мл, от 108 БОЕ/мл до 1011 БОЕ/мл, от 108 БОЕ/мл до 1010 БОЕ/мл, от 108 БОЕ/мл до 5×109 БОЕ/мл, от 108 БОЕ/мл до 109 БОЕ/мл, от 108 БОЕ/мл до 5×108 БОЕ/мл.
Вирус группы оспы предпочтительно является очищенным или частично очищенным для уменьшения содержания белков клетки-хозяина и ДНК клетки-хозяина для того, чтобы он хорошо переносился после введения человеку. Кроме того, целый ряд примесей мог бы быть источником человеческих аллергических реакций после инъекции. Такие способы частичной очистки или очистки являются традиционными в данной области и могут варьировать как функция разных параметров, таких как сам вирус, клетка-продуцент, используемая культуральная среда, ферменты и другие компоненты, вводимые во время способов продукции и очистки (например, нуклеазы, протеазы, соли и т.д.). Например, примеси, подобные яичному овальбумину и антибиотикам, типично присутствуют, когда вирус продуцируется на первичных клетках, подобных фибробластам эмбрионов курицы (CEF), тогда как нуклеиновые кислоты и белки клетки-хозяина являются обычными примесями вирусного препарата, продуцированного на сделанных бессмертными линиях клеток, таких как линии клеток утки и линии клеток человека. В том, что касается общего руководства, рекомендуется, чтобы уровень ДНК клетки-хозяина был меньше, чем 10 нг/дозу (см. нормативную спецификацию), и уровень белков клетки-хозяина был меньше, чем 159 мкг/дозу. Типичные примеры подходящих методик для достижения частично очищенного или очищенного препарата вируса включают, без ограничения, фильтрование тангенциальным потоком, ферментативное расщепление, хроматографию, фронтальное фильтрование и тому подобное. Следовательно, в предпочтительном воплощении вирус группы оспы (в частности, вирус осповакцины) является по меньшей мере частично очищенным, содержащим от 5 до 500 мкг/дозу белков клетки-хозяина и меньше, чем 10 нг/дозу ДНК клетки-хозяина.
Авторы изобретения обнаружили то, что жидкие препараты согласно изобретению способны стабилизировать три отличных штамма вируса осповакцины: MVA, Wyeth и Copenhagen (см. Пример 4). Разные штаммы вируса осповакцины, таким образом, могут быть стабилизированы с использованием жидких препаратов согласно изобретению. В частности, указанный вирус осповакцины может быть выбран из штаммов Elstree, Western Reserve, Wyeth, NYVAC, NYCBOH, Paris, Copenhagen и модифицированный вирус осповакцины Ankara (MVA). Указанный вирус осповакцины предпочтительно может быть выбран из штаммов модифицированный вирус осповакцины Ankara (MVA), Wyeth и Copenhagen. В предпочтительном воплощении вирус осповакцины, присутствующий в препарате, представляет собой вирус MVA и, в частности, MVA 575 (ЕСАСС V00120707) или MVA-BN (ЕСАСС V00083008). В другом предпочтительном воплощении вирус осповакцины, присутствующий в препарате, представляет собой вирус осповакцины Wyeth. В другом предпочтительном воплощении вирус осповакцины, присутствующий в препарате, представляет собой вирус осповакцины Copenhagen.
Вирус группы оспы, в частности, вирус осповакцины, содержащийся в препаратах по изобретению, может быть вирусом группы оспы дикого типа, ослабленным или рекомбинантным, в частности, вирусом осповакцины. Термин «рекомбинантный вирус группы оспы» относится к вирусу группы оспы, содержащему по меньшей мере одну экзогенную последовательность, вставленную в его геном. Термин «экзогенная последовательность» в том виде, в котором он используется в данном документе, относится к нуклеиновой кислоте, которая не присутствует в природе в родительском вирусе группы оспы.
Когда вирус группы оспы (в частности, вирус осповакцины), содержащийся в препаратах согласно изобретению, является рекомбинантным, экзогенная(ные) последовательность(сти) может(гут) представлять собой любую интересующую экзогенную последовательность.
В первом предпочтительном воплощении рекомбинантный вирус группы оспы (в частности, вирус осповакцины) содержит экзогенную последовательность, кодирующую молекулу, прямо или опосредованно имеющую цитотоксическую функцию. Под «прямо или опосредованно» цитотоксической авторы изобретения подразумевают то, что сама молекула, кодируемая экзогенной последовательностью, может быть токсичной (например, токсины, цитокины или ферменты, такие как рибонуклеаза, дезоксирибонуклеаза), или она может метаболизироваться с образованием токсичного продукта, или она может действовать как-то еще с образованием токсичного продукта. В предпочтительном воплощении молекула, кодируемая экзогенной последовательностью, может представлять собой токсин, такой как рицин или экзотоксин A Pseudomonas. Последовательность кДНК рицина раскрыта в LAMB et al (Eur. J. Biochem., 1985, 148:265-270). В другом предпочтительном воплощении молекула, кодируемая экзогенной последовательностью, может представлять собой цитокин. Такой цитокин может, в частности, быть выбран из фактора некроза опухолей (TNF), интерлейкина-2 (IL-2), интерферона-гамма (IFNγ) или гранулоцитарно-макрофагального колониестимулирующего фактора (GMCSF). В другом предпочтительном воплощении экзогенная последовательность, кодирующая молекулу, имеющую прямую или опосредованную цитотоксическую функцию, может представлять собой суицидный ген. Суицидный ген кодирует белок, способный превращать относительно нетоксичное пролекарство до доксичного лекарства. Например, фермент цитозиндезаминаза превращает 5-фторцитозин (5-FC) до 5-фторурацила (5-FU) (MULLEN et al., 1922, PNAS 89:33); фермент вируса простого герпеса тимидинкиназа сенсибилизирует клекти к обработке противовирусным агентом ганцикловир (GCV) или ацикловир (MOOLTEN, 1986, Cancer Res. 46:5276; EZZEDINE et al., 1991, New Biol 3:608). Можно использовать цитозиндезаминаза любого организма, например Е. coli или Saccharomyces cerevisiae. Таким образом, в предпочтительном воплощении изобретения суицидный ген кодирует белок, имеющий цитозиндезаминазную активность, и более предпочтительно - белок FCU1 или белок FCU 1-8, раскрытый в патентных заявках WO 99/54481, WO 2005/007857, WO 2009/065546 и WO 2009/065547, которые включены в данный документ посредством ссылки. В данном отношении предпочтительными рекомбинантными вирусами осповакцины, содержащимися в жидких препаратах согласно изобретению, являются следующие:
- MVA-FCU 1 (см. WO 99/54481), также именуемый TG4023;
- MVA-FCU 1-8 (см. WO 2005/007857); и
- VV-FCU 1, где указанный вирус осповакцины (VV), более конкретно, содержит дефектный ген I4L и/или F4L, и дефектный ген J2R (см. WO 2009/065546 и WO 2009/065547).
Во втором предпочтительном воплощении рекомбинантный вирус осповакцины содержит экзогенный ген, кодирующий рибозим, способный расщеплять целевую РНК или ДНК. Целевая РНК или ДНК, подлежащая расщеплению, может представлять собой РНК или ДНК, которая является существенной для функции клетки, и ее расщепление приводит к гибели клетки, или РНК или ДНК, подлежащая расщеплению, может представлять собой РНК или ДНК, которая кодирует нежелательный белок, например, онкогенный продукт, и расщепление данной РНК или ДНК может предупреждать то, что клетка станет раковой.
В третьем предпочтительном воплощении рекомбинантный вирус группы оспы (в частности, вирус осповакцины) содержит экзогенную последовательность, кодирующую антисмысловую РНК. Под «антисмысловой РНК» авторы изобретения подразумевают молекулу РНК, которая гибридизуется с молекулой мРНК и препятствует экспрессии от данной молекулы мРНК, кодирующей белок, или с другой молекулой РНК в клетке, такой как пред-мРНК или тРНК, или рРНК, или гибридизуется с геном и препятствует экспрессии от данного гена.
В четвертом предпочтительном воплощении рекомбинантный вирус группы оспы (в частности, вирус осповакцины) содержит экзогенную последовательность, заменяющую функцию дефектного гена в клетке-мишени. Существует несколько тысяч наследственных генетических заболеваний млекопитающих, включая человека, которые вызваны дефектными генами. Примеры таких генетических заболеваний включают муковисцидоз, где известна мутация в гене CFTR; мышечную дистрофию Дюшенна, где известна мутация в гене дистрофина; серповидно-клеточную анемию, где известна мутация в гене HbA. Многие типы рака вызываются дефектными генами, особенно протоонкогенами, и генами суппрессоров опухоли, которые подверглись мутации. Примерами протоонкогенов являются ras, src, bcl и так далее; примерами генов суппрессоров опухоли являются р53 и Rb.
В пятом предпочтительном воплощении рекомбинантный вирус группы оспы (в частности, вирус осповакцины) содержит экзогенную последовательность, кодирующую антиген, ассоциированный с опухолью (ТАА). ТАА относится к молекуле, которая выявляется в опухолевых клетках с большей частотой или плотностью, чем в неопухолевых клетках того же самого типа ткани. Примеры ТАА включают СЕА, MART1, MAGE1, MAGE3, GP-100, MUC1 (см. WO 92/07000, WO 95/09241 и ROCHLITZ et al. J Gene Med. 2003 Aug;5(8):690-9, включенные в данный документ посредством ссылки), MUC2, онкоген ras с точечной мутацией, р53 - нормальный или с точечной мутацией, сверхэкспрессируемый р53, СА-125, PSA, C-erb/B2, BRCA I, BRCA II, PSMA, тирозиназу, TRP1, TRP2, NY-ESO-1, TAG72, KSA, HER- 2/neu, bcr-abl, рах3-fkhr, ews-fli-1, сурвивин и LRP, но не ограничиваются ими. Согласно более предпочтительному воплощению ТАА представляет собой MUC1.
В шестом предпочтительном воплощении рекомбинантный вирус группы оспы (в частности, вирус осповакцины) содержит экзогенный ген, кодирующий антиген. Термин «антиген» в том виде, в котором он используется в данном документе, относится к лиганду, который может быть связан антителом; сам антиген не обязательно должен быть иммуногенным. Предпочтительно антиген происходит из следующих:

Например, антиген может происходить из:











Согласно более предпочтительному воплощению антиген выбран из антигенов HCV, HPV или микобактерий (в частности, Mycobacterium tuberculosis и Mycobacterium bovis) и, в частности, антигенов, упомянутых выше. В данном отношении предпочтительный рекомбинантный вирус осповакцины, присутствующий в жидких препаратах согласно изобретению, представляет собой MVA-HCV (см. WO 2004/111082), также именуемый TG4040, кодирующий антигены HCV NS3, NS4 и NS5B.
Естественно, рекомбинантный вирус группы оспы (в частности, вирус осповакцины), присутствующий в жидких препаратах согласно изобретению, может содержать более чем одну экзогенную последовательность, и каждая экзогенная последовательность может кодировать более чем одну молекулу.
Например, в том же самом рекомбинантном вирусе группы оспы (в частности, вирусе осповакцины) может быть полезным ассоциировать:


В данном отношении предпочтительными рекомбинантными вирусами осповакцины, присутствующими в жидких препаратах согласно изобретению, являются:
- MVA-[MUC1-IL2] (см. WO 92/07000 и WO 95/09241), также именуемый TG4010, кодирующий ТАА MUC1 и человеческий IL-2; и
- MVA-[HPV-IL2] (см. WO 90/10459, WO 95/09241, WO 98/04705, WO 99/03885, WO 2007/121894), также именуемый TG4001, кодирующий неонкогенные полипептиды Е6 и Е7 HPV-16 и человеческий IL-2.
Другим примером полезной ассоциации двух экзогенных последовательностей в том же самом векторе на основе вируса группы оспы (в частности, вируса осповакцины) является вектор на основе вируса группы оспы (в частности, вируса осповакцины), включающий:


В данном отношении предпочтительным рекомбинантным вирусом осповакцины, присутствующим в жидких препаратах согласно изобретению, является вирус осповакцины (предпочтительно штамм Wyeth), дефектный в отношении гена J2R и содержащий экзогенную последовательность, кодирующую гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) (см. KIM JH et al., 2006 Sep, Mol Ther., 14(3):361-70 и BREITBACH CJ et al., 2011, Curr Pharm Biotechnol. Vol 12. No 12).
Способы получения и очистки вирусов группы оспы и, в частности, вируса осповакцины, известны специалистам в данной области. Например, способы получения и очистки вирусов группы оспы и, в частности, вируса осповакцины раскрыты в WO 2007/147528 и WO 2010/130753, которые включены в данный документ посредством ссылки.
Вирус осповакцины, в частности, может быть сначала амплифицирован посредством:
а) получения культуры упаковывающих клеток;
б) инфицирования культуры упаковывающих клеток вирусом осповакцины;
в) культивирования инфицированных упаковывающих клеток до получения потомства вируса осповакцины и
г) отбора продуцированного вируса осповакцины из супернатанта культуры и/или упаковывающих клеток.
На стадии а) подходящие упаковывающие клетки зависят от типа вируса осповакцины, подлежащего амплификации.
MVA является строго ограничиваемым хозяином и может быть амплифицирован на клетках птиц: либо на первичных клетках птиц (таких как фибробласты эмбрионов курицы или CEF), либо на линии сделанных бессмертными клеток птиц и, в частности:





Для других штаммов вируса осповакцины или других вирусов группы оспы, помимо первичных клеток птиц (таких как CEF - «фибробласты эмбрионов курицы» - также именуемых СЕС или «клетки эмбриона курицы») и линий клеток птиц, для амплификации доступны многие другие линии клеток, не являющихся клетками птиц, включающие HeLa, BHK-21 (клетки почки новорожденного хомяка 21), MRC-5, HEK-293 (клетки эмбриональной почки человека-293) и клетки Vero. В предпочтительном воплощении вирус осповакцины, отличный от MVA, амплифицируется в клетках HeLa.
Упаковывающие клетки предпочтительно культивируются в среде, не содержащей продуктов животного или человеческого происхождения, с использованием химически определенной среды без продукта животного или человеческого происхождения. В частности, в то время как могут присутствовать факторы роста, они предпочтительно продуцируются рекомбинантно, а не очищаются из животного материала. Подходящая среда, не содержащая животных компонентов, может быть легко выбрана специалистами в данной области, в зависимости от выбранных упаковывающих клеток. Такие среды имеются в продаже. В частности, при использовании CEF в качестве упаковывающих клеток, они могут культивироваться в среде для культуры клеток VP-SFM (Invitrogen). CEF также предпочтительно культивируются в течение 1-5 суток, более предпочтительно - от 1 до 2 суток и даже более предпочтительно - 2 суток до инфицирования. Кроме того, CEF предпочтительно культивируются при температуре, составляющей от +30°С до +37°С. При использовании сделанных бессмертными линий клеток, не являющихся птичьими, они предпочтительно культивируются в течение 2-7 суток до инфицирования. Если необходимо большое число сделанных бессмертными клеток, не являющихся птичьими, может быть сделано несколько пассажей с продолжительностью 2-7 суток для того, чтобы увеличить общее число клеток. Кроме того, сделанные бессмертными клетки, не являющиеся птичьими, предпочтительно культивируются при температуре, составляющей от +36°С до +38°С, более предпочтительно - при примерно +37°С.
На стадии б) упаковывающие клетки инфицируются вирусом группы оспы (в частности, вирусом осповакцины) при подходящих условиях (в частности, с использованием подходящей множественности инфекции (МОИ)) для обеспечения продуктивной инфекции упаковывающих клеток. В частности, когда вирус осповакцины представляет собой MVA (в частности, вирусы, раскрытые в WO 90/10459, WO 92/07000, WO 95/09241, WO 98/04705, WO 99/03885, WO 2004/111082, WO 2007/121894, WO 2014/009438 и WO 2014/009433) и амплифицируется с использованием CEF, он может высеваться в культуральный сосуд для клеток, содержащий CEF при МОИ, которая предпочтительно составляет от 0,001 до 0,1, более предпочтительно - от 0,03 до 0,07 и даже более предпочтительно примерно 0,05. В том, что касается других штаммов вируса осповакцины, в частности, онколитического вируса осповакцины, такого как штаммы Wyeth и Copenhagen (а именно, штаммы, раскрытые в WO 2007/030668, WO 2008/113078, WO 2009/065546, WO 2009/065547), вирус осповакцины может быть высеян в сосуд для культуры клеток, содержащий упаковывающие клетки при МОИ, которая предпочтительно составляет от 0,0001 до 0,1 и, более предпочтительно - примерно 0,0001. Стадия инфицирования также предпочтительно проводится в среде (которая может быть такой же или другой, чем среда, используемая для культуры упаковывающих клеток), не содержащей продуктов животного или человеческого происхождения, с использованием химически определенной среды без продукта животного или человеческого происхождения. Для MVA в CEF культуральная среда, используемая на стадии б), предпочтительно представляет собой базальную среду, а именно, базальную среду для культуры клеток Игла (Invitrogen).
На стадии в) инфицированные упаковывающие клетки затем культивируются при подходящих условиях, хорошо известных специалистам в данной области, пока не продуцируется потомство вируса группы оспы (в частности, вируса осповакцины). Культивирование инфицированных упаковывающих клеток также предпочтительно проводится в среде (которая может быть такой же или отличной от среды, используемой для культивирования упаковывающих клеток и/или стадии инфицирования), не содержащей продуктов животного или человеческого происхождения, с использованием химически определенной среды без продукта животного или человеческого происхождения. Для MVA, амплифицированного на CEF, CEF, в частности, могут культивироваться в базальной среде, в частности, базальной среде для культуры клеток Игла (Invitrogen) при температуре от +33°С до +37°С на протяжении 1-4 суток. Для других штаммов вируса осповакцины, продуцированных в сделанной бессмертной линии клеток, не являющихся клетками птиц, стадию в) можно, в частности, проводить при температуре от +35°С до +38°С на протяжении 1-4 суток.
На стадии г) вирус группы оспы (в частности, вирус осповакцины), продуцированный на стадии в), отбирают из супернатанта культуры и/или упаковывающих клеток. При отборе вируса группы оспы (в частности, вируса осповакцины) из упаковывающих клеток (и возможно также из супернатанта культуры) стадии, г) может предшествовать стадия, обеспечивающая разрушение мембраны упаковывающей клетки. Данная стадия приводит к высвобождению вируса группы оспы (в частности, вируса осповакцины) из упаковывающих клеток. Разрушение мембраны упаковывающих клеток может индуцироваться разными методиками, хорошо известными специалистам в данной области, включающими замораживание/оттаивание, гипотонический лизис, обработку ультразвуком, микропсевдоожижение или гомогенизацию при высокой скорости, но не ограничивающимися ими.
Вирус группы оспы (в частности, вирус осповакцины) можно затем дополнительно очищать с использованием этапов очистки, хорошо известных в данной области, таких как:



В предпочтительном воплощении настоящего изобретения вирус осповакцины, присутствующий в препарате, представляет собой вирус MVA (в частности, вирусы, раскрытые в WO 90/10459, WO 92/07000, WO 95/09241, WO 98/04705, WO 99/03885, WO 2004/111082, WO 2007/121894, WO 2014/009438 и WO 2014/009433), амплифицированный на CEF, более предпочтительно вирус MVA (в частности, вирусы, раскрытые в WO 90/10459, WO 92/07000, WO 95/09241, WO 98/04705, WO 99/03885, WO 2004/111082, WO 2007/121894, WO 2014/009438 и WO 2014/009433), амплифицированный на CEF, и который не подвергался стадии обработки по меньшей мере одной протеазой.
В другом предпочтительном воплощении вирус осповакцины, присутствующий в препарате, представляет собой вирус MVA (в частности, вирусы, раскрытые в WO 90/10459, WO 92/07000, WO 95/09241, WO 98/04705, WO 99/03885, WO 2004/111082, WO 2007/121894, WO 2014/009438 и WO 2014/009433), амплифицированные на сделанной бессмертной линии клеток птиц (включая сделанную бессмертной линию клеток птиц Cairina moschata, содержащую последовательность нуклеиновой кислоты, кодирующую обратную транскриптазу теломеразы (TERT), сделанную бессмертной линию клеток птиц Cairina moschata, содержащую последовательность нуклеиновой кислоты Е1А и последовательность нуклеиновой кислоты, кодирующую обратную транскриптазу теломеразы (TERT), линию клеток DF1, линию клеток Ebx или линию клеток DEC 99), более предпочтительно, вирус MVA (в частности, вирусы, раскрытые в WO 90/10459, WO 92/07000, WO 95/09241, WO 98/04705, WO 99/03885, WO 2004/111082, WO 2007/121894, WO 2014/009438 и WO 2014/009433), амплифицированный на сделанной бессмертной линии клеток птиц (включая линии клеток, упомянутые выше), которая не подвергалась по меньшей мере одной стадии обработки по меньшей мере одной протеазой.
В другом предпочтительном воплощении вирус осповакцины, присутствующий в препарате, представляет собой вирус осповакцины Wyeth или Copenhagen (в частности, вирусы, раскрытые в WO 2007/030668, WO 2008/113078, WO 2009/065546, WO 2009/065547), амплифицированные в клетках Hela, более предпочтительно вирус осповакцины Wyeth или Copenhagen (в частности, вирусы, раскрытые в WO 2007/030668, WO 2008/113078, WO 2009/065546, WO 2009/065547), амплифицированные в клетках Hela, которые были подвергнуты по меньшей мере одной стадии обработки по меньшей мере одной протеазой.
рН и буфер
Жидкие препараты согласно изобретению имеют рН, составляющий от 6,5 до 8,5. В частности, жидкие препараты согласно изобретению могут иметь рН, составляющий от 6,5 до 8,4; от 6,5 до 8,3; от 6,5 до 8,2; от 6,5 до 8,1; от 6,5 до 8,0; от 6,5 до 7,9; от 6,5 до 7,8; от 6,5 до 7,7; от 6,5 до 7,6; от 6,5 до 7,5; от 6,6 до 8,5; от 6,6 до 8,4; от 6,6 до 8,3; от 6,6 до 8,2; от 6,6 до 8,1; от 6,6 до 8,0; от 6,6 до 7,9; от 6,6 до 7,8; от 6,6 до 7,7; от 6,6 до 7,6; от 6,6 до 7,5; от 6,7 до 8,5; от 6,7 до 8,4; от 6,7 до 8,3; от 6,7 до 8,2; от 6,7 до 8,1; от 6,7 до 8,0; от 6,7 до 7,9; от 6,7 до 7,8; от 6,7 до 7,7; от 6,7 до 7,6; от 6,7 до 7,5; от 6,8 до 8,5; от 6,8 до 8,4; от 6,8 до 8,3; от 6,8 до 8,2; от 6,8 до 8,1; от 6,8 до 8,0; от 6,8 до 7,9; от 6,8 до 7,8; от 6,8 до 7,7; от 6,8 до 7,6; от 6,8 до 7,5; от 6,9 до 8,5; от 6,9 до 8,4; от 6,9 до 8,3; от 6,9 до 8,2; от 6,9 до 8,1; от 6,9 до 8,0; от 6,9 до 7,9; от 6,9 до 7,8; от 6,9 до 7,7; от 6,9 до 7,6; от 6,9 до 7,5; от 7 до 8,5; от 7 до 8,4; от 7 до 8,3; от 7 до 8,2; от 7 до 8,1; от 7 до 8; от 7 до 7,9; от 7 до 7,8; от 7 до 7,7; от 7 до 7,6; от 7 до 7,5; от 7,1 до 8,5; от 7,1 до 8,4; от 7,1 до 8,3; от 7,1 до 8,2; от 7,1 до 8,1; от 7,1 до 8; от 7,1 до 7,9; от 7,1 до 7,8; от 7,1 до 7,7; от 7,1 до 7,6; от 7,1 до 7,5; от 7,2 до 8,5; от 7,2 до 8,4; от 7,2 до 8,3; от 7,2 до 8,2; от 7,2 до 8,1; от 7,2 до 8; от 7,2 до 7,9; от 7,2 до 7,8; от 7,2 до 7,7; от 7,2 до 7,6; от 7,2 до 7,5; от 7,3 до 8,5; от 7,3 до 8,4; от 7,3 до 8,3; от 7,3 до 8,2; от 7,3 до 8,1; от 7,3 до 8; от 7,3 до 7,9; от 7,3 до 7,8; от 7,3 до 7,7; от 7,3 до 7,6; от 7,3 до 7,5; от 7,4 до 8,5; от 7,4 до 8,4; от 7,4 до 8,3; от 7,4 до 8,2; от 7,4 до 8,1; от 7,4 до 8; от 7,4 до 7,9; от 7,4 до 7,8; от 7,4 до 7,7; от 7,4 до 7,6; от 7,4 до 7,5; от 7,5 до 8,5; от 7,5 до 8,4; от 7,5 до 8,3; от 7,5 до 8,2; от 7,5 до 8,1; от 7,5 до 8; от 7,5 до 7,9; от 7,5 до 7,8; от 7,5 до 7,7 или от 7,5 до 7,6. Предпочтительно жидкие препараты согласно изобретению имеют рН от 7 до 8 и, более конкретно, около 7,5, в частности, составляющий от 7,2 до 7,8; от 7,3 до 7,7; от 7,4 до 7,6 или примерно 7,5.
Для того чтобы поддерживать данный рН, жидкие препараты согласно изобретению содержат буфер с буферной емкостью при рН препарата. Такие буферы хорошо известны специалистам в данной области и, в частности, включают следующие буферы:



















Предпочтительно указанный буфер выбран из TRIS-HCl, TRIS, трицина, HEPES и фосфатного буфера, содержащего смесь Na2HPO4 и KH2PO4 или смесь Na2HPO4 и NaH2PO4. Более предпочтительно указанный буфер выбран из буфера TRIS-HCl, TRIS или трицина, и более предпочтительно указанный буфер представляет собой буфер TRIS-HCl или TRIS, даже более предпочтительно указанный буфер представляет собой буфер TRIS-HCl.
Указанный буфер (в частности, буферы, упомянутые выше, и, в частности, TRIS-HCl) предпочтительно присутствует в концентрации от 10 до 50 мМ. В частности, он может присутствовать в концентрации от 10 до 45 мМ, от 10 до 40 мМ, от 10 до 35 мМ, от 10 до 30 мМ, от 10 до 25 мМ, от 10 до 20 мМ, от 10 до 15 мМ, от 15 до 50 мМ, от 15 до 45 мМ, от 15 до 40 мМ, от 15 до 35 мМ, от 15 до 30 мМ, от 15 до 25 мМ, от 15 до 20 мМ, от 20 до 50 мМ, от 20 до 45 мМ, от 20 до 40 мМ, от 20 до 35 мМ, от 20 до 30 мМ, от 20 до 25 мМ, от 25 до 50 мМ, от 25 до 45 мМ, от 25 до 40 мМ, от 25 до 35 мМ, от 25 до 30 мМ, от 30 до 50 мМ, от 30 до 45 мМ, от 30 до 40 мМ, от 30 до 35 мМ, от 35 до 50 мМ, от 35 до 45 мМ, от 35 до 40 мМ, от 40 до 50 мМ, от 40 до 45 мМ или от 45 до 50 мМ. Предпочтительно указанный буфер (в частности, буферы, упомянутые выше, и, в частности, TRIS-HCl) предпочтительно присутствует в концентрации от 10 до 40 мМ, в частности, от 10 до 30 мМ.
Одновалентная соль
Жидкие препараты согласно изобретению содержат одновалентную соль. Считается, что данная одновалентная соль обеспечивает подходящее осмотическое давление. Кроме того, также считается, что указанная одновалентная соль имеет свойства ингибирования протеаз, которые могут присутствовать в препарате, таким образом, улучшая стабильность. Такие протеазы, включают клеточные протеазы, высвобождаемые при разрушении упаковывающих клеток, и также, при очистке вируса осповакцины, присутствующего в препарате, способом, включающим применение протеазы, оставляющим следы указанной добавленной протеазы. Ингибирующий эффект значительной концентрации одновалентных солей на протеазы был задокументирован в данной области (см.

Указанная одновалентная соль, в частности, может быть выбрана из NaCl и KCl, предпочтительно указанная одновалентная соль представляет собой NaCl.
Указанная одновалентная соль (в частности, NaCl) предпочтительно присутствует в концентрации от 10 до 1000 мМ. В частности, она может присутствовать в концентрации от 10 до 950 мМ, от 10 до 900 мМ, от 10 до 850 мМ, от 10 до 800 мМ, от 10 до 750 мМ, от 10 до 700 мМ, от 10 до 650 мМ, от 10 до 600 мМ, от 10 до 550 мМ, от 10 до 500 мМ, от 10 до 450 мМ, от 10 до 400 мМ, от 10 до 350 мМ, от 10 до 300 мМ, от 10 до 250 мМ, от 10 до 200 мМ, от 10 до 150 мМ, от 10 до 100 мМ, от 10 до 90 мМ, от 10 до 80 мМ, от 10 до 75 мМ, от 10 до 70 мМ, от 10 до 60 мМ, от 10 до 50 мМ, от 10 до 40 мМ, от 10 до 30 мМ, от 10 до 25 мМ, от 10 до 20 мМ, от 20 до 1000 мМ, от 20 до 950 мМ, от 20 до 900 мМ, от 20 до 850 мМ, от 20 до 800 мМ, от 20 до 750 мМ, от 20 до 700 мМ, от 20 до 650 мМ, от 20 до 600 мМ, от 20 до 550 мМ, от 20 до 500 мМ, от 20 до 450 мМ, от 20 до 400 мМ, от 20 до 350 мМ, от 20 до 300 мМ, от 20 до 250 мМ, от 20 до 200 мМ, от 20 до 150 мМ, от 20 до 100 мМ, от 20 до 90 мМ, от 20 до 80 мМ, от 20 до 75 мМ, от 20 до 70 мМ, от 20 до 60 мМ, от 20 до 50 мМ, от 20 до 40 мМ, от 20 до 30 мМ, от 20 до 25 мМ, от 25 до 1000 мМ, от 25 до 950 мМ, от 25 до 900 мМ, от 25 до 850 мМ, от 25 до 800 мМ, от 25 до 750 мМ, от 25 до 700 мМ, от 25 до 650 мМ, от 25 до 600 мМ, от 25 до 550 мМ, от 25 до 500 мМ, от 25 до 450 мМ, от 25 до 400 мМ, от 25 до 350 мМ, от 25 до 300 мМ, от 25 до 250 мМ, от 25 до 200 мМ, от 25 до 150 мМ, от 25 до 100 мМ, от 25 до 90 мМ, от 25 до 80 мМ, от 25 до 75 мМ, от 25 до 70 мМ, от 25 до 60 мМ, от 25 до 50 мМ, от 25 до 40 мМ, от 25 до 30 мМ, от 30 до 1000 мМ, от 30 до 950 мМ, от 30 до 900 мМ, от 30 до 850 мМ, от 30 до 800 мМ, от 30 до 750 мМ, от 30 до 700 мМ, от 30 до 650 мМ, от 30 до 600 мМ, от 30 до 550 мМ, от 30 до 500 мМ, от 30 до 450 мМ, от 30 до 400 мМ, от 30 до 350 мМ, от 30 до 300 мМ, от 30 до 250 мМ, от 30 до 200 мМ, от 30 до 150 мМ, от 30 до 100 мМ, от 30 до 90 мМ, от 30 до 80 мМ, от 30 до 75 мМ, от 30 до 70 мМ, от 30 до 60 мМ, от 30 до 50 мМ, от 30 до 40 мМ, от 40 до 1000 мМ, от 40 до 950 мМ, от 40 до 900 мМ, от 40 до 850 мМ, от 40 до 800 мМ, от 40 до 750 мМ, от 40 до 700 мМ, от 40 до 650 мМ, от 40 до 600 мМ, от 40 до 550 мМ, от 40 до 500 мМ, от 40 до 450 мМ, от 40 до 400 мМ, от 40 до 350 мМ, от 40 до 300 мМ, от 40 до 250 мМ, от 40 до 200 мМ, от 40 до 150 мМ, от 40 до 100 мМ, от 40 до 90 мМ, от 40 до 80 мМ, от 40 до 75 мМ, от 40 до 70 мМ, от 40 до 60 мМ, от 40 до 50 мМ, от 50 до 1000 мМ, от 50 до 950 мМ, от 50 до 900 мМ, от 50 до 850 мМ, от 50 до 800 мМ, от 50 до 750 мМ, от 50 до 700 мМ, от 50 до 650 мМ, от 50 до 600 мМ, от 50 до 550 мМ, от 50 до 500 мМ, от 50 до 450 мМ, от 50 до 400 мМ, от 50 до 350 мМ, от 50 до 300 мМ, от 50 до 250 мМ, от 50 до 200 мМ, от 50 до 150 мМ, от 50 до 100 мМ, от 50 до 90 мМ, от 50 до 80 мМ, от 50 до 75 мМ, от 50 до 70 мМ, от 50 до 60 мМ, от 60 до 1000 мМ, от 60 до 950 мМ, от 60 до 900 мМ, от 60 до 850 мМ, от 60 до 800 мМ, от 60 до 750 мМ, от 60 до 700 мМ, от 60 до 650 мМ, от 60 до 600 мМ, от 60 до 550 мМ, от 60 до 500 мМ, от 60 до 450 мМ, от 60 до 400 мМ, от 60 до 350 мМ, от 60 до 300 мМ, от 60 до 250 мМ, от 60 до 200 мМ, от 60 до 150 мМ, от 60 до 100 мМ, от 60 до 90 мМ, от 60 до 80 мМ, от 60 до 75 мМ, от 60 до 70 мМ, от 70 до 1000 мМ, от 70 до 950 мМ, от 70 до 900 мМ, от 70 до 850 мМ, от 70 до 800 мМ, от 70 до 750 мМ, от 70 до 700 мМ, от 70 до 650 мМ, от 70 до 600 мМ, от 70 до 550 мМ, от 70 до 500 мМ, от 70 до 450 мМ, от 70 до 400 мМ, от 70 до 350 мМ, от 70 до 300 мМ, от 70 до 250 мМ, от 70 до 200 мМ, от 70 до 150 мМ, от 70 до 100 мМ, от 70 до 90 мМ, от 70 до 80 мМ, от 70 до 75 мМ, от 75 до 1000 мМ, от 75 до 950 мМ, от 75 до 900 мМ, от 75 до 850 мМ, от 75 до 800 мМ, от 75 до 750 мМ, от 75 до 700 мМ, от 75 до 650 мМ, от 75 до 600 мМ, от 75 до 550 мМ, от 75 до 500 мМ, от 75 до 450 мМ, от 75 до 400 мМ, от 75 до 350 мМ, от 75 до 300 мМ, от 75 до 250 мМ, от 75 до 200 мМ, от 75 до 150 мМ, от 75 до 100 мМ, от 75 до 90 мМ, от 75 до 80 мМ, от 80 до 1000 мМ, от 80 до 950 мМ, от 80 до 900 мМ, от 80 до 850 мМ, от 80 до 800 мМ, от 80 до 750 мМ, от 80 до 700 мМ, от 80 до 650 мМ, от 80 до 600 мМ, от 80 до 550 мМ, от 80 до 500 мМ, от 80 до 450 мМ, от 80 до 400 мМ, от 80 до 350 мМ, от 80 до 300 мМ, от 80 до 250 мМ, от 80 до 200 мМ, от 80 до 150 мМ, от 80 до 100 мМ, от 80 до 90 мМ, от 90 до 1000 мМ, от 90 до 950 мМ, от 90 до 900 мМ, от 90 до 850 мМ, от 90 до 800 мМ, от 90 до 750 мМ, от 90 до 700 мМ, от 90 до 650 мМ, от 90 до 600 мМ, от 90 до 550 мМ, от 90 до 500 мМ, от 90 до 450 мМ, от 90 до 400 мМ, от 90 до 350 мМ, от 90 до 300 мМ, от 90 до 250 мМ, от 90 до 200 мМ, от 90 до 150 мМ, от 90 до 100 мМ, от 100 до 1000 мМ, от 100 до 950 мМ, от 100 до 900 мМ, от 100 до 850 мМ, от 100 до 800 мМ, от 100 до 750 мМ, от 100 до 700 мМ, от 100 до 650 мМ, от 100 до 600 мМ, от 100 до 550 мМ, от 100 до 500 мМ, от 100 до 450 мМ, от 100 до 400 мМ, от 100 до 350 мМ, от 100 до 300 мМ, от 100 до 250 мМ, от 100 до 200 мМ, от 100 до 150 мМ, от 150 до 1000 мМ, от 150 до 950 мМ, от 150 до 900 мМ, от 150 до 850 мМ, от 150 до 800 мМ, от 150 до 750 мМ, от 150 до 700 мМ, от 150 до 650 мМ, от 150 до 600 мМ, от 150 до 550 мМ, от 150 до 500 мМ, от 150 до 450 мМ, от 150 до 400 мМ, от 150 до 350 мМ, от 150 до 300 мМ, от 150 до 250 мМ, от 150 до 200 мМ, от 200 до 1000 мМ, от 200 до 950 мМ, от 200 до 900 мМ, от 200 до 850 мМ, от 200 до 800 мМ, от 200 до 750 мМ, от 200 до 700 мМ, от 200 до 650 мМ, от 200 до 600 мМ, от 200 до 550 мМ, от 200 до 500 мМ, от 200 до 450 мМ, от 200 до 400 мМ, от 200 до 350 мМ, от 200 до 300 мМ, от 200 до 250 мМ, от 250 до 1000 мМ, от 250 до 950 мМ, от 250 до 900 мМ, от 250 до 850 мМ, от 250 до 800 мМ, от 250 до 750 мМ, от 250 до 700 мМ, от 250 до 650 мМ, от 250 до 600 мМ, от 250 до 550 мМ, от 250 до 500 мМ, от 250 до 450 мМ, от 250 до 400 мМ, от 250 до 350 мМ, от 250 до 300 мМ, от 300 до 1000 мМ, от 300 до 950 мМ, от 300 до 900 мМ, от 300 до 850 мМ, от 300 до 800 мМ, от 300 до 750 мМ, от 300 до 700 мМ, от 300 до 650 мМ, от 300 до 600 мМ, от 300 до 550 мМ, от 300 до 500 мМ, от 300 до 450 мМ, от 300 до 400 мМ, от 300 до 350 мМ, от 350 до 1000 мМ, от 350 до 950 мМ, от 350 до 900 мМ, от 350 до 850 мМ, от 350 до 800 мМ, от 350 до 750 мМ, от 350 до 700 мМ, от 350 до 650 мМ, от 350 до 600 мМ, от 350 до 550 мМ, от 350 до 500 мМ, от 350 до 450 мМ, от 350 до 400 мМ, от 400 до 1000 мМ, от 400 до 950 мМ, от 400 до 900 мМ, от 400 до 850 мМ, от 400 до 800 мМ, от 400 до 750 мМ, от 400 до 700 мМ, от 400 до 650 мМ, от 400 до 600 мМ, от 400 до 550 мМ, от 400 до 500 мМ, от 400 до 450 мМ, от 450 до 1000 мМ, от 450 до 950 мМ, от 450 до 900 мМ, от 450 до 850 мМ, от 450 до 800 мМ, от 450 до 750 мМ, от 450 до 700 мМ, от 450 до 650 мМ, от 450 до 600 мМ, от 450 до 550 мМ или от 450 до 500 мМ.
MVA (в частности, MVA, раскрытые в WO 90/10459, WO 92/07000, WO 95/09241, WO 98/04705, WO 99/03885, WO 2004/111082, WO 2007/121894, WO 2014/009438 и WO 2014/009433) обычно амплифицируется в первичных клетках птиц, причем в данном случае не нужна обработка протеазой для устранения белков первичных клеток птиц, так как первичные клетки не считаются опасными. Таким образом, для MVA и, в более общем случае, когда вирус группы оспы (предпочтительно вирус осповакцины), присутствующий в препарате, был очищен способом, который не включает обработку по меньшей мере одной протеазой, указанная одновалентная соль (в частности, NaCl) может присутствовать в относительно низкой концентрации, а именно: в концентрации от 10 до 200 мМ, от 10 до 150 мМ, от 10 до 100 мМ, от 10 до 90 мМ, от 10 до 80 мМ, от 10 до 75 мМ, от 20 до 200 мМ, от 20 до 150 мМ, от 20 до 100 мМ, от 20 до 90 мМ, от 20 до 80 мМ, от 20 до 75 мМ, от 25 до 200 мМ, от 25 до 150 мМ, от 25 до 100 мМ, от 25 до 90 мМ, от 25 до 80 мМ, от 25 до 75 мМ, от 30 до 200 мМ, от 30 до 150 мМ, от 30 до 100 мМ, от 30 до 90 мМ, от 30 до 80 мМ, от 30 до 75 мМ, от 40 до 200 мМ, от 40 до 150 мМ, от 40 до 100 мМ, от 40 до 90 мМ, от 40 до 80 мМ, от 40 до 75 мМ, от 50 до 200 мМ, от 50 до 150 мМ, от 50 до 100 мМ, от 50 до 90 мМ, от 50 до 80 мМ, от 50 до 75 мМ, от 60 до 200 мМ, от 60 до 150 мМ, от 60 до 100 мМ, от 60 до 90 мМ, от 60 до 80 мМ, от 60 до 75 мМ, от 70 до 200 мМ, от 70 до 150 мМ, от 70 до 100 мМ, от 70 до 90 мМ, от 70 до 80 мМ или от 70 до 75 мМ, более предпочтительно - в концентрации, близкой к 75 мМ, такой как от 50 до 100 мМ, от 60 до 90 мМ, от 70 до 80 мМ или примерно 75 мМ.
Другие штаммы вирусов группы оспы и, в частности, онколитические вирусы осповакцины, такие как вирус осповакцины Wyeth или Copenhagen (в частности, штаммы, раскрытые в WO 2007/030668, WO 2008/113078, WO 2009/065546, WO 2009/065547), обычно амплифицируются на разных линиях клеток, сделанных бессмертными. Некоторые из этих линий клеток могут содержать онкогены, и в данном случае власти в сфере здравоохранения требуют устранения или по меньшей мере радикального уменьшения уровня ДНК и белков продуцирующих клеток. С этой целью способ очистки обычно включает по меньшей мере одну стадию обработки по меньшей мере одной протеазой. Остающиеся следы протеазы(аз) могут, особенно в жидком препарате, иметь вредные эффекты на стабильность вируса осповакцины. В данном отношении авторы изобретения обнаружили то, что увеличение концентрации указанной одновалентной соли (в частности, NaCl) приводит к улучшенной стабильности вируса осповакцины. Не будучи связанными теорией, считается, что повышенная концентрация указанной одновалентной соли (в частности, NaCl) имеет ингибирующий эффект на остающиеся следы протеазы(аз).
Следовательно, когда вирус группы оспы (в частности, вирус осповакцины), присутствующий в препарате, был очищен способом, который включает по меньшей мере одну стадию обработки по меньшей мере одной протеазой, указанная одновалентная соль (в частности, NaCl) предпочтительно присутствует в концентрации от 100 до 1000 мМ, от 100 до 950 мМ, от 100 до 900 мМ, от 100 до 850 мМ, от 100 до 800 мМ, от 100 до 750 мМ, от 100 до 700 мМ, от 100 до 650 мМ, от 100 до 600 мМ, от 100 до 550 мМ, от 100 до 500 мМ, от 100 до 450 мМ, от 100 до 400 мМ, от 100 до 350 мМ, от 100 до 300 мМ, от 100 до 250 мМ, от 100 до 200 мМ, от 150 до 1000 мМ, от 150 до 950 мМ, от 150 до 900 мМ, от 150 до 850 мМ, от 150 до 800 мМ, от 150 до 750 мМ, от 150 до 700 мМ, от 150 до 650 мМ, от 150 до 600 мМ, от 150 до 550 мМ, от 150 до 500 мМ, от 150 до 450 мМ, от 150 до 400 мМ, от 150 до 350 мМ, от 150 до 300 мМ, от 150 до 250 мМ, от 150 до 200 мМ, от 200 до 1000 мМ, от 200 до 950 мМ, от 200 до 900 мМ, от 200 до 850 мМ, от 200 до 800 мМ, от 200 до 750 мМ, от 200 до 700 мМ, от 200 до 650 мМ, от 200 до 600 мМ, от 200 до 550 мМ, от 200 до 500 мМ, от 200 до 450 мМ, от 200 до 400 мМ, от 200 до 350 мМ, от 200 до 300 мМ, от 200 до 250 мМ, от 250 до 1000 мМ, от 250 до 950 мМ, от 250 до 900 мМ, от 250 до 850 мМ, от 250 до 800 мМ, от 250 до 750 мМ, от 250 до 700 мМ, от 250 до 650 мМ, от 250 до 600 мМ, от 250 до 550 мМ, от 250 до 500 мМ, от 250 до 450 мМ, от 250 до 400 мМ, от 250 до 350 мМ, от 250 до 300 мМ, от 300 до 1000 мМ, от 300 до 950 мМ, от 300 до 900 мМ, от 300 до 850 мМ, от 300 до 800 мМ, от 300 до 750 мМ, от 300 до 700 мМ, от 300 до 650 мМ, от 300 до 600 мМ, от 300 до 550 мМ, от 300 до 500 мМ, от 300 до 450 мМ, от 300 до 400 мМ, от 300 до 350 мМ, от 350 до 1000 мМ, от 350 до 950 мМ, от 350 до 900 мМ, от 350 до 850 мМ, от 350 до 800 мМ, от 350 до 750 мМ, от 350 до 700 мМ, от 350 до 650 мМ, от 350 до 600 мМ, от 350 до 550 мМ, от 350 до 500 мМ, от 350 до 450 мМ, от 350 до 400 мМ, от 400 до 1000 мМ, от 400 до 950 мМ, от 400 до 900 мМ, от 400 до 850 мМ, от 400 до 800 мМ, от 400 до 750 мМ, от 400 до 700 мМ, от 400 до 650 мМ, от 400 до 600 мМ, от 400 до 550 мМ, от 400 до 500 мМ, от 400 до 450 мМ, от 450 до 1000 мМ, от 450 до 950 мМ, от 450 до 900 мМ, от 450 до 850 мМ, от 450 до 800 мМ, от 450 до 750 мМ, от 450 до 700 мМ, от 450 до 650 мМ, от 450 до 600 мМ, от 450 до 550 мМ или от 450 до 500 мМ. Например, указанная одновалентная соль может присутствовать в концентрации, близкой к 200 мМ, такой как от 100 до 300 мМ, от 150 до 250 мМ или примерно 200 мМ. В качестве альтернативы, указанная одновалентная соль может присутствовать в концентрации, близкой к 500 мМ, такой как от 250 до 750 мМ, от 400 до 600 мМ или примерно 500 мМ. В еще одном другом воплощении указанная одновалентная соль может присутствовать в концентрации, близкой к 750 мМ, такой как от 500 до 1000 мМ, от 700 до 800 мМ или примерно 750 мМ.
Дисахарид или сахароспирт
Жидкие препараты согласно изобретению содержат фармацевтически приемлемый дисахарид или сахароспирт.
Данный фармацевтически приемлемый дисахарид или сахароспирт представляет собой криопротектор, и считается, что он защищает вирус группы оспы (в частности, вирус осповакцины) при низкой температуре хранения, такой как примерно +5°С. Кроме того, такой фармацевтически приемлемый дисахарид или сахароспирт увеличивает вязкость жидкого препарата, что может ограничивать взаимодействия между вирусом группы оспы (в частности, вирусом осповакцины) и потенциально вредными соединениями.
Фармацевтически приемлемый дисахарид или сахароспирт, в частности, может быть выбран из сахарозы, трегалозы, мальтозы, лактозы, маннита и сорбита, предпочтительно указанный фармацевтически приемлемый дисахарид или сахароспирт представляет собой сахарозу.
Фармацевтически приемлемый дисахарид или сахароспирт (в частности, дисахариды и сахароспирты, упомянутые выше, и, в частности, сахароза) предпочтительно присутствуют в концентрации от 5 до 20% (масса в г, поделенная на объем в л, что называется масс./об.). В частности, он может присутствовать в концентрации от 5 до 19% (масс./об.), от 5 до 18% (масс./об.), от 5 до 17% (масс./об.), от 5 до 16% (масс./об.), от 5 до 15% (масс./об.), от 5 до 14% (масс./об.), от 5 до 13% (масс./об.), от 5 до 12% (масс./об.), от 5 до 11% (масс./об.), от 5 до 10% (масс./об.), от 6 до 20% (масс./об.), от 6 до 19% (масс./об.), от 6 до 18% (масс./об.), от 6 до 17% (масс./об.), от 6 до 16% (масс./об.), от 6 до 15% (масс./об.), от 6 до 14% (масс./об.), от 6 до 13% (масс./об.), от 6 до 12% (масс./об.), от 6 до 11% (масс./об.), от 6 до 10% (масс./об.), от 7 до 20% (масс./об.), от 7 до 19% (масс./об.), от 7 до 18% (масс./об.), от 7 до 17% (масс./об.), от 7 до 16% (масс./об.), от 7 до 15% (масс./об.), от 7 до 14% (масс./об.), от 7 до 13% (масс./об.), от 7 до 12% (масс./об.), от 7 до 11% (масс./об.), от 7 до 10% (масс./об.), от 8 до 20% (масс./об.), от 8 до 19% (масс./об.), от 8 до 18% (масс./об.), от 8 до 17% (масс./об.), от 8 до 16% (масс./об.), от 8 до 15% (масс./об.), от 8 до 14% (масс./об.), от 8 до 13% (масс./об.), от 8 до 12% (масс./об.), от 8 до 11% (масс./об.), от 8 до 10% (масс./об.), от 9 до 20% (масс./об.), от 9 до 19% (масс./об.), от 9 до 18% (масс./об.), от 9 до 17% (масс./об.), от 9 до 16% (масс./об.), от 9 до 15% (масс./об.), от 9 до 14% (масс./об.), от 9 до 13% (масс./об.), от 9 до 12% (масс./об.), от 9 до 11% (масс./об.) или от 9 до 10% (масс./об.). Предпочтительно указанный фармацевтически приемлемый дисахарид или сахароспирт (в частности, дисахариды и сахароспирты, упомянутые выше, и, в частности, сахароза) предпочтиельно присутствуют в концентрации, близкой к 10% (масс./об.), такой как, от 5 до 15% (масс./об.), от 6 до 14% (масс./об.), от 7 до 13% (масс./об.), от 8 до 12% (масс./об.), от 9 до 11% (масс./об.) или примерно 10%.
Хелатор
Жидкие препараты согласно изобретению содержат фармацевтически приемлемый хелатор и, в частности, агент, хелатирующий дикатионы.
Причины того, почему указанный фармацевтически приемлемый хелатор улучшает стабильность вируса группы оспы (в частности, вируса осповакцины) в жидком состоянии, в действительности не понятны. В самом деле, как объясняется в разделе предшествующего уровня техники, эффект EDTA на стабильность вируса значительно отличается между разными вирусами, и нельзя легко сделать очевидную классификацию вирусов, для которых EDTA имеет полезный эффект, относительно вирусов, для которых EDTA не имеет полезного или даже имеет вредный эффект. В частности, в то время как значительный полезный эффект был обнаружен для аденовируса (безоболочечный ДНК-вирус, см. EVANS et al. J Pharm Sci. 2004 Oct, 93(10):2458-75 и US 7456009), не было обнаружено значимого полезного эффекта для вируса гриппа (оболочечный РНК-вирус, см. US 2007/0161085), собачьего парвовируса (безоболочечный ДНК-вирус), собачьего аденовируса типа 2 (безоболочечный ДНК-вирус), вируса собачьей чумы (оболочечный РНК-парамиксовирус) и вируса собачьего парагриппа (оболочечный РНК-парамиксовирус) (см. WO 2014/029702). Наконец, вредный эффект был обнаружен для вируса ньюкаслской болезни (оболочечный РНК-парамиксовирус, см. US 7914979).
Однако, как продемонстрировано в экспериментальном разделе, указанный фармацевтически приемлемый хелатор имеет существенную роль в стабилизации вируса группы оспы (в частности, вируса осповакцины) в жидких препаратах согласно настоящему изобретению.
Фармацевтически приемлемый хелатор, в частности, может быть выбран из этилендиаминтетрауксусной кислоты (EDTA), 1,2-бис(о-аминофенокси)этан-N,N,N',N'-тетрауксусной кислоты (ВАРТА), этиленгликольтетрауксусной кислоты (EGTA), димеркаптоянтарной кислоты (DMSA), диэтилентриаминпентауксусной кислоты (DTPA) и 2,3-димеркапто-1-пропансульфоновой кислоты (DMPS), предпочтительно указанный фармацевтически приемлемый хелатор представляет собой EDTA.
Фармацевтически приемлемый хелатор (в частности, хелаторы, упомянутые выше, и, в частности, EDTA) предпочтительно присутствует в концентрации по меньшей мере 50 мкМ. В частности, он может присутствовать в концентрации от 50 до 1000 мкМ, от 50 до 750 мкМ, от 50 до 500 мкМ, от 50 до 400 мкМ, от 50 до 300 мкМ, от 50 до 250 мкМ, от 50 до 200 мкМ, от 50 до 150 мкМ; от 50 до 100 мкМ, от 50 до 75 мкМ, от 75 до 1000 мкМ, от 75 до 750 мкМ, от 75 до 500 мкМ, от 75 до 400 мкМ, от 75 до 300 мкМ, от 75 до 250 мкМ, от 75 до 200 мкМ, от 75 до 150 мкМ; от 75 до 100 мкМ, от 100 до 1000 мкМ, от 100 до 750 мкМ, от 100 до 500 мкМ, от 100 до 400 мкМ, от 100 до 300 мкМ, от 100 до 250 мкМ, от 100 до 200 мкМ, от 100 до 150 мкМ; от 150 до 1000 мкМ, от 150 до 750 мкМ, от 150 до 500 мкМ, от 150 до 400 мкМ, от 150 до 300 мкМ, от 150 до 250 мкМ, от 150 до 200 мкМ. Указанный фармацевтически приемлемый хелатор (в частности, хелаторы, упомянутые выше, и, в частности, EDTA) может, в частности, присутствовать в концентрации, близкой к 150 мкМ, такой как от 50 до 250 мкМ, от 100 до 200 мкМ или примерно 150 мкМ. Однако могут присутствовать более высокие концентрации, так как не наблюдали вредного влияния на стабильность, даже при низких концентрациях.
Возможные дополнительные компоненты
Жидкие препараты согласно изобретению, кроме того, могут содержать дополнительные соединения со стабилизирующим эффектом на вирус осповакцины.
C2-С3 спирт
В то время как было обнаружено то, что присутствие фармацевтически приемлемого буфера, обеспечивающего рН от 6,5 до 8,5, одновалентной соли, фармацевтически приемлемого дисахарида или сахароспирта и фармацевтически приемлемого хелатора является существенным для стабилизации вируса осповакцины в жидком состоянии, авторы изобретения также обнаружили то, что дополнительное присутствие низкой концентрации С2-С3 спирта, не будучи необходимым для стабилизации вируса осповакцины, оказывает синергетический эффект с присутствием хелатора для дальнейшего улучшения стабильности вируса осповакцины в жидком состоянии. В отличие от этого, слишком высокая концентрация того же самого С2-С3 спирта имеет вредные эффекты на стабильность вируса осповакцины в жидком состоянии. Следовательно, жидкие препараты согласно изобретению предпочтительно дополнительно содержат С2-С3 спирт в концентрации от 0,05 до 5% (объем на объем или об./об.). Это открытие было довольно неожиданным, так как вирусы группы оспы и, в частности, вирусы осповакцины являются оболочечными вирусами, для которых может ожидаться то, что добавление полярного растворителя изменит оболочку, в отличие от случая безоболочечных вирусов, таких как аденовирусы.
Указанный С2-С3 спирт может, в частности, быть выбран из этанола и изопропанола, предпочтительно указанный С2-С3 спирт представляет собой этанол.
Указанный С2-С3 спирт (в частности, спирты, упомянутые выше, а именно этанол) может, в частности, присутствовать в концентрации от 0,05 до 5% (об./об.), от 0,05 до 4% (об./об.), от 0,05 до 3% (об./об.), от 0,05 до 2% (об./об.), от 0,05 до 1% (об./об.), от 0,05 до 0,9% (об./об.), от 0,05 до 0,8% (об./об.), от 0,05 до 0,7% (об./об.), от 0,05 до 0,6% (об./об.), от 0,05 до 0,5% (об./об.), от 0,1 до 5% (об./об.), от 0,1 до 4% (об./об.), от 0,1 до 3% (об./об.), от 0,1 до 2% (об./об.), от 0,1 до 1% (об./об.), от 0,1 до 0,9% (об./об.), от 0,1 до 0,8% (об./об.), от 0,1 до 0,7% (об./об.), от 0,1 до 0,6% (об./об.), от 0,1 до 0,5% (об./об.), от 0,2 до 5% (об./об.), от 0,2 до 4% (об./об.), от 0,2 до 3% (об./об.), от 0,2 до 2% (об./об.), от 0,2 до 1% (об./об.), от 0,2 до 0,9% (об./об.), от 0,2 до 0,8% (об./об.), от 0,2 до 0,7% (об./об.), от 0,2 до 0,6% (об./об.), от 0,2 до 0,5% (об./об.), от 0,3 до 5% (об./об.), от 0,3 до 4% (об./об.), от 0,3 до 3% (об./об.), от 0,3 до 2% (об./об.), от 0,3 до 1% (об./об.), от 0,3 до 0,9% (об./об.), от 0,3 до 0,8% (об./об.), от 0,3 до 0,7% (об./об.), от 0,3 до 0,6% (об./об.), от 0,3 до 0,5% (об./об.), от 0,4 до 5% (об./об.), от 0,4 до 4% (об./об.), от 0,4 до 3% (об./об.), от 0,4 до 2% (об./об.), от 0,4 до 1% (об./об.), от 0,4 до 0,9% (об./об.), от 0,4 до 0,8% (об./об.), от 0,4 до 0,7% (об./об.), от 0,4 до 0,6% (об./об.), от 0,4 до 0,5% (об./об.), от 0,5 до 5% (об./об.), от 0,5 до 4% (об./об.), от 0,5 до 3% (об./об.), от 0,5 до 2% (об./об.), от 0,5 до 1% (об./об.), от 0,5 до 0,9% (об./об.), от 0,5 до 0,8% (об./об.), от 0,5 до 0,7% (об./об.) или от 0,5 до 0,6% (об./об.). Предпочтительно указанный С2-С3 спирт (в частности, спирты, упомянутые выше, и, в частности, этанол) присутствует в концентрации, не превышающей 2% (об./об.) (в частности, в любом интервале, раскрытом выше, с большим значением самое большее 2%), и, более предпочтительно, близкой к 0,5% (об./об.), такой как от 0,1 до 1% (об./об.), от 0,1 до 0,9% (об./об.), от 0,2 до 0,8% (об./об.), от 0,3 до 0,7% (об./об.), от 0,4 до 0,6% (об./об.), наиболее предпочтительно - примерно 0,5% (об./об.).
Натрия глутамат
В то время как его стабилизирующий эффект является менее отчетливым, жидкие композиции согласно изобретению также могут содержать натрия глутамат в концентрации, меньшей чем 10 мМ, такой как от 0 до 10 мМ, от 0 до 9 мМ, от 0 до 8 мМ, от 0 до 7,5 мМ, от 0 до 7 мМ, от 0 до 6,5 мМ, от 0 до 6 мМ, от 0 до 5,5 мМ, от 0 до 5 мМ, от 1 до 10 мМ, от 1 до 9 мМ, от 1 до 8 мМ, от 1 до 7,5 мМ, от 1 до 7 мМ, от 1 до 6,5 мМ, от 1 до 6 мМ, от 1 до 5,5 мМ, от 1 до 5 мМ, от 2 до 10 мМ, от 2 до 9 мМ, от 2 до 8 мМ, от 2 до 7,5 мМ, от 2 до 7 мМ, от 2 до 6,5 мМ, от 2 до 6 мМ, от 2 до 5,5 мМ, от 2 до 5 мМ, от 2,5 до 10 мМ, от 2,5 до 9 мМ, от 2,5 до 8 мМ, от 2,5 до 7,5 мМ, от 2,5 до 7 мМ, от 2,5 до 6,5 мМ, от 2,5 до 6 мМ, от 2,5 до 5,5 мМ, от 2,5 до 5 мМ, от 3 до 10 мМ, от 3 до 9 мМ, от 3 до 8 мМ, от 3 до 7,5 мМ, от 3 до 7 мМ, от 3 до 6,5 мМ, от 3 до 6 мМ, от 3 до 5,5 мМ, от 3 до 5 мМ, от 3,5 до 10 мМ, от 3,5 до 9 мМ, от 3,5 до 8 мМ, от 3,5 до 7,5 мМ, от 3,5 до 7 мМ, от 3,5 до 6,5 мМ, от 3,5 до 6 мМ, от 3,5 до 5,5 мМ, от 3,5 до 5 мМ, от 4 до 10 мМ, от 4 до 9 мМ, от 4 до 8 мМ, от 4 до 7,5 мМ, от 4 до 7 мМ, от 4 до 6,5 мМ, от 4 до 6 мМ, от 4 до 5,5 мМ, от 4 до 5 мМ, от 4,5 до 10 мМ, от 4,5 до 9 мМ, от 4,5 до 8 мМ, от 4,5 до 7,5 мМ, от 4,5 до 7 мМ, от 4,5 до 6,5 мМ, от 4,5 до 6 мМ, от 4,5 до 5,5 мМ, от 4,5 до 5 мМ, от 5 до 10 мМ, от 5 до 9 мМ, от 5 до 8 мМ, от 5 до 7,5 мМ, от 5 до 7 мМ, от 5 до 6,5 мМ, от 5 до 6 мМ или от 5 до 5,5 мМ.
В частности, авторы изобретения обнаружили то, что, в частности для MVA, присутствие натрия глутамата в концентрации примерно 5 мМ является оптимальным. Когда в жидких препаратах согласно изобретению присутствует натрия глутамат, он, таким образом, предпочтительно присутствует в концентрации, близкой к 5 мМ, такой как от 2,5 до 7,5 мМ, от 3 до 7 мМ, от 3,5 до 6,5 мМ, от 4 до 6 мМ, от 4,5 до 5,5 мМ, более предпочтительно - примерно 5 мМ.
Потенциально исключенные соединения
Поверхностно-активное вещество
Было показано то, что неионные поверхностно-активные вещества индуцируют стабилизацию разных вирусов в жидком состоянии (см. EVANS et al. J Pharm Sci. 2004 Oct, 93(10):2458-75, US 7456009, SHI et al. J Pharm Sci. 2005 Jul, 94(7): 1538-51, US 2007/0161085).
Однако для вируса осповакцины авторы изобретения обнаружили то, что присутствие поверхностно-активного вещества, такого как неионное поверхностно-активное вещество Tween 80 (также известное как полисорбат 80), в низкой концентрации не имеет полезного влияния, и что концентрации выше 0,02% об./об. или даже выше 0,005% об./об. являются вредными для стабильности вируса осповакцины (см. Пример 1).
Если полисорбат или, в более общем смысле, неионное поверхностно-активное вещество или даже любое поверхностно-активное вещество присутствует в жидкой композиции согласно изобретению, оно должно присутствовать в концентрации меньше, чем 0,1%, предпочтительно меньше, чем 0,05% (об./об.), меньше, чем 0,04% (об./об.), меньше, чем 0,03% (об./об.), меньше, чем 0,02% (об./об.), меньше, чем 0,01% (об./об.), меньше, чем 0,009% (об./об.), меньше, чем 0,008% (об./об.), меньше, чем 0,007% (об./об.), меньше, чем 0,006% (об./об.), меньше, чем 0,005% (об./об.), меньше, чем 0,004% (об./об.), меньше, чем 0,003% (об./об.), меньше, чем 0,002% (об./об.) или даже меньше, чем 0,001% (об./об.).
В другом предпочтительном воплощении жидкой композиции согласно изобретению данная жидкая композиция не содержит полисорбат или, в более широком смысле - не содержит неионные поверхностно-активные вещества, или даже в более широком смысле - не содержит какое-либо поверхностно-активное вещество.
В предпочтительном воплощении жидкий препарат согласно изобретению не содержит поверхностно-активное вещество или содержит поверхностно-активное вещество в концентрации меньше, чем 0,1%, предпочтительно меньше, чем 0,05% (об./об.), меньше, чем 0,04% (об./об.), меньше, чем 0,03% (об./об.), меньше, чем 0,02% (об./об.), меньше, чем 0,01% (об./об.), меньше, чем 0,009% (об./об.), меньше, чем 0,008% (об./об.), меньше, чем 0,007% (об./об.), меньше, чем 0,006% (об./об.), меньше, чем 0,005% (об./об.), меньше, чем 0,004% (об./об.), меньше, чем 0,003% (об./об.), меньше, чем 0,002% (об./об.) или даже меньше, чем 0,001% (об./об.).
Двухвалентные соли
Обнаружили то, что двухвалентные соли, такие как MgCl2 или CaCl2, индуцируют стабилизацию разных вирусов в жидком состоянии (см. EVANS et al. J Pharm Sci. 2004 Oct, 93(10):2458-75 и US 7456009). В таких случаях двухвалентные катионы присутствовали в жидком препарате в концентрации по меньшей мере 0,5 мМ и предпочтительно по меньшей мере 1 мМ.
Авторы изобретения, однако, обнаружили то, что присутствие двухвалентных солей не имеет сильного полезного влияния на стабильность вируса осповакцины (см. Пример 1) и скорее имеет вредные эффекты при более высоких концентрациях (по меньшей мере 75 мМ). Жидкие препараты согласно изобретению, таким образом, могут не содержать MgCl2 и/или CaCl2, или, если брать шире, двухвалентные соли.
Однако, поскольку двухвалентные катионы, по-видимому, не имеют вредного влияния на стабильность вируса осповакцины в низкой концентрации, такие двухвалентные катионы могут присутствовать в жидких препаратах согласно изобретению, в частности, в низкой концентрации. Когда такие двухвалентные катионы (в частности, MgCl2 или CaCl2) присутствуют в жидких препаратах согласно изобретению, они, тем не менее, предпочтительно присутствуют в концентрации меньше, чем 100 мМ, предпочтительно меньше, чем 90 мМ, меньше, чем 80 мМ, меньше, чем 75 мМ, меньше, чем 70 мМ, меньше, чем 60 мМ, меньше, чем 50 мМ, меньше, чем 45 мМ, меньше, чем 40 мМ, меньше, чем 35 мМ, меньше, чем 30 мМ, меньше, чем 25 мМ, меньше, чем 20 мМ, меньше, чем 15 мМ, меньше, чем 10 мМ, меньше, чем 9 мМ, меньше, чем 8 мМ, меньше, чем 7 мМ, меньше, чем 6 мМ, меньше, чем 5 мМ, меньше, чем 4 мМ, меньше, чем 3 мМ, меньше, чем 2 мМ, более предпочтительно - меньше, чем 1 мМ, меньше, чем 0,9 мМ, меньше, чем 0,8 мМ, меньше, чем 0,7 мМ, меньше, чем 0,6 мМ, меньше, чем 0,5 мМ.
В предпочтительном воплощении жидкий препарат согласно изобретению не содержит двухвалентных солей или содержит двухвалентные соли в концентрации меньше, чем 100 мМ, предпочтительно меньше, чем 90 мМ, меньше, чем 80 мМ, меньше, чем 75 мМ, меньше, чем 70 мМ, меньше, чем 60 мМ, меньше, чем 50 мМ, меньше, чем 45 мМ, меньше, чем 40 мМ, меньше, чем 35 мМ, меньше, чем 30 мМ, меньше, чем 25 мМ, меньше, чем 20 мМ, меньше, чем 15 мМ, меньше, чем 10 мМ, меньше, чем 9 мМ, меньше, чем 8 мМ, меньше, чем 7 мМ, меньше, чем 6 мМ, меньше, чем 5 мМ, меньше, чем 4 мМ, меньше, чем 3 мМ, меньше, чем 2 мМ, более предпочтительно - меньше, чем 1 мМ, меньше, чем 0,9 мМ, меньше, чем 0,8 мМ, меньше, чем 0,7 мМ, меньше, чем 0,6 мМ, меньше, чем 0,5 мМ.
Аминокислоты, отличные от глутаминовой кислоты
Обнаружили то, что аминокислоты и, в частности, гистидин, аргинин или метионин, индуцируют стабилизацию разных вирусов в жидком состоянии (см. EVANS et al. J Pharm Sci. 2004 Oct, 93(10):2458-75, US 7456009, US 2007/0161085, US 7914979, WO 2014/029702, WO 2014/053571). Когда гистидин присутствует в жидком препате для улучшения стабильности, гистидин обычно присутствует в концентрации по меньшей мере 5 мМ и предпочтительно по меньшей мере 10 мМ (см. EVANS et al. J Pharm Sci. 2004 Oct, 93(10):2458-75, US 7456009, WO 2014/029702). Когда аргинин присутствует в жидком препате для улучшения стабильности, аргинин обычно присутствует в концентрации по меньшей мере 50 мМ (см. US 2007/0161085, по меньшей мере 1% масс./об. аргинина соответствует по меньшей мере примерно 57,4 мМ) и иногда предпочтительно по меньшей мере 150 мМ, и, в частности, примерно 300 мМ (см. WO 2014/029702). Когда метионин присутствует в жидком препате для улучшения стабильности, метионин обычно присутствует в концентрации по меньшей мере 25 мМ и предпочтительно примерно 67 мМ (см. WO 2014/029702).
Авторы изобретения, однако, обнаружили то, что присутствие аминокислот, отличных от глутаминовой кислоты (аргинина, гистидина или, в общем, аминокислот), не имеет полезного влияния на стабильность вируса осповакцины (см. Пример 1).
Жидкие препараты согласно изобретению, таким образом, могут не содержать гистидин. Альтернативно или дополнительно, жидкие препараты согласно изобретению могут не содержать аргинин. Альтернативно или дополнительно, жидкие препараты согласно изобретению могут не содержать метионин. В частности, жидкие препараты согласно изобретению могут не содержать аргинин и метионин или даже могут не содержать гистидин, аргинин и метионин. В более широком смысле, жидкие препараты согласно изобретению могут не содержать аминокислоты, отличные от глутаминовой кислоты.
Однако в отсутствие полезного эффекта не было обнаружено, что такие аминокислоты, отличные от натрия глутамата, имеют вредный эффект, и, таким образом, могут присутствовать в жидких препаратах согласно изобретению, в частности, в низкой концентрации.
При наличии гистидина в жидких препаратах согласно изобретению он, тем не менее, предпочтительно присутствует в концентрации меньше, чем 10 мМ, предпочтительно меньше, чем 9 мМ, меньше, чем 8 мМ, меньше, чем 7,5 мМ, меньше, чем 7 мМ, меньше, чем 6 мМ или даже меньше, чем 5 мМ.
Аналогично, когда в жидких препаратах согласно изобретению присутствует аргинин, он, тем не менее, предпочтительно присутствует в концентрации меньше, чем 300 мМ, предпочтительно меньше, чем 150 мМ, меньше, чем 100 мМ, меньше, чем 75 мМ или даже меньше, чем 50 мМ. Также, когда в жидких препаратах согласно изобретению присутствует метионин, он, тем не менее, предпочтительно присутствует в концентрации меньше, чем 60 мМ, предпочтительно меньше, чем 50 мМ, меньше, чем 40 мМ, меньше, чем 30 мМ или даже меньше, чем 25 мМ.
Если брать шире, когда в жидких препаратах согласно изобретению присутствует одна или более чем одна аминокислота, отличная от натрия глутамата, она предпочтительно присутствует в концентрации меньше, чем 300 мМ, предпочтительно меньше, чем 150 мМ, меньше, чем 100 мМ, меньше, чем 75 мМ, меньше, чем 50 мМ, меньше, чем 40 мМ, меньше, чем 30 мМ, меньше, чем 25 мМ, меньше, чем 20 мМ, меньше, чем 10 мМ, меньше, чем 9 мМ, меньше, чем 8 мМ, меньше, чем 7,5 мМ, меньше, чем 7 мМ, меньше, чем 6 мМ или даже меньше, чем 5 мМ.
В предпочтительном воплощении жидкий препарат согласно изобретению не содержит гистидин или содержит гистидин в концентрации меньше, чем 10 мМ, предпочтительно меньше, чем 9 мМ, меньше, чем 8 мМ, меньше, чем 7,5 мМ, меньше, чем 7 мМ, меньше, чем 6 мМ или даже меньше, чем 5 мМ.
В предпочтительном воплощении жидкий препарат согласно изобретению не содержит аргинин или содержит аргинин в концентрации меньше, чем 300 мМ, предпочтительно меньше, чем 150 мМ, меньше, чем 100 мМ, меньше, чем 75 мМ или даже меньше, чем 50 мМ.
В предпочтительном воплощении жидкий препарат согласно изобретению не содержит метионин или содержит метионин в концентрации меньше, чем 60 мМ, предпочтительно меньше, чем 50 мМ, меньше, чем 40 мМ, меньше, чем 30 мМ или даже меньше, чем 25 мМ.
В предпочтительном воплощении жидкий препарат согласно изобретению не содержит аминокислот, отличных от натрия глутамата, или содержит аминокислоты, отличные от натрия глутамата, в концентрации меньше, чем 300 мМ, предпочтительно меньше, чем 150 мМ, меньше, чем 100 мМ, меньше, чем 75 мМ, меньше, чем 50 мМ, меньше, чем 40 мМ, меньше, чем 30 мМ, меньше, чем 25 мМ, меньше, чем 20 мМ, меньше, чем 10 мМ, меньше, чем 9 мМ, меньше, чем 8 мМ, меньше, чем 7,5 мМ, меньше, чем 7 мМ, меньше, чем 6 мМ или даже меньше, чем 5 мМ.
Мочевина
Авторы изобретения также обнаружили то, что мочевина не имеет полезного влияния на стабильность вируса осповакцины (см. Пример 1).
Жидкие препараты согласно изобретению, таким образом, предпочтительно могут не содержать мочевину.
Высокомолекулярные полимеры
Лиофилизированные вирусные препараты обычно содержат высокомолекулярные полимеры, такие как декстран или поливинилпирролидон (PVP), которые способствуют образованию осадка во время лиофилизации (см. ЕР 1418942 и WO 2014/053571).
Однако такие высокомолекулярные полимеры не являются полезыми для стабилизации вируса осповакцины в жидком состоянии, и жидкие препараты согласно изобретению, таким образом, могут не содержать таких высокомолекулярных полимеров. При наличии в жидких препаратах согласно изобретению они предпочтительно присутствуют в концентрации меньше, чем 10 г/л, предпочтительно меньше, чем 7,5 г/л, меньше, чем 5 г/л, меньше, чем 2,5 г/л или даже меньше, чем 1 г/л.
В предпочтительном воплощении жидкий препарат согласно изобретению, таким образом, не содержит декстрана, PVP или, если брать шире, высокомолекулярных полимеров, или содержит декстран, PVP или, если брать шире, высокомолекулярные полимеры в концентрации меньше, чем 10 г/л, предпочтительно меньше, чем 7,5 г/л, меньше, чем 5 г/л, меньше, чем 2,5 г/л или даже меньше, чем 1 г/л.
Стабилизаторы животного или человеческого происхождения
Стабилизаторы животного или человеческого происхождения, такие как сыворотка или желатин, в течение длительного времени использовали для стабилизации живых вирусов (см. US 2007/0161085). Однако такие полученные от животных или человека стабилизаторы животного или человеческого происхождения потенциально включают риск для здоровья из-за потенциального загрязнения вирусами или нетрадиционными агентами.
Такие полученные от животных или человека стабилизаторы не являются необходимыми для стабильности вируса осповакцины в жидких препаратах согласно изобретению, и жидкие препараты согласно изобретению, таким образом, предпочтительно не содержат полученных от животных или человека стабилизаторов, таких как сыворотка или желатин.
Предпочтительные препараты
Разные конкретные соединения, принадлежащие к семейству каждого незаменимого или опционного элемента препаратов согласно изобретению, были описаны выше в разделе, конкретно относящемся к данному элементу. В контексте изобретения каждый список подходящих соединений для конкретного элемента и каждое конкретное соединение, раскрытое для конкретного элемента, могут быть объединены с любым другим родовым элементом, списком подходящих соединений для указанного другого элемента или любым конкретным соединением, раскрытым для указанного другого элемента.
В частности, предпочтительные воплощения незаменимого или опционного элемента препаратов согласно изобретению могут быть объединены с любым другим родовым элементом или с предпочтительными воплощениями указанного другого элемента.
Особенно предпочтительные препараты согласно изобретению включают препараты, содержащие, по существу состоящие или состоящие из элементов, упомянутых в Таблице 1 ниже:
















Применение фармацевтически приемлемого хелатора для стабилизации вируса осповакцины против повреждения УФ (ультрафиолет)
Вирус осповакцины является особенно чувствительным к повреждению УФ (см. LYTLE et al. J. Virol. 2005, 79(22): 14244).
Неожиданно авторы изобретения обнаружили то, что EDTA имеет защитное влияние на вирус осповакцины против повреждения УФ (см. Пример 6). Настоящее изобретение, таким образом, также относится к применению фармацевтически приемлемого хелатора для стабилизации вируса группы оспы (в частности, вируса осповакцины) против повреждения УФ.
Для стабилизации вируса группы оспы (в частности, вируса осповакцины) против повреждения УФ хелатирующий агент предпочтительно выбран из этилендиаминтетрауксусной кислоты (EDTA), 1,2-бис(о-аминофенокси)этан-N,N,N',N'-тетрауксусной кислоты (ВАРТА), этиленгликольтетрауксусной кислоты (EGTA), димеркаптоянтарной кислоты (DMSA), диэтилентриаминпентауксусной кислоты (DTPA) и 2,3-димеркапто-1-пропансульфоновой кислоты (DMPS), предпочтительно указанный фармацевтически приемлемый хелатор представляет собой EDTA.
При применении фармацевтически приемлемого хелатора для стабилизации вируса группы оспы (в частности, вируса осповакцины) против повреждения УФ указанный вирус группы оспы (в частности, вирус осповакцины) предпочтительно находится в жидкой композиции, и указанный фармацевтически приемлемый хелатор (в частности, хелаторы, упомянутые выше, и, в частности, EDTA) предпочтительно присутствует в концентрации по меньшей мере 50 мкМ, предпочтительно от 50 до 1000 мкМ, от 50 до 750 мкМ, от 50 до 500 мкМ, от 50 до 400 мкМ, от 50 до 300 мкМ, от 50 до 250 мкМ, от 50 до 200 мкМ, от 50 до 150 мкМ; от 50 до 100 мкМ, от 50 до 75 мкМ, от 75 до 1000 мкМ, от 75 до 750 мкМ, от 75 до 500 мкМ, от 75 до 400 мкМ, от 75 до 300 мкМ, от 75 до 250 мкМ, от 75 до 200 мкМ, от 75 до 150 мкМ; от 75 до 100 мкМ, от 100 до 1000 мкМ, от 100 до 750 мкМ, от 100 до 500 мкМ, от 100 до 400 мкМ, от 100 до 300 мкМ, от 100 до 250 мкМ, от 100 до 200 мкМ, от 100 до 150 мкМ; от 150 до 1000 мкМ, от 150 до 750 мкМ, от 150 до 500 мкМ, от 150 до 400 мкМ, от 150 до 300 мкМ, от 150 до 250 мкМ или от 150 до 200 мкМ.
Даже более предпочтительно для стабилизации вируса группы оспы (в частности, вируса осповакцины) против повреждения УФ используется жидкий препарат согласно изобретению (как раскрыто выше).
Следующие примеры просто предназначены для того, чтобы проиллюстрировать настоящее изобретение.
ПРИМЕРЫ
Пример 1: скрининг стабилизирующих соединений-кандидатов
Тестировали эффект разных соединений-кандидатов для стабилизации вируса MVA в жидком препарате при +5°С на основе соединений, для которых из предшествующего уровня техники известно то, что они имеют стабилизирующий эффект на другие типы вирусов.
Материалы и методы
Вирусы
Использовали следующие вирусы MVA:



Данные три вируса MVA продуцировали в фибробластах эмбрионов курицы и выделяли и очищали способом, включающим выделение инфицированной кульуры CEF, разрушение клеток механическими способами и разные стадии очистки, которые не включают какую-либо стадию обработки протеазой.
Также использовали рекомбинантный вирус осповакцины штамма Wyeth, продуцированный в непрерывной человеческой линии клеток и очищенный способом, который включает по меньшей мере одну стадию обработки по меньшей мере одной протеазой (VV Wyeth), при исходном целевом титре от 2×108 до 2×109 БОЕ/мл.
Протестированные препараты
Протестированные препараты представлены в Таблицах 2-11 ниже:

























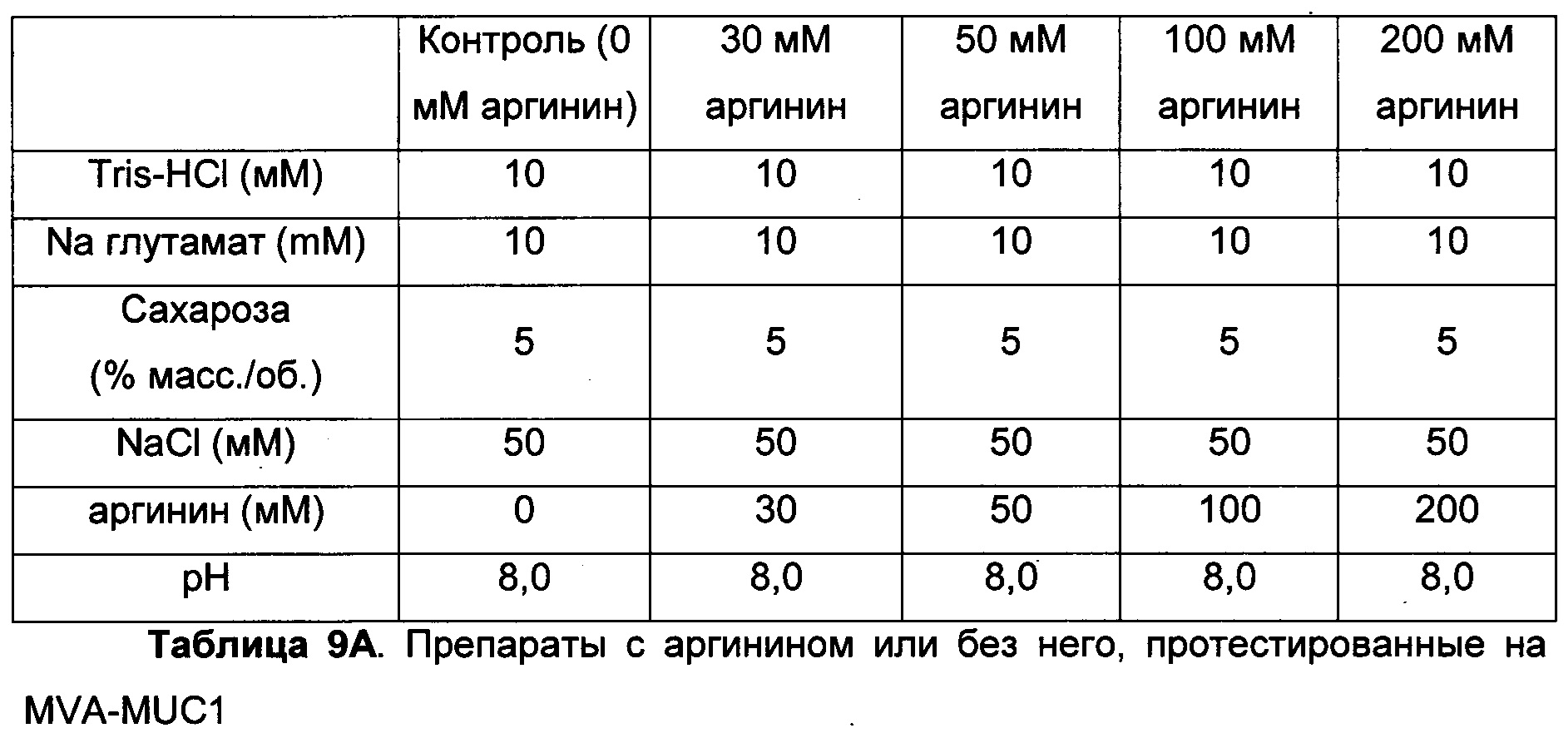






Анализ стабильности
Стабильность анализировали при +37°С (плюс/минус 2°С), +25°С (плюс/минус 2°С) и/или +5°С (плюс/минус 3°С) (см. раздел результатов).
При +37°С (плюс/минус 2°С) (анализ стабильности в условиях ускоренного старения) образцы выдерживали при относительной влажности 75%, и стабильность анализировали посредством измерения потерь инфективности на протяжении по меньшей мере 28 суток (с промежуточными измерениями в сутки 7 и 14).
При +25°С (плюс/минус 2°С) (анализ стабильности в условиях ускоренного старения) образцы выдерживали при относительной влажности 60%, и стабильность анализировали посредством измерения потерь инфективности на протяжении по меньшей мере 6 месяцев (с промежуточными измерениями примерно в 1 месяц и в 2 и 3 месяца).
При +5°С (плюс/минус 3°С) (анализ при целевой температуре хранения) образцы выдерживали без какого-либо контроля относительной влажности, и стабильность анализировали посредством измерения потерь инфективности на протяжении по меньшей мере 24 месяцев (с промежуточными измерениями примерно в 1 месяц и в 3, 6, 12, 18 и 24 месяца).
Потери инфективности рассчитывали посредством вычитания числа инфекционных геномов или бляшкообразующих единиц на мл (ИГ/мл или БОЕ/мл) во время измерения из исходного числа ИГ/мл или БОЕ/мл в сутки 0 и выражали в виде десятичного логарифма (log10 (ИГ/мл или БОЕ/мл)), что в настоящем описании сокращается как log (ИГ/мл или БОЕ/мл).
Измерение инфекционных титров
Инфекционные титры в данное время можно измерять либо путем измерения числа инфекционных геномов (ИГ) на мл (ИГ/мл), либо посредством применения бляшечного анализа на клетках BHK-21 (инфекционный титр вируса осповакцины затем выражается в бляшкообразующих единицах (БОЕ) на мл (БОЕ/мл)). В данном исследовании было предпочтительным измерение числа инфекционных геномов на мл (ИГ/мл), так как данный способ быстрее и точнее. Однако, в то время как не показаны конкретные данные с использованием бляшечного анализа на клетках BHK-21, следует отметить то, что инфекционные титры в некоторые моменты были также измерены с использованием бляшечного анализа на клетках BHK-21, и что всегда было обнаружено то, что результаты согласуются с результатами, полученными с использованием способа инфекционных геномов.
Измерение числа инфекционных геномов на мл (ИГ/мл) проводится следующим образом:

Образец вируса серийно разводится в культуральной среде DMEM (среда Игла, модифицированная по Дульбекко), дополненной 5% фетальной телячей сывороткой (FCS), в 96-луночном культуральном планшете (100 мкл на лунку).
Клетки BHK-21 отбирали в культуральной среде (DMEM плюс 5% FCS) и высевали в соотношении 1:100 (100 мкл на лунку) в 96-луночный планшет, содержащий разведения вируса. Культуральный планшет затем инкубируется при +37°С, 5% CO2, в течение 24 часов плюс/минус 4 часа.

В 20-28 ч после инфицирования супернатанты отбрасываются, и монослои клеток промываются 2 раза PBS (фосфатно-солевой буферный раствор). В каждую лунку добавляют 100 мкл лизисного буфера, содержащего протеиназу К. Планшет инкубируется при +56°С в течение по меньшей мере 30 минут (вплоть до 420 минут) и затем нагревается при +95°С в течение 5 минут для того, чтобы инактивировать протеиназу К.

Лизаты клеток разводятся в 49 раз в воде и подвергаются кПЦР с набором специфичных праймеров и зондов, нацеленных на область секретируемого белка, связывающего хемокины (SCBP), генома вируса осповакцины.
Число инфекционных геномов тестируемого образца (ИГ/мл) количественно измеряется способом параллельного анализа (PLA) с использованием вирусного стандарта, откалиброванного в инфекционный титр (БОЕ/мл) (установленный с использованием стандартного анализа бляшкообразующих единиц).
Данный способ может измерять инфекцонные геномы (ИГ/мл) для любого значения по меньшей мере 1×105 ИГ/мл.
Измерение инфекционных титров с использованием бляшечного анализа на клетках BHK-21 проводится следующим образом:
1. Распределение клеток
Клетки-хозяева BHK-21 выращивали в монослоях в DMEM. При конфлюентности клетки промывали 10 мл PBS и затем трипсинизировали. После удаления трипсина клетки затем ресуспендировали в 10 мл DMEM с 10% SFV при 37°С.
Затем суспензию клеток гомогенизировали и распределяли в многолуночные планшеты (по 2 мл в каждую из 6 лунок планшета). Затем указанные планшеты инкубировали при 37°С, 5% CO2.
2. Инфицирование клеток
Примерно через 1 сутки после распределения клеток в каждую лунку, содержащую клетки BHK-21 со стадии 1, добавляли аликвоты суспензий вируса. При необходимости указанные суспензии сначала серийно разводили в PBS, 100× катионах и 1% фетальной телячей сыворотке (FCS) согласно способу, хорошо известному специалисту в данной области. В зависимости от случая, суспензии вируса, которые добавляли к клеткам BHK-21 со стадии 1, были либо жидкими композициями, содержащими вирус, перед лиофилизацией, либо растворенной композицией, содержащей вирус (т.е. после лиофилизации, в разные периоды времени и при разных температурах).
Культуральную среду затем удаляли и, после перемешивания на протяжении 60 минут при комнатной температуре, в каждую лунку распределяли 2 мл инфекционной среды (DMEM+5% FCS). Затем инкубировали планшеты при 37°С, 5% CO2.
3. Фиксация клеток
После удаления среды клетки промывали PBS (примерно 1 мл на лунку). Затем добавляли 1 мл раствора метанола/ацетона (50/50), и образующуюся смесь аккуратно перемешивали при комнатной температуре.
Затем давали планшетам высохнуть при комнатной температуре.
4. Выявление и определение титра
Определение титра вируса проводили согласно хорошо известной пероксидазной реакции с использованием антител против компонентов вакцины и антител против антител кролика, объединенных с пероксидазой. Более конкретно, перед реакцией антитела против компонентов вакцины разводили в 100 раз в PBS плюс 2% FCS. Затем 500 мкл указанных антител добавляли в каждую лунку и инкубировали при 37°С на протяжении примерно 30 минут и затем промывали 3 раза 1 мл PBS плюс 1% Triton Х-100.
Реакцию с антителами против антител кролика, объединенными с пероксидазой, проводили таким же способом, за исключением того, что перед реакцией указанные антитела разводили в 200 раз в PBS плюс 2% FCS.
Раствор DAB (диаминобензидин) получали растворением одной имеющейся в продаже таблетки DAB в 15 мл 0,05 М TRIS-HCl. Затем полученный раствор фильтровали на фильтровальном блоке NALGENE, 2 мкм, и образующийся отфильтрованный раствор добавляли к 15 мкл водного раствора 30% H2O2. Сразу после приготовления 1 мл раствора DAB добавляли в каждую лунку и оставляли, пока не появлялось коричневое окрашивание. Окрашивающий раствор затем удаляли, и результаты интерпретируются визуально.
Затем инфекционный титр рассчитывали в БОЕ/мл с использованием следующей формулы:
[среднее число вирусных бляшек × 4] × коэффициент разведения = число БОЕ/мл
Каждый из данных способов имеет аналогичную вариабельность примерно плюс/минус 0,30 log10 для одного определения. Однако вариабельность обоих способов уменьшается при увеличении числа определений (т.е. числа протестированных повторностей). Для двойного определения (применение образцов в двойной повторности) ожидается вариабельность плюс/минус 0,25 log10. Для тройного определения (применение образцов в тройной повторности) ожидается вариабельность плюс/минус 0,20 log10. Во всех примерах при измерении числа инфекционных геномов (ИГ) на мл (ИГ/мл) делали одно определение, тогда как определение бляшкообразующих единиц (БОЕ) на мл (БОЕ/мл) делали в тройных повторностях.
Результаты
Необходимость одновалентной соли
Стабильность MVA-MUC1 тестировали в препаратах, содержащих Tris-HCl, Na глутамат, сахарозу, рН 8,0, и содержащих либо 0 мМ, либо 50 мМ NaCl (см. Таблицу 2 выше).
Потери инфективности через 7, 14 или 28 суток при 37°С представлены на Фиг. 1. В то время как ни один из двух протестированных препаратов не является очень стабильным, результаты ясно показывают то, что добавление 50 мМ NaCl значимо улучшает стабильность в сутки 14 (примерно 1 log потери по сравнению с почти 2 log потери) и в сутки 28 (примерно 3 log потери по сравнению с более чем 6 log потери).
Следовательно, добавление в препарат NaCl значительно улучшает стабильность.
Полезный эффект EDTA, низкой концентрации EtOH или EDTA/EtOH
Влияние EDTA на стабильность MVA-HCV при +37°С и +5°С в препарате, содержащем Tris-HCl, Na глутамат, сахарозу, NaCl, рН 7,5, тестировали с использованием разных концентраций EDTA (см. Таблицу 3). Результаты представлены на Фиг. 2.
При +37°С (анализ стабильности при условиях ускоренного старения) все препараты, содержащие EDTA, демонстрируют потерю инфективности меньше, чем 1 log в 7 и 14 суток, и потерю инфективности меньше, чем 1,5 log в 28 суток. В заметном отличие от этого, препараты без EDTA (контроль DS и контроль DS2) демонстрировали очень слабый профиль стабильности (примерно 1, 2,5 и 4 log потери инфективности в 7, 14 и 28 суток соответственно). Использованная концентрация EDTA (от 50 мкМ до 1000 мкМ), по-видимому, не влияет на стабилизирующий эффект. В сутки 28 препараты, содержащие EtOH, помимо EDTA, по-видимому, дополнительно стабилизируются (см. Фиг. 2).
Влияние этанола (EtOH) на стабильность MVA-HCV при +37°С и +5°С в препарате, содержащем Tris-HCl, Na глутамат, сахарозу, NaCl, рН 7,5, тестировали с использованием разных концентраций EtOH (см. Таблицу 3). Результаты представлены на Фиг. 3.
При 37°С (анализ стабильности в условиях ускоренного старения) все препараты, содержащие EtOH, демонстрируют значительно меньшие потери инфективности, чем контроли без EtOH в сутки 7 и 14. Кроме того, можно наблюдать некоторую тенденцию к большей стабилизации меньших концентраций EtOH. В заметном отличие от этого, препараты без EtOH (контроль DS и контроль DS2) демонстрировали очень слабый профиль стабильности (примерно 1, 2,5 и 4 log потери инфективности в 7, 14 и 28 суток соответственно). Кроме того, препараты, содержащие EDTA, помимо EtOH, демонстрируют значительно меньшие потери инфективности, чем препараты, содержащие только EtOH (см. Фиг. 3).
Следовательно, первичные анализы с использованием EDTA и EtOH показывают то, что оба соединения независимо увеличивают стабильность MVA-HCV в жидких препаратах, причем стабилизирующий эффект EDTA выше, чем стабилизирующий эффект EtOH. Кроме того, комбинация обоих соединений дополнительно увеличивает стабильность.
Дальнейшие эксперименты проводили для подтверждения стабильности MVA-HCV в препаратах, содержащих варьирующие концентрации EDTA (от 50 до 250 мкМ) и EtOH (от 0,5 до 2,5%) (см. Таблицу 4), при +37°С, 25°С и 5°С. Результаты представлены на Фиг. 4А, 4Б и 4В. При всех протестированных температурах для всех препаратов наблюдали хорошую стабильность. В частности, для всех препаратов, содержащих EDTA и EtOH, потери инфективности были близки к 1 log через 28 суток при 37°С (см. Фиг. 4А), и потери инфективности были меньше, чем 0,3 через 12 месяцев при +5°С. При +5°С большинство препаратов, содержащих EDTA и EtOH, дополнительно демонстрируют потери инфективности меньше, чем 0,3 log10 через 18 и 24 месяца. В отличие от этого, стабильность контрольных препаратов DS и DS2 без EDTA и EtOH снижалась очень быстро, особенно при 37°С и 25°С (например, потеря инфективности примерно 1 log в 7 суток при 37°С и 28 суток при 25°С).
Другое представление результатов, полученных при +37°С и +5°С, представлено на Фиг. 4Г посредством применения матрицы экспериментов для определения проектного поля препарата согласно количествам EDTA и этанола для того, чтобы определить оптимальные концентрации EDTA и EtOH на основе результатов, полученных как при +37°С (в сутки 7 и 28), так и при +5°С (в 24 месяца). На этой Фиг. концентрация EDTA (мкМ) представлена по абсциссе, и концентрация EtOH (%) - по ординате. Кривые, соответствующие целесообразности препарата затем представлены в данной 2-мерной области, причем чем выше значение целесообразности, тем лучше препарат.
На Фиг. 4Г показано то, что наилучшие препараты получаются для 50-150 мкМ EDTA и 0,5-1% об./об. EtOH.
На основе данного анализа был определен оптимальный препарат с использованием 150 мкМ EDTA и 0,5% об./об. EtOH.
Полезный эффект низкой концентрации натрия глутамата
Влияние Na глутамата на стабильность MVA-HCV при +37°С и +25°С в препарате, содержащем Tris-HCl, Na глутамат, сахарозу, NaCl, рН 7,5, тестировали с разными концентрациями Na глутамата - от 0 до 10 мМ или без него (см. Таблицу 5). Результаты представлены на Фиг. 5А, 5Б и 5В соответственно.
При +37°С три препарата, содержащих по меньшей мере 5 мМ Na глутамат, демонстрируют потери инфективности меньше, чем 1 в сутки 28, тогда как два препарата, содержащих 0 мМ или 2,5 мМ Na глутамата, имеют потери инфективности больше, чем 1, но близкие к 1. Это показывает то, что Na глутамат не имеет высокого стабилизирующего эффекта, но что низкая концентрация Na глутамата от 5 до 10 мМ может иметь минорный стабилизирующий эффект. Кроме того, Фиг. 5А свидетельствует о том, что оптимальная концентрация составляет около 5 мМ, поскольку препараты с Na глутаматом в концентрации 7,5 и 10 мМ имеют немного меньшую стабильность, чем препарат с Na глутаматом в концентрации 5 мМ (Фиг. 5А).
При +25°С потери инфективности в 12 месяцев подтверждают то, что Na глутамат имеет малый стабилизирующий эффект, и что концентрация примерно 5 мМ является оптимальной (Фиг. 5Б).
При +5°С потери инфективности от 12 месяцев до 30 месяцев подтверждают то, что Na глутамат имеет малый стабилизирующий эффект, и что концентрация примерно 5 мМ является оптимальной (Фиг. 5В).
Результаты, полученные при +5°С, демонстрируют такие маленькие потери инфективности в 12 месяцев, что сложно продемонстрировать полезный эффект Na глутамата. На самом деле, присутствие в препаратах других соединений, в частности EDTA и EtOH, может объяснять стабилизирующий эффект, и маленький эффект Na глутамата сложно доказывать при этой низкой температуре. Однако это не противоречит маленькому эффекту и оптимальной концентрации примерно 5 мМ, наблюдаемым при более высоких температурах +25 и +37°С.
Полезный эффект низкой концентрации сахарозы
Влияние сахарозы на стабильность MVA-MUC1 при +37°С в препарате, содержащем Tris-HCl, Na глутамат, сахарозу, NaCl, рН 8,0, тестировали с разными концентрациями сахарозы (см. Таблицу 6). Результаты представлены на Фиг. 6 и демонстрируют то, что концентрация сахарозы не оказывает значительного влияния на уровень стабильности.
Отсутствие полезного эффекта и даже вредный эффект полисорбата 80 или полисорбата 40
Влияние полисорбата 80 или полисорбата 40 на стабильность MVA-HPV при +25°С и +5°С в препарате, содержащем Tris-HCl, Na глутамат, сахарозу, NaCl, рН 7,5 (см. Таблицу 7), тестировали с использованием разных концентраций полисорбата 80 или полисорбата 40, для которых было показано, что они имеют стабилизирующий эффект на другие вирусы (см. EVANS et al. J Pharm Sci. 2004 Oct, 93(10):2458-75, US 7456009, SHI et al. J Pharm Sci. 2005 Jul, 94(7): 1538-51, US 2007/0161085). Результаты представлены на Фиг. 7А и 7Б.
При +25°С и +5°С отсутствие полисорбата обеспечивает увеличение стабильности по сравнению с контрольным препаратом без полисорбата, таким образом, что не наблюдается стабилизирующий эффект.
В отличие от этого, при обеих температурах для концентраций полисорбата по меньшей мере 0,02% об./об. может быть отмечен дестабилизирующий эффект, который увеличивается с использованной концентрацией полисорбата. При +5°С даже очень низкая концентрация 0,005% об./об. приводит к некоторому дестабилизирующему эффекту.
Следовательно, необходимо заключить то, что полисорбат не имеет стабилизирующего эффекта, и что концентрация по меньшей мере 0,02% об./об. имеет скорее дестабилизирующий эффект. Таким образом, полисорбат предпочтительно должен быть исключен или должен присутствовать в жидких препаратах вируса осповакцины в очень низких концентрациях.
Аналогичным образом тестировали стабильность штамма Wyeth вируса осповакцины, продуцированного в непрерывной линии клеток человека и очищенного способом, который включает по меньшей мере одну стадию обработки по меньшей мере одной протеазой, в контрольном препарате, содержащем 30 мМ Tris-HCl, 10% (масс./об.) сахарозы, или в препарате, дополнительно содержащем 150 мкг/мл полисорбата 80, через 7, 14, 21 или 28 суток при +37°С. Результаты представлены на Фиг. 7В и ясно показывают то, что для данного штамма вируса осповакцины полисорбат также не имеет положительного эффекта на стабильность.
Отсутствие полезного эффекта и даже вредный эффект при высоких концентрациях MgCl2
Влияние MgCl2 на стабильность MVA-MUC1 при +37°С на протяжении 14 суток в препарате, содержащем Tris-HCl, Na глутамат, сахарозу, NaCl, рН 8,0 (см. Таблицу 8), тестировали без MgCl2 или с разными концентрациями MgCl2, для которых было показано то, что они имеют стабилизирующий эффект на другие вирусы (см. EVANS et al. J Pharm Sci. 2004 Oct, 93(10):2458-75 и US 7456009). Результаты представлены на Фиг. 8 и ясно показывают то, что MgCl2 не имеет полезного эффекта на стабильность MVA и даже имеет вредные эффекты на стабильность MVA при концентрациях по меньшей мере 0,5 М.
MgCl2, таким образом, предпочтительно должен быть исключен или должен присутствовать в жидких препаратах вируса осповакцины в низких концентрациях.
Это тем более верно, так как оптимизированные препараты согласно изобретению содержат хелатор (в частности хелатор двухвалентных катионов и, более предпочтительно, EDTA), который, таким образом, может препятствовать любому полезному влиянию MgCl2 на стабильность вирусов группы оспы и, более конкретно, вирусов осповакцины.
Дополнительное доказательство вредного эффекта MgCl2 в препаратах согласно изобретению представлено в Примере 5 ниже (см. также Фиг. 16).
Аналогичным образом тестировали стабильность штамма Wyeth вируса осповакцины, продуцированного в непрерывной линии клеток человека и очищенного способом, который включает по меньшей мере одну стадию обработки по меньшей мере одной протеазой, в контрольном препарате, содержащем 30 мМ Tris-HCl, 10% (масс./об.) сахарозы, или в препарате, дополнительно содержащем 1000 мМ (1 М) MgCl2, через 7 или 14 суток при +37°С. Результаты представлены на Фиг. 8Б и ясно показывают то, что для данного штамма вируса осповакцины MgCl2 также не имеет положительного влияния на стабильность.
Отсутствие полезного эффекта и скорее вредный эффект аргинина
Влияние аргинина на стабильность MVA-MUC1 при +37°С в препарате, содержащем Tris-HCl, Na глутамат, сахарозу, NaCl, рН 8,0 (см. Таблицу 9) тестировали без аргинина или с разными концентрациями аргинина, для которых было показано то, что они имеют стабилизирующий эффект на другие вирусы (см. US 2007/0161085). Результаты представлены на Фиг. 9 и ясно показывают то, что аргинин не имеет полезного эффекта на стабильность MVA. В отличие от этого, через 28 суток при 37°С присутствие аргинина является скорее вредным, в частности, при высокой концентрации.
Аргинин, таким образом, предпочтительно должен быть исключен или должен присутствовать в жидких препаратах вируса осповакцины в очень низких концентрациях.
Аналогичным образом тестировали стабильность штамма Wyeth вируса осповакцины, продуцированного в непрерывной линии клеток человека и очищенного способом, который включает по меньшей мере одну стадию обработки по меньшей мере одной протеазой, в контрольном препарате, содержащем 30 мМ Tris-HCl, 10% (масс./об.) сахарозы, или в препарате, дополнительно содержащем 50 мМ аргинин, через 7, 14, 21 или 28 суток при +37°С. Результаты представлены на Фиг. 9Б и ясно показывают то, что для данного штамма вируса осповакцины аргинин также не имеет положительного влияния на стабильность.
Отсутствие полезного эффекта смеси аминокислот
Влияние смеси аминокислот на стабильность MVA-MUC1 при +37°С и +25°С в препарате, содержащем Tris-HCl, Na глутамат, сахарозу, NaCl, рН 8,0 (см. Таблицу 10) тестировали с указанной смесью аминокислот или без нее. Результаты представлены на Фиг. 10 и ясно показывают то, что присутствие смеси аминокислот не имеет значительного эффекта на стабильность MVA.
В то время как смесь аминокислот может присутствовать в жидких препаратах вируса осповакцины, она явно не является существенной и не обязательно должна присутствовать.
Отсутствие полезного эффекта и скорее вредный эффект гистидина Влияние гистидина на стабильность MVA-HPV при +25°С и +5°С в препарате, содержащем Tris-HCl, Na глутамат, сахарозу, NaCl, рН 7,5, тестировали без гистидина или с 10 мМ гистидином (см. Таблицу 11) - в концентрации, для которой было показано то, что она имеет стабилизирующий эффект на другие вирусы (см. EVANS et al. J Pharm Sci. 2004 Oct, 93(10):2458-75, US 7456009, US 2007/0161085, US 7914979, WO 2014/029702, WO 2014/053571). Результаты представлены на Фиг. 11А и 11Б.
При +25°С или при 5°С не наблюдали стабилизирующего эффекта гистидина. В отличие от этого, при обеих температурах можно наблюдать тенденцию к дестабилизирующему эффекту.
Гистидин, таким образом, предпочтительно должен быть исключен или должен присутствовать в жидких препаратах вируса осповакцины в очень низких концентрациях.
Заключения
Приведенные выше результаты ясно показывают то, что:






Одно или более чем одно из данных соединений может, таким образом, присутствовать в стабильных жидких препаратах вируса осповакцины.
В частности, приведенные выше результаты показывают то, что буферизованный жидкий препарат, содержащий сахарозу, одновалентную соль и EDTA, и предпочтительно также содержащий этанол, демонстрирует особенно хорошую стабильность.



Такие соединения могут присутствовать или могут не присутствовать в препаратах согласно изобретению.





Пример 2: влияние рН на стабильность вируса MVA
Протестировали влияние рН жидкого препарата на стабильность вируса осповакцины для того, чтобы определить подходящий интервал рН для стабильных жидких препаратов.
Материалы и методы
Вирусы MVA
Использованным вирусом MVA был MVA-HCV (TG4040) - рекомбинантный вирус MVA, экспрессирующий неструктурные белки HCV (NS3, NS4 и NS5B) из штамма ja генотипа 1 b HCV (см. WO 2004/111082), который разводили до исходной целевой концентрации 4-8×107 ИГ/мл.
MVA-HCV был получен в фибробластах эмбрионов курицы (CEF) и выделен, и очищен способом, включающим выделение инфицированной культуры CEF, разрушение клеток механическими способами и разные стадии очистки, которые не включают какую-либо стадию обработки протеазой.
Протестированные препараты
Протестированные препараты представлены в Таблице 12 ниже:

Анализ стабильности
Анализ стабильности проводили, как описано в Примере 1.
Измерение инфекционных титров
Измерение инфекционных титров делали, как описано в Примере 1.
Результаты
Влияние рН на стабильность MVA-HCV при +37°С и +5°С в препарате, содержащем Tris-HCl, Na глутамат, сахарозу, NaCl, EDTA и этанол, тестировали при разных значениях рН. Результаты представлены на Фиг. 12А и 12Б.
При +37°С (Фиг. 12А) уже через 7 суток очевидно то, что важно, чтобы рН находился в интервале от более чем 6 до менее чем 9. В частности, хорошие результаты получаются, когда рН составляет от 7 до 8.
При +5°С (Фиг. 12Б) результаты в 12 месяцев также свидетельствуют о том, что лучше, чтобы рН находился в интервале от более чем 6 до менее чем 9. В частности, хорошие результаты получаются, когда рН составляет от 7 до 8.
Заключения
Приведенные выше результаты показывают то, что рН жидкого препарата вируса осповакцины предпочтительно должен находиться в интервале от более чем 6 до менее чем 9. В частности, хорошие результаты получаются, когда рН составляет от 7 до 8. рН, составляющий от 6,5 до 8,5, таким образом, может быть приемлемым.
Пример 3: влияние исходного титра вируса MVA на стабильность
Затем также тестировали влияние исходного титра вируса осповакцины на последующую стабильность в жидком препарате.
Материалы и методы
Вирусы MVA
Использованный вирус MVA представлял собой MVA-HCV (TG4040) - рекомбинантный вирус MVA, экспрессирующий неструктурные белки HCV (NS3, NS4 и NS5B) из штамма ja генотипа 1 b HCV (см. WO 2004/111082), который был разведен до варьирующих исходных целевых концентраций: 1,0×108 БОЕ/мл, 5,0×107 БОЕ/мл, 1,0×107 БОЕ/мл и 5,0×106 БОЕ/мл.
MVA-HCV продуцировали в фибробластах эмбрионов курицы и выделяли и очищали способом, включающим выделение инфицированной культуры CEF, разрушение клеток механическими способами и разные стадии очистки, которые не включают какую-либо стадию обработки протеазой.
Протестированные препараты
Протестированные препараты представлены в Таблице 13 ниже:

Анализ стабильности
Анализ стабильности проводили, как описано в Примере 1.
Измерение инфекционных титров
Измерение инфекционных титров делали, как описано в Примере 1.
Результаты
Развитие потерь инфективности MVA-HCV при варьирующих исходных титрах при +37°С, +25°С и +5°С представлено на Фиг. 13А, 13Б и 13В соответственно.
При +37°С инфекционные титры всех препаратов согласно изобретению снижались меньше, чем на 1 log через 7 суток. Однако можно наблюдать тенденцию к более высокой стабильности препаратов с более высоким исходным титром MVA-HCV. В сутки 14 инфекционные титры всех препаратов согласно изобретению, за исключением препарата, содержащего исходный титр MVA-HCV 5,0×106 БОЕ/мл, снижались все еще меньше, чем на 1 log, но наблюдается явная тенденция к более высокой стабильности препаратов с более высоким исходным титром MVA-HCV. Это наблюдение подтверждается в сутки 28, только препараты согласно изобретению, содержащие исходный титр MVA-HCV 5,0×107 БОЕ/мл или 1,0×108 БОЕ/мл демонстрируют потерю инфективности меньше, чем 1 log (Фиг. 13А).
Такой же тип наблюдений был сделан при +25°С (Фиг. 13Б). Однако отличие стабильности препаратов согласно изобретению, в зависимости от исходного титра MVA-HCV, скорее различало два подсемейства: три препарата с по меньшей мере 1,0×107 БОЕ/мл (которые демонстрируют потерю инфекционного титра меньше, чем 1 log в 7 месяцев) и единственный препарат с меньше, чем 1,0×107 БОЕ/мл (5,0×106 БОЕ/мл, который демонстрирует потерю инфекционного титра более чем 1 log в 7 месяцев и уже демонстрирует потерю инфекционного титра почти 1 log в 3 месяца).
При +5°С отличие стабильности препаратов согласно изобретению, в зависимости от исходного титра MVA-HCV, различает те же самые два подсемейства, что и при +25°С (Фиг. 13В): три препарата с по меньшей мере 1,0×107 БОЕ/мл (которые демонстрируют потерю инфекционного титра меньше, чем 0,2 log в 18 месяцев) и единственный препарат с меньше, чем 1,0×107 БОЕ/мл (5,0×106 БОЕ/мл, который демонстрирует потерю инфекционного титра более чем 0,5 log уже в 12 месяцев и более чем определенный предел 0,3 log уже в 2 месяца).
Заключения
В виду приведенных выше результатов, по-видимому, исходный титр по меньшей мере 1,0×107 БОЕ/мл является высоко предпочтительным для гарантии стабильности жидкого препарата MVA.
Пример 4: стабильность разных штаммов вируса осповакцины
Для того, чтобы подтвердить стабильность оптимизированных препаратов, определенных в предыдущих примерах, такие оптимизированные препараты тестировали на разных штаммах вируса осповакцины в двух отличных экспериментах.
Материалы и методы
Вирусы
Использовали следующие вирусы осповакцины:




Данные три вируса MVA продуцировали в фибробластах эмбрионов курицы и выделяли и очищали способом, включающим выделение инфицированной культуры CEF, разрушение клеток механическими способами и разные стадии очистки, которые не включают какую-либо стадию обработки протеазой.






Способы, использованные для продукции/очистки вирусов MVA-HCV/CEC, MVA-HCV/линия клеток утки, MVA-FCU1/СЕС, Copenhagen-FCU1/CEC не включают какую-либо стадию с добавлением фермента-протеазы.


Протестированные препараты
Эксперимент 1:
Протестированные препараты для вирусов MVA представлены в Таблице 14 ниже:
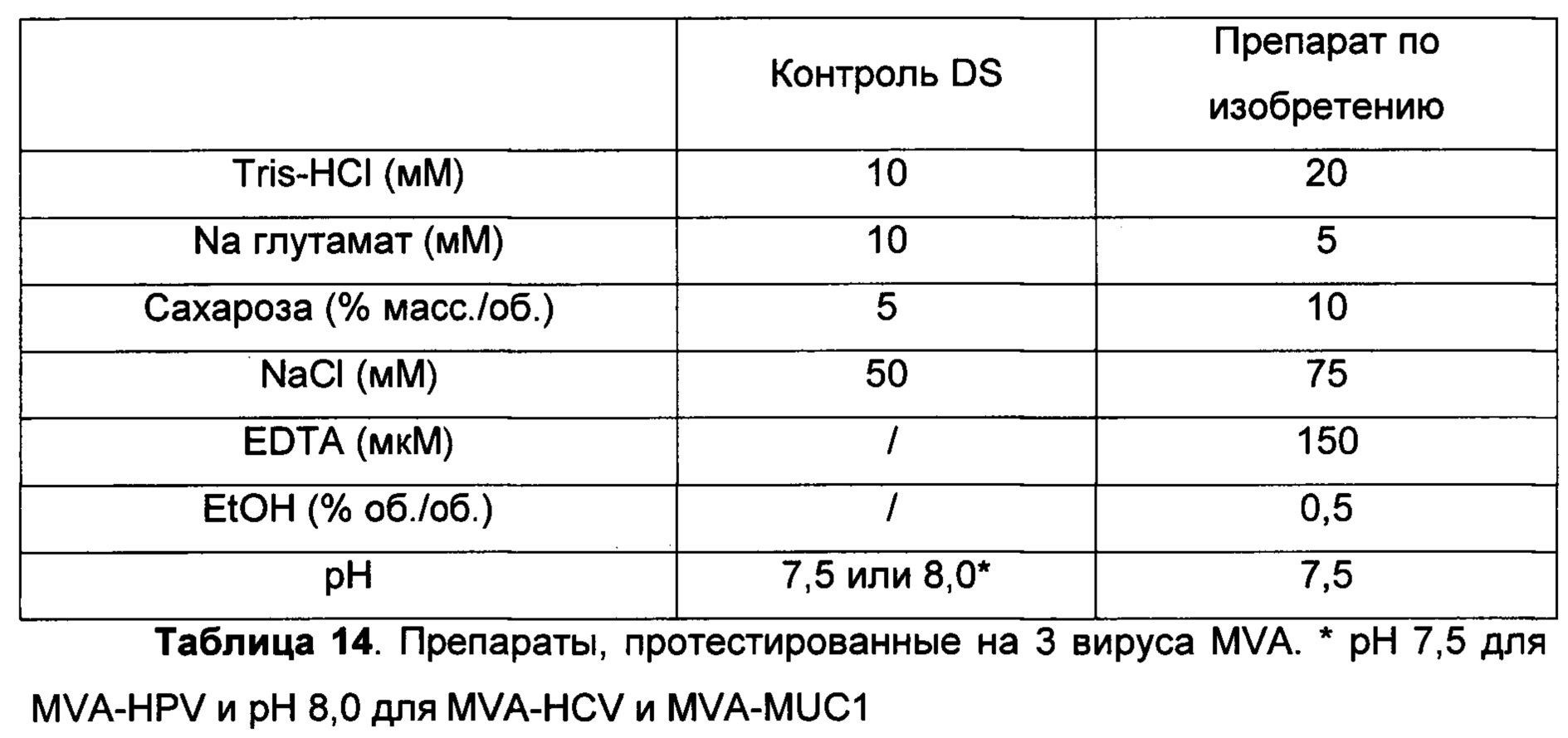
Эксперимент 2:
Протестированные препараты для вирусов MVA-HCV/CEC, MVA-HCV/линия клеток утки, MVA-FCU1/CEC и Copenhagen-FCU1/CEC представлены в Таблице 15А ниже:


Эксперимент 3:
Протестированные препараты для вируса VV Wyeth представлены в Таблице 15Б ниже:

Анализ стабильности
Анализ стабильности проводили, как описано в Примере 1.
Измерение инфекционных титров
Измерение инфекционных титров делали, как описано в Примере 1.
Результаты
Эксперимент 1:
Стабильность трех вирусов MVA в оптимизированном препарате по изобретению при +37°С, +25°С и +5°С представлена на Фиг. 14А, 14Б и 14В соответственно.
При +37°С все три вектора на основе MVA демонстрировали потерю инфекционного титра меньше, чем 1 log в сутки 28, таким образом, демонстрируя очень хорошую стабильность при этой повышенной температуре.
При +25°С все три вектора на основе MVA также демонстрировали потерю инфекционного титра меньше, чем 1 log в 6 месяцев, таким образом, также демонстрируя очень хорошую стабильность при этой температуре.
Наконец, все три вектора на основе MVA также демонстрировали потерю инфекционного титра меньше, чем 0,3 log через 30 месяцев при +5°С, таким образом, демонстрируя очень высокую стабильность при этой целевой температуре хранения.
В то время как некоторые небольшие изменения можно наблюдать, в зависимости от использованного вектора на основе MVA, приведенные выше результаты ясно показывают то, что оптимизированный препарат, разработанный в предшествующих примерах, применим к любому вектору на основе MVA, независимо от того, какая(кие) гетерологичная(ные) последовательность(ти) вставлена(ны) в него.
Эксперимент 2:
В этом втором эксперименте тот же самый препарат, ранее оптимизированный для MVA, тестировали на нескольких вирусах MVA, полученных разными способами, и на другом штамме вируса осповакцины: Copenhagen (вектор TG6002).
Результаты представлены на Фиг. 15А и показывают то, что протестированный препарат согласно изобретению, который был оптимизирован на вирусах MVA, также обеспечивает стабилизацию других штаммов вируса осповакцины, таких как Copenhagen. В частности, для всех протестированных вирусов наблюдается потеря меньше, чем 1 log в сутки 14.
Наименее стабилизированным вирусом является MVA-HCV/CEC. Это может объясняться тем фактом, что данный вирус представляет собой вирус, используемый с наименьшим исходным титром.
Эксперимент 3:
В данном третьем эксперименте тот же самый препарат, ранее оптимизированный для MVA, тестировали на другом штамме вируса осповакцины (штамме Wyeth), который был продуцирован в непрерывной линии клеток человека и очищен способом, который включает по меньшей мере одну стадию обработки по меньшей мере одной протеазой.
Результаты представлены на Фиг. 15Б и показывают то, что протестированный препарат согласно изобретению, который был оптимизирован на вирусах MVA, также обеспечивает стабилизацию штамма вируса осповакцины Wyeth, несмотря на потенциальное остаточное присутствие некоторого количества протеазы в окружении данного вируса. В частности, в сутки 28 наблюдается потеря меньше, чем 1 log.
Также следует отметить то, что в контексте окружения вируса, которое может содержать некоторое остаточное количество протеазы, увеличение концентрации одновалентной соли (NaCl) от 200 до 500 мМ дополнительно увеличивает стабильность вируса.
Заключения
Приведенные выше результаты ясно демонстрируют то, что оптимизированные препараты, разработанные авторами изобретения, являются применимыми для разных штаммов вирусов осповакцины, и что гетерогенные конструкции, которые могут быть вставлены в такие вирусы, не оказывают значимого влияния на стабилизацию, обеспечиваемую оптимизированными препаратами согласно изобретению.
Приведенные выше результаты также показывают то, что оптимизированные препараты, разработанные авторами изобретения, являются применимыми, даже когда способ очистки включает обработку по меньшей мере одной протеазой, и, таким образом, когда окружение вируса может содержать остаточную протеазу. В данном конкретном случае увеличение концентрации одновалентной соли препарата до более чем 200 мМ дополнительно улучшает стабильность.
Пример 5: замена предпочтительных соединений соединениями того же самого семейства или других семейств
Для того чтобы подтвердить, могли ли индивидуальные соединения, протестированные ранее, быть заменены другими соединениями того же самого семейства или других семейств, провели эксперимент, в котором каждое из ранее протестированных индивидуальных соединений оптимизированного препарата было заменено соединением того же самого семейства или других семейств:





Материалы и методы
Вирус
Использованным вирусом MVA был MVA-MUC1 (TG4010) - рекомбинантный вирус MVA, экспрессирующий ассоциированный с опухолью антиген MUC1 и интерлейкин 2 (см. WO 92/07000 и WO 95/09241), разведенный до исходного целевого титра от 8,0×107 до 2×108 ИГ/мл.
MVA-MUC1 продуцировали в фибробластах эмбрионов курицы и выделяли и очищали способом, включающим выделение инфицированной культуры CEF, разрушение клеток механическими способами и разные стадии очистки, которые не включают какую-либо стадию обработки протеазой.
Протестированные препараты
Протестированные препараты представлены в Таблице 16 ниже:



Анализ стабильности
Анализ стабильности проводили, как описано в Примере 1.
Измерение инфекционных титров
Измерение инфекционных титров делали, как описано в Примере 1.
Результаты
Потери инфективности разных протестированных препаратов при +37°С представлены на Фиг. 16А.
Статистическую значимость замены исходно протестированного соединения одним из других соединений, упомянутых выше, анализировали с использованием программы NemrodW® через 21 (Фиг. 16Б) или 28 (Фиг. 16В) суток при +37°С. Результаты показывают то, что:





Потери инфективности разных протестированных препаратов при +5°С представлены на Фиг. 16Г. Результаты показывают то, что в сутки 180 все протестированные препараты демонстрируют очень низкие потери инфективности, причем все они меньше 0,3 log10.
Заключения
Приведенные выше результаты ясно демонстрируют то, что в оптимизированном препарате согласно изобретению исходно протестированные соединения могут быть заменены другими соединениями того же самого семейства (Tris-HCl - другим буфером с буферной емкостью от рН 7 до рН 8, NaCl - другой одновалентной солью, сахароза - другим дисахаридом или сахароспиртом, EDTA -другим хелатором, EtOH - другим С2-С3 спиртом) без значимого изменения стабильности вируса осповакцины.
В отличие от этого, NaCl или другую одновалентную соль не следует заменять двухвалентной солью, таким образом, подтверждая предыдущие результаты, демонстрирующие вредный эффект двухвалентных солей при их присутствии в значительной концентрации (в данном случае 75 мМ).
Пример 6: иммунизирующие свойства in vivo стабильного жидкого препарата MVA согласно изобретению
Кроме того, подтвердили, имел ли стабилизированный жидкий препарат MVA согласно изобретению аналогичную иммуногенность in vivo после 12 месяцев хранения, чем только что полученный препарат MVA.
Материалы и методы
Вирус MVA
Используемым вирусом MVA был MVA-MUC1 (TG4010) - рекомбинантный вирус MVA, экспрессирущий ассоциированный с опухолью антиген MUC1 и интерлейкин 2 (см. WO 92/07000 и WO 95/09241), разведенный до исходного целевого титра от 1 до 3×108 БОЕ/мл.
MVA-MUC1 продуцировали в фибробластах эмбрионов курицы и выделяли и очищали способом, включающим выделение инфицированной культуры CEF, расщепление клеток механическими способами и разные стадии очистки, которые не включают какую-либо стадию обработки протеазой.
Протестированный препарат и хранение
MVA-MUC1 готовили в жидком препарате, содержащем 20 мМ Tris-HCl, 10% масс./об. сахарозы, 75 мМ NaCl, 150 мкМ EDTA, 0,5% об./об. EtOH и 5 мМ Na глутамат.
Для анализа иммуногенности использовался либо только что приготовленный MVA, который хранили при -80°С (Т равно 0), либо приготовленный MVA, который хранили на протяжении 12 месяцев при +5°С плюс/минус 3°С (Т равно 12 месяцев).
Анализ иммуногенности
Используемой моделью является профилактическая модель, в которой вектор MVA-MUC1 инъецируется мышам до дополнительного введения опухолевых клеток, экспрессирующих антиген MUC1. Дополнительные подробности приведены ниже:
1-ый эксперимент:







2-ой эксперимент:
Использовали ту же самую модель для сравнния иммуногенности одного препарата или MVA-MUC1 в препарате в Т равно 0 и Т равно 24 месяца для дозы 104 БОЕ.
Результаты
1-ый эксперимент:
В Таблице 17А ниже представлена процентная доля мышей, которые не содержали опухоли в сутки 86, в зависимости от инъецированного продукта (один препарат или MVA-MUC1 после 0 или 12 месяцев хранения) и дозы.

Приведенные выше результаты показывают то, что:


2-й эксперимент:
В Таблице 17Б ниже представлена процентная доля мышей, которые не содержали опухоли в сутки 65, в зависимости от продукта (один препарат или MVA-MUC1 после 0 или 24 месяцев хранения).


Приведенные выше результаты показывают то, что:


Заключение
Приведенные выше данные подтверждают то, что оптимизированные препараты согласно изобретению не только поддерживают инфекционные титры вируса на протяжении хранения в течение двух лет, но также поддерживают способность индуцировать защитный иммунный ответ in vivo.
Пример 7: защитный эффект EDTA против повреждения УФ
Известно, что вирус осповакцины является чувствительным к повреждению УФ (см. LYTLE et al. J. Virol. 2005, 79(22): 14244). Способность разных препаратов защищать вирус осповакцины против повреждения УФ тестировали в двух независимых экспериментах.
Материалы и методы
Вирусы MVA
Используемый вирус MVA представлял собой MVA-HCV (TG4040) - рекомбинантный вирус MVA, экспрессирующий неструктурные белки HCV (NS3, NS4 и NS5B) из штамма ja генотипа 1 b HCV (см. WO 2004/111082), который разводили до исходного целевого титра от 5×107 до 7×107 ИГ/мл для эксперимента 1 и от 3×108 до 5×108 ИГ/мл для эксперимента 2.
MVA-HCV продуцировали в фибробластах эмбрионов курицы и выделяли и очищали способом, включающим выделение инфицированной культуры CEF, разрушение клеток механическими способами и разные стадии очистки, которые не включают какую-либо стадию обработки протеазой.
Протестированные препараты
Препараты, протестированные в отношении MVA-HCV в эксперименте 1, представлены в Таблице 18 ниже:

Препараты, протестированные в отношении MVA-HCV в эксперименте 2, представлены в Таблице 19 ниже:

Условия освещения
Образцы хранили при следующих условиях освещения:



Анализ стабильности
Стабильность анализировали при +25°С (плюс/минус 2°С) на протяжении 28 суток.
Потери инфективности рассчитывали путем вычитания числа инфекционных геномов на мл (ИГ/мл) во время измерения из исходного числа ИГ/мл в сутки 0 и выражали в виде десятичного логарифма (log10 (ИГ/мл)), что сокращается в настоящем описании как log (IG/мл).
Измерение инфекционных титров
Измерение инфекционных титров осуществляли, как описано в Примере 1.
Результаты
Результаты представлены на Фиг. 17А и 17Б для экспериментов 1 и 2 соответственно.
На Фиг. 17А тестировали эффект разных условий освещения (без освещения, PSM или ICH) на стабильность контрольного и оптимизированного препарата согласно изобретению. Для всех препаратов условия освещения ICH приводят к значительной дестабилизации, что не удивительно, зная чувствительность к свету вируса осповакцины и очень сильное освещение в условиях ICH. Однако, несмотря на дестабилизацию всех препаратов, из Фиг. 17А очевидно то, что применение жидкого препарата согласно изобретению приводит к пониженной дестабилизации MVA-HCV (см., в частности, потери инфективности в сутки 2, 3 и 7). Следует отметить, что при этих радикальных условиях освещения потери инфекционного титра, наблюдаемые с контрольным препаратом, усиливались, достигая 1 log в сутки 2.
Кроме того, в случае более умеренных условий освещения (условия PSM) применение жидкого препарата согласно изобретению также приводит к значительно уменьшенной дестабилизации MVA-HCV, причем потери инфективности через 28 суток при +25°С являются, главным образом, меньшими, чем 0,5 log, тогда как они превышают 1 log через 21 сутки при 25°С с контрольным препаратом.
На Фиг. 17Б тестировали стабилизирующий эффект разных препаратов при условиях освещения ICH. Как и на Фиг. 17А, оптимизированный препарат, содержащий Tris-HCl, NaCl, Na глутамат, сахарозу, EDTA и EtOH, улучшает стабильность при условиях освещения ICH лучше, чем контрольный препарат без EDTA и EtOH. Кроме того, Фиг. 17Б демонстрирует то, что стабилизирующий эффект обусловлен EDTA, так как препарат с EDTA, но без EtOH имеет аналогичный стабилизирующий эффект, тогда как препарат с EtOH, но без EDTA не лучше, чем контрольный препарат.
Заключения
Приведенные выше результаты ясно показывают то, что препараты согласно изобретению не только стабилизируют вирус осповакцины в отсутствие света, но также дополнительно защищают вирус осповакцины против деградации из-за повреждения УФ. Это может быть очень полезным для уменьшения ограничений по хранению вируса осповакцины в жидком препарате.
Пример 8: надежный стабилизирующий эффект заявленных препаратов при варьирующих концентрациях ингредиентов
Для того чтобы протестировать надежность стабилизирующего эффекта препаратов согласно изобретению, тестировали несколько препаратов, содержащих варьирующие концентрации различных ингредиентов, на их способность стабилизировать вектор на основе MVA.
Материалы и методы
Вирус
Используемым вирусом MVA был MVA-MUC1 (TG4010) - рекомбинантный вирус MVA, экспрессирующий ассоциированный с опухолью антиген MUC1 и интерлейкин 2 (см. WO 92/07000 и WO 95/09241), разведенный до исходного целевого титра от 1 до 4×108 БОЕ/мл.
MVA-MUC1 продуцировали в фибробластах эмбрионов курицы и выделяли и очищали способом, включающим выделение инфицированной культуры CEF, разрушение клеток механическими способами и разные стадии очистки, которые не включают какую-либо стадию обработки протеазой.
Протестированные препараты
Протестированные препараты представлены в Таблице 20 ниже:
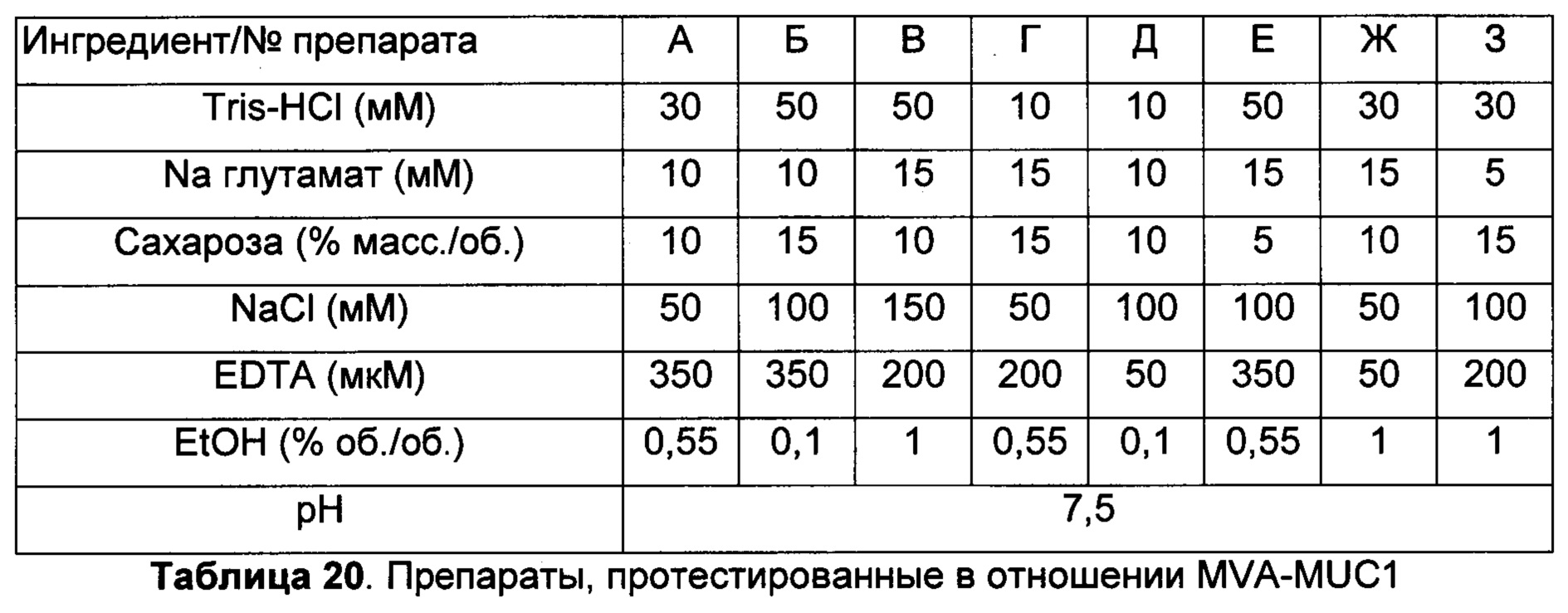
Анализ стабильности
Анализ стабильности проводили, как описано в Примере 1.
Измерение инфекционных титров
Измерение инфекционных титров делали, как описано в Примере 1.
Результаты
Потери инфективности разных протестированных препаратов при +37°С представлены на Фиг. 18.
В сутки 21 после приготовления все протестированные препараты имели потери инфективности меньше 1 log10. В сутки 28 большинство протестированных препаратов также имели потери инфективности меньше 1 log10.
Заключение
Приведенные выше данные подтверждают то, что оптимизированные препараты согласно изобретению имеют надежный стабилизирующий эффект в интервале концентраций ингредиентов, содержащихся в препарате.
Пример 9: стабилизирующий эффект заявленных препаратов на другой тип вируса осповакцины
Материалы и методы
Вирус
Использовали нерекомбинантный вирус ложной коровьей оспы (семейство парапоксвирусов) при исходном целевом титре от 1 до 3×108 БОЕ/мл.
Протестированные препараты
Протестированные препараты представлены в Таблице 21 ниже:

Анализ стабильности
Анализ стабильности проводили, как описано в Примере 1, при 37°С.
Измерение инфекционных титров
Измерение инфекционных титров делали, как описано в Примере 1.
Результаты
Результаты представлены на Фиг. 19, и они показывают то, что протестированный препарат согласно изобретению сильно стабилизирует вирус ложной коровьей оспы. В частности, в то время как для контрольного вируса ложной коровьей оспы потери инфективности после 28 суток при 37°С составляют свыше 2,5 log10 в одних Tris и сахарозе, для приготовленного в виде препарата вируса ложной коровьей оспы потери инфективности после 28 суток при 37°С составляют лишь примерно 0,5 log10.
Заключение
Приведенные выше результаты ясно показывают то, что препараты согласно изобретению также подходят для стабилизации вируса ложной коровьей оспы - вируса группы оспы из семейства парапоксвирусов.
БИБЛИОГРАФИЧЕСКИЕ ССЫЛКИ
ANTOINE et al., 1998, Virol. 244, 365-396;
BREITBACH CJ et al., 2011, Curr Pharm Biotechnol. Vol 12. No 12;
EVANS et al. 2004 Oct, J Pharm Sci., 93(10):2458-75;
EZZEDINE et al., 1991, New Biol 3:608;
GOEBEL et al., 1990, Virol. 179:247-266;
GOEBEL et al., 1990, Virol. 179:517-563;
GOMEZ et al., 2008, Current Gene Therapy, 8:97-120;
IVANOV et al., Experimental Pathology and Parasitology, 4/2000 Bulgarian Academy of Sciences;
JOHNSON et al., 1993, Virol. 196:381-401;
KIM JH et al., 2006 Sep, Mol Ther. 14(3):361-70;
KIRN et al., 2009 Jan, Nat Rev Cancer, 9(1):64-71;
LAMB et al., 1985, Eur. J. Biochem., 148:265-270;
LIU et al., 2004 Oct 5, Proc Natl Acad Sci USA, 101 Suppl 2:14567-71;
LYTLE et al., 2005, J. Virol. 79(22): 14244;
MASSEY R. et al., 1987, Nature, 328:457-458;
MAYR et al., 1975, Infection 3:6-16;
MOOLTEN, 1986, Cancer Res. 46:5276;
MULLEN et al., 1922 PNAS 89:33;
OSBORNE JD et al., 2007 Dec 17, Vaccine, 25(52):8807-32;
REXROAD et al., June 2002, Cell Preservation Technology, 1(2): 91-104;
ROCHLITZ et al., 2003 Aug, J Gene Med., 5(8):690-9;
SHI et al., 2005 Jul, J Pharm Sci. 94(7):1538-51;

EP 1418942;
US 4675187;
US 5879924;
US 7456009;
US 7914979;
US 2007/0161085;
WO 88/07378;
WO 90/10459;
WO 91/11201;
WO 92/07000;
WO 95/09241;
WO 98/04705;
WO 99/03885;
WO 99/54481;
WO 2004/111082;
WO 2005/007840;
WO 2005/007857;
WO 2007/030668;
WO 2007/077256;
WO 2007/121894;
WO 2007/147528;
WO 2008/113078;
WO 2009/004016;
WO 2009/065546;
WO 2009/065547;
WO 2010/130753;
WO 2014/009433;
WO 2014/009438;
WO 2014/029702;
WO 2014/053571.
Реферат
Группа изобретений относится к жидким препаратам вируса группы оспы. Жидкий препарат вируса группы оспы содержит вирус группы оспы с титром от 10до 10БОЕ (бляшкообразующих единиц)/мл, фармацевтически приемлемый буфер, выбранный из TRIS-HCl, TRIS, HEPES и трицина, в концентрации от 10 до 50 мМ, одновалентную соль, выбранную из NaCl и KCl, в концентрации от 10 до 1000 мМ, фармацевтически приемлемый дисахарид или сахароспирт, выбранный из сахарозы, трегалозы и маннита, в концентрации от 5 до 20% (масс./об.) и фармацевтически приемлемый хелатор, выбранный из этилендиаминтетрауксусной кислоты (EDTA), этиленгликольтетрауксусной кислоты (EGTA) и диэтилентриаминпентауксусной кислоты (DTPA), в концентрации от 50 до 250 мкМ, где рН препарата составляет от 6,5 до 8,5. Также раскрыто применение фармацевтически приемлемого хелатора для стабилизации вируса группы оспы против повреждения ультрафиолетом. Группа изобретений обеспечивает стабильность вируса группы оспы при хранении. 2 н. и 17 з.п. ф-лы, 39 ил., 21 табл., 9 пр.

Комментарии