Применение алифатических иминопроизводных камфоры в качестве эффективных ингибиторов репродукции вируса гриппа штамм a/california/07/09 (h1n1) pdm09 и a/puerto rico/8/34 (h1n1) - RU2651754C1
Код документа: RU2651754C1
Описание
Изобретение относится к медицине и фармацевтике, конкретно, к биологически активным веществам, представляющим собой иминопроизводные камфоры общей формулы I:

где n=1, 2, 3, 4, 5;
которые могут использоваться в качестве ингибиторов репродукции вируса гриппа (штамм A/California/07/09 (H1N1)pdm09 и A/Puerto Rico/8/34 (H1N1)) и могут быть использованы в медицине, вирусологии и фармакологии.
Одним из актуальных направлений современной медицинской химии является разработка противовирусных препаратов. Грипп - острое инфекционное заболевание дыхательных путей, вызываемое РНК-содержащим вирусом, имеющим высокую эпидемиологическую и клиническую значимость с высокой частотой осложнений среди лиц, повышенного уровня риска. Первая волна пандемии гриппа A/H1N1/2009 года стала достаточно серьезной проблемой - отсутствие необходимого количества средств противовирусной терапии, инъекционных препаратов для лечения тяжелых форм гриппозной инфекции, ограничение возможности использования препаратов вследствие появления резистентных штаммов.
Заболеваемость гриппом, вне редких пандемий, характеризуется ежегодными эпидемическими подъемами с выраженным сезонным характером. В странах Северного полушария эпидемии гриппа происходят, как правило, в зимний период. Однако спорадические случаи заболевания гриппом регистрируются также и в другие сезоны года. По данным ВОЗ, во всем мире ежегодные эпидемии гриппа приводят примерно к 3-5 млн. случаев тяжелых форм заболевания и примерно к 250000-500000 случаев смерти. Большинство случаев смерти, связанных с гриппом, в промышленно развитых странах происходит среди людей 65 лет и старше. Максимальные показатели заболеваемости отмечаются в городах с большой численностью населения (Москва, Санкт-Петербург и др.), где заболеваемость гриппом и ОРВИ превышает аналогичный показатель по России в 1,7 и 1,6 раза, соответственно [«Грипп у взрослых: методические рекомендации по диагностике, лечению, специфической и неспецифической профилактике» / под ред. академика, проф. А.Г. Чучалина Санкт-Петербург: Издательско-полиграфический комплекс «НП-Принт», 2014]. Грипп и ОРВИ остаются практически неконтролируемыми заболеваниями из-за высокой изменчивости антигенной структуры циркулирующих вирусов гриппа и гетерогенности возбудителей ОРВИ. Кроме того, вирусы гриппа и других ОРВИ способны изменять свои свойства и патогенность. Последним примером таких изменений является возбудитель гриппа H1N1, циркулирующий в эпидемический сезон 2009-2010 гг., получивший название «свиной грипп».
Противовирусные средства для лечения гриппа представляют собой очень ограниченную группу лекарственных препаратов, причем для большинства из них известна лекарственная резистентность.
Каркасные соединения (соединения имеющих в своем остове жесткий структурный блок) широко использовались в качестве противовирусных препаратов. Так, адамантановые препараты являются дешевыми в производстве, что делает их доступными для лечения и профилактики гриппа среди населения. Однако в настоящее время в результате широкого использования адамантановых препаратов (ремантадин и амантадин) значительно утрачены их противовирусные свойства в отношении вирусов гриппа А. Потерю активности в основном связывают с мутацией в трансмембранном домене белка М2 вируса гриппа. Кроме хорошо известного ремантадина, сравнимой с ним противовирусной активностью обладает достаточно обширный класс соединений. Так, известно средство на основе дейтифорина (2-(1'-аминоэтил)бицикло[2.2.1]гептана, являющееся одним из наиболее интересных препаратов на основе природных бициклических каркасных соединений - борнанов [Патент RU 2448692 С2, оп. 27.04.2012]. Симметричные диимины на основе камфоры, разделенные алифатической цепочкой, обладают сравнительно высокой активностью (индекс селективности от 40 до 89) [Патент РФ 2520967]. Известно соединение, являющееся продуктом взаимодействия камфоры и аминоэтанола, обладающее высокой противовирусной активностью [Патент РФ 2530554].
Наиболее близким к структуре заявляемых соединений - прототипом, настоящего изобретения является дейтифорин, представляющий собой фармацевтические соли (2-(1'-аминоэтил)бицикло[2.2.1]гептана общей формулы II

Недостатком известного соединения II является невысокая противовирусная активность.
Задачей изобретения является повышение эффективности подавления репродукции вируса гриппа и расширение ассортимента ингибиторов репродукции вируса гриппа для преодоления лекарственной устойчивости современных вирусных штаммов.
Поставленная задача решается новыми соединениями общей формулы I, обладающими выраженными свойствами ингибиторов репродукции вируса гриппа.

где n=1, 2, 3, 4, 5.
Соединения общей формулы I перспективны далее для использования как в индивидуальном виде, так и в качестве компонента композиционных противовирусных лекарственных форм.
Исследования биологической активности соединений I, проведенные в отношении двух штаммов вируса гриппа (штамм A/California/07/09 (H1N1)pdm09 и A/Puerto Rico/8/34 (H1N1)), показали их высокую эффективность как ингибиторов репродукции этого вируса. Камфора, будучи предшественником соединений I, не проявила противовирусной активности в проведенных исследованиях. Полученные количественные показатели ингибирования подтверждают высокую степень подавления репликации вируса гриппа в культуре клеток соединениями 1, превышающую тот же показатель у эталонов сравнения - амантадина и римантадина в 15 и более раз. Использование в качестве препаратов сравнения адамантановых производных обусловлено наличием жестких структурных фрагментов как в полученных нами соединениях, так и в указанных препаратах. Для соединений Ia, Ib проведено изучение токсичности in vivo. Было показано, что LD50 соединений Ia, Ib превышает 2000 мг на кг.
Синтез соединений Ia и Ib проводили в закрытой системе с использованием изопропилата титана в качестве дегидратирующего средства и при микроволновом облучении, что позволяет избежать снижения концентрации амина в реакционной смеси и приводит к увеличению выхода целевого продукта. При переходе к высшим гомологам бутиламина меняются условия синтеза соответствующих иминов. Нами показано, что в случае n≥3 оптимальными условиями синтеза иминов Ic-е является нагревание до кипения исходных реагентов без растворителя с использованием в качестве катализатора ZnCl2. Контроль над всеми реакциями осуществляли отбором проб и анализом с помощью ГХ-МС.
Спектральные исследования выполнены в Химическом Сервисном Центре коллективного пользования СО РАН. Величины удельного вращения [α]589 определяли на спектрометре PolAAr 3005. Спектры ЯМР1Н и13С регистрировали на спектрометрах Bruker AV-400 (1Н: 400.13 МГц,13С: 100.61 МГц), DRX-500 (1Н: 500.13 МГц,13С: 125.76 МГц). В качестве внутреннего стандарта использовали остаточные сигналы растворителя - хлороформа (δн 7.24, δс 76.90 м.д.). Нумерация атомов в соединениях дана для отнесения сигналов в спектрах ЯМР и не совпадает с нумерацией атомов в номенклатурном названии. Масс-спектры высокого разрешения записывали на спектрометре DFS Thermo Scientific в режиме полного сканирования в диапазоне m/z 0-500, ионизация электронным ударом 70 эВ при прямом вводе образца. Разделение продуктов реакций проводили с помощью колоночной хроматографии на силикагеле (60-200 μ, Masherey-Nagel). Хромато-масс-спектры записывали на газовом хроматографе Agilent 7890 А с квадрупольным масс-спектрометром Agilent 5975С в качестве детектора, кварцевая колонка HP-5MS 30000×0.25 мм, газ-носитель - гелий.. Удельное вращение выражено в (град⋅мл)⋅(г⋅дм)-1, концентрация раствора (г)⋅(100 мл)-1. Растворители перед использованием сушились и перегонялись.
Изобретение иллюстрируется следующими примерами:
Пример 1.
Общая методика получения оснований Шиффа с использованием микроволнового излучения.
В виалу для микроволновой печи объемом 10 мл поместили рассчитанные количества соответствующего амина (1.5 экв), (+)-камфоры (1 экв) и Ti(iOPr)4 (1 экв). Затем виалу поместили в микроволновую печь СЕМ (Discover). Время проведения реакции 1.5 часа, температура 140°C. По окончании реакционную смесь охладили до комнатной температуры, добавили 0.1 М КОН, перемешивали 15 мин. Образующийся осадок отфильтровали, супернатант разбавили насыщ. NaCl, экстрагировали EtOAc. Объединенный органический слой сушили над Na2SO4. Растворитель удалили на ротационном испарителе. Очищали колоночной хроматографией на 10 г SiO2, элюент гексан/этилацетат (100:0→0:100)+метанол (1%).
N-((1R,4R)-1,7,7-Триметилбицикло[2.2.1]гептан-2-илиден)пропан-1-амин.

Выход 45%. ЯМР1Н (400 МГц, CDCl3, δ, м.д., J/Гц): 0.71 (3Н, с, Ме-9), 0.84 (3Н, т, J=7.4, Ме-13), 0.87 (3H, с, Ме-10), 0.92 (3H, с, Ме-8), 1.14 (1Н, ддд,2J=12.3, J4эндо,5эндо=9.3, J4эндо, 5экзо=4.2, Н-4эндо), 1.30 (1H, ддд, J=12.3, J5эндо, 4эндо=9.3, J5эндо, 4экзо=4.5, Н-5эндо), 1.51-1.65 (3H, м, Н-5экзо, 2Н-12), 1.76-1.85 (1Н, м, Н-4экзо), 1.74-1.84 (1H, м, Н-4экзо), 1.78 (1Н, д,2J=17.2, Н-2эндо), 1.87 (1Н, дд, J3, 2экзо=J3, 4экзо=4.5, Н-3), 2.83 (1Н, ддд,2J=16.9, J2экзо, 3=4.5, J2экзо, 4экзо=3.8, Н-2экзо), 3.06-3.19 (2Н, м, Н-11).13С ЯМР (125 МГц, CDCl3, δ, м.д.): 180.9 с (С-1), 53.7 т (С-11), 52.9 с (С-6), 46.3 с (С-7), 43.4 д (С-3), 34.9 т (С-2), 31.8 т (С-5), 27.0 т (С-4), 23.3 т (С-12), 19.1 к (С-10), 18.5 к (С-9), 11.5 к (С-13), 11.0 к (С-8).

N-((1R,4R)-1,7,7-Триметилбицикло[2.2.1]гептан-2-илиден)бутан-1-амин.

Выход 51%. ЯМР1Н (400 МГц, CDCl3, δ, м.д., J/Гц): δ 0.70 (3H, с, Ме-9), 0.86 (3H, т, J=7.4, Ме-14), 0.87 (3H, с, 12 Ме-10), 0.91 (3H, с, Ме-8), 1.14 (1H, ддд,2J=12.3, J4эндо, 5эндо=9.3, J4эндо, 5экзо=4.2, Н-4эндо), 1.19-1.37 (3H, м, Н-13, Н-5эндо), 1.47-1.55 (2Н, м, 2Н-12) 1.56-1.64 (1Н, м, Н-5экзо), 1.73-1.84 (1Н, м, Н-4экзо), 1.77 (1H, д,2J=16.7, Н-2эндо), 1.87 (1Н, дд, J3, 2экзо=J3, 4экзо=4.4, Н-3), 2.28 (1Н, ддд,2J=17.0, J2экзo, 3=4.5, J2экзo, 4экзо=3.8, Н-2экзо), 3.09-3.22 (2Н, м, Н-11).13С ЯМР (125 МГц, CDCl3, δ, м.д.): 180.6 с (С-1), 52.9 с (С-6), 51.6 т (С-11), 46.3 с (С-7), 43.4 д (С-3), 34.8 т (С-2), 32.3 т (С-12), 31.7 т (С-5), 27.0 т (С-4), 20.2 т (С-13), 19.0 к (С-10), 18.5 к (С-9), 13.5 к (С-14), 10.9 к (С-8).

Пример 2.
Общая методика синтеза оснований Шиффа без растворителя.
Смесь (+)-камфоры 1 г (0.006 моль) и соответствующего амина (0.01 моль) помещали в круглодонную колбу, снабженную обратным холодильником. Добавляли каталитическое количество ZnCl2 (5% моль). Реакционную смесь нагревали до кипения в течение 8-24 ч в зависимости от строения амина. За ходом реакции следили по ХМС. После завершения реакции, добавили диэтиловый эфир, промыли насыщенным раствором NaCl, сушили безводным Na2SO4 и упаривали досуха. Полученный продукт очищали либо вакуумной перегонкой (Ic, Id, Ie), либо колоночной хроматографией на 20 г SiO2. Элюент гексан/этилацетат (100:0→0:100)+метанол (1%).
N-((1R,4R)-1,7,7-Триметилбицикло[2.2.1]гептан-2-илиден)пентан-1-амин.

Выход 59%. ЯМР1Н (400 МГц, CDCl3, δ, м.д., J/Гц): 0.67 (3H, с, Ме-9), 0.81 (3H, т, J=7.4, Ме-15), 0.84 (3H, с, Ме-10), 0.88 (3H, с, Ме-8), 1.11 (1Н, ддд,2J=12.3, J4эндо, 5эндо=9.3, J4эндо, 5экзо=4.2, Н-4эндо), 1.15-1.30 (5Н, м, Н-14, Н-13, Н-5эндо), 1.45-1.53 (2Н, 2Н-12) 1.53-1.62 (1Н, м, Н-5экзо,), 1.71-1.81 (1H, м, Н-4экзо), 1.75 (1H, д,2J=16.7, Н-2эндо), 1.84 (1Н, дд, J3, 2экзо=J3, 4экзо=4.4, Н-3), 2.25 (1H, ддд,2J=17.0, J2экзо, 3=4.5, J2экзo, 4экзо=3.8, Н-2экзо), 3.04-3.19 (2Н, м, Н-11).13С ЯМР (125 МГц, CDCl3, δ, м.д.): 181.2 с (С-1), 53.2 с (С-6), 52.2 т (С-11), 46.6 с (С-7), 43.6 д (С-3), 35.2 т (С-2), 32.0 т (С-12), 30.1 т (С-5), 29.6 т (С-13), 27.3 т (С-4), 22.4 т (С-14), 19.3 к (С-10), 18.8 к (С-9), 13.9 к (С-15), 11.3 к (С-8).

N-((1R,4R)-1,7,7-Триметилбицикло[2.2.1]гептан-2-илиден)гексан-1-амин.

Выход 75%. ЯМР1Н (400 МГц, CDCl3, δ, м.д., J/Гц): 0,70 (3H, с, Ме-9), 0.83 (3H, т, J=6.6, Ме-16), 0.87 (3Н, с, Ме-10), 0.91 (3H, с, Ме-8), 1.14 (1Н, ддд,2J=12.3, J4эндо, 5эндо=9.3, J4эндо, 5экзо=4.2, Н-4эндо), 1.18-1.33 (7Н, м, Н-13, Н-14, Н-15, Н-5эндо), 1.46-1.54 (3H, м, 2Н-12, Н-5экзо), 1.72-1.84 (1H, м, Н-4экзо), 1.77 (1Н, д,2J=16.7, Н-2эндо), 1.87 (1Н, дд, J3, 2экзо=J3, 4экзо=4.4, Н-3), 2.28 (1Н, ддд,2J=17.0, J2экзo, 3=4.5, J2экзo, 4экзо=3.8, Н-2экзо), 3.09-3.22 (2Н, м, Н-11).13С ЯМР (125 МГц, CDCl3, δ, м.д.): 180.9 с (С-1), 53.1 с (С-6), 52.2 т (С-11), 46.6 с (С-7), 43.6 д (С-3), 35.1 т (С-2), 32.0 т (С-12), 31.5 т (С-5), 30.3 т (С-13), 27.3 т (С-4), 27.0 т (С-14), 22.4 т (С-15), 19.3 к (С-10), 18.8 к (С-9), 13.8 к (С-16), 11.3 к (С-8).

N-((1R,4R)-1,7,7-Триметилбицикло[2.2.1]гептан-2-илиден)гептан-1-амин.
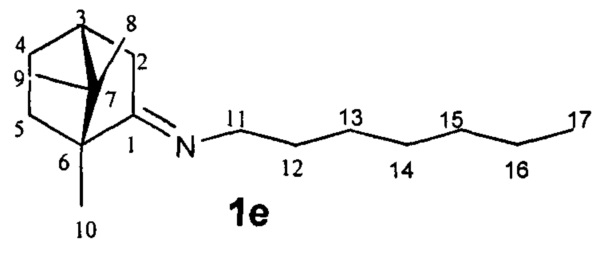
Выход 70%. ЯМР1H (400 МГц, CDCl3, δ, м.д., J/Гц): 0.70 (3H, с, Ме-9), 0.82 (3H, т, J=6.8, Ме-17), 0.87 (3H, с, Ме-10), 0.91 (3H, с, Ме-8), 1.08-1.34 (10Н, м, Н-4эндо, Н-5эндо, 2Н-13, 2Н-14, 2Н-15, 2Н-16), 1.46-1.65 (3H, м, 2Н-12, Н-5экзо), 1.73-1.84 (1H, м, Н-4экзо), 1.77 (1H, д,2J=16.7, Н-2эндо), 1.87 (1Н, дд, J3, 2экзо, J3, 4экзо=4.4, Н-3), 2.28 (1Н, ддд,2J=17.0, J2экзо, 3=4.5, J2экзо, 4зкзо=3.8, Н-2экзо), 3.07-3.22 (2Н, м, Н-11).13С ЯМР (125 МГц, CDCl3) δ, м.д.): 181.0 с (С-1), 53.2 с (С-6), 52.2 т (С-11), 46.6 с (С-7), 43.6 д (С-3), 35.2 т (С-2), 32.0 т (С-5), 31.7 т (С-12), 30.4 т (С-13), 29.0 т (С-14), 27.3 т (С-4 и С-15), 22.4 т (С-16), 19.3 к (С-10), 18.8 к (С-9), 13.9 к (С-17), 11.3 к (С-8).

Пример 3.
Изучение цитотоксичности соединений Ia-е.
Цитотоксичность продуктов была изучена в отношении клеток MDCK. Клетки MDCK сеяли в 96-луночные планшеты и культивировали при 37°C в среде MEM с добавлением 10% сыворотки крупного рогатого скота в атмосфере 5% CO2 (в газопроточном инкубаторе Sanyo-175) до состояния монослоя. Из исследуемых соединений Ia-k готовили маточный раствор концентрации 10 мг/мл в диметилсульфоксиде, после чего готовили серию двукратных разведений препаратов в среде MEM от 1000 до 3,75 μg/ml. Растворенный препарат вносили в лунки планшетов и инкубировали 2 суток при 37°C. По истечении этого срока клетки промывали 2 раза по 5 минут фосфатно-солевым буфером, и количество живых клеток оценивали при помощи микротетразолиевого теста (МТТ). С этой целью в лунки планшетов добавляли по 100 мкл раствора (5 мг/мл) 3-(4,5-диметилтиазолил-2) 2,5-дифенилтетразолия бромида (ICN Biochemicals Inc., Aurora, Ohio) на физиологическом растворе. Клетки инкубировали при 37°C в атмосфере 5% CO2 в течение 2 часов и промывали 5 минут фосфатно-солевым буфером. Осадок растворяли в 100 мкл на лунку ДМСО, после чего оптическую плотность в лунках планшетов измеряли на многофункциональном ридере Victor 1420 (Perkin Elmer, Finland) при длине волны 535 нм. По результатам теста для каждого продукта определяли 50% цитотоксическую дозу (CTD50), т.е. концентрацию соединения, вызывающую гибель 50% клеток в культуре. Результаты приведены в таблице.
Пример 4.
Изучение противовирусной активности препаратов.
Определение противовирусной активности препаратов проводили на клетках MDCK в 96-луночных планшетах для клеточных культур. Соединения растворяли в поддерживающей среде для клеток, вносили в лунки панелей с клеточным монослоем и инкубировали в течение 1 часа при 36°C в атмосфере 5% CO2.
Из вируссодержащей жидкости (штамм A/California/07/09 (H1N1)pdm09) готовили серию десятикратных разведении от 10-1 до 10-7, добавляли в лунки с препаратами и инкубировали при 36°C в течение 48 часов в атмосфере 5% CO2. По окончании срока инкубации 100 мкл культуральной жидкости смешивали с равным объемом 1% куриных эритроцитов в отдельных планшетах с круглым дном. Учет результатов проводили через 60 минут инкубации при 20°C. За титр вируса принимали величину, обратную десятичному логарифму наибольшего разведения исходного вируса, способного вызвать положительную реакцию гемагглютинации в лунке и выражали в количестве 50% инфекционных доз (CTD50). Вирусингибирующее действие исследуемых соединений оценивали по снижению титра вируса в опыте по сравнению с контролем. На основании полученных данных рассчитывали 50% ингибирующую дозу ЕС50, то есть концентрацию препарата, снижающую уровень вирусной репродукции вдвое (на 0,3 lg ID50), и химиотерапевтический индекс, или индекс селективности (SI), представляющий собой отношение CTD50 к ЕС50.
В процессе исследования ингибирования репродукции вируса гриппа соединениями общей формулы I и эталонами сравнения (амантадином, ремантадином и дейтифорином) были получены результаты, приведенные в таблице.

Из таблицы видно, что соединения Ia-е проявляют выраженную противовирусную активность наряду с низкой токсичностью. Так, химиотерапевтический индекс соединений Ia и Ib превышает таковой у препаратов сравнения в 15 и более раз. Преимуществом данных веществ является их активность в отношении ремантадин-устойчивого штамма вируса гриппа A/California/07/09 (H1N1)pdm09 и A/Puerto Rico/8/34 (H1N1), что свидетельствует о перспективности применения их для терапии современных эпидемически актуальных вирусов, подавляющее большинство которых устойчивы к ремантадину.
Пример 5.
Для оценки острой токсичности синтезированных продуктов (Ia, Ib) in vivo использовали белых беспородных мышей (вес 16-20 г). В каждую группу исследования брали по 6 животных. Исследуемые соединения растворяли в физиологическом фосфатном буфере (рН 7.2) и вводили животным внутрибрюшинно однократно в объеме 0,2-0,5 мл. Диапазон доз соединений составил 200-2000 мг/кг веса животных. Смертность животных регистрировали в течение 3 суток после введения. На основании данных по смертности оценивали 50% летальную дозу, т.е. дозу, вызывающую гибель 50% животных в группе. Было показано, что LD50 соединений Ia, Ib превышает 2000 мг/кг.
Реферат
Изобретение относится к области медицины и фармацевтики. Предложено применение иминопроизводных камфоры общей формулы (I), где n=1, 2, 3, 4, 5, в качестве ингибиторов репродукции вируса гриппа штамм A/California/07/09 (H1N1) pdm09 и и A/Puerto Rico/8/34 (H1N1). Технический результат: соединения проявляют выраженную противовирусную активность наряду с низкой токсичностью - химиотерапевтический индекс соединений (1а-е) значительно превышает таковой у препаратов сравнения. 1 табл., 5 пр.
Формула


Комментарии