Офтальмологическая композиция, содержащая повидон-иод - RU2740910C2
Код документа: RU2740910C2
Чертежи
Описание
Целью данного изобретения является офтальмологическая композиция, содержащая повидон-йод (PVP-I) в концентрации от 0,2% до 1,0% (масса/масса), в которой имеются водная и масляная фазы, причем последняя состоит из триглицеридов со средней длиной углеродной цепи и составляет менее 3% от суммарной массы указанной композиции.
Уровень техники
Повидон-йод (PVP-I) представляет собой комплекс йода с полимером, называемым поливинилпирролидоном (PVP) и содержащим в среднем 10% (масса/масса) доступного йода. Для задач данного изобретения доступным считается йод, титруемый тиосульфатом, причем содержание йодид-ионов не превышает 6,6% (масса/масса).
Повидон-йод широко используется в качестве дезинфицирующего средства для обработки повреждений кожи и гигиены полости рта.
Множество данных подтверждают, что бактерицидное действие лекарственных композиций на основе повидон-йода обусловлено только свободным молекулярным йодом (I2), а не йодом, доступным для титрования тиосульфатом (J. Hickey, J. Pharm. Pharmacol. 1997, 49: 1195-1199; Berkelman R.L., J. Clinical Microbiol. 1982, 635-639).
Растворы повидон-йода концентрацией 5% используются в профилактических целях перед офтальмологическими хирургическими вмешательствами только после местной анестезии, так как их введение вызывает жжение и покраснение глаз. Также сообщалось, что офтальмологические галеновы препараты, содержащие повидон-йод в концентрации 2,5%, очень плохо переносятся пациентами, тогда как при концентрации повидон-йода 1-1,25% они переносятся лучше и их закапывание вызывает лишь временное жжение.
Нужда в препаратах с низким содержанием повидон-йода диктуется также тем, что разбавленные водные растворы повидон-йода обладают гораздо более высокой противомикробной активностью, нежели более концентрированные аналогичные растворы, поскольку обеспечивают более высокую концентрацию молекулярного йода I2(Rackur H., Journal of Hospital Infection 1985, 6 Suppl., 13-23). Так, в 10%-ных растворах повидон-йода молекулярный йод I2содержится в концентрации около 1 части на миллион (част./млн.), в 0,1%-ных растворах повидон-йода концентрация молекулярного йода составляет около 20 част./млн.. Автор указанной выше работы объясняет этот феномен тем, что в разбавленных растворах повидон-йода агрегаты поливинилпирролидона, способные захватывать йод, распадаются с высвобождением молекулярного йода легче, чем в концентрированных растворах (Rackur H., Proc. Intl. Symp. on Povidone 1983, Digenis D.J., Ansell J., eds., University of Kentucky College of Pharmacy, p.99).
В водных растворах максимальная концентрация свободного молекулярного йода достигается при концентрациях повидон-йода, близких к 0,1% (масса/масса).
На сегодняшний день для практического применения нет композиций, в которых повидон-йод присутствует в желаемых низких концентрациях, из-за того, что такие композиции нестабильны: со временем концентрация молекулярного йода в них снижается обратно пропорционально концентрации повидон-йода. Иными словами, чем более разбавлен раствор повидон-йода, тем он менее стабилен.
Свободный молекулярный йод теряется из указанных композиций, так как проходит через стенки содержащих их емкостей. В публикации BASF Pharma Ingredients & Services, Technical Information: PVP-iodine grades (August 2010, page 7) описывается влияние природы упаковочного материала на стабильность водных растворов повидон-йода различных концентраций; показано, что потери молекулярного йода тем больше, чем ниже концентрация повидон-йода и чем более проницаем материал, из которого сделана заключающая раствор емкость (например, полиэтилен низкой плотности). В той же работе продемонстрировано, что полиэтилен высокой плотности лучше удерживает молекулярный йод в растворах повидон-йода концентрацией более 1%. При меньших концентрациях повидон-йода удерживающая способность полиэтилена высокой плотности в отношении молекулярного йода недостаточна, а наиболее эффективным материалом в этом смысле оказывается стекло.
В той же работе (BASF Pharma Ingredients & Services, Technical Information: PVP-iodine grades, August 2010) на стр. 10 описывается влияние pH на стабильность растворов повидон-йода; эти данные демонстрируют возрастание потерь свободного молекулярного йода для растворов повидон-йода с pH выше 4,5.
Офтальмологические композиции нельзя держать в полностью стеклянной таре, так как по крайней мере пипетка должна быть пластиковой. Поэтому в настоящее время невозможно сделать должную упаковку для растворов повидон-йода концентрацией ниже 1%, предназначенных к продаже с целью применения в офтальмологической практике.
В работе Jansen J.T.G., Povidone-iodine eye drops 0,3% Pharmaceutisch Weekblad 117, 1982 (page 420) описывается офтальмологическая композиция, полученная путем 30-кратного разведения 10%-ного раствора повидон-йода физиологическим раствором. При хранении этой композиции в охлажденной пластиковой таре время полужизни составило 1 месяц.
В патенте США № 5,126,127 описываются офтальмологические композиции с повидон-йодом в концентрации от 0,3% (масса/масса) до 0,6% (масса/масса), не содержащие забуферивающих агентов и имеющие pH от 2,5 до 4,5. Такие значения pH способствуют стабильности растворов повидон-йода (см. цитировавшуюся выше работу BASF Pharma Ingredients & Services, Technical Information 2010, стр. 10), однако неизбежно ухудшают переносимость препарата для человеческого глаза.
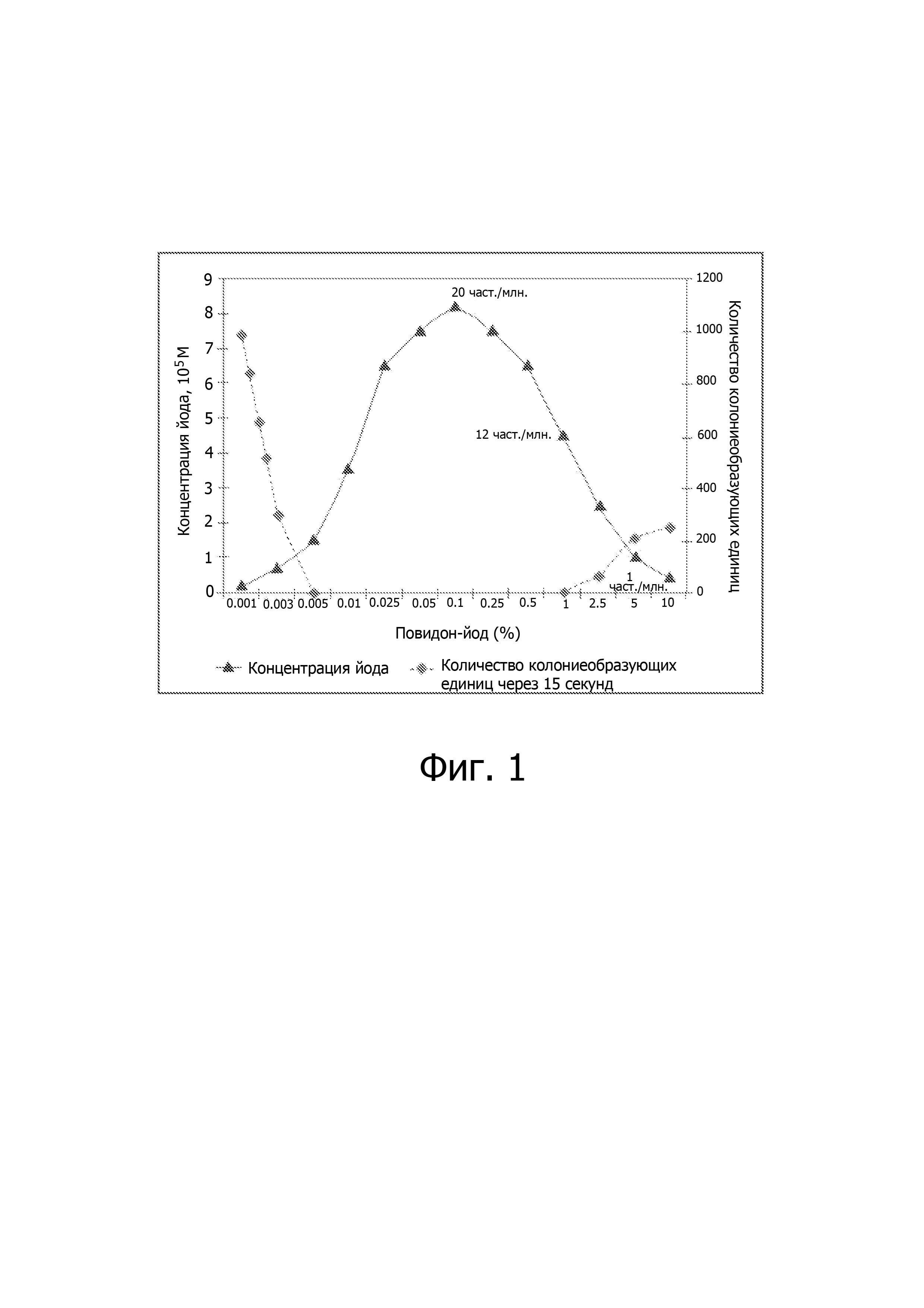
В патенте США № 5,178,853 описываются офтальмологические композиции с повидон-йодом в концентрации от 0,3% (масса/масса) до 1,0% (масса/масса), включающие забуферивающие агенты, имеющие pH в диапазоне 5,5-6,5 и содержащие также иодид калия в количествах более 10% (масса/масса) относительно концентрации (% масса/масса) повидон-йода. Эти композиции стабильны в таре из пластика, а именно из полиэтилентерефталата (PET). Указанные композиции стабильны в течение 24 месяцев при комнатной температуре. Благодаря присутствию иодида препараты, содержащие повидон-йод, удается получить при рН, близких к нейтральным, так что они меньше раздражают ткани глаза. Однако сам иодид-ион (I-) отрицательно влияет на концентрацию свободного молекулярного иода (I2). Ион I-взаимодействует с I2,образуя трехйодистый ион I3-, который остается в растворе, не проникая через стенки заключающей его емкости, в отличие от более летучего молекулярного иода I2. Как и следовало ожидать, содержание молекулярного иода I2в указанных композициях составляет всего лишь 2 част./млн., тогда как в отсутствие иодид-иона I- оно составляет около 20 част./млн. (см. фиг. 1).
Сходные данные, а именно стабилизация офтальмологических композиций, содержащих повидон-йод, с помощью иодида калия, описаны в Европейском патенте № 0371283. Но предлагаемые в этой работе растворы не удовлетворяют офтальмологическим требованиям, поскольку концентрации молекулярного иода в них слишком низкие, чтобы обеспечить нужный бактерицидный эффект.
В патенте США № 5,863,556 описываются композиции для применения в офтальмологии, которые содержат повидон-йод в концентрациях от 0,2% (масса/масса) до 1,0% (масса/масса). Особенность их состава в том, что повидон-йод заключен в липосомы, благодаря чему его стабильность повышается. Однако эти препараты нельзя получить в жидкой форм, пригодной для офтальмологического применения, так как содержащиеся в них твердые липосомы, заключающие в себе повидон-йод, будут задерживаться при фильтровании, необходимом для стерилизации жидких офтальмологических препаратов. Другие методы стерилизации, например путем облучения или под давлением при высокой температуре, не подходят, так как в таких условиях повидон-йод распадается.
В публикации WO2013/078998 также описываются препараты с низкой концентрацией повидон-йода, представляющие собой суспензии, которые содержат повидон-йод, предварительно соосажденный с альгинатом натрия и хлоридом кальция.
В других случаях медицинского применения, например, при лечении повреждений кожи, композиции с высокими концентрациями повидон-йода, даже около 10% (масса/масса), и потому стабильные, с успехом используются и хорошо переносятся пациентами, но в офтальмологии настоятельно необходимы композиции с низкими – ниже 1% (масса/масса) - концентрациями повидон-йода, хорошо переносимые пациентами, достаточно стабильные, обеспечивающие нужный устойчивый уровень свободного молекулярного йода и желаемую противомикробную активность, что позволило бы применять их в офтальмологической практике в терапевтических целях как надежно эффективные дезинфицирующие средства (Margreet Hogeweg, Letters to the Editor, Community Eye Health 2003 Vol. 16 No. 48: 63).
Описание
Целью данного изобретения является офтальмологическая композиция, содержащая повидон-йод в концентрации 0,2%-1,0% (масса/масса), водную и масляную фазы, причем последняя состоит из триглицеридов со средней длиной углеродной цепи и составляет менее 3% от суммарной массы композиции.
В других воплощениях данного изобретения указанная офтальмологическая композиция содержит также поверхностно-активный агент и иодид-ион в концентрации от 0,01% (масса/масса) до 1,0% (масса/масса).
Описание иллюстраций
Фигура 1. Корреляция между содержанием свободного молекулярного йода I2и снижением количества микроорганизмов через 15 секунд после обработки водными растворами повидон-йода различной концентрации.
Осуществление изобретения
Как показывают графики, представленные на фиг.1, противомикробная активность композиций, содержащих повидон-йод, тем больше, чем выше уровень свободного молекулярного йода I2,а этот уровень максимален при концентрациях повидон-йода от 0,01% (масса/масса) до 1% (масса/масса), при которых стабильность композиции низкая, как говорилось выше.
Данное изобретение демонстрирует, что композиции с повидон-йодом в концентрациях от 0,2% (масса/масса) до 1,0% (масса/масса), содержащие водную и масляную фазы, из которых последняя состоит из триглицеридов со средней длиной углеродной цепи и составляет менее 3% от суммарной массы композиции, обеспечивают постоянный высокий уровень свободного молекулярного йода I2.
При том, что хорошо известно о негативном влиянии присутствия иодидов на доступность свободного молекулярного йода, показано, что, как ни странно, добавление иодида в концентрации от 0,01% (масса/масса) до 1,0% (масса/масса) в описанные выше композиции в присутствии поверхностно-активного агента обеспечивает поддержание весьма высокого уровня свободного молекулярного йода I2, хотя по имеющимся в данной области техники данным в присутствии иодидов уровень свободного молекулярного йода составляет несколько частей на миллион (част./млн.). Это воплощение данного изобретения описывается на примерах 15-17, приведенных ниже. Офтальмологический препарат по данному изобретению – это композиция, содержащая водную и масляную фазы, поверхностно-активный агент и повидон-йод в количестве от 0,2% (масса/масса) до 1,0% (масса/масса), предпочтительно от 0,4% (масса/масса) до 0,8% (масса/масса). В указанной композиции содержание свободного молекулярного йода I2при T0(свежеприготовленная композиция) составляет от 10 част./млн. до 100 част./млн..
В другом воплощении данного изобретения указанная офтальмологическая композиция также содержит иодид, предпочтительно иодид калия или иодид натрия, в концентрации от 0,01% (масса/масса) до 1,0% (масса/масса). В этом воплощении данного изобретения поверхностно-активный агент выбирают предпочтительно из макрогола (15)-гидроксистеарата (SOLUTOL HS 15) и D-α-токоферил-полиэтиленгликоля-1000 сукцината
(витамин E TPGS). Указанная масляная фаза состоит из триглицеридов, предпочтительно со средней длиной алифатической цепи, образованной 6-12 атомами углерода. Указанные триглицериды предпочтительно являются эфирами капроновой, каприловой, каприновой и лауриновой кислот. В композициях по данному изобретению эти триглицериды присутствуют в количестве менее 3%, предпочтительно от 0,05% до 1%, более предпочтительно от 0,05% до 0,9% от суммарной массы препарата. В одном из предпочтительных воплощений данного изобретения указанные триглицериды со средней длиной углеродной цепи присутствуют в количестве от 0,1% (масса/масса) до 0,9% (масса/масса). В присутствии иодидов указанная масляная фаза предпочтительно содержит триглицериды каприловой и каприновой кислот. Указанный поверхностно-активный агент присутствует в композициях по данному изобретению в количестве от 0,05% (масса/масса) до 4% (масса/масса), предпочтительно от 0,2% (масса/масса) до 2% (масса/масса). Указанный поверхностно-активный агент является предпочтительно TPGS.
В другом воплощении данного изобретения указанная композиция содержит забуферивающий агент, предпочтительно фосфатный или цитратный буферный раствор с рН от 4,5 до 6,5, предпочтительно от 5,4 до 5,9. Или же для подведения рН используют сильное основание.
В другом воплощении данного изобретения указанная композиция содержит осмотирующие агенты, которые выбирают предпочтительно из глицерина и хлорида натрия.
В другом воплощении данного изобретения указанная композиция содержит полимеры, увеличивающие вязкость препарата. В качестве такого агента предпочтителен гиалуронат натрия в концентрации от 0,01% (масса/масса) до 0,2% (масса/масса), предпочтительно от 0,04% (масса/масса) до 0,08% (масса/масса). В другом воплощении данного изобретения в указанную композицию добавляют полимеры, пригодные для офтальмологического применения, например выбираемые из карбопола, поливинилового спирта и гидроксипропилцеллюлозы.
Композиции по данному изобретению можно держать в емкостях из полиэтилена или полипропилена подходящей толщины и плотности, заключающих одну дозу препарата, или в многодозовых емкостях. В одном из предпочтительных воплощений данного изобретения предлагаемая композиция помещается в стеклянную тару, предпочтительно во флаконы из темного стекла с пипеткой, сделанной предпочтительно из полипропилена, полиэтилена или бромбутилкаучука. Объем указанных флаконов предпочтительно 10 мл.
Композиции с повидон-йодом по данному изобретению объединяют в себе ряд преимуществ: они хорошо переносятся пациентами при лечении глаз, обладают высоким содержанием свободного молекулярного йода, отличаются физико-химической стабильностью и долго сохраняют достаточный уровень свободного молекулярного йода. Препараты по данному изобретению даже без добавления иодидов, сопряженного с описанными выше недостатками, сохраняют титр повидон-йода 85-120% от допустимого по фармакопее США (USP) значения для растворов, содержащих повидон-йод.
Композиции по данному изобретению можно использовать сами по себе или же в форме фармацевтических препаратов, в которых такая композиция объединена или смешана с одним или более фармацевтически приемлемыми эксципиентами. Фармацевтические препараты для применения по данному изобретению могут быть составлены обычным образом с использованием одного или более фармацевтически приемлемых эксципиентов, включая носители, разбавители и вспомогательные ингредиенты. В другом воплощении данного изобретения указанные фармацевтические препараты предпочтительно содержат в дополнение к композиции по данному изобретению один или более других активных ингредиентов. Указанные фармацевтические препараты представлены предпочтительно в форме глазных капель.
В другом аспекте данного изобретения предлагается способ лечения офтальмологических патологических состояний, включающий введение нуждающемуся в том индивиду препарата по данному изобретению.
Данное изобретение иллюстрируется приведенными ниже примерами, которые служат для лучшего его описания и не ограничивают объем изобретения.
Примеры
Препараты, испытывавшиеся в примерах по данному изобретению.
Примеры 1, 2, 3: композиции, содержащие повидон-йод в различных концентрациях, триглицериды со средней длиной углеродной цепи (MCT) 0,11% (масса/масса), D-α-токоферил-1000 сукцинат (TPGS) 0,39% (масса/масса) (см. таблицу 1).
Примеры 4, 5, 6: композиции, содержащие повидон-йод в концентрации 0,66% (масса/масса) и различные концентрации триглицеридов со средней длиной цепи и D-α-токоферил-полиэтиленгликоля-1000 сукцината (см. таблицу 2).
Примеры 7, 8, 9: композиции, содержащие также фосфатный буферный раствор (см. таблицу 3).
Примеры 10, 11, 12: композиции, содержащие также полимеры (см. таблицу 4).
Сравнительные примеры 13, 14: композиции, содержащие триглицериды со средней длиной углеродной цепи в концентрациях 3% (масса/масса) и 8% (масса/масса) (см. таблицу 5). Примеры 15, 16, 17: композиции, содержащие также иодид калия (таблица 6).
Таблица 1
Таблица 2
Таблица 3
Таблица 4
Таблица 5
Таблица 6
Композиции по примерам 1-17 расфасовывали во флаконы из темного стекала объемом 10 мл, снабженные полиэтиленовой пипеткой.
Определяли стабильность композиций за период продолжительностью 24 месяца при температуре 4°C, измеряя уровни повидон-йода; было обнаружено, что измеряемые уровни неизменно превышали 85% от исходного уровня повидон-йода.
Таблица 7. Стабильность препаратов по примерам 1-6 при температуре 4 ± 2°C
Таблица 8. Стабильность препаратов по примерам 7-12 при температуре 4 ± 2°C
Таблица 9. Стабильность препаратов по примерам 15-17 при температуре 4 ± 2°C.
Для каждого из препаратов, проанализированных в примерах 1-12 и 15-17, уровни повидон-йода через 24 месяца превышали 85% относительно уровня в момент T0.
Таблица 10 демонстрирует данные по стабильности, полученные для препаратов по сравнительным примерам 13 и 14, в которых был избыток триглицеридов со средней длиной углеродной цепи.
Таблица 10. Стабильность препаратов по примерам 13 и 14 при температуре 4±2°C.
Как можно судить по данным о рН и осмолярности, физико-химическая стабильность указанных препаратов существенно падает. Через 18 месяцев уровень повидон-йода в препарате по примеру 13 упал до 23% от исходного значения, в препарате по примеру 14 – до 12% от исходного значения. Через 24 месяца повидон-йод в этих композициях не определяется.
Реферат
Группа изобретений относится к области клинической фармакологии, а именно к офтальмофармакологии, и предназначена для офтальмологического применения стабильной композиции, содержащей повидон-йод. Офтальмологическая композиция содержит водную фазу, масляную фазу и повидон-йод (PVP-I) в концентрации 0,2-1,0% (масса/масса). Указанная масляная фаза состоит из триглицеридов со средней длиной углеродной цепи и составляет менее 3% от суммарной массы композиции. Указанная композиция может входить в состав фармацевтического препарата для терапевтического применения в офтальмологии. Также обеспечивается способ лечения офтальмологических патологических состояний, включающий введение указанной композиции. Использование группы изобретений обеспечивает физико-химическую стабильность и сохранение высокого содержания свободного молекулярного йода, а также хорошую переносимость пациентами при лечении заболеваний глаз. 3 н. и 10 з.п. ф-лы, 1 ил., 10 табл., 17 пр.

Комментарии