Хлоридная соль пептида tat-nr2b9с, композиция на его основе и способы их получения - RU2707885C2
Код документа: RU2707885C2
Чертежи

























Описание
Ссылка на родственную заявку
Настоящая заявка представляет собой обычную заявку на выдачу патента США №62/004142, поданную 28 мая 2014 года, включенную посредством ссылки во всей своей полноте для всех целей.
Ссылка на перечень последовательностей
Перечень последовательностей, обозначенный 446849SEQLIST.txt, 16618 бит, созданный 28 мая 2014 года, включен посредством ссылки.
Предшествующий уровень техники настоящего изобретения
Tat-NR2B9c (также известный как NA-1) является средством, которое ингибирует PSD-95, нарушая тем самым связывание с рецепторами N-метил-D-аспартата (NMDAR) и с нейрональными синтазами оксида азота (nNOS), а также снижая эксайтотоксичность, индуцированную ишемией головного мозга. Лечение снижает размер инфаркта и функциональные дефициты. TAT-NR2B9c успешно проходит II фазу испытания (см. WO 2010144721 и Aarts et al., Science 298, 846-850 (2002), Hill et al., Lancet Neurol. 11:942 - 950 (2012)).
Поскольку TAT-NR2B9c не вызывает тяжелых побочных эффектов, его можно вводить при подозрении на инсульт или другие ишемические состояния или геморрагические состояния без диагноза согласно принятым в данной области критериям для подтверждения отсутствия кровоизлияния. Например, TAT-NR2B9c может быть введен на месте, где произошли инсульт или травма нервной системы (например, на дому у больного) или в машине скорой помощи, транспортирующей субъекта в больницу.
TAT-NR2B9c ранее был описан как жидкая композиция нормального солевого раствора или фосфатно-буферного солевого раствора или композиция, лиофилизированная из нормального солевого раствора (WO 2010144721).
Краткое раскрытие настоящего изобретения
Настоящее изобретение относится к хлоридной соли пептида, который представляет собой TAT-NR2B9c (SEQ ID NO: 6) или отличается от TAT-NR2B9c не более 5 аминокислотными заменами, вставками или делециями, или любого другого пептида, раскрываемого в настоящем документе как активное средство. Хлоридная соль может быть получена путем обмена трифторацетата на хлорид в трифторацетатной соли TAT-NR2B9c. Хлоридная соль также может быть получена путем обмена трифторацетата на ацетат, а затем ацетата на хлорид, исходя из трифторацетатной соли TAT-NR2B9c. Необязательно, более 99% анионов в соли составляет хлорид.
Настоящее изобретение, кроме того, относится к предварительно лиофилизированному составу, содержащему хлоридную соль, описываемую выше, буфер и сахар. Необязательно, хлоридной солью является хлоридная соль ТАТ-NR2B9c. Необязательно, буфером является гистидин, сахаром является трегалоза, а pH составляет 6-7. Необязательно, каждый из ацетата и трифторацетата содержит менее 1% по массе анионов в составе. Необязательно, каждый из ацетата и трифторацетата содержит менее 0,1% по массе анионов в составе. Необязательно, хлоридная соль пептида имеет концентрацию 70-120 мг/мл, гистидин имеет концентрацию 15-100 мМ, а трегалоза имеет концентрацию 80-160 мМ. Необязательно, хлоридная соль пептида имеет концентрацию 70-120 мг/мл, гистидин имеет концентрацию 20-100 мМ, а трегалоза имеет концентрацию 100-140 мМ. Необязательно, TAT-NR2B9c имеет концентрацию 70-120 мг/мл, концентрация гистидина составляет 20-50 мМ, а концентрация трегалозы составляет 100-140 мМ. Необязательно, концентрация гистидина составляет 20 мМ, концентрация трегалозы составляет 100-200 мМ, предпочтительно 120 мМ, а концентрация TAT-NR2B9c составляет 90 мг/мл.
Настоящее изобретение, кроме того, относится к лиофилизированному составу, полученному путем лиофилизации любого из предварительно лиофилизированных составов, описываемых выше. Необязательно, каждый из ацетата и трифторацетата содержит менее 1% по массе анионов в составе. Необязательно, каждый из ацетата и трифторацетата содержит менее 0,1% по массе анионов в составе.
Настоящее изобретение, кроме того, относится к восстановленному составу, полученному путем объединения любого из лиофилизированных составов, описываемых выше, с водным раствором. Необязательно, водным раствором является вода или нормальный солевой раствор. Необязательно, объем восстановленного состава представляет собой 3-6-кратный объем предварительно лиофилизированного состава.
Настоящее изобретение, кроме того, относится к восстановленному составу, содержащему TAT-NR2B9c или другое активное средство, описываемое в настоящем документе, при концентрации 15-25 мг/мл, буфер и сахар. Необязательно, буфером является гистидин при концентрации 4-20 мМ, сахаром является трегалоза при концентрации 20-30 мМ, а pH составляет 6-7. Необязательно, восстановленный состав по пункту 19 представляет собой состав, в котором каждый из ацетата и трифторацетата содержит менее 1% по массе анионов в составе. Необязательно, каждый из ацетата и трифторацетата содержит менее 0,1% по массе анионов в составе.
Настоящее изобретение, кроме того, относится к способу получения состава, предусматривающему хранение образца лиофилизированного состава, описываемого выше, в течение по меньшей мере недели при температуре по меньшей мере 20°С; и восстановление лиофилизированного состава. Необязательно, лиофилизированный состав восстанавливают в воде или солевом растворе. Необязательно, способ также предусматривает введение больному восстановленного состава, необязательно, после дополнительного разбавления нормальным солевым раствором. Необязательно, состав хранят в течение по меньшей мере года. Необязательно, хранение осуществляют при окружающей температуре. Необязательно, хранение предусматривает периоды, при которых температура превышает 37°С. Согласно некоторым способам больной страдает инсультом или травматическим повреждением CNS (центральной нервной системы). Согласно некоторым способам лиофилизированный образец хранят в машине скорой помощи. Согласно некоторым способам больной страдает субарахноидальным кровоизлиянием. Согласно некоторым способам больного подвергают эндоваскулярной репарации аневризмы.
Краткое описание графических материалов
На фиг. 1 представлен график, демонстрирующий зону инфаркта головного мозга крысы после инсульта 3PVO после лечения различными составами TAT-NR2B9c.
На фиг. 2А, В А) представлена столбцовая диаграмма, демонстрирующая стабильность различных составов TAT-NR2B9c при -20°С и 40°С. По оси Y представлена чистота Tat-NR2B9c после 1 недели при температуре хранения, как измерено по % общей площади с использованием RP-HPLC. В) Те же данные, что и для А, но сортированные по буферу и pH.
На фиг. 3 представлена столбцовая диаграмма, демонстрирующая стабильность (с помощью HPLC) 20 мг/мл TAT-NR2B9c в гистидиновом буфере, pH 6,5, в присутствии различных объемообразующих средств и соли при -20°С и 40°С.
На фиг. 4А, В представлены графики дифференциальной сканирующей калориметрии для 20 мг/мл TAT-NR2B9c в гистидиновом буфере, pH 6,5, в присутствии маннита (А) или маннита и NaCl (В).
На фиг. 5А, В представлены графики дифференциальной сканирующей калориметрии для 20 мг/мл TAT-NR2B9c в гистидиновом буфере, pH 6,5, в присутствии трегалозы (А) или трегалозы и NaCl (В).
На фиг. 6А, В представлен график дифференциальной сканирующей калориметрии для 20 мг/мл TAT-NR2B9c в гистидиновом буфере, pH 6,5, в присутствии декстрана-40 (А) или декстрана-40 и NaCl (В).
На фиг. 7А, В А) показан внешний вид осадка после лиофилизации 3 мл 90 мг/мл TAT-NR2B9c в 100 мМ гистидине, pH 6,5, с 120 мМ трегалозой. В) Показан внешний вид осадка альтернативных составов TAT-NR2B9c с различными количествами гистидина и трегалозы.
Определения
Наряду с активными ингредиентами лиофилизированные составы могут включать в себя один или несколько следующих классов компонентов. Классы не являются взаимоисключающими; другими словами, одно и то же средство может относиться к нескольким классам.
«Объемообразующее средство» обеспечивает структуру высушенного замораживанием пептида. Объемообразующие средства включают в себя маннит, трегалозу, декстран-40, глицин, лактозу, сорбит и сахарозу, среди прочих. Кроме обеспечения фармацевтически приемлемого осадка объемообразующие средства также могут обеспечивать полезные свойства в отношении модификации температуры коллапса, обеспечения защиты при замораживании и оттаивании, температуры стеклования и усиления стабильности белка на протяжении длительного хранения. Эти средства также могут служить в качестве модификаторов тоничности.
Буфер представляет собой средство, которое поддерживает pH раствора в приемлемом диапазоне до лиофилизации. Предпочтительным буфером является гистидин. Другие буферы включают в себя сукцинат (натрия или калия), гистидин, цитрат (натрия), глюконат, ацетат, фосфат, Tris и т.п. Предпочтительные буферы являются эффективными в диапазоне pH от приблизительно 5,5 до приблизительно 7 или от приблизительно 6 до приблизительно 7; предпочтительно pH составляет приблизительно 6,5. Примеры буферов, которые контролируют pH в этом диапазоне, включают в себя сукцинат (такой как натрия сукцинат), глюконат, гистидин, цитрат и другие буферы на основе органических кислот.
«Криопротектор» обеспечивает стабильность пептида при индуцированных замораживанием воздействиях, предположительно, в результате преимущественного вытеснения с поверхности белка. Он также может обеспечивать защиту в ходе первичной и вторичной сушки и длительного хранения продукта. Примерами являются полимеры, такие как декстран и полиэтиленгликоль; сахара (в том числе сахарные спирты), такие как сахароза, глюкоза, трегалоза и лактоза; поверхностно-активные вещества, такие как полисорбаты; и аминокислоты, такие как глицин, аргинин и серии.
«Лиопротектор» обеспечивает стабильность пептида в ходе процесса сушки или дегидратации (циклов первичной и вторичной сушки), предположительно, путем обеспечения аморфной матрицы в стеклообразном состоянии и путем связывания с белком посредством водородной связи с заменой молекул воды, которые удаляются в ходе процесса сушки. Это помогает сохранять пептидную конформацию, минимизировать расщепление пептида в ходе цикла лиофилизации и улучшать долговременную стабильность продукта. Примеры включают в себя многоатомные спирты или сахара, такие как сахароза и трегалоза.
Кроме тех, что уже упоминались, другие стабилизаторы или ингибиторы расщепления могут включать в себя ингибиторы деамидирования, поверхностно-активные вещества, некоторые из которых представляют собой сложные эфиры жирных кислот и сорбитанполиэтоксилатов (например, полисорбат 20 или полисорбат 80), полоксамер 188 и детергенты.
Термины «лиофилизация», «лиофилизированный» и «высушенный замораживанием» относятся к процессу, с помощью которого материал, подлежащий сушке, сначала замораживают, а затем лед или замороженный растворитель удаляют путем сублимации в вакуумной среде.
Термин «фармацевтический состав» или «композиция» означает препарат, который обеспечивает эффективность активного средства и не содержит дополнительные компоненты, являющиеся токсичными для субъектов, которым будут вводить состав.
Термин «время восстановления» означает время, которое необходимо для регидратирования лиофилизированного состава раствором до раствора, который не содержит частицы, заметные невооруженным глазом.
Термин «стабильный» лиофилизированный пептидный состав означает состав без существенных изменений, наблюдаемых при 20°С в течение по меньшей мере одной недели, месяца или предпочтительно более по меньшей мере трех месяцев, по меньшей мере шести месяцев или года. Изменения считают незначительными, если разрушается не более 10%, предпочтительно 5% пептида, как измерено с помощью SEC-HPLC. Регидратированный раствор при визуальном анализе выглядит бесцветным или прозрачным - слегка опалесцирующим. Концентрация, pH и осмоляльность состава характеризуются не более чем +/-10% изменением после хранения. Эффективность находится в пределах 70-130%, предпочтительно 80-120% или иногда 80-100% свежеприготовленного контрольного образца. Наблюдается не более 10%, предпочтительно 5% фрагментация. Образуется не более чем 10%, предпочтительно 5% агрегация. Стабильность может быть измерена различными способами, рассматриваемыми в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991), и Jones, A. Adv. Drug Delivery Rev. 10:29-90 (1993).
Термин «изотонический» означает, что представляющий интерес состав имеет, по сути, то же осмотическое давление, что и кровь человека. Изотонические составы, как правило, будут иметь осмотическое давление от приблизительно 270 до 328 мОсм. Слегка гипотоническое давление составляет 250-269, а слегка гипертоническое давление составляет 328-350 мОсм. Осмотическое давление может быть измерено, например, с использованием парового осмометра или осмометра замораживающего типа.
Модификаторы тоничности: Соли (NaCl, KCl, MgCl2, CaCl2) могут быть использованы в качестве модификаторов тоничности для контроля осмотического давления. Кроме того, криопротекторы/лиопротекторы и/или объемообразующие средства, такие как сахароза, маннит или глицин, могут служить модификаторами тоничности.
Числовые значения, такие как концентрации или pH, приводятся в пределах допуска, отражающих точность, с которой значение может быть измерено. Если контекст не требует иного, дробные величины округляются до ближайшего целого числа. Если контекст не требует иного, приведение диапазона значений означает, что могут быть использованы любое целое число или поддиапазон в пределах диапазона.
Термины «заболевание» и «состояние» используются синонимически с указанием какого-либо нарушения или прерывания нормальной структуры или функции у субъекта.
Подробное раскрытие настоящего изобретения
I. Общие сведения
Пептиды, синтезируемые твердофазными способами, как правило, получают в виде трифторацетатных солей, поскольку трифторуксусную кислоту (TFA) используют для снятия защиты с пептидов и/или для удаления пептидов из смол. Для фармацевтического применения трифторацетат, как правило, заменяют ацетатом в качестве противоиона, поскольку ацетат является нетоксичным, и замена трифторацетата ацетатом является эффективной. Так было в случае с пептидом ТАТ-NR2B9c, синтезируемым в настоящее время, как описано в WO 2010144721 или в PCT/US 2013/071755, а также в других документах.
Ацетат часто является предпочтительным противоионом для фармацевтических пептидов, поскольку трифторацетат может быть заменен ацетатом с незначительным изменением в типичном процессе очистки пептида, получаемого твердофазным синтезом, при котором конечное промывание выполняют с уксусной кислотой вместо трифторуксусной кислоты с последующим элюированием ацетонитрилом. Иногда вместо этого используют другие противоионы. Например, иногда используют хлорид для плохо растворимых пептидов, поскольку он улучшает их растворимость. Однако замена трифторацетата или ацетата на хлорид приводит к потере некоторого количества пептида. Более того, присутствие HCl, образующейся при хлоридном обмене, как сообщали, модифицирует структуру и снижает термическую стабильность некоторых пептидов (Biochemistry, 5th edition, Berg et al. eds, Freeman; 2002); J Pept Sci. 2007 Jan; 13(1):37-43). TAT-NR2B9c уже является высокорастворимым пептидом в виде ацетатной соли. Следовательно, замена трифторацетатной или ацетатной соли хлоридом, как, казалось бы, имеет недостатки, заключающиеся в снижении выхода и возможном уменьшении стабильности без какого-либо компенсирующего преимущества.
Неожиданно было обнаружено, что хлоридная соль TAT-NR2B9c обеспечивает значительно большую стабильность в лиофилизированной форме, чем ацетатная соль TAT-NR2B9c в том же составе или ацетатная соль TAT-NR2B9c, лиофилизированная из солевого раствора. Хлоридная соль может оставаться достаточно стабильной для клинического применения, даже при хранении при окружающих температурах летнего периода, достигающих или даже превышающих 37°С, в течение нескольких лет. Более высокая стабильность хлоридной соли по сравнению с ацетатом более чем компенсирует любые большие затраты или снижение выхода, требующиеся при замене трифторацетата как соли. Настоящее изобретение относится к лиофилизированным составам активных средств, в частности, TAT-NR2B9c, в виде хлоридной соли. Такие составы являются стабильными при окружающей температуре (например, по меньшей мере 20°С), что, таким образом, облегчает обеспечение поставок такого состава в машинах скорой помощи или т.п., или персоналом службы экстренной помощи для введения на месте заболевания или несчастного случая, или между таким местом и медицинским учреждением.
Лиофилизированные составы получают из предварительно лиофилизированного состава, содержащего активное средство, буфер, объемообразующее средство и воду. Могут присутствовать, а могут не присутствовать, другие компоненты, такие как крио-или лиоконсерванты, средство регулирования тоничности, фармацевтически приемлемые носители и т.п. Предпочтительным активным средством является хлоридная соль TAT-NR2B9c. Предпочтительным буфером является гистидин. Предпочтительным объемообразующим средством является трегалоза. Трегалоза также служит крио- и лиоконсервантом. Типичный предварительно лиофилизированный состав содержит активное средство (например, хлоридную соль TAT-NR2B9c), гистидин (10-100 мМ, 15-100 мМ, 15-80 мМ, 40-60 мМ или 15-60 мМ, например, 20 мМ или необязательно 50 мМ или 20-50 мМ) и трегалозу (50-200 мМ, предпочтительно 80-160 мМ, 100-140 мМ, более предпочтительно 120 мМ). pH составляет 5,5-7,5, более предпочтительно 6-7, более предпочтительно 6,5. Концентрация активного средства (например, хлоридной соли TAT-NR2B9c) составляет 20-200 мг/мл, предпочтительно 50-150 мг/мл, более предпочтительно 70-120 мг/мл или 90 мг/мл. Таким образом, типичный предварительно лиофилизированный состав содержит 20 мМ гистидина, 120 мМ трегалозы и 90 мг/мл хлоридной соли TAT-NR2B9c. Необязательно может быть включен скавенджер ацетилирования, такой как лизин, как описывается в находящейся на одновременном рассмотрении заявке №057769-446850, для дополнительного снижения какого-либо остаточного ацетата или трифторацетата в составе.
После лиофилизации лиофилизированные составы характеризуются низким содержанием воды, предпочтительно приблизительно 0% - 5% воды, более предпочтительно менее 2,5% воды по массе. Лиофилизированные составы можно хранить в морозильной камере (например, при -20 или -70°С), в холодильнике (при 0-4°С) или при комнатной температуре (при 20-25°С).
Активные средства восстанавливают в водном растворе, предпочтительно в воде для инъекции или необязательно в нормальном солевом растворе (в 0,8-1,0% солевом растворе и предпочтительно в 0,9% солевом растворе). Восстановление может быть до того же или до меньшего или большего объема, чем объем предварительно лиофилизированного состава. Предпочтительно, объем после восстановления больше, чем до восстановления (например, больше в 3-6 раз). Например, объем при предварительной лиофилизации, составляющий 3-5 мл, может быть восстановлен до объема 10 мл, 12 мл, 13,5 мл, 15 мл, или 20 мл, или 10-20 мл, среди прочих. После восстановления концентрация гистидина составляет предпочтительно 2-20 мМ, например, 2-7 мМ, 4,0-6,5 мМ, 4,5 мМ или 6 мМ; концентрация трегалозы составляет предпочтительно 15-45 мМ или 20-40 мМ или 25-27 мМ или 35-37 мМ. Концентрация лизина составляет предпочтительно 100-300 мМ, например, 150-250 мМ, 150-170 мМ или 210-220 мМ. Активное средство предпочтительно имеет концентрацию 10-30 мг/мл, например 15-30, 18-20, 20 мг/мл активного средства (например, TAT-NR2B9c) или 25-30, 26-28 или 27 мг/мл активного средства. Типичный состав после восстановления содержит 4-5 мМ гистидина, 26-27 мМ трегалозы, 150-170 мМ лизина и 20 мг/мл TAT-NR2B9c (при этом концентрации округлены до ближайшего целого числа). Второй типичный состав после восстановления содержит 5-7 мМ гистидина, 35-37 мМ трегалозы, 210-220 мМ лизина и 26-28 мг/мл TAT-NR2B9c (при этом концентрации округлены до ближайшего целого числа). Восстановленный состав может быть дополнительно разбавлен перед введением, например, путем добавления в мешок для жидкости, содержащий нормальный солевой раствор для внутривенной инфузии.
Какое-либо описание состава в виде содержащихся или включенных (или подобной терминологией) указанных компонентов следует понимать как альтернативное или дополнительное описание состава, состоящего из этих указанных компонентов или состоящего, по сути, из таковых.
Способы сушки замораживанием изложены, например, в Methods in Enzymology, Vol. 22, Pages 33-39, Academic Press, New York (1971), а также в Freeze-Drying, E.W. Flosdorf, Rheinhold, New York (1949). TAT-NR2B9c предпочтительно лиофилизируют в том же флаконе, в котором его будут восстанавливать для применения. Водный раствор TAT-NR2B9c добавляют во флакон необязательно после фильтрования через стерильную систему фильтрации, такую как 0,22-микронный фильтр, обычно используемый для пептидов. Составы могут быть лиофилизированы в контролируемом цикле, таком как описываемый в примерах. Предварительно лиофилизированный состав может быть помещен во флакон и лиофилизирован при пониженных температуре и давлении. После лиофилизации флаконы могут быть закупорены. Для применения лиофилизат восстанавливают водой для инъекции, нормальным солевым раствором или другим фармацевтически приемлемым носителем или разбавителем.
Ряд контейнеров является приемлемым для лиофилизации. Контейнер должен выдерживать внешнее давление при его закупорке и хранении в условиях частичного вакуума. Контейнер должен быть сделан из материала, который обеспечивает приемлемый теплообмен между внешней и внутренней средой. Размер контейнера должен быть таким, чтобы раствор, подлежащий лиофилизации, занимал не более 20% полезного объема или мог превышать его с избытком согласно имеющим преимущественную силу рекомендациями USP по объему в контейнере. Например, 3-мл флакон может быть наполнен 0,5 мл раствора. Флаконы могут быть сделаны из стекла, например, боросиликата, или пластика, например, полипропилена.
Могут быть использованы стеклянные бутылки, обычно используемые для лиофилизации биологических материалов. Другим приемлемым контейнером является двухкамерный шприц, в котором одна камера содержит лиофилизированный осадок пептида TAT-NR2B9c, а другая камера содержит водный разбавитель. После завершения лиофилизации вакуум во флаконах или ампулах может быть ослаблен путем заполнения системы инертным газом, с закупориванием на месте с использованием стандартного оборудования, а затем с обжимным запечатыванием. Такой способ обеспечит стерильный конечный продукт. Также могут быть использованы другие решения из двух частей, такие как мешок с разрушаемой перегородкой между камерой с лиофилизированным лекарственным средством и разбавителем.
II. Активные средства
Хотя большая часть описания относится к активному средству TAT-NR2B9c, в целях иллюстрации, другие активные средства, описываемые ниже, могут быть получены в виде хлоридных солей или составлены согласно принципам, описываемым для TAT-NR2B9c. Конкретные концентрации, приводимые для TAT-NR2B9c, могут быть использованы как есть для других средств или преобразованы с получением эквимолярных концентраций для другого средства и TAT-NR2B9c.
Активные средства ингибируют взаимодействие между PSD-95 и одним или несколькими NMDAR (например, 2А, 2 В, 2С или 2D) или nNOS (например, Swiss-Prot Р29475) путем связывания с PSD-95. Такие средства применимы для уменьшения одного или нескольких повреждающих эффектов инсульта и других неврологических состояний, опосредованных, по меньшей мере частично, эксайтотоксичностью NMDAR. Такие средства включают в себя пептиды с аминокислотной последовательностью, содержащей мотив PL NMDA-рецептора или домен PDZ в PSD-95 или основанной на таковом. Такие пептиды также могут ингибировать взаимодействия между PSD-95 и nNOS и другими глутаматными рецепторами (например, каинитиновыми рецепторами или АМРА-рецепторами), такими как KV1.4 и GluR6. Предпочтительные пептиды ингибируют взаимодействие между доменами PDZ-1 и -2 в белке постсинаптической плотности-95 (PSD-95) (аминокислотной последовательностью человека, предоставленной Stathakism, Genomics 44(1):71-82 (1997)) и С-концевой PL последовательностью одной или нескольких субъединиц NMDA-рецептора 2, в том числе субъединицы NR2B нейронального рецептора N-метил-D-аспартата (Mandich et al., Genomics 22, 216-8 (1994)). NMDAR2B имеет ID GenBank 4099612, 20 С-концевых аминокислот FNGSSNGHVYEKLSSIESDV (SEQ ID NO: 11) и PL мотив ESDV (SEQ ID NO: 12). Предпочтительные пептиды ингибируют человеческие формы PSD-95 и человеческие рецепторы NMDAR. Однако ингибирование также может быть показано видовыми вариантами белков. Ниже представлен перечень NMDA- и глутаматных рецепторов, которые могут быть использованы.


Пептиды могут включать в себя или могут основываться на PL мотиве из С-конца любой из вышеупомянутых субъединиц и имеют аминокислотную последовательность, содержащую [S/T]-X-[V/L]. Эта последовательность предпочтительно встречается на С-конце пептидов в соответствии с настоящим изобретением. Предпочтительные пептиды имеют аминокислотную последовательность, содержащую [E/D/N/Q]-[S/T]-[D/E/Q/N]-[V/L] (SEQ ID NO: 38) на своем С-конце. Типичные пептиды содержат ESDV (SEQ ID NO: 12), ESEV (SEQ ID NO: 29), ETDV (SEQ ID NO: 39), ETEV (SEQ ID NO: 40), DTDV (SEQ ID NO: 41) и DTEV (SEQ ID NO: 42) в виде С-концевых аминокислот. Двумя особенно предпочтительными пептидами являются KLSSIESDV (SEQ ID NO: 5) и KLSSIETDV (SEQ ID NO: 43). Такие пептиды, как правило, содержат 3-25 аминокислот (без пептида интернализации), пептиды длиной 5-10 аминокислот и особенно 9 аминокислот (также без пептида интернализации) являются предпочтительными. В некоторых таких пептидах все аминокислоты получены из С-конца NMDA-рецептора (не включая аминокислоты из пептида интернализации).
Пептиды и пептидомиметики в соответствии с настоящим изобретением могут содержать модифицированные аминокислотные остатки, например, остатки, которые являются N-алкилированными. N-концевые модификации алкилом могут включать в себя, например, N-метил, N-этил, N-пропил, N-бутил, N-циклогексилметил, N-циклогексилэтил, N-бензил, N-фенилэтил, N-фенилпропил, N-(3,4-дихлорфенил)-пропил, N-(3,4-дифторфенил)-пропил и N-(нафтален-2-ил)-этил).
В Bach, J. Med. Chem. 51, 6450-6459 (2008), и WO 2010/004003 описываются серии аналогов NR2B9c (SEQ ID NO: 6). Активность связывания PDZ демонстрируется пептидами, имеющими только три С-концевых аминокислоты (SDV). У Bach также сообщается об аналогах с аминокислотной последовательностью, содержащей X1tSX2V или состоящей из таковой (SEQ ID NO: 68), при этом t и S представляют собой альтернативные аминокислоты, X1 выбран из Е, Q и А или их аналога, Х2 выбран из А, Q, D, N, N-Me-A, N-Me-Q, N-Me-D и N-Me-N или их аналога. Необязательно пептид является N-алкилированным в положении Р3 (третья аминокислота от С-конца, т.е. в положении, которое занимает tS). Пептид может быть N-алкилированным с циклогексаном или ароматическим заместителем и дополнительно содержит спейсерную группу между заместителем и концевой аминогруппой пептида или пептидного аналога, в котором спейсером является алкильная группа, предпочтительно выбранная из метилена, этилена, пропилена и бутилена. Ароматическим заместителем может быть нафтален-2-ильный фрагмент или ароматическое кольцо, замещенное одной или двумя галогеновыми и/или алкильными группами.
Также могут быть включены другие модификации без неблагоприятного влияния на активность, и они включают в себя замену одной или нескольких аминокислот в естественной L-изомерной форме аминокислотами в D-изомерной форме. Таким образом, любая аминокислота, встречающаяся в природе в L-конфигурации (которую также можно называть R или S в зависимости от структуры химического объекта) может быть заменена аминокислотой того же типа химической структуры или пептидомиметика, но противоположной хиральности, обычно называемой D-аминокислотой, но которую, кроме того, можно называть R- или S-формой. Таким образом, пептидомиметик может включать в себя 1, 2, 3, 4, 5, по меньшей мере 50% или все D-аминокислотные остатки. Пептидомиметик, содержащий несколько или все D остатки, иногда называют «инвертированным» пептидом.
Пептидомиметики также включают в себя ретропептиды. Ретропептид имеет обратную аминокислотную последовательность. Пептидомиметики также включают в себя ретроинвертированные пептиды, в которых порядок аминокислот является противоположным таким образом, что изначально С-концевая аминокислота находится на N-конце, а D-аминокислоты используются вместо L-аминокислот. В WO 2008/014917 описывается ретроинвертированный аналог Tat-NR2B9c с аминокислотной последовательностью vdseisslk-rrrqrrkkrgyin (SEQ ID NO: 69) (строчные буквы указывают на D-аминокислоты), и сообщается о том, что он является эффективным в ингибировании ишемии головного мозга. Другим эффективным пептидом, описываемым в настоящем документе, является Rv-Tat-NR2B9c (RRRQRRKKRGYKLSSIESDV; SEQ ID NO: 70).
Линкер, например, полиэтиленгликолевый линкер, может быть использованы для димеризации активного фрагмента пептида или пептидомиметика с целью усиления его аффинности и селективности в отношении белков, содержащих тандемные домены PDZ. См., например, Bach et al., (2009) Angew. Chem. Int. Ed. 48:9685-9689, и WO 2010/004003. Содержащий PL мотив пептид предпочтительно является димеризованным путем соединения N-концов двух таких молекул, при этом С-концы остаются свободными. У Bach, кроме того, сообщается, что пентамерный пептид IESDV (SEQ ID NO: 71) от С-конца NMDAR 2В был эффективным в ингибировании связывания NMDAR 2В с PSD-95. IETDV (SEQ ID NO: 73) также можно использовать вместо IESDV. Необязательно, приблизительно 2-10 копий PEG может быть соединено в тандеме в качестве линкера. Необязательно, линкер также может быть присоединен к пептиду интернализации или липидирован для усиления клеточного поглощения. Примеры типичных димерных ингибиторов показаны ниже (см. Bach et al., PNAS 109 (2012), 3317-3322). Любой из ингибиторов PSD-95, раскрываемых в настоящем документе, может быть использован вместо IETDV, и любой пептид интернализации или липидирующий фрагмент может быть использован вместо tat. Также могут быть использованы другие линкеры, помимо тех, что показаны.

IETAV определяется в SEQ ID NO: 26, YGRKKRRQRRR в SEQ ID NO: 2, a rrrqrrkkr в SEQ ID NO: 10, при этом строчные буквы указывают на D-аминокислоты.
Соответствующая фармакологическая активность пептидов, пептидомиметиков или других средств при необходимости может быть подтверждена с использованием ранее описываемых крысиных моделей инсульта перед тестированием на примате и клинических испытаниях, описываемых в настоящей заявке. Пептиды или пептидомиметики также могут быть скринированы по способности ингибировать взаимодействия между PSD-95 и NMDAR 2В с использованием анализов, описываемых, например, в заявке на выдачу патента США №20050059597, которая включена посредством ссылки. Применимые пептиды, как правило, характеризуются значениями IC50 менее 50 мкМ, 25 мкМ, 10 мкМ, 0,1 мкМ или 0,01 мкМ в таком анализе. Предпочтительные пептиды, как правило, характеризуются значениями IC50 0,001-1 мкМ и более предпочтительно 0,001-0,05, 0,05-0,5 или 0,05-0,1 мкМ. Если пептид или другое средство характеризуют как ингибирующие связывание одного взаимодействия, например, взаимодействия PSD-95 с NMDAR2B, то такое описание не исключает того, что пептид или средство также ингибирует другое взаимодействие, например, ингибирование связывания PSD-95 с nNOS.
Пептиды, подобные только что описанным, необязательно могут быть дериватизированы (например, ацетилированы, фосфорилированы, миристоилированы, геранилированы, пегилированы и/или гликозилированы) для улучшения аффинности связывания ингибитора, для улучшения способности ингибитора транспортироваться через клеточную мембрану или для повышения стабильности. В качестве конкретного примера, для ингибиторов, в которых третий остаток от С-конца представляет собой S или Т, данный остаток может быть фосфорилирован перед применением пептида.
Фармакологическое средство может быть связано с пептидом интернализации для облегчения поглощения клетками и/или прохождения через гематоэнцефалический барьер. Пептиды интернализации составляют хорошо известный класс относительно коротких пептидов, которые позволяют многим клеточным или вирусным белкам пересекать мембраны. Пептиды интернализации, также известные как пептиды трансдукции через клеточную мембрану или пептиды проникновения в клетку, могут содержать, например, 5-30 аминокислот. Такие пептиды, как правило, имеют катионный заряд от вышеупомянутой нормальной представленности (относительно белков в целом) остатков аргинина и/или лизина, который, как полагают, облегчает их прохождение через мембраны. Некоторые из таких пептидов содержат по меньшей мере 5, 6, 7 или 8 остатков аргинина и/или лизина. Примеры включают в себя белок Antennapedia (Bonfanti, Cancer Res. 57, 1442-6 (1997)) (и его варианты), белок tat вируса иммунодефицита человека, белок VP22, продукт гена UL49 вируса простого герпеса 1 типа, пенетратин, SynB1 и 3, транспортан, амфипатический, gp41NLS, polyArg и некоторые белковые токсины растений и бактерий, такие как рицин, абрин, модессин, дифтерийный токсин, холерный токсин, сибиреязвенный токсин, термолабильные токсины и экзотоксин A Pseudomonas aeruginosa (ETA). Другие примеры описываются в следующих ссылках: Temsamani, Drug Discovery Today, 9(23):1012-1019, 2004; De Coupade, Biochem J., 390:407-418, 2005; Saalik Bioconjugate Chem. 15: 1246-1253, 2004; Zhao, Medicinal Research Reviews 24(1):1-12, 2004; Deshayes, Cellular and Molecular Life Sciences 62:1839-49, 2005); Gao, ACS Chem. Biol. 2011, 6, 484-491, SG3 (RLSGMNEVLSFRWL (SEQ ID NO: 9)), Stalmans PLoS ONE 2013, 8(8) e71752, 1-11 and supplement; Figueiredo et al., IUBMB Life 66, 182-194 (2014); Copolovici et al., ACS Nano, 8, 1972-94 (2014); Lukanowski Biotech J. 8, 918-930 (2013); Stockwell, Chem. Biol. Drug Des. 83, 507-520 (2014); Stanzl et al. Accounts. Chem. Res/ 46, 2944-2954 (2013); (все включены посредством ссылки).
Предпочтительным пептидом интернализации является tat из вируса HIV. Пептид tat, описанный в предыдущей работе, содержит стандартную аминокислотную последовательность YGRKKRRQRRR (SEQ ID NO: 2), обнаруженную в белке Tat HIV, или состоит из таковой. Если присутствуют дополнительные остатки, фланкирующие такой мотив tat (рядом с фармакологическим средством), то такими остатками могут быть, например, натуральные аминокислоты, фланкирующие этот сегмент от белка tat, спейсерные или линкерные аминокислоты, как правило, используемые для связывания двух пептидных доменов вида, например, gly (ser)4 (SEQ ID NO: 44), TGEKP (SEQ ID NO: 45), GGRRGGGS (SEQ ID NO: 46) или LRQRDGERP (SEQ ID NO: 47) (см., например, Tang et al. (1996), J. Biol. Chem. 271, 15682-15686; Hennecke et al. (1998), Protein Eng. 11, 405-410)), или могут быть любые другие аминокислоты, которые существенно не снижают способность обеспечивать поглощение варианта без фланкирующих остатков. Предпочтительно, число фланкирующих аминокислот, отличных от таковых активного пептида, не превышает десяти на любой стороне YGRKKRRQRRR (SEQ ID NO: 2). Одним приемлемым пептидом tat, содержащим дополнительные аминокислотные остатки, фланкирующие С-конец YGRKKRRQRRR (SEQ ID NO: 2), является YGRKKRRQRRRPQ (SEQ ID NO: 48). Однако, предпочтительно, фланкирующие аминокислоты отсутствуют.Другие пептиды tat, которые могут быть использованы, включают в себя GRKKRRQRRRPQ (SEQ ID NO: 4) и GRKKRRQRRRP (SEQ ID NO: 72).
Варианты вышеупомянутого пептида tat, обладающие пониженной способностью связываться с кальциевыми каналами N-типа, описываются в WO 2008/109010. Такие варианты могут содержать аминокислотную последовательность XGRKKRRQRRR (SEQ ID NO: 49) или состоять из таковой, в которой X представляет собой аминокислоту, отличную от Y, или отсутствует (в этом случае G представляет собой свободный N-концевой остаток). Предпочтительный пептид tat имеет N-концевой остаток Y, замещенный F. Таким образом, предпочтительным является пептид tat, содержащий FGRKKRRQRRR (SEQ ID NO: 3) или состоящий из таковой. Другой предпочтительный вариантный пептид tat состоит из GRKKRRQRRR (SEQ ID NO: 1). Другой предпочтительный пептид tat содержит RRRQRRKKRG или RRRQRRKKRGY (аминокислоты 1-10 или 1-11 из SEQ ID NO: 70) или состоит из таковых. Другие полученные из tat пептиды, которые облегчают поглощение фармакологического средства без ингибирования кальциевых каналов N-типа, включают в себя те, что представлены ниже.


X может представлять собой свободный аминоконец, одну или несколько аминокислот или конъюгированный фрагмент.Пептиды интернализации могут быть использованы в инвертированной, или ретро-, или инвертированной ретроформе со связанным пептидом или пептидомиметиком, находящимся в такой форме, или без такового. Например, предпочтительный химерный пептид имеет аминокислотную последовательность, содержащую YGRKKRRQRRR-KLSSIESDV (SEQ ID NO: 6, также известную как TAT-NR2B9c или Tat-NR2B9c) или YGRKKRRQRRR-KLSSIETDV (SEQ ID NO: 7), или состоящую из таковой. Другие предпочтительные химерные пептиды отличаются от SEQ ID NO: 6 или NO: 7 не более чем 1, 2, 3, 4 или 5 аминокислотными заменами, делециями или добавлениями (внутренними или на концах). Другие предпочтительные пептиды включают в себя RRRQRRKKRGY-KLSSIESDV (SEQ ID NO: 70), также известную как RvTat-NR2B9c, или имеют аминокислотную последовательность, содержащую RRRQRRKKRGY-KLSSIETDV (SEQ ID NO: 37) или состоящую из таковой.
Пептиды интернализации могут быть присоединены к фармакологическим средствам традиционными способами. Например, средства могут быть соединены с пептидами интернализации химической связью, например, через соединяющее или конъюгирующее средство. Множество таких средств коммерчески доступно и рассматривается в S.S. Wong, Chemistry of Protein Conjugation and Cross-Linking, CRC Press (1991). Некоторые примеры сшивающих реагентов включают в себя J-сукцинимидил-3-(2-пиридилдитио)-пропионат (SPDP) или N,N'-(1,3-фенилен)-бис-малеимид; N,N'-этилен-бис-(йодоацетамид) или другой такой реагент с метиленовыми мостиками с 6-11 атомами углерода (которые относительно специфичны для сульфгидрильных групп) и 1,5-дифтор-2,4-динитробензол (который образует необратимые связи с аминогруппами и тирозиновыми группами). Другие сшивающие реагенты включают в себя п,п'-дифтор-м, м'-динитродифенилсульфон (который образует необратимые поперечные связи с аминогруппами и фенольными группами); диметиладипимидат (который является специфичным для аминогрупп); фенол-1,4-дисульфонилхлорид (который реагирует преимущественно с аминогруппами); гексаметилендиизоцианат или диизотиоцианат или азофенил-п-диизоцианат (который реагирует преимущественно с аминогруппами); глутаральдегид (который реагирует с несколькими различными боковыми цепями) и дисдиазобензидин (который реагирует, главным образом, с тирозином и гистидином).
Для фармакологических средств, которые являются пептидами, присоединение к пептиду интернализации, может быть достигнуто путем создания белка слияния, содержащего пептидную последовательность, слитую, предпочтительно на своем N-конце, с пептидом интернализации.
Взамен или в дополнение к связи пептида (или другого средства), ингибирующего PSD-95, с пептидом интернализации, такой пептид может быть связан с липидом (липидизация) для повышения гидрофобности конъюгата по сравнению с отдельным пептидом и облегчения тем самым прохождения связанного пептида сквозь клеточные мембраны и/или сквозь барьер головного мозга. Липидизацию предпочтительно выполняют на N-концевой аминокислоте, но также она может быть выполнена на внутренних аминокислотах, при условии, что способность пептида ингибировать взаимодействие между PSD-95 и NMDAR 2В не снижается более чем на 50%. Предпочтительно, липидизацию выполняют на аминокислоте, отличной от одной из четырех крайних С-концевых аминокислот. Липиды являются органическими молекулами, более растворимыми в эфире, чем в воде, и включают в себя жирные кислоты, глицериды и стерины. Приемлемые формы липидизации включают в себя миристоилирование, пальмитоилирование или присоединение других жирных кислот, предпочтительно с длиной цепи 10-20 атомов углерода, таких как лауриновая кислота и стеариновая кислота, а также геранилирование, геранилгеранилирование и изопренилирование. Предпочтительными являются липидизации типа, встречающегося при посттрансляционной модификации природных белков. Липидизация жирной кислотой посредством образования амидной связи с альфа-аминогруппой N-концевой аминокислоты пептида также является предпочтительной. Липидизация может быть осуществлена пептидным синтезом, предусматривающим предварительно липидированную аминокислоту, может быть осуществлена ферментативно in vitro или путем рекомбинантной экспрессии, с помощью химического сшивания или химической дериватизации пептида. Аминокислоты, модифицированные путем миристоилирования и другими липидными модификациями, являются коммерчески доступными.
Липидизация предпочтительно облегчает прохождение связанного пептида (например, KLSSIESDV (SEQ ID NO: 5) или KLSSIETDV (SEQ ID NO: 43)) через клеточную мембрану и/или гематоэнцефалический барьер, не вызывая временного снижения кровяного давления, как это наблюдается при введении стандартного пептида tat при высокой дозировке (например, при 3 мг/кг или больше), или по меньшей мере с менее значительным снижением, чем с тем же пептидом, связанным со стандартным пептидом tat.
Фармакологические пептиды, необязательно слитые с пептидами tat, могут быть синтезированы твердофазным синтезом или рекомбинантными способами. Пептидомиметики могут быть синтезированы с использованием ряда процедур и методов, описанных в научной и патентной литературе, например, в Organic Syntheses Collective Volumes, Gilman et al. (Eds) John Wiley & Sons, Inc., NY, al-Obeidi (1998) Mol. Biotechnol. 9:205-223; Hruby (1997) Curr. Opin. Chem. Biol. 1:114-119; Ostergaard (1997) Mol. Divers. 3:17-27; Ostresh (1996) Methods Enzymol. 267:220-234.
III. Соли
Пептиды типа, описываемого выше, как правило, получают твердофазным синтезом. Так как при твердофазном синтезе используется трифторацетат (TFA) для удаления защитных групп или удаления пептидов из смолы, пептиды, как правило, сначала получают в виде трифторацетатных солей. Трифторацетат может быть замещен другим анионом, например, путем связывания пептида с твердой подложкой, такой как колонка, промывания колонки для удаления имеющегося противоиона, уравновешивания колонки раствором, содержащим новый противоион, а затем элюированием пептида, например, с помощью введения гидрофобного растворителя, такого как ацетонитрил, в колонку. Замещение трифторацетата ацетатом может быть выполнено ацетатным промыванием, как последней стадией перед элюированием пептида в ином традиционном твердофазном синтезе. Замещение трифторацетата или ацетата хлоридом может быть выполнено промыванием аммония хлоридом с последующим элюированием. Применение гидрофобной подложки является предпочтительным, и препаративная обращенно-фазовая HPLC является особенно предпочтительной для ионного обмена. Трифторацетат может быть замещен хлоридом напрямую или сначала может быть замещен ацетатом, а затем ацетат замещен хлоридом.
Противоионы, будь то трифторацетат, ацетат или хлорид, связываются с положительно заряженными атомами в TAT-NR2B9c, в частности, в N-концевой аминогруппе, а также в аргининовых и лизиновых остатках боковых цепей аминокислоты. Хотя осуществление настоящего изобретения не зависит от понимания точной стехиометрии взаимодействия пептида с анионом в соли TAT-NR2B9c, полагают, что в молекулах приходится до приблизительно 9 противоионов на молекулу соли.
Хотя замещение одного противоиона другим происходит эффективно, чистота конечного противоиона может составлять менее 100%. Таким образом, упоминание хлоридной соли TAT-NR2B9c или другого активного средства означает, что в препарате соли хлорид является анионом, преобладающим по массе (или молям) над всеми другими анионами, присутствующими во всей соли. Другими словами, хлорид составляет более 50% и предпочтительно более 75%, 95%, 99%, 99,5% или 99,9% по массе или молям всех анионов, присутствующих в соли. В такой соли или составе, полученном из соли, ацетат и трифторацетат в комбинации и отдельно составляют менее 50%, 25%, 5%, 0,5% или 0,1% анионов в соли или составе.
IV. Заболевания
Лиофилизированные составы применимы в лечении ряда заболеваний, в частности, неврологических заболеваний, и особенно заболеваний, опосредованных отчасти эксайтотоксичностью. Такие заболевания и состояния включают в себя инсульт, эпилепсию, гипоксию, субарахноидальное кровоизлияние, травматическое повреждение CNS, не ассоциированное с инсультом, такое как травматическое повреждение головного мозга и повреждение спинного мозга, другая ишемия головного мозга, болезнь Альцгеймера и болезнь Паркинсона. Другие неврологические заболевания, излечимые средствами в соответствии с настоящим изобретением, как известно, не ассоциированные с эксайтотоксичностью, включают в себя тревожность и боль.
Инсульт является состоянием, вызываемым нарушением кровотока в CNS независимо от причины. Возможные причины включают в себя эмболию, кровоизлияние и тромбоз. Некоторые нейрональные клетки погибают сразу в результате нарушения кровотока. Эти клетки высвобождают свои составляющие молекулы, в том числе глутамат, который, в свою очередь, активирует NMDA-рецепторы, повышающие уровни внутриклеточного кальция и внутриклеточные уровни ферментов, что приводит к дальнейшей гибели нейрональных клеток (каскад эксайтотоксичности). Гибель ткани CNS называют инфарктом. Объем инфаркта (т.е. объем нейрональных клеток, умерших в результате инсульта в головном мозге) может быть использован в качестве показателя степени патологического повреждения в результате инсульта. Симптоматический эффект зависит как от объема инфаркта, так и от того, в какой части головного мозга он наблюдается. Индекс инвалидности может быть использован в качестве меры симптоматического повреждения, например, шкала Рэнкина оценки исходов перенесших инсульт больных (Rankin, Scott Med J; 2:200-15 (1957)) и индекс Бартела. Шкала Рэнкина основана на оценивании непосредственно общих состояний больного следующим образом:
0: отсутствие симптомов;
1: отсутствие существенного нарушения жизнедеятельности, несмотря на наличие некоторых симптомов; способен выполнять все повседневные обязанности;
2: легкое нарушение жизнедеятельности; не способен выполнять все прежние обязанности, но способен обслуживать себя без посторонней помощи;
3: умеренное нарушение жизнедеятельности, требующее некоторой помощи, однако способен ходить без посторонней помощи;
4: нарушение жизнедеятельности от умеренного до тяжелого; не способен ходить без посторонней помощи и не способен справляться со своими физическими потребностями без посторонней помощи;
5: тяжелое нарушение жизнедеятельности; прикован к постели, недержание мочи и кала, требует постоянной помощи и присмотра персонала.
Индекс Бартела основывается на сериях вопросов о способности больного выполнять 10 основных повседневных действий с присваиванием балла от 0 до 100, при этом более низкий бал указывает на большее нарушение жизнедеятельности (Mahoney et al, Maryland State Medical Journal 14:56-61 (1965)).
В качестве альтернативы, тяжесть/исходы инсульта могут быть измерены с использованием шкалы инсульта NIH, доступной во всемирной сети Интернет на ninds.nih.gov/doctors/NIH Stroke ScaleJBooklet.pdf.
Шкала основывается на способности больного выполнять 11 групп функций, что предусматривает оценивание у больного уровня сознания, двигательных, сенсорных и языковых функций.
Ишемический инсульт, более конкретно, относится к типу инсульта, который вызывается закупориванием кровотока к головному мозгу. Основным условием для этого типа закупоривания чаще всего является развитие жировых отложений, выстилающих стенки сосудов. Это состояние называется атеросклерозом. Такие жировые отложения могут вызывать два типа обструкции. Церебральный тромбоз относится к тромбу (кровяному сгустку), который развивается в закупоренной части сосуда. «Церебральная эмболия» относится в целом к кровяному сгустку, который формируется в другом месте сердечно-сосудистой системы, как правило, в сердце и крупных артериях верхней части грудной клетки и шеи. Затем часть кровяного сгустка отрывается, попадает в кровь и проходит через кровеносные сосуды головного мозга, пока не достигнет сосудов, слишком мелких, чтобы его пропустить. Второй важной причиной эмболии является нерегулярное сердцебиение, известное как артериальная фибрилляция. Это создает условия, в которых сгустки могут образовываться в сердце, перемещаться и доходить до головного мозга. Дополнительными потенциальными причинами ишемического инсульта являются кровоизлияние, тромбоз, рассечение артерии или вены, остановка сердца, шок любой этиологии, в том числе кровоизлияние, и ятрогенные причины, такие как непосредственное хирургическое повреждение кровеносных сосудов головного мозга или сосудов, ведущих к головному мозгу, или хирургическое вмешательство на сердце. На ишемический инсульт приходится приблизительно 83 процента всех случаев инсульта.
Преходящие ишемические приступы (TIA) являются незначительными или предвещающими инсультами. При TIA присутствуют состояния, указывающие на ишемический инсульт, и развиваются типичные предвещающие инсульт признаки. Однако закупоривание (кровяной сгусток) возникает в течение короткого периода времени и имеет тенденцию растворяться посредством нормальных механизмов. Больные, подвергающиеся хирургическому вмешательству на сердце, особенно подвержены риску преходящего церебрального ишемического приступа.
Геморрагический инсульт составляет приблизительно 17 процентов случаев инсульта. Он возникает в результате ослабленного сосуда, который разрывается и кровоточит в окружающий головной мозг. Кровь скапливается и сжимает окружающие ткани головного мозга. Двумя основными типами геморрагических инсультов являются внутримозговое кровоизлияние и субарахноидальное кровоизлияние. Геморрагический инсульт возникает из-за разрушения ослабленного кровеносного сосуда. Потенциальные причины разрыва ослабленного кровеносного сосуда включают в себя гипертоническое кровоизлияние, при котором высокое кровяное давление вызывает разрыв кровеносного сосуда, или другую основную причину ослабленного кровеносного сосуда, такую как разрушающая сосуды мальформация головного мозга, в том числе аневризма головного мозга, артериовенозная мальформация (AVM) или кавернозная мальформация. Геморрагические инсульты также могут являться результатом геморрагической трансформации ишемического инсульта, что ослабляет кровеносные сосуды при инфаркте, или кровоизлияния из первичных или метастатических опухолей в CNS, которые содержат патологически слабые кровеносные сосуды. Геморрагический инсульт также может возникать по ятрогенным причинам, таким как прямое хирургическое вмешательство на кровеносных сосудах головного мозга. Аневризма является баллонированием ослабленного участка кровеносного сосуда. Если ее не лечить, аневризма продолжит ослабевать до разрыва и кровоизлияний в головной мозг. Артериовенозная мальформация (AVM) представляет собой скопление аномально сформированных кровеносных сосудов. Кавернозная мальформация представляет собой венозную патологию, которая может вызвать кровоизлияние из ослабленных венозных структур. Любой из таких сосудов может разорваться, что также вызывает кровотечение в головной мозг. Геморрагический инсульт также может произойти в результате физической травмы. Геморрагический инсульт в одной части головного мозга может привести к ишемическому инсульту в другой из-за нехватки крови, потерянной при геморрагическом инсульте.
Один класс больных, подлежащих лечению, составляют больные, подвергающиеся хирургической процедуре, которая затрагивает или может затрагивать кровеносный сосуд, питающий головной мозг, или иной в головном мозге или CNS. Некоторые примеры включают в себя больных, подвергающихся сердечно-легочному шунтированию, стентированию сонной артерии, диагностической ангиографии головного мозга или коронарных артерий аортальной дуги, процедурам сосудистой хирургии и нейрохирургическим процедурам. Дополнительные примеры таких больных обсуждаются в приведенном выше разделе IV. Особенно подходят больные с аневризмой головного мозга. Таких больных можно лечить с помощью ряда хирургических процедур, включающих в себя клипирование аневризмы для остановки крови или выполнение эндоваскулярного хирургического вмешательства для блокирования аневризмы небольшими спиралями или введением стента в кровеносный сосуд, в котором появляется аневризма, или введением микрокатетера. Эндоваскулярные процедуры являются менее инвазивными, чем клипирование аневризмы, и ассоциируются с лучшим исходом для больного, но исход все еще предполагает возникновение небольших инфарктов. Таких больных можно лечить ингибитором взаимодействия PSD-95 с NMDAR 2В и, в частности, средствами, описываемыми выше, в том числе пептидом YGRKKRRQRRRKLSSIESDV (SEQ ID NO: 6, также известным как Tat-NR2B9c). Временные рамки введения относительно осуществляемого хирургического вмешательства могут быть такими, как описываемые выше для клинического испытания.
Другой класс больных, подлежащих лечению, составляют больные, страдающие субарахноидальным кровоизлиянием с аневризмой или без таковой (см. заявку на выдачу патента США №61/570264).
IV. Эффективные режимы введения
После восстановления лиофилизированный состав вводят так, что активное средство (например, NR2B9c) вводится в количестве, при частоте и пути введения, эффективных для излечения, снижения или ингибирования дальнейшего ухудшения по меньшей мере одного признака или симптома заболевания у больного, страдающего подлежащим лечению заболеванием. Терапевтически эффективное количество означает количество активного средства, достаточное в значительной степени для излечения, снижения или ингибирования дальнейшего ухудшения по меньшей мере одного признака или симптома подлежащего лечению заболевания или состояния у группы больных (или животных моделей), страдающих заболеванием, которое лечат средством в соответствии с настоящим изобретением, по сравнению с поражением у контрольной группы больных (или животных моделей), страдающих этим заболеванием или состоянием, которые не получают лечения данным средством. Количество также считается терапевтически эффективным, если получающий индивидуальное лечение больной достигает более благоприятного исхода, чем средний исход в контрольной группе сравнимых больных, не получающих лечения способами в соответствии с настоящим изобретением. Терапевтически эффективный режим предусматривает введение терапевтически эффективной дозы при частоте и пути введения, необходимых для достижения поставленной цели.
Для больных, страдающих инсультом или другим ишемическим состоянием, активное средство вводят при режиме, предусматривающем количество, частоту и путь введения, эффективные для снижения повреждающих воздействий инсульта или другого ишемического состояния. Если состоянием, требующим лечения, является инсульт, то исход может быть определен по объему инфаркта или индексу инвалидности, а дозировку считают терапевтически эффективной, если получающий индивидуальное лечение больной показывает нетрудоспособность в два балла или меньше по шкала Рэнкина и 75 или больше по шкале Бартела, или если группа получающих лечение больных показывает существенно улучшенное (т.е. меньшее нарушение жизнедеятельности) распределение баллов по шкале нарушения жизнедеятельности, чем сравниваемая не получающая лечение группа, см. Lees et at L, N Engl J Med 2006; 354:588-600. Одной дозы средства, как правило, достаточно для лечения инсульта.
Настоящее изобретение также относится к способам и составам для профилактики расстройства у субъекта с риском данного расстройства. Как правило, такой субъект характеризуется повышенной вероятностью развития расстройства (например, состояния, болезни, расстройства или заболевания) по сравнению с контрольной группой. Контрольная группа, например, может содержать одного или несколько индивидуумов, произвольно выбранных из общей группы (например, подобранной по возрасту, полу, расовой и/или этнической принадлежности), у которых данное расстройство не было диагностировано или не наблюдалось в семейном анамнезе. Субъекта можно считать подверженным риску расстройства, если обнаруживают, что «фактор риска», ассоциированный с данным расстройством, ассоциируется с данным субъектом. Фактор риска может включать в себя любую активность, признак, событие или свойство, ассоциированные с данным расстройством, например, посредством статистических или эпидемиологических исследований на группе субъектов. Субъект, таким образом, может быть классифицирован как подверженный риску расстройства, даже если исследования, идентифицирующие основные факторы риска, не предусматривают субъекта конкретно. Например, субъект, подвергающийся хирургическому вмешательству на сердце, подвержен риску преходящего церебрального ишемического приступа, поскольку частота преходящего церебрального ишемического приступа повышается в группе субъектов, подвергшихся хирургическому вмешательству на сердце, по сравнению с группой субъектов, не подвергавшихся таковому.
Другие широко распространенные факторы риска инсульта включают в себя возраст, семейный анамнез, пол, число предыдущих случаев инсульта, преходящий ишемический приступ или сердечный приступ, высокое давление крови, курение, диабет, заболевание сонной или других артерий, предсердную фибрилляцию, другие заболевания сердца, такие как болезнь сердца, сердечная недостаточность, дилятационная кардиомиопатия, заболевание сердечного клапана и/или врожденный порок сердца; высокое содержание холестерина в крови и питание с высоким содержанием насыщенного жира, трансжира или холестерина.
При профилактике лиофилизированный состав после восстановления вводят больному, подверженному риску заболевания, но еще не страдающему заболеванием, при количестве, частоте и пути, достаточных для предупреждения, задерживания или ингибирования развития по меньшей мере одного признака или симптома заболевания. Профилактически эффективное количество означает количество средства, достаточное в значительной степени для предупреждения, ингибирования или задерживания по меньшей мере одного признака или симптома заболевания в группе больных (или животных моделей), подверженных риску заболевания, которое лечат данным средством, по сравнению с контрольной группой больных (или животных моделей), подверженных риску заболевания, не получавших лечение химерным средством в соответствии с настоящим изобретением. Количество также считают профилактически эффективным, если получающий индивидуальное лечение больной достигает исхода, более благоприятного, чем средний исход в контрольной группе сравнимых больных, не получающих лечение способами в соответствии с настоящим изобретением. Профилактически эффективный режим предусматривает введение профилактически эффективной дозы при частоте и пути введения, необходимых для достижения поставленной цели. Для профилактики инсульта у больного, подверженному надвигающемуся риску инсульта (например, у больного, подвергающегося хирургическому вмешательству на сердце), одной дозы средства, как правило, достаточно.
В зависимости от средства введение может быть парентеральным, внутривенным, назальным, пероральным, подкожным, внутриартериальным, внутричерепным, интратекальным, внутрибрюшинным, местным, интраназальным или внутримышечным. Внутривенное введение является предпочтительным для пептидных средств.
Для введения людям предпочтительная доза активного средства (например, Tat - NR2B9c) составляет 2-3 мг/кг и более предпочтительно 2,6 мг/кг. Указанные дозировки следует понимать как включающие в себя предел погрешности, характерный для точности, с которой дозировки могут быть измерены в типичных условиях стационара. Такие количества относятся к введению одной дозой, т.е. одной дозой на приступ заболевания.
Активные средства, такие как Tat-NR2B9c, предпочтительно доставляют путем инфузии в кровеносный сосуд, более предпочтительно путем внутривенной инфузии. Время инфузии может влиять как на побочные эффекты (например, из-за дегрануляции тучных клеток и высвобождения гистамина), так и на эффективность. Как правило, для данного уровня дозировки более короткое время инфузии, вероятнее, приведет к высвобождению гистамина. Однако более короткое время инфузии также может обеспечить улучшенную эффективность. Хотя осуществление настоящего изобретения не зависит от понимания механизма, последний результат можно объяснить как задержкой, являющейся существенной, в отношении развития патологии у больного, так и задержкой, являющейся существенной, в отношении периода полувыведения из плазмы химерного средства, в результате чего химерное средство не достигает оптимального терапевтического уровня. Для химерного средства Tat-NR2B9c предпочтительное время инфузии, обеспечивающее баланс между данными причинами, составляет 5-15 минут и более предпочтительно 10 минут. Указанные временные промежутки следует понимать как включающие в себя погрешность +/- 10%. Временные промежутки инфузии не предусматривают дополнительное время для выведения диффузии с целью выведения каких-либо оставшихся небольших количеств от начальной диффузии, которая иным образом протекала до конца. Временные промежутки для инфузии Tat-NR2B9c также могут служить нормой для других активных средств.
Хотя настоящее изобретение описано подробно для ясности понимания, могут быть осуществлены некоторые модификации в пределах объема прилагаемой формулы изобретения. Все публикации, номера доступа и патентные документы, цитируемые в настоящей заявке, тем самым включены посредством ссылки во всей своей полноте для всех целей в той же степени, как если бы каждый был указан индивидуально. В тех случаях, когда более чем одна последовательность ассоциируется с номером доступа в различные моменты времени, подразумевается, что последовательности связаны с данным номером доступа по состоянию на действительную дату подачи настоящей заявки. Действительной датой подачи считается дата самого раннего приоритета заявки, раскрывающей представляющий интерес номер доступа. Если из контекста не следует иное, любые элемент, вариант осуществления, стадия, признак или аспект настоящего изобретения могут быть осуществлены в сочетании с любыми другими.
Примеры
В примерах 1-7 показано, что ацетатная соль TAT-NR2B9c может быть составлена в лиофилизированной форме с гистидином и трегалозой. В примере 10 показано, что хлоридная соль TAT-NR2B9c обеспечивает значительно большую стабильность, чем ацетатная соль в ином аналогичном лиофилизированном составе. В примере 9 показано, что хлоридная соль TAT-NR2B9c, составленная в гистидине и трегалозе, также дает улучшенную стабильность по сравнению с ранее описанным лиофилизированным составов TAT-NR2B9c из нормального солевого раствора.
Пример 1. Демонстрация того, что стандартные буферы и вспомогательные средства не влияют на эффективность TAT-NR2B9c in vivo
Составляли пять жидких токсикологических составов, ориентированных на концентрацию 20 мг/мл TAT-NR2B9c. Таблица 1 включает в себя композицию среды, номер партии, а также эффективность, чистоту и pH на момент составления. Приблизительно 5 мл каждого состава разливали по флаконам для тестирования. Флаконы замораживали при -20°С для имитации условий транспортировки или хранения в жидком состоянии.

1Эффективность и чистоту оценивали с помощью RP-HPLC анализа с использованием способа TFA.
2Чистота состава №2 заметно ниже, чем у других составов.
3pH фосфатно-буферных составов заметно отличается от начального pH буфера 7,0.
Было отмечено, что фосфатно-буферный состав не поддерживает pH, также как гистидиновые буферы, от составления до тестирования, что указываем на то, что гистидин может быть превосходным буфером для состава.
Составы №№1-5 тестировали на модели инсульта 3-PIAL Vessel Occlusions (3PVO) у крыс. Крысам, подвергнувшимся инсульту, давали один из составов путем внутривенного введения в бедренную вену, а затем животных умертвляли через 24 часа после инсульта. Собирали головной мозг, фиксировали и окрашивали трифенилтетразолия хлоридом (ТТС) для визуализации ишемических частей головного мозга. Все тестируемые составы могли обеспечивать значительную нейропротекцию у животных по сравнению с контролем в виде только солевого раствора (фиг. 1).
Способы
Модель ишемии с окклюзией трех пиальных сосудов
Эксперименты выполняли на крысах. Продолжительную окклюзию трех пиальных сосудов (3PVO) осуществляли, как описывалось ранее (Angiogenic protection from focal ischemia with angiotensin II type 1 receptor blockade in the rat. Forder et al., Am J Physiol Heart Circ Physiol. 2005 Apr; 288(4):H1989-96). Вкратце, крыс массой от 250 г до 350 г анестезировали внутримышечной инъекцией 0,5 мл/кг кетамина (100 мг/кг), ацепромазина (2 мг/кг) и ксилазина (5 мг/кг), дополненной одной третьей от начальной дозы при необходимости. Животным устанавливали анальный термометр и помещали их на грелку, поддерживаемую при приблизительно 37°С. Череп вскрывали путем срединного разреза и очищали от ткани. С использованием препаровальной лупы и пневматической бормашины проделывали в черепе 6-8-мм окно над правой соматосенсорной корой (2 мм каудально и 5 мм латерально по отношению к брегме) путем высверливания прямоугольника в черепе и вытягивания кусочка черепа, оставляя твердую мозговую оболочку неповрежденной. Ветви 3 пиальных средних мозговых артерий артериольной системы каутеризировали вокруг колончатого кора, выбирали и электрически каутеризировали через твердую мозговую оболочку. После каутеризаций скальп зашивали. Каждую крысу возвращали в ее индивидуальную клетку под нагревательной лампой для поддержания температуры тела до полного восстановления крысы. Подавали корм и воду. Через один час после ишемии 3PVO крысам вводили инъекцию с составами NA-1 при 3 нмоль/г в ~0,45 мл солевого раствора из расчета на массу крысы. Дозы вводили в течение 5 минут.
Через двадцать четыре часа после хирургического вмешательства головной мозг быстро собирали. Брали коронарные срезы (2 мм) по головному мозгу и инкубировали в 2% трифенилтетразолия хлориде (ТТС) (Sigma-Aldrich St. Louis МО) в течение 15 минут при 37°С. Изображения сканировали (CanoScan 4200F Canon) и оценивали количественно.
Пример 2. Определение стабильности TAT-NR2B9c в различных буферах и при различных значениях pH
Скрининг буферов
Десять буферов составляли при 1 мг/мл TAT-NR2B9c для скрининга вспомогательных средств. Образцы хранили при 25°С/60% относительной влажности (RH) и 40°С/75% RH. Образцы тестировали на предмет стабильности (чистоты) при t = 0, а при t = 1 неделя на предмет чистоты с помощью RP-HPLC (способов TFA и MSA), результаты показаны в таблицах 2 и 3.
Результаты указывают на улучшенную стабильность для TAT-NR2B9c в жидкой среде, буферизированной от pH 6,0 до pH 6,5. Расщепление, по-видимому, усиливается за пределами этого диапазона в любом направлении. Данные, полученные способом MSA, демонстрирующим четкие паттерны расщепления, зависели как от pH, так и от буферных компонентов, и обеспечили ценную информацию для разработки будущего состава. Результаты для основного пика чистоты по % площади HPLC с использованием способа MSA представлены в таблице 2, тогда как результаты для основного пика чистоты по % площади HPLC с использованием способа TFA представлены в таблице 3.


Результаты указывают на то, что стабильность раствора TAT-NR2B9c лучше всего поддерживается в буферной среде с pH 6,0-6,5, и при этом среда хорошо переносится при IV введении. Как правило, буферные системы гистидина и цитрата могли поддерживать TAT-NR2B9c в интактной форме, даже при хранении в условиях ускоренных испытаний стабильности при 25°С или 40°С в течение 1 недели.
Существует несколько факторов, которые следует учитывать при выборе буферных компонентов: специфические паттерны расщепления, которые наблюдаются в каждой среде, и любые данные об идентифицированных сопутствующих примесях или токсикологической настороженности могут упростить процесс принятия решений, если избегать указанных сопутствующих примесей. За период тестирования буферы с гистидином и цитратом с pH от 6 до 6,5 демонстрировали незначительное количество продуктов расщепления. Буфер с гистидином отдельно, используемый в данном исследовании, содержал примесь, которая присутствовала в гистидиновом буфере при отсутствии добавленного TAT-NR2B9c. Таким образом, поиск поставщика гистидина без такой примеси упростил бы анализ. В таблице 4 представлено краткое описание буферных компонентов с точки зрения стабильности TAT-NR2B9c.


Пример 3. Определение стабильности TAT-NR2B9c в гистидиновых и цитратных буферах, а также при различных значениях pH с варьирующими количествами натрия хлорида
Цель данного исследования заключалась в демонстрации эффектов натрия хлорида (NaCl) на pH и стабильность TAT-NR2B9c в жидких составах. Буферные составы с 1 мг/мл TAT-NR2B9c приведены в таблице 5, а результаты по pH представлены в таблице 6. Данные показывают достаточно стабильные результаты на протяжении исследования. Однако заметные изменения наблюдались в цитрате с добавлением NaCl, в котором была затронута буферная способность, и pH падало на ~ 0,2 единицы. Выбранные pH 6,0 и 6,5 попадают в верхний предел идеального буферного диапазона для цитрата (pH 2,5-5,6) так, что могут вызывать затруднения с различными добавками в ходе процесса составления и должны учитываться при оценивании устойчивости состава.


Результаты указывают на то, что добавление 200 мМ NaCl в забуференные гистидином и цитратом растворы TAT-NR2B9c существенно не влияет на pH растворов ни при хранении в течение недели при заморозке, ни при температурных условиях ускоренных испытаний 40°С.
Далее проверяли стабильность TAT-NR2B9c в данных составах при хранении в течение 1 недели при заморозке и температурных условиях ускоренных испытаний. В таблице 7 показаны результаты тестирования с использованием способа RP-HPLC с градиентом MSА. Данные также представлены на фиг. 2А и 2В. На фиг. 2А представлена стабильность в условиях ускоренных испытаний составов, отсортированные слева направо (от низкой до высокой стабильности). На фиг. 2В показана относительная стабильность в условиях ускоренных испытаний с буферным средством.

Данные результаты указывают на то, что стабильность раствора TAT-NR2B9c наилучшим образом поддерживается при pH 6,5, и добавление NaCl может обеспечивать небольшое улучшение стабильности (фиг.2А и 2В). Благодаря улучшенной буферной способности и сопоставимой стабильности гистидинового буфера, особенно если примесь, перемещающаяся с относительным временем удерживания (RRT) 0,28, исключается (область примеси, включенная в приведенную выше таблицу, приводящая к более низкому значению стабильности для площади пика Tat-NR2B9c), гистидиновые буферные компоненты при pH 6,5 представляют лучший состав для перехода к исследованиям лиофилизации.
Среды при pH 6,5 хорошо переносятся при IV введении.
Пример 4. Отбор объемообразующих средств для TAT-NR2B9c с целью формирования стабильного лиофилизированного осадка
Для идентификации объемообразующих средств, которые обеспечивали бы хороший осадок при лиофилизации и улучшенную стабильность, составляли несколько растворов с 20 мг/мл TAT-NR2B9c в 50 мМ гистидиновом буфере, объемообразующем средстве и NaCl, как указано в таблице 8. Для имитации времени и температур манипуляций, которым могут подвергаться составы TAT-NR2B9c в ходе процесса лиофилизации, данные образцы хранили при -20°С (контроль) и 40°С/75% RH (тест) и анализировали после одной недели хранения на предмет чистоты с помощью HPLC (способа MSA) и pH. Результаты, представляющие стабильность pH, показаны в таблице 9, а результаты стабильности TAT-NR2B9c в различных жидких составах показаны в таблице 10 и на фиг. 3.

Результаты жидких составов объемообразующего средства в отношении стабильности TAT-NR2B9c
Маннит, трегалоза и декстран-40 хорошо поддерживают pH при 6,5 (таблица 9), и наблюдается приблизительно 1% снижение чистоты (таблица 10) за 1 неделю при хранении жидкого состава при высокой температуре. С точки зрения химической стабильности лиофилизируемого раствора Tat-NR2B9c для заполнения маннит и трегалоза являются предпочтительными объемообразующими средствами, поскольку они обеспечивают лучшую стабильность для TAT-NR2B9c, чем растворы декстрана-40 (фиг. 3).
Пример 5. Термический анализ объемообразующих средств для облегчения разработки циклов лиофилизации
В рамках разработки циклов лиофилизации для лиофилизированного лекарственного продукта TAT-NR2B9c предложенные растворы для заполнения из матрицы образцов объемообразующего средства (таблица 8) оценивали с помощью дифференциальной сканирующей калориметрии (DSC) по термическим характеристикам, в том числе по стеклованию (Tg) в составе. Результаты приведены в таблице 11, а следы DSC включены в фиг. 4А-6В.

При концентрации TAT-NR2B9c 20 мг/мл тестируемые составы TAT-NR2B9c демонстрировали термический профиль, характеризуемый широким явлением плавления с началом при низкой температуре. Такое расширенное плавление маскируется явлением кристаллизации, как правило, наблюдаемым в составах с маннитом, и может указывать на то, что должен быть выполнен жесткий цикл сушки замораживанием, если продукт никогда не превышает температуру стеклования. В этом случае, на основании наблюдаемых стеклований раствора для заполнения лекарственного продукта Tat-NR2B9c применение маннита в качестве объемообразующего средства потребует температуры первичной сушки ниже -40°С, типичного предела возможности для масштабируемого цикла. С точки зрения термических профилей трегалоза и декстран-40 отлично подходят для применения в качестве объемообразующего средства. Однако, с учетом того, что стабильность ТАТ-NR2B9c в жидких составах, содержащих трегалозу, превосходила таковую в содержащих декстран, трегалоза была бы предпочтительным объемообразующим средством из тестируемых.
Из-за относительно низких температур Tg, которые, вероятно, потребуются для более длительного цикла лиофилизации для сушки, рассматривали более широкий диапазон стандартных объемообразующих средств и следили за снижением объема заполнения в системе контейнер/укупорка так, чтобы там был пониженный объем жидкости для лиофилизации. В попытке уменьшить объем заполнения и поддержать 270 мг/флакон проводили исследование растворимости TAT-NR2B9c в гистидине, pH 6,5, и в гистидин + трегалоза, pH 6,5. Образцы анализировали визуально при 35, 50, 75 и 100 мг/мл. Все растворы были прозрачными при t = 0 и t = 24 часа. На основании этих данных могли использовать объем заполнения ниже 3 мл, который с использованием состава TAT-NR2B9c 90 мг/мл обеспечил бы 270 мг в целевом флаконе. Во флаконе может потребоваться широкий диапазон количеств, но 270 мг обеспечит дозу 2,6 мг/кг для больного массой 100 кг. При условии, что, если целевая концентрация восстановления для введения больному все еще составляет 20 мг/мл (но может составлять от 1 мг/мл до 100 мг/мл), то 20-мл флакон для лиофилизации, содержащий 270 мг TAT-NR2B9c, может быть использован с объемом восстановления 13,5 мл. Таким образом, оптимальные объемы жидкости для лиофилизации TAT-NR2B9c во флаконе будут составлять от 2,5 мл до 10 мл.
Перед тем, как приступить к разработке лиофилизации, тестировали широкий диапазон объемообразующих средств, и Tg показаны в таблице 12. Также оценивали 100 мг/мл TAT-NR2B9c в гистидине, pH 6,5, с помощью DSC, данные включены в таблицу 12.

На основании данных DSC в таблице 12 наблюдается несколько вариантов составов для лекарственных продуктов, как с активным средством, так и с плацебо. Как правило, составы №№5 и 11 являются наиболее перспективными для активного продукта с точки зрения Tg. Любое объемообразующее средство может быть приемлемым для применения в плацебо продукте, но состав №4 (маннит) будет иметь наименьшую продолжительность цикла, если выполняется отжиг, и может быть наиболее пригодным для соответствующего внешнего вида активного средства.
Поскольку определяется оптимальный активный состав, важно рассмотреть вопрос о стабильности раствора, устойчивости цикла лиофилизации и химической стабильности. Состав №5 из таблицы 12 (трегалоза) демонстрирует хорошую стабильность раствора и химическую стабильность лиофилизата при условиях ускоренных испытаний (данные показаны ниже), но требует более длительного цикла лиофилизации при конфигурации заполнения 13,5 мл. Такой более продолжительный цикл не может быть идеальным для коммерческого производства в будущем, при котором желателен более короткий цикл. Состав №11 из таблицы 12 (без объемообразующего средства, при 100 мг/мл TAT-NR2B9c) характеризуется более высокой температурой стеклования, чем состав №5, что создает возможность для более горячего, более короткого цикла. Кроме того, пониженный объем заполнения позволит существенно сократить время выполнения, поскольку нужно будет сублимировать меньше льда из каждого флакона.
Пример 6. Стабильность TAT-NR2B9c с варьирующими обьемообразующими средствами, масштабами и условиями лиофилизации
Стабильность объемообразующего средства в условиях ускоренных испытаний
Небольшую партию лекарственного продукта TAT-NR2B9c лиофилизировали для оценивания стабильности в твердом состоянии после 1 недели при 25°С, 40°С и 60°С. TAT-NR2B9c составляли при концентрации активного средства 20 мг/мл в трех различных средах. Образцы оценивали по внешнему виду, восстановлению, pH, количеству и чистоте с помощью HPLC (способа MSA) при t = 0 и t = 1 неделя. Содержание воды оценивали только при t = 0.
Все лекарственные продукты TAT-NR2B9c выглядели как белые лиофилизированные осадки и восстанавливались в пределах менее 10 секунд при t = 0 и t = 1 неделя.
Среды лекарственного продукта описываются в таблице 13 и приведены с соответствующими результатами по температуре стеклования и содержанию воды. Результаты pH, количества TAT-NR2B9c и чистоты TAT-NR2B9c описываются в таблицах 14-16.
Таблица 13. Матрица образца объемообразующего средства: Tg и % содержания воды

Все три объемообразующих средства - трегалоза, декстран-40 и трегалоза:декстран-40 - поддерживают pH при 6,5 (таблица 14), и наблюдается диапазон 0,5-2,5% снижения чистоты при 60°С через 1 неделю (таблица 15). Оба лекарственных продукта, содержащие декстран-40 и хранящиеся при 60°С, показали увеличение сопутствующих примесей при времени удерживания (RT) ~ 6,0. Данные сопутствующие примеси не присутствовали в образцах трегалозы, что подтверждает то, что трегалоза обладает стабилизирующим эффектом в лиофилизированном лекарственном продукте, а декстран-40 может вызвать специфичное расщепление продукта.
Включение декстрана-40 в объемообразующее средство обеспечивает более высокую температуру первичной сушки, но декстран-40 в качестве объемообразующего средства демонстрировал наихудшую стабильность. Комбинация трегалозы и декстрана-40 (1:1) приводит к температуре стеклования, которая на приблизительно 10°С выше, чем с трегалозой отдельно. Однако оказалось, что стабильность при 60°С является промежуточной для образцов с трегалозой и декстраном отдельно, так что трегалоза является предпочтительным объемообразующим средством.
Разработка лиофилизированного состава TAT-NR2B9c: эксперимент малого масштаба №2
Небольшую партию лекарственного продукта TAT-NR2B9c лиофилизировали для оценивания условий температуры хранения при 5°С в ходе первичной сушки. ТАТ-NR2B9c составляли при концентрации активного средства 27 мг/мл в 50 мМ гистидина, pH 6,5, и 120 мМ трегалозы. Параметры цикла приведены в таблице 17. Четыре 20-мл стеклянных флакона для лиофилизации заполняли на 10 мл. Два флакона зондировали датчиками температуры.


1Температура первичной сушки с учетом большого размера флакона и объема заполнения напрямую не связана с температурой стеклования.
Из-за большого объема заполнения необходимо установить температуру хранения существенно выше, чем температура стеклования, чтобы компенсировать испарительное охлаждение. Температура раствора в ходе первичной сушки составляла -29°С, что близко к температуре стеклования -28°С согласно термическому анализу DSC.
Стабильность лиофилизата 90 мг/мл TAT-NR2B9c в условиях ускоренных испытаний (эксперимент малого масштаба №3)
До составления раствора для заполнения в малом масштабе №3 90 мг/мл ТАТ-NR2B9c в буфере (50 мМ гистидин, pH 6,5) оценивали по pH. pH раствора составляло 6.04. Было установлено, что с увеличением концентрации TAT-NR2B9c силу буферизации также необходимо увеличивать. Растворы получали при 150 мМ, 100 мМ, 75 мМ и с водой и оценивали по рН. Значения рН приведены в таблице 18. Эксперимент малого масштаба №3 осуществляли в буфере с 100 мМ гистидина при рН 6.5, и рН доводили до 6,5 после добавления TAT-NR2B9c.

Небольшую партию лекарственного продукта TAT-NR2B9c лиофилизировали для оценивания стабильности в твердом состоянии после 1 недели хранения при 25°С и 60°С. Составляли два состава с 90 мг/мл TAT-NR2B9c (буфер и буфер с трегалозой). Образцы оценивали по внешнему виду, восстановлению, содержанию воды и чистоте с помощью HPLC (способа MSA) при t = 0 и t = 1 неделя.
Все лекарственные продукты TAT-NR2B9c выглядели как белые лиофилизированные осадки. Некоторые осадки были растрескавшимися. Составы плацебо были визуально похожи на составы активного средства.
Время восстановления составляло приблизительно 1,5 минуты в сравнении с менее 10 секундами для предыдущих составов. Увеличение времени восстановления, скорее всего, объясняется повышением концентраций TAT-NR2B9c и гистидина. Дальнейшие тесты показали хорошую стабильность TAT-NR2B9c с концентрациями гистидинового буфера 50 и 75 мМ при уменьшении временных периодов ресуспендирования. Также из-за размера 2-мл флакона, используемого для данного исследования, добавляли только 1 мл воды в лиофилизат. Фактический объем восстановления составляет 4,5 мл в данной конфигурации малого масштаба. Время восстановления, вероятнее всего, улучшится при использовании большего объема разбавителя.
Флаконы помещали в условия испытания стабильности при 25°С и 60°С и тестировали после 1 недели хранения.
Согласно данным внешнего вида образец трегалозы давал более приемлемый осадок. Цикл лиофилизации проводили консервативно в течение 5 дней с температурой первичной сушки -32°С. На основании данных температурных датчиков цикл может быть сокращен, что демонстрирует тот факт, что при более высокой концентрации и более низком объеме заполнения оптимизированный цикл будет короче.
Результаты чистоты представлены в таблице 19.

На основании этих данных стабильности в условиях ускоренных испытаний трегалоза демонстрирует стабилизирующий эффект на состав Tat-NR2B9c, что улучшает химическую стабильность лиофилизата. Удивительным является то, что трегалоза способна обеспечивать такой стабилизирующий эффект, тогда как другие стандартные объемообразующие средства, такие как декстран и маннит, используемые для других пептидов, не могут.
Пониженный объем заполнения минимизирует конкурирующее испарительное охлаждение окружающих флаконов и минимизирует сопротивление потоку сублимирующейся воды.
Разработка цикла лиофилизации - эксперимент малого масштаба №4 (плацебо и активное средство)
Эксперимент малого масштаба №4 разработки цикла лиофилизации предпринимали для тестирования внешнего вида осадка и условий лиофилизации для 3-мл заполнения. Тестируемыми образцами были 100 мМ His, рН 6,5, с 120 мМ трегалозы и 90 мг/кг TAT-NR2B9c или аналогичный образец без трегалозы. Консервативный 4-дневный цикл выполняли, как описано в таблице 20. Флаконы с плацебо и активным средством включали с конфигурацией заполнения 3 мл в 20-мл стеклянный флакон для лиофилизации вместо маленьких флаконов, используемых в предыдущих экспериментах. Активный датчик температуры использовали для подтверждения температуры в ходе цикла лиофилизации. Полученные в результате флаконы с активным средством показаны на фиг. 7А.

Состав при 90 мг/мл в 20-мл флаконе формировал приемлемый осадок при 4-дневном цикле, и данные датчика температуры подтверждали, что цикл может быть сокращен до 3 дней.
Содержание воды для плацебо и активного средства составляло 0,01% и 0,00%.
Разработка цикла лиофилизации - эксперимент малого масштаба №5 (плацебо и активное средство)
Эксперимент малого масштаба №5 выполняли для рассмотрения разработки соответствующего флакона плацебо для клинических испытаний, а также для рассмотрения временных периодов ресуспендирования для составов при потенциальном промышленном масштабе (270 мг/флакон). Оценивали 10 составов плацебо и 1 состав активного средства по внешнему виду и времени восстановления. Осадки активного средства представляли собой «элегантные», белые осадки с незначительной усадкой в результате трещины около поверхности стенки флакона. Осадки плацебо были белыми с большим количеством трещин в осадках, содержащих возрастающие количества трегалозы.
Флаконы восстанавливали с помощью 13,5 мл воды. Время растворения приведено в таблице 21. Лиофилизат активного средства немедленно ресуспендировали, но он был мутным в течение 17,6 секунды прежде, чем стать прозрачным, бесцветным раствором. Все плацебо представляли собой прозрачный, бесцветный раствор.
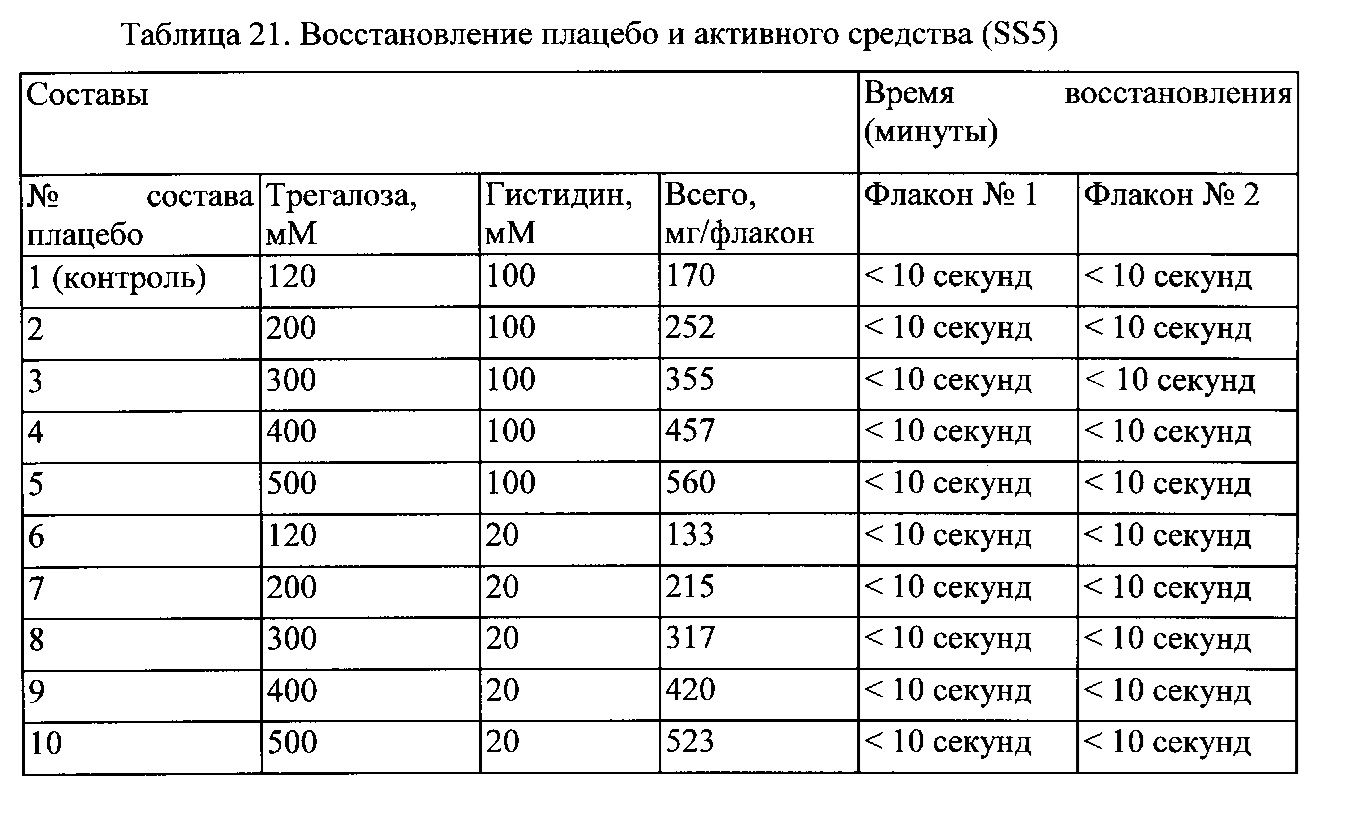

На основании стабильности, временных периодов ресуспендирования и временных периодов лиофилизации предпочтительным коммерческим составом для TAT-NR2B9c с предварительной лиофилизацией будет 20-100 мМ гистидин, 120 мМ трегалоза, pH 6,5. Концентрации трегалозы могут быть увеличены без потери стабильности или «элегантности» осадка, но не временных периодов ресуспендирования.
Проверка повышенного содержания трегалозы в образовании осадка и плацебо, соответствующего по внешнему виду и времени ресуспендирования
Для лучшего соответствия плацебо тестировали варьирующие концентрации трегалозы с TAT-NR2B9c и без такового, а также при объемах заполнения либо 3, либо 5 мл.
Во-первых, будут кратко описаны составы активного средства и составы плацебо. Затем будут отмечены основные визуальные соответствия для 3-мл заполнения и 5-мл заполнения. На данный момент анализируются аналитические образцы (раствор для заполнения и один эффективный образец). В таблицах 22 и 23 показана подгруппа тестируемых составов.

На фиг. 7В показан внешний вид составов активного средства, приведенных выше.


В таблице 24 показаны условия цикла лиофилизации для приведенных выше образцов.


н.т. = не тестировали.
Пример 7. Стабильность лиофилизированного TAT-NR2B9c, 270 мг, в буфере с 20 мМ гистидином, рН 6,5, и 120 мМ трегалозой
Получение лиофилизированного лекарственного продукта
Составляли небольшую партию лекарственного продукта TAT-NR2B9c при 90 мг/мл в 20 мМ гистидине, рН 6,5, и 120 мМ трегалозе и лиофилизировали для оценивания стабильности в твердом состоянии после 4 недель при -20°С, 40°С и 60°С.
В таблице 25 показаны условия лиофилизации.

Образцы хранили в термостатах при постоянной температуре и оценивали чистоту, эффективность и время восстановления в 13,2 мл (для конечного объема 13,5) после 0, 1, 2 и 4 недель. Данные для каждой температуры хранения и времени представлены в таблицах 26А-С.

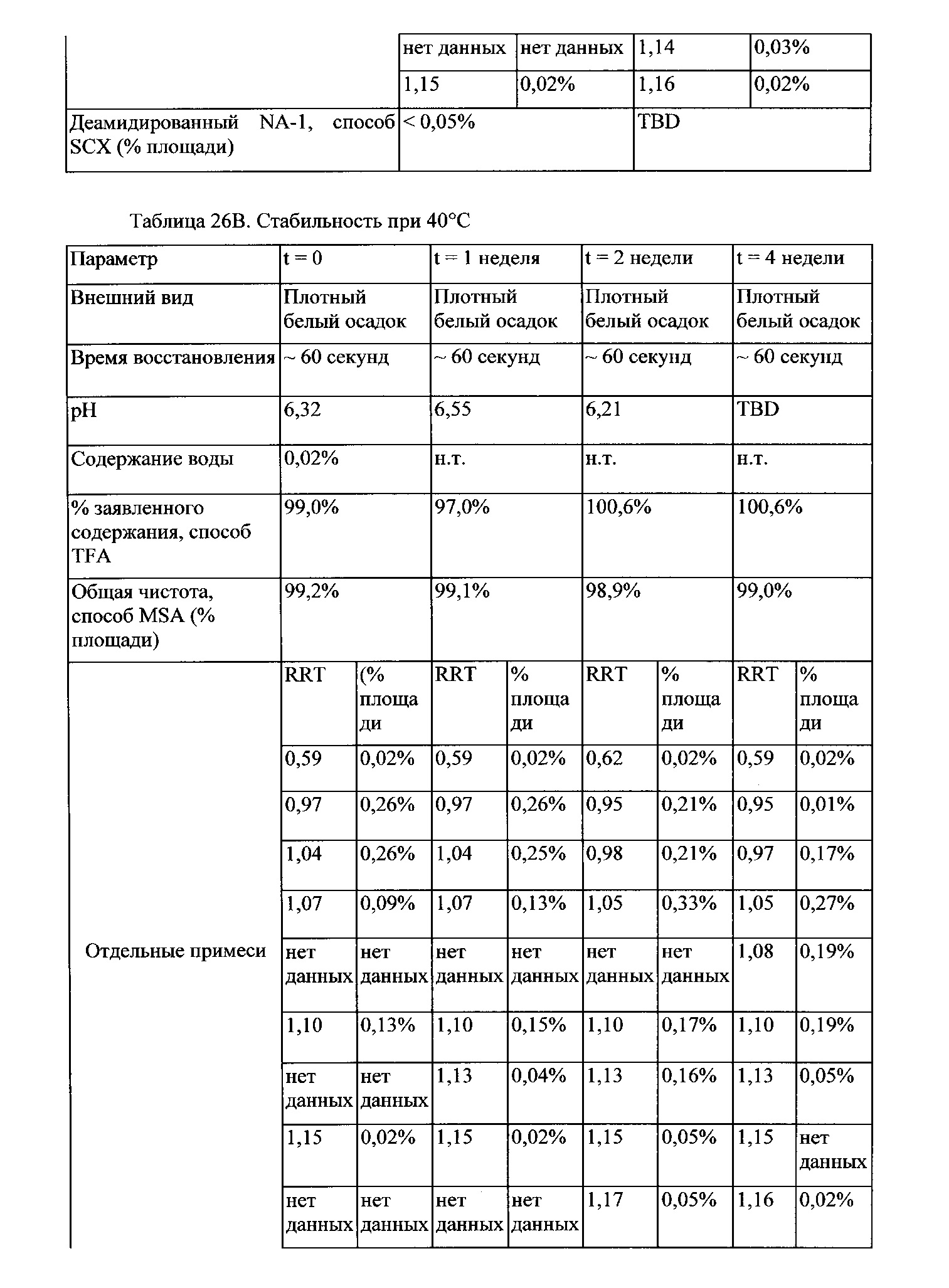


Данный состав TAT-NR2B9c является стабильным при -20°С. Для температур хранения 40°С и 60°С содержание потенциальных примесей с относительным временем удерживания (RRT) 1,07, 1,1 и 1,29 медленно повышалось с использованием анализа HPLC MSA, при этом наибольший рост наблюдали при RRT 1,07. Для температуры хранения 40°С содержание примеси повышалось от 0,09% до 0,27% за 1 месяц, а для температуры хранения 60°С содержание примеси повышалось от 0,09% до 0,59%. Примесь не наблюдали при -20°С. Примеси, интерполируемые с использованием уравнения Аррениуса, составляли менее 0,5% через 16 месяцев при 25°С или через 123 месяца при 5°С и менее 2% через > 60 месяцев при комнатной температуре и через много лет при 5°С. Таким образом, данный состав и родственные составы приемлемы для хранения лиофилизированного лекарственного продукта при комнатной температуре.
Данное исследование расщепление проводили еще один месяц для подтверждения того, что продукты расщепления, наблюдаемые при 60°С, также наблюдаются и при 40°С. Полагали, что эти три примеси появляются при более низкой температуре, указывая на то, что, вероятно, они являются продуктами расщепления, которые не специфичны для сильно повышенных температур. Идентичности этих компонентов определяли с помощью LC/MS/MS исследований и обнаружили, что все они содержат продукты ацетилирования соединения TAT-NR2B9c полной длины. Такие явления ацетилирования происходили как на N-конце пептида, так и на лизиновых боковых цепях. Таким образом, стабильность TAT-NR2B9c может быть увеличена за счет добавления либо скавенджера, либо других вспомогательных средств для снижения ацетилирования TAT-NR2B9c в лиофилизированном состоянии или за счет снижения или удаления ацетата таким образом, чтобы снижалась вероятность ацетилирования.
Общие выводы
На основании стабильности, временных периодов ресуспендирования и временных периодов лиофилизации предпочтительным коммерческим составом для TAT-NR2B9c является 20-100 мМ гистидин, 120 мМ трегалоза, рН 6,5. Концентрации трегалозы могут быть повышены без потери стабильности или «элегантности» осадка, но временные периоды ресуспендирования увеличиваются при повышении концентрации трегалозы.
Пример 8. Разработка и стабильность хлоридной соли TAT-NR2B9c (ТАТ-NR2B9C-Cl)
Получение лиофилизированного лекарственного продукта
В связи с нестабильностью ранее разработанных составов солевых растворов TAT-NR2B9c и наблюдением того, что в лиофилизированных составах может происходить ацетилирование ацетатной соли TAT-NR2B9c, ацетатную соль меняли на хлоридную соль. Это выполняли с помощью препаративной RP-HPLC с использованием аммония хлорида. Цель данного способа заключается в идентификации новой композиции заявляемого объекта и нового состава, которые обеспечат улучшенную стабильность для TAT-NR2B9c, предпочтительно улучшенную стабильность, как при комнатной температуре, так и при 37°С. Поскольку TAT-NR2B9c является эффективным при введении потенциальным жертвам инсульта и других неврологических расстройств, и особенно важное значение имеет раннее лечение этих расстройств, состав, являющийся стабильным вне больничных условий, помог бы миллионам людей, страдающих этими расстройствами ежегодно. Например, такое лекарственное средство можно было бы хранить в машинах скорой помощи или небольших клиниках, кабинетах врачей или даже доступными для отдельных лиц, и предоставлять субъектам, страдающим неврологическими расстройствами, такими как инсульт, или другими заболеваниями, подлежащими лечению нейропротекторными средствами, намного раньше, чем они могли бы быть введены при необходимости поездки в больницу для лечения.
Общий протокол процесса

1) Колонку промывали 2 объемами слоя (BV) 80% СН3ОН.
2) Пропускали 2 BV 0,025% HCl в воде или 0,1% TFA в воде, что было предпочтительным.
3) Загруженный образец: 30 г ацетата TAT-NR2B9c (PPL-NA11301) растворяли в 1,5 л воды согласно USP (20 г/л) при условиях связывания TAT-NR2B9c с колонкой.
4) Ополаскивали 200 мл воды согласно USP (также загруженной в колонку) с удаление имеющегося ацетатного противоиона.
5) Пропускали 3 BV 0,1 М аммония хлорида (NH4Cl) для подачи нового хлоридного противоиона.
6) Пропускали 2 BV 2%.
7) Пропускали 20% В (ацетонитрила) для элюирования продукта.
8) Собирали фракции при элюировании пика продукта.
9) Фракции анализировали с помощью аналитической HPLC.
10) Колонку опять промывали с помощью 3 BV 80% СН3ОН.
Аналитическая система HPLC
YMC ODS-A С18 колонка, 5 мкм, 120

Результаты синтеза и обсуждения
Два основных пула, собранных при циклах, смешивали и лиофилизировали (~ 5 л). Собирали 23,4 г конечного продукта с чистотой 99,01%. Остаточный ацетат составлял менее 1%. Стандартные уточнения протокола должны увеличивать выход от 78% до > 95%. Данная процедура подобным образом может быть использована для обмена TFA соли TAT-NR2B9c на хлоридную соль, поскольку TFA соль будет связываться с колонкой на стадии 3 аналогичным образом.
Составление лиофилизированной формы TAT-NR2B9c-

TAT-NR2B9c-Cl составляли в 20 мМ гистидине и 120 мМ трегалозе, рН 6,5, для прямого сравнения с предыдущим предпочтительным лиофилизированным составом при тех же условиях лиофилизации при 270 мг/флакон (масса активного средства). Также сравнивали стабильность данного состава с предварительно раскрываемым составом TAT-NR2B9c-Ac, ресуспендированным в солевом растворе и лиофилизированным. Для последнего составляли небольшую партию лекарственного продукта ТАТ-NR2B9c-ацетат при 90 мг/мл в солевом растворе (без других вспомогательных средств) и лиофилизировали при 270 мг/флакон. Стабильность составов в лиофилизированном состоянии оценивали после 4 недель при -20°С (контроль), 40°С и 60°С.


В таблице 27 показана относительная площадь каждого пика, наблюдаемого в каждом HPLC анализе при каждой температуре после 1 месяца хранения и при каждом относительном времени удерживания (идентичность пиков) для прямого сравнения.
Для обоих составов и способов исходная чистота была очень похожа (98% для ТАТ-NR2B9c-Cl по сравнению с 97,93% для TAT-NR2B9c-Ac с помощью способа TFA и 99,3% по сравнению с 99,13% для способа с применением метансульфоновой кислоты (MSA)). Из данных при 60°С видно, что композиция Tat-NR2B9c-Cl, гистидина и трегалозы, по сути, более стабильна, чем состав солевого раствора Tat-NR2B9c, при обоих способах. Для способа TFA после 1 месяца хранения при 60°С соль Tat-NR2B9c-Сl сохраняет 98,6% основного пика, тогда как состав солевого раствора Tat-NR2B9c-Ac сохраняет только 96,8% исходного материала. При способе MSA разница еще более четко выражена, при этом соль Tat-NR2B9c-Cl сохраняет 99,4% своего исходного материала, тогда как состав солевого раствора Tat-NR2B9c-Ac сохраняет только 97,2% своего исходного материала.
В таблице 28 показана относительная площадь каждого пика, наблюдаемого в каждом HPLC анализе в одинаковых образцах после 11 месяцев при различных температурах хранения. Эти данные подтверждают улучшенную стабильность состава соли NA-1-Cl по сравнению с составом NA-1-Ас в хлориде. При сравнении площади основных пиков NA-1 в TFA анализе при 40°С, который проводили в условиях ускоренных испытаний по указаниям ICH для подтверждения хранения лиофилизированного лекарственного средства при комнатной температуре, NA-1-Cl сохраняет 98,14% чистоты от исходной чистоты 98,58%, тогда как чистота NA-1-Ас в солевом растворе падает от 98,57% чистоты до 96,48%, что ниже спецификации по чистоте 97%, и состав не будет считаться стабильным через приблизительно год. Ту же тенденцию наблюдали при анализе MSA от 99,3% чистоты до 98,71% чистоты для NA-1-Cl и 97,08% для NA-1-Ас в солевом растворе. При изучении результатов чистоты при 60°С после 11 месяцев (таблица 28) различия были существенно более глубокими, при этом NA-1-Cl является значительно более стабильным, чем NA-1-Ас.
С клинической точки зрения, рекомендуемые пределы чистоты лекарственного средства для людей могут составлять 97% чистоты без неохарактеризованной примеси, превышающей 0,5%, при условиях ускоренных испытаний хранения. С использованием уравнения Аррениуса можно применить данные стабильности при 40°С и 60°С для прогнозирования падения основного пика чистоты или роста наблюдаемых примесей при различных температурах хранения (например, при 25°С или 37°С, по сравнению с наблюдаемыми данными при 40°С или 60°С). Если предположить, что лекарственное средство будет храниться при окружающей температуре, было бы полезно продемонстрировать стабильность при 37°С, поскольку при многих окружающих условиях без холодильника окружающая температура летом может находиться в данном диапазоне. Учитывая требование чистоты 97,0% при 37°С и используя типичные данные стабильности из анализа TFA для основного пика чистота, поскольку он является наиболее чувствительным (т.е. показывает самое большое снижение чистоты при 40°С и 60°С), прогнозируют срок годности состава солевого раствора 29,8 месяца (или чуть более 2 лет), тогда как для состава Tat-NR2B9c-Cl прогнозируют срок годности ~ 500 месяцев или приблизительно 41 год. Это представляет собой существенное улучшение стабильности.
С точки зрения роста наибольшей примеси (за исключением примеси при относительном времени удерживания (RTT) 1,02 по способу TFA, которая является идентифицированной примесью), рост наибольшей примеси через 1 месяц для состава Tat-NR2B9c-Cl составляет 0,17-0,43 (RRT 0,99 по способу TFA), тогда как рост наибольшей примеси для состава солевого раствора Tat-NR2B9c-Ac составляет 0,05-0,72 (1,13 RRT по способу TFA). Учитывая предел примесей выше 0,5% при 37°С и используя уравнение Аррениуса вместе с данными при 40°С и 60°С по каждой из этих примесей, прогнозируют срок годности состава солевого раствора ~ 4,8 месяца при 37°С, тогда как для композиции Tat-NR2B9c-Cl прогнозируют срок годности >10 лет. Таким образом, с точки зрения либо общего уровня TAT-NR2B9c, либо роста наибольшей примеси композиция Tat-NR2B9c-Cl представляет значительное улучшение по сравнению с составом солевого раствора.
Пример 9. TAT-NR2B9c-Cl является более стабильным, чем TAT-NR2B9c-Ас, в составах гистидина, трегалозы
Как TAT-NR2B9c-Cl, так и TAT-NR2B9c-Ac составляли при 90 мг/мл в 20 мМ гистидине, 120 мМ трегалозе, рН 6,5. Трех-миллилитровые аликвоты (270 мг) каждого лиофилизировали по той же программе, что представлена выше, и по окончании помещали в инкубаторы с постоянной температурой и влажностью при -20°С (контроль), 40°С и 60°С. Через 4 недели тестировали стабильность каждого состава с использованием двух независимых друг от друга HPLC способов - один с TFA в качестве носителя, а другой с MSA в качестве носителя.
В таблице 29 показана относительная площадь каждого пика, наблюдаемого в каждом из двух HPLC анализов при каждой температуре после 1 месяца хранения и при каждом относительном времени удерживания (RRT; идентичность пиков), для прямого сравнения. На левой панели представлен состав Tat-NR2B9c-Ac, а на правой панели показаны результаты состава соли Tat-NR2B9c-Cl. Пик при RRT 1 соответствует интактному пептиду TAT-NR2B9c в каждом анализе и в каждой колонке. Для обоих составов и способов исходные показатели чистоты очень подобны (98% для ТАТ-NR2B9c-Cl по сравнению с 98,3% для TAT-NR2B9c-Ac по способу TFA, и 99,3% по сравнению с 99,2%, соответственно, по способу MSA). Из данных при 60°С видно, что композиция Tat-NR2B9c-Cl существенно более стабильна, чем состав Tat-NR2B9c-Ac, при обоих способах. При способе TFA после 1 месяца хранения при 60°С соль Tat-NR2B9c-Cl сохраняет 98,6% основного пика (96,64%, разделенного на 98% исходной), тогда как состав солевого раствора Tat-NR2B9c-Ac сохраняет только 96% исходного материала (94,44%, разделенного на 98,3% исходной чистоты). По способу MSA различие еще более заметное, при этом соль Tat-NR2B9c-Cl сохраняет 99,4% исходного материала (98,68%/99,3%), тогда как состав солевого раствора Tat-NR2B9c-Ac сохраняет только 95,6% своего исходного материала (94,81%/99,2%). При рассматривании наибольших примесей для каждой композиции становится понятно, что для условий ускоренных испытаний стабильности как при 40°С, так и при 60°С соль TAT-NR2B9c-ацетат имеет больше примесей и, таким образом, является менее стабильной. Удивительно, что хлоридная соль TAT-NR2B9c более стабильна, чем ацетатная соль при аналогичных условиях.
В таблице 30 показана относительная площадь каждого пика, наблюдаемого в каждом HPLC анализе в одних и тех же образцах после 11 месяцев при различных температурах хранения. Эти данные подтверждают улучшенную стабильность состава соли NA-1-Cl по сравнению с солью NA-1-Ас при составлении в таком же буфере (20 мМ гистидин/120 мМ трегалоза, рН 6,5). При сравнении площади основных пиков NA-1 в TFA анализе при 40°С, который проводили в условиях ускоренных испытаний по указаниям ICH для подтверждения хранения лиофилизированного лекарственного средства, NA-1-Cl сохраняет 98,14% чистоты от исходной чистоты 98,58%, тогда как чистота NA-1-Ас в солевом растворе падает от 98,57% до 95,91%, что ниже спецификации по чистоте 97%, и состав не может считаться стабильным. Ту же тенденцию наблюдали при анализе MSA: от 99,3% чистоты до 98,71% чистоты для NA-1-Cl и 96,85% для NA-1-Ас в солевом растворе. При изучении результатов чистоты при 60°С после 11 месяцев (таблица 30) различия были существенно более глубокими, при этом NA-1-Cl является значительно более стабильным, чем NA-1-Ас (~ 95% чистота для обоих анализов для хлоридной соли по сравнению с ~ 83% чистотой для ацетатной соли). Таким образом, хлоридная соль NA-1 является, как было предсказано, неожиданно и существенно более стабильной, чем ацетатная соль в том же буфере.
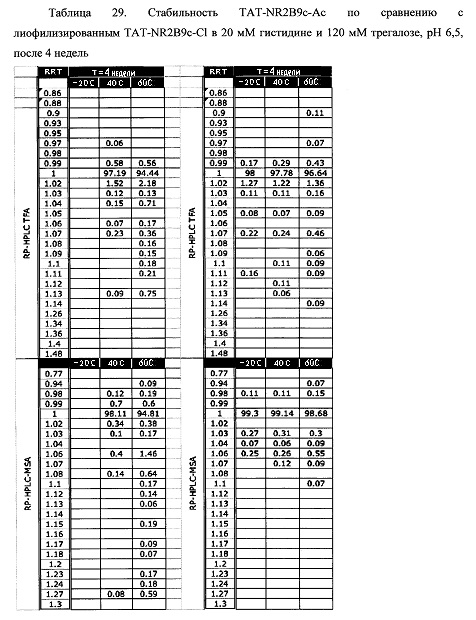

Реферат
Изобретение относится к лиофилизированным составам активных средств, в частности, TAT-NR2B9c, в виде хлоридной соли, в которой более 99% анионов в соли представляют собой хлорид. Хлоридная соль TAT-NR2B9c демонстрирует улучшенную стабильность по сравнению с формой ацетатной соли ранее известных составов. Составы хлоридной соли ТАТ-NR2B9c являются стабильными при окружающей температуре, что, таким образом, облегчает обеспечение поставок такого состава в машинах скорой помощи для введения на месте заболевания или несчастного случая или при перевозке в больницу. TAT-NR2B9c продемонстрировал потенциал для лечения инсульта, аневризмы, субарахноидального кровоизлияния и других неврологических или нейротравматических состояний. 5 н. и 11 з.п. ф-лы, 7 ил., 30 таб., 9 пр.
Формула
Документы, цитированные в отчёте о поиске
Пептиды nd2 и способы лечения неврологического заболевания

Комментарии