Препараты антител - RU2749732C2
Код документа: RU2749732C2
Чертежи


Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к препарату антитела (иммуноглобулина), содержащему IgM, обладающему специфической активностью активации комплемента, но низкой способностью к неспецифической активации комплемента. Настоящее изобретение также относится к применению препарата антитела в медицине.
Предпосылки создания изобретения
Композиции иммуноглобулинов, полученные из плазмы человека и пригодные для внутривенного введения, известны в данной области и в течение нескольких десятилетий играют важную роль в лечении широкого ряда заболеваний. Иммуноглобулины применяют, например, при лечении инфекций у человека, и их можно отнести к различным классам с различными биохимическими и физиологическими свойствами. Иммуноглобулин G участвует в защите против вирусных антигенов, в то время как IgM является преимущественно активным в иммунных ответах против бактерий и токсинов.
Растворы иммуноглобулинов содержат IgG, IgA и IgM в разных процентных соотношениях, где различные препараты имеют различные применения в лечении, например, препараты с более высоким процентным содержанием IgM применяют для профилактики или лечения бактериальных инфекций.
Растворы иммуноглобулинов обычно получают из фракций плазмы или сыворотки крови, например, фракций Коэна. Затем эти фракции подвергают ряду стадий очистки для удаления загрязнений, таких как вирусы, денатурированные белки, протеазы и липиды.
Плазму человека для фракционирования собирают от тысяч доноров, и она может содержать патогенные вирусы, несмотря на тестирование источника плазмы. Таким образом, стадии способа инактивации или удаления вирусов являются необходимыми для получения безопасных продуктов для применения в медицине. В данной области известно несколько способов инактивации/удаления вирусов, например, химическая обработка, облучение УФС-светом или фильтрация через нанометровые фильтры, которые осуществляют для обеспечения полной вирусной безопасности.
Способность стадий способа удалять или инактивировать вирус подтверждают с использованием моделей способа получения в лабораторном масштабе, и для каждой стадии определяют степень удаления или инактивации. Увеличение степени инактивации/удаления добавляет фармацевтическому продукту дополнительную вирусную безопасность. Современные руководства регулирующих органов требуют, по меньшей мере, двух эффективных стадий для оболочечных и безоболочечных вирусов в производстве происходящих из плазмы лекарственных средств. Хотя несколько способов, таких как обработка растворителем/детергентом, обработка октановой кислотой, фильтрация через нанометровые фильтры и термическая обработка, являются эффективными для инактивации или удаления оболочечных вирусов, известно только немного способов для инактивации или удаления безоболочечных вирусов, например, парвовирусов. Эти безоболочечные вирусы по большей части являются очень мелкими, обычно проходя через нанометровые фильтры с размерами пор более 20 нм. Этот размер пор является слишком небольшим для молекул IgM, имеющих диаметр вплоть до 30 нм. Безоболочечные вирусы эффективно инактивируют химическими веществами, подобными β-пропиолактону, которые, однако, также приводят к модифицированному иммуноглобулину с нарушенными функциями. Другой эффективной обработкой является облучение УФС (EP 1842561, CAF-DCF). Однако известные обработки растворителем/детергентом, обработка октановой кислотой и слабая термическая обработка не оказывают существенного эффекта на безоболочечные вирусы.
Как указано выше, в дополнение к вирусам, которые потенциально присутствуют, также необходимым является удаление других загрязнений, подобных липидам, протеазам, агрегатам белка и денатурированным иммуноглобулинам. Удаление всех этих загрязнений является необходимым (1) чтобы обеспечить соответствие продукта инструкциям по биологической безопасности, относящимся к загрязнению вирусами, (2) чтобы продукт являлся переносимым пациентом после внутривенного введения, (3) чтобы дать возможность продукту оставаться стабильным во время долгосрочного хранения (любая остаточная протеолитическая активность может приводить к деградации продукта после долгосрочного хранения, например, 2 года), и (4) чтобы получить желаемую смесь соединений/фармацевтическую композицию.
В то же самое время, однако, является необходимым, чтобы стадии очистки для удаления загрязнений не затрагивали молекулы иммуноглобулинов, чтобы они, настолько, насколько возможно, сохраняли свою нормальную биологическую активность и сохранялись в растворе с высоким выходом. Этого равновесия трудно достичь, поскольку многие известные стадии очистки могут также оказывать негативное влияние на активность иммуноглобулинов, и в частности, на IgM; например, увеличенное время облучения УФС может снижать выход нативного и активного IgM, полученного в конечном растворе иммуноглобулина. Это не только приводит к снижению эффективности конечного раствора иммуноглобулина, но может также вызывать менее хорошую переносимость раствора in vivo.
Агрегаты и денатурированные иммуноглобулины, количество которых может увеличиваться из-за конкретных стадий очистки, особенно представляют потенциальный риск для пациентов, поскольку они обладают высокой способностью неспецифически активировать комплемент, приводя к тяжелым побочным эффектам у пациентов, которым вводят эти денатурированные иммуноглобулины. Неспецифическая активация комплемента относится к инициации каскада реакций комплемента в отсутствие специфических комплексов антитело-антиген. Неспецифической активации комплемента строго необходимо избегать, поскольку она может вызывать нежелательные побочные эффекты, такие как гипотензия, покраснение, головная боль, лихорадка, озноб, тошнота, рвота, мышечная боль, диспноэ и тахикардия. Специфическая активация комплемента, с другой стороны, является желательной и возникает только после связывания иммуноглобулинов с их специфическими антигенами.
Неспецифическую активацию комплемента измеряют как так называемую антикомплементарную активность (ACA) посредством стандартизированного теста, описанного в Европейской фармакопее.
Роль системы комплемента в иммунной защите от патогенов хорошо известна. Система комплемента состоит приблизительно из 20 белков, которые активируются последовательно. Для активации классического пути активации комплемента, как правило, необходим специфический комплекс антиген-антитело, в то время как альтернативный путь может быть активирован антигенами без присутствия антител. Как в классическом, так и в альтернативном пути активации комплемента образуется протеаза C3-конвертаза. C3-конвертаза расщепляет и активирует компонент C3, образуя C3a и C3b, и вызывая каскад дальнейших событий расщепления и активации до расщепления C5 конвертазы на C5a и C5b. C5b инициирует атакующий мембрану путь, что приводит в результате к атакующему мембрану комплексу, состоящему из C5b, C6, C7, C8 и полимерного C9. Это представляет собой цитолитический конечный продукт каскада комплемента, который формирует трансмембраный канал, вызывающий осмотический лизис клеток-мишеней, таких как бактерии.
Активация комплемента, кроме того, приводит к образованию анафилатоксинов, включая биологически активный белок C5a. Этот анафилатоксин является сильным хемотаксическим средством для иммунных и воспалительных клеток, индуцирует активацию клеток и вызывает высвобождение гистамина из тучных клеток. В ситуациях избыточной или неконтролируемой, и/или неспецифической активации комплемента сверхпродукция C5a может вызывать неблагоприятные эффекты у пациентов.
C5a представляет собой эффективный хемоаттрактант лейкоцитов, вызывая накопление лейкоцитов, особенно нейтрофильных гранулоцитов, в участках активации комплемента. C5a активирует лейкоциты и является сильным медиатором воспаления. В то время как эти функции являются преимущественными во время специфических реакций комплекса антитело-антиген, любого неспецифического образования C5a необходимо избегать из-за потенциальных побочных эффектов.
Неспецифическая активация комплемента является особенной проблемой для препаратов иммуноглобулинов IgM (т.е. препаратов, содержащих, по меньшей мере, 5% IgM), поскольку, в отличие от препаратов IgG, антитела IgM легко агрегируют в растворе. Препараты IgM трудно стабилизировать, особенно если они обогащены по сравнению с концентрациями в плазме и сохраняются в жидком растворе. Также известно, что IgM является сильным активатором комплемента; одна молекула, связанная с антигеном, может активировать комплемент. Это отличается от IgG, где две или более молекул IgG должны быть связаны с антигеном в тесной связи друг с другом для активации комплемента.
Кроме того, основными показаниями для лечения посредством содержащих IgM препаратов иммуноглобулинов являются бактериальные инфекции и сепсис. Поскольку эти пациенты уже страдают гипотензией, дополнительное нежелательное получение неспецифической активации комплемента и C5a может приводить к клиническому ухудшению состояния пациента. Соответственно, описано, что препараты IgM сложно получать для внутривенного введения.
Существует несколько способов, описанных в данной области, для получения содержащих IgM препаратов иммуноглобулинов из плазмы человека.
Начальную очистку растворов IgM человека проводят классическими способами фракционирования плазмы Коэна или их хорошо известными модификациями (например, Коэна/Онкли, Кистлера/Нитшманна). С использованием способа осаждения холодным этанолом фракцию IgM выделяют во фракции III или фракции I/III (также называемых B или B+I). Описаны способы очистки растворов белка, обогащенных IgM, начиная с фракции III или I/III. В EP0013901 описан способ очистки, начиная с фракции III, включающий стадии с использованием обработки октановой кислотой, β-пропиолактоном и стадию адсорбции с использованием анионообменной смолы. Этот способ используют для получения Pentaglobin® (пентаглобина®) - до настоящего времени единственного коммерчески доступного внутривенного продукта IgM. β-пропиолактон является хорошо известным химическим веществом, используемым на стадиях стерилизации для инактивации потенциально присутствующих вирусов. Поскольку β-пропиолактон является очень реакционноспособным веществом, вызывающим химическую модификацию белков, существует также существенная потеря противовирусной и антибактериальной активности иммуноглобулинов. С другой стороны, эта химическая модификация приводит к уменьшенной антикомплементарной активности по сравнению с активностью химически немодифицированного иммуноглобулина. В EP0352500 описано получение концентрата IgM для внутривенного введения с уменьшенной антикомплементарной активностью при использовании анионообменной хроматографии, β-пропиолактона, облучения УФС-светом и стадии инкубации при повышенной температуре (40°C-60°C). Препарат, полученный этим способом, являлся стабильным в жидком растворе в течение ограниченного времени из-за химической модификации. Концентрация IgM составляла более 50% общего содержания иммуноглобулинов.
Получение растворов белка, обогащенных IgM без химической модификации β-пропиолактоном, описано в EP0413187 (Biotest) и EP0413188 (Biotest). Эти способы включают подвергание подходящего раствора белка обработке октановой кислотой и анионообменной хроматографии, начиная с фракции Коэна III или II/III. В патенте EP0413187 (Biotest) обработку октановой кислотой проводят путем перемешивания в течение 15 мин для удаления липидов, присутствующих во фракции Коэна III.
Препарат согласно EP0413187 обладал низкой антикомплементарной активностью, от 0,6 до 0,8 CH50/мг белка, но нуждался в стабилизации и инактивации вируса посредством β-пропиолактона. Считается, что низкая антикомплементарная активность составляет ≤1 CH50/мг белка согласно монографии EP для иммуноглобулинов.
В EP0413188B1 (Biotest) описано получение обогащенного IgM препарата для внутривенного введения с использованием анионообменной хроматографии для снижения антикомплементарной активности. Кроме того, описана термическая обработка при pH 4-4,5 при 40-60°C, предпочтительно, от 50 до 54°C, для снижения антикомплементарной активности. Этот препарат необходимо было лиофилизировать для обеспечения стабильности препарата в течение нескольких месяцев. Не смогли показать долгосрочной стабильности в форме жидкого раствора.
В M.Wickerhauser et al. «Large Scale Preparation of Macroglobulin», Vox Sang 23, 119-125 (1972) показано, что препараты IgM, выделенные осаждением PEG, обладают высокой антикомплементарной активностью (ACA) в стандартной реакции связывания комплемента, и эту активность ACA уменьшали в 10 раз инкубацией препарата IgM при pH 4,0 при 37°C в течение 8 часов с последующим повторным доведением pH до нейтрального. Не показано, является ли это уменьшение в 10 раз достаточным для обеспечения переносимости при внутривенном введении. Авторы не оценивали потенциал специфической активации комплемента своего концентрата IgM и не оценивали безопасности на какой-либо модели на животных или человеке.
По другому способу описано применение мягкой термической обработки препаратов IgM при 40-62°C, предпочтительно, 45-55°C, при pH 4,0-5,0 (EP 0450412, Miles) для уменьшения неспецифической активации комплемента. В этой патентной заявке октановую кислоту добавляют к суспензии фракции Коэна III для удаления активатора прекалликреина и липопротеинов центрифугированием. Тем не менее, такая мягкая термическая обработка приводит к частичной потере антигенных детерминант IgM. Это может увеличивать риск образования неоантигенов, приводя к увеличенной иммуногенности для человека или потере активности.
Получение содержащего IgM раствора белка для внутривенного применения с использованием обработки протеазой (например, пепсином) после стадии осаждения октановой кислотой описано в EP0835880 (US 6136312, ZLB). Обработка протеазой приводит к частичной фрагментации молекулы иммуноглобулина, уменьшающей полную функциональную активность частей Fab и Fc. Таким образом, обработанные протеазой иммуноглобулины нельзя рассматривать как немодифицированные. Этот способ получения приводит также к приблизительно 5% фрагментов с молекулярной массой <100 кДа.
Описанные способы проведения обработки октановой кислотой (EP0413187 и EP0835880) обладают тем недостатком, что обработка октановой кислотой не является эффективной по отношению к удалению и инактивации безоболочечных вирусов, и не удаляет по существу всю протеолитическую активность. В EP 0345543 (Bayer, Miles) описан высококонцентрированный препарат IgM, по меньшей мере, с 33% IgM для терапевтического применения, где препарат является по существу свободным от титров изоагглютинина. В этой патентной заявке осаждение октановой кислотой проводят добавлением октановой кислоты, и изоагглютинины удаляют аффинной хроматографией на Synsorb. Конечный препарат необходимо лиофилизировать.
В целом, получение содержащего IgM препарата с низкой антикомплементарной активностью является возможным, если иммуноглобулины химически или ферментативно модифицируют и/или дополнительно очищают хроматографией и/или подвергают мягкой термической обработке. Однако эти способы обладают своими недостатками отсутствия удаления вируса/инактивации вируса (и, таким образом, вирусной безопасности), уменьшения количества молекул иммуноглобулинов в нативной форме и/или остаточной антикомплементарной активности. В связи с этим, еще существует необходимость предоставления улучшенных содержащих IgM препаратов иммуноглобулинов, пригодных для внутривенного введения человеку.
Краткое изложение сущности изобретения
В первом аспекте настоящее изобретение относится к препарату антител, пригодному для внутривенного введения человеку, содержащему IgG, IgA и, по меньшей мере, 5% антител IgM по массе от общего количества антител, где препарат получают из плазмы человека, причем препарат антитела обладает специфической активностью активации комплемента и где в анализе in vitro с сывороткой человека, пригодной для определения способности препарата антитела неспецифически активировать комплемент, препарат антитела по существу не образует C5a и/или по существу не образует C3a.
Авторы настоящего изобретения неожиданно обнаружили, что возможно получение препарата антитела IgM из сыворотки человека, который обладает специфической активностью активации комплемента и по существу не обладает неспецифической активностью комплемента. Этот продукт обладает преимуществами, поскольку он сохраняет эффективность продукта при уменьшении нежелательных побочных эффектов, таких как гипотензия, ассоциированных с неспецифической активацией комплемента после внутривенного введения.
Следующий аспект настоящего изобретения относится к способу получения препарата антитела по настоящему изобретению из плазмы человека, включающему стадии:
(a) получения из плазмы человека фракции плазмы в виде раствора, содержащего иммуноглобулины;
(b) смешивания C7-C9 карбоновой кислоты с раствором и обработки смешанного раствора вибросмесителем для осаждения загрязняющих белков;
(c) отделения осажденных белков от раствора для получения содержащей IgM композиции иммуноглобулинов;
(d) инкубации содержащей IgM композиции иммуноглобулинов от pH 3,5 до pH 4,5 для получения инкубированного раствора;
(e) облучения инкубированного раствора УФС для получения облученного УФС раствора; и
(f) фильтрации облученного УФС раствора в стерильных условиях для получения препарата антитела, пригодного для внутривенного введения человеку.
Авторы настоящего изобретения неожиданно обнаружили, что использование вибросмесителя на стадии, когда раствор иммуноглобулина смешивают с карбоновой кислотой, обладает необычайными преимуществами. Эта стадия способа обеспечивает более эффективное удаление нежелательных белков (включая протеазы) и образует промежуточный продукт, лучше подходящий для стадий дальнейшей переработки, используемых для получения иммуноглобулинового лекарственного средства; промежуточный продукт дает возможность более эффективных стадий дальнейшей переработки. Соответственно, стадии дальнейшей переработки могут быть менее жесткими, помогая получать препарат антитела по настоящему изобретению, способный к специфической активации комплемента и по существу неспособный к неспецифической активации комплемента.
В частности, содержащую иммуноглобулин IgM композицию, полученную на стадии (c), можно комбинировать с дополнительными стадиями обработки, такими как обработка в слабокислых условиях и обработка облучением УФС, для получения содержащего IgM иммуноглобулинового продукта или препарата антитела, который является пригодным для внутривенного введения и который обладает следующими преимущественными свойствами: обладает низкой антикомплементарной активностью; сохраняет высокий уровень нативного и активного IgM; и обладает вирусной безопасностью и, таким образом, пригоден для внутривенного введения человеку. Уровень вирусной безопасности, достигаемый способами, описанными в настоящем описании, ранее не могли быть получены. Дополнительными преимуществами является низкая протеолитическая активность (и, таким образом, стабильность в ходе долгосрочного хранения) и отсутствие химических модификаций.
Кроме того, настоящее изобретение относится к препарату антитела для применения в медицине. В одном варианте осуществления препарат антитела предназначен для применения в лечении иммунологических нарушений и бактериальных инфекций.
Следующий аспект настоящего изобретения относится к способу лечения, включающему введение препарата антитела по настоящему изобретению пациенту.
Настоящее изобретение в настоящее время описано более подробно только посредством примера, со ссылкой на сопутствующие фигуры.
На фиг.1 представлен обзор стадий, которые можно использовать для получения препарата антитела, пригодного для внутривенного введения, согласно настоящему изобретению. На стадии обработки октановой кислотой с использованием устройства вибросмесителя большое значение придается обработке pH4 и обработке УФС. Исходный материал получают общепринятым способом осаждения плазмы человека холодным этанолом.
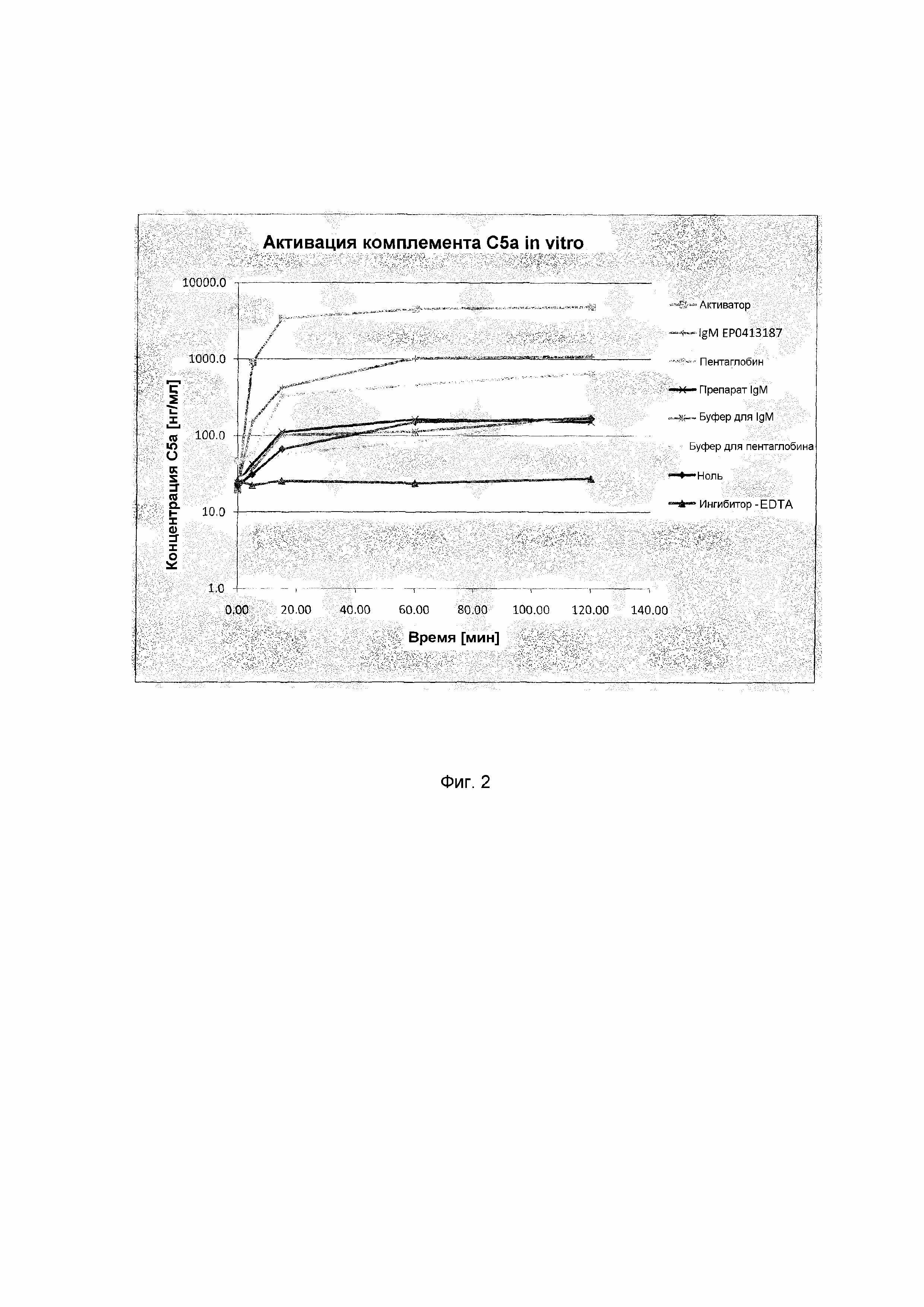
На фиг.2 представлен график, показывающий зависимые от времени средние концентрации C5a, обнаруженные в сыворотке человека после инкубации с препаратами IgM.
На фиг.3 представлен график, показывающий зависимые от времени средние концентрации C3a, обнаруженные в сыворотке человека после инкубации с препаратами IgM.
Подробное описание изобретения
Препарат антитела
Как описано выше, настоящее изобретение относится к препарату антитела, пригодному для внутривенного введения человеку, содержащему IgG, IgA и, по меньшей мере, 5% антител IgM по массе от общего количества антител, где препарат получен из плазмы человека, причем препарат антитела обладает специфической активностью активации комплемента, и где в анализе in vitro с сывороткой человека, пригодной для определения способности препарата антитела неспецифически активировать комплемент, препарат антитела по существу не образует C5a и/или по существу не образует C3a.
Препарат антитела по настоящему изобретению содержит белки плазмы человека, из которых, по меньшей мере, 90%, предпочтительно, по меньшей мере, 95% состоят из иммуноглобулинов (поликлональные антитела). В частности, препарат содержит иммуноглобулины IgG, IgA и IgM, где, по меньшей мере, 5% иммуноглобулинов представляют собой IgM. Количество иммуноглобулинов IgG, IgA и IgM можно определять посредством нефелометрии или посредством иммунопреципитации согласно Ph. Eur. 2.7.1.
Более предпочтительно, препарат антитела содержит, по меньшей мере, 10% IgM и наиболее предпочтительно, по меньшей мере, 15% IgM. Что касается IgG и IgA, предпочтительно, препарат антитела содержит более 5% IgA и/или более 40% IgG. Все проценты представляют собой процент от общего количества антител (например, г IgM/(г IgG+г IgA+г IgM)×100).
Способы определения того, что препарат антитела обладает специфической активностью активации комплемента (т.е. способностью активировать каскад реакций комплемента в присутствии антигена), посредством оценки функциональной активности Fc-фрагмента молекулы иммуноглобулина, известны в данной области. В частности, пригодный способ описан в способе Eur. Ph. согласно Европейскому руководству ICH S6 (CPMP/ICH/302/95) с использованием антигена краснухи. Дополнительные подробности относительно специфической активации комплемента представлены ниже в отношении биологической активности.
Препарат антитела по существу не вызывает неспецифической активации комплемента (т.е. активации каскада реакций комплемента иммуноглобулинами в отсутствие антигена) в анализах in vitro, пригодных для определения неспецифической активации комплемента в нормальной сыворотке человека (т.е. сыворотке от здоровых людей). В частности, анализ может определять количество C5a и/или C3a, образуемое в анализе в отсутствие антигена. Как указано выше, активация комплемента приводит к образованию C5a и C3a. Поскольку оба этих белка вовлечены в терминальный путь системы комплемента (больше чем в классический/лектиновый путь или альтернативный путь), они являются особенно пригодными для определения активации комплемента.
Препарат антитела по существу не образует C5a и/или по существу не образует C3a при использовании в подходящем анализе in vitro с сывороткой человека в отсутствие антигена. В предпочтительном варианте осуществления препарат антитела, доведенный до концентрации IgM 1,72 мг/мл, образует менее 200 нг/мл C5a после 60 минут анализа, и/или препарат антитела, доведенный до концентрации IgM 1,72 мг/мл, образует менее 6000 нг/мл C3a после 60 минут анализа.
Альтернативно или дополнительно, количество C5a и/или C3a, образуемое препаратом антитела в анализе, является таким же, как количество C5a и/или C3a, образуемое в таком же анализе отдельно сывороткой человека ±70%. Предпочтительно, это присутствует после 60 минут анализа.
Пригодные анализы известны в данной области. В предпочтительном варианте осуществления анализ включает стадии:
(a) добавления количества препарата антитела к 100 мкл сыворотки человека для получения реакционной смеси, содержащей 1,72 мг/мл IgM, и инкубации реакционной смеси в течение 60 минут при 37°C при постоянном перемешивании;
(b) получения набора разведений реакционной смеси, пригодного для ELISA;
(c) проведения сэндвич-ELISA для набора разведений реакционной смеси с использованием первичного и вторичного антитела против C5a или C3a и хромогенного вещества, где вторичное антитело конъюгировано с ферментом, и хромогенное вещество является субстратом фермента; и
(d) определения количества C5a или C3a в реакционной смеси на основании изменения окраски, полученного в результате контакта хромогенного вещества с ферментом, связанным с C5a или C3a через вторичное антитело.
В ELISA набор разведений приводят в контакт с лунками планшета для анализа, покрытыми первичным антителом. После инкубации лунки промывают для удаления разведенного образца, затем инкубируют с вторичным антителом и оно связывается со всеми C3a/C5a, связанными с первичным антителом в лунках, поскольку обладает эпитопом на C3a/C5a, другим, чем первичное антитело. После дополнительной промывки для удаления не связавшегося вторичного антитела проводят инкубацию с хромогеном, и он вступает в реакцию с ферментом, конъюгированным с вторичным антителом. Полученное изменение окраски можно измерить посредством определения с помощью фотометра оптической плотности, являющейся пропорциональной концентрации C5a/C3a, присутствующей в наборе разведений.
В частности, количество препарата антитела, добавленного на стадии (a), представляет собой количество, подходящее для создания концентрации 1,72 мг/мл IgM в реакционной смеси. Стадии (c) и (d) могут включать: (i) введение набора разведений реакционной смеси в лунки планшета для анализа, покрытые первичным антителом против C3a/C5a (т.е. «связывающим антителом»); (ii) инкубацию планшета, чтобы дать возможность связывания всего C3a/C5a с первичным антителом; (iii) промывку планшета для удаления любого материала в разведениях, не связанного с первичным антителом; (iv) введение вторичного антитела, связанного с ферментом (детектирующего антитела), которое также связывается с C3a/C5a; (v) инкубацию планшета, чтобы дать возможность всему вторичному антителу связаться с C3a/C5a; (vi) промывку планшета для удаления не связанного вторичного антитела; (vii) введение химического вещества, переводимого ферментом в цветовой сигнал; и (viii) измерение поглощения в лунках планшета для определения присутствия и количества C3a/C5a.
Сэндвич-ELISA проводят способами, известными в данной области, и/или с использованием коммерчески доступных наборов согласно инструкциям производителя. Пригодными и особенно предпочтительными коммерчески доступными наборами для твердофазного иммуноферментного анализа (ELISA) являются набор Quidel Micro Vue C5a Plus EIA; A025, и набор Quidel Micro Vue C3a Plus EIA; A032.
В следующем варианте осуществления настоящего изобретения препарат антитела содержит менее 2% агрегатов 1200 кДа или выше, предпочтительно, менее 1,5%. Это относится к % от содержания иммуноглобулинов. Количество агрегатов может быть определено высокоэффективной эксклюзионной хроматографией (HPSEC). Это можно осуществлять способами, известными в данной области.
Альтернативно или дополнительно, способность препарата антитела по существу не вызывать неспецифической активации комплемента может быть определена как антикомплементарная активность препарата, составляющая мене 1,0 CH50/мг белка, более предпочтительно, менее 0,75 CH50/мг белка. Анализ для определения антикомплементарной активности в этой шкале можно проводить способом, описанным в Европейской фармакопее (способ 2.6.17, Ph. Eur. 6. Edition, 2008). Дополнительные подробности этого анализа представлены в разделе анализы ниже.
В предпочтительном варианте осуществления препарат антитела получают из сыворотки человека в отсутствие стадии, включающей химическую или ферментативную модификацию антител, т.е. способ получения препарата антител из сыворотки человека не включает стадию контакта антител с реагентом, который может вызывать их ферментативную или химическую модификацию. В частности, способ не включает контакт антител с β-пропиолактоном, вызывающим химическую модификацию антител, или не включает контакт антител с пепcином, вызывающим ферментативное расщепление антител.
Альтернативно или дополнительно, препарат антитела получают из сыворотки человека в отсутствие стадии, включающей нагревание антител до температуры 40°C или более в течение 10 минут или более. В частности, известно, что стадии нагревания могут денатурировать иммуноглобулины и вызвать агрегацию иммуноглобулинов.
Более предпочтительно, препарат антитела получают способом, способным удалять более 3 log10, предпочтительно, более 4 log10, и наиболее предпочтительно, более 5 log10 безоболочечных вирусов, таким образом, придавая препарату антитела вирусную безопасность. Препарат антитела, таким образом, является более безопасным, чем препараты антител из предшествующего уровня техники, особенно в отношении активных безоболочечных вирусов, подобных, например, парвовирусам. Это приводит в результате к препарату антитела, который является по существу свободным от вирусов и, в частности, по существу свободным от безоболочечных вирусов. Кроме того, способом по настоящему изобретению можно достигать такого уровня удаления/инактивации вирусных частиц без существенного влияния на количество активного IgM или на антикомплементарную активность препарата антитела.
В частности, препарат антитела можно получать из плазмы человека способом, включающим стадии:
(a) получения из плазмы человека фракции плазмы в виде раствора, содержащего иммуноглобулины;
(b) смешивания C7-C9 карбоновой кислоты с раствором и обработки смешанного раствора вибросмесителем для осаждения загрязняющих белков;
(c) отделения осажденных белков от раствора для получения содержащей IgM композиции иммуноглобулинов;
(d) инкубации содержащей IgM композиции иммуноглобулинов от pH 3,5 до pH 4,5 для получения инкубированного раствора;
(e) облучения инкубированного раствора УФС для получения облученного УФС раствора; и
(f) фильтрации облученного УФС раствора в стерильных условиях для получения препарата антитела, пригодного для внутривенного введения человеку.
Является предпочтительным, чтобы способ дополнительно включал подвергание инкубированного раствора, полученного на стадии (d), нанофильтрации перед облучением на стадии (e). Дополнительные подробности и предпочтительные аспекты способа получения описаны в разделе ниже.
В следующем предпочтительном варианте осуществления изобретения препарат антитела можно вводить яванским макакам при 115 мг IgM/кг массы тела/час в отсутствие 10% или большего снижения артериального давления от уровня, предшествующего обработке. Как указано выше, неспецифическая активация комплемента вызывает гипотензию, и таким образом, отсутствие значительного изменения артериального давления указывает, что по существу не возникает неспецифической активации комплемента у здоровых обезьян in vivo. Артериальное давление можно измерять посредством вставки катетера для измерения давления в нижний отдел брюшной аорты через правую бедренную артерию.
В предпочтительном варианте осуществления препарат антитела также содержит антитела против одного или более из Pneumococcus saccharide, Escherichia coli, Enterococcus faecalis, Candida albicans и Chlamydia.
В следующем предпочтительном варианте осуществления, по меньшей мере, 90% антител в препарате антитела являются биологически активными. Термин биологически активный означает, что антитела в препарате находятся в нативной форме и, в частности, способны к активации каскада реакций комплемента в результате специфического связывания с антигеном. Биологическую активность препарата антитела можно оценивать на основании анализов для определения титра/активности связывания антитела и целостности/функции Fc, известных в данной области. В частности, в анализе in vitro на основе антигена краснухи, пригодном для определения функции Fc, активность Fc-фрагмента антител препарата антитела является такой же, как активность эталонного биологического препарата ±10%, более предпочтительно ±5%.
Эталонные биологические препараты используют в международном сообществе медицины и здравоохранения, и они помогают обеспечивать сопоставимость медицинских продуктов. В таком качестве пригодные биологические эталонные препараты для анализа известны и доступны в данной области (например, биологический эталонный препарат иммуноглобулина (партия No. 3). В частности, анализ можно проводить согласно общепринятому тесту Fc-функции иммуноглобулинов Eur. Ph. 2.7.9 (современное издание апреля 2011), в котором используют биологический эталонный препарат иммуноглобулина (партия No. 3) в качестве контроля, против которого определяют % активности препарата антитела. Этот тест включает стадии (i) нагрузки обработанных дубильной кислотой эритроцитов группы O человека вирусом краснухи для получения покрытых антигеном клеток крови; (ii) инкубации некоторого количества препарата антитела с клетками крови; добавления комплемента морской свинки для начала инициированного комплементом лизиса клеток крови; (iii) измерения кинетики гемолиза посредством зависимых от времени изменений поглощения при 541 нм; (iv) оценки функции антител из препарата антитела с использованием максимального изменения поглощения за единицу времени.
Препарат антитела предпочтительно также обладает более низкой протеолитической активностью, чем препараты антител, описанные в предшествующем уровне. В частности, протеолитическая активность не поддается детекции в препарате при его хранении в интервале 2-8°C. Протеолитическую активность можно измерять стандартизованными способами тестирования, известными в данной области, такими как способы с использованием хромогенного субстрата, описанные в разделе анализы ниже и в примере 6.
Препарат антитела по настоящему изобретению может дополнительно содержать стабилизатор, такой как глицин.
Как и в случае препаратов, известных в данной области, препарат антитела по настоящему изобретению можно хранить при 5±3°C. Однако благодаря эффективной очистке способом по настоящему изобретению, стабильность препарата антитела является необычайно хорошей. Конечный продукт является стабильным в жидкой форме в течение, по меньшей мере, 3 месяцев, предпочтительно, по меньшей мере, 6 месяцев и наиболее предпочтительно, по меньшей мере, двух лет при 2-8°C, что означает, что отсутствует фрагментация или полимеризация IgM более 1,5%, измеренных в HPSEC, увеличение протеолитической активности, уменьшение активности антитела IgM против Escherichia coli и активности антитела IgM против Pneumococcus saccharide более 25% и увеличение антикомплементарной активности более 25%, остающейся ниже 1 CH50/мг белка. Кроме того, конечный продукт, полученный способом по настоящему изобретению, является стабильным в жидкой форме в течение, по меньшей мере, 3 месяцев, предпочтительно, по меньшей мере, 6 месяцев, и наиболее предпочтительно, по меньшей мере, одного года при комнатной температуре (от 23 до 27°C), как оценено по таким же критериям.
Способ получения препарата антитела
Как описано выше, настоящее изобретение относится к получению содержащего IgM препарата антитела из фракции плазмы, содержащей иммуноглобулины. В частности, настоящее изобретение относится к способу получения препарата антитела, описанного в настоящем описании, из плазмы человека, включающему стадии:
(a) получения из плазмы человека фракции плазмы в виде раствора, содержащего иммуноглобулины;
(b) смешивания C7-C9 карбоновой кислоты с раствором и обработки смешанного раствора вибросмесителем для осаждения загрязняющих белков;
(c) отделения осажденных белков от раствора для получения содержащей IgM композиции иммуноглобулинов;
(d) инкубации содержащей IgM композиции иммуноглобулинов от pH 3,5 до pH 4,5 для получения инкубированного раствора;
(e) облучения инкубированного раствора УФС для получения облученного УФС раствора; и
(f) фильтрации облученного УФС раствора в стерильных условиях для получения препарата антитела, пригодного для внутривенного введения человеку.
Фракции плазмы, пригодные для получения фармацевтических композиций иммуноглобулинов, и способы их получения хорошо известны в данной области. Фракция плазмы предпочтительно представляет собой осажденную фракцию плазмы и наиболее предпочтительно, осажденную фракцию плазмы, полученную способом фракционирования по Коэну или его хорошо известных модификаций (например, Кистлера-Нитшманна). Наиболее предпочтительно, фракция представляет собой фракцию I/III или фракцию III (известные также как фракция B+I или фракция B) после фракционирования холодным этанолом. Является предпочтительным, чтобы иммуноглобулины фракции плазмы содержали, по меньшей мере, 5% IgM.
Стадия (a) включает предоставление фракции плазмы в виде раствора, содержащего иммуноглобулины. Во многих случаях фракция плазмы, содержащая иммуноглобулины, находится в твердой или полутвердой форме. Таким образом, задачей этой стадии является обеспечение перехода или перевод белка из фракции плазмы в раствор, так чтобы он находился в состоянии, подходящем для смешивания с карбоновой кислотой на стадии (b). Эта стадия может включать смешивание фракции плазмы с подходящим буфером. Предпочтительно, буфер имеет низкую молярность (т.е. менее 1M) и имеет pH от 4,5 до 5,5, например, 0,1M буфер ацетат натрия pH 5,05±0,1. Смешивание можно выполнять с использованием лопастной мешалки или вибросмесителя.
На стадии (b) раствор, образованный на стадии (a), смешивают с использованием вибросмесителя с C7-C9 карбоновой кислотой для осаждения загрязняющих белков (например, протеаз, вирусов и т.д.). Карбоновая кислота может быть разветвленной и/или может включать заместители, которые по существу не изменяют эффект стадии (b). Карбоновая кислота предпочтительно представляет собой октановую кислоту. Карбоновую кислоту предпочтительно добавляют в концентрации, по меньшей мере, 0,075 кг/кг фракции плазмы, вплоть до концентрации 0,2 кг/кг. Более предпочтительно, карбоновую кислоту добавляют при 0,8-0,15 кг/кг фракции плазмы и, наиболее предпочтительно, от 0,09 кг/кг до 0,13 кг/кг. Кислоту любой подходящей молярности можно использовать для обеспечения правильной концентрации.
Можно использовать любой тип коммерчески доступного вибросмесителя, пригодного для использования в химической/фармацевтической промышленности. Примеры пригодных вибросмесителей доступны от Graber+Pfenninger GmbH. В частности, вибросмеситель «Labormodell Typ 1» можно использовать для экспериментов в лабораторном масштабе, и «Industriemixer Typ 4» можно использовать для препаратов в промышленном масштабе. Вибросмесители можно использовать согласно инструкциям производителя и, в частности, в установках, описанных производителями как подходящие для перемешивания растворов, содержащих белки. Например, вибросмесители обычно можно эксплуатировать при менее 100 Гц с амплитудой менее 10 мм, например, авторы настоящего изобретения проводили вибросмешивание в лабораторном масштабе с использованием «Labormodell Typ 1» при 50 Гц, с применением источника электропитания 230 В. Амплитуду вибрации процесса смешивания меняли от 0 до 3 мм, и для препарата IgM предпочтительно использовали 3 мм. Смесители с диаметром от 23 мм до 65 мм использовали для экспериментов в лабораторном масштабе. Для промышленного масштаба использовали диаметр смесителя 395 мм (диаметры отверстий 13,5 мм и 16 мм).
На стадии (b) pH смешанного раствора предпочтительно составляет 4,5-5,5, и более предпочтительно, от pH 4,8 до pH 5,3. Стадию можно проводить в буфере ацетата натрия и, например, в буфере приблизительно 0,1M ацетата натрия. Температура, при которой проводят стадию (b), предпочтительно составляет от 10°C до 35°C, и более предпочтительно, 14-30°C.
Время смешивания с использованием вибросмесителя не является конкретно ограниченным, но оно предпочтительно составляет, по меньшей мере, 30 минут и не более 3 часов, и более предпочтительно, 40-110 минут. Периоды времени инкубации менее 30 минут могут снижать уровень инактивации вируса.
В одном варианте осуществления стадии (b) трифосфат кальция смешивают с раствором на стадии (b). Предпочтительно, его добавляют при 0,01-0,02 кг/кг фракции плазмы (как таковой в твердой или полутвердой форме). Трифосфат кальция можно добавлять одновременно, отдельно или последовательно с карбоновой кислотой. В предпочтительном варианте осуществления трифосфат кальция добавляют, по меньшей мере, через 20 минут после карбоновой кислоты.
На стадии (c) загрязняющие белки, осажденные на стадии (b), отделяют от раствора для получения содержащей IgM композиции иммуноглобулинов (т.е. содержащего иммуноглобулины раствора). Эта стадия разделения не является конкретно ограниченной, но ее можно проводить любым пригодным способом, известным в данной области. Однако стадию разделения предпочтительно проводят с использованием фильтрации и, более предпочтительно, ультрафильтрации, и результатом стадии (c), таким образом, является фильтрованный раствор.
Как описано выше, способ по настоящему изобретению является преимущественным в отношении производства, поскольку он, по-видимому, обеспечивает более эффективное осаждение загрязняющих белков, и, в результате, стадию (c) проще проводить. Когда разделяют смесь, полученную в результате стадии (b), достигают прозрачного очищенного раствора, т.е. содержащей IgM композиции иммуноглобулинов. Фильтрация, таким образом, является более быстрой и простой.
Дополнительные стадии способа (d)-(f) необходимы для перевода содержащей IgM композиции иммуноглобулинов, полученной на стадии (c), в препарат антитела, пригодный для внутривенного введения.
Стадия (d) включает обработку содержащей IgM композиции иммуноглобулинов, полученной на стадии (c), в слабокислых условиях, стадия (e) включает подвергание обработанной кислотой композиции облучению УФС для получения облученного УФС раствора, и стадия (f) включает фильтрацию облученного УФС раствора в стерильных условиях для получения препарата антитела, пригодного для внутривенного введения человеку.
Для обработки в слабокислых условиях содержащую IgM композицию иммуноглобулинов, полученную на стадии (c), инкубируют при pH от 3,5 до pH 4,5 и, предпочтительно, от pH 3,8 до pH 4,2, для получения инкубированного раствора. Слабокислые условия могут быть созданы добавлением пригодной кислоты к содержащей IgM композиции иммуноглобулинов, например, pH можно доводить добавлением 0,2M HCl.
Эту стадию инкубации предпочтительно проводят при температуре от 32 до 42°C и, более предпочтительно, от 35 до 39°C. Время инкубации составляет предпочтительно, по меньшей мере, 2 часа и не более 24 часов, и более предпочтительно, по меньшей мере, 9 часов, но не более 16 часов.
На стадии облучения инкубированный раствор, полученный после обработки слабой кислотой, описанной выше, обрабатывают УФС-светом для получения обработанного УФС раствора. Эту стадию можно проводить с использованием устройств, которые являются коммерчески доступными, таких как устройство UVivatec® (Bayer Technology Services). Является предпочтительным, чтобы инкубированный раствор обрабатывали при 254±10 нм от 200 до 500 Дж/м2, более конкретно, от 200 до 300 Дж/м2, для дополнительной инактивации вирусов и протеаз, которые потенциально присутствуют. Отмечено, что обработка УФС в мягких условиях, которая в норме является необходимой, является возможной только для осветленного прозрачного фильтрата, который получают по настоящему изобретению после обработки октановой кислотой при вибросмешивании. Более опалесцирующие или мутные растворы, в норме получаемые общепринятыми способами смешивания, могут нуждаться в более длительных периодах времени облучения, которые могут приводить к большей денатурации активного IgM и меньшим степеням инактивации вируса.
На стадии (f) облученный раствор фильтруют в стерильных условиях для получения препарата антитела, пригодного для внутривенного введения человеку. Предпочтительно, фильтрация представляет собой нанофильтрацию, более предпочтительно, через фильтр, имеющий размер пор 40-50 нм.
В дополнение к обработке слабой кислотой, облучению УФС и стадии фильтрации, дополнительные стадии получения препарата иммуноглобулина для внутривенного введения могут, необязательно, также включать одну или более дополнительных стадий фильтрации. В одном варианте осуществления раствор белка можно адсорбировать на DEAE-Sephadex и затем отделять от Sephadex глубинной фильтрацией. Например, его можно дополнительно подвергать периодической адсорбции с помощью 75 мг на кг белка DEAE Sephadex при pH 5,8 для удаления нежелательного сопутствующего белка церулоплазмина.
В особенно предпочтительном варианте осуществления инкубированный раствор, полученный после обработки слабой кислотой, подвергают адсорбции на DEAE-Sephadex и затем отделяют от Sephadex глубинной фильтрацией, перед обработкой облучением УФС.
В другом варианте осуществления обрабатываемый раствор иммуноглобулина можно фильтровать через нанометровый фильтр. Фильтры с размером пор 75±5 нм-35±5 нм или фильтры с номинальным размером пор 75-35 нм (например, Pall Ultipor DV50) можно использовать на различных стадиях в ходе процесса. (Номинальный размер пор, например, 50 нм обозначает степень удерживания ≥4 log10 для вируса размером 50 нм или более). В предпочтительном варианте осуществления раствор, полученный на стадии DEAE-Sephadex, описанной в разделе выше, фильтруют через фильтр 0,2 мкм перед облучением УФС.
Конечным препаратом антитела (т.е. обработанным содержащим IgM раствором иммуноглобулина), полученным способом, определенным выше, можно непосредственно заполнять контейнер в стерильных условиях. Альтернативно, препарат антитела можно получать в виде состава в содержащем глицин буфере при pH от 4 до 5,5 и, предпочтительно, от 4,1 до 4,5. Препарат антитела можно также разводить до концентрации белка от 40 до 80 г/л и предпочтительно, от 55 до 70 г/л. Отмечено, что возможно также обогащать содержание IgM препарата антитела хорошо известными способами, например, такими как анионообменная хроматография.
Как указано выше, способ, описанный выше, приводит к более высокой инактивации и удалению вирусных частиц, особенно очень устойчивых, безоболочечных вирусов, таких как парвовирусы, которые обычно не очень чувствительны к обработке октановой кислотой. Более того, достигают улучшенного удаления протеолитической активности по сравнению с общепринятым перемешиванием. Этих свойств достигают, сохраняя в то же время высокий уровень IgM, который является химически не модифицированным. Эти открытия противоречат общепринятой точке зрения, что обработка октановой кислотой не является эффективной стадией против безоболочечных вирусов, и улучшенной вирусной безопасности необходимо достигать посредством инактивации вируса более жесткими способами, такими как обработка β-пропиолактоном. Также было хорошо известно, что, например, повышение концентрации октановой кислоты для полного удаления протеолитической активности приводит к массовой потере IgM.
Результатов способа достигают использованием смешивающих устройств с применением режима вибрации в сочетании с обработкой октановой кислотой. Это является особенно неожиданным, поскольку известно, что IgM является очень чувствительным к напряжению сдвига, которое может приводить к нежелательной высокой антикомплементарной активности. Соответственно, невозможно было предусмотреть использование вибросмесителя для получения композиции IgM и невозможно было ожидать настолько благоприятного вклада применения вибросмешивания в ходе получения содержащего IgM раствора.
Более того, посредством данного способа разделение, осуществляемое на стадии (c), такое как осветление фильтрацией обработанного октановой кислотой раствора, полученного на стадии (b), улучшается при использовании вибросмесителя. Разделения достигают более просто, с уменьшением времени обработки и производственной себестоимости, и стадия (c) приводит к прозрачному раствору, что создает преимущества для дальнейшей переработки. Общепринятые растворы, получаемые фильтрацией продуктов обработанных октановой кислотой содержащих IgM растворов, подвергнутых перемешиванию, являются опалесцирующими или мутными.
Содержащую IgM композицию, полученную на стадии (c), предпочтительно подвергают обработке в слабокислых условиях (например, pH 4) и стадии облучения УФС для дополнительного улучшения вирусной безопасности и стабилизации конечного продукта. Благодаря улучшенному осветлению содержащей IgM композиции иммуноглобулинов, полученной на стадии (c), является возможным уменьшать необходимое время облучения УФС для достижения вирусной инактивации безоболочечных вирусов более 3 или 4 log10. Это приводит к более высокому выходу нативного и активного IgM в ходе обработки УФС.
Неожиданно, эти стадии приводят к содержащему химически и ферментативно немодифицированному IgM раствору, обладающему более высокими выходами нативного и активного IgM, обладающему низкой антикомплементарной активностью и низкой протеолитической активностью, и обладающему высокой антибактериальной и противовирусной активностью, выдающейся вирусной безопасностью по отношению к оболочечным и безоболочечным вирусам; ключевой характеристикой для лекарственных средств, предназначенных для внутривенного введения. Более того, обработанный содержащий IgM раствор обладает улучшенной долгосрочной стабильностью, являясь очень стабильным в жидком растворе в течение более 12 месяцев при 2-8°C.
Применение в медицине
Препарат антитела по настоящему изобретению является пригодным для применения в медицине, и его можно применять при лечении иммунологических нарушений и инфекций, в частности, нарушения с дефицитом IgM и бактериальных инфекций. Обогащенный IgM человека препарат поливалентных иммуноглобулинов для внутривенного введения содержит более высокие титры антител против клинически значимых грамотрицательных и грамположительных бактерий, а также более высокие титры антител против эндотоксинов грамотрицательных бактерий и экзотоксинов грамотрицательных и грамположительных бактерий по сравнению с препаратами поливалентного иммуноглобулина G.
В частности, препараты антител по настоящему изобретению являются пригодными для внутривенного введения пациентам.
Изобретение относится также к способу лечения пациента, включающему стадию введения препарата антитела по настоящему изобретению пациенту. В частности, пациент может страдать иммунологическим нарушением или бактериальной инфекцией. В предпочтительном варианте осуществления препараты антител вводят внутривенно.
Настоящее изобретение в настоящее время описано дополнительно только путем примеров.
ПРИМЕРЫ
Способы анализа
Распределение размеров молекул посредством ВЭЖХ для концентрата IgM
Способ ниже можно использовать для определения % агрегатов в препарате антитела (как использовано в примере 8).
Тестовый раствор: образцы инъецировали неразведенными приблизительно при 50 г/л с объемом инъекции 10 мкл (загрузка приблизительно 500 мкг белка).
Эталонный раствор: иммуноглобулин человека (например, Intratect, Biotest AG).
Стандартный раствор: стандарт для гель-фильтрации Bio-Rad (Art.-No. 151-1901).
Колонка:
- размер: l=30 мм, Ø=7,8 мм,
- стационарная фаза: Tosoh Bioscience TSK-Gel G4000 SWXL, пригодная для фракционирования глобулярных белков с относительными молекулярными массами в диапазоне 20000-7×106 Да.
Подвижная фаза: растворить 4,873 г дигидрата гидрофосфата динатрия, 1,741 г моногидрата дигидрофосфата натрия, 11,688 г хлорида натрия и 50 мг азида натрия в 1 литре воды.
Скорость потока: 0,5 мл/мин.
Детекция: спектрофотометр при 280 нм. На хроматограмме, полученной с эталонным раствором.
Хроматограмму интегрируют согласно следующей схеме и идентифицируют пики:
Полимер (>1200 кДа), 10-13 мин.
IgM (1200-750 кДа), 13-19 мин.
Димер/IgA (750-350 кДа), 19-20 мин.
IgG (350-100 кДа), 20-26 мин.
Фрагменты (<100 кДа), 26-40 мин.
Фрагменты (<100 кДа), 26-40 мин.
Определение неспецифической активации комплемента
Для предварительно обработанных гемолизином эритроцитов овцы проводили гемолиз посредством комплемента. Посредством связывающих комплемент антител в образце гемолиз супрессируется. Определяют количество комплемента, которое связывается (инактивируется) 1 мг иммуноглобулина.
Определенное количество иммуноглобулина (10 мг) смешивают с комплементом морской свинки и титруют свободный комплемент. Антикомплементарная активность выражает использованный комплемент относительно использованного комплемента из эталонного раствора. Гемолитическая единица активности комплемента (CH50) представляет собой количество комплемента, приводящее к гемолизу 2,5×108 оптимально подготовленных эритроцитов из общего количества 5×108 эритроцитов в оптимальных буферных условиях.
Оптимально подготовленные эритроциты (8 мл стабилизированных эритроцитов овцы, промытых три раза желатиново-барбиталовым буфером, конечный 1 мл осадка эритроцитов суспендирован в 24 мл желатиново-барбиталового буфера) получают смешиванием 20 мл суспензии эритроцитов с 20 мл гемолизина (доведенного до 2 MHE/мл - минимальной гемолитической единицы) и инкубацией в течение 15 мин при 37°C.
Эквивалент 10 мг иммуноглобулина разводят в желатиново-барбиталовом буфере (1 г желатина в 1 л барбиталового буфера, pH 7,3, 5-кратный раствор барбиталового буфера: 83 г хлорид натрия, 10,192 г барбитала натрия в 2 литрах воды, pH 7,3). К конечному объему 1 мл добавляют 200 мкл комплемента 100 CH50/мл. Пробирки инкубируют при встряхивании в течение 1 час при 37°C. Образцы разводят и титруют против оптимально подготовленных эритроцитов. После инкубации в течение 1 час при 37°C образцы центрифугируют и определяют оптическую плотность с использованием спектрофотометра при длине волны 541 нм.
Определение протеолитической активности
Протеолитическую активность можно оценивать посредством смешивания хромогенного субстрата (в частности, субстрата, чувствительного, по меньшей мере, к одной сериновой протеазе) и образца препарата антитела (обычно разведенного в буфере для соответствия линейному диапазону анализа) при 37°C и мониторинга кинетики поглощения с использованием спектрофотометра. Протеолитическую активность образца рассчитывают из начальной разницы поглощения (∆Abs/мин) с использованием уравнения C (Ед./л)=313S×ΔAbs/мин×F (C=протеолитическая активность; S=коэффициент перевода, относящийся к специфическому изменению поглощения хромогенного субстрата; и F=коэффициент разведения). Использование субстрата происходит согласно инструкциям производителя.
Протеолитическую активность можно в частности оценивать посредством следующих стадий:
(a) 25 мг субстрата S-2288 (Chromogenix) растворяют в 7,2 мл воды для инъекций;
(b) образец препарата антитела разводят в буфере (100 мМ Трис.HCl pH 8,4, 106 мМ NaCl) для соответствия линейному диапазону анализа, и температуру доводят до 37°C;
(c) смешивают равные количества (например, 200 мкл) разведенного препарата антитела и растворенного субстрата;
(d) измеряют кинетику поглощения при 405 нм в течение 1-3 минут при 37°C с использованием спектрофотометра;
(e) протеолитическую активность образца рассчитывают из начальной разницы поглощения (∆Abs/мин) с использованием уравнения C (Ед./л)=313×∆Abs/мин×F (C=протеолитическая активность, F=коэффициент разведения)
Предел количественного определения по данному способу составляет 8 Ед./л, и с использованием образца препарата антитела по настоящему изобретению протеолитическая активность не поддается детекции. Поэтому уровень протеолитической активности в конечном продукте по настоящему изобретению составляет ниже 8 Ед./л.
Пример 1 - Получение обогащенного IgM препарата из фракции I/III
180 кг фракции Коэна I/III, полученной фракционированием плазмы человека холодным этанолом, суспендируют в 720 л 0,1M буфера ацетата натрия pH 5,05 и перемешивают в течение 15-30 минут после достижения температуры суспензии (22±4°C).
Раствор обрабатывают добавлением 19,8 кг октановой кислоты (используют 0,110 кг на кг массы I/III) при комнатной температуре и раствор белка дополнительно перемешивают в течение 80 минут, с использованием вибросмесителя (Vibromixer®, размер 4, Graber+Pfenniger GmbH, Vibromixer, доведенный до уровня 2-3). Октановую кислоту добавляют медленно в течение 30 мин.
Добавляют приблизительно 3 кг трифосфата кальция (Ca3(PO4)2), и раствор белка дополнительно перемешивают в течение, по меньшей мере, 15 мин. Преципитат удаляют осветляющей фильтрацией с использованием фильтр-пресса. Проводят дополнительную фильтрацию через 0,2 мкм и раствор белка подвергают ультрафильтрации с использованием мембран 10 кДа. Раствор белка подвергают диафильтрации против раствора 0,04M NaCl и затем доводят до концентрации белка 40 г/л.
Раствор белка обрабатывают при pH 4,0±0,1 после разведения 1+1 водой для инъекций. Доведение pH проводят с использованием 1M HCl, и раствор белка инкубируют в течение 9 час при 37°C±2°C. После инкубации при pH 4 раствор белка доводят до pH 5,8, с использованием 1M NaOH. Полученный раствор белка дополнительно очищают добавлением DEAE Sephadex в периодическом режиме (75 г DEAE Sephadex на кг белка). Раствор белка инкубируют при перемешивании в течение ≥60 мин при комнатной температуре. DEAE Sephadex удаляют осветляющей фильтрацией. Раствор белка подвергают фильтрации через 0,2 мкм.
Раствор белка фильтруют через фильтр 0,1 мкм и фильтр Pall, Ultipor VF DV50, 20”. Фильтрат далее обрабатывают УФС-светом при 254 нм, с использованием устройства для проточного процесса UVivatec® (Bayer Technology Services/Sartorius Stedim) при дозе УФС 240 Дж/м2. Скорость потока через УФС-реактор рассчитывают с использованием инструкций производителя. Облученный раствор белка концентрируют до концентрации белка 50-70 г/л посредством ультрафильтрации и подвергают диафильтрации (мембрана 10 кДа, с использованием буфера 0,32M глицина pH 4,3). Конечный продукт фильтруют через фильтр 0,2 мкм и сохраняют при 2-8°C.
Пример 2 - Исследование условий на стадии обработки октановой кислотой
Для обработки октановой кислотой тестировали следующие экспериментальные диапазоны, также в сочетании друг с другом, с применением способа, описанного в примере 1 (результаты не показаны).
Количество октановой кислоты: 0,09 кг/кг-0,13 кг/кг (количество октановой кислоты на кг использованной фракции I/III) (120-180 мМ октановая кислота).
pH при обработке октановой кислотой от pH 4,8 до 5,3.
Диапазон температур реакции: 14°C-30°C.
Время инкубации: 40-110 мин.
Все тестированные условия приводили к промежуточным соединениям, которые легко было осветлять для дальнейшей переработки, и со значительным снижением протеолитической активности от нескольких тысяч Ед./л в суспендированной фракции Коэна I/III). Промежуточные соединения приводили к конечному продукту с протеолитической активностью ниже 8 Ед./л (рассчитанной, как описано ниже в примере 6), что составляет предел количественного определения.
Пример 3 - Снижение количества вируса посредством использования вибросмесителя - Определение степеней удаления вируса для обработки октановой кислотой с и без использования вибросмесителя
250 мл суспендированной фракции I/III гомогенизировали в течение 30 мин при pH 5,05 и 22°C. В суспензию добавляли 2,6 мл исходного раствора вируса. Добавляли октановую кислоту (110 г/кг) и гомогенизировали в течение 60 мин с использованием вибросмесителя. В параллельном эксперименте такую же смесь гомогенизировали при стандартном перемешивании. Через 60 мин добавляли трифосфат кальция (0,15 г/кг октановой кислоты) и суспензию перемешивали в течение 15 мин. Суспензию осветляли глубинной фильтрацией с использованием дискового фильтра. Дисковый фильтр предварительно промывали 70-80 мл буфера. После фильтрации фильтр промывали 80 мл буфера. Фильтрат и смывки объединяли и отбирали образец для титрования вирусов.
Титры вирусов из образцов, взятых до добавления октановой кислоты и после фильтрации, определяли на подходящих индикаторных клетках для SV40, Reo и PPV (CV-1, CCL.7.1 и PK13). Наконец, рассчитывали степень удаления в соответствии с современными руководствами для валидационных исследований вирусов.
В валидационных исследованиях вирусов безоболочечные вирусы, такие как SV40 и Reo, эффективно удаляли с порядком более 4 log10 и более 5 log10, соответственно. Более того, PPV удаляли более чем на 3 log10. Эти значения более чем в 10 раз и вплоть до 1000 раз выше, чем при такой же обработке октановой кислотой в условиях стандартного перемешивания без вибросмешивания.
Пример 4 - Оценка обработки УФС
Оценивали оптимальный диапазон для дозы облучения УФС. Существует равновесие между минимально необходимой дозой для достижения инактивации, по меньшей мере, 4 log10 для безоболочечных вирусов и максимально переносимой дозой для избегания денатурации молекул IgM, приводящей к нарушенной функции Fab для связывания антигенов и нарушенной функции Fc, влияющей на активацию комплемента. В диапазоне 200-400 Дж/м2 можно наблюдать только слабое увеличение количества агрегатов иммуноглобулинов и отсутствие значительного влияния на содержание фрагментов.
Для экспериментов оптическую плотность (OD) исходного раствора белка используют для расчета скорости потока в системе UVivatec lab с помощью предоставленного поставщиком Excel-Sheet из BTS (Master Calculation Sheet UVivatec Lab II версии 3.0 покупателя). Скорость потока рассчитывают, принимая во внимание производительность лампы, заданное положение датчика УФ-сигнала лампы и желаемую дозу облучения УФС.
Содержащий IgM раствор с содержанием белка приблизительно 55 г/л (партия 86 GB005BE07) прокачивали насосом со скоростью потока 5,8 л/час через систему UVivatec для достижения дозы 200 Дж/м2 за однократный проток. Дозы 300 Дж/м2 достигали прокачиванием насосом раствора белка со скоростью потока 3,9 л/м2 через систему. 400 Дж/м2 достигали прокачиванием насосом раствора белка со скоростью потока 2,9 л/м2 через систему.
Невозможно было наблюдать значимых различий для содержания иммуноглобулинов, протеолитической активности или ACA в диапазоне 200-400 Дж/м2. Предпочтительный диапазон для дозирования устанавливали от 200 до 300 Дж/м2, поскольку 200 Дж/м2 являются достаточно хорошими для инактивации безоболочечных вирусов, и при 300 Дж/м2 невозможно было наблюдать значимого влияния на образование агрегатов и титры антител. Предпочтительная доза составляет 225 Дж/м2.
Разведенный содержащий IgM раствор с содержанием белка 8-12 г/л (партия 86BB059BE07) прокачивали насосом со скоростью потока 5,8 л/час через систему UVivatech для достижения доз от 200 до 300 Дж/м2 за однократный проток.
Распределение между классами иммуноглобулинов остается без влияния в ходе облучения УФ в пределах этого диапазона дозирования. Характер распределения молекулярной массы, анализированного посредством HPSEC, также не изменяется. Уровень чистоты, анализированный посредством CZE, остается неизменным. Протеолитическая активность (PA), активатор прекалликреина (PKA) и антикомплементарная активность (ACA) остаются неизменными. Антибактериальная активность, измеренная способом Elisa, также существенно не изменяется для всех классов иммуноглобулинов.
Аликвоты - облученные УФ с увеличивающимися значениями интенсивности - далее перерабатывали до конечного продукта и подвергали такой же панели аналитических тестов. В конечных продуктах также не существовало поддающихся наблюдению различий. Все тестированные титры антител всегда лежат в диапазоне 100±10% от контрольного препарата, не обработанного УФC.
Пример 5 - Общее снижение количества вирусов посредством использования вибросмесителя/обработки pH4 и обработки УФC - Определение степеней удаления вирусов
Подтверждение удаления/инактивации вируса для трех стадий обработки октановой кислотой при вибросмешивании, обработки pH4 и обработки УФC (215 Дж/м2) проводили с использованием следующих моделей вирусов: вирус бычьей вирусной диареи (BVDV) в качестве модели вируса для вируса гепатита C, вирус псевдобешенства (PRV) в качестве модели вируса для вирусов герпеса человека, вируса иммунодефицита человека (HIV-1), вируса конского артерита (EAV) в качестве модели вируса для коронавирусов, вируса Синдбис (SinV) в качестве модели вируса для флавивирусов, вируса энцефаломиелита мышей (MEV) в качестве модели вируса для вируса гепатита A, реовируса (Reo) в качестве модели вируса для других безоболочечных вирусов, парвовируса свиней (PPV) в качестве модели вируса для парвовируса B 19 человека.
Результаты этих исследований для трех стадий обработки октановой кислотой, обработки pH4 и обработки УФC перечислены в следующей таблице 2.
Необязательная нанофильтрация с помощью фильтров с номинальным размером пор приблизительно 50 нм добавляет дополнительную безопасность посредством увеличения общего снижения вплоть до более 17 log 10 в зависимости от размера вируса. Например, >17,5 log10 достигают затем для HIV-1, в то время как PPV дополнительно не удалялся нанофильтрацией.
Таким образом, способ очистки согласно изобретению приводит к препарату IgM с выдающейся вирусной безопасностью с недостижимыми до настоящего времени для такого содержащего IgM препарата степенями инактивации/снижения количества вирусов более 8 log10. Это является особенно важным для безоболочечных вирусов, подобных MEV, Reo и PPV, которые, как правило, более устойчивы против способов инактивации и удаления вирусов из-за их малого размера и отсутствия липидной оболочки.
Пример 6 - Определение остаточной протеолитической активности для обработки октановой кислотой с и без использования вибросмесителя
Обработку октановой кислотой проводили, как в примере 1, и в параллельном эксперименте без вибросмесителя, но при интенсивном стандартном перемешивании с помощью лопастной мешалки. Протеолитическую активность в образцах после обработки октановой кислотой/трифосфатом кальция и ультра/диафильтрации определяли с использованием хромогенного субстрата S-2288 (Chromogenix), следуя инструкциям производителя. 25 мг субстрата S-2288 (Chromogenix) растворяют в 7,2 мл воды для инъекций. Образцы разводят в буфере (100 мМ Трис/HCl pH 8,4, 106 мМ NaCl) для соответствия линейному диапазону анализа, например, 200 мкл буфера смешивают с 200 мкл образца (смешивание и доведение температуры до 37°C) и 200 мкл раствора хромогенного субстрата. Кинетику поглощения измеряют при 405 нм (1-3 мин) при 37°C, с использованием спектрофотометра. Протеолитическую активность образца рассчитывают из начальной разницы поглощения (∆Abs/мин) с использованием уравнения C (Ед./л)=313×∆Abs/мин×F (C=протеолитическая активность. F=коэффициент разведения)
Фильтрат после обработки октановой кислотой был прозрачным, когда использовали вибросмешивание. В сравнительном эксперименте фильтрат после обработки октановой кислотой с лопастной мешалкой был очень мутным и сложным для фильтрации.
Пример 7 - Анти-бактериальные титры в препарате IgM по изобретению
Для сравнения с единственным коммерчески доступным переносимым при внутривенном введении содержащим IgM препаратом пентаглобином, антибактериальную активность анализировали в трех партиях этого общепринятого лекарственного средства и сравнивали с препаратом по изобретению. Определение антител класса IgA или IgM против антибактериальных или противогрибковых антигенов в препарате IgM проводили посредством ELISA. Планшеты для микротитрования покрывали соответствующим антигеном и инкубировали со стандартом или препаратом IgM. Антитела, связанные с антигеном, детектировали с помощью конъюгата против IgA человека или против IgM человека. Детекцию проводили с использованием субстрата фермента. Полученное изменение окраски соответствует количеству антител, присутствующих в препарате IgM.
Опосредованная IgM и IgA активность в новом препарате, как правило, по меньшей мере, в 1,5 раза превышала активность в пентаглобине, что можно объяснить тем фактом, что IgM и IgA в пентаглобине химически модифицированы β-пропиолактоном. Согласно настоящему изобретению эта стадия заменена более мягкими процедурами.
В целом эти данные показывают, что связывающая область молекул IgM в конечном препарате является функционально полностью активной.
Пример 8 - Исследования стабильности при хранении для жидкого продукта IgM
Продукт согласно примеру 1 без обработки УФC сохраняли в стеклянных флаконах по 10 или 100 мл (объем заполнения 5 мл или 50 мл) при 2-8°C и анализировали по всем параметрам согласно спецификации. Результаты показаны в таблице 8. Параметрами, важными, чтобы показать стабильность, являются содержание агрегатов и фрагментов, измеренные высокоэффективной эксклюзионной хроматографией (HPSEC), протеолитическая активность (PA) и антикомплементарная активность (ACA). Эти параметры являются критическими для переносимости при внутривенном введении и, по-видимому, изменяются в ходе долгосрочного хранения. При 2-8°C не присутствовало существенного изменения этих параметров. Даже при хранении при комнатной температуре (23-27°C) эти значения оставались в пределах спецификации, хотя присутствует небольшое увеличение количества фрагментов через 24 месяца при комнатной температуре. Определяли также другие параметры, подобные окрашиванию, опалесценции, значению pH, и они оставались неизменными в течение всего периода исследования. Титры IgM и IgA против различных бактерий оставались стабильными в течение 2 лет при 2-8°C.
Продукт согласно примеру 1 с обработкой УФC также сохраняли в стеклянных флаконах по 10 или 100 мл (объем заполнения 5 мл или 50 мл) при 2-8°C и комнатной температуре и анализировали по всем параметрам согласно спецификации. Результаты показаны в таблице 9. В этом текущем исследовании стабильности доступные в настоящее время данные за 12 месяцев показывают такой же профиль стабильности продукта, как без обработки УФC, что позволяет экстраполяцию на стабильность в течение 24 месяцев.
Пример 9 - Неспецифическая активация комплемента in vitro продуктом IgM
Пример 9A - Определение уровней C5a
Анализ способности препарата IgM неспецифически активировать комплемент in vitro проводили с использованием фактора C5a в качестве маркера активации терминального пути комплемента. Для этой цели сыворотку человека инкубировали с иммуноглобулиновыми продуктами или буфером в течение 120 мин. Образцы отбирали через 0, 5, 15, 60 и 120 минут инкубации. Чтобы продемонстрировать соответствующую функцию системы in vitro, показано полное ингибирование, а также полная активация системы комплемента. Концентрацию факторов комплемента измеряли посредством определений оптической плотности с помощью фотометра с использованием коммерчески доступного набора для твердофазного иммуноферментного анализа (ELISA) (Quidel MicroVue C5a Plus EIA Kit; A025).
Сыворотку человека (Quidel NHS; A113) быстро размораживали при 37°C и немедленно помещали в лед. Каждый отдельный образец состоял из реакционной пробы, содержащей сыворотку (100 мкл). Добавки сначала отмеряли пипеткой с последующим добавлением сыворотки человека для запуска реакции в каждой реакционной пробе.
Сыворотка человека без каких-либо добавок служила нолем и показывала фоновую активацию комплемента из-за условий эксперимента. Добавление агрегированного под действием нагревания IgG (HAAG Quidel; A114; 1,3 мкл) служило сильным активатором комплемента сыворотки человека, чтобы продемонстрировать способность отвечать в системе in vitro. EDTA (конечная концентрация 10 мМ) добавляли к сыворотке человека для полного ингибирования активации комплемента на протяжении всего времени реакции и экспериментальной обработки. Препарат IgM, пентаглобин (согласно EP0013901) и препарат IgM согласно EP0413187 доводили до концентрации IgM 1,72 мг/мл в каждой реакции. В качестве отрицательного контроля использовали соответствующий объем буфера для составления.
Все реакции останавливали после инкубации в течение 0, 5, 15, 60 и 120 минут при 37°C при постоянном перемешивании добавлением стабилизирующего раствора (стабилизатор образцов Quidel A9576; 140 мкл). Последующее разведение образцов и анализ ELISA проводили согласно протоколу производителя. Эксперимент проводили в двух независимых повторах и рассчитывали средние значения. Результаты показаны в таблице 10 и на фиг.2.
Добавление активатора (агрегированного под действием нагревания IgG) приводило к сильному увеличению количества C5a в пределах 15 минут, что указывает на чувствительный ответ системы in vitro для детекции активации комплемента. Добавление EDTA в качестве ингибитора приводило к неизменным значениям в течение всего времени инкубации, что указывает на то, что активация комплемента является специфической и не является артефактом, обусловленным манипуляциями с образцами или получением образцов. Инкубация сыворотки человека при 37°C и воздействие на нее искусственных поверхностей индуцировало слабую активацию комплемента, документированную как нулевые значения.
Эталонный препарат IgM согласно EP0413187 приводил к активации комплемента вплоть до более 1000 нг/мл через 60 минут (таблица 10). Для коммерчески доступного химически модифицированного эталонного препарата пентаглобина (EP0013901) еще показали половину потенциала активации комплемента по сравнению с продуктом EP0413187.
Концентрация C5a в сыворотке, обработанной препаратом IgM по настоящему изобретению, является сравнимой с концентрацией C5a, измеренной в сыворотке без добавок (ноль) или в сыворотке, обработанной буферами для составления (300 мМ глицин, pH 4,3 или 0,45% NaCl/2,5% глюкоза, pH 6,8). Таким образом, иммуноглобулины в препарате IgM по настоящему изобретению по существу не активируют комплемент неспецифически в сыворотке человека в тестовой системе in vitro.
Пример 9B Определение уровней C3a
Анализ способности препарата IgM неспецифически активировать комплемент in vitro проводили с использованием фактора C3a в качестве маркера активации пути комплемента. Для этой цели сыворотку человека инкубировали с иммуноглобулиновыми продуктами или буфером в течение 120 мин. Образцы отбирали через 0, 5, 15, 60 и 120 минут инкубации. Чтобы продемонстрировать соответствующую функцию системы in vitro, показано полное ингибирование, а также полная активация системы комплемента. Концентрацию факторов комплемента измеряли путем определения оптической плотности с помощью фотометра с использованием коммерчески доступного набора для твердофазного иммуноферментного анализа (ELISA) (Quidel Micro Vue C3a Plus EIA Kit; A032).
Сыворотку человека (Quidel NHS; A113) быстро размораживали при 37°C и немедленно помещали в лед. Каждый отдельный образец состоял из реакционной пробы, содержащей сыворотку (100 мкл). Добавки сначала отмеряли пипеткой с последующим добавлением сыворотки человека для запуска реакции в каждой реакционной пробе.
Сыворотка человека без каких-либо добавок служила нолем и показывала фоновую активацию комплемента из-за условий эксперимента. Добавление фактора яда кобры (CVF Quidel; A600; 20 Ед./мл) служило сильным активатором комплемента сыворотки человека, чтобы продемонстрировать способность отвечать в системе in vitro. EDTA (конечная концентрация 10 мМ) добавляли к сыворотке человека для полного ингибирования активации комплемента на протяжении всего времени реакции и экспериментальной обработки. Препарат IgM и пентаглобин (согласно EP0013901) доводили до концентрации IgM 1,72 мг/мл в каждой реакции. В качестве отрицательного контроля использовали соответствующий объем буфера для составления.
Все реакции останавливали после инкубации в течение 0, 5, 15, 60 и 120 минут при 37°C при постоянном перемешивании посредством добавления стабилизирующего раствора (стабилизатор образцов Quidel A9576; 140 мкл). Последующее разведение образцов и анализ ELISA проводили согласно протоколу производителя. Эксперимент проводили в двух независимых повторах и рассчитывали средние значения. Результаты показаны в таблице 11 и на фиг.3.
Добавление активатора (CVF) приводило к сильному увеличению количества C3a в пределах 15 минут, что указывает на чувствительный ответ в системе in vitro для детекции активации комплемента. Добавление EDTA в качестве ингибитора приводило к неизменным значениям в течение всего времени инкубации, что указывает на то, что активация комплемента является специфической и не является артефактом, обусловленным манипуляциями с образцами или получением образцов. Инкубация сыворотки человека при 37°C и воздействие на нее искусственных поверхностей индуцировало слабую активацию комплемента, документированную как нулевые значения.
Коммерчески доступный химически модифицированный эталонный препарат пентаглобина (EP0013901) показал в три раза более высокий потенциал активации C3 по сравнению с нолем.
Концентрация C3a в сыворотке, обработанной препаратом IgM по настоящему изобретению, является сравнимой с концентрацией C3a, измеренной в сыворотке без добавок (ноль) или в сыворотке, обработанной буферами для составления (300 мМ глицин, pH 4,3 или 0,45% NaCl/2,5% глюкоза, pH 6,8). Таким образом, иммуноглобулины в препарате IgM по настоящему изобретению по существу не активируют комплемент неспецифически в сыворотке человека в тестовой системе in vitro.
Пример 10 - Эксперименты in vivo с продуктом IgM
Для подтверждения безопасности и переносимости исследовали эффекты препарата IgM на артериальное кровяное давление после повторяющихся внутривенных инфузий в течение 5 суток 8 бодрствующим яванским макакам. Вводили дозу 190 мг/IgM/кг/сутки препарата IgM, полученного способами, описанными в настоящем описании. Пентаглобин, коммерчески доступный, содержащий IgM препарат с переносимостью при внутривенном введении, вводили некоторым обезьянам в качестве сравнительного вещества.
Пентаглобин вводили таким же путем, как такую же дозу IgM. Кровяное давление определяли после инъекции, чтобы определить, было ли введение ассоциировано с непереносимым уровнем неспецифической активации комплемента. Контрольную дозу 0,9% NaCl вводили животным за несколько часов до введения препаратов иммуноглобулинов. Кровяное давление определяли посредством вставки катетера для измерения давления в нижний отдел брюшной аорты через правую бедренную артерию. Результаты передавали посредством телеметрии.
Введение препарата IgM (15 мл/кг/сутки) оказывало только незначительные эффекты на артериальное кровяное давление (среднее, систолическое и диастолическое). Различия вплоть до 4 часов после каждой инфузии по сравнению со значениями до тестирования не превышали 4 мм рт.ст. (533,3 Па). Эти различия можно рассматривать как биологически не значимые.
Уровни C3a определяли в образцах плазмы, отобранных после инъекции, в качестве маркера неспецифической активации пути комплемента. Уровни C3a [нг/мл] только слабо увеличивались при введении препарата IgM (15 мл/кг BW) и были даже ниже, чем для коммерчески доступного эталонного препарата пентаглобина при равных количествах IgM. Отбор образцов крови проводили приблизительно через 6 часов после обработки.
Каких-либо существенных токсикологических обнаружений нельзя приписать препарату IgM, и не присутствовало значимых изменений, которые не наблюдались с пентаглобином. Поскольку безопасность пентаглобина хорошо установлена в многолетней клинической практике, является обоснованным заключить, что эти изменения не имеют какой-либо клинической значимости.
Хорошую переносимость и безопасность препарата IgM также верифицировали в исследовании фазы I на людях для 24 здоровых мужчин и женщин - добровольцев. Систолическое кровяное давление в первые 4 часа после введения в среднем уменьшалось только приблизительно на 9% (11,9 мм рт.ст. (1,587 Па)) после инфузии 91-274 мг препарата IgM на кг BW/d при 0,5 мл/мин.
Это находилось в таком же диапазоне, как и плацебо - 0,9% NaCl-раствор (9,4%, 11,7 мм рт.ст. (1,56 Па)).
Не зарегистрировано тяжелых неблагоприятных событий, и все не тяжелые неблагоприятные события являлись самоограничивающимися. Кроме того, не существовало доказательств переноса инфекционного агента, как показано посредством определений PCT.
Отмечено, что полезность исследований эффективности на животных моделях соответствующих заболеваний является ограниченной из-за иммуногенности и преформированных Gal-антител в препаратах IgM, полученных из плазмы человека. Однако, принимая во внимание знания предшествующего уровня техники относительно использования пентаглобина в лечении заболеваний и титры антител против бактерий в препаратах IgM, полученных способом по настоящему изобретению (как показано в примере 7), можно заключить, что препарат IgM обладает клинической эффективностью.
Пример 11 - Функциональная целостность Fc-фрагмента препарата антитела
Функциональную целостность Fc-фрагмента антител в препарате антитела, полученного согласно способу, описанному в настоящем описании, анализировали с использованием современного способа Ph. Eur. (2.7.9 Test for Fc Function of Immunoglobulins Eur. Ph. Edition current April 2011) согласно Европейскому руководству ICH S6 (CPMP/ICl 1/302/95) (Note for Guidance on preclinical safety evaluation of biotechnology-derived pharmaceuticals) для препаратов IgG. В монографии Европейской Фармакопеи для иммуноглобулинов (01/2005:20709) предложен тест Fc-функции иммуноглобулинов на основе антигена краснухи.
В частности, обработанные дубильной кислотой эритроциты группы O человека нагружали антигеном вируса краснухи. Конкретные объемы препаратов антител инкубировали с покрытыми антигеном клетками крови. Инициированный комплементом лизис клеток крови запускали добавлением комплементом морской свинки. Кинетику последующего гемолиза измеряли посредством зависимых от времени измерений поглощения при 541 нм. Оценку проводили с использованием максимального изменения поглощения в единицу времени. Биологический эталонный препарат иммуноглобулина человека; BRP партии no. 3 использовали в качестве сравнения.
Активность Fc-фрагмента молекулы антитела определяли в 7 партиях содержащего IgM препарата антитела, и она составляла во всех партиях от 96,5 до 103,3% по сравнению с биологическим эталонным препаратом (BRP), таким образом, доказывая функциональность содержащего IgM препарата антитела.
Реферат
Представлена группа изобретений, относящаяся к области медицины. Представлен препарат антитела, пригодный для внутривенного введения человеку, содержащий IgG, IgA, IgM в определенном количестве, где препарат получают из плазмы человека, где препарат антитела имеет концентрацию белка от 40 г/л до 80 г/л и имеет содержание иммуноглобулинов более чем 90% от общего содержания белка. Предложены применение препарата антитела для изготовления лекарственного средства для лечения иммунологического нарушения или бактериальной инфекции и способ лечения пациента, страдающего нарушением, выбранным из иммунологического нарушения или бактериальной инфекции. Предложенная группа изобретений обеспечивает эффективные средства и методы активации комплемента. 4 н. и 15 з.п. ф-лы, 13 табл., 11 пр., 3 ил.
Формула
Документы, цитированные в отчёте о поиске
Способ получения препарата на основе иммуноглобулина м для внутривенного применения

Комментарии