Состав антитела - RU2743681C2
Код документа: RU2743681C2
Чертежи






Описание
Предпосылки изобретения
Настоящее изобретение относится к фармацевтическим составам фармацевтически активного антигенсвязывающего белка. Такие составы содержат, в дополнение к антигенсвязывающему белку, буферное средство и регулятор тоничности.
За последние годы увеличилось фармацевтическое применение антител. Во многих случаях такие антитела инъецируют внутривенным (IV) путем. К сожалению, количество антитела, которое можно инъецировать внутривенным путем, ограничено физико-химическими свойствами антитела, в частности, его растворимостью и стабильностью в подходящем жидком составе и объемом инфузионной жидкости. Альтернативными путями введения являются подкожная или внутримышечная инъекция. Для этих путей инъекции необходима высокая концентрация белка в конечном растворе, подлежащем инъекции.
Таким образом, существует потребность в высококонцентрированных, стабильных фармацевтических составах терапевтически активных антигенсвязывающих белков, таких как антитела, для подкожной инъекции. Преимуществом подкожных инъекций является то, что они позволяют врачу-терапевту осуществлять их в течение достаточно короткого для пациента вмешательства. Кроме того, пациента можно научить самостоятельно осуществлять подкожную инъекцию. Такое самостоятельное введение особенно подходит при поддержании дозы, т.к. нет необходимости в больничном уходе (снижено использование медицинских ресурсов). Как правило, инъекции подкожным путем ограничены приблизительно 2 мл. В случае пациентов, которым необходимы многократные дозы, можно инъецировать несколько составов с однократными дозами во множество мест на поверхности тела.
Сущность изобретения
В одном из аспектов настоящее изобретение относится к фармацевтическому составу антигенсвязывающего белка, содержащему буферное средство и регулятор тоничности. Более конкретно, настоящее изобретение относится к приблизительно от 150 до 250 мг/мл антигенсвязывающего белка; приблизительно от 1 до 100 мМ буферного средства, обеспечивающего pH от приблизительно 5,0 до приблизительно 7,0; и приблизительно от 70 до 170 мМ регулятора тоничности. В одном из вариантов осуществления антигенсвязывающим белком является антитело против BLyS.
В другом аспекте настоящее изобретение относится к способу лечения заболевания или состояния, поддающегося лечению антителом против BLyS, у индивидуума, включающему введение состава по настоящему изобретению индивидууму в количестве, эффективном для лечения заболевания или состояния. В одном из аспектов заболевание или состояние является аутоиммунным заболеванием или нарушением.
В другом аспекте настоящее изобретение относится к набору, содержащему один или более сосудов, содержащих состав по настоящему изобретению и инструкции для подкожного введения состава пациенту.
В другом аспекте настоящее изобретение относится к составу по настоящему изобретению для применения в лечении заболевания, выбранного из группы, состоящей из системной красной волчанки, васкулита, ассоциированного с антинейтрофильными цитоплазматическими антителами ("ANCA"), волчаночного нефрита, первичного синдрома Шегрена, хронической иммунной тромбоцитопении, миастении, симптоматической макроглобулинемии Вальденстрема, иммунной десенсибилизации у пациентов, ожидающих трансплантации почки, мембранозной нефропатии, системного склероза, ревматоидного артрита, множественной миеломы, рассеянного склероза и почечной недостаточности.
Краткое описание чертежей
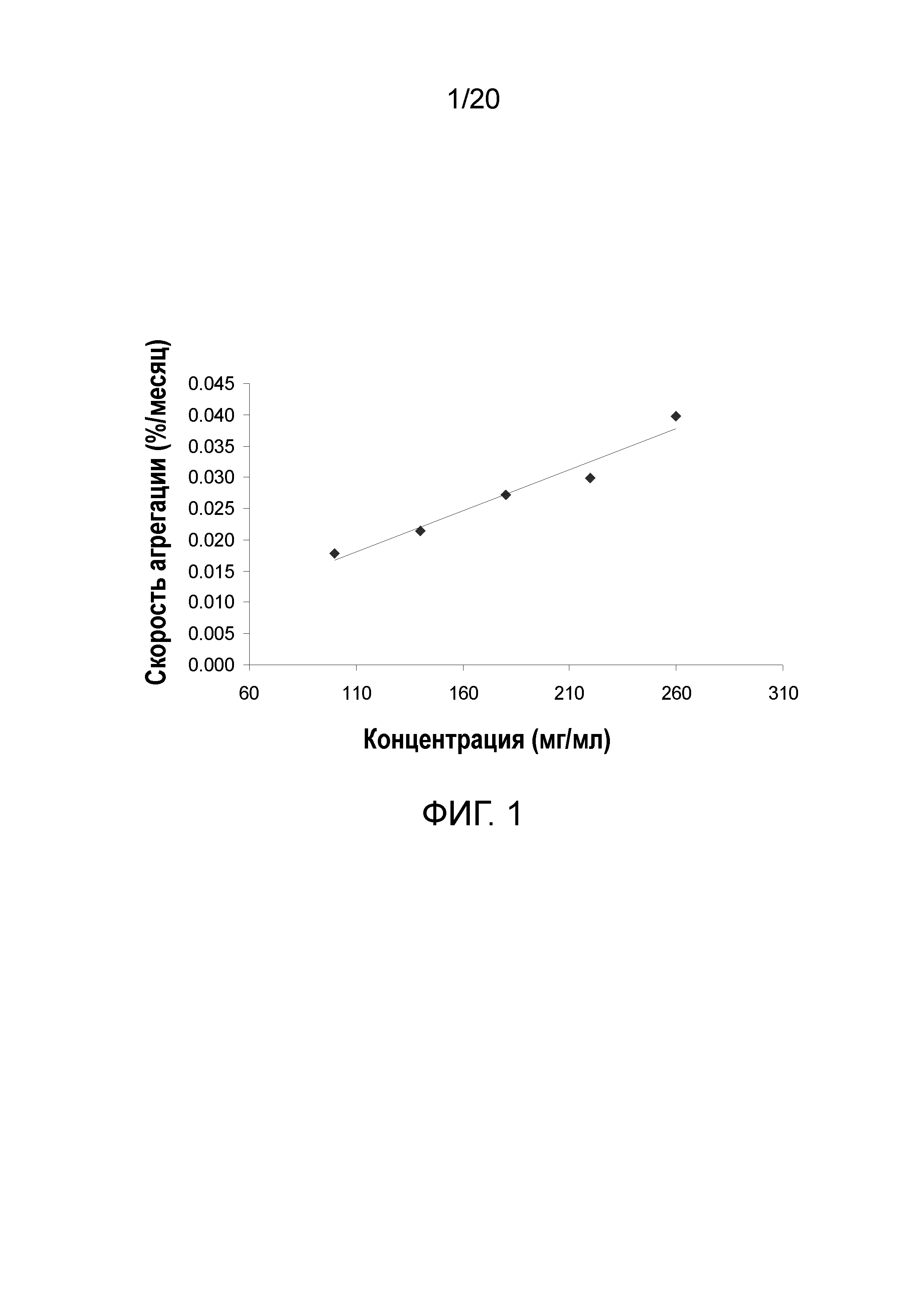
На фиг. 1 показан эффект концентрации белка в отношении скорости агрегации для состава 1.
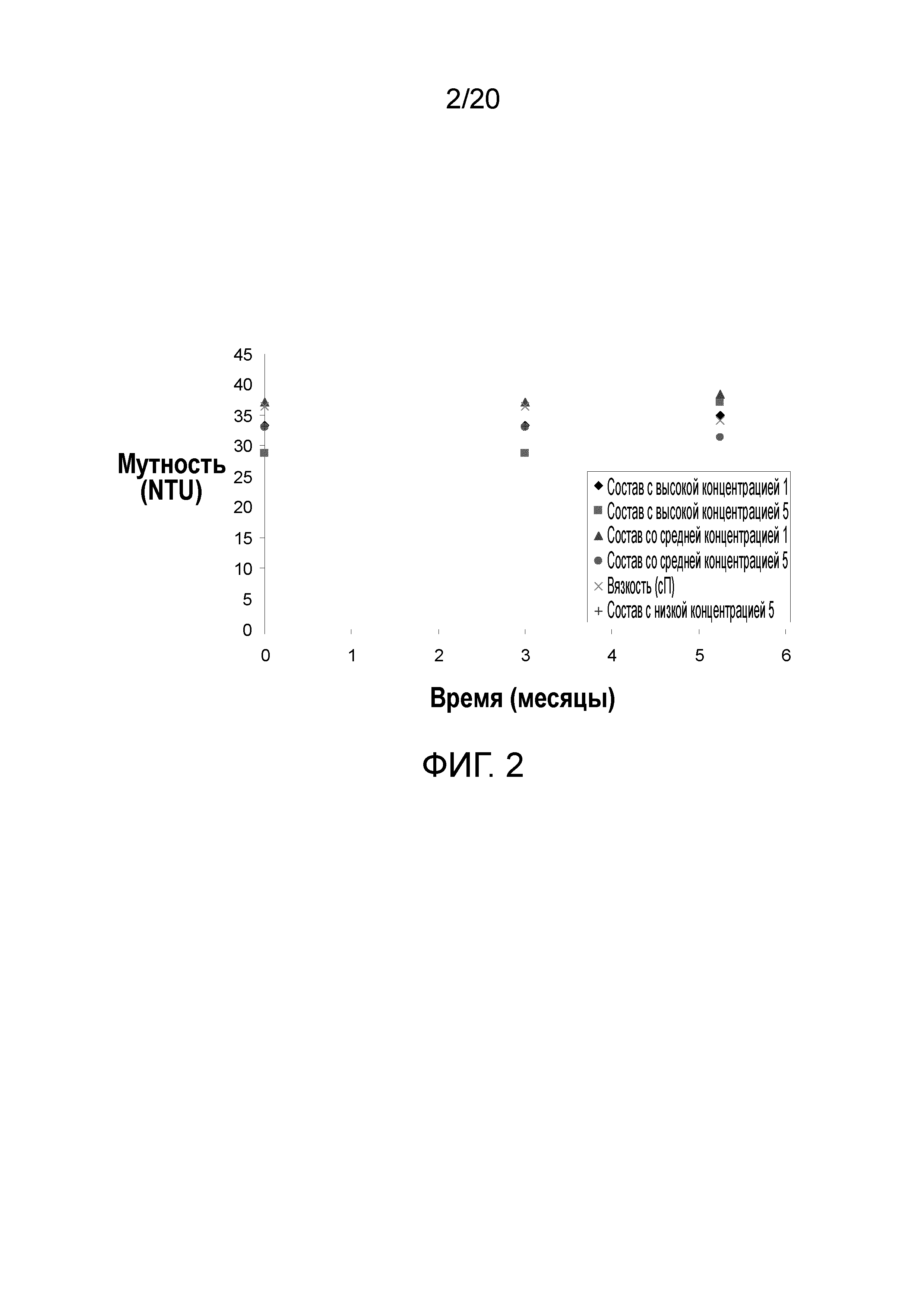
На фиг. 2 показана мутность составов 1 и 5 после 5¼ месяцев при 2-8°C.
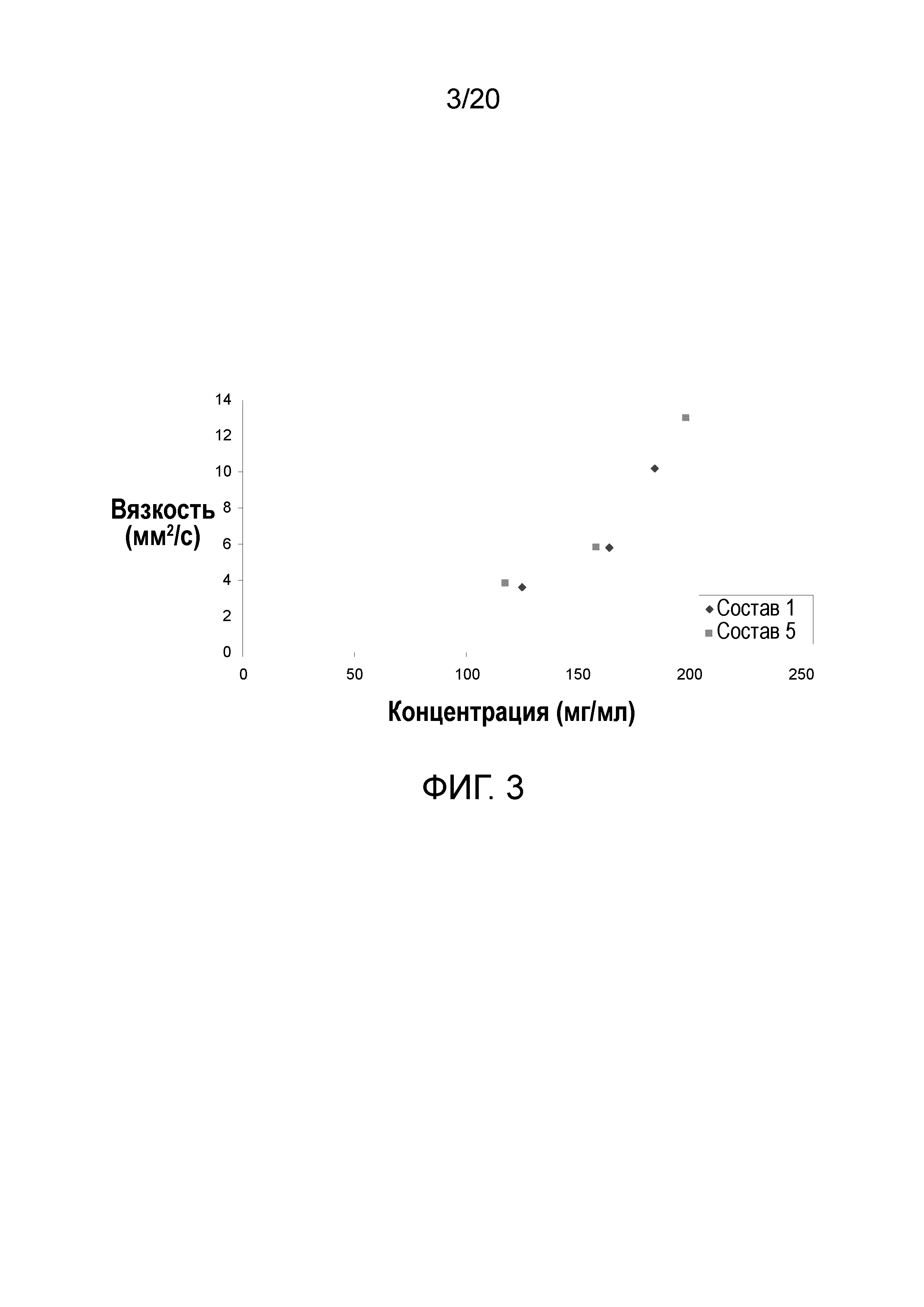
На фиг. 3 показана взаимосвязь вязкости и концентрации белимумаба.
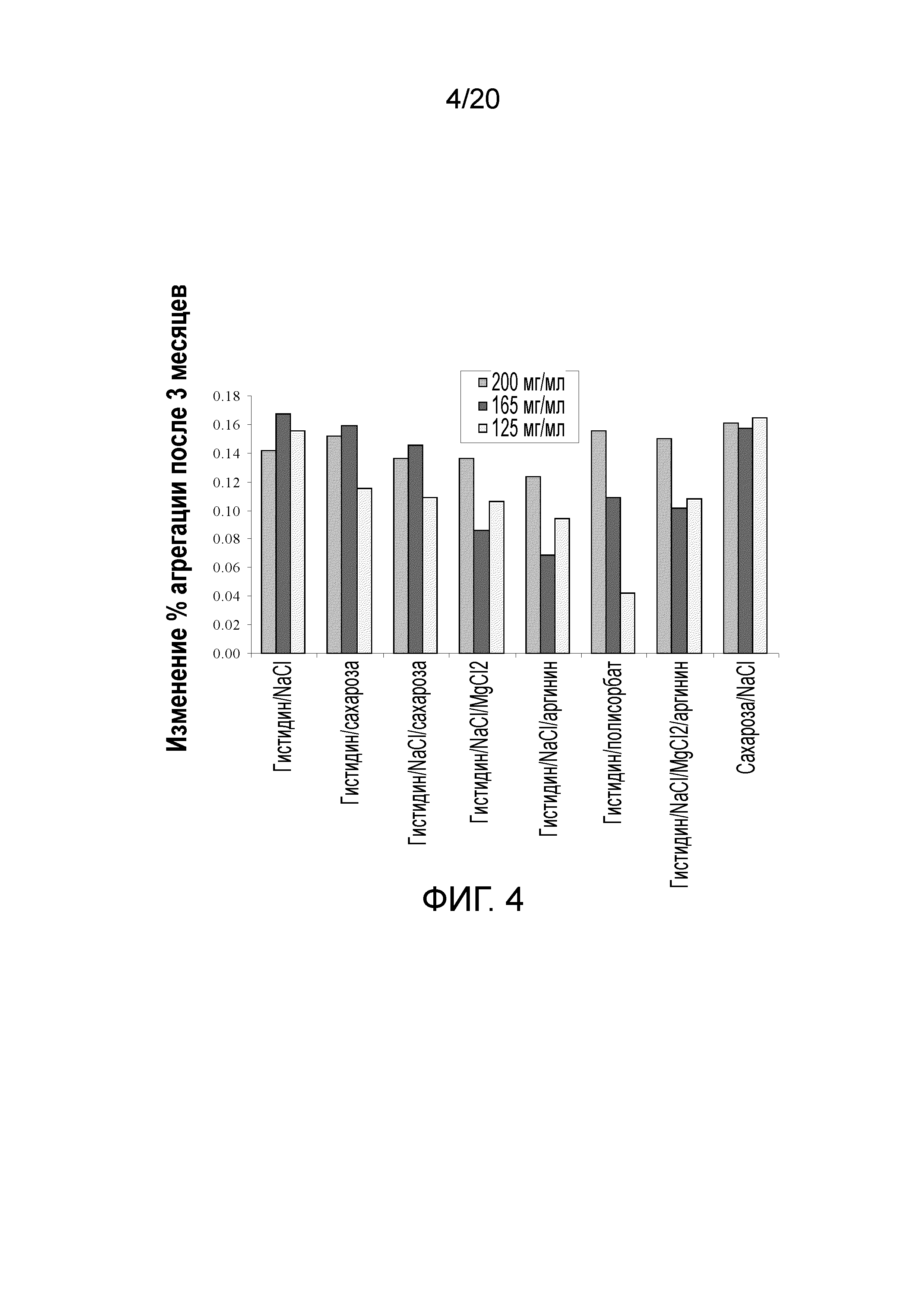
На фиг. 4 показано изменение % агрегатов после 3 месяцев хранения при 2-8°C для различных составов.
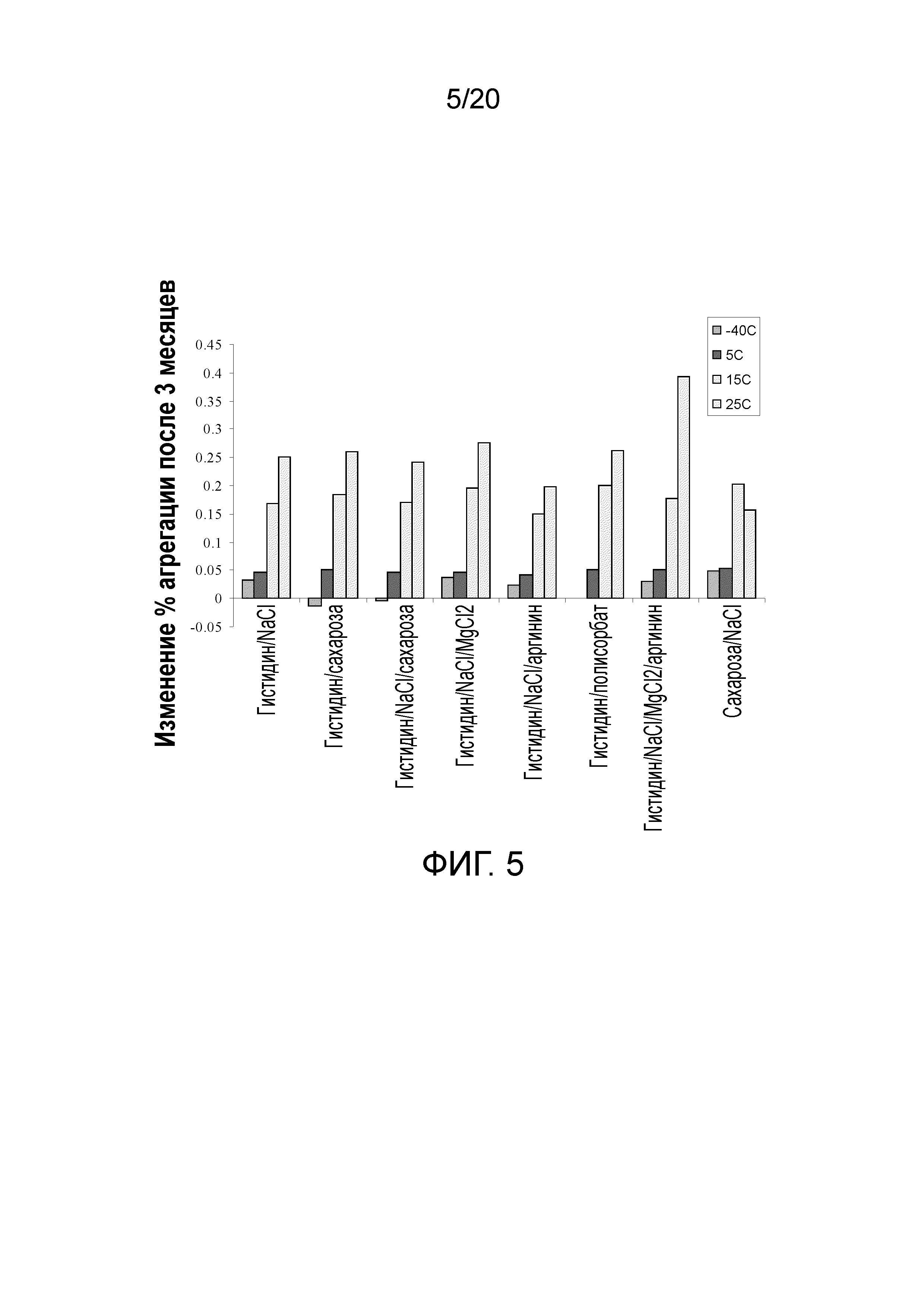
На фиг. 5 показано изменение % агрегатов после 3 месяцев хранения при различных температурах и составах.
На фиг. 6 показан эффект температуры в отношении скорости агрегации после 5¼ месяцев при температуре до 25°C и показано, что в аргининовом составе (незакрашенные квадраты на графике) агрегация значительно снижена по сравнению с составом 1 (закрашенные квадраты).
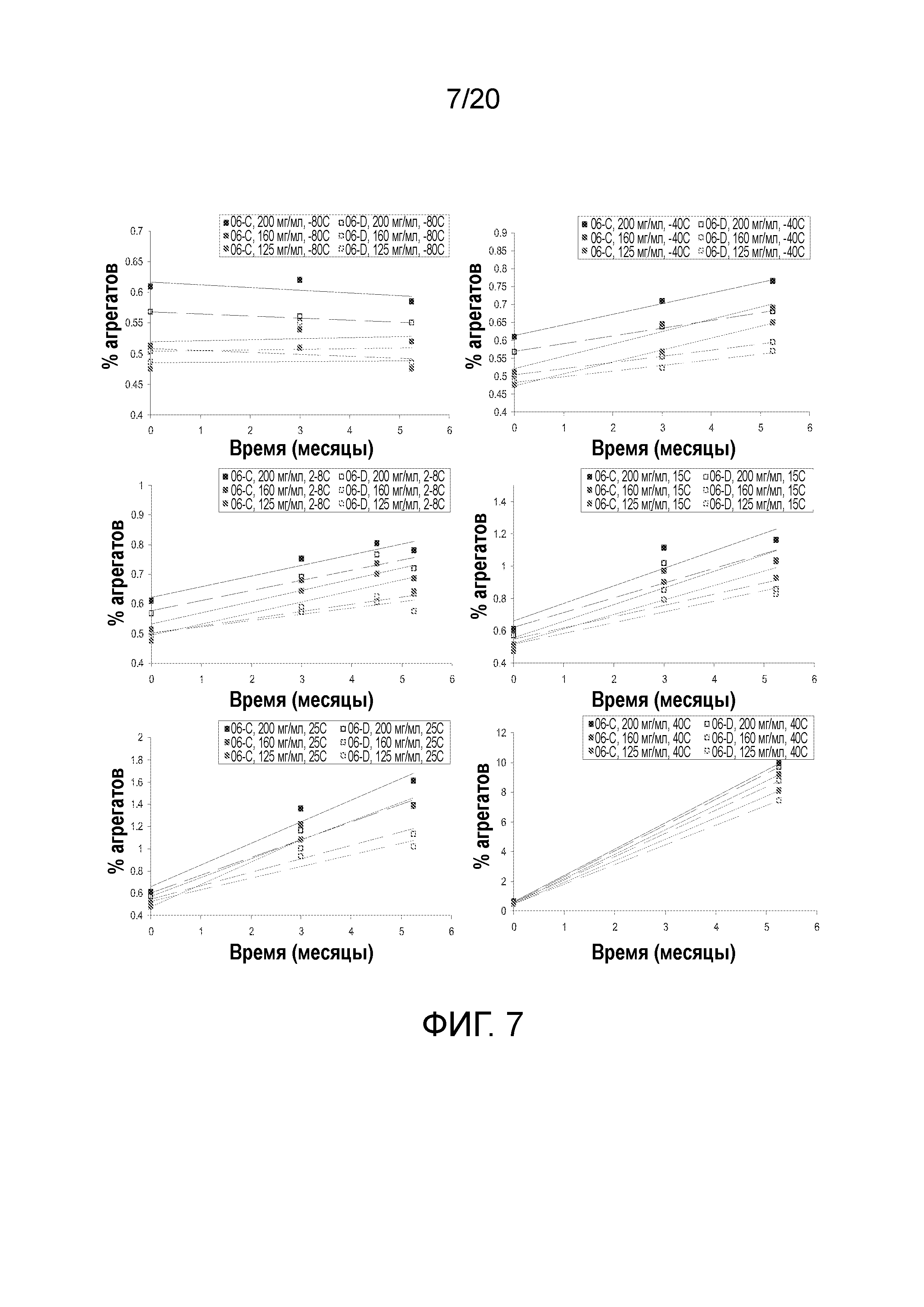
На фиг. 7 показаны скорости агрегации состава 1 (закрашенные квадраты; 06-C) и состава 5 (пустые квадраты; 06-D) при концентрации от 125 до 200 мг/мл и температуре от -80°C до 40°C после 5¼ месяцев хранения и то, как последовательно состав 5 (пунктирные линии) демонстрирует более низкую скорость агрегации, чем состав 1 (сплошные линии).
На фиг. 8 показано снижение скоростей деградации CGE составов 1 (06-C) и 5 (06-D) при концентрации от 125 до 200 мг/мл и температуре от -80°C до 40°C после 5¼ месяцев хранения.
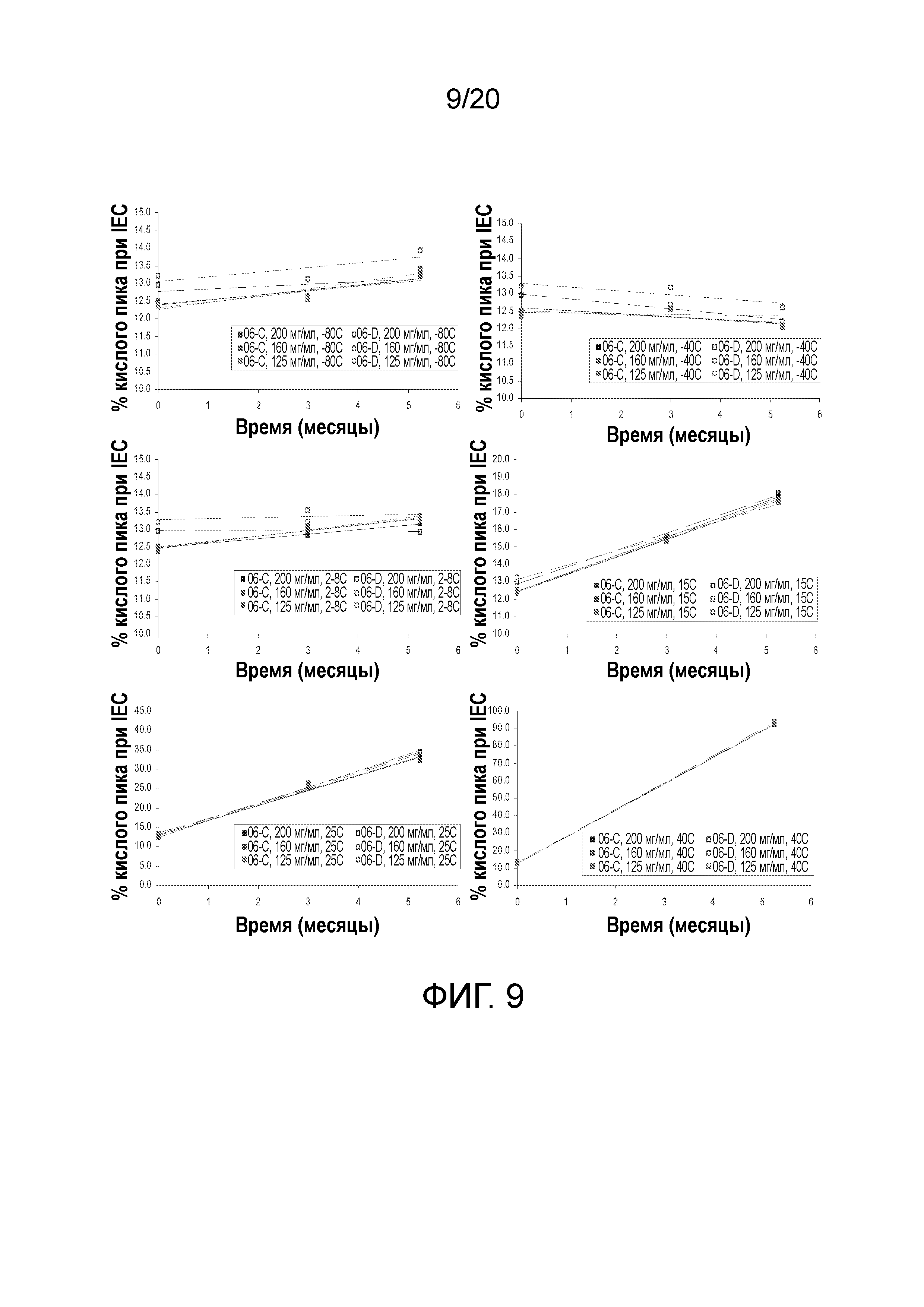
На фиг. 9 показаны скорости накопления кислых вариантов составов 1 (закрашенные квадраты; 06-C) и 5 (пустые квадраты; 06-D) при концентрации от 125 до 200 мг/мл и температуре от -80°C до 40°C после 5¼ месяцев хранения.
На фиг. 10 показаны уровни окисления тяжелой цепи белимумаба в составах 1 и 5 при концентрации от 125 до 200 мг/мл и температуре от -80°C до 40°C после 5¼ месяцев хранения.
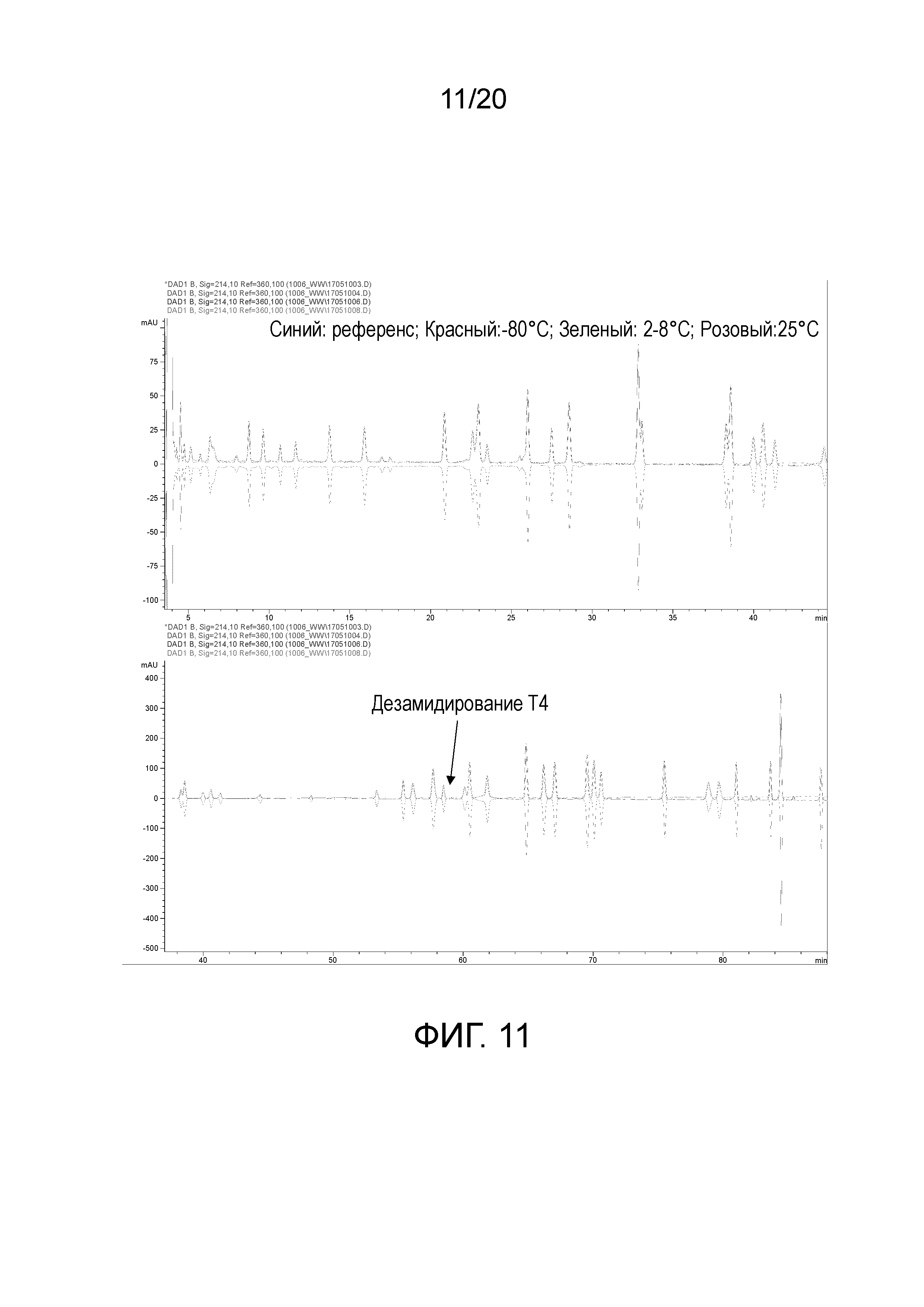
На фиг. 11 показана пептидная карта белимумаба в составе 1 при 200 мг/мл после 5¼ месяцев хранения.
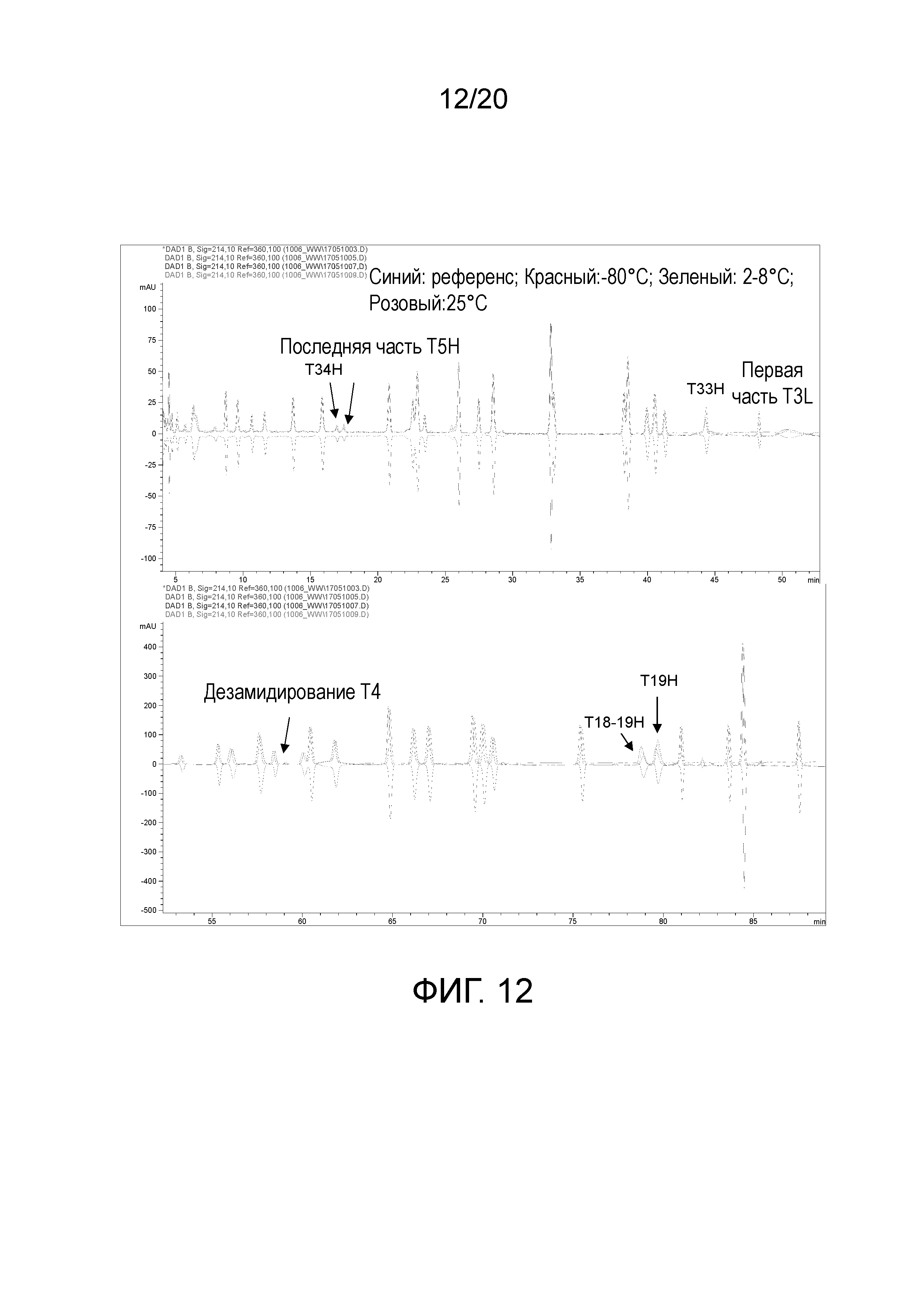
На фиг. 12 показана пептидная карта белимумаба в составе 5 при 200 мг/мл после 5¼ месяцев хранения.
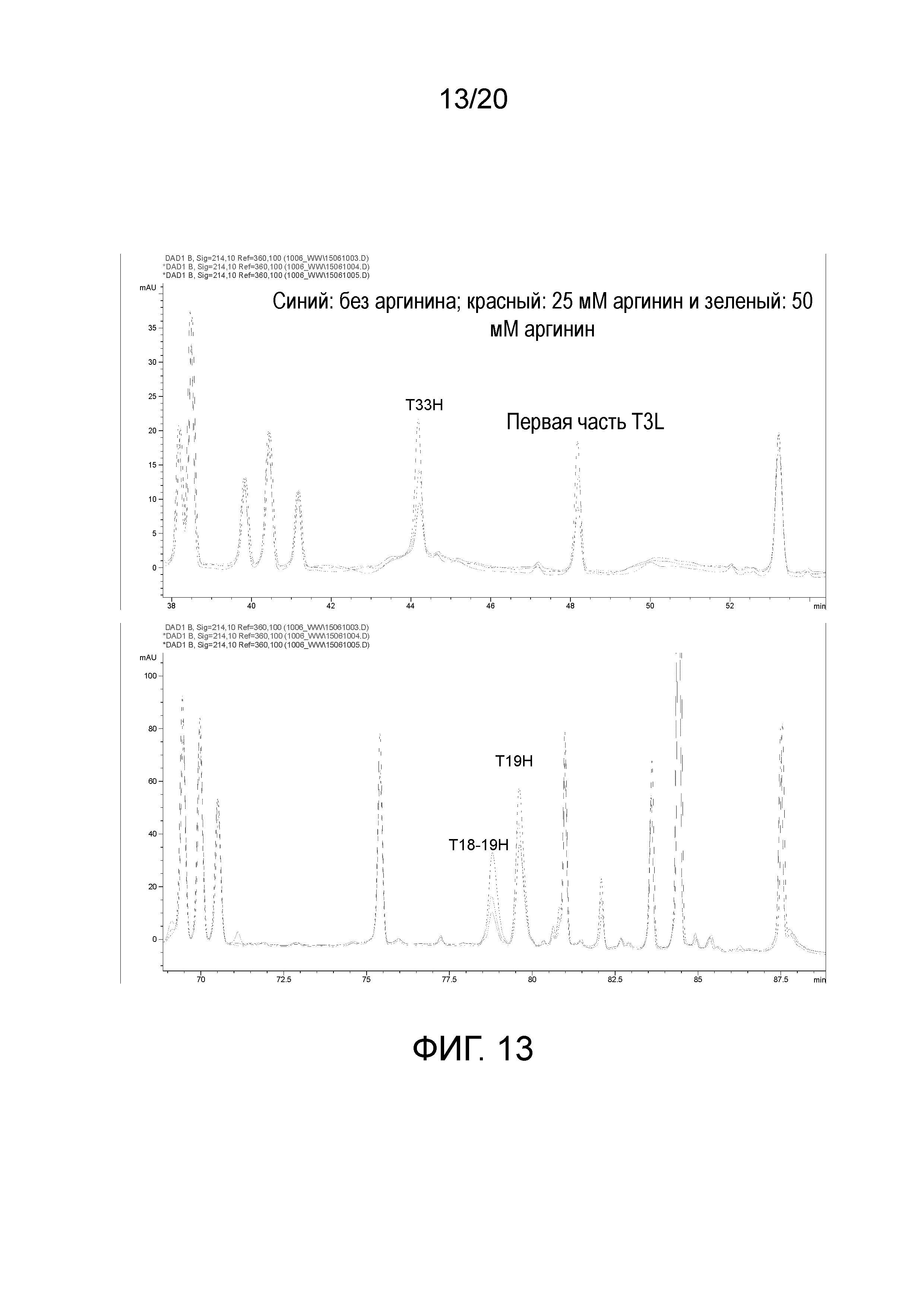
На фиг. 13 показана пептидная карта образцов белимумаба с различными уровнями аргинина.
На фиг. 14 показан скрининг HTF pH-буфера.
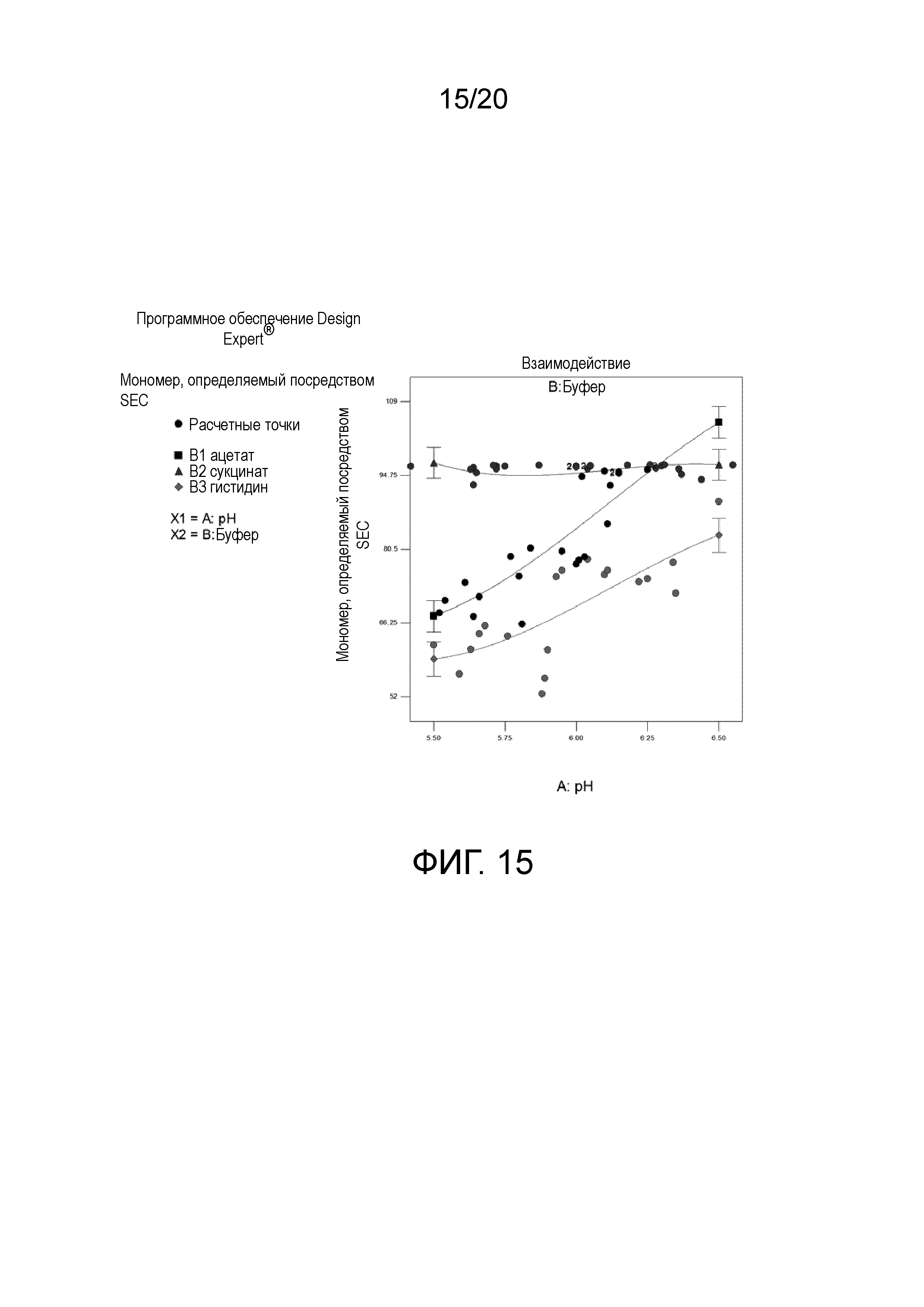
На фиг. 15 показано парное взаимодействие - pH × буфер - мономер при SEC.
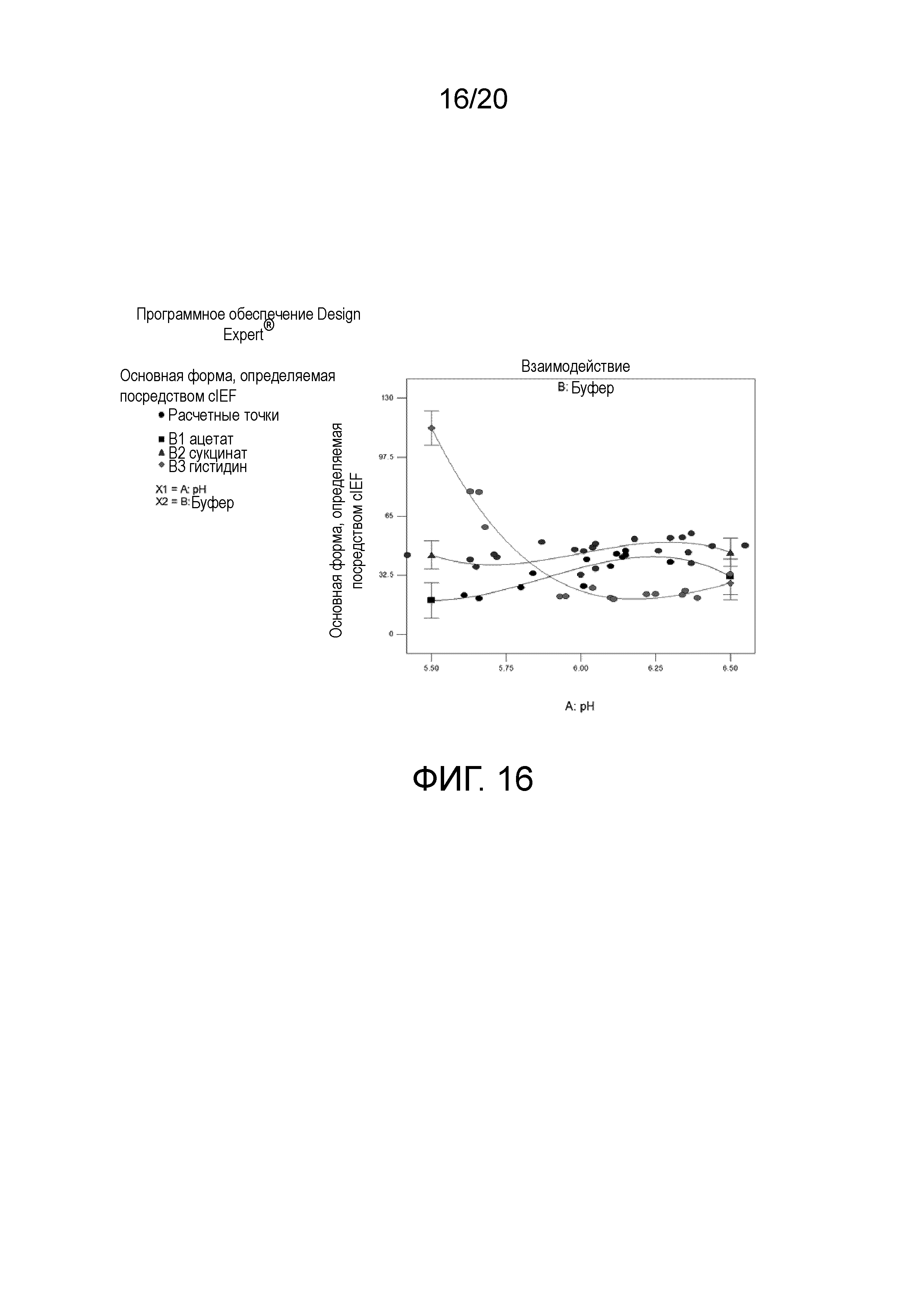
На фиг. 16 показано парное взаимодействие - pH × буфер - основная форма при cIEF.
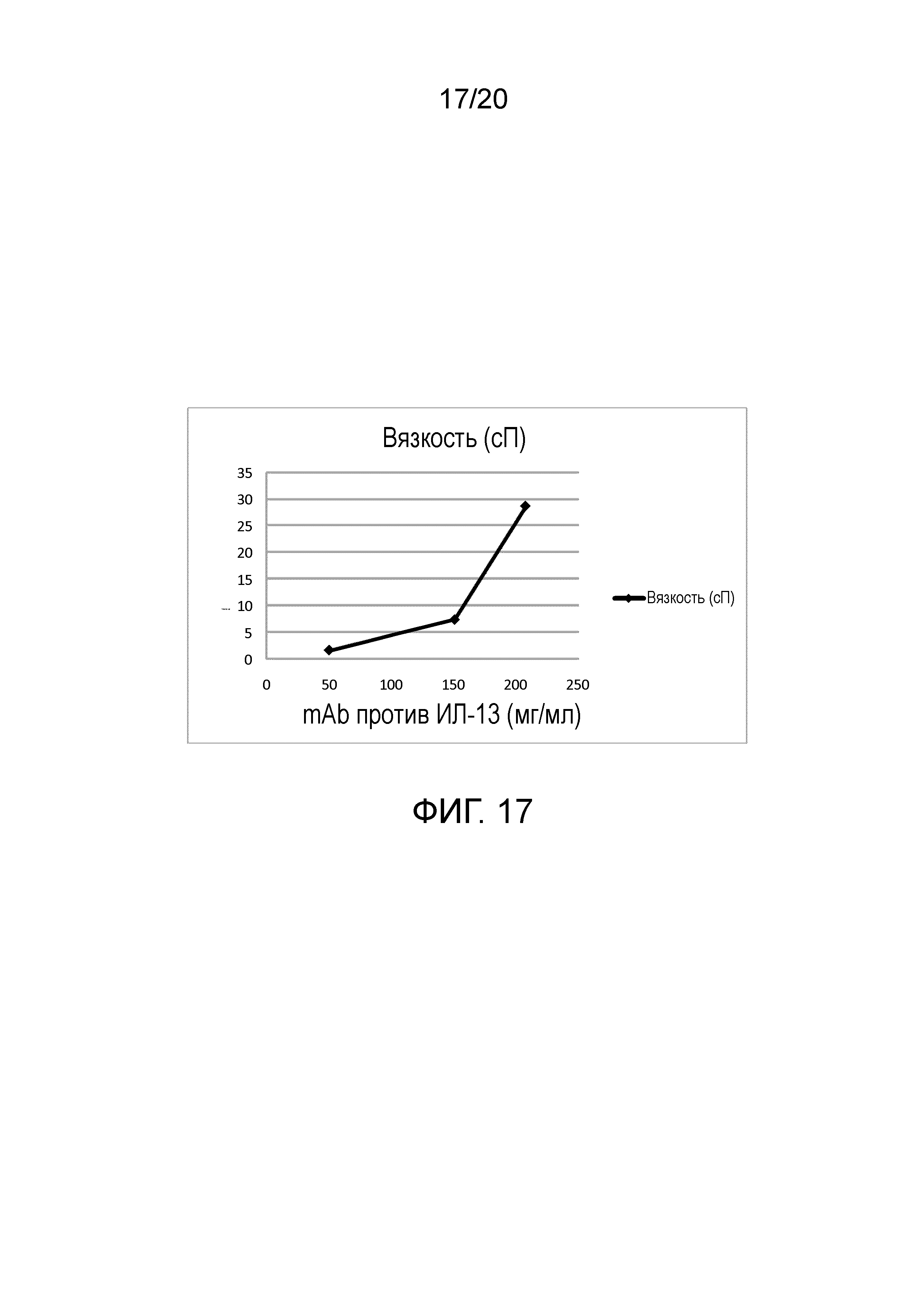
На фиг. 17 показана вязкость антитела против ИЛ-13 при различных концентрациях.
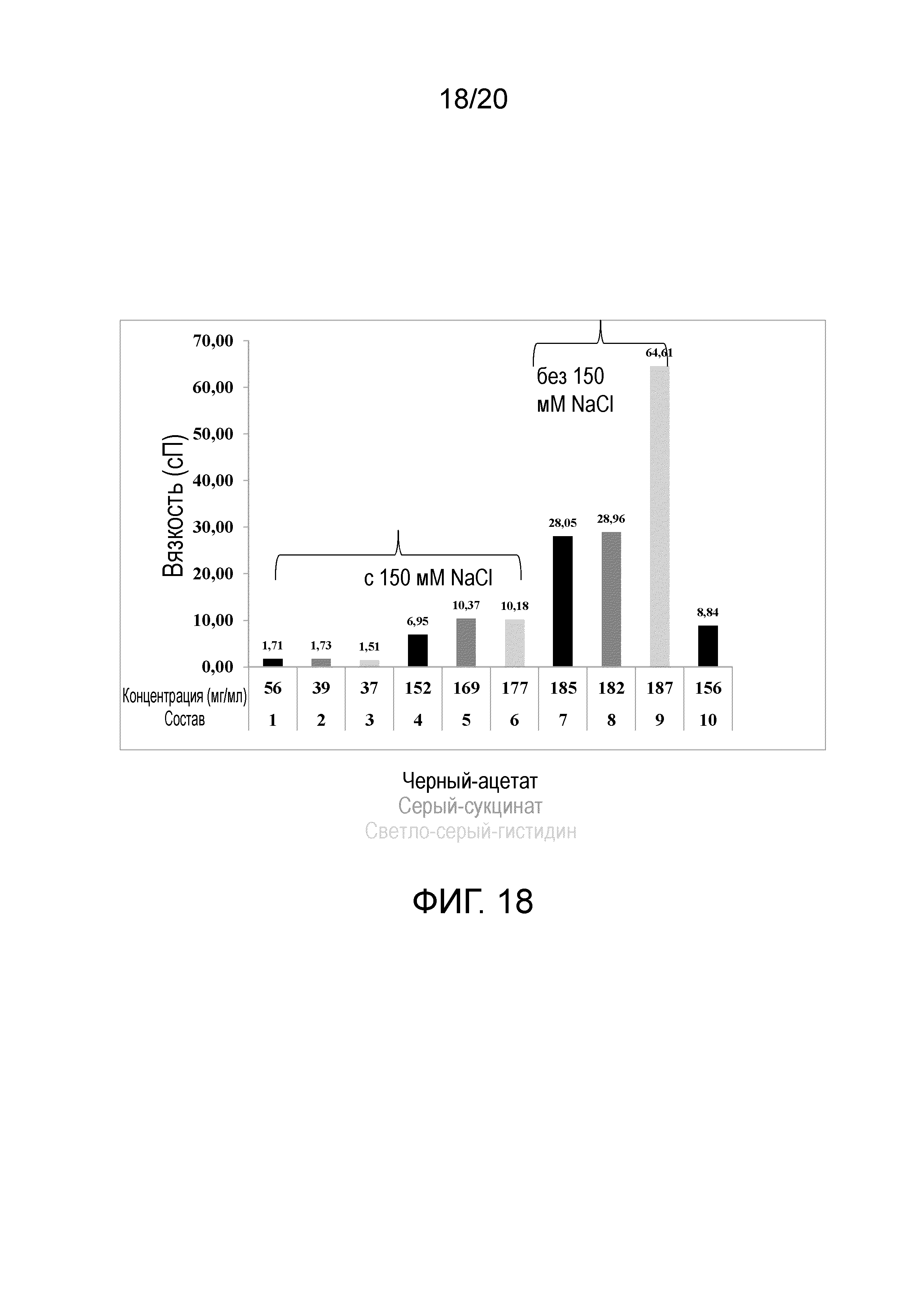
На фиг. 18 показаны результаты вязкости (сП) относительно концентрации (мг/мл) для образцов антитела против ИЛ-13 T=0 из исследования со встряхиванием.
На фиг. 19 показано, что 7-дневные образцы с ацетатом подвергались желатинизации (слева). Не наблюдали желатинизации в образцах с сукцинатом или гистидином (в центре и справа). Наблюдали, что 10-дневный образец с сукцинатом находился в полугелевом состоянии.
На фиг. 20 показано сравнение спектров кругового дихроизма в диапазоне УФ для 3-месячных образцов в исследовании химической стабильности.
Подробное описание изобретения
Следует понимать, что настоящее изобретение не ограничено конкретными способами, реагентами, соединениями, композициями или биологическими системами, которые, безусловно, могут варьироваться. Также следует понимать, что терминология, используемая в настоящем описании, предназначена для описания исключительно конкретных вариантов осуществления, а не для ограничения. Как применяют в настоящем описании и прилагаемой формуле изобретения, формы в единственном числе включают ссылки на формы во множественном числе, если контекст четко не указывает на иное. Таким образом, например, ссылка на "полипептид" включает комбинацию двух или более полипептидов и т.п.
Как применяют в настоящем описании, термин "приблизительно" при ссылке на измеряемое значение, такое как количество, длительность времени и т.п., предназначен для включения изменений ±20% или ±10%, включая ±5%, ±1% и ±0,1% от указанного значения, т.к. такие изменения являются приемлемыми для осуществления описываемых способов.
Если не указано иначе, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое общепринято понятно специалисту в области, к которой относится настоящее изобретения. Хотя в практическом осуществлении для тестирования настоящего изобретения можно использовать любые способы и материалы, аналогичные или эквивалентные представленным в настоящем описании, предпочтительные материалы и способы представлены в настоящем описании. В описании и формуле настоящего изобретения будут использовать следующую терминологию.
В одном из аспектов настоящее изобретение относится к фармацевтическому составу антигенсвязывающего белка, содержащему буферное средство и регулятор тоничности. В другом аспекте настоящее изобретение относится к фармацевтическому составу антигенсвязывающего белка, содержащему буферное средство, стабилизатор, регулятор тоничности и неионное поверхностно-активное вещество. В одном из вариантов осуществления состав лиофилизируют или сушат распылением. В определенных вариантах осуществления состав лиофилизируют или сушат распылением, а затем восстанавливают диспергирующим средством. В одном из вариантов осуществления диспергирующее средство является стерильной водой или "водой для инъекции" (WFI). Антигенсвязывающий белок можно дополнительно разводить изотоническим физиологическим раствором или другими эксципиентами для получения желаемой концентрации перед введением. В одном из вариантов осуществления состав является восстановленным составом. В другом варианте осуществления состав является жидким фармацевтическим составом.
Термин "фармацевтический состав" или "состав" относится к препарату, находящемуся в такой форме, которая позволяет биологической активности активного ингредиента быть эффективной, и не содержащему дополнительные компоненты, являющиеся неприемлемо токсичными для индивидуума, которому будут вводить состав. Такие составы являются стерильными.
"Стерильный" состав является асептическим или не содержит какие-либо живые микроорганизмы и их споры.
В иллюстративных вариантах осуществления настоящего изобретения жидкие составы проявляют желаемые характеристики, такие как желаемые характеристики вязкости и поверхностного натяжения.
Термин "поверхностное натяжение" относится к силе притяжения, проявляемой молекулами ниже поверхности в отношении молекул на границе раздела поверхность/воздух, являющейся результатом высокой молекулярной концентрации жидкости по сравнению с низкой молекулярной концентрацией газа. Жидкости с низкими значениями поверхностного натяжения, такие как неполярные жидкости, текущие легче, чем вода. Как правило, значения поверхностного натяжения выражают в ньютонах/метры или дины/сантиметры.
Как применяют в настоящем описании, "динамическое поверхностное натяжение" возникает на границе раздела поверхность/воздух и представляет собой динамическое межфазное натяжение по отношению к границе раздела поверхность/поверхность. Существует ряд альтернативных способов измерения динамического поверхностного натяжения, например, поверхностная тензиометрия "прилипшего пузырька" или поверхностная тензиометрия "пульсирующего газового пузыря".
Термин "вязкость" относится к внутреннему сопротивлению потоку, проявляемому жидкостью при определенной температуре; соотношению напряжения сдвига и коэффициента сдвига. Жидкость имеет вязкость в один пуаз, если сила в 1 дину/квадратный сантиметр заставляет две параллельные поверхности жидкости площадью один квадратный сантиметр и в один квадратный сантиметр друг от друга двигаться мимо друг друга со скоростью 1 см/секунду. Один пуаз равен одной сотне сантипуазов.
В одном из вариантов осуществления вязкость состава, содержащего буферное средство и стабилизатор, снижают по меньшей мере на приблизительно 5%, по меньшей мере на приблизительно 10%, по меньшей мере на приблизительно 15%, по меньшей мере на приблизительно 20%, по меньшей мере на приблизительно 25% или по меньшей мере на приблизительно 30% по сравнению с вязкостью состава в отсутствие буферного средства и стабилизатора. В одном из вариантов осуществления вязкость состава, содержащего буферное средство и стабилизатор, составляет менее приблизительно 50 сП, менее приблизительно 45 сП, менее приблизительно 40 сП, менее приблизительно 35 сП, менее приблизительно 30 сП, менее приблизительно 25 сП, менее приблизительно 20 сП, менее приблизительно 15 сП или менее приблизительно 10 сП.
Что касается эффективной вязкости, следует понимать, что значение вязкости зависит от условий, в которых проводят измерение, таких как используемая температура, коэффициент сдвига и напряжение сдвига. Эффективную вязкость определяют как соотношение напряжения сдвига и прилагаемого коэффициента сдвига. Существует ряд альтернативных способов измерения эффективной вязкости. Например, вязкость можно тестировать с помощью подходящего конического, плоскопараллельного или другого типа вискозиметра или реометра.
"Желатинизацию" определяют как процесс образования жесткой сети, по-видимому, вызываемый началом топологических перекрываний среди полимеризующихся MAb или филаментов, а также перекрестной сшивкой и образованием пучков этих филаментов. Эта жесткая сеть проявляется как модуль упругости раствора (G′), а также повышение его собственного модуля вязкости (G′′).
В одном из аспектов настоящее изобретение относится к способу снижения или ингибирования желатинизации раствора, включающему использованием состава по настоящему изобретению. В другом аспекте настоящее изобретение относится к способу снижения или ингибирования желатинизации раствора, содержащего терапевтический белок, включающему включение гистидина и хлорида натрия в раствор.
Термины "полипептид", "пептид" и "белок" в настоящем описании взаимозаменяемо используют в отношении полимера аминокислотных остатков. Полипептид может иметь природное (тканевое) происхождение, иметь рекомбинантную или природную экспрессию из прокариотических или эукариотических клеточных препаратов, или их получают химически синтетическими способами. Термины применимы к аминокислотным полимерам, в которых один или более аминокислотных остатков является искусственным химическим миметиком соответствующей природной аминокислоты, а также природным аминокислотным полимерам и неприродному аминокислотному полимеру. Аминокислотные миметики относятся к химическим соединениям, имеющим структуру, отличающуюся от общей химической структуры аминокислоты, но функционирующую аналогично природной аминокислоте. Неприродные остатки хорошо описаны в научной и патентной литературе; несколько примеров неприродных композиций, применимых в качестве миметиков природных аминокислотных остатков, и руководства описаны ниже. Миметики ароматических аминокислот можно получать, заменяя, например, D- или L-нафилаланин; D- или L-фенилглицин; D- или L-2-тиенилаланин; D- или L-1, -2,3-, или 4-пиренилаланин; D- или L-3-тиенилаланин; D- или L-(2-пиридинил)-аланин; D- или L-(3-пиридинил)-аланин; D- или L-(2-пиразинил)-аланин; D- или L-(4-изопропил)-фенилглицин: D-(трифторметил)-фенилглицин; D-(трифторметил)-фенилаланин: D-p-фтор-фенилаланин; D- или L-p-бифенилфенилаланин; K- или L-p-метокси-бифенилфенилаланин: D- или L-2-индол(алкил)аланины и D- или L-алкиламины, где алкил может являться замещенным или незамещенным метилом, этилом, пропилом, гексилом, бутилом, пентилом, изопропилом, изо-бутилом, втор-изобутилом, изо-пентилом или некислыми аминокислотами. Ароматические кольца неприродной аминокислоты включают, например, тиазолильные, тиофенильные, пиразолильные, бензимидазолильные, нафтильные, фуранильные, пирролильные и пиридильные ароматические кольца.
Как применяют в настоящем описании, термин "пептид" включает пептиды, являющиеся консервативными вариантами пептидов, примеры которых приведены в настоящем описании. Как применяют в настоящем описании, термин "консервативный вариант" означает замену аминокислотного остатка другим, биологически схожим остатком. Неограничивающие примеры консервативных вариантов включают замену одного гидрофобного остатка, такого как изолейцин, валин, лейцин, аланин, цистеин, глицин, фенилаланин, пролин, триптофан, тирозин, норлейцин или метионин, другим, или замену одного полярного остатка другим, такую как замена аргинина лизином, глутаминовой кислоты аспарагиновой кислотой или глутамина аспарагином и т.п. Нейтральные гидрофильные аминокислоты, которые можно заменять друг другом, включают аспарагин, глутамин, серин и треонин. "Консервативный вариант" также включает использование замещенной аминокислоты вместо незамещенной родительской аминокислоты, при условии, что антитела, индуцированные против замещенного полипептида, также иммунологически реагируют с незамещенным полипептидом. Такие консервативные замены входят в определение классов пептидов по изобретению. Биологическую активность пептидов можно определять стандартными способами, известными специалистам в этой области и представленными в настоящем описании.
При использовании в отношении белка термин "рекомбинантный" означает, что белок модифицируют посредством встраивания гетерологичной нуклеиновой кислоты или белка или изменения нативной нуклеиновой кислоты или белка.
Как применяют в настоящем описании, термин "терапевтический белок" относится к любому белку и/или полипептиду, который можно вводить млекопитающему для вызывания биологического или медицинского ответа ткани, системы, животного или человека, которого добивается, например, исследователь или клиницист. Терапевтический белок может вызывать несколько биологических или медицинских ответов. Кроме того, термин "терапевтически эффективное количество" означает любое количество, которое, при сравнении с соответствующим индивидуумом, которому не вводили такое количество, приводит, в качестве неограничивающих примеров, к выздоровлению, профилактике или улучшению заболевания, нарушения или побочного эффекта или снижению скорости прогрессирования заболевания или нарушения. Термин также включает количества, эффективные для повышения нормальной физиологической функции, а также количества, эффективные для вызывания физиологической функции у пациента, повышающие или способствующие терапевтическому эффекту второго фармацевтического средства.
Все "аминокислотные" остатки, определенные в настоящем описании, находятся в природной L-конфигурации. В следующей таблице сокращенные обозначения аминокислотных остатков представлены в соответствии со стандартной номенклатурой полипептидов.
Таблица 1. Сокращенные обозначения аминокислот.
Следует отметить, что все последовательности аминокислотных остатков представлены в настоящем описании формулой, чья ориентация слева направо является общепринятым направлением с амино-конца к карбоксильному концу.
В другом варианте осуществления полипептид является антигенсвязывающим белком. В одном из вариантов осуществления антигенсвязывающий белок выбран из группы, состоящей из растворимого рецептора, антитела, фрагмента антитела, отдельного вариабельного домена иммуноглобулина, Fab, F(ab')2, Fv, соединенного дисульфидными связями Fv, scFv, полиспецифического антитела с закрытой конформацией, соединенного дисульфидными связями scFv или диатела.
Как применяют в настоящем описании, термин "антигенсвязывающий белок" относится к антителам, фрагментам антител и другим белковым конструкциям, способным связываться с антигеном.
Термины Fv, Fc, Fd, Fab, или F(ab)2 используют в соответствии с их стандартными значениями (см., например, Harlow et al., Antibodies A Laboratory Manual, Cold Spring Harbor Laboratory, (1988)).
Термин "химерное антитело" относится к типу сконструированного антитела, содержащего природную вариабельную область (легкую цепь и тяжелые цепи), полученную из донорного антитела, связанную с константными областями легкой и тяжелой цепи, полученными из акцепторного антитела.
Термин "гуманизированное антитело" относится к типу сконструированного антитела, имеющего CDR, полученные из не принадлежащего человеку донорного иммуноглобулина, оставшиеся части молекулы, полученные из иммуноглобулина, получены из одного (или более) иммуноглобулина человека. Кроме того, для сохранения аффинности связывания можно изменять каркасные остатки (см., например, Queen et al., Proc. Natl. Acad Sci USA, 86:10029-10032 (1989), Hodgson et al., Bio/Technology, 9:421 (1991)). Подходящим акцепторным антителом человека может являться антитело, выбранное из общедоступной базы данных, например, базы данных KABAT™, базы данных Los Alamos и базы данных Swiss Protein, по гомологии нуклеотидных и аминокислотных последовательностей донорного антитела. Антитело человека, отличающееся гомологией с каркасными областями донорного антитела (с учетом аминокислот) может подходить для получения константной области тяжелой цепи и/или каркасной области вариабельной области тяжелой цепи для встраивания донорных CDR. Подходящее акцепторное антитело, способное являться донором каркасных областей константной или вариабельной области легкой цепи можно выбирать аналогичным образом. Следует отметить, что тяжелые и легкие цепи акцепторного антитела можно получать не из одного акцепторного антитела. На предшествующем уровне техники описывают несколько способов получения таких гуманизированных антител, см., например, EP-A-0239400 и EP-A-054951.
Термин "донорное антитело" относится к антителу (моноклональному и/или рекомбинантному), аминокислотные последовательности вариабельных областей, CDR или других его функциональных фрагментов или аналогов которого переносят в первого иммуноглобулинового партнера, чтобы, таким образом, получать измененную кодирующую область иммуноглобулина и получаемое экспрессирующееся измененное антитело с антигенной специфичностью и нейтрализующей активностью, характерной для донорного антитела.
Термин "акцепторное антитело" относится к антителу (моноклональному и/или рекомбинантному), гетерологичному донорному антителу, все (или любую часть, но в некоторых вариантах осуществления все) аминокислотные последовательности которого, кодирующие его каркасные области тяжелой и/или легкой цепи и/или константные области тяжелой и/или легкой цепи, переносят в первого иммуноглобулинового партнера. В определенных вариантах осуществления антитело человека является акцепторным антителом.
"CDR" определяют как аминокислотные последовательности определяющих комплементарность областей антитела, представляющие собой гипервариабельные области тяжелых и легких цепей иммуноглобулина. См., например, Kabat et al., Sequences of Proteins of Immunological Interest, 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987). Существует три CDR тяжелой цепи и три CDR легкой цепи (или области CDR) в вариабельной части иммуноглобулина. Таким образом, как применяют в настоящем описании, термин "CDR" относится ко всем трем CDR тяжелой цепи, или всем трем CDR легкой цепи (или всем CDR тяжелой и всем CDR легкой цепи, при необходимости). Структура и фолдинг белка антитела может означать, что другие остатки считают частью антигенсвязывающей области, и это будет понятно специалисту в этой области. См., например, Chothia et al., (1989) Conformations of immunoglobulin hypervariable regions; Nature 342, p 877-883.
Как применяют в настоящем описании, термин "домен" относится к свернутой структуре белка, имеющей третичную структуру, не зависящую от остальной части белка. Как правило, домены отвечают за отдельные функциональные свойства белков, и во многих случаях их можно добавлять, удалять или переносить в другие белки без утраты функции остальной части белка и/или домена. "Отдельный вариабельный домен антитела" является свернутым полипептидным доменом, содержащим последовательности, характерные для вариабельных доменов антитела. Таким образом, он включает полные вариабельные домены антитела и модифицированные вариабельные домены, например, в которых одну или более петель заменяют последовательностями, не характерными для вариабельных доменов антитела, или вариабельные домены антитела, являющиеся укороченными или содержащие N- или C-концевые удлинения, а также свернутые фрагменты вариабельных доменов, сохраняющие, по меньшей мере, связывающую активность и специфичность полноразмерного домена.
Фраза "отдельный вариабельный домен иммуноглобулина" относится к вариабельному домену антитела (VH, VHH, VL), специфически связывающемуся с антигеном или эпитопом независимо от другой области V или домена. Отдельный вариабельный домен иммуноглобулина может находиться в формате (например, гомо- или гетеромультимера) с другими, отличающимися вариабельными областями или вариабельными доменами, где другие области или домены не являются необходимыми для связывания антигена отдельным вариабельным доменом иммуноглобулина (т.е. где отдельный вариабельный домен иммуноглобулина связывается с антигеном независимо от дополнительных вариабельных доменов). Как применяют в настоящем описании, термин "доменное антитело" или "dAb" означает то же, что и "отдельный вариабельный домен иммуноглобулина", способный связываться с антигеном. Отдельный вариабельный домен иммуноглобулина может являться вариабельным доменом антитела человека, но также включает отдельные вариабельные домены антитела других видов, таких как VHH dAb грызуна (например, как описывают в WO 00/29004), акулы-няньки и Верблюжьих (нанотела). VHH Верблюжьих являются полипептидами отдельного вариабельного домена иммуноглобулина, полученными из видов, включающих верблюда, ламы, альпаку, дромадера и гуанако, продуцирующих тяжелую цепь антитела, в котором от природы отсутствуют легкие цепи. Такие домены VHH можно гуманизировать стандартными способами, доступными в этой области, и такие домены все равно рассматривают как "доменные антитела" по изобретению. Как применяют в настоящем описании, "VH" включает домены VHHВерблюжьих. NARV являются другим типом отдельного вариабельного домена иммуноглобулина, идентифицированного у хрящевых рыб, включая акулу-няньку. Эти домены также известны как вариабельная область нового рецептора антигена (общепринято сокращаемая как V(NAR) или NARV). Более подробно см. Mol. Immunol. 44, 656-665 (2006) и патентную заявку США № 2005/0043519 A.
Термин "эпитоп-связывающий домен" относится к домену, специфически связывающемуся с антигеном или эпитопом, независимо от другой области V или домена, он может являться доменным антителом (dAb), например, отдельным вариабельным доменом иммуноглобулина человека, верблюда или акулы.
Как применяют в настоящем описании, термин "антигенсвязывающий участок" относится к участку белка, способному специфически связываться с антигеном, он может являться отдельным доменом, например, эпитоп-связывающим доменом, или он может представлять собой спаренные домены VH/VL, как можно найти в общепринятом антителе. В некоторых аспектах по изобретению домены одноцепочечного Fv (ScFv) могут обеспечивать антигенсвязывающие участки.
Термины "mAbdAb" и dAbmAb" применяют в настоящем описании для обозначения антигенсвязывающих белков по настоящему изобретению. Два термина можно использовать взаимозаменяемо, и они предназначены для того, чтобы иметь то же значение, которое применяют в настоящем описании.
Фармацевтический состав по настоящему изобретению относится к приблизительно от 150 до 250 мг/мл антигенсвязывающего белка; приблизительно от 1 до 100 мМ буферного средства, обеспечивающего pH приблизительно от 5,0 до приблизительно 7,0; и приблизительно от 70 до 170 мМ регулятора тоничности. Альтернативно, фармацевтический состав по настоящему изобретению относится к приблизительно от 150 до 250 мг/мл антигенсвязывающего белка; приблизительно от 1 до 100 мМ буферного средства, обеспечивающего pH 6,0±0,5; приблизительно от 1 до 100 мМ стабилизатора; приблизительно от 90 до 150 мМ регулятора тоничности; и приблизительно от 0,005 до 0,015% (масс./об.) неионного поверхностно-активного вещества. В одном из вариантов осуществления антигенсвязывающий белок является антителом против BLyS.
Кроме того, описывают фармацевтический состав, содержащий приблизительно от 150 до 250 мг/мл антигенсвязывающего белка; приблизительно от 1 до 100 мМ гистидина при pH 6,0±0,5; приблизительно от 70 до 170 мМ NaCl. В одном из вариантов осуществления состав дополнительно содержит приблизительно от 0,005 до 0,03% (масс./об.) неионного поверхностно-активного вещества. В одном из вариантов осуществления состав дополнительно содержит от приблизительно 0,01 до приблизительно 0,1 мМ металлохелата. В одном из вариантов осуществления антигенсвязывающий белок является антителом против ИЛ-13.
Фармацевтический состав по настоящему изобретению можно получать в жидкой форме или в лиофилизированной форме.
фармацевтический состав по настоящему изобретению содержит буферное средство. Буферные средства включают, в качестве неограничивающих примеров, лимонную кислоту, HEPES, гистидин, ацетат калия, цитрат калия, фосфат калия (KH2PO4), ацетат натрия, бикарбонат натрия, цитрат натрия, фосфат натрия (NAH2PO4), Трис-основание и Трис-HCl. В одном из вариантов осуществления буферным средством является гистидин. В определенных вариантах осуществления концентрация гистидина составляет приблизительно 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 мМ. В одном из вариантов осуществления концентрация гистидина составляет 10±5 мМ. В одном из вариантов осуществления концентрация гистидина составляет 10±2 мМ. В одном из вариантов осуществления концентрация гистидина составляет приблизительно 10 мМ. В одном из вариантов осуществления концентрация гистидина составляет приблизительно 15 мМ.
Как применяют в настоящем описании, термин "буферное средство, обеспечивающее pH приблизительно от 5,0 до приблизительно 7,0" относится к средству, обеспечивающему то, что содержащий его раствор не поддается изменениям pH под действием его кислых/основных компонентов конъюгата. Буфер, используемый в составах по настоящему изобретению, может иметь pH в диапазоне от приблизительно 5,5 до приблизительно 6,5 или от приблизительно 5,8 до приблизительно 6,2. В одном из вариантов осуществления pH составляет приблизительно 6,0. В одном из вариантов осуществления pH составляет приблизительно 6,250. Примеры буферных средств, которые будут контролировать pH в этом диапазоне, включают ацетат, сукцинат, глюконат, гистидин, цитрат, глицилглицин и другие буферы органических кислот. Наиболее подходящим буфером по настоящему изобретению является гистидиновый буфер, такой как, например, L-гистидин.
"Гистидиновый буфер" является буфером, содержащим аминокислоту гистидин. Примеры гистидиновых буферов включают хлорид гистидина, ацетат гистидина, фосфат гистидина, сульфат гистидина. Составом гистидина, определенным в примерах как наиболее подходящий, является гистидиновый буфер, полученный из 0,65 мг/мл L-гистидина, 1,2 мг/мл моногидрохлорида L-гистидина.
Фармацевтический состав по настоящему изобретению содержит регулятор тоничности. Регуляторы тоничности включают, в качестве неограничивающих примеров, декстрозу, глицерин, маннит, хлорид калия и хлорид натрия. В одном из вариантов осуществления регулятором тоничности является хлорид натрия. В одном из вариантов осуществления концентрация хлорида натрия составляет приблизительно от 70 до 170 мМ; приблизительно 90-150 мМ; или приблизительно 115±10 мМ. В определенных вариантах осуществления концентрация хлорида натрия составляет приблизительно 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170 или 175 мМ. В одном из вариантов осуществления концентрация хлорида натрия составляет приблизительно 115 мМ. В другом варианте осуществления концентрация хлорида натрия составляет 150±10 мМ. В одном из вариантов осуществления концентрация хлорида натрия составляет приблизительно 150 мМ.
Термин "изотонический" означает, что состав имеет, по существу, то же осмотическое давление, что и кровь человека. Изотонические составы, как правило, будут иметь осмотическое давление приблизительно от 250 до 350 мОсм. Изотоничность можно измерять с использованием осмометра давления пара или по понижению точки замерзания.
В определенных вариантах осуществления фармацевтический состав по настоящему изобретению содержит стабилизатор. Стабилизаторы, включают, в качестве неограничивающих примеров, сывороточный альбумин человека (hsa), бычий сывороточный альбумин (bsa), α-казеин, глобулины, α-лактальбумин, LDH, лизоцим, миоглобин, овальбумин и РНКазу A. Стабилизаторы также включают аминокислоты и их метаболиты, такие как глицин, аланин (α-аланин, β-аланин), аргинин, бетаин, лейцин, лизин, глутаминовая кислота, аспарагиновая кислота, пролин, 4-гидроксипролин, саркозин, γ-аминомасляная кислота (ГАМК), опины (аланопин, октопин, стромбин) и триметиламин-N-оксид (TMAO). В одном из вариантов осуществления стабилизатором является аминокислота. В одном из вариантов осуществления аминокислотой является аргинин. В одном из вариантов осуществления концентрация аргинина составляет приблизительно от 20 до 30 мМ. В одном из вариантов осуществления концентрация аргинина составляет приблизительно 25±2 мМ.
В определенных вариантах осуществления фармацевтический состав по настоящему изобретению содержит неионное поверхностно-активное вещество. Неионные поверхностно-активные вещества включают, в качестве неограничивающих примеров, сложные эфиры полиоксиэтиленсорбитана и жирных кислот (такие как полисорбат 20 и полисорбат 80), сополимеры полиэтилена-полипропилена, полиэтилен-полипропиленгликоли, полиоксиэтилен-стеараты, алкиловые простые эфиры полиоксиэтилена, например, монолауриловый простой эфир полиоксиэтилена, простые эфиры алкилфенилполиоксиэтилена (Triton-X), coполимер полиоксиэтилена-полиоксипропилена (полоксамер, плюроник), додецилсульфат натрия (SDS). В одном из вариантов осуществления неионным поверхностно-активным веществом является полисорбат 80. В одном из вариантов осуществления концентрация полисорбата 80 составляет приблизительно от 0,005 до 0,02% (масс./об.). В одном из вариантов осуществления концентрация полисорбата 80 составляет приблизительно 0,01% (масс./об.). В одном из вариантов осуществления концентрация полисорбата 80 составляет приблизительно 0,02% (масс./об.).
В определенных вариантах осуществления фармацевтический состав по настоящему изобретению содержит металлохелат. Металлохелаты включают, в качестве неограничивающих примеров, ЭДТА и EGTA. В одном из вариантов осуществления металлохелатом является ЭДТА. В одном из вариантов осуществления концентрация ЭДТА составляет приблизительно от 0,01 до приблизительно 0,02 мМ. В одном из вариантов осуществления концентрация ЭДТА составляет приблизительно 0,05 мМ.
В одном из вариантов осуществления антигенсвязывающим белком является моноклональное антитело или его фрагмент. В одном из вариантов осуществления моноклональное антитело или его фрагмент являются мышиным, химерным, гуманизированным или полностью человеческим. В одном из вариантов осуществления моноклональное антитело или его фрагмент связывается с BLys или ИЛ-13.
В одном из аспектов состав содержит антигенсвязывающий белок, гистидин, аргинин, NaCl и полисорбат 80. В другом аспекте состав содержит приблизительно 200 мг/мл антигенсвязывающего белка, приблизительно 10 мМ гистидин, приблизительно 25 мМ аргинин, приблизительно 115 мМ NaCl и приблизительно 0,01% полисорбата 80, при pH приблизительно 6,0. В одном из вариантов осуществления антигенсвязывающий белок связывается с BLys.
В одном из вариантов осуществления фармацевтический состав по настоящему изобретению относится к приблизительно 200 мг/мл антигенсвязывающего белка; приблизительно 15 мМ гистидину при pH приблизительно 6,25; приблизительно 150 мМ NaCl; приблизительно 0,02% (масс./об.) полисорбата 80 и приблизительно 0,05 мМ ЭДТА. В одном из вариантов осуществления антигенсвязывающий белок связывается с ИЛ-13.
В одном из аспектов фармацевтический состав по настоящему изобретению является стабильным после замораживания и размораживания. "Стабильный" состав является составом, в котором весь белок, по существу, сохраняет свою физическую стабильность, и/или химическую стабильность, и/или биологическую активность после хранения при предполагаемой температуре хранения, например 2-8°C. Желательно, чтобы состав, по существу, сохранял свою физическую и химическую стабильность, а также свою биологическую активность после хранения. Период хранения выбирают, как правило, с учетом предполагаемого срока годности состава. Кроме того, состав должен быть стабильными после замораживания (например, до -70°C) и размораживания состава, например, после 1, 2 или 3 циклов замораживания и размораживания. В этой области доступны различные аналитические способы измерения стабильности белка, и их обзор можно найти, например, в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991) и Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993). Стабильность можно измерять при выбранной температуре в течение выбранного периода времени. Стабильность можно оценивать качественно и/или количественно множеством различных способов, включая оценку образования агрегатов (например, с использованием эксклюзионной хроматографии, посредством измерения мутности и/или посредством визуального осмотра); оценку гетерогенности заряда с использованием катионообменной хроматографии или капиллярного зонного электрофореза; анализ амино-концевой или карбокси-концевой последовательности; масс-спектрометрический анализ; анализ электрофореза в ПААГ в присутствие SDS для сравнения восстановленного и интактного антитела; анализ пептидной карты (например, триптической или LYS-C); оценку биологической активности или антигенсвязывающей функции антитела и т.д.
В одном из вариантов осуществления фармацевтический состав по настоящему изобретению подходит для подкожного или внутримышечного введения.
"Процент идентичности" между поисковой аминокислотной последовательностью и исследуемой аминокислотной последовательностью представляет собой значение "идентичности", выражаемое в виде процентной доли, вычисляемой с помощью алгоритма BLASTP, когда исследуемая аминокислотная последовательность имеет 100% покрытие относительно поисковой аминокислотной последовательности после попарного выравнивания с помощью BLASTP. Такие попарные выравнивания с помощью BLASTP между поисковой аминокислотной последовательностью и исследуемой аминокислотной последовательностью осуществляют с использованием параметров по умолчанию алгоритма BLASTP, доступного на веб-сайте National Center for Biotechnology Institute, с отключенным фильтром для областей низкой сложности. Важно, что поисковую аминокислотную последовательность можно описывать с помощью аминокислотной последовательности, определенной в одном или более пунктах формулы изобретения в настоящем описании.
Поисковая последовательность может являться на 100% идентичной исследуемой последовательности или она может включать до целого числа изменений аминокислот по сравнению с исследуемой последовательностью таким образом, что % идентичности составляет менее 100%. Например, поисковая последовательность является по меньшей мере на 50, 60, 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентичной исследуемой последовательности. Такие изменения включают по меньшей мере одну делецию, замену (включая консервативную и неконсервативную замену) или инсерцию аминокислот, и где указанные изменения могут находиться в амино- или карбокси-концевых положениях поисковой последовательности или где-либо между этими концевыми положениями, рассеянными отдельно среди аминокислот в поисковой последовательности или в одной или более смежных групп в поисковой последовательности.
% идентичности можно определять по всей длине поисковой последовательности, включая CDR. Альтернативно, % идентичности может исключать CDR, например, CDR являются на 100% идентичными по отношению к исследуемой последовательности, и изменение % идентичности относится к остальной части поисковой последовательности, таким образом, что последовательность CDR является фиксированной/интактной.
В одном из вариантов осуществления антигенсвязывающим белком является моноклональное антитело или его фрагмент. В одном из вариантов осуществления моноклональное антитело или его фрагмент являются мышиным, химерным, гуманизированным или полностью человеческим. В одном из вариантов осуществления моноклональное антитело или его фрагмент связывается с BLyS (SEQ ID NO: 1) или гетеро- или гомотримерной формой BLyS, например, моноклональное антитело или его фрагмент связывается с растворимой формой BLys (SEQ ID NO: 10). В одном из вариантов осуществления моноклональное антитело содержит вариабельные области тяжелой и легкой цепи, содержащие последовательность, являющуюся на 90% идентичной, или на 91% идентичной, или на 92% идентичной, или на 93% идентичной, или на 94% идентичной, или на 95% идентичной, или на 96% идентичной, или на 97% идентичной, или на 98% идентичной, или на 99% идентичной по отношению к SEQ ID NO: 2 и на 90% идентичной, или на 91% идентичной, или на 92% идентичной, или на 93% идентичной, или на 94% идентичной, или на 95% идентичной, или на 96% идентичной, или на 97% идентичной, или на 98% идентичной, или на 99% идентичной по отношению к SEQ ID NO: 3, соответственно, или последовательность, являющуюся на 90% идентичной, или на 91% идентичной, или на 92% идентичной, или на 93% идентичной, или на 94% идентичной, или на 95% идентичной, или на 96% идентичной, или на 97% идентичной, или на 98% идентичной, или на 99% идентичной по отношению к SEQ ID NO: 4, и на 90% идентичной, или на 91% идентичной, или на 92% идентичной, или на 93% идентичной, или на 94% идентичной, или на 95% идентичной, или на 96% идентичной, или на 97% идентичной, или на 98% идентичной, или на 99% идентичной по отношению к SEQ ID NO: 5, соответственно. В одном из вариантов осуществления моноклональное антитело содержит вариабельные области тяжелой и легкой цепи, содержащие последовательность, являющуюся на 95% идентичной по отношению к SEQ ID NO: 2 и 3, соответственно, или последовательность, являющуюся на 95% идентичной по отношению к SEQ ID NO: 4 и 5, соответственно. В одном из вариантов осуществления моноклональное антитело содержит вариабельные области тяжелой и легкой цепи, содержащие последовательность, являющуюся на 90% идентичной по отношению к SEQ ID NO: 2 и 3, соответственно, или последовательность, являющуюся на 90% идентичной по отношению к SEQ ID NO: 4 и 5, соответственно. В одном из вариантов осуществления моноклональное антитело содержит вариабельные области тяжелой и легкой цепи, содержащие SEQ ID NO: 2 и 3, соответственно, или SEQ ID NO: 4 и 5, соответственно. В одном из вариантов осуществления моноклональное антитело содержит тяжелые и легкие цепи, содержащие последовательность, являющуюся на 90% идентичной, или на 91% идентичной, или на 92% идентичной, или на 93% идентичной, или на 94% идентичной, или на 95% идентичной, или на 96% идентичной, или на 97% идентичной, или на 98% идентичной, или на 99% идентичной по отношению к SEQ ID NO: 6, и на 90% идентичной, или на 91% идентичной, или на 92% идентичной, или на 93% идентичной, или на 94% идентичной, или на 95% идентичной, или на 96% идентичной, или на 97% идентичной, или на 98% идентичной, или на 99% идентичной по отношению к SEQ ID NO: 7, соответственно, или последовательность, являющуюся на 90% идентичной, или на 91% идентичной, или на 92% идентичной, или на 93% идентичной, или на 94% идентичной, или на 95% идентичной, или на 96% идентичной, или на 97% идентичной, или на 98% идентичной, или на 99% идентичной по отношению к SEQ ID NO: 8, и на 90% идентичной, или на 91% идентичной, или на 92% идентичной, или на 93% идентичной, или на 94% идентичной, или на 95% идентичной, или на 96% идентичной, или на 97% идентичной, или на 98% идентичной, или на 99% идентичной по отношению к SEQ ID NO: 9, соответственно. В одном из вариантов осуществления моноклональное антитело содержит тяжелые и легкие цепи, содержащие последовательность, являющуюся на 95% идентичной по отношению к SEQ ID NO: 6 и 7, соответственно, или последовательность, являющуюся на 95% идентичной по отношению к SEQ ID NO: 8 и 9, соответственно. В одном из вариантов осуществления моноклональное антитело содержит тяжелые и легкие цепи, содержащие последовательность, являющуюся на 90% идентичной по отношению к SEQ ID NO: 6 и 7, соответственно, или последовательность, являющуюся на 90% идентичной по отношению к SEQ ID NO: 8 и 9, соответственно. В одном из вариантов осуществления моноклональное антитело содержит тяжелые и легкие цепи, содержащие SEQ ID NO: 6 и 7, соответственно, или SEQ ID NO: 8 и 9, соответственно. В одном из вариантов осуществления антитело против BLyS выбрано из группы белимумаба, табалумаба и их смеси. В одном из вариантов осуществления антитело против BLyS содержит последовательности тяжелой и легкой цепи, приведенные в SEQ ID NO: 6 и 7.
В одном из вариантов осуществления фармацевтический состав по настоящему изобретению имеет концентрацию моноклонального антитела 200±20 мг/мл. В одном из вариантов осуществления концентрация антитела составляет приблизительно 200 мг/мл. В одном из вариантов осуществления антитело против BLyS вводят совместно одновременно или последовательно с кортикостероидом. В одном из вариантов осуществления кортикостероид выбран из группы, состоящей из преднизона, преднизолона, гидрокортизона, метилпреднизолона и дексаметазона. В одном из вариантов осуществления кортикостероидом является преднизон.
В одном из аспектов настоящее изобретение относится к фармацевтическому составу по любому из предшествующих пп. для лечения заболевания или нарушения, поддающегося лечению антителом против BLyS. В одном из вариантов осуществления настоящее изобретение относится к способу лечения заболевания или состояния, поддающегося лечению антителом против BLyS, у индивидуума, включающему введение индивидууму состава по настоящему изобретению в количестве, эффективном для лечения заболевание или состояния. В одном из вариантов осуществления заболевание или состояние выбрано из группы, состоящей из системной красной волчанки, васкулита, ассоциированного с антинейтрофильными цитоплазматическими антителами ("ANCA"), волчаночного нефрита, первичного синдрома Шегрена, хронической иммунной тромбоцитопении, миастении, симптоматической макроглобулинемии Вальденстрема, иммунной десенсибилизации у пациентов, ожидающих трансплантации почки, мембранозной нефропатии, системного склероза, ревматоидного артрита, множественной миеломы, рассеянного склероза и почечной недостаточности. В другом аспекте настоящее изобретение относится к составу для применения в лечении заболевания, выбранного из группы, состоящей из системной красной волчанки, васкулита, ассоциированного с антинейтрофильными цитоплазматическими антителами ("ANCA"), волчаночного нефрита, первичного синдрома Шегрена, хронической иммунной тромбоцитопении, миастении, симптоматической макроглобулинемии Вальденстрема, иммунной десенсибилизации у пациентов, ожидающих трансплантации почки, мембранозной нефропатии, системного склероза, ревматоидного артрита, множественной миеломы, рассеянного склероза и почечной недостаточности.
В одном из аспектов настоящее изобретение относится к набору, содержащему один или более сосудов, содержащих состав по настоящему изобретению и инструкции для подкожного введения состава пациенту. В одном из вариантов осуществления набор дополнительно содержит инъекционное устройство для подкожного введения состава пациенту.
В одном из вариантов осуществления настоящее изобретение относится к инъекционному устройству, содержащему стабильный состав антитела против BLyS по любому из предшествующих пп. В случае подкожной доставки состав можно вводить с помощью подходящего устройства, такого как (в качестве неограничивающих примеров) шприц; инъекционное устройство (например, устройство INJECT-EASE™ и GENJECT™); инфузионный насос (такой как, например Accu-Chek™); шприц-ручка (такая как GENPEN™); или безыгольное устройство (например, MEDDECTOR™ и BIOJECTOR™).
Фармацевтический состав по настоящему изобретению, по существу, не содержит видимые (человеческим глазом) частицы. Невидимые частицы (измеряемые способом затенения) должны удовлетворять следующим критериям: максимальное количество частиц≥10 мкм на сосуд->6000; максимальное количество частиц≥25 мкм на сосуд->600.
Фармацевтический состав фармацевтически активного антитела против BLyS по настоящему изобретению можно вводить с помощью подкожной инъекции, при этом введение повторяют несколько раз с временными интервалами 1, 2, 3 или 4 недель. В одном из вариантов осуществления фармацевтический состав фармацевтически активного антитела против BLyS вводят раз в неделю или раз в две недели. Полный объем инъецируемой жидкости в большинстве случаев вводят в течение периода времени от 1 до 10 минут, предпочтительно - от 2 до 6 минут, наиболее предпочтительно - 3±1 минуты.
В случае профилактики или лечения заболевания соответствующая дозировка антитела будет зависеть от типа заболевания, подлежащего лечению, как определено выше, тяжести и течения заболевания, вводят ли антитело в профилактических или терапевтических целях, предшествующей терапии, анамнеза пациента и его ответа на антитело и решения лечащего врача. Антитело соответствующим образом вводят пациенту за один раз или в виде серии введений. В зависимости от типа и тяжести заболевания приблизительно от 1 мкг/кг до 50 мг/кг массы тела, или более конкретно - приблизительно от 0,1 мг/кг до 20 мг/кг массы тела) антитела является предполагаемой исходной дозой для введения пациенту в виде, например, одного или более отдельных введений или посредством непрерывной инфузии. Более конкретно, доза антитела будет находиться в диапазоне от приблизительно 0,05 мг антитела/кг массы тела до приблизительно 10 мг антитела/кг массы тела.
Другой вариант осуществления изобретения относится к промышленному изделию, содержащему фармацевтический состав по настоящему изобретению и инструкции по его применению. Это промышленное изделие содержит контейнер. Подходящие контейнеры включают, например, бутыли, сосуды (например, много- или двухкамерные сосуды), шприцы (такие как, много- или двухкамерные шприцы) и пробирки. Контейнер можно получать из множества материалов, таких как стекло или пластик. Контейнер содержит состав и ярлык, находящийся на нем или связанный с ним, на контейнере можно указывать руководство по использованию. Контейнер, содержащий состав, может являться сосудом для многократного использования, делающим возможным повторные введения (например, от 2 до 6 введений) восстановленного состава. Промышленное изделие может дополнительно включать другие материалы, желаемые с коммерческой точки зрения и точки зрения пользователя, включая другие буферы, дилюенты, фильтры, иглы, шприцы и вкладыши в упаковку с инструкциями по применению.
Антитело, составляемое по настоящему изобретению, предпочтительно является, по существу, чистым и, желательно, по существу, гомогенным. Термин "по существу, чистое" антитело означает композицию, содержащую по меньшей мере приблизительно 90% по массе антитела с учетом общей массы композиции, предпочтительно - по меньшей мере приблизительно 95% по массе. Термин "по существу, гомогенное" антитело означает композицию, содержащую по меньшей мере приблизительно 99% по массе антитела с учетом общей массы композиции.
Настоящее изобретение будет более понятным с учетом следующих примеров. Однако их не следует истолковывать в качестве ограничений объема изобретения. Все литературные и патентные источники включены в настоящее описание в качестве ссылок.
Примеры дополнительно проиллюстрированы прилагаемыми фигурами 1-20.
Примеры
Пример 1: Составы белимумаба
Закрытие контейнера
Во всех исследованиях, если не указано иначе, использовали сосуды Schott типа I с пробками Daikyo D21-7S Flurotec® и отламывающимися алюминиевыми крышками. Эту комбинацию сосуда и пробки рекомендуют в качестве конфигурации фазы 1. Образцы для оценки длительной стабильности хранили при >2-8°C с использованием длинных, тонкостенных, заранее наполненных шприцов Gerresheimer емкостью 1,0 мл, калибром 29G, с несъемной иглой с защитными колпачками Stelmi 4800 и плунжерами Daikyo W4023 Flurotec®, и их заполняли под вакуумом при подаче азота. Образцы помещали в криогенные сосуды при <2-8°C.
Обращение с продуктом
Перед всеми экспериментами белимумаб фильтровали стерилизацией через фильтр 0,22 мкм и асептически наполняли им выбранные закрываемые контейнеры. Все образцы для исследования стабильности защищали от света при хранении.
Выбор эксципиента
Эксципиенты, удовлетворяющие условиям нескольких Фармакопей, обязательные для производства согласно GMP BDS и FDP, по мере возможности использовали в скрининговых исследованиях и для всех составов в исследовании длительной стабильности.
В таблице 2 представлен список тестируемых составов.
Таблица 2
Длительная стабильность
Зависящая от концентрации агрегация в составе 1
Как и ожидали, агрегация повышалась в зависимости от концентрации белка (таблица 3, фигура 1). Скорость агрегации приблизительно удваивалась при концентрации от 100 мг/мл до 260 мг/мл, но даже концентрация 260 мг/мл будет приводить к повышению агрегации лишь на приблизительно 1% в течение 3 лет при 2-8°C при 200 мг/мл белимумаба. Необходимо отметить, что исходная степень агрегации, наблюдаемая при SEC-ВЭЖХ, повышается с повышением концентрации белка, хотя лишь на приблизительно 0,1% (Строка "0 месяцев" в таблице 3).
Скрининг составов-кандидатов для исследования длительной стабильности
Учитывая следующие результаты, после оценки данных за 3 месяца составы-кандидаты сужали до составов 1 и 5, а затем через 5¼ месяцев состав 5 выбирали в качестве конечного состава.
Внешний вид, pH и осмоляльность
Все образцы являлись опалесцирующими, светло-желтыми и не содержали видимые частицы во все временные точки до 5¼ месяцев. Конечный лекарственный продукт во всех восьми составах при всех трех концентрациях наиболее близко соответствует цветовому стандарту Y5 при тестировании посредством колориметрии в исходной временной точке. Все образцы FDP в составах гистидин/NaCl (в настоящем описании обозначаемом как состав 1) и гистидин/NaCl/аргинин (в настоящем описании обозначаемом как состав 5) также соответствовали составу Y5 через 3 и 5¼ месяцев хранения при 2-8°C. Мутность образцов с сахарными стабилизаторами (сахароза и сорбит) являлась значимо более низкой, чем у всех других образцов, находясь в диапазоне 29-38 NTU в исходной временной точке и через 3 месяца. Мутность также повышалась в образцах, содержащих NaCl, при снижении концентрации белка. Через 5¼ месяцев при 2-8°C тестировали лишь составы 1 и 5, и не наблюдали ответ на состав, концентрацию или время (фигура 2).
pH всех образцов находился в диапазоне от 6,1 до 6,3 в исходной временной точке и не сдвигался в составах 1 и 5 через 5¼ месяцев (данные для состава 5 представлены в таблице 13). Осмоляльность тестировали только в исходной временной точке; во всех образцах она составляла 299±17 мОсм/кг.
Вязкость и возможность введения с помощью шприца
Составы, содержащие сахар (сахарозу, сорбит), демонстрировали наибольшие вязкости, за ними следует состав с сукцинатом/хлоридом натрия (таблица 5). Остальные образцы, содержащие соли, являлись сравнимыми. В составах 1 и 5 вязкость повышалась экспоненциально с повышением концентрации белка (фигура 3).
При анализе возможности введения с помощью шприца, измеряемая как сила, необходимая для выпуска 1 мл через тонкостенную иглу калибра 29G за 10 секунд, наблюдали аналогичные тенденции в исходной временной точке. Через 5¼ месяцев тестировали только составы 1 и 5 и не наблюдали значительного повышения возможности введения с помощью шприца с течением времени при 2-8°C. Возможность введения с помощью шприца в течение 20 секунд также тестировали на одном шприце каждого типа через 5¼ месяцев, и показано, что сила выпуска снижалось на значение до 40% при удвоении времени выпуска. Хотя это и не тестировали, силу выпуска также можно снижать при повышении калибра иглы.
Силы, необходимые для введения лекарственного средства с помощью семи имеющихся на рынке шприцов-ручек, более схожих с заранее наполненными шприцами, т.к. для них необходима ручная движущая сила, схожи с силой в случае белимумаба при 200 мг/мл (таблица 7). Время инъекции варьировалось по причине разных объемов и диаметров контейнеров, приведенных в таблице 7 для сравнения. В конечном итоге, исследование University of Nottingham, выполненное по заказу UKʹs Department of Trade and Industry, показало, что в сидячем положении 59 женщин возрастом от 16 до 90 были способны приложить своим большим пальцем направленную вниз статическую силу от 53,7 до 237,7 Н на уровне бедра. Хотя ни данные для шприца-ручки, ни исследование силы не являются идеальными корреляторами для использования заранее наполненного шприца, оба набора данных усиливают достоверность того, что вязкость и возможность введения с помощью шприца 200 мг/мл белимумаба не препятствует ручному введению. Однако, сила, необходимая для выпуска 200 мг/мл белимумаба из длинного, заранее наполненного шприца емкостью 1 мл через тонкостенную иглу калибра 29G находится на уровне желаемого предела для ручной инъекции или вблизи него, и более широкая игла будет являться предпочтительной.
Варианты размера
Данные SEC-ВЭЖХ через 3 месяца
Агрегация, наблюдаемая при SEC-ВЭЖХ, представляла собой преобладающее, зависящее от концентрации поведение белимумаба во всех составах. Процент фрагментации (наблюдаемый как обратное плечо) варьировался от 0,1 до 0,2%, но не изменялся с течением времени (что подтверждается данными для 5¼ месяцев).
Через 3 месяца при 2-8°C наблюдали отдельные различия скорости агрегации (фигура 4) в случае белимумаба, составленного в восьми составах. Состав 5 (гистидин/NaCl/аргинин) демонстрировал наименьшую скорость в течение трех месяцев, в частности, при 200 мг/мл (показано синим на фигуре 4). Это было подтверждено усиленными тенденциями при 200 мг/мл (фигура 5). Сукцинат являлся наихудшим стабилизатором при низких температурах, но лучшим - при повышенных температурах. Многие из других составов солей и сахаров, включая состав 1 (гистидин/NaCl), демонстрировали схожие абсолютные процентные доли агрегатов и скорости агрегации.
Данные SEC-ВЭЖХ через 5¼ месяцев
Белимумаб в составах 1 и 5 оценивали через 5¼ месяцев. Продолжали наблюдать тенденции, наблюдаемые через 3 месяца, при этом состав, содержащий аргинин, демонстрировал более низкую скорость агрегации, особенно при наибольшей концентрации 200 мг/мл. На фигуре 6 показаны скорости агрегации через 5¼ месяцев при температуре до 25°C и то, что в составе с аргинином (незакрашенные квадраты на графике) значительно снижена агрегация по сравнению с составом 1 (закрашенные квадраты). Дополнительный анализ скоростей агрегации при различных температурах, представленный на фигуре 7, показал, как последовательно состав 5 (пунктирные линии) демонстрирует более низкую скорость агрегации, чем состав 1 (сплошные линии). Если скорость агрегации при 2-8°C, наблюдаемая в течение до 5¼ месяцев, сохраняется в течение 3 лет, FDP будет повышаться лишь приблизительно на 1,2%.
CGE
При капиллярном электрофорезе составов 1 и 5 в восстановительных условиях в геле не наблюдали тенденции после 5¼ месяцев хранения при различных температурах (скорости представлены на фигуре 8). Таким образом, перекрестная сшивка и клиппирование не зависят от концентрации или состава.
Гетерогенность заряда
При ионном обмене наблюдали, что ни концентрация, ни добавление аргинина в забуференный гистидином состав с солью не влияли на варианты заряда (фигура 9). Хотя кислые варианты повышаются с течением времени при повышенной температуре, через 5¼ месяцев наблюдали изменение вариантов от небольшого до его отсутствия.
Окисление
Не наблюдали значительных изменений окисления среди любых из 8 составов после 3 месяцев хранения при 2-8°C (данные не представлены). Через 5¼ месяцев при сравнении данных для -80°C и 15°C не наблюдали различий в окислении между составами 1 и 5 или среди трех концентраций в любом составе (фигура 10). Наблюдали приблизительно 1,0% дополнительного окисления во всех образцах после 5¼ месяцев хранения при 25°C и наблюдали приблизительно 4,5% дополнительного окисления при 40°C.
Пептидное картирование
Не наблюдали различий между образцами состава 1 при концентрации 200 мг/мл, хранящимися при -80°C и 2-8°C, или референсным стандартом после 5¼ месяцев (фигура 11). Образец, хранящийся при 25°C, как и ожидали, демонстрировал небольшое повышение дезамидирования T4 при повышенных температурах. Образец состава 5 аналогично демонстрировал дезамидирование T4 лишь при 25°C, но также демонстрировал непостоянные высоты в случае ряда других пептидных пиков (T33, T34 и T5 тяжелой цепи, T3 легкой цепи на фигуре 12). Эти высоты пиков не изменялись вместе с температурой, поэтому предполагали противодействие расщеплению с помощью аргинина.
Для определения того, являлось ли противодействие аргинина причиной непостоянства, добавляли 0, 25 и 50 мМ аргинин в образец состава 1, который пропускали через этап обессоливания. Затем все три образца пропускали через остальные этапы, включающие расщепление трипсином. Те же пептидные пики, которые демонстрировали непостоянство в образцах для исследования стабильности, демонстрировали ответы, коррелирующие с концентрацией аргинина (фигура 13). Это свидетельствует о том, что аргинин не всегда можно полностью удалять на этапе обессоливания, и это объясняет независящее от температуры изменение, наблюдаемое на пептидных картах образцов, составленных в составе 5. Т.к. в пептидных картах не наблюдали других модификаций, можно предположить, что, несмотря на различия в картах, составы 1 и 5 не имели наблюдаемой деградации после 5¼ месяцев при 2-8°C, и имели лишь минимальную деградацию после 5¼ месяцев при 25°C.
Активность
Белимумаб остается биологически активным после хранения при 2-8°C в течение 3 месяцев в составе 1 или составе 5 при концентрациях от 125 до 200 мг/мл или после 5¼ месяцев в составе 5 при 200 мг/мл (таблица 8).
Оценка замораживания/размораживания
Образцы, подвергнутые 5 быстрым циклам замораживания/размораживания от -40°C до 2-8°C, имели схожую степень агрегации с контрольными образцами при -40°C, что свидетельствует о том, что в случае состава 1 или состава 5 быстрое замораживание/размораживание не вызывает беспокойства (таблица 9).
Образцы, подвергнутые 3 медленным циклам замораживания/размораживания, демонстрировали повышение на 0,2% уровня агрегатов по сравнению с жидкими контролями (таблица 10).
DSC
Калориметрию использовали для оценки стеклования при отрицательной температуре (Tgʹ) каждого состава и для определения того, образуется ли эвтектика при отрицательной температуре. Эвтектика хлорида натрия-воды может образовываться при температуре ниже приблизительно -21oC, и эвтектическая кристаллизация эксципиентов может влиять на качество продукта посредством включения поверхностных взаимодействий кристаллов и изменения локального химического окружения в вымороженном концентрате, содержащем белок. Хранение при температуре ниже Tgʹ может улучшать стабильность посредством повышения времени релаксации и снижения ассоциированной деградации.
Составы 1 и 5 с высокой концентрацией белимумаба имеют схожее поведение в отношении переходов при отрицательной температуре (таблица 11). В случае состава 1 Tgʹ находилась в диапазоне от -23°C (самое быстрое замерзание) до -33°C (самое медленное замерзание). В случае состава 5 Tgʹ находилась в диапазоне от -22°C (самое быстрое замерзание) до -32°C (самое медленное замерзание). В случае обоих составов наблюдали эвтектическую эндотерму только после термоциклирования с множеством этапов отжига при -23°C. Эвтектическим составом, наиболее вероятно, являлся хлорид натрия-вода.
Эти результаты свидетельствуют о том, что термические переходы этих составов при отрицательной температуре являются чувствительными к термической истории образца. Вероятно, это является результатом высокого содержания растворенных твердых веществ и наличия хлорида натрия, что может влиять на Tgʹ в белке/аморфной фазе. Результаты, в комбинации с данными о стабильности при -80°C и -40°C из раздела 5.2, также свидетельствуют о том, что хранение BDS при <-40°C и с защитой от света является достаточным для белимумаба в составе 5.
Оценка встряхивания
После 48 часов встряхивания при 250 об./мин. не наблюдали значительного изменения чистоты по результатам SEC-ВЭЖХ или мутности в сосуде или шприце в диапазоне исследуемых концентраций полисорбата (таблица 12). Показано, что 0,01% полисорбата 80 являлись эффективными и надежными в составе 5 в качестве протектора против встряхивания в сосуде и шприце.
Выводы
Выбирали состав для подкожного введения белимумаба при 200 мг/мл с учетом его способности минимизировать скорости первичного пути деградации (состав 5; 0,65 мг/мл L-гистидина, 1,2 мг/мл моногидрохлорида L-гистидина, 6,7-7,3 мг/мл хлорида натрия, 5,3 мг/мл гидрохлорида L-аргинина, 0,1 мг/мл полисорбата 80, pH 6,0; или, альтернативно, 10 мМ гистидин, 115 мМ хлорид натрия, 25 мМ гидрохлорид L-аргинина, 0,01% (масс./об.) полисорбата 80, pH 6,0). Показано, что скорость агрегации (~0,03%/месяц при 2-8°C) повышается с концентрацией белимумаба, но ингибируется при использовании 25 мМ аргинина. Скорость дезамидирования составляла приблизительно 0,2%/месяц при 2-8°C. Состав с концентрацией 200 мг/мл имеет приемлемую силу выпуска в случае ручной или автоинжекторной доставки с использованием длинного шприца емкостью 1 мл и тонкостенной иглы калибра 29G или шире. Показано, что профили замораживания/размораживания и хранение при -80°C и -40°C являются приемлемыми, и продукт не подвержен стрессу при встряхивании.
Таблица 13. Длительная стабильность белимумаба в составе 5 при 200 мг/мл
Пример 2: Антитело против ИЛ-13 является mAb с высокой концентрацией-высокой дозой
Антитело против ИЛ-13 является гликозилированным гуманизированным mAb (IgG1) против интерлейкина-13 (ИЛ-13) человека. Для достижения очень высокой клинической дозы (10 мг/кг) для подкожной доставки, с учетом моделирования PK/PD, лекарственное вещество и лекарственный продукт необходимо разрабатывать в концентрации 200 мг/мл в презентации в виде сосуда. В качестве прямого следствия достижения гораздо более высокой концентрации mAb в сосуде при составлении антитела против ИЛ-13 возникали различные проблемы, такие как: (i) идентификация уникального состава, способного поддерживать стабильность, возможность производства, проблемы анализа и доставки моноклонального антитела с высокой концентрацией, предназначенного для доставки в высокой клинической дозе посредством подкожной доставки, (ii) предотвращение проблем анализа и стабильности, являющихся результатом желатинизации моноклонального антитела при более высоких концентрациях, (iii) предотвращение различных связанных проблем, которые могут возникать, в частности, при доставке моноклонального антитела в объеме инъекции 1,5 мл или менее. В качестве непосредственного результата, выявленного при работе по разработке состава, определяли, что это моноклональное антитело имеет склонность к необратимому образованию гелеобразной матрицы в конкретных буферных системах при повышенных температурах, таким образом, создавая значительный риск нестабильности белка. Вязкость повышается экспоненциально с концентрацией и может осложнять фильтрацию. Моноклональные антитела с более высокой концентрацией имеют более высокую склонность к агрегации с повышенным риском образования частиц и обратимой самоассоциации. Таким образом, исследования по разработке состава с высокой пропускной способностью (HTF) осуществляли для идентификации оптимального буфера и pH для нового состава для поддержки моноклонального антитела с высокой концентрацией, сконструированного для получения высокой клинической дозы. В этих и других лабораторных исследованиях идентифицировали оптимальный состав, предотвращающий явление желатинизации при повышенных температурах. В дополнительных исследованиях по разработке состава идентифицировали различные эксципиенты, подлежащие включению в выбранную буферную систему. Они представляли собой исследование встряхивания, замораживания/размораживания и повышенных температур для оценки физической стабильности с последующими исследованиями кратковременной и длительной стабильности для оценки химической стабильности mAb против ИЛ-13. Также осуществляли различные другие исследования для обеспечения удовлетворения аспектов, касающихся клинической доставки.
Пример 3: Скрининг HTF pH-буфера: (идентификация целевого pH и буфера)
В случае тестируемого ранее состава на основе ацетата для моноклонального антитела против ИЛ-13 при 50 мг/мл уже устанавливали, что pH не являлся оптимальным. Субоптимальный pH буфера состава может повышать нестабильность раствора моноклонального антитела против ИЛ-13 с более высокой концентрацией посредством изменения заряда белка и влияния на электростатические взаимодействия. Разработку состава с высокой концентрацией начинали с идентификации оптимального pH, а также определения лучшего типа буфера.
Исследование осуществляли при концентрации mAb 13 мг/мл. Скрининг буфера осуществляли способом HTF в 96-луночных планшетах. Исследование включало широкий диапазон типов буферов и уровней pH. Каждый планшет включал 48 образцов в 2 повторениях в случайном порядке. Образцы подвергали стрессу в течение 3 дней при 50°C/RH. Тестирование включало определение общего внешнего вида (GA), концентрации при A280 и A260 нм, pH, эксклюзионную хроматографию (SEC), капиллярное изоэлектрофокусирование (cIEF) и динамическое рассеяние света (DLS). Тестируемые факторы представлены в таблице 14.
Таблица 14: Скрининговое исследование HTF буфера
В результате тестирования общего внешнего вида планшетов выявляли высокие уровни осаждения в некоторых из образцов, особенно в ацетатном, цитратном и фосфатном буфере. Сукцинатный буфер являлся единственным типом буфера, не демонстрирующим осаждение.
Получали профили дезамидирования и агрегации для всех образцов с помощью cIEF и SEC, соответственно. На фигуре 1 показан график с совмещением данных cIEF и SEC. На графике показано, что составы с наибольшим % мономеров при SEC также имели сниженный % основной формы при cIEF, что свидетельствует о том, что антитело против ИЛ-13 агрегирует при более низком pH и дезамидируется при более высоком pH. Можно наблюдать, что % мономеров является более высоким, если pH составляет 6-7, чем при pH 4-5,5, независимо от типа буфера.
В целом, скрининг HTF pH-буфера приводил к следующим выводам: (i) цитратный и ацетатный буферы приводили к наибольшим количествам замутненных лунок (свидетельство осаждения), что определяли посредством определения GA, и (ii) фосфатный буфер способствовал осаждению вместе с повышением агрегации и дезамидирования с учетом результатов cIEF и SEC, и (iii) антитело против ИЛ-13 агрегирует при низком pH и дезамидируется при более высоком pH.
Пример 4: Скрининг HTF pH-буфера: (определение оптимального pH)
Осуществляли второе исследование HTF на основе дизайна 3×3-факторного DOE (3 буфера, 3 pH), состоящее всего из 90 образцов. Выбранные буферы для оценки включали ацетатный, гистидиновый и сукцинатный при конечных диапазонах pH от 5,5 до 6,5. Выбирали буферы, имеющие фиксированную концентрацию 25 мМ. Дизайн делал возможным 6 повторений для каждого состава вместе с 6 повторениями для ацетатного состава на планшете для исследования стресса, служащими в качестве контроля в целях сравнения.
Каждый планшет подвергали стрессу в течение 3 дней при 50°C/RH. Тестирование включало определение общего внешнего вида (GA), концентрации при A280 и A260 нм, pH, SEC, cIEF, DLS и DSC (дифференциальную сканирующую калориметрию) выбранных образцов.
Результаты исследования анализировали с помощью статистического программного обеспечения, известного как Design Expert. Выявляли интересные тенденции, когда все результаты анализов подвергали дисперсионному анализу (ANOVA) с использованием того же программного обеспечения. Обнаруживали, что тип буфера и pH являются значимыми факторами для результатов, полученных посредством определения концентрации, скорректированной концентрации, DLS, SEC и cIEF.
На фигуре 2 показано взаимодействие между pH и типом буфера и % мономеров при SEC. В случае ацетатного и гистидинового буферов % мономеров повышался с повышением pH. На фигуре 3 показано взаимодействие между pH и типом буфера и % основной формы при cIEF. Обнаруживали, что pH и буфер являются значимыми. Учитывая этот график, pH в диапазоне 5,5-6,5, по-видимому, не влияет на % основной формы в случае ацетата или сукцината, но не в случае гистидина.
В целом, скрининг HTF pH-буфера приводил к выбору конечного оптимального pH 6,25.
Пример 5: Определение оптимальных условий термического стресса с учетом профиля термической стабильности при DSC
Среди различных факторов, которые потенциально могут влиять на желатинизацию белка, таких как концентрация, pH, содержание соли, есть один критический фактор, регулирующий это явление - температура. Условия термической стабильности, выбранные для антитела против ИЛ-13, тестируемого посредством HTF и других исследований по разработке, оценивали посредством DSC. В основном, глобулярные белки среднего размера начинают разворачиваться при приблизительно 25°C, и в случае моноклональных антител эта температура составляет приблизительно 60°C. Разворачивание этого mAb при всех тестируемых буферах (ацетатном, гистидиновом и сукцинатном) начинается при приблизительно 61°C, что свидетельствует о термически стабильной молекуле и подтверждает, что повышенная температура хранения 50°C будет допускать наличие свернутого моноклонального антитела против ИЛ-13. Т.к. между началом разворачивания и повышенной температурой хранения 50°C существует различие в более чем 10°C, 50°C решали использовать в качестве температуры хранения для скрининга.
В таблице 15 указаны значения Tm, определяемые из необработанных сканов. Значения Tm1 охватывает диапазон 71,3-71,6°C, и значения Tm2 охватывают больший диапазон 83,5-84,1°C. Не наблюдали значительных изменений Tm одного буфера при разных значениях pH. Изменения Tm1 и Tm2, измеряемые для всех условий, составляют менее 1°C, таким образом, тестируемые растворы белков имеют схожие термодинамические стабильности.
Таблица 15: Значения Tm, определяемые из необработанных сканов
Пример 6: Оценка реализуемости состава с высокой концентрацией
Клиническая потребность в подкожном введении (SC) лекарственных средств с высокой дозой белка >100 мг/мл часто привносит дополнительные технически задачи при разработке для производства, аналитического тестирования, стабильности и доставки. Общим признаком состава с высокой концентрацией белка является высокая вязкость, что непосредственно является результатом обратимой самоассоциации белков. Высокая вязкость также может привносить дополнительные задачи при клинической разработке по причине высоких сил инъецирования, повышения боли в месте инъекции, а также может изменять фармакокинетические профили лекарственного средства. Таким образом, важный элемент усилий по разработке продукта относится к идентификации состава с низкой вязкостью. Эффект в отношении вязкости можно уменьшать посредством изменений pH или добавления эксципиентов.
По причине ожидаемого экспоненциального повышения вязкости в результате повышения концентрации mAb до 200 мг/мл осуществляли исходное исследование реализуемости для изучения вязкости и инъецируемости раствора антитела против ИЛ-13 с высокой концентрацией. Раствор ~150 мг/мл концентрировали до ~210 мг/мл в ранее полученном составе на основе ацетата. Измерения вязкости осуществляли при следующих концентрациях mAb 50, 150 и 200 мг/мл с использованием конического реометра.
На фигуре 4 представлены различные уровни вязкости, график которых построен относительно указанных выше концентраций, с наблюдаемым экспоненциальным повышением вязкости с повышением концентрации. Результат исследования вязкости для концентрированного раствора при 207,7 мг/мл составлял 28,6 сП.
Максимальную силу инъецирования определяли, помещая антитело против ИЛ-13 в концентрации 207,7 мг/мл в стеклянный шприц емкостью 1 мл, снабженный иглой калибра 27, со скоростью введения с помощью шприца, установленной на 3 мм/мин, измеряемой с использованием электромеханической системы тестирования Instron. В таблице 16 представлены численные результаты, полученные для вязкости и возможности введения с помощью шприца, при максимальной концентрации 207,7 мг/мл.
Определение вязкости (28,6 сантипуаз) и максимальной силы инъецирования 30,3 Ньютон при концентрации 207,7 мг/мл позволяет предполагать, что необходимы дополнительные усилия в разработке состава, чтобы сделать возможной и достичь реализуемости производства и дозирования презентации антитела против ИЛ-13 с высокой концентрацией.
Таблица 16: Результаты определения реализуемости высокой концентрации
Пример 7: Оценка физических свойств посредством исследований встряхивания
Определяли, что гистидиновый и сукцинатный буфер при pH 6,25 являлись оптимальными буферными системами, однако, необходимы дополнительные исследования для разработки состава для идентификации подходящего состава для растворов mAb с высокой концентрацией, склонных к высокой вязкости в зависимости от высокой концентрации и желатинизации как функции температуры.
Составы, используемые в исследованиях встряхивания, разработаны на основе скринингового исследования HTF. В исследовании HTF идентифицировали две буферные системы (гистидин и сукцинат при pH 6,25), обеспечивающие хорошую стабильность. Третью буферную систему (50 мМ ацетат, pH 5,5) также включали в качестве контроля. Образцы буферных систем гистидина и сукцината при pH 6,25 получали с использованием способов маломасштабного обмена буфера и концентрирования. Затем, основываясь на литературе, добавляли следующие эксципиенты: 0,02% полисорбата 80 (PS80) для защиты белка от напряжения сдвига и 150 мМ хлорид натрия в качестве потенциального средства, снижающего вязкость.
Образцы в объеме 1,2 мл помещали в стеклянный сосуд емкостью 3 мл при номинальном объеме 1 мл и встряхивали в течение 72 часов при 250 об./мин. при 2-8°C на горизонтальном шейкере, защищенном от света. Затем образцы тестировали различными аналитическими способами. В таблице 17 ниже приведены составы, используемые для исследования напряжения сдвига/встряхивания. Включали составы с более низкой концентрацией, т.к. ранее не проводили исследования встряхивания при 50 мг/мл. Также включали контрольные составы без эксципиентов, таких как PS80. В случае образцов с ацетатом также включали контроли с NaCl.
Таблица 17. Дизайн исследования встряхивания и образцы.
Не наблюдали значительных изменений при определении общего внешнего вида, SEC, DLS и MFI во всех образцах, составленных с NaCl и полисорбатом 80. Составы белка с высокой концентрацией не являлись стабильными в составе с ацетатом (контроле) по результатам SEC-ВЭЖХ.
Целевая концентрация всех тестируемых mAb против ИЛ-13 составляет 200 мг/мл, однако, по причине ограничений выходов способа и характерного непостоянства измерений вязкости, номинальная концентрация составов с гистидином и сукцинатом при 200 мг/мл находится в пределах диапазона±10%. При измерении вязкости образцов, используемых в исследовании встряхивания, выявляли, что в 6 раз более низкая вязкость достижима в составах, содержащих 150 мМ хлорид натрия при номинальной концентрации 200 мг/мл, независимо от буферной системы (фигура 5). Составы, содержащие буферы в отдельности, демонстрировали более высокую вязкость в случае гистидина по сравнению с ацетатом натрия и сукцинатом натрия. Это позволяет предполагать, что ионы натрия в последних буферах могут способствовать снижению вязкости, что, таким образом, также объясняет, что ионы натрия из хлорида натрия могут отвечать за эффект снижения вязкости. Однако, т.к. гистидин комбинируют с 150 мМ хлоридом натрия, вязкость снижается в той же степени, что и в других буферных системах. Это также может позволить предположить, что существует синергическое взаимодействие между гистидиновым буфером и NaCl, эффективно снижающим вязкость.
Это исследование также включало составы 1, 2 и 3 с более низкой концентрацией 50 мг/мл; однако, среди составов не наблюдали различий, что свидетельствует о важности полученных данных о стабильности для состава с высокой концентрацией при целевой концентрации (данные не представлены).
Зависимость вязкости от концентрации белка и содержания натрия в образцах обобщена на фигуре 5. Все считывания вязкости для образцов с 50 мг/мл (более низкой концентрации) представляли собой менее 2 сП. Вязкость образца с ацетатом с номинальной концентрацией 200 мг/мл, содержащего 150 мМ NaCl, составляла приблизительно на 3 сП ниже, чем в соответствующих образцах с гистидином и сукцинатом, главным образом, по причине более низкой, чем номинальная, концентрации 200 мг/мл в результате плохих выходов способа. Общие концентрации составляли менее 200 мг/мл в результате потерь при получении концентрированного образца, как показано на фигуре 5.
Результаты исследования четко свидетельствуют о том, что включение 150 мМ NaCl значительно снижало вязкость среди всех тестируемых буферных систем. Также наблюдали уникальный взгляд на понимание синергического взаимодействия между гистидиновым буфером и NaCl.
Примечание: Целевая концентрация всех тестируемых mAb против ИЛ-13 составляет 200 мг/мл, однако, по причине ограничений выходов способа и характерного непостоянства измерений вязкости, номинальная концентрация составов с гистидином и сукцинатом при 200 мг/мл находится в пределах диапазона±10%.
Пример 8: Оценка физических свойств при повышенных температурах
Следующее исследование планировали для оценки физической стабильности антитела против ИЛ-13 с высокой концентрацией при номинальной концентрации 200 мг/мл после воздействия термического стресса при соответствующим образом определенной повышенной температуре.
Образцы инкубировали при повышенной температуре 50°C/60%RH в течение 7 или 10 дней.
Аналитическое тестирование включало определение общего внешнего вида (GA), вязкости, концентрации при A280 нм, SEC-ВЭЖХ, MFI и DLS. В таблице 18 представлены образцы составов, используемые для исследования повышенной температуры.
Таблица 18: Составы, используемые для исследования повышенной температуры
Результаты определения общего внешнего вида, как представлено в таблице 19 и на фигуре 6, демонстрировали желатинизацию состава 1 (ацетат) после 7 дней. Состав 2 (сукцинат) демонстрировал полужелатинизацию после 10 суток хранения, в то время как состав 3 (гистидин) не демонстрировал желатинизацию образца после 10 суток хранения. Не наблюдали наличия частиц в любом из образцов, который не подвергался желатинизации. Образцы с сукцинатом и гистидином после 7 дней и 10 дней классифицировали как "белесоватый переливающийся". "Белесоватый переливающийся" приравнивают к снижению прозрачности, что может свидетельствовать о более высокой концентрации невидимых частиц и агрегации. Результаты MFI (не представлены) показали, что в t=0 состав 1 (ацетат) имел на ~50% больше частиц, чем другие составы.
Таблица 19: Результаты GA при запланированном 2-недельном исследовании при повышенной температуры 50°C/60%RH
Результаты исследования четко свидетельствуют о том, что комбинация 150 мМ NaCl с гистидиновым буфером при pH 6,25 предотвращала явление желатинизации. Результаты также свидетельствуют о том, что тип буфера оказывает значительное влияние на физическую стабильность (гистидин>сукцинат>ацетат). Эти результаты могут позволить предположить синергическое взаимодействие, существующее между гистидиновым буфером и NaCl для повышения физической стабильности составов mAb с высокой концентрацией.
Пример 9: Исследование замораживания/размораживания при 200 мг/мл
Целью этого исследования являлась оценка влияния трех циклов замораживания/размораживания в диапазоне от 2-8°C до -70°C на профиль физической и химической стабильности mAb против ИЛ-13 при номинальной концентрации 200 мг/мл. В исследовании замораживания/размораживания изучали стабильность в 15 мМ гистидиновом буфере, pH 6,25, содержащем 100 или 150 мМ NaCl, 0,05 мм ЭДТА, 0,02% полисорбата 80. Состав на основе ацетата включали в качестве контроля при pH 5,5. Образцы при номинальном объеме 1,2 мл помещали в стеклянные сосуды емкостью 3 мл и подвергали трем циклам замораживания/размораживания при температуре от 2-8°C до -70°C и защите от света. В таблице 20 представлены образцы для этого исследования.
Таблица 20: Образцы составов, тестируемые в исследовании замораживания/размораживания
Образцы анализировали следующими способами анализа: определение GA, pH, вязкости, концентрации при A280 нм, активности посредством SPR, электрофореза в ПААГ в присутствие SDS, SEC-ВЭЖХ, cIEF и MFI.
Замораживание/размораживание (F/T). Не наблюдали значимых различий между результатами для F/T и контрольных образцов для любого состава при определении общего внешнего вида, pH, активности посредством SPR, концентрации, SEC, электрофореза в ПААГ в присутствие SDS или вязкости. Не наблюдали снижения % основной формы при cIEF относительно исходного уровня для гистидиновых составов. В таблице 21 приведены все данные определения общего внешнего вида, pH, активности, концентрации и вязкости. В таблице 22 приведены все данные электрофореза в ПААГ в присутствие SDS. В таблице 23 приведены все данные SEC и cIEF.
Общие результаты исследования четко свидетельствуют о том, что комбинация 150 мМ NaCl с гистидиновым буфером при pH 6,25 является лучшим составом и стабильным после подвергания стрессу замораживания/размораживания.
Таблица 21: Результаты аналитического тестирования в случае замораживания/размораживания посредством определения GA, pH, активности, концентрации и вязкости
Таблица 22: Результаты исследования замораживания/размораживания (электрофорез в ПААГ в присутствие SDS)
Таблица 23: Результаты исследования замораживания/размораживания (SEC, cIEF)
Пример 10: Исследование кратковременной химической стабильности и биофизическая характеризация лекарственного продукта на основе mAb при номинальной концентрации 200 мг/мл
Исследование стабильности для разработки осуществляли для оценки кратковременной химической стабильности состава mAb при 200 мг/мл, содержащем NaCl, PS80 и ЭДТА. В исследовании кратковременной химической стабильности изучали стабильность в 15 мМ гистидиновом буфере, pH 6,25, содержащем 100 или 150 мМ NaCl, 0,05 мм ЭДТА, 0,02% полисорбата 80. Состав на основе ацетата включали в качестве контроля. Образцы при номинальном объеме 1,2 мл помещали в стеклянные сосуды емкостью 3 мл и помещали в следующие условия хранения: 5°C, 25°C и 40°C. В таблице 24 ниже представлены образцы для этого исследования.
Таблица 24: Образцы для исследования кратковременной химической стабильности и исходные данные об осмоляльности
Образцы анализировали следующими способами анализа: определение GA, pH, вязкости, концентрации посредством A280 нм, активности посредством SPR, электрофореза в ПААГ в присутствие SDS, SEC-ВЭЖХ и cIEF. Исследование длилось всего 3 месяца, и также осуществляли различные тестирования для биофизической характеризации с использованием DSC, DLS, CD и MFI в исходной и конечной временной точке.
Результаты тестирования для аналитической (концентрация, активность, SEC, электрофорез в ПААГ в присутствие SDS, cIEF) и биофизической характеризации (DSC, флуоресценция, CD) свидетельствуют о том, что состав B (200 мг/мл антитела против ИЛ-13 в 15 мМ гистидине, pH 6,25, 150 мМ NaCl, 0,05 мМ ЭДТА, 0,02% полисорбата 80) являлся лучшим из трех составов в исследовании кратковременной химической стабильности.
Результаты аналитического тестирования и обсуждение:
В таблице 25 обобщены данные исследования при 5°C в течение до 3 месяцев с использованием всех аналитических способов, а в таблице 26 обобщены данные исследования в стрессовых и ускоренных условиях при 25°C и 40°C в течение до 3 месяцев.
Образцы в гистидиновых составах (A и B) демонстрировали более высокий % основной формы после 3 месяцев при 5°C и 25°C, чем контрольные образцы с ацетатом, что определяли посредством cIEF. При определении чистоты посредством электрофореза в ПААГ в присутствие SDS выявляли более высокий % содержания тяжелой и легкой цепи в случае образцов в обоих гистидиновых составах (A и B) после 3 месяцев при 25°C, чем в контрольных образцах с ацетатом. В условиях хранения 40°C/75%RH все три состава через 1 месяц демонстрировали более низкий % содержания H+L по сравнению с исходным уровнем, однако составы A и B превосходили состав C (90,6 и 91,8 по сравнению с 88,2%). Наблюдали значительное снижение % основной формы в случае всех образцов, хранящихся 1 месяц при 40°C, но снижение являлось меньшим в случае гистидиновых составов (8,8 или 7,5%) по сравнению с изменением в случае ацетатного состава (9,9%), при этом состав B демонстрировал наименьший % снижения. Наиболее высокую активность наблюдали в гистидиновом составе B, содержащем 150 мМ NaCl, через 3 месяца при 25°C/60%RH и через 1 месяц при 40°C/75%RH. Наиболее низкую активность наблюдали в контрольном и предшествующем составе C на основе ацетата, не обеспечивающем подходящую стабильность для mAb в высокой концентрации. Результаты определения вязкости в случае исходного тестирования составов A и B (18,0 и 16,3 сП) являлись более низкими, чем в случае состава C (18,7 сП), что являлось ожидаемым по причине более высокой концентрации NaCl в составах A и B (100 и 150 мМ NaCl, соответственно). Результаты определения вязкости состава B являлись наиболее низкими во всех условиях и во все временные точки.
Таблица 25: Данные исследования кратковременной химической стабильности при 5°C
Таблица 26: Данные исследования кратковременной химической стабильности в стрессовых и ускоренных условиях
Результаты биофизической характеризации и обсуждение:
В таблице 27 представлены данные DLS для исходной временной точки и данные флуоресцентного анализа для исходной временной точки и 3 месяцев.
Результаты MFI, не показавшие наличия видимых частиц, наблюдали в любом образце в течение 3 месяцев. Не наблюдали значимых различий среди трех составов при DLS, посредством которого измеряют гидродинамический радиус mAb. Данные анализа флуоресценции и кругового дихроизма не свидетельствуют об искажениях вторичной и третичной структуры в гистидиновых составах после 3 месяцев хранения. На фигуре 7 показан график сравнения CD спектров. Более низкий сигнал для образцов состава C может свидетельствовать об изменении третичной структуры. Различия, наблюдаемые в % тушения в случае состава C, также свидетельствуют об изменении третичной структуры в случае этого состава. Данные DSC для образцов в исходной временной точке и через 3 месяца представлены в таблице 28. Тенденция к более высокой Tm и общие результаты в ккал/моль для обоих составов гистидин/NaCl позволяет предполагать, что дополнительная соль делает возможной более высокую термодинамическую стабильность, чем у ацетатного состава.
Таблица 27: Данные DLS и анализа флуоресценции в исследовании кратковременной химической стабильности
Таблица 28: Данные DSC в исследовании кратковременной химической стабильности
Пример 11: Исследования длительной химической стабильности и биофизическая характеризация лекарственного продукта на основе mAb при номинальной концентрации 200 мг/мл
Временную точку 16 месяцев тестировали для всех образцов в отношении стабильности, как представлено в таблице 14. Результаты для этой временной точки использовали для оценки длительной химической стабильности лекарственного продукта mAb при номинальной концентрации 200 мг/мл, составленного в гистидине, NaCl, PS80 и ЭДТА. Для подтверждения длительной стабильности осуществляли ограниченное тестирование.
Образцы анализировали следующими способами анализа: определение GA, pH, вязкости, концентрации посредством A280 нм, электрофореза в ПААГ в присутствие SDS, SEC-ВЭЖХ и cIEF. Также осуществляли тестирование для биофизической характеризации, включающее анализ флуоресценции, DSC и CD.
Таблица 25 включает данные для временной точки 16 месяцев при 5°C, полученные всеми аналитическими способами.
Результаты аналитического тестирования и обсуждение: Образцы гистидиновых составов (A и B) проявляли более высокий % содержания мономеров после 16 месяцев при 5°C. Состав C имел на 0,9% больше, чем любой из гистидиновых составов.
Результаты биофизической характеризации и обсуждение: В целом, результаты биофизической характеризации являлись сравнимыми для временных точек 3 месяца и 16 месяцев. Данные анализа флуоресценции и кругового дихроизма не свидетельствуют об искажениях вторичной и третичной структуры в гистидиновых составах после 16 месяцев хранения. Результаты для образцов состава A и B после 16 месяцев при 5°C не демонстрировали значительных изменений. Наблюдали значительное повышение интенсивности для обоих образцов состава C, что свидетельствует о том, что молекула не свернута и экспонирует больше флуоресцентных групп. Не наблюдали повышения видимых частиц во временной точке 16 месяцев с учетом результатов анализа MFI в случае составов A и B. Данные DSC для образцов во временной точке 16 месяцев. Тенденция к более высокой Tm и общие результаты в ккал/моль для обоих составов гистидин/NaCl позволяют предполагать, что дополнительная соль делает возможной более высокую термодинамическую стабильность, чем у ацетатного состава.
В таблице 27 представлены данные анализа флуоресценции для временной точки 16 месяцев. В таблице 28 представлены результаты DSC для временной точки 16 месяцев.
Результаты аналитического тестирования (определения концентрации, активности, SEC, электрофореза в ПААГ в присутствие SDS, cIEF) и биофизической характеризации (DSC, флуоресцентного анализа, CD) свидетельствуют о том, что состав A (200 мг/мл антитела против ИЛ-13 в 15 мМ гистидине, pH 6,25, 150 мМ NaCl, 0,05 мМ ЭДТА, 0,02% полисорбата 80) являлся лучшим из трех составов по длительной химической стабильности.
Список последовательностей
SEQ ID NO: 1, BLyS
MDDSTEREQS RLTSCLKKRE EMKLKECVSI LPRKESPSVR SSKDGKLLAA TLLLALLSCC LTVVSFYQVA ALQGDLASLR AELQGHHAEK LPAGAGAPKA GLEEAPAVTA GLKIFEPPAP GEGNSSQNSR NKRAVQGPEE TVTQDCLQLI ADSETPTIQK GSYTFVPWLL SFKRGSALEE KENKILVKET GYFFIYGQVL YTDKTYAMGH LIQRKKVHVF GDELSLVTLF RCIQNMPETL PNNSCYSAGI AKLEEGDELQ LAIPRENAQI SLDGDVTFFG ALKLL
SEQ ID NO: 2, VH белимумаба
QVQLQQSGAE VKKPGSSVRV SCKASGGTFN NNAINWVRQA PGQGLEWMGG IIPMFGTAKY SQNFQGRVAI TADESTGTAS MELSSLRSED TAVYYCARSR DLLLFPHHAL SPWGRGTMVT VSS
SEQ ID NO: 3, VL белимумаба
SSELTQDPAV SVALGQTVRV TCQGDSLRSY YASWYQQKPG QAPVLVIYGK NNRPSGIPDR FSGSSSGNTA SLTITGAQAE DEADYYCSSR DSSGNHWVFG GGTELTVLG
SEQ ID NO: 4, VH табалумаба
MKHLWFFLLL VAAPRWVLSQ VQLQQWGAGL LKPSETLSLT CAVYGGSFSG YYWSWIRQPP GKGLEWIGEI NHSGSTNYNP SLKSRVTISV DTSKNQFSLK LSSVTAADTA VYYCARGYYD ILTGYYYYFD YWGQGTLVTV SS
SEQ ID NO: 5, VL табалумаба
EIVLTQSPAT LSLSPGERAT LSCRASQSVS RYLAWYQQKP GQAPRLLIYD ASNRATGIPA RFSGSGSGTD STLTISSLEP EDFAVYYCQQ RSNWPRTFGQ GTKVEIKRT
SEQ ID NO: 6, тяжелая цепь белимумаба
QVQLQQSGAE VKKPGSSVRV SCKASGGTFN NNAINWVRQA PGQGLEWMGG IIPMFGTAKY SQNFQGRVAI TADESTGTAS MELSSLRSED TAVYYCARSR DLLLFPHHAL SPWGRGTMVT VSSASTKGPS VFPLAPSSKS TSGGTAALGC LVKDYFPEPV TVSWNSGALT SGVHTFPAVL QSSGLYSLSS VVTVPSSSLG TQTYICNVNH KPSNTKVDKK VEPKSCDKTH TCPPCPAPEL LGGPSVFLFP PKPKDTLMIS RTPEVTCVVV DVSHEDPEVK FNWYVDGVEV HNAKTKPREE QYNSTYRVVS VLTVLHQDWL NGKEYKCKVS NKALPAPIEK TISKAKGQPR EPQVYTLPPS RDELTKNQVS LTCLVKGFYP SDIAVEWESN GQPENNYKTT PPVLDSDGSF FLYSKLTVDK SRWQQGNVFS CSVMHEALHN HYTQKSLSLS PGK
SEQ ID NO: 7, легкая цепь белимумаба
SSELTQDPAV SVALGQTVRV TCQGDSLRSY YASWYQQKPG QAPVLVIYGK NNRPSGIPDR FSGSSSGNTA SLTITGAQAE DEADYYCSSR DSSGNHWVFG GGTELTVLGQ PKAAPSVTLF PPSSEELQAN KATLVCLISD FYPGAVTVAW KADSSPVKAG VETTTPSKQS NNKYAASSYL SLTPEQWKSH RSYSCQVTHE GSTVEKTVAP TECS
SEQ ID NO: 8, тяжелая цепь табалумаба
QVQLQQWGAG LLKPSETLSL TCAVYGGSFS GYYWSWIRQP PGKGLEWIGE INHSGSTNYN PSLKSRVTIS VDTSKNQFSL KLSSVTAADT AVYYCARGYY DILTGYYYYF DYWGQGTLVT VSSASTKGPS VFPLAPCSRS TSESTAALGC LVKDYFPEPV TVSWNSGALT SGVHTFPAVL QSSGLYSLSS VVTVPSSSLG TKTYTCNVDH KPSQTKVDKR VESKYGPPCP PCPAPEFLGG PSVFLFPPKP KDTLMISRTP EVTCVVVDVS QEDPEVQFNW YVDGVEVHNA KTKPREEQFN STYRVVSVLT VLHQDWLNGK EYKCKVSNKG LPSSIEKTIS KAKGQPREPQ VYTLPPSQEE MTKNQVSLTC LVKGFYPSDI AVEWESNGQP ENNYKTTPPV LDSDGSFFLY SRLTVDKSRW QEGNVFSCSV MHEALHNHYT QKSLSLSLGK
SEQ ID NO: 9, легкая цепь табалумаба
EIVLTQSPAT LSLSPGERAT LSCRASQSVS RYLAWYQQKP GQAPRLLIYD ASNRATGIPA RFSGSGSGTD STLTISSLEP EDFAVYYCQQ RSNWPRTFGQ GTKVEIKRTV AAPSVFIFPP SDEQLKSGTA SVVCLLNNFY PREAKVQWKV DNALQSGNSQ ESVTEQDSKD STYSLSNTLT LSKADYEKHK VYACEVTHQG LSSPVTKSFN RGEC
SEQ ID NO: 10, растворимая форма BLyS
AVQGPEETVT QDCLQLIADS ETPTIQKGSY TFVPWLLSFK RGSALEEKEN KILVKETGYF FIYGQVLYTD KTYAMGHLIQ RKKVHVFGDE LSLVTLFRCI QNMPETLPNN SCYSAGIAKL EEGDELQLAI PRENAQISLD GDVTFFGALK LL
Реферат
Группа изобретений относится к медицине и касается стабильного фармацевтического состава антигенсвязывающего белка, содержащего от 150 до 250 мг/мл антигенсвязывающего белка, от 1 до 100 мМ гистидинового буферного средства, от 70 до 170 мМ хлорида натрия и от 20 до 30 мМ аргинина, где указанный антигенсвязывающий белок является моноклональным антителом или его фрагментом, которые связываются с BLyS (SEQ ID NO: 1) или гетеро- или гомотримерной формой BLyS. Группа изобретений также касается способа лечения заболевания или состояния, выбранных из группы, состоящей из системной красной волчанки, васкулита, ассоциированного с антинейтрофильными цитоплазматическими антителами ("ANCA"), волчаночного нефрита, первичного синдрома Шегрена, хронической иммунной тромбоцитопении, миастении, симптоматической макроглобулинемии Вальденстрема, иммунной десенсибилизации у пациентов, ожидающих трансплантации почки, мембранозной нефропатии, системного склероза, ревматоидного артрита, множественной миеломы, рассеянного склероза и почечной недостаточности, у индивидуума, включающего введение индивидууму указанного состава в количестве, эффективном для лечения заболевания или состояния. Группа изобретений обеспечивает стабильное подкожное введение антитела в высокой концентрации. 3 н. и 18 з.п. ф-лы, 20 ил., 28 табл., 11 пр.

Комментарии