Составы, содержащие антитела - RU2745601C2
Код документа: RU2745601C2
Чертежи


Описание
Настоящее изобретение относится к новым фармацевтическим составам, прежде всего к новым фармацевтическим составам, в которых активный ингредиент включает антитела человека против интерлейкина Iβ человека (ИЛ-1β), прежде всего антитела, описанные в заявке WO 2002/016436.
Антитела, как и другие белковые лекарственные средства, представляют собой сложные соединения и в общем случае для обеспечения фармацевтически эффективной дозы для введения млекопитающим, прежде всего человеку, в фармацевтическом составе должно содержаться большое количество антител. Жидкие составы, содержащие белковые лекарственные средства, должны обеспечивать сохранение исходной биологической активности белкового лекарственного средства и защиту функциональных групп белкового лекарственного средства от разложения в процессе получения и хранения. Механизм деградации белков включает химическую и физическую нестабильность.
Сравнительно недавно полагали, что проблему нестабильности белковых лекарственных средств можно исключить при лиофилизации лекарственного средства с последующим его растворением немедленно или незадолго перед использованием. Однако вновь растворенные составы должны характеризоваться воспроизводимостью, стабильностью и физиологической активностью, чтобы обеспечить получение безопасного лекарственного средства и эффективные результаты лечения.
Жидкие фармацевтические составы, содержащие белковые лекарственные средства, т.е. антитела, должны также обладать стабильностью в течение длительного времени, содержать безопасное и эффективное количество фармацевтического соединения.
Давно известной проблемой при создании жидких белковых лекарственных составов является агрегация, при которой молекулы белка физически слипаются друг с другом, что приводит, например, к образованию опалесцирующего нерастворимого материала или осадка, и может вызвать нежелательную иммунологическую реакцию. Кроме того, основной проблемой, возникающей при агрегации, является возможность засорения шприцов или насосов, что снижает их безопасность.
Таким образом, существует необходимость в разработке составов, включающих белковые лекарственные средства, прежде всего антитела, характеризующихся долговременной стабильностью и отсутствием агрегации при высоких концентрациях антител. Настоящее изобретение относится к решению перечисленных выше проблем и предлагается новый состав, включающий антитела, в котором отсутствует агрегация белков, характеризующийся стабильностью и достаточно низкой вязкостью, и, следовательно, пригодный для введения млекопитающим, прежде всего человеку.
Интерлейкин-1β (ИЛ-1β или интерлейкин-1β в данном контексте используются взаимозаменяемо) является эффективным иммуномодулятором, который опосредует широкий спектр иммунных и воспалительных ответных реакций организма. Аномальное или избыточное продуцирование ИЛ-1β связано с патологией различных заболеваний и нарушений, таких как сепсис, септический или эндотоксический шок, аллергия, астма, остеопороз, ишемия, инсульт, ревматоидный артит и другие воспалительные заболевания. Антитела против ИЛ-1β предложено использовать для лечения опосредованных ИЛ-1 заболеваний и состояний, см., например, заявку WO 95/01997 и обсуждение во введении и заявку WO 02/16436, содержание которых включено в настоящее описание в качестве ссылки.
Прежде всего, предпочтительным антителом к ИЛ-1β для составов по настоящему изобретению является антитело ACZ885, описанное в данном контексте (последовательности Seq Id. No. 1 и Seq. Id. No. 2), или его функциональные фрагменты, сохраняющие сродство к антигену, такому как F(ab)2, Fab, scFv, домены VH, CDR.
В одном объекте настоящего изобретения предлагается состав, содержащий антитела, стабильные при хранении и доставке. Согласно настоящему изобретению стабильный состав обозначает состав, в котором антитело в основном сохраняет свою физическую и химическую стабильность, а также целостность при хранении. Например, содержание примесей и родственных соединений после лиофилизации и хранения или после хранения в случае жидких составов составляет приблизительно 2-5%, предпочтительно 2-3%. Стабильность составов, содержащих антитела, можно оценивать методом анализа биологической активности, при этом биологическая активность при хранении должна сохраняться на уровне приблизительно 80-125% от исходной активности. Биологическую активность антител в составе по настоящему изобретению при хранении определяют методом анализа с использованием гена-репортера и генетически модифицированных линий клеток, как описано в разделе Примеры ниже.
В еще одном объекте настоящего изобретения предлагается стабильный жидкий состав, содержащий антитела, пригодный для подкожного введения. Предпочтительно жидкий состав также можно использовать для лиофилизации и последующего растворения. В настоящем изобретении также предлагается состав, стабильный по крайней мере в течение периода времени, в который его вводят млекопитающим, прежде всего человеку.
В общем случае предпочтительно использовать небольшие объемы фармацевтического состава для подкожного введения (обычно максимум 1,0 мл - 1,2 мл). В случае составов, содержащих антитела, например, высокую дозу антител для подкожного введения, требуется использовать составы с высокой концентрацией антител (например, 50 мг/мл - 150 мг/мл ил более). Из-за требуемой высокой концентрации антител создание составов, содержащих антитела, представляет собой сложную задачу с учетом необходимой физической и химической стабильности антител, образования агрегатов и трудностей получения, хранения и доставки составов, содержащих антитела.
Повышенная вязкость белковых составов является отрицательным фактором при переработке, например, повышенная вязкость влияет на технологические характеристики состава при введении жидкости через систему доставки пациенту, при высокой вязкости жидкий состав может застревать в игле, что вызывает дискомфорт у пациента, увеличивает продолжительность инъекции и ухудшает применимость автоинжектора. Кроме того необходимым условием простоты переработки, хранения и применения для составов, содержащих относительно высокую концентрацию антител, является их низкая вязкость. Термин «вязкость», используемый в данном контексте, может обозначать кинематическую вязкость или абсолютную вязкость. Обычно кинематическую вязкость выражают в сантистоксах (сСт). Единицей кинематической вязкости в системе СИ является мм2/с, что соответствует 1 сСт. Абсолютную вязкость выражают в сантипуазах (сП). Единицей абсолютной вязкости в системе СИ является миллипаскаль в секунду (мПа/с), причем 1 сП = 1 мПа/с.
Таким образом, настоящее изобретение относится к составам, содержащим антитела против ИЛ-1β, стабильным и не содержащим агрегатов при высокой концентрации антител и характеризующимся достаточно низкой вязкостью.
Жидкие фармацевтические составы, содержащие антитела, должны соответствовать предварительно определенным требованиям. Одной из основных проблем жидких лекарственных средств является стабильность, так как белки имеют тенденцию к образованию растворимых и нерастворимых агрегатов во время получения и хранения составов. Кроме того в растворах могут протекать различные химические реакции (деамидирование, окисление, расщепление, изомеризация и т.п.), приводящие к увеличению степени деградации продукта и/или потере биологической активности. Предпочтительно, жидкие составы, содержащие антитела, должны характеризоваться сроком хранения более 18 месяцев. Наиболее предпочтительно жидкий состав ACZ885 должен характеризоваться сроком хранения более 24 месяцев. Срок хранения и активность антитела против ИЛ-1β определяют по данным анализа биоактивности, как описано в разделе Примеры, при этом должно сохраняться от 80% до 125% исходной активности.
Состав, содержащий антитела, прежде всего состав, содержащий антитела ACZ885, должен характеризоваться сроком хранения от приблизительно 36 до 60 месяцев при 2-8°С. Предпочтительно жидкий состав ACZ885 должен характеризоваться сроком хранения от приблизительно 24 до 36 месяцев при 2-8°С. Предпочтительно лиофилизированный состав ACZ885 должен характеризоваться сроком хранения до 60 месяцев при 2-8°С.
Основными факторами, определяющими срок хранения, обычно являются образование побочных продуктов и продуктов разложения, а также потеря биологической активности. Состав по настоящему изобретению характеризуется требуемым уровнем стабильности.
Кроме достаточно высокой физической и химической стабильности состав должен характеризоваться приемлемым значением pH и осмотической концентрации (от 250 до 500 мОсмоль/кг) для подкожного введения. Однако литературные данные свидетельствуют о том, что составы с высокой осмотической концентрацией (до 1100 мОсмоль/кг) можно вводить подкожно без значительного ощущения боли или жжения после введения. Известно также, что высокая концентрация антител увеличивает вязкость состава и степень агрегации. Пригодные фармацевтические составы по настоящему изобретению характеризуются вязкостью от приблизительно менее 16 мПа, предпочтительно от 3 до 16 мП и еще более предпочтительно 3-10 мП.
В настоящем изобретении неожиданно было установлено, что можно получать высокостабильные составы, содержащие антитела, характеризующиеся преимуществами в отношении сохранения активности антител в течение длительного периода хранения без агрегации и характеризующиеся пригодной вязкостью не смотря на высокую концентрацию антител. В объекте настоящего изобретения предлагается фармацевтический состав (состав по настоящему изобретению), включающий антитела в качестве активного ингредиента, буферную систему, стабилизатор и ПАВ. Состав по настоящему изобретению представляет собой жидкость, пригодную также для лиофилизации и повторного растворения с образованием жидкого состава с более низкой, аналогичной или более высокой концентрацией антител. Вновь растворенный состав обозначает состав, полученный из лиофилизированного продукта, при этом антитела находятся в полученном составе в диспергированном виде.
Настоящее изобретение относится к новым составам, содержащим антитела против ИЛ-1β в качестве активного ингредиента и буферную систему, характеризующуюся значением pH от 5,5 до 7,5, предпочтительно от 5,5 до 7, еще более предпочтительно от 6,2 до 6,8. Кроме того настоящее изобретение относится к новым фармацевтическим составам, включающим антитело ACZ885 в качестве активного ингредиента и буферную систему, характеризующуюся значением pH от 5,5 до 7,5, предпочтительно от 5,5 до 7, более предпочтительно от 6,2 до 6,8.
Было также установлено, что стабильный состав можно получить с использованием буферной системы, характеризующихся значением pH от 5,5 до 7,5, предпочтительно от 5,5 до 7, более предпочтительно от 6,2 до 6,8. В одном варианте pH находится в указанных выше интервалах, например, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8.
Предпочтительные буферные системы по настоящему изобретению включают цитратную, гистидиновую, натрий сукцинатную и натрий и/или калий фосфатную буферные системы и другие, органические или неорганические кислоты, более предпочтительно гистидиновую или цитратную буферные системы, причем наилучшие результаты получены с использованием гистидиновой буферной системы.
Концентрация пригодной буферной системы по настоящему изобретению составляет от приблизительно 10 мМ до приблизительно 50 мМ или от приблизительно 10 мМ до приблизительно 40 мМ, в зависимости, например, от буферного вещества и требуемой стабильности состава.
В предпочтительном варианте буферная система обозначает гистидиновый буферный раствор, причем гистидин предпочтительно используют в концентрации от 10 до 50 мМ, предпочтительно от 15 до 40 мМ, еще более предпочтительно от 20 до 30 мМ.
Состав по настоящему изобретению предпочтительно может содержать стабилизатор. Стабилизаторы по настоящему изобретению включают сахарозу, трегалозу, маннит, сорбит и гидрохлорид аргинина. Наилучшие результаты получены с использованием сахарозы или маннита. Концентрация пригодных стабилизаторов в составе по настоящему изобретению составляет от приблизительно 50 до 300 мМ, предпочтительно от 180 до 300 мМ, наиболее предпочтительно приблизительно 270 мМ сахарозы или маннита. В одном объекте лиофилизированный и вновь растворенный жидкий состав содержит сахарозу или манит в качестве стабилизатора. В другом объекте жидкий состав содержит маннит в качестве стабилизатора.
Состав по настоящему изобретению необязательно также включает один или более эксципиентов, выбранных из группы, включающей наполнитель, соль, ПАВ и консервант.
Наполнитель обозначает соединение, которое добавляют для увеличения массы фармацевтического состава, и которое улучшает физическую структуру состава в лиофилизированной форме. Пригодные наполнители по настоящему изобретению включают маннит, глицин, полиэтиленгликоль и сорбит. Концентрация наполнителя по настоящему изобретению составляет 20-90 мМ.
Использование ПАВ снижает агрегацию вновь растворенного белка и/или снижает формирование частиц во вновь растворенном составе. ПАВ добавляют в количестве, которое обеспечивает снижение агрегации вновь растворенного белка и сводит к минимуму формирование частиц после повторного растворения.
Пригодные ПАВ по настоящему изобретению включают полисорбаты (например, полисорбаты 20 или 80), полоксамеры (например, полоксамер 188), тритон, додецилсульфат натрия (ДСН)), лаурилсульфат натрия, октилгликозид натрия, лаурил-, миристил-, линолеил- или стеарилсульфобетаин, лаурил-, миристил-, линолеил- или стеарилсаркозин, линолеил-, миристил- или цетилбетаин, лауроамидопропил-, кокамидопропил-, линолеамидопропил-, миристамидопропил-, пальмидопропил- или изостеарамидопропилбетаин (например, лауроамидопропил), миристамидопропил-, пальмидопропил- или изостеарамидопропилдиметиламин, натриевую соль метилкокоил- или динатриевую соль метилолеилтауроновой кислоты и ПАВ серии MONAQUAT® (Mona Industries, Inc., Paterson, New Jersey), полиэтиленгликоль, полипропиленгликоль и сополимеры этиленгликоля и пропиленгликоля (например, плюроник PF68 и т.п.). В предпочтительном варианте ПАВ выбирают из группы, включающей полисорбат 20 и полисорбат 80.
Концентрация ПАВ в составах по настоящему изобретению составляет от приблизительно 0,001 до 0,5 об.% или от приблизительно 0,005 до 0,10 об.%, предпочтительно от 0,01 до 0,10 об.%, наиболее предпочтительно от приблизительно 0,04 до 0,06 об.%. ПАВ добавляют в состав перед лиофилизацией, в лиофилизированный состав и/или во вновь растворенный состав при необходимости, предпочтительно ПАВ добавляют перед лиофилизацией.
В составах по настоящему изобретению необязательно используют консервант. Пригодные консерванты для применения в составах по настоящему изобретению включают хлорид октадецилдиметилбензиламмония, хлорид гексаметония, хлорид бензалкония (смесь хлоридов алкилбензилдиметиламмония, которые содержат алкильные группы с длинной цепью) и хлорид бензетония. Другие типы консервантов включают ароматические спирты, такие как фенол, бутиловый и бензиловый спирты, алкилпарабены, такие как метил- или пропилпарабен, катехин, резорцин, циклогексанол, 3-пентанол и мета-крезол.
Другие фармацевтически пригодные носители, эксципиенты или стабилизаторы, такие как описанные в справочнике Remington's Science and Practice of Pharmacy, 21 издание (2005) или Art, Science and Technology of Pharmaceutical Compounding, 3 издание (2008), можно включать в составы по настоящему изобретению при условии, что они не оказывают отрицательное влияние на характеристики состава. Пригодные носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях и включают дополнительные буферные агенты, консерванты, сорастворители, антиоксиданты, включая аскорбиновую кислоту и метионин, хелатные агенты, такие как ЭДТУ, комплексы металлов (например, комплексы цинка с белками), биодеградабельные полимеры, такие как полиэфиры и/или солеобразующие противоионы, такие как натрий.
В одном объекте настоящего изобретения предлагается стабильный жидкий, лиофилизированный или вновь растворенный состав, содержащий антитела, предпочтительно антитело против ИЛ-1β, наиболее предпочтительно ACZ885 и буферную систему, причем значение pH жидкого или вновь растворенного состава составляет от 5,5 до 7,5, предпочтительно от 5,5 до 7, предпочтительно от 6,2 до 6,8, при этом достигается требуемая стабильность, минимальная агрегация и приемлемая низкая вязкость. Состав по настоящему изобретению пригоден для лиофилизации и повторного растворения в воде в течение приемлемого периода времени, обычно менее 10 мин. В настоящем изобретении предлагается стабильный вновь растворенный состав, содержащий антитело против ИЛ-1β, наиболее предпочтительно антитело ACZ885, и буферную систему, при этом указанный состав получен из лиофилизированной смеси антител и буферной системы, причем значение pH вновь восстановленного состава составляет от 5,5 до 7,5, предпочтительно от 5,5 до 7, предпочтительно от 6,2 до 6,8, а время растворения составляет менее 10 мин. Стабильный вновь растворенный состав обозначает состав, в котором антитела в основном сохраняют свою физическую и химическую стабильность, а также целостность при хранении в течение периода времени от повторного растворения до применения, обычно в течение от нескольких часов до нескольких дней.
В другом варианте осуществления настоящего изобретения предлагается способ получения состава, включающий следующие стадии: (а) лиофилизация состава, содержащего антитело против ИЛ-1β, наиболее предпочтительно антитело ACZ885, и буферную систему, и (б) повторное растворение лиофилизированной смеси, полученной на стадии (а), в среде для повторного растворения, при этом получают стабильный состав.
Состав, полученный на стадии (а) может дополнительно содержать стабилизатор и один или более эксципиентов, выбранных из группы, включающей наполнитель, соль, ПАВ и консервант, как описано в данном контексте.
В качестве среды для повторного растворения используют некоторые разбавленные органические кислоты или воду, например, стерильную воду или бактериостатическую воду для инъекций. Среду для повторного растворения выбирают из группы, включающей стерильную воду, бактериостатическую воду для инъекций, или из группы, включающей уксусную кислоту, пропионовую кислоту, янтарную кислоту, хлорид натрия, хлорид магния, кислотный раствор хлорида натрия, кислотный раствор хлорида магния и кислотный раствор аргинина при концентрации от приблизительно 50 до приблизительно 100 мМ.
Таким образом, в настоящем изобретении предлагается фармацевтический состав, содержащий
а) антитело против ИЛ-1β, предпочтительно антитело ACZ885, при концентрации от приблизительно 10 до 150 мг/мл и
б) буферную систему, предпочтительно цитратную, гистидиновую, натрий сукцинатную или натрий и/или калий фосфатную буферную систему, наиболее предпочтительно гистидиновую буферную систему, причем указанную буферную систему используют при концентрации от приблизительно 10 до 50 мМ, а значение pH буферной системы составляет от 5,5 до 7,5, предпочтительно от 6,2 до 6,8, и необязательно:
в) стабилизатор, предпочтительно сахарозу, трегалозу, маннит, сорбит или гидрохлорид аргинина, наиболее предпочтительно сахарозу или маннит при концентрации от приблизительно 50 до 300 мМ и необязательно
г) дополнительные эксципиенты, выбранные из группы, включающей наполнитель, соль, ПАВ и консервант.
В некоторых вариантах наполнитель (например, маннит или глицин) используют для получения состава, предназначенного для лиофилизации. Наполнитель позволяет получить однородный лиофилизированный продукт без избыточных пустот.
Предпочтительный жидкий состав по настоящему изобретению обозначает состав, содержащий ACZ885 в концентрации 10-150 мг/мл, 270 мМ маннит, 20 мМ гистидин и 0,04% полисорбат 80, причем pH состава составляет 6,5.
Предпочтительный вновь растворенный состав по настоящему изобретению обозначает лиофилизированный состав, который после повторного растворения содержит ACZ885 в концентрации 10-150 мг/мл, 270 мМ сахарозу, 30 мМ гистидин и 0,06% полисорбат 80, причем pH состава составляет 6,5.
В настоящем изобретении также предлагается способ лечения млекопитающих, прежде всего человека, включающий введение терапевтически эффективного количества вновь растворенного состава, описанного в данном контексте, млекопитающему, прежде всего человеку, причем млекопитающее, прежде всего человек, страдает от нарушения, требующего лечения антителом против ИЛ-1β, наиболее предпочтительно ACZ885. Например, состав можно вводить подкожно.
Составы по настоящему изобретению можно использовать для профилактики и лечения опосредованных ИЛ-1 заболеваний или состояний, например, воспалительных состояний, аллергии и аллергических состояний, реакции повышенной чувствительности, аутоиммунных реакций, тяжелых инфекций и отторжения трансплантатов тканей или органов.
В одном объекте настоящего изобретения предлагается применение состава по настоящему изобретению для лечения опосредованных ИЛ-1 заболеваний или состояний.
Например, составы по настоящему изобретению можно использовать для лечения реципиентов трансплантатов сердца, легкого, сердца-легкого, печени, почек, поджелудочной железы, кожи или роговицы, включая отторжение аллотрансплантата или ксенотрансплантата и для предотвращения заболевания трансплантат-против-хозяина, например, при пересадке костного мозга и органов, связанной с артериосклерозом.
Составы по настоящему изобретению прежде всего можно использовать для лечения, профилактики или снижения интенсивности симптомов аутоиммунных заболеваний и воспалительных состояний, прежде всего воспалительных состояний с этиологией, включающей аутоиммунный компонент, таких как артрит (например, ревматоидный артрит, хронический прогрессирующий артрит и деформирующий артрит) и ревматические заболевания, включая воспалительные состояния и ревматические заболевания, включая остеопороз, воспалительную боль, повышенную чувствительность (включая как повышенную чувствительность дыхательных путей, так и повышенную чувствительность кожи) и аллергии. Специфические аутоиммунные заболевания, для лечения которых можно применять составы по настоящему изобретению, включают аутоиммунные гематологические нарушения (включая, например, гемолитическую анемию, истинную эритроцитарную анемию, апластическую анемию, истинную эритроцитарную анемию и идиопатическую тромбоцитопению), системную красную волчанку, полихондрит, склеродермию, гранулематоз Вегенера, дерматомиозит, хронический активный гепатит, тяжелую псевдопаралитическую миастению, псориаз, синдром Стивенса-Джонсона, идиопатическую энтеропатию, аутоиммунное идиопатическое воспалительное заболевание кишечника (включая, например, неспецифический язвенный колит, болезнь Крона и синдром раздраженной кишки), эндокринную офтальмопатию, болезнь Грейва, саркоидоз, рассеянный склероз, биллиарный первичный цирроз печени, юношеский диабет (сахарный диабет типа I), увеит (передний или задний), сухой кератоконъюктивит и ранний кератоконъюктивит, интерстициальный фиброз легких, псориатический артрит и гломерулонефрит (с нефротическим синдромом или без него, например, включая идиопатический нефротический синдром или нефропатию минимальных изменений).
Составы по настоящему изобретению можно также использовать для лечения, профилактики или снижения интенсивности симптомов астмы, бронхита, пневмокониоза, эмфиземы легких и других обструктивных или воспалительных заболеваний дыхательных путей.
Составы по настоящему изобретению можно также использовать для лечения нежелательных острых и гиперострых воспалительных реакций, опосредованных ИЛ-1 или включающих продуцирование ИЛ-1, прежде всего, ИЛ-1β, или опосредованных высвобождением ФНО при действии ИЛ-1, например, острых инфекций, например, септического шока (например, эндотоксического шока и респираторного дистресс-синдрома взрослых), менингита, пневмонии и тяжелых ожогов, а также для лечения кахексии или синдрома истощения, связанного с патологическим высвобождением ФНО в результате инфекции, рака или дисфункции органа, прежде всего кахексии, связанной со СПИД, например, связанного с ВИЧ-инфекцией или развивающегося после инфицирования ВИЧ.
Составы по настоящему изобретению прежде всего можно использовать для лечения заболеваний метаболизма костной ткани, включая остеоартрит, остеопороз и другие воспалительные артриты, и потерю костной ткани, включая возрастной остеопороз и прежде всего пародонтит.
Составы по настоящему изобретению можно использовать для профилактики и лечения аутовоспалительного синдрома у пациентов, таких как млекопитающие, прежде всего человек. Аутовоспалительные синдромы по настоящему изобретению включают, например, но, не ограничиваясь только ими, группу наследственных нарушений, характеризующихся рецидивирующими эпизодами воспаления, которые в отличие от аутоиммунных заболеваний не характеризуются высоким титром аутоантител или антигенов специфических Т клеток. Кроме того, аутовоспалительный синдром по настоящему изобретению характеризуется повышенным уровнем секреции ИЛ-1β (потеря отрицательной регуляторной роли пирина, который мутирует при указанных заболеваниях), активация фактора NFkB и нарушенный апоптоз лейкоцитов). Аутовоспалительный синдром по настоящему изобретению включает синдром Макла-Уэлса, поздний аутоиммунный диабет взрослых, семейный холодовой аутовоспалительный синдром, криопирин-связанный перемежающийся синдром, мультисистемный воспалительный синдром неонатального возраста, хронический младенческий неврологический кожно-артикулярный синдром, семейная средиземноморская лихорадка и/или некоторые формы ювенильного артрита, такие как ювенильный идиопатический артрит системного происхождения, некоторые формы ювенильного ревматоидного артрита, такие как ювенильный идиопатический ревматоидный артрит системного происхождения и/или некоторые формы ревматоидного артрита взрослых.
Предпочтительно составы по настоящему изобретению можно использовать для профилактики и лечения ювенильного ревматоидного артрита и ревматоидного артрита взрослых и/или синдрома Макла-Уэлса.
Составы по настоящему изобретению можно также использовать для лечения диабета 2 типа, в тех случаях, если клинические и доклинические исследования свидетельствуют об улучшении функции островковых клеток за счет блокады ИЛ-1. Составы по настоящему изобретению кроме того можно использовать для лечения различных форм патологических состояний, связанных с диабетом, таких как ретинопатия, заживление ран, сосудистые заболевания (включая артериальный рестеноз после стентирования или ангиопластики), почечную дисфункцию, хроническое заболевание почек, а также метаболический синдром и ожирение. Составы по настоящему изобретению можно также использовать для лечения мигрени, синовита, подагры, псевдоподагры/подагрического артрита или хондрокальциноза, хронического обструктивного заболевания легких, повреждения, вызванного вентиляцией легких, различных болевых состояний, таких как морфинрезистентная боль, невропатическая боль, досрочная родовая боль, боль при смещении межпозвоночных дисков, воспалительная боль, головная боль или мигрень. ИЛ-1β принимает участие в восприятии боли и усиливает нейрогенные сигналы. Кроме того, составы по настоящему изобретению можно использовать для лечения атеросклероза, острых почечных колик, билиарных колик и боли, связанной с указанными нарушениями.
Составы по настоящему изобретению можно использовать для лечения синдромов перемежающейся лихорадки: семейной средиземноморской лихорадки, перемежающегося синдрома, ассоциированного с рецептором фактора некроза опухоли, синдрома гипериммуноглобулина D, также известного как синдром перемежающейся лихорадки, связанный с мевалонаткиназой, семейного холодового аутовоспалительного синдрома и перемежающейся лихорадки, афтозного стоматита, фарингита, аденита, при которых ИЛ-1β является доминантным цитокином. Другие заболевания, при которых ИЛ-1β является доминантным цитокином и которые можно лечить с использованием составов по настоящему изобретению, включают синдром анти-синтетазы, синдром активации макрофагов, болезнь Бехчета, синдром Блау, синдром PAPA, синдром Шницлера, синдром Свита. Соединения по настоящему изобретению, блокирующие лиганд-рецептор ИЛ-1β и ИЛ-1β, можно также использовать для лечения васкулита, гигантоклеточного артериита, пурпура Геноха-Шенлейна, первичного системного васкулита, болезни Кавасаки (слизисто-кожный межузелковый синдром), артериита Такаясу, нодозного полиартериита, эссенциального криоглобулинемического васкулита, ангиопатии микроскопических сосудов и синдрома Чарга-Стросса, уртикарного васкулита. Кроме того составы по настоящему изобретению можно использовать для лечения аутоиммунных заболеваний, таких как саркоидоз, обыкновенная пузырчатка, анкилозирующий спондилоартрит, болезнь Альцгеймера, амилоидоз, вторичный амилоидоз и болезнь Стилла взрослых.
Составы по настоящему изобретению можно использовать для лечения опосредованных HLA-B27 заболеваний, таких как, но, не ограничиваясь только ими, псориатический анкилозирующий спондилоартрит, артрит Рейтера и энтеропатический артрит. Антитела против ИЛ-1β по настоящему изобретению можно использовать для лечения ревматической атаки, ревматической полимиалгии и гигантоклеточного артериита. Составы по настоящему изобретению также можно использовать для лечения инфекций, прежде всего бактериальных инфекций и вирусных инфекций, более предпочтительно для лечения бактериальных инфекций, связанных с симптомами или проявлениями артрита, такими как, но, не ограничиваясь только ими, гематологический остеомиелит, инфекционный артрит, туберкулезный артрит.
Для показаний, описанных выше, пригодные дозы зависят, например, от конкретного используемого антитела против ИЛ-1β, организма-хозяина, способа введения и природы и тяжести состояния, подлежащего лечению. Частота введения в профилактических целях обычно составляет от приблизительно одного раза в неделю до приблизительно одного раза в 3 месяца, более предпочтительно приблизительно от одного раза в 2 недели до одного раза в 10 дней, например, один раз каждые 4 или 8 недель.
Составы по настоящему изобретению вводят пациенту в ходе одного курса лечения или в ходе нескольких курсов лечения, и их можно вводить пациенту в любое время после постановки диагноза, как в отдельности, так и в комбинации с другими лекарственными средствами или курсами лечения, пригодными для лечения состояний, описанных в данном контексте.
Профилактическое лечение обычно включает введение состава по настоящему изобретению от одного раза в месяц до одного раза каждые 2 или 3 месяца, или более редко.
Состав по настоящему изобретению, содержащий ACZ885, вводят предпочтительно внутривенно, но его также можно вводить подкожно или внутримышечно. Для указанных целей состав вводят с помощью шприца. Например, состав, содержащий ACZ885, вводят с использованием автоинжектора, обычного шприца, необязательно предварительно заполненного, необязательно в стерильной упаковке, необязательно используют шприцы с защитными устройствами. Для введения можно также использовать микроиглы и пластыри с покрытиями и резервуаром.
Составы по настоящему изобретению можно вводить млекопитающим, предпочтительно человеку, нуждающимся в лечении с использованием антител против ИЛ-1β, т.е. ACZ885, известным способом, таким как внутривенное введение, в виде струйного вливания или непрерывного вливания в течение определенного периода времени, внутримышечный, внутрибрюшинный, цереброспинальный, подкожный, внутрисуставный способ, инъекция в синовиальную полость, внутриоболочечный, пероральный, местный способ или ингаляция.
Составы для введения in vivo должны быть стерильными. Стерилизацию проводят при фильтровании через стерильную мембрану до или после лиофилизации и повторного растворения. В другом варианте стерилизацию смеси проводят при автоклавировании ингредиентов, за исключением антител, например, при приблизительно 120°С в течение приблизительно 30 мин.
Составы по настоящему изобретению, содержащие ACZ885, предпочтительно вводят подкожно при лечении ревматоидного артрита у взрослых, ювенильного ревматоидного артрита, хронического обструктивного заболевания легких, криопирин-связанного перемежающегося синдрома, синдрома Макла-Уэлса, остеоартрита, диабета типа 2 и подагры.
В настоящем изобретении также предлагается изотонический жидкий состав, который получают разбавлением вновь растворенного состава раствором для вливаний.
Термин «лечение» относится как к терапевтическому лечению, так и к профилактике или предотвращению заболевания.
Термин «млекопитающее» в отношении объекта лечения относится к любому животному, относящемуся к млекопитающим, включая человека, домашних и сельскохозяйственных животных, животных в зоопарке, животных, используемых для спортивных мероприятий или домашних животных, таких как собаки, лошади, кошки, крупный рогатый скот и т.п. Предпочтительное млекопитающее обозначает человека.
Нарушение обозначает любое состояние, которое можно улучшить при лечении антителом против ИЛ-1β. Указанные состояния включают хронические и острые заболевания или нарушения, включая патологические состояния, которые приводят к предрасположенности млекопитающих к описанным нарушениям. Примеры нарушений, подлежащих лечению, включают описанные выше заболевания и нарушения, но не ограничиваются только ими.
Терапевтически эффективное количество обозначает по крайней мере минимальную концентрацию, требуемую для достижения значимого улучшения или предотвращения конкретного нарушения.
Описание фигур
На фиг. 1 показаны результаты анализа методом оф-ЖХВР (верхняя диаграмма) и гельпроникающей хроматографии (нижняя диаграмма) состава, содержащего ACZ885, через 4 недели хранения при 40°С.
На фиг. 2 показана относительная эффективность состава, содержащего ACZ885, через 4 недели хранения при 40°С.
Примеры
Получение жидкого состава и лиофилизированного продукта
Получали состав, содержащий ACZ885, пригодный после повторного растворения, как для внутривенного введения, так и для последующего разбавления и подкожного введения.
Для проверки пригодности для использования в составах, содержащих ACZ885, были выбраны четыре различных буферных системы (цитратная, гистидиновая, натрий сукцинатная и натрия/калий фосфатная буферные системы при концентрации каждой системы 40 мМ).
Для оценки пригодности буферных систем в отношении агрегации белков использовали циклы встряхивания и замораживания-оттаивания.
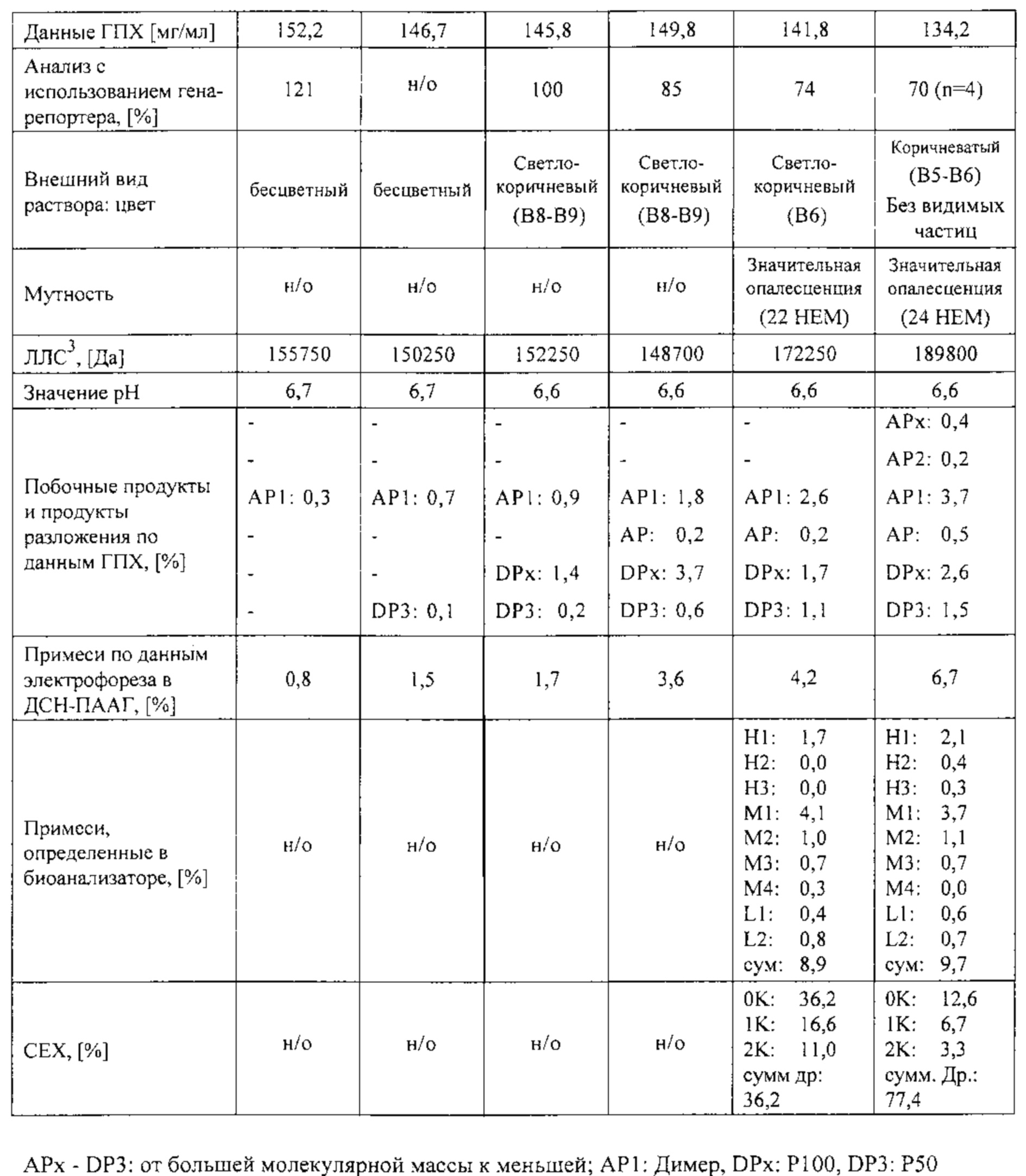
Наименьшая агрегации белка наблюдается при использовании гистидиновой или цитратной буферной системы в интервале pH от 5,0 до 7, как показано в таблице 1.


Исследовали влияние pH в интервале от 3,5 до 8,0 (шаг увеличения pH составлял 0,5 единиц pH). Через 4 недели хранения при 40°С и различных значениях pH по данным различных аналитических методов был выбран оптимальный интервал от 6,2 до 6,8, как показано на фиг. 1.

Для гистидиновой и цитратной буферных систем получены аналогичные результаты. Цитратный буферный раствор не пригоден для подкожных инъекций, так как увеличивает болевые ощущения после введения, следовательно, гистидиновый буферный раствор предпочтителен по сравнению с цитратным буферным раствором для составов, предназначенных для подкожного введения.
После выбора пригодного буферного раствора исследовали влияние стабилизаторов на агрегацию белка. Составы, содержащие сахарозу, глицин, маннит, сорбит или трегалозу, анализировали после хранения в течение 6 и 16 недель при 5°С и 40°С. В случае состава, содержащего сахарозу, после хранения при 40°С наблюдалось образование раствора желтого цвета, возможно вследствие реакции Майяра между аминогруппами белка или гистидина и восстанавливающим сахаром. Составы, содержащие сахарозу или маннит, были выбраны для лиофилизации и повторного растворения. Составы, содержащие маннит, были выбраны для получения жидких составов.
Дальнейшие исследования проводили для оценки влияния концентрации ПАВ на физико-химическую стабильность состава по настоящему изобретению. Приведенные ниже данные свидетельствуют о том, что составы, не содержащие ПАВ, характеризуются наибольшим содержанием частиц и, что твин является предпочтительным с точки зрения физической стабильности образцов. Твин в концентрации 0,10% характеризуется более высоким содержанием частиц по сравнению с более низкими концентрациями.

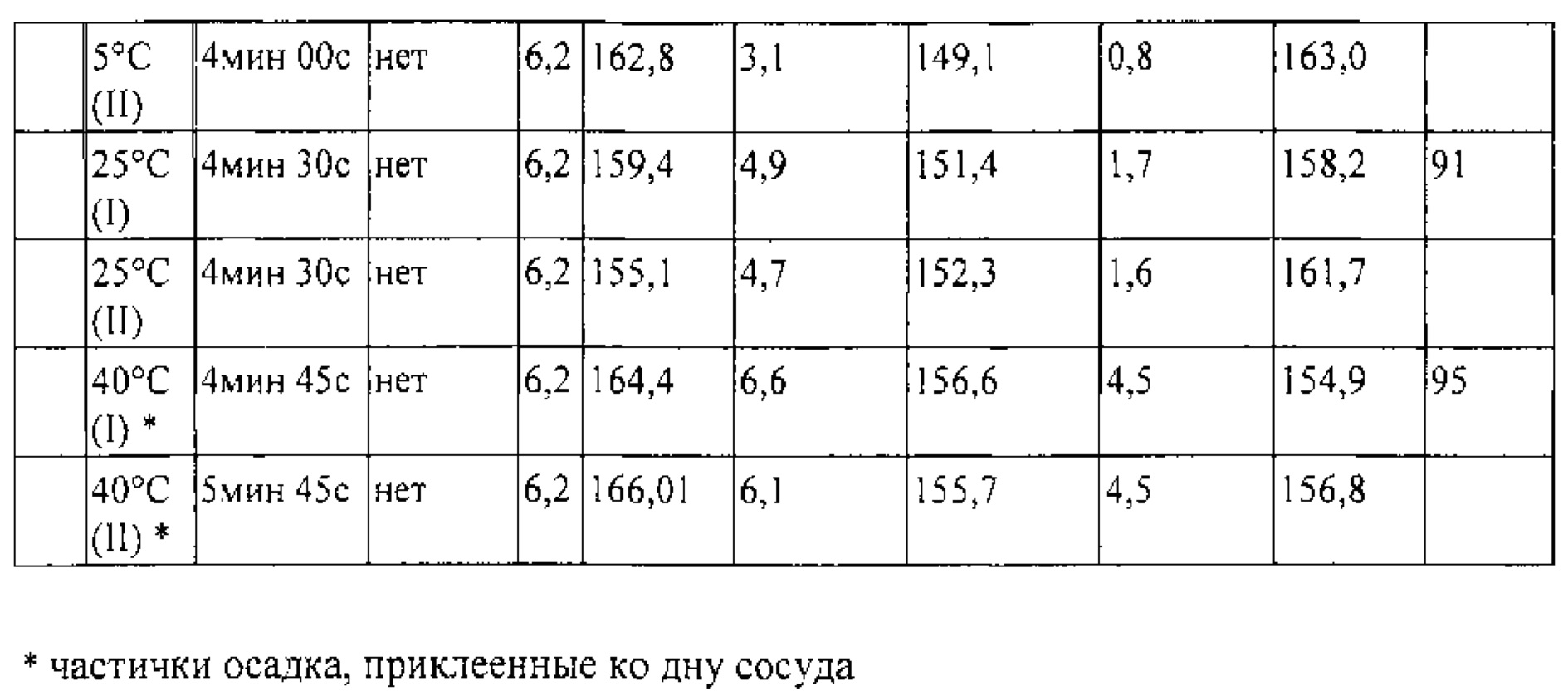
Образцы жидкого состава, содержащего 150 мг/мл ACZ885, 20 мМ гистидин, 270 мМ маннит, 0,04% (мас/об) твин 80, pH 6,5, хранили при 5°С, 25°С и 40°С в течение до 24 месяцев. При 5°С не наблюдается значительного количества растворимых и нерастворимых агрегатов. Биоактивность, определенная методом анализа с использованием гена-репортера, как описано в данном контексте, составляет от 70 до 125%. Эти данные (см. таблицы 4-6) свидетельствуют о том, что исследуемый состав стабилен при хранении в течение 24 месяцев.




Повторное растворение лиофилизированного состава
Жидкие составы по настоящему изобретению, содержащие ACZ885, пригодны для лиофилизации. Лиофилизацию можно проводить в нормальных условиях, известных в области фармацевтики. Можно добавлять наполнитель, повышающий массу лиофилизата и улучшающий его внешний вид, например, такой как глицин.
К антителам добавляли буферное вещество до концентрации от 10 до 40 мМ, стабилизатор и ПАВ и смешивали, а полученный состав лиофилизировали.

Повторное растворение обычно проводили при температуре 15-25°С для обеспечения полной гидратации. Лиофилизат растворяли в стерильной воде.
Конечная концентрация после повторного растворения составляет 150 мг/мл, каждый состав лиофилизовали и снова растворяли в воде.
Стабильность
Различные составы хранили в течение трех месяцев при температурах 2-8 С, 25°С и 40°С.
В качестве индикатора стабильности белка использовали агрегацию после лиофилизации и хранения.
Анализ с использованием гена-репортера
Биологическую активность ACZ885 определяли с использованием гена-репортера и генетически модифицированной линии клеток. Указанную линию клеток получали из эмбриональных клеток почек человека и стабильно трансфектировали конструктом-репортером, в котором промотер NF-kappa b (промотер, чувствительный к ИЛ-1β) вставлен перед последовательностью люциферазы.
Трансфекцию проводили при совместном введении устойчивого к неомицину гена. В указанной клеточной линии в присутствии ИЛ-1β стимулируется экспрессия люциферазы по дозозависимому механизму.
Добавление определенных количеств ACZ885 к фиксированной субмаксимальной дозе ИЛ-1β вызывало снижение экспрессии люциферазы в течение периода инкубации до 18 ч. При завершении периода инкубации количество люциферазы оценивали по ее ферментативной активности в клеточном лизате. Люцифераза катализирует превращение субстрата люциферина в оксилюциферин, являющийся хемилюминесцентным продуктом, люминесценцию (затухающего типа) которого измеряли на пригодном люминометре.
Биологическую активность исследуемого образца ACZ885 определяли при сравнении его ингибирующей активности в отношении ИЛ-1β-зависимой индукции активности люциферазы со стандартным образцом ACZ885. Образцы и стандарт нормализовали по содержанию белка. Относительную активность затем рассчитывали с использованием параллельной группы анализов в соответствии с Европейской фармакопеей. Конечный результат выражали в виде относительной активности (в процентах) образца по сравнению со стандартным образцом.
Реагенты и буферные растворы
- стандартная клеточная среда MEM + среда Эрла + L-глютамин,
- инактивированная при нагревании эмбриональная телячья сыворотка (ЭТС), протестированная на отсутствие микоплазмы,
- генетицин,
- буферный раствор для отделения клеток, не содержащий ферментов на основе фосфатного солевого буферного раствора (ФСБ),
- среда для анализа OptiMEM-I + GlutaMAX-I,
- субстрат люциферазы для хемилюминесценции затухающего типа,
- рекомбинантный интерлейкин-1β (ИЛ-1β).
Стадии анализа
1) Готовили стандартный образец и образцы исследуемого соединения при различных концентрациях, т.е. серийные разведения 1:2 исходных растворов, содержащих 400 нг/мл ACZ885,
2) 2×104 клеток, ресуспендированных в среде для анализа, добавляли в каждую лунку 96-луночного микропланшета,
3) анализ инициировали при добавлении раствора ИЛ-1β и планшеты выдерживали в увлажненном инкубаторе в атмосфере СО2 в течение 18 ч,
4) после выдерживания в каждую лунку добавляли раствор субстрата люциферазы. Планшет затем выдерживали в темноте в течение 10 мин и измеряли люминесценцию в каждой лунке на соответствующем люминесцентном ридере для микропланшетов,
6) средневзвешенную относительную активность образца рассчитывали с использованием параллельной группы анализов в соответствии с Европейской фармакопеей по данным по крайней мере двух независимых экспериментов.

Состав 3 характеризуется самой низкой степенью агрегации. Составы 1 и 3 проявляют биологическую активность при хранении на уровне приблизительно 90-105% от исходной активности.
Введение состава
Соответствующую дозу (т.е. терапевтически эффективное количество) ACZ885 вводили в зависимости, например, от состояния, подлежащего лечению, тяжести и развития заболевания, цели введения ACZ885 (для профилактики или лечения заболевания), предшествующего курса лечения, истории болезни пациента и ответной реакции на ACZ885 и мнения лечащего врача.
Тяжелая цепь ACZ885, вариабельный фрагмент Seq. Id. No. 1

Легкая цепь ACZ885, вариабельный фрагмент Seq. Id. No. 2


--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Новартис AG
<120> Состав антител против IL-1b
<130> 53159
<160> 4
<170> Patentln version 3.3
<210> 1
<211> 117
<212> Белок
<213> Человек
<400> 1
Met Glu Phe Gly Leu Ser Trp Val Phe Leu Val Ala Leu Leu Arg Gly
1 5 10 15
Val Gln Cys Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln
20 25 30
Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Val Tyr Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ala Ile Ile Trp Tyr Asp Gly Asp Asn Gln Tyr Tyr Ala
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Tyr Leu Thr Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 2
<211> 126
<212> белок
<213> человек
<400> 2
Met Leu Pro Ser Gln Leu Ile Gly Phe Leu Leu Leu Trp Val Pro Ala
1 5 10 15
Ser Arg Gly Glu Ile Val Leu Thr Gln Ser Pro Asp Ile Gln Ser Val
20 25 30
Thr Pro Lys Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile
35 40 45
Gly Ser Ser Leu His Trp Tyr Gln Gln Lys Pro Asp Gln Ser Pro Lys
50 55 60
Leu Leu Ile Lys Tyr Ala Ser Gln Ser Ile Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser
85 90 95
Leu Glu Ala Glu Asp Ala Ala Ala Tyr Tyr Cys His Gln Ser Ser Ser
100 105 110
Leu Pro Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
115 120 125
<210> 3
<211> 410
<212> ДНК
<213> человек
<400> 3
atggagtttg ggctgagctg ggttttcctc gttgctcttt taagaggtgt ccagtgtcag 60
gtgcagctgg tggagtctgg gggaggcgtg gtccagcctg ggaggtccct gagactctcc 120
tgtgcagcgt ctggattcac cttcagtgtt tatggcatga actgggtccg ccaggctcca 180
ggcaaggggc tggagtgggt ggcaattatt tggtatgatg gagataatca atactatgca 240
gactccgtga agggccgatt caccatctcc agagacaatt ccaagaacac gctgtatctg 300
caaatgaacg gcctgagagc cgaggacacg gctgtgtatt attgtgcgag agatcttagg 360
actgggcctt ttgactactg gggccaggga accctggtca ccgtctcctc 410
<210> 4
<211> 378
<212> ДНК
<213> человек
<400> 4
atgttgccat cacaactcat tgggtttctg ctgctctggg ttccagcctc caggggtgaa 60
attgtgctga ctcagtctcc agactttcag tctgtgactc caaaggagaa agtcaccatc 120
acctgccggg ccagtcagag cattggtagt agcttacact ggtaccagca gaaaccagat 180
cagtctccaa agctcctcat caagtatgct tcccagtcct tctcaggggt cccctcgagg 240
ttcagtggca gtggatctgg gacagatttc accctcacca tcaatagcct ggaagctgaa 300
gatgctgcag cgtattactg tcatcagagt agtagtttac cattcacttt cggccctggg 360
accaaagtgg atatcaaa 378
<---
Реферат
Группа изобретений относится к медицине и касается стабильного жидкого фармацевтического состава, содержащего от 50 до 150 мг/мл антитела против IL-1бета, которое представляет собой ACZ885, где буферная система представляет собой гистидин в концентрации от 10 до 50 мМ, стабилизатор выбран из группы, состоящей из маннита, сорбита и трегалозы, и pH состава составляет от 5,5 до 7,5. Группа изобретений также касается шприца, содержащего указанный жидкий состав; автоинжектора, содержащего указанный жидкий состав. Группа изобретений обеспечивает сохранение по меньшей мере около 70% активности состава после хранения в течение 24 месяцев при 25°C, как определено с помощью анализа с использованием гена-репортера. 4 н. и 9 з.п. ф-лы, 1 пр., 2 ил., 8 табл.

Комментарии