Композиции, содержащие полисахаридную матрицу для контролируемого высвобождения активных ингредиентов - RU2748261C2
Код документа: RU2748261C2
Чертежи
Описание
Область техники
Изобретение относится к новым композициям, содержащим клатрат, состоящий из циклодекстрина и активного ингредиента, однородно диспергированных в водном растворе полисахаридной полимерной матрицы, и их применению при заболеваниях, таких как скелетно-мышечные нарушения, характеризующиеся воспалительным состоянием, где требуется комбинация фармакологических и вискосапплементарных действий.
Уровень техники
В настоящее время остеоартрит считается патологией всего сустава, затрагивающей все его ткани, такие как хрящ, кость, связки, мениск, суставная капсула, синовиальная мембрана, мышцы и нервная ткань, и обычно характеризуется симптоматикой, включающей боль, онемение, скованность, потерю гибкости, раздражение и образование костных шпор (Le Graverand-Gastineau М-РН et al., Curr Drug Targets, 2010, 5, 528-35; Felson DT et al., Arthritis Reum 2004, 50(2), 341-4). Ряд различных факторов риска, связанных с этим заболеванием, включает пол, возраст, ожирение, генетическую предрасположенность, механику суставов, метаболические факторы и острые травмы суставов; часто различные типы остеоартрита связаны с различными факторами риска, вовлеченными в развитие и прогрессирование заболевания (Wieland НА et al, Nat Rev Drug Discov 2005, 4(4), 331-44; Bay-Jensen A-C et al., Rheumatol Int 2010, 30(4), 435-42). Например, в случаях острых травматических событий, являющихся причиной приблизительно 12% случаев остеоартрита, наблюдают повышение уровня воспалительного цитокина (IL-1, IL-6, TNF-α) в синовиальной жидкости, что приводит к потенциальной диффузии в хряще, где они могут запускать протеолиз и вызывать потерю хрящевого матрикса (Irie Ket al., Knee 2003, 10(1), 93-6; Kapoor M et al., Nat Rev Rheumatol 2011, 7, 33-42). На сегодняшний день, хотя многие активные ингредиенты доступны для изменения течения ревматических заболеваний (DMARD), они не позволяют в равной степени блокировать или обращать течение остеоартрита (DMOAD) (Le Graverand-Gastineau М-РН et al., Curr Drug Targets 2010, 5, 528-35; Hunter DJ, Nat Rev Rheumatol 2011, 7, 13-22; Matthews GL et al., Expert Opin Emerg Drugs 2011, 16(3), 479-91).
В этом отношении следует помнить, что было выявлено несколько активных ингредиентов с антикатаболическими и проанаболическими функциями, такие как глюкокортикоиды, которые подходили для предотвращения и лечения потери хрящевой матрицы, связанной с посттравматическим остеоартритом. (РТОА) (Hunter DJ, Nat Rev Rheumatol 2011, 7, 13-22; Lu YC et al., Arthritis Res Ther 2011, 13(5), R142; Nixon AJ et al., Clin Orthop Relat Res 2000, (Suppl. 379), S201-13; Miller RE et al., Arthritis Rheum 2010, 62(12), 3686-94). Однако ни один из указанных кандидатов не соответствовал критериям безопасности/эффективности, и, в частности, частота и серьезность системных побочных эффектов оказались решающими факторами провала многочисленных клинических исследований (Matthews GL et al., Expert Opin Emerg Drugs 2011, 16(3), 479-91). Несмотря на отсутствие фармакологической терапии, способной блокировать и, возможно, обратить течение заболевания, лечение остеоартрита в настоящее время направлено на улучшение симптомов, и обычно назначаемое лечение состоит из введения анальгетических лекарственных средств, таких как парацетамол, стероиды (кортикостероиды) и нестероидные противовоспалительные препараты (НПВП) и опиоиды. Фармакологическое лечение с помощью НПВП является одним из наиболее часто используемых и позволяет получить статистически значимый обезболивающий эффект. Несмотря на это, использование лекарственных средств этого типа связано с несколькими побочными эффектами, такими как желудочно-кишечные осложнения, сердечнососудистый риск и почечная токсичность (Kennedy S et al., ВС Medical Journal 2010, 52, 404-09). Применение противовоспалительных и иммунодепрессантных стероидных лекарственных средств, безусловно, является еще одним основным видом лечения, и их внутрисуставное введение в сустав приводит к хорошему кратковременному облегчению боли (1-2 недели). Однако данное фармакологическое лечение, как известно, связано с такими побочными эффектами, как воспаление, гемартроз, суставная инфекция, кристаллическая артропатия, атрофия суставного хряща и стероидная артропатия.
Другая стратегия лечения остеоартрита заключается в использовании медицинских устройств на основе гиалуроновой кислоты или ее производных, способных восстанавливать вязкоупругий характер и естественный гомеостаз синовиальной жидкости. Гиалуроновая кислота и ее сшитые производные в форме водных композиций, непосредственно вводимые в сустав для обеспечения реологических свойств вязкости и вязкоупругости, позволили получить ряд преимуществ при лечении остеоартрита, таких как: уменьшение и подавление боли в суставе, смазывание суставов, улучшение дисфункции, связанной с артрозом, и нормализация функций суставов (Kennedy S et al., ВС Medical Journal 2010, 52, 404-09; Ayhan and et al., World J Orthop 2014, 5(3), 351-61). Одним из преимуществ терапии гиалуроновой кислотой и/или ее производными является высокий профиль безопасности, который ограничивает побочные эффекты возможным воспалением в месте инъекции, хотя использование сшитых гиалуроновых кислот связано с более высокой частотой возникновения побочных эффектов по сравнению с применением линейной гиалуроновой кислоты (Kennedy S et al., ВС Medical Journal 2010, 52, 404-09; Onel and et al., Clin Drug Investig 2008, 28, 37-45; Kotevoglu N et al., Rheumatol Int 2006, 26, 325-30). Благодаря всем указанным характеристикам, вискосапплементарная терапия сегодня считается альтернативой фармакологической терапии и, в частности, она подходит для лечения легких форм остеоартрита ((Kennedy S et al., ВС Medical Journal 2010, 52, 404-09). Недавние исследования также показали, что комбинированное внутрисуставное введение гиалуроновой кислоты и нестероидных противовоспалительных лекарственных средств позволяет получить большие преимущества, чем введение только гиалуроновой кислоты (Lee SC et al., J Back Musculoskeletal Rehabilitation 2011, 24, 31-38). В связи с этим комбинации вискосапплементарной терапии и фармакологического лечения уделяется все больше внимания, особенно ввиду возможности проведения лечения, которое позволяет связать противовоспалительную и иммуносупрессивную активность некоторых активных ингредиентов в соответствии с конкретной степенью тяжести остеоартрита с хорошо известными смазывающими и вязкоупругими свойствами составов на основе биополимеров, таких как гиалуроновая кислота и ее производные.
В этом отношении были описаны водные композиции на основе сшитого производного гиалуроновой кислоты в присутствии кортикостероида, такого как триамцинолона ацетонид, где высвобождение лекарственного средства из полимерной матрицы происходило контролируемым образом (US 2011/0033540). Также сообщалось о водных составах сшитой гиалуроновой кислоты, с впоследствии включенными кортикостероидами, такими как триамцинолона гексацетонид (US 2011/0059918). Аналогично, были описаны водные системы для высвобождения триамцинолона ацетонида из полимерных микрочастиц, где полимер представляет собой не гиалуроновую кислоту, а сополимер молочной и гликолевой кислот (WO 2014/153384). В упомянутых системах активный ингредиент нерастворим в воде и в результате однородно диспергируется благодаря сочетанию полимерной матрицы и использованию вспомогательных веществ, таких как ПЭГ, полисорбаты и другие. Высвобождение лекарственного средства из указанных систем определяется типом и количеством вспомогательных веществ и разрушением полимерной матрицы.
Одной из основных проблем, связанных с использованием активных ингредиентов в водных парентеральных составах является плохая растворимость в воде самих активных ингредиентов. Данная проблема решалась несколькими способами, включая использование солюбилизирующих агентов, таких как циклодекстрины. Циклодекстрины широко используются в качестве вспомогательных веществ в различных фармацевтических препаратах. Например, инъецируемая водная фармацевтическая композиция диклофенака, полисорбата и циклодекстрина описана в ЕР 1609481. В более общем виде растворимость в воде других активных ингредиентов, таких как триамцинолон, с помощью циклодекстринов была описана в нескольких публикациях (Miro A et al., Carb Polym 2012, 1288-1298; Loftsson T et al., Int J of Pharm 2008, 18-28). Сообщалось также, что ассоциация циклодекстрин-активный ингредиент не только оказывает существенное влияние на активный ингредиент, но также на проницаемость биологических мембран для самого активного ингредиента (Loftsson Т, Pharmazie 2012, 363-70). Комбинация циклодекстринов и полисахаридов, принадлежащих к семейству гликозаминогликанов, описана в литературе, и, в частности, было показано, что их ассоциация подходит для получения внутрисуставных составов для лечения остеоартрита, как сообщается в WO 2015/092516. Использование циклодекстринов в сочетании с фармацевтическими активными ингредиентами и биополимерами, такими как гиалуроновая кислота, для получения инъецируемых композиций было описано в нескольких докладах. В WO 2013/133647 описана водная композиция гиалуроновой кислоты, циклодекстрина и пироксикама, стабилизированная вспомогательными веществами, такими как ПЭГ и полисорбаты; указанную композицию также тестировали на модели остеоартрита у животных с получением значительных улучшений по сравнению с использованием только гиалуроновой кислоты (WO 2014/200211; Park CW et al, Biomol Ther 2014, 22(3), 260-66). Одним из основных преимуществ составов на основе гиалуроновой кислоты, циклодекстрина и активного ингредиента является то, что лекарственное средство полностью или частично солюбилизировано в матрице, что ограничивает возникновение проблем, связанных с присутствием осадков и/или кристаллов, например, кристаллической артропатии. Кроме того, указанная другая фармацевтическая форма, полученная путем добавления циклодекстрина, может обеспечить более эффективное использование активного ингредиента, и, следовательно, количество лекарственного средства, необходимое для достижения терапевтического эффекта, может быть уменьшено, таким образом ограничивая возникновение других побочных эффектов, таких как стероидная артропатия и атрофия хряща. В то же время, одним из основных ограничений данной стратегии является уменьшение возможности контролировать высвобождение лекарственного средства из матрицы, в отличие от того, что наблюдается в системах, состоящих из сшитых биополимеров и активного ингредиента в присутствии или отсутствии циклодекстринов и других вспомогательных веществ (Quaglia F et al., J Control Rel 2001, 71, 329-37). С другой стороны, как сообщалось ранее, использование сшитых полимерных матриц для получения агентов для вискосапплементарной терапии, используемых при лечении остеоартрита, ставится под сомнение в связи с более высокой частотой побочных эффектов. В свете указанных данных, очевидно, что получение жидкой инъецируемой композиции, состоящей из линейных биополимеров, содержащих однородно диспергированный активный ингредиент, высвобождение которого является контролируемым, может привести к улучшению терапии остеоартрита. К настоящему времени выявленная техническая проблема связана с полной и равномерной солюбилизацией или диспергированием активного ингредиента в водной матрице, его стабилизацией и контролируемым высвобождением из нее.
Решением данной проблемы может быть новый тип композиции по существу основанный на присутствии по меньшей мере двух полимеров или двух отдельных полимерных доменов, которые способны взаимодействовать друг с другом обратимым образом и без образования ковалентных связей, так чтобы сохранить типичный профиль безопасности линейных биополимеров и одновременно обеспечить динамическую матрицу, способную модулировать диффузию и, следовательно, высвобождение активного ингредиента из полимерной матрицы. Добавление циклодекстрина и других вспомогательных веществ/диспергаторов в систему позволило бы наконец равномерно распределить активный ингредиент, стабилизировать его физическую форму, а также обеспечить и регулировать его диффузию из полимерной матрицы. В ЕР 2021408 описаны полисахаридные смеси, состоящие из полианионов, таких как гиалуроновая кислота, и поликатионов, таких как производные хитина и хитозана, полученные посредством реакции восстановительного аминирования с восстанавливающими сахаридами.
Описанные композиции представляют особый интерес, поскольку было показано, что два полисахарида, которые, будучи полиэлектролитами с различным зарядом и в принципе несовместимыми друг с другом в водном растворе, приводят к образованию однородно диспергированных водных растворов без образования коацерватов, характеризующихся высокой вязкостью и вязкоупругостью. Дериватизация хитозана фактически улучшает совместимость хитозана с полианионными биополимерами, такими как альгиновая кислота и гиалуроновая кислота, в водных растворах.
Сущность изобретения
В связи с этим задачей настоящего изобретения является обеспечение композиций, способных модулировать высвобождение активных ингредиентов из несшитых водных полимерных матриц для применения для лечения хронических и острых состояний заболеваний костно-мышечной системы, характеризующихся воспалительными состояниями, где требуется обеспечить вискосапплементарный эффект в дополнение к фармакологическому эффекту.
Следовательно, в первом аспекте объектом настоящего изобретения являются композиции, содержащие клатрат, состоящий из циклодекстрина и активного ингредиента, где клатрат циклодекстрина и активного ингредиента однородно диспергирован в полисахаридной полимерной матрице в водном растворе, образованном гиалуроновой кислотой и олигосахаридным производным хитозана с лактозой, полученным посредством реакции восстановительного аминирования D-глюкозамина хитозана, имеющим степень замещения функциональной группы амина лактозой по меньшей мере 40%.
Смесь полисахаридного полимера образует матрицу, в которой активный ингредиент однородно диспергирован благодаря вкладу циклодекстрина и из которой он высвобождается в зависимости от самой полисахаридной композиции и вида циклодекстрина.
Композиции, являющиеся объектом изобретения, обеспечивают физико-химическую стабилизацию активного ингредиента, его полную или частичную солюбилизацию в водной среде, когда активный ингредиент нерастворим в воде, и регулирование его высвобождения. Будучи полисахаридной полимерной матрицей в водном растворе, такие композиции представляют собой водные композиции, характеризующиеся вязкостью и/или вязкоупругостью. Такие свойства обеспечивают преимущественное применение таких композиций для лечения различных стадий заболеваний костно-мышечной системы, где требуется сочетание фармакологичесого и вискосапплементарного действий.
Таким образом, во втором аспекте, композиции, являющиеся объектом изобретения, предназначены для применения для локорегионарного лечения заболеваний костно-мышечной системы, характеризующихся воспалительными состояниями, и, предпочтительно, острых или хронических заболеваний костно-мышечной системы.
Преимущества, достигаемые с помощью настоящего изобретения, станут более понятны для специалиста в данной области техники из следующего подробного описания и со ссылкой на следующие фигуры.
Краткое описание чертежей
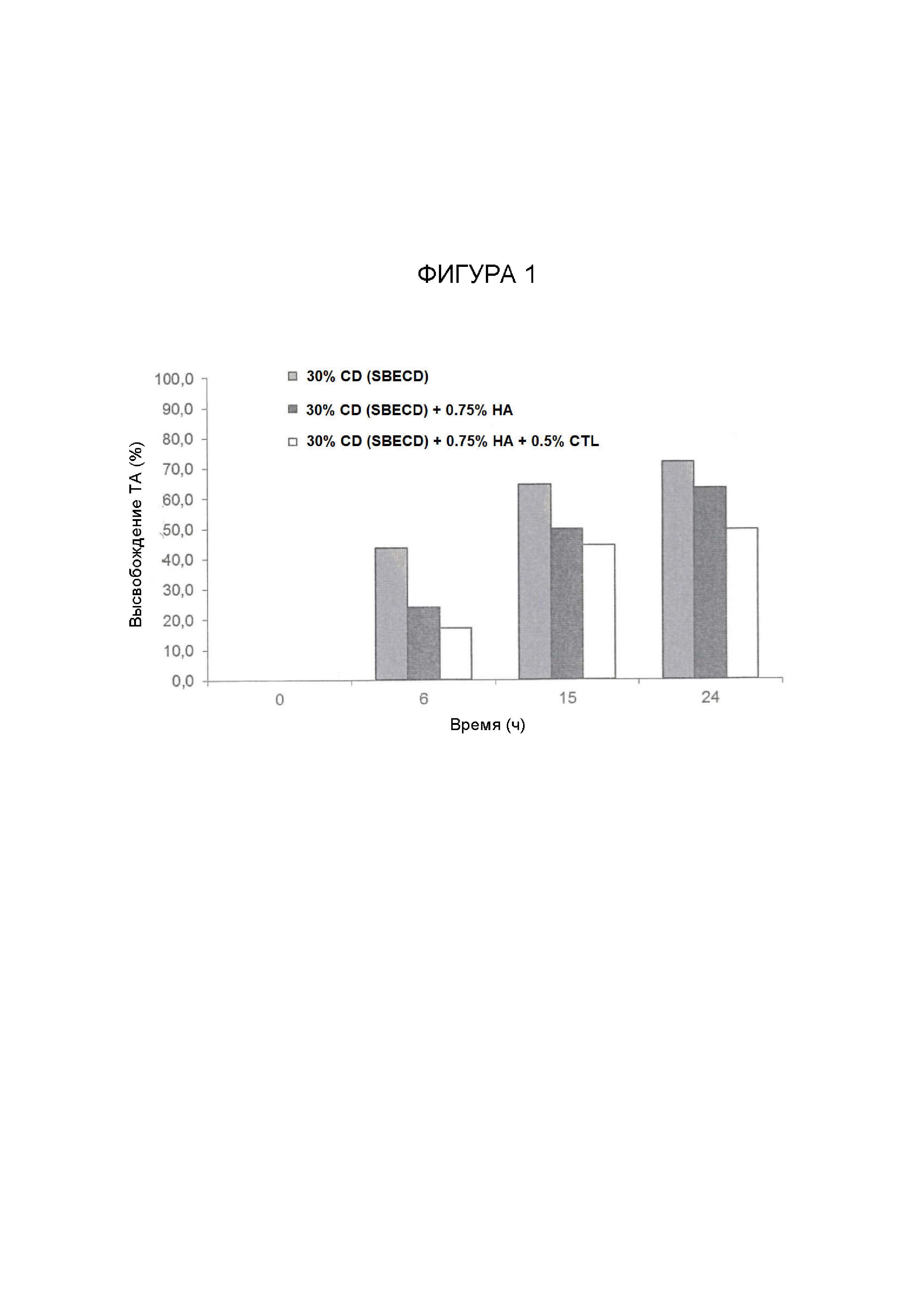
Фигура 1. На фигуре показана кинетика высвобождения 30% (масс./об.) водного раствора клатрата циклодекстрина SBECD + триамцинолона ацетонида (ТА), диспергированного в матрице из 0,75% (масс./об.) водного раствора гиалуроновой кислоты (НА) с или без 0,75% (масс./об.) водного раствора хитлака (CTL).
Подробное описание изобретения
Композиция для высвобождения активных фармакологических ингредиентов (кратко обозначаемых как API) в соответствии с настоящим изобретением состоит из полисахаридной полимерной матрицы, в которой API и клатрат, образованный циклодекстрином, который включает активный ингредиент посредством комплексообразования, однородно диспергированы. Такая композиция по существу представляет собой гидрогель, поскольку полимерная матрица состоит из водного раствора полисахаридной смеси с реологическими свойствами вязкости и вязкоупругости, состоящей из гиалуроновой кислоты и производного хитозана с лактозой (далее кратко называемого хитлаком). Она также может содержать другие вспомогательные вещества и/или диспергаторы, поверхностно-активные вещества, такие как полисорбаты, полиэтиленгликоль и полоксамеры.
Если не указано иное, в настоящем изобретении под гиалуроновой кислотой (НА), хитлаком (CTL), циклодекстрином (CD), полисорбатами, полиэтиленгликолем, полоксамерами и активным фармакологическим ингредиентом понимают следующее:
«Гиалуроновая кислота» означает гиалуроновую кислоту и ее фармацевтически приемлемые солевые формы. Другими словами, в настоящем документе «гиалуроновая кислота» относится к гиалуроновой кислоте, фармацевтически приемлемым гиалуронатным солям и смесям гиалуроновой кислоты и гиалуронатных солей. Гиалуронатные соли предпочтительно включают неорганические соли с щелочными катионами, такими как натрий и калий. При необходимости могут быть использованы два или более из указанных выше соединений. Хотя в настоящем изобретении молекулярная масса гиалуроновой кислоты (в дальнейшем называемая MW) конкретно не ограничена, рекомендуется диапазон 500-10000 кДа, предпочтительно 500-2000 кДа, где MW определяется посредством измерения характеристической вязкости и экстраполяции уравнения Марка-Хокинга. Используемый в настоящем документе термин молекулярная масса относится к среднемассовой молекулярной массе. Как правило, способ измерения для расчета массовой (среднемассовой) молекулярной массы представляет собой гель-проникающую хроматографию (метод ГПХ).
Наконец, гиалуроновая кислота может быть получена из различных природных источников или методами ферментации по рекомбинантной технологии.
«Хитлак» означает производное хитозана, подходящим образом функционализированное лактозой, путем замещения аминогруппы D-глюкозамина хитозана. Хитозан, используемый для получения указанного производного, может быть получен из нескольких природных источников (например, путем деацетилирования хитина) или методами рекомбинантной технологии и имеет среднюю молекулярную массу (MW) до 1000 кДа, предпочтительно от 500 до 600 кДа, и более предпочтительно от 200 до 400 кДа, где MW определяется посредством гель-проникающей хроматографии. Такой хитозан предпочтительно имеет степень деацетилирования до 90%, и предпочтительно имеет степень остаточного ацетилирования от 10 до 20%. Кроме того, для целей настоящего изобретения степень замещения аминогрупп D-глюкозамина хитозана лактозой составляет по меньшей мере 40%. Предпочтительно степень замещения аминогрупп хитозана таким олигосахаридом составляет от 50 до 70%, и более предпочтительно до 60%. Для целей настоящего изобретения циклодекстрины и их производные выполняют функцию включения активного ингредиента путем образования с ним комплексов включения (также называемых клатратами) и, таким образом, действуют в качестве носителя и средства для регулирования его высвобождения.
В настоящем изобретении термин «циклодекстрин» означает эфирные производные β-циклодекстрина и γ-циклодекстрина. Как правило, указанные простые эфиры или смеси простых эфиров включают β-циклодекстрин и γ-циклодекстрин, в которых одна или более гидроксильных групп замещены C1-6-алкильными, гидрокси-С1-6-алкильными, карбокси-С1-6-алкильными или C1-6-алкилоксикарбонильными группами. Предпочтительно, указанные соединения включают β-циклодекстрин и γ-циклодекстрин, в которых одна или более гидроксильных групп замещены C1-3-алкильными, гидрокси-С2-4-алкильными, карбокси-С1-2-алкильными группами и более предпочтительно метильной, этильной, гидроксиэтильной, гидроксипропильной, гидроксибутильной, карбоксиметильной или карбоксиметильной группами. «Циклодекстрины», упоминаемые в настоящем изобретении, также могут состоять из простых эфиров, содержащих β-циклодекстрин и γ-циклодекстрин, в которых одна или более гидроксильных групп замещены сульфоалкил-С1-4-эфирными группами. В этом случае подходят как сульфопропиловый эфир β-циклодекстрина, так и сульфобутиловый эфир β-циклодекстрина.
Указанные выше «циклодекстрины» имеют степень замещения (DS, степень замещения гидроксильных функциональных групп на единицу глюкозы), составляющую от 0,125 до 3 и более предпочтительно от 0,3 до 2. Кроме того, одна или более гидроксильных групп могут быть заменены сахаридными группами, такими как мальтоза, глюкоза и мальтотриоза. Примеры «циклодекстрина», относящиеся к настоящему изобретению, включают: 2,6-диметил-β-циклодекстрин, 2-гидроксиэтил-β-циклодекстрин, 2-гидроксипропил-β-циклодекстрин, (2-карбоксиметокси)пропил-β-циклодекстрин 2-гидроксипропил-γ-циклодекстрин, сульфобутиловый эфир (7)-(β-циклодекстрин, и предпочтительными среди них являются сульфобутиловый эфир (7)-β-циклодекстрина (далее называемый SBECD), 2-гидроксипропил-β-циклодекстрин (далее называемый HPβCD) и 2-гидроксипропил-γ-циклодекстрин (далее называемый HPγCD).
«Полисорбаты» означают, по существу, коммерческие продукты, такие как Полисорбат 20, Полисорбат 60 и Полисорбат 80.
В настоящем изобретении «полиэтиленгликоль» означает полиэтиленгликоль со средней молекулярной массой от 200 до 100000 Да, структура которого предполагает присутствие гидроксильной концевой группы, инициаторной группы, выбранной, например, из аминов, карбокси и гидроксильных групп. Можно использовать любую молекулярную массу, предпочтительный полиэтиленгликоль имеет среднюю молекулярную массу от 400 до 10000. Можно использовать как линейные, так и разветвленные полимеры. В настоящем изобретении полоксамеры означают сополимер полиоксиэтилена и полиоксипропилена или блок-полимеры, обычно известные под торговым названием Pluronic® F-68, Pluronic® F-127 или Poloxamer, Poloxamer 188.
«Фармакологически активные ингредиенты» (далее называемые API), относящиеся к настоящему изобретению, независимо от их растворимости или нерастворимости в водных растворах, выбирают из таких противоинфекционных средств, как, например, антибиотики, средства против артрита, кортикостероиды и нестероидные противовоспалительные средства. Примерами активного ингредиента, относящегося к настоящему изобретению, выбранного из кортикостероидов, являются триамцинолона ацетонид и триамцинолона гексацетонид, примерами нестероидных
противовоспалительных агентов являются фармацевтически приемлемые формы диклофенака, пироксикама, кеторолака и ибупрофена. Преимущественно для целей настоящего изобретения контроль высвобождения зависит от конкретной комбинации циклодекстрина, гиалуроновой кислоты и хитлака. Фактически, хотя известно, что на диффузию веществ в растворе влияет вязкость среды, и, следовательно, количества и соотношение гиалуроновой кислоты и хитлака, мы обнаружили, что также можно ввести дополнительную степень контроля на основе взаимодействия полимерной матрицы с клатратом таким образом, что одно и то же API в разных клатратах циклодекстрина будет высвобождаться по-разному из той же комбинации хитлак/HYAC.
Полисахаридная матрица, состоящая из гиалуроновой кислоты и хитлака, составляет от 0,5% до 4%, и отдельные полисахаридные компоненты составляют от 0,25% до 2%, соответственно. Соотношения гиалуроновой кислоты и хитлака составляют от 1:3 до 10:1, и более предпочтительно от 1:1 до 5:1.
Циклодекстрин составляет от 1 до 30%. Конкретное количество зависит от фактического количества активного фармакологического ингредиента, который должен быть солюбизирован, и, как правило, отношение циклодекстрина к активному ингредиенту составляет от 3 до 100. Активный ингредиент, однородно диспергированный в составе, присутствует в количествах от 0,05 до 2,50 мас. %. Конкретное количество зависит от типа активного ингредиента и его терапевтической дозировки. Наконец, полисорбаты, полоксамеры и пропиленгликоль можно использовать для стабилизации композиции, не исключая регулирование высвобождения лекарственного средства, которое определяется полимерной матрицей и циклодекстрином. Обычно их количество по массе составляет от 0,02% до 0,10% в случае полисорбатов и полоксамеров, тогда как количество составляет от 0,5% до 10% в случае полиэтиленгликоля. В настоящем изобретении дополнительно предложен способ получения новой матрицы для активных ингредиентов с контролируемым высвобождением с применением несшитых полисахаридов и циклодекстринов. Вкратце, циклодекстрин, активный ингредиент и необязательные вспомогательные вещества смешивают в водном растворителе и систему перемешивают в течение времени, достаточного для достижения солюбилизации активного ингредиента в соответствии с количеством используемого циклодекстрина и вспомогательного вещества. Затем добавляют водный раствор хитлака и при перемешивании добавляют гиалуроновую кислоту в виде твердого вещества.
Полученный состав перемешивают до получения однородного препарата. Растворитель, обычно используемый для настоящего изобретения, представляет собой солевой раствор или забуференный фосфатом солевой раствор.
Применение несшитой полисахаридной матрицы в присутствии циклодекстрина и вспомогательных веществ для высвобождения активных ингредиентов, описанных в настоящем изобретении, позволяет получать инъецируемые вязкоупругие композиции, содержащие активные ингредиенты, высвобождение которых можно модулировать в соответствии с относительными количествами полимеров и вида циклодекстринов без использования сшитых полимерных матриц благодаря беспрецедентной регулировке надмолекулярных взаимодействий между клатратами API и циклодекстрина и полиэлектролитной матрицей на основе определенной комбинации размеров и зарядов циклодекстрина и API. Заряд и размер клатратов играют важную роль в диффузии через полиэлектролитную матрицу. Неожиданно мы обнаружили, что различные клатраты, полученные из различных циклодекстринов с одним и тем же API, характеризуются различными скоростями высвобождения, даже в отсутствие полимерной матрицы, и что добавление полиэлектролитной матрицы позволяет осуществить дополнительную регулировку кинетики высвобождения, которая связана со специфическими взаимодействиями между клатратом и полимерной матрицей.
Настоящее изобретение далее подробно описано со ссылкой на конкретные примеры для иллюстрации принципов изобретения. Однако приведенные примеры можно варьировать и модифицировать различным образом, и это не должно интерпретироваться как ограничение объема настоящего изобретения. Следующие примеры предназначены для полного объяснения изобретения, что будет понятно для специалиста в данной области техники. Как будет видно из приведенных ниже примеров, вариации растворимости активного ингредиента были обнаружены путем объединения циклодекстрина и состава гиалуроновой кислоты. То же самое можно наблюдать для системы циклодекстрин-активный ингредиент, добавляемой либо с хитлаком, либо с хитлаком и гиалуроновой кислотой.
Обнаруженные изменения растворимости могут быть связаны с различным воздействием полимерной матрицы на клатрат активного ингредиента и циклодекстрина. Было обнаружено, что различия в солюбилизирующей способности при одинаковой концентрации и одинаковом виде циклодекстрина и активного ингредиента зависят от вида используемого полисахарида, совместного присутствия других полисахаридов и конкретного соотношения между двумя полисахаридами. Не будучи ограниченными какой-либо теорией, возможное объяснение может состоять в том, что различные соотношения полисахаридов могут генерировать растворы, содержащие растворимый полиэлектролит с различными характеристиками. Можно предположить, что указанные различные надмолекулярные макроструктуры способны по-разному стабилизировать клатраты активного ингредиента и циклодекстрина и, таким образом, в конечном счете, допускают различные степени солюбилизации, которые, следовательно, влияют на стабилизацию и диффузию клатратов через матрицу. Влияние полимерных компонентов на солюбилизирующую способность циклодекстринов обсуждалось в литературе (Loftsson et al., Journal of Pharmaceutical Sciences 2012, 101, 3019-32), однако нет никаких указаний относительно синергетического эффекта поликатионных и полианионных полисахаридных компонентов на растворимость и диффузию через матрицу комплексов включения циклодекстрин-лекарственное средство.
Добавление других полимеров или поверхностно-активных веществ в качестве вспомогательных веществ, таких как полисорбат и/или ПЭГ, по-видимому, не оказывает существенного влияния на дисперсию/солюбилизацию комплекса включения CD+API и, следовательно, нет никаких препятствий для их использования в комбинации с полисахаридной матрицей.
Однако следует отметить, что высвобождение активного ингредиента становится все более быстрым, когда система лишена полисахаридной матрицы, в то время как введение в систему одного полимерного компонента, такого как гиалуроновая кислота, позволяет замедлить скорость высвобождения. Кроме того, когда оба полимера присутствуют в системе, наблюдается дальнейшее замедление высвобождения активного ингредиента, и, неожиданно, замена одного циклодекстрина на другой позволяет разрабатывать системы с более быстрым или более медленным высвобождением.
ПРИМЕРЫ
Получение композиций для контролируемого высвобождения активного фармацевтического ингредиента в соответствии с изобретением, в котором клатрат циклодекстрина и API диспергирован в полианионной и поликатионной полисахаридной матрице, осуществляли с изучением каждый раз действия отдельных компонентов композиции.
Эксперименты, описанные в приведенных ниже примерах, были проведены с использованием следующих полисахаридов
Гиалуроновая кислота (НА): 1-1,6 МДа (1000-1600 кДа) фармацевтического качества, подходящего для введения человеку, полученная биоферментацией.
Гидрохлорид хитлака (CTL): гидрохлорид хитлака получали путем добавления водной соляной кислоты к раствору хитлака в воде до достижения рН 2,5. Затем полимерную соль осаждали метанолом, фильтровали на фильтре из спеченного стекла (Гуча), и собранное твердое вещество промывали метанолом (3х) и сушили. Хитлак, используемый для получения соли, характеризуется степенью замещения лактозой, составляющей от 50 до 70%, и был получен из хитозана 200-400 кДа с остаточной степенью ацетилирования приблизительно 15%.
Исходные растворы полисахаридов известной концентрации получали с использованием воды для инъекционных растворов, как описано ниже. 2% хитлака в PBS 1Х: 1,6 г гидрохлорида хитлака растворяли в 66,08 мл воды для инъекционных растворов, и затем к полученному раствору по каплям добавляли 5,92 мл 0,5 М NaOH. Затем к раствору добавляли 8 мл 10 X фосфатно-солевого буферного раствора (PBS 10Х: 1370 мМ NaCl, 27 мМ KCl, 81 мМ Na2HPO4, 17,6 мМ NaH2PO4) и перемешивали в течение дополнительных 15 минут.
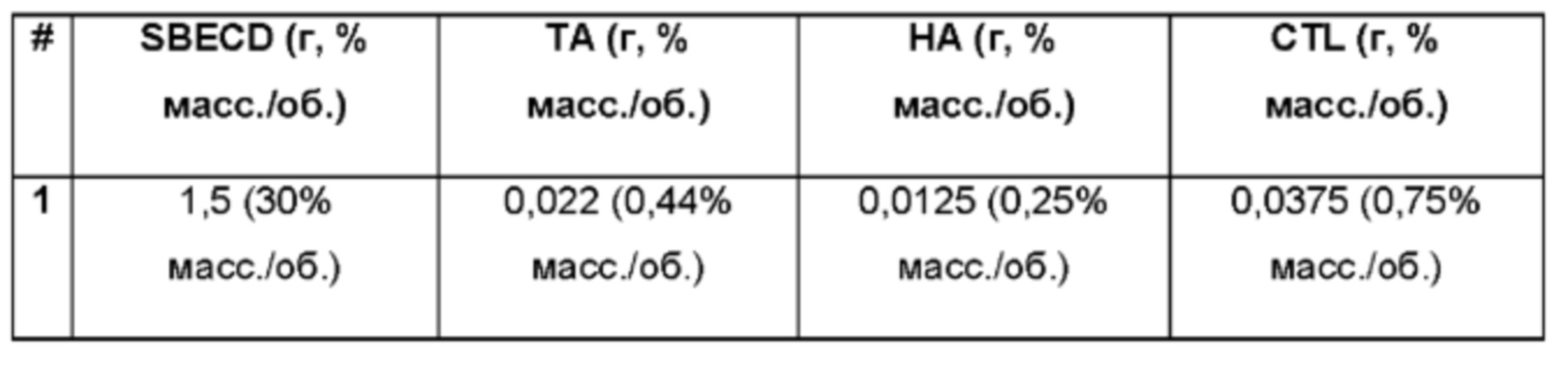
Пример 1. Водная композиция триамцинолона ацетонида (ТА, 0,44%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 30%) в матрице из гиалуроновой кислоты (НА, 0,25%) и хитлака (CTL, 0,75%). 1,5 г сульфобутилового эфира 7-бета-циклодекстрина растворяли в 3,125 мл фосфатно-солевого буферного раствора (PBS 1Х: 137 мМ NaCl, 2,7 мМ KCl, 8,1 мМ Na2HPO4, 1,76 мМ Na2H2PO4), впоследствии добавляли 22 мг триамцинолона ацетонида и полученную таким образом систему перемешивали в течение 16 ч при комнатной температуре. Затем добавляли 1,875 мл 2% (масс./об.) раствора хитлака в фосфатно-солевом буферном растворе (PBS 1Х: 137 мМ NaCl, 2,7 мМ KCl, 8,1 мМ Na2HPO4, 1,76 мМ NaH2PO4), систему перемешивали в течение 15 минут и затем добавляли 37,5 мг гиалуроновой кислоты. Полученную таким образом смесь перемешивали при 60°С в течение 2 ч и при комнатной температуре в течение 16 ч. Значение рН раствора составляло 7,4.
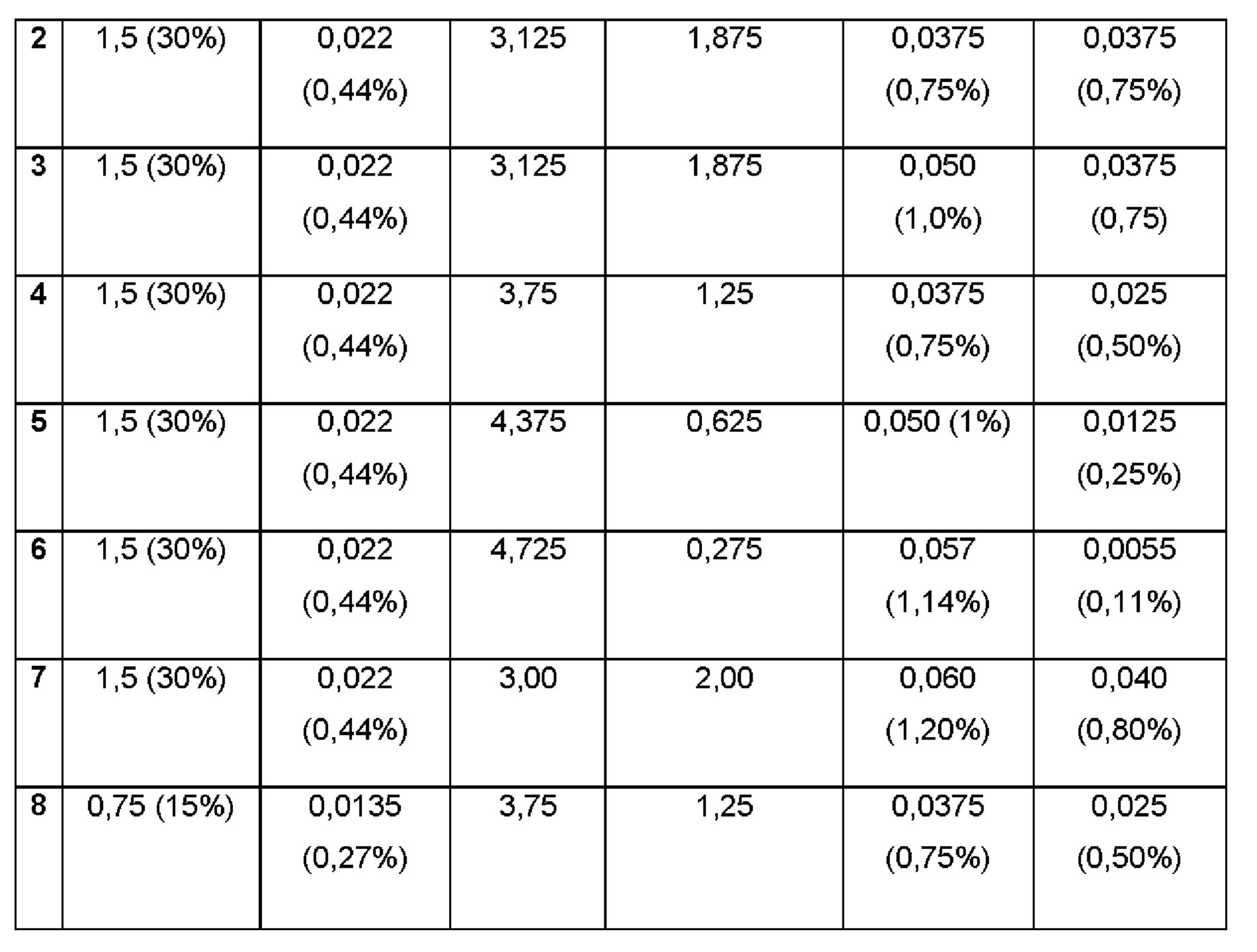
Примеры 2-8. Водные композиции триамцинолона ацетонида (ТА, 0,44 и 0,27%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 15 и 30%) в матрице из гиалуроновой кислоты (НА) и хитлака (CTL)при различных концентрациях.
Составы Примеров 2-8 были получены в соответствии с процедурой, показанной в Примере 1, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
Пример 9. Водная композиция триамцинолона ацетонида (ТА, 1,2%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 30%) и полисорбат (0,05%) в матрице из гиалуроновой кислоты (НА, 0,75%) и хитлака (CTL, 0,50%).
1,5 г сульфобутилового эфира 7-бета-циклодекстрина растворяли в 3,75 мл фосфатно-солевого буферного раствора (PBS 1Х: 137 мМ NaCl, 2,7 мМ KCl, 8,1 мМ Na2HPO4, 1,76 мМ NaH2PO4), впоследствии добавляли 2,5 мг полисорбата 20 и 60 мг триамцинолона ацетонида и полученную таким образом систему перемешивали в течение 16 ч при комнатной температуре. Затем добавляли 1,25 мл 2% (масс./об.) раствора хитлака в фосфатно-солевом буферном растворе (PBS 1Х: 137 мМ NaCl, 2,7 мМ KCl, 8,1 мМ Na2HPO4, 1,76 мМ NaH2PO4), систему перемешивали в течение 15 минут и затем добавляли 37,5 мг гиалуроновой кислоты. Полученную таким образом смесь перемешивали при 60°С в течение 2 ч и при комнатной температуре в течение 16 ч. Значение рН раствора составляло 7,4.
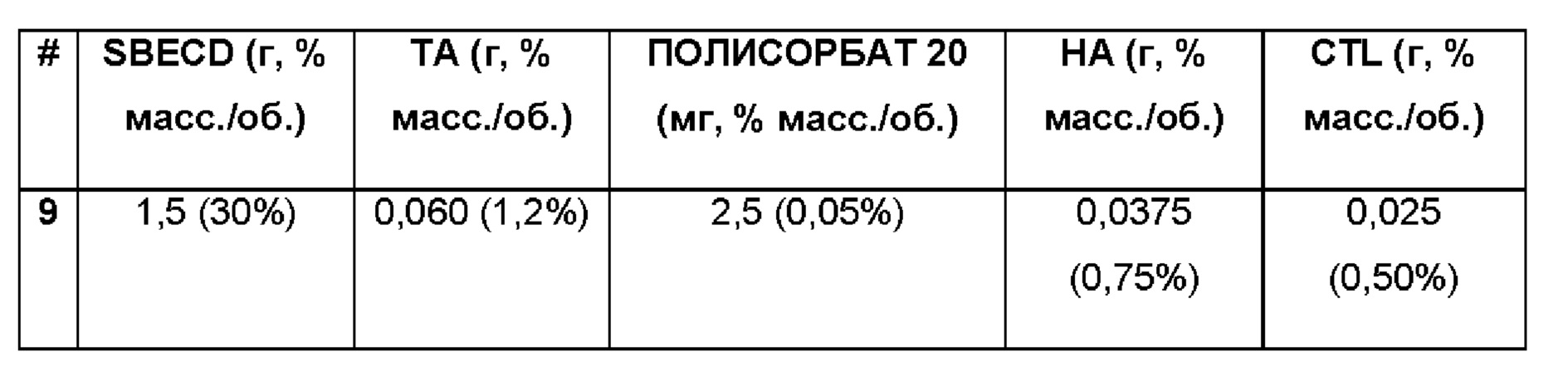
Примеры 10-11. Водные композиции триамцинолона ацетонида (ТА, 1,2%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 15%) и полисорбат (0,05%) в матрице из гиалуроновой кислоты (НА) и хитлака (CTL) при различных концентрациях.
Составы Примеров 10-11 были получены в соответствии с процедурой, показанной в Примере 9 и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
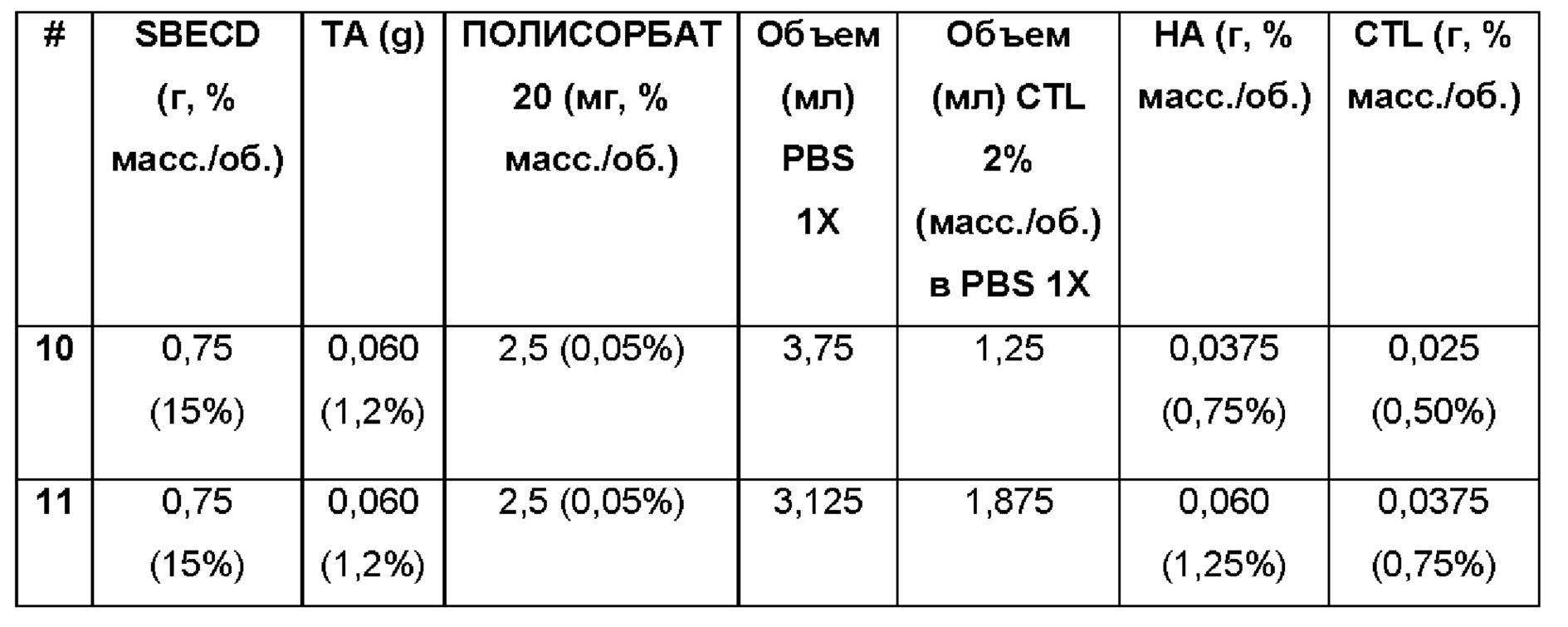
Пример 12. Водная композиция триамцинолона ацетонида (ТА, 1,2%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 15%), полисорбат (0,05%) и PEG 5000 (9%) в матрице из гиалуроновой кислоты (НА, 0,75%) и хитлака (CTL, 0,50%).
0,75 г сульфобутилового эфира 7-бета-циклодекстрина растворяли в 3,125 мл фосфатно-солевого буферного раствора (PBS 1Х: 137 мМ NaCl, 2,7 мМ KCl, 8,1 мМ Na2HPO4, 1,76 мМ NaH2PO4), впоследствии добавляли 2,5 мг полисорбата 20 и 0,45 г полиэтиленгликоля (PEG 5000), и 60 мг триамцинолона ацетонида, и полученную таким образом систему перемешивали в течение 16 ч при комнатной температуре. Затем добавляли 1,875 мл 2% (масс./об.) раствора хитлака в фосфатно-солевом буферном растворе (PBS 1Х: 137 мМ NaCl, 2,7 мМ KCl, 8,1 мМ Na2HPO4, 1,76 мМ NaH2PO4), систему перемешивали в течение 15 минут и затем добавляли 60 мг гиалуроновой кислоты. Полученную таким образом смесь перемешивали при 60°С в течение 2 ч и при комнатной температуре в течение 16 ч. Значение рН растворов составляло 7,4.
Примеры 13-20. Водные композиции триамцинолона ацетонида (ТА, 0,44%), включенного в гидроксипропил-β-циклодекстрин (HPβCD, 30%) в матрице из гиалуроновой кислоты (НА) и хитлака (CTL) при различных концентрациях. Составы Примеров 13-20 были получены в соответствии с процедурой, указанной в Примере 1, с использованием гидроксипропил-β-циклодекстрина и количеств, указанных в таблице ниже. Значение рН растворов составляло 7,4.
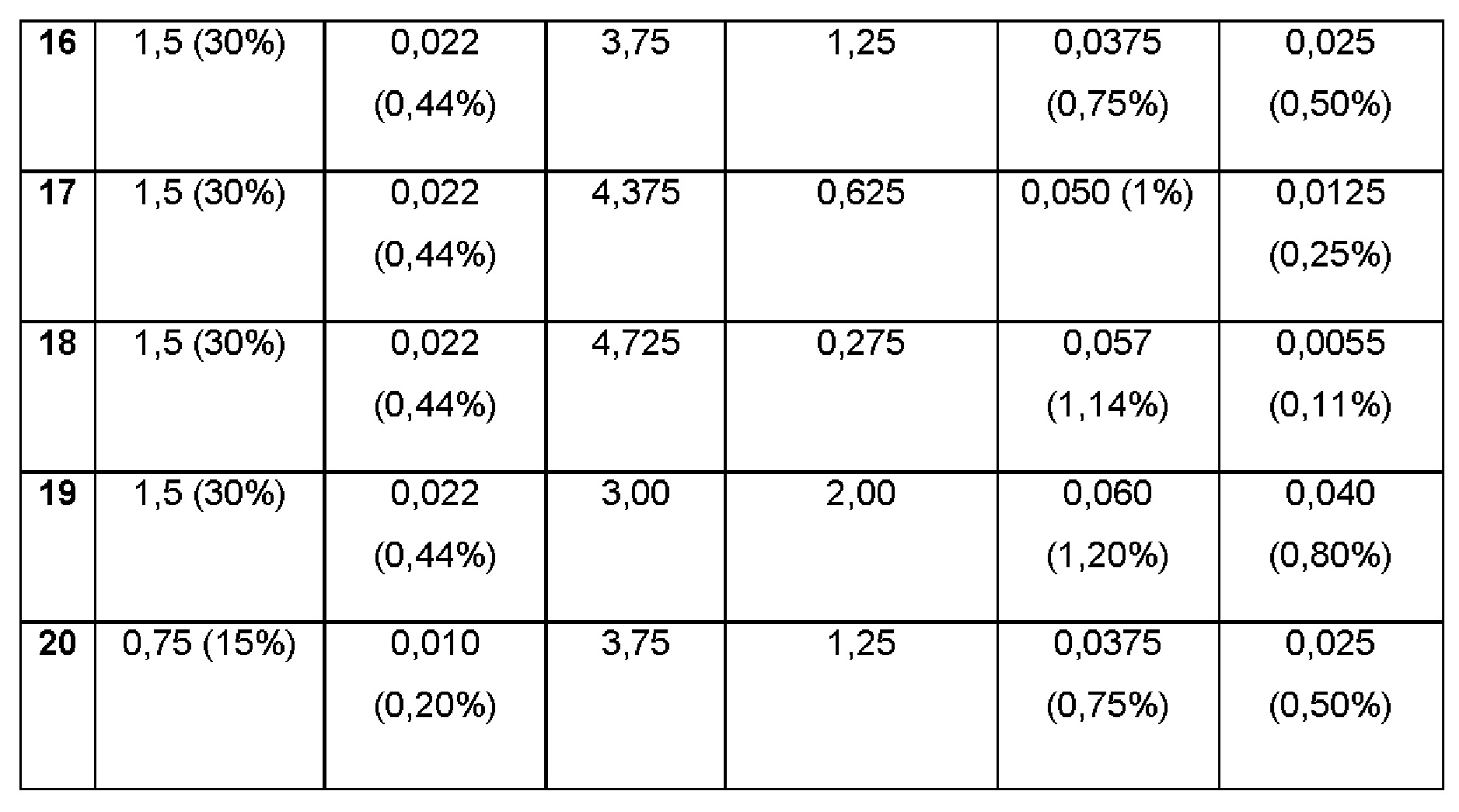
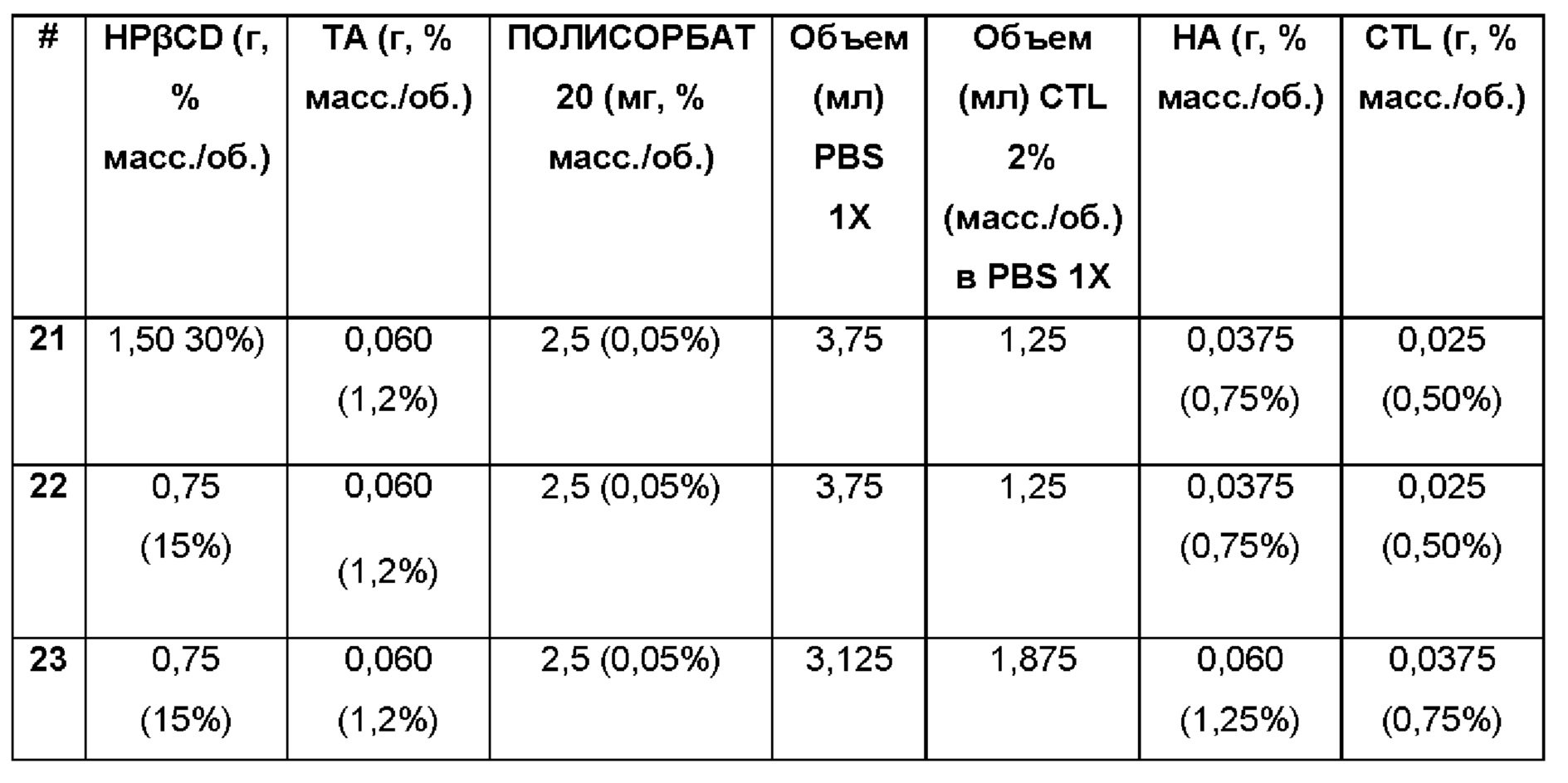
Примеры 21-23. Водные композиции триамцинолона ацетонида (ТА, 1,2%), включенного в гидроксипропил-β-циклодекстрин (HPβCD) и полисорбат (0,05%) в матрице из гиалуроновой кислоты (НА) и хитлака (CTL) при различных концентрациях.
Составы Примеров 21-23 были получены в соответствии с процедурой, указанной в Примере 9, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
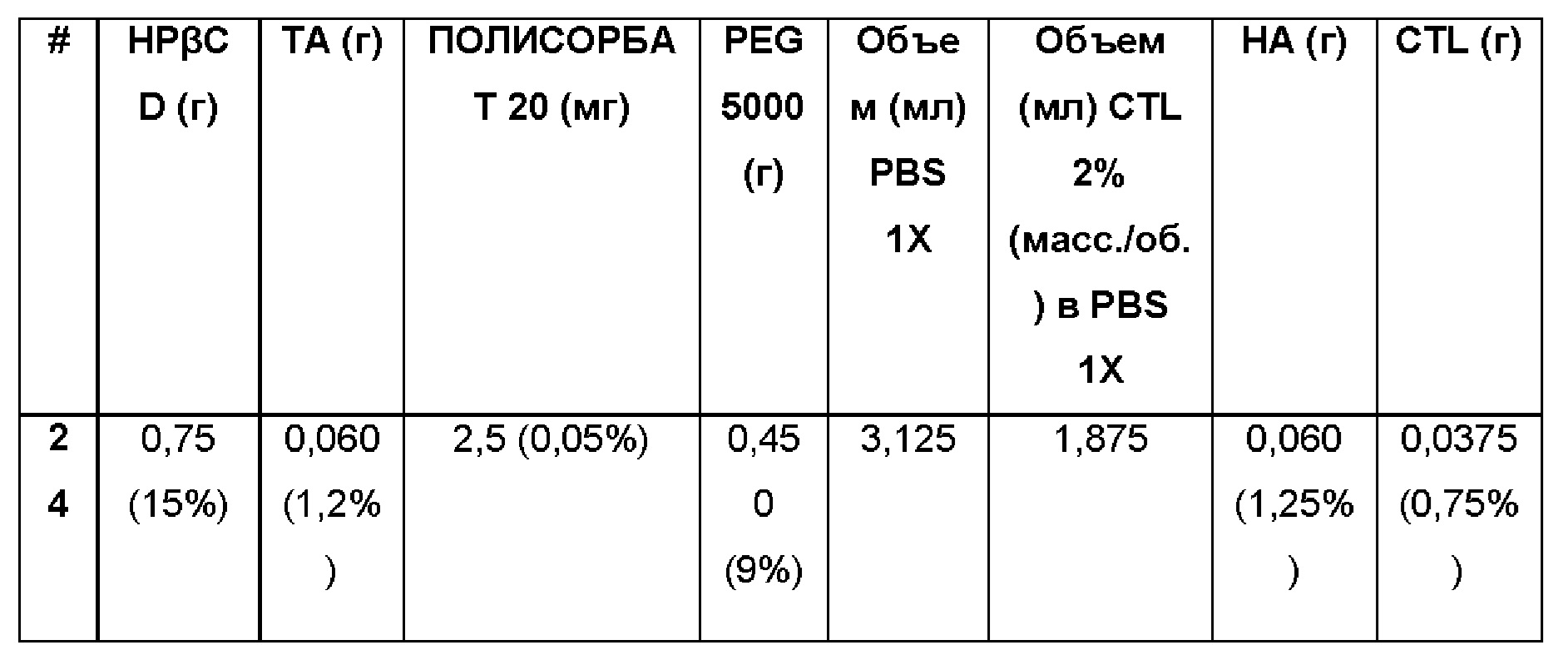
Пример 24. Водная композиция триамцинолона ацетонида (ТА, 1,2%), включенного в гидроксипропил-β-циклодекстрин (HPβCD 15%), полисорбат (0,05%) и PEG 5000 (9%) в матрице из гиалуроновой кислоты (НА, 1,25%) и хитлака (CTL, 0,75%) при различных концентрациях.
Состав Примера 24 был получен в соответствии с процедурой, указанной в Примере 12, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.
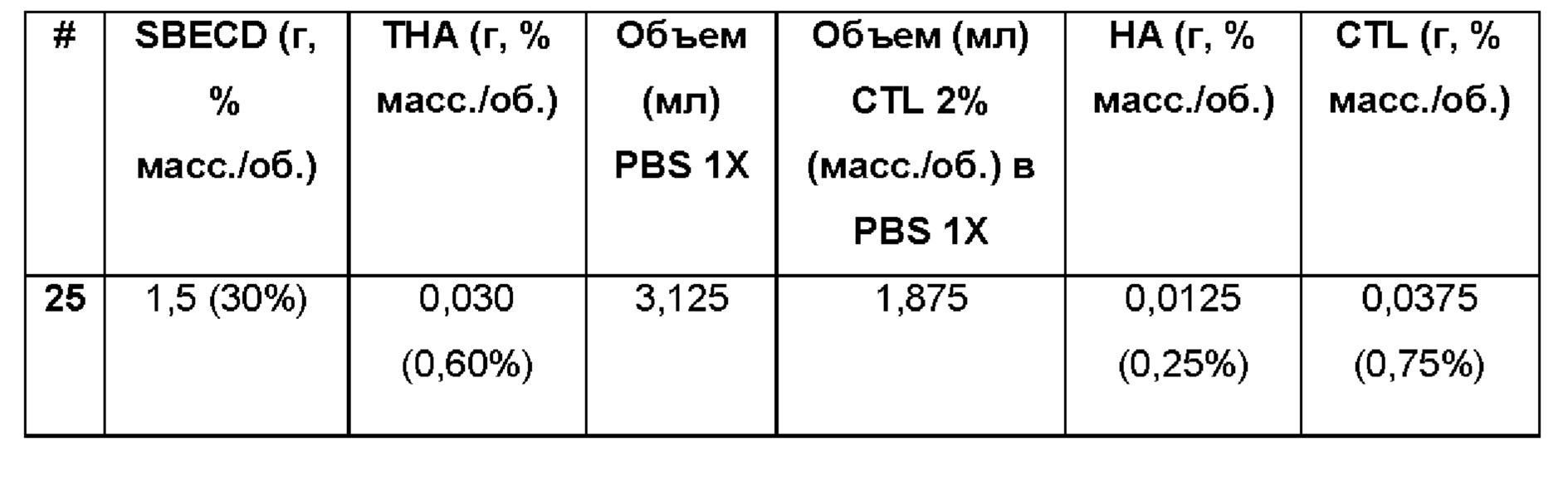
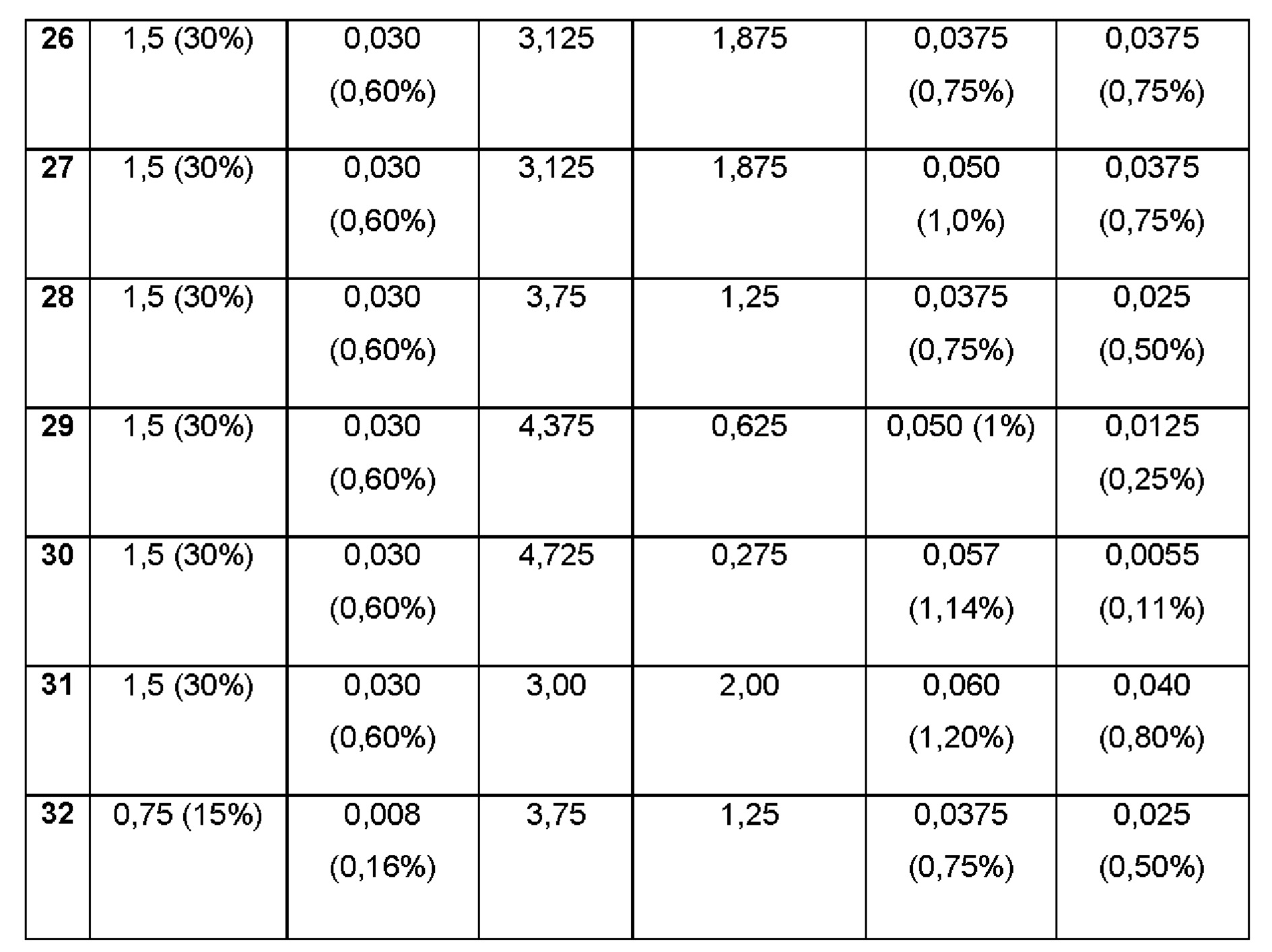
Примеры 25-32. Водные композиции триамцинолона гексацетонида (ТНА, 0,60 и 0,16%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 15 и 30%) в матрице из гиалуроновой кислоты (НА) и хитлака (CTL) при различных концентрациях.
Составы Примеров 25-32 были получены в соответствии с процедурой, указанной в Примере 1, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
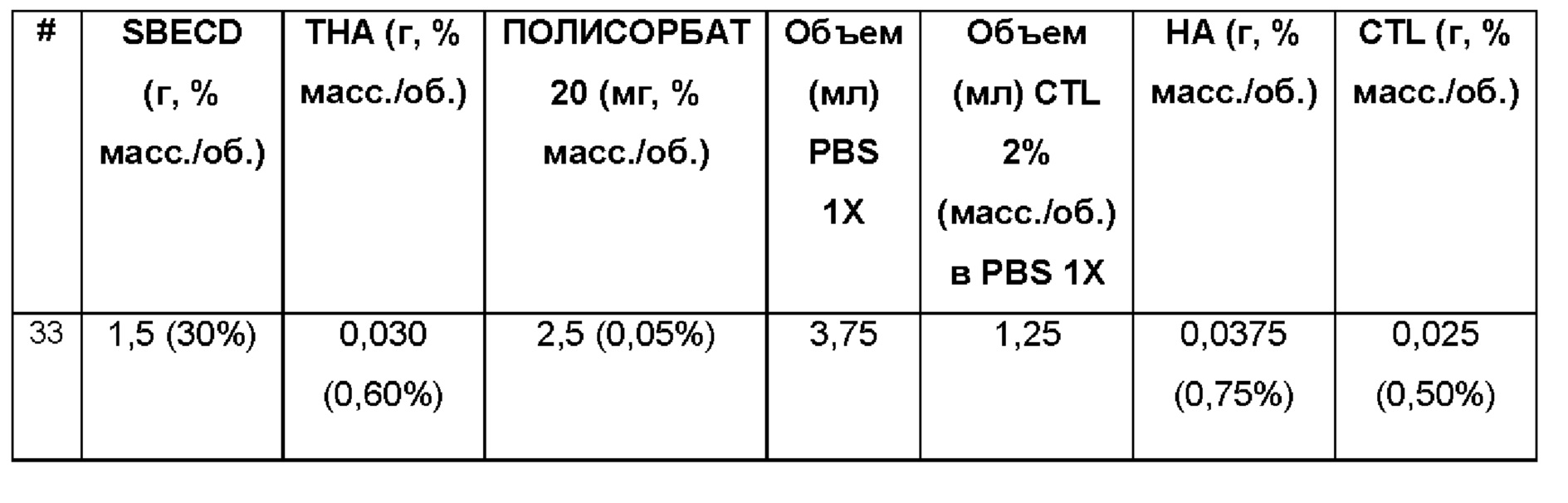
Примеры 33-36. Водные композиции триамцинолона гексацетонида (ТНА, 0,60 и 1,2%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 15 и 30%) и полисорбат (0,05%) в матрице из гиалуроновой кислоты (НА) и хитлака (CTL) при различных концентрациях.
Составы Примеров 33-36 были получены в соответствии с процедурой, указанной в Примере 9, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.

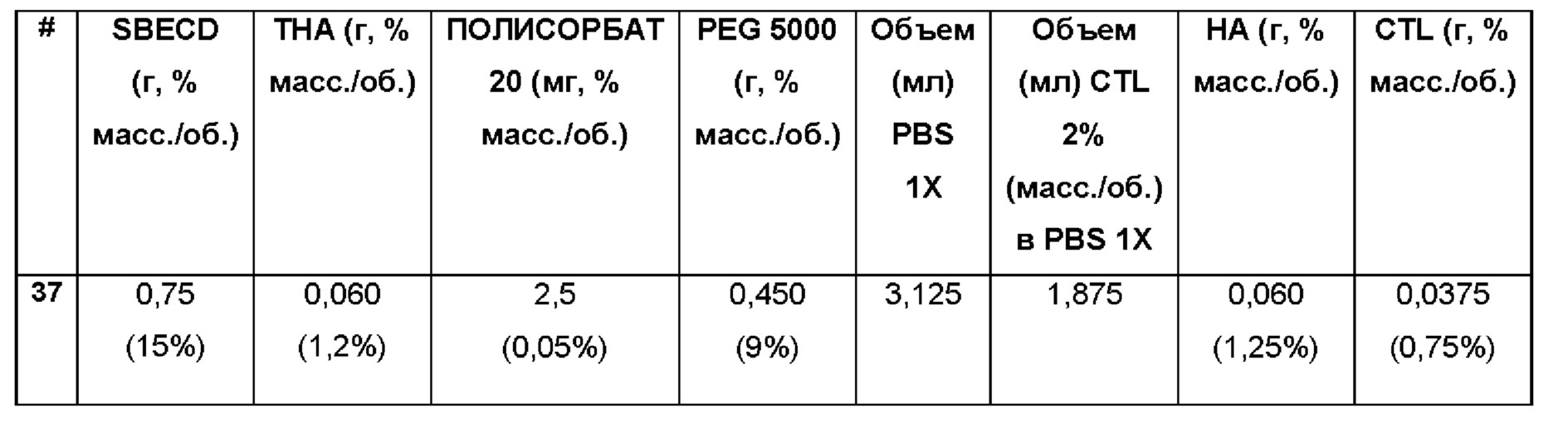
Пример 37. Водная композиция триамцинолона гексацетонида (ТНА, 1,2%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 15%), полисорбат (0,05%) и PEG 5000 (9%) в матрице из гиалуроновой кислоты (НА, 1,25%) и хитлака (CTL, 0,75%).
Состав Примеров 37 был получен в соответствии с процедурой, указанной в Примере 12, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.
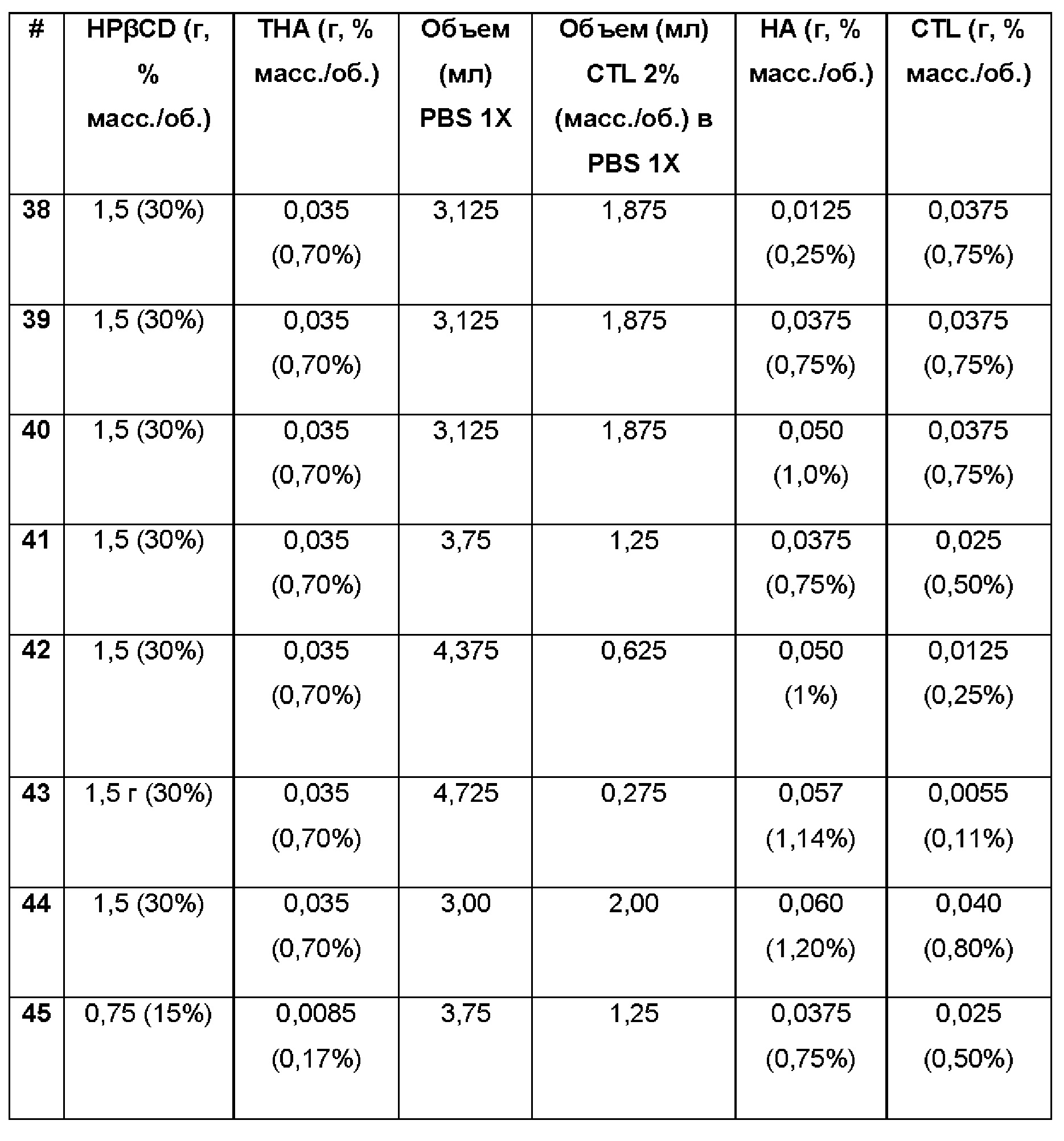
Примеры 38-45. Водные композиции триамцинолона гексацетонида (ТНА, 0,70 и 0,17%), включенного в гидроксипропил-β-циклодекстрин (HPβCD, 15 и 30%) в матрице из гиалуроновой кислоты (НА) и хитлака (CTL) при различных концентрациях.
Составы Примеров 38-45 были получены в соответствии с процедурой, указанной в Примере 1, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
Примеры 46-48. Водные композиции триамцинолона гексацетонида (ТНА, 1,2%), включенного в гидроксипропил-β-циклодекстрин (HPβCD, 15 и 30%) и полисорбат (0,05%) в матрице из гиалуроновой кислоты (НА) и хитлака (CTL) при различных концентрациях.
Составы Примеров 46-48 были получены в соответствии с той же процедурой, как указанно в Примере 9, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
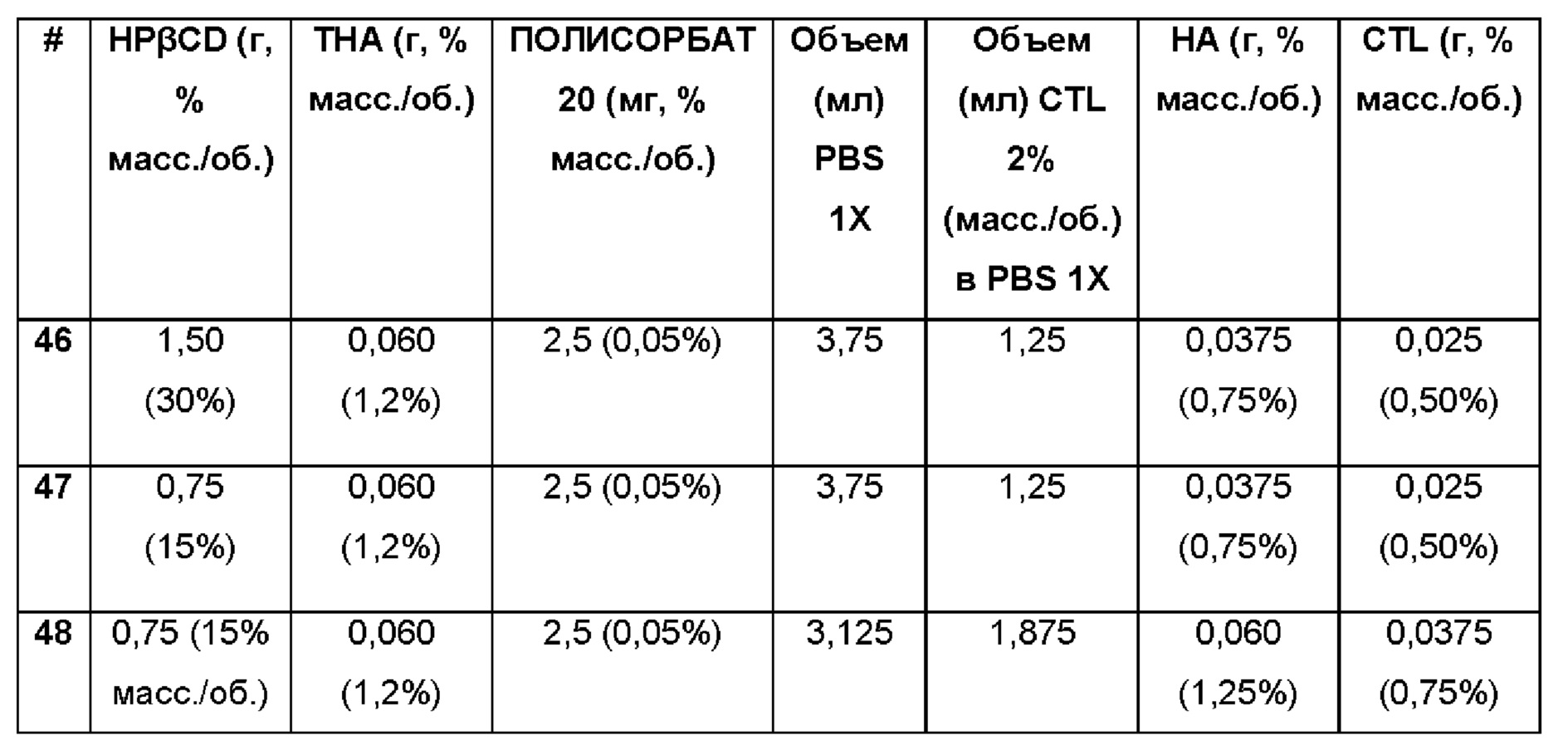
Пример 49. Водная композиция триамцинолона гексацетонида (ТНА, 1,2%), включенного в гидроксипропил-β-циклодекстрин (HPβCD, 15%), полисорбат (0,05%) и PEG 5000 (9%) в матрице из гиалуроновой кислоты (НА, 1,25%) и хитлака (CTL, 0,75%).
Состав Примеров 49 был получен в соответствии с процедурой, указанной в Примере 12, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
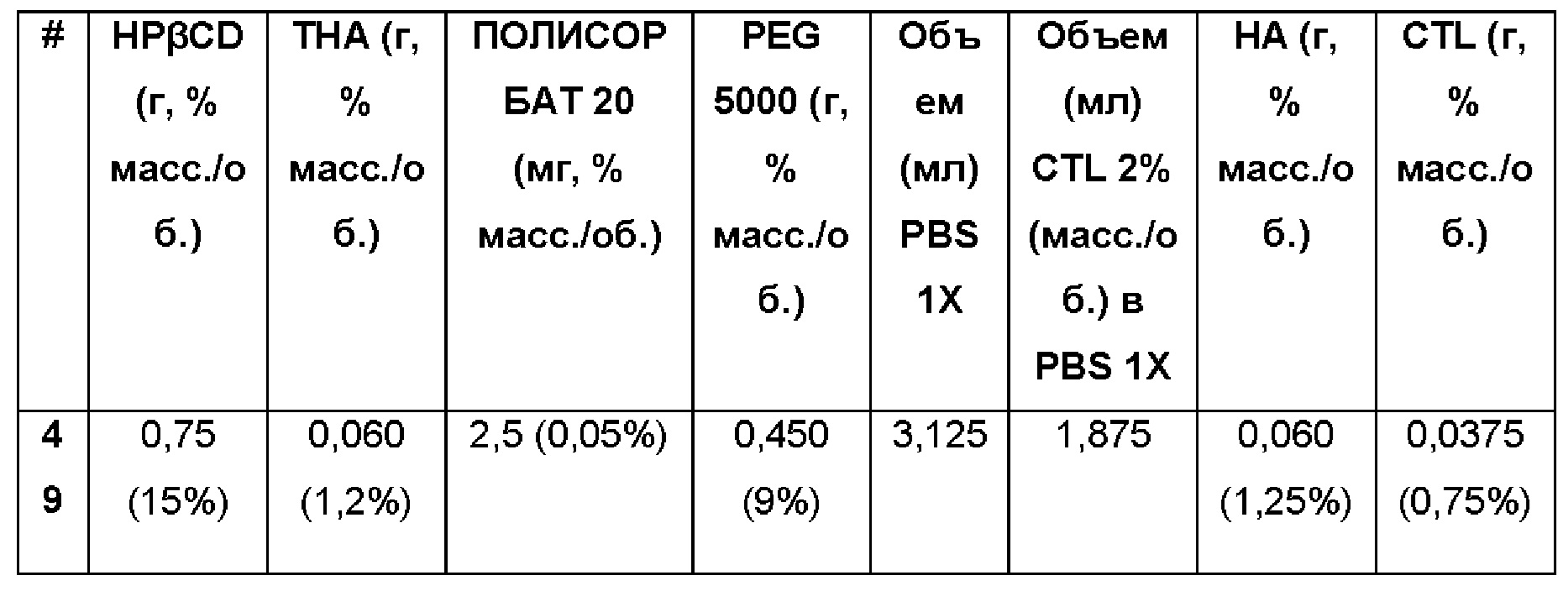
Примеры 50-51. Водные композиции натриевой соли диклофенака (DCNa, 1,5%), включенной в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 5%) в матрице из гиалуроновой кислоты (НА) и хитлака (CTL) при различных концентрациях.
Составы Примеров 50-51 были получены в соответствии с той же процедурой, как указанно в Примере 1, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
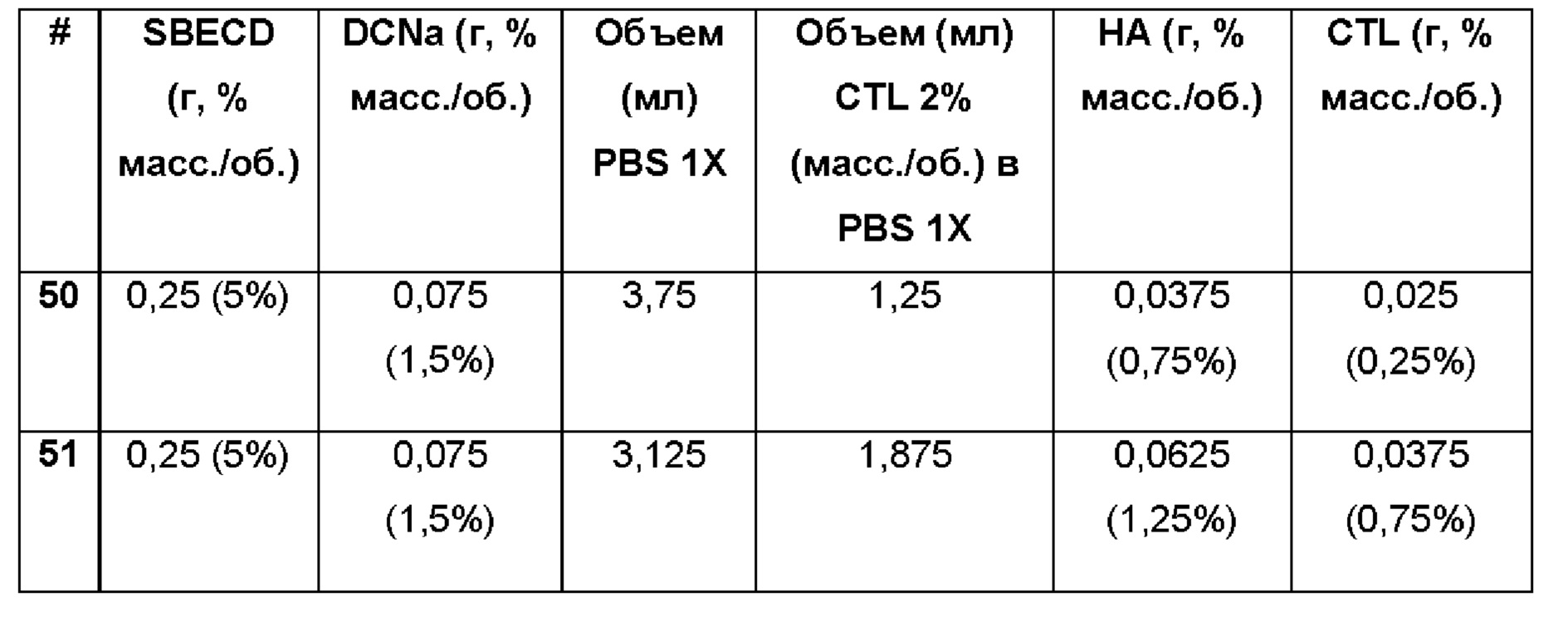
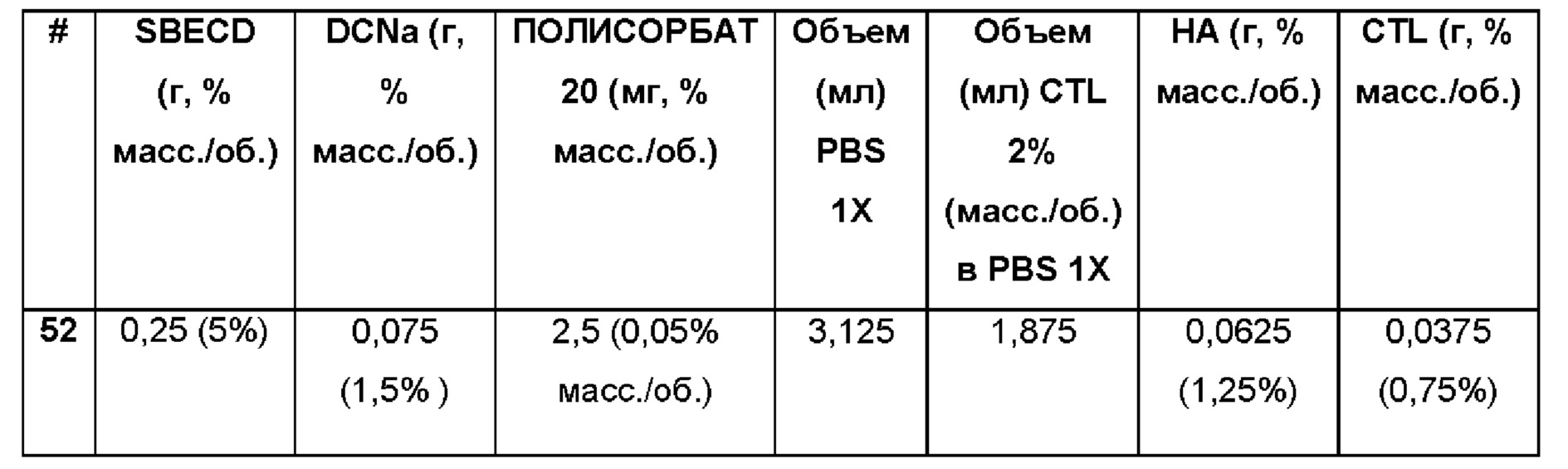
Пример 52. Водная композиция натриевой соли диклофенака (DCNa, 1,5%), включенной в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 5%) и полисорбат (0,05%) в матрице из гиалуроновой кислоты (НА, 1,25%) и хитлака (CTL, 0,75%).
Состав Примера 52 был получен в соответствии с той же процедурой, как указанно в Примере 9, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.
Пример 53. Водная композиция натриевой соли диклофенака (DCNa, 1,5%), включенного в гидроксипропил-бета-циклодекстрин (HPβCD, 5%) в матрице из гиалуроновой кислоты (НА, 0,75%) и хитлака (CTL, 0,50%).
Состав Примера 53 был получен в соответствии с той же процедурой, как указанно в Примере 1, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
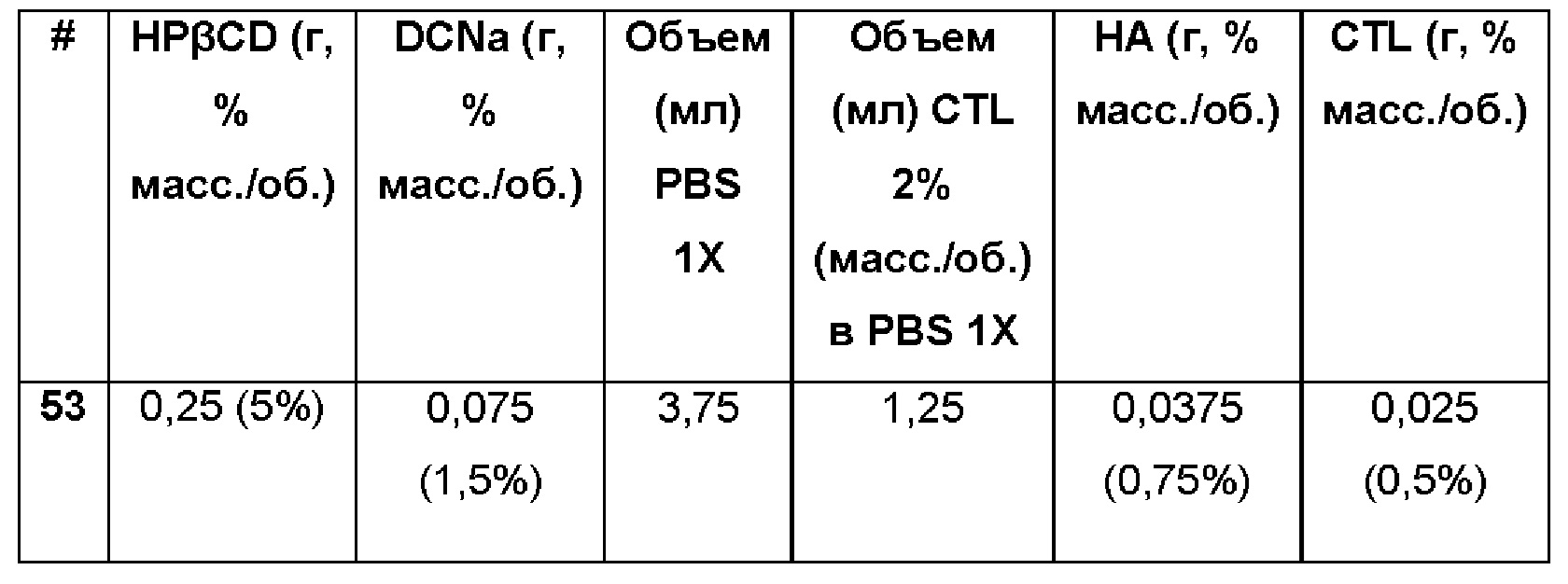
Пример 54. Водная композиция натриевой соли диклофенака (DCNa, 1,5%), включенного в гидроксипропил-бета-циклодекстрин (HPβCD, 5%) в матрице из гиалуроновой кислоты (НА, 1,25%) и хитлака (CTL, 0,75%). Состав Примера 54 был получен в соответствии с той же процедурой, как указанно в Примере 1, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.

Пример 55. Водная композиция натриевой соли диклофенака (DCNa, 1,5%), включенного в гидроксипропил-бета-циклодекстрин (HPβCD, 5%) и полисорбат (0,05%) в матрице из гиалуроновой кислоты (НА, 1,25%) и хитлака (CTL, 0,75%).
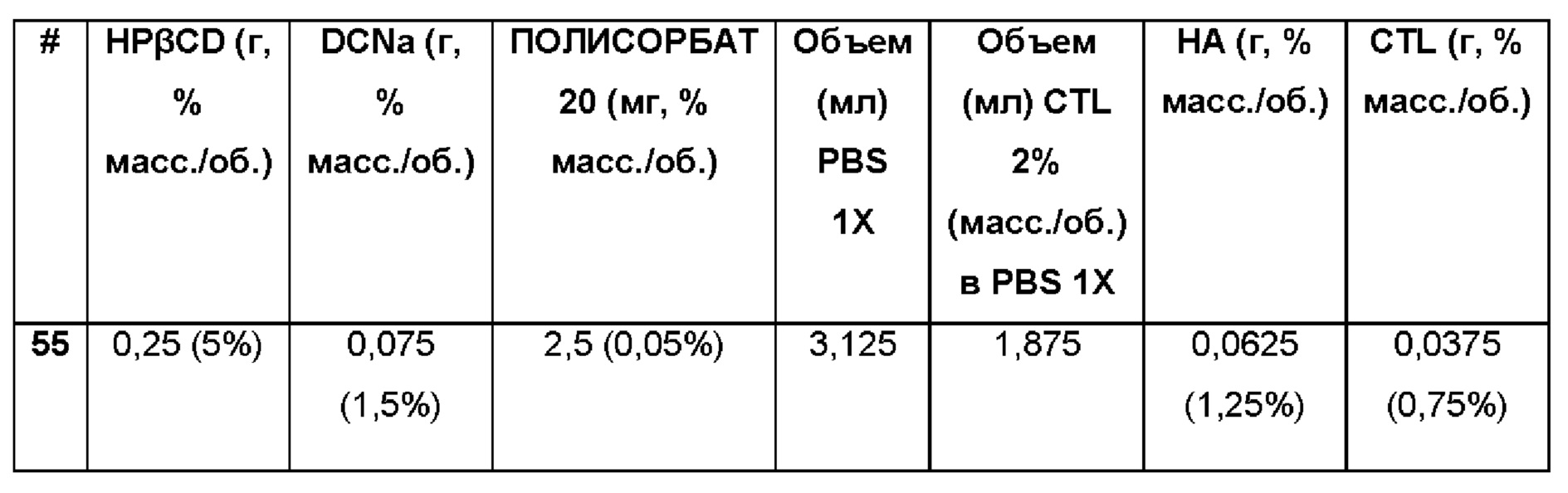
Состав Примера 55 был получен в соответствии с той же процедурой, как указанно в Примере 9, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.
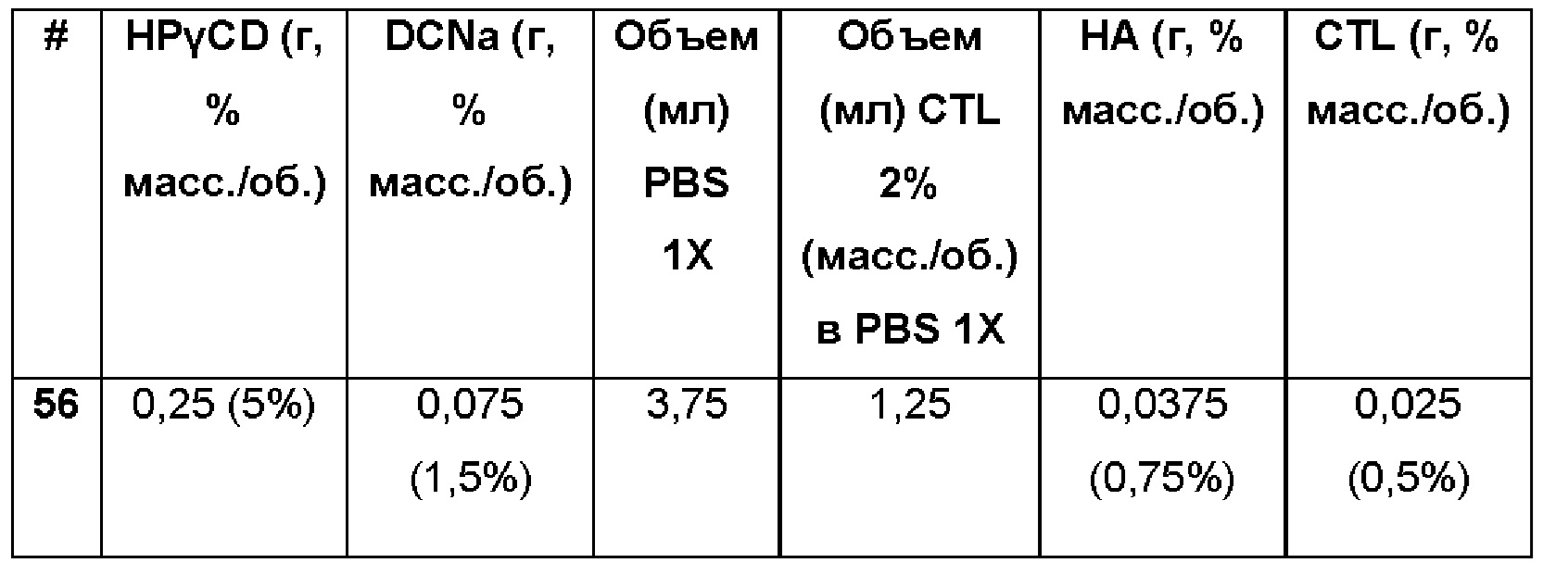
Пример 56. Водная композиция натриевой соли диклофенака (DCNa, 1,5%), включенного в гидроксипропил-гамма-циклодекстрин (HPγCD, 5%) в матрице из гиалуроновой кислоты (НА, 0,75%) и хитлака (CTL, 0,50%). Состав Примера 56 был получен в соответствии с той же процедурой, как указанно в Примере 1, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.
Пример 57. Сравнительный пример водной композиции триамцинолона ацетонида (ТА, 0,44%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 30%) в матрице из хитлака (CTL, 0,75%). 1,5 г сульфобутилового эфира 7-бета-циклодекстрина растворяли в 3,125 мл фосфатно-солевого буферного раствора (PBS 1Х: 137 мМ NaCl, 2,7 мМ KCl, 8,1 мМ Na2HPO4, 1,76 мМ NaH2PO4), впоследствии добавляли 22 мг триамцинолона ацетонида и полученную таким образом систему перемешивали в течение 16 ч при комнатной температуре. Затем добавляли 1,875 мл 2% (масс./об.) раствора хитлака в фосфатно-солевом буферном растворе (PBS 1Х: 137 мМ NaCl, 2,7 мМ KCl, 8,1 мМ Na2HPO4, 1,76 мМ NaH2PO4) и систему перемешивали в течение дополнительных 30 минут. Значение рН раствора составляло 7,4.

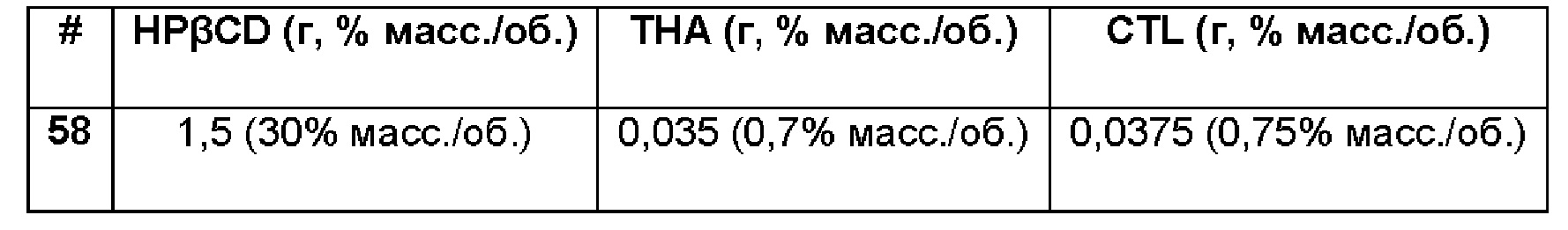
Пример 58. Сравнительный пример водной композиции триамцинолона ацетонида (ТА, 0,44%), включенного в гидроксипропил-бета-циклодекстрин (HPβCD, 30%) в матрице из хитлака (CTL, 0,75%).
Состав Примера 58 был получен в соответствии с той же процедурой, как указанно в Примере 57, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.

Пример 59. Сравнительный пример водной композиции триамцинолона гексацетонида (ТНА, 0,7%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 30%) в матрице из хитлака (CTL, 0,75%). Состав Примера 59 был получен в соответствии с той же процедурой, как указанно в Примере 57, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.

Пример 60. Сравнительный пример водной композиции триамцинолона гексацетонида (ТНА, 0,7%), включенного в гидроксипропил-бета-циклодекстрин (HPβCD, 30%) в матрице из хитлака (CTL, 0,75%). Состав Примера 60 был получен в соответствии с той же процедурой, как указанно в Примере 57, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.
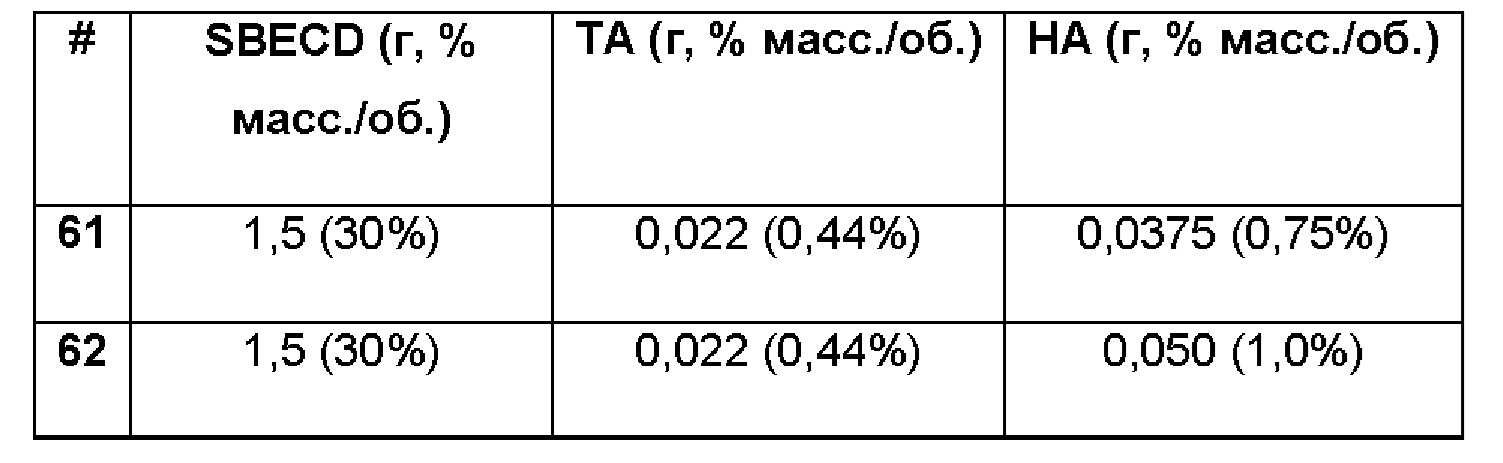
Примеры 61-63. Сравнительные примеры водных композиций триамцинолона ацетонида (ТА, 0,44%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 30%) в матрице только из гиалуроновой кислоты (НА) при различных концентрациях.
1,5 г сульфобутилового эфира 7-бета-циклодекстрина растворяли в 5 мл фосфатно-солевого буферного раствора (PBS 1Х: 137 мМ NaCl, 2,7 мМ KCl, 8,1 мМ Na2HPO4, 1,76 мМ NaH2PO4), впоследствии добавляли 22 мг триамцинолона ацетонида и полученную таким образом систему перемешивали в течение 16 ч при комнатной температуре. Затем добавляли 37,5, 50 и 62,5 мг гиалуроновой кислоты при перемешивании, соответственно, и полученную таким образом смесь перемешивали при 60°С в течение 2 ч и при комнатной температуре в течение 16 ч. Указанный раствор имел значение рН 7,4.

Пример 64. Сравнительный пример водной композиции триамцинолона ацетонида (ТА, 1,2%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 30%) и полисорбат (0,05%) в матрице только из гиалуроновой кислоты (НА, 0,75%).
1,5 г сульфобутилового эфира 7-бета-циклодекстрина и 2,5 мг полисорбата 20 растворяли в 5 мл фосфатно-солевого буферного раствора (PBS 1X: 137 мМ NaCl, 2,7 мМ KCl, 8,1 мМ Na2HPO4, 1,76 мМ NaH2PO4), впоследствии добавляли 22 мг триамцинолона ацетонида и полученную таким образом систему перемешивали в течение 16 ч при комнатной температуре. Затем добавляли 37,5 мг гиалуроновой кислоты при перемешивании и полученную таким образом смесь перемешивали при 60°С в течение 2 ч и при комнатной температуре в течение 16 ч. Значение рН раствора составляло 7,4.

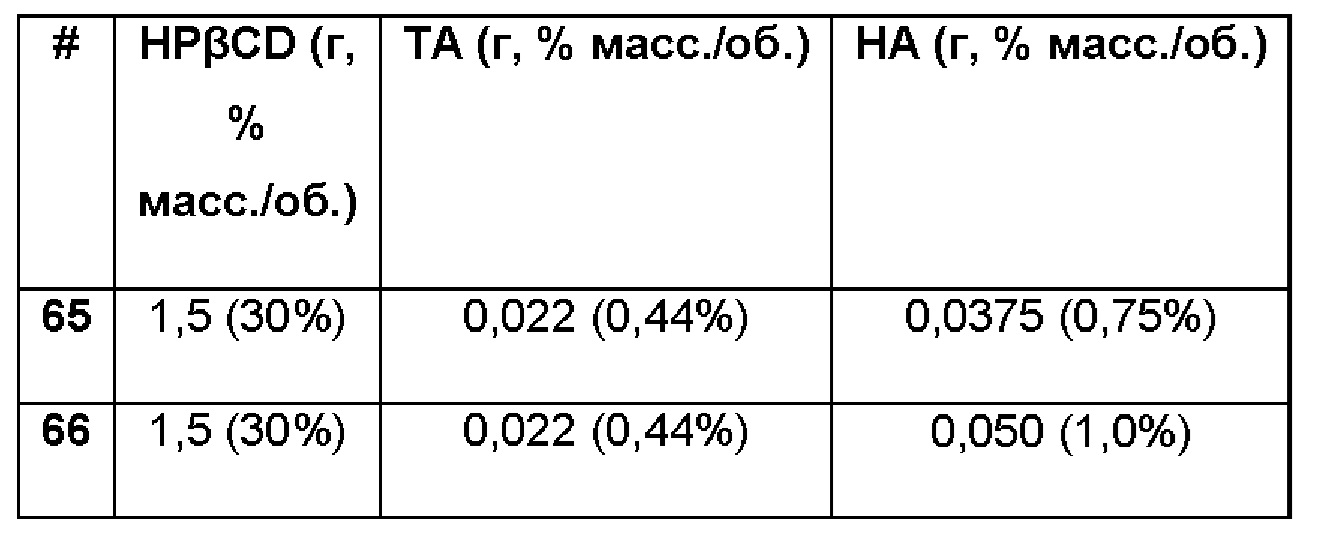
Примеры 65-67. Сравнительные примеры водных композиций триамцинолона ацетонида (ТА, 0,44%), включенного в гидроксипропил-бета-циклодекстрин (HPβCD, 30%) в матрице только из гиалуроновой кислоты (НА) при различных концентрациях.
Составы Примеров 65-67 были получены в соответствии с процедурой, указанной в Примере 61, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.

Пример 68. Сравнительный пример водной композиции триамцинолона ацетонида (ТА, 1,2%), включенного в гидроксипропил-бета-циклодекстрин (HPβCD, 30%) и полисорбат (0,05%) в матрице только из гиалуроновой кислоты (НА, 0,75%).
Состав Примера 68 был получен в соответствии с процедурой, указанной в Примере 64, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.

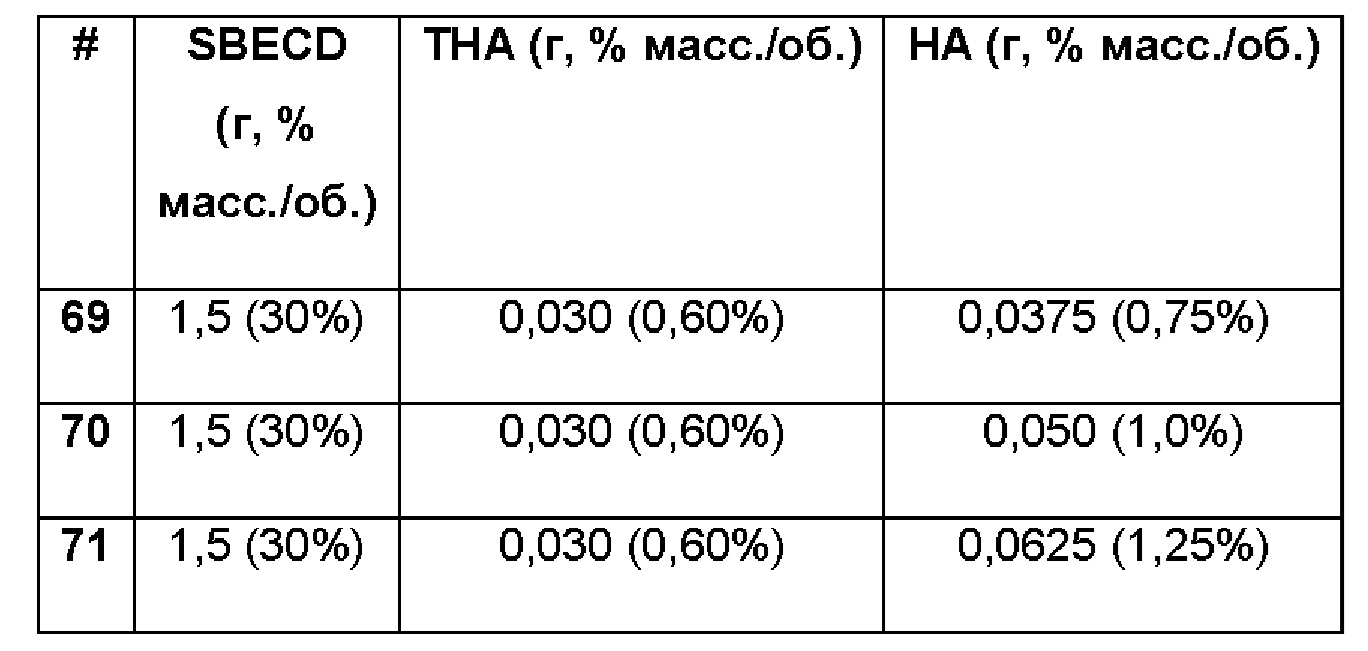
Примеры 69-71. Сравнительные примеры водных композиций триамцинолона гексацетонида (ТНА, 0,60%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 30%) в матрице только из гиалуроновой кислоты (НА) при различных концентрациях.
Составы Примеров 69-71 были получены в соответствии с процедурой, указанной в Примере 61, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
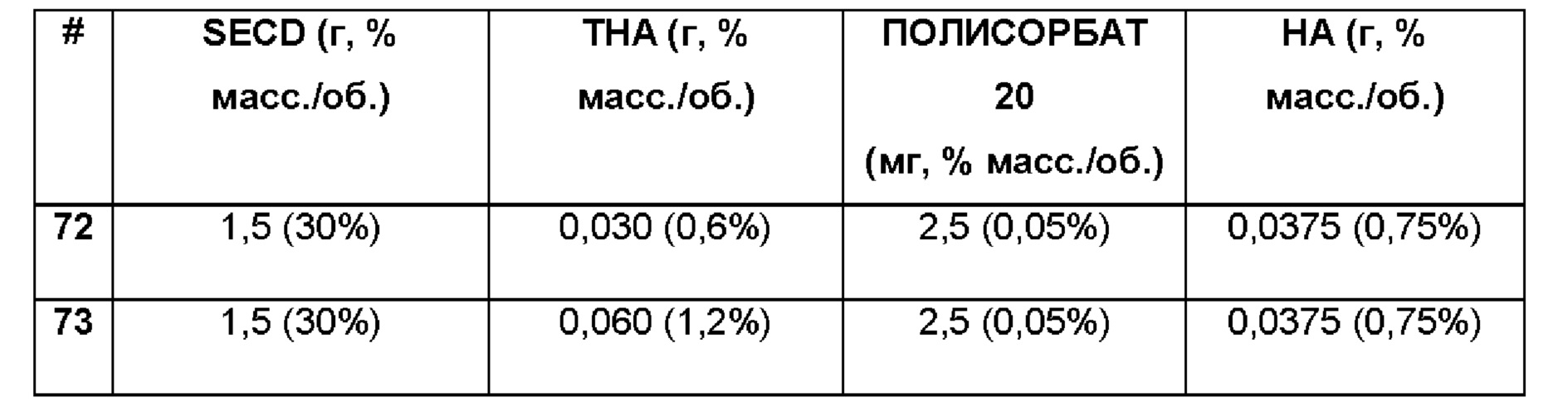
Примеры 72-73. Сравнительные примеры водных композиций триамцинолона гексацетонида (ТНА, 0,60 и 1,2%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 30%) и полисорбат (0,05%) в матрице только из гиалуроновой кислоты (НА, 0,75%). Составы Примеров 72-73 были получены в соответствии с процедурой, указанной в Примере 64, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
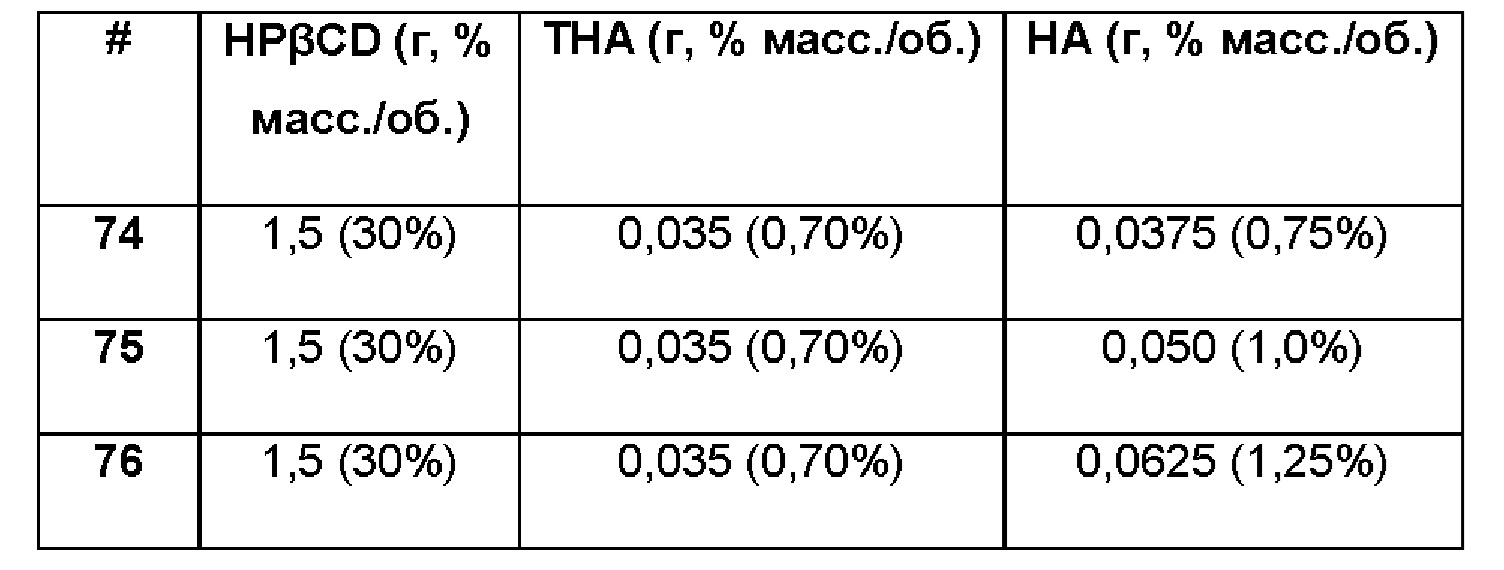
Примеры 74-76. Сравнительные примеры водных композиций триамцинолона гексацетонида (ТНА, 0,70%), включенного в гидроксипропил-бета-циклодекстрин (HPβCD, 30%) в матрице только из гиалуроновой кислоты (НА) при различных концентрациях.
Составы Примеров 74-76 были получены в соответствии с процедурой, указанной в Примере 61, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
Пример 77. Сравнительный пример водной композиции триамцинолона гексацетонида (ТНА, 1,2%), включенного в гидроксипропил-бета-циклодекстрин (HPβCD, 30%) и полисорбат (0,05%) в матрице только из гиалуроновой кислоты (НА, 0,75%).
Состав Примера 77 был получен в соответствии с процедурой, указанной в Примере 64, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.

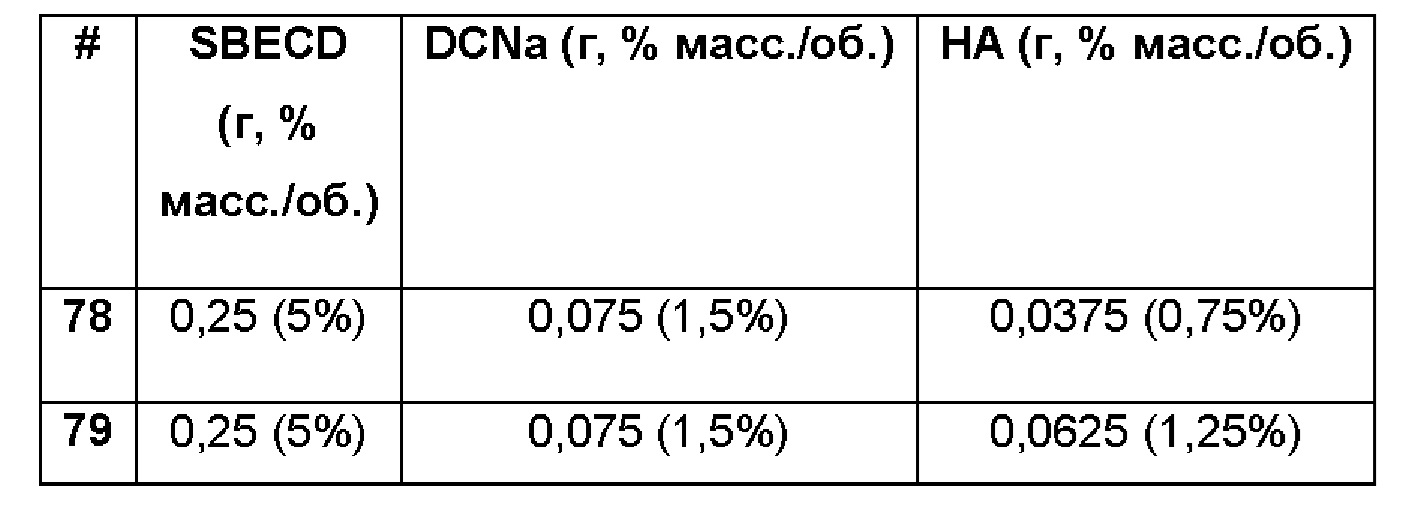
Примеры 78-79. Сравнительные примеры водных композиций натриевой соли диклофенака (DCNa, 1,5%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 5%) в матрице только из гиалуроновой кислоты (НА, 0,75 и 1,25%).
Составы Примеров 78-79 были получены в соответствии с процедурой, указанной в Примере 61, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
Пример 80. Сравнительный пример водной композиции натриевой соли диклофенака (DCNa, 1,2%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 5%) и полисорбат (0,05%) в матрице только из гиалуроновой кислоты (НА, 0,75%).
Состав Примера 80 был получен в соответствии с процедурой, указанной в Примере 64, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.

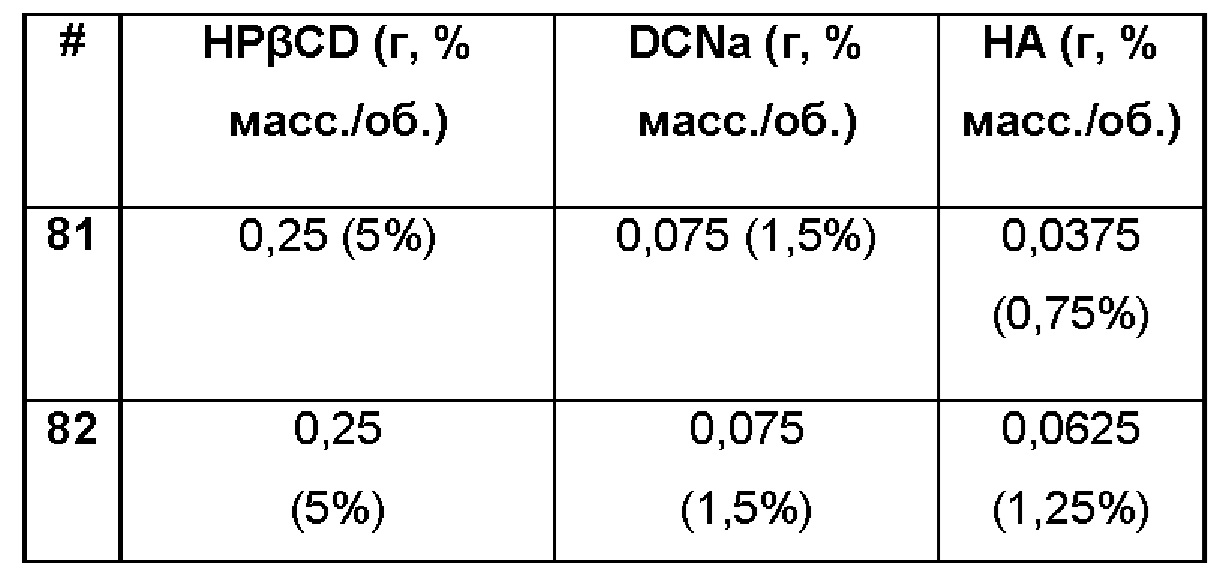
Пример 81-82. Сравнительные примеры водных композиций натриевой соли диклофенака (DCNa, 1,5%), включенного в гидроксипропил-бета-циклодекстрин (HPβCD, 5%) в матрице только из гиалуроновой кислоты (НА, 0,75% и 1,25%).
Состав Примеров 81-82 был получен в соответствии с процедурой, указанной в Примере 61, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
Пример 83. Сравнительный пример водной композиции натриевой соли диклофенака (DCNa, 1,5%), включенного в гидроксипропил-бета-циклодекстрин (HPβCD, 5%) и полисорбат (0,05%) в матрице только из гиалуроновой кислоты (НА, 1,25%).
Состав Примера 83 был получен в соответствии с процедурой, указанной в Примере 64, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.

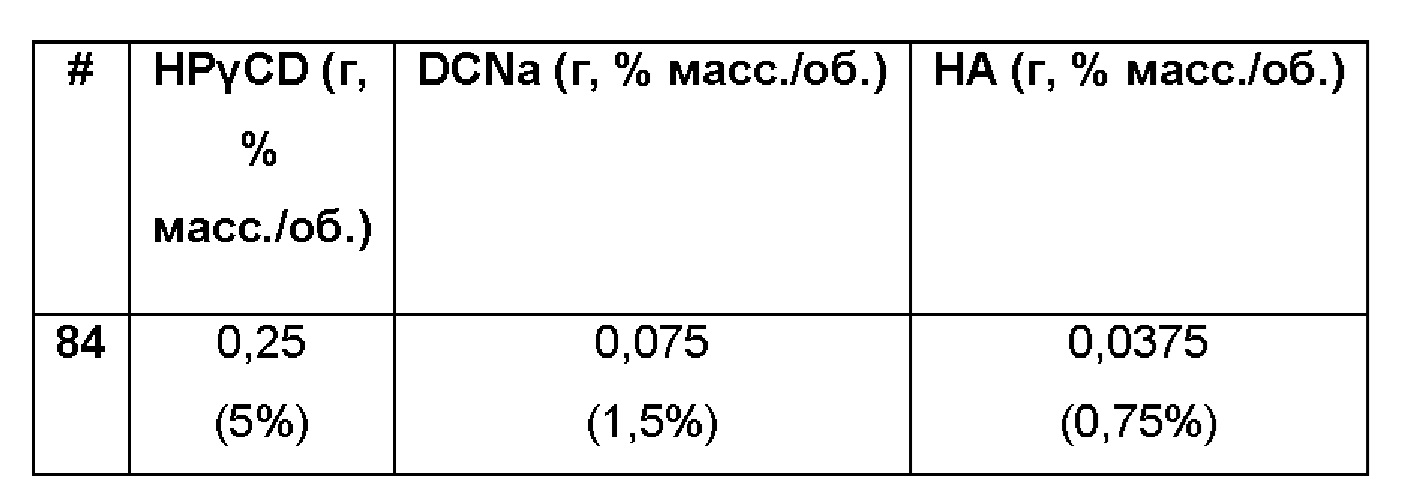
Пример 84. Сравнительный пример водной композиции натриевой соли диклофенака (DCNa, 1,5%), включенного в гидроксипропил-гамма-циклодекстрин (HPγCD, 5%) в матрице только из гиалуроновой кислоты (НА, 0,75%).
Состав Примера 84 был получен в соответствии с процедурой, указанной в Примере 61, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.
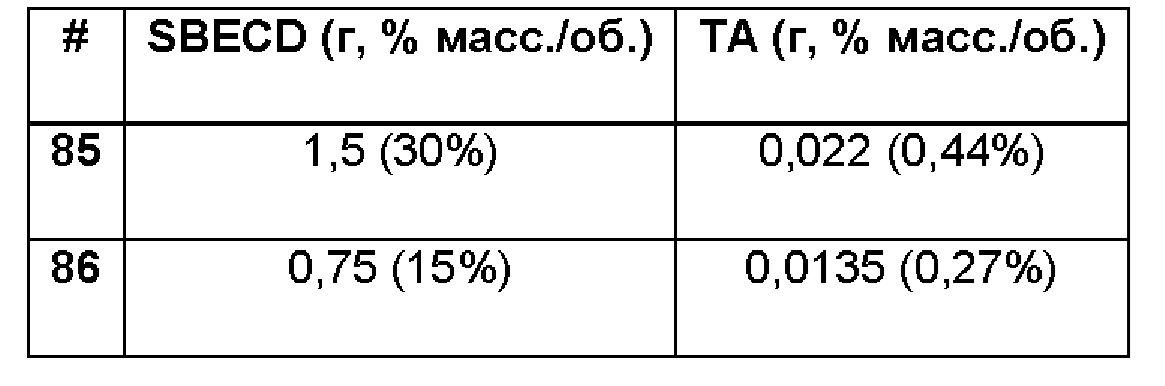
Примеры 85-86. Сравнительные примеры водных композиций триамцинолона ацетонида (ТА, 0,44 и 0,27%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 30 и 15%) без полимерной матрицы.
1,5 г сульфобутилового эфира 7-бета-циклодекстрина растворяли в 5 мл фосфатно-солевого буферного раствора (PBS 1Х: 137 мМ NaCl, 2,7 мМ KCl, 8,1 мМ Na2HPO4, 1,76 мМ NaH2PO4), 22 и 13,5 мг триамцинолона ацетонида добавляли, соответственно, и полученную таким образом систему перемешивали в течение 16 ч при комнатной температуре. Значение рН растворов составляло 7,4.
Пример 87. Сравнительный пример водной композиции триамцинолона ацетонида (ТА, 0,44%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 30 и 15%) и полисорбат (0,05%) без полимерной матрицы.
1,5 г сульфобутилового эфира 7-бета-циклодекстрина и 2,5 полисорбат 20 растворяли в 5 мл фосфатно-солевого буферного раствора (PBS 1X: 137 мМ NaCl, 2,7 мМ KCl, 8,1 мМ Na2HPO4, 1,76 мМ NaH2PO4), впоследствии добавляли 22 мг триамцинолона ацетонида и полученную таким образом систему перемешивали в течение 16 ч при комнатной температуре. Значение рН раствора составляло 7,4.

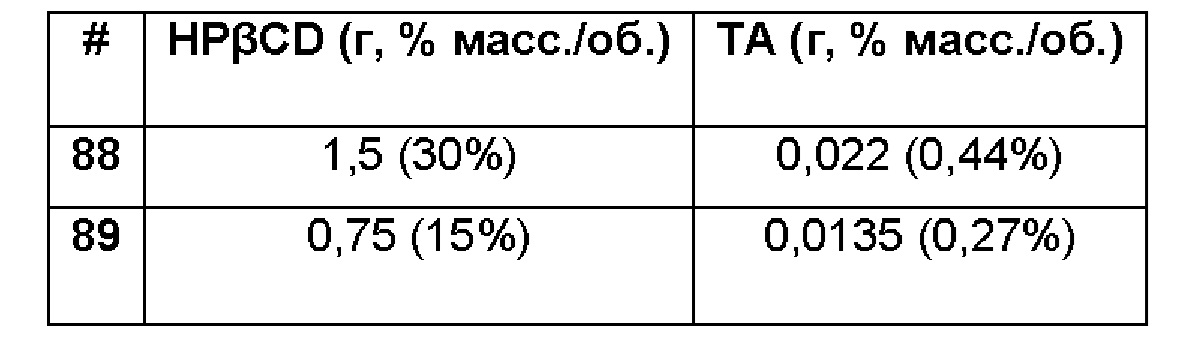
Примеры 88-89. Сравнительные примеры водных композиций триамцинолона ацетонида (ТА, 0,44 и 0,27%), включенного в гидроксипропил-бета-циклодекстрин (HPβCD, 30 и 15%) без полимерной матрицы. Составы Примеров 88-89 были получены в соответствии с процедурой, указанной в Примерах 85 и 86, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
Пример 90. Сравнительный пример водной композиции триамцинолона ацетонида (ТА, 1,2%), включенного в гидроксипропил-бета-циклодекстрин (HPβCD, 30%) и полисорбат (0,05%) без полимерной матрицы. Состав Примера 90 был получен в соответствии с процедурой, указанной в Примере 87, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.

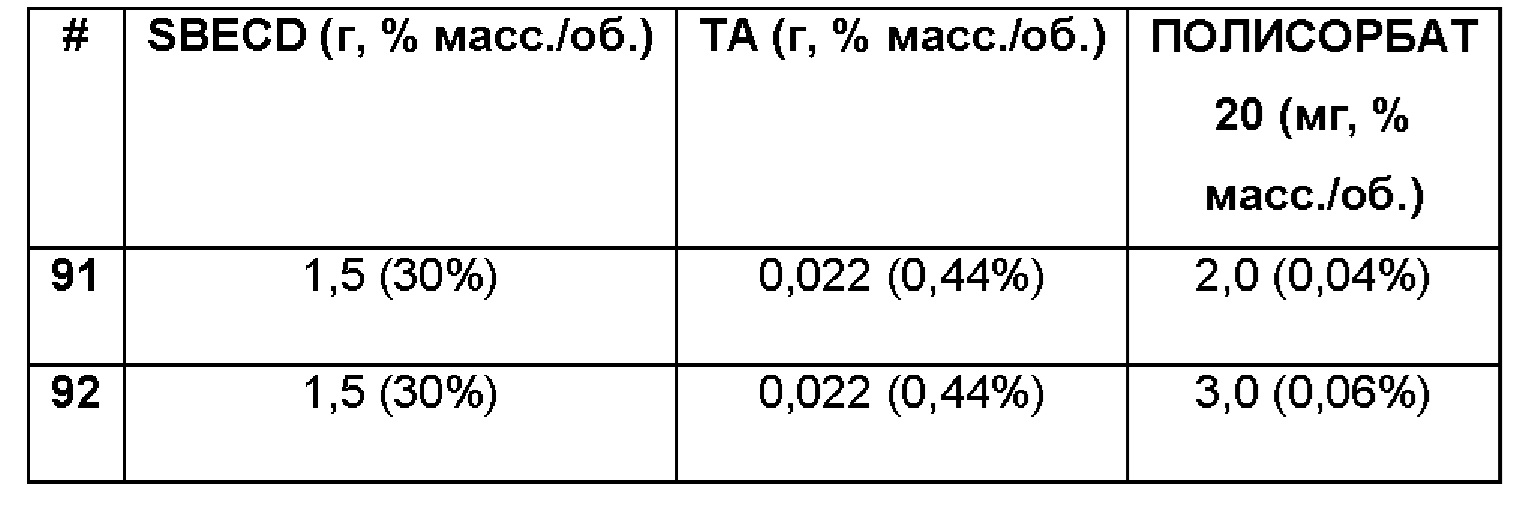
Составы Примеров 91-92 были получены в соответствии с процедурой, указанной в Примере 87, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
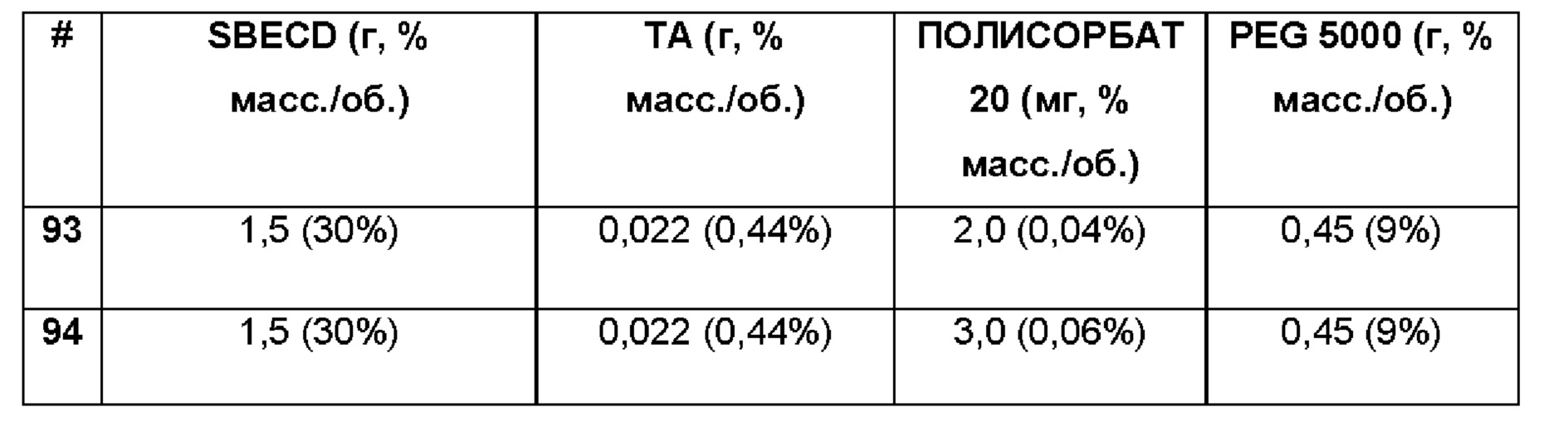
Примеры 93-94. Сравнительные примеры водных композиций триамцинолона ацетонида (ТА, 0,44%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 30 и 15%), полисорбат (0,04% и 0,06%), и PEG 5000 (9%) без полимерной матрицы.
1,5 г сульфобутилового эфира 7-бета-циклодекстрина и 2,0 и 3,0 мг, соответственно, полисорбата 20, 0,45 г пропиленгликоля растворяли в 5 мл фосфатно-солевого буферного раствора (PBS 1Х: 137 мМ NaCl, 2,7 мМ KCl, 8,1 мМ Na2HPO4, 1,76 мМ NaH2PO4), впоследствии добавляли 22 мг триамцинолона ацетонида и полученную таким образом систему перемешивали в течение 16 ч при комнатной температуре. Значение рН растворов составляло 7,4.
Примеры 95-96. Сравнительные примеры водных композиций триамцинолона ацетонида (ТА, 0,44%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 30 и 15%) и Pluronic F68 (0,04% и 0,06%) без полимерной матрицы.
1,5 г сульфобутилового эфира 7-бета-циклодекстрина и 2,0 и 3,0 мг, соответственно, Pluronic F68 20 растворяли в 5 мл фосфатно-солевого буферного раствора (PBS 1Х: 137 мМ NaCl, 2,7 мМ KCl, 8,1 мМ Na2HPO4, 1,76 мМ NaH2PO4), впоследствии добавляли 22 мг триамцинолона ацетонида и полученную таким образом систему перемешивали в течение 16 ч при комнатной температуре. Значение рН растворов составляло 7,4.
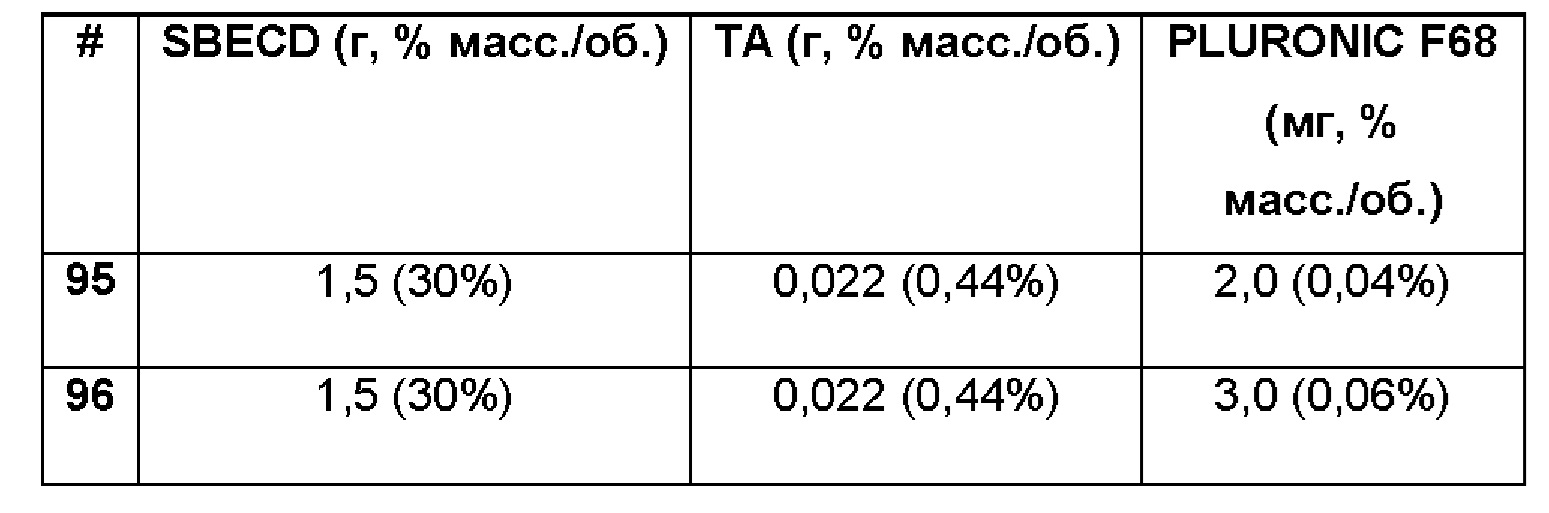
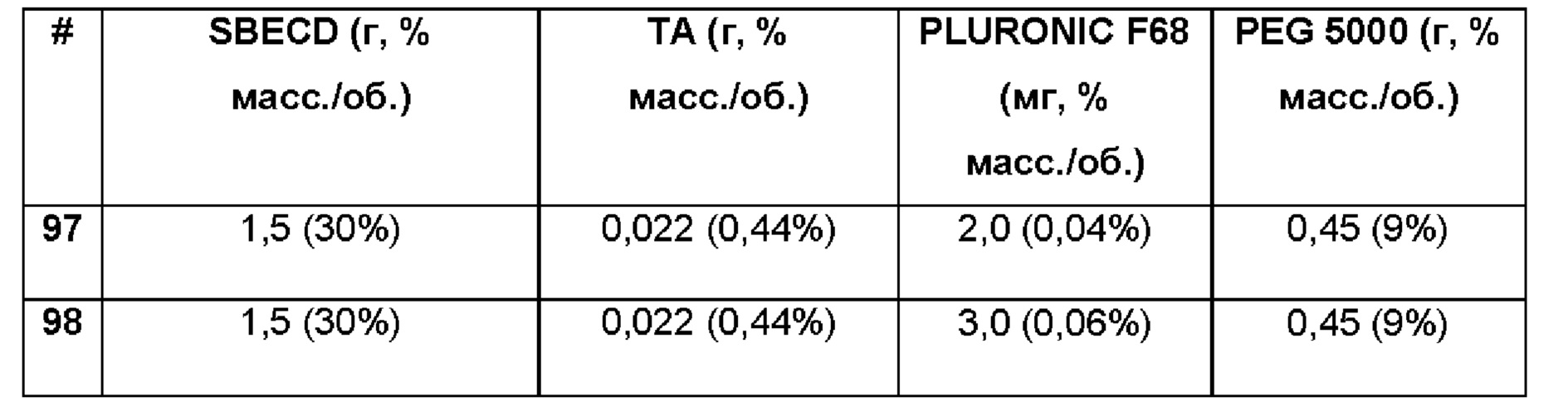
Примеры 97-98. Сравнительные примеры водных композиций триамцинолона ацетонида (ТА, 0,44%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 30 и 15%), Pluronic F68 (0,04% и 0,06%) и PEG 5000 (9%) без полимерной матрицы.
1,5 г сульфобутилового эфира 7-бета-циклодекстрина и 2,0 и 3,0 мг, соответственно, Pluronic F68 20, 0,45 г пропиленгликоля растворяли в 5 мл фосфатно-солевого буферного раствора (PBS 1Х: 137 мМ NaCl, 2,7 мМ KCl, 8,1 мМ Na2HPO4, 1,76 мМ NaH2PO4), впоследствии добавляли 22 мг триамцинолона ацетонида и полученную таким образом систему перемешивали в течение 16 ч при комнатной температуре. Значение рН растворов составляло 7,4.
Примеры 99-100. Сравнительные примеры водных композиций триамцинолона гексацетонида (ТНА, 0,60 и 0,16%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 30%) без полимерной матрицы.
Составы Примеров 99-100 были получены в соответствии с процедурой, указанной в Примере 85, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.

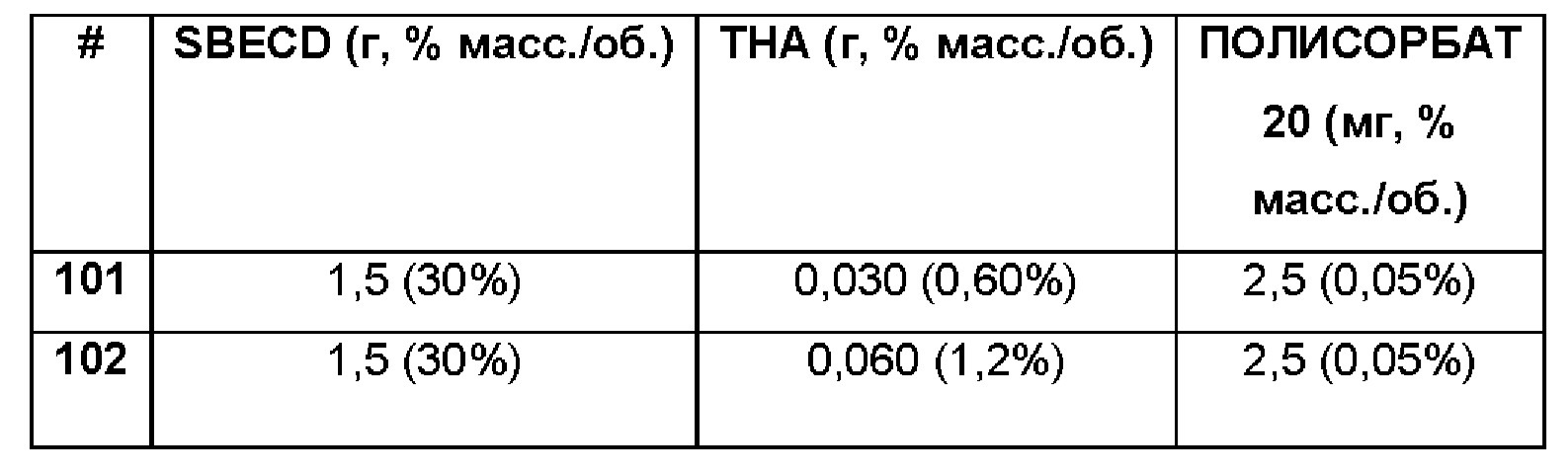
Примеры 101-102. Сравнительные примеры водных композиций триамцинолона гексацетонида (ТНА, 0,60 и 1,2%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 30%) и полисорбат (0,05%) без полимерной матрицы.
Составы Примеров 101-102 были получены в соответствии с процедурой, указанной в Примере 87, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН растворов составляло 7,4.
Пример 103. Сравнительный пример водной композиции триамцинолона гексацетонида (ТНА, 0,70%), включенного в гидроксипропил-бета-циклодекстрин (HPβCD, 30%) без полимерной матрицы. Состав Примера 103 был получен в соответствии с процедурой, указанной в Примере 85, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.

Пример 104. Сравнительный пример водной композиции триамцинолона гексацетонида (ТНА, 1,2%), включенного в гидроксипропил-бета-циклодекстрин (HPβCD, 30%) и полисорбат (0,05%) без полимерной матрицы. Состав Примера 104 был получен в соответствии с процедурой, указанной в Примере 87, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.

Пример 105. Сравнительный пример водной композиции натриевой соли диклофенака (DCNa, 1,5%), включенного в сульфобутиловый эфир 7-бета-циклодекстрина (SBECD, 5%) без полимерной матрицы. Состав Примера 105 был получен в соответствии с процедурой, указанной в Примере 85, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.

Пример 106. Сравнительный пример водной композиции натриевой соли диклофенака (DCNa, 1,5%), включенного в гидроксипропил-бета-циклодекстрин (HPβCD, 5%) без полимерной матрицы.
Состав Примера 106 был получен в соответствии с процедурой, указанной в Примере 85, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.

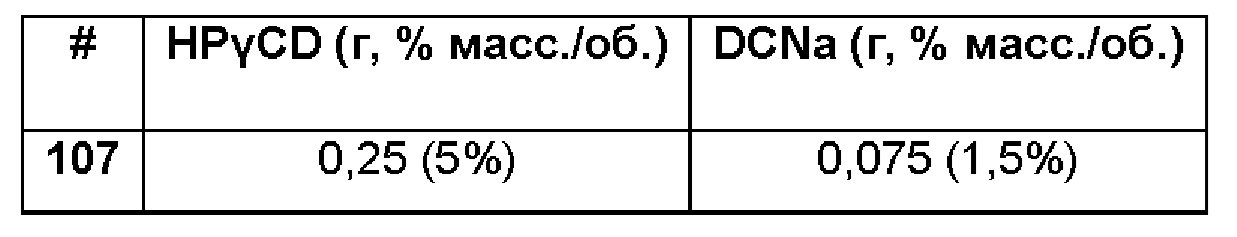
Пример 107. Сравнительный пример водной композиции натриевой соли диклофенака (DCNa, 1,5%), включенного в гидроксипропил-гамма-циклодекстрин (HPγCD, 5%) без полимерной матрицы.
Состав Примера 107 был получен в соответствии с процедурой, указанной в Примере 85, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.
Примеры 108-110
Водная композиция пироксикама (PYR, 0,05%), включенного в различные циклодекстрины (5%) в матрице из гиалуроновой кислоты и хитлака 0,75% и 0,5%, соответственно.
Составы Примеров 108-110 были получены в соответствии с процедурой, указанной в Примере 1, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.
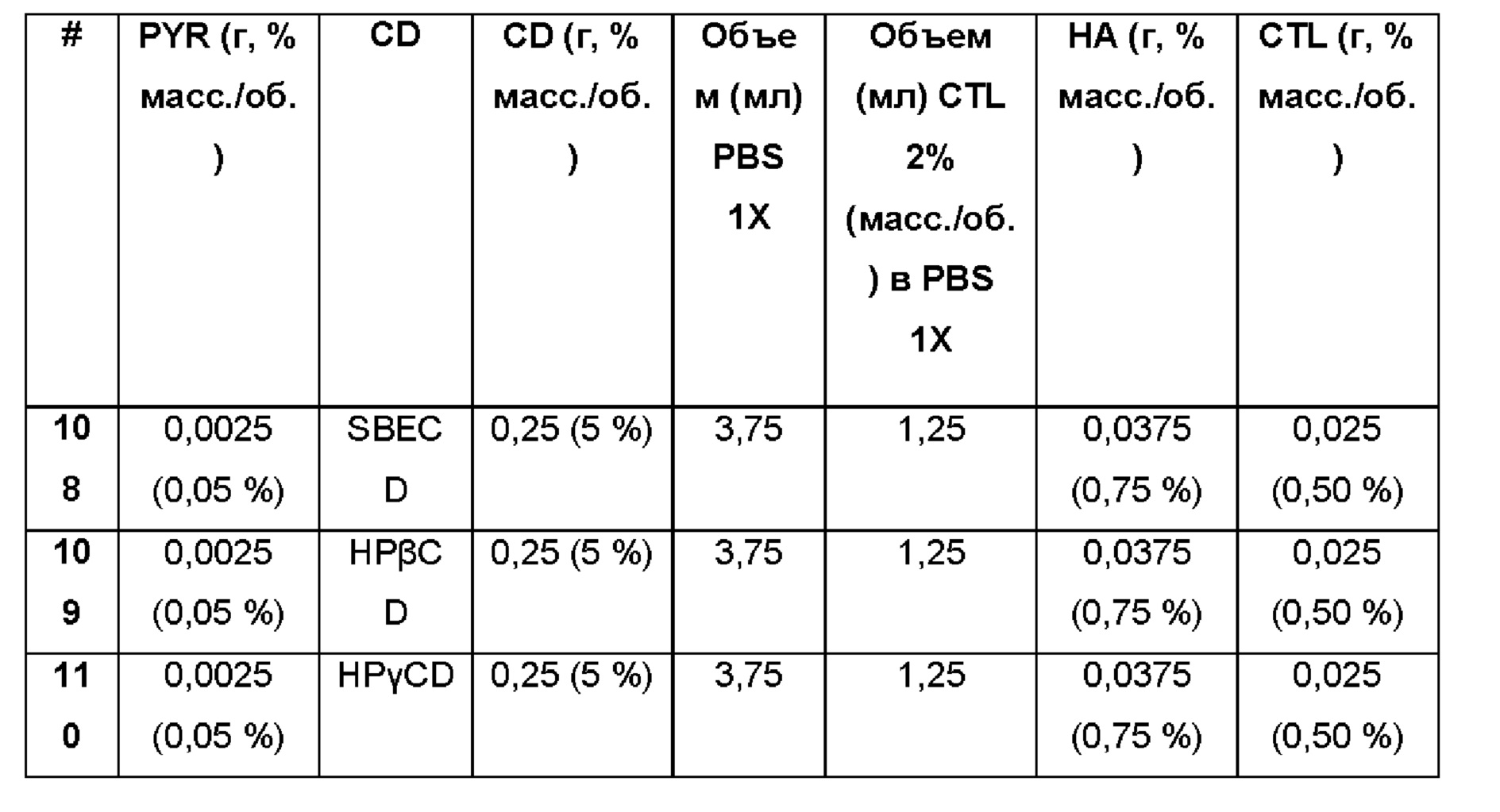
Примеры 111-113
Водная композиция кеторолака (KET, 0,25%), включенного в различные циклодекстрины (5%) в матрице из гиалуроновой кислоты и хитлака 0,75% и 0,5%, соответственно.
Составы Примеров 111-113 были получены в соответствии с процедурой, указанной в Примере 1, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.

Примеры 114-116
Сравнительные примеры водной композиции пироксикама (PYR, 0,05%), включенного в различные циклодекстрины (5%) в матрице из гиалуроновой кислоты 0,75%.
Составы Примеров 114-117 были получены в соответствии с процедурой, указанной в Примере 61, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.
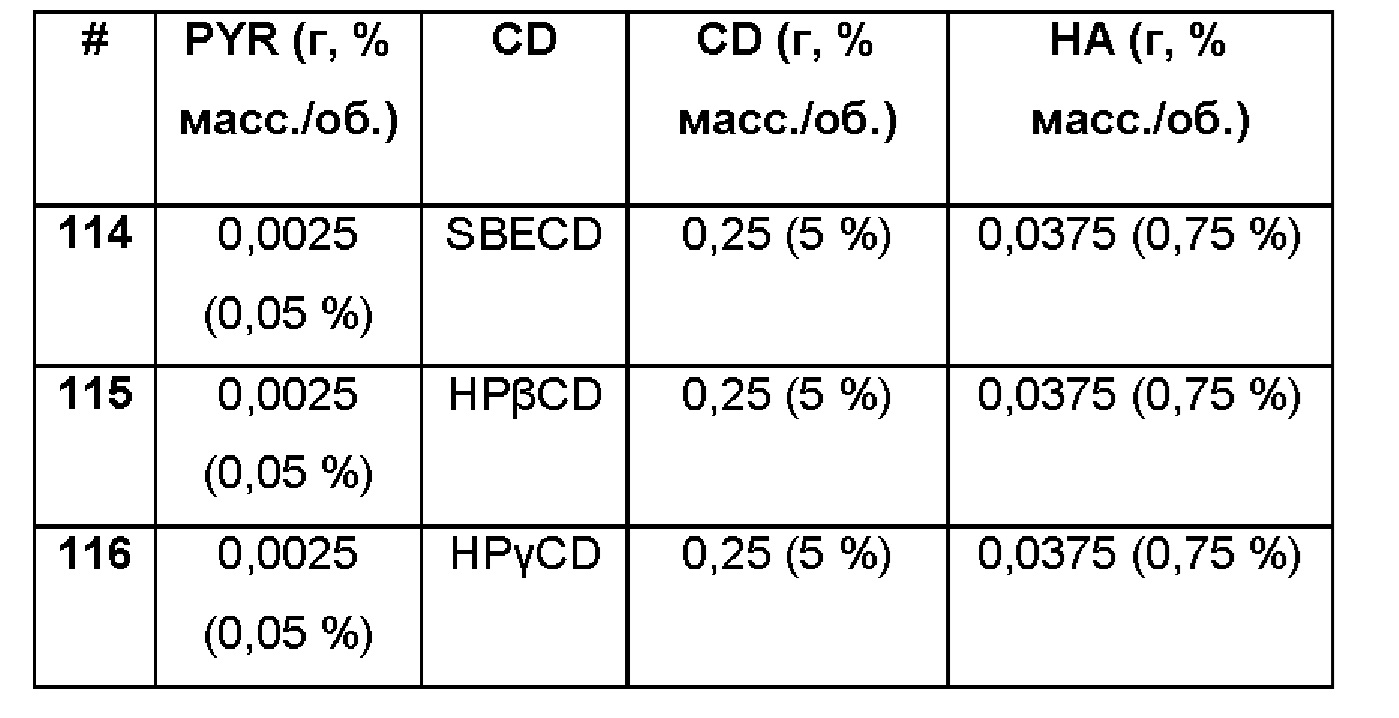
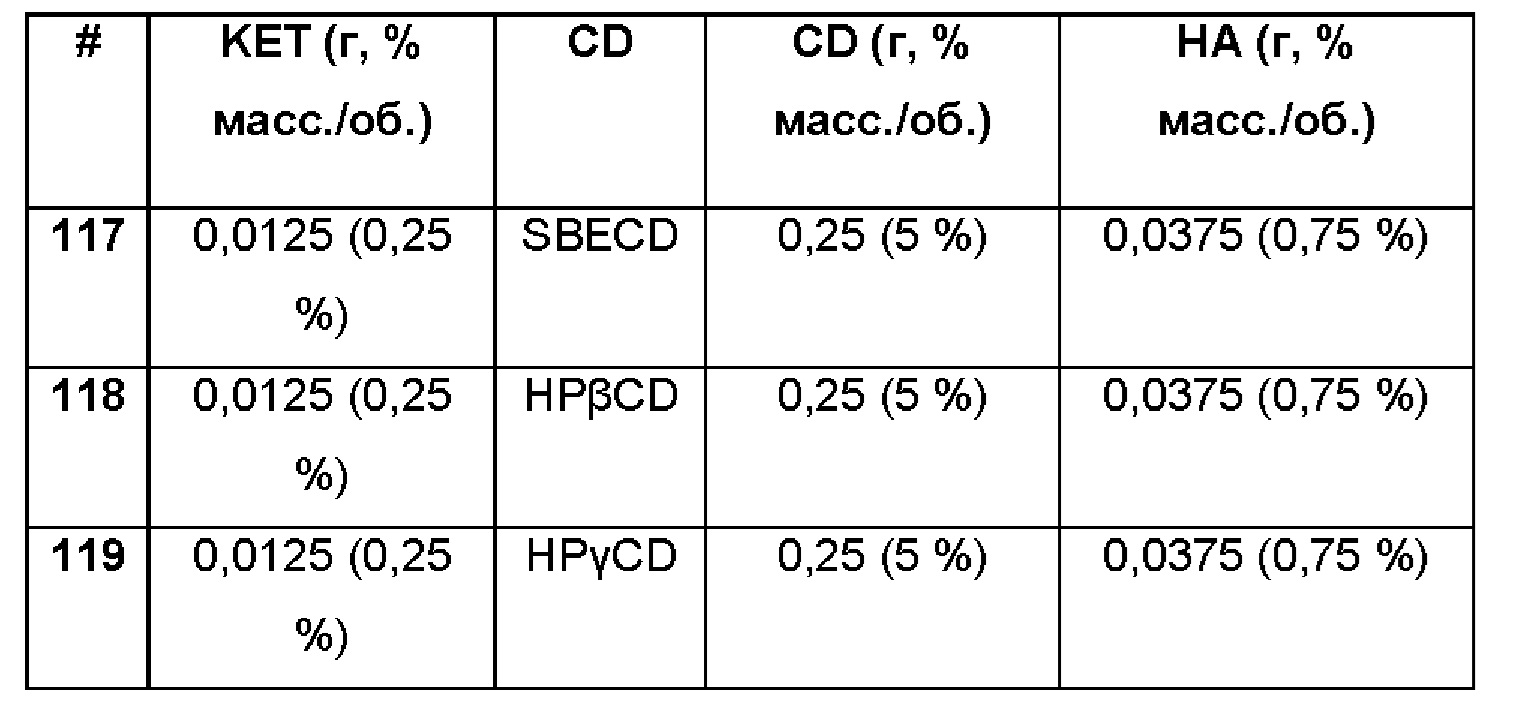
Примеры 117-119
Сравнительные примеры водной композиции кеторолака (KET, 0,25%), включенного в различные циклодекстрины (5%) в матрице из гиалуроновой кислоты 0,75%.
Составы Примеров 117-119 были получены в соответствии с процедурой, указанной в Примере 61, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.
Примеры 120-122
Сравнительные примеры водной композиции пироксикама (PYR, 0,05%), включенного в различные циклодекстрины (5%) без полимерной матрицы. Составы Примеров 120-122 были получены в соответствии с процедурой, указанной в Примере 85, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.

Примеры 123-125
Сравнительные примеры водной композиции кеторолака (KET, 0,25%), включенного в различные циклодекстрины (5%) без полимерной матрицы.
Составы Примеров 123-125 были получены в соответствии с процедурой, указанной в Примере 85, и с использованием количеств, указанных в приведенной ниже таблице. Значение рН раствора составляло 7,4.
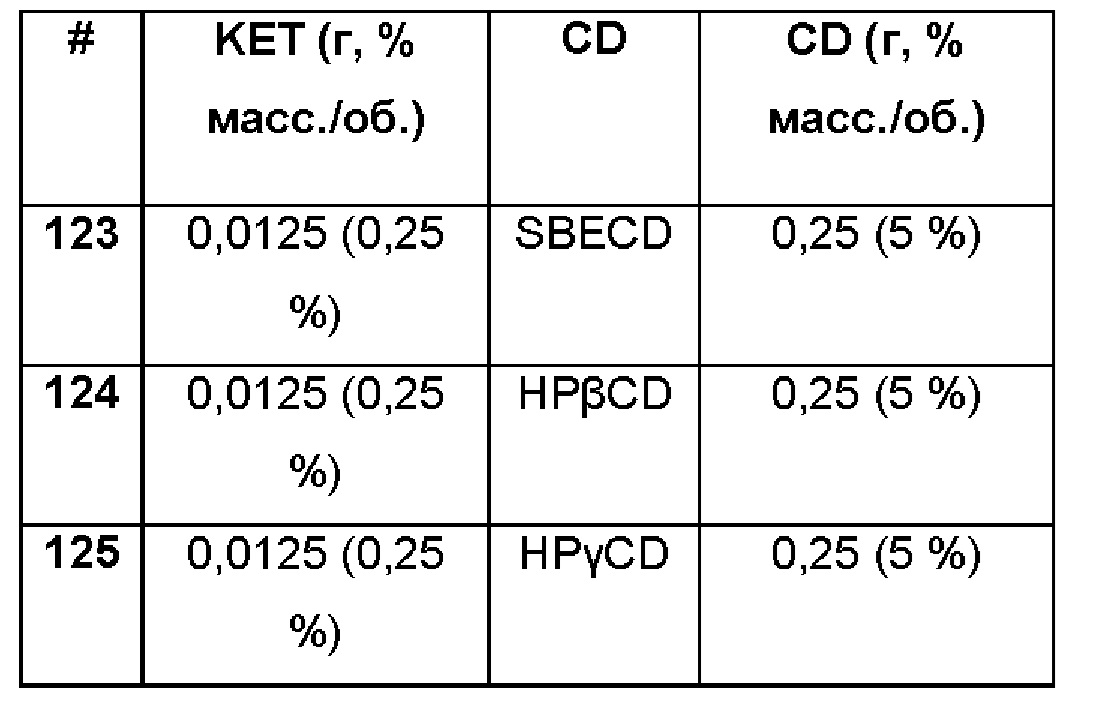
Композиции, полученные в соответствии с Примерами 1-125, были испытаны на:
влияние полисахаридной полимерной матрицы на солюбилизацию активного ингредиента, включенного в циклодекстрин; влияние дополнительных компонентов на солюбилизацию активного ингредиента, включенного в циклодекстрин; влияние полисахаридной полимерной матрицы на кинетику высвобождения активного ингредиента. Пример 126. Влияние полисахаридной полимерной матрицы на солюбилизирующую способность различных циклодекстринов с нерастворимыми в воде активными ингредиентами: триамцинолона ацетонидом (ТА) и триамцинолона гексацетонидом (ТНА). В таблице 1 приведены выбранные данные по растворимости триамцинолона в присутствии полисахаридных компонентов и циклодекстринов (а = процентное значение на основе системы API@CD без полимеров, рассчитанное как 100*(API@CD@POLY/API@CD).


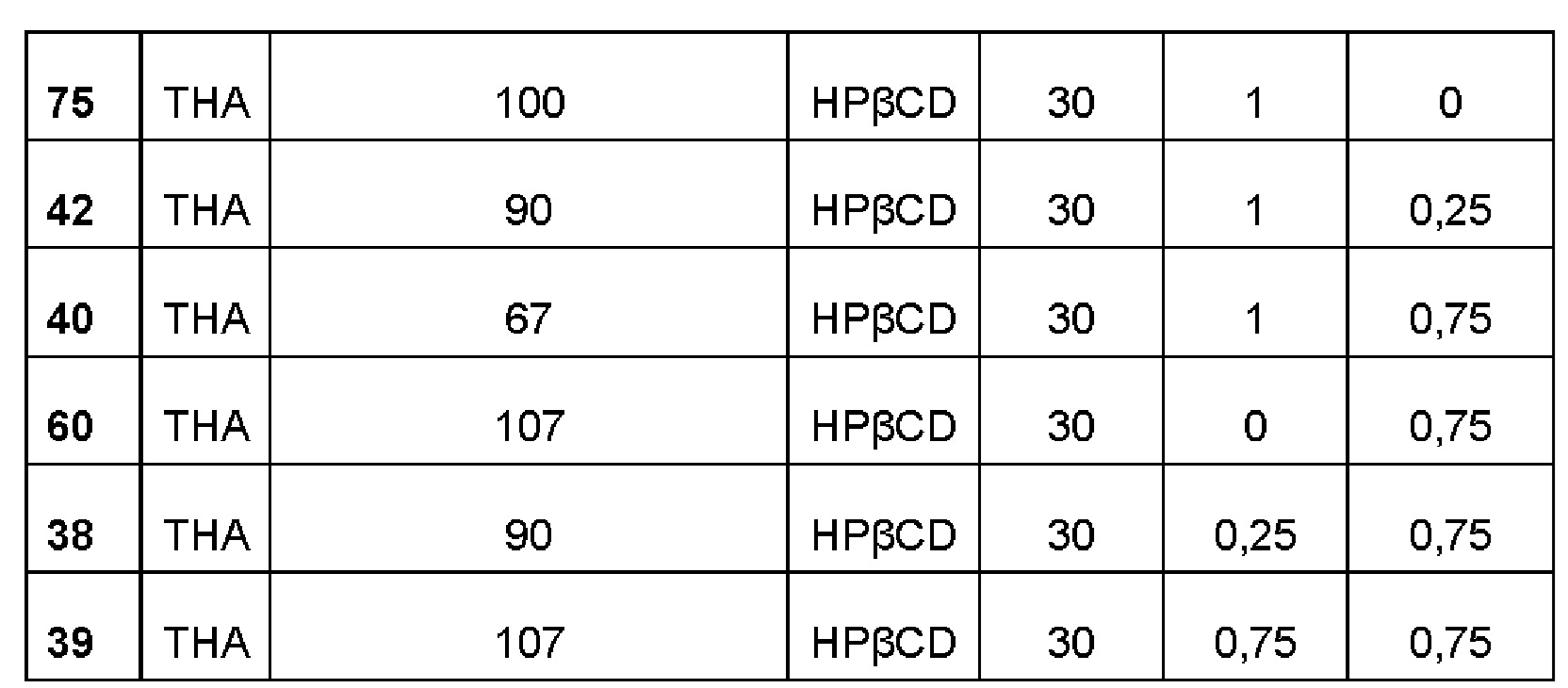
Как видно из приведенных выше результатов, изменения растворимости активного ингредиента наблюдались для композиции на основе циклодекстрина и гиалуроновой кислоты. То же самое можно наблюдать, когда в систему циклодекстрин-активный ингредиент добавляют либо хитлак, либо хитлак и гиалуроновую кислоту.
Пример 127. Влияние циклодекстрина SBECD с триамцинолона ацетонидом (ТА) в сочетании с полисорбатами, полиэтиленгликолем и полоксамерами на солюбилизирующую способность.
В целях сравнения было исследовано влияние других вспомогательных веществ, обычно используемых в фармацевтических композициях, таких как полисорбаты, полиэтиленгликоль и полоксамеры, на растворимость активного ингредиента в циклодекстрине. Композиции получали, как описано в примерах.
В большинстве случаев никаких изменений не наблюдалось (Таблица 2), в других случаях были небольшие изменения и, в любом случае, всегда положительные изменения с увеличением растворимости комплекса включения, что, следовательно, подтверждает, что данные вспомогательные вещества могут использоваться без каких-либо исключений.

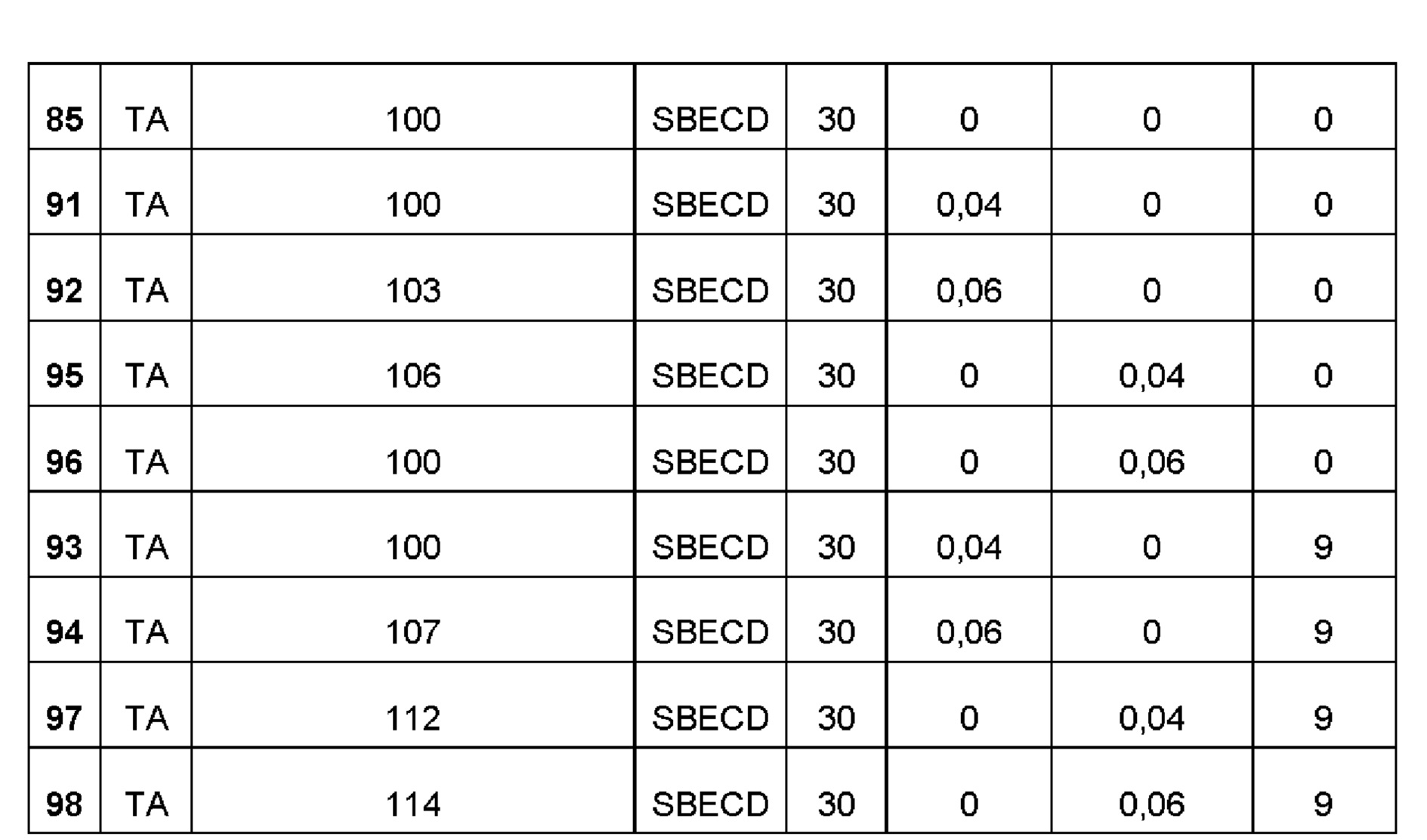
(а = процентное значение на основе системы API@CU без полимеров, рассчитанное как 100*(API@CD@ECCIP/API@CD). Пример 128. Кинетика высвобождения триамцинолона ацетонида (ТА), триамцинолона гексацетонида (ТНА) и диклофенака, пироксикама и кеторолака, включенных в циклодекстрины SBECD, HPβCD и HPγCD, из полисахаридной полимерной матрицы, образованной гиалуроновой кислотой (НА) и хитлаком (CTL).
0,500 г композиции переносили в лунку (мини-диализное устройство Slide-A-Lyzer, 10k-MWCO, код продукта: 69570, Thermo Fisher Scientific), снабженную диализной мембраной на дне (отсечка 10 кДа), предварительно обработанную деионизированной водой в течение 30 минут.Затем лунку герметизировали и погружали в 5 мл фосфатно-солевого буфера (PBS1X: NaCl 137 мМ, KCl 2,7 мМ, Na2HPO4 8,1 мМ, NaH2PO4 1,76 мМ) с добавлением 2,5 мг полисорбата 20 (0,05%). После требуемого количества времени концентрацию активного ингредиента, оставшегося в лунке, количественно определяли с помощью УФ-визуализации.
Результаты, полученные через 24 часа, показаны в приведенной ниже таблице 3, и на фигуре 1 в качестве примера показан типичный профиль высвобождения рассматриваемых систем.
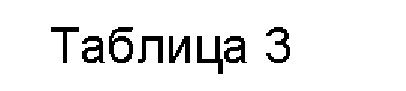

Анализ данных, приведенных в Таблице 3, показывает, что высвобождение активного ингредиента становится все более быстрым, когда в системе отсутствует полисахаридная матрица, указанное введение в систему одного полимерного компонента, такого как гиалуроновая кислота, позволяет замедлить скорость высвобождения, и дальнейшее замедление высвобождения активного ингредиента происходит, когда в полисахаридной матрице присутствует хитлак.
В заключение следует отметить, что вид циклодекстрина, выбранный в конкретной композиции, позволяет регулировать степень высвобождения, и, точнее, было отмечено, что SBECD позволяет достигать более высоких значений высвобождения, быстрее, чем HPBCD, с точки зрения общего количества высвобожденного API.
Пример 129
Сравнительные примеры процентного высвобождения в течение 24 часов триамцинолона ацетонида (ТА), триамцинолона гексацетонида (ТНА) диклофенака, пироксикама и кеторолака, включенного в циклодекстрины SBECD, HPβCD и HPγCD, из полисахаридной полимерной матрицы, образованной гиалуроновой кислотой (НА) и хитлаком (СТ), нормализованного по процентному высвобождению в течение 24 часов триамцинолона ацетонида (ТА), триамцинолона гексацетонида (ТНА), диклофенака, пироксикама и кеторолака, включенных в циклодекстрины SBECD, HPβCD и HPγCD без полимерной матрицы.
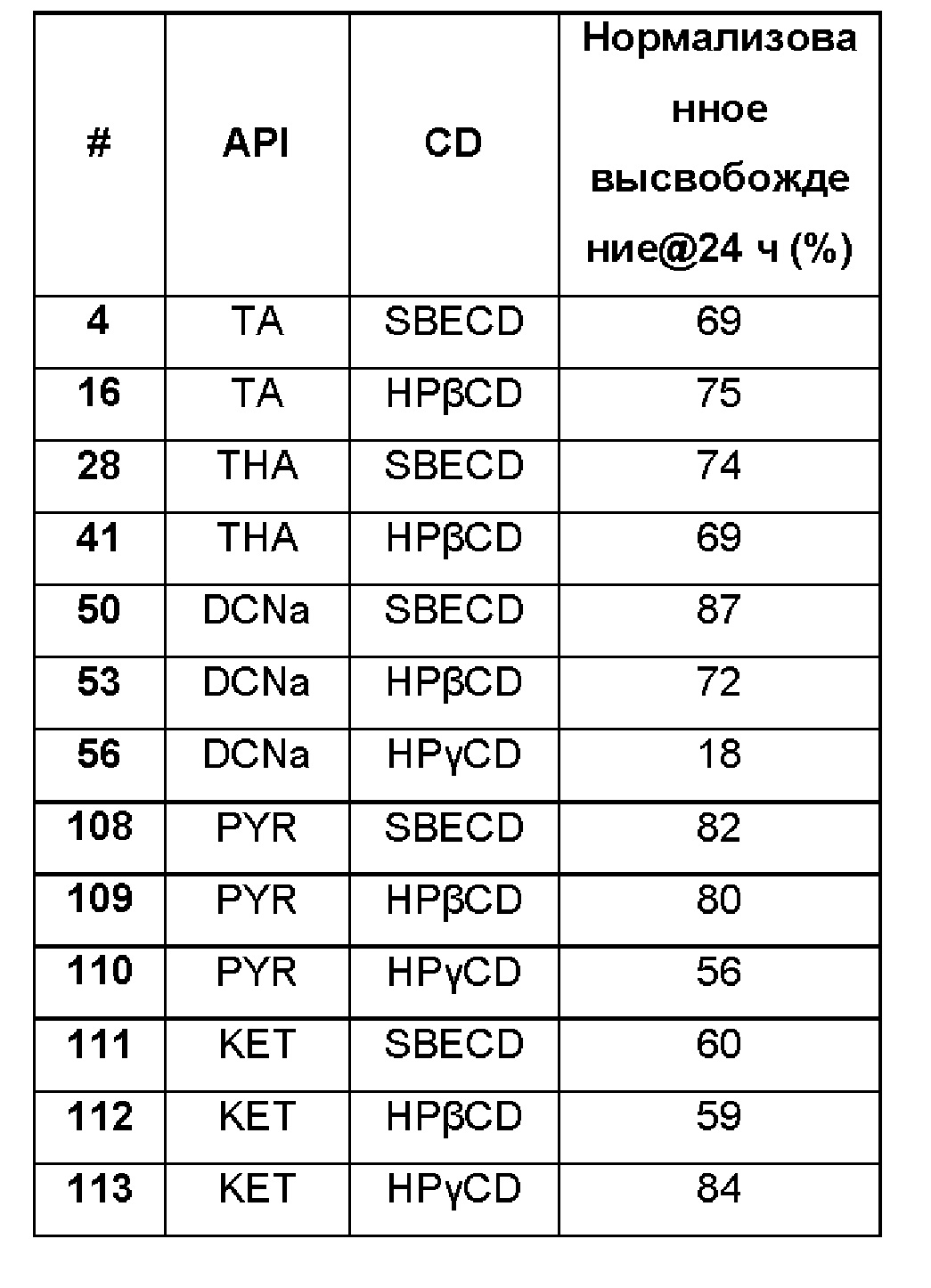
Реферат
Настоящее изобретение относится к области медицины, а именно к композиции для локорегионарного лечения заболевания костно-мышечной системы, характеризующегося острым или хроническим воспалительным состоянием, содержащей клатрат циклодекстрина и фармакологически активного ингредиента, где клатрат циклодекстрина и фармакологически активного ингредиента однородно диспергирован в полисахаридной полимерной матрице в водном растворе, образованной гиалуроновой кислотой и/или ее солью и олигосахаридным производным хитозана с лактозой, полученным путем реакции восстановительного аминирования D-глюкозамина хитозана, имеющим степень замещения функциональной группы амина лактозой по меньшей мере 40%, где указанный циклодекстрин представляет собой эфирное производное β-циклодекстрина, γ-циклодекстрина или их смесей, и где указанная соль гиалуроновой кислоты представляет собой фармацевтически приемлемую соль, состоящую из гиалуроната и катиона щелочного металла. Настоящее изобретение обеспечивает получение композиций, способных полностью и равномерно солюбилизировать фармакологически активный ингредиент (API) в несшитой водной полисахаридной полимерной матрице и модулировать высвобождение API из матрицы. 15 з.п. ф-лы, 3 табл., 129 пр., 1 ил.

Комментарии