Анти-cd40-антитела, применение и методы - RU2649055C2
Код документа: RU2649055C2
Чертежи




































Описание
Область техники
Настоящее изобретение имеет отношение к полипептидам на основе антител, которые специфически связываются с CD40, демонстрируют улучшенную аффинность и/или агонистическую активность, и которые полезны при лечении таких болезней, как рак. Изобретение также имеет отношение к фармацевтическим композициям, способам применения и наборам, содержащим такие антитела.
Введение
Рак является причиной более 30% случаев смерти в развитых странах. В то время как колоссальные успехи достигнуты при лечении отдельных опухолей (болезнь Ходжкина, некоторые лимфомы/лейкозы, локализованный рак кожи), обычные способы лечения, такие как хирургическое вмешательство, химиотерапия и радиотерапия, часто являются неэффективными при лечении диссеминированных солидных опухолей.
Иммунотерапия (синоним биологической терапии) рака считается очень перспективной для лечения определенных типов рака, включая диссеминированные метастатические опухоли (Stagg et al., 2007, Immunol Rev. 220:82-101; Melief, 2008, Immunity, 29:372-383, Melero et al., 2007, Nat Rev Cancer, 7:95-106; Waldmann, 2006, Annu. Rev Med. 57:65-81; Khawli et al., 2008, Handb. Exp. Pharmacol. 181:291-328; Berinstein, 2007, Vaccine, 25 Suppl 2: B72-B88; Mellor & Munn, 2008, Nat Rev Immunol. 8:74-80). Иммунотерапия стремится привлекать к борьбе с раком собственную иммунную систему пациента и вызывает долгосрочное уничтожение опухолевых клеток.
Разработано несколько различных подходов к иммунотерапии рака, включая следующие:
(1) Лечение моноклональными антителами (Mab) может использоваться для: i) нацеливания на раковые клетки с целью их уничтожения, при этом могут использоваться либо «голые» антитела или конъюгированные с токсином (например, ритуксимаб), и/или ii) блокирования рецепторов фактора роста (например, герцептин), и/или iii) стимулирования иммунной системы.
(2) Противораковые вакцины, включающие вакцины на основе опухолевых клеток (аутогенные или аллогенные), антигенные вакцины и вакцины на основе дендритных клеток (DC), ДНК-вакцины и вакцины на основе векторов (например, перенос гена на основе аденовируса).
(3) Неспецифическая иммунотерапия и адьюванты, действующие путем более широкого стимулирования иммунной системы, и таким образом активирующие опухолеспецифические иммунные клетки, которые подавляются опухолевой средой. Это может осуществляться путем стимулирования или активации иммунных эффекторных клеток, обеспечивающих иммунную реакцию на опухоль (например, эффекторные Т-клетки, или Teff клетки), или путем ингибирования или инактивирования клеток с ингибирующим фенотипом (например, регуляторные Т клетки или Treg клетки). Подобный подход включает активные молекулы, такие как цитокины, бактериальные адьюванты, а также лекарственные средства (включая mAb), которые нацелены на иммунорегуляторные рецепторы (например, CTLA-4 и CD40). Дополнительные подходы включают адоптивный Т-клеточный перенос и терапию Treg-истощения, которые находятся где-то между двумя последними группами.
CD40 представляет собой гликопротеин, экспрессированный на клеточной поверхности, который относится к суперсемейству рецепторов фактора некроза опухоли (TNFR) и играет центральную роль в иммунной системе. Он экспрессируется целым рядом иммунных клеток, таких как В-клетки, дендритные клетки, моноциты и макрофаги. Профессиональные антигенпрезентирующие клетки (АРС) активируются, когда происходит передача сигнала через CD40 (смотри обзор в Schonbeck и Libby, 2001, Cell Mol Life Sci, 58(1): 4-43).
Природный лиганд CD40, обозначаемый CD 154 или CD40L, в основном экспрессируется на зрелых Т-лимфоцитах (Armitage et al., 1992, Nature, 357: 80-82; Schonbeck et al., 2001, Cell Mol Life Sci., 58,40-43; van Kooten et al., 2000, J. Leuk. Biol., 67: 2-17; Quezada et al., 2004, Annu. Rev. Immunol., 22:3077-328). CD40L-опосредованное проведение сигнала запускает некоторые биологические события, включая активацию иммунных клеток, пролиферацию и выработку цитокинов и хемокинов (Schonbeck et al., 2001, Cell Mol Life Sci., 58:40-43; van Kooten et al., 2000, J. Leuk., Biol., 67: 2-17).
CD40-передача сигнала имеет решающее значение для Т-клеточно-зависимого и В-клеточно-зависимого иммунных ответов, причем у пациентов с нефункциональным CD40 или CD40L заметно подавлен иммунитет (Foy et al., 1993, J Exp Med 5:1567-1575; Siepmann et al., 2001, Immunology 3:263-272; Allen et al., 1993, Science, 259:990-993). Стимулирование антигенпрезентирующих клеток, таких как человеческие В-клетки и дендритные клетки, рекомбинантным CD40L или анти-CD40-антителами вызывает стимулирование поверхностных маркеров, таких как CD23, CD80, CD86, Fas и МНС II, и секрецию растворимых цитокинов, например, IL-12, TNF-γ и TNF-α (van Kooten et al., 2000, J Leucoc Biol, 67:2-17; Schonbeck et al., 2001, выше). В опухолевой обстановке стимулированные CD40 дендритные клетки могут активировать опухолеспецифические эффекторные Т-клетки, которые обладают способностью уничтожать опухолевые клетки ((van Kooten et al., 2000, J Leucoc Biol,67:2-17; Sotomayor et al., 1999, Nature Medicine, 5:780-787).
Экспрессия CD40 наблюдается во многих нормальных и опухолевых клетках. Например, во всех В-лимфомах и в 30% - 70% солидных опухолей наблюдается экспрессия CD40. Меланомы и карциномы также относятся к опухолям с экспрессией CD40. Установлено, что активация CD40 является эффективной при инициировании противоопухолевых ответов (Tong et al., 2003, Cancer Gene Therapy, 10(1): 1-13; Ottalano et al., 2002, Tumori, 88 (5):361-6). Эффект CD40-активации, способствующий замедлению роста опухоли, вовлекает, по меньшей мере, механизмы иммунной активации, вызывающие опухолеспецифический Т-клеточный ответ, прямой апоптотический эффект на CD40-положительные опухоли и стимулирование гуморального ответа, приводящее к ADCC. Противоопухолевый эффект CD40-активации также был показан на CD40-отрицательных опухолях (Tutt et al., 2002, J Immunol., 168 (6):2720-8; van Mierlo et al., 2002, Proc Nati Acad Sci, USA, 99(8):5561-6). В данном случае наблюдаемое уничтожение опухоли было строго связано с возникновением CTL, опухолеспецифических цитотоксических Т-лимфоцитов.
Были предложены адьюванты для противораковых вакцин, характеризующиеся стимуляцией CD40. Была проведена доклиническая экспериментальная проверка концепции агонистических CD40-антител в отношении некоторых форм рака (Kalbashi et al., 2010, J Immunotherapy, 33:810-816; Loskog et al., 2009, Semin Immunology, 21:301-307; French et al., 1999, Nature Medicine, 548-553; Sotomayor et al., 1999, Nature Medicine, 5:780-787; Staveley et al., 2003, Nature Medicine, 171:697-707). Также были проведены клинические испытания для агонистических CD40-антител, включая SGN-40 (гуманизированное антитело, имеющее ограниченные и слабые агонистические свойства) и СР-870,893 (полностью человеческое и селективное CD40 агонистическое моноклональное антитело) (Khalil и Vonderheide, 2007, Update on Cancer Therapeutics, 2:61-65; Hussein et al., 2010, Haematologica, 95:845-848).
В то же время системное введение CD40-антител связано с вредными побочными действиями, такими как шок и синдром высвобождения цитокинов (van Mierlo et al., 2002, Proc. Natl. Acad. Sci. USA, 99:5561-5566; van Mierlo et al., 2004, J Immunol 173:6753-6759).
В свете вышеизложенного, имеется необходимость в усовершенствованных методах лечения опухолей, в частности в анти-CD40-агонистических антителах, пригодных для применения в клинике.
Раскрытие изобретения
В первом аспекте изобретение предоставляет антитело или его антигенсвязывающий фрагмент с мультиспецифическим связыванием с CD40, или вариант, гибрид или производное указанного антитела, или антигенсвязывающего фрагмента, или гибрид указанного варианта или производного, который сохраняет мультиспецифическое связывание с CD40, при этом эффективность антитела, антигенсвязывающего фрагмента или его гибрида, варианта или производного в активации дендритных клеток является более высокой, или равной, его эффективности в активации В-клеток, и при этом антитело, антигенсвязывающий фрагмент или гибрид, вариант или его производное обладает аффинностью (KD) в отношении CD40 менее чем 1×10-10M (m.e. 0,1 нМ).
Альтернативно или в дополнение к этому, первый аспект изобретения предоставляет антитело или его антигенсвязывающий фрагмент с мультиспецифическим связыванием с CD40, или вариант, гибрид или производное указанного антитела или антигенсвязывающего фрагмента, или гибрид указанного варианта или производного, который сохраняет мультиспецифическое связывание с CD40, при этом антитело, антигенсвязывающий фрагмент или гибрид, вариант или его производное способно оказывать двойные цитотоксические эффекты на CD40+-опухолевые клетки (предпочтительно in vivo). При помощи термина "двойные цитотоксические эффекты" мы включаем прямое апоптотическое действие на опухолевые клетки и непрямой опосредованный иммунными клетками цитотоксический (например, ADCC) эффект на опухолевые клетки.
Термин эффективность" в отношении активации дендритных клеток и активирования В-клеток, мы подразумеваем значение ЕС50, необходимое для такой клеточной активации посредством антитела, антигенсвязывающего фрагмента или его гибрида, варианта или производного. Специалистам ясно, что эффективность в активации дендритных клеток и активации В-клеток может быть измерена с помощью различных методов, включая, но не ограничиваясь этим, методы, описанные в Примерах ниже.
В одном варианте осуществления активация дендритных клеток определяется, исходя из значения ЕС50, необходимого для стимулирования экспрессии CD80, измеренной с помощью FACS-анализа (такого как в Примере 4), а активация В-клеток определяется, исходя из значения ЕС50, необходимого для пролиферации В-клеток (такого как в Примере 6).
Известно, что анти-CD40 антитело, разработанное Pfizer, CP-870,893, обладает приблизительно в 20 раз более высокой эффективностью в активации В-клеток, чем эффективностью в активации дендритных клеток (Gladue et al., 2011, Cancer Immunol Immunotherapy (7), 1009-1017). Кроме того, было показано, что одним из основных фармакодинамических эффектов после воздействия СР-870,893 является быстрое уменьшение процентного содержания В-клеток в числе лимфоцитов периферической крови (Vonderheide et al., 2007, Journal of Clinical Oncology 25, 7, 876-883). Действие на В-клетки может приводить к ограничивающей дозу токсичности при лечебной дозе, которая является недостаточной для активирования дендритных клеток. Настоящие изобретатели полагают, что активация дендритных клеток имеет большее клиническое значение, чем активация В-клеток. Терапия рака агонистом CD40 плотно связана с активацией Т-клеток (French et al., 1999, Nature Medicine, 548-553; van Kooten et al., 2000, J Leucoc Biol,67:2-17; Sotomayor et al., 1999, Nature Medicine, 5:780-787), причем такая активация Т-клеток зависит от активации профессиональных антигенпрезентирующих клеток, в частности дендритных клеток (Melief et al., 2000, 75: 235-282).
Настоящие изобретатели разработали клоны агонистических анти-CD40-антител, обладающие улучшенной способностью активации дендритных клеток.
В одном варианте осуществления антитела изобретения, антигенсвязывающие фрагменты, варианты, гибриды и их производные обладают эффективностью в активации дендритных клеток, которая больше или равна их эффективности в активации В-клеток. Или, другими словами, антитела изобретения, антигенсвязывающие фрагменты, варианты, гибриды и их производные обладают эффективностью в активации В-клеток, которая меньше чем или равна эффективности в активации ими дендритных клеток.
Термин "специфичность связывания" включает способность антитела изобретения, антигенсвязывающего фрагмента, варианта, гибрида или его производного связываться, по меньшей мере, в 10 раз сильнее с CD40, чем с любым другим полипептидом; предпочтительно, по меньшей мере, в 50 раз сильнее и более предпочтительно, по меньшей мере, в 100 раз сильнее. Предпочтительно, антитело изобретения, антигенсвязывающий фрагмент, вариант, гибрид или его производное селективно связывается с CD40 при физиологических условиях (например, in vivo; и например, когда CD40 присутствует на клеточной поверхности).
Термин "мультиспецифическое" подразумевает, что антитело изобретения, антигенсвязывающий фрагмент, вариант, гибрид или его производное содержит два или более антигенсвязывающих участков со специфичностью связывания с CD40. Например, антитело может содержать два или три, или четыре, или пять, или шесть, или более таких антигенсвязывающих участков. В одном варианте осуществления антитело является интактным, двухвалентным IgG антителом.
CD40 представляет собой гликопротеин, экспрессированный на клеточной поверхности, который относится к суперсемейству рецепторов фактора некроза опухоли (TNFR) и играет центральную роль в иммунной системе. Он экспрессируется целым рядом иммунных клеток, таких как В-клетки, дендритные клетки, моноциты и макрофаги, при этом профессиональные АРС активируются, когда происходит передача сигнала через CD40 (смотри Tasci et al., 2001, Cell. Mol. Life ScL, (58), 4-43). Экспрессия CD40 наблюдается во многих нормальных и опухолевых клетках, таких как клетки В-лимфомы, солидных опухолей, меланомы и карциномы. Точно установлено, что активация CD40 является эффективной при инициировании противоопухолевых ответов, и активация CD40 способствует замедлению роста опухолей, по меньшей мере, при помощи механизмов иммунной активации, прямого апоптотического действия на CD40-положительные опухоли и гуморального ответа, приводящего к ADCC и CDC.
Возникновение ADCC и CDC зависит от взаимодействия иммунной системы хозяина с Fc-фрагментом антитела, который определяется константным доменом тяжелой цепи. Из числа природных константных доменов гамма-1 представляет собой изотип, который наиболее эффективно вызывает ADCC и CDC (Janeway's Immunobiology, 2008, 7th edition. Garland Science). В соответствии с этим, предпочтительным Fc для антител изобретения является гамма-1 Fc, который и относит анти-CD40 антитело к IgG1 изотипу. Кроме того, можно дополнительно увеличить эти эффекты, используя целый ряд известных методов, таких как Fc-инженерия (точечные мутации) и модификации гликанов (смотри Carter, Nature Reviews Immunology, 2006 (6), 343-357).
Механизм, с помощью которого антитела активируют CD40 на дендритных клетках и В-клетках, зависит и от эпитопа на CD40, с которым происходит связывание, и от мультимеризации рецепторов. Димеризация рецептора CD40 при помощи типичного двухвалентного антитела (IgG1) изобретения полезна для его агонистического действия.
Термин "CD40" включает какой-либо природный или синтетический белок со структурной и/или функциональной идентичностью с человеческим белком CD40, как определено в описании, и/или его природными вариантами.
Предпочтительно, CD40 представляет собой человеческий CD40, такой как с №доступа в UniProt P25942 и №доступа в GenBank AAH12419.
Однако, специалистам ясно, что CD40 может происходить от любого млекопитающего, такого как одомашненное млекопитающее (предпочтительно сельскохозяйственного или промышленного значения, включая лошадь, свинью, корову, овцу, собаку или кошку). Термин "белок млекопитающего" включает любой белок, обнаруженный в, полученный из и/или выделенный из одной или более клеток млекопитающего; например, термин "человеческий белок" включает белок, найденный в, полученный из и/или выделенный из одной или более клеток человека.
Как отмечалось выше, антитела изобретения, антигенсвязывающие фрагменты, варианты, гибриды и их производные способны активировать В-клетки и дендритные клетки.
Профессиональные АРС, такие как дендритные клетки, активируются, когда происходит передача сигнала через CD40, который инициирует некоторые биологические события, включая активацию иммунных клеток, пролиферацию и выработку цитокинов и хемокинов. Методы определения активации дендритных клеток, связанной с CD40, известны в данной области техники (обсуждаются, например, в Schonbeck et al., 2001, Cell Mol Life Sci., 58:40-43; van Kooten et al., 2000, J. Leuk, Biol., 67: 2-17) и описаны в сопровождающих Примерах.
Стимулирование человеческих В-клеток рекомбинантным CD40L или анти-CD40-антителами вызывает повышающую регуляцию маркеров клеточной поверхности, таких как CD23, CD30, CD80, CD86, Fas и МНС II, секрецию растворимых цитокинов, например, IL-6, TNF-γ и TNF-α, и гомеотипическую агрегацию. Методы определения В-клеточной активации, связанной с CD40, известны в данной области техники (обсуждаются, например, в Schonbeck et al; 2001, supra) и описаны в сопровождающих Примерах.
Антитела изобретения, антигенсвязывающие фрагменты, варианты, гибриды и их производные были оптимизированы, чтобы обеспечить усовершенствованную эффективность в активации дендритных клеток. В одном варианте осуществления возможность активация дендритных клеток селективно увеличивается относительно эффективности в активации В-клеток.
Методы и способы анализа для определения эффективности антитела в отношении активации дендритных клеток и В-клеток хорошо известны в данной области техники.
Например, активация дендритных клеток может быть оценена путем измерения повышенного количества маркеров клеточной поверхности, таких как CD86 и CD80 (смотри Пример 3) и/или путем измерения индуцированной анти-CD40-антителом секреции IFNγ из Т-клеток (смотри Пример 4 ниже).
Аналогично, активация В-клеток может быть оценена путем измерения повышенного количества маркеров клеточной поверхности (таких как CD86; смотри Gladue et al., 2011, выше) и/или путем измерения индуцированной анти-CD40-антителом пролиферации В-клеток (смотри Пример 6, ниже).
Антитела изобретения, антигенсвязывающие фрагменты, варианты, гибриды и их производные активируют дендритные клетки, по меньшей мере, так же эффективно, как они активируют В-клетки (что устанавливается, например, путем измерения экспрессии CD80 и/или CD86). Таким образом, антитела изобретения, антигенсвязывающие фрагменты, варианты, гибриды и их производные могут обладать в два раза большей эффективностью в активации дендритных клеток по сравнению с В-клетками, например, по меньшей мере, в три раза, в четыре раза, в пять раз, в шесть раз, в семь раз, в восемь раз, в девять раз, в десять раз или более повышенной эффективностью в активации дендритных клеток.
Термин "антитело" включает в основном интактные молекулы антител, а также химерные антитела, гуманизированные антитела, человеческие антитела (в которых, по меньшей мере, одна аминокислота видоизменена относительно природного человеческого антитела), одноцепочечные антитела, биспецифические антитела, тяжелые цепи антитела, легкие цепи антитела, гомодимеры и гетеродимеры тяжелых и/или легких цепей антитела, антигенсвязывающие фрагменты и их производные. Термин также включает антитело-подобные молекулы, которые можно получить при помощи методов фагового дисплея или других методов случайного отбора молекул. Термин также включает все классы антител, включая IgG, IgA, IgM, IgD и IgE.
Как указано в дальнейшем, в изобретение также включаются фрагменты антител, такие как Fab, F(ab')2, Fv и другие фрагменты, которые сохраняют антигенсвязывающий участок. Подобным образом термин "антитело" включает генно-инженерные производные антител, такие как одноцепочечные Fv-молекулы (scFv) и однодоменные антитела (dAb). Такие фрагменты и производные могут быть сделаны мультивалентными для CD40 путем мультимеризации, например, scFv-scFV или dAb-dAb димеры.
Вариабельные домены тяжелой цепи (VH) и легкой цепи (VL) антитела участвуют в распознавании антигена, факт, впервые установленный с помощью первых экспериментов с протеазным расщеплением. Новое подтверждение было получено при "гуманизации" антител грызунов. Вариабельные домены грызунов могут быть соединены с константными доменами человеческого происхождения, при этом полученное в результате антитело сохраняет антигенную специфичность антитела, происходящего от грызуна (Morrison et al (1984) Proc. Natl. Acad. Sci. USA 81, 6851-6855).
Изобретение включает варианты, гибриды и производные антител и антигенсвязывающих фрагментов изобретения, а также гибриды указанных вариантов или производных, при условии, что такие варианты, гибриды и производные обладают специфичностью связывания с CD40 и эффективностью в активации дендритных клеток, которая выше, или равна, эффективности в активации В-клеток.
Так как антитела и их антигенсвязывающие фрагменты содержат один или более полипептидных компонентов, подходящие варианты, гибриды и производные антитела и его антигенсвязывающего фрагмента, как определено в описании, могут быть получены с помощью методов белковой инженерии и сайт-направленного мутагенеза, хорошо известных в данной области, с использованием рекомбинантных полинуклеотидов (смотри, например, Molecular Cloning: a Laboratory Manual, 3rd edition, Sambrook & Russell, 2001, Cold Spring Harbor Laboratory Press, которая включается в описание путем отсылки).
Таким образом, варианты, гибриды и производные антитела или его антигенсвязывающего фрагмента, как определено выше, могут быть изготовлены на основе полипептидного компонента антитела или его антигенсвязывающего фрагмента.
Термин "гибрид" включает указанный полипептид, соединенный с любым другим полипептидом. Например, указанный полипептид может быть соединен с таким полипептидом, как глутатон-S-трансфераза (GST) или белок А, для того, чтобы облегчить очистку указанного полипептида. Примеры таких гибридов хорошо известны специалистам в данной области техники. Подобным образом, указанный полипептид может быть соединен с олиго-гистидиновой меткой, такой как His6, или с эпитопом, распознаваемым антителом, таким как хорошо известный Myc-tag эпитоп. Кроме того, в объем изобретения включаются гибриды с любым вариантом или производным указанного полипептида.
Гибрид может содержать или включать дополнительную часть (участок), которая придает указанному полипептиду желательное свойство; например, данная часть может использоваться при обнаружении или выделении полипептида, или оказывать содействие поглощению полипептида клеткой. Часть может представлять собой, например, молекулу биотина, радиоактивный фрагмент, флуоресцентный фрагмент, например, небольшой флуорофор или зеленый флуоресцентный белок (GFP), что хорошо известно специалистам в данной области техники. Фрагмент может быть иммуногенной меткой, например, Myc-tag, как известно специалистам в данной области техники, или может быть липофильной молекулой или полипептидным доменом, который способен оказывать содействие клеточному поглощению полипептида, что также хорошо известно специалистам в данной области техники.
Термин "варианты" указанного полипептида включает вставки, делеции и замены, консервативные или неконсервативные. В частности, мы включаем варианты полипептида в том случае, когда такие изменения практически не изменяют активность указанного полипептида. Варианты могут включать, например, аллельные варианты, которые будут, как правило, отличаться от данной последовательности только одним или двумя или тремя и, как правило, не более чем 10 или 20 аминокислотными остатками. В основном варианты имеют консервативные замены.
Полипептидный вариант может иметь аминокислотную последовательность, обладающую, по меньшей мере, 75% идентичностью с одной или более из аминокислотных последовательностей, приведенных выше, например, по меньшей мере, 80%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% или, по меньшей мере, 99% идентичностью с одной или более из аминокислотных последовательностей, определенных в описании.
Например, варианты полипептидов, определенные в описании, включают полипептиды, содержащие последовательность, по меньшей мере, с 60% идентичностью с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:19; SEQ ID NO:20; SEQ ID NO:21; SEQ ID NO:22; SEQ ID NO:23; SEQ ID NO:24; SEQ ID NO:25; SEQ ID NO:26; SEQ ID NO:27; и SEQ ID NO:28; SEQ ID NO:32; SEQ ID NO:33; SEQ ID NO:34; SEQ ID NO:35; SEQ ID NO:36; SEQ ID NO:37; SEQ ID NO:38 и SEQ ID NO:39; и предпочтительно, по меньшей мере, 70% или 80% или 85% или 90% идентичность с указанной последовательностью и более предпочтительно, по меньшей мере, 95%, 96%, 97%, 98% или 99% идентичность с указанной последовательностью.
Процент идентичности может быть определен, например, с помощью программы LALIGN (Huang и Miller, Adv. Appl. Math. (1991) 12:337-357) на сайте Expasy (экспертная система анализа белков) (http://www.ch.embnet.org/software/LALIGN_form.html) с использованием в качестве параметров общего выравнивания, матрицы замен BLOSUM62, штрафа за пробел в последовательности -14, штрафа за продолжение пробела -4. Альтернативно, процент идентичности последовательности между двумя полипептидами может быть определен с помощью подходящего программного обеспечения, например программы GAP Genetic Computing Group университета Висконсина, при этом понятно, что процент идентичности вычисляется относительно полипептидов, последовательности которых выровнены оптимально.
Альтернативно, выравнивание может проводиться с помощью программы Clustal W (как описано в работе Thompson et al., 1994, Nucl. Acid Res. 22:4673-4680, которая включается в описание путем отсылки). Использовались указанные ниже параметры:
Параметры быстрого попарного выравнивания: размер идентичного участка; 1, длина сегмента, включающего «наилучший выровненный сегмент»; 5, штраф за внесение пробела; 3, число непрерывно совпадающих к-плетов; 5. Метод подсчета очков: х процент.
- Параметры множественного выравнивания: штраф за внесение пробела; 10, штраф за продолжение пробела; 0.05.
- Матрица замен: BLOSUM.
Альтернативно, для определения локального выравнивания последовательностей может использоваться программа BESTFIT.
Антитело, антигенсвязывающий фрагмент, вариант, гибрид или производное изобретения может содержать или включать одну или более модифицированных аминокислот или их производных.
Химические производные одной или более аминокислот могут быть получены при взаимодействии с функциональной боковой группой. Такие образующие производные молекулы включают, например, те молекулы, в которых свободные аминогруппы образуют производные с получением амингидрохлоридов, p-толуол сульфонильных групп, карбоксибензокси-групп, t-бутилоксикарбонильных групп, хлорацетильных групп или формильных групп. Свободные карбоксильные группы могут образовывать производные с получением солей, метиловых и этиловых сложных эфиров или других типов сложных эфиров и гидразидов. Свободные гидроксильные группы могут давать O-ацильные или O-алкильные производные. Кроме того, включенными в качестве химических производных являются пептиды, содержащие природные производные двадцати стандартных аминокислот. Например: 4-гидроксипролин может заменять пролин; 5-гидроксилизин может заменять лизин; 3-метилгистидин может заменять гистидин; гомосерин может заменять серин, и орнитин может заменять лизин. Производные также включают пептиды, содержащие одну или более вставок или делеций, при условии, что сохраняется необходимая активность. Другими включенными модификациями являются амидирование, аминоконцевое ацилирование (например, ацетилирование или амидирование тиогликолевой кислоты), концевое карбоксиламидирование (например, с аммонием или метиламином) и подобные концевые модификации.
Специалистам ясно, что также могут использоваться пептидомиметические соединения. Термин 'пептидомиметическое' относится к соединению, которое имитирует конформацию и желательные свойства отдельного пептида как терапевтического средства.
Например, указанный полипептид включает не только молекулы, в которых аминокислотные остатки соединяются пептидными (-CO-NH-) связями, но также молекулы, в которых пептидная связь является «перевернутой». Такие ретро-инверсо-пептидомиметики могут быть изготовлены с помощью известных в данной области техники методов, например, описанных в работе Meziere et al. (1997) J. Immunol. 159, 3230-3237, которая включается в описание путем отсылки. Этот подход включает в себя изготовление псевдопептидов с изменениями, затрагивающими остов, а не ориентировку боковых цепей. Ретро-инверсо-пептиды, содержащие связи NH-CO вместо пептидных связей CO-NH, являются более устойчивыми к протеолизу. Альтернативно, указанный пептид может быть пептидомиметическим соединением, в котором один или более аминокислотных остатков связаны с помощью связи -y(CH2NH)- вместо обычной амидной связи.
В альтернативном варианте, можно обойтись совсем без пептидной связи, при условии, что используется подходящий линкерный фрагмент, который сохраняет расстояние между атомами углерода аминокислотных остатков; может быть выгодно, когда линкерный фрагмент имеет в основном то же самое распределение заряда и в основном ту же самую планарность (плоскостность) как пептидная связь.
Понятно, что указанный полипептид может быть удобно блокирован на его N- или С-конце, для того, чтобы способствовать уменьшению чувствительности к экзо-протеолитическому расщеплению.
Целый ряд некодированных или модифицированных аминокислот, таких как D-аминокислоты и N-метиламинокислоты, также используются для модификации пептидов млекопитающих. В дополнение к этому, предполагаемые биоактивные конформации могут быть стабилизированы при помощи ковалентных модификаций, таких как циклизация, или путем введения лактама или других типов мостиков, например, смотри работу Veber et al., 1978, Proc. Natl. Acad. Sci. USA 75:2636 и Thursell et al., 1983, Biochem. Biophys. Res. Comm. 111:166, которая включается в описание путем отсылки.
Общей темой среди многих стратегий синтеза является введение некоторого циклического фрагмента в пептидный остов. Циклический фрагмент ограничивает конформационное пространство пептидной структуры, что часто приводит к увеличенной специфичности пептида в отношении отдельного биологического рецептора. Дополнительное преимущество этой стратегии заключается в том, что введение циклического фрагмента в пептид также может давать в результате пептид, обладающий уменьшенной чувствительностью к клеточным пептидазам.
Таким образом, типичные полипептиды изобретения содержат или включают в качестве концевых аминокислот цистеин. Такой полипептид может существовать в гетеродетной циклической форме вследствие образования дисульфидной связи между меркаптидными группами концевых цистеинов или в гомодетной форме вследствие образования пептидной связи между концевыми аминокислотами. Как указано выше, циклизация небольших пептидов за счет использования дисульфидных или амидных связей между N- и С-концевыми цистеинами может преодолеть проблемы специфичности и времени полужизни, в ряде случаев наблюдаемые в случае линейных пептидов, путем уменьшения протеолиза и также увеличения устойчивости структуры, что может давать соединения с более высокой специфичностью. Полипептиды, циклизированные с помощью дисульфидных связей имеют свободные амино- и карбокси-концы, которые по-прежнему могут быть чувствительны к протеолитической деградации, тогда как пептиды, циклизированные путем образования амидной связи между N-концевым амином и С-концевым карбоксилом, уже не содержат свободных амино- или карбокси-концов. Таким образом, пептиды могут соединяться или C-N связью или дисульфидной связью.
Настоящее изобретение каким-либо образом не ограничивается методом циклизации пептидов, однако включает пептиды, циклическая структура которых может быть получена с помощью любого подходящего метода синтеза. Таким образом, гетеродетные связи могут включать, но не ограничиваются этим, образование через дисульфидные мостики, алкиленовые или сульфидные мостики. Методы синтеза циклических гомодетных пептидов и циклических гетеродетных пептидов, содержащих дисульфидные, сульфидные и алкиленовые мостики, раскрываются в США 5,643,872, включенном в описание путем отсылки. Другие примеры методов циклизации обсуждаются и раскрываются в США 6,008,058, включенном в описание путем отсылки.
Дополнительным подходом к синтезу циклических стабилизированных пептидомиметических соединений является метатезис с закрытием цикла (RCM). Этот метод включает стадии синтеза предшественника пептида и его контактирование с RCM катализатором с получением конформационно ограниченного пептида. Подходящие предшественники пептида могут содержать две или более ненасыщенные С-С связи. Этот метод может осуществляться с использованием твердофазного пептидного синтеза. В этом варианте осуществления предшественник, закрепленный на твердой подложке, контактирует с RCM катализатором, а затем продукт отщепляется от твердой подложки с выходом конформационно ограниченного пептида.
Другой подход, раскрытый D. H. Rich в работе Protease Inhibitors, Barren и Selveson, eds., Elsevier (1986), которая включается в описание путем отсылки, заключается в создании имитаторов пептидов в результате применения идеи аналога переходного состояния при разработке ингибитора фермента. Например, известно, что вторичный спирт статина имитирует тертраэдрическое переходное состояние расщепляющейся амидной связи субстрата пепсина.
Таким образом, концевые модификации используются, как хорошо известно, для уменьшения чувствительности к протеолитическому расщеплению и, следовательно, для удлинения времени полужизни пептидов в растворах, в частности в биологических жидкостях, в которых могут присутствовать протеазы. Циклизация полипептидов также является подходящей модификацией вследствие устойчивых структур, образованных циклизацией, и с точки зрения биологической активности циклических пептидов.
Таким образом, в одном варианте осуществления указанный полипептид является циклическим. Однако в альтернативном варианте осуществления указанный полипептид является линейным.
Предпочтительно, антитело, антигенсвязывающий фрагмент, вариант, гибрид или его производное имеют более высокую возможность активации дендритных клеток, чем известное анти-CD40-антитело "В44" (аминокислотные последовательности которого показаны в Примере 10, ниже).
Агонистическое антитело В44 происходит из библиотеки n-CoDeR®, которая является библиотекой фрагментов рекомбинантных антител человека и собственностью биофармацевтической компании BioInvent International AB (Söderlind et al., 2000, Nature Biotechnol., 18:852-6; WO 98/32845). Антитело В44 обладает аффинной константой (KD) от умеренной до низкой 1.7 нМ и умеренной эффективностью, как определено in vitro (Ellmark et al., 2002, Immunology, 106:456-463; Ellmark et al., 2008, AIDS Research и Human Retroviruses, 243, 367-372). Аффинность и эффективность В44 агонистического антитела делает его непригодным в качестве клинически и терапевтически релевантного анти-CD40 агонистического антитела.
Более предпочтительно, антитело, антигенсвязывающий фрагмент, вариант, гибрид или его производное обладает возможностью активации дендритных клеток (что измеряется в виде ЕС50, как описано в Примере 4), по меньшей мере, 0,5 мкг/мл (т.е. ЕС50 ниже или равно 0,5 мкг/мл). Например, антитело, антигенсвязывающий фрагмент, вариант, гибрид или его производное может иметь значение ЕС50, необходимое для стимулирования CD80 (как определено в Примере 4) менее чем 0,5 мкг/мл, например, менее чем 0,4 мкг/мл, 0,3 мкг/мл, 0,2 мкг/мл, 0,1 мкг/мл или менее чем 0,05 мкг/мл.
В одном варианте осуществления изобретения антитело, антигенсвязывающий фрагмент, вариант, гибрид или его производное обладает специфичностью связывания с CD40, улучшенной по сравнению с антителом В44.
В отношении специфичности связывания антитела, наиболее часто рассматриваемым кинетическим параметром является общая аффинность, которая обычно выражается в виде константы диссоциации (KD). Этот статический параметр отражает относительную занятость клеточного рецептора при равновесии и имеет отношение к системному введению. Однако, во время местного введения антитело может просачиваться из местного опухолевого пространства и, таким образом, время реакции ограничивается. Следовательно, высокая скорость ассоциации (высокая ka) может быть очень важна для обеспечения клинического эффекта при местном введении, поскольку она определяет время, которое требуется антителу для достижения равновесия (Katakura et al., Journal of Molecular Catalysis, (28), 191-200, 2004). В дополнение к этому низкая скорость диссоциации (низкая kd) может влиять на продолжительность лечения и может способствовать сдерживанию антитела в области опухоли, таким образом, сводя к минимуму системное воздействие и токсичность.
Методы измерения общей аффинности (KD), скорости ассоциации (ka) и скорости диссоциации (kd) взаимодействия (например, взаимодействия между антителом и лигандом) хорошо известны в данной области техники. Типичные методы in vitro описаны в сопутствующих Примерах. Также возможно использование методов, основанных на проточной цитометрии (Sklar et al., Annu Rev Biophys Biomol Struct, (31), 97-119, 2002).
Антитело изобретения или антигенсвязывающий фрагмент, вариант, гибрид или его производное обладают аффинностью (KD) к CD40 ниже чем 1,0×10-10 М, например, KD ниже чем 9.0×10-11 М, 8.0×10-11 М, 7.0×10-11 М, 6.0×10-11 М, 5.0×10-11 М, 4.0×10-11М, 3.0×10-11 М, 2.0×10-11 М или ниже чем 1.0×10-11 М.
В другом предпочтительном варианте осуществления антитело, антигенсвязывающий фрагмент, вариант, гибрид или его производное имеет скорость ассоциации к CD40 выше, чем скорость ассоциации В44 антитела, например, скорость ассоциации (ka) выше чем 2.7×106 Мсек и предпочтительно скорость диссоциации (ka) выше чем 3.0×106 Мсек; или 4.0×106 Мсек; или 5.0×106 Мсек; или 6.0×106 Мсек; или 7.0×106 Мсек; или 8.0×106 Мсек; или 9.0×106 Мсек; или 1.0×107 Мсек.
В другом предпочтительном варианте осуществления антитело, антигенсвязывающий фрагмент, вариант, гибрид или его производное имеет более низкую скорость диссоциации с CD40, ниже, чем скорость диссоциации с В44 антителом, например, скорость диссоциации (kd) ниже чем 4.5×10-3 сек и предпочтительно скорость диссоциации ниже чем 3.0×10-3 сек; или 2.0×10-3 сек; или 1.0×10-3 сек; или 9.0×10-4сек; или 8.0×10-4 сек; или 7.0×10-4 сек; или 6.0×10-4 сек; или 5.0×10-4 сек; или 3.0×10-4сек; или 2.0×10-4 сек; или 1.0×10-4 сек; или 9.0×10-5 сек; или 8.0×10-5 сек; или 7.0×10-5сек; или 6.0×10-5 сек; или 5.0×10-5 сек; или 4.0×10-5 сек; или 3.0×10-5 сек; или 2.0×10-5сек; или 1.0×10-6 сек.
В одном предпочтительном варианте осуществления антитело, антигенсвязывающий фрагмент, вариант, гибрид или его производное имеет аффинность (KD) к CD40 в пределах от 1.0×10-10 М до 1×10-11 М и скорость диссоциации (ka) с CD40 в пределах от 2.7 106 до 1×107 Мсек.
Как правило, изобретение предоставляет антитело или антигенсвязывающий фрагмент, или вариант, гибрид или его производное, с аффинностью связывания с CD40, расположенном на поверхности клетки.
Фраза "расположенный на поверхности клетки" означает, что CD40 связан с клеткой так, что один или более участков CD40 присутствует на внешней стороне клеточной поверхности. Например, CD40 может быть «вставлен» в цитоплазматическую мембрану клетки (т.е. ориентирован как трансмембранный белок), при этом один или более его участков представлены на внеклеточной поверхности. Альтернативно, CD40 может удерживаться на внешней поверхности клетки с помощью ковалентных и/или ионных взаимодействий, располагаясь в определенном участке или участках клеточной поверхности.
Таким образом, при помощи термина "поверхность раковой клетки" мы имеем в виду, что CD40 так локализуется относительно одной или более клеток, происходящих от или характерных для раковой клетки или опухоли.
В одном варианте осуществления антитело или антигенсвязывающий фрагмент, или вариант, гибрид или его производное содержит или состоит из интактного антитела.
Альтернативно, антитело или антигенсвязывающий фрагмент, или вариант, гибрид или его производное содержит или включает антигенсвязывающий фрагмент, выбранный из группы, состоящей из Fv-фрагмента (такого как одноцепочечный Fv-фрагмент или связанный посредством дисульфида Fv-фрагмент) и Fab-подобного фрагмента (такого как Fab-фрагмент; Fab' фрагмент или F(ab)2 фрагмент).
Например, антигенсвязывающий фрагмент или вариант, гибрид или его производное может содержать scFv.
Термин "ScFv молекулы" включает молекулы, в которых VH и VL домены-партнеры связаны через «гибкий» олигопептид.
Использование фрагментов антител, а не целых антител, обеспечивает кратное преимущество. Небольшой размер фрагментов может давать в результате улучшенные фармакологические свойства, такие как лучшее проникновение в место-мишень. Эффекторные функции целых антител, такие как связывание комплемента, устраняются. Все Fab, Fv, ScFv и dAb фрагменты антител могут экспрессироваться и секретироваться Е. coli, что дает возможность простой выработки больших количеств указанных фрагментов.
Предпочтительно, антитело изобретения, антигенсвязывающий фрагмент, вариант, гибрид или его производное представляет собой рекомбинантную молекулу.
Хотя антитело может быть поликлональным антителом, предпочтительно, что оно является моноклональным антителом, или, что антигенсвязывающий фрагмент, вариант, гибрид или его производное получают из моноклонального антитела.
Подходящие моноклональные антитела можно получить с помощью известных методов, например, раскрытых в "Monoclonal Antibodies; A manual of techniques", H Zola (CRC Press, 1988) и в "Monoclonal Hybridoma Antibodies: Techniques и Application", SGR Hurrell (CRC Press, 1982). Можно получить поликлональные антитела, являющиеся полиспецифическими или моноспецифическими. Предпочтительно, антитела являются моноспецифическими.
Предпочтительно, антитело, антигенсвязывающий фрагмент, вариант, гибрид или его производное является человеческим или гуманизированным.
Антитела могут быть человеческими антителами, в том смысле, что они имеют аминокислотную последовательность человеческого антитела со специфичностью к белку CD40, как определено в описании, однако, понятно, что они могут быть получены с помощью известных в данной области техники методов, не требующих иммунизации людей. Например, полипептиды антител могут быть получены in vitro в клеточных линиях человека и нечеловеческих клеточных линиях. Альтернативно, доступны трансгенные мыши, которые фактически содержат гены иммуноглобулинов человека (смотри Vaughan et al (1998) Nature Biotechnol. 16, 535-539.
Соответствующим образом полученные нечеловеческие антитела могут быть "гуманизированы" известными способами, например, путем введения CDR-участков мышиного антитела в каркасный участок человеческого антитела.
Химерные антитела обсуждаются Neuberger et al (1998, 8th International Biotechnology Symposium Part 2, 792-799).
Специалистам ясно, что специфичность связывания антитела или его антигенсвязывающего фрагмента определяется наличием гипервариабельных участков (CDR) в пределах вариабельных участков тяжелой и легкой цепей. Как обсуждается ниже, в особенно предпочтительном варианте осуществления антител и антигенсвязывающих фрагментов, вариантов, гибридов и их производных, определенных в описании, специфичность связывания с CD40 определяется наличием одной или более аминокислотных последовательностей CDR, определенных в описании.
Использованный в описании термин "аминокислота" включает двадцать стандартных закодированных генетически аминокислот и их соответствующие стереоизомеры в 'D' форме (по сравнению с природной 'L' формой), омега-аминокислоты
другие природные аминокислоты, нестандартные аминокислоты (например, α,α-двузамещенные аминокислоты, N-алкил-аминокислоты и т.д.) и химические производные аминокислот (смотри ниже).
В том случае, когда аминокислота прямо перечисляется, например, "аланин" или "Ala" или "А", термин относится и к L-аланину и D-аланину, если специально не указано иначе. Другие нестандартные аминокислоты также могут быть подходящими компонентами для полипептидов настоящего изобретения, при условии, что желательное функциональное свойство сохраняется полипептидом. Что касается показанных пептидов, каждый кодированный остаток аминокислоты, если необходимо, представлен однобуквенным обозначением, соответствующим обычному названию стандартной аминокислоты.
В одном варианте осуществления полипептиды, как определено в описании, содержат или состоят из L-аминокислот.
В предпочтительном варианте осуществления антитело, фрагмент, вариант, гибрид или производное содержит вариабельный домен легкой цепи (VL), в которой CDR1 содержит или состоит из аминокислотной последовательности:

в которой:
X1 представляет собой S или Т; и
X2 представляет собой K или H или D или G или N.
В предпочтительном варианте осуществления антитело, фрагмент, вариант, гибрид или производное содержит вариабельный домен легкой цепи (VL), в которой CDR2 содержит или состоит из аминокислотной последовательности:

в которой:
X3 представляет собой G или R.
В предпочтительном варианте осуществления антитело, фрагмент, вариант, гибрид или производное содержит вариабельный домен легкой цепи (VL), в которой CDR3 содержит или состоит из аминокислотной последовательности:

в которой:
X4 представляет собой D или S или Е или G или K; и
X5 представляет собой S или Т или G; и
X6 представляет собой L или S или Т или L или I; и
X7 представляет собой S или Т или L; и
X8 представляет собой V или L.
Более предпочтительно антитело, фрагмент, вариант, гибрид или производное содержит вариабельный домен легкой цепи (VL), в которой CDR1 содержит или состоит из аминокислотной последовательности, выбранной из группы, состоящей из:

Более предпочтительно антитело, фрагмент, вариант, гибрид или производное содержит вариабельный домен легкой цепи (VL), в которой CDR2 содержит или состоит из аминокислотной последовательности, выбранной из группы, состоящей из:

Более предпочтительно антитело, фрагмент, вариант, гибрид или производное содержит вариабельный домен легкой цепи (VL), в которой CDR3 содержит или состоит из аминокислотной последовательности, выбранной из группы, состоящей из:

В особенно предпочтительных вариантах осуществления антитело или антигенсвязывающий фрагмент, или вариант, гибрид или производное изобретения содержит вариабельный домен легкой цепи (VL), включающий следующие CDR:
(i) SEQ ID NO: 1 и SEQ ID NO:2 и SEQ ID NO:3; или
(ii) SEQ ID NO:4 и SEQ ID NO:10 и SEQ ID NO:12; или
(iii) SEQ ID NO:5 и SEQ ID NO:10 и SEQ ID NO:13; или
(iv) SEQ ID NO:4 и SEQ ID NO:10 и SEQ ID NO:12; или
(v) SEQ ID NO:6 и SEQ ID NO:10 и SEQ ID NO:14; или
(vi) SEQ ID NO:7 и SEQ ID NO:11 и SEQ ID NO:15; или
(vii) SEQ ID NO:8 и SEQ ID NO:10 и SEQ ID NO:16; или
(viii) SEQ ID NO:9 и SEQ ID NO:10 и SEQ ID NO:17; или
(ix) SEQ ID NO:9 и SEQ ID NO:10 и SEQ ID NO:12; или
(x) SEQ ID NO:9 и SEQ ID NO:10 и SEQ ID NO:18.
В дополнительном предпочтительном варианте осуществления антитело, фрагмент, вариант, гибрид или производное содержит вариабельный домен легкой цепи (VL), включающий аминокислотную последовательность, выбранную из группы, состоящей из:
SEQ ID NO:19; SEQ ID NO:20; SEQ ID NO:21; SEQ ID NO:22;
SEQ ID NO:23; SEQ ID NO:24; SEQ ID NO:25; SEQ ID NO:26; и
SEQ ID NO:27.
В одном варианте осуществления антитело, фрагмент, вариант, гибрид или производное содержит константный домен легкой цепи (CL), включающий аминокислотную последовательность SEQ ID NO:63.
Кроме того, предпочтительно, что антитело, фрагмент, вариант, гибрид или производное содержит вариабельный домен тяжелой цепи (VH), в котором CDR1 содержит или состоит из последовательности аминокислот:

Также предпочтительно, что антитело, фрагмент, вариант, гибрид или производное содержит вариабельный домен тяжелой цепи (VH), в котором CDR2 содержит или состоит из последовательности аминокислот:

Также предпочтительно, что антитело, фрагмент, вариант, гибрид или производное содержит вариабельный домен тяжелой цепи (VH), в котором CDR3 содержит или состоит из последовательности аминокислот:

В особенно предпочтительном варианте осуществления изобретения антитело, фрагмент, вариант, гибрид или производное содержит вариабельный домен тяжелой цепи (VH), содержащий CDR SEQ ID NO:28 и SEQ ID NO:29 и SEQ ID NO:30.
В дополнительном предпочтительном варианте осуществления антитело, фрагмент, вариант, гибрид или производное содержит вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, выбранную из группы, состоящей из:
SEQ ID NO:31; SEQ ID NO:32; SEQ ID NO:33; SEQ ID NO:34;
SEQ ID NO:35; SEQ ID NO:36; SEQ ID NO:37; SEQ ID NO:38; и
SEQ ID NO:39.
В одном варианте осуществления, антитело, фрагмент, вариант, гибрид или производное содержит константный домен тяжелой цепи (CH), содержащий аминокислотную последовательность SEQ ID NO:62.
Особенно предпочтительно, что антитело, фрагмент, вариант, гибрид или производное содержит следующие CDR:
(i) SEQ ID NO:1 и SEQ ID NO:2 и SEQ ID NO:3 и SEQ ID NO:28 и SEQ ID NO:29 и SEQ ID NO:30; или
(ii) SEQ ID NO:4 и SEQ ID NO:10 и SEQ ID NO:12 и SEQ ID NO:28 и SEQ ID NO:29 и SEQ ID NO:30; или
(iii) SEQ ID NO:5 и SEQ ID NO:10 и SEQ ID NO:13 и SEQ ID NO:28 и SEQ ID NO:29 и SEQ ID NO:30; или
(iv) SEQ ID NO:4 и SEQ ID NO:10 и SEQ ID NO:12 и SEQ ID NO:28 и SEQ ID NO:29 и SEQ ID NO:30; или
(v) SEQ ID NO:6 и SEQ ID NO:10 и SEQ ID NO:14 и SEQ ID NO:28 и SEQ ID NO:29 и SEQ ID NO:30; или
(vi) SEQ ID NO:7 и SEQ ID NO:11 и SEQ ID NO:15 и SEQ ID NO:28 и SEQ ID NO:29 и SEQ ID NO:30; или
(vii) SEQ ID NO:8 и SEQ ID NO:10 и SEQ ID NO:16 и SEQ ID NO:28 и SEQ ID NO:29 и SEQ ID NO:30; или
(viii) SEQ ID NO:9 и SEQ ID NO:10 и SEQ ID NO:17 и SEQ ID NO:28 и SEQ ID NO:29 и SEQ ID NO:30; или
(ix) SEQ ID NO:9 и SEQ ID NO:10 и SEQ ID NO:12 и SEQ ID NO:28 и SEQ ID NO:29 и SEQ ID NO:30; или
(x) SEQ ID NO:9 и SEQ ID NO:10 и SEQ ID NO:18 и SEQ ID NO:28 и SEQ ID NO:29 и SEQ ID NO:30.
В одном варианте осуществления антитело изобретения или антигенсвязывающий фрагмент, или вариант, гибрид или его производное связывается с эпитопом в пределах первого домена (D1) CD40 (предпочтительно, человеческого CD40).
Например, антитело изобретения или антигенсвязывающий фрагмент, или вариант, гибрид или его производное может конкурировать за связывание с CD40 с одним или более из иллюстративных антител изобретения (смотри таблицу А; как описано в Примерах ниже):


Таким образом, антитело изобретения или антигенсвязывающий фрагмент, или вариант, гибрид или его производное может связываться с тем же самым эпитопом CD40 как одно или более из иллюстративных антител изобретения.
В одном предпочтительном варианте осуществления антитело изобретения или антигенсвязывающий фрагмент, или вариант, гибрид или его производное содержит VL и VH пары одного из иллюстративных антител изобретения (как показано в таблице А)
Таким образом, в особенно предпочтительном варианте осуществления, антитело, антигенсвязывающий фрагмент, вариант, гибрид или его производное содержит вариабельный домен легкой цепи (VL) и вариабельный домен тяжелой цепи (VH), содержащий следующие аминокислотные последовательности:
(i) SEQIDNO:19 и SEQ ID NO:31; или
(ii) SEQ ID NO:20 и SEQ ID NO:32; или
(iii) SEQ ID NO:21 и SEQ ID NO:33; или
(iv) SEQ ID NO:22 и SEQ ID NO:34; или
(v) SEQ ID NO:23 и SEQ ID NO:35; или
(vi) SEQ ID NO:24 и SEQ ID NO:36; или
(vii) SEQ ID NO:25 и SEQ ID NO:37; или
(viii) SEQ ID NO:26 и SEQ ID NO:38; или
(ix) SEQ ID NO:27 и SEQ ID NO:39.
Предпочтительно, антитело, антигенсвязывающий фрагмент, вариант, гибрид или его производное содержит Fc-область антитела. Специалистам понятно, что Fc-участок может происходить из IgG антитела или из другого класса антитела (такого как IgM, IgA, IgD или IgE). Например, Fc-область может происходить из IgG1, IgG2, IgG3 или IgG4 антитела. Предпочтительно, однако, Fc-область происходит из IgG1 антитела.
Fc-область может быть природной (например, часть эндогенно выработанного антитела) или может быть искусственной (например, содержащей одну или более точковых мутаций относительно природной Fc-области). Fc-области с точковыми мутациями, улучшающими их способность связывания с FcR, могут быть полезными, например, при изменении времени полужизни в сыворотке или улучшении связывания с Fcγ рецепторами (FcγR) участвующими в ADCC и CDC. В частности, мутации, которые увеличивают связывание с FcγRIIB, например, S267E (Strohl et al., 2009, Curr Opin Biotechnol, 20:685-691), могут быть полезны для изобретения, определяя связь между связыванием FcγRIIB и функциональной активностью CD40-антител (Li et al., 2011, Science, 333: 1030-1034).
В одном варианте осуществления Fc-область содержит или состоит из аминокислотной последовательности SEQ ID NO:62.
Предпочтительно, что антитело изобретения, антигенсвязывающий фрагмент, вариант, гибрид или его производное представляет собой молекулу IgG, или является антигенсвязывающим фрагментом, вариантом, гибридом или производным молекулы IgG. Последовательность аминокислот особенно предпочтительной IgG последовательности описывается в сопутствующих Примерах.
В одном варианте осуществления антитело изобретения или антигенсвязывающий фрагмент, или вариант, гибрид или его производное дополнительно содержит цитотоксичный фрагмент, который может быть цитотоксичным непосредственно или опосредованно.
Фраза "цитотоксичный непосредственно" означает, что фрагмент сам по себе является цитотоксичным. Фраза "цитотоксичный опосредованно" означает, что фрагмент, который сам по себе не является цитотоксичным, может вызывать цитотоксичность, например, путем воздействия на молекулу в дальнейшем или путем дополнительного воздействия на нее.
Удобнее всего, когда цитотоксичный фрагмент является цитотоксичным, будучи внутри клетки и, предпочтительно, не является цитотоксичным, будучи вне клетки.
Предпочтительно, изобретение предоставляет антитело или антигенсвязывающий фрагмент, или вариант, гибрид или его производное, в котором цитотоксичный фрагмент является непосредственно цитотоксичным химиотерапевтическим средством. В некоторых случаях цитотоксичный фрагмент является непосредственно цитотоксичным полипептидом. Цитотоксичные химиотерапевтические средства хорошо известны в данной области техники.
Цитотоксичные химиотерапевтические средства, такие как противоопухолевые препараты, включают: алкилирующие средства, включая азотистый иприт, такие как хлорметин (HN2), циклофосфамид, ифосфамид, мелфалан (L-сарколизин) и хлорамбуцил; этиленимины и метилмеламины, такие как гексаметилмеламин, тиотепа; алкилсульфонаты, такие как бусульфан; нитрозомочевины, такие как кармустин (BCNU), ломустин (CCNU), семустин (метил-CCNU) и стрептозоцин (стрептозотоцин); и триазены, такие как декарбазин (DTIC; диметилтриазеноимидазол-карбоксамид); антиметаболиты, включая аналоги фолиевой кислоты, такие как метотрексат (аметоптерин); аналоги пиримидина, такие как фторурацил (5-фторурацил; 5-FU), флоксуридин (фтордезоксиуридин; FUdR) и цитарабин (цитозин арабинозид); и аналоги пурина и родственные ингибиторы, такие как меркаптопурин (6-меркаптопурин; 6-МР), тиогуанин (6-тиогуанин; TG) и пентостатин (2'-дезоксикоформицин). Средства природного происхождения включают винкаалкалоиды, такие как винбластин (VLB) и винкристин; эпиподофиллотоксины, такие как этопозид и тенипозид; антибиотики, такие как дактиномицин (актиномицин D), даунорубицин (дауномицин; рубидомицин), доксорубицин, блеомицин, пликамицин (митрамицин) и митомицин (митомицин С); ферменты, такие как L-аспарагиназа; и модификаторы биологического отклика, такие как интерферон alphenomes. Прочие средства включают координационные комплексы платины, такие как цисплатин (cis-DDP) и карбоплатин; антрацендионы, такие как митоксантрон и антрациклин; замещенную мочевину, такую как гидроксимочевина; производное метилгидразина, такое как прокарбазин (N-метилгидразин, MIH); и средства для подавления функции коры надпочечников, такие как митотан (о,р'-DDD) и аминоглутетимид; таксол и его аналоги/производные; и агонисты/антагонисты гормонов, такие как флутамид и тамоксифен.
Ранее различные из этих средств были присоединены к антителам и другим средствам для нацеленной доставки, поэтому антитела изобретения, содержащие эти средства, легко могут быть получены специалистом в данной области техники. Например, карбодиимидная конъюгация (Bauminger & Wilchek (1980) Methods Enzymol. 70, 151-159; включенная в описание путем отсылки) может использоваться для конъюгирования целого ряда средств, включая доксорубицин, с антителами или пептидами.
Карбодиимиды включают группу соединений, имеющих общую формулу R1-N=C=N-R2, где R1 и R2 могут быть алифатическими или ароматическими, и используются для синтеза пептидных связей. Препаративный метод является простым, относительно быстрым и проводится при мягких условиях. Карбодиимидные соединения «атакуют» карбоксильные группы и превращают их в реакционноспособные центры для свободных аминогрупп.
В частности, водорастворимый карбодиимид, 1-этил-3-(3-диметиламинопропил) карбодиимид (EDC) используется для объединения функционального фрагмента со связывающим фрагментом и может использоваться для конъюгирования доксорубицина с опухолевыми хоминг-пептидами. Конъюгация доксорубицина и связывающего фрагмента требует присутствия аминогруппы, которая предоставляется доксорубицином, и карбоксильной группы, которая предоставляется антителом.
В дополнение к использованию карбодиимидов непосредственно для образования пептидных связей также может использоваться EDC для получения активных сложных эфиров, таких как N-гидроксисукцинимидный сложный эфир (NHS). Затем NHS-сложный эфир, который связывается только с аминогруппами, может использоваться с целью стимулирования образования амидной связи с одной аминогруппой доксорубицина. Использование EDC и NHS в комбинации обычно применяется при конъюгировании с целью увеличения выхода при образовании конъюгата (Bauminger & Wilchek, supra, 1980).
Также могут использоваться другие методы конъюгирования цитотоксического фрагмента с антителом. Например, может использоваться окисление йоднокислым натрием с последующим восстановительным алкилированием соответствующих реагентов, как и перекрестное сшивание глутаральдегидом. Однако, считается, что вне зависимости от того, какой способ получения конъюгата изобретения выбран, должно быть сделано определение, что антитело сохраняет свою нацеливающую способность, и что функциональный фрагмент сохраняет свою характерную функцию.
В одном варианте осуществления изобретения цитотоксичный фрагмент является цитотоксичным фрагментом пептида или полипептида, посредством которого мы включаем любой фрагмент, приводящий к гибели клетки. Цитотоксичные пептидные и полипептидные фрагменты хорошо известны в данной области техники и включают, например, рицин, абрин, экзотоксин синегнойной палочки, тканевой фактор и тому подобное. Способы присоединения их к нацеливающим молекулам, таким как антитела, также хорошо известны в данной области техники. Применение рицина в качестве цитотоксичного агента описано в работе Burrows & Thorpe (1993) Proc. Natl. Acad. Sci. USA 90, 8996-9000, включенной в описание путем отсылки, а применение тканевого фактора, приводящее к локализованному свертыванию крови и инфаркту опухоли, описано Ran et al (1998) Cancer Res. 58, 4646-4653 и Huang et al (1997) Science 275, 547-550. Tsai et al (1995) Dis. Colon Rectum 38, 1067-1074 описывает А цепь абрина, конъюгированную с моноклональным антителом (включается в описание путем отсылки). Другие белки, инактивирующие рибосомы, описаны как цитотоксичные средства в WO 96/06641. Экзотоксин Pseudomonas также может использоваться в качестве цитотоксичного полипептидного фрагмента (смотри, например, Aiello et al (1995) Proc. Natl. Acad. Sci. USA 92, 10457-10461; включенную в описание путем отсылки).
Некоторые цитокины, такие как TNFα и IL-2, также могут использоваться в качестве цитотоксичных агентов.
Кроме того, некоторые радиоактивные атомы могут быть цитотоксичными, если доставляются в достаточных дозах. Таким образом, цитотоксичный фрагмент может содержать радиоактивный атом, который, при использовании поставляет достаточное количество радиоактивности в место-мишень, дабы проявлять цитотоксичность. Подходящие радиоактивные атомы включают фосфор-32, йод-125, йод-131, индий-111, рений-186, рений-188 или иттрий-90, или любой другой изотоп, излучающий достаточно энергии для уничтожения соседних клеток, органелл или нуклеиновой кислоты. Предпочтительно, изотопы и плотность (число) радиоактивных атомов в таких средствах изобретения являются такими, что доза более чем 4000 cGy (сантигрэй) (предпочтительно, по меньшей мере, 6000, 8000 или 10000 cGy), доставляется к месту-мишени и, предпочтительно, к клеткам в месте-мишени и их органеллам, в частности ядру.
Радиоактивный атом может быть присоединен к антителу, антигенсвязывающему фрагменту, варианту, гибриду или его производному известными способами. Например, к связывающему фрагменту может быть присоединен EDTA или другой хелатирующий агент и использован для прикрепления111In или90Y. Остатки тирозина могут быть напрямую помечены125I или131I.
Цитотоксичный фрагмент может быть подходящим опосредованно-цитотоксичным полипептидом. В особенно предпочтительном варианте осуществления опосредованно-цитотоксичный полипептид представляет собой полипептид, который обладает ферментативной активностью и может преобразовать нетоксичное и/или относительно нетоксичное пролекарство в цитотоксичное средство. Этот тип системы с использованием антител часто называется ADEPT (направленная на антитела ферментно-пролекарственная терапия). Данная система подразумевает, что антитело показывает местонахождение ферментативного участка в желательном месте в организме пациента, и после предоставления времени, для того чтобы фермент локализовался в данном месте, введение пролекарства, которое является субстратом для фермента, при этом конечный продукт катализа является цитотоксичным соединением. Цель этого подхода заключается в увеличении до максимума концентрации лекарственного средства в желательном месте и уменьшении до минимума концентрации лекарственного средства в нормальных тканях (смотри Senter, P.D. et al (1988) "Anti-tumour effects of antibody-alkaline phosphatase conjugates in combination with etoposide phosphate" Proc. Natl. Acad. Sci. USA 85, 4842-4846; Bagshawe (1987) Br. J. Cancer 56, 531-2; и Bagshawe, K.D. et al (1988) "A cytotoxic agent can be generated selectively at cancer sites" Br. J. Cancer. 58, 700-703.)
В предпочтительном варианте осуществления цитотоксичный фрагмент способен преобразовать нецитотоксичное пролекарство в цитотоксичное средство.
Ферментом и пролекарством системы, использующей целевой фермент, как описано здесь, может быть что-либо из ранее предложенного. Цитотоксичное вещество может быть любым существующим противоопухолевым препаратом, например, аликилирующим средством; средством, интеркалирующим в ДНК; средством, ингибирующим какие-либо ключевые ферменты, такие как дигидрофолатредуктаза, тимидинсинтетаза, рибонуклеотидредуктаза, нуклеозидкиназа или топоизомераза; или средство, которое осуществляет клеточную смерть путем взаимодействия с любыми другими клеточными компонентами. Этопозид является примером ингибитора топоизомеразы.
Описанные в литературе системы пролекарств включают: феноловый иприт в качестве пролекарства, активированного Е. coli β-глюкуронидазой (Wang et al, 1992 и Roffler et al, 1991); пролекарство доксорубицина, активированное человеческой (3-глюкуронидазой (Bosslet et al, 1994); дополнительные пролекарства доксорубицина, активированные α-галактозидазой кофейных зерен (Azoulay et al, 1995); пролекарства даунорубицина, активированные α-D-галактозидазой кофейных зерен (Gesson et al, 1994); пролекарство 5-фторуридина, активированное Е. coli β-D-галактозидазой (Abraham et al, 1994); и пролекарства метотрексата (например, метотрексат-аланин) активированное карбоксипептидазой A (Kuefner et al, 1990, Vitols et al, 1992 и Vitols et al, 1995). Эти и другие пролекарства включены в таблицу В, ниже.
Таблица В взята из работы Bagshawe (1995) Drug Dev. Res. 34, 220-230, из которой можно получить полные ссылки в отношении этих различных систем; производное таксола описано в Rodrigues, M.L. et al (1995) Chemistry & Biology 2, 223).
Подходящие ферменты для образования части ферментного участка включают экзопептидазы, такие как карбоксипептидазы G, G1 и G2 (для глутамилированных пролекарств на основе иприта), карбоксипептидазы А и В (для пролекарств на основе МТХ) и аминопептидазы (для 2-α-аминоацильных МТС пролекарств); эндопептидазы, такие как, например, тромболизин (для пролекарств тромбина); гидролазы, такие как фосфатазы (например, щелочная фосфатаза) или сульфатазы (например, арил-фосфатазы) (для фосфорилированных или сульфатированных пролекарств); амидазы, такие как пенициллинамидаза и арилациламидаза; лактамазы, такие как β-лактамазы; глюкозидазы, такие как β-глюкуронидаза (для β-глюкурономид антрациклинов), α-галактозидаза (для амигдалина) и β-галактозидаза (для β-галактоз-антрациклина); дезаминазы, такие как цитозин дезаминаза (для 5FC); киназы, такие как урокиназа и тимидинкиназа (для ганцикловира); редуктазы, такие как нироредуктаза (для СВ1954 и аналогов), азоредуктаза (производные иприта на основе азобензола) и DT-диафораза (для СВ1954); оксидазы, такие как глюкозоксидаза (для глюкозы), ксантиноксидаза (для ксантина) и лактопероксидаза; DL-рацемазы, каталитические антитела и циклодекстрины.
Предпочтительно, пролекарство является относительно нетоксичным по сравнению с лекарственным средством. Как правило, оно имеет менее чем 10% токсичности, предпочтительно менее чем 1% токсичности при сравнении в подходящем тесте на цитотоксичность in vitro.
Весьма вероятно, что фрагмент, который способен превращать пролекарство в цитотоксичное лекарственное средство, будет активным при отделении от остальной части средства (агента) изобретения, однако необходимо, чтобы он был активным, только когда (а) он находится в комбинации с остальной частью средства (агента) изобретения, и (b) средство (агент) изобретения присоединяется, располагается рядом или поглощается клетками-мишенями.
Когда такой фрагмент является полипептидом, два участка могут быть связаны вместе с помощью любого из общепринятых способов перекрестного сшивания полипептидов, например, описанных в O'Sullivan et al (1979) Anal. Biochem. 100, 100-108. Например, антитело, антигенсвязывающий фрагмент, вариант, гибрид или его производное может быть снабжено тиольными группами и дополнительным фрагментом, реагирующим с бифункционлаьным агентом, способным вступать в реакцию с тиольными группами, например N-гидроксисукцинимид сложным эфиром йодуксусной кислоты (NHIA) или N-сукцинимидил-3-(2-пиридилдитио)пропионатом (SPDP). Амидные и тиоэфирные связи, например, обеспеченные м-малеимидобензоил-N-гидроксисукцинимид сложным эфиром, являются более устойчивыми in vivo, чем дисульфидные связи.
Альтернативно, антитело, антигенсвязывающий фрагмент, вариант, фрагмент или его производное может быть получено в виде гибридного соединения с помощью методов рекомбинантной ДНК, при условии, что длина ДНК включает соответствующие участки, кодирующие два фрагмента агента изобретения или смежные друг с другом или разделенные участком, кодирующим линкерный пептид, который не нарушает желательные свойства агента. Предположительно, два участка агента могут перекрываться полностью или частично.
Цитотоксический фрагмент может быть радиосенсибилизирующим средством. Радиосенсибилизаторы включают фторпиримидины, аналоги тимидина, гидроксимочевину, гемцитабин, флударабин, никотинамид, галогенированные пиримидины, 3-аминобензамид, 3-аминобензодиамид, этанидазол, пимонидазол и мисонидазол (смотри, например, McGinn et al (1996) J. Natl. Cancer Inst. 88, 1193-11203; Shewach & Lawrence (1996) Invest. New Drugs 14, 257-263; Horsman (1995) Acta Oncol. 34, 571-587; Shenoy & Singh (1992) Clin. Invest. 10, 533-551; Mitchell et al (1989) Int. J. Radiat. Biol. 56, 827-836; Iliakis & Kurtzman (1989) Int. J. Radiat. Oncol. Biol. Phys. 16, 1235-1241; Brown (1989) Int. J. Radiat. Oncol. Biol. Phys. 16, 987-993; Brown (1985) Cancer 55, 2222-2228).
Кроме того, доставка генов в клетки может радиосенсибилизировать их, например, доставка гена р53 или циклина D (Lang et al (1998) J. Neurosurg. 89, 125-132; Coco Martin et al (1999) Cancer Res. 59, 1134-1140).
Дополнительный фрагмент может быть фрагментом, который становится цитотоксичным, или высвобождает цитотоксичный фрагмент, после облучения. Например, изотоп бор-10 при соответствующем облучении высвобождает α-частицы, являющиеся цитотоксичными (например, смотри США 4, 348, 376 to Goldenberg; Primus et al (1996) Bioconjug. Chem. 7, 532-535).
Подобным образом, цитотоксичный фрагмент может быть фрагментом, который используется в фотодинамической терапии, таким как фотофрин (смотри, например, Dougherty et al (1998) J. Natl. Cancer Inst. 90, 889-905).
Дополнительный фрагмент может содержать молекулу нуклеиновой кислоты, которая является прямо или опосредованно цитотоксичной. Например, молекула нуклеиновой кислоты может быть антисмысловым олигонуклеотидом, который после локализации в месте-мишени способен войти в клетки и привести их к гибели. Данный олигонуклеотид, следовательно, может быть олигонуклеотидом, который предотвращает экспрессию жизненно необходимого гена, или олигонуклеотидом, который приводит к изменению экспрессии гена, вызывающего апоптоз. Альтернативно, цитотоксичный фрагмент является молекулой нуклеиновой кислоты, кодирующей прямо и/или опосредованно цитотоксичный полипептид.
Примеры подходящих олигонуклеотидов включают олигонуклеотиды, направленные на bcl-2 (Ziegler et al (1997) J. Natl. Cancer Inst. 89, 1027-1036), ДНК полимеразу а и топоизомеразу IIα (Lee et al (1996) Anticancer Res. 16, 1805-1811.
Вместо обычных нуклеиновых кислот могут использоваться пептидные нуклеиновые кислоты (смотри Knudsen & Nielsen (1997) Anticancer Drugs 8, 113-118).
В дополнительном варианте осуществления антитело, антигенсвязывающий фрагмент, вариант, гибрид или его производное может быть заключено в носитель (средство доставки) для доставки нуклеиновой кислоты к мишени. Носителем может быть любой подходящий носитель. Это может быть, например, липосома, содержащая нуклеиновую кислоту, или это может быть вирус или вирусоподобная частица, способная доставить нуклеиновую кислоту. В этих случаях молекула, которую нужно доставить, как правило, находится на поверхности средства доставки. Например, подходящий фрагмент антитела может находиться на наружной поверхности липосомы, а нуклеиновая кислота, которую нужно доставить, может находиться на внутренней поверхности липосомы. В качестве другого примера, вирусный вектор, такой как ретровирусный или аденовирусный вектор, создается таким образом, что связывающий фрагмент прикрепляется к или располагается на поверхности вирусной частицы, таким образом, позволяя вирусной частице нацеливаться на желательное место. Также известны такие нацеленные системы доставки, как модифицированная аденовирусная система, описанная в WO 94/10323, согласно которой, как правило, ДНК переносится в аденовирусе или частице, подобной аденовирусу. Michael et al (1995) Gene Therapy 2, 660-668, описывает модификацию аденовируса с целью добавления клеточно-селективного фрагмента в белок волокна. Нацеленные ретровирусы также доступны для использования в изобретении; например, последовательности, обеспечивающие свойства специфического связывания, могут быть встроены в предсуществующие вирусные env гены (смотри обзор этого и других нацеленных векторов для генной терапии в Miller & Vile (1995) Faseb J. 9, 190-199).
Могут использоваться иммунолипосомы (липосомы, направленные антителом). Для получения иммунолипосом синтезируют МРВ-РЕ (N-[4-(р-малеимидофенил)-бутирил]-фосфатидилэтанол-амин) в соответствии с методом Martin & Papahadjopoulos (1982) J. Biol. Chem. 257, 286-288. МРВ-РЕ включается в липосомальные бислои, чтобы обеспечить возможность ковалентного присоединения антитела или его фрагмента к липосомальной поверхности. Липосому нагружают ДНК или другой генетической конструкцией для доставки в клетки-мишени, например, путем образования указанных липосом в растворе ДНК или другой генетической конструкции, а затем экструзией (проталкиванием) через фильтры с поликарбонатными мембранами с размером пор 0.6 мкм и 0.2 мкм под давлением азота до 0.8 МРа. После экструзии захваченную ДНК-конструкцию отделяют от свободной ДНК-конструкции с помощью ультрацентрифугирования при 80000×g в течение 45 минут. Свежеприготовленные МРВ-РЕ-липосомы в деоксигенированном буфере смешивают со свежеприготовленным антителом (или его фрагментом) и проводят реакцию связывания в атмосфере азота при 4°С при постоянном вращении с донышка на крышку в течение ночи. Иммунолипосомы отделяют от неконъюгированных антител с помощью ультрацентрифугирования при 80000×g в течение 45 минут. Иммунолипосомы могут вводиться внутрибрюшинно или непосредственно в опухоль.
Нуклеиновая кислота, доставляемая в место-мишень, может представлять собой любую ДНК, которая приводит, прямо или опосредованно, к цитотоксичности. Например, нуклеиновая кислота может кодировать рибозим, являющийся цитотоксичным для клетки, или она может кодировать фермент, способный превращать практически нетоксичное пролекарство в цитотоксичное лекарственное средство (эта последняя система иногда называется GDEPT - геноопосредованная ферментативная пролекарственная терапия).
Рибозимы, которые могут быть закодированы нуклеиновой кислотой, предназначенной для доставки в мишень, описаны в Cech and Herschlag "Site-specific Cleavage of single stranded DNA" US 5,180,818; Altman et al "Cleavage of targeted RNA by RNAse P" US 5,168,053, Cantin et al "Ribozyme Cleavage of HIV-1 RNA" US 5,149,796; Cech et al "RNA ribozyme restriction endoribonucleases и methods", US 5,116,742; Been et al "RNA ribozyme polymerases, dephosphorylases, restriction endonucleases и methods", US 5,093,246; и Been et al "RNA ribozyme polymerases, dephosphorylases, restriction endoribonucleases и methods; cleaves single-stranded RNA at specific site by transesterification", US 4,987,071, все документы включаются в описание путем отсылки. Подходящие мишени для рибозимов включают факторы транскрипции, такие как c-fos и с-тус, и bcl-2. Durai et al (1997) Anticancer Res. 17, 3307-3312 описывает рибозим в виде головки молота против bcl-2.
ЕР 0415731 описывает систему GDEPT. Аналогичное обсуждение, касающееся выбора фермента и пролекарства, применяется к системе GDEPT, как и к системе ADEPT, описанной выше.
Нуклеиновая кислота, доставляемая в место-мишень, может кодировать непосредственно цитотоксичный полипептид.
Альтернативно, дополнительный фрагмент может содержать полипептид или полинуклеотид, кодирующий полипептид, который не является прямо или опосредованно цитотоксичным, однако оказывает терапевтическое действие. Примеры таких полипептидов включают антипролиферативные и противовоспалительные цитокины и антипролиферативные, иммуномодулирующие или влияющие на свертывание крови факторы, которые могут быть полезны в медицине, например, при лечении рака.
Дополнительный фрагмент может быть ингибитором ангиогенеза, таким как пептиды ангиостатин или эндостатин. Дополнительный фрагмент также может быть ферментом, трансформирующим полипептид-предшественник в ангиостатин или эндостатин. Человеческие матриксные металлопротеиназы, такие как эластаза макрофагов, желатиназа и стромелизин, превращают плазминоген в ангиостатин (Cornelius et al (1998) J. Immunol. 161, 6845-6852). Плазминоген является предшественником ангиостатина.
В одном варианте осуществления антитело, антигенсвязывающий фрагмент, вариант, гибрид или его фрагмент содержит цитотоксичный фрагмент, содержащий радиоактивный атом, например, радиоактивный атом, выбранный из группы, состоящей из фосфра-32; йода-125; йода-131; индия-111; рения-186; рения-188; иттрия-90.
В предпочтительном варианте осуществления изобретение предоставляет антитело, антигенсвязывающий фрагмент, вариант, гибрид или его фрагмент дополнительно содержащий легко обнаружимый фрагмент.
Термин "легко обнаружимый фрагмент" означает, что фрагмент является таким фрагментом, который после расположения его в месте-мишени после введения средства изобретения пациенту, может быть обнаружен, как правило, неинвазивно с внешней поверхности организма и места расположения места-мишени. Таким образом, средства этого варианта осуществления изобретения используются при визуализации и диагностировании.
В большинстве случаев легко обнаружимый фрагмент представляет собой или содержит радиоактивный атом, используемый при визуализации. Подходящие радиоактивные атомы включают99mTc и123I для сцинтиграфических исследований. Другие легко обнаружимые фрагменты включают, например, спиновые метки для магнитно-резонансной томографии (MRI), такие как123I,131I,111In,19F,13C,15N,17O, гадолиний, марганец или железо. Очевидно, что агент изобретения должен иметь достаточно подходящих атомных изотопов, для того, чтобы молекула была легко обнаружима.
Радиометки или другие метки могут вводиться известными способами. Например, антитело, антигенсвязывающий фрагмент, вариант, гибрид или его производное может быть синтезировано биологически или может быть синтезировано с помощью химического синтеза аминокислот с использованием подходящих предшественников аминокислот, с использованием, например, фтор-19 вместо водорода. Метки, такие как99mTc,123I,186Rh,188Rh и111In могут присоединяться, например, через остатки цистеина в полипептидах. Иттрий-90 может быть присоединен через остаток лизина. Для включения123I можно использовать метод IODOGEN (Fraker et al (1978) Biochem. Biophys. Res. Comm. 80, 49-57). Ссылка ("Monoclonal Antibodies in Immunoscintigraphy", J-F Chatal, CRC Press, 1989) подробно описывает другие методы.
Предпочтительно, легко обнаружимый фрагмент содержит радиоактивный атом, такой как, например, технеций-99m или йод-123.
Альтернативно, легко обнаружимый фрагмент можно выбрать из группы, включающей йод-123; йод-131; индий-111; фтор-19; углерод-13; азот-15; кислород-17; гадолиний, марганец, железо.
В другом предпочтительном варианте осуществления изобретения дополнительный фрагмент способен селективно связываться прямо или опосредованно с цитотоксичным фрагментом или с легко обнаружимым фрагментом. Таким образом, в этом варианте осуществления дополнительный фрагмент может быть любым фрагментом, который связывается с еще одним соединением или компонентом, являющимся цитотоксичным или легко обнаружимым.
Дополнительный фрагмент может представлять собой антитело, которое селективно связывается с дополнительным соединением или компонентом, или он может быть какой-нибудь другой связывающей молекулой, такой как стрептавидин, биотин или тому подобное. Следующие примеры иллюстрируют типы молекул, которые включаются в изобретение; другие подобные молекулы очевидны из идей, представленных в описании.
Биспецифическое антитело - это антитело, в котором один сайт связывания содержит антитело изобретения, антигенсвязывающий фрагмент, вариант, гибрид или его производное, а второй сайт связывания содержит фрагмент, который связывается, например, с ферментом, способным превратить практически нетоксичное пролекарство в цитотоксичное лекарственное средство.
Понятно, что антитела изобретения, антигенсвязывающие фрагменты, варианты, гибриды и их производные применяются как реактивы для исследования и терапевтические средства. Соответственно, антитела изобретения, антигенсвязывающие фрагменты, варианты, гибриды и их производные могут быть помечены обнаружимым образом, например, они могут быть помечены так, чтобы быть обнаружимыми прямо или опосредованно.
Удобно, когда антитела помечаются радиоактивной молекулой или окрашенной молекулой или флуоресцентной молекулой, или они могут быть связаны с ферментом. Как правило, фермент является ферментом, способным превратить неокрашенный (или нефлуоресцирующий) субстрат в окрашенный (или флуоресцирующий) продукт. Антитело может быть помечено биотином (или стрептавидином) и затем косвенно обнаружено с помощью стрептавидина (или биотина), который помечен радиоактивной молекулой, или окрашенной молекулой, или флуоресцентной молекулой, или тому подобным, или они могут быть связаны с каким-либо ферментом описанного выше типа.
Предпочтительно, легко обнаружимый фрагмент содержит радиоактивный атом, например технеций-99m или йод-123, или радиоактивный атом, выбранный из группы, состоящей из йода-123; йода-131; индия-111; фтора-19; углерода-13; азота-15; кислорода-17; гадолиния; марганца и железа.
Во втором аспекте изобретение предоставляет молекулу нуклеиновой кислоты, кодирующую антитело или антигенсвязывающий фрагмент, или вариант, гибрид или его фрагмент согласно изобретению или часть ее полипептидной цепи. Термин "молекула нуклеиновой кислоты" включает молекулы ДНК, кДНК и мРНК, которые могут быть одно- или двухцепочечными.
Предпочтительно, молекула нуклеиновой кислоты содержит одну или более нуклеотидных последовательностей, выбранных из группы, состоящей из SEQ ID NO:40; SEQ ID NO:41; SEQ ID NO:42; или SEQ ID NO:43; или SEQ ID NO:44; или SEQ ID NO:45; или SEQ ID NO:46; или SEQ ID NO:47; или SEQ ID NO:48; или SEQ ID NO:49; или SEQ ID NO:50; или SEQ ID NO:51; или SEQ ID NO:52; или SEQ ID NO:53; или SEQ ID NO:54; или SEQ ID NO:55; или SEQ ID NO:56; или SEQ ID NO:57.
Даже более предпочтительно изобретение предоставляет молекулу нуклеиновой кислоты, содержащую следующие последовательности нуклеиновых кислот:
(i) SEQ ID NO:40 и SEQ ID NO:49; или
(ii) SEQ ID NO:41 и SEQ ID NO:50; или
(iii) SEQ ID NO:42 и SEQ ID NO:52; или
(iv) SEQ ID NO:43 и SEQ ID NO:53; или
(v) SEQ ID NO:44 и SEQ ID NO:54; или
(vi) SEQ ID NO:45 и SEQ ID NO:55; или
(vii) SEQ ID NO:46 и SEQ ID NO:56; или
(viii) SEQ ID NO:47 и SEQ ID NO:57; или
(ix) SEQ ID NO:48 и SEQ ID NO:51.
В третьем аспекте изобретение предоставляет вектор, содержащий молекулу нуклеиновой кислоты в соответствии со вторым аспектом изобретения.
Предпочтительно, вектор является вектором экспрессии. Термин "вектор экспрессии" означает вектор, который способен в подходящем хозяине экспрессировать полипептид, кодированный молекулой нуклеиновой кислоты.
Такие векторы могут использоваться для экспрессирования закодированного антитела изобретения, антигенсвязывающего фрагмента, варианта, гибрида или его производного в клетке-хозяине с целью получения достаточных количеств.
Для того, чтобы функционально связать молекулы нуклеиновых кислот, в частности ДНК, с векторами, например, через комплементарные «липкие» концы, разработан целый ряд методов. Например, комплементарные гомополимерные участки могут быть добавлены к ДНК-сегменту с целью вставки в вектор ДНК. Затем вектор и ДНК-сегмент соединяются водородной связью между комплементарными гомополимерными «хвостами» с образованием рекомбинантных молекул ДНК.
Синтетические линкеры, содержащие один или более сайтов рестрикции, обеспечивают другой метод присоединения ДНК-сегмента к векторам. ДНК-сегмент, например, полученный при расщеплении рестрикционным ферментом эндонуклеазой, обрабатывают ДНК полимеразой бактериофага Т4 или ДНК полимеразой I Е. coli, ферменты, которые удаляют выступающие, 3'-однонитевые концы с их 3'-5'-экзонукеолитической активностью и «заполняют «выемки» в 3'-концах с помощью полимеразной активности.
Соответственно, комбинация этих активностей порождает сегменты ДНК с тупыми концами. Затем сегменты с тупыми концами инкубируют с большим молярным избытком линкерных молекул в присутствии фермента, способного катализировать лигирование молекул ДНК с тупыми концами, такого как ДНК лигаза бактериофага Т4. Таким образом, продукты реакции представляют собой ДНК-сегменты, несущие полимерные линкерные последовательности на своих концах. Затем эти сегменты ДНК расщепляются соответствующим рестрикционным ферментом и лигируются с вектором экспрессии, который расщепляется ферментом, который обеспечивает концы, соответствующие концам ДНК-сегмента.
Синтетические линкеры, содержащие различные сайты рестрикционной эндонуклеазы, являются коммерчески доступными от ряда источников, включая International Biotechnologies Inc., New Haven, CN, США.
Желательным способом модификации ДНК, кодирующей полипептид, является использование ПЦР. Этот метод может использоваться для введения ДНК в подходящий вектор, например, путем конструирования в подходящие сайты рестрикции, или он может использоваться для видоизменения ДНК другими подходящими способами, известными в данной области техники.
В этом методе ДНК, предназначенная для амплифицирования ферментным путем, фланкируется двумя специфическими праймерами, которые сами становятся включенными в амплифицированную ДНК. Специфические праймеры могут содержать сайты, распознаваемые рестрикционной эндонуклеазой, которые могут использоваться для клонирования в векторы экспрессии с помощью известных в данной области техники методов.
Затем ДНК (или в случае ретровирусных векторов РНК) экспрессируется в подходящем хозяине для получения полипептида, содержащего средство изобретения. Таким образом, ДНК, кодирующая полипептид, может использоваться в соответствии с известными методами, соответствующим образом модифицированными с учетом идей, приведенных в настоящем документе, для создания вектора экспрессии, который затем используется для трансформации подходящей клетки-хозяина с целью экспрессии и выработки полипептида. Такие методы включают методы, описанные в патенте США №4,440,859, выданном 3 апреля 1984 Rutter et al, патенте 4,530,901, выданном 23 июля 1985 Weissman, патенте 4,582,800, выданном 15 апреля 1986 Crowl, патенте 4,677,063, выданном 30 июня 1987 Mark et al, 4,678,751, выданном 7 июля 1987 Goeddel, патенте 4,704,362, выданном 3 ноября 1987 Itakura et al, патенте 4,710,463, выданном 1 декабря 1987 Murray, патенте 4,757,006, выданном 12 июля 1988 Toole, Jr. et al, патенте 4,766,075 выданном 23 августа 1988 Goeddel et al и патенте 4,810,648, выданном 7 марта 1989 Stalker, все они включаются в описание путем отсылки.
ДНК (или в случае ретровирусных векторов, РНК), кодирующая полипептид, может соединяться с целым рядом других последовательностей ДНК для введения соответствующему хозяину. Сопутствующая ДНК будет зависеть от природы хозяина, способа введения ДНК хозяину, и от того, является ли желательным сохранение в виде эписомы или слияние с геномом.
В общем, ДНК вставляется в вектор экспрессии, например, плазмиду, в правильной ориентации и с соответствующей рамкой считывания для экспрессии. Если необходимо, ДНК может быть связана с подходящими регуляторными нуклеотидными последовательностями, контролирующими транскрипцию и трансляцию, распознаваемыми желательным хозяином, хотя такие средства контроля обычно имеются в векторе экспрессии. Затем вектор вводится хозяину с помощью стандартных методов. Как правило, не все из хозяев будут трансформироваться вектором. Поэтому необходимо выбирать клетки-хозяева для трансформации. Один способ отбора затрагивает включение в вектор экспрессии последовательности ДНК с любыми необходимыми контрольными элементами, которая кодирует выбираемое свойство (признак) в трансформированной клетке, например, устойчивость к антибиотику. Альтернативно, ген такого выбираемого свойства может располагаться на другом векторе, который используется для совместной трансформации желательной клетки-хозяина.
Затем клетки-хозяева, трансформированные вектором экспрессии изобретения, культивируют в течение достаточного времени и в соответствующих условиях, известных специалистам в данной области техники, принимая во внимание раскрытые в описании идеи, чтобы дать возможность экспрессии полипептида, который затем может быть извлечен.
Известны многие системы экспрессии, включая бактерии (например, Escherichia coli и Bacillus subtilis), дрожжи (например, Saccharomyces cerevisiae), мицелиальные грибы (например, Aspergillus), растительные клетки, животные клетки и клетки насекомых.
Как правило, векторы включают прокариотический репликон, такой как ColEl ori, для воспроизведения в прокариотах, даже если вектор используется для экспрессии в других непрокариотических типах клеток. Векторы также могут включать подходящий промотор, такой как прокариотический промотор, способный направлять экспрессию (транскрипцию и трансляцию) генов в бактериальной клетке-хозяине, такой как Е. coli, трансформированной с их использованием.
Промотор представляет собой контролирующий экспрессию элемент, образованный последовательностью ДНК, которая обеспечивает возможность связывания РНК-полимеразы и осуществления транскрипции. Промоторные последовательности, предназначенные для работы с типичными бактериальными хозяевами, как правило, предоставляются в плазмидных векторах, содержащих удобные сайты рестрикции для вставки ДНК-сегмента настоящего изобретения.
Типичными прокариотическими векторными плазмидами являются pUC18, pUC19, pBR322 и pBR329, доступные от компании Biorad Laboratories, (Ричмонд, Калифорния, США) и pTrc99A и рКК223-3, доступные от компании Pharmacia (Piscataway, Нью-Джерси, США).
Типичной векторной плазмидой клеток млекопитающих является pSVL, доступная от компании Pharmacia (Piscataway, Нью-Джерси, США). Этот вектор использует поздний промотор SV40 для управления экспрессией клонированных генов, самый высокий уровень экспрессии обнаружен в клетках, продуцирующих Т-антиген, таких как COS-1 клетки.
Примером индуцибельного вектора экспрессии млекопитающих является pMSG, также доступный от компании Pharmacia. Этот вектор использует глюкокортикоид-индуцибельный промотор длинного концевого повтора вируса опухоли молочной железы мыши для управления экспрессией клонированного гена.
Подходящими плазмидными векторами дрожжей являются pRS403-406 и pRS413-416, доступные от компании Stratagene Cloning Systems (La Jolla, CA 92037, США). Плазмиды pRS403, pRS404, pRS405 и pRS406 представляют собой дрожжевые интегративные плазмиды (YIps) и включают селектируемые маркеры дрожжей HIS3, TRP1, LEU2 и URA3. Плазмиды pRS413-416 представляют собой центромерные плазмиды дрожжей (Ycps).
Другие векторы и системы экспрессии, предназначенные для использования с целым рядом клеток-хозяев, хорошо известны в данной области техники.
В четвертом аспекте изобретение предоставляет рекомбинантную клетку-хозяина, содержащую молекулу нуклеиновой кислоты согласно второму аспекту изобретения или вектор согласно третьему аспекту изобретения.
Предпочтительно, клетка-хозяин представляет собой бактериальную клетку или является клеткой млекопитающего, такой как человеческая клетка.
Клетка-хозяин может быть или прокариотической или эукариотической. Предпочтительными прокариотическими клетками-хозяевами являются бактериальные клетки, как правило, штамм Е. coli, например, штаммы DH5 Е. coli, доступные от компании Bethesda Research Laboratories Inc.(Bethesda, Мэриленд, США), и RR1, доступный от Американской коллекции типовых культур (АТСС) Роквилл, Мэриленд, США (№АТСС 31343). Предпочтительные эукариотические клетки включают клетки дрожжей, насекомых и клетки млекопитающих, предпочтительно клетки позвоночных, такие как клетки мыши, крысы, обезьяны или фибробласты человека и линии клеток почки. Дрожжевые клетки-хозяева включают YPH499, YPH500 и YPH501, которые доступны от компании Stratagene Cloning Systems, La Jolla, CA 92037, США. Предпочтительные клетки-хозяева млекопитающих включают клетки яичника китайского хомячка (СНО), доступные от АТСС, такие как клетки CRL 1658 и 293, являющиеся клетками почки эмбриона человека. Предпочтительными клетками насекомых являются клетки Sf9, которые могут быть трансфицированы бакуловирусными векторами экспрессии.
Трансформацию подходящих клеток-хозяев ДНК-конструктом настоящего изобретения осуществляют хорошо известными методами, которые в большинстве случаев зависят от типа используемого вектора. По поводу трансформации прокариотических клеток-хозяев смотри, например, Cohen et al (1972) Proc. Natl. Acad. Sci. USA 69, 2110 и Sambrook et al (1989) Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY. Трансформация дрожжевых клеток описана в Sherman et al (1986) Methods In Yeast Genetics, A Laboratory Manual, Cold Spring Harbor, NY. Также используется метод Beggs (1978) Nature 275, 104-109. Клетки позвоночных, реактивы, используемые при трансфицировании таких клеток, например, фосфат кальция и DEAE-декстран, или липосомальные композиции доступны от компаний Stratagene Cloning Systems или Life Technologies Inc., Gaithersburg, MD 20877, США.
Для трансформации и/или трансфекции клеток также используется метод электропорации, широко применяемый в данной области техники для трансформации дрожжевых клеток, бактериальных клеток, клеток насекомых и позвоночных.
Например, многие виды бактерий могут быть трансформированы с помощью методов, описанных в работе Luchansky et al (1988) Mol. Microbiol. 2, 637-646, включенной в описание путем отсылки. Наибольшее число трансформированных клеток стабильно получают после электропорации смеси ДНК-клетки, суспендированной в 2.5 РЕВ с использованием 6250V на см при 25 μFD.
Методы трансформации дрожжей с помощью электропорации раскрываются в Becker & Guarente (1990) Methods Enzymol. 194, 182.
Успешно трансформированные клетки, т.е. клетки, содержащие ДНК-конструкт настоящего изобретения, могут быть идентифицированы с помощью хорошо известных методов. Например, клетки, полученные в результате введения экспрессирующего конструкта настоящего изобретения, можно выращивать с целью продуцирования полипептида изобретения. Клетки можно собрать и лизировать, а содержание ДНК проверить на присутствие ДНК, например, с помощью метода, описанного Southern (1975) J. Mol. Biol. 98, 503 или Berent et al (1985) Biotech. 3, 208. Альтернативно, может быть определено наличие белка в супернатанте с помощью антител, как описано ниже.
В дополнение к прямому анализу на присутствие рекомбинантной ДНК успешная трансформация может быть подтверждена с помощью хорошо известных иммунологических методов, когда рекомбинантная ДНК способна управлять экспрессией белка. Например, клетки, успешно трансформированные вектором экспрессии, продуцируют белки, показывающие соответствующие антигенные свойства.
Образцы предположительно трансформированных клеток собирают и исследуют на белок с помощью подходящих антител.
Клетка-хозяин может быть клеткой организма животного, не являющегося человеком. Таким образом, включаются трансгенные животные, не являющиеся человеком, экспрессирующие средство (агент) согласно изобретению (или его связывающий фрагмент) благодаря наличию трансгена. Предпочтительно, трансгенное животное, не являющееся человеком, является грызуном, например, мышью. Трансгенное животное, не являющееся человеком, может быть получено с помощью хорошо известных в данной области техники методов.
В пятом аспекте изобретение предоставляет фармацевтическую композицию, содержащую эффективное количество антитела изобретения или антигенсвязывающего фрагмента, или варианта, гибрида или его производного и фармацевтически приемлемый буфер, эксципиент, разбавитель или носитель.
Использованный в описании термин 'терапевтически эффективное количество' или 'эффективное количество' или 'терапевтически эффективное' имеет отношение к количеству, которое обеспечивает терапевтическое действие в отношении данного состояния и режима введения. Речь идет о заранее установленном количестве активного антитела, вычисленного с целью получения желательного терапевтического эффекта, в сочетании с необходимым вспомогательным веществом и разбавителем, т.е. носителем или наполнителем для введения. Кроме того, термин предназначается для обозначения количества, достаточного для уменьшения или предотвращения клинически значимой недостаточности активности, функционирования и ответа хозяина. Альтернативно, терапевтически эффективное количество является достаточным для того, чтобы вызвать улучшение клинически значимого состояния у хозяина. Специалистам понятно, что количество соединения может варьировать в зависимости от его специфической активности. Подходящие размеры дозировки могут включать предопределенное количество активной композиции, подсчитанное с целью получения желательного терапевтического эффекта, в сочетании с необходимым разбавителем.
Терапевтически эффективное количество может быть определено медицинским работником или ветеринаром, исходя из характерных особенностей пациента, таких как возраст, вес, пол, состояние, осложнения, другие заболевания и т.д., как хорошо известно в данной области техники.
Таким образом, антитело или антигенсвязывающий фрагмент, вариант, гибрид или его производное может быть заключено в состав в различных концентрациях в зависимости от эффективности/токсичности используемого полипептида. Предпочтительно, композиция содержит активный полипептид в концентрации между 0.1 мкМ и 1 мкМ, например между 1 мкМ и 500 мкМ, между 500 мкМ и 1 мМ или между 300 мкМ и 700 мкМ.
Термин "фармацевтически приемлемый" подразумевает, что композиция является стерильной и апирогенной. Подходящие фармацевтические носители хорошо известны в области фармацевтики. Носитель(и) должны быть "приемлемыми" в том смысле, что они должны быть совместимыми с антителом изобретения и не вредными для реципиентов. В большинстве случаев носители являются водой или физиологическим раствором, стерильным и апирогенным; однако, могут использоваться другие приемлемые носители.
Подходящие фармацевтически приемлемые буферы, разбавители, носители и эксципиенты хорошо известны в данной области техники (смотри Remington's Pharmaceutical Sciences, 18th edition, A.R Gennaro, Ed., Mack Publishing Company (1990) и справочник Pharmaceutical Excipients, 3rd edition, A. Kibbe, Ed., Pharmaceutical Press (2000), раскрытия которых полностью включаются в описание путем отсылки).
Термин "буфер" включает водный раствор, содержащий кислотно-основную смесь, предназначенный для стабилизации значения рН. Примерами буферов являются Trizma, Бицин, Трицин, MOPS, MOPSO, MOBS, Tris, Hepes, HEPBS, MES, фосфат, карбонат, ацетат, цитрат, гликолят, лактат, борат, ACES, ADA, тартрат, AMP, AMPD, AMPSO, BES, CABS, какодилат, CHES, DIPSO, EPPS, этаноламин, глицин, HEPPSO, имидазол, имидазолмолочная кислота, PIPES, SSC, SSPE, POPSO, TAPS, TABS, TAPSO и TES.
Термин "разбавитель" включает водный или неводный раствор, предназначенный для разбавления средства (агента) в фармацевтическом препарате. Разбавитель может быть одним или более из числа физиологического раствора, воды, полиэтиленгликоля, пропиленгликоля, этанола или масел (таких как сафлоровое масло, кукурузное масло, арахисовое масло, хлопковое масло или кунжутное масло).
Термин "адьювант (вспомогательное средство)" включает какое-либо соединение, добавленное к композиции для увеличения биологического эффекта средства изобретения. Адьювантом может быть одна или более из солей цинка, меди или серебра с разными анионами, например, но не ограничиваясь этим, фторид, хлорид, бромид, иодид, тиоцианат, сульфит, гидроксид, фосфат, карбонат, лактат, гликолят, цитрат, борат, тартрат и ацетаты различных ацильных композиций. Адьювантом также могут быть катионные полимеры, такие как катионные сложные эфиры целлюлозы, катионные простые эфиры целлюлозы, деацетилированная гиалуроновая кислота, хитозан, катионные дендримеры, катионные синтетические полимеры, такие как поли(винилимидазол), и катионные полипептиды, такие как полигистидин, полиаргинин, и пептиды, содержащие эти аминокислоты.
Эксципиентом может быть один или более из углеводородов, полимеров, липидов и минералов. Примеры углеводородов включают лактозу, глюкозу, сахарозу, маннитол и циклодестрины, которые добавляют к композиции, например, с целью облегчения лиофилизации. Примерами полимеров являются крахмал, эфиры целлюлозы, целлюлоза, карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, этилгидроксиэтилцеллюлоза, альгинаты, каррагинан, гиалуроновая кислота и ее производные, полиакриловая кислота, полисульфонат, полиэтиленгликоль /полиэтиленоксид, сополимеры полиэтиленоксида и полипропиленоксида, поливиниловый спирт/поливинилацетат разной степени гидролиза и поливинилпирролидон, все с разной молекулярной массой, которые добавляются к композиции, например, с целью контролирования вязкости, для достижения биоадгезии или для защиты липида от химического или протеолитического расщепления. Примерами липидов являются жирные кислоты, фосфолипиды, моно-, ди- и триглицериды, церамиды, сфинголипиды и гликолипиды, все с разной длиной ацильной цепи и насыщением, лецитин яиц, лецитин сои, гидрогенизированный лецитин яиц и сои, которые добавляются к композиции по причинам, сходным с причинами для добавления полимеров. Примерами минералов являются тальк, оксид магния, оксид цинка и оксид титана, которые добавляются к композиции с целью получения пользы, например, уменьшения накопления жидкости или предпочтительных пигментных свойств.
Активные средства изобретения на основе антител могут заключаться в состав фармацевтической композиции любого типа, известного в данной области техники и подходящего для их доставки.
В одном варианте осуществления фармацевтические композиции изобретения могут иметь форму липосом, в которых агент (средство) объединен, в дополнение к другим фармацевтически приемлемым носителям, с амфипатическими средствами, такими как липиды, находящиеся в агрегированных формах, таких как мицеллы, нерастворимые монослои и жидкие кристаллы. Подходящие липиды для липосомальной композиции включают, без ограничения, моноглицериды, диглицериды, сульфатиды, лизолецитин, фосфолипиды, сапонин, желчные кислоты и тому подобное. Подходящие липиды также включают перечисленные выше липиды, модифицированные поли(этиленгликолем) в полярных головках с целью увеличения времени циркуляции в кровотоке. Приготовление таких липосомальных композиций можно найти, например, в США 4,235,871, раскрытие которого включается в описание путем отсылки.
Фармацевтические композиции изобретения также могут иметь форму биодеградируемых микросфер. Алифатические полиэфиры, такие как поли(молочная кислота) (PLA), поли(гликолиевая кислота) (PGA), сополимеры PLA и PGA (PLGA) или поли(капролактоны) (PCL), и полиангидриды широко используются в качестве биодеградируемых полимеров в производстве микросфер. Получение таких микросфер можно найти в США 5,851,451 и в ЕР 0213303, раскрытия которых включаются в описание путем отсылки.
В дополнительном варианте осуществления фармацевтические композиции изобретения предоставляются в форме полимерных гелей, при этом полимеры, такие как крахмал, эфиры целлюлозы, карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, этилгидроксиэтилцеллюлоза, альгинаты, каррагенаны, гиалуроновая кислота и ее производные, полиакриловая кислота, поливинилимидазол, полисульфонат, полиэтиленгликоль/полиэтиленоксид, сополимеры полиэтиленоксида и полипропиленоксида, поливиниловый спирт/поливинилацетат разной степени гидролиза и поливинилпирролидон, используются для загустения раствора, содержащего средство изобретения. Полимеры также могут включать желатин или коллаген.
Альтернативно, средства могут быть просто растворены в физиологическом растворе, воде, полиэтиленгликоле, пропиленгликоле, этаноле или маслах (таких как сафлоровое масло, кукурузное масло, хлопковое масло или кунжутное масло), трагакантовой камеди и/или различных буферах.
Следует понимать, что фармацевтические композиции изобретения могут включать ионы и иметь определенное значение рН для усиления действия активного вещества (агента). Кроме того, композиции могут подвергаться обычным фармацевтическим процедурам, таким как стерилизация, и/или могут содержать обычные вспомогательные средства (адьюванты), такие как консервирующие вещества, стабилизаторы, увлажняющие вещества, эмульгаторы, буферы, наполнители и т.д.
Фармацевтические композиции согласно изобретению могут вводиться любым подходящим способом, известным специалистам в данной области техники. Поэтому возможные способы введения включают парентеральный (внутривенный, подкожный и внутримышечный), местный, окулярный, назальный, легочный, щечный, пероральный, вагинальный и ректальный. Также возможно введение из имплантатов.
Удобно, когда фармацевтическая композиция пригодна для введения в или около места локализации опухоли, например, внутритуморально или перитуморально.
Предпочтительно, фармацевтическая композиция пригодна для парентерального введения. Методы включения антитела в состав фармацевтической композиции хорошо известны специалистам в области медицины и фармацевтики. Предпочтительные композиции описаны в сопутствующих Примерах.
Средства (т.е. антитело, антигенсвязывающий фрагмент, вариант, гибрид или его производное), медикаменты и фармацевтические композиции изобретения могут доставляться с помощью инъецируемой системы доставки лекарственных средств с замедленным высвобождением. Такие системы специально разрабатываются с целью уменьшения частоты инъекций. Примером такой системы является система Nutropin Depot, в которой рекомбинантный гормон роста человека (rhGH) инкапсулирован в биодеградируемые микросферы, после их введения rhGH медленно высвобождается в течение длительного периода времени. Предпочтительно, доставка осуществляется внутримышечно (i.m.) и/или подкожно (s.c.) и/или внутривенно (i.v.).
Средства, медикаменты и фармацевтические композиции изобретения могут вводиться при помощи имплантированного хирургическим путем устройства, которое высвобождает лекарственное средство непосредственно в нужное место. Например, Vitrasert высвобождает ганцикловир непосредственно в глаз при лечении CMV ретинита. Прямое применение этого токсичного препарата в месте локализации заболевания обеспечивает эффективное лечение без существенных системных побочных действий лекарственного средства.
Для введения средств, медикаментов и фармацевтических композиций изобретения также могут использоваться системы для терапии с электропорацией (ЕРТ). Устройство, обеспечивающее воздействие импульсного электрического поля на клетки, увеличивает проницаемость клеточных мембран для лекарственного средства, что приводит к значительному увеличению внутриклеточной доставки лекарственного средства.
Средства, медикаменты и фармацевтические композиции изобретения также могут доставляться путем электро-включения (EI). EI происходит в том случае, когда на поверхности кожи небольшие частицы до 30 микрон в диаметре подвергаются воздействию электрических импульсов, одинаковых или подобных импульсам, использованным при электропорации. При EI эти частицы проходят через роговой слой в более глубокие слои кожи. Такие частицы могут быть нагружены или покрыты лекарственными средствами или генами или могут просто действовать как "пули", образующие поры в коже, через которые может «входить» лекарственное средство.
Альтернативным методом доставки средств, медикаментов и фармацевтических композиций изобретения является термочувствительная инъекционная система ReGel. При температуре ниже температуры тела ReGel представляет собой инъецируемую жидкость, тогда как при температуре тела она тотчас же образует резервуар с гелем, который медленно разрушается и растворяется в известных, безопасных, биодеградируемых полимерах. Активное вещество доставляется в течение некоторого периода времени по мере того как биополимеры растворяются.
Средства, медикаменты и фармацевтические композиции изобретения также могут доставляться перорально. При этом используется естественный процесс перорального потребления витамина B12 и/или витамина D в организме для совместной доставки белков и пептидов. Используя систему поглощения витамина B12 и/или витамина D, средства, медикаменты и фармацевтические композиции изобретения могут проходить через стенку кишечника. Синтезированы комплексы между аналогами витамина В12 и/или аналогами витамина D и лекарственным средством, сохраняющие значительную аффинность в отношении внутреннего фактора (IF) в участке витамина В12/участке витамина D комплекса и существенную биоактивность активного вещества комплекса.
Средства, медикаменты и фармацевтические композиции изобретения могут вводиться в клетки с помощью "троянских пептидов". Это класс полипептидов, называемых пенетратинами, которые обладают способностью к перемещению и способны переносить гидрофильные соединения через цитоплазматическую мембрану. Эта система обеспечивает возможность прямого нацеливания олигопептидов на цитоплазму и ядро, и может быть неспецифичной в отношении типа клеток и высокоэффективной. Смотри Derossi et al. (1998), Trends Cell Biol. 8, 84-87.
Предпочтительно, медикаменты и/или фармацевтические композиции настоящего изобретения представляют собой дозированную лекарственную форму, содержащую ежедневную дозу или единицу, ежедневную субдозу или соответствующую фракцию активного ингредиента.
Средства, медикаменты и фармацевтические композиции изобретения, как правило, вводятся перорально или любым парентеральным способом, в форме фармацевтической композиции, содержащей активный ингредиент, необязательно в виде нетоксичной органической или неорганической соли присоединения кислоты или основания, в фармацевтически приемлемой лекарственной форме. В зависимости от заболевания и пациента, нуждающегося в лечении, а также способа введения, композиции могут вводиться в разных дозировках.
При лечении человека средства, медикаменты и фармацевтические композиции изобретения могут вводиться отдельно, но в большинстве случаев вводятся в смеси с подходящим фармацевтическим эксципиентом, разбавителем или носителем, выбранным с учетом предполагаемого способа введения и общепринятой фармацевтической практики.
Например, средства, медикаменты и фармацевтические композиции изобретения могут вводиться пероральным, щечным или подъязычным путем в форме таблеток, капсул, вагинальных суппозиториев, эликсиров, растворов или суспензий, которые могут содержать вкусовые или окрашивающие вещества, с немедленным, длительным или контролируемым высвобождением. Кроме того, средства, медикаменты и фармацевтические композиции изобретения могут вводиться посредством интракавернозного введения.
Таблетки могут содержать эксципиенты, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция, двухосновной фосфат кальция и глицин, разрыхлители, такие как крахмал (предпочтительно кукурузный, картофельный или маниоковый крахмал), натрий крахмал гликолят, кроскармеллоза натрия и некоторые комплексные силикаты и гранулированные связующие вещества, такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (НРМС), гидрокси-пропилцеллюлоза (НРС), сахароза, желатин и гуммиарабик. Кроме того, в состав могут быть включены смазывающие вещества, такие как стеарат магния, стеариновая кислота, глицерил бегенат и тальк.
Твердые композиции подобного типа также могут использоваться в качестве наполнителя в желатиновой капсуле. Предпочтительные эксципиенты включают лактозу, крахмал, целлюлозу, молочный сахар или полиэтиленгликоли с высокой молекулярной массой. Для применения в виде водных суспензий и/или эликсиров средства, медикаменты и фармацевтические композиции изобретения могут быть объединены с различными подсластителями или вкусовыми веществами, красящими веществами или красителями, с эмульгирующими и/или суспендирующими веществами и с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин и их комбинации.
Средства, медикаменты и фармацевтические композиции изобретения могут быть введены парентерально, например, внутривенно, внутриартериально, внутрибрюшинно, внутриоболочечно, внутрь желудочков, внутригрудинно, внутрь черепа, внутримышечно или подкожно, или они могут быть введены с помощью вливаний. Наиболее оптимальным является их использование в виде стерильных водных растворов, которые могут содержать другие вещества, например, достаточное количество солей или глюкозы для получения изотонического с кровью раствора. Водные растворы должны быть соответствующим образом забуферены (предпочтительно до значения рН от 3 до 9), по необходимости. Приготовление соответствующих стерильных парентеральных композиций легко осуществляется с помощью стандартных фармацевтических методов, хорошо известных в данной области техники.
Медикаменты и фармацевтические композиции, пригодные для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические средства и растворенные вещества, которые приводят композиции в изотоническое состояние с кровью назначенного реципиента, и водные и неводные стерильные суспензии, которые могут включать суспендирующие средства и загустители. Медикаменты и фармацевтические композиции могут находиться в однодозных или многодозных контейнерах, например, закупоренных ампулах и флаконах, и могут храниться в высушенном сублимацией (лиофилизированном) состоянии, нуждаясь только в добавлении стерильного жидкого носителя, например, воды для инъекций, непосредственно перед использованием. Инъекционные растворы и суспензии для немедленного приема могут быть приготовлены из стерильных порошков, гранул и таблеток, типа описанных ранее.
Средства, медикаменты и фармацевтические композиции изобретения также могут быть введены интраназально или с помощью ингаляции, при этом они могут удобно доставляться в виде порошка или аэрозоля из герметичного контейнера, пульверизатора или небулайзера с помощью подходящего пропеллента (распыляющего вещества), например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан (HFA 134A3 или 1,1,1,2,3,3,3-гептафторпропан (HFA 227EA3), двуокиси углерода или другого подходящего газа. В случае герметичных аэрозольных баллонов единица дозирования обеспечивается клапаном для доставки дозированного количества. Герметичный контейнер, пульверизатор или небулайзер может содержать раствор или суспензию активного средства, например, с использованием смеси этанола и пропеллента в качестве растворителя, при этом он может дополнительно содержать смазывающее вещество, например, сорбитан триолеат. Капсулы и картриджи (изготовленные, например, из желатина), предназначенные для использования в ингаляторе или инсуффляторе (порошковдувателе), могут содержать порошкообразную смесь средства изобретения и подходящей порошкообразной основы, такой как лактоза или крахмал.
Альтернативно, средства, медикаменты и фармацевтические композиции изобретения могут вводиться в виде суппозиториев или пессариев, или они могут использоваться местно в форме лосьона, раствора, крема, геля, мази или присыпки. Средства, медикаменты и фармацевтические композиции изобретения также могут быть введены чрескожно, например, с помощью чрескожного пластыря. Кроме того, они могут быть введены окулярным способом, в частности для лечения заболеваний глаз.
Для офтальмологического использования средства, медикаменты и фармацевтические композиции изобретения могут быть созданы в виде микронизированных суспензий в изотоническом, стерильном физиологическом растворе с отрегулированным значением рН или, предпочтительно, в виде растворов в изотоническом, стерильном физиологическом растворе с отрегулированным значением рН, необязательно в комбинации с консервантом, таким как бензалкония хлорид. Альтернативно, они могут быть созданы в виде мази, такой как вазелин.
Для местного применения на коже средства, медикаменты и фармацевтические композиции изобретения могут быть созданы в виде подходящей мази, содержащей активное вещество, суспендированное или растворенное, например, в смеси с одним или более из числа минерального масла, жидкого вазелина, медицинского (белого) вазелина, пропиленгликоля, полиоксиэтилен-полиоксипропилена, эмульгированного воска и воды. Альтернативно, они могут быть созданы в виде лосьона или крема, суспендированного или растворенного, например, в смеси с одним или более из следующего: минерального масла, сорбитмоностеарата, полиэтиленгликоля, жидкого парафина, полисорбата 60, воска цетиловых эфиров, цетеарилового спирта, 2-октилдодеканола, бензилового спирта и воды.
Композиции, подходящие для местного применения во рту, включают леденцы, содержащие активный ингредиент в ароматизированной основе, обычно сахарозе и гуммиарабике или трагакантовой камеди; пастилки, содержащие активный ингредиент в нейтральной основе, такой как желатин и глицерин, или сахароза и гуммиарабик; и жидкости для полоскания рта, содержащие активный ингредиент в подходящем жидком носителе.
В основном, предпочтительным способом введения людям является местное введение средств, медикаментов и фармацевтических композиций изобретения в место локализации или около места локализации опухоли, в частности интратуморальное или перитуморальное введение.
Что касается применения в ветеринарии, средства, медикаменты и фармацевтические композиции изобретения вводятся в виде подходящей композиции в соответствии с общепринятой ветеринарной практикой, причем ветеринарный врач будет определять режим дозирования и способ введения, который будет наиболее приемлемым для конкретного животного.
В шестом аспекте изобретение предоставляет набор, содержащий фармацевтическую композицию согласно пятому аспекту изобретения.
В седьмом аспекте изобретение предоставляет антитело или антигенсвязывающий фрагмент, или вариант, гибрид или его производное согласно первому аспекту изобретения, или молекулу нуклеиновой кислоты согласно второму аспекту изобретения, или вектор согласно третьему аспекту изобретения, или клетку-хозяина согласно четвертому аспекту изобретения, или фармацевтическую композицию согласно пятому аспекту изобретения для использования в медицине.
В восьмом аспекте изобретение предоставляет антитело или антигенсвязывающий фрагмент, или вариант, гибрид или его производное согласно первому аспекту изобретения, или молекулу нуклеиновой кислоты согласно второму аспекту изобретения, или вектор согласно третьему аспекту изобретения, или клетку-хозяина согласно четвертому аспекту изобретения, или фармацевтическую композицию согласно пятому аспекту изобретения для использования при лечении рака.
В девятом аспекте изобретение предоставляет антитело или антигенсвязывающий фрагмент, или вариант, гибрид или его производное согласно первому аспекту изобретения, или молекулу нуклеиновой кислоты согласно второму аспекту изобретения, или вектор согласно третьему аспекту изобретения, или клетку-хозяина согласно четвертому аспекту изобретения, или фармацевтическую композицию согласно пятому аспекту изобретения для использования в производстве медикамента для лечения рака.
Предпочтительно, в седьмом и/или восьмом и/или девятом аспектах изобретения лечение рака включает стадию введения эффективного количества антитела или антигенсвязывающего фрагмента, или варианта, гибрида или его производного или молекулы нуклеиновой кислоты или вектора или клетки-хозяина или фармацевтической композиции индивидууму, нуждающемуся в этом.
В десятом аспекте изобретение предоставляет способ лечения индивидуума, больного раком, причем данный метод включает стадию введения индивидууму, нуждающемуся в этом, эффективного количества антитела или антигенсвязывающего фрагмента, или варианта, гибрида или его производного, согласно первому аспекту изобретения, или нуклеиновой кислоты согласно второму аспекту изобретения, или вектора согласно третьему аспекту изобретения, или клетки-хозяина согласно четвертому аспекту изобретения, или фармацевтической композиции согласно пятому аспекту изобретения.
Предпочтительно, что в седьмом и/или восьмом и/или девятом и/или десятом аспектах изобретения стадия введения индивидууму, нуждающемуся в этом, включает локальное введение, например, локальное введение в опухоль у пациента (например, внутритуморально или перитуморально).
Известно, что такая локальная инъекция в опухоль анти-CD40-антитела может порождать системный противоопухолевый эффект при очень низкой дозе (van Mierlo et al., 2002, Proc Nati Acad Sci USA, 99:5561-5566; Kalbasi et al., 2010, J Immunotherapy, 33:810-816). Более того, сообщалось, что при лечении мышей интратуморально в один бок, наблюдалось устранение опухолей в противоположном боку, и что противоопухолевый эффект зависит от активации дендритных клеток и последующей активации ответа цитотоксическими Т-лимфоцитами. В дополнение к этому, лечение вызывало защитный иммунитет против повторного появления опухоли.
После персонифицированной оптимизации дозы антитела или антигенсвязывающего фрагмента, или варианта, гибрида или его производного, как описано выше, пациенту вводят максимальную терапевтическую дозу в течение всего периода лечения. Однако, следует понимать, что доза может быть уменьшена с течением времени, как только лечение начинает давать необходимый терапевтический эффект.
В большинстве случаев терапевтическая доза антитела или антигенсвязывающего фрагмента, или варианта, гибрида или его производного для пациента-человека будет находиться в пределах от 100 мкг до 700 мг на введение (исходя из веса тела 70 кг).
Например, максимальная терапевтическая доза может составлять в пределах от 0,1 до 10 мг/кг на введение, например, между 0,1 и 5 мг/кг или между 1 и 5 мг/кг или между 0,1 и 2 мг/кг. Следует понимать, что такая доза может вводиться с разными интервалами, которые определяет онколог/терапевт; например, доза может вводиться ежедневно, два раза в неделю, еженедельно, раз в две недели или ежемесячно.
В одном варианте осуществления максимальная терапевтическая доза антитела или антигенсвязывающего фрагмента, или варианта, гибрида или его производного является низкой дозой. Например, доза, предназначенная для локального введения и необходимая для получения терапевтического эффекта в данном изобретении, может составлять менее чем 25% от типичной системной дозы того же самого средства. В одном варианте осуществления доза равна или меньше чем 1 мг на введение, например, равна или меньше чем 500 мкг, 400 мкг, 300 мкг, 200 мкг, 100 мкг, 50 мкг, 30 мкг, 20 мкг, 10 мкг, 5 мкг или 1 мкг на введение. Следует понимать, что такие дозы могут повторно вводиться пациенту в течение некоторого времени, например, два раза в день, один раз в день, один раз в два дня, два раза в неделю, один раз в неделю, два раза в месяц, один раз в месяц и т.д.).
В одном варианте осуществления средство(а) на основе антител используется для введения в дозе от 10 мкг до 100 мкг на одно введение.
Например, средство(а) на основе антител может использоваться для введения в дозе от 20 мкг до 40 мкг на одно введение, например 30 мкг на введение.
В одном варианте осуществления средство(а) на основе антител способно(ы) обеспечить системный противоопухолевый эффект. Такой системный противоопухолевый эффект может быть достигнут, даже если терапия проводится локально/внутритуморально. При локальном введении иммунотерапевтических антител, например, с помощью внутриопухолевых инъекций, CD40 терапия нацеливается только на клетки в области опухоли. Следовательно, на уровень CD40 активации оказывает влияние только концентрация CD40 агониста в участке ткани, где, как предполагается, он оказывает свое действие. При местном введении оптимальная доза может определяться объемом участка ткани, имеющим отношение к лечению, а не весом тела пациента. При лечении внутритуморально вместо этого объема доза будет определяться объемом опухоли. Таким образом, соответствующая общая доза может быть более низкой, чем для системного лечения, и может определяться на основе диагностирования опухоли с использованием позитронно-эмиссионного сканирования (PET) или других методов визуализации, а не по весу пациента.
Следует понимать, что средства изобретения на основе антител пригодны для применения при лечении любого типа рака, при котором активация CD40 может обеспечить терапевтическую пользу.
Например, рак может быть выбран из группы, состоящей из рака предстательной железы, рака молочной железы, колоректального рака, рака поджелудочной железы, рака яичника, рака легких, рака шейки матки, рабдомиосаркомы, нейробластомы, множественной миеломы, лейкоза, острого лимфобластного лейкоза, меланомы, рака мочевого пузыря и глиобластомы.
В одном варианте осуществления рак связан с CD40+опухолевыми клетками. Однако, средства изобретения на основе антител также могут использоваться при лечении видов рака, связанных с CD40- опухолевыми клетками.
Кроме того, понятно, что средства изобретения на основе антител также могут использоваться в качестве монотерапии рака у пациента или в виде части комбинированного лечения (при этом дополнительное лечение может быть фармацевтическим средством, радиотерапией и/или хирургическим лечением).
Таким образом, пациент также может получать один или более дополнительных видов лечения рака, например, фармацевтические средства (такие как химиотерапевтические средства), радиотерапию и/или хирургическое лечение.
В одном варианте осуществления один или более дополнительных видов лечения выбирают из группы, состоящей из общепринятых химиотерапевтических средств (таких как алкилирующие средства, анти-метаболиты, растительные алкалоиды и терпеноиды, ингибиторы топоизомеразы и противоопухолевые средства), радиотерапевтических средств, терапевтических средств на основе антител (таких как гемтузумаб, алемтузумаб, ритуксимаб, трастузумаб, нимотузумаб, цетуксимаб, бевацизумаб) и стероидов.
В одиннадцатом аспекте изобретение предоставляет способ продуцирования антитела или антигенсвязывающего фрагмента, или варианта, гибрида или его производного согласно изобретению, данный способ включает культивирование клетки-хозяина согласно четвертому аспекту изобретения при условиях, дающих возможность экспрессии кодированного антитела или его антигенсвязывающего фрагмента.
Методы культивирования клеток-хозяев и выделения рекомбинантных белков хорошо известны в данной области техники. Понятно, что в зависимости от клетки-хозяина продуцируемые белки могут различаться. Например, определенные клетки-хозяева, такие как дрожжевые или бактериальные клетки, или не имеют или имеют разные системы посттрансляционной модификации, которые могут приводить к выработке форм агентов изобретения (или их связывающих фрагментов), которые могут быть посттрансляционно модифицированы другим способом.
Предпочтительно, что антитела изобретения, антигенсвязывающие фрагменты, варианты, гибриды или их производные (или их связывающие фрагменты) продуцируются в эукариотической системе, такой как клетка млекопитающего.
Согласно менее предпочтительному варианту осуществления антитела изобретения, антигенсвязывающие фрагменты, варианты, гибриды или их производные могут продуцироваться in vitro с использованием коммерчески доступных систем трансляции in vitro, таких как лизат ретикулоцитов кролика или проростки пшеницы (доступные от компании Promega). Предпочтительно, система трансляции представляет собой лизат ретикулоцитов кролика. В целях удобства система трансляции может быть соединена с системой транскрипции, такой как TNT-система транскрипции-трансляции (Promega). Эта система имеет преимущество продуцирования подходящего мРНК-транскрипта из кодированного ДНК полинуклеотида в той же самой реакции, как и трансляция.
Следует понимать, что в случае если агент изобретения содержит различные фрагменты, например, связывающий и/или цитотоксический домены, эти фрагменты могут кодироваться одной или более отдельными молекулами нуклеиновых кислот.
Предпочтительно, способ производства этого аспекта изобретения включает дополнительную стадию выделения антител изобретения, антигенсвязывающих фрагментов, вариантов, гибридов или их производных, произведенных клеткой-хозяином или полученных из in vitro трансляционной смеси. Предпочтительно, при выделении используется антитело, селективно связывающее экспрессированный полипептид изобретения.
Способы получения антител хорошо известны в данной области техники. Например, антитела можно индуцировать у животного путем иммунизации подходящим пептидом. Альтернативно, благодаря современной технологии, можно получать антитела без необходимости использовать животных; такие методы включают, например, методику фагового дисплея антител, как известно в данной области техники.
В одном варианте осуществления антитело изобретения, антигенсвязывающий фрагмент, вариант, гибрид или его производное является продуктом, прямо или косвенно, in vitro оптимизации белка (например, с использованием FIND® технологии Alligator Bioscience AB, как описано в WO 02/48351 и WO 03/097834).
Перечисление или обсуждение в этом подробном описании ранее опубликованного документа необязательно должно приниматься как подтверждение, что документ является частью существующего уровня техники или представляет собой общедоступные сведения.
Далее будут описаны предпочтительные, неограничивающие примеры, которые осуществляют некоторые аспекты изобретения, со ссылкой на следующие фигуры:
Фигура 1 - (А) "Тепловая карта" библиотек и выход из селекции в первоначальный высокопроизводительный скрининг (HTS). Каждый прямоугольник представляет положение аминокислоты. Тепловые карты относятся исключительно к положениям, где мутации введены и/или обнаружены при анализе последовательности. Линкер между VH и VL не показан. Частота мутаций в каждом положении показана темным оттенком. (В) Число положений более чем с 5 мутациями вычисляли на основе последовательностей из процедуры селекции.
Фигура 2 - Визуализация результатов HTS. На оси y показано отношение двух измерений методом ELISA (нормальная промывка и строгая промывка); на оси x показан сигнал связывания, полученный при первоначальном анализе ELISA (нормальная промывка). Каждая сфера (кружок) на графике представляет данные от одного клона. Показаны В44 (серый) и клоны из цикла селекции номер 5 (черный).
Фигура 3 - Схематическое изображение доменов CD40.
Фигура 4 - Поверхностный плазменный резонанс связывания клонов антитела CD40 с мишенью при 37°С и физиологическом значении рН.
Фигуры 5 - Повышенное количество поверхностного маркера, CD86 у клонов CD40 антител относительно антитела В44.
Фигура 6 - Представлен вес опухолей, измеренный в конечной точке (день 28). Показано лечение 30 мкг G12 или изотипическим контролем (**р<0.01 для обеих лечебных групп по сравнению с контролем при использовании двустороннего теста Манна-Уитни).
Фигура 7 - Представлен средний объем опухоли (n=9) в различных лечебных группах (+/- SEM). Мышей, получавших 30 мкг лекарственного средства, сравнили с изотипическим контролем (30 мкг). Лечение G12 обеспечивает значительный противоопухолевый эффект по сравнению с изотипическим контролем.
Фигура 8 - Представлен вес опухолей, измеренный в конечной точке (день 28). G12 сравнивается с PBS-обработкой в присутствии человеческих дендритных клеток и Т-клеток, при этом каждой лечебной группе (n=10) трансплантировали аутологичные Т-клетки и дендритные клетки от двух разных доноров (пять мышей для каждого донора, всего десять мышей). Обработка G12 является значимой по сравнению с изотипическим контролем (р<0.05 для лечебной группы по сравнению с контролем с использованием двустороннего t-критерия Стьюдента).
Фигура 9 - Представлен средний (n=10) объем опухолей в лечебных группах (+/-SEM). Мышей подвергали обрабатке 30 мкг G12 и сравнили с PBS-обработкой в присутствии человеческих дендритных клеток и Т-клеток, при этом каждой лечебной группе (n=10) трансплантировали аутологичные Т-клетки и дендритные клетки от двух различных доноров (пять мышей для каждого донора, всего десять мышей). Обработка G12 является значимой по сравнению с изотипическим контролем.
Фигура 10 - Представлены кривые выживаемости мышей с инокулированной опухолью, получавших лекарственное средство. Лечение G12 значительно увеличивает выживаемость животных по сравнению с изотипическим контролем (р<0.013). Кривые выживаемости мышей, леченых G12, по сравнению с S2C6 (р<0.13). Выживаемость мышей, леченых S2C6, по сравнению с изотипическим контролем (р<0.088). Каждая лечебная группа состояла из 5 мышей, N=5.
Фигура 11 - Представлены кривые выживаемости мышей-опухоленосителей, которых лечили лекарственным средством. Представленные кривые выживаемости основываются на объединенных данных. Группа мышей, которых лечили G12, и изотипический контроль содержали по 20 животных в каждой группе. Группа, обработанная S2C6, состояла из 12 животных. Кривую выживаемости группы, обработанной G12, и группы, обработанной S2C6, сравнили с группой, обработанной изотипическим контролем, с помощью логарифмического рангового критерия с использованием метода Бонферрони для корректировки множественных сравнений. Кривая выживаемости G12 достоверно различается при сравнении с изотипическим контролем (нескорректированное р 0,004).
Фигура 12 - Представлены уровни цитокинов у леченых мышей. Образцы сыворотки были взяты через 4 часа после второй обработки на 10 день у леченых мышей и исследованы в отношении уровней циокинов. Уровни цитокинов у мышей, получавших G12, S2C6 и изотипический контроль, сравнили с помощью однофакторного дисперсионного анализа Anova с использованием критерия множественного сравнения Бонферрони для вычисления откорректированных р значений. Лечение G12 является значимым по сравнению с мышами, которых обработали S2C6. Уровни цитокинов отмеченные *** показали р<0,001; данные, отмеченные **, показали значение р 0,001<р<0,01 и уровни цитокинов, отмеченные *, показали значение р 0,01<р<0,05. Группа, получавшая G12, и группа, получавшая S2C6, состояли из 23 мышей, N=23. Лечебная группа с изотипическим контролем состояла из 18 мышей, N=18.
Фигура 13 - Уровни антител в сыворотке леченых мышей. Образцы сыворотки были взяты через 4 часа после первой (день 7) и второй обработки (день 10) G12 или контролями и исследованы в отношении уровня антител. На 7 и 10 дни титр антител был значимо ниже, приблизительно в два раза, для клона анти-CD40-антител G12 по сравнению с клоном S2C6.
Для вычисления значения р для сравнения средних значений G12 и S2C6 использовали односторонний критерий Стьюдента для одной выборки. Титр G12 в сыворотке был приблизительно в 100 раз ниже по сравнению с изотипическим контролем вследствие эффектов, связанных с мишенью (титр G12 сходен с изотипическим титром у мышей, отрицательных по человеческому CD40).
После обработки одинаковыми дозами (30 мкг) G12 и S2C6 наблюдается значительное различие в сывороточных титрах G12 и S2C6 через 4 часа после обработки. Это означает, что G12 находится дольше в опухоли и окружающей ткани по сравнению с S2C6. Это различие может быть результатом высокой скорости ассоциации G12 и аффинности к мишени (CD40) по сравнению с другими CD40 антителами, например, S2C6.
Уровни антител, обозначенные ***, показывают р<0,001; данные, обозначенные **, показывают значение р 0,001<р<0,01. Лечебная группа G12 и лечебная группа S2C6 состояли из 23 мышей, N=23. Лечебная группа изотипического контроля состояла из 18 мышей, N=18.
Примеры
Пример 1 - Направленная эволюция агонистического CD40 антитела с улучшенной эффективностью
Введение
Антитело В44 происходит из библиотеки n-CoDeR®, которая является библиотекой фрагментов антител человека (Söderlind et al., 2000). Для создания библиотек были использованы аминокислотные последовательности и модель строения анти-CD40 агонистического антитела В44, за исключением одной библиотеки, в которой по всей последовательности были вставлены случайные мутации.
Антитела изобретения были получены и отобраны, как описано далее.
Дизайн библиотеки
На основе анализа последовательности и структурного моделирования антитела В44 были созданы три библиотеки сконструированных последовательностей и одна библиотека случайных последовательностей. Структурная модель В44 была основана на подходящих матричных структурах, 1NL0 для VH и 2J6E для VL, из базы данных белковых структур (PDB).
В AL-10013-04, остатки из горячих точек зародышевой линии клеток (смотри LeFranc et al, IMGT/VQEST, http://www.imgt.org/IMGTeducation/Tutorials/IGandBcells/_UK/SomaticHypermutations/) в В44 были установлены с помощью анализа нуклеотидной последовательности (Но и Pastan "Therapeutic antibodies: Methods и protocols", 2009, (525) Humana Press). Мутации в горячих точках зародышевой линии представляют собой положения аминокислот в перестроенных вариабельных доменах иммуноглобулина, которые имеют склонность подвергаться мутациям во время соматического процесса гипермутирования. Остатки из «горячих точек CDRL3 зародышевой линии были рандомизированы вместе с выбранными остатками из горячих точек в близком по структуре CDRL1. Вариабельность в каждой из мутаций в горячих точках зародышевой линии относилась исключительно к 8-9 выбранным остаткам с целью уменьшения сложности и создания библиотеки с широкими функциональными возможностями. Эти остатки были выбраны, чтобы представлять физиохимические свойства всех (20) природных аминокислот (Tanping, Protein Engineering, 2003, 16, 323-330) (Koide et al, 2009, ACS Chemical biology), сохраняя при этом комплексность и теоретическую вариабельность на подходящем уровне. Теоретическая вариабельность этой библиотеки составляла 1.9×107 отдельных вариантов.
В AL-10013-05 все поверхности, экспонирующие CDR-остатки, были установлены на основе структурной модели В44. Эти остатки изменялись, ограничивая вариабельность до 1 или двух гомологичных остатков, за исключением Н3, где была введена дополнительная вариабельность (смотри фигуру 1). Целью являлось создание библиотеки с высокими функциональными возможностями, сохраняя при этом сложность и теоретическую вариабельность на подходящем уровне. Теоретическая вариабельность этой библиотеки составляла 1.9×107 отдельных вариантов.
В библиотеке сконструированных последовательностей AL-10013-06 остатки в центральной части CDRL3 и остатки в структурно смежном CDRH2 были рандомизированы (n=11). Эти остатки были установлены по структурной модели В44. Вариабельность в каждом положении была ограничена до 4-5 остатков, выбранных для того, чтобы представлять физиохимические свойства, подходящие для получения высокоаффинного, "минималистического", белок-связывающего эпитопа (Koide et al 2009, ACS Chemical biology, Fellouse et al., 2007, J Mol Biol)1,2, сохраняя при этом сложность и теоретическую вариабельность на подходящем уровне. Библиотека AL-10013-06 содержит 1.6×107 отдельных вариантов.
В библиотеке случайных последовательностей AL-10013-07, полная последовательность В44 была рандомизирована с использованием метода допускающей ошибки ПЦР, разработанной так, чтобы свести к минимуму мутационные изменения (Genemorph). Размер полученной библиотеки составлял 6.3×108 отдельных вариантов.
Стратегия селекции
Исходные библиотеки были обогащены относительно связующих веществ для биотинилированного CD40-Fcγ, таким образом, создавая пул последовательностей из каждой библиотеки, которые кодировали функциональные связующие вещества ("Цикл 1" в таблице 1). Начальное обогащение относительно связующих веществ было подтверждено секвенированием.
Пулы последовательностей, кодирующие функциональные варианты, затем были подвергнуты рекомбинации с использованием FIND®. Технология FIND® Alligator Bioscience AB описана в WO 02/48351 и WO 03/097834.
FIND® - рекомбинантная библиотека содержала 2×108 уникальных вариантов.
Полученная FIND®-рекомбинантная библиотека подвергалась четырем циклам дополнительного отбора ("Циклы 2-5" в таблице 1).
Из каждого цикла отбора выбрали приблизительно 2000 клонов и провели высокопроизводительный скрининг. Протокол селекции на «созревание аффинности» включал стадии, затрагивающие следующие свойства: скорость ассоциации; скорость диссоциации; мультимеризация и сохранение эпитопа.
С целью увеличения аффинности было включено десятикратное уменьшение концентрации антигена в трех циклах, а затем пятикратное уменьшение концентрации антигена в двух циклах.
Скорость ассоциации должна сохраняться и реагировать на сокращение времени инкубации.
Скорость диссоциации должна повышаться при увеличении строгости промывки. Небиотинилированный CD40 был включен в циклы 4 и 5 для предотвращения мультимеризации и подавления селекции на авидность.
Результаты селекции с помощью первоначального высокопроизводительного скрининга суммированы в "тепловых картах" библиотек, которые показывают положение и частоту мутаций, полученных в каждой библиотеке (фигура 1А).
На фигуре 1В показано, как FIND® рекомбинантная технология уменьшает число мутированных остатков, в то же время, улучшая аффинность.

а время инкубации показано для: Время инкубации с биотинилированным CD40/дополнительное время инкубации с небиотинилированным CD40 в цикле 4 и 5/ время инкубации давало возможность «спасти» комплексы фаг/антиген на магнитных частицах.
b Стандартная промывка включала семь промывок с использованием буфера для селекции (PBS-T/BSA), а затем четыре промывки PBS. В цикле 3-5 в протокол была добавлена длительная инкубация (время дано в минутах).
Высокопроизводительный скрининг (HTS)
Из каждого цикла отбора выбрали приблизительно 2000 клонов и провели высокопроизводительный скрининг.
Высокопроизводительный скрининг был проведен, как указано далее: измерение скорости диссоциации при двух различных условиях промывки осуществляли методом анализа прямого связывания ELISA. Улучшенная скорость диссоциации коррелировала с повышенным отношением из двух измерений. Результаты высокопроизводительного анализа наносили на график в виде измеренного отношения в зависимости от сигнала связывания в ELISA (фигура 2).
HTS-анализ был основан на сэндвич-ELISA, измеряющем связывание ScFv-his фрагмента в необработанных супернатантах Е. coli с CD40, нанесенным на микротитровальные планшеты.
Прозрачный плоскодонный 394-луночный планшет с высоким связыванием (Greiner #781074) был покрыт CD40mFc (Apollo #9025Н) с помощью инкубирования в течение 2 часов при комнатной температуре или в течение ночи при 4°С. Планшеты промывали (промывочный буфер: PBS+0,05% Твин 20 (PBST), Medicago#09-9410-100, ELx405 промывкой для микропланшетов (BioTek) и затем блокировали в PBST+3% сухое молоко (Semper). Планшеты вновь промыли, а в лунки добавили образец или контроль. Образцы инкубировали в течение 1 часа при комнатной температуре и затем промыли, используя или нормальную промывку (3 цикла промывки) или жесткую промывку (3 цикла промывки, затем инкубация с PBST 30 мин, а затем 3 цикла промывки).
Добавили детекторное Ab, Penta-His-HRP (Qiagen #1014992), затем планшеты обработали хемилюминесцентным субстратом SuperSignal Pico (Thermo #37069) и обнаруживали с помощью ридера Envision (Perkin Elmer).
Пример 2 - Улучшенная аффинность типичного анти-CD40 антитела
FIND® рекомбинантные анти-CD40 антитела были отобраны по наличию улучшенной аффинности (KD) к CD40 рецептору. Аффинность анти-CD40 антитела к мишени была определена с помощью поверхностного плазменного резонанса и вычисленные кинетические константы показаны в таблице 1 и таблице 2. Аффинность анти-CD40 клона антител была улучшена приблизительно в сто раз по сравнению с исходным В44 антителом, таблица 2 и фигура 3, при физиологическом значении рН и 37°С.
Улучшенная аффинность клонов анти-CD40 антител также наблюдалась при низком значении рН, таблица 2. Для определения кинетических констант при рН 5.4 и 37°С использовали поверхностный плазменный резонанс и сравнили с В44 антителом.
Результаты показывают, что уменьшение значения рН до 5.4 только незначительно влияло на общую аффинность, и что увеличение аффинности по сравнению с В44 сохраняется (в то время как скорость диссоциации и скорость ассоциации изменялись независимо). Это может давать клинический результат при использовании изобретения в местной иммунотерапии.
Материалы и методы
Определение кинетических параметров и аффинных констант с помощью поверхностного плазменного резонанса
Измерение аффинности очищенных антител проводили методом поверхностного плазмонного резонанса с помощью прибора Biacore 3000 в соответствии с протоколами производителя.
CD40hfc (R&Dsystems, США) был иммобилизован на сенсорном чипе BIAcore, СМ5, с использованием обычного аминного связывания. Связывание анти-CD40 антител изобретения (серийно разведенные 1/3 из 1-0,012 nM) исследовали в HBS-P (GE, BR-1003-68) при скорости потока 30 мкл/мин при 37°С и рН 7.3. Ассоциация продолжалась в течение 3 минут, а диссоциация - в течение 10 минут. Восстановление осуществлялось дважды с использованием 50 мМ NaOH в течение 30 секунд. Кинетические параметры и аффинные константы были вычислены с помощью программного обеспечения BIAevaluation 4.1.
Альтернативно, образцы инкубировали в ацетатном буфере рН 5.4, 10 мМ ацетат, 150 мМ NaCl, 0,005% Т20, при 37°С.
Результаты приведены в таблицах 2 и 3.
Результаты

Пример 3 - Картирование эпитопов и перекрестная реактивность типичных антител изобретения
Рецептор CD40 содержит четыре внеклеточных домена, каждый из которых состоит из двух типов модульных единиц (элементов) (Naismith и Sprang, 1998, Trends Biochem, (23) 74-79), причем каждый модуль стабилизируется одной или двумя дисульфидными связями. Для того, чтобы исследовать специфичность отобранных scFv, местоположение каждого scFv эпитопа было определено картированием доменов. Способность scFv фрагментов связываться с укороченными CD40-конструктами, экспрессированными на поверхности трансфицированных COS-7 или L-клеток, была измерена с помощью FACScan анализа (как описано Ellmark et al 2002, Immunology). Типичные антитела изобретения были способны связываться с конструктами, в которых первый модуль был удален (D1/B2), но не с конструктами, в которых весь первый домен CD40 был удален (смотри фигуру 4 и таблицу 4).
Перекрестная специфичность
Клоны антител изобретения давали перекрестную реакцию с CD40 от яванской макаки, макаки-резуса и других соответствующих видов макак. Они не давали перекрестной реакции с CD40 мышей или собак.
Пример 4 - Усиление экспрессии поверхностных молекул дендритных клеток с помощью типичных анти-CD40 антител
Лигирование CD40 рецептора вызывает активацию дендритных клеток, которая потенциально ведет к активации специфического противоопухолевого Т-клеточного ответа. Происходящие от моноцитов дендритные клетки, обработанные анти-CD40 антителом, показывают повышенную экспрессию поверхностных молекул CD80, CD83, CD86 и HLA-DR. Усиление экспрессии поверхностных молекул, CD80 и CD86, необходимо при костимулировании Т-клеточной активации.
Другие агонистические CD40 антитела, например, СР-870,893, имеют приблизительно в 20 раз более высокую эффективность активации В-клеток, чем активации дендритных клеток (Gladue et al., 2011, Cancer Immunol Immunother 60[7]; 1009-1017).
Активация дендритных клеток с клинической точки зрения более важна, чем В-клеточная активация, причем воздействие на В-клетки может привести к ограничивающей дозу токсичности при лечебной дозе, которая не активирует дендритные клетки. Таким образом, полезно улучшить эффективность активации дендритных клеток, в то же время, сохраняя эффективность активации В-клеток в том же самом диапазоне. Клоны, описанные в изобретении, имеют эффективность активации В-клеток, которая находится в том же диапазоне, как активация дендритных клеток, что может обеспечить клинические преимущества.
Улучшенная эффективность клонов анти-CD40 антител в содействии активации дендритных клеток по сравнению с первоначальным анти-CD40 антителом, В44, была определена с помощью методов анализа in vitro. Улучшенная эффективность активации дендритных клеток наблюдалась у клонов анти-CD40 антител, что установлено усилением экспрессии поверхностных молекул CD86.
В таблице 5 суммированы результаты исследований экспрессии поверхностных маркеров.
На фигурах 5 А и В показана экспрессия CD86 и ее зависимость от концентрации.
Материалы и методы
Анализ активации дендритных клеток
Дендритные клетки были получены из моноцитов периферической крови. Коротко, мононуклеарные клетки периферической крови (РВМС) были выделены из лейкоцитарной пленки цельной крови при помощи градиента фиколла, и CD14+ моноциты были выделены с помощью CD14+MACS микрогранул (Miltenyi) согласно инструкциям производителя. CD14+ клетки, с чистотой до -95%, культивировали в среде RPMI+10% FCS, 150 нг/мл GM-CSF и 50 нг/мл IL-4 при 37°С в течение шести дней при концентрации 1×106 клеток/мл. Через три дня культивирования 80% среды заменили на свежую среду и цитокины.
Через шесть дней культивирования в клетках наблюдался подавленный CD 14 и повышенный CD1a. Клетки промыли, ресуспендировали в среде со свежими цитокинами и сериями разведении стимулирующих антител. Клетки культивировали при концентрации 667000 клеток/мл и антител 3.3-0.013 мкг/мл. Стимулирующими антителами были В44 и восемь клонов А4, А5, В9, С4, F6, G12, Н11 и Н12. Дендритные клетки культивировали при 37°С в течение дополнительных 48 часов. Затем усиление экспрессии маркеров активации CD86, CD80 и HLA-DR исследовали при помощи FACS.


Пример 5 - Увеличенная секреция IFN-γ активированными Т-клетками, вызванная типичными анти-CD40 антителами
Была исследована in vitro активация Т-клеток дендритными клетками, стимулированными клонами анти-CD40 антител, и проанализирована выработка IFNγ.
Результаты суммированы в таблице 6.
Анализ с использованием аллогенных Т-клеток и дендритных клеток показал улучшение эффективности клона анти-CD40 антител по сравнению с В44 антителом.
Материалы и методы
Анализ активации аллогенных Т-клеток дендритными клетками
Дендритные клетки были получены из моноцитов периферической крови, как описано в разделе «Анализ активации дендритных клеток».
Через шесть дней дендритные клетки промывали, ресуспедировали в среде со свежими цитокинами и культивировали в присутствии Т-клеток от разных доноров. Т-клетки выделяли из РВМС с помощью CD3+MACS микрогранул (Miltenyi) в соответствии с инструкциями производителя.
Концентрации дендритных клеток и Т-клеток в данном способе анализа активации Т-клеток составляли 667000 клеток/мл каждого типа клеток. Кроме того, совместная культура содержала 150 нг/мл GM-CSF и 50 нг/мл IL-4 и серии разведении стимулирующих антител 3,3-0,013 мкг/мл. Стимулирующими антителами были В44 и восемь клонов А4, А5, В9, С4, F6, G12, Н11 и Н12. Совместную культуру инкубировали при 37°С в течение дополнительных 72 часов. Затем, исследовали супернатанты на содержание IFN-γ с помощью ELISA (Biolegends) согласно инструкциям производителя.
Пример 6 - Сравнение активации В-клеток типичными анти-CD40 антителами
Связывание агонистичесих анти-CD40 антител с CD40 на В-клетках приводило к В-клеточной активации и пролиферации, гомеотипической агрегации и усилению экспрессии поверхностных маркеров, таких как CD23, CD30, CD80, CD86, Fas, главного комплекса гистосовместимости (МНС) II и растворимых цитокинов, например, IL-6, TNF-α и TNF-β (Schönbeck и Libby, 2001, Cell Mol Life 58(1), 4-43).
Определение CD40, индуцированного пролиферацией В-клеток, обычно используется для оценки CD40 агонистических антител (Pound et al, 1999, Int Immunol, (11), 11-20).
Материалы и методы
Мононуклеарные клетки периферической крови (РВМС) были выделены из лейкоцитарной пленки цельной крови при помощи градиента фиколла, и CD14+ моноциты были выделены с помощью CD14+MACS микрогранул (Miltenyi) согласно инструкциям производителя. CD19+ клетки (5-7.5×104/лунку), с чистотой до -95%, культивировали в среде RPMI+10% FCS+10 нг/мл IL4 и серийные разведения антител. Через 48-72 час измеряли метаболическую активность с помощью Cell titer-Glo (Promega). Значения ЕС50 вычисляли, используя Graph Pad prism.
Результаты
Анти-CD40 антитела изобретения обладаю сходной эффективностью при активации В-клеток (т.е. тот же самый порядок величины) как В44 (смотри таблицу 7).
Пример 7 - Способность типичных анти-CD40 антител изобретения связываться с клетками RAMOS
Способность анти-CD40-антител изобретения связываться с клетками RAMOS была определена in vitro. Был проведен FACS-анализ связывания анти-CD40 антител с линией клеток лимфомы Беркитта человека RAMOS. Были вычислены значения ЕС50 для анти-CD40 антител изобретения и исходного В44 анти-CD40 антитела.
Материалы и методы
Для анализа связывания использовали линию клеток RAMOS лимфомы Беркитта человека (ЕСАСС, Sigma Aldrich, США). Неконъюгированные анти-CD40 антитела изобретения были исследованы в отношении связывания с клетками RAMOS.
RAMOS клетки, приблизительно 125000 клеток, инкубировали с анти-CD40 антителом, серийно разведенным 1/3 из 30-0.0015 мкг/мл в течение 30 минут при 4°С. Клетки дважды промыли FACS буфером, а потом добавили к клеткам вторичное антитело, анти-человек Ig кроличий F(ab')2 /FITC (DAKO, Glostrup, Denmark), в течение следующих 30 минут при 4°С. Клетки промыли и исследовали на приборе FACScalibur согласно инструкциям производителя (Becton Dickinson, USA), а затем определили среднюю интенсивность флуоресценции ("MFI").
Результаты
Результаты приведены в таблице 8.
Иллюстративные клоны анти-CD40 антител обладают эффективностью приблизительно в 100-раз более высокой по сравнению с В44 антителом.
Пример 8 - Эффект иллюстративного антитела на модели опухоли мыши in vivo
Противоопухолевая активность иллюстративного анти-CD40 антитела изобретения была исследована на мышиной модели NSG при отсутствии и в присутствии Т-клеток и дендритных клеток.
(A) Исследование с использованием CD40 положительных опухолей при отсутствии Т-клеток и дендритных клеток.
Материалы и методы
Самок мышей NSG (NOD.Cg-Prkdcscid Il2rgtm/Wjl/SzJ (NSG)) получили от Jackson и дали им возможность акклиматизироваться до обработки. Клетки рака мочевого пузыря (EJ-клетки, 3×106 клеток/мышь) были введены подкожно. G12 или изотопный контроль был введен внутритуморально на день 0, 7 и 14 в дозе 1,2 мг/кг (30 мкг). Объем опухоли измеряли на 0, 7, 10, 14, 17, 21, 23 и 27 дни. Опухоли извлекали и взвешивали на 28 день.
Результаты
Результаты представлены на фигурах 6 и 7.
(B) Исследование с использованием CD40 положительных опухолей в присутствии Т-клеток и дендритных клеток.
Материалы и методы
Самок мышей NSG (NOD.Cg-PrkdcscidIl2tm/Wjl/SzJ (NSG)) получили от Jackson и дали им возможность акклиматизироваться до обработки. Клетки рака мочевого пузыря (EJ-клетки, 2,5×106 клеток/мышь) были введены подкожно вместе с DC (1×105) и Т-клетками (5×105), полученными от того же самого донора. Дендритные клетки были получены из моноцитов (как описано выше). Каждая лечебная группа состояла из 10 мышей (n 10), при этом использовали Т-клетки и DC от двух доноров у пяти мышей/донор (смотри таблицу 9).
G12 или PBS-контроль вводили интратуморально на день 0, 7 и 14 в дозе 1,2 мг/кг (30 мкг). Объем опухоли измеряли на 0, 7, 10, 14, 17, 21, 23 и 27 день. Опухоли извлекали и взвешивали на 28 день.
Результаты
Результаты представлены на фигурах 8 и 9.
Пример 9 - Способность спасать клетки от апоптоза
Способность анти-CD40 антител спасать клетки, экспрессирующие человеческий CD40, от апоптоза и остановки роста исследовали in vitro. Апоптоз и остановку роста индуцировали у трансфицированных WEHI-231 клеток добавлением анти-IgM антитела. Клетки «спасали» добавлением анти-CD40 антитела. Далее определяли способность клеток к пролиферации.
Была отмечена улучшенная эффективность, до 40 раз, клонов анти-CD40 антител относительно В44 антитела - смотри таблицу 9.
Материалы и методы
Спасение от апоптоза:
Стабильную клеточную линию трансфицировали человеческим CD40, huCD40/WEHI-231, и использовали для исследования «спасения» от апоптоза и остановки роста (Ellmark et al., 2003, Immunology, 108, 452-7). Клетки huCD40/WEHI-231 культивировали в 96-луночных планшетах (2×104 клеток/лунку) в присутствии или в отсутствие анти-мышь IgM, (Jackson Immunoresearch, США) и анти-CD40 антител изобретения, серийно разведенных 1/3 из 25-0.0001 мкг/мл, в течение 72 часов. Добавили Cell titer-Glo и инкубировали смесь в течение 30 минут при комнатной температуре (Promega, США). Пролиферацию клеток оценивали путем измерения высвобождения АТФ. Сигнал люминесценции измеряли с помощью FluoSTAR OPTIMA, причем сигнал был нормирован (BMG, Германия)
Пример 10: Краткое изложение информации о последовательностях
Для каждого антитела, описанного ниже, показаны VL положения аминокислот 1-112 и VH положения аминокислот 1-119 вместе с соответствующими последовательностями нуклеотидов. В аминокислотных последовательностях подчеркнуты CDR - в VL аминокислотных последовательностях CDR обнаружены в положениях аминокислот 23-40 (CDR1), положениях 52-58 (CDR2) и 90-101 (CDR3); в VHаминокислотных последовательностях CDR обнаружены в положениях аминокислот 26-35 (CDR1), положениях 42-67 (CDR2) и 97-108 (CDR3).
Антитело В44
Аминокислотная последовательность вариабельного домена легкой цепи (VL) SEQ ID NO:58

Последовательность нуклеотидов вариабельного домена легкой цепи (VL)- SEQ ID NO:59

Аминокислотная последовательность вариабельного домена тяжелой цепи (VH) - SEO ID NO:60

Последовательность нуклеотидов вариабельного домена тяжелой цепи (VH) - SEO ID NO:61
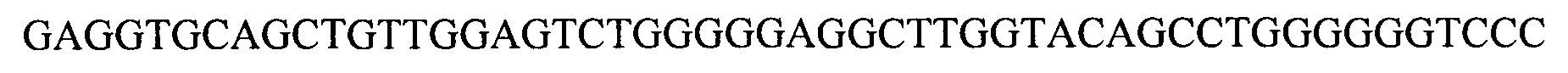
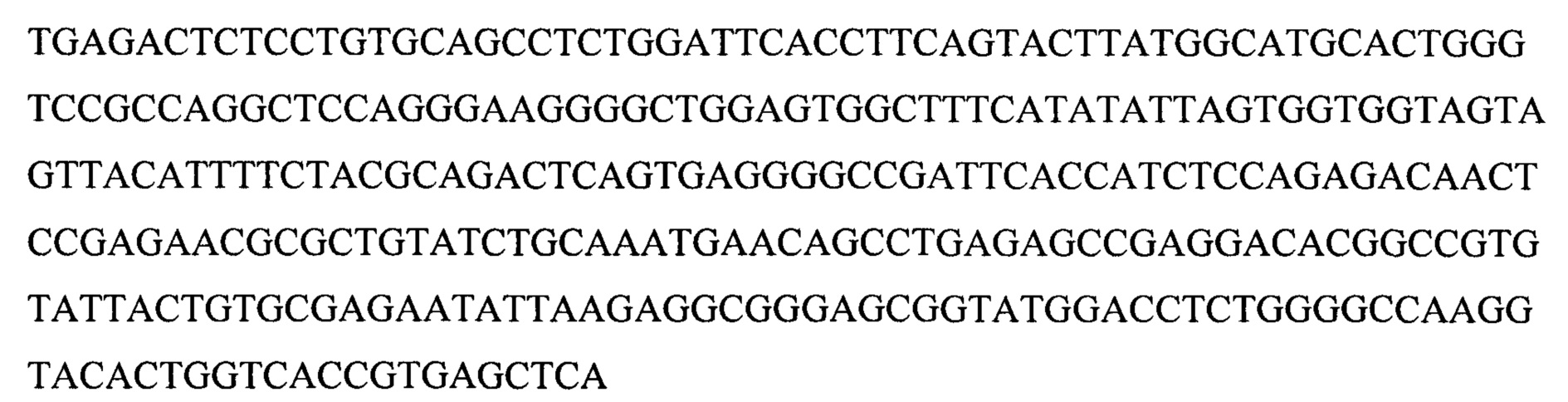
Клон антител А4
Аминокислотная последовательность вариабельного домена легкой цепи (VL) - SEQ ID NO:19
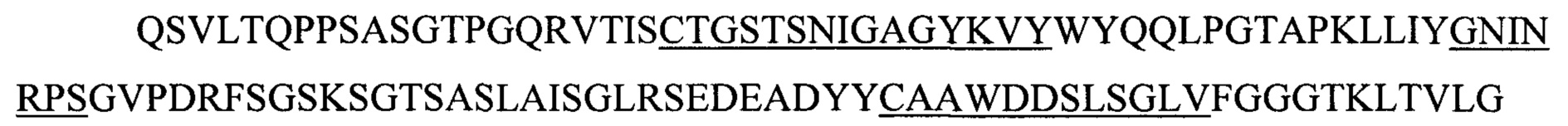
Последовательность нуклеотидов вариабельного домена легкой цепи (VL) - SEQ ID NO:40

Аминокислотная последовательность вариабельного домена тяжелой цепи (VH) - SEOIDNO:31

Последовательность нуклеотидов вариабельного домена тяжелой цепи (VH) - SEQ ID NO:49

аминокислотные последовательности CDR


Клон антител А5
Аминокислотная последовательность вариабельного домена легкой цепи (VL) - SEO ID NO:20

Последовательность нуклеотидов вариабельного домена легкой цепи (VL) - SEQ ID NO:41

Аминокислотная последовательность вариабельного домена тяжелой цепи (VH) - SEO ID NO:32

Последовательность нуклеотидов вариабельного домена тяжелой цепи (VH) - SEQ ID NO:50

аминокислотные последовательности CDR
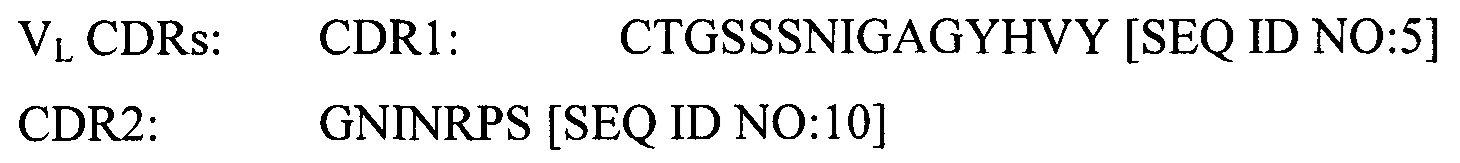

Клон антител С4
Аминокислотная последовательность вариабельного домена легкой цепи (VL) - SEQ ID NO:21
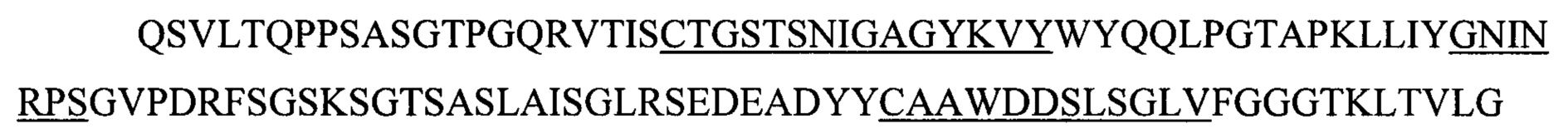
Последовательность нуклеотидов вариабельного домена легкой цепи (VL) - SEQ ID NO:48

Аминокислотная последовательность вариабельного домена тяжелой цепи (VH) - SEQ ID NO:33

Последовательность нуклеотидов вариабельного домена тяжелой цепи (VH) - SEQ ID NO:51

аминокислотные последовательности CDR


Клон антител G4
Аминокислотная последовательность вариабельного домена легкой цепи (VL) - SEQ ID NO:22

Последовательность нуклеотидов вариабельного домена легкой цепи (VL) - SEQ ID NO:42
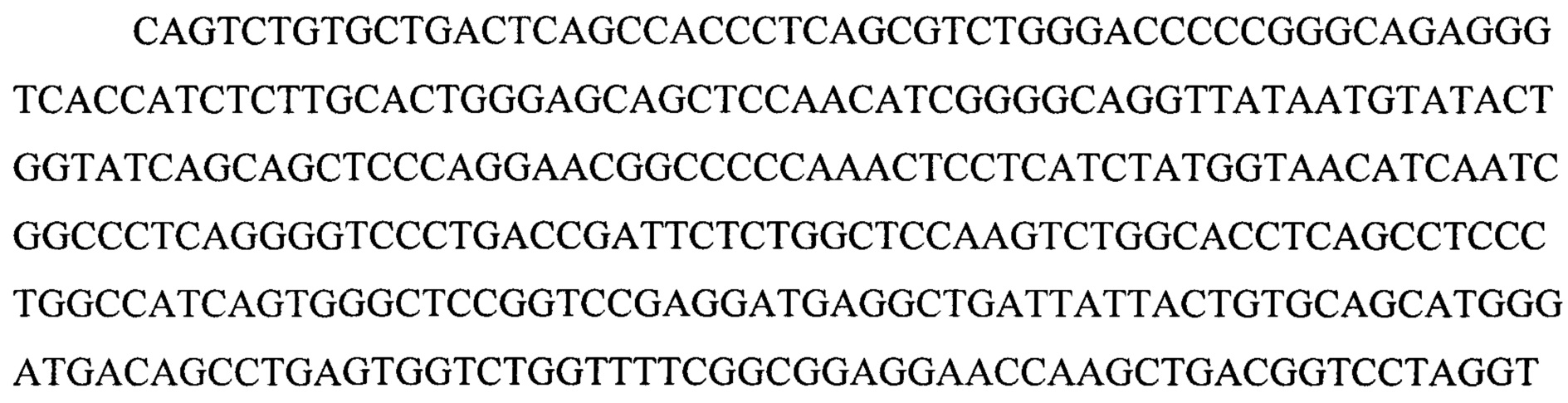
Аминокислотная последовательность вариабельного домена тяжелой цепи (VH) - SEQ ID NO:34

Последовательность нуклеотидов вариабельного домена тяжелой цепи (VH) - SEQ ID NO:52

аминокислотные последовательности CDR


Клон антител F6
Аминокислотная последовательность вариабельного домена легкой цепи (VL) - SEO ID NO:23

Последовательность нуклеотидов вариабельного домена легкой цепи (VL) - SEQ ID NO:43

Аминокислотная последовательность вариабельного домена тяжелой цепи (VH) - SEQ ID NO:35

Последовательность нуклеотидов вариабельного домена тяжелой цепи (VH) - SEQ ID NO:53

аминокислотные последовательности CDR


Клон антител F9
Аминокислотная последовательность вариабельного домена легкой цепи (VL) - SEO ID NO:24

Последовательность нуклеотидов вариабельного домена легкой цепи (VL) - SEQ ID NO:44

Аминокислотная последовательность вариабельного домена тяжелой цепи (VH) - SEO ID N0:36

Последовательность нуклеотидов вариабельного домена тяжелой цепи (VH) - SEQ ID NO:54

аминокислотные последовательности CDR

Клон антител G12
Аминокислотная последовательность вариабельного домена легкой цепи (VL) - SEO ID NO:25

Последовательность нуклеотидов вариабельного домена легкой цепи (VL) - SEO ID NO:45

Аминокислотная последовательность вариабельного домена тяжелой цепи (VH) - SEO ID NO:37

Последовательность нуклеотидов вариабельного домена тяжелой цепи (VH) - SEQ ID NO:55

аминокислотные последовательности CDR

Клон антител Н12
Аминокислотная последовательность вариабельного домена легкой цепи (VL) - SEQ ID NO:26

Последовательность нуклеотидов вариабельного домена легкой цепи (VL) - SEQ ID NO:46

Аминокислотная последовательность вариабельного домена тяжелой цепи (VH) - SEO ID N0:38

Последовательность нуклеотидов вариабельного домена тяжелой цепи (VH) - SEQ ID NO:56


аминокислотные последовательности CDR

Клон антител В9 и НИ
Аминокислотная последовательность вариабельного домена легкой цепи (VL) - SEO ID NO:27

Последовательность нуклеотидов вариабельного домена легкой цепи (VL) - SEQ ID NO:47

Аминокислотная последовательность вариабельного домена тяжелой цепи (VH) - SEO ID NO:39

Последовательность нуклеотидов вариабельного домена тяжелой цепи (VH) - SEO ID NO:57

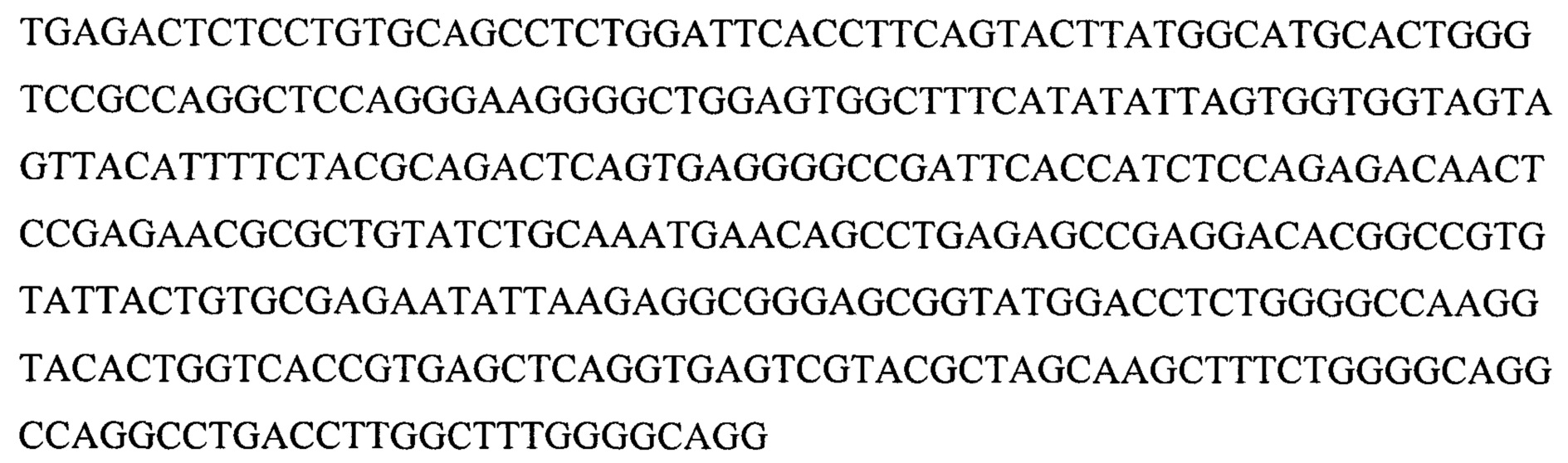
аминокислотные последовательности CDR

Константные области типичных антител изобретения

[SEQ ID NO:63]
Типичные мутации каркасного участка в вариабельном домене тяжелой цепи (VH)
Мутации указаны ниже подчеркнутым жирным шрифтом.
Аминокислотная последовательность вариабельного домена тяжелой цепи (VH) [SEO ID NO:64]

Последовательность нуклеотидов вариабельного домена тяжелой цепи (VH) [SEQ ID NO:65]

Аминокислотная последовательность вариабельного домена тяжелой цепи (VH) [SEQ ID NO:66]

Последовательность нуклеотидов вариабельного домена тяжелой цепи (VH) [SEQ ID NO:67]


Пример 11: Типичные фармацевтические композиции
Хотя и возможно введение антител изобретения в отдельности, предпочтительным является их предоставление в виде медикамента или фармацевтической композиции в сочетании с одним или более приемлемыми носителями. Носитель(и) должен быть "приемлемым" в том смысле, что он должен быть совместимым со средством изобретения и невредным для реципиентов. В большинстве случаев носители представляют собой стерильные и апирогенные воду или физиологический раствор.
Следующие примеры иллюстрируют медикаменты и фармацевтические композиции согласно изобретению, в которых активным ингредиентом является антитело изобретения.
Пример А: Таблетка
Таблетки изготавливают из вышеуказанных ингредиентов путем влажной грануляции и последующего прессования.
Пример В: Офтальмологический раствор
Пример С: Композиции для таблеток
Следующие композиции А и В приготавливают посредством влажной грануляции ингредиентов с раствором повидона с последующим добавлением стеарата магния и прессованием.
Следующие композиции, D и Е, приготавливают непосредственным прессованием смешанных ингредиентов. Использованная в композиции Е лактоза относится к типу, предназначенному для прессования.
Композиция F (композиция с контролируемым высвобождением) Данную композицию получают путем влажного гранулирования ингредиентов (указанных ниже) с раствором повидона с последующим добавлением стеарата магния и прессованием.
Высвобождение лекарственного средства происходит в течение примерно 6-8 часов и завершается через 12 часов.
Пример D: Композиции для капсул
Композиция А
Композицию для капсул приготавливают путем смешивания ингредиентов композиции D (в приведенном выше Примере С) и наполнения состоящих из двух частей твердых желатиновых капсул. Композицию В (ниже) приготавливают аналогично.
Капсулы приготавливают путем плавления Макрогола 4000 ВР, диспергирования активного ингредиента в расплавленном веществе и наполнения состоящей из двух частей твердой желатиновой капсулы расплавленным веществом.
Капсулы приготавливают путем диспергирования активного ингредиента в лецитине и арахисовом масле и наполнения мягких, эластичных желатиновых капсул дисперсией.
Композиция Е (капсула с контролируемым высвобождением)
Следующую композицию для капсул с контролируемым высвобождением приготавливают путем экструзии ингредиентов а, b и с с применением экструдера с последующей сферонизацией экструдата и высушиванием. Затем высушенные шарики покрывают контролирующей высвобождение мембраной (d) и загружают их в состоящие из двух частей твердые желатиновые капсулы.
Пример Е: Композиция для инъекций
Активный ингредиент растворяют в фосфатном буфере (35-40°С), затем доводят до нужного объема и фильтруют через стерильный микропористый фильтр в стерильные 10 мл флаконы из желтого стекла (тип 1) и закупоривают стерильными крышками и дополнительным укупорочным средством.
Пример F: Раствор для внутримышечных инъекций
Активный ингредиент растворяют в гликофуроле. Затем добавляют бензиловый спирт. Растворяют и добавляют воду до 3 мл. Затем смесь фильтруют через стерильный микропористый фильтр и закупоривают в стерильные 3 мл стеклянные флаконы (тип 1).
Пример G: Суспензия в виде сиропа
Бензоат натрия растворяют в части дистиллированной воды и добавляют раствор сорбитола. Добавляют активный ингредиент и диспергируют. Загуститель (диспергируемая целлюлоза) диспергируют в глицерине. Две дисперсии смешивают и доводят до необходимого объема дистиллированной водой. Дополнительное загустение достигается в случае необходимости путем дополнительного сжатия суспензии.
Пример Н: Суппозитории
* Активный ингредиент используется в виде порошка, в котором, по меньшей мере, 90% частиц имеют диаметр 63 мкм или менее.
Одну пятую Витепсола H15 плавят в котле с паровой рубашкой максимально при 45°С. Активный ингредиент просеивают через сито 200 мкм и добавляют к расплавленной основе с перемешиванием, используя смеситель silverson оснащенный режущей головкой, до получения гомогенной дисперсии. Поддерживая смесь при 45°С, добавляют остальной Витепсол H15 к суспензии и перемешивают до получения гомогенной смеси. Суспензию пропускают через 250 мкм ситчатый нержавеющий фильтр и при непрерывном перемешивании позволяют охладиться до 40°С. При температуре от 38°С до 40°С 2,02 г смеси загружают в подходящие пластиковые формы. Дают возможность суппозиториям охладиться до комнатной температуры.
Пример I: Пессарии
Вышеперечисленные ингредиенты смешивают и приготавливают пессарии непосредственным прессованием полученной смеси.
Пример 12: Эффект типичных антител на модели опухоли мыши in vivo
Противоопухолевую активность анти-CD40 антитела изобретения исследовали на трансгенных мышах с человеческим CD40, инокулированных клетками рака мочевого пузыря. Клетки рака мочевого пузыря МВ49 инокулировали подкожно трансгенным мышам с человеческим CD40. На 7 и 10 дни мышам внутрибрюшинно вводили G12 или контроли. Обработка G12 давала в результате значимый противоопухолевый эффект по сравнению с изотипическим контролем.
Исходное антитело S2C6 представляет собой химерное анти-CD40 антитело, состоящее из мышиных вариабельных доменов, VH и VL, соединенных с человеческими гамма-1 и каппа константными областями, соответственно (Европейский патент №ЕР 1885399, Francisco et al., 2000 Cancer Research). Таким образом, антитело является аналогом гуманизированного анти-CD40 антитела SGN-40 (Law et al., 2005 Cancer Research). SGN-40 проходил клинические испытания (Advani et al., 2009 J Clinical Oncology; Hussein et al., 2010 Haematologica).
Материалы и методы
Линия клеток МВ49 представляет собой индуцированную канцерогеном переходно-клеточную карциному, полученную от самцов мышей C57BL/6 (Summerhayes & Franks, 1979, Journal of the National Cancer Institute). МВ49 экспрессируют мышиный CD40, но не экспрессируют человеческий CD40. G12 не взаимодействует перекрестно с мышиным CD40 и не может связываться с опухолевыми МВ49 клетками.
2.5×105 клеток рака мочевого пузыря МВ49 подкожно инокулировали в бок самки трансгенной C57BL/6 мыши с человеческим CD40 на 0 день. Трансгенные мыши с человеческим CD40 (на основе мыши, дефицитной по (mCD40-/-)) экспрессируют человеческий CD40 дикого типа. Лечение начинали на 7 день с помощью антител, вводимых перитуморально в подкожную опухоль на 7 и 10 день (две дозы). Объем опухоли измеряли 2 раза/неделю штангенциркулем и вычисляли по формуле объема эллипсоида. Мышей умерщвляли, если опухоль превышала 1 см3, или если развивались язвы. Образцы сыворотки брали через 4 часа после каждого введения. Уровни цитокинов в образцах сыворотки исследовали с помощью Mouse Prolnflammatory 7-Plex Ultrasensitive Kit, используя Mesoscale discovery platform (MSD, Gaithersburg, MD, США). Титр антител измеряли в сыворотке используя сэндвич-ELISA. Линия клеток МВ49 представляет собой индуцированную канцерогеном переходно-клеточную карциному, полученную от самцов мышей C57BL/6 (Summerhayes & Franks, 1979, Journal of the National Cancer Institute). Клетки МВ49 экспрессируют мышиный CD40, но не экспрессируют человеческий CD40. G12 не реагирует перекрестно с мышиным CD40 и не может связываться с опухолевыми клетками МВ49.
Результаты
Результаты приведены на фигуре 10.
Воздействие G12 значительно увеличивает выживаемость животных по сравнению с изотипическим контролем (р<0.013). Кривая выживаемости мышей, получивших G12, по сравнению с S2C6 (р<0.13). Выживаемость мышей, получивших S2C6, по сравнению с изотипическим контролем (р<0.088).
Пример 13: Эффект типичных антител на модели опухоли мыши in vivo
Противоопухолевую активность анти-CD40 антител, интерлейкина-6 (IL-6), фактора-альфа некроза опухоли (TNF-α) и цитокина, происходящего от кератиноцитов (КС) (также известного, как хемокин (С-Х-С мотив) лиганд 1 / CXCL1), исследовали, используя объединенные данные от большой группы леченых животных. Лечебная группа G12 содержала 20 животных, лечебная группа S2C6 содержала 12 животных, и группа с изотипическим контролем содержала 20 животных.
Клетки рака мочевого пузыря МВ49 подкожно инокулировали трансгенным мышам с человеческим CD40. Мышам перитуморально вводили G12 или контроли на 7 и 10 день. Лечение G12 обеспечивало значимое увеличение выживаемости мышей-опухоленосителей по сравнению с группой, которая получала изотипический контроль (фигура 11).
У мышей, подвергавшихся лечению, брали образцы сыворотки и анализировали в отношении уровня цитокинов. Уровни цитокинов после лечения демонстрируют более сильное стимулирование иммунного ответа посредством G12 по сравнению с исходным антителом, S2C6 (фигура 12).
Материалы и методы
2.5×105 клеток рака мочевого пузыря МВ49 подкожно инокулировали в бок самки трансгенной C57BL/6 мыши с человеческим CD40 на 0 день. Трансгенные мыши с человеческим CD40 (на основе мыши, дефицитной по (mCD40-/-)) экспрессируют человеческий CD40 дикого типа. Воздействие начинали на 7 день с помощью антител, вводимых перитуморально в подкожную опухоль на 7 и 10 день (две дозы). Объем опухоли измеряли 2 раза/неделю штангенциркулем и вычисляли по формуле объема эллипсоида. Мышей умерщвляли, если опухоль превышала 1 см, или если развивались язвы. Образцы сыворотки брали через 4 часа после каждого введения. Уровни цитокинов в образцах сыворотки исследовали с помощью Mouse Prolnflammatory 7-Plex Ultrasensitive Kit, используя Mesoscale discovery platform (MSD, Gaithersburg, MD, США). Статистический анализ проводили с использованием программы Graph Pad Prism 6.0 (GraphPad Software, Inc. La Jolla, CA)
Результаты
Результаты приведены на фигурах 11 и 12.
Пример 14: Исследование уровней антител in vivo
Исследовали уровни антител в сыворотке мышей, подвергавшихся лечению. Образцы сыворотки брали после первого (день 7) и второго воздействия (день 10). Титр антител был значительно ниже для клона анти-CD40 антител по сравнению с исходными антителами. Результаты приведены на фигуре 13.
Материалы и методы
Были исследованы уровни антител в образцах сыворотки, взятых через 4 часа после первого (день 7) и второго (день 10) воздействия (из эксперимента, описанного в Примере I). Титр антител в сыворотке определяли методом сэндвич-ELISA.
Лечебная группа G12 состояла из 23 мышей (N=23), лечебная группа с использованием исходного антитела S2C6 состояла из 23 мышей (N=23), и лечебная группа с изотипическим контролем состояла из 18 мышей (N=18).
Результаты
Результаты приведены на фигуре 13.
Ссылки
Advani et al., Phase I Study of the humanized anti-CD40 monoclonal antibody Dacetuzumab in refractory of recurrent non-hodgkin's lymphoma. J Clinical Oncology 27: 4371-4377 (2009).
Armitage et al., Molecular и biological characterization of a murine ligand for CD40. Nature 357: 80-82 (1992).
Bajorath, J. Detailed comparison of two molecular models of the human CD40 ligand with an x-ray structure и critical assessment of model-based mutagenesis и residue mapping studies. J Biol Chem 273,24603-9 (1998).
Bajorath, J. et al. Analysis of gp39/CD40 interactions using molecular models и site-directed mutagenesis. Biochemistry 34, 9884-92 (1995).
Bajorath, J. et al. Identification of residues on CD40 и its ligand which are critical for the receptor-ligand interaction. Biochemistry 34,1833-44 (1995).
Carter et al., Nature Reviews Immunology 6, 343-357 (2006).
Diehl, L. et al. CD40 activation in vivo overcomes peptide-induced peripheral cytotoxic T-lymphocyte tolerance и augments anti-tumor vaccine efficacy. Nat. Med. 5, 774-779 (1999).
Ellmark et al., Identification of a Strongly Activating Human Anti-Cd40 Antibody that Suppresses HIV Type 1 Infection. AIDS Research и Human Rettroviruses, 24, 3, 367-373, (2008).
Ellmark et al; Modulation of the CD40-CD40L ligand interaction using human anti-CD40 single-chain antibody fragments obtained from the n-CoDeR® phage display library. Immunology, 106, 456-463.
European patent no. EP1885399
Fellouse, F.A. et al. High-throughput generation of synthetic antibodies from highly functional minimalist phage-displayed libraries. J Mol Biol 373, 924-940 (2007).
Francisco et al., Agonistic properties и in vivo antitumor activity of the anti-CD40 antibody SGN-14. Cancer Research 60, 3225-3231 (2000).
French, R.R., et al., CD40 antibody evokes a cytotoxic T-cell response that eradicates lymphoma и bypasses T-cell help. Nat Med 5, 548-53 (1999).
Gatenby et al., Why do cancers have high aerobi glycolysis? Nature review Cancer 4, 891-899(2004).
Glaude et al., The CD40 agonist antibody CP-870,893 enhances dendritic cell и B-cell activity и promotes anti-tumor efficacy in SCID-hu mice. Cancer Immunol Immunotherapy 60(7):1009-17(2011).
Hussein et al., A phase I multi-dose study of dacetumuzumab (SGN-40, a humananized anti-CD40 monoclonal antibody) in patients with multiple myeloma. Haematologica, 95: 845-848(2010).
Janeway's Immunobiology, 7: th edition, Garland Science (2008).
Kai et al., Nature Biotechnology, 26, 209-211 (2008).
Kalbasi, A. et al. CD40 expression by human melanocytic lesions и melanoma cell lines и direct CD40 targeting with the therapeutic anti-CD40 antibody CP-870,893. J Immunother 33, 810-816 (2010).
Katakura et al., Journal of Molecular Catalysis B: Enzymatic (2008).
Koide, A., et al. Exploring the capacity of minimalist protein interfaces: interface energetics и affinity maturation to picomolar KD of a single-domain antibody with a flat paratope. J Mol Biol 373, 941-953 (2007).
Law et al., Preclinical antilymphoma activity of a humanized anti-CD40 monoclonal antibody, SGN-14 Cancer Research 65,18, 8331-8338 (2005).
Loskog, A.S. & Eliopoulos, A.G. The Janus faces of CD40 in cancer. Semin. Immunol 21, 301-307 (2009).
Quezada, S.A., Jarvinen, L.Z., Lind, E.F., & Noelle, R.J. CD40/CD154 interactions at the interface of tolerance и immunity. Annu. Rev. Immunol. 22:307-28., 307-328 (2004).
Schonbeck, U. & Libby, P. The CD40/CD154 receptor/ligand dyad. Cell Mol Life Sci 58, 4-43 (2001).
Siepmann et al., Rewiring CD40 is necessary for deliveru of rescue signals to В cells in germinal centres и subsequent entry into the memory pool. Immunology, 102(3), 263-72 (2001).
Sklar et al., Annual Review Biophysical Biomol Structure, 31, 97-119, (2002).
Söderlind, E. et al. Recombining germline-derived CDR sequences for creating diverse single-framework antibody libraries. Nat Biotechnol 18, 852-6 (2000).
Sotomayor, E.M. et al. Conversion of tumor-specific CD4+ T-cell tolerance to T-cell priming through in vivo ligation of CD40. Nature Medicine 5, 780-787 (1999).
Staveley-O'Carroll, К. et al. In vivo ligation of CD40 enhances priming against the endogenous tumor antigen и promotes CD8+ Т cell effector function in SV40 Т antigen transgenic mice. J Immunol 171, 697-707 (2003).
Summerhayes & Franks, Journal of the National Cancer Institute 62: 1017-1023 (1979)
Tasci, I. et al., Soluble CD40 ligand levels in otherwise healthy subjects with impaired fasting glucose. Cell. Life. Sci. 58, 4-43 (2001).
Tong et al., CD40-directed gene therapy shows prospects for treating human cancers. Cancer Gene Therapy 10(1), 1-13 (2003).
Tutt et al., Т cell immunity to lymphoma following treatment with anti-CD40 monoclonal antibody. J Immunol 168 (6) 2720-8, (2002).
van Kooten, C. & Banchereau, J. CD40-CD40 ligand. J Leukoc Biol 67, 2-17 (2000).
van Mierlo, G.J. et al. CD40 stimulation leads to effective therapy of CD40(-) tumors through induction of strong systemic cytotoxic Т lymphocyte immunity. Proc. Natl. Acad. Sci. U. S. A. 99, 5561-5566 (2002).
White et al., Interaction with FcγRIIB is critical for the agonistic activity of anti-CD40 monoclonal antibody Journal of Immunology (187), 1754-1763, (2011).
Wilson et al., Cancer Cell (19), 101-113, (2011).
Реферат
Изобретение относится к области биохимии, в частности к антителу или его антигенсвязывающему фрагменту c биспецифическим связыванием с CD40. Также раскрыты иммуноконъюгат, включающий указанное антитело или антигенсвязывающий фрагмент, молекула нуклеиновой кислоты, кодирующая указанное антитело или его фрагмент, экспрессионный вектор, содержащий указанную нуклеиновую кислоту, клетка-хозяин, содержащая указанный вектор, фармацевтическая композиция, содержащая указанное антитело или его фрагмент. Раскрыты применение антитела или антигенсвязывающего фрагмента, способ лечения индивидуума, с помощью указанного антитела или его фрагмента. Изобретение обладает способностью специфически связываться с CD40, что позволяет эффективно лечить рак, ассоциированный с экспрессией CD40. 8 н. и 53 з.п. ф-лы, 14 пр., 12 табл., 14 ил.
Формула
Документы, цитированные в отчёте о поиске
Гуманизированные анти-cd40-антитела и способы их применения

Комментарии