Композиция, ингибирующая теломеразу - RU2639819C2
Код документа: RU2639819C2
Чертежи



Описание
Область техники
Изобретение относится к области органической и медицинской химии, молекулярной биологии и касается композиции, ингибирующей теломеразу, которая может быть использована для изучения теломераз и каталитических субъединиц теломераз, обратных транскриптаз, а также для изучения и лечения опухолевых и вирусных заболеваний.
Уровень техники
Теломераза - это фермент, необходимый для компенсации укорочения длины теломер в клетках эукариот. Теломеры состоят из характерных тандемных повторов (например, TTAGGG у человека), найденных на концах большинства эукариотических хромосом (Blackburn, "Structure and Function of Telomeres,"Nature, 350: 569-573, 1991). Количество повторов определяет длину теломер. Пролиферативный потенциал клетки связывают с длиной теломер, так как стабильность и целостность эукариотических хромосом зависят от динамической структурной организации теломер (Baird DM. "Mechanisms of telomeric instability", Cytogenet Genome Res. 2008; 122(3-4): 308-14, 2009), при их укорочении меньше критической длины стабильность нарушается, затем клетка гибнет. Теломеры играют важную роль в контроле разделения хромосом и вовлечены в регулирование клеточного цикла. С каждым клеточным делением у соматической клетки теряются приблизительно 60-100 оснований с концов хромосом. Теломеры сокращаются, клетка, в конечном счете, достигает кризиса, и в клетке запускается апоптоз. В организме существуют клетки с неограниченным потенциалом деления. Именно в них (в половых, стволовых клетках, а также в клетках опухоли) существует процесс компенсации укорочения теломер. За этот процесс отвечает фермент-теломераза. Теломераза активна в таких клетках и поддерживает длину теломер выше кризисного уровня. Теломераза - это специализированная обратная транскриптаза (для человека hTERT), работающая в комплексе с собственной рибонуклеиновой кислотой (РНК). Эта РНК называется теломеразной (для человека hTERC) и содержит участок для синтеза теломерных повторов ДНК (матричный участок). Другими словами, для приобретения способности к неограниченному делению клетка должна активировать механизм, поддерживающий длину теломер выше критического уровня, а именно теломеразу. Так, существенный уровень теломеразной активности был обнаружен в более чем 85% опухолей (Kim et al. "Specific Association of Human Telomerase Activity with Immortal Cells and Cancer", Science, 266: 2011-2015, 1994). Теломеразная активность также присутствует в стволовых сумках нормальных тканей, но на более низком уровне (Morin, "Is Telomerase a Universal Cancer Target?", J. Natl. Cancer Inst., 87: 859-861, 1995). Таким образом, присутствие активной теломеразы в опухоли обеспечивает наличие мишени, дающей потенциально хорошую селективность к опухолевым клеткам по отношению к здоровой ткани. Ингибирование теломеразы было предложено в качестве нового подхода к терапии рака (первые работы Morin, "Is Telomerase a Universal Cancer Target?", J. Natl. Cancer Inst., 87: 859-861, 1995; Parkinson, "Do Telomerase Antagonists Represent a Novel Anti-Cancer Strategy?" Brit. J. Cancer, 73: 1-4, 1996; Raymond et al. "Agents that target telomerase and telomeres," Curr Opinion Biotech., 7: 583-591, 1996, более современное состояние в обзоре Shay JW, Wright WE. Telomerase therapeutics for cancer: challenges and new directions. Nat Rev Drug Discov. 5(7): 577-84, 2006).
Третичная структура белка каталитической субъединицы теломеразы человека остается на настоящий момент неразрешенной, но на основе анализа первичной структуры показано, что этот белок сходен с другими обратными транскриптазами (Lingner et al. "Reverse Transcriptase Motifs in the Catalytic Subunit of Telomerase," Sci., 276: 561-567, 1997), поэтому ее активность подавляется при использовании ингибиторов обратных транскриптаз, например AZT (Strahl and Blackburn, "Effects of Reverse Transcriptase Inhibitors on Telomere Length and Telomerase Activity in Two Immortalized Human Cell Lines", Mol. Cell. Biol., 16; 53-65, 1996) и других нуклеозидов (Fletcher et al., "Human Telomerase Inhibition by 7-Deaza 2'-deoxypurine Nucleoside Triphosphates", Biochem, 35: 15611-15617, 1996). Также была показана возможность ингибирования любой теломеразной активности при использовании антисмысловой последовательности к матричному участку теломеразной РНК, например нуклеиновых кислот, слитых с пептидом (Norton et al. "Inhibition of Human Telomerase Activity by Peptide Nucleic Acids", Nature Biotechnol., 14: 615-619, 1996) и фосфотиоатных олигонуклеотидов (Mata et al. "A Hexameric Phosphorothioate Oligonucleotide Telomerase Inhibitor Arrests Growth of Burkitt's Lymphoma Cells in Vitro and in Vivo", Toxicol Appl. Pharmacol., 144: 189-197, 1997). Антисмысловый дезоксирибонуклеотид, содержащий 185 нуклеотидов hTERC, был в состоянии сократить теломеры в клетках HeLa за 23-26 клеточных делений до критического уровня и вызвал апоптоз. Другой дезоксирибонуклеотид, содержащий 2'-5'-аденилат (2-5А) с тем, чтобы не только связать, но и расщепить hTERC, вызвал апоптоз в глиоме, раке простаты, раке шейки матки, мочевого пузыря и яичников в течение 4-5 дней. Чтобы увеличить сродство к hTERC-последовательности и стабильность олигонуклеотида были использованы 2'-O-метил-РНК-олигонуклеотиды. Самым эффективным оказался олигонуклеотид GRN163 (Asai et al. A novel telomerase template antagonist (GRN163) as a potential anticancer agent. Cancer Research, 63: 3931-3939, 2003). Клетки, культивируемые с этим соединением, гибли в течение 100 дней, GRN163 ингибировал теломеразную активность при очень низких, по сравнению с другими олигонуклеотидами, концентрациях, GRN163L является первым ингибитором теломеразы, который вошел в клиническую практику. Доклинические исследования показали безопасность и эффективность такого ингибирования. Безопасность и определение дозы для пациентов, невосприимчивых к другой терапии, находятся в стадии изучения. Эти исследования не закончены (США, Clinical Trials. gov, NCT00310895), однако уже показанная эффективность GRN163L - однозначное подтверждение того, что ингибирование теломеразы - это основа антираковой терапии.
Из WO 99/01560 от 14.01.1999 (RU 2000102361, дата приоритета 01.07.1998) также известны ингибиторы теломеразной активности олигонуклеотидной природы.
Известны примеры использования координационных соединений железа (III), цинка (II), никеля (II), марганца (III) и платины (II) (Monchaud et al. "A hitchhiker's guide to G-quadruplex ligands", Org. Biomol. Chem., 6, 627, 2008). Большинство координационных соединений содержит производные порфирина или конденсированные пиридиновые системы. Ингибирование теломеразы наблюдается при значениях IC50-TRAP (IC50 - концентрация ингибитора, при которой активность фермента подавляется на 50%) от 0,12 до 30 мкМ.
Известен ингибитор теломеразы, который представляет собой координационное соединение меди (II), содержащее лиганд на основе производного порфирина [S.Е. Evans, М.A. Mendez, K.В. Turner, L.R. Keating, R.Т. Grimes, S. Melchoir and V.A. Szalai, J. Biol. Inorg. Chem., 2007, 12(8), 1235-1249]. Это соединение селективно взаимодействует с квадруплексом ДНК, значение IC50-TRAP в экспериментах по ингибированию теломеразы составляет 26 мкМ. К недостаткам этого ингибитора теломеразы следует отнести сложность синтеза органического лиганда и координационного соединения, а также низкое значение IC50.
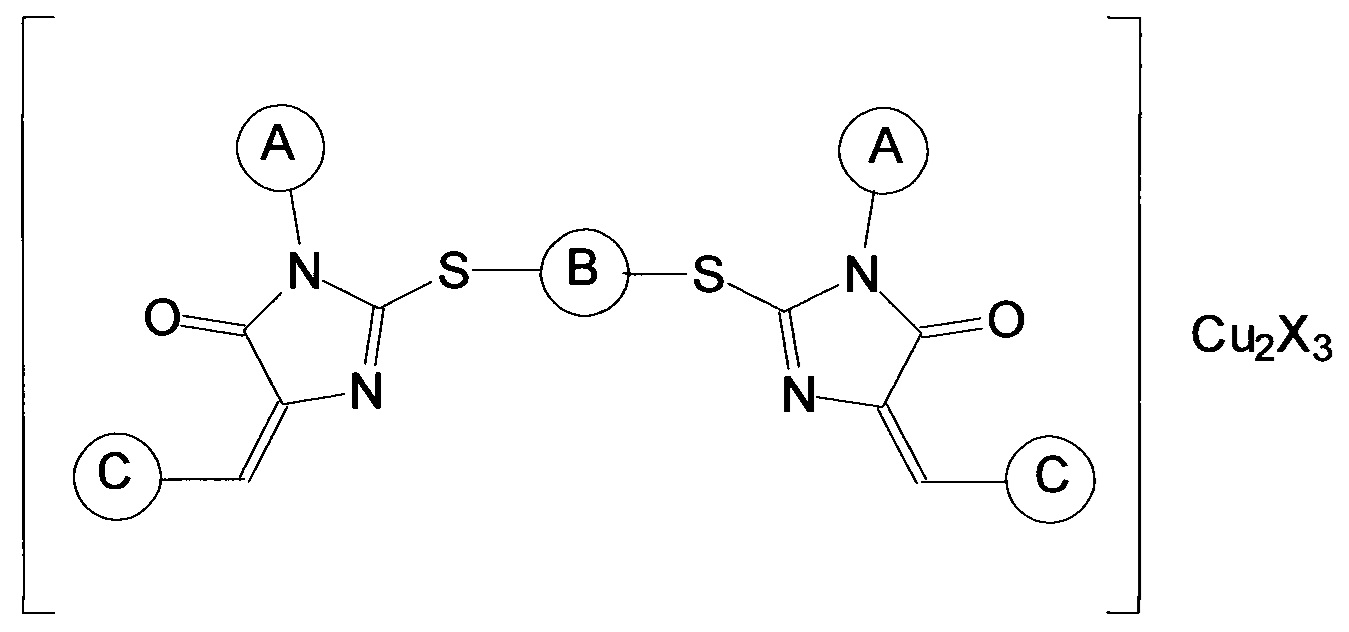
Наиболее близким аналогом изобретения является группа соединений, раскрытая в заявке на выдачу патента РФ №2010113946 от 09.04.2010, «Ингибиторы теломеразы и способ их получения», опубл. 20.10.2011 (патент №2468030), и включающая координационные соединения производных имидазол-4-она общей формулы

где заместитель А выбран из группы, включающей арильные заместители, конденсированные арильные заместители, циклопентил, циклогексил, алифатические заместители, алифатические заместители с двойной связью, алифатические заместители с тройной связью, метиламиновый заместитель CH3NH-, карбэтокси-группу C2H5O(O)С-, пятичленные гетероциклические заместители с одним атомом азота, пятичленные гетероциклические заместители с двумя атомами азота, шестичленные гетероциклические заместители, заместитель В отсутствует или является алифатическим заместителем, заместитель С представляет собой гетероарильный заместитель, присоединяемый к производному имидазол-4-она через атом углерода и выбран из группы, включающей 5-членные ненасыщенные моноциклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, 6-членные ненасыщенные моноциклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, 8-, 9- и 10-членные ненасыщенные бициклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, X представляет собой хлорид Cl или нитрат NO3. Эти соединения обладают выраженным ингибирующим действием в отношении теломеразы, но их использование ограничивается низкой растворимостью в воде, что во многих случаях не позволяет достичь требуемой величины эффекта ингибирования.
Указанный недостаток известных ингибиторов теломеразы может быть преодолен при использовании композиции, ингибирующей теломеразу, более подробно описанной далее со ссылками на прилагаемые иллюстративные материалы.
Раскрытие изобретения
Технический результат, достигаемый при использовании заявленных композиций, ингибирующих теломеразу, заключается в возможности достижения больших величин эффекта ингибирования теломеразы за счет увеличения растворимости координационных соединений производных имидазол-4-она.
Описание чертежей
Фиг. 1 - структурные формулы заместителей А в производных имидазол-4-она, которые могут входить в состав заявленной композиции, ингибирующей теломеразу.
Фиг. 2 - структурные формулы заместителей B в заявленных производных имидазол-4-она, которые могут входить в состав заявленной композиции, ингибирующей теломеразу.
Фиг. 3 - структурные формулы заместителей С в заявленных производных имидазол-4-она, которые могут входить в состав заявленной композиции, ингибирующей теломеразу.
Раскрытие изобретения
Согласно изобретению композиция, ингибирующая теломеразу (фармацевтическая композиция), включает по крайней мере один блок-сополимер полиоксиэтилена и полиоксипропилена, а также по крайней мере одно координационное соединение производного имидазол-4-она общей формулы

где заместитель А выбран из группы, включающей арильные заместители, конденсированные арильные заместители, циклопентил, циклогексил, алифатические заместители, алифатические заместители с двойной связью, алифатические заместители с тройной связью, метиламиновый заместитель CH3NH-, карбэтокси-группу C2H5O(O)С-, пятичленные гетероциклические заместители с одним атомом азота, пятичленные гетероциклические заместители с двумя атомами азота, шестичленные гетероциклические заместители, заместитель В отсутствует или является алифатическим заместителем, заместитель С представляет собой гетероарильный заместитель, присоединяемый к производному имидазол-4-она через атом углерода, X представляет собой хлорид Cl или нитрат NO3.
В предпочтительном варианте выполнения изобретения заместитель А является незамещенным, или монозамещенным, или дизамещенным арильным заместителем, при этом заместители R в арильной группе выбраны из группы, включающей галогены и алкильные заместители.
В предпочтительном варианте выполнения изобретения заместитель А является незамещенным, или монозамещенным, или дизамещенным конденсированным арильным заместителем, при этом заместители R в конденсированной арильной группе выбраны из группы, включающей галогены и алкильные заместители.
В предпочтительном варианте выполнения заместитель А выбран из группы, включающей фенил C6H5-, 3-хлор-4-фторфенил 3-Cl-4-F-С6Н3-, 4-карбэтоксифенил 4-C2H5O(O)СС6Н4-, метил СН3-, аллил СН2=СНСН2-, 2-антрил, пропил С3Н7- (фиг. 1).
В предпочтительном варианте выполнения заместитель В выбран из группы, включающей 1,2-этандиил -(СН2)2-, 1,3-пропандиил -(СН2)3-, 1,4-бутандиил -(СН2)4-, 1,6-гександиил -(СН2)6-, 1,10-декандиил -(СН2)10- (фиг. 2).
В предпочтительном варианте выполнения заместитель С выбран из группы, включающей 5-членные ненасыщенные моноциклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, 6-членные ненасыщенные моноциклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, 8-, 9- и 10-членные ненасыщенные бициклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S.
В предпочтительном варианте выполнения заместитель С выбран из группы, включающей 2-хинолил, 2-пиридил, 1-метил-2-имидазолил, 4-метил-5-имидазолил, 5-имидазолил, 2-имидазолил, 1,5-диметил-3-пиразолинил, 1,5-дифенил-3-пиразолинил (фиг. 3).
В предпочтительном варианте выполнения изобретения координационное соединение производного имидазол-4-она в композиции содержится в количестве от 5 до 60 масс%., блок-сополимера - остальное.
В предпочтительном варианте выполнения изобретения в блок-сополимере полиоксиэтилена и полиоксипропилена молярная масса гидрофобной части блок-сополимера составляет от 1500 г/моль до 36000 г/моль.
В предпочтительном варианте выполнения изобретения в блок-сополимере полиоксиэтилена и полиоксипропилена содержание гидрофобной части блок-сополимера составляет от 50% по массе до 80% по массе.
В предпочтительном варианте выполнения изобретения блок-сополимер полиоксиэтилена и полиоксипропилена выбран из группы, включающей плюроники Р85, F108, F127, L101 и F68.
В таблице 1 и таблице 2 приведены сведения о блок-сополимерах полиоксиэтилена и полиоксипропилена, которые могут входить в состав заявленной композиции, ингибирующей теломеразу.
В предпочтительном варианте выполнения изобретения композиция содержит от 2 до 50 мг/мл блок-сополимер полиоксиэтилена и полиоксипропилена.



В предпочтительном варианте выполнения изобретения композиция содержит от 3 до 10 мг/мл координационного соединения производного имидазол-4-она.
В одном из вариантов выполнения изобретения композиция может быть представлена в виде водного раствора.
Изобретение относится также к сухой композиции, полученной из композиции, содержащей воду (водного раствора). В предпочтительном варианте выполнения изобретения сухая композиция получена методом лиофильной сушки. В предпочтительном варианте выполнения изобретения сухая композиция дополнительно содержит вспомогательные добавки, выбранные из группы, включающей наполнители, разрыхлители, смазывающие и скользящие вещества, эмульгаторы, подсластители, ароматизаторы. В предпочтительном варианте выполнения изобретения сухая композиция дополнительно содержит вспомогательные добавки, выбранные из группы, включающей лактозу, цитрат натрия, соли фосфорной кислоты, крахмал, стеарат магния, лаурилсульфат натрия, тальк, высокомолекулярный полиэтиленгликоль.
Из уровня техники известны приемы, позволяющие в ряде случаев повысить растворимость малорастворимых соединений за счет их солюбилизации в растворах поверхностно-активных веществ, например, как указано в патенте США №6227410 от 21.08.2001, блок-сополимеров полиоксиэтилена и полиоксипропилена - плюроников. Тем не менее, на основе информации, известной из уровня техники, без проведения дополнительных исследований нельзя определить, как изменится ингибирующая активность соединения при его солюбилизации.
Таким образом, влияние поверхностно-активных веществ на активность ингибиторов теломеразы, раскрытых в заявке на выдачу патента РФ №2010113946 от 09.04.2010, не является очевидным для специалиста в соответствующей области техники.
При проведении экспериментальных исследований было найдено, что при солюбилизации ряда координационных соединений производных имидазол-4-она, обладающих ингибирующим действием в отношении теломеразы, в растворах блок-сополимеров полиоксиэтилена и полиоксипропилена - плюроников Р85, F108, F127, L101 и F68 - ингибирующая активность координационного соединения сохраняется, при этом за счет увеличения растворимости ингибитора становится возможным достижение больших величин эффекта ингибирования.
Изобретение иллюстрируется примерами альтернативных вариантов его выполнения.
Пример 1
Композицию, ингибирующую теломеразу, готовили из комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2

и блок-сополимера полиоксиэтилена и полиоксипропилена - плюроника Р85.
Получение композиции, ингибирующей теломеразу, осуществляли следующим образом.
Раствор координационного соединения производного имидазол-4-она в ацетонитриле смешивали с раствором блок-сополимера полиоксиэтилена и полиоксипропилена в метаноле и полученную смесь упаривали, при этом получали сухую композицию, ингибирующую теломеразу. Пленку, образовавшуюся после удаления растворителя, растворяли в необходимом количестве воды с получением раствора солюбилизированного координационного соединения производного имидазол-4-она - композиции, ингибирующей теломеразу.
Экспериментально было определено, что в соответствии с этим способом можно получить растворы солюбилизированного комплекса (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2 с содержанием координационного соединения производного имидазол-4-она 3 мг/мл при содержании блок-сополимера полиоксиэтилена и полиоксипропилена 30 мг/мл. Растворимость комплекса (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанил-диил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2 в воде составляет 0,6 мг/мл. Таким образом, введение в состав композиции, ингибирующей теломеразу, блок-сополимера полиоксиэтилена и полиоксипропилена приводит к увеличению растворимости комплекса (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2 в 5 раз.
Активность композиции измеряли следующим образом.
Клетки (MCF-7) культивировали в течение 24 часов в жидкой культуральной среде перед определением активности композиции. Затем в культуру клеток добавляли определенное количество полученной композиции, ингибирующей теломеразу, и культивировали в течение 24 часов. Затем клетки отделяли от культуральной среды, помещали в жидкую культуральную среду, не содержащую композиции, ингибирующей теломеразу, и культивировали в течение 72 часов. Затем определяли количество живых клеток с использованием стандартной процедуры, основанной на восстановлении бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия - реагента МТТ - клеточными ферментами до окрашенного нерастворимого формазана. Для этого клетки отделяли от культуральной среды, помещали в жидкую культуральную среду, содержащую реагент МТТ, и культивировали в течение 3 часов при 37°С. Затем культуральную среду отделяли от осадка формазана, осадок формазана растворяли в диметилсульфоксиде и измеряли оптическую плотность раствора при 562 нм с использованием прибора SpectraMax М5 производства «Molecular Devices». По предварительно построенному градуировочному графику определяли количество формазана в растворе, которое пропорционально количеству живых клеток. Уменьшение интенсивности размножения клеток после обработки клеточной культуры композицией, ингибирующей теломеразу, характеризует подавление активности теломеразы в клетках и, как следствие, ингибирующую активность композиции, ингибирующей теломеразу.
Было определено, что интенсивность размножения клеток уменьшалась на 60% при обработке композицией, ингибирующей теломеразу, содержащей 3 мкг/мл комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2. Такое же уменьшение интенсивности размножения клеток было зафиксировано при обработке клеток водным раствором комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2 с концентрацией 3 мкг/мл, что свидетельствует о том, что присутствие блок-сополимера полиоксиэтилена и полиоксипропилена в композиции, ингибирующей теломеразу, не уменьшает ингибирующую активность координационного соединения производного имидазол-4-она.
Таким образом, экспериментально было показано, что при использовании заявленной композиции, ингибирующей теломеразу, ингибирующая активность координационного соединения производного имидазол-4-она сохраняется, при этом становится возможным использование композиций, ингибирующих теломеразу, с большим содержанием комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, что позволяет увеличить максимально достижимую величину эффекта ингибирования.
Экспериментально было показано, что после удаления из композиции, ингибирующей теломеразу, растворителя методом лиофильной сушки и последующего растворения лиофилизованной композиции, ингибирующей теломеразу, в воде ингибирующая активность композиции, ингибирующей теломеразу, полностью сохраняется.
Группа примеров 1
Композиции, ингибирующие теломеразу, готовили аналогично примеру 1, при этом в качестве координационных соединений производных имидазол-4-она использовали комплекс (5Z,5'Z)-2,2'-(декан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2

комплекс (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2

комплекс (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-пропил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2

комплекс (5Z,5'Z)-2,2'-(бутан-1,4-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2
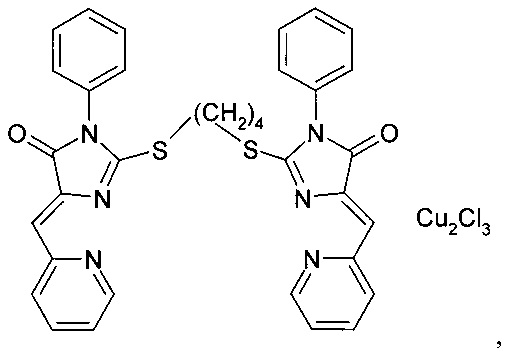
комплекс (5Z,5'Z)-2,2'-(бутан-1,4-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2

комплекс (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-хинолилметилен)-3-пропил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2

комплекс (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5 -(2-пиридилметилен)-3-циклопентил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-циклогексил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'2)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(бут-2-инил)-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метиламино-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'Z)-2,2'-(этан-l,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-карбэтокси-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанил-диил)бис(5-(2-пиридилметилен)-3-(2-оксопирролидин-3-ил)-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(1-метил-1Н-имидазол-2-ил)-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(2-пиридил)-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'Z)-2,2'-дисульфанилбис(5-(2-пиридилметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанил-диил)бис(5-(1-метил-1Н-имидазол-2-илметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2, комплекс (5Z, 5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она) с Cu(NO3)2, при этом в качестве блок-сополимеров полиоксиэтилена и полиоксипропилена использовали плюроники Р85, F108, F127, L101, F68, при этом использовали такие количества блок-сополимеров полиоксиэтилена и полиоксипропилена и координационных соединений производных имидазол-4-она, чтобы в готовых композициях, ингибирующих теломеразу, содержание блок-сополимеров полиоксиэтилена и полиоксипропилена варьировалось в пределах от 2 до 50 мг/мл, а содержание координационных соединений производных имидазол-4-она варьировалось в пределах от 3 до 10 мг/мл, при этом молярная масса гидрофобной части блок-сополимера полиоксиэтилена и полиоксипропилена от 1500 г/моль до 36000 г/моль, при этом содержание гидрофобной части в блок-сополимере полиоксиэтилена и полиоксипропилена варьировалась от 50% по массе до 80% по массе.
Экспериментально было определено, что во всех случаях введение в состав композиций, ингибирующих теломеразу, блок-сополимеров полиоксиэтилена и полиоксипропилена приводит к увеличению растворимости координационных соединений производных имидазол-4-она в 3-10 раз.
Активность композиции измеряли аналогично примеру 1. Во всех случаях присутствие блок-сополимеров полиоксиэтилена и полиоксипропилена в композициях, ингибирующих теломеразу, не уменьшало ингибирующую активность координационных соединений производных имидазол-4-она.
Таким образом, экспериментально было показано, что при использовании заявленных композиций, ингибирующих теломеразу, ингибирующая активность координационных соединений производных имидазол-4-она сохраняется, при этом становится возможным использование композиций, ингибирующих теломеразу, с большим содержанием координационных соединений производных имидазол-4-она, что позволяет увеличить максимально достижимую величину эффекта ингибирования.
Экспериментально было показано, что после удаления из композиций, ингибирующих теломеразу, растворителя методом лиофильной сушки и последующего растворения лиофилизованных композиций, ингибирующих теломеразу, в воде ингибирующая активность композиций, ингибирующих теломеразу, полностью сохраняется.
Таким образом, при использовании заявленных композиций, ингибирующих теломеразу, достигается технический результат, заключающийся в возможности достижения больших величин эффекта ингибирования теломеразы за счет увеличения растворимости координационных соединений производных имидазол-4-она.
Реферат
Изобретение относится к композиции, ингибирующей теломеразу. Указанная композиция включает блок-сополимер полиоксиэтилена и полиоксипропилена, а также координационное соединение производного имидизол-4-она, ингибирующее теломеразу, общей формулыПри этом координационное соединение производного имидазол-4-она содержится в количестве от 5 до 60 мас.%, блок-сополимер – остальное. Изобретение обеспечивает больший эффект ингибирования теломеразы за счет увеличения растворимости координационных соединений производных имидазол-4-она. 8 з.п. ф-лы, 3 ил., 2 табл., 1 пр.
Формула

Комментарии