Лекарственный препарат - RU2161961C1
Код документа: RU2161961C1
Чертежи







Описание
Настоящее изобретение относится к медицине, а точнее касается препарата для профилактики и лечения воспалительных специфических и неспецифических заболеваний различной этиологии и локализации, а также использование его в качестве средства воздействия на вирусы герпеса и иммунодефицита человека, антисептического, дезинфицирующего, иммуноадъювантного и спермацидного средства.
Поверхностно-активные вещества (ПАВ) нашли применение в медицине в основном как антисептические и дезинфицирующие средства - роккал, зефирол, катамин АБ, церигель, дегмицид, хлоргексидина биглюконат и др. (Машковский М. Д., Лекарственные средства. - М.: Медицина, 1999). Ограниченность применения ПАВ в медицине связана с тем, что многие из них наряду с антимикробными свойствами обладают раздражающим действием на кожу и слизистые, а также токсическим влиянием на организм. Кроме того, до конца не выяснен механизм их действия на микро- и макроорганизм, не разработаны простые и информативные методы, позволяющие быстро и точно характеризовать безвредность действия, нет сведений о мутагенных свойствах, спорным остается вопрос об их канцерогенности (Кривошеин Ю.С. с соавт., Антибиотики, 1984, N 7, с. 519-526; Скуратович А.А. с соавт. Вестник дермат. и венер., 1983, N 11, с. 29-32).
Известны средства для профилактики специфических (венерических) заболеваний - марганцовокислый калий, фурацилин, хлоргексидин, препараты серебра, сулемы и другие (Овчинников Н.М. с соавт., Вестник дерматологии и венерологии, 1978, N 6, с. 49; Скуратович А.А. Акт. вопр. дерм. и венер. Минск, 1980, С. 172-175).
Для лечения заболеваний мочеполовой системы применяют широко антибиотики, борную кислоту, сульфат цинка, осарсол, имидазольные и другие соединения. Однако ни одно из перечисленных средств не является эффективным одновременно против возбудителей специфических и неспецифических заболеваний мочеполовой системы, большиство из них оказывают раздражающее действие на кожу и слизистые половых органов, некоторые дорогостоящие, к ним вырабатывается резистентность у микроорганизмов.
Известно применение антисептиков в лечении воспалительных заболеваний носоглотки. Для этого используют фурацилин, перманганат калия, риванол, хонозол, хлоргексидина биглюконат, октинисепт и др. Главным недостатком этих средств является подавление ими двигательной активности мерцательного эпителия верхних дыхательных путей, местных иммунных реакций, а также выраженное раздражающее действие (Пискунов Г.З. с соавт. Российская ринология, 1996, N 5, с. 23-25; Пискунов С.З. с соавт. Российская ринология, 1995, N 3-4, с. 6-11).
Антисептики применяются в офтальмологии для лечения конъюнктивитов и профилактики посттравматических и послеоперационных ослажнений (фурацилин, борная кислота, декаметоксин, сульфат цинка и др.). Эффективность лечения этими препаратами не очень высока, кроме этого, нередко наблюдаются их раздражающее действие и аллергические реакции (Майчук Ю.Ф. Аллергические заболевания глаз. - М.: Медицина, 1983, 224 с.). Эти препараты не эффективны при хламидиозных и герпетических поражениях глаз.
Имеются экспериментальные работы по исследованию противовирусного действия некоторых ПАВ, противозачаточных средств, содержащих эти соединения, а также применение их для профилактики ВИЧ-инфекции у людей (Wainberg М.А. et al. Inactivaition of Human Immunodeficiency Virus Type 1 in Tissue Culture Fluid and in Genital Secretions by the Spemicide Bensalkonium Chloride; J. of Clin. Microbiol., 1990, N 1, 156-159; Polsky B. et al. In vitro inactivation of HIV-I by contraceptive sponge containing Nonoxynol-9. The Lanctt, 1988, 1 N 8600, p. 1456, J. Kreiss et al. Efficacy of Nonoxynol-9 Contraceptive Sponge Use in Preventing Heterosexual Acquisition of HIV in Nairobi Prostitutes., JAMA, 1992, N 4,477-482).
Однако до сего времени не найдено надежное средство для вышеуказанных целей.
Цель изобретения - разработка лекарственного препарата (ЛП), обладающего губительным действием на возбудителей инфекционных и воспалительных заболеваний (бактерии, вирусы, грибы, простейшие), не вызывая побочных явлений со стороны организма при его применении.
Задача решается тем, что
предлагается лекарственный препарат на
основе бензилдиметил[3-(миристоиламино)пропил]аммония хлорид моногидрата (ЛП) следующей химической формулы
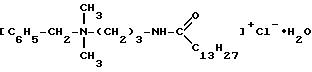
в качестве средства для лечения и профилактики инфекционных и воспалительных заболеваний, в том числе специфических и неспецифических заболеваний мочеполовой системы, носоглотки, глаз, а также средства для профилактики герпеса и ВИЧ-инфекции при половом пути передачи, спермацидного, антисептического и дезинфицирующего средства, содержащего эффективное количество активного компонента ЛП в фармацевтическом разбавителе.
ЛП получают известной реакцией конденсации миристамидопропилдиметиламина с хлористым бензилом с последующей очисткой до требуемой квалификации.
Полученное вещество представляет собой белый мелкокристаллический порошок без запаха, растворимый в воде, низкомолекулярных спиртах, ацетоне, хлороформе.
Для целей лечения и
профилактики предлагается использовать ЛП в фармацевтическом разбавителе с массой долей 0,01 - 1,0%, когда разбовителем может быть
вода, органический растворитель, а также любая растительная, животная
или синтетическая основа при следующем соотношении компонентов, %:
Фармацевтический разбавитель - 99,0 - 99,9
ЛП - 1,0 - 0,01
Такие лекарственные формы обеспечивают защиту
от бактериальных, вирусных, грибковых и протозойных инфекций, передающихся половым путем, а также надежный терапевтический
эффект при уретропростатитах, синуситах, конъюнктивитах и других
воспалительных заболеваниях различной локализации.
Предлагаемый препарат может выпускаться в виде 0,01-1,0% раствора на дистиллированной воде в специальных флаконах с насадкой из полиэтилена, а также в виде мази, геля, свечей, таблеток и в аэрозольной упаковке.
Доклинические испытания препарата
Антимикробные свойства ЛП
С помощью методик,
рекомендованных Всемирной организацией здравоохранения (ВОЗ), исследовали антимикробное действие ЛП в отношении 611 стандартных музейных и
диких штаммов микроорганизмов (413 грамотрицательные, 135
грамположительные бактерии, 52 грибы, 8 вирусы, 3 простейшие).
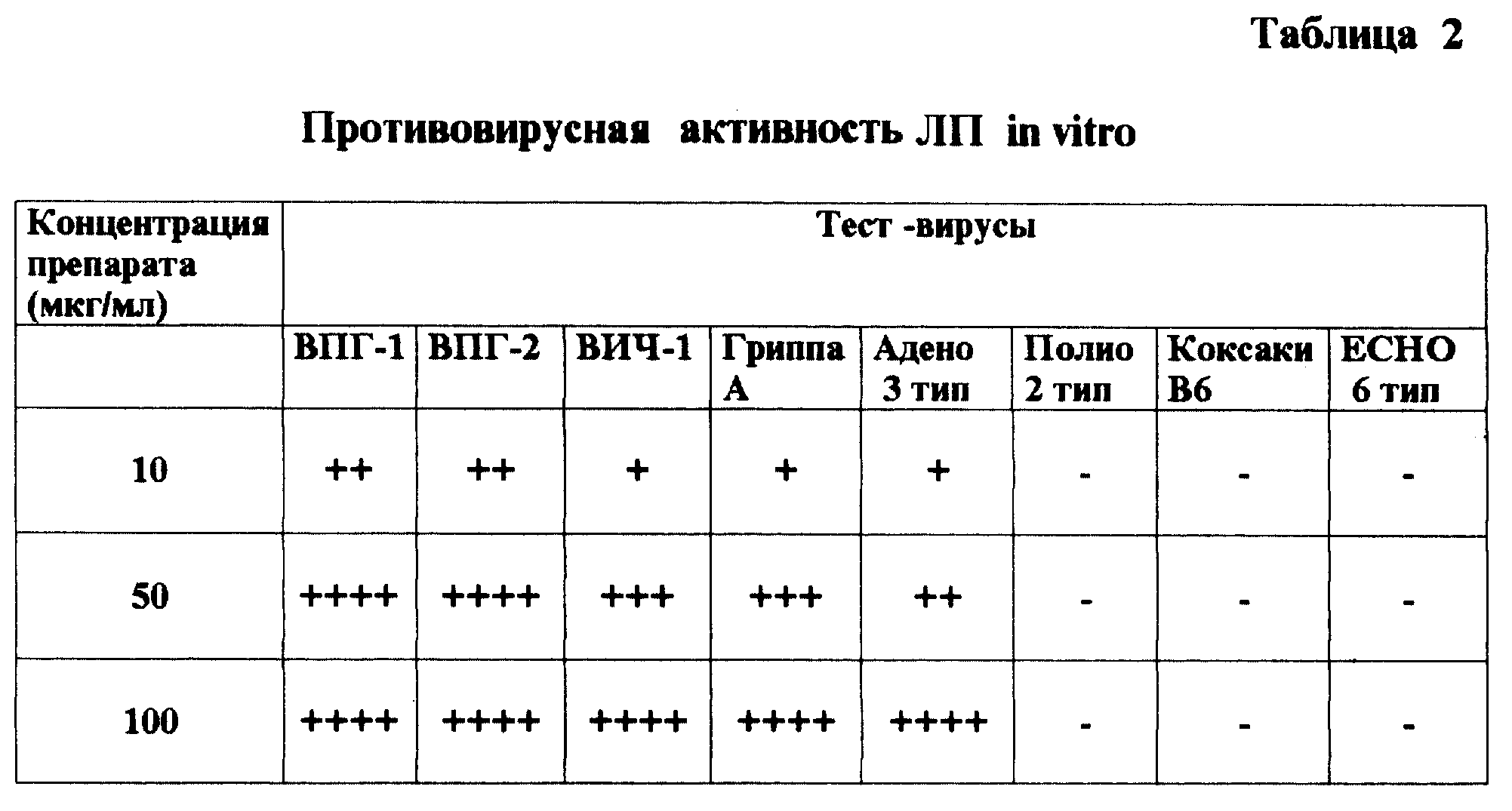
Полученные данные показали, что ЛП наиболее активен в отношении грамположительных бактерий, вегетативных форм бацилл и грибов, возбудителей дерматомикозов (0,0001 - 0,01%). Диапазон антимикробного влияния ЛП на грамотрицательные бактерии находился для большинства культур в пределах 0,002 - 0,05%. Рост бактерий родов Proteus, Providencia и Mycobacterium подавлялся при концентрации препарата 0,5 - 2,0%. Простейшие - Trichomonas vaginalis оказались чувствительны к концентрации ЛП 0,002 - 0,02%. ЛП показал высокие вирулицидные свойства в отношении сложных вирусов (герпесвирусы, ВИЧ-1, гриппа, аденовирусы и др.) (см. табл. 1 и 2).
Выявлено, что ЛП оказался наиболее активным анти-ВИЧ-1 средством по сравнению с другими дезинфектантами, испытанными для инактивации этого вируса. Наши данные полностью совпадают с результатами, полученными другими исследователями (табл. 3).
Антимикробные свойства ЛП сохраняются длительное время в условиях комнатной температуры, холодильника (срок наблюдения до 5 лет). Бактерицидная активность ЛП не зависит от лекарственной устойчивости микроорганизмов. ЛП подавляет конъюгационную передачу плазмид, детерминирующих патогенные свойства бактерий (Hly, Ent, R и других).
Механизм антимикробного и вирулицидного действия ЛП, изученный с помощью электронной микроскопии, физико-химических и биохимических методов, показал, что он обусловлен дезинтеграцией поверхностных гликопротеидов клеточной стенки, а также нарушением в клетке ферментных систем. Эти процессы идут параллельно и зависят от дозы препарата.
Иммуномодулирующие свойства ЛП.
Используя общепринятые методы оценки гуморального и клеточного иммунитета in vitro и in vivo выявлено, что препарат ЛП обладает дозозависимым действием на иммунную систему. В рабочих концентрациях ЛП вызывает иммуноадъювантный эффект, что проявляется в усилении первичного и вторичного иммунного ответа; в более высоких концентрациях - иммунодепрессивный, подавляя иммунные реакции. Стимулирующее влияние проявляется на опсонофагоцитарный механизм и такие показатели, как фагоцитарное число, фагоцитарный индекс, HCT-тест. Отмечено повышение уровня Еа-РОК и Ет-РОК; РБТЛ с ФГА стимулируют функциональную активность T-T и T-B-индуцированных хелперов, снижая активность T-T и T-B- индуцированных супрессоров. Таким образом, доказано дозозависимое стимулирующее влияние ЛП на поглотительную способность лейкоцитов и уровень кислородозависимых систем микробицидности, экспрессию моноцитарными клетками рецепторов к Fc-фрагменту иммуноглобулинов и C-компоненту комплемента. На основании полученных данных можно сделать вывод о том, что ЛП обладает не только антисептическими, но и иммуномодулирующими свойствами.
Токсикология
Острая токсичность определялась по LD50 на белых мышах и крысах при однократном
внутрижелудочном и подкожном введении препарата по общепринятой методике. Полученные
данные показали, что LD50 ЛП при внутрижелудочном введении мышам составляет 1000 мг/кг, а крысам - 1200
мг/кг. Подкожные инъекции препарата вызывали гибель животных от меньших доз - LD50 составила для мышей 628 м/кг и крыс - 670 мг/кг. LD50 при внутривенном введении ЛП составляла
для мышей 38,5 мг/кг, а крысам - 42,5 мг/кг.
На основании полученных данных можно заключить, что ЛП относится к препаратам с низкой токсичностью - IV класс опасности [ГОСТ 12.1.007-76. Токсическое действие веществ на организм (классы опасности)].
Хроническая токсичность ЛП изучалась на кроликах, которым в течение 45 сут наносили ежедневно по 3 раза в день на выбритые участки кожи 0,01% - 0,1% -1,0% растворы. На каждую дозу было взято по 5 животных. Мазь, содержащую 0,5% ЛП, наносили крысам (16 животных) в виде тонкого слоя ежедневно на участок кожи, равный 0,1 площади тела в течение 1 мес. Концентрат аэрозоля ЛП вводили кроликам во влагалище в дозе 1 мл на животное ежедневно (7 животных). Клей (0,5%) апплицировали крысам по методике нанесения мази.
Оценку состояния организма животных в опытах проводили по следующим показателям: общему состоянию, выживаемости, массе тела, периферической крови, ЭКГ, тестам, характеризующим функциональное состояние печени и почек, коэффициенту массы внутренних органов и их морфологическому состоянию. У крыс, помимо указанных выше показателей, изучали реакции, отражащие состояние центральной нервной системы; у кроликов - легочную вентиляцию и артериальное давление. У некоторых животных исследовали активность лейкоцитарной пероксидазы с помощью реакции Грэхема, содержание гликогена по методу Hotchkiss и Шабадаша, проводили температурно-пертурбационную дифференциальную спектрофотометрию сывороточного альбумина.
На основании анализа полученных многочисленных данных сделан вывод о том, что ЛП в концентрациях до 1,0% при длительном поступлении в организм (хронический эксперимент) через кожу и слизистые не оказывает отрицательного влияния на жизненно важные органы и системы животных, т.е. не является токсичным для организма.
Местное раздражающее действие ЛП на кожу и слизистые оболочки глаз и влагалища изучали на морских свинках и кроликах, а на слизистые уретры и мочевого пузыря - на собаках.
Полученные данные показали, что аппикации растворов ЛП на кожу в концентрациях 0,01 - 0,5% в течение 40 сут не вызывали ни визуальных, ни гистологических изменений. Увеличение концентрации препарата до 1,0% приводило к 30 дню аппликаций к небольшой сухости кожи и незначительной атрофии эпидермиса. Большие концентрации ЛП (3-5%) начиная с 10 - 15 дня вызывали более значительные изменения кожи.
Закапывание раствора ЛП в глаза кроликов и морских свинок в течение 10 дней в концентрациях 0,01 - 0,05% раздражающего действия на слизистые не вызывало (оценка по шкале Драйзе - 0, по классификации Огура - группа А). Более высокие концентрации препарата вызывали явления раздражения слизистой глаза (по шкале Драйзе 8 - 10 баллов, по классификации Огура - группа В).
После инстилляции 0,01 - 0,05% раствора ЛП в уретру самцов-собак по 20 мл в течение 10 дней 4 раза в сут не наблюдали каких-либо изменений в поведении животных. Анализ мочи, крови и гистологические исследования слизистой уретры, мочевого пузыря и других органов собак не выявили отклонений от нормы.
Не выявлено также морфологических и гистологических изменений со стороны слизистой влагалища животных-самок при инстиллировании растворов, 0,5% мази и аэрозоля.
Аллергизирующее действие ЛП изучали на 40 половозрелых морских свинках-самцах весом 300-400 г. Полученные данные показали, что как на первично-контактном, так и на вторично-контактном участках кожи ни разу в течение срока наблюдения визуально не отмечалась реакция раздражения. На гистологических срезах кожи и других органов животных, забитых на 41 день эксперимента, не выявлено каких-либо воспалительных микрореакций или других изменений. Следовательно, ЛП не обладает аллергизирующим действием.
Таким образом, токсикологические исследования позволили заключить, что ЛП относится к веществам с малой токсичностью (IV класс вредных веществ). В рабочих концентрациях (0,01 - 1,0%) препарат не обладает раздражающим действием на кожу, слизистые глаза, уретры, мочевого пузыря и аллергизирующими свойствами. Некоторые побочные эффекты проявляются только при использовании ЛП в дозах, намного превышающих рабочие его концентрации. Длительное поступление ЛП в организм не вызывает каких-либо заметных отклонений в функционировании жизнено важных органов и систем у экспериментальных животных.
Изучение мутагенного. эмбриотоксического действия и канцерогенных свойств ЛП проводили по рекомендациям ВОЗ. Мутагенные свойства исследовали на микробных тест-системах по B. Ames, а также выявлением частоты аберрации хромосом и доминантных летальных мутаций в клетках костного мозга мышей. На основании полученных данных сделан вывод о том, что ЛП не обладает прямым мутагенным действием, а также не образует соединений, имеющих мутагенные свойства при метаболической активации in vitro и in vivo.
Исследования эмбриотоксического действия ЛП и его влияния на репродуктивную функцию проводили на крысах. В первой группе самкам крысам в срок от шестого до восемнадцатого дня беременности вводили втурижелудочно раствор ЛП. Суммарно каждое животное получило до 1000 мг/кг препарата. Во второй группе ЛП вводили с первого дня и до конца беременности один раз в сут. В третьей группе препарат инстиллировали самцам на протяжении 60 дней, самкам - 30 дней, затем проводили спаривание.
На основании проведенных исследований можно сделать заключение о том, что ЛП не обладает тератогенным, эмбриотоксическим эффектом, не снижает репродуктивную функцию и не нарушает развития потомства в постнатальном периоде жизни.
Канцерогенные свойства препарата исследовали путем введения его в мочевой пузырь собакам в смеси с быстро затвердевающей пластмассой нонакрилом-65, а также на мышах и крысах, которым 3-5 раз в неделю наносили растворы препарата на выбритые участки кожи в межлопаточной области в течение года. Опытные и контрольные мыши и крысы содержались в стандартных условиях до естественной гибели, собак забивали через 2,5 года, проводили их паталого-анатомические и гистологические исследования.
Обобщая полученные данные, можно заключить, что ЛП не вызывает образования опухолей или свойственных для этой патологии изменений в мочевом пузыре, коже и других внутренних органах животных, т.е. не обладает канцерогенной активностью.
Изучение спермацидного действия проводили по методике, рекомендованной ВОЗ. Для этого сперматозоиды людей смешивали с различными концентрациями ЛП и в микроскопе контролировали их подвижность, а также исследовали другие показатели (pH, редукция метиленового синего, тест контакта с цервикальной слизью, уровень фруктозы и др.). Всего было исследовано 27 спермиев мужчин в возрасте 18 - 23 года. Результаты опытов показали, что оптимальной концентрацией ЛП, прекращающей подвижность сперматозоидов в течение 30 с является 0,02%. Более высокие концентрации препарата приводят не только к мгновенному обездвиживанию сперматозоидов, но и их лизису.
Влияние ЛП на функцию мукоцилиарного транспорта. Доказано, что мукоцилиарный клиренс играет ведущую роль в защитной функции носа и околоносных пазух. Многие лекарственные препараты подавляют транспортную функцию мерцательного эпителия слизистой носа, поэтому не используются в отолярингологической практике.
Влияние ЛП на функцию мукоцилиарного транспорта изучали в эксперименте на слизистой пищевода лягушки, а также в клинике на людях с помощью сахариновой пробы, полимерной пленки с метиленовым синим и сахарином и с помощью радионуклидной метки. Доказано, что в концентрациях 0, 01 и 0,05% ЛП не влияет на транспортную функцию мерцательного эпителия, а у больных синуситами нормализует мукоцилиарный клиренс.
Изучение
профилактического и лечебного действия ЛП на
животных
Профилактическое действие ЛПа при венерических заболеваниях изучали на модели экспериментального сифилиса на кроликах. Опыты поставлены
на 156 кроликах породы шиншила, которых
заражали свежеприготовленной взвесью бледных трепонем (штаммы Никольса и ЦКВИ-8) накожным способом. Спустя 30, 60, 120, 180 и 240 мин после заражения
обрабатывали кожу зараженного участка 0,01 - 1,0%
раствором ЛП. Кроликов контрольной группы обрабатывали дистиллированной водой. Все животные находились на клинико-серологическом контроле 6 - 12 мес.
Для контроля использовали реакцию Вассермана (РВ),
РИБТ и РИФ, которые ставили с 1,5 мес после заражения каждые 2-3 мес. Также были использованы методы пассирования лимфатических узлов и повторного
заражения в кожу мошонки взвесью трепонем
аналогичного штамма. Результаты опытов показали, что обработка подопытных кроликов 0,01 - 1,0% раствором ЛП в период от 30 мин до 2,5 час с момента заражения
приводит к 100% защите животных от
сифилиса.
Лечебное действие на моделях гнойных ран и перитонита у экспериментальных животных (крысы, кролики, морские свинки, собаки - всего более 500 животных) проводили согласно общепринятых методик, используя бактериологические, морфологические, гистологические и иммунологические методы исследования.
Полученные данные показали высокую терапевтическую активность ЛП, применяемого в виде водного раствора, мази и аэрозоля при гнойно-воспалительных заболеваниях и перитоните у экспериментальных животных. ЛП оказался более эффективным препаратом при лечении гнойных ран по сравнению с широко применяемым антисептиком хлоргексидина биглюконатом (табл. 4).
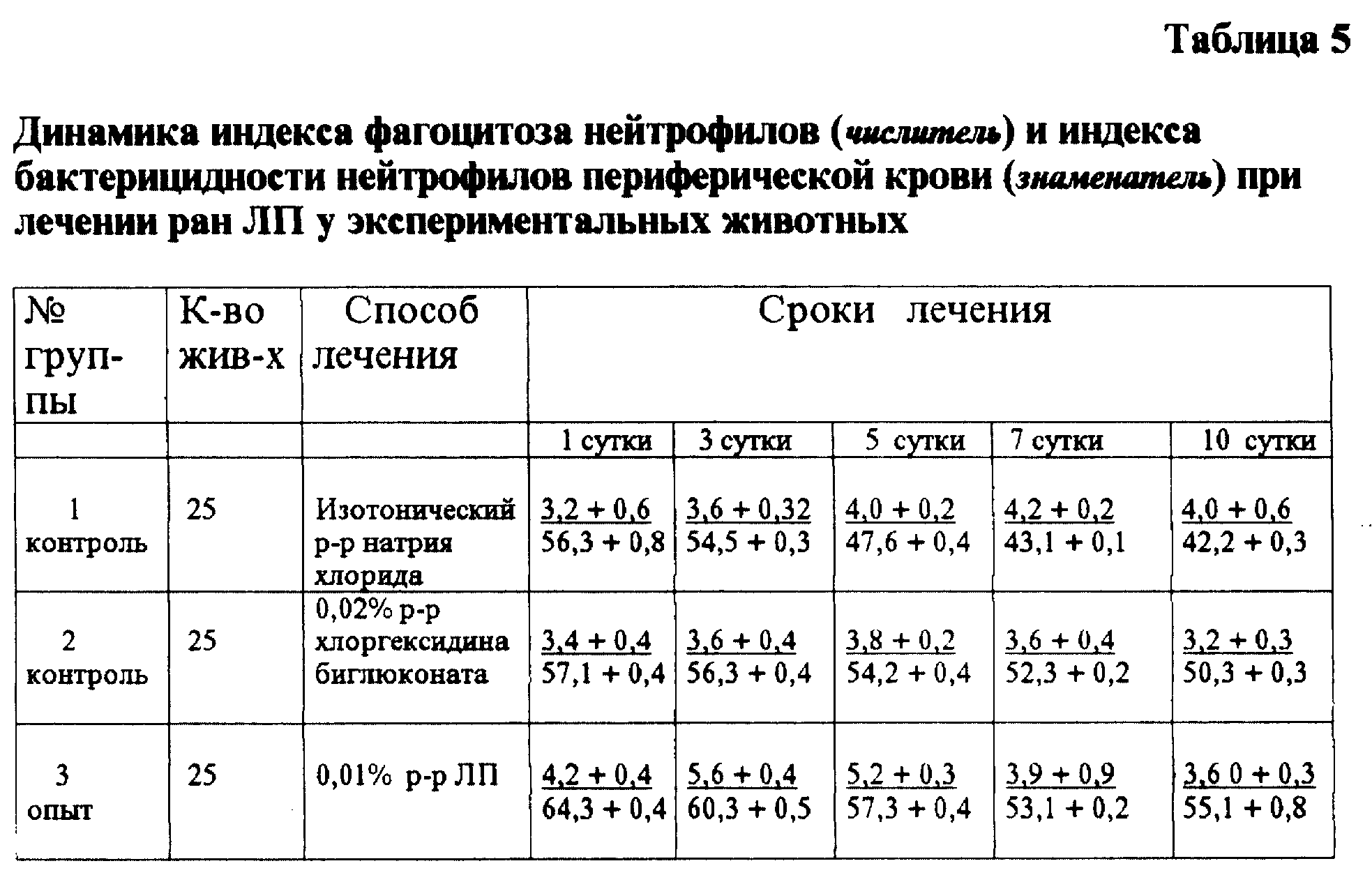
Статистически достоверно доказано, что наблюдаемый положительный эффект у экспериментальных животных обусловлен стимулирующим действием ЛП на факторы резистентности - фагоцитарный индекс и бактерицидность нейтрофилов. Антисептик хлоргексидина биглюконат подобным действием не обладает (табл. 5).
Анализируя данные, полученные при использовании 0,5% мази ЛП для лечения гнойных экспериментальных ран у кроликов, можно сделать вывод, что мазь оказывает выраженный терапевтический эффект, который связан с бактерицидным действием, снижением микробной нагрузки, усиливающим регенерацию и стимулирующим местные иммунные реакции действием.
Исследование антифунгального действия мази ЛП. На моделях кандидоза у морских свинок, воспроизведенных с помощью внутрикожного введения Candida albicans с последующей скарификацией и трихофитии, вызванной втиранием клеток Trichophyton rubnim (штамм 796) в предварительно депилированный и скарифицированный участок кожи на боковой поверхности, изучали лечебное действие 0,5% мази. Для сравнения были использованы официнальные противогрибковые мази ундецин, клотримазол и цикундан.
Обобщая полученные результаты, можно заключить, что лечебная эффективность мази, содержащей 0,5% ЛП, достаточно высока и превосходит эффективность мазей сравнения. Так, к 4-му дню применения мази в 2 раза уменьшилась площадь очагов поражения, вызванных кандида альбиканс и трихофитоном, наблюдалось очищение центра очага от язв, эрозий корок, снизилась обсемененность тканей патогенными грибами на 1-2 порядка и к 8-му дню наступало клиническое выздоровление. Суммируя результаты исследований, можно сделать вывод, что мазь ЛП - эффективное антигрибковое средство, которое имеет преимущества перед аналогами.
Лечебное действие ЛП на моделях ожогов у мышей.
У мышей на депилированной дорсальной поверхности спины вызывали контактный термический ожог при помощи стандартного устройства. Лечение начинали через 24 часа после ожога мазью и аэрозолем с 0,5% ЛП. Для сравнения применяли официнальную мазь левосин. Полученные результаты представлены в табл. 6.
Как видно из данных табл. 6, достоверное снижение площади ран при лечении мазью и аэрозолем с ЛП начинается после 8-х сут, что на 4 сут раньше, чем в контроле. Можно утверждать, что это сокращение происходит за счет ускорения перехода от фазы воспаления к фазе репарации и связано оно с противовоспалительными и иммуноадъювантными свойствами ЛП.
Действие ЛП при гнойно-воспалительных поражениях роговицы глаз. Опыты поставлены на 14 кроликах породы шиншилла весом 2-2,5 кг. Гнойно-воспалительные поражения роговицы вызывали путем введения внутрь роговицы глаза взвеси суточной культуры Staphylococcus aureus штамм 209 P. На 2-4 сут у 13 кроликов на роговице глаза образовались язвы размером 3 х 6 мм с гнойным отделяемым на дне, а также наблюдались явления воспалительных реакций: конъюнктивит, блефароспазм и др.
Взятые в опыт кролики были разделены на три группы. Животных первой группы лечили раствором ЛП (глазные капли на основе ЛП - ЛПГК), второй - официнальными декаметоксиновыми глазными каплями (ДГК), а животным третьей, контрольной группы, в пораженные глаза закапывали изотонический раствор хлорида натрия. Препараты закапывали ежедневно трехкратно на протяжении всего эксперимента.
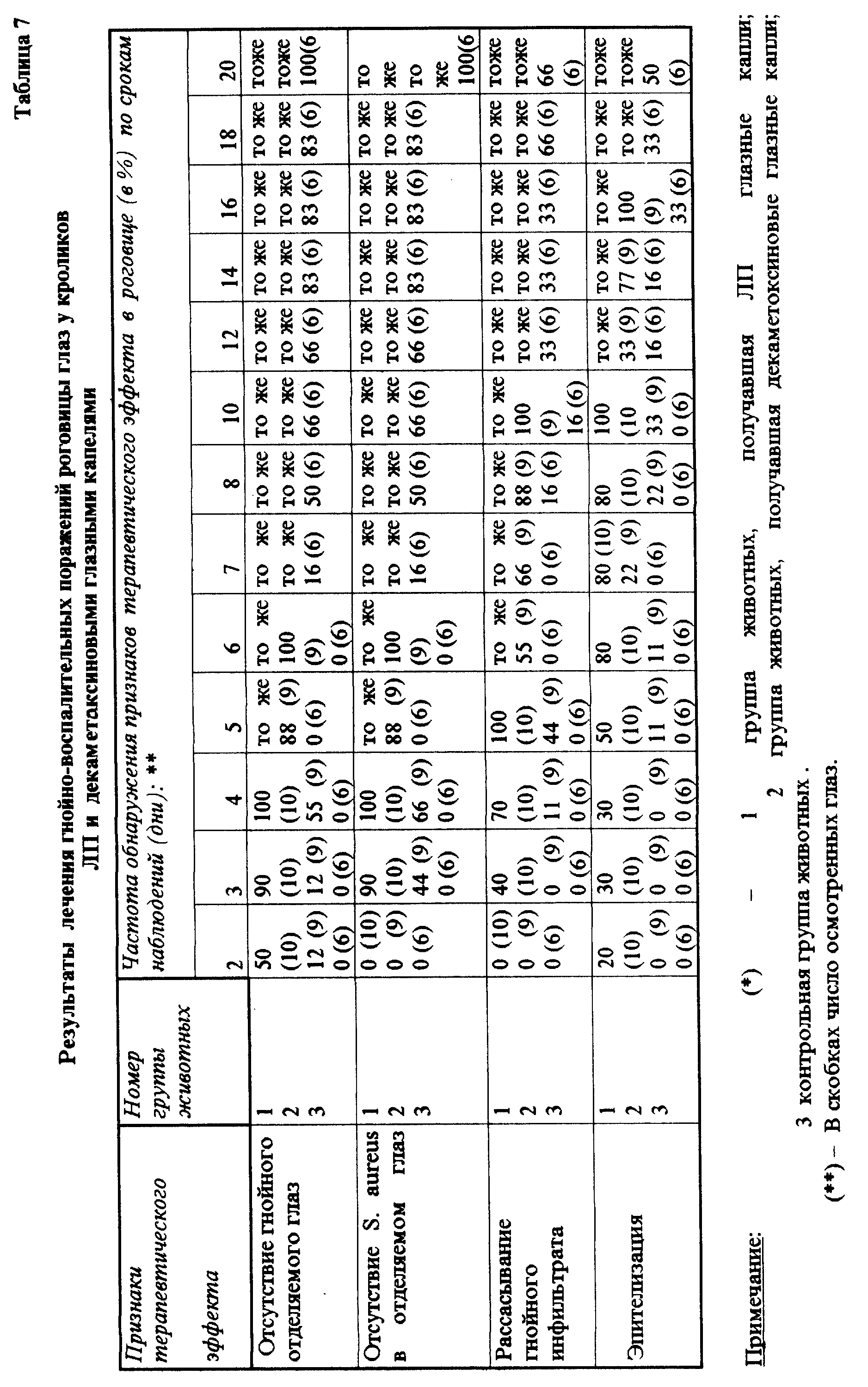
За всеми животными ежедневно проводили наблюдения, контролируя динамику изменений в роговице глаз опытных и контрольных животных по ранее описанной методике. Кроме этого, проводили посевы смывов с роговицы глаз кроликов на мясо-пептонный бульон для определения наличия S. aureus 209 P. Результаты опытов представлены в табл. 7.
Приведенные данные свидетельствуют, что гнойные выделения и обнаружение S. aureus полностью прекратились на 4 и 6 сут у всех животных, леченных ЛПГК и ДГК соответственно. В то же время среди нелеченых животных гнойные выделения наблюдались на протяжении всего периода эксперимента.
Рассасывание гнойного инфильтрата быстрее началось и завершилось у всех животных, леченных ЛПГК (на 3 сут), а ДГК - на 5 сут от начала лечения. У животных, леченных ЛПГК и ДГК, время начала и завершения рассасывания гнойного инфильтрата составило соответственно 4 и 10 сут от начала лечения. Эпителизация роговицы глаз наступила у всех животных к 10 и 16 дню от начала лечения ЛПГК и ДГК соответственно.
Таким образом, из приведенных выше данных можно заключить, что ЛПГК являются высокоэффективным средством при лечении гнойно-воспалительных поражений роговицы глаз, причем терапевтический эффект ЛПГК выше, чем у ДГК (декаметоксиновых глазных капель), выпускаемых промышленностью.
Клинические исследования
Клиническое изучение
ЛП в качестве средства индивидуальной профилактики венерических заболеваний было проведено
в 7 ведущих кожно-венерологических учреждениях, а в качестве антисептика для лечения и профилактики
гнойно-воспалительных процессов в 20 клиниках хирургического, акушерско-гинекологического,
офтальмологического, оториноларингологического, комбустиологического профиля.
Анализ отчетов, полученных из лечебных учреждений, показал, что ЛП в различных лекарственных формах не оказывал вредного побочного действия на организм человека, не вызывал раздражения кожи или слизистых, а также аллергических реакций.
Венерология. Применение 0,01% раствора ЛП для профилактики венерических заболеваний путем обработки уретры, влагалища и наружных половых органов защищает пациентов в 100% случаев, если препарат был применен не позже 2,5 часов после полового акта. Всего под наблюдением находилось более 1000 пациентов, относящихся к группе риска.
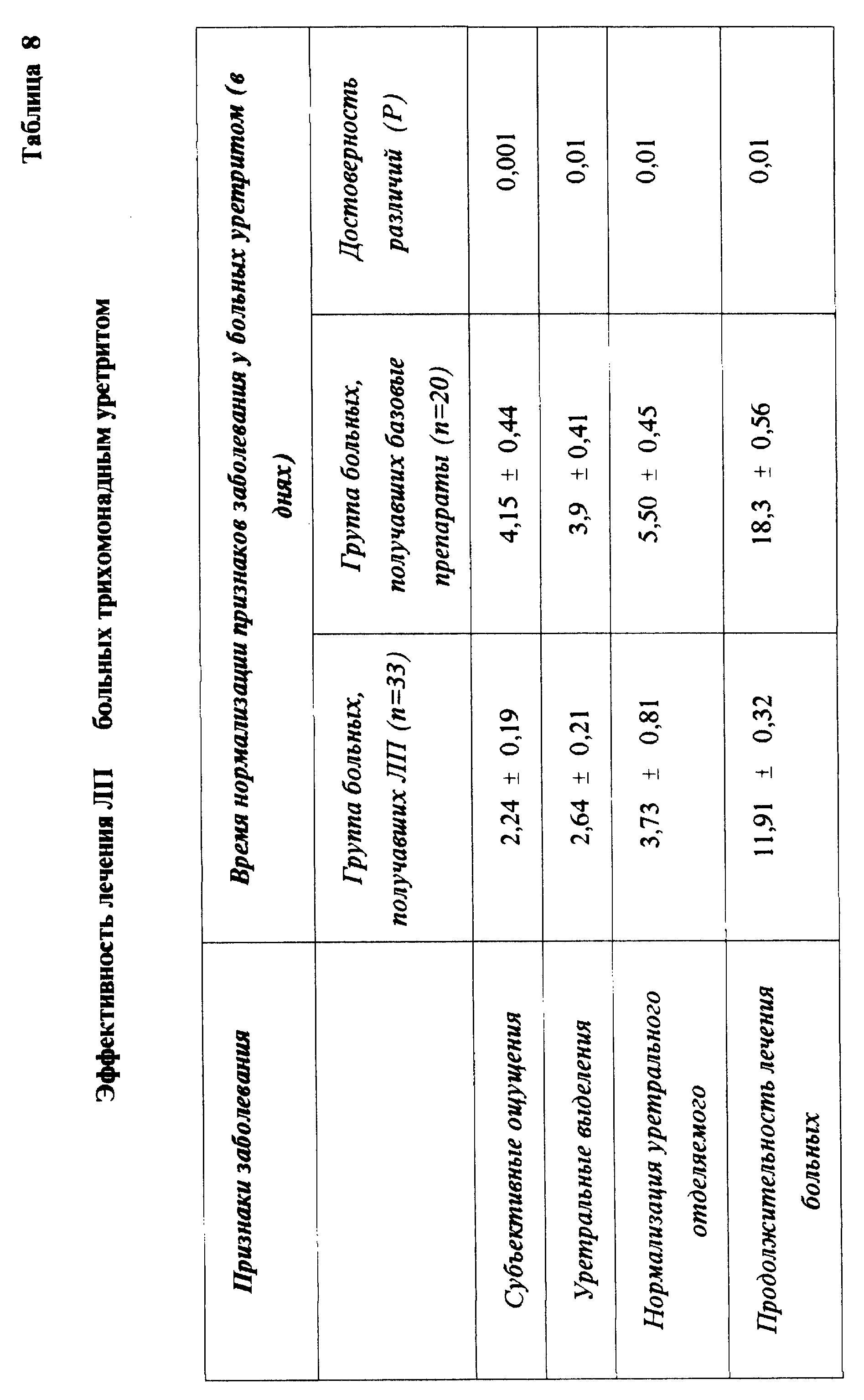
Урология. Применение ЛП при лечении острых и хронических уретропростатитов специфической и неспецифической этиологии выявило его высокую эффективность, что подтверждалось полным клиническим излечением, а также уменьшением сроков лечения (табл. 8). Разработаны способы использования ЛП в лечении хламидийных уретропростатитов.
Хирургия. Использование различных лекарственных форм ЛП (растворы водные и спиртовые, мази, гели, аэрозоли, клей) для лечения и профилактики гнойно-воспалительных процессов различной этиологии и локализации выявили их высокую эффективность и отсутствие побочных реакций.
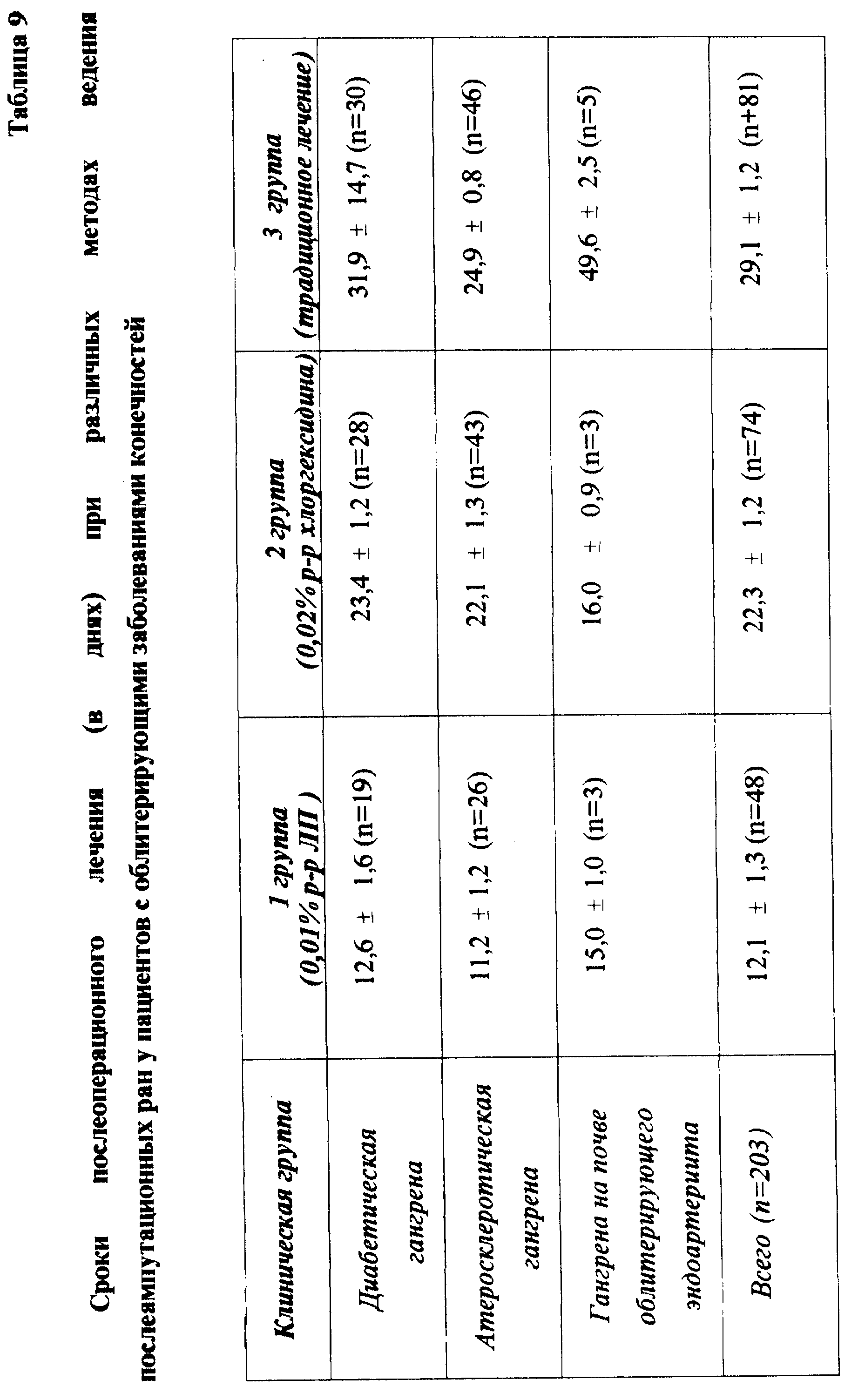
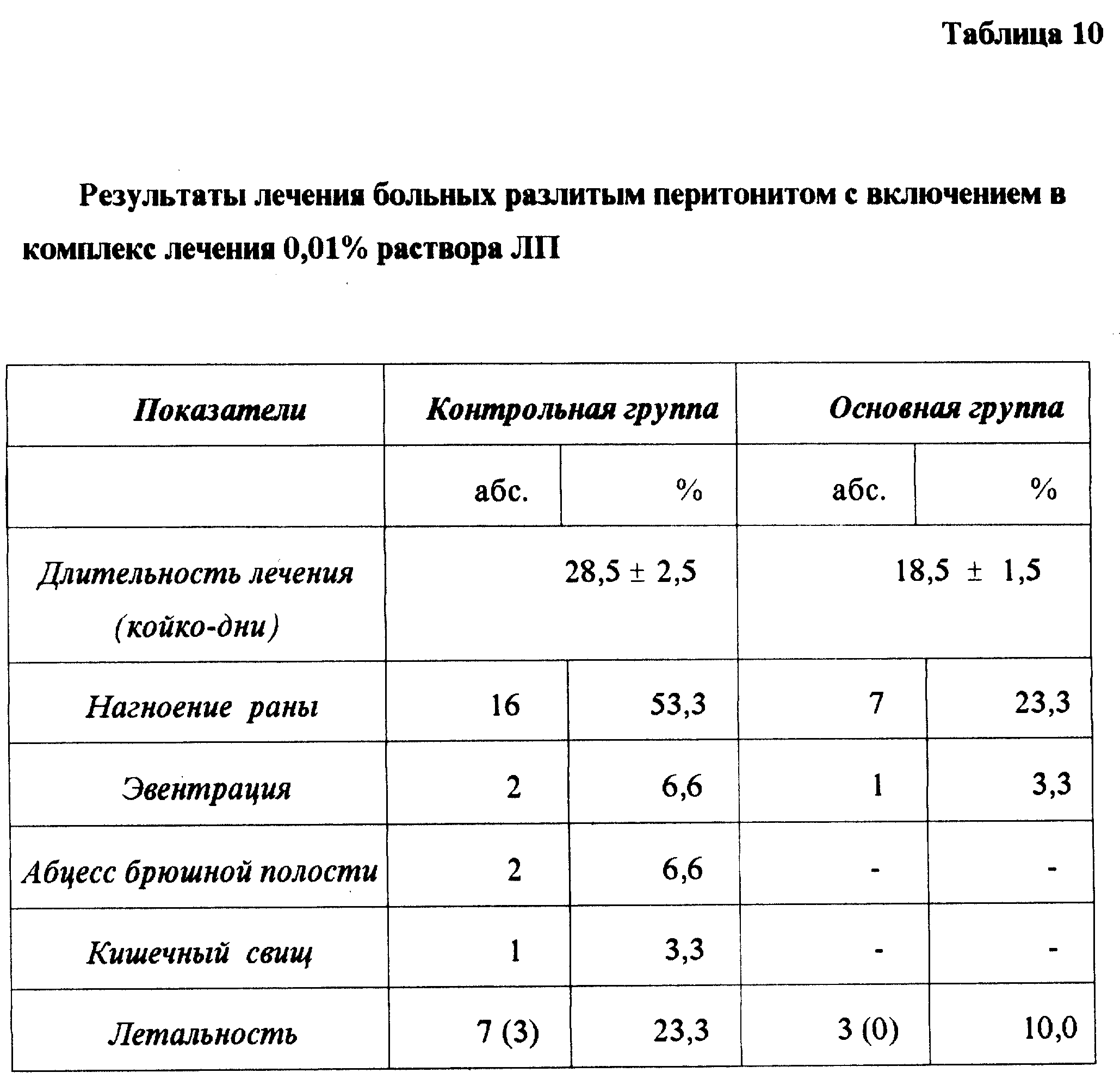
Препараты применялись с положительным эффектом при гнойных ранах травматических и послеоперационных, кисти и пальцев, плевро-легочных и ожоговых, послеампутационных при облитерирующих заболеваниях сосудов конечностей (табл. 9), свищах, пролежнях и трофических язвах, а также при перитонитах (табл. 10).
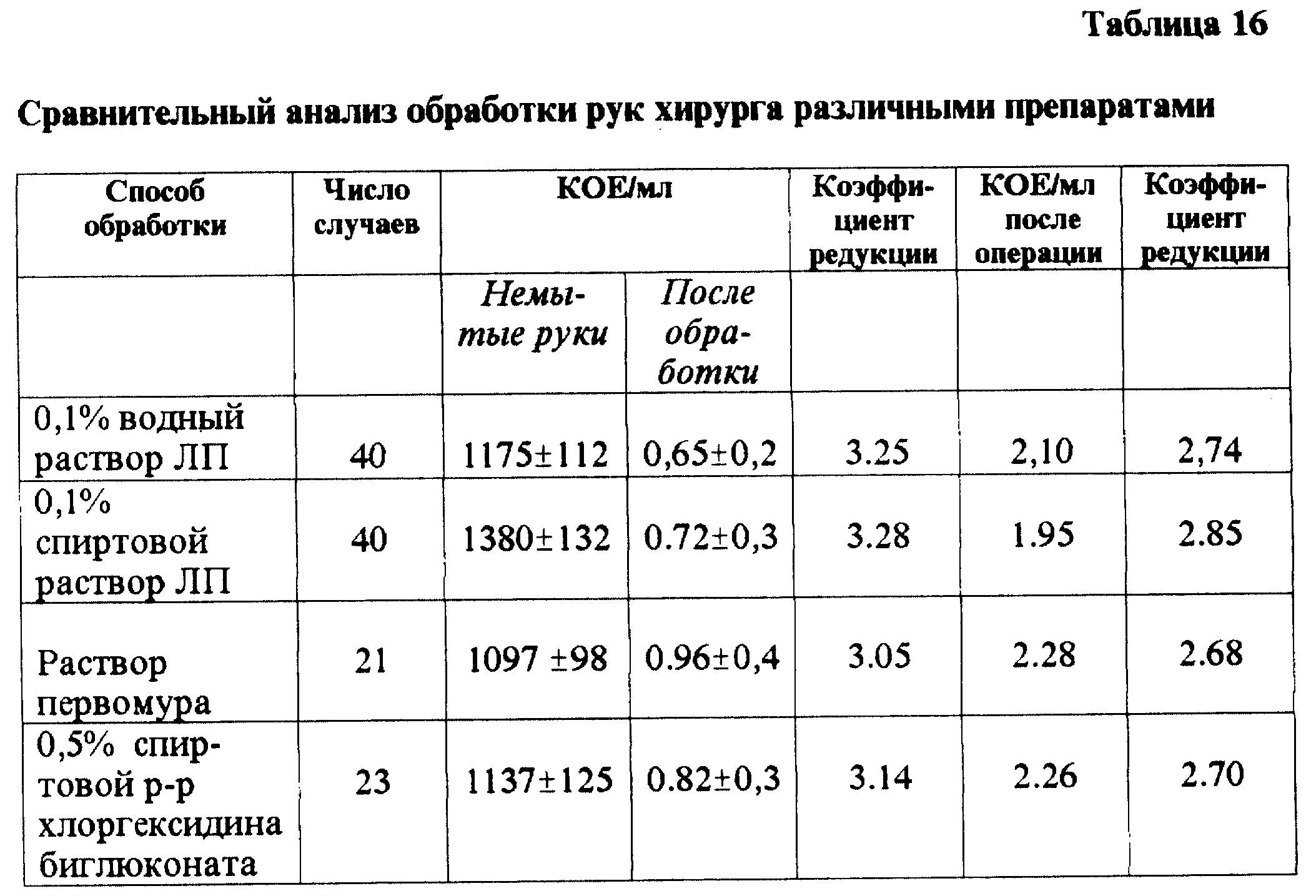
Водные и спиртовые растворы ЛП испытаны как антисептики для обработки рук хирурга и операционного поля. Клей ЛП оказался высокоэфективным для профилактики гнойных осложнений микротравм и безповязочного ведения послеоперационных ран.
Акушерство и гинекология. Препараты ЛП показали высокую эффективность при лечении и профилактике гнойно-воспалительных процессов, возникающих после разрывов промежностей и влагалища при родах, после кесарева сечения, влагалищной гистерэктомии, консервативно-пластических вагинальных операций, профилактики пуэрперальной инфекции у женщин с ОПГ-гестозами (табл. 11), а также при лечении воспалительных заболеваний влагалища неспецифической и специфической (хламидии, герпес и др.) этиологии - вульвовагиниты, кольпиты, цервициты и др.
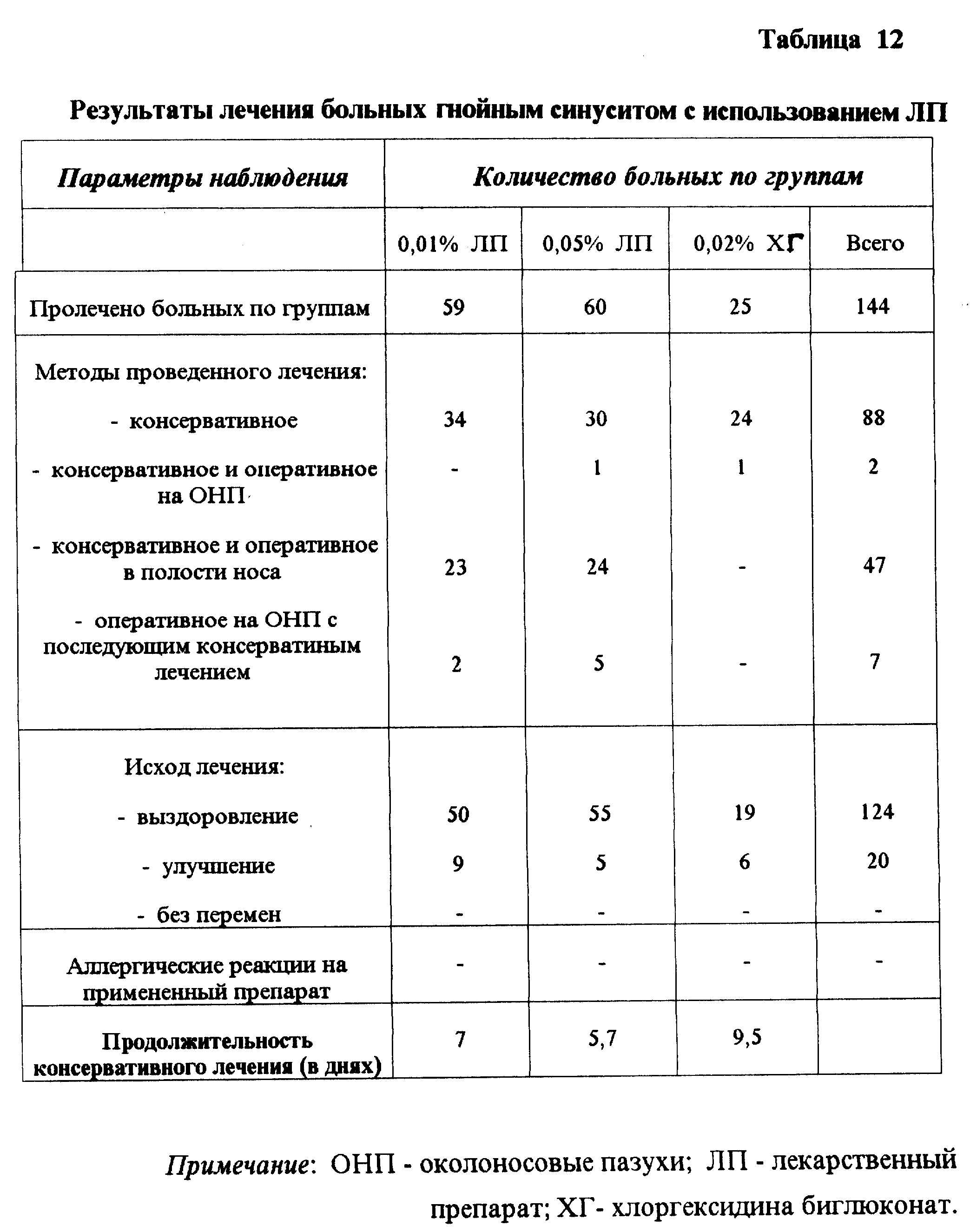
Оториноларингология. Широкомасштабные испытания ЛП в ЛОР практике выявило его высокую эффективность при лечении воспалительных заболеваний околоносовых пазух - острые и хронические гаймориты, риносинуситы, а также ангины, ларингофарингиты и др. (табл. 12). Наблюдаемый эффект обусловлен антисептическими и иммуноадьювантными свойствами препарата, а также тем, что он не подавляет мукоцилиарный клиренс слизистой оболочки.
Офтальмология. Препараты ЛП в виде глазных капель (0,01% раствор ЛП на 0,9% растворе хлорида натрия) испытаны для лечения конъюнктивитов неспецифической и специфической (хламидийной, гонококковой) этиологии. Установлена высокая клиническая (90,4%) и этиологическая (63,7%) эффективность этиопатогенетической терапии офтальмохламидиозов с местным применением в виде инстилляций в полость конъюнктивы 0,01% ЛПГК.
ЛПГК оказались эффективными также при подготовке больных к внутриглазным операциям и послеоперационном их ведении для профилактики гнойно-воспалительных осложнений.
Наблюдаемый эффект, по нашему мнению, обусловлен антисептическим, противовоспалительным, антихламидийным, иммуномодулирующим действием и способностью ЛП нормализовать местный фибринолитический потенциал конъюнктивы глаза.
Дерматология. Различные лекарственные формы ЛП испытаны в дерматологии для моно- и комплексной терапии бактериальных и грибковых заболеваний кожи. Высокой эффективностью обладают препараты ЛП в виде мази и геля при лечении стрепто- и стафилодермий, кандидомикозов кожи и слизистых, микозов стоп и крупных складок, в том числе дисгидротических форм и форм, осложненных пиодермией, дерматозов гладкой кожи, онихомикоза и кератомикозов, в том числе отрубевидного лишая. У больных с различными клиническими формами пиодермитов положительный эффект удалось достичь в 98,3% случаев, что сокращает сроки лечения в среднем на 2-3 дня по сравнению с традиционными методами терапии. Отмечен положительный лечебный эффект при угревой сыпи и герпетических поражениях кожи и слизистых (табл. 13).
Иммуноадъювантные свойства ЛП при лечении гнойно-воспалительных заболеваний у
людей
Общеизвестно, что у больных с гнойно-воспалительными процессами, как
правило, развивается иммунологическая недостаточность в виде нарушения местных и общих иммунных реакций (Кузин М.И.,
Костюченок Б.М. Раны и раневая инфекция. Руководство для врачей. - М.: Медицина.
1990, 591 с.; Теория и практика местного лечения гнойных ран, под ред. Даценко Б. М., Киев, 3доров'я, 1995, 383 с.).
Многочисленными лабораторными и общеклиническими методами исследования достоверно показано, что положительный лечебный эффект ЛП при гнойно-воспалительных процессах обусловлен не только его антимикробными свойствами, но и стимулирующим действием на иммунные реакции организма.
При лечении 68 больных с хроническим уретропростатитом с использованием ЛП у них наблюдалась достоверно значимая стимуляция поглотительной способности уретральных нейтрофильных гранулоцитов (табл. 14). Положительный лечебный эффект при включении в терапию ЛП составил 92,8% и привышал эффект, полученный при применении иммуномодулятора тималина (86,9%). В группе больных, получавших базисную терапию без иммуноадъювантов, положительный эффект отмечен лишь в 52,9% случаев.
При лечении 235 больных с различными клиническими формами пиодермитов с включением в комплексную терапию 0,5% мази ЛП позволило получить положительный клинический эффект в 98,3% случаев, тогда как в сравниваемой группе такой эффект достигался в 89,2% случаев.
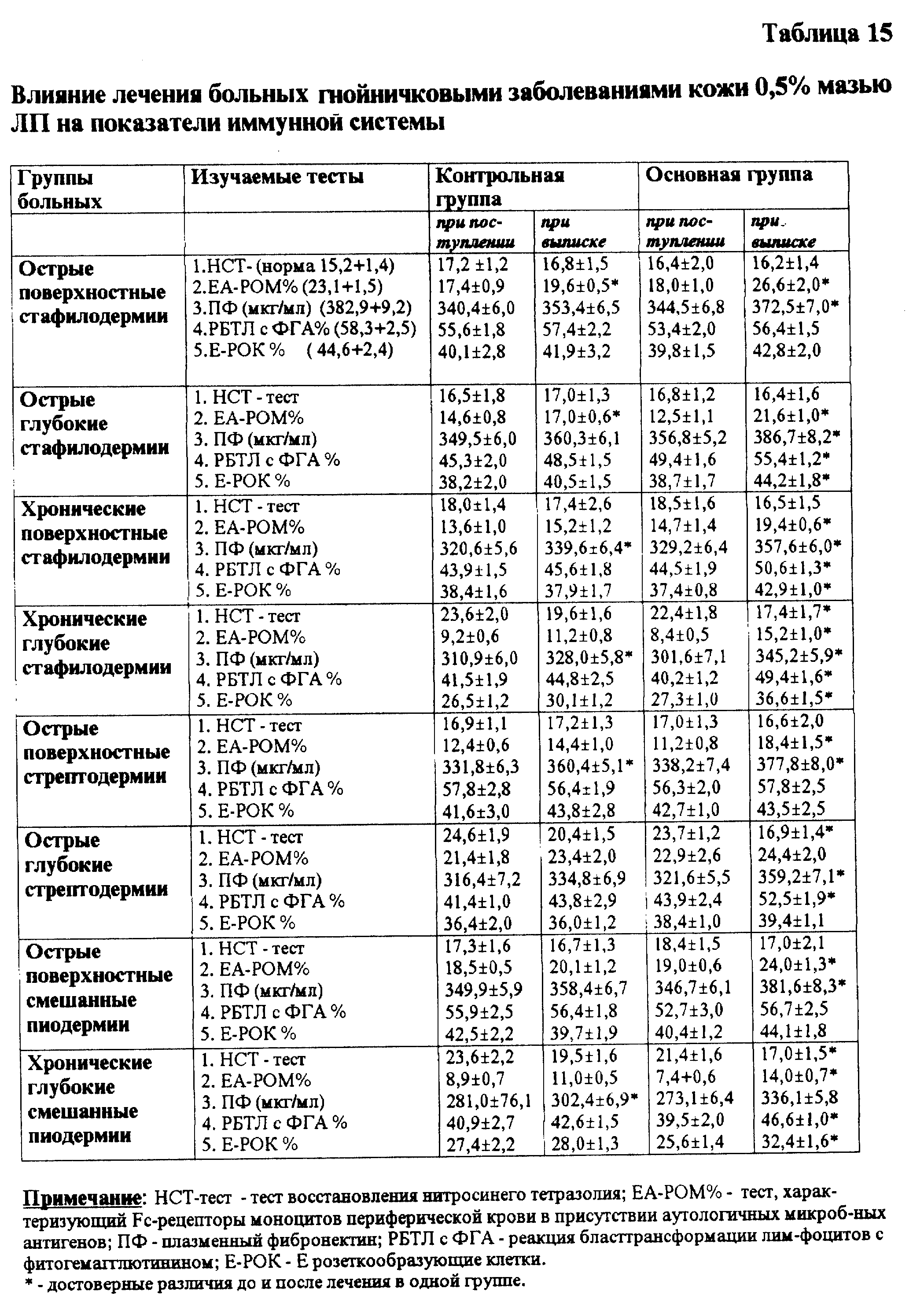
У больных пиодермиями изменены показатели иммунологической реактивности организма. ЛП оказывает стимулирующее влияние на опсоно-фагоцитарный механизм и другие показатели иммунитета (см. табл. 15). На основании представленных данных можно заключить, что иммуномодулирующее действие 05% мази ЛП при лечении больных пиодермиями происходит за счет влияния препарата на активность кислородозависимых систем микробицидности при параллельном увеличении их резервов в фагоцитарных клетках, изменения антигенного раздражения рецепторного аппарата моноцитов и лимфоцитов, стимуляции фибронектинсинтетической функции лейкоцитов и др.
Подобные влияние на иммунные факторы организма различных форм ЛП были получены при лечении больных с гнойно-воспалительными заболеваниями различной этиологии и локализации в хирургических, акушерско-гинекологических, офтальмологических, оториноларингологических и других клиниках.
В результатах многочисленных экспериментальных и клинических исследований отмечено, что ЛП превосходит по эффективности широко используемые антисептики: хлоргексидина биглюконат, фурацилин, йодвидон и др. и может быть рекомендован для повсеместного применения в клинической практике.
Дезинфицирующая активность ЛП
Использование ЛП для
хирургической антисептики
Экспериментальное
обоснование использования 0,1% водного и 0,1% спиртового растворов ЛП для хирургической антисептики. Опыты проводили в условиях, соответствующих
практическому применению антисептиков. Использовали
метод M. Rotter (Rotter M.L. Hygienic Hand Desinfection // Infect. Contr. 1984. N 1. P. 18 - 22.) на людях-добровольцах с вычислением коэффициента
редукции после контаминации кожи рук стандартным
тест-штаммом Е. coli. В качестве контроля применяли способы обработки рук первомуром и 0,5% спиртовым раствором хлоргексидина биглюконата (гибитан), в
соответствии с действующими нормативами (Приказ
МЗ СССР N 720-78; Инструкция МЗ СССР N 06-14/10 от 3.08.84).
Реманентное последействие ЛП устанавливали в модели P.Michand с соавт.
(Michaud R., Mс. Grath М., Goos W. Application of a
glaved - hand model for multiparameter measurements of skin - determing activity // J. Klin. Microb. 1976. N 3. H. 406-413.)
Анализ данных
показывает, что при контаминации кистей рук
тест-штаммами Е. coli в 1 мл смыва находится в среднем 1,4·105 микробных тел (логарифм 5,15). Обработка рук 70% спиртом, первомуром, 0,5%
спиртовым раствором хлоргексидина
биглюконата, а также спиртовыми и водными растворами ЛП, приводила к уменьшению их обсемененности, но в различной степени. Наименее эффективным из исследованных
растворов оказался 70% спирт
(коэффициент редукции 3,47 lg10). Антимикробный эффект, соответствующий требованиям, предъявляемым к антисептикам, используемым для хирургической обработки,
нормативными документами,
получен при испытаниях 0,1% водного и 0,1% спиртового растворов ЛП. Экспозиции контаминированных кистей рук в 0,1% водном растворе антисептика в течение 3 и 5 мин дали
одинаковые результаты:
коэффициенты редукции равнялись 5,11 lg10. Наивысший коэффициент редукции (5,15 lg10) был получен при использовании 0,1% спиртового раствора ЛП.
При обработке контаминированных рук первомуром коэффициент редукции составлял 4,94 lg10, а 0,5% спиртовым раствором хлоргексидина биглюконата - 5,04 lg10.
Высокая эффективность 0,1% водного раствора ЛП была подтверждена и в опытах на 20 добровольцах без искусственной кантаминации стандартной тест-культурой их рук, а также при испытаниях растворов ЛП в клинической практике. Посевы смывов с кожи рук у всех 20 волонтеров, обработанных 0,1% водным и спиртовым растворами ЛП дали коэффициенты редукции от 2,5 lg10 до 3,3 lg10.
Реманентное последействие растворов ЛП проверяли на 10 добровольцах, на руки которых после контаминации Е. coli и обработки соответствующим препаратом надевали стерильные хирургические перчатки, а затем сразу и спустя 1, 2 и 3 часа делали высевы с кожи рук, подсчитывали количество выросших Е. coli и определяли коэффициент редукции.
Полученные данные показывают, что коэффициенты редукции при использовании обоих растворов ЛП были высокими (5,22-5,25 lg10) и сохранялись на этих уровнях в течение трех часов.
Анализ результатов опытов по эффективности обработки кожи операционного поля и локтевых сгибов у 84 добровольцев показал, что нужный обеззараживающий эффект достигается при использовании 0,1% спиртового раствора ЛП, а также 0,5% спиртового раствора хлоргексидина биглюконата (коэффициенты редукции 2,5-3,4 lg10), что соответствует общепринятым нормативам.
Обобщая результаты проведенных исследований, можно прийти к заключению, что 0,1% водный и 0,1% спиртовой растворы ЛП по своим свойствам соответствуют требованиям, предъявляемым к антисептикам, применяемым в хирургической практике, они обеспечивают быстрый дезинфицирующий эффект. Коэффициенты редукции растворов ЛП, а также реманентное последействие превосходят таковые у первомура и хлоргексидина биглюконата, препаратов, используемых в настоящее время для хирургической антисептики (табл. 16).
Выявлена также высокая дезинфицирующая активность 0,1% спиртового раствора ЛП при обработке операционного поля и кожи локтевых сгибов.
Ни в одном случае использования 0,1% водного и 0,1% спиртового растворов ЛП не отмечено побочных отрицательных местных или общих реакций. Положительным моментом является стойкость рабочих растворов ЛП к действию внешних факторов и длительный срок их сохранения (срок наблюдения 3 года).
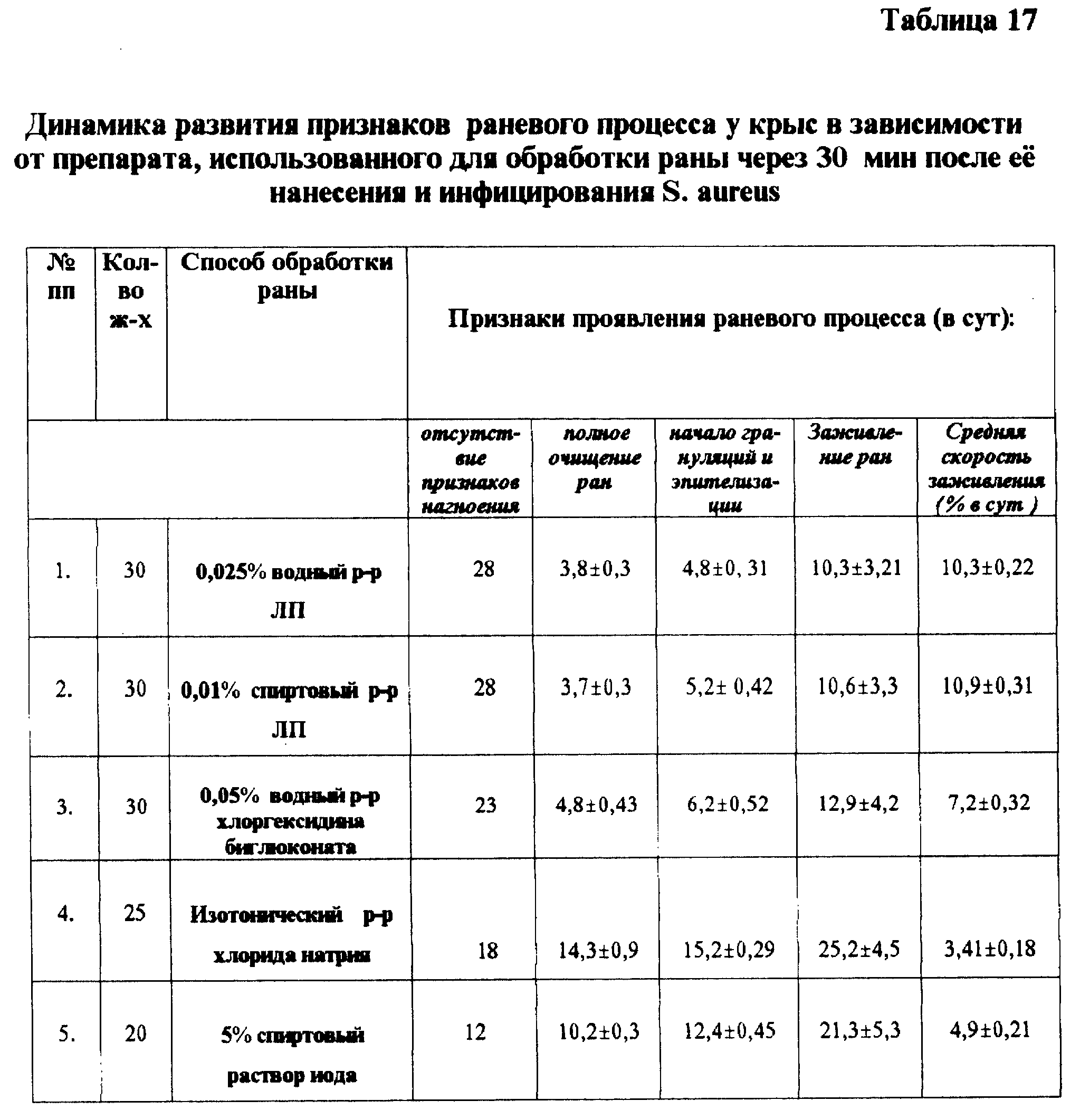
Профилактическое действие растворов ЛП при инфицированных ранах.
В эксперименте исследования проводили на крысах, у которых раны моделировали по общепринятой методике, инфицируя их S. aureus. Спустя 30 минут раны обрабатывали растворами ЛП, после чего наблюдали за развитием раневого процесса с помощью общепринятых показателей (см. табл. 17). Анализ полученных данных показывает, что наилучший профилактический эффект достигнут при применении для обработки инфицированных ран водного и спиртового растворов ЛП по сравнению с растворами хлоргексидина биглюконата и йода.
Клинические испытания водного и спиртового растворов ЛП с целью профилактики гнойных осложнений при микротравмах проведены в заводских условиях в цехах повышенного травматизма в течение 3-х лет. Из 107 человек с микротравмами и ссадинами, обратившимися в медпункт завода, после обработки растворами ЛП присоединение вторичной инфекции наблюдалось лишь у 5 человек (4,5%). В контрольной группе (128 человек), где обработка микротравм проводилась красителями (бриллиантовая зелень, фукорцин, метиленовая синь), а также йодом, присоединение вторичной инфекции наблюдалось у 49 человек (34,6%). Отмечено, что заживление микротравм у лиц, подвергшихся обработке растворами ЛП, происходило в период от 3 до 6 дней (в среднем 3,5±0,6 дней), в то время как в группе, где применялись красители, эти сроки составляли от 5 до 8 дней (в среднем 5,5±0,3 дней).
Наблюдаемый эффект растворов ЛП при профилактике гнойных осложнений микротравм обусловлен выраженными антимикробными действиями препарата и его способностью стимулировать местные иммунные и регенераторные процессы.
Реферат
Изобретение относится к области медицины и касается лекарственного препарата для лечения и профилактики специфических и неспецифических инфекционных и гнойно-воспалительных заболеваний. Изобретение заключается в том, что препарат состоит из активного компонента - бензилдиметил[3-(миристоиламино)аммония хлорида моногидрата в фармацевтическом разбавителе (вода, спирт, любая растительная, животная или синтетическая основа). Изобретение обеспечивает использование препарата, обладающего губительным действием на возбудителей инфекционных и воспалительных заболеваний (бактерии, вирусы, грибы, простейшие), не вызывая побочных явлений со стороны организма при его применении. 2 з.п. ф-лы. 17 табл.
Формула
Растительная, животная или синтетическая основа - 99,0 - 99,9
Бензилдиметил[3-(миристоиламино)пропил] аммония хлорида моногидрат - 1,0 - 0,01

Комментарии