Фармацевтические композиции спиро-оксиндольного соединения для местного введения и их применение в качестве терапевтических агентов - RU2596488C2
Код документа: RU2596488C2
Чертежи

Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к фармацевтической композиции для местного введения млекопитающему, предпочтительно человеку, содержащей один или более фармацевтически приемлемых вспомогательных веществ и терапевтически эффективное количество спиро-оксиндольного соединения, которое является блокатором натриевых каналов, предпочтительно антагонистом нейрональных потенциалзависимых натриевых каналов. В частности, настоящее изобретение относится к фармацевтическим композициям для лечения заболеваний или состояний, таких как боль, предпочтительно постгерпетическая невралгия (PHN), остеоартрит и постоянная постоперационная боль, которая облегчается ингибированием натриевых каналов, предпочтительно нейрональных потенциалзависимых натриевых каналов. Однако другие неврологические заболевания, не связанные с болью, можно лечить аналогичным образом как часть настоящего изобретения, например, облегчение симптомов миотонии и множественного склероза.
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Заболевания и состояния, которые облегчаются ингибированием (или "блокированием") натриевых каналов, в частности нейрональных потенциалзависимых натриевых каналов, включают острую и хроническую боль, в частности невропатическую и воспалительную боль. Постоянная (хроническая) невропатическая боль наблюдается при широком диапазоне клинических состояний, включая постгерпетическую невралгию (PHN), невралгию тройничного нерва, болезненную диабетическую невропатию (PDN), боль в нижнем отделе спины, постоперационную боль, боль, связанную с химиотерапией и ВИЧ инфекцией. Оценка распространенности хронической невропатической боли сильно различается в зависимости от географического региона в диапазоне от приблизительно 11% популяции США до оценки, что 20% всех взрослых европейцев страдают от умеренной - сильной хронической боли (смотри, например, Hall, G.C. et al., "Primary Care Incidence and Treatment of Four Neuropathic Pain Conditions: A Descriptive Study, 2002-2005," BMC Fam. Pract. (2008); Vol. 9, No. 26; и Hardt, J. et al., "Prevalence of Chronic Pain in a Representative Sample in the United States," Pain Medicine (2008), Vol. 9, No. 7, pp. 803-812). В США считают, что наиболее распространенным заболеваниям с хронической невропатической болью, PHN и PDN, подвергаются 1 миллион и 3 миллиона человек, соответственно (смотри, например, Dworkin, R.H. et al., "Advances in Neuropathic Pain Diagnosis, Mechanism, and Treatment Recommendations," Arch. Neurol. (2003), Vol. 60, pp. 1524- 534).
Большое количество фармакологических агентов доступно для лечения невропатической боли, включая трициклические антидепрессанты, ингибиторы обратного захвата норадреналина и серотонина, антиконвульсанты (например, габапентин и прегабалин), анестезирующие средства местного действия и опиоиды (например, морфин). Однако данные способы лечения обеспечивают недостаточной эффективностью и/или обладают неприемлемыми побочными эффектами при постоянном применении, с достаточным облегчением невропатической боли, сообщенным только для приблизительно 50% пациентов (смотри, например, Moulin, D.E., "The Clinical Management of Neuropathic Pain," Pain Res. Manag. (2006), Vol. 11 (Supplement A), pp. 30A-36A). Часто, мультилекарственная терапия с применением трициклических антидепрессантов, антиконвульсантов и анестезирующих средств местного действия является необходимой для облегчения невропатической боли.
Lidoderm® пластырь (5% лидокаин) относится к классу локальных и местных анестезирующих лекарственных препаратов и одобрен для лечения PHN. Однако, тогда как лидокаин может обладать местным эффектом, он поглощается системно и должен применяться с особыми мерами предосторожности при местном введении, поскольку нанесение на большую поверхность может приводить к тяжелой общей токсичности и смерти.
Voltaren® (гель диклофенала натрия) представляет собой нестероидный противовоспалительный агент (NSAID) в виде состава для местного применения. Он представляет собой имеющийся на рынке способ лечения пациентов с остеоартритом. Тогда как риск гастроинтестинальных побочных эффектов для NSAID местного применения является меньшим, чем риск для NSAID перорального применения, данные серьезные побочные эффекты остаются проблемой для местного применения диклофенака. Более того, недавно сообщалось о значительном увеличение количеств ферментов печени у некоторых пациентов при длительном применении диклофенака, делая необходимым регулярное наблюдение на гепатотоксичность у данной популяции пациентов (смотри, FDA website, MedWatch, 2009; Volteren Gel (diclofenac sodium) 1% topical gel; Safety Labeling Changes Approved by FDA Center for Drug Evaluation and Research -- September 2009).
Хорошо известно, что нейрональные потенциалзависимые натриевые каналы (Nav) модулируют передачу болевых сигналов. Например, мутация с потерей функции Nav1.7, который экспрессируется в основном в сенсорных нейронах периферической нервной системы и дезрегулируется или повреждением нерва и воспалением, вызывает состояние у человека, известное как врожденная нечувствительность к боли, которое характеризуется неспособностью чувствовать боль (смотри, например, Goldberg, Y.P. et al., Clin. Genet. (2007), Vol. 71, No. 4, pp. 311-119). Лидокаин и другие местные анастетики действуют в основном ингибированием Nav.
PCT опубликованная патентная заявка No. WO 06/110917 относится к спиро-оксиндольным соединениям, которые описываются в качестве пригодных в качестве блокаторов натриевых каналов. Данные соединения, в частности, ингибируют поток ионов натрия через натриевые каналы. Как таковые, данные соединения рассматриваются в качестве блокаторов натриевых каналов и, следовательно, являются пригодными для лечения заболеваний и состояний у млекопитающих, предпочтительно людей, которые являются результатом нарушенной биологической активности потенциалзависимых натриевых каналов или которые могут облегчаться регулированием биологической активности натриевых каналов.
Следовательно, существует необходимость в местной фармацевтической композиции, содержащей соединение, которое является блокатором натриевых каналов, предпочтительно антагонистом нейрональных потенциалзависимых натриевых каналов, для лечения боли, обладающей минимальным системным воздействием соединения и которая является косметически и фармацевтически приемлемой для продолжительного применения соединения на коже (т.е., нераздражающей, не вызывающей жжения и неаллергенной).
СУЩНОСТЬ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтическим композициям, содержащим одно или более фармацевтически приемлемых вспомогательных веществ и терапевтически эффективное количество спиро-оксиндольного соединения или его фармацевтически приемлемой соли. В частности, настоящее изобретение относится к фармацевтическим композициям, содержащим одно или более фармацевтически приемлемых вспомогательных веществ и терапевтически эффективное количество спиро-оксиндольного соединения, которое является блокатором натриевых каналов. Данные фармацевтические композиции являются пригодными для лечения и/или предотвращения заболеваний или состояний, опосредованных натриевыми каналами, и являются вводимыми местно нуждающемуся в лечении млекопитающему, предпочтительно человеку, с минимальным системным воздействием спиро-оксиндольного соединения.
Соответственно, в одном аспекте, настоящее изобретение относится к фармацевтической композиции для местного введения млекопитающему, в котором фармацевтическая композиция содержит один или более фармацевтически приемлемых вспомогательных веществ и терапевтически эффективное количество спиро-оксиндольного соединения, имеющего следующую формулу:
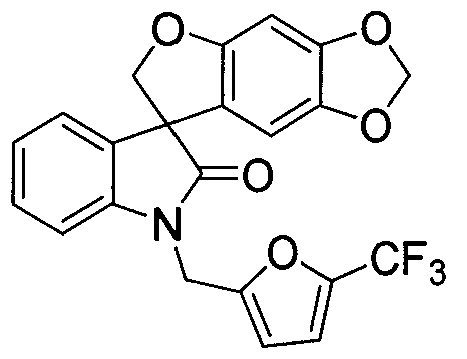
в виде энантиомера, рацемата или нерацемической смеси энантиомеров или его фармацевтически приемлемой соли.
В другом аспекте, настоящее изобретение относится к способу лечения боли у млекопитающего, предпочтительно человека, в котором способ включает введение нуждающемуся в лечении млекопитающему терапевтически эффективного количества фармацевтической композиции настоящего изобретения, как изложено выше.
В другом аспекте, настоящее изобретение относится к способу лечения или уменьшения тяжести заболевания, состояния или расстройства, когда активация или гиперактивация одного или более из нейрональных потенциалзависимых натриевых каналов, выбранных из NaV1.1, NaV1.2, NaV1.3, NaV1.4, NaV1.5, NaV1.6, NaV1.7, NaV1.8 или NaV1.9 вовлечена в заболевание, состояние или расстройство, в которых способ включает введение нуждающемуся в лечении млекопитающему терапевтически эффективного количества фармацевтической композиции настоящего изобретения, как изложено выше.
В другом аспекте, настоящее изобретение относится к способу лечения ряда заболеваний или состояний, опосредованных натриевыми каналами, предпочтительно заболеваний или состояний, опосредованных нейрональными потенциалзависимыми натриевыми каналами, в котором заболевания или состояния выбраны из, но не ограничиваются, боли, связанной с ВИЧ, невропатии, вызванной лечением ВИЧ, невралгии тройничного нерва, постгерпетической невралгии (PHN), семейной эритромелалгии, первичной эритромелалгии, семейной ректальной боли, эудинии, теплочувствительности, боли, связанной с множественным склерозом (РС), бокового амиотрофического склероза (ALS), болезненной диабетической нейропатии, периферической невропатии, артрита, ревматоидного артрита, остеоартрита, тендинита, бурсита, опорно-двигательных вывихов, тендовагинита, хондромаляции надколенника, миозита, миотонии (включая, но не ограничиваясь SCN4A-связанную миотонию), парамиотонии, рабдомиолиза, пароксизмальной дистонии, миастенических синдромов, злокачественной гипертермии, заболеваний, связанных с токсином натриевых каналов, боли, связанной с раком, синдрома беспокойных ног, фибромиалгии и нейродегенеративных заболеваний, а также других неврологических расстройств, включая множественный склероз, в котором способ включает введение нуждающемуся в лечении млекопитающему терапевтически эффективного количества фармацевтической композиции настоящего изобретения как изложено выше.
В другом аспекте, настоящее изобретение относится к способу лечения ряда заболеваний или состояний, опосредованных натриевыми каналами, предпочтительно заболеваний или состояний, опосредованных нейрональными потенциалзависимыми натриевыми каналами, у млекопитающего, предпочтительно человека, в котором заболевания или состояния выбраны из, но не ограничиваются, нейропротекции в ишемических условия, вызванных инсультом или травмой нервов, нейродегенеративного заболевания, а также других неврологических заболеваний, включая множественный склероз, в котором способ включает введение нуждающемуся в лечении млекопитающему терапевтически эффективного количества фармацевтической композиции настоящего изобретения, как изложено выше.
В другом аспекте, настоящее изобретение относится к способу лечения ряда заболеваний или состояний, опосредованных натриевыми каналами, предпочтительно заболеваний или состояний, опосредованных нейрональными потенциалзависимыми натриевыми каналами, у млекопитающего, предпочтительно человека, в котором заболевания или состояния выбраны из, но не ограничиваются, зуда, дерматита, контактного дерматита, аллергического дерматита, экземы, угревой сыпи и воспалительных заболеваний кожи, в котором способ включает введение нуждающемуся в лечении млекопитающему терапевтически эффективного количества фармацевтической композиции настоящего изобретения, как изложено выше.
В другом аспекте, настоящее изобретение относится к способу лечения ряда заболеваний или состояний, опосредованных натриевыми каналами, предпочтительно заболеваний или состояний, опосредованных нейрональными потенциалзависимыми натриевыми каналами, у млекопитающего, предпочтительно человека, за счет ингибирования тока ионов через потенциалзависимый натриевый канал у млекопитающего, предпочтительно нейрональный потенциалзависимый натриевый канал, в котором способ включает введение нуждающемуся в лечении млекопитающему терапевтически эффективного количества фармацевтической композиции настоящего изобретения, как изложено выше.
Дополнительным аспектом настоящего изобретения является способ получения фармацевтической композиции настоящего изобретения.
Конкретные варианты осуществления данных аспектов настоящего изобретения описывают более подробно ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Следующие чертежи образуют часть настоящего описания, и они включены для дополнительного описания определенных аспектов настоящего изобретения. Настоящее изобретение можно лучше понять со ссылкой на один или более из данных чертежей в комбинации с подробным описанием конкретных вариантов осуществления, представленных в настоящем изобретении.
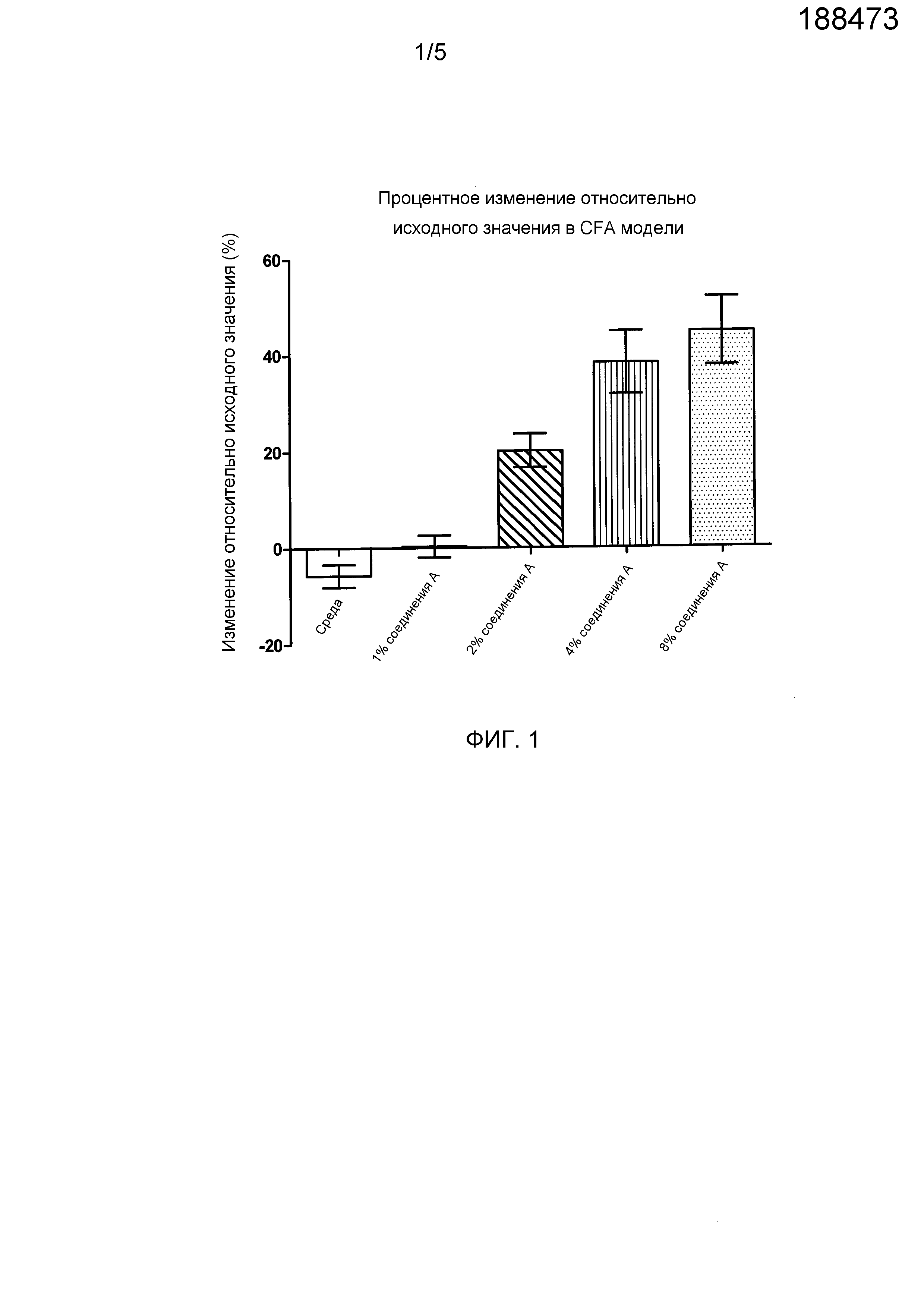
Фигура 1 представляет собой график, показывающий среднее процентное изменение относительно исходного значения (CFB) для каждой группы с определенной дозой, описанной в исследованиях с хронической воспалительной болью, вызванной CFA, примера 1. Данные выражены в виде среднее ± SD изменение относительно исходных величин.
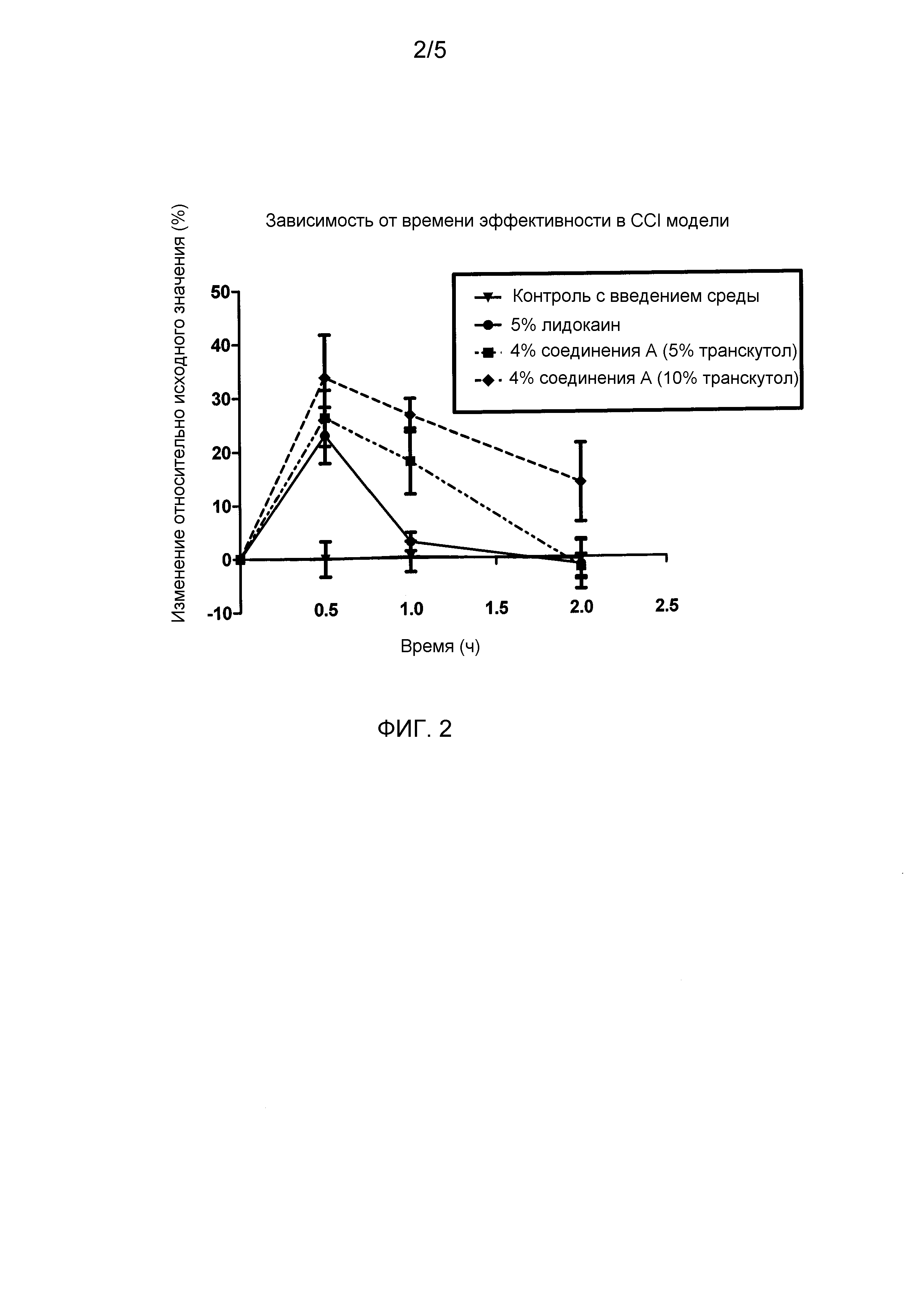
Фигура 2 представляет собой график, показывающий средний порог отдергивания лапы, выраженный в виде процентного изменения относительно исходной величины (CFB) для каждой обрабатываемой группы, описанной в исследовании с моделью невропатической боли в примере 2. Данные построены в виде среднее ± SEM.
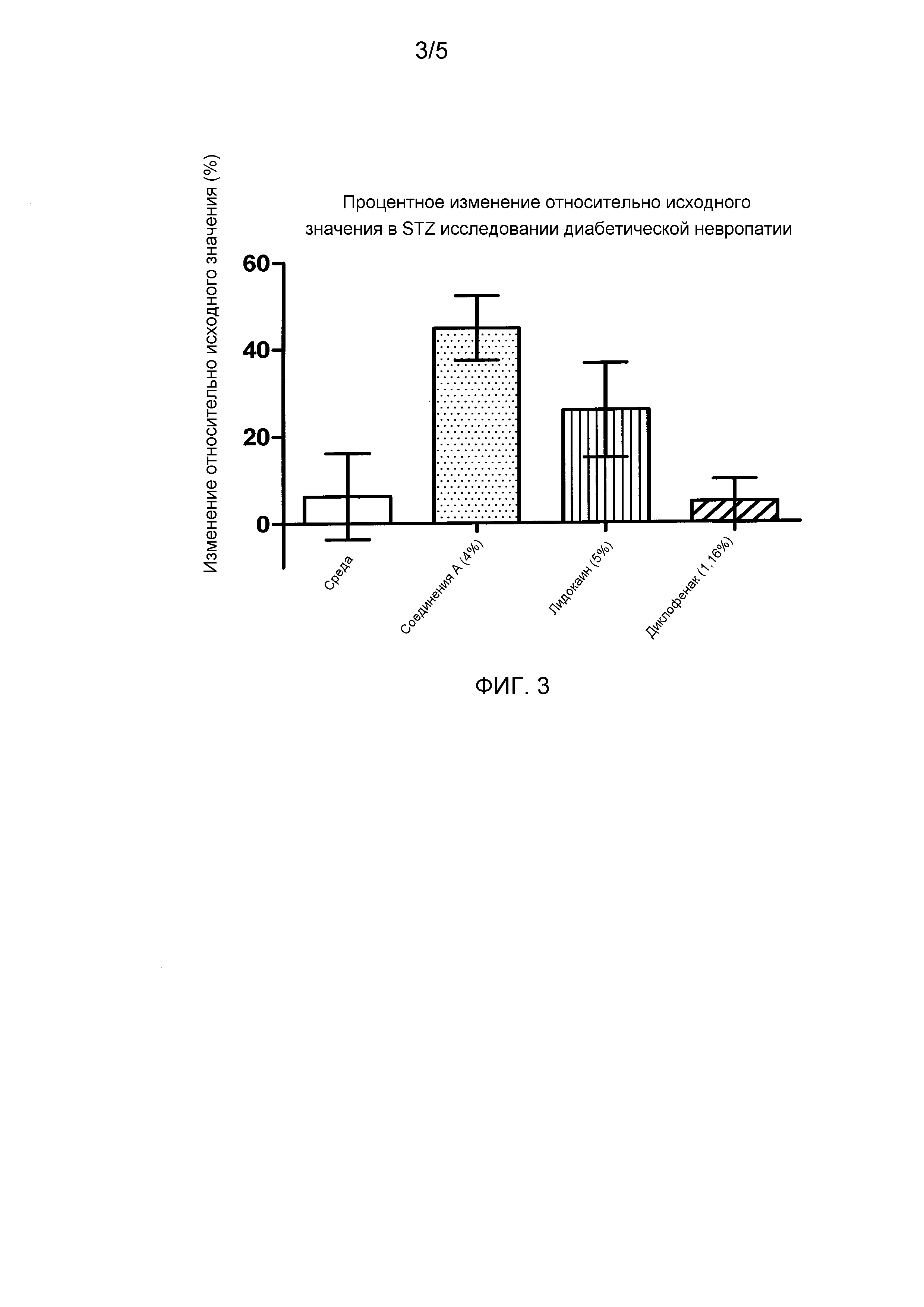
Фигура 3 представляет собой график, показывающий изменение при воздействии нити фон Фрея через 30 минут после введения дозы относительно исходной величины (CFB) для обработанной лапы в исследовании с диабетической невропатией в примере 4.
Фигура 4 представляет собой график, показывающий среднее процентное изменение относительно исходного значения (CFB) для каждой группы с введением дозы, описанной в CCI модели для невропатической боли в примере 5. Данные выражены в виде среднее ± SD изменение относительно исходных величин.
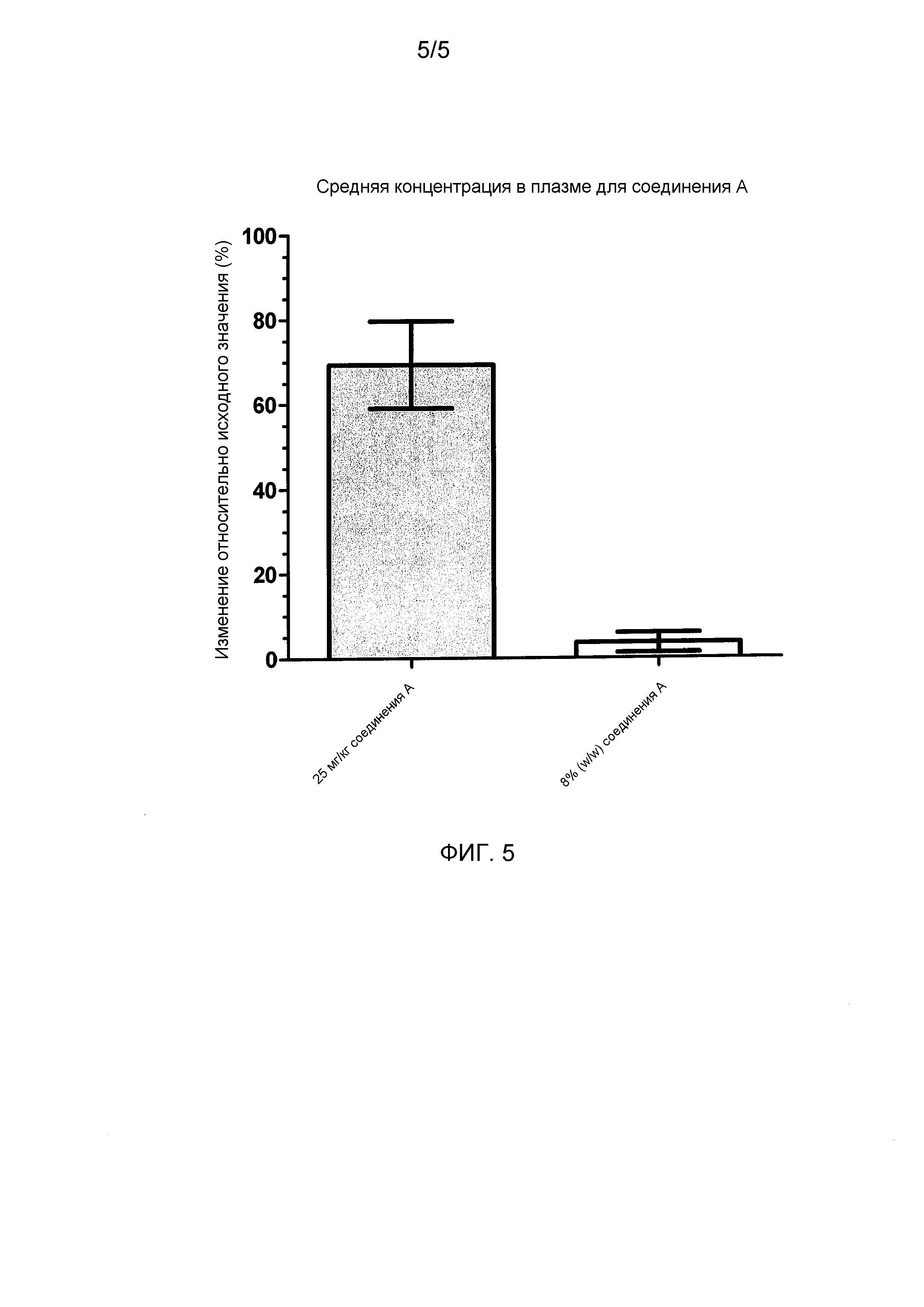
Фигура 5 представляет собой график, показывающий средние концентрации в плазме соединения A для каждой обработанной группы, описанной в исследовании с CCI моделью в примере 5.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
ОПРЕДЕЛЕНИЯ
Если не определено другим образом в настоящем описании, следующие термины и фразы должны иметь следующие значения:
"Спиро-оксиндольное соединение" относится к соединению, имеющему следующую формулу:
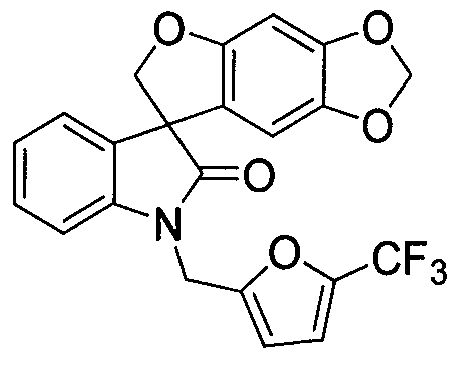
или его фармацевтически приемлемой соли. Данное соединение описано в PCT опубликованной патентной заявке No. WO 06/110917, которая вводится полностью в настоящее изобретение с помощью ссылки. Спиро-оксиндольное соединение может существовать в виде одного энантиомера, рацемата или нерацемической смеси энантиомеров. Один из энантиомеров спиро-оксиндольного соединения имеет следующую формулу:
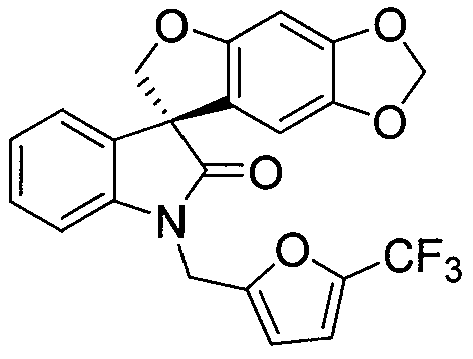
и назван в настоящем изобретении (S)-1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-оном. Данный энантиомер также обозначают в настоящем изобретении как "соединение A". Предполагается, что применение идентификатора "соединение A" включает энантиомер в виде свободного основания или в виде фармацевтически приемлемой соли.
Термин "приблизительно", когда его помещают перед числовой величиной "X" в настоящем изобретении, относится к интервалу, в диапазоне от X минус 10% X до X плюс 10% X и предпочтительно к интервалу, в диапазоне от X минус 5% X до X плюс 5% X.
Выражение "% вес./вес." относится к процентам по весу относительно суммарного веса рассматриваемой композиции.
Выражение "% вес./об." относится к весу растворенного вещества в указанном объеме растворителя. Например, 50% вес./об. PEG представляет собой 50 грамм PEG в 100 мл растворителя.
"Клатраты" относится к веществам с координированными газами, жидкостями или соединениями в качестве комплексов включения так, что комплекс можно транспортировать в твердой форме, и включенный компонент (или молекулу "гость") впоследствии высвобождают действием растворителя или плавлением. Термин "клатрат" можно применять взаимозаменяемо с фразой "молекула включения" или с фразой "комплекс включения". Клатраты, предусмотренные для применения в настоящем изобретении, можно получить из циклодекстринов. Циклодекстрины являются широко известными в качестве обладающих способностью образовывать клатраты (т.е., соединения включения) с различными молекулами. Смотри, например, Inclusion Compounds, edited by J.L. Atwood, J.E.D. Davies, and D.D. MacNicol, London, Orlando, Academic Press, 1984; Goldberg, I., "The Significance of Molecular Type, Shape and Complementarity in Clathrate Inclusion", Topics in Current Chemistry (1988), Vol. 149, pp. 2-44; Weber, E. et al, "Functional Group Assisted Clathrate Formation - Scissor-Like and Roof-Shaped Host Molecules", Topics in Current Chemistry (1988), Vol. 149, pp. 45-135; и MacNicol, D.D. et al., "Clathrates and Molecular Inclusion Phenomena", Chemical Society Reviews (1978), Vol. 7, No. 1, pp. 65-87. Известно, что превращение в циклодекстриновые клатраты увеличивает стабильность и растворимость определенных веществ, посредством этого облегчая их применение в качестве фармацевтических агентов. Смотри, например, Saenger, W., "Cyclodextrin Inclusion Compounds in Research and Industry", Angew. Chem. Int. Ed. Engl. (1980), Vol. 19, pp. 344-362; патент США No. 4886788 (Schering AG); патент США No. 6355627 (Takasago); патент США No. 6288119 (Ono Pharmaceuticals); патент США No. 614969 (Ono Pharmaceuticals); патент США No. 6235780 (Ono Pharmaceuticals); патент США No. 6262293 (Ono Pharmaceuticals); патент США No. 6225347 (Ono Pharmaceuticals); и патент США No. 4935446 (Ono Pharmaceuticals).
"Млекопитающее" включает людей и ручных животных, таких как лабораторные животные и домашних животных (например, кошек, собак, свиней, рогатый скот, овец, коз, лошадей и кроликов), и недомашних животных, таких как дикие и подобные.
"Фармацевтически приемлемое вспомогательное вещество" или "вспомогательное вещество" включает без ограничения любое неактивное вещество, которое смешивают со спиро-оксиндольным соединением настоящего изобретения для того, чтобы получить лекарственную форму для местного введения. Предполагается, что термин "фармацевтически приемлемое вспомогательное вещество" включает, но не ограничивается, любые растворители, агенты, улучшающие проникновение, антиоксиданты, агенты, увеличивающие густоту (т.е., загустители), мазевые основы, защитные агенты, адсорбенты, демульсенты, смягчающие средства, консерванты, увлажнители, буферы, вспомогательные вещества, усилители биодоступности, носители, вещества, способствующие скольжению, подсластители, разбавители, красители, усилители вкуса, вещества, увеличивающие растворимость (включая поверхностно-активные вещества), увлажнители, диспергаторы, суспендирующие агенты, стабилизаторы и изотонические агенты, которые одобрены контрольным органом, таким как, например, но не ограничиваясь, управление по контролю качества пищевых продуктов и лекарственных средств США, европейское агентство по лекарственным средствам и министерство здравоохранения Канады, в качестве приемлемых для применения в составах для местного введения фармакологически активного ингредиента и/или считающиеся общепризнанными в качестве безопасных веществ (GRAS вещества), и/или они перечислены в указатели неактивных ингредиентов, опубликованном управлением по контролю качества пищевых продуктов и лекарственных средств США. "Фармацевтически приемлемое вспомогательное вещество" также может включать приемлемые вспомогательные вещества, перечисленные в Remington: The Science and Practice of Pharmacy, Fox, 21st ed. 2005. Примеры фармацевтически приемлемых вспомогательных веществ включают, но не ограничиваются, следующие:
аскорбиновая кислота и эфиры;
бензиловый спирт;
бензилбензоат;
бутилированный гидрокситолуол ("BHT");
бутилированный гидроксианизол ("BHA");
каприловый/каприновый триглицерид;
цетиловый спирт;
хелатообразующие агенты (например, EDTA и лимонная кислота);
холестерин;
полимеры на основе поперечно-сшитой акриловой кислоты (например, Carbopol®);
децилметилсульфоксид;
диэтилсебакат;
диметиламин ("DMA");
диметикон;
диметилсульфоксид;
моноэфир диэтиленгликоля (например, Transcutol® P);
диизопропиладипат (например, Ceraphyl® 230);
этанол;
флавоноид;
глютатион;
глицерин;
глицерололеат/пропиленгликоль (например, Arlacel 186);
глицеролмоноолеат;
глицерилкаприлат/капрат и PEG-8 (полиэтиленгликоль)
каприлат/капратный комплекс;
каприлокапроилмакроголглицериды (например, Labrasol®);
глицерилмонокаприлат (например, Capmul® MCM C8);
глицерилмонолинолеат (например, Maisine™ 35-1);
глицерилмоноолеат (например, Peceol™);
глицерилмоностеарат;
гексиленгликоль;
гидроксипропил-β-циклодекстрин (ΗΡ-β-CD);
изопропиловый спирт;
изопропилмиристат;
лаурокапрам; (например, Azone®);
лауролилмакрогол-32 глицериды (например, Gelucire® 44/14);
макрогол-15 гидроксистеарат (например, Solutol® HS15);
триглицериды средней длины (например, Miglyol® 810, Miglyol® 840 или Miglyol® 812);
метиллаурат;
N-метил-2-пирролидон (например, Pharmasolve®);
минеральное масло;
монодиглицериды (например, Capmul® MCM);
октилдодеканол;
олеиновая кислота;
олеиновый спирт;
арахисовое масло;
1,2-пентандиол;
полисорбаты (например, Tween® 80);
полиэтиленгликоль (например, PEG-8, PEG 400, PEG1000, PEG 3350, PEG 6000 или Lutrol® E 400);
полиоксил 35 касторовое масло (например, Cremophor® EL);
полиоксил 40 гидрогенизированное касторовое масло (например, Cremophor® RH 40);
пропиленгликоль;
пропиленгликольдиацетат;
пропиленгликольмонокаприлат (например, Capmul PG-8, Capryol 90);
пропиленгликольмонолаурат (например, Capmul PG-12);
пропиленгликольмоноолеат;
2-пирролидон;
соевое масло;
стеариловый спирт;
сульфобутилэфир-β-циклодекстрин (например, Capitsol®);
токоферолы (например, ацетат витамина E);
α-токоферолполиэтиленгликольсукцинат (TPGS);
вода; и
медицинский вазелин.
Дополнительные фармацевтически приемлемые вспомогательные вещества описывают в настоящем изобретении.
"Растворители" относятся к веществам, которые легко растворяют другие вещества, такие как спиро-оксиндольное соединение настоящего изобретения, для того, чтобы образовать раствор. Подходящие растворители для целей настоящего изобретения включают полиэтиленгликоль (например, PEG 400, PEG 100 и PEG 3350), диэтиленгликольмоноэтиловый эфир (например, Transcutol®), Tween 80, спирты (например, олеиновый спирт и стеариновый спирт), Labrasol®, каприловый/каприновый триглицерид, эфиры жирных кислот (например, изопропилмиристат и диизопропиладипат (например, Ceraphyl® 230)), диэтилсебакат, пропиленгликольмонокаприлат (например, Capmul® PG-8), пропиленгликольлаурат (например, Capmul® PG-12), монодиглицериды (например, Capmul® MCM), глицерилмонокаприлат (например, Capmul® MCM C8), триглицериды со средней длинной цепи, гексиленгликоль, глицерилмоноолеат (например, Peceol™), 1,2-пентандиол, октилдодеканол, глицерилмонолинолеат (например, Maisine™ 35-1), изопропиловый спирт, глицерололеат/пропиленгликоль (например, Arlacel® 186), минеральное масло, воду и глицерин.
"Агенты, улучшающие проникновение" относятся к веществам, которые увеличивают проницаемость кожи или слизистой оболочки для фармакологически активного ингредиента, предпочтительно спиро-оксиндольного соединения настоящего изобретения, для того, чтобы увеличить скорость, с которой активный ингредиент проникает через кожу или слизистую оболочку млекопитающего, предпочтительно человека. Подходящие агенты, улучшающие проникновение, для целей настоящего изобретения включают, но не ограничиваются, диметилсульфоксид (DMSO), децилметилсульфоксид, лаурокапрам (например, Azone®), пирролидоны (например, 2-пирролидон и N-метил-2-пирролидон (Pharmasolve®)), поверхностно-активные вещества, спирты (например, олеиновый спирт), олеиновую кислоту, полиэтиленгликоль (например, PEG 400), диэтиленгликольмоноэтиловый эфир (например, Transcutol®) и эфиры жирных кислот (например, изопропилмиристат, метиллаурат, глицеролмоноолеат и пропиленгликольмоноолеат). Агент, улучшающий проникновение, можно применять независимо, или более чем один агент можно применять в фармацевтической композиции настоящего изобретения.
"Мазевые основы" относится к веществам, которые действует в качестве носителя и усиливают проникновение в кожу для того, чтобы доставить фармакологически активный ингредиент, предпочтительно спиро-оксиндольное соединение настоящего изобретения, в область, которую подвергают лечению, млекопитающего, предпочтительно человека. Подходящие "мазевые основы" для целей настоящего изобретения включают, но не ограничиваются, полиэтиленгликоли (например, PEG 400 и PEG 3350). Мазевую основу можно применять независимо, или более чем одну мазевую основу можно применять в фармацевтической композиции настоящего изобретения.
"Загуститель" относится к веществам, которые увеличивают вязкость и/или физическую стабильность фармацевтической композиции настоящего изобретения. Подходящие "загустители" для целей настоящего изобретения включают, но не ограничиваются, стеариловый спирт, карбополы, диметикон и полимеры. Загуститель можно применять независимо, или более чем один загуститель можно применять в фармацевтической композиции настоящего изобретения.
"Антиоксиданты" относится к веществам, которые способны предотвращать окисление другой молекулы. Подходящие "антиоксиданты" для целей настоящего изобретения включают, но не ограничиваются, бутилированный гидрокситолуол (BHT), бутилированный гидроксианизол (BHA), токоферолы (например, ацетат витамина E), флавоноид, глютатион, аскорбиновую кислоту и ее эфиры, DMSO и хелатообразующие агенты (например, EDTA и лимонная кислота).
"Фармацевтически приемлемая соль" включает и соли присоединения кислоты и соли присоединения основания.
"Фармацевтически приемлемая соль присоединения кислоты" относится к тем солям, которые сохраняют биологическую эффективность и свойства свободных оснований, которые не являются биологически или иным образом нежелательными, и которые образуются с неорганическими кислотами, такими как, но не ограничиваясь, хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобными, и органическими кислотами, такими как, но не ограничиваясь, уксусная кислота, 2,2-дихлоруксусной кислоты, адипиновая кислота, альгиновая кислота, аскорбиновая кислота, аспарагиновая кислота, бензолсульфокислота, бензойная кислота, 4-ацетамидобензойная кислота, камфорная кислота, камфор-10-сульфокислота, каприновая кислота, капроновая кислота, каприловая кислота, угольная кислота, коричная кислота, лимонная кислота, цикламиновая кислоты, додецилсерная кислота, этан-1,2-дисульфокислота, этансульфоновая кислота, 2-гидроксиэтансульфокислота, муравьиная кислота, фумаровая кислота, галактаровая кислота, гентизиновая кислота, глюкогептоновая кислота, глюконовая кислота, глюкуроновая кислота, глутаминовая кислота, глутаровая кислота, 2-оксо-глутаровая кислота, глицерофосфорная кислота, гликолевая кислота, гиппуровая кислоты, изомасляная кислота, молочная кислота, лактобионовая кислоты, лауриловая кислота, малеиновая кислота, яблочная кислота, малоновая кислота, миндальная кислота, метансульфокислота, муциновая кислота, нафталин-1,5-дикислота, нафталин-2-сульфокислота, 1-гидрокси-2-нафтойная кислота, никотиновая кислота, олеиновая кислота, оротовая кислота, щавелевая кислота, пальмитиновая кислота, памовая кислота, пропионовая кислота, пироглютаминовая кислота, пировиноградная кислота, салициловая кислота, 4-аминосалициловая кислота, себациновая кислота, стеариновая кислота, янтарная кислота, винная кислота, тиоциановая кислота, п-толуолсульфокислота, трифторуксусная кислота, ундециленовая кислота и подобные.
"Фармацевтически приемлемая соль присоединения основания" относится к таким солям, которые сохраняют биологическую эффективность и свойства свободных кислот, которые не являются биологически или иным образом нежелательными. Данные соли получают добавлением неорганического основания или органического основания к свободной кислоте. Соли, полученные из неорганических оснований, включают, но ими не ограничиваются, соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и подобных. Предпочтительными неорганическими солями являются соли аммония, натрия, калия, кальция и магния. Соли, полученные из органических оснований, включают, но не ограничиваются, соли первичных, вторичных и третичных аминов, замещенных аминов, включая встречающиеся в природе замещенные амины, циклических аминов и основных ионообменных смол, такие как аммиак, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, диэтаноламин, этаноламин, деанол, 2-диметиламиноэтанол, 2-диэтиламиноэтанол, дициклогексиламина, лизин, аргинин, гистидин, кофеин, прокаин, гадрабамин, холин, бетаин, бенетамин, бензатин, этилендиамин, глюкозамин, метилглюкамин, теобромин, триэтаноламин, трометамин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминовые смолы и подобные. Особенно предпочтительными органическими основаниями являются изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин, холин и кофеин.
"Фармацевтическая композиция" относится к составу спиро-оксиндольного соединения настоящего изобретения и среде, обычно принятой в данной области техники, для местного введения спиро-оксиндольного соединения млекопитающим, например, людям. Данная среда включает все фармацевтически приемлемые вспомогательные вещества. Для целей настоящего описания, фраза "фармацевтическая композиция" является взаимозаменяемой с фразой "фармацевтический состав".
"Заболевание или состояние, опосредованное натриевыми каналами" относится к заболеванию или состоянию, которое улучшается или облегчается регулированием натриевых каналов и включает, но не ограничивается, боль или постгерпетическую невралгию. Дополнительные примеры заболеваний или состояний, опосредованных натриевыми каналами, описаны ниже.
"Терапевтически эффективное количество" относится к такому количеству спиро-оксиндольного соединения настоящего изобретения или фармацевтической композиции настоящего изобретения, которое при введении млекопитающему, предпочтительно человеку, является достаточным для осуществления лечения, как определено ниже, указанного заболевания или состояния у млекопитающего, предпочтительно человека. Количество спиро-оксиндольного соединения или фармацевтической композиции, которое образует "терапевтически эффективное количество" будет изменяться в зависимости от спиро-оксиндольного соединения, фармацевтической композиции, характера заболевания или состояния и его тяжести, других условий (например, возраста, веса, общего состояния здоровья), воздействующих на здоровье млекопитающего, которого подвергают лечению, и способа введения, а также от эффективности, биодоступности и in vivo времени полувыведения компонентов применяемой фармацевтической композиции, но специалист в данной области техники может определить его обычным способом, принимая во внимание его собственные знания и данное описание.
"Лечить" или "лечение", как применяют в настоящем изобретении, включает лечение соответствующего заболевания или состояния у млекопитающего, предпочтительно человека, страдающего от соответствующего заболевания или состояния, и включает:
(i) предотвращение возникновения заболевания или состояния у млекопитающего, в частности, когда данное млекопитающее предрасположено к состоянию, но ему еще не поставлен диагноз данного заболевания;
(ii) ингибирование заболевания или состояния, т.е., остановка его развития;
(iii) облегчение заболевания или состояния, т.е., вызов регрессии заболевания или состояния; или
(iv) облечение симптомов, являющихся результатом заболевания или состояния.
Как применяют в настоящем изобретении, термины "заболевание" и "состояние" можно применять взаимозаменяемо, или они могут различаться в том, что конкретное заболевание или состояние может не иметь причинного фактора (так что этиология еще не определена), и оно, следовательно, еще не признано в качестве заболевания, но только как нежелательное состояние или синдром, в котором приблизительно конкретный набор симптомов обнаружен практикующими врачами.
"Анальгезия" относится к отсутствию боли в ответ на стимул, который в нормальных условиях является болевым.
"Аллодиния" относится к состоянию, при котором обычно безвредное раздражение, такое как давление или мягкое прикосновение, ощущается как чрезвычайно болевое.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Среди различных аспектов настоящего изобретения, описанных выше в сущности настоящего изобретения, определенные варианты осуществления являются предпочтительными.
Среди фармацевтических композиций настоящего изобретения, как изложено выше в сущности настоящего изобретения, один вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и одно или более фармацевтически приемлемых вспомогательных веществ, выбранных из приведенного списка фармацевтически приемлемых вспомогательных веществ, как изложено выше в определениях.
Другой вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и одного или более фармацевтически приемлемых вспомогательных веществ, в которой фармацевтически приемлемые вспомогательные вещества выбраны из одного или более растворителей, необязательно из одного или более агентов, улучшающих проникновение, необязательно из одного или более загустителей, необязательно из одной или более мазевых основ, и необязательно из одного или более антиоксидантов.
Другой вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и два или более фармацевтически приемлемых вспомогательных веществ, в котором фармацевтически приемлемые вспомогательные вещества выбраны из одного или более растворителей, необязательно из одно или более агентов, улучшающих проникновение, необязательно из одного или более загустителей, необязательно из одной или более мазевых основ, и необязательно из одного или более антиоксидантов.
Другой вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и два или более фармацевтически приемлемых вспомогательных веществ, в которой фармацевтически приемлемые вспомогательные вещества выбраны из одного или более растворителей, необязательно из одного или более агентов, улучшающих проникновение, необязательно из одного или более загустителей, необязательно из одной или более мазевых основ, и необязательно из одного или более антиоксидантов.
Другой вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и один или более фармацевтически приемлемых вспомогательных веществ, в которой одно из фармацевтически приемлемых вспомогательных веществ представляет собой растворитель, выбранный из полиэтиленгликоля, диэтиленгликоля моноэтилового эфира, полисорбатов, спиртов, каприлокапроилмакроголглицеридов, каприлового/капринового триглицерида, эфиров жирных кислот, диэтилсебаката, пропиленгликольмонокаприлата, пропиленгликольлаурата, монодиглицеридов, глицерилмонокаприлата, триглицеридов со средней длинной цепи, гексиленгликоля, глицерилмоноолеата, 1,2-пентандиола, октилдодеканола, глицерилмонолинолеата, глицерололеата/пропиленгликоля, минерального масла, воды или глицерина.
Другой вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и один или более фармацевтически приемлемых вспомогательных веществ, в которой одно из фармацевтически приемлемых вспомогательных веществ представляет собой агент, улучшающий проникновение, выбранный из диметилсульфоксида, децилметилсульфоксида, лаурокапрама, пирролидонов, поверхностно-активных веществ, спиртов, олеиновой кислоты, полиэтиленгликоль, диэтиленгликольмоноэтилового эфира или эфиров жирных кислот.
Другой вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и один или более фармацевтически приемлемых вспомогательных веществ, в которой одно из фармацевтически приемлемых вспомогательных веществ представляет собой загуститель, выбранный из стеаринового спирта, карбополов, диметикона или полимеров.
Другой вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и один или более фармацевтически приемлемых вспомогательных веществ, в которой одно из фармацевтически приемлемых вспомогательных веществ представляет собой мазевую основу, выбранную из полиэтиленгликолей.
Другой вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и один или более фармацевтически приемлемых вспомогательных веществ, в которой одно из фармацевтически приемлемых вспомогательных веществ представляет собой антиоксидант, выбранный из бутилированного гидрокситолуола, бутилированного гидроксианизола, токоферолов, флавоноида, глютатиона, аскорбиновой кислоты и эфиров, диметилсульфоксида или хелатообразующих агентов.
Другой вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и один или более фармацевтически приемлемых вспомогательных веществ, в которой каждое фармацевтически приемлемое вспомогательное вещество присутствует при концентрации от приблизительно 0,01% вес/вес до приблизительно 99% вес./вес.
Другой вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и один или более фармацевтически приемлемых вспомогательных веществ, в которой первое фармацевтически приемлемое вспомогательное вещество представляет собой растворитель, присутствующий при концентрации от приблизительно 30% вес./вес. до приблизительно 70% вес./вес., второе фармацевтически приемлемое вспомогательное вещество представляет собой агент, улучшающий проникновение, присутствующий при концентрации от приблизительно 2% вес./вес. до приблизительно 25% вес./вес., третье фармацевтически приемлемое вспомогательное вещество представляет собой агент, улучшающий проникновение, присутствующий при концентрации от приблизительно 1% вес./вес. до приблизительно 10% вес./вес., четвертое фармацевтически приемлемое вспомогательное вещество представляет собой агент, улучшающий проникновение, присутствующий при концентрации от приблизительно 1% вес./вес. до приблизительно 25% вес./вес., пятое фармацевтически приемлемое вспомогательное вещество представляет собой загуститель, присутствующий при концентрации от приблизительно 0,1% вес./вес. до приблизительно 10% вес./вес., шестое фармацевтически приемлемое вспомогательное вещество представляет собой антиоксидант, присутствующий при концентрации от приблизительно 0,01% вес./вес. до приблизительно 2% вес./вес., и седьмое фармацевтически приемлемое вспомогательное вещество представляет собой мазевую основу, присутствующий при концентрации от приблизительно 10% вес./вес. до приблизительно 50% вес./вес.
Другой вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и один или более фармацевтически приемлемых вспомогательных веществ, в которой первое фармацевтически приемлемое вспомогательное вещество представляет собой растворитель, присутствующий при концентрации от приблизительно 45% вес./вес. до приблизительно 55% вес./вес., второе фармацевтически приемлемое вспомогательное вещество представляет собой агент, улучшающий проникновение, присутствующий при концентрации от приблизительно 5% вес./вес. до приблизительно 15% вес./вес., третье фармацевтически приемлемое вспомогательное вещество представляет собой агент, улучшающий проникновение, присутствующее при концентрации от приблизительно 2,5% вес./вес. до приблизительно 7,5% вес./вес., четвертое фармацевтически приемлемое вспомогательное вещество представляет собой агент, улучшающий проникновение, присутствующее при концентрации от приблизительно 2,5% вес./вес. до приблизительно 7,5% вес./вес., пятое фармацевтически приемлемое вспомогательное вещество представляет собой загуститель, присутствующее при концентрации от приблизительно 0,1% вес./вес. до приблизительно 7,5% вес./вес., шестое фармацевтически приемлемое вспомогательное вещество представляет собой антиоксидант, присутствующий при концентрации от приблизительно 0,05% вес./вес. до приблизительно 1% вес./вес., и седьмое фармацевтически приемлемое вспомогательное вещество представляет собой мазевую основу, присутствующее при концентрации от приблизительно 15% вес./вес. до приблизительно 30% вес./вес.
Другой вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, и один или более фармацевтически приемлемых вспомогательных веществ, выбранных из растворителя, выбранного из PEG 400 или PEG 3350; один или более агентов, улучшающих проникновение, выбранных из Transcutol® P, олеинового спирта или изопропилмиристата; загуститель, выбранный из стеарилового спирта; мазевую основу, выбранную из PEG 400 или PEG 3350; и антиоксидант, выбранный из бутилированного гидрокситолуола.
Для данного варианта осуществления, дополнительный вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, в которой PEG 400 присутствует при концентрации от приблизительно 30% вес./вес. до приблизительно 70% вес./вес., Transcutol® P присутствует при концентрации от приблизительно 2% вес./вес. до приблизительно 25% вес./вес., олеиновый спирт присутствует при концентрации от приблизительно 1% вес./вес. до приблизительно 10% вес./вес., изопропилмиристат присутствует при концентрации от приблизительно 1% вес./вес. до приблизительно 25% вес./вес., стеариловый спирт присутствует при концентрации от приблизительно 0,1% вес./вес. до приблизительно 10% вес./вес., BHT присутствует при концентрации от приблизительно 0,01% вес./вес. до приблизительно 2% вес./вес. и PEG 3350 присутствует при концентрации от приблизительно 10% вес./вес. до приблизительно 50% вес./вес.
Для данного варианта осуществления, дополнительный вариант осуществления представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, в которой PEG 400 присутствует при концентрации от приблизительно 45% вес./вес. до приблизительно 55% вес./вес., Transcutol® P присутствует при концентрации от приблизительно 5% вес./вес. до приблизительно 15% вес./вес., олеиновый спирт присутствует при концентрации от приблизительно 2,5% вес./вес. до приблизительно 7,5% вес./вес., изопропилмиристат присутствует при концентрации от приблизительно 2,5% вес./вес. до приблизительно 7,5% вес./вес., стеариловый спирт присутствует при концентрации от приблизительно 0,1% вес./вес. до приблизительно 7,5% вес./вес., BHT присутствует при концентрации от приблизительно 0,05% вес./вес. до приблизительно 1% вес./вес. и PEG 3350 присутствует при концентрации от приблизительно 15% вес./вес. до приблизительно 30% вес./вес.
Из всех вышеуказанных вариантов осуществления, дополнительный вариант осуществления представляет собой вариант, в котором спиро-оксиндольное соединение присутствует при концентрации от приблизительно 0,1% вес./вес. до приблизительно 10% вес./вес.
Для данного варианта осуществления, дополнительный вариант осуществления представляет собой вариант, в котором спиро-оксиндольное соединение присутствует при концентрации от приблизительно 2% вес./вес. до приблизительно 8% вес./вес.
Из всех вышеуказанных вариантов осуществления, дополнительный вариант осуществления представляет собой вариант, в котором фармацевтическая композиция содержит спиро-оксиндольное соединение при концентрации 2,0% вес./вес.; PEG 400 при концентрации 52,9% вес./вес.; Transcutol® P при концентрации 10% вес./вес.; олеиновый спирт при концентрации 5% вес./вес.; изопропилмиристат при концентрации 5% вес./вес.; стеариловый спирт при концентрации 5% вес./вес.; бутилированный гидрокситолуол при концентрации 0,1% вес./вес.; и PEG 3350 при концентрации 20% вес./вес. фармацевтической композиции.
Из всех вышеуказанных вариантов осуществления, другой дополнительный вариант осуществления представляет собой вариант, в котором фармацевтическая композиция содержит спиро-оксиндольное соединение при концентрации 4% вес./вес.; PEG 400 при концентрации 50,9% вес./вес.; Transcutol® P при концентрации 10% вес./вес.; олеиновый спирт при концентрации 5% вес./вес.; изопропилмиристат при концентрации 5% вес./вес.; стеариловый спирт при концентрации 5% вес./вес.; бутилированный гидрокситолуол при концентрации 0,1% вес./вес.; и PEG 3350 при концентрации 20% вес./вес. фармацевтической композиции.
Из всех вышеуказанных вариантов осуществления, другой дополнительный вариант осуществления представляет собой вариант, в котором фармацевтическая композиция содержит спиро-оксиндольное соединение при концентрации 4% вес./вес.; PEG 400 при концентрации 50,9% вес./вес.; Transcutol® P при концентрации 5% вес./вес.; олеиновый спирт при концентрации 5% вес./вес.; изопропилмиристат при концентрации 5% вес./вес.; стеариловый спирт при концентрации 10% вес./вес.; бутилированный гидрокситолуол при концентрации 0,1% вес./вес.; и PEG 3350 при концентрации 20% вес./вес. фармацевтической композиции.
Из всех вышеуказанных вариантов осуществления, другой дополнительный вариант осуществления представляет собой вариант, в котором фармацевтическая композиция содержит спиро-оксиндольное соединение при концентрации 8% вес./вес.; PEG 400 при концентрации 46,9% вес./вес.; Transcutol® P при концентрации 10% вес./вес.; олеиновый спирт при концентрации 5% вес./вес.; изопропилмиристат при концентрации 5% вес./вес.; стеариловый спирт при концентрации 5% вес./вес.; бутилированный гидрокситолуол при концентрации 0,1% вес./вес.; и PEG 3350 при концентрации 20% вес./вес. фармацевтической композиции.
Из всех вышеуказанных вариантов осуществления, дополнительный вариант осуществления представляет собой вариант, в котором спиро-оксиндольное соединение представляет собой соединение следующей формулы:
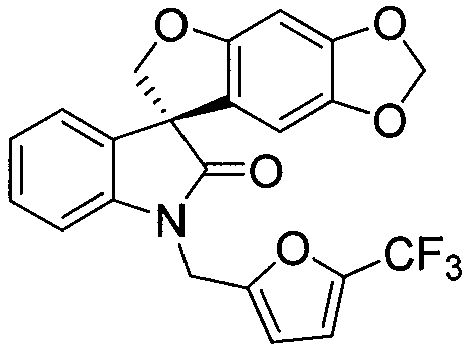
или его фармацевтически приемлемую соль.
Из способов лечения, предотвращения или улучшения заболевания или состояния, опосредованного натриевыми каналами, у млекопитающего, как изложено выше в сущности настоящего изобретения, один вариант осуществления включает местное введение нуждающемуся в лечении млекопитающему, предпочтительно человеку, терапевтически эффективного количества фармацевтической композиции любого из вышеуказанных вариантов осуществления фармацевтических композиций настоящего изобретения.
Для данного варианта дополнительный вариант осуществления представляет собой вариант, в котором упомянутое заболевание или состояние выбрано из группы, состоящей из невропатической боли, воспалительной боли, висцеральной боли, постгерпетической невралгии, боли при раке, боли при химиотерапии, боли в результате травмы, операционной боли, постоперационной боли, прурита, остеоартрита, невралгии тройничного нерва, семейной эритромелалгии, первичной эритромелалгии, семейной ректальной боли, боли при родах, боли при родовых схватках, нейрогенного мочевого пузыря, язвенного колита, хронической боли, постоянной боли, периферически опосредованной боли, центрально опосредованной боли, хронической головной боли, мигрени, синусовой головной боли, головной боли напряжения, фантомной боли конечностей, травмы периферических нервов и их комбинаций.
Конкретные варианты осуществления фармацевтических композиций настоящего изобретения и способов применения фармацевтических композиций настоящего изобретения описывают более подробно ниже.
ПРИМЕНИМОСТЬ ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтическим композициям, содержащим одно или более фармацевтически приемлемых вспомогательных веществ и терапевтически эффективное количество спиро-оксиндольного соединения, или его фармацевтически приемлемой соли, для применения в лечении заболеваний или состояний, опосредованных натриевыми каналами, предпочтительно заболеваний или состояний, связанных с болью, таких как, например, постгерпетическая невралгия, остеоартрит и постоянная постоперационная боль, у млекопитающего местным введением терапевтически эффективного количества фармацевтической композиции нуждающемуся в лечении млекопитающему, предпочтительно человеку.
Заболевания или состояния, опосредованные натриевыми каналами, особенно интересные для настоящего изобретения, представляют собой те заболевания или состояния, которые улучшаются или облегчаются регулированием, предпочтительно ингибированием (или блокированием) натриевых каналов. Предпочтительно заболевания или состояния, опосредованные натриевыми каналами, настоящего изобретения представляют собой те заболевания или состояния, которые улучшаются или облегчаются регулированием, предпочтительно ингибированием (или блокированием) нейрональных потенциалзависимых натриевых каналов (Nav), включая, но не ограничиваясь, боль или постгерпетическую невралгию.
Соответственно, настоящее изобретение относится к способу лечения ряда заболеваний или состояний, опосредованных натриевыми каналами, у млекопитающего, предпочтительно человека, в котором заболевания или состояния выбрано из, но не ограничиваясь, боли, постгерпетической невралгии (PHN), постоперационной боли, прурита, боли, связанной с ВИЧ, невропатии, вызванной лечением ВИЧ, невралгии тройничного нерва, семейной эритромелалгии, первичной эритромелалгии, семейной ректальной боли, эудинии, теплочувствительности, боли, связанной с множественным склерозом (MS), бокового амиотрофического склероза (ALS), болезненной диабетической невропатии, периферической невропатии, артрита, ревматоидного артрита, остеоартрита, тендинита, бурсита, опорно-двигательных вывихов, тенозиновита, хондромаляции надколенника, миозита, миотонии (включая, но не ограничиваясь, SCN4A-связанную миотонии), парамиотонии, рабдомиолиза, пароксизмальной дистонии, синдромов миастении, злокачественной гипертермии, заболеваний, связанных с токсинами натриевых каналов, боли при раке, синдрома беспокойных ног, фибромиалгии и нейродегенеративных заболеваний, а также других неврологических расстройств, включая множественный склероз, введением млекопитающему терапевтически эффективного количества фармацевтической композиции настоящего изобретения.
Для целей настоящего изобретения и если не указано особо, термин "боль" относится ко всем категориям боли и признано, что она включает, но не ограничивается, невропатическую боль, воспалительную боль, ноцицептивную боль, идиопатическую боль, невралгическую боль, орофациальную боль, боль при ожогах, соматическую боль, висцеральную боль, миофасциальную боль, зубную боль, боль при раке, боль при химиотерапии, боль при травме, хирургическую боль, постхирургическую боль, родовую боль, боль при родовых схватках, рефлекторную симпатическую дистрофию, отрыв плечевого сплетения, острую боль (например, костно-мышечную и постоперационную боль), хроническую боль, постоянные боли, периферически-опосредованную боль, центрально опосредованную боль, состояния, связанные с головной болью, фантомную боль конечностей, травмы периферических нервов, боль после инсульта, поражение таламуса, радикулопатию, боль при ВИЧ, постгерпетическую боль и их комбинации.
Прурит, общеизвестный как чесотка, и также известный как почесуха, представляет собой распространенное дерматологическое заболевание. Тогда как точные причины прурита являются сложными и плохопонятыми, давно признано, что он опосредован сенсорными нейронами, некоторые из которых также опосредуют болевые реакции. В частности, считают, что натриевые каналы, вероятно, сообщаются или передают вдоль нервного аксона чесоточные сигналы вдоль кожи. Передача чесоточных импульсов приводит в результате к неприятному ощущению, которое вызывает желание или рефлекс расчесывания.
На нейробиологическом уровне считают, что, существует коллективная многокомпонентность специфических медиаторов, связанных с нейрональными путями и основными процессами чесотки и боли, и недавние данные предполагают, что существует большое совпадение между периферическими медиаторами и/или рецепторами, связанными с болью и чесоткой (Ikoma et al., Nature Reviews Neuroscience, 7:535-547, 2006). Удивительно, что боль и чесотка имеют аналогичные механизмы нейрональной сенсибилизации в периферической нервной и центральной нервной системе, но также обладают интересными различиями.
Например, мягкие болевые стимулы после царапанья являются эффективными для исчезновения чесоточной сенсибилизации. Напротив, анальгетики, такие как опиоиды, могут вызывать тяжелый прурит. Антагонистическое взаимодействие между болью и чесоткой можно применять при лечении прурита, и современные исследования сконцентрированы на обнаружении общих мишеней для бедующей анальгетической и противопруритной терапии. Показано, что соединение A или его фармацевтически приемлемая соль обладают анальгетическими эффектами в ряде моделей животных при пероральных дозах в диапазоне от 1 мг/кг до 100 мг/кг.
Соответственно, соединение A в виде энантиомера или его фармацевтически приемлемой соли может также быть пригодно для лечения прурита.
Виды прурита, включают, но не ограничиваются:
a) псориазный прурит, чесотку в результате гемодиализа и чесотку, вызванную заболеваниями кожи (например, дерматитом), системными заболеваниями, невропатией, психогенными факторами или их смесью;
b) чесотку, вызванную аллергическими реакциями, укусами животных, гиперчувствительностью (например, сухостью кожи, экземой, псориазом), акне, воспалительными заболеваниями или ранами;
c) раздражение кожи или воспалительный эффект после введения другого терапевтического средства, такого как, например, антибиотики, противовирусные препараты и антигистаминовые препараты; и
d) чесотку, вызванную вирусной инфекцией, такую как чесотка, связанная с постгерпетической невралгией.
Общую применимость спиро-оксиндольного соединения или его фармацевтически приемлемой соли настоящего изобретения в качестве блокатора натриевых каналов описывают в PCT опубликованной патентной заявке No. WO 06/110917. В частности, общую применимость спиро-оксиндольного соединения или его фармацевтически приемлемой соли, применяемых в фармацевтических композициях настоящего изобретения для регулирования, особенно ингибирования тока ионов через натриевые каналы, определяют, применяя анализы, описанные в PCT опубликованной патентной заявке No. WO 06/110917. Общую применимость соединения A или его фармацевтически приемлемой соли, применяемых в фармацевтических композициях настоящего изобретения для лечения заболеваний или состояний, опосредованных натриевыми каналами, можно установить в стандартизированных моделях животных и в моделях животных, описанных в PCT опубликованной патентной заявке No. WO 06/110917 для демонстрации эффективности спиро-оксиндольного соединения или его фармацевтически приемлемой соли для лечения данного заболевания и состояния.
Соответственно, настоящее изобретение относится к способу лечения ряда заболеваний или состояний, опосредованных натриевыми каналами, предпочтительно заболеваний или состояний, опосредованных нейрональными потенциалзависимыми натриевыми каналами, у млекопитающего, предпочтительно человека, за счет ингибирования тока ионов через потенциалзависимые натриевые каналы у млекопитающего, предпочтительно нейрональные потенциалзависимые натриевые каналы, в котором способ включает введение нуждающемуся в лечении млекопитающему терапевтически эффективного количества фармацевтической композиции настоящего изобретения, как изложено выше.
Как указано выше, фармацевтические композиции настоящего изобретения являются пригодными для лечения заболеваний или состояний, опосредованных натриевыми каналами, предпочтительно заболеваний или состояний, опосредованных нейрональными потенциалзависимыми натриевыми каналами. В частности, фармацевтические композиции настоящего изобретения являются пригодными для лечения или уменьшения тяжести заболевания или состояния, когда активация или гиперактивация одного или более из нейрональных потенциалзависимых натриевых каналов, выбранных из Nav1.1, Nav1.2, Nav1.3, Nav1.4, Nav1.5, Nav1.6, Nav1.7, Nav1.8 или Nav1.9, вовлечена в заболевание или состояние. Предпочтительно, фармацевтические композиции настоящего изобретения являются пригодными для лечения или уменьшения тяжести заболевания или состояния, когда активация или гиперактивация Nav1.7 вовлечена в заболевание или состояние, такое как боль или постгерпетическая невралгия.
Соответственно, настоящее изобретение относится к способу лечения или уменьшения тяжести заболевания, состояния или расстройства, когда активация или гиперактивация одного или более из нейрональных потенциалзависимых натриевых каналов, выбранных из Nav1.1, Nav1.2, Nav1.3, Nav1.4, Nav1.5, Nav1.6, Nav1.7, Nav1.8 или Nav1.9, вовлечена в заболевание, состояние или расстройство, в котором способы включают введение нуждающемуся в лечении млекопитающему терапевтически эффективного количества фармацевтической композиции настоящего изобретения, как изложено выше.
Дополнительное описание применимости фармацевтических композиций настоящего изобретения изложено ниже.
ПОЛУЧЕНИЕ СПИРО-ОКСИНДОЛЬНОГО СОЕДИНЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Спиро-оксиндольное соединение в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, применяемое в фармацевтических композициях настоящего изобретения, можно получить способами, описанными в PCT опубликованной патентной заявке No. WO 06/110917, или способами, известными специалистам в данной области техники. Соединение A и его соответствующий (R)-энантиомер, и его фармацевтически приемлемые соли можно получить способами, описанными в PCT опубликованной патентной заявке No. WO 2011/002708, соответствующее описание которой полностью вводится в настоящее изобретение, или способами, известными специалистам в данной области техники.
Соединение A или его фармацевтически приемлемая соль и его соответствующий (R)-энантиомер можно получить разделением спиро-оксиндольного соединения, применяя или хиральные способы высокоэффективной жидкостной хроматографии или способы хроматографии с псевдодвижущимся слоем, как описано ниже на следующей реакционной схеме, в которой "хиральная ВЭЖХ" относится к хиральной высокоэффективной жидкостной хроматографии и "SMB" относится к хроматографии с псевдодвижущимся слоем:
РЕАКЦИОННАЯ СХЕМА
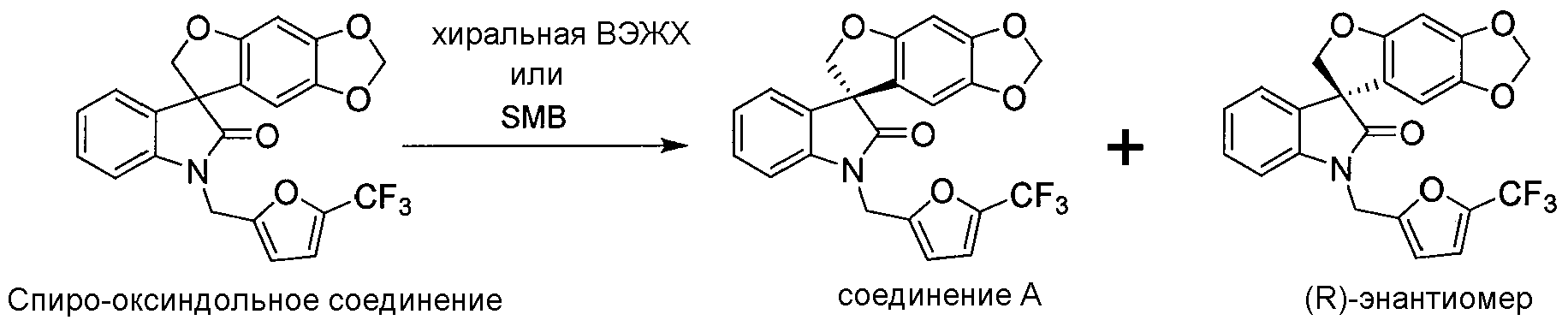
Специалисту в данной области техник известны варианты в указанной выше реакционной схеме, которые являются пригодными для разделения отдельных энантиомеров.
Альтернативно, соединение A и его соответствующий R-энантиомер можно получить из хиральных исходных веществ, которые являются известными или легко получаемыми, применяя способ, аналогичный известным способам.
Предпочтительно, соединение A, полученное способами, описанными в настоящем изобретении, практически не содержит (R)-энантиомера или содержит только следы (R)-энантиомера.
Следующие способы получения служат для иллюстрации способов разделения, описанных на реакционной схеме, и не предполагается, что они ограничивают объем настоящего изобретения.
ПРИМЕР ПОЛУЧЕНИЯ 1
Получение 1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-она (Спиро-оксиндольное соединение)
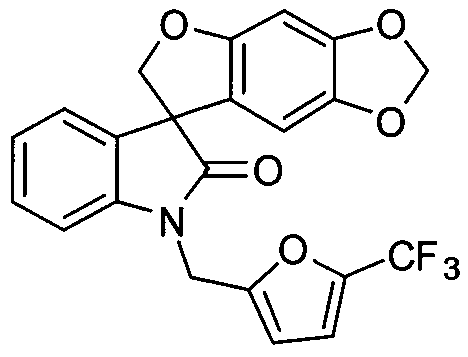
К суспензии спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1 'H)-она (1,0 г, 3,6 ммоль), который можно получить согласно способам, описанным в PCT опубликованной патентной заявке No. WO 06/110917, и карбоната цезия (3,52 г, 11 ммоль) в ацетоне (50 мл) добавляли 2-бромметил-5-трифторметилфуран (1,13 г, 3,9 ммоль) одной порцией, и реакционную смесь перемешивали при 55-60°C в течение 16 часов. После охлаждения до температуры окружающей среды, реакционную смесь фильтровали, и фильтрат упаривали при пониженном давлении. Остаток подвергали колоночной хроматографии, элюируя смесью этилацетат/гексан (1/9 - 1/1) для того, чтобы получить 1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-он, т.е., спиро-оксиндольное соединение, (1,17 г, 76%) в виде белого твердого остатка: Т.пл. 139-141°C;1H-ЯМР (300 МГц, CDCl3) δ 7,32-6,97 (м, 5H), 6,72 (д, J=3,24 Гц, 1H), 6,66 (с, 1H), 6,07 (с, 1H), 5,90-5,88 (м, 2H), 5,04 (ABq, 2H), 4,74 (ABq, 2H);13C ЯМР (75 МГц, CDCl3) δ 176,9, 155,7, 153,5, 148,8, 142,2, 141,9, 140,8, 140,2, 139,7, 139,1, 132,1, 129,2, 124,7, 124,1, 123,7, 121,1, 120,1, 117,6, 114,5, 114,4, 110,3, 109,7, 103,0, 101,9, 93,8, 80,0, 57,8, 36,9; MS(ES+) m/z 430,2 (M+1), 452,2 (M+23); рассчит. для C22H14F3NO5: C, 61,54%; H, 3,29%; N, 3,26%; найдено: C, 61,51%; H, 3,29%; N, 3,26%.
ПРИМЕР ПОЛУЧЕНИЯ 2
Разделение спиро-оксиндольного соединения хиральной ВЭЖХ
Спиро-оксиндольное соединение разделяли на соединение А и соответствующий (R)-энантиомер хиральной ВЭЖХ в следующих условиях:
Колонка: Chiralcel ® OJ-RH; 20 мм внутренний диаметр. × 250 мм, 5 микрон; Lot: OJRH CJ-EH001 (Daicel Chemical Industries, Ltd)
Элюент: ацетонитрил/вода (60/40, об./об., изократический)
Скорость потока: 10 мл/мин
Продолжительность цикла: 60 минут
Загрузка: 100 мг соединения формулы (I) в 1 мл ацетонитрила
Температура: окружающей среды
В указанных выше условиях хиральной ВЭЖХ, (R)-энантиомер, т.е., (R)-1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2.3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-он, выделяли в виде первой фракции в виде твердого белого остатка; ee (энантиомерный избыток) >99% (аналитический OJRH, 55% ацетонитрил в воде); Т.пл. 103-105°C;1H-ЯМР (300 МГц, ДМСО-d6) δ 7,32-6,99 (м, 5H), 6,71 (д, J=3,35 Гц, 1H), 6,67 (с, 1H), 6,05 (с, 1H), 5,89 (ABq, 2H), 5,03 (ABq, 2H), 4,73 (ABq, 2H);13C ЯМР (75 МГц, CDCl3) δ 177,2, 155,9, 152,0, 149,0, 142,4, 142,0, 141,3, 132,0, 129,1, 123,9, 120,6, 119,2, 117,0, 112,6, 109,3, 108,9, 103,0, 101,6, 93,5, 80,3, 58,2, 36,9; MS(ES+) m/z 430,2 (M+1), [α]D-17,46 (с 0,99, ДМСО).
Соединение A, т.е., (S)-1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2.3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-он, выделяли в виде второй фракции в виде твердого белого остатка; ee >99% (аналитическая OJRH, 55% ацетонитрил в воде); Т.пл. 100-102°C;1H ЯМР (300 МГц, ДМСО-d6) 7,32-6,99 (м, 5H), 6,71 (д, J=3,43 Гц, 1H), 6,67 (с, 1H), 6,05 (с, 1H), 5,89 (ABq, 2H), 5,03 (ABq, 2H), 4,73 (ABq, 2H);13C ЯМР (75 МГц, CDCL3) δ 177,2, 155,9, 152,0, 149,0, 142,4, 142,0, 141,3, 132,0, 129,1, 123,9, 120,6, 119,2, 117,0, 112,6, 109,3, 108,9, 103,0, 101,6, 93,5, 80,3, 58,2, 36,9; MS(ES+) m/z 430,2 (M+1), [α]D+14,04 (c 0,99, ДМСО).
ПРИМЕР ПОЛУЧЕНИЯ 3
Разделение спиро-оксиндольного соединения ПДС хроматографией
Спиро-оксиндольное соединение разделяли на соединение A и соответствующий (R)-энантиомер ПДС хроматографией в следующих условиях:
Экстракт: 147,05 мл/мин
Рафинат: 76,13 мл/мин
Элюент: 183,18 мл/мин
Подача: 40 мл/мин
Циркуляция: 407,88 мл/мин
Продолжительность цикла: 0,57 мин
Температура: 25°C
Давление: 46 бар
Подаваемый раствор (25 г соединения формулы (I) в 1,0 л подвижной фазы (25:75:0,1 (об.:об.:об.) смесь ацетонитрил /метанол/трифторуксусная кислота)) непрерывно вводили в SMB систему (Novasep Licosep Lab Unit), которую снабжали восемью идентичными колонками в 2-2-2-2 конфигурации, содержащими 110 г (на колонку, 9,6 см, 4,8 см в.д.) chiralpack AD в качестве неподвижной фазы. Первый элюирующийся энантиомер ((R)-энантиомер) содержался в потоке рафината, и второй элюирующийся энантиомер (соединение A) содержался в потоке экстракта. Характеристические данные соединения A и (R)-энантиомера, полученных после SMB разделения, были идентичными данным, полученным при применении хиральной ВЭЖХ.
ПОЛУЧЕНИЕ ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
При получении фармацевтических композиций настоящего изобретения применяют общепринятые способы фармацевтического формулирования, медицинской химии и подобных, которые являются известными специалистам в данной области техники. Данные способы объясняются полностью в литературе. Получение фармацевтических композиций описывают, например, в Remington: The Science and Practice of Pharmacy, 21st edition (Lippincott Williams & Wilkins, (2005) и Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 8th Ed. (Med, PA: Williams & Wilkins, 2005), введенные в настоящее изобретение с помощью ссылки.
Фармацевтические композиции настоящего изобретения предпочтительно находятся в мазевой форме. Мази представляют собой полутвердые вещества, которые содержат небольшое количество, если вообще содержат, воды, и их обычно получают смешением активного ингредиента с масляной или немасляной основой с помощью подходящего аппарата.
Фармацевтические композиции настоящего изобретения содержат один или более фармацевтически приемлемых вспомогательных веществ.
Ясно, что фармацевтически приемлемые вспомогательные вещества, применяемые в любой из местных фармацевтических композиций настоящего изобретения, являются предпочтительно стерильными и/или предпочтительно одобрены управлением по контролю качества пищевых продуктов и лекарственных средств США, европейским агентством по лекарственным средствам и министерством здравоохранения Канады в качестве приемлемых для применения в местных составах, которые будут вводить людям или животным.
При получении фармацевтических композиций настоящего изобретения, обширные исследования, такие как исследования растворимости и стабильности, проводили для того, чтобы обеспечить фармацевтическими композициями, которые допускают растворение требуемого терапевтически эффективного количества активного ингредиента, т.е. спиро-оксиндольного соединения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, предпочтительно соединения A или его фармацевтически приемлемой соли, в одном или более фармацевтически приемлемых вспомогательных веществ, и которые допускают быстрое растворение активного ингредиента в фармацевтической композиции, и хорошо сохраняются при многократном применении. Кроме того, требуется, чтобы фармацевтические композиции были физически и химически стабильными при комнатной температуре в течение подходящего периода времени, предпочтительно в течение от приблизительно 1 месяца до приблизительно 5 лет, более предпочтительно в течение от приблизительно 1 года до приблизительно 3 лет.
Спиро-оксиндольное соединение настоящего изобретения, в частности соединение A, является относительно липофильным и обладает плохой растворимостью в воде. Растворимость соединения A в воде составляет менее 5 пг/мл. Кроме того, соединение A имеет рассчитанный Log P приблизительно равный 3,07, и не содержит функциональных групп, которые могут ионизироваться при изменении pH и, следовательно, изменение pH раствора до 2, 7,4 и 12 не изменяет растворимость соединения A, которая остается <5 г/мл.
Были предприняты попытки увеличить растворимость соединения A для применения в местной фармацевтической композиции, предпочтительно в виде мази, применяя различные способы повышения растворимости. Цель заключалась в проведении тщательного исследования применения различных фармацевтически приемлемых вспомогательных веществ для получения максимальной растворимости соединения A. Затем, проводили ряд исследований растворимости, которые осуществляли, применяя стандартные способы исследования растворимости, для обнаружения подходящего вспомогательного вещества (веществ) и/или комбинаций вспомогательных веществ для достижения целевой дозы для соединения A. Растворимость соединения A в данных исследованиях определяли УФ спектрофотометрией, применяя длину волны УФ поглощения соединения А при 312 нм.
В добавление к предпринятым исследованиям растворимости, проводился ряд исследований стабильности для определения физической и химической стабильности полученных фармацевтических композиций.
На основании результатов, полученных из исследований растворимости и стабильности, и результатов, полученных в in vivo исследованиях эффективности, получали следующие примерные фармацевтические композиции настоящего изобретения:
В общем, каждое фармацевтически приемлемое вспомогательное вещество может присутствовать в фармацевтической композиции настоящего изобретения при концентрации от приблизительно 0,5% вес./вес. до приблизительно 99,0% вес./вес. Более предпочтительно, каждое фармацевтически приемлемое вспомогательное вещество может присутствовать в фармацевтической композиции настоящего изобретения при концентрации от приблизительно 1% вес./вес. до приблизительно 90% вес./вес. Даже более предпочтительно, каждое фармацевтически приемлемое вспомогательное вещество может присутствовать в фармацевтической композиции настоящего изобретения при концентрации от приблизительно 10% вес./вес. до приблизительно 80,0% вес./вес.
Предпочтительно, в фармацевтической композиции настоящего изобретения, PEG 400 присутствует при концентрации от приблизительно 30% вес./вес. до приблизительно 70% вес./вес., Transcutol® P присутствует при концентрации от приблизительно 2% вес./вес. до приблизительно 25% вес./вес., олеиновый спирт присутствует при концентрации от приблизительно 1% вес./вес. до приблизительно 10% вес./вес., изопропилмиристат присутствует при концентрации от приблизительно 1% вес./вес. до приблизительно 25% вес./вес., стеариловый спирт присутствует при концентрации от приблизительно 0,1% вес./вес. до приблизительно 10% вес./вес., BHT присутствует при концентрации от приблизительно 0,01% вес./вес. до приблизительно 2% вес./вес. и PEG 3350 присутствует при концентрации от приблизительно 10% вес./вес. до приблизительно 50% вес./вес.
Более предпочтительно, в фармацевтической композиции настоящего изобретения PEG 400 присутствует при концентрации от приблизительно 45% вес./вес. до приблизительно 55% вес./вес., Transcutol® P присутствует при концентрации от приблизительно 5% вес./вес. до приблизительно 15% вес./вес., олеиновый спирт присутствует при концентрации от приблизительно 2,5% вес./вес. до приблизительно 7,5% вес./вес., изопропилмиристат присутствует при концентрации от приблизительно 2,5% вес./вес. до приблизительно 7,5% вес./вес., стеариловый спирт присутствует при концентрации от приблизительно 0,1% вес./вес. до приблизительно 7,5% вес./вес., BHT присутствует при концентрации от приблизительно 0,05% вес./вес. до приблизительно 1% вес./вес. и PEG 3350 присутствует при концентрации от приблизительно 15% вес./вес. до приблизительно 30% вес./вес.
Предпочтительно, в фармацевтической композиции настоящего изобретения спиро-оксиндольное соединение, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, или его фармацевтически приемлемой соли, присутствует при концентрации от приблизительно 0,1% вес./вес. до приблизительно 10% вес./вес., и предпочтительно от приблизительно 2% вес./вес. до приблизительно 8% вес./вес.
Стабильность фармацевтической композиции, описанной в настоящем изобретении, можно исследовать общепринятым способом, например, измерением соединения A или его фармацевтически приемлемой соли и его продуктов разложения, растворимости, рыхлости, времени распада, микробного содержания, внешнего вида и/или микроскопии, в течение определенных периодов времени.
Предпочтительно, фармацевтические композиции настоящего изобретения будут стабильны в течение периода времени от приблизительно 1 месяца до приблизительно 5 лет при хранении при температуре от приблизительно 5°C до приблизительно 50°C. Более предпочтительно, фармацевтические композиции настоящего изобретения будут стабильны в течение периода времени от приблизительно 6 месяцев до приблизительно 4 лет при хранении при температуре от приблизительно 15°C до приблизительно 45°C. Даже более предпочтительно, фармацевтические композиции настоящего изобретения будут стабильны в течение периода времени от приблизительно 6 месяцев до приблизительно 3 лет при хранении при температуре от приблизительно 25°C до приблизительно 40°C. В более предпочтительном варианте осуществления, фармацевтические композиции являются стабильными при температуре от приблизительно 25°C до приблизительно 40°C в течение периода времени, такого как год, и предпочтительно 2 года. Более предпочтительно, фармацевтические композиции являются стабильными в течение 3 лет.
Фармацевтические композиции настоящего изобретения, описанные выше в таблице 1, можно получить, как показано в следующем примере получения 1. Однако ясно, что специалист в данной области техники будет способен получить фармацевтические композиции аналогичными способами или способами, известными специалистам в данной области техники. Также ясно, что специалист в данной области техники будет способен получить аналогичным способом, как описано ниже, другие фармацевтические композиции настоящего изобретения, которые конкретно не проиллюстрированы ниже, применяя подходящие компоненты и изменяя параметры получения, при необходимости.
ПРИМЕР ПОЛУЧЕНИЯ 1
Стандартную колбу с механической мешалкой тарировали и записывали вес тары. При непрерывном перемешивании, олеиновый спирт, изопропилмиристат, Transcutol® P, PEG 3350, стеариловый спирт, PEG 400 и бутилированный гидрокситолуол (BHT) добавляли в колбу в количествах, перечисленных в таблице 1, одно вспомогательное вещество за раз до получения гомогенного раствора перед добавлением следующего вспомогательного вещества, при предпочтительно 60°C-70°C. К реакционной смеси добавляли требуемое количество соединения A или его фармацевтически приемлемой соли, в количестве, указанном в таблице 1 при предпочтительно 60°C-70°C. Полученную в результате смесь перемешивали в течение периода времени, предпочтительно в течение периода времени от приблизительно 30 минут до приблизительно 1 часа. После завершения (когда соединение A или его фармацевтически приемлемая соль полностью растворилась), механическую мешалку удаляли, и начинали процесс гомогенизирования. Silverson мешалку (модель No. L4RT) применяли для гомогенизации, когда гомогенизацию осуществляли в течение 10 минут и скорость вращения устанавливали равной 6000 об/мин. В процессе гомогенизации температуру раствора непрерывно контролировали и держали предпочтительно равной от приблизительно 60°C до приблизительно 70°C. После завершения гомогенизации, источник тепла удаляли для охлаждения смеси и быстро переключали на перемешивание механической мешалкой до образования мази, и температура достигала подходящей температуры, предпочтительно 35°C или ниже. Стенки колбы непрерывно скребли в процессе охлаждения и стадии перемешивания для обеспечения гомогенности мази. Затем, полученную в результате мазь переносили в подходящую емкость.
Способ, описанный выше, можно осуществлять, применяя общепринятое оборудование и при общепринятых условиях, известных специалисту в данной области техники. Все неочищенные вещества применяли в виде, в котором они были получены от различных производителей за исключением соединения A, которое получали, как описано в настоящем изобретении.
ВВЕДЕНИЕ ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Фармацевтические композиции настоящего изобретения следует вводить местно млекопитающему, предпочтительно человеку. Фармацевтическую композицию наносят местно на область или по соседству с областью, в которой требуется лечение. Обычно, одно - четыре нанесения в день фармацевтической композиции настоящего изобретения рекомендуется в течение периода лечения, или ее можно повторно наносить каждый раз по необходимости. Облегчение обычно достигают в пределах минут, и оно длится в течение периодов различной продолжительности в диапазоне от минут до часов, даже, в некоторых случаях, дней.
Обычно, количество фармацевтического состава настоящего изобретения, наносимое на пораженный участок кожи, изменяется в диапазоне от приблизительно 0,02 г/см2 площади поверхности кожи до приблизительно 0,5 г/см2, предпочтительно, от 0,1 г/см2 до приблизительно 0,30 г/см2 площади поверхности кожи.
В некоторых вариантах осуществления, фармацевтическая композиция настоящего изобретения при местном применении на кожу нуждающегося в лечении млекопитающего, проявляет только местный эффект. В других вариантах осуществления, фармацевтическая композиция настоящего изобретения при местном применении на кожу нуждающегося в лечении млекопитающего дополнительно обладает систематическим эффектом.
Нанесение фармацевтической композиции настоящего изобретения может проводиться медицинским персоналом или пациентом. В определенных вариантах осуществления, для максимальной эффективности и повышенной абсорбции, площадь, на которую предполагается наносить фармацевтическую композицию настоящего изобретения, сначала очищают, например, применяя вяжущее средство, такое как обычный имеющийся в продаже антисептик или спирт.
Затем данную поверхность сушат, и фармацевтическую композицию настоящего изобретения наносят на требуемую площадь и втирают до того, как вся фармацевтическая композиция абсорбируется, или не остается остатков на коже.
Обычно удачное терапевтически эффективное количество фармацевтической композиции настоящего изобретения будет удовлетворять некоторым или всем из следующих критериев. Как ясно специалисту в данной области техники, терапевтически эффективная доза спиро-оксиндольного соединения настоящего изобретения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, предпочтительно в виде соединения A или его фармацевтически приемлемой соли, будет такой, что она будет эффективной для ее предполагаемой цели (например, предотвращения, уменьшения или облегчения боли). В общем, спиро-оксиндольное соединение настоящего изобретения, в виде энантиомера, рацемата или нерацемической смеси энантиомеров, предпочтительно в виде соединения A или его фармацевтически приемлемой соли, присутствует в фармацевтической композиции настоящего изобретения в количестве от приблизительно 2% до приблизительно 10% суммарного веса композиции, предпочтительно в количестве от приблизительно 4% до приблизительно 8% суммарного веса композиции, более предпочтительно, от приблизительно 4% до приблизительно 6% суммарного веса композиции.
Эффективность (как выражено IC50 величиной) соединения A или его фармацевтически приемлемой соли должна быть меньшей чем 10 мкМ, предпочтительно ниже 1 мкМ и самое предпочтительное ниже 50 нМ. IC50 ("ингибирующая концентрация - 50%") представляет собой величину количества соединения, требующуюся для достижения 50% ингибирования потока ионов через натриевый канал, в течение конкретного периода времени, в анализе настоящего изобретения. Например, соединение A или его фармацевтически приемлемая соль при испытании в гуанидиновом инфлюксном анализе, описанном в PCT опубликованной патентной заявке No. WO 06/110917, показывает IC50, меньшую чем 1 мкМ концентрацию.
Реципиенты введения фармацевтической композиции настоящего изобретения могут представлять собой любые позвоночные животные, такие как млекопитающие. Среди млекопитающих, предпочтительными реципиентами являются млекопитающие отряда приматов (включая людей, приматов и обезьян), парнокопытные (включая лошадей, коз, коров, овец и свиней), грызунов (включая мышей, крыс, кроликов и хомяков) и плотоядных (включая кошек и собак). Среди птиц, предпочтительными реципиентами являются индейки, куры и другие члены этого отряда. Самыми предпочтительными реципиентами являются люди.
КОМБИНАЦИОННАЯ ТЕРАПИЯ
Фармацевтические композиции настоящего изобретения можно удобно комбинировать с одним или более другими терапевтическими агентами или в виде любой их комбинации, для лечения заболевания и состояния, опосредованного натриевыми каналами. Например, фармацевтическую композицию настоящего изобретения можно вводить одновременно, последовательно или раздельно в комбинации с другими терапевтическими агентами, включая, но не ограничиваясь:
- опиатные анальгетики, например, морфин, героин, кокаин, оксиморфин, леворфанол, леваллорфан, оксикодон, кодеин, дигидрокодеин, пропоксифен, налмефен, фентанил, гидрокодон, гидроморфон, мерипидин, метадон, налорфин, налоксон, налтрексон, бупренорфин, бутарфонол, нальбуфин и пентазоцин;
- неопиатные анальгетики, например, ацетоменифен и салицилаты (например, аспирин);
- нестероидные противовоспалительные лекарственные средства (NSAID), например, ибупрофен (Advil®), напроксен, фенопрофен, кетопрофен, диклофенак, дифлузинал, этодолак, фенбуфен, флуфенизал, флурбипрофен, индометацин, кеторолак, меклофенамовая кислота, мефенамовая кислоты, мелоксикам, набуметон, нимесулид, нитрофлурбипрофен, олсалазин, оксапрозин, фенилбутазон, пироксикам, сульфасалазин, сулиндак, толметин и зомепирак;
- противосудорожные препараты, например, карбамазепин, окскарбазепин, ламотриджин, габапентин и прегабалин;
- антидепрессанты, такие как трициклические антидепрессанты, например, амитриптилин, кломипрамин, деспрамин, имипрамин, дулоксетин и нортриптилин;
- COX-2 селективные ингибиторы, например, целекоксиб, рофекоксиб, парекоксиб, вальдекоксиб, деракоксиб, эторикоксиб и лумиракоксиб;
- альфа-адренергетики, например, доксазозин, тамсулозин, клонидин, гуанфацин, дексметатомидин, модафинил и 4-амино-6,7-диметокси-2-(5-метансульфонамидо-1,2,3,4-тетрагидроизохинол-2-ил)-5-(2-пиридил)хиназолин;
- барбитуратные седативные средства, например, амобарбитал, апробарбитал, бутабарбитал, бутабитал, мефобарбитал, метарбитал, метогекситал, пентобарбитал, фенобарбитал, фенобартитал, секобарбитал, талбутал, теамилал и тиопентала;
- антагонист тахикинина (НК), в частности НК-3, НК-2 или NK-1 антагонист, например, (αR,9R)-7-[3,5-бис(трифторметил)бензил)]-8,9,10,11-тетрагидро-9-метил-5-(4-метилфенил)-7Н-[1,4]диазоцино [2,1-g][1,7]нафтиридин-6-13-дион (TAK-637), 5-[[2R,3S)-2-[(1R)-1-[3,5-бис(трифторметилфенил]этокси-3-(4-фторфенил)-4-морфолинил]метил]-1,2-дигидро-3H-1,2,4-триазол-3-он (МК-869), апрепитант, ланепитант, дапитант или 3-[[2-метокси-5-(трифторметокси)фенил]метиламино]-2-фенилпиперидин (2S,3S);
- парацетамол;
- антагонисты метаботропных рецепторов глутамата (mGluR);
- местный анестетик, такой как мексилетин и лидокаин;
- кортикостероид, такой как дексаметазон;
- мускариновые антагонисты, например, толтеродин, пропиверин, хлорид тропсия, дарифенацин, солифенацин, темиверин и ипратропия;
- каннабиноиды;
- агонисты ваниллоидных рецепторов (например, резинфератоксин) или антагонисты ваниллоидных рецепторов (например, капсазепин);
- агенты для местного применения (например, лидокаин, капсацин и резинферотоксин);
- миорелаксанты, такие как бензодиазепины, баклофен, карисопродолом, хлорзоксазон, циклобензаприн, метокарбамол и орфренадин;
- противогистаминовые средства или H1 антагонисты;
- антагонисты NMDA рецептора;
- PDEV ингибиторы;
- Tramadol®;
- холиноэргические (никотиновые) анальгетики;
- альфа-2-дельта лиганды;
- антагонисты простагландинов E2 подтипа;
- антагонисты лейкотриена B4; и
- ингибиторы 5-липоксигеназы.
Заболевания и состояния, опосредованные натриевыми каналами, которые можно лечить и/или предотвращать, применяя данные комбинации, включают, но не ограничиваются, боль, постгерпетическую невралгию (PHN), постоперационную боль, прурит, боль, связанную с ВИЧ, невропатию, вызванную лечением ВИЧ, невралгию тройничного нерва, семейную эритромелалгию, первичную эритромелалгию, семейные ректальные боли, эудинию, теплочувствительность, боль, связанную с множественным склерозом (MS), боковой амиотрофический склероз (ALS), болезненную диабетическую невропатию, периферическую невропатию, артрит, ревматоидный артрит, остеоартрит, тендинит, бурсит, опорно-двигательные вывихи, тенозиновит, хондромаляцию надколенника, миозит, миотонию (включая, но не ограничиваясь, миотонию, связанную с SCN4A), парамиотонию, рабдомиолиз, пароксизмальную дистонию, миастенические синдромы, злокачественную гипертермию, муковисцидоз, заболевания, связанные с токсинами натриевых каналов, боль при раке, синдром беспокойных ног, фибромиалгию и нейродегенеративные заболевания, а также другие неврологические расстройства, включая множественный склероз.
Как применяют в настоящем изобретении, "комбинация" относится к любой смеси или сочетанию фармацевтической композиции настоящего изобретения с один или более дополнительными терапевтическими агентами. Если из контекста не ясно другое, "комбинация" может включать одновременную или последовательную доставку фармацевтической композиции настоящего изобретения с одним или более терапевтическими агентами. Если из контекста не ясно другое, "комбинация" может включать лекарственные формы фармацевтической композиции настоящего изобретения с другим терапевтическим агентом. Если из контекста не ясно другое, "комбинация" может включать различные пути введения фармацевтической композиции настоящего изобретения с другим терапевтическим агентом. Например, фармацевтическая композиция настоящего изобретения вводится местно в комбинации с другим терапевтическим агентом, который вводится перорально. Если из контекста не ясно другое, "комбинация" может включать составы фармацевтической композиции настоящего изобретения с другим терапевтическим агентом. Лекарственные формы, пути введения и фармацевтические композиции включают, но не ограничиваются, лекарственные формы, пути введения и фармацевтические композиции, описанные в настоящем изобретении.
ГОТОВОЕ ИЗДЕЛИЕ
Настоящее изобретение также относится к наборам, которые содержат фармацевтическую композицию настоящего изобретения. Набор также содержит инструкции по применению фармацевтической композиции для регулирования активности натриевых каналов, для лечения боли, а также других применений, как описано в настоящем изобретении. Предпочтительно, серийная упаковка будет содержать одну или более единичных доз фармацевтической композиции. Специалисту в данной области техники ясно, что данные композиции, которые является чувствительными к свету и/или воздуху, могут требовать специальной упаковки и/или формулирования. Например, можно применять упаковку, которая является светонепроницаемой и/или которая герметично упакована, что препятствует контакту с воздухом окружающей среды, и/или формулирована с подходящими покрытиями или вспомогательными веществами.
Настоящее изобретение будет более понятно посредством следующих не ограничивающих биологических примеров, которые описывают анализы, которые можно провести для демонстрации применимости настоящего изобретения.
БИОЛОГИЧЕСКИЙ ПРИМЕР 1
Пропорциональность дозы при хронической воспалительной боли, вызванной CFA
В данном испытании, механическую гиперальгезию оценивали электронной нитью фон Фрея посредством Electrovonfrey анестезиометра (Model 2290, IITC Life Science, Woodland Hills, CA). После целой недели акклиматизации в виварии вводили 150 мкл эмульсии "полного адъюванта Фрейнда" (CFA) (CFA, суспендированный в эмульсии масло/соляной раствор (1:1) при конечной концентрации 0,5 мг/мл) подкожно в подошвенную поверхность голеностопного сустава задней левой ноги крыс при легкой анестезии изофлураном. Животным позволяли восстановиться после анестезии и оценивали базовый механический болевой порог для всех животных через неделю после введения CFA. Всех животных приучали к экспериментальным камерам в течение 20 минут в день эксперимента. Затем, животных распределяли случайным образом на 5 различных групп испытания, включая группу с введением среды в качестве контроля, и группы с введением 4 фармацевтических композиций соединения A при 1%, 2%, 4% и 8% (вес./вес.). После измерения базовых величин, животных анестезировали изофлураном, брили в месте нанесения, и затем вводили дозу нанесением 50 мг испытуемых композиций на вес ипсилатеральный голеностопный сустав и заднюю ногу. Затем, животных помещали в трубку из плексигласа на 30 минут для предотвращения преждевременного удаления/поглощения лекарственного средства. Испытуемые композиции наносили дважды в день в течение 3 дней. На четвертый день, непосредственно после нанесения, животных помещали в трубки на 15 минут, и затем удаляли и помещали в камеры из плексигласа на 15 минут перед проведением измерения порогов отдергивания лапы. Пороги отдергивания при воздействии нити фон Фрея измеряли как среднее нескольких независимых измерений, выполненных в пределах 1-2 минут друг от друга на соответствующей лапе каждого животного через 30 минут после введения дозы. Применяемый момент времени определяли заранее для того, чтобы показать самый большой анальгетический эффект для каждой испытуемой композиции.
Пороги реакции животных на тактильные стимулы измеряли, применяя Electrovonfrey анастезиометр модели 2290 (IITC Life Science, Woodland Hills, CA). Животных помещали в приподнятую камеру из плексигласа, установленную на сетчатую поверхность. После 15 минут приспособления нить фон Фрея применяли перпендикулярно к подошвенной поверхности ипсилатеральных задних лап животных с достаточной силой, измеренной в граммах, для того, чтобы вызвать быструю ответную реакцию лапы. Ответная реакция показывала отдергивание лапы после болевого стимула и устанавливала эффективное предельное значение.
РЕЗУЛЬТАТЫ
На исходном уровне не было значительных различий между средними значениями величин отдергивания лапы при воздействии нити фон Фрея для 5 испытуемых групп. На четвертый день дозирования через 30 минут после дозирования все группы, обработанные фармацевтическими композициями соединения A при 2%, 4%, и 8% (вес./вес.), показали статистически значимое увеличение механического порога отдергивания лапы при воздействии нити фон Фрея, как выражено процентным изменением относительно исходного значения (CFB), показывая анальгетический эффект (смотри фигуру 1). Анальгетический эффект для композиций соединения A увеличивался с увеличением доз вплоть до самой большой испытуемой дозы 8% (вес./вес.), которая показывала максимальный процент CFB при +45,1%. 1% (вес./вес.) группа дозирования, однако, не показывала наблюдаемого увеличения порога отдергивания лапы при механическом воздействии нитью фон Фрея. Результаты, как показано на фигуре 1, показывают, что композиции соединения A обладают анальгетическими эффектами в модели воспалительной боли, вызванной CFA, в диапазоне 2%-8% (вес./об.).
БИОЛОГИЧЕСКИЙ ПРИМЕР 2
Зависимость от времени эффективности в модели невропатической боли; хроническая компрессия
Невропатическая боль характеризуется спонтанной болью и аллодинией, вызванной стимулом, и гиперальгезией. Фармацевтические композиции настоящего изобретения оценивали в модели хронической компрессии, применяя крыс линии Спрага-Доули, как описано ниже.
Приблизительно 3 см разрез делали вдоль кожи и фасции на среднем уровне бедра задней левой лапы крыс, применяя лезвие скальпеля № 10. Левые седалищный нерв экспонировали наружу посредством отслаивания бицепса бедра с осторожностью, чтобы снизить до минимума геморрагию. Четыре нитки неплотно связывали вдоль седалищного нерва, применяя четыре нити для сшивания раны из хромированного кетгута через интервалы на расстоянии 1 мм - 2 мм. Напряжение неплотных нитей было достаточным для того, чтобы вызвать незначительное стягивания седалищного нерва при рассматривании через препаровальную лупу с 4-кратным увеличением. В качестве симулирующего контроля, правый седалищный нерв экспонировали наружу и обрабатывали аналогичным способом, как описано выше, за исключением того, что нити для сшивания раны не связывали на нерве. Антибактериальную мазь применяли непосредственно на рану, и мышцу закрывали, применяя стерилизованные нити для сшивания раны. Betadine® применяли на мышце и ее окружение, с последующим закрытием кожи хирургическими зажимами.
Позволяли развиться болевой невропатии в течение, по меньшей мере, 14 дней в ипсилатеральной лапе, как определено нижними порогами отдергивания лапы при механическом стимуле. Только животных со значительной гиперальгезией, как определено пониженным порогом отдергивания лапы при воздействии нитью фон Фрея, измеренном в граммах, применяли в исследовании. Все животные, применяемые в данном исследовании, обладали порогом отдергивания лапы <12 г.
Пороги ответной реакции животных на тактильные стимулы измеряли, применяя Electrovonfrey анестезиометр модели 2290 (IITC Life Science, Woodland Hills, CA). Животных помещали в приподнятую камеру из плексигласа, установленную на сетчатую поверхность. После 15 минут приспособления, нить фон Фрея применяли перпендикулярно к подошвенной поверхности ипсилатеральных задних лап животных с достаточной силой, измеренной в граммах, для того, чтобы вызвать быструю ответную реакцию лапы. Силу (в граммах), требующуюся для того, чтобы вызвать быструю реакцию отдергивания, записывали перед введением дозы в качестве исходного значения и через некоторое количество моментов времени после введения дозы.
Через три дня после измерения исходного значения, животных анестезировали изофлураном и брили обе ипсилатеральные задние лапы, включая область верхней части бедра с седалищной вырезкой, лодыжку и лапу. Затем, животных случайным образом распределяли на 4 различные испытуемые группы, включая контрольную группу с введением среды и группы с введением 5% (вес./об.) лидокаина (Xylocaine®) и 2 групп с введением фармацевтических композиций настоящего изобретения, содержащей соединение A при 4% (вес./вес.) и или 5% или 10% Transcutol® P. После измерения исходного значения, 100 мг испытуемой композиции наносили на всю выбритую область. Затем, животных помещали в пластиковые трубки на, по меньшей мере, 15 минут, для предотвращения преждевременного удаления/поглощения лекарственного средства. Затем, животных помещали в камеры из плексигласа за 15 минут перед измерением с применением нити фон Фрея в соответствующие моменты времени. Пороги отдергивания лапы при воздействии нити фон Фрея измеряли как среднее нескольких независимых измерений, выполненных в пределах 1-2 минут друг от друга, для соответствующей лапы каждого животного через 0,5, 1 и 2 часа после введения дозы.
РЕЗУЛЬТАТЫ
Среднее процентное изменение относительно исходного значения (CFB) для порогов отдергивания лапы каждой группы показано на фигуре 2. Наблюдения +23,1%, +26,3%, и +33,8% CFB выполняли для 5% (вес./об.) лидокаиновой группы и испытуемых групп с введением 4% (вес./вес.) соединения A в 5% и 10% Transcutol® P через 0,5 часа после введения дозы, соответственно. Через 1 час после введения дозы, +18,1% и +26,7% CFB наблюдали для групп, обработанных 4% (вес./вес.) соединения A в 5% и 10% Transcutol® P, соответственно. Заметного изменения (p>,05) не наблюдали для группы с обработкой 5% (вес./об.) лидокаином в любой момент времени, следующий за моментом через 0,5 час после введения дозы. Группа с введением 4% (вес./вес.) соединения A в 10% транскутола показала анальгетические эффекты от 0,5 часа вплоть до 2 часов после введения дозы, с повышенной эффективностью и более длительной анальгезией при сравнении с группой с введением 4% (вес./вес.) соединения A в 5% транскутола. Обе группы с введением 4% (вес./вес.) соединения A показали более длительный анальгетический эффект при сравнении с 5% лидокаиновой группой, которая показывала анальгетические эффекты только вплоть до 0,5 час после введения дозы в модели невропатической боли, вызванной CCI.
БИОЛОГИЧЕСКИЙ ПРИМЕР 3
STZ модель диабетической невропатии
Данное исследование оценивает эффективность фармацевтических композиций настоящего изобретения в модели невропатической боли, вызванной STZ, у мужских особей крыс Спрега-Доули, после сильной дозы, при сравнении с местным введением 5% (вес./об.) лидокаина (Xylocaine®) и местным введением 1,16% (вес./об.) диклофенака (Voltaren®). Модель на грызунах болевой периферической диабетической невропатии (PDN), которая имитирует состояние человека, создавали, вызывая диабетическое состояние у крыс с помощью разрушения бета-клеток поджелудочной железы, синтезирующих инсулин. Единичное введение стрептозотоцина (STZ) разрушает бета-клетки у грызунов и вызывает диабетическое состояние, которое с течение времени развивается в болевую периферическую диабетическую невропатию (PDN).
Стрептозотоцин (STZ) растворяли в цитратном буфере (20 мМ, pH 4,5) и вводили при дозе 60 мг/кг, внутрибрюшинно, для того чтобы вызывать смерть бета-клеток поджелудочной железы. Концентрацию глюкозы в крови измеряли один раз в неделю после инъекции, применяя AccuSoft систему контроля уровня сахара в крови. Бустер-инъекцию вводили через две недели после первоначальной инъекции животным, которые не обладали повышенными концентрациями сахара в крови после первой инъекции. Животных с концентрациями глюкозы в плазме выше 16 ммоль/л считали диабетическими и включали в исследование. Гиперальгезию и аллодинию, которые являются симптомами диабетической невропатической боли, отслеживали, применяя испытание фон Фрея, как описано ниже. Показания испытания фон Фрея записывали и для левой и для правой лапы. Только животных со значительной гиперальгезией, как определено пониженным порогом, измеренным в граммах, отдергивания лапы при воздействии нити фон Фрея, включали в исследование. Исследование выполняли в течение восьмой недели после STZ инъекции. В течение данного времени внимательно следили за состоянием здоровья крыс.
Животных случайным образом разделяли на 4 испытуемые группы (n=7 животных/группа), включающие контрольную группу с введением среды и группы с введением 5% (вес./об.) лидокаина (Xylocaine®), 1,16% (вес./об.) диклофенака (Voltaren®) и фармацевтической композиции с 4% (вес./вес.) соединения A. После измерения исходных величин, 50 мг испытуемой композиции наносили на всю левую лапу. Животных помещали в трубки из плексигласа на 15 минут для предотвращения преждевременного удаления/поглощения лекарственного средства, и затем переносили в камеры из плексигласа для измерения с помощью нити фон Фрея. Пороги отдергивания лапы животных при механическом тактильном стимуле измеряли, применяя Electrovonfrey анестезиометр (Model 2290, IITC Life Science, Woodland Hills, CA). Животных помещали в приподнятые акриловые камеры, установленные на поверхность из проволочной сетки. После 15 минут привыкания, гибкие волоски фон Фрея (насадка #15) применяли перпендикулярно к подошвенной поверхности ипсилатеральных задних лап животных, с достаточной силой для того, чтобы вызвать быструю реакцию лапы. Ответная реакция отдергивание после болевого стимула и составляла эффективное предельное значение. Силу (g), требуемую для того, чтобы вызвать быструю реакцию отдергивания регистрировали перед введением дозы в качестве исходной величины и через 30 минут после введения дозы.
Величины отдергивания регистрировали и для обработанной (левая) и для необработанной (правая) лап. Данные отдергивания лапы при воздействии волосков фон Фрея анализировали, применяя GraphPad Prism 5 программное обеспечение для статистического анализа. Однофакторный ANOVA применяли для многомерного анализа с корректировкой Бонферрони. Двухвыборочный t-критерий для независимых выборок применяли для одномерного анализа. Результаты выражали в виде среднее ± SEM. Величины, которые достигали p<0,05 степени значимости, считали статистически значимыми.
РЕЗУЛЬТАТЫ
На исходном уровне не было значительных различий между четырьмя испытуемыми группами при измерениях отдергивания лапы с помощью волосков фон Фрея для обработанных лап, не было и различий между величинами для левой и правой задних лап.
Через 30 минут после дозирования, среднее процентное изменение относительно исходного значения (CFB) для порога отдергивания лапы каждой группы (обработанных лап) приводили на фигуре 3. Изменение относительно исходного значения достигало 44,9% для группы с введением 4% (вес./вес.) соединения A (p<0,05), значительно выше 25,9% изменения относительно исходного значения, наблюдаемого для группы с введением 5% (вес./об.) лидокаина. Значительного CFB не наблюдали в группе с введением 1,16% (вес./об.) диклофенака.
Следовательно, местный анальгетический эффект наблюдали для композиции, содержащей 4% (вес./вес.) соединения A в модели невропатической боли, вызванной STZ, через 30 минут после введения дозы, проявляющийся как 44,9% изменение относительно исходного значения, больше чем местная эффективность, наблюдаемая для контрольных соединений.
БИОЛОГИЧЕСКИЙ ПРИМЕР 4
Соотношение между эффективностью и системным воздействием для местного и перорального введения; хроническая компрессия
Модель хронической компрессии (CCI), разработанную модель невропатической боли на крысах, применяли в данном исследовании для сравнения степеней эффективности и системного воздействия соединения A между местным и пероральным введением мужским особям крыс.
Периферическую невропатию вызывали у крыс помещением неплотносжимающих нитей вокруг общего седалищного нерва, как описано Bennett G J, and Xie Y-K., Pain, (1988) 33: pp. 87-107. Восьминедельные мужские особи крыс линии Спрега-Доули анестезировали 3,5% изофлураном, и 3 см разрез делали вдоль кожи и фасции на среднем уровне бедра задней левой лапы крыс, применяя лезвие скальпеля №10. Левые седалищный нерв экспонировали наружу посредством отслаивания бицепса бедра с осторожностью, чтобы снизить до минимума геморрагию. Четыре нитки неплотно связывали вдоль седалищного нерва, применяя четыре нити для сшивания раны из хромированного кетгута через интервалы на расстоянии 1 мм - 2 мм. Напряжение неплотных нитей было достаточным, чтобы вызвать незначительное стягивания седалищного нерва при рассматривании через препаровальную лупу с 4-кратным увеличением. Антибактериальную мазь применяли непосредственно на рану, и мышцу закрывали, применяя стерилизованные нити для сшивания раны. Betadine® применяли на мышце и ее окружение, с последующим закрытием кожи хирургическими зажимами.
Болевой невропатии позволяли развиться в ипсилатеральной лапе, как определено меньшими порогами отдергивания лапы при механическом стимуле. Только животных с заметной гиперальгезией, как определено пониженным порогом, измеренным в граммах, отдергивания лапы при воздействии нити фон Фрея, применяли в исследовании. Все животные, которых включали в данное исследование, обладали порогами отдергивания лапы <12 г.
Пороги отдергивания лапы животных после механического тактильного стимула измеряли, применяя Electrovonfrey анестезиометр модели 2290 (IITC Life Science, Woodland Hills, CA). Животных помещали в приподнятые камеры из плексигласа, установленные на поверхность из металлической сетки. После 15 минут приспособления в данной камере волосок фон Фрея применяли перпендикулярно подошвенной поверхности ипсилатеральных задних лап животных, с достаточной силой, измеренной в граммах, для того чтобы вызвать быструю ответную реакцию лапы. Ответная реакция показывала отдергивание в результате болевого стимула и составляла эффективное предельное значение.
После измерения исходного порога отдергивания лапы, животных разделяли случайным образом на 4 различные испытуемые группы (N=8 животные/группа), включающие контрольную группу с введением среды для перорального дозирования, контрольную группу с введением среды для местного дозирования и две группы с обработкой соединением A. Для групп с введением пероральной дозы, животным вводили дозу пероральным принудительным введением после измерения исходной величины. Дозы соединения A выбирали на основе предыдущих исследований, показывающих, что пероральная доза 25 мг/кг соединения A оказывает приблизительно полумаксимальный обратимый эффект подавления боли и степень эффективности, сравнимую со степенью эффективности фармацевтической композиции настоящего изобретения, содержащей соединение A при 8% (вес./вес.). Для групп с введением местной дозы, 50 мг испытуемой композиции наносили на ипсилатеральные лодыжку и ногу. Затем, животных помещали в пластиковые трубки на 15 минут для того, чтобы предотвратить преждевременное удаление/поглощение лекарственного средства. Затем, животных помещали в камеры из плексигласа на 15 минут перед измерением порога отдергивания лапы. Пороги отдергивания лапы при воздействии нити фон Фрея измеряли как среднее нескольких независимых определений, выполненных в пределах 1-2 минут друг от друга на соответствующей лапе каждого животного. Измерение порога отдергивания проводили через 60 минут после введения дозы для группы с пероральным введением и 30 минут после введения дозы для группы с местным введением, представляющие их соответствующие моменты пиковой эффективности, как определено в предыдущем исследовании.
Образцы крови отбирали у тех же животных, непосредственно после измерения порога отдергивания, применяя следующий способ через приблизительно 10-15 минут после моментов их соответствующей эффективности. У крыс отбирали кровь проколом яремной вены при анестезии. Записывали момент времени, в который отбирали каждый образец крови, относительно момента введения дозы. Каждый образец крови (~150 мкл) собирали в покрытую гепарином, маркированную microvette пробирку, содержащую 10 мкл гепарина (100 единиц) и тут же помещали на лед. Образцы крови центрифугировали при 4°C для отделения плазмы. Плазму переносили в маркированные пробирки и быстро замораживали в жидком азоте для хранения при -80°C. В момент анализа, плазму размораживали и экстрагировали, применяя твердофазную экстракцию, и концентрацию лекарственного средства в плазме количественно определяли ВЭЖХ/MS/MS.
Данные о порогах отдергивания лапы при воздействии нити фон Фрея анализировали, применяя GraphPad Prism 5 программное обеспечение для статистического анализа. Однофакторный ANOVA применяли для многомерного анализа с корректировкой Бонферрони. Двухвыборочный t-критерий для независимых выборок применяли для одномерного анализа. Результаты выражали в виде среднего ± SEM. Величины, которые достигали p<0,05 степени значимости, считали статистически значимыми.
РЕЗУЛЬТАТЫ
На исходном уровне отсутствовали значительные различия между средними значениями измерений порогов отдергивания лапы при воздействии нити фон Фрея для всех четырех испытуемых групп.
Среднее процентное изменение относительно исходного значения (CFB) для порогов отдергивания лапы каждой группы показано на фигуре 4. Через 60 и 30 минут после введения дозы, CFB достигал 44,3% для группы с пероральным введением 25 мг/кг дозы соединения A и 47,1% для группы с местным введением 8% (вес./вес.) дозы соединения A, соответственно, который был статистически значимым (p<0,001) при сравнении с группами с введением среды, и показывал анальгетический эффект. Статистическую значимость не наблюдали между CFB групп с пероральным и местным введением дозы (p=0,742).
Образцы плазмы собирали у животных непосредственно после испытания с применением нити фон Фрея. Системная концентрация в плазме соединения A для групп с пероральным и местным введением показана на фигуре 5. Концентрация в плазме соединения A в группе с местным введением была значительно меньшей (~20x), чем концентрация в группе с пероральным введением (p<0,0001).
8% (вес./вес.) соединение A местным введением показывало степень эффективности (47% CFB), которая является сравнимой с 25 мг/кг соединения A (44% CFB) пероральным введением в модели CCI невропатической боли. Системное содержание в плазме крови соединения A было значительно меньшим (~20x) в группе с местным введением, чем в группе с пероральным введением. Следовательно, соединение A, вводимое местно, в модели CCI невропатической боли обеспечивает эффективностью, сравнимой с соединением A, вводимым перорально, с минимальным содержанием в плазме крови.
Если не указано иное, любой патент США, опубликованная патентная заявка США или PCT опубликованная патентная заявка, на которую ссылаются в настоящем описании, вводится в настоящее изобретение полностью с помощью ссылки, включая предварительную патентную заявку США No. 61/308759.
Хотя вышеуказанное изобретение описано довольно подробно для того, чтобы облегчить понимание, ясно, что определенные изменения и модификации можно осуществить на практике в пределах объема прилагаемой формулы изобретения. Соответственно, описанные варианты осуществления следует рассматривать как иллюстративные и не ограничивающие, и настоящее изобретение не ограничивается деталями, приведенными в настоящем описании, но может быть изменено в пределах объема и эквивалентов прилагаемой формулы изобретения.
Реферат
Группа изобретений относится к фармацевтике. Описана фармацевтическая композиция для местного введения, содержащая терапевтически эффективное количество спиро-оксиндольного соединения, имеющего следующую формулу:В композиции спиро-оксиндольное соединение присутствует в концентрации от 1% вес./вес. до 8% вес./вес. Композиция содержит растворитель (PEG 400 или PEG 3350), агент, улучшающий проникновение (Transcutol® Р, или олеиновый спирт, или изопропилмиристат), загуститель (стеариловый спирт), мазевую основу (PEG 400 или PEG 3350) и антиоксидант (бутилированный гидрокситолуол). Описан способ лечения, предотвращения или улучшения заболевания или состояния, опосредованного натриевыми каналами, включающий введение указанной выше композиции. Также описан способ лечения боли за счет ингибирования ионного тока через потенциалзависимые натриевые каналы. Группа изобретений обеспечивает расширение ассортимента композиций для местного введения. 3 н. и 9 з.п. ф-лы, 5 ил., 4 пр., 1 табл.
Формула
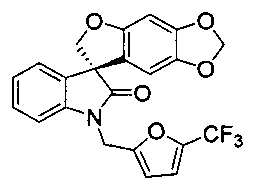
где спиро-оксиндольное соединение присутствует при концентрации от приблизительно 1% вес./вес. до приблизительно 8% вес./вес.; и растворитель, агент, улучшающий проникновение, загуститель, мазевая основа и антиоксидант, где растворитель выбирают из PEG 400 или PEG 3350, агент, улучшающий проникновение, выбирают из Transcutol® Р, олеинового спирта или изопропилмиристата, загуститель представляет собой стеариловый спирт, мазевую основу выбирают из PEG 400 или PEG 3350, и антиоксидант представляет собой бутилированный гидрокситолуол (ВНТ).

Комментарии