Новые фармацевтические композиции - RU2501566C2
Код документа: RU2501566C2
Чертежи




















Описание
Область техники
Настоящее изобретение относится к фармацевтическим композициям, повышающим терапевтический эффект от биологически активных пептидов, особенно пептидов, полученных из лактоферрина человека. Композиции полезны для лечения и/или предотвращения ран, шрамов и спаек после хирургических вмешательств.
Уровень техники
Перитонеальные спайки представляют собой волокнистые соединения ткани между брюшными структурами после хирургической травмы или других видов травм. Общая брюшная, сосудистая, гинекологическая, урологическая и ортопедическая хирургическая операция может привести к формированию спаек у 95% пациентов (Ellis et al. 1999. Adhesion-related hospital readmissions after abdominal and pelvic surgery: a retrospective cohort study. Lancet 353, 1476-1480). Послеоперационные спайки считаются основной причиной небольшой кишечной непроходимости (Menzies et al. 2001. Small bowel obstruction due to postoperative adhesions: treatment patterns and associated costs in 110 hospital admissions. Ann. R. Coll. Surg. Engl. 83, 40-46), хорошо известной этиологии вторичного бесплодия у женщин (Marana et al. 1995. Correlation between the American Fertility Society classifications of adnexal adhesions and distal tubal occlusion, salpingoscopy, and reproductive outcome in tubal surgery. Fertil Steril64, 924-929), так же, как возможной причиной послеоперационной боли (Paajanen et al. 2005. Laparoscopy in chronic abdominal pain: a prospective nonrandomized long-term follow-up study. J. Clin. Gastroenterol. 39, 110-114). Более 30% лиц, подвергающихся хирургии на нижней части живота, повторно госпитализируются непосредственно из-за заболевания или, возможно, в связи с образованием спаек в какой-то период их жизни. (Lower et al. 2000. The impact of adhesions on hospital readmissions over ten years after 8849 open gynaecological operations: an assessment from the Surgical and Clinical Adhesions Research Study. Bjog 107, 855-862).
В течение многих десятилетий, проводились попытки уменьшить послеоперационные спайки, уменьшая хирургическую травму (избегание высыхания, бережное обращение с тканью, тщательный гемостаз) и загрязнение брюшной полости инородными материалами (использованием перчаток без крахмала, марли без ворса и рассасывающихся нитей) (Ηolmdahl et al. 1997. Adhesions: pathogenesis and prevention-panel discussion and summary. Eur. J. Surg. Suppl., 56-62). Важно отметить, что лапароскопические методы недостаточны для того, чтобы преодолеть проблему послеоперационных спаек (Duron et al. 2000. Prevalence and mechanisms of small intestinal obstruction following laparoscopic abdominal surgery: a retrospective multicenter study. French Association for Surgical Research. Arch Surg 135, 208-212). Таким образом, внутриперитонеальные спайки остаются серьезной клинической проблемой, и теперь полагают, что на будущие улучшения можно только незначительно влиять через превосходную хирургическую технику. Вместо этого, акцент делается на разработку специализированных продуктов для предотвращения образования спаек, которые образуются в связи с хирургическим вмешательством.
Большинство терапевтических стратегий, испытанных в предотвращении спайки представляют собой устройства медицинской продукции. Были оценены различные типы физических барьеров, где используются биоразлагаемые мембраны, примененные в течение вмешательства, для того чтобы держать повреждения брюшной поверхности раздельно во время критического периода перитонеального заживления. Два наиболее широко используемых уменьшающих спайки барьера представляют собой Interceed (Johnson & Johnson Medical Inc., Arlington, TX) и Seprafilm™ (Genzyme, Cambridge, MA, USA). Seprafilm™, состоящие из натриевой соли гиалуроновой кислоты и карбоксиметилцеллюлозы (КМЦ), формирующие вязкий гель примерно через 24-48 ч после введения, который медленно рассасывается в течение 1 недели (Diamond, 1996. Reduction of adhesions after uterine myomectomy by Seprafilm membrane (HAL-F): a blinded, prospective, randomized, multicenter clinical study. Seprafilm Adhesion Study Group. Fertil Steril 66, 904-910; Beck, 1997. The role of Seprafilm bioresorbable membrane in adhesion prevention. Eur. J. Surg. Suppl., 49-55). Было показано, что Seprafilm™ снижает послеоперационные спайки в клинических условиях (Vrijland et al. 2002. Fewer intraperitoneal adhesions with use of hyaluronic acid-carboxymethylcellulose membrane: a randomized clinical trial. Ann. Surg. 235, 193-199.; Beck et al. 2003. A prospective, randomized, multicenter, controlled study of the safety of Seprafilm adhesion barrier in abdominopelvic surgery of the intestine. Dis Colon Rectum 46, 1310-1319; Tang et al. 2003. Bioresorbable adhesion barrier facilitates early closure of the defunctioning ileostomy after rectal excision: a prospective, randomized trial. Dis Colon Rectum 46, 1200-1207), однако, устройство трудно применять, так как оно прилипает к перчаткам и органам и является хрупким (DeCherney & diZerega, 1997. Clinical problem of intraperitoneal postsurgical adhesion formation following general surgery and the use of adhesion prevention barriers. Surg. Clin. North. Am. 77, 671-688). Кроме того, Seprafilm™ увеличивает риск осложнений, связанных с анастамозной утечкой и не совместим с лапароскопическими операциями (diZerega et al. 2002. A randomized, controlled pilot study of the safety and efficacy of 4% icodextrin solution in the reduction of adhesions following laparoscopic gynaecological surgery. Hum Reprod 17, 1031-1038). Мембрана Interceed, состоящая из окисленной регенерированной целлюлозы, превращается в студенистую массу, покрывающую ранения брюшной полости, показала эффективность в профилактике спаек в нескольких клинических исследованиях (Mais et al. 1995. Prevention of de-novo adhesion formation after laparoscopic myomectomy: a randomized trial to evaluate the effectiveness of an oxidized regenerated cellulose absorbable barrier Hum Reprod. 10, 3133-3135; Mais et al. 1995 Reduction of adhesion reformation after laparoscopic endometriosis surgery: a randomized trial with an oxidized regenerated cellulose absorbable barrier Obstet Gynecol. 86, 512-515; Wallwiener et al. 1998. Adhesion formation of the parietal and visceral peritoneum: an explanation for the controversy on the use of autologous and alloplastic barriers? Fertil Steril69, 132-137). Однако применение Interceed требует полного гемостаза, поскольку даже небольшие количества внутрибрюшного кровотечения исключает любое благоприятное действие этого барьера (DeCherney & diZerega, 1997, выше). Общее ограничение использования физических барьеров состоит в сайт-специфичности продукта, требующей от хирурга предвидения, где будут происходить спайки и где они будут наиболее вероятной причиной клинических проблем. В качестве альтернативы барьерам, различные жидкости для внутрибрюшной инстилляции, такие как икодекстрин (Adept, Baxter Healthcare Corporation, IL, USA) или раствор лактата Рингера, были введены после операции в объемах, достаточных для плавания брюшных структур, и таким образом предотвращая раневые поверхности от соприкосновения друг с другом (Yaacobi et al. 1991. Effect of Ringer's lactate irrigation on the formation of postoperative abdominal adhesions. J Invest Surg 4, 31-36; Cavallari et al. 2000. Inability of University of Wisconsin solution to reduce postoperative peritoneal adhesions in rats. Eur. J. Surg. 166, 650-653.; diZerega et al., выше). Тем не менее, гравитация вызывает проблемы, предотвращая равномерное распределение жидкости в брюшной полости. Кроме того, растворы всасываются из брюшной полости за время быстрее, чем время, необходимое для перитонеального заживления.
Ограниченное количество фармакологически активных соединений было протестировано для предотвращения послеоперационных спаек. В качестве некоторых примеров, воспалительный компонент и пролиферация фибробластов каскада заживления ран были целью для фармакотерапии с помощью стероидных лекарственных средств и цитотоксических лекарственных средств, соответственно. Тем не менее, эти препараты показали неоднозначную эффективность и потенциальные серьезные побочные эффекты (LeGrand et al. 1995. Comparative efficacy of nonsteroidal anti-inflammatory drugs and anti-thromboxane agents in a rabbit adhesion-prevention model. J. Invest. Surg. 8, 187-194; Li et al. 2004. Synthesis and biological evaluation of a cross-linked hyaluronan-mitomycin C hydrogel. Biomacromolecules 5, 895-902).
Из-за ограниченной эффективности и трудностей выполнения испытуемой терапии в подавляющем числе хирургических вмешательств, осуществляемых в брюшной полости, сегодня не применяются какие-либо продукты, чтобы предотвратить образование спаек, и послеоперационные спайки продолжают причинять страдания пациентам и представляют основную часть затрат для общества (Ray et al. 1998. Abdominal adhesiolysis: inpatient care and expenditures in the United States in 1994. J. Am. Coll. Surg. 186, 1-9; 2005).
Задачей настоящего изобретения является создание средств, которые могут предотвращать образование послеоперационных спаек без нежелательных побочных эффектов, присущих доступным в настоящее время фармацевтическим композициям, приборам и процедурам.
Описание изобретения
Авторы изобретения описывают новый подход для предотвращения образования внутрибрюшных спаек, используя биологически активные пептиды, полученные из лактоферрина человека, которые представлены в фармацевтической композиции, повышающей терапевтический эффект пептидов. Биологически активные пептиды показывают ингибирующее действие на наиболее важные признаки образования рубца: снижение риска инфекции, исключение воспаления и развития фибринолиза. Пептиды приготовлены вместе с природным гидрофильным полимером гиалуроновой кислоты, который обеспечивает медленное высвобождение лекарственного средства и вносит свой вклад в конечный результат от физического эффекта барьера. Используя модель дефекта боковой стенки из-за трения слепой кишки у крысы, которая обычно считается адекватным неклиническим предиктором клинической эффективности противорубцовых лекарственных средств, было показано, что биологически активные пептиды, полученные из лактоферрина человека вместе с гиалуроновой кислотой значительно сокращают послеоперационные интраабдоминальные спайки. Улучшение влияния пептидов вместе с гиалуроновой кислотой является неожиданным и значительно синергическим по сравнению с влиянием пептидов и эффектом гиалуроновой кислоты по отдельности.
Соответственно, настоящее изобретение относится к фармацевтическим композициям, повышающим терапевтический эффект биологически активных пептидов, особенно пептидов, полученных из лактоферрина человека.
Один из аспектов настоящего изобретения относится к фармацевтической композиции для лечения и/или предотвращения ран, шрамов и спаек после хирургического вмешательства включает i) один или несколько биологически активных пептидов, полученных из лактоферрина человека, и ii) гиалуроновой кислоты с высокой молекулярной массой.
Другой аспект настоящего изобретения предусматривает применение i) одного или нескольких биологически активных пептидов, полученных из лактоферрина человека, и ii) гиалуроновой кислоты с высокой молекулярной массой для производства фармацевтической композиции для лечения и/или предотвращения ран, шрамов и спаек после хирургического вмешательства.
Еще один аспект настоящего изобретения относится к способу лечения, профилактики и/или предотвращения ран, шрамов и спаек после хирургического вмешательства, включающему введение фармацевтической композиции, содержащей i) один или несколько биологически активных пептидов, полученных из лактоферрина человека, и ii) гиалуроновую кислоту с высокой молекулярной массой, субъекту, нуждающемуся в таком лечении.
Под «биологически активным пептидом, полученным из лактоферрина человека» подразумевается биологически активный пептид, содержащий по меньшей мере одну последовательность мотива, частично или полностью полученного из последовательности лактоферрина человека, где эта последовательность может включать одну или несколько аминокислотных замен.
Под «биологически активными» пептидами понимаются пептиды, которые имеют один или более видов активности, такие как противовоспалительная активность, иммуномодулирующая активность, фибринолитическая активность, антиангиогенезная активность и антимикробная активность, такая как антибактериальная активность, антивирусная активность или противогрибковая активность.
Биологически активные пептиды, пригодные для использования в соответствии с настоящим изобретением, описаны в PCT/EP2008/064062, PCT/EP2008/065186, WO 00/01730, соответственно EP 1095061 и US 7253143, которые включены сюда ссылкой.
Биологически активный пептид может быть выбран из пептидов, содержащих последовательность аминокислот
Phe-X1-X2-X3-X4-X5-X6-X7-Lys-Val-Arg (SEQ ID NO:1) где аминокислота X1 представляет собой Gln или Ala, аминокислота X2 представляет собой Trp или Leu, аминокислота X3 представляет собой Gln, Ala, Orn, Nle или Lys, аминокислота X4 представляет собой Arg, Ala или Lys, аминокислота X5 представляет собой Asn, Ala, Orn или Nle, аминокислота X6 представляет собой Met, Ala или Leu, аминокислота X7 представляет собой Arg, Ala или Lys.
Предпочтительно биологически активный пептид может быть выбран из пептидов формулы (I) и пептидов формулы (II)
R1-Cys-Phe-X1-X2-X3-X4-X5-X6-X7-Lys-Val-Arg-R2 Формула(1)
где R1 представляет собой отсутствие аминокислоты или Lys, или пептидную последовательность, выбранную из Gly-Arg-Arg-Arg-Arg-Ser-Val-Gln-Trp-Cys-Ala-Val-Ser-Gln-Pro-Glu-Ala-Thr-Lys … (SEQ ID NO: 2) и их усеченные на N-конце фрагменты, включающие

где аминокислота X8 представляет собой Gly, Lys, Glu или Asp;
когда X8 представляет собой Gly, то R3 представляет собой, Ser-(Arg)n-X9, и связь α является пептидной связью между карбоксильной группой Gly и аминогруппой Ser;
когда X8 представляет собой Lys, то R3 представляет собой X9-(Arg)n-Ser, и связь α является амидной связью между ε-аминогруппой в Lys и карбоксильной группой в Ser и
когда X8 представляет собой Glu или Asp, то R3 представляет собой Ser-(Arg)n-X9 и связь α является амидной связью между γ-карбоксильной группой Glu или β-карбоксильной группой Asp и аминогруппой Ser;
аминокислота X9 представляет собой отсутствие аминокислоты или Gly
и n представляет собой целое число от 1 до 10, предпочтительно целое число от 2 до 6, предпочтительно целое число от 4 до 6, или даже более предпочтительно целое число от 3 до 4,
и где R1 представляет собой отсутствие аминокислоты или Cys, или пептид с последовательностью, выбранной из
Gly-Arg-Arg-Arg-Arg-Ser-Val-Gln-Trp-Cys-Ala-Val-Ser-Gln-Pro-Glu-Ala-Thr-Lys-Cys
(SEQ ID NO: 48)
и их усеченные на N-конце фрагменты, включающие

Еще более предпочтительно, биологически активный пептид может быть выбран из пептидов





Наиболее предпочтительно биологически активный пептид выбирается из пептидов

Пептиды, включающие два остатка цистеина, могут быть в виде циклической структуры пептида, где эти два цистеина формируют цистеиновый мостик.
Соответственно, одним предпочтительным биологически активным пептидом является пептид

В случае наличия, может быть выгодна замена аминокислоты Cys на ацетамидометил-цистеин (обозначается как CysM) для того, чтобы избежать формирования дисульфидного мостика между пептидом и другим пептидом, включающим цистеин.
В соответствии с одним предпочтительным аспектом изобретения карбоксиконец пептида был кэпирован, т.е. свободная COOH-группа на карбоксиконце была преобразована, например, путем амидирования в CONH2. (Обозначается как -NH2).
В соответствии с другим предпочтительным аспектом изобретения аминокислоты на аминоконце пептида были кэпированы, т.е. свободная NH2-группа на аминоконце была преобразована, например, путем ацетилирования в амид CH3CONH- (обозначен как Ас-).
Согласно еще одному предпочтительному аспекту изобретения как карбоксиконец, так и аминоконец пептида были кэпированы.
В случае когда пептид в соответствии с изобретением описывается как кэпированный на карбоксиконце и/или на аминоконце, также возможно в соответствии с изобретением применять соответствующий не кэпированный пептид.
В случае, когда пептид в соответствии с изобретением описывается как не кэпированный на карбоксиконце и/или аминоконце, также возможно в соответствии с изобретением применять соответствующий кэпированный пептид.
Преимуществом кэпированных версий является то, что N- и С-концевые аминокислоты этих пептидов являются нейтральными и незаряженными, и таким образом были изменены электростатические свойства. Предполагая, что рецепторы связывают соответствующие последовательности лактоферрина человека, где нет N- и С-концевого заряда, кэпированные пептиды должны связываться лучше, поскольку они в этом отношении напоминают нативный белок больше, чем не кэпированные пептиды.
Предпочтительно биологически активный пептид присутствует в фармацевтической композиции в концентрации от 0,1 мг/мл до 100 мг/мл, наиболее предпочтительно от 0,5 мг/мл до 25 мг/мл.
Биологически активный пептид может присутствовать в виде фармацевтически приемлемых солей.
Предпочтительно гиалуроновая кислота с высокой молекулярной массой имеет молекулярную массу выше 300000 Да, наиболее предпочтительно выше, чем 800000 Да.
Предпочтительно гиалуроновая кислота с высокой молекулярной массой присутствует в фармацевтической композиции в концентрации от 0,1 до 10% (масс./масс.), наиболее предпочтительно от 0,5 до 2,5% (масс./масс.).
Гиалуроновая кислота с высокой молекулярной массой может быть представлена в виде фармацевтически приемлемой соли.
Фармацевтические композиции по изобретению могут быть использованы для предотвращения образования послеоперационных шрамов, спаек, келоидных рубцов, образовавшихся в связи с хирургическими процедурами на различных тканях, таких как кожа, мышцы, сухожилия, нервные ткани, кровеносные сосуды, и в разных местах тела, таких как глаза, уши, голосовые связки, руки, спинной мозг, внутрибрюшная полость, внутригрудная полость, внутричерепная полость, полость рта, гинекологическими процедурами, эндометриозом, фимозом.
Авторы изобретения неожиданно обнаружили, что биологическое действие пептидов, полученных из лактоферрина человека, может быть значительно повышено, если пептиды вводят в фармацевтическую композицию, содержащую пептид вместе с гиалуроновой кислотой с высокой молекулярной массой.
Это повышение не может быть объяснено только возможным эффектом гиалуроновой кислоты как таковой, но и неожиданным синергетическим эффектом.
Описание фигур
Фиг.1. Поведение PXL01 загруженного в гель гиалуроната натрия при 37°C.
Поведение PXL01 загруженного в гели гиалуроната натрия при 37°C. Концентрация PXL01 составляет 6 мг/мл в 1,5% растворе гиалуроната натрия. Кумулятивный выход лекарственного средства выражали в % лекарственного средства, высвобожденного в момент времени t. Данные представлены как среднее ± SDV трех независимых препаратов продукта со сдвигом добавленной средней тренда.
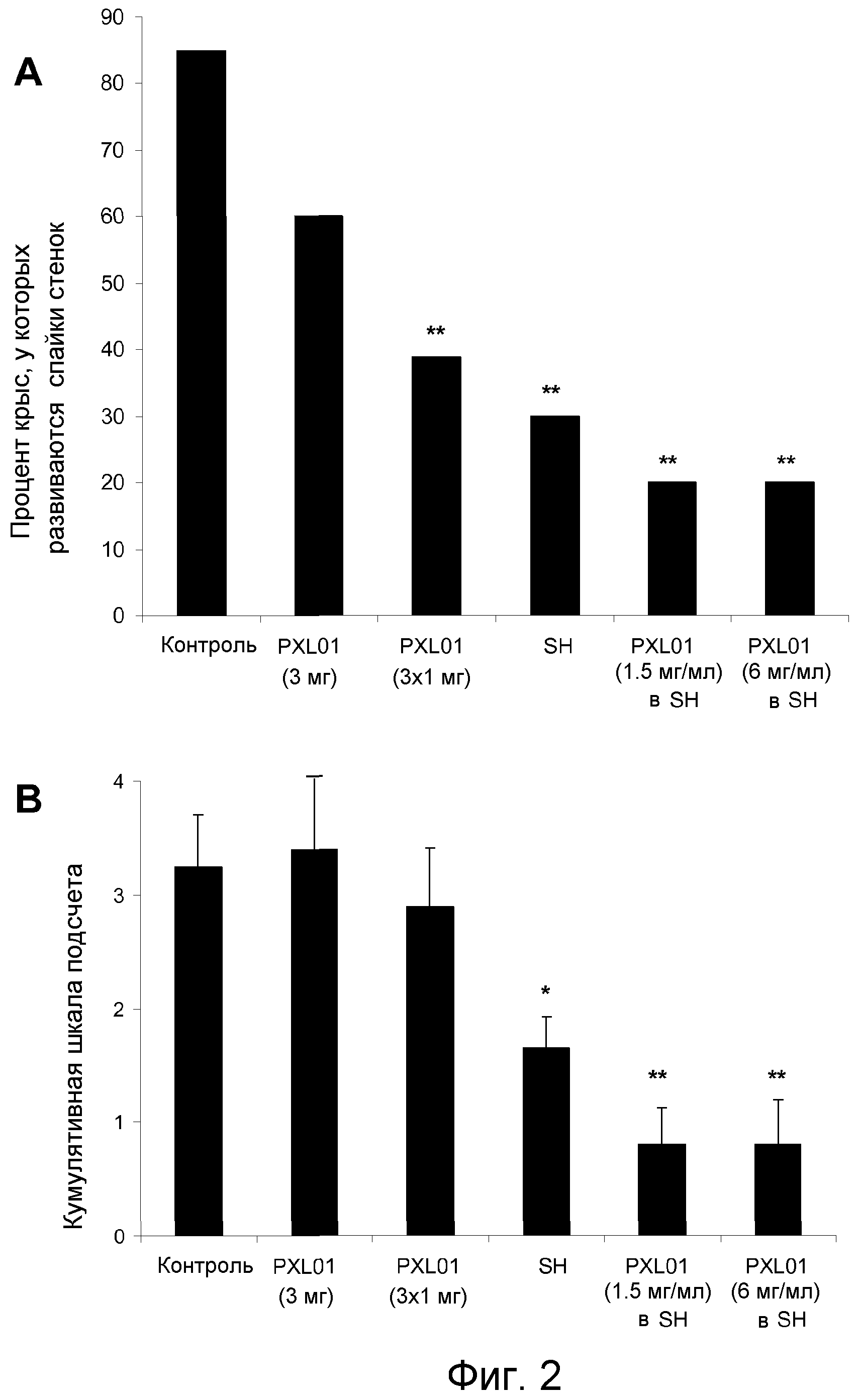
Фиг.2. PXL01 предотвращает образование спаек в крысиной модели абдоминальной хирургии.
(А) Частота образования спаек между травмированными участками брюшной стенки и слепой кишки представлена как процент животных, у которых развиваются спайки стенок для этих повреждений в каждой группе. (В) Кумулятивная шкала подсчета показывает общее количество спаек, обнаруженных в брюшной полости, представленные как среднее ± SEM. (C) Оценка спаек по шкале Nair представлена как среднее ± стандартная ошибка среднего (подсчет критериев, перечисленных в примерах). (D) Процент животных без какого-либо образования спаек в брюшной полости в каждой группе. (Е) Изменения в массе в течение 6 дней выживания после операции представлены в процентах от исходной массы, n (контроль) = 20, n (1 введение 0,5 мл PXL01 (6 мг/мл) в dH2O) = 10, n (3 введения по 0,5 мл PXL01 (2 мг/мл) в dH2O в связи с операцией и 24 и 48 ч после операции) = 18, n (1 введение 1,5% гиалуроната натрия) = 20, n (1 введение 1 мл PXL01 (1,5 мг/мл) в 1,5% гиалуроната натрия) = 10, n (1 введение 1,5 мл PXL01 (6 мг/мл) в 1,5% гиалуроната натрия) = 10). Статистическая значимость была оценена тестом точности Фишера (A, D) или непараметрическим тестом Манна Уитни (B, C). *, p<0,05; **, p<0,01 указывают на статистическую разницу по сравнению с контрольной хирургической группой животных. Adm, введение; SH, гиалуронат натрия, dH2O, дистиллированная вода.
ПРИМЕРЫ
ЭКСПЕРИМЕНТЫ
Пептид
В экспериментах был использован пептид PXL01 (SEQ ID NO: 56).
Подготовка PXL01 в гидрогеле гиалуроната натрия
PXL01, растворенный в растворе хлорида натрия, был добавлен в 2,5% раствор гиалуроната натрия при объемном соотношении 2/5 раствора PXL01 и 3/5 раствора гиалуроната натрия, чтобы получить 1,5 или 6 мг/мл PXL01 в 1,5% гиалуронате натрия. Раствор гомогенизировали, пропуская смеси несколько раз через иглу диаметром 2,1 мм.
Характеристика приготовленного продукта
Концентрация и однородность PXL01 в гиалуронате натрия определяли высокоэффективной жидкостной хроматографией с УФ-детектором (Agilent модель 1100) при 220 нм. Была использована аналитическая колонка Vydac 218TP (С18, 5 мкм, 250×4,6 мм). Используемые подвижные фазы (0,1% TFA в воде, содержащей 1% ацетонитрила (растворитель А) и 0,1% TFA в ацетонитриле (растворитель В)) были запущены при градиенте скорости потока 1,0 мл/мин. Разбавленные PXL01 стандарты были применены для создания калибровочной кривой.
Образцы готовили путем добавления раствора гиалуронидазы (гиалуронидаза из Streptomyces hyalurolyticus, Sigma-Aldrich, St Louis, MO) с ферментативной активностью 500 ед/мл в образце раствора. Смеси перемешивали в течение 2 час при комнатной температуре и разбавляли по мере необходимости TFA с водой с последующим дополнительным перемешиванием. Пробы центрифугировали при 7000 оборотов в минуту в течение 5 мин до введения в колонку.
Установка системы высвобождения in vitro
0,25 мл готового продукта было помещено в лунки планшета с тканевой культурой (24-луночные плоскодонные планшеты для культуры тканей, Techno Plastic Products AG) с получением тонкой пленки толщиной приблизительно 1,3 мм. Планшеты были помещены в термостат (37°С) на 1 час, чтобы достичь температуры 37°C. 0,5 мл среды высвобождено (PBS, рН 7,4), повторно уравновешено при 37°С и на поверхность был тщательно наслоен гель, и планшеты с культурой ткани были перенесены в термостатический шейкер (60 об/мин, 37°С). В заданные промежутки времени 10 мкл аликвоты водного раствора были отобраны из среды высвобождения. Концентрация высвобожденного PXL01 контролировалась на длине волны 230 нм с использованием спектрофотометрического оборудования. Поскольку измерение поглощения при 230 нм смогло обнаружить пептид, а также растворенный гиалуронат натрия в среде высвобождения, в качестве контроля среды высвобождения использовали среду, которая содержала такое же количество гиалуроната натрия без PXL01, что и гиалуронат натрия с лекарственным средством.
Животные модели для оценки предотвращения спаек после хирургического вмешательства
Самки крыс Sprague-Dawley (200-250 г, Charles River Laboratories, Sulzfeldt, Германия) содержались с 12-часовым циклом свет-темнота, и с ними обращались в соответствии с правилами защиты лабораторных животных. Исследование было проведено после предварительного согласования с местным комитетом по этике.
Истирание слепой кишки и иссечение брюшной стенки были выполнены, чтобы вызвать спайки de novo, как описано выше (Harris et al. 1995. Analysis of the kinetics of peritoneal adhesion formation in the rat and evaluation of potential antiadhesive agents. Surgery 117, 663-669). Вкратце, крысам был дан изофлурановый наркоз (lsoba®vet, Shering-Plough Animal Health, Farum, Дания) и бупренорфин (48 мкг/кг, Temgesic, Shering-Plough, Brussels, Бельгия) в качестве послеоперационного обезболивающего. Был выполнен разрез длиной 5 см по средней линии брюшной полости, и на брюшной стенке было сделано повреждение прямоугольной формы (5 мм × 25 мм) полной толщины через обе, пристеночную и мышечную, фасции брюшины. Кроме того, область серозной оболочки по обе стороны слепой кишки, около 10 мм × 15 мм, мягко протирали с помощью ватной марли до появления точечных кровоизлияний. Крысы были рандомизированы на необработанную контрольную группу или обработанную группу. Избыточная кровь из раны была удалена, и тестируемое вещество было нанесено при помощи шприца на стертые области. Рана от лапаротомии была закрыта непрерывным швом, и кожа была закрыта металлическими зажимами (Appose ULC35W, TycoHealthcare Group LP, Norwalk, CT, US). Животные были умерщвлены через 6 дней после операции передозировкой пентобарбитала натрия (Pentobarbital vet, APL, Stockholm, Швеция). Брюшная полость была вскрыта, и спайки были подсчитаны оценщиком, не знающим о лечении. Степень спайки между брюшным разрезом и стертой слепой кишкой была определена количественно как процент животных, у которых развивались спайки между стенками, соединяющими эти повреждения, в каждой группе. Кроме того, чтобы всесторонне оценить общее количество спаек, образующихся в брюшной полости, в том числе спайки, отдаленные от хирургической травмы, были использованы две разные схемы классификации. Кумулятивная шкала подсчета, описанная Bothin (Bothin et al. 2001. The intestinal flora influences adhesion formation around surgical anastomoses. Br J Surg 88, 143-145), учитывает общее количество спаек, присутствующих в брюшной полости: один балл дается каждой наблюдаемой спайке, и баллы складываются для получения оценки. Шкала оценки спаек в соответствии с Nair (Nair et al. 1974. Role of proteolytic enzyme in the prevention of postoperative intraperitoneal adhesions. Arch Surg 108, 849-85) включает как общее количество спаек, так и появление спаек между целевыми органами, при этом более высокое значение дается последнему (0 - нет спаек, 1 - одна полоса спайки внутренних органов и целевого органа; 2 - две полосы спайки внутренних органов и целевого органа, 3 - более двух полос спаек внутренних органов и целевого органа, 4 - внутренние органы непосредственно прилипают к брюшной стенке, независимо от количества и степени полос спаек. В заключение, доля крыс без каких-либо брюшных спаек была оценена в каждой группе. Любые возможные признаки воспаление брюшины (эритема и/или отек) или нарушения заживления ран были зарегистрированы при вскрытии. Были сопоставлены массы тела животных до и через 6 дней после операции как общий показатель благополучия.
Модель анастомоза толстого кишечника у крыс
Самки крыс Sprague Dawley (200-250 г, Charles River Laboratories, Sulzfeldt, Германия) содержались с 12-часовым циклом свет-темнота и с ними обращались в соответствии с правилами защиты лабораторных животных. Исследование было проведено после предварительного согласования с местным комитетом по этике. Анестезию индуцировали изофлураном (lsoba®vet, Shering-Plough Animal Health, Farum, Дания), и крысы получали бупренорфин (48 мкг/кг; Temgesic, Shering-Plough, Брюссель) внутримышечно, чтобы облегчить послеоперационную боль, и бимотрим (80 мг/кг; Bimeda, UK, подкожно до операции).
Брюшная стенка была выбрита, и была выполнена лапаратомия по средней линии длиной около 3 см. Толстая кишка была отделена и иссечена в 2 см дистально от слепой кишки. Серозномышечный анастомоз от начала до конца шва был проведен для 8 узловых швов с использованием нити монокрил 6/0 (Y432H, Ethicon Inc., St-Stevens Woluwe, Бельгия). Трубка была помещена в толстой кишке для анастомоза как стент во время наложения швов. Крысы были случайным образом разделены на группы, получающие PXL01 (6 мг/мл) в 1,5% гиалуроната натрия, покрывающие анастомоз и окружающую брюшину (n=8) или не получающие лечение (n=8). Брюшная полость была закрыта непрерывным швом (4-0 монокрил, Y3100H, Ethicon Inc.) в мышечном слое и скрепками на коже. Чтобы предотвратить обезвоживание, 2 мл изотонического солевого раствора вводили подкожно.
Животные получали дополнительные дозы бупренорфина (24 мкг/кг: Temgesic, Shering-Plough, Брюссель) подкожно два раза в день в течение двух дней после операции. Животные были умерщвлены через 7 дней после операции передозировой пентобарбитала натрия (Pentobarbital vet, APL, Stockholm, Швеция). Брюшная полость была вскрыта, и был вырезан кишечный участок 4-см длины с областью анастомоза, расположенной в середине. Трубка, подключенная к монитору давления, была вставлена с одной стороны кишечного сегмента, и конец другой стороны был лигирован. Кишечный сегмент был помещен непосредственно в изотонический хлорид натрия, окрашенный солевой раствор вводили через трубку в кишечные сегменты, и интралюминарное давление контролировали с помощью записывающего устройства Grass (Grass Instruments Co, Quincy, Ohio, USA). Максимальное давление до разрыва анастомоза было зарегистрировано как давление разрыва. Появление окрашенного солевого раствора вокруг анастомоза указывало время точки разрыва. Оценщик не знал о полученном каждым животным лечении.
РЕЗУЛЬТАТЫ
Режим высвобождения PXL01 в гиалуронате натрия
PXL01, растворенный в растворе хлорида натрия, смешивают с раствором гиалуроната натрия, получая гомогенный гидрогель, содержащий PXL01. В экспериментах по высвобождению in vitro был показан всплеск высвобождения PXL01 из геля гиалуроната натрия с примерно 70% PXL01 в течение 1 часа (фиг.1). Режим высвобождения характеризуется начальным взрывом, как уже продемонстрировано для других растворимых соединений, включенных в гиалуронат натрия (Sherwood et al. 1992. Controlled antibody delivery systems. Biotechnology (NY) 10, 1446-1449). Это может иметь функциональное применение в обеспечении начальной дозы в течение доставки лекарственного средства, сводя к минимуму любой период задержки. Важно отметить, что высвобождение PXL01 из подготовленных продуктов, приготовленных в трех независимых случаях, в значительной степени показало, что подготовка PXL01 с гелями гиалуроната натрия высоко воспроизводима (фиг.1).
Предупреждение образования перитонеальной спайки с PXL01
Модель трения слепой кишки дефекта боковой стенки у крысы (Arnold et al., выше) была использована для выяснения антиспаечного влияния PXL01. Эта модель обеспечивает надежные и последовательные спайки между двумя раневыми поверхностями, если лечение не оказано, и при этом у 85% крыс в контрольной группе развиваются прямые перитонеальные спайки стенок слепой кишки (фиг.2А). Незначительное снижение образования спаек наблюдается при введении 3 мг PXL01 в водном растворе в качестве разовой дозы в связи с операцией (фиг.2А-D). Тем не менее, животные, получавшие 3 дозы 1 мг PXL01 в водном растворе продемонстрировали заметное снижение спаек по сравнению с контрольной группой крыс (фиг.2А, С). Эти результаты показывают, что медленное высвобождение PXL01 в хирургической области выгодно по сравнению с однократной обработкой с водным раствором пептида.
Гиалуронат натрия был выбран в качестве носителя для достижения контролируемого высвобождения PXL01. PXL01 является хорошо растворимым и достаточно стабильным в гиалуронате натрия, также PXL01 в гидрогеле гиалуроната натрия биоадгезивен и прост в применении к хирургической области с помощью шприца. Когда PXL01 был применен в 1,5% препарате гиалуроната натрия с высоким молекулярным весом, образование брюшных спаек значительно снизилось по сравнению с контрольной группой. Имело место 4-кратное снижение по кумулятивной шкале подсчета спаек (фиг.2B) и более чем 3-кратное снижение образования спаек в соответствии с Nair (фиг.2С). 60% животных, получавших 6 мг/мл PXL01 в гиалуронате натрия, были полностью свободны от спаек по сравнению с 5% животных в контрольной группе и 20% животных в группе, получавшей гиалуронат натрия (фиг.2D). По нескольким шкалам подсчета гиалуронат натрия как таковой приводит к снижению образования спаек, предположительно из-за эффекта физического барьера (Burns et al. 1995. Prevention of tissue injury and postsurgical adhesions by precoating tissues with hyaluronic acid solutions. J. Surg. Res. 59, 644-652.).
Связанные с лечением побочные эффекты не были выявлены в ходе исследования, касающегося заживления ран, или воспаления брюшины оценены в ходе некропсии. Кроме того, средняя масса тела крыс в группах лечения была увеличена по сравнению с их предоперационным весом, хотя разница по сравнению с контрольной группой не достигла статистической значимости (фиг.2Е). Важно отметить, что PXL01 в гиалуронате натрия, применяемый во всем кишечном анастомозе, не снижал потенциал излечения по оценкам давления разрыва анастомоза, измеренного через 7 дней после операции (давление разрыва для группы лечения (n=8) 206,3±14,3 мм Hg по сравнению с 197,4±9,6 мм Hg в контрольной группе (n=8)).
Способность PXL01, предотвращать спайки была ограничена в водном растворе (фиг.2А-D), и это, возможно, связано с тем, что пептид быстро выводится из брюшины. Тем не менее, пептид был высокоэффективным при применении в гиалуронате натрия (фиг.2А-D), вызывая значительное снижение спаек в соответствии с различными масштабами классификации, включая образование спаек между двумя раневыми поверхностями, а также в брюшной области, удаленной от области применения. Гиалуронат натрия, естественный компонент внеклеточного матрикса, является локально катаболизируемым или он переносится лимфой, или за счет общей циркуляции, и далее он элиминируется эндотелиальными клетками печени (Fraser et al. 1988. Uptake and degradation of hyaluronan in lymphatic tissue. Biochem. J. 256, 153-158; Laurent & Fraser 1992. Hyaluronan. Faseb_J. 6, 2397-2404.). Гиалуронат натрия, очевидно, усиливает влияние PXL01, поддерживая местные концентрации препарата через контролируемое высвобождение. Эксперименты in vitro указывают на относительно короткий период высвобождения PXL01 из гиалуроната натрия (фиг.1), свидетельствуя, что продолжительность высвобождения лекарственного средства, необходимая для предотвращения образования спаек in vivo, может быть весьма ограничена. Это согласуется с предыдущим доказательством того, что критические образования в спайках в брюшной полости происходят в первые 36 ч (Harris et al. 1995. Analysis of the kinetics of peritoneal adhesion formation in the rat and evaluation of potential antiadhesive agents. Surgery 117, 663-669.). Как было показано ранее, некоторые системы доставки на основе микрочастиц вызвали спайки или воспаление (Hockel et al. 1987. Prevention of peritoneal adhesions in the rat with sustained intraperitoneal dexamethasone delivered by a novel therapeutic system. Ann. Chir. Gynaecol. 76, 306-313; Kohane et al. 2006. Biodegradable polymeric microspheres and nanospheres for drug delivery in the peritoneum. J. Biomed. Mater. Res. A 77, 351-361). Неожиданные побочные эффекты, такие как вялость, воспаление брюшины или торможение заживления ран у животных, получавших PXL01 при любой концентрации, не наблюдались. На момент умерщвления все группы поддерживали или превысили свой вес до операции (фиг.2Е). Важно отметить, что PXL01 в гиалуронате натрия, применяемый во всем кишечном анастомозе, не мешал потенциалу излечивания анастомоза.
Таким образом, авторы настоящего изобретения описывают неожиданные наблюдения, что биологическое действие лактоферрина на предупреждение спаек после хирургического вмешательства может быть значительно повышено, если пептиды вводят в фармацевтической композиции, содержащей пептид вместе с гиалуроновой кислотой с высокой молекулярной массой. Эффект был значительно синергетичный по сравнению с эффектом от пептида и эффектом от гиалуроновой кислоты по отдельности. Как было показано ранее, некоторые системы доставки на основе микрочастиц вызвали спайки или воспаление (Hockel et al. 1987, выше; Kohane et al. 2006, выше). Кроме того, как было показано, применение физических барьеров для предотвращения образование спаек приводило к неблагоприятным последствиям, таким как анастомозная утечка, в связи с вмешательством в процесс заживления ран (diZerega et al. 2002, выше). В настоящем исследовании было показано, что гиалуронат натрия не увеличивает спайки, а действует синергически с лактоферрином в предотвращении образования спаек. Важно отметить, что введение пептидов в гиалуронате натрия не было связано с какой-либо обеспокоенностью по поводу безопасности заживления анастомоза, и, таким образом, продукт продемонстрировал превосходный уровень безопасности по сравнению с ранее описанными агентами, действующими против образования спаек. Пептид, загруженный в гель гиалуроната натрия, прост в обращении и введении и совместим с лапаратомией или лапароскопией. Таким образом, продукт, как ожидается, обеспечит значимый режим предотвращения образования спаек, причем предотвращение не только спаек, которые образуются в местах оперативных процедур, но и спаек de novo, которые формируются на поверхности, непосредственно не связанной с операцией, в связи с непреднамеренными травмами тканей во время хирургических манипуляций, без каких-либо побочных эффектов при лечении.
Реферат
Изобретение относится к фармацевтической промышленности и представляет собой фармацевтическую композицию для профилактики образования послеоперационных шрамов, спаек и келоидов в связи с хирургическим вмешательством, включающую биологически активный пептид, содержащий аминокислотную последовательность SEQ ID NO:56, где пептид присутствует в концентрации от 0,1 мг/мл до 100 мг/мл; и гиалуроновую кислоту с высокой молекулярной массой или фармацевтически приемлемую соль гиалуроновой кислоты с высокой молекулярной массой, где гиалуроновая кислота с высокой молекулярной массой имеет среднюю молекулярную массу свыше 300000 Да и где гиалуроновая кислота присутствует в концентрации от 0,1 до 10% (масс./масс.). Изобретение обеспечивает достижение синергетического эффекта в отношении сокращения послеоперационных интраабдоминальных спаек. 3 н. и 3 з.п. ф-лы, 2 ил.
Формула
i) биологически активный пептид, содержащий аминокислотную последовательность
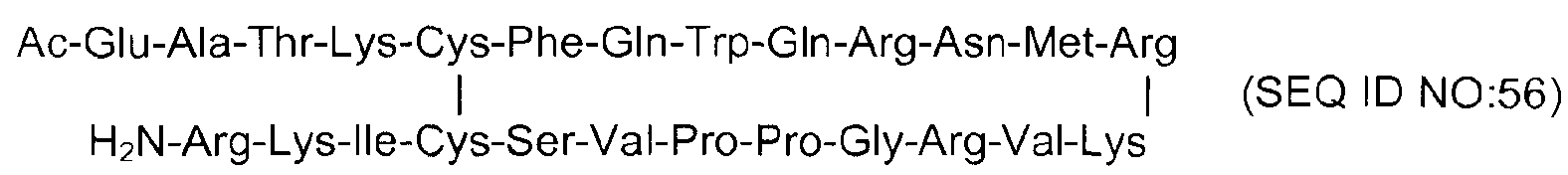
где пептид присутствует в концентрации от 0,1 мг/мл до 100 мг/мл; и
ii) гиалуроновую кислоту с высокой молекулярной массой или фармацевтически приемлемую соль гиалуроновой кислоты с высокой молекулярной массой, где гиалуроновая кислота с высокой молекулярной массой имеет среднюю молекулярную массу свыше 300000 Да, и где гиалуроновая кислота присутствует в концентрации от 0,1 до 10% (мас./мас.).
Документы, цитированные в отчёте о поиске
Композиции и способы лечения или предупреждения воспалительных заболеваний

Комментарии