Стабилизированная композиция для лечения псориаза - RU2526162C2
Код документа: RU2526162C2
Чертежи



Описание
2420-176849RU/071
СТАБИЛИЗИРОВАННАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ПСОРИАЗА
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящая заявка относится к стабильным при комнатной температуре неводным композициям мази, содержащим витамин D и кортикостероид, используемым для лечения псориаза.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Псориаз представляет собой неинфекционное заболевание, которое поражает кожу и суставы. Данное заболевание сопровождается образованием на коже красных чешуйчатых бляшек, называемых псориатическими бляшками, которые представляют собой зоны воспаления и избыточной продукции кожной ткани. По данным Национального Института Здоровья (National Institute of Health) до 7,5 миллионов американцев поражены псориазом. Было подсчитано, что приблизительно у 10 - 30% людей с псориазом имеется риск развития также заболевания суставов, известного как псориатический артрит, который вызывает боль в суставах, их тугоподвижность и набухание.
Псориаз представляет собой хроническое рецидивирующее состояние, которое может в значительной мере варьировать по тяжести проявления. У некоторых больных псориазом имеются небольшие локализованные зоны псориатических бляшек, тогда как у других такие бляшки могут охватывать практически все тело. При этом часто поражаются также ногти пальцев рук и стопы.
Причина возникновения псориаза неизвестна, однако считается, что это заболевание может иметь генетический компонент. Стресс, избыточное потребление алкоголя и курение представляют собой известные факторы, ухудшающие такое состояние. Кроме очевидных физических проявлений псориаз может сопровождаться у пораженных этим заболеванием индивидуумов депрессией и снижением уровня самооценки.
Известно множество местных лекарственных средств, которые использовались для лечения псориаза. Такие средства включают, например, витамин D-3 (кальципотриен), деготь, кортикостероиды (например клобетазол, флуоцинолон и бетаметазон), экстракт древесной коры (например антралин) и ретиноиды (например тазаротен). Были также описаны композиции для лечения псориаза, которые включают и соединения витамина D, и кортикостероиды (см. патент США № 6753013). Сочетания витамина D и кортикостероидов могут быть нестабильными, поскольку для кортикостероидов благоприятны кислые условия, тогда как соединения витамина D более стабильны в щелочных условиях. Местная мазь ТАКЛОНЕКС® (TACLONEX®) представляет собой объединенный продукт, который включает и кальципотриен, и дипропионат бетаметазона, стабилизированный растворителем типа полиоксиалкиленового эфира.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Стабильная при хранении мазь по настоящему изобретению включает соединение витамина D, кортикостероид и замещенный N,N-ди(C1-C8)алкиламином сложный эфир (С4-C18) алкил (C2-CI8) карбоновой кислоты, сложный эфир (C1-C4) алкил (C8-C22)карбоновой кислоты в вазелине в качестве носителя и необязательно содержит минеральное масло, токоферол или оба этих компонента. Предпочтительно соединение витамина D включает кальципотриен. Кортикостероид предпочтительно представляет собой фармацевтически приемлемую соль клобетазола или фармацевтически приемлемую соль бетаметазона. Предпочтительный сложный эфир N,N-ди(C1-C8)алкиламино-замещенной (С4-C18) алкил (C2-CI8) карбоновой кислоты представляет собой додецил-2-(N,N-диметиламино)пропионат (DDAIP).
Композиции по настоящему изобретению характеризуются стабильностью при хранении, сравнимой с коммерчески доступной мазью для местного применения ТАКЛОНЕКС®, и при этом демонстрируют неожиданно повышенное проникновение в кожу кальципотриена, в сравнении с коммерческим продуктом.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показан график, демонстрирующий кумулятивное проникновение кальципотриена через кожу уха свиньи, применительно к длительности такого проникновения в кожу в стандартном тесте на проникновение в кожу, проводимом с использованием композиций по настоящему изобретению, содержащих кальципотриен, дипропионат бетаметазона и различные количества DDAIP, в сравнении с композицией, не содержащей DDAIP, и мазью ТАКЛОНЕКС®.
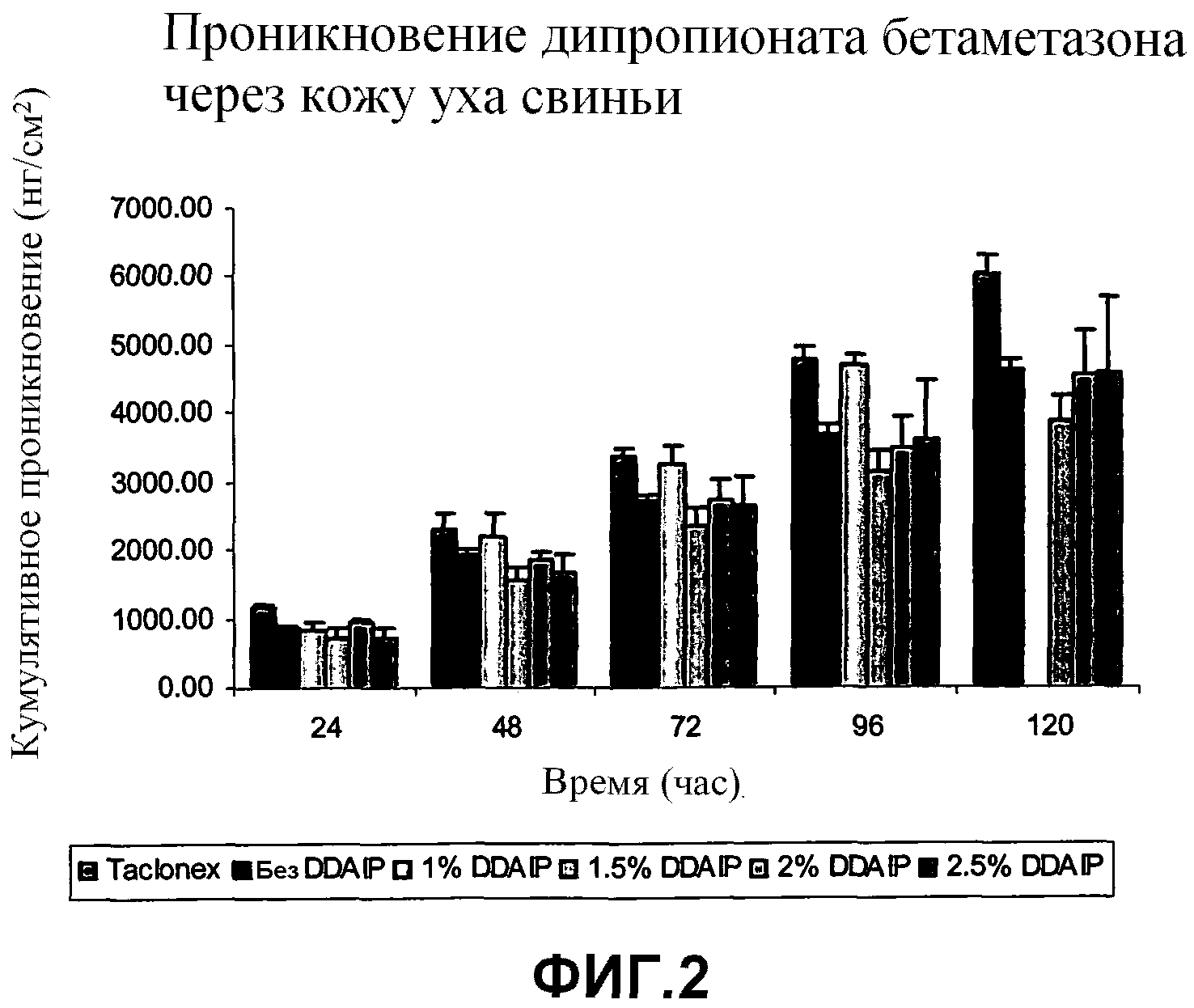
На фиг.2 показан график, демонстрирующий кумулятивное проникновение бетаметазона через кожу уха свиньи, применительно к длительности такого проникновения в кожу в стандартном тесте на проникновение в кожу, проводимом с использованием композиций по настоящему изобретению, содержащих кальципотриен, дипропионат бетаметазона и различные количества DDAIP, в сравнении с композицией, не содержащей DDAIP, и мазью ТАКЛОНЕКС®.
На фиг.3 показан график, демонстрирующий кумулятивное проникновение кальципотриена через кожу уха свиньи, применительно к длительности такого проникновения в кожу в стандартном тесте на проникновение в кожу, проводимом с использованием композиций по настоящему изобретению, содержащих кальципотриен, пропионат клобетазола и различные количества DDAIP, в сравнении с композицией, не содержащей DDAIP.
На фиг.4 показан график, демонстрирующий кумулятивное проникновение клобетазола через кожу уха свиньи, применительно к длительности такого проникновения в кожу в стандартном тесте на проникновение в кожу, проводимом с использованием композиций по настоящему изобретению, содержащих кальципотриен, пропионат клобетазола и различные количества DDAIP, в сравнении с композицией, не содержащей DDAIP.
На графиках, приведенных на фиг.1, 2, 3 и 4, колонки для каждой временной точки для каждой группы и на каждом из графиков сгруппированы в порядке, описанном под каждым из графиков.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к стабильной при хранении мази, используемой для лечения псориаза. Композиция по настоящему изобретению включает соединение витамина D, кортикостероид и сложный эфир N,N-ди(C1-C8) алкиламино-замещенной (C4-C18)алкил(C2-C18)карбоновой кислоты, сложный эфир (C1-C4)алкил(C8-C22)карбоновой кислоты в вазелине (например в белом вазелине) в качестве носителя и необязательно содержит минеральное масло, токоферол (витамин Е) или оба этих компонента: и минеральное масло, и токоферол.
Подходящие соединения на основе витамина D, которые могут использоваться в композициях по настоящему изобретению, включают кальципотриен (также известный как кальципотриол), кальцитриол, такальцитол, максакальцитол и 1(S),3(R)дигидрокси-20(R)-[((3(2-гидрокси-2-пропил)фенил)метокси)метил]-9,10-секо-прегна-5(Z),7(E),10(19)триен, а также сочетания двух или более таких соединений. Предпочтительным соединением витамина D является кальципотриен, который представляет собой (lR,3S)-5-[2-[(lR,3aR,7aS)-l-[(2S)-5-циклопропил-5-гидрокси-пент-3-ен-2-ил]-7a-метил-2,3,3a,5,6,7-гексагидро-1H-инден-4-илиден]этилиден]-4-метилиден-циклогексан-1,3-диол (название по классификации IUPAC) предпочтительно в виде моногидрата. Соединение витамина D предпочтительно присутствует в композиции в концентрации от приблизительно 0,001 до приблизительно 0,01 весовых процентов.
Подходящие кортикостероиды, которые могут использоваться в композициях по настоящему изобретению, включают гидрокортизон, дезонид, пивалат флуметазона, ацетонид флуоцинолона, ацетонид триамцинолона, дипропионат алклометазона, валерат гидрокортизона, предникарбат, пивалат клокортолона, пропионат флутиказона, фуроат мометазона, бетаметазон, дипропионат бетаметазона, амцинонид, дезоксиметазон, дифлоразон, флуоцинонид, галцинонид, пропионат галобетазола, пропионат клобетазола и сочетание двух или более указанных соединений. Особенно предпочтительными кортикостероидами являются пропионат клобетазола и дипропионат бетаметазона. Предпочтительно кортикостероид присутствует в данной композиции в концентрации от приблизительно 0,01 до приблизительно 0,1 весовых процентов.
Токоферол также предпочтительно включается в композиции по настоящему изобретению, например, в концентрации приблизительно от 0,001 до 0,01 весовых процентов.
Кроме того, композиции по настоящему изобретению включают сложный эфир N,N-ди(C1-C8) алкиламино-замещенной (C4-C18)алкил (C2-C18) карбоновой кислоты, например, в качестве растворителя, и усилитель проникновения в кожу предпочтительно в концентрации от приблизительно 0,1 до приблизительно 5 весовых процентов. Термин «N,N-ди(C1-C8)алкиламино-замещенный» применительно к сложному эфиру (C4-C18)алкил(C2-C18)карбоновой кислоты обозначает, что либо алкильная часть, либо часть карбоновой кислоты, на основе которой был получен сложный эфир, содержит заместитель на основе аминогруппы NRxRy, где Rx и Ry каждый независимо обозначает (C1-C8) алкильную группу. Предпочтительно Rxи Ry, оба, представляют собой метильную группу. Примеры таких подходящих соединений включают: додецил-2-(N,N-диметиламино)пропионат (DDAIP); додецил-2-(N,N-диметиламино)ацетат (DDAA) и 1-(N,N-диметиламино)-2-пропил-додеканоат (DAIPD), 1-(N,N-диметиламино)-2-пропилмиристат (DAIPM) и 1-(N,N-диметиламино)-2-пропилолеат (DAIPO). Получение DDAIP и кристаллических аддитивных солей кислоты описано в патенте США № 6118020 (Büyüktimkin, et. al), который включен в настоящее описание полностью в качестве ссылки. Сложные эфиры алкилкарбоновой кислоты, включающей аналогичное замещение длинноцепочечными алкилами по аминогруппе, могут быть синтезированы из легко доступных соединений, как описано в патенте США № 4980378 (Wong, et al), который включен в настоящее описание полностью в качестве ссылки в том объеме, который соответствует данной теме. Предпочтительным сложным эфиром N,N-ди(C1-C8) алкиламино-замещенной (C4-C18)алкил(C2-C18)карбоновой кислоты является DDAIP.
Композиции по настоящему изобретению могут включать приблизительно до 10 весовых процентов (например 1-10 процентов) минерального масла. Предпочтительно композиция включает от приблизительно 1 до приблизительно 5 весовых процентов минерального масла
В предпочтительном варианте композиция по настоящему изобретению включает от приблизительно 0,001 до приблизительно 0,01 весовых процентов соединения витамина D; от приблизительно 0,01 до приблизительно 0,1 весовых процентов кортикостероида; от приблизительно 0,001 до приблизительно 0,01 весовых процентов токоферола; от приблизительно 0,1 до приблизительно 5 весовых процентов сложного эфира N,N-ди(C1-C8)алкиламино-замещенной (C4-C18)алкил (C2-C18)карбоновой кислоты, сложный эфир (C1-C4)алкил(C8-C22)карбоновой кислоты в вазелине в качестве носителя и необязательно содержит минеральное масло.
В особенно предпочтительных вариантах осуществления настоящего изобретения соединение витамина D включает кальципотриен, кортикостероид выбирают из группы, состоящей из пропионата клобетазола и дипропионата бетаметазона, и сложный эфир N,N-ди(C1-C8)алкиламино-замещенной (C4-C18)алкил(C2-C18)карбоновой кислоты представляет собой DDAIP, регистрационный номер CAS №224297-43-2. Один такой предпочтительный вариант осуществления изобретения относится к композиции, которая включает от приблизительно 0,001 до приблизительно 0,01 весовых процентов кальципотриена; от приблизительно 0,01 до приблизительно 0,1 весовых процентов кортикостероида, выбранного из пропионата клобетазола и дипропионата бетаметазона; от приблизительно 0,001 до приблизительно 0,01 весовых процентов токоферола; приблизительно до 10 весовых процентов минерального масла и от приблизительно 0,1 до приблизительно 5 весовых процентов сложного эфира N,N-ди(C1-C8) алкиламино-замещенного (C4-C18)алкил(C2-C18)карбоновой кислоты, сложный эфир (C1-C4)алкил(C8-C22)карбоновой кислоты в вазелине в качестве носителя.
Приведенные ниже неограничивающие примеры даны для иллюстрации некоторых аспектов и особенностей настоящего изобретения.
ПРИМЕР 1
Получают две композиции по настоящему изобретению. Состав композиций описан в таблицах 1 и 2. В таблице 1 и таблице 2, а также в последующих таблицах сокращенное обозначение «CAL» относится к кальципотриену; сокращенное обозначение «BET-D» относится к дипропионату бетаметазона и сокращенное обозначение «CLO-P» относится к пропионату клобетазола.
ПРИМЕР 2
Данные по стабильности комбинированных композиций, описанных в примере 1, показаны в таблице 3. В качестве эталонного препарата была взята мазь ТАКЛОНЕКС® (TACLONEX®) (коммерческий продукт, содержащий кальципотриен и дипропионат бетаметазона, стабилизированный сложным эфиром поли(алкиленоксида) в качестве растворителя), в отношении которой известно, что она является стабильным продуктом. Композицию из примера 1 и мазь ТАКЛОНЕКС® хранили в указанных температурных условиях, как описано в таблице 3, и далее анализировали по методу высокоэффективной жидкостной хроматографии для выявления активного фармацевтического ингредиента (API). Приведенные в таблице 3 цифры обозначают проценты целевого активного ингредиента относительно известных препаратов композиций, полученные при анализе образцов, отобранных в соответствующие временные точки в процессе хранения в указанных температурных условиях.
Приведенные в таблице 3 данные четко показывают, что композиции по настоящему изобретению обладают стабильностью при хранении, которая сравнима с таковой для эталонного коммерческого продукта.
ПРИМЕР 3
Композиции по настоящему изобретению также оценивали с точки зрения их способности проникать в кожу уха свиньи. Кожа уха свиньи традиционно используется для оценки проникновения местных продуктов в связи с тем, что результат такой оценки проникновения близок к соответствующей характеристике для кожи у человека. Исследовали композиции по настоящему изобретению, которые содержали 0,005 вес.% кальципотриена, 0,002 вес.% токоферола, 3 вес.% минерального масла, и либо 0,05 вес.% пропионата клобетазола, либо 0,064 вес.% дипропионата бетаметазона в белом вазелине в качестве носителя, и которые также содержали варьирующие концентрации DDAIP (1, 1,5, 2 и 2,5 вес.%) вместе с контрольной композицией, которая не содержала DDAIP, а также с мазью ТАКЛОНЕКС® (TACLONEX®). Оценивали проникновение кальципотриена, клобетазола и бетаметазона. Полученные результаты показаны в таблицах 4 и 5, а также на фиг.1, 2, 3 и 4. Числовые значения, приведенные в таблицах 4 и 5, а также на соответствующих чертежах, даны в единицах нанограммов растворенного вещества на квадратный сантиметр кожи (нг/см2). На фиг.1 показан график, демонстрирующий кумулятивное проникновение кальципотриена через кожу уха свиньи, применительно к количеству композиции, которое имелось на коже в определенный момент времени, в сравнительном аспекте для указанной композиции, содержащей кальципотриен/бетаметазон, и для мази ТАКЛОНЕКС® (TACLONEX®). На фиг.2 показан график, демонстрирующий кумулятивное проникновение бетаметазона через кожу уха свиньи, применительно к количеству композиции, которое имелось на коже в определенный момент времени, в сравнительном аспекте для указанной композиции, содержащей кальципотриен/бетаметазон, и для мази ТАКЛОНЕКС® (TACLONEX®). На фиг.3 показан график, демонстрирующий кумулятивное проникновение кальципотриена через кожу уха свиньи, применительно к количеству композиции, которое имелось на коже в определенный момент времени, для композиций, содержащих кальципотриен/клобетазол. На фиг.4 показан график, демонстрирующий кумулятивное проникновение клобетазола через кожу уха свиньи, применительно к количеству композиции, которое имелось на коже в определенный момент времени, для композиций, содержащих кальципотриен/клобетазол.
Данные, показанные в таблице 4 и на фиг.1 и 2, четко демонстрируют, что DDAIP в диапазоне концентраций 1,5-2,5 % обеспечивают неожиданно повышенный эффект с точки зрения проникновения кальципотриена во всех оцениваемых временных точках в сравнении с композицией, не содержащей DDAIP, как и в сравнении с мазью ТАКЛОНЕКС® (TACLONEX®), которая содержит в качестве растворителя сложный эфир поли(алкиленгликоля). Аналогично, композиция, содержащая 1% DDAIP, также демонстрировала неожиданное повышение проникновения кальципотриена при оценке в период времени от 24 до 96 часов, в сравнении с композицией, не содержащей DDAIP, и с мазью ТАКЛОНЕКС® (TACLONEX®). Композиция, содержащая 2% DDAIP, характеризовалась приблизительно в 7,1 раз более высокой проникающей способностью кальципотриена в сравнении с композицией, которая не содержала DDAIP, и характеризовалась проникновением, которое в 1,9 раз превышало этот показатель для мази ТАКЛОНЕКС®.
Данные, показанные в таблице 5 и на чертежах 3 и 4 четко демонстрируют, что DDAIP в диапазоне концентраций 1-2,5% обеспечивают неожиданный повышенный эффект с точки зрения проникновения кальципотриена во всех оцениваемых временных точках в сравнении с композицией, не содержащей DDAIP, аналогично такому эффекту повышения, который наблюдался для композиций, содержащих бетаметазон. Проникновение клобетазола также значительно повышалось в присутствии DDAIP. Присутствие DDAIP в концентрации 2% обеспечивало уровень проникновения клобеталоза через 120 часов, который приблизительно в 2,8 раз превышал соответствующий уровень проникновение для клобетазола в композиции, не содержащей DDAIP. Присутствие 1,5% DDAIP обеспечивало такой уровень проникновения кальципотриена через 120 часов, который приблизительно в 7,7 раз превышал соответствующий показатель для кальципотриена в случае композиции, не содержащей DDAIP.
Приведенные выше примеры были даны лишь в качестве иллюстрации предпочтительных вариантов осуществления настоящего изобретения, и их не следует трактовать в плане какого-либо ограничения области настоящего изобретения.
Реферат
Изобретение относится к медицине и описывает неводную мазь, включающую соединение витамина D, кортикостероид и сложный эфир N,N-ди(C-C)алкиламино-замещенной (C-C)алкил(C-C)карбоновой кислоты в вазелине, необязательно содержащую минеральное масло и токоферол. Мазь характеризуется стабильностью при хранении и повышенным проникновением кортикостероида в кожу. 3 н. и 20 з.п. ф-лы, 4 ил., 5 табл., 3 пр.
Формула
соединение витамина D;
кортикостероид и
сложный эфир N,N-ди(C1-C8)алкиламино-замещенной (C4-C18)алкил(C2-C18)карбоновой кислоты;
в вазелине в качестве носителя, необязательно содержащая минеральное масло, токоферол или сочетание минерального масла и токоферола.
(a) от 0,001 до 0,01 весовых процентов соединения витамина D;
(b) от 0,01 до 0,1 весовых процентов кортикостероида;
(c) от 0,001 до 0,01 весовых процентов токоферола и
(d) от 0,1 до 5 весовых процентов сложного эфира N,N-ди(C1-C8)алкиламино-замещенной (C4-C18)алкил(C2-C18)карбоновой кислоты, сложный эфир (C1-C8)алкил(C8-C22)карбоновой кислоты в вазелиновом носителе и необязательно содержащая минеральное масло.
(a) от 0,001 до 0,01 весовых процентов кальципотриена;
(b) от 0,01 до 0,1 весовых процентов кортикостероида, выбранного из группы, состоящей из пропионата клобетазола и дипропионата бетаметазона;
(c) от 0,001 до 0,01 весовых процентов токоферола; и
(d) от 0,1 до 5 весовых процентов додецил-2-(N,N-диметиламино)пропионата (DDAIP);
в вазелиновом носителе и содержащая до 10 весовых процентов минерального масла.
Документы, цитированные в отчёте о поиске
Фармацевтическая композиция

Комментарии