Средство для доставки, обеспечивающее непрерывноеи/или регулируемое высвобождение биологически активных агентов - RU2208582C2
Код документа: RU2208582C2
Чертежи


Описание
Область
техники
Настоящее изобретение относится к материалам, представляющим собой ксерогели двуокиси кремния (силикаксерогелям) с регулируемой способностью к растворению, полученным в результате
превращения
золя в гель, и их применению. В частности, настоящее изобретение относится к частицам небольшого диаметра из ксерогеля двуокиси кремния с регулируемой растворимостью, полученным в
результате процесса
образования геля из золя, при котором гелеобразование и испарение растворителя происходят одновременно. Более конкретно изобретение относится к частицам небольшого диаметра из
ксерогеля двуокиси
кремния с регулируемой растворимостью, полученным в процессе образования геля из золя, при котором гелеобразование и испарение растворителя производятся методом распылительной
сушки или приемами
тонковолокнистого прядения или волочения. Кроме того, изобретение относится к ксерогелям двуокиси кремния с регулируемой растворимостью, полученным в процессе образования геля из
золя, в качестве
средств для доставки, обеспечивающим непрерывное и/или регулируемое высвобождение биологически активных веществ, особенно лекарств, белков или гормонов, и фармацевтическим
композициям, включающим
указанные средства. Далее изобретение относится к формам указанных средств, пригодным для имплантации и трансмукозального использования. И, наконец, изобретение относится к
пригодным для имплантации
медицинским средствам, содержащим ксерогели двуокиси кремния с регулируемой растворимостью, полученные в процессе образования геля из золя, которые могут дополнительно
содержать биологически активное
средство.
Предшествующий уровень техники.
Ксерогели двуокиси кремния являются частично гидролизованными оксидами кремния. Гели гидролизованных оксидов можно получить в процессе гелеобразования из золя, с помощью которого с давних пор обычно изготавливали керамику и стекло.
Процесс получения геля из золя
основан на гидролизе металл-алкоксида и
последующей полимеризации гидроксидов металла, как показано ниже:
1) Si(OR)4+Н2O--> HO-Si(OR)3+ROH
2)
HO-Si(OR)3+3H2
O+ROH --> Si(ОН)4+4ROH
3) Si(ОН)4+Si(ОН)4 --> (HO)3Si-O-Si(OH)3+H2O
Если реакция полимеризации
продолжается далее, образуются дополнительные цепочки, кольцевые и трехмерные структуры, а также гель, содержащий воду, спирт как производное алкоксигруппы, и
собственно гель. Золь может содержать
также другие добавки, такие как кислоты или основания, используемые для катализа реакции. Если на данной стадии из геля удалить спирт и воду промывкой или
выпариванием, то получается ксерогель.
Во время высушивания происходит большая усадка (сморщивание) геля, порождающая в нем внутренние напряжения. Если монолитному гелю не обеспечено достаточного периода времени для уменьшения внутренних напряжений, он даст трещины. В процессе высушивания происходит дальнейшая полимеризация за счет оставшихся ОН-групп. Непрерывная полимеризация идет в течение продолжительного времени после застудневания. Это называется старением. По мере продолжения полимеризации гель или ксерогель становятся все более стабильными. Однако при комнатной температуре полимеризация после нескольких недель старения прекратится, а ксерогель не станет полностью инертным. Если температуру повысить, реакцию полимеризации можно ускорить, далее наступит стабилизация и сморщивание и внутри ксерогеля возникнут более глубинные напряжения.
Если температура повышается достаточно высоко (около 1000oС для монолитных Si-гелей), гель или ксерогель будут представлять собой только оксид, и в нем будут отсутствовать ОН-группы. Однако в случае чистых оксидов скорость реакции экстремально низка. Если оксиды включают и другие ионы, например Na, К, Мg или Са, скорость реакции может быть в большой степени увеличена. Так называемые биоактивные стекла получили свое развитие из этих систем. Скорость растворения этих стекол зависит от состава и площади поверхности стекла.
Эти стекла плавятся при температуре свыше 1000oС.
Основные принципы соединения органических веществ с гелями хорошо известны. Основная идея состоит в том, что органическое вещество добавляют к золю при получении геля из золя. Затем после желатинизации органическая часть становится неотъемлемой составляющей полученного в результате материала. В обычно используемых процессах плавки стекла такой прием совершенно неприемлем из-за чрезвычайно высоких температур, не обеспечивающих сохранности органических веществ.
Температура спекания, естественно, является ограничительным фактором также для различных веществ в силикатах, модифицированный органикой (ORMOSILS). Применительно к лекарствам температура спекания ограничена разрушением структуры или функциональных свойств лекарственных средств. Для белков, ферментов, антител и целых клеток предел температуры спекания 40oС, т.к. они начинают коагулировать при этой и более высокой температуре.
Органические вещества включаются в силикагели в основном для модифицирования природных свойств силикатов этими органическими веществами. Некоторые комбинации вводимых веществ и матриц (носителей), используемые ныне, описаны в Chemistry of Materials (1994) 6:1605-1614 (D.Avnir et al.).
Материалы на основе золей и гелей Si, используемые для лекарственных средств кратковременного орального предназначения (менее 24 часов), и способы смешивания лекарственного средства с вязким золем двуокиси кремния были описаны в Drug Development and Industrial Pharmacy (1983) 9 (1&2):69-91 (К. Unger et al. ). В статье описан способ поликонденсации в растворе, который начинается со смешивания полиэтоксисилоксана (PES) с лекарством, растворенным в соответствующем растворителе, обеспечивающий удерживание молекул лекарства полимером. Скорость выхода лекарства из полимера определяется диффузией через поры материала носителя.
В опубликованной заявке ЕР 0680753 описаны покрытия из двуокиси кремния, полученные в результате гелеобразования из золя, и частицы, содержащие биологически активное вещество, в котором скорость активного начала регулируется добавлением проникающих агентов, таких как полиэтиленгликоль или сорбитол.
В опубликованной заявке WO 96/03117 обсуждаются носители с регулируемой скоростью выделения веществ, биоактивных по отношению к костной системе, содержащие стекло, основой которого является кремнезем, обеспечивающие контролируемое выделение биологически активных молекул, способы их получения и способы применения. Заявлено, что эти носители получают на основе процесса превращения золя в гель.
Краткое изложение изобретения.
Объектом настоящего изобретения являются ксерогели двуокиси кремния с регулируемой растворимостью, полученные в результате образования геля из золя. Другой объект изобретения - частицы небольшого диаметра из ксерогеля двуокиси кремния с регулируемой растворимостью, полученные в результате процесса образования геля из золя, в котором гелеобразование и испарение растворителя происходят одновременно. В частности, настоящее изобретение обеспечивает частицы небольшого диаметра из ксерогеля двуокиси кремния с регулируемой растворимостью, полученного в процессе образования геля из золя, в котором гелеобразование и испарение растворителя производятся методом распылительной сушки или приемами тонковолокнистого прядения или волочения.
Другим объектом изобретения являются средства для доставки биологически активных агентов, обеспечивающие их непрерывное и/или регулируемое выделение, в частности лекарств, белков или гормонов, и представляющие собой ксерогель двуокиси кремния с регулируемой растворимостью, полученный в процессе образования геля из золя, а также фармацевтические препараты, содержащие указанные средства. В частности, настоящее изобретение относится к средствам для доставки биологически активных агентов, обеспечивающим их непрерывное и/или регулируемое выделение, представляющим собой частицы небольшого диаметра из ксерогеля двуокиси кремния с регулируемой растворимостью, полученные в процессе образования геля из золя, в котором гелеобразование и испарение растворителя происходят одновременно, и биологически активный агент, отличный от ксерогеля диоксида кремния, включенный в структуру ксерогеля диоксида кремния путем добавления указанного биологически активного агента, и фармацевтическим препаратам, содержащим указанные средства. Причем указанный агент может быть добавлен к реакционной смеси на стадии золя получения ксерогеля диоксида кремния. Еще один объект изобретения - способ введения биологически активного средства в организм человека или животного, который включает имплантирование, инъекцию или приложение трансмукозально к телу человека или животного средства доставки, состоящего согласно изобретению из ксерогеля двуокиси кремния с регулируемой растворимостью, в структуру которого включен биологически активный агент.
Другой объект изобретения - пригодное к имплантации средство лекарственного назначения, содержащее ксерогель двуокиси кремния с регулируемой растворимостью, полученное в результате превращения золя в гель, которое может дополнительно содержать биологически активный агент.
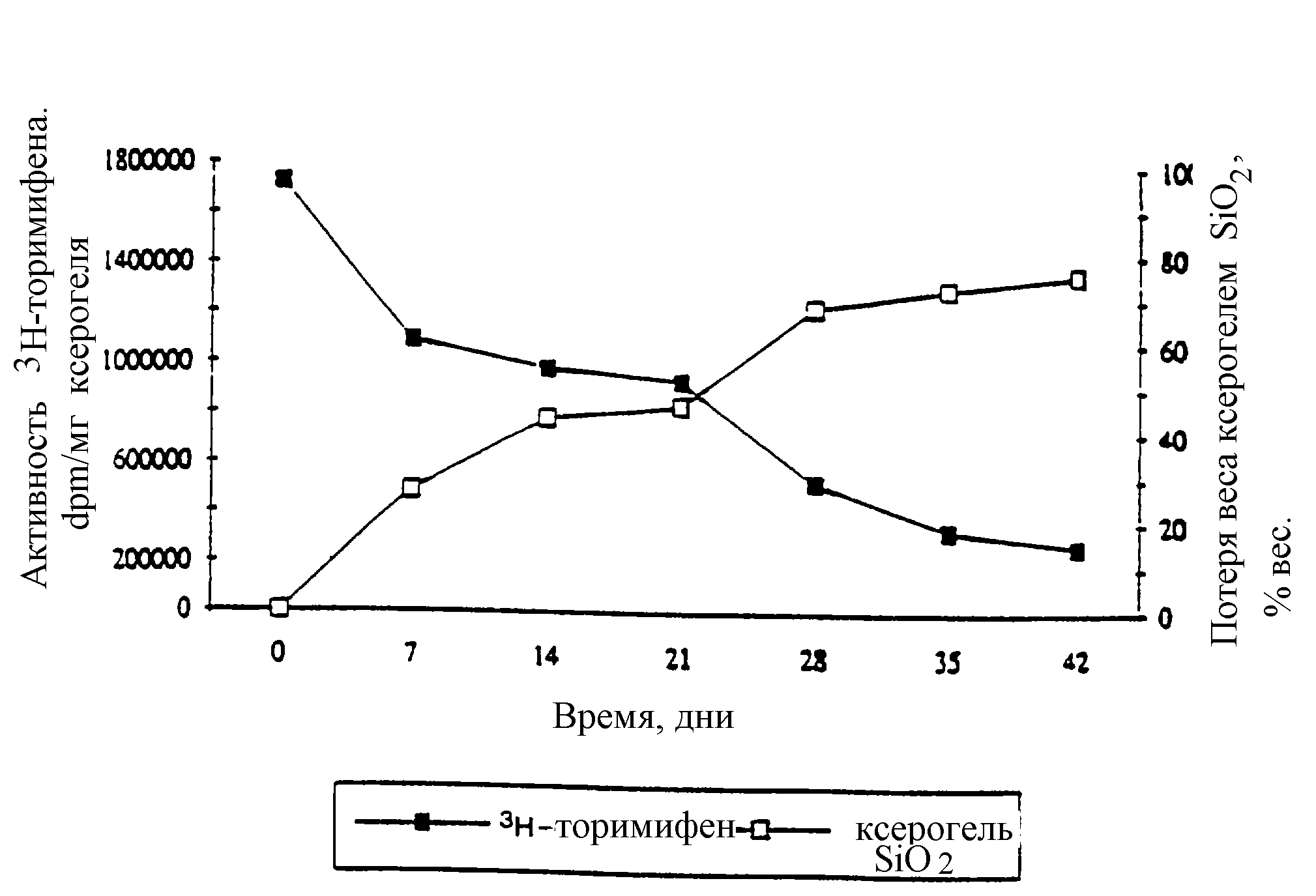
На чертеже графически показаны в процентах доля сохраняющегося имплантата из ксерогеля двуокиси кремния и активности3H-торемифена в различные периоды времени при эксперименте in vivo, описанном в примере 5.
Описание
изобретения
Заявители обнаружили, что ксерогели
двуокиси кремния, полученные превращением золя в гель,
и частицы небольшого диаметра из ксерогеля двуокиси кремния, полученного превращением
золя в гель, когда гелеобразование и испарение
растворителя происходят одновременно, растворяются в течение
продолжительного периода времени (более 24 часов) и этот процесс можно контролировать.
Далее выделение биологически активных агентов,
включенных в структуру ксерогеля двуокиси кремния, также
происходит в течение продолжительного периода времени и также может регулироваться.
Следовательно, ксерогели двуокиси кремния данного
изобретения могут использоваться как средства пролонгирования
действия биологически активных агентов. Таким образом, они могут использоваться как
средства направленного транспорта или лекарственные
препараты, которые, например, имплантированы, или инъецированы,
или трансмукозально введены в тело человека или животного. Возможно введение
внутрь любой ткани (внутрь мягких тканей или кости). Это
позволяет применять их местно (наружно), так что возможен
направленный транспорт биологически активного агента в определенную точку-мишень.
Следовательно, от биологически активного агента получают
максимальный эффект.
Средство направленного транспорта или лекарственное средство может быть введено подкожно, внутримышечно, внутрикостно, в полости рта, носа, матки и внутрь любой больной ткани. Трансмукозально прикрепленными средствами направленного транспорта или лекарственными средствам могут быть частицы в форме шариков, вводимые в виде спрея в полость носа или в область языка, где они растворяются и обеспечат выделение биологически активного агента. Аналогично частицы небольшого размера могут быть инъецированы в ткани в среде жидкого носителя.
Установлено, что ксерогели двуокиси кремния данного изобретения могут использоваться как пригодные для имплантации лечебные средства. Лечебное средство данного изобретения может быть имплантировано в любую ткань, или введено трансмукозально, или путем инъекции в организм человека или животного. Ксерогели двуокиси кремния согласно изобретению полностью растворяются в течение желаемого периода времени в процессе контакта с жидкостями организма. Таким образом, средства направленного транспорта и лечебные средства данного изобретения растворяются полностью и их растворимость поддается регулированию.
В этой связи средства направленного транспорта представляют собой ксерогель двуокиси кремния с включенным в его структуру биологически активным агентом. Фармацевтический препарат, такой как гранула или капсула, в этом смысле представляет собой препарат, содержащий средство направленного транспорта и, возможно, дополнительные инертные наполнители, используемые в фармацевтических препаратах. Лечебное средство данного изобретения также может использоваться в ортопедии и хирургии, что не требует включения в структуру ксерогеля биологически активного агента. Лечебное средство может представлять собой, например, тканую и нетканую салфетку, изготовленную из волокон ксерогеля двуокиси кремния.
Было установлено, что материал из заявленного в изобретении ксерогеля двуокиси кремния является весьма биосовместимым. Другими словами, он не оказывает вредного воздействия на окружающую ткань, например не вызывает воспалительной реакции.
Ксерогель двуокиси кремния настоящего изобретения обладает растворимостью, которую можно регулировать, и выделение биологически активного агента из ксерогеля данного изобретения основывается на этом растворении, которое и обеспечивает непрерывное локальное выделение биологически активного агента в ткани. Скорость выделения биологически активного агента можно регулировать, варьируя условия гелеобразования, например температуру распылительной сушки. Также и другие факторы, например отношение площади поверхности к объему в материале, элементный состав ксерогеля двуокиси кремния, размер геля, позволяющие вырабатывать ксерогели двуокиси кремния без дефектов, регулируют скорость выделения биологически активного агента.
Матрица из ксерогеля двуокиси кремния с включенным в нее биологически активным агентом растворяются медленно, когда диаметр частиц ксерогеля порядка около 1-500 мкм. Если диаметр частиц больше, скорости растворения матрицы и активного агента также возрастают.
Биологически активный агент может быть любым органическим или неорганическим веществом, которое биологически активно. Биологически активным агентом может быть, например, лекарство, белок, гормон, живая или мертвая клетка, бактерия, вирус или их часть. Биологически активные агенты включают такие вещества, которые, в частности, применяются для долговременной терапии, например гормонального лечения, например контрацепции и гормональной заместительной терапии, и для лечения остеопороза, рака, эпилепсии, болезни Паркинсона, болевых симптомов и расстройств памяти. Пригодными биологически активными агентами могут быть, например, противовоспалительные средства, противоинфекционные (например, антибиотики и антивирусные агенты, такие как глиндамицин, миконазол), анальгетики и анальгетические средства, антиастматические средства, противосудорожные средства (например, оксикарбазепин), антидепрессанты, антидиабетические средства, антинеопластики, противоопухолевые средства (например, торемифен, тамоксифен, таксол), антипсихотические, антиспазматические, антихолинергические средства, симпатомиметики, кардиоваскулярные препараты, антиаритмические, антигипертензивные средства, диуретики, вазодиляторы, лекарства для ЦНС (центральной нервной системы), такие как лекарства против болезни Паркинсона (например, селеджилин), стероидные гормоны (например, эстрадиол, прогестерон, несторон), седативные средства (например, антипамезол, дексмедетомидин, левомедетомидин), транквилизаторы и лекарства, применяемые при расстройствах памяти. Лекарство может быть в форме соли, как, например, гидрохлорид селеджилина, гидрохлорид (-)-4-(5-фтор-2,3-дигидро-1Н-инден-2-ил)-1H-имидазола, гидрохлорид 4-(5-хлор-2,3-дигидро-1Н-инден-2-ил)-1H-имидазола, гидрохлорид дексмедетомидина и цитрат торемифена или его кислотно-аддитивной соли. Лекарство может быть также в форме свободной кислоты, как, например, ибупрофен; свободного основания, как, например, кофеин или миконатзол; или нейтрального соединения, такого как 2-2-(4-(4-хлор-1,2-дифенил-бут-1-енил)фенокси)этанол. Пептид может быть, например, леводопа, а белок может быть, например, производным межклеточного вещества ткани зубной эмали или морфогенетическим белком кости. Эффективное количество биологически активного агента может быть добавлено в реакционную смесь на любой стадии процесса. Тем не менее, предпочтительно биологически активный агент добавлять в реакционную смесь на стадии превращения золя в гель перед тем, как произойдет реакция поликонденсации (золь-стадия), или смешивать его с исходными материалами. Точное количество, используемое в конкретной ситуации, зависит от множества факторов, таких как способ введения, тип млекопитающего, условие, при котором вводится биологически активный агент, особенности используемого биологически активного агента, желаемая продолжительность его действия и т.д. Количество цитрата торемифена в ксерогеле двуокиси кремния может варьировать от около 1% вес. до 40% вес.
Ксерогели двуокиси кремния с регулируемой растворимостью данного изобретения могут быть приготовлены взаимодействием алкоксида двуокиси кремния, такого как тетраэтилортосиликат (ТЭОС) с водой и необязательно растворителем, таким как этанол или этиленгликоль, или комбинацией растворителей при низких температурах, например, -20-100oС, предпочтительно при комнатной температуре в присутствии подкислителей, например уксусной кислоты или основного катализатора, что приводит к гидролизу (образуется золь) и поликонденсации (образуется гель). Катализатор следует выбирать не оказывающий вредного действия на биологически активный агент.
В противоположность приготовлению монолитных ксерогелей двуокиси кремния и покрытий из нее при производстве ксерогельных частиц малого диаметра, например, методом распылительной сушки или методом тонковолокнистого прядения или волочения образование геля из золя и испарение растворителя происходят одновременно, образуя частицы малого диаметра и регулируемой растворимостью, такие как волокна или шарики. Если гелеобразование заканчивается прежде, чем испарится растворитель, образовавшийся гель представляет собой монолитный кусок, простирающийся от одной стенки контейнера до другой. В настоящем изобретении, напротив, при одновременном гелеобразовании и испарении растворителя, например, методом распылительной сушки или методом тонковолокнистого прядения или волочения испарение растворителя из золя заставляет уже образовавшиеся коллоидные гелевые частицы, имеющие наноразмеры, уплотняться и сближаться друг с другом и заставляет их взаимодействовать друг с другом таким образом, чтобы это приводило к образованию из ксерогеля частиц двуокиси кремния.
В настоящем изобретении показано, что если гель получен в форме частиц малого диаметра, таких как шарики и волокна, то внутренние напряжения в нем, возникающие в результате сушки, практически полностью отсутствуют, и частицы способны к медленному рассасыванию.
Таким образом, медленно рассасывающиеся материалы отныне можно получать при низких температурах вообще без необходимости спекания, что позволяет использовать в качестве их ингредиентов органические вещества.
Высушенные и/или частично подвергнутые спеканию гели, например ксерогели, содержащие SiO2, модифицированы ОН-группами, что разрушает сплошную пространственную структуру кремнезема. Для того чтобы растворить эти оксиды, необходимо нарушить гидролизацию связей между атомом кислорода и атомом металла, чтобы атом водорода занял место атома металла. Так что пространственная структура оксида металла уже не становится сплошной. Процесс гидролиза может идти повсеместно, разрушая одну за другой все связи атомов металла с атомами кислорода до тех пор, пока весь оксид не растворится. Успешность растворения ксерогелей зависит от нескольких условий. Температура спекания или высушивания является параметром, который оказывает влияние на скорость растворения материала. Повышенная температура спекания повышает скорость реакции поликонденсации и конечное состояние. Другие условия, от которых зависит реакция поликонденсации, такие как молярное соотношение ТЭОС:Н2O, рН золя двуокиси кремния, старение, скорость гелеобразования, форма, например толщина геля, и высушивание, имеют второстепенное влияние на режим растворения гелей, подвергнутых спеканию при низкой температуре (ниже 300oС). Далее различные добавки, такие как полиэтиленгликоль или сорбитол, которые используются как агенты проникания, также оказывают незначительное влияние на скорость выделения биоактивного агента. Состав геля также оказывает влияние на режим растворения особенно материалов, подвергнутых спеканию при температуре свыше 200oС. Состав ксерогеля может быть модифицирован такими элементами, как Na, Са, Р, К, Мg, Сl, Аl, В, Ti, N, Fe и С.
На пористость и площадь поверхности ксерогеля двуокиси кремния могут влиять температура спекания и добавки. При условии спекания при одной и той же температуре различные сочетания добавок оказывают большое влияние на пористость и площадь поверхности. Однако такое изменение оказывает весьма незначительное влияние на скорость растворения ксерогелей, полученных при комнатной температуре. Скорости растворения ксерогелей, полученных при высоких температурах (500-1100oС), будут сильно зависеть от этих факторов.
Вместо этого, по-видимому, диаметр единичной гелевой частицы и способ производства оказывают глубокое влияние на скорость растворения ксерогеля. Частицы силикагеля можно изготавливать различными путями. Традиционным дроблением получают частицы, которые растворяются с той же скоростью, что и исходная масса материала в расчете на единицу площади поверхности. В WO 9603117 описано выделение ванкомицина из дробленых частиц ксерогеля двуокиси кремния размером 500-700 μм. Выделение было очень быстрым, и большая часть включенного ванкомицина (около 90%) выделилась в течение первого дня. Напротив, если, например, золь высушен распылением с получением частиц (с размерами менее 200 μм)) при комнатной температуре, и его хранили в эксикаторе в течение 2 месяцев, выделение включенного лекарства будет непрерывным, и полное растворение продлится в течение 6 дней. Скорость растворения полученных распылительной сушкой частиц, по-видимому, будет в шесть раз медленнее, чем скорость растворения in vitro частиц, полученных дроблением.
В настоящем изобретении частицы и шарики из силикагеля получают распылительной сушкой при температуре, превышающей точку плавления золя двуокиси кремния. Во время распыления в воздухе маленькие капельки высыхают в атмосфере настолько, что таким образом происходит желатинизация гидролизованных ионов двуокиси кремния и образование коллоидных гелевых частиц. Если капельки ударяются о поверхность, когда они еще не высохли, они образуют псевдосферы, что обусловлено различиями в поверхностной энергии капель и поверхности, на которую они попадают. В таком случае они застынут как псевдосферы. Застывшие в гель частицы получают тепловую обработку и стареют при комнатной температуре, что приводит в дальнейшем к полимеризации ОН-групп. Эти условия теплообработки и старения значительно замедляют растворение частиц. В частицы могут быть включены ионы, такие как Na, К, Р, Са, Мg, Аl и В, для того, чтобы получить частицы, способные к растворению и/или биоактивные с точки зрения укрепления кости.
Распылительная сушка при комнатной температуре гелевых частиц, не содержащих биологически активного агента, и старение их в эксикаторе обеспечивает получение гомогенных бездефектных медленно растворяющихся частиц. Эти частицы равномерно растворяются при скорости 1,9% вес. в неделю. Полученные при распылительной сушке частицы, содержащие биологически активный агент, показывают равномерное выделение двуокиси кремния со скоростью 22,4% вес. в неделю. Микросферические частицы (< 50 μм), содержащие 10% вес. биологически активного агента, полученные в распылительной мини-сушилке (Buchi, Швейцария) при 132oС, растворяются со скоростью 77,3% вес. в неделю. Без биологически активного агента скорость растворения согласно измерениям составляла 5,8% вес. в неделю.
Волокнистый ксерогель двуокиси кремния, обладающий регулируемой растворимостью, можно получить методом прядения золя с последующим старением или термообработкой нагреванием при невысоких температурах. Температура при этом должна быть приближена к комнатной. Методы получения волокон дают гомогенные и бездефектные материалы. Волокна ксерогеля двуокиси кремния, полученные с помощью прядильного устройства для стекловаренного порошка и выдержанные в эксикаторе в течение четырех месяцев, становятся материалами, которые растворяются со скоростью 2,5% вес. в неделю. В волокна могут быть включены такие ионы, как Na, К, Р, Са, Мg, Аl и В с целью получения волокон, обладающих растворимостью и/или биоактивностью в отношении укрепления костей.
Тканые и нетканые салфетки, изготовленные из волокон ксерогеля двуокиси кремния данного изобретения, могут использоваться для отделения двух или более типов тканей друг от друга. Они могут также использоваться как прокладки для восстановления костной ткани. Весьма удобно, если основа ткани растворима, тогда нет необходимости в дополнительной операции по ее удалению. Было установлено, что не подвергнутые спеканию, а подвергнутые старению волокна данного изобретения показывают скорости растворения, приемлемые для такого рода использования (10% вес. в неделю).
Костный фильтр-приемник представляет собой лечебное средство, помещаемое на всасывающую трубочку, которое удаляет остатки клеток и избыток жидкостей из места операции. Когда хирург сверлит, распиливает, стачивает или иным образом работает над костной тканью, осколки кости должны быть собраны с помощью фильтра и возвращены в место повреждения. До сих пор такие фильтры не были растворимы в ткани. Если эти фильтры изготовить из волокон или частиц, полученных гелеобразованием, то они будут обладать растворимостью и могут включать биологически активный агент. Таким образом, весь фильтр целиком может быть погружен в место повреждения, содержащее обломки кости.
Имплантаты, изготовленные из волокнистых материалов на основе ксерогеля двуокиси кремния, обладают гибкостью и растворимы.
Полимолочная кислота, полигликолевая кислота и поликапролактон являются деградирующими полимерами, используемыми в медицине, которые, однако, требуют укрепления (армирования) и поддерживания определенного усилия в течение достаточно долгого времени, когда деградация уменьшает прочность матрицы. Регулируемая растворимость волокон и частиц геля двуокиси кремния, описываемых в данном изобретении, делают их идеальными для решения этой задачи, так как они обладают достаточным сопротивлением и регулируемой скоростью растворения. Они могут использоваться также для укрепления пластиковых упаковочных материалов, которые выполнены из полимолочной кислоты, крахмала или любого другого биодеградируемого полимера.
Ксерогели двуокиси кремния данного изобретения, обладающие регулируемой растворимостью и полученные превращением золя в гель, могут использоваться как субстраты при выращивании клеток в форме мембран или покрытий, которые выполнены из волокон или частиц, полученных распылительной сушкой.
Нижеследующие примеры предназначены для иллюстрации изобретения и не должны рассматриваться как ограничивающие его объем.
Пример 1
Получение монолита ксерогеля
двуокиси кремния
Золь для монолитного силикагеля готовили из ТЭОС,
дистиллированной воды и СН3СООН в соотношении 1:14,2:0,5.
Поли-этиленгликоль использовался как добавка в
указанном соотношении, соответствующая 0,005 (средний молекулярный вес 10000) или 0,
012 (средний молекулярный вес 4600).
Ксерогели двуокиси кремния готовили гидролизом и поликонденсацией ТЭОС с добавлением или без полиэтиленгликоля и воды при комнатной температуре. Небольшое количество катализатора (уксусная кислота) добавили для ускорения реакции. К чистому гидролизованному раствору добавили кристаллы лекарства, и золь двуокиси кремния был вылит в ячейки пластины микротитратора и выдержан при 40oС в печи для гидролиза, поликонденсации и старения в течение 18 часов. Подвергнутые старению силикагели были вымочены в воде в течение двух дней, чтобы удалить остаточные органические вещества внутри геля, и обезвожены при 40oС до постоянного веса в течение нескольких дней с получением ксерогеля двуокиси кремния, содержащего включенное в его структуру лекарство. Фракция ксерогелей двуокиси кремния была подвергнута спеканию при температуре от 80oС до 120oС (2oС/час, 2 часа при 80o С/120oС). Цитрат торемифена использовался в качестве модельного лекарственного средства в опытах, в которых оценивали влияние ПЭГ, температуры спекания и содержание лекарства при скорости выделения лекарства и кремнезема из матрицы.
Исследование растворения in
vitro
Кривые растворения цитрата торемифена и двуокиси кремния из ксерогеля изучали с помощью аппарата
II для растворения USP XXII (метод лопастного перемешивания,
Sotax АТ6, Базель,
Швейцария) при постоянной температуре (37oС). Смоделированная основная жидкость (SBF, рН 7,4), содержащая 0,
5% (масса/объем) додецилнатрий-сульфата, использовалась как
среда растворения.
SBF готовили растворением реагентных сортов NaCl (136,8 мМ), NаНСО3 (4,2 мМ), КСl (3,0 мМ), K2
HPO4•3Н2О (1,0 мМ), MgCl2
•6Н2О (1,5 мМ), CaCl2•2H2O (2,5 мМ) и Na2SO4 (0,5 мМ) в
дистиллированной воде. рН доводили до 7,4 с помощью
трис-(гидроксиметил)-аминометана (50
мМ) и соляной кислоты.
Объем среды растворения был 250 мл. Интенсивность перемешивания была 50 об/мин и температура была 37oС.
Величины поглощения растворенных образцов измеряли УФ-спектрофотометром (Hewlett Packard 845/A, США) при максимуме абсорбции цитрата торемифена (A278). Растворенный силикагель определяли спектрофотометрически как SiO2 - молибден голубой комплекс при А820 (Koch and Koch-Dedic, 1974).
Пористость
Пористость образцов ксерогеля
двуокиси
кремния измерялась с помощью прибора для определения пористости при высоком давлении (автоскан 33, Quantachrome Corp., США). Измеренный
размер пор составлял от 6,5 нм до 14 μм.
Результаты
Цитрат торемифена добавляли в реакционную смесь в виде кристаллических частиц, и он казался молекулярной дисперсией в
матрице силикагеля. Концентрация добавленного цитрата
торемифена в золе двуокиси кремния варьировала от 1,9 до 5,5% вес. (что соответствовало приблизительно 11,5-34,4% вес. лекарства в высушенном на
воздухе геле). Большие количества цитрата торемифена
осаждались в процессе гелеобразования при 40oС.
Влияние такого параметра как содержание лекарства изучали на силикагелях, подвергнутых спеканию (120oС), содержащих 11,5, 22,9 и 34,4% вес. цитрата торемифена. Кривая, показывающая выделение цитрата торемифена, имела линейный характер согласно кинетике выделения нулевого порядка. Выделение цитрата торемифена было более медленным из ксерогелей двуокиси кремния, содержащих 11,5% вес. (0,05%/мг /час) и более быстрым из ксерогелей с 34,4% вес. лекарства (0,11% вес. /мг /час). Кремнеземная матрица растворялась в соответствии с кинетикой выделения нулевого порядка.
Ксерогели двуокиси кремния, полученные спеканием при повышенных температурах, не показали какого-либо значительного эффекта при исследовании скорости выделения цитрата торемифена или двуокиси кремния.
Unger и сотр. показал, что водорастворимые полимеры, такие как полиэтиленоксиды усиливают высвобождение лекарств из поликонденсированных силикагелей. Однако выделение цитрата торемифена или кремнезема из кремнезем-ксерогельных цилиндров не увеличивалось в результате добавления полиэтиленгликоля. Фактически выделение цитрата торемифена и кремнезема происходило наиболее быстро из ксерогелей двуокиси кремния в отсутствие полиэтиленгликоля. Цитрат торемифена выделяется равномерно со скоростью 0,16%/мг /час, а кремнезем - 0,31%/мг /час. Из ксерогелей двуокиси кремния, содержащих ПЭГ 4600, цитрат торемифена выделяется равномерно со скоростью 0, 13%/мг /час, а из ксерогелей, содержащих ПЭГ 10000, со скоростью 0,1%/мг /час. Аналогично растворение кремнезема было наиболее быстрым из ксерогеля без добавок ПЭГ, скорость 0,31%/мг /час. Из ксерогелей, содержащих ПЭГ 4600, кремнезем выделялся равномерно со скоростью 0,24%/мг /час, а из ксерогелей с ПЭГ 10000 - со скоростью 0,16%/мг /час.
Была установлена связь между выделением кремнезема и цитрата торемифена, заключающаяся в том, что выделение цитрата торемифена главным образом зависит от растворения ксерогельной матрицы (rзнач=0,995).
По-видимому,
добавление
ПЭГ уменьшает общий объем пор и площадь поверхности пор, особенно в образцах, подвергнутых спеканию при 120oС. В более раннем исследовании водорастворимые полимеры
использовались в
процессах гелеобразования из золей для регулирования распределения размеров пор (Sato et al. , J. Mat. Sci. 25, 4880-85, 1990). Согласно этой работе ПЭГ уменьшал площадь поверхности
и
уменьшал размер
пор (таблица 1)
Гидрохлорид селеджилина, гидрохлорид (-)-4-(5-фтор-2,3-дигидро-1Н-инден-2-ил)-1H-имидазола, гидрохлорид дексмедетомидина, ибупрофен и кофеин могут также
быть
включены в золь
двуокиси кремния, полученный, как указано выше. Пептиды (леводопа) и белки (производное основы зубной эмали) также могут быть включены в вышеупомянутый золь двуокиси кремния.
Пример
2
Изготовление волокон ксерогеля двуокиси кремния
Золь для получения волокон путем вытягивания готовили из ТЭОС, дистиллированной воды, НNО3 и этанола,
взятых в
соотношении 1:2,0:0,036:1,0. Перед вытягиванием волокон золю давали возможность образовывать коллоидные гелевые частицы в течение 1 часа при 75oС. Волокна ксерогеля получали из
золя,
используя аппарат для тонковолокнистого прядения стекловаренного порошка. Волокна вытягивали в этом аппарате, где происходила поликонденсация при 75oС. Установлено, что в начале
процесса
вытягивания волокон вязкость золя составляла приблизительно 10 мПа•с. Волокна помещали в водный раствор на период 48 часов и до 4 месяцев. В дополнение к выдержке волокон при
комнатной
температуре их также обрабатывали при 300oС и 700oС (скорость нагревания 10oС/час, 2 часа при максим. температуре). Волокна растворяли в водном
трис-метиламинометан-HCl-буфере или смоделированной основной жидкости (рН 7,54, 23oС; рН 7,40, 37oС).
Содержание двуокиси кремния, кальция и фосфата в растворах анализировали атомно-абсорбционной спектроскопией; измеряли убыль веса волокон; а оставшиеся волокна исследовали методом SEM-EDX анализа.
Результаты
Волокна, полученные
вытягиванием, гладкие и в связи со способом получения пропускают свет. Ни светорассеяние, ни скрытые полости не были определены с помощью световой микроскопии. Эти волокна оказались
некристаллической
природы в отношении рентгенограммы дифракции. Более того, повреждения, вызванные микрокрекингом или какими-либо дефектами, не были обнаружены. На поверхности волокна, полученного
методом
стекловаренного вытягивания, имеются маленькие поры размером около 100 нм. Только волокна, выдержанные при комнатной температуре (RT), растворялись в значительной степени. RT-волокна,
которые
хранились 4 месяца в эксикаторе, растворяли 10% вес. в течение 4 недель. Был измерен предел прочности на растяжение полученных указанным способом волокон, и он составил около 800 МПа для
волокон с
диаметром около 10 μм. Измеренный модуль Янга для этих волокон находился в пределах 5 ГПа. Энергия деформации составила около 10%, что является обычной величиной для волокон из
стекла.
Механические свойства волокон определялись температурой тепловой обработки (сушки).
Волокна ксерогеля двуокиси кремния in vivo
В этом эксперименте исследовали
волокнистые
ксерогели, не подвергнутые и подвергнутые спеканию (200oС, 400oС, 600oС и 800oС), вводимые подкожно крысам. Волокна стерилизовали горячим
воздухом (за
исключением не подвергнутых спеканию волокон, которые стерилизовали в этаноле - 70% в течение 2 часов с сушкой в эксикаторе в течение 2 дней).
Животных анестезировали раствором HYPNORM (0,315 мг/мл фентанилцитрата и 10 мг/мл флуанизона) и DORMICUM (малеат мидазолама). Удаляли шерсть с кожи животных. Каждому животному под кожу на спине имплантировали два или три образца. Спустя 2 недели животных умерщвляли. Образцы тканей помещали в РММА, разрезали, размалывали и окрашивали толуидином голубым или Von Kossa (5% нитрата серебра, 0,1% раствор сафранина 0 и 5% раствор сульфата натрия). Гистологические срезы анализировали световой микроскопией и сканирующей электронной микроскопией.
При клиническом исследовании не было обнаружено ни опухолей, ни признаков воспаления. Ранки зажили хорошо. В гистологических срезах спустя две недели после операции воспалительные реакции не обнаруживались. Некоторые срезы помимо фибробластов содержали макрофаги, но в целом положение было удовлетворительным. В гистологических срезах толуидин голубой окрашивал участки, близлежащие от волокон, в голубой цвет, возможно из-за растворяющейся двуокиси кремния волокон. Почти все волокна хорошо были вживлены в окружающую их соединительную ткань. SЕМ-исследованием не было обнаружено никаких признаков ресорбции волокон. На поверхности волокон не наблюдался Са, Р-слой. Воспалительная реакция у крыс, вызванная волокнами, была незначительной.
Пример 3
Приготовление волокон ксерогеля двуокиси кремния,
содержащих цитрат торемифена
Золь
для волокон, получаемых вытягиванием, готовили из ТЭОС, дистиллированной воды, НNO3 и этанола в соотношении 1:2,0:0,036:1,0. Золю давали
возможность застудневать в гелевые
коллоидные
частицы при 75oС, и цитрат торемифена (400 мг/10 мл) растворяли в золе спустя три часа. Перед вытягиванием волокон методом стекловарения
золь-гель двуокиси кремния выдерживали
при 75oС в течение 8,5 часов для дальнейшего формирования коллоидных частиц.
Пример 4
Получение частиц ксерогеля двуокиси
кремния сферической формы путем
распылительной сушки
при комнатной температуре
ТЭОС, дистиллированную воду и уксусную кислоту смешивали в соотношении 1: 14,2:0,5 при комнатной температуре в
магнитном смесителе. После
гидролиза золь распыляли в
воздухе и каплям давали свободно падать на полимерную подложку и полностью застудневать перед сбором. Частицы, превратившиеся в гель, держали в
эксикаторе в течение 4 дней
перед исследованием
растворимости.
5,5 мг Гелевых частиц (0,5-1000 μм) помещали в 50 мл смоделированной основной жидкости (SBF) при 37oС и рН 7,4. Сосуд для исследования растворимости на время опыта подвергался осторожному встряхиванию. Три параллельных определения выполнялись спустя 171, 336 и 504 часа, причем каждое - в трех повторностях. Образцы в результате растворения теряли 1,9% вес. в пределах недели.
Полученные распылительным высушиванием частицы (60-200 μм), содержащие цитрат торемифена, получали вышеописанным способом. Цитрат торемифена при концентрации 20 мг/мл растворялся в золе двуокиси кремния при распылительном высушивании после 1 часа гидролиза.
Растворение лекарства и двуокиси кремния, содержащих 10,2% вес. цитрата торемифена, исследовали, как описано в примере 1, спустя два месяца после приготовления. Цитрат торемифена и двуокись кремния растворялись равномерно. Цитрат торемифена растворялся со скоростью 0,68% вес./час, а двуокись кремния - 0,13% вес./час.
Пример 5
Изготовление ксерогеля двуокиси кремния в форме дисков,
содержащих
торемифен
Золь для монолитного ксерогеля
двуокиси кремния готовили из тетраэтоксисилана (ТЭОС, Aldrich), деионизированной воды, уксусной кислоты (СНзСООН, J. Т.Baker) и
полиэтиленгликоля
(ПЭГ, М.в. 4600, J.Т.Baker) в соотношении 1: 14,2:0,
5:0,0012 при комнатной температуре (RT). К раствору добавляли торемифенцитрат (33 мг/г) и3H-меченный торемифен (16
μCi/r).
Раствор выливали в пластину с ячейками (100 мкл/ячейка) и
выдерживали при 40oС для гидролиза, поликонденсации и старения в течение 18 часов. После старения ксерогель
высушивали до
постоянного веса при 40oС.
Содержащие
торемифен диски ксерогеля двуокиси кремния in vivo
Для исследования отобрали 60 мышей - самок (С 57В1,
Denmark) со средним
весом около 19,6 г (SD 1,2). Животных разделили на две
экспериментальных группы (5 мышей в каждой группе): группу, подвергнутую действию ксерогеля, содержащего торемифен, и
группу, подвергнутую
воздействию не содержащего торемифен ксерогеля. Животных
подвергали обработке в течение 7, 14, 21, 28, 35 и 42 дней. Доза3H-торемифена была около 80 μCi/кг (0,
8 μмCi/);
торемифен-цитрата 350 мг/кг (≈3,4 мг/) и силикагеля
около 1,53 г/кг массы тела. Диск ксерогеля, содержащий торемифен, имплантировали подкожно с обеих сторон позвоночника.
После заранее определенного периода времени ксерогельные диски с левой стороны позвоночника были эксплантированы вместе с окружающей тканью, фиксированы в 70%-ном этаноле и помещены в Technovit (Algol). Срезы по 20 μм окрашивали толуидином голубым. Образцы печени, почек, лимфатических узлов фиксировали в забуференном формальдегиде (Merck) и помещали в парафин. Срезы в 6 мкм окрашивали гематоксилин-эозином. Все образцы тканей микроскопировали. Ксерогельные диски с правой стороны позвоночника вырезали из окружающего фиброзного мешка и высушивали при комнатной температуре в эксикаторе в течение 24 часов. Определяли их вес и вычисляли процентную долю имплантата, оставшуюся в каждой точке.
Для определения количества торемифена, остающегося в имплантате, высушенные диски растворяли в 0,1 N NaOH и измеряли активность с помощью жидкостного сцинтилляционного счетчика (модель 81000, LKB-Wallac, Turku, Финляндия). После умерщвления мышей образцы тканей, взятые из исследуемых участков, сжигались в аппарате для окисления (Junitek, Kaarina, Финляндия).
Потеря веса матрицей ксерогеля двуокиси кремния составила около 75% вес. в течение 42 дней. Скорость эрозии была высокой в течение 28 дней и затем снизилась, как видно из чертежа. Диски из ксерогеля двуокиси кремния показали непрерывное выделение торемифена в течение периода исследования. Количество3H-торемифена, оставшееся в имплантате спустя 42 дня, составило все еще около 16% (см. чертеж). Скорость выделения торемифена зависела от биоэрозии ксерогельной матрицы. Корреляция между ними для двуокиси кремния и3 H-торемифена была r=0,9890.
Необработанный имплантат из ксерогеля двуокиси кремния не вызывал раздражения в месте вживления. Вокруг имплантата образовался фиброзный мешок. Обширного вызванного ксерогелем двуокиси кремния токсичного воздействия на организм не наблюдалось. Ксерогель двуокиси кремния показывал непрерывно идущее растворение в течение свыше шести недель. В соответствии с вышеописанным исследованием ксерогели двуокиси кремния являются биосовместимыми и обладают контролируемой растворимостью. Таким образом, ксерогель двуокиси кремния является подходящим носителем для имплантируемой на длительный период времени системы направленного транспорта.
Пример 6
Получение
высушенных распылением сферических частиц ксерогеля двуокиси
кремния, содержащих торемифен, при рН 3,8 с помощью распылительной мини-сушилки
Золь для
распылительной сушки готовили из ТЭОС,
дистиллированной воды и уксусной кислоты, взятых в молярном
соотношении 1:14,2:0,5 при комнатной температуре в смесителе с магнитной мешалкой. После гидролиза
растворяли цитрат торемифена (20 мг/мл)
и золь высушивали распылением в мини-сушилке для распыления
(Buchi, Швейцария). После добавления цитрата торемифена рН золя был 3,8. Условия сушки распылением
были следующие; температура на входе
134oС, в потоке 600, аспиратор 90, насос 16.
Около 40-50 гелевых частиц (< 50 мкм) помещали в 250 мл смоделированной основной жидкости (SBF) при 37oС и рН 7,4. Динамику растворения цитрата торемифена и двуокиси кремния изучали с помощью USP XXII аппарата II для растворения (лопастной метод, Sotax AT6, Базель, Швейцария). Кривая растворения цитрата торемифена была линейной в соответствии с кинетикой времени второго порядка. Спустя 30 часов выделилось 80% вес. цитрата торемифена. Растворение двуокиси кремния было равномерным. Микросферы из двуокиси кремния растворялись со скоростью 0,46% вес. в час.
Пример 7
Получение высушенных распылением сферических частиц ксерогеля
двуокиси кремния, содержащих цитрат
торемифена, при рН 2 с помощью распылительной мини-сушилки: Влияние
старения
Раствор для распылительной сушки готовили при мольном соотношении ТЭОС:
Н2O: НСl=1,0:14,2:0,003.
Торемифен-цитрат в концентрации 20 мг/мл растворяли спустя час после
гидролиза. рН золя с цитратом торемифена был около 3,8. Перед распылительной сушкой рН золя
доводили до 2,1 соляной кислотой. Золь
двуокиси кремния высушивали распылением немедленно или после 65 часов
старения при комнатной температуре. Условия сушки распылением были такие же, как и в
примере 6. Растворение цитрата торемифена и
двуокиси кремния происходило так же, как и в примере 6.
Выделение цитрата торемифена и двуокиси кремния происходило в соответствии с кинетикой времени второго порядка (таблица 2). Спустя 30 часов 63,1% вес. цитрата торемифена выделилось из микросфер геля двуокиси кремния, подвергнутого старению, и 75,2% вес. - из неподвергнутого старению. Выделение цитрата торемифена шло на 20% медленнее из микросфер геля после старения. Выделение двуокиси кремния из микросфер геля после старения шло почти на 20% медленнее, чем из микросфер геля, не подвергнутого старению.
Пример 8
Выделение торемифена из размолотых частиц ксерогеля
двуокиси кремния
Золь готовили, как описано в примере 1, для получения
монолитного SiO2-ксерогеля
из ТЭОС, дистиллированной воды и уксусной кислоты при молярном соотношении 1:14,
2:0,5. Как добавка был использован полиэтиленгликоль (средний молекулярный вес
4600) при концентрации 10 мг/мл. Цитрат
торемифена растворяли в гидролизованном золе в концентрации 40 мг/мл. Золь
двуокиси кремния помещали затем в пробирки и выдерживали при 40oС в печи
для гидролиза, поликонденсации и
старения в течение 18 часов. Полимеризовавшийся силикагель затем разламывали и
сушили до постоянного веса. Размер гранул был в пределах около 4-50 мкм в диаметре.
Около 42 мг гелевых частиц помещали в 250 мл смоделированной основной жидкости (SBF) при 37oС и рН 7,4. Динамику растворения цитрата торемифена и двуокиси кремния изучали с помощью USP XXII аппарата II для растворения (лопастной метод, Sotax AT6, Базель, Швейцария).
Цитрат торемифена растворялся равномерно в соответствии с кинетикой времени второго порядка при скорости 8,1%/час1/2. Ксерогельная матрица из двуокиси кремния растворялась равномерно со скоростью 0,2% в час.
Пример 9
Получение монолита ксерогеля
двуокиси кремния, содержащего
цитрат торемифена: Влияние соотношения ТЭОС:Н2О и водорастворимых
полимеров на растворение цитрата торемифена и двуокиси кремния
Силикагели готовили
из ТЭОС, воды, этанола и НСl,
взятых в молярном соотношении 1: 6: 2,3:0,003 или 1:14:2,3:0,003 при комнатной
температуре. Полиэтиленгликоль (средний молекулярный вес 10 000 или 4600) использовался
как добавка в концентрации 10
мг/мл вместе с цитратом торемифена в концентрации 20 мг/мл. Гидролизованный золь
разливался в ячейки пластины, выдерживался при 40oС в печи для гидролиза,
поликонденсации и старения в
течение 18 часов. Силикагели высушивали при 25oС в эксикаторе с 11%
относительной влажности до постоянного веса с получением ксерогеля двуокиси кремния,
содержащего включенный цитрат
торемифена.
Динамика растворения цитрата торемифена и двуокиси кремния изучалась, как описано в примере 1.
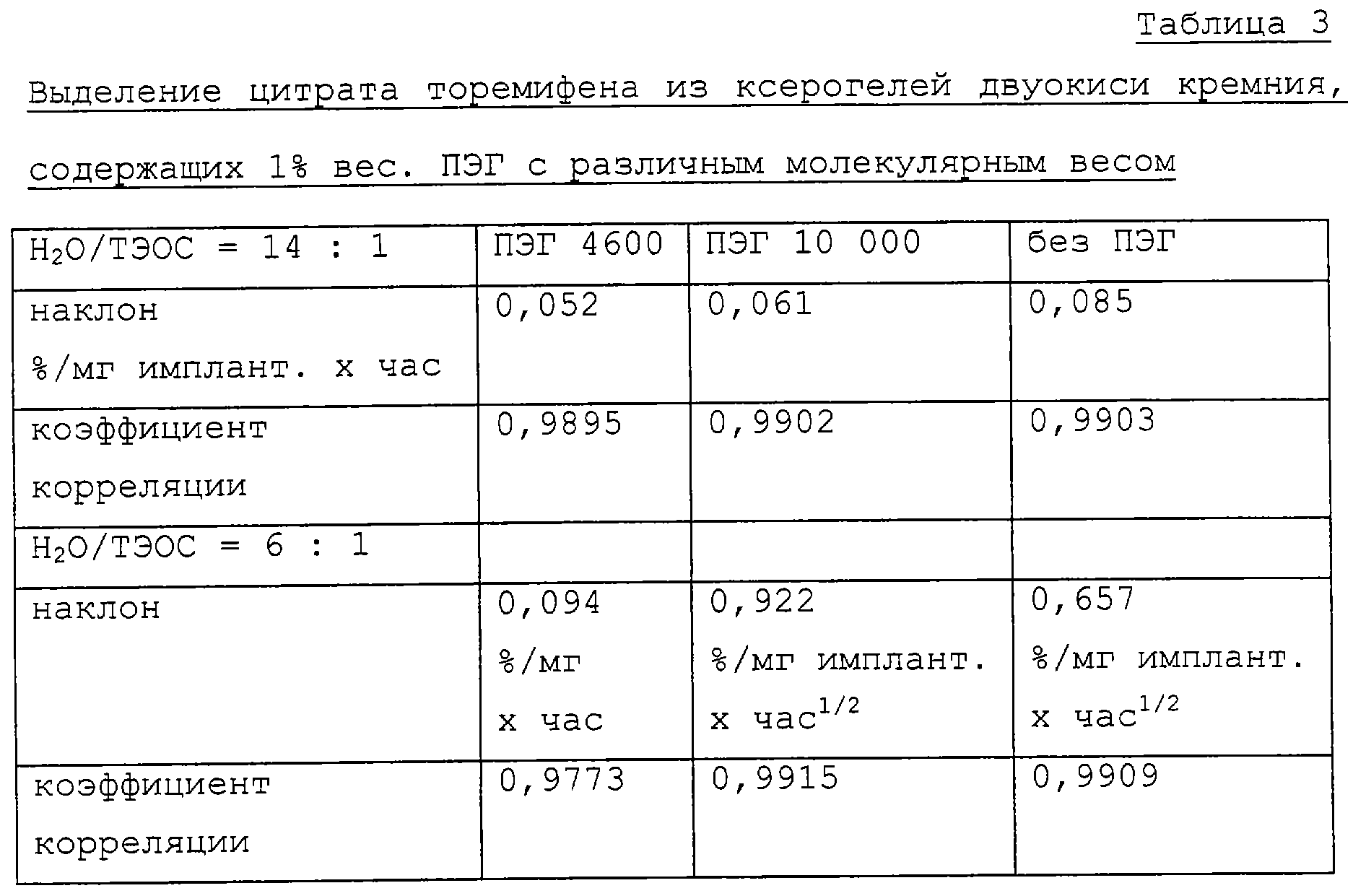
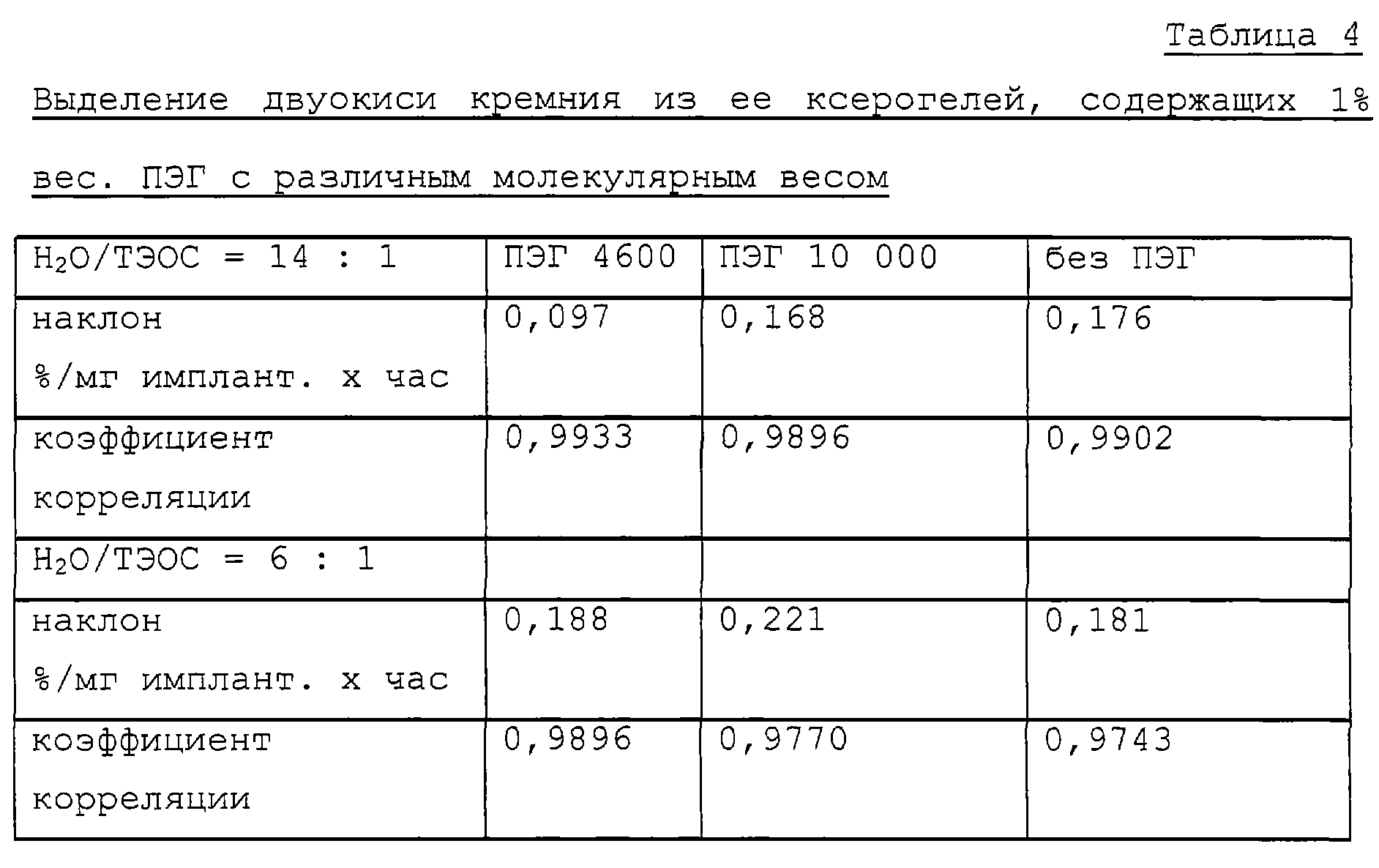
Выделение цитрата торемифена и разрушение кремнеземной матрицы изучались при двух различных молярных соотношениях Н2О:ТЭОС (14:1 и 6:1). Выделение цитрата торемифена шло быстрее из кремнеземной матрицы, содержащей ПЭГ, с соотношением Н2O:ТЭОС, равным 6, гели из матрицы, содержащей ПЭГ, с соотношением Н2O: ТЭОС, равным 14 (таблица 3). Без ПЭГ скорость выделения была равной при обоих соотношениях Н2 O/ТЭОС. Аналогично скорость разрушения матрицы, содержащей ПЭГ, с соотношением Н2 О/ТЭОС, равным 6, была выше (25-50%), чем разрушение матрицы с соотношением Н2О/ТЭОС, равным 14 (таблица 4).
Пример 10
Получение монолита ксерогеля двуокиси кремния,
содержащего цитрат торемифена: Влияние условий старения и сушки
Золь готовили, как описано в
примере 1. Полиэтиленгликоль (М.в. 4600) использовали как добавку (10 мг/мл). Цитрат торемифена
спустя 1 час растворяли в концентрации 20 мг/мл в гидролизованном золе.
Золь выливали в ячейки пластины
и выдерживали при 40oС в течение 18 часов. После этого гели переносили в не
проницаемые для воздуха пробирки для старения при 40oС в течение 7
или 28 дней. После старения
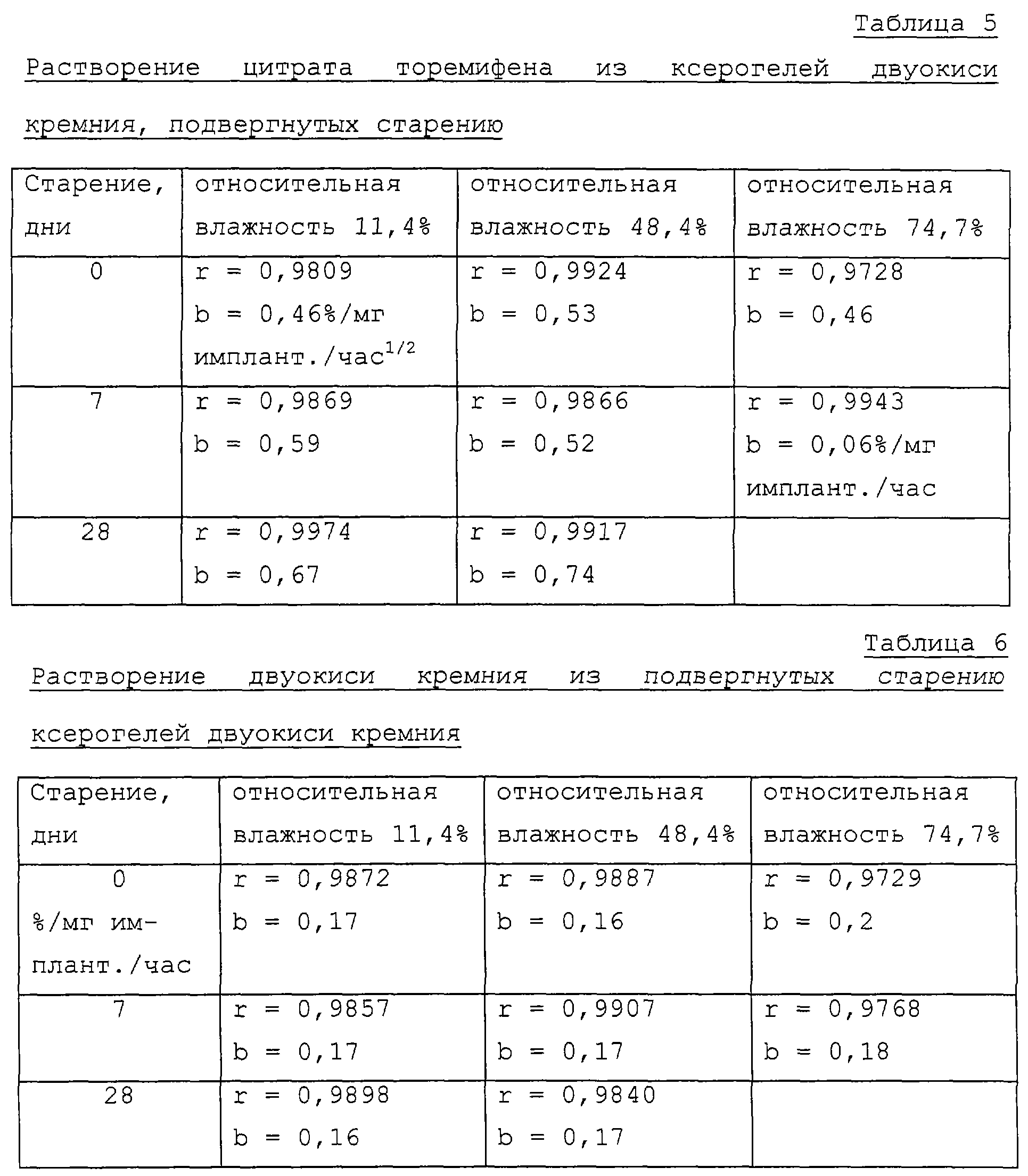
силикагели с различными значениями относительной влажности (11,4%, 48,4% и 74,7%) высушивали
до постоянного веса при 25oС (таблица 5). Растворение цитрата
торемифена и двуокиси кремния
изучали, как описано в примере 1.
Растворение двуокиси кремния шло равномерно во всех образцах ксерогеля. Продолжительность старения не оказывала влияния на скорость разрушения кремнеземной матрицы (таблица 6). Цитрат торемифена не растворялся в соответствии с кинетикой времени второго порядка. Выделение цитрата торемифена шло немного быстрее (около 30%) из ксерогеля, подвергнутого 28-дневному старению, чем из ксерогелей без старения.
Другие воплощения данного изобретения будут очевидными для специалистов в данной области, исходя из особенностей и практического применения вышеописанного изобретения. Подразумевается, что детальное описание и примеры следует рассматривать только как типичные примеры реализации изобретения.
Реферат
Изобретение относится к материалам, представляющим собой ксерогели двуокиси кремния (силикаксерогели) с регулируемой способностью к растворению, полученным в результате превращения золя в гель, и их применению. Средство для доставки включает медленно разлагаемую частицу ксерогеля диоксида кремния небольшого диаметра, полученного в процессе образования геля из золя, в котором гелеобразование золя и выпаривание воды или растворителя происходит одновременно, и биологически активный агент, отличный от ксерогеля диоксида кремния, включенный в структуру ксерогеля диоксида кремния путем добавления указанного биологически активного агента к реакционной смеси указанного процесса образования геля из золя на любой стадии указанного процесса. Изобретение позволяет получить ксерогель с регулируемой растворимостью 3 с. и 9 з.п.ф-лы, 1 ил., 6 табл.

Комментарии