Новые 4-(азациклоалкил)бензол-1,3-диоловые соединения в качестве ингибиторов тирозиназ, способ их получения и их применение в лечении человека и в косметических средствах - RU2499794C2
Код документа: RU2499794C2
Чертежи

Описание
Изобретение относится к новым 4-(азациклоалкил)бензол-1,3-диоловым соединениям в качестве промышленных и полезных продуктов. Изобретение также относится к способу их получения и к их применению в качестве ингибиторов тирозиназ, в фармацевтической или косметической композициях для применения для лечения или предотвращения пигментных нарушений.
Пигментация кожи, в частности пигментация кожи человека, является результатом синтеза меланина дендритными клетками, меланоцитами. Меланоциты содержат органеллы, называемые меланосомами, которые переносят меланин в верхние слои кератиноцитов, которые затем транспортируются на поверхность кожи посредством дифференцировки эпидермиса (Gilchrest BA, Park HY, Eller MS, Yaar M, Mechanisms of ultraviolet light-induced pigmentation. Photochem. Photobiol. 1996; 63:1-10; Hearing VJ, Tsukamoto K, Enzymatic control of pigmentation in mammals. FASEB J. 1991; 5:2902-2909).
Среди ферментов меланогенеза, ключевым ферментом является тирозиназа, которая катализирует первые два этапа синтеза меланина. Гомозиготные мутации тирозиназы вызывают окулокутанный альбинизм типа 1, характеризующийся полным отсутствием синтеза меланина (Toyofuku K, Wada I, Spritz RA, Hearing VJ, The molecular basis of oculocutaneous albinism type 1 (OCA1): sorting failure and degradation of mutant tyrosinases results in a lack of pigmentation. Biochem. J. 2001; 355:259-269).
Для лечения нарушений пигментации, являющихся результатом увеличения продукции меланина, для которых нет лечения, которое бы удовлетворяло все ожидания пациентов и дерматологов, важно разработать новые терапевтические подходы.
Большинство из осветляющих кожу соединений, которые уже известны, являются фенолами и гидрохиноновыми производными. Эти соединения ингибируют тирозиназу, но большинство из них являются цитотоксическими для меланоцитов вследствие образования хинонов. Существует риск того, что это токсическое действие вызовет постоянную депигментацию кожи. Получение соединений, которые могут ингибировать меланогенез, в это же время являясь очень слабо цитотоксическими или не обладая токсичностью в отношении меланоцитов, является наиболее желательным.
Среди соединений, уже описанных в литературе, в патентной заявке WO 99/15148 в качестве депигментирующих средств описано применение 4-циклоалкилрезорцинолов.
В патенте FR2704428 в качестве депигментирующих средств описано применение 4-гелогенрезорцинолов.
В патентных заявках WO 2006/097224 и WO 2006/097223 в качестве депигментирующих средств описано применение 4-циклоалкилметилрезорцинолов.
В патентной заявке WO 2005/085169 в качестве депигментирующего средства описано применение алкил-3-(2,4-дигидроксифенил)пропионата.
В патентной заявке WO 2004/017936 описано применение 3-(2,4-дигидроксифенил)акриламида в качестве депигментирующего средства.
В патентной заявке WO 2004/052330 в качестве депигментирующих средств описано применение 4-[1,3]дитиан-2-илрезорцинолов.
Более конкретно, в патенте EP 0341664 в качестве депигментирующих средств описано применение 4-алкилрезорцинолов, среди которых 4-н-бутилрезорцинол, также известный как руцинол, является частью композиции депигментирующего крема, продаваемого под названием иклен (Iklen®).
Неожиданно и на удивление заявители к настоящему времени выявили, что новые соединения с 4-(азациклоалкил)бензол-1,3-диоловой структурой обладают очень хорошей ингибирующей активностью в отношении фермента тирозиназы и очень низкой цитотоксичностью. Кроме того, эти соединения обладают ингибирующей активностью в отношении фермента тирозиназы, которая является большей, чем ингибирующая активность руцинола, в то же время являясь менее цитотоксической в отношении меланоцитов, чем руцинол.
Эти соединения находят применение в лечении человека, в частности в дерматологии и в области косметологии.
Таким образом, настоящее изобретение относится к соединениям общей формулы (I), приведенной ниже:

где:
R1 представляет собой:
- C1-C5-алкиловый радикал,
- C3-C6-циклоалкиловый радикал,
- ариловый радикал,
- замещенный ариловый радикал,
- аралкиловый радикал,
- C1-C5-алкокси радикал,
- аминовый радикал, соответствующий структуре (a):

где R2 представляет собой:
- водород,
- C1-C5-алкиловый радикал,
- C3-C6-циклоалкиловый радикал,
- ариловый радикал,
- замещенный ариловый радикал,
- пиридиловый радикал,
- аралкиловый радикал,
- радикал, соответствующий структуре (b):

где значение p может представлять собой 1 или 2,
- радикал, соответствующий структуре (c)

где R4 представляет собой:
- карбоксиметиловый, -COOCH3, или карбоксиэтиловый, -COOEt, радикал,
- C1-C3-алкиловый радикал,
- водород,
и R5 представляет собой:
- замещенный или незамещенный ариловый радикал,
- C3-C6-циклоалкиловый радикал,
- пиридил,
и R3 представляет собой:
- водород,
- C1-C5-алкиловый радикал;
R1 также может представлять собой радикал, соответствующий формуле (d):

где R6 представляет собой:
- водород,
- C1-C5-алкиловый радикал,
- C3-C6-циклоалкиловый радикал,
- ариловый радикал,
- замещенный ариловый радикал,
- пиридиловый радикал,
- аралкиловый радикал,
R7 представляет собой:
- водород,
- C1-C5-алкиловый радикал,
и R8 представляет собой:
- водород,
- гидроксил,
- аминовый радикал,
- C1-C3-алкокси радикал;
Y представляет собой водород или фтор, и
значение m и n может представлять собой 0, 1 или 2,
а также к солям соединений формулы (I) и их изомерным и энантиомерным формам.
Среди солей соединений общей формулы (I) с фармацевтически приемлемым основанием предпочтительно можно указать соли с органическим основанием или с неорганическим основанием.
Подходящие неорганические основания представляют собой, например, гидроксид калия, гидроксид натрия или гидроксид кальция.
Подходящие органические основания представляют собой, например, морфолин, пиперазин или лизин.
Соединения общей формулы (I) также могут существовать в форме гидратов или сольватов.
Растворители, подходящие для образования сольватов представляют собой, например, спирты, такие как этанол или изопропанол.
Термин "C1-C5-алкил" по настоящему изобретению означает линейную или разветвленную насыщенную углеводородную цепь, содержащую от 1 до 5 атомов углерода.
Термин "C1-C3-алкил" по настоящему изобретению означает линейную или разветвленную насыщенную углеводородную цепь, содержащую от 1 до 3 атомов углерода.
Термин "C3-C6-циклоалкил" по настоящему изобретению означает циклическую насыщенную углеводородную цепь, содержащую от 3 до 6 атомов углерода.
Термин "арил" по настоящему изобретению означает фенил или нафтил.
Термин "замещенный арил" по настоящему изобретению означает фенил или нафтил, замещенные одной или несколькими группами атомов, выбранных из алкила, алкокси, фтора и трифторметила.
Термин "аралкил" по настоящему изобретению означает C1-C5-алкиловый радикал, как определено выше, замещенный замещенным или незамещенным ариловым радикалом.
Термин "C1-C5-алкокси" по настоящему изобретению означает атом кислорода, замещенный линейной или разветвленной насыщенной углеводородной цепью, содержащей от 1 до 5 атомов углерода.
Термин "C1-C3-алкокси" по настоящему изобретению означает атом кислорода, замещенный линейной или разветвленной насыщенной углеводородной цепью, содержащей от 1 до 3 атомов углерода.
По настоящему изобретению, соединения общей формулы (I), являющиеся особенно предпочтительными, представляют собой соединения, где:
- R1 представляет собой аралкиловый радикал или аминовый радикал, соответствующий структуре (a):

где R2 представляет собой:
- C1-C5-алкиловый радикал,
- аралкиловый радикал или
- радикал, соответствующий структуре (d):

где R4 представляет собой:
- карбоксиметиловый, -COOCH3, или карбоксиэтиловый, -COOEt, радикал,
- C1-C3-алкиловый радикал,
и R5 представляет собой:
- замещенный или незамещенный ариловый радикал,
и R3 представляет собой водород,
- Y представляет собой атом водорода или фтора,
- m=1 и n=1,
а также соли этих соединений общей формулы (I) и их изомерные и энантиомерные формы.
Среди соединений формулы (I), составляющих часть контекста настоящего изобретения, в частности можно указать следующие:
1: трет-бутиловый эфир 3-(2,4-дигидроксифенил)азетидин-1-карбоновой кислоты
2: [3-(2,4-дигидроксифенил)азетидин-1-ил]фенилметанон
3: пентиламид 3-(2,4-дигидроксифенил)азетидин-1-карбоновой кислоты
4: трет-бутиловый эфир 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
5: изобутиловый эфир 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
6: циклогексиламид 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
7: фениламид 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
8: (4-фторфенил)амид 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
9: (4-трифторметилфенил)амид 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
10: этиловый эфир 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
11: [4-(2,4-дигидроксифенил)пиперидин-1-ил]фенилметанон
12: бутиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
13: пропиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
14: 1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]бутан-1-он
15: 1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-метилпропан-1-он
16: фениламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
17: (4-фторфенил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
18: п-толиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
19: фенэтиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
20: (3-фторфенил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
21: ((R)-1-фенилэтил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
22: метилфениламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
23: пиридин-2-иламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
24: ((S)-1-фенилэтил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
25: ((S)-1-фенилпропил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
26: (R)-2-амино-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-3-фенилпропан-1-он
27: 1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-3-фенилпропан-1-он
28: 2-фторбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
29: 3-фторбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
30: 4-фторбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
31: бензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
32: 2-метилбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
33: 3-метилбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
34: 4-метилбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
35: 2-метоксибензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
36: 3-метоксибензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
37: 4-метоксибензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
38: ((S)-1-п-толилэтил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
39: [(S)-1-(4-фторфенил)этил]амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
40: (S)-индан-1-иламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
41: ((S)-1-нафтален-1-илэтил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
42: ((S)-1-нафтален-2-илэтил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
43: [(S)-1-(4-метоксифенил)этил]амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
44: [(S)-1-(3-метоксифенил)этил]амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
45: (S)-2-амино-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-3-фенилпропан-1-он
46: ((S)-1-фенилэтил)амид 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
47: (R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилэтанон
48: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилэтанон
49:(R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-3-фенилпропан-1-он
50: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-3-фенилпропан-1-он
51: (R)-2-амино-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-(4-фторфенил)этанон
52: (R)-2-амино-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-фенилэтанон
53: (S)-2-амино-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-фенилэтанон
54: (R)-2-амино-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-(4-трифторметилфенил)этанон
55: 2-амино-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-фенилбутан-1-он
56: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-метокси-2-фенилэтанон
57: ((S)-1-циклогексилэтил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
58: (1,2,3,4-тетрагидронафтален-1-ил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
59: метиловый эфир (R)-{[4-(2,4-дигидроксифенил)пиперидин-1-карбонил]амино}фенилуксусной кислоты
60: (пиридин-3-илметил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
61: (пиридин-4-илметил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
62: бензиламид 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
63: бутиламид 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
64: (3-фторфенил)амид 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
65: фенэтиламид 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
66: метиловый эфир (R)-{[4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбонил]амино}фенилуксусной кислоты
67: (S)-индан-1-иламид 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
68: [(S)-1-(4-метоксифенил)этил]амид 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
69: ((S)-1-циклогексилэтил)амид 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
70: (R)-1-[4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилэтанон
71: (S)-1-[4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилэтанон
72: (R)-2-амино-1-[4-(5-фтор-2,4-дигидроксифенил)-пиперидин-1-ил]-2-фенилэтанон
73: (S)-2-амино-1-[4-(5-фтор-2,4-дигидроксифенил)-пиперидин-1-ил]-2-фенилэтанон
74: (R)-1-[4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилпропан-1-он
75: (S)-1-[4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилпропан-1-он
76: (R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилпропан-1-он
77: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилпропан-1-он
78: метиловый эфир (R)-{[4-(2,4-дигидроксифенил)пиперидин-1-карбонил]амино}-(4-фторфенил)уксусной кислоты
79: метиловый эфир (S)-{[4-(2,4-дигидроксифенил)пиперидин-1-карбонил]амино}-(4-фторфенил)уксусной кислоты
80: (R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-метил-3-фенилпропан-1-он
81: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-метил-3-фенилпропан-1-он
82: (пиридин-3-илметил)амид 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
83: (пиридин-4-илметил)амид 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
84: ((R)-1-фенилэтил)амид (5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
85: (R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилбутан-1-он
86: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилбутан-1-он
87: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-(4-фторфенил)-2-гидроксиэтанон
88: (R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-(4-фторфенил)-2-гидроксиэтанон
89: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-(3-метоксифенил)этанон
90: (R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-(3-метоксифенил)этанон
91: циклогексилметиламид 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
92: циклогексилметиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
93: (2-этилбутил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
94: (2-этилбутил)амид 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
95: циклопентилметиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
96: циклопентилметиламид 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
97: (6-метилпиридин-3-илметил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
98: (4-метилпиридин-3-илметил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
99: (5-метилпиридин-3-илметил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
100: (2-метилпиридин-3-илметил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
101: (2,6-диметилпиридин-4-илметил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
102: (2-пиридин-2-илэтил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
103: (2-пиридин-3-илэтил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
104: (2-пиридин-4-илэтил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
Соединения общей формулы (I) получают в соответствии с общей схемой реакций, представленной на фигуре 1.
В присутствии бутиллития проводят реакцию соединений 2,4-бис(бензилокси)бромбензол (X=Br; Y=H) или 1,5-бис(бензилокси)-2-фтор-4-йодбензол (X=I; Y=F) (1), которые являются коммерчески доступными или получаемыми общепринятыми способами синтеза (W.D. Langley, Org. Synth. I, 122 (1932)) (в случае соединений фтора Mottram, L. F.; Boonyarattanakalin, S.; Kovel, R. E.; Peterson, B.R. Organic Letters 2006, 8(4), 581-584), например, с азациклоалканонами (2), которые являются коммерчески доступными или получаемыми общепринятыми способами синтеза (W.D. Langley, Org. Synth. I, 122 (1932)), с получением соответствующих бензиловых спиртов общей формулы (3), где Y=H или F и Z=этил или трет-бутил (Annoura, H.; Nakanishi, K.; Uesugi, M.; Fukunaga, A.; Imajo, S.; Miyajima, A.; Tamura-Horikawa, Y.; Tamura, S.; Bioorg. Med. Chem. 2002, 10 (2), 371-383).

Соединения общей формулы (4) получают гидрированием бензиловых спиртов общей формулы (3) в присутствии водорода и катализатора на основе палладия, такого как, например, палладий на угле, в растворителе, таком как метанол (Merschaert, A.; Delhaye, L.; Kestemont, J.-P.; Brione, W.; Delbeke, P.; Mancuso, V.; Napora, F.; Diker, K.; Giraud, D.; Vanmarsenille, M.; Tetrahedron Lett. 2003, 44 (24), 4531-4534).

Для получения соединения общей формулы (5) соединения общей формулы (4) можно бензилировать с применением бензилбромида и основания, например, такого как карбонат калия, в растворителе, например, таком как метилэтилкетон (Bolek, D.; Guetschow, M.; J. Heterocycl. Chem. 2005, 42 (7), 1399-1403).

Соединения общей формулы (5) превращают в амины общей формулы (6), например, воздействием трифторуксусной кислоты, если Z=трет-бутил (Kasyan, A.; Wagner, C.; Maier, M. E.; Tetrahedron 1998, 54 (28), 8047-8054), или, например, воздействием водного раствора гидроксида калия, если Z=этил (Morice, C.; Domostoj, M.; Briner, K.; Mann, A.; Suffert, J.; Wermuth, C.-G.; Tetrahedron Lett. 2001, 42 (37), 6499-6502).

Затем соединения общей формулы (6) преобразуют в соединения общей формулы (7).

соединения общей формулы (7) могут:
- или представлять собой карбамиды: их получают реакцией соединений общей формулы (6), например, с изоцианатами (Ranise, A.; Schenone, S.; Bruno, O.; Bondavalli, F.; Filippelli, W.; Falcone, G.; Rivaldi, B.; Farmaco. 2001, 56 (9), 647-657);
- или представлять собой амиды: их получают реакцией соединений общей формулы (6), например, с ацилхлоридами (Katritzky, A. R.; Singh, S. K.; Cai, C.; Bobrov, S.; J. Org. Chem. 2006, 71 (9), 3364-3374) или с ацидами (De Laszlo, S. E.; Allen, E. E.; Li, B.; Ondeyka, D.; Rivero, R.; Malkowitz, L.; Molineaux, C.; Siciliano, S. J.; Springer, M. S.; Greenlee, W. J.; Mantlo, N.; Bioorg. Med. Chem. Lett. 1997, 7 (2), 213-218);
- или представлять собой карбаматы: их получают реакцией соединений общей формулы (6), например, с хлорформиатами (Brackeen, M. F.; Cowan, D. J.; Stafford, J. A.; Schoenen, F. J.; Veal, J. M.; Domanico, P. L.; Rose, D.; Strickland, A. B.; Verghese, M.; Feldman, P. L.; J. Med. Chem. 1995, 38 (24), 4848-4854).
В конечном итоге, получают соединения общей формулы (I) гидрированием соединений общей формулы (7) в присутствии водорода и катализатора на основе палладия, например, такого как палладий на угле, в растворителе, например, таком как метанол.

Таким образом, изобретение относится к применению по меньшей мере одного соединения общей формулы (I), как определено выше, в качестве лекарственного средства.
Изобретение также относится к применению по меньшей мере одного соединения общей формулы (I), как определено выше, в качестве лекарственного средства, где указанное соединение обладает ингибирующим тирозиназу действием.
Изобретение также относится к применению по меньшей мере одного соединения общей формулы (I), как определено выше, для получения фармацевтической или косметической композиции, где указанное соединение обладает ингибирующим тирозиназу действием.
Преимущественно значение IC50 соединений по настоящему изобретению (доза, ингибирующая 50% ферментативной активности) в отношении тирозиназы является меньшим или равным 10 мкМ, а более конкретно - меньшим или равным 1 мкМ.
Изобретение также относится к соединению общей формулы (I) для его применения для лечения и/или предотвращения пигментных нарушений.
Фактически соединения общей формулы (I) по изобретению особенно пригодны для применения, связанного с лечением или предотвращением пигментных нарушений, таких как мелазма, хлоазма, лентигиноз, старческое лентиго, неравномерная гиперпигментация, связанная со старением кожи от воздействия ультрафиолетовых лучей, веснушчатостью, поствоспалительной гиперпигментацией вследствие царапин, ожогов, рубцов, дерматоза, контактной аллергии; невусы, генетически определенная гиперпигментация, гиперпигментация метаболического или связанного с лекарственными средствами происхождения, меланомы или другие очаги гиперпигментации.
Объектом настоящего изобретения также является фармацевтическая композиция для применения, в частности, для лечения указанных выше состояний, и которая характеризуется тем, что она содержит в фармацевтически приемлемом носителе, совместимом с выбранным для указанной композиции способом введения, соединение общей формулы (I) в форме одного из своих изомеров или энантиомеров, или его соли с фармацевтически приемлемым основанием.
Термин "фармацевтически приемлемый носитель" предназначен для обозначения среды, которая совместима с кожей, слизистыми оболочками и производными кожи.
Композицию по изобретению можно вводить местно. Предпочтительно фармацевтическая композиция упакована в форме, подходящей для местного применения.
При местном применении фармацевтическая композиция по изобретению более конкретно предназначена для применения в лечении кожи и слизистых оболочек и может находиться в жидкой, пастообразной или твердой форме, а более конкретно в форме мазей, кремов растворов или гелей.
Концентрация соединений по изобретению в композициях, используемых для местного применения, как правило, составляет от 0,001% до 10% по массе, предпочтительно - от 0,01% до 5% по массе относительно общей массы композиции.
Соединения общей формулы (I) по изобретению также находят применения в области косметики, в частности в защите от вредных составляющих солнечного света, для предотвращения вызванного действием света или возрастного старения кожи и тканей, схожих с кожей и/или борьбы с ними.
Таким образом, объектом изобретения также является композиция, содержащая в косметически приемлемом носителе по меньшей мере одно из соединений общей формулы (I). Термин "косметически приемлемый носитель" предназначен для обозначения носителя, который совместим с кожей, слизистыми оболочками и тканями, схожими с кожей.
Объектом настоящего изобретения также является косметическое применение композиций, содержащих по меньшей мере одно соединение общей формулы (I), для предотвращения и/или лечения признаков старения и/или кожи.
Объектом настоящего изобретения также является косметическое применение композиций, содержащих по меньшей мере одно соединение общей формулы (I), для гигиены тела или волос.
Косметическая композиция по изобретению, содержащая в косметически приемлемом носителе соединение общей формулы (I), или одну из его изомерных и энантиомерных форм или его соль с косметически приемлемым основанием, в частности может находиться в форме крема, молочка, геля, суспензий микросфер или наносфер или липидных или полимерных везикул, пропитанных салфеток, растворов, спреев, пен, карандашей, мыла, моющих основ или шампуней.
Концентрация соединения общей формулы (I) в косметической композиции предпочтительно составляет от 0,001% до 10% по массе относительно общей массы композиции.
Фармацевтические и косметические композиции, как описано выше, также могут содержать инертные добавки или даже фармакодинамически активные относительно фармацевтических композиций добавки или комбинации этих добавок и, в частности:
- увлажнители;
- усилители вкуса;
- консерванты, такие как сложные эфиры парагидроксибензойной кислоты;
- стабилизаторы;
- регуляторы влажности;
- регуляторы pH;
- модификаторы осмотического давления;
- эмульгаторы;
- экранирующие средства от УФ-A и УФ-B;
- антиоксиданты, такие как α-токоферол, бутилированный гидроксианизол или бутилированный гидрокситолуол, супероксиддисмутаза, восстановленный кофермент Q; пиросульфит натрия;
- смягчающие средства;
- увлажняющие средства, такие как глицерин, PEG 400, тиаморфолинон и его производные или мочевина;
- противосеборрейные или противоугревые средства, такие как S-карбоксиметилцистеин, S-бензилцистамин, их соли или их производные или бензоилпероксид.
Понятно, что специалисты в данной области смогут проследить за выбором оптимального соединения(ий) для добавления в эти композиции так, чтобы благоприятные свойства, по существу связанные с настоящим изобретением, не нарушались или по существу не нарушались рассматриваемым добавлением.
Далее посредством иллюстрации и без какого-либо ограничительного характера будут приведены несколько примеров получения соединений общей формулы (I) по изобретению, результатов исследования биологической активности этих соединений, а также различные препараты на основе таких соединений.
ПРИМЕР 1: трет-бутиловый эфир 3-(2,4-дигидроксифенил)азетидин-1-карбоновой кислоты
a) 2,4-бис(бензилокси)-1-бромбензол
106,6 г (0,771 моль, 3 экв.) карбоната калия (325 меш) добавляют в раствор 50,1 г (0,257 моль, 1 экв.) 97% 4-бромрезорцинола в 500 мл ацетона. Реакционную смесь охлаждают до 5-10°C и добавляют по каплям 75 мл (0,630 моль, 2,45 экв.) бензилбромида. Реакционную смесь перемешивают при температуре окружающей среды в течение ночи, а затем нагревают при 50°C в течение 2 часов. Растворитель выпаривают и затем остаток обрабатывают смесью вода/этилацетат. Водную фазу экстрагируют этилацетатом, и органические фазы объединяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и выпаривают. Остаток (114,34 г) подвергают хроматографии на силикагеле (600 г), проводя элюирование гептаном/дихлорметаном 90/10.
Получают 94,4 г 2,4-бис(бензилокси)-1-бромбензола в форме белых кристаллов. Выход=99%.
b) трет-бутиловый эфир 3-(2,4-бис(бензилокси)фенил)-3-гидроксиазетидин-1-карбоновой кислоты
В 100-мл трехгорлой колбе в 60 мл тетрагидрофурана растворяют 5 г 2,4-бис(бензилокси)-1-бромбензола. Смесь охлаждают до -70°C, а затем добавляют 11,4 мл 2,5M н-бутиллития в гексане. Реакционную смесь перемешивают при -70°C в течение 1 часа, а затем по каплям добавляют 2,8 г 1-Boc-азетидин-3-она, растворенного в 4 мл THF. Реакционную смесь перемешивают при -70°C в течение 2 часов, а затем оставляют на ночь при температуре окружающей среды. Реакционную смесь выливают в 40 мл 2 М раствора соляной кислоты, а затем экстрагируют 100 мл этилацетата. Органические фазы объединяют, промывают 50 мл воды, а затем сушат над сульфатом магния и выпаривают. Остаток подвергают хроматографии на силикагеле (колонка AnaLogix SF40-80 g), проводя элюирование гептаном/этилацетатом 80/20. Получают 2,2 г трет-бутилового эфира 3-(2,4-бис(бензилокси)фенил)-3-гидроксиазетидин-1-карбоновой кислоты. Выход: 37%.
c) трет-бутиловый эфир 3-(2,4-дигидроксифенил)азетидин-1-карбоновой кислоты
1 г трет-бутилового эфира 3-(2,4-бис(бензилокси)фенил)-3-гидроксиазетидин-1-карбоновой кислоты растворяют в смеси 20 мл этилацетата/10-мл метанола, а затем добавляют 0,2 г 10% палладия на угле. Реакционную смесь перемешивают в течение 24 часов в атмосфере водорода. Реакционную смесь фильтруют, а затем остаток подвергают хроматографии на силикагеле (гептан/этилацетат 7/3). Получают 0,16 г трет-бутилового эфира 3-(2,4-дигидроксифенил)азетидин-1-карбоновой кислоты. Выход=28%.
1H ЯМР (DMSO, 400 мГц): 1,38 (с, 9H); 3,72 (м, 1H); 3,85 (уш.м, 2H); 4,07 (уш.м, 2H); 6,17 (дд, J=8,4 & 2,4 Гц, 1H); 6,27 (д, J=2,4 Гц, 1H); 6,92 (д, J=8,4 Гц, 1H); 9,12 (с, 1H); 9,32 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 28,1, 55, 102,4, 105,9, 117,9, 127,6, 155,8, 156,0, 157,0.
ПРИМЕР 2: [3-(2,4-дигидроксифенил)азетидин-1-ил]фенилметанон
a) трет-бутиловый эфир 3-(2,4-бис(бензилокси)фенил)азетидин-1-карбоновой кислоты
В 25-мл круглодонную колбу малыми порциями добавляют в раствор 0,86 г трет-бутилового эфира 3-(2,4-дигидроксифенил)азетидин-1-карбоновой кислоты (пример 1) в 9 мл метилэтилкетона 1,35 г карбоната калия.
Добавляют по каплям 0,93 мл бензилбромида и затем реакционную смесь перемешивают в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь фильтруют и затем остаток подвергают хроматографии на силикагеле (гептан/этилацетат 70/30).
Получают 1,1 г трет-бутилового эфира 3-(2,4-бис(бензилокси)фенил)азетидин-1-карбоновой кислоты. Выход=76%.
b) трифторацетат 3-(2,4-бис(бензилокси)фенил)азетидина
В 25-мл круглодонной колбе растворяют 1 г трет-бутилового эфира 3-(2,4-бис(бензилокси)фенил)азетидин-1-карбоновой кислоты в 10-мл дихлорметана, а затем добавляют 2,5 мл трифторуксусной кислоты. Реакционную смесь перемешивают в течение 2 часов. Растворители выпаривают и затем остаток обрабатывают простым изопропиловым эфиром. Получают 0,92 г 3-(2,4-бис(бензилокси)фенил)азетидинтрифторацетата. Выход=90%.
c) [3-(2,4-бис(бензилокси)фенил)азетидин-1-ил]фенилметанон
В 10-мл круглодонной колбе растворяют 0,25 г 3-(2,4-бис(бензилокси)фенил)азетидинтрифторацетата в 5 мл тетрагидрофурана в присутствии 0,1 мл N,N-диизопропилэтиламина. Добавляют 0,07 мл бензоилхлорид и затем смесь перемешивают в течение 24 часов при температуре окружающей среды. Реакционную смесь экстрагируют этилацетатом и затем органические фазы объединяют и сушат над сульфатом магния. Остаток подвергают хроматографии на силикагеле (гептан/этилацетат 9/1). Получают 0,2 г [3-(2,4-бис(бензилокси)фенил)азетидин-1-ил]фенилметанон. Выход=82%.
d) [3-(2,4-дигидроксифенил)азетидин-1-ил]фенилметанон
В 10-мл круглодонной колбе растворяют 0,2 г [3-(2,4-бис(бензилокси)фенил)азетидин-1-ил]фенилметанона в 6 мл метанола в присутствии 0,1 г 10% палладия на угле. Реакционную смесь перемешивают в течение 18 часов в атмосфере водорода. Реакционную смесь фильтруют и затем остаток подвергают хроматографии на силикагеле (гептан/этилацетат 1/1).
Получают 0,08 г [3-(2,4-дигидроксифенил)азетидин-1-ил]фенилметанона. Выход=67%.
1H ЯМР (DMSO, 400 мГц): 3,86 (м, 1H); 4,04 (м, 1H); 4,29 (м, 2H); 4,58 (т, J=8,6 Гц, 1H); 6,19 (дд, J=8,4 & 2,4 Гц, 1H); 6,28 (д, J=2,4 Гц, 1H); 6,98 (д, J=8,4 Гц, 1H); 7,47 (м, 3H); 7,63 (д, J=8 Гц, 2H) 9,14 (с, 1H); 9,37 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 29,3, 54,2, 58,7, 102,4, 105,9, 117,8, 127,7, 127,8, 128,3, 130,7, 133,3, 156,0, 157,0, 168,9.
ПРИМЕР 3: пентиламид 3-(2,4-дигидроксифенил)азетидин-1-карбоновой кислоты
a) пентиламид 3-(2,4-бис(бензилокси)фенил)азетидин-1-карбоновой кислоты
В 10-мл круглодонной колбе растворяют 0,15 г 3-(2,4-бис(бензилокси)фенил)азетидинтрифторацетата в 3 мл тетрагидрофурана в присутствии 0,1 мл N,N-диизопропилэтиламина. Добавляют 0,04 мл пентилизоцианата и затем реакционную смесь перемешивают в течение 20 минут при температуре окружающей среды. Реакционную смесь экстрагируют этилацетатом и органические фазы затем объединяют и сушат над сульфатом магния. Остаток подвергают хроматографии на силикагеле (гептан/этилацетат 9/1). Получают 0,1 г пентиламид 3-(2,4-бис(бензилокси)фенил)азетидин-1-карбоновой кислоты. Выход=67%.
b) пентиламид 3-(2,4-дигидроксифенил)азетидин-1-карбоновой кислоты
В 10-мл круглодонной колбе растворяют 0,2 г пентиламида 3-(2,4-бис(бензилокси)фенил)азетидин-1-карбоновой кислоты в 6 мл метанола в присутствии 0,1 г 10% палладия на угле. Реакционную смесь перемешивают в течение 6 часов в атмосфере водорода. Реакционную смесь фильтруют и затем остаток подвергают хроматографии на силикагеле (дихлорметан/метанол 95/5).
Получают 0,02 г пентиламида 3-(2,4-дигидроксифенил)азетидин-1-карбоновой кислоты. Выход=33%.
1H ЯМР (DMSO, 400 мГц): 0,85 (т, J=1 Гц, 3H); 1,22 (м, 4H); 1,34 (м, 2H); 2,94 (уш.м, 2H); 3,59 (уш.м, 1H); 3,73 (уш.м, 2H); 4,02 (уш.м, 2H); 6,17 (м, 3H); 6,26 (д, J=2,4 Гц, 1H); 6,91 (д, J=8,4 Гц, 1H); 9,1 (уш.с, 1H); 9,27 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 13,9, 21,9, 27,6, 28,5, 29,6, 55,0, 102,3, 106,0, 118,5, 127,3, 155,8, 156,8, 159,9.
ПРИМЕР 4: трет-бутиловый эфир 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
a) трет-бутиловый эфир 3-оксопирролидин-1-карбоновой кислоты
В 1-л трехгорлой колбе растворяют 10 г N-Boc-3-гидроксипирролидина в 350 мл диметилсульфоксида в присутствии 52,3 мл триэтиламина. К указанному выше раствору по каплям добавляют 28 г комплекса пиридин-триоксид серы, растворенного в 350 мл диметилсульфоксида. Реакционную смесь перемешивают в течение 4 часов при температуре окружающей среды. Реакционную смесь закисляют до pH 4,5-5 1 M раствором соляной кислоты и затем реакционную смесь экстрагируют этилацетатом. Органические фазы объединяют, а затем сушат над безводным сульфатом натрия. Остаток фильтруют через силикагель (гептан/этилацетат 1/1). Получают 5,7 г трет-бутилового эфира 3-оксопирролидин-1-карбоновой кислоты. Выход: 58%.
b) трет-бутиловый эфир 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
Трет-бутиловый эфир 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты получают способом, аналогичным способу из примеров 1b и 1c, но с применением трет-бутилового эфира 3-оксопирролидин-1-карбоновой кислоты.
1H ЯМР (DMSO, 400 мГц): 1,40 (с, 9H); 1,89 (м, 2H); 3,04 (т, J=9,5 Гц, 1H); 3,23 (м, 1H); 3,36 (м, 2H); 3,57 (дд, J=7,6 & 10 Гц, 1H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,28 (д, J=2,4 Гц, 1H); 6,82 (м, 1H); 9,06 (с, 1H); 9,27 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 28,1, 29,9 & 30,8, 36,2 & 37,2, 45,2 & 45,4, 50,7 & 51,1, 78,0, 102,5, 106,0, 127,1, 153,5, 155,5, 156,7.
ПРИМЕР 5: изобутиловый эфир 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
a) 3-(2,4-бис(бензилокси)фенил)пирролидинтрифторацетат
В 50-мл круглодонной колбе растворяют 1 г трет-бутилового эфира 3-(2,4-бис(бензилокси)фенил)пирролидин-1-карбоновой кислоты (пример 4) в 16 мл дихлорметана, а затем добавляют 4 мл трифторуксусной кислоты. Реакционную смесь перемешивают в течение 1 часа. Растворители выпаривают и затем остаток обрабатывают простым изопропиловым эфиром. Получают 1,26 г 3-(2,4-бис(бензилокси)фенил)пирролидинтрифторацетата. Выход=76%.
b) изобутиловый эфир 3-(2,4-бис(бензилокси)фенил)пирролидин-1-карбоновой кислоты
В 10-мл круглодонной колбе растворяют 0,25 г 3-(2,4-бис(бензилокси)фенил)пирролидинтрифторацетата в 5 мл тетрагидрофурана в присутствии 0,25-мл N,N-диизопропилэтиламина. Добавляют 0,108 г изобутилхлорформиата и реакционную смесь перемешивают в течение 30 минут при температуре окружающей среды. Реакционную смесь экстрагируют этилацетатом и затем органические фазы объединяют и сушат над сульфатом магния. Остаток подвергают хроматографии на силикагеле (гептан/этилацетат 8/2). Получают 0,22 г изобутилового эфира 3-(2,4-бис(бензилокси)фенил)-пирролидин-1-карбоновой кислоты. Выход=66%.
c) изобутиловый эфир 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
В 25-мл круглодонной колбе растворяют 0,22 г изобутилового эфира 3-(2,4-бис(бензилокси)фенил)пирролидин-1-карбоновой кислоты в 6 мл метанола в присутствии 0,1 г 10% палладия на угле. Реакционную смесь перемешивают в течение 18 часов в атмосфере водорода. Реакционную смесь фильтруют и затем остаток подвергают хроматографии на силикагеле (гептан/этилацетат 1/1).
Получают 0,1 г изобутилового эфира 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты. Выход=75%.
1H ЯМР (DMSO, 400 мГц): 0,88 (т, J=1 Гц, 6H); 1,80-2,07 (м, 3H); 3,10 (кв, J=9 Гц, 1H); 3,23-3,48 (м, 3H); 3,63 (м, 1H); 3,75 (м, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,28 (д, J=2,4 Гц, 1H); 6,82 (м, 1H); 9,07 (с, 1H); 9,29 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 18,9, 27,6, 30,0 & 30,8, 36,4 & 37,3, 45,0 & 45,5, 50,6 & 51,0, 70,1, 102,5, 106,0, 117,5, 127,0, 154,1, 155,9, 156,7.
ПРИМЕР 6: циклогексиламид 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
a) циклогексиламид 3-(2,4-бис(бензилокси)фенил)пирролидин-1-карбоновой кислоты
В 10-мл круглодонной колбе растворяют 0,25 г 3-(2,4-бис(бензилокси)фенил)пирролидинтрифторацетата в 5 мл тетрагидрофурана в присутствии 0,25-мл N,N-диизопропилэтиламина. Добавляют 0,1 г циклогексилизоцианата и реакционную смесь перемешивают в течение 30 минут при температуре окружающей среды. Реакционную смесь экстрагируют этилацетатом и затем органические фазы объединяют и сушат над сульфатом магния. Остаток подвергают хроматографии на силикагеле (гептан/этилацетат 7/3). Получают 0,23 г циклогексиламид 3-(2,4-бис(бензилокси)фенил)пирролидин-1-карбоновой кислоты. Выход=66%.
b) циклогексиламид 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
В 25-мл круглодонной колбе растворяют 0,23 г циклогексиламида 3-(2,4-бис(бензилокси)фенил)пирролидин-1-карбоновой кислоты в 4 мл метанола в присутствии 3 мл этилацетата и 0,1 г 10% палладия на угле. Реакционную смесь перемешивают в течение 18 часов в атмосфере водорода. Реакционную смесь фильтруют и затем остаток подвергают хроматографии на силикагеле (гептан/этилацетат 7/3).
Получают 0,095 г циклогексиламид 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты. Выход=100%.
1H ЯМР (DMSO, 400 мГц): 1,17 (м, 4H); 1,55 (м, 1H); 1,60 (м, 4H); 1,86 (м, 1H); 1,99 (м, 1H); 3,03 (т, J=9,2 Гц, 1H); 3,21 (кв., J=9,2 Гц, 1H); 3,38 (м, 3H); 3,56 (т, J=8 Гц, 1H); 5,67 (д, J=7,9 Гц, 1H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,28 (д, J=2,4 Гц, 1H); 6,85 (д, J=8,2 Гц, 1H); 9,04 (с, 1H); 9,25 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 25,1, 25,3, 30,6, 33,3, 36,9, 45,0, 48,7, 50,7, 102,4, 105,9, 118,0, 127,0, 155,8, 155,9, 156,6.
ПРИМЕР 7: фениламид 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
Фениламид 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 6, но с применением фенилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,94-2,09 (м, 2H); 3,23 (т, J=9,4 Гц, 1H); 3,37 (м, 1H); 3,48 (м, 1H); 3,54 (м, 1H); 3,76 (дд, J=7,7 & 9,5 Гц, 1H); 6,17 (дд, J=8,4 & 2,4 Гц, 1H); 6,30 (д, J=2,4 Гц, 1H); 6,89 (м, 2H); 7,21 (т, J=7,6 Гц, 2H); 7,51 (д, J=7,6 Гц, 2H), 9,08 (с, 1H); 9,31 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 30,5, 37,0, 45,4, 51,0, 102,4, 106,0, 117,7, 119,3, 121,4, 127,2, 128,2, 140,6, 153,8, 156,0, 156,7.
ПРИМЕР 8: (4-фторфенил)амид 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
(4-фторфенил)амид 3-(2,4-дигидроксифенил)-пирролидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 6, но с применением 4-фторфенилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,93-2,08 (м, 2H); 3,24 (т, J=9,4 Гц, 1H); 3,37 (м, 1H); 3,44 (м, 1H); 3,53 (м, 1H); 3,76 (дд, J=7,7 & 9,5 Гц, 1H); 6,17 (дд, J=8,4 & 2,4 Гц, 1H); 6,30 (д, J=2,4 Гц, 1H); 6,91 (д, J=8,3 Гц, 1H); 7,05 (т, J=8,8 Гц, 2H); 7,51 (м, 2H); 8,15 (с, 1H); 9,08 (с, 1H); 9,31 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 30,5, 37,0, 45,4, 51,0, 102,5, 106,0, 114,7, 117,7, 121,0, 127,1, 137,0, 155,9, 156,7, 158,3.
ПРИМЕР 9: (4-трифторметилфенил)амид 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты (4-трифторметилфенил)амид получают способом, аналогичным способу из примера 6, но с применением 4-трифторметилфенилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,95-2,08 (м, 2H); 3,26 (т, J=9,4 Гц, 1H); 3,37 (м, 1H); 3,44 (м, 1H); 3,57 (м, 1H); 3,77 (дд, J=7,7 & 9,5 Гц, 1H); 6,17 (дд, J=8,4 & 2,4 Гц, 1H); 6,30 (д, J=2,4 Гц, 1H); 6,90 (д, J=8,3 Гц, 1H); 7,56 (д, J=8,7 Гц, 1H); 7,76 (д, J=8,7 Гц, 2H); 8,52 (с, 1H); 9,08 (с, 1H); 9,33 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 30,4, 37,0, 45,5, 51,0, 102,5, 106,0, 117,5, 118,6, 121,1 (кв), 124,6 (кв), 125,4, 127,2, 153,38, 156,0, 156,7.
ПРИМЕР 10: этиловый эфир 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
a) этиловый эфир 4-(2,4-бис(бензилокси)фенил)-4-гидроксипиперидин-1-карбоновой кислоты
В 500-мл трехгорлой колбе растворяют 20 г 2,4-бис(бензилокси)-1-бромбензола в 240 мл тетрагидрофурана. Смесь охлаждают до -70°C, а затем добавляют 26 мл 2,5 М н-бутиллития в гексане. Реакционную смесь перемешивают при -70°C в течение 1 часа, а затем по каплям добавляют 11,1 г этилового эфира 4-оксопиперидин-1-карбоновой кислоты. Реакционную смесь перемешивают при -70°C в течение 2 часов, а затем оставляют на ночь при температуре окружающей среды. Реакционную смесь выливают в 100 мл 2 М раствора соляной кислоты, а затем экстрагируют 400 мл этилацетата. Органические фазы объединяют, промывают 150 мл воды, а затем сушат над сульфатом магния и выпаривают.
Остаток кристаллизуют из смеси дихлорметан/гептан. Получают 16 г этиловый эфир 4-(2,4-бис(бензилокси)фенил)-4-гидроксипиперидин-1-карбоновой кислоты. Выход: 62%.
b) этиловый эфир 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
В смеси 50 мл метанола растворяют 1 г этилового эфира 4-(2,4-бис(бензилокси)фенил)-4-гидрокси-пиперидин-1-карбоновой кислоты, а затем добавляют 0,5 г 10% палладия на угле. Реакционную смесь перемешивают в течение 2 часов в атмосфере водорода. Реакционную смесь фильтруют и затем остаток кристаллизуют из дихлорметана. Получают 0,5 г этиловый эфир 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты. Выход=86%.
1H ЯМР (DMSO, 400 мГц): 1,17 (т, J=1 Гц, 3H); 1,38 (м, 2H); 1,64 (м, 2H); 2,84 (м, 3H) 4,01 (м, 4H); 6,12 (дд, J=8,4 & 2,4 Гц, 1H); 6,25 (д, J=2,4 Гц, 1H); 6,79 (д, J=8,3 Гц, 1H); 8,96 (с, 1H); 9,14 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 14,6, 31,6, 34,6, 44,2, 60,5, 102,3, 106,0, 122,1, 126,7, 154,6, 155,2, 156,2.
ПРИМЕР 11: [4-(2,4-дигидроксифенил)пиперидин-1-ил]фенилметанон
a) этиловый эфир 4-(2,4-бис(бензилокси)фенил)пиперидин-1-карбоновой кислоты
В 100-мл круглодонную колбу малыми порциями в раствор 6,2 г этилового эфира 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты (пример 10) в 62 мл метилэтилкетона добавляют 9,7 г карбоната калия.
По каплям добавляют 6,7 мл бензилбромида и затем реакционную смесь перемешивают в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь фильтруют и затем остаток подвергают хроматографии на силикагеле (гептан/этилацетат 80/20).
Получают 9,8 г этилового эфира 4-(2,4-бис(бензилокси)фенил)пиперидин-1-карбоновой кислоты. Выход=92%.
b) 4-(2,4-бис(бензилокси)фенил)пиперидин
В 500-мл трехгорлой колбе растворяют 9 г этилового эфира 4-(2,4-бис(бензилокси)фенил)пиперидин-1-карбоновой кислоты в 180 мл этанола, а затем добавляют 40 мл 5 М раствора гидроксида натрия. Реакционную смесь доводят до температуры кипения с обратным холодильником в течение 48 часов. Реакционную смесь выливают в 400 мл воды. Твердое вещество отфильтровывают, а затем проводят хроматографию на силикагеле (дихлорметан/метанол 98/2). Получают 3,8 г 4-(2,4-бис(бензилокси)фенил)пиперидина.
c) [4-(2,4-бис(бензилокси)фенил)пиперидин-1-ил]фенилметанон
В 25-мл круглодонной колбе растворяют 0,5 г 4-(2,4-бис(бензилокси)фенил)пиперидина в 10-мл тетрагидрофурана в присутствии 0,26 мл N,N-диизопропилэтиламина. Добавляют 0,17 мл бензоилхлорида и затем смесь перемешивают в течение 24 часов при температуре окружающей среды. Реакционную смесь экстрагируют этилацетатом, а затем органические фазы объединяют и сушат над сульфатом магния. Остаток подвергают хроматографии на силикагеле (гептан/этилацетат 8/2). Получают 0,5 г [4-(2,4-бис(бензилокси)фенил)-пиперидин-1-ил]фенилметанона. Выход=80%.
d) [4-(2,4-дигидроксифенил)пиперидин-1-ил]фенилметанон
В 25-мл круглодонной колбе растворяют 0,5 г [4-(2,4-бис(бензилокси)фенил)пиперидин-1-ил]фенилметанон в 15 мл метанола в присутствии 0,2 г 10% палладия на угле. Реакционную смесь перемешивают в течение 48 часов в атмосфере водорода. Реакционную смесь фильтруют и затем остаток подвергают хроматографии на силикагеле (гептан/этилацетат 1/1).
Получают 0,3 г [4-(2,4-дигидроксифенил)пиперидин-1-ил]фенилметанона. Выход=96%.
1H ЯМР (DMSO, 400 мГц): 1,50 (уш.м, 2H); 1,59 (уш.м, 1H); 1,75, (уш.м, 1H); 2,79 (уш.м, 1H); 2,97 (м, 1H); 3,11 (уш.м, 1H); 3,62 (уш.м, 1H); 4,59 (уш.м, 1H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,27 (д, J=2,4 Гц, 1H); 6,85 (д, J=8,3 Гц, 1H); 7,41 (м, 5H); 8,98 (с, 1H), 9,17 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 31,7, 34,6, 47,9, 102,4, 106,0, 122,0, 126,6, 126,9, 128,3, 129,2, 136,6, 139,6, 155,1, 156,1, 168,8, 170,3.
ПРИМЕР 12: бутиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
a) бутиламид 4-(2,4-бис(бензилокси)фенил)пиперидин-1-карбоновой кислоты
В 10-мл круглодонной колбе растворяют 0,25 г 4-(2,4-бис(бензилокси)фенил)пиперидина в 5 мл тетрагидрофурана в присутствии 0,23 мл N,N-диизопропилэтиламина. Добавляют 0,08 мл бутилизоцианата и затем реакционную смесь перемешивают в течение 20 минут при температуре окружающей среды. Реакционную смесь экстрагируют этилацетатом, а затем органические фазы объединяют и сушат над сульфатом магния. Остаток подвергают хроматографии на силикагеле (гептан/этилацетат 8/2). Получают 0,25 г бутиламида 4-(2,4-бис(бензилокси)фенил)пиперидин-1-карбоновой кислоты. Выход=78%.
b) бутиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
В 25-мл круглодонной колбе растворяют 0,25 г бутиламида 4-(2,4-бис(бензилокси)фенил)пиперидин-1-карбоновой кислоты в 9 мл метанола в присутствии 0,1 г 10% палладия на угле. Реакционную смесь перемешивают в течение 4 часов в атмосфере водорода. Реакционную смесь фильтруют. Получают 0,14 г бутиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты. Выход=90%.
1H ЯМР (DMSO, 400 мГц): 0,86 (т, J=7 Гц, 3 H); 1,30 (м, 2H); 1,37 (м, 4H); 1,60 (м, 2H); 2,62 (м, 2H); 2,80 (м, 1H); 3,00 (м, 2H); 4,03 (м, 2H); 6,12 (дд, J=8,4 & 2,4 Гц, 1H); 6,25 (д, J=2,4 Гц, 1H); 6,38 (т, J=5,4 Гц, 1H); 6,77 (д, J=8,2 Гц, 1H); 8,95 (с, 1H); 9,11 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 13,8, 19,6, 31,7, 32,0, 34,7, 44,3, 102,3, 106,0, 122,5, 126,7, 155,2, 156,0, 157,3.
ПРИМЕР 13: пропиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
Пропиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением пропилизоцианата.
1H ЯМР (DMSO, 400 мГц): 0,86 (т, J=1 Гц, 3 H); 1,37 (м, 4H); 1,59 (м, 2H); 2,65 (м, 2H); 2,79 (м, 1H); 2,97 (м, 2H); 4,03 (м, 2H); 6,12 (дд, J=8,4 & 2,4 Гц, 1H); 6,25 (д, J=2,4 Гц, 1H); 6,41 (т, J=5,4 Гц, 1H); 6,77 (д, J=8,2 Гц, 1H); 8,95 (с, 1H); 9,12 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 11,3, 23,0, 31,7, 34,7, 41,9, 44,3, 102,3, 106,0, 122,5, 126,7, 155,2, 156,0, 157,3.
ПРИМЕР 14: 1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]бутан-1-он
1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]бутан-1-он получают способом, аналогичным способу из примера 11c, но с применением бутаноилхлорида.
1H ЯМР (DMSO, 400 мГц): 0,86 (т, J=7,5 Гц, 3H); 1,29-1,55 (м, 4H); 1,67 (м, 2H); 2,27 (т, J=8 Гц, 2H); 2,48 (уш.м, 1H); 2,90 (т, J=11,6 Гц, 1H); 3,02 (т, J=12,8 Гц, 1H); 3,91 (уш.д, J=12,8 Гц, 1H); 4,50 (уш.д, J=13,2 Гц, 1H); 6,13 (дд, J=8,4 & 2,4 Гц, 1H); 6,24 (д, J=2,4 Гц, 1H); 6,77 (д, J=8,3 Гц, 1H); 8,93 (с, 1H), 9,11 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 14,3, 18,8, 32,1 & 32,9, 34,8, 35,1, 42,3 & 46,3, 102,8, 106,5, 122,6, 127,2, 155,6, 156,6, 170,5.
ПРИМЕР 15: 1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-метилпропан-1-он
1-[4-(2,4-дигидроксифенил)-пиперидин-1-ил]-2-метилпропан-1-он получают способом, аналогичным способу из примера 11c, но с применением 2-метилпропаноилхлорида.
1H ЯМР (DMSO, 400 мГц): 0,96 (2т, J=7,5 Гц, 6H); 1,28-1,46 (м, 2H); 1,68 (м, 2H); 2,51 (уш.м, 1H); 2,87 (м, 2H); 3,05 (т, J=12,8 Гц, 1H); 4,01 (уш.д, J=12,8 Гц, 1H); 4,53 (уш.д, J=13,2 Гц, 1H); 6,13 (дд, J=8,4 & 2,4 Гц, 1H); 6,25 (д, J=2,4 Гц, 1H); 6,79 (д, J=8,3 Гц, 1H); 8,97 (с, 1H), 9,15 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 19,3, 19,6, 28,9, 31,6 & 32,6, 34,7, 42,0 & 45,6, 102,3, 106,0, 122,0, 126,7, 155,2, 156,1, 173,9.
ПРИМЕР 16: фениламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
Фениламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением фенилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,46 (м, 2H); 1,70 (д, J=11,6 Гц, 2H); 2,82 (т, J=11,4 Гц, 2H); 2,90 (м, 1H); 4,23 (д, J=13,1 Гц, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,25 (д, J=2,4 Гц, 1H); 6,82 (д, J=8,3 Гц, 1H); 6,91 (т, J=8,2 Гц, 1H); 7,21 (т, J=8 Гц, 2H); 7,45 (д, J=8 Гц, 2H); 8,47 (с, 1H); 8,97 (с, 1H); 9,16 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 31,8, 34,7, 44,7, 102,4, 106,0, 119,5, 121,4, 122,3, 126,8, 128,2, 140,7, 154,9, 155,2, 156,1.
ПРИМЕР 17: (4-фторфенил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
(4-фторфенил)амид 4-(2,4-дигидроксифенил)-пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением 4-фторфенилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,46 (м, 2H); 1,69 (д, J=11,6 Гц, 2H); 2,82 (т, J=11,4 Гц, 2H); 2,90 (м, 1H); 4,22 (д, J=13,1 Гц, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,28 (д, J=2,4 Гц, 1H); 6,81 (д, J=8,3 Гц, 1H); 7,08 (т, J=8,2 Гц, 2H); 7,46 (м, 2H); 8,51 (с, 1H); 9,00 (с, 1H); 9,16 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 31,8, 34,7, 44,6, 102,4, 106,0, 114,6, 121,2, 122,3, 126,8, 137,0, 154,9, 155,2, 156,0, 156,1, 158,4.
ПРИМЕР 18: п-толиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
п-Толиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением п-толилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,46 (м, 2H); 1,69 (д, J=11,6 Гц, 2H); 2,22 (с, 3H); 2,83 (т, J=11,4 Гц, 2H); 2,90 (м, 1H); 4,22 (д, J=13,1 Гц, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,27 (д, J=2,4 Гц, 1H); 6,82 (д, J=8,3 Гц, 1H); 7,02 (д, J=8,2 Гц, 2H); 7,34 (д, J=8 Гц, 2H); 8,37 (с, 1H); 8,97 (с, 1H); 9,15 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 20,3, 31,8, 34,7, 44,6, 102,4, 106,0, 119,7, 122,3, 126,8, 128,6, 130,2, 138,1, 154,9, 155,2, 156,1.
ПРИМЕР 19: фенэтиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
Фенэтиламид 4-(2,4-дигидроксифенил)-пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением фенэтилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,34 (м, 2H); 1,60 (д, J=11,6 Гц, 2H); 2,64-2,73 (м, 4H); 2,83 (м, 1H); 3,22 (м, 2H); 4,02 (д, J=13,1 Гц, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,54 (м, 1H); 6,78 (д, J=8,3 Гц, 1H); 7,18 (м, 3H); 7,28 (м, 2H); 8,97 (с, 1H); 9,12 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 31,7, 34,7, 36,0, 41,9, 44,3, 102,4, 106,0, 122,5, 125,8, 126,7, 128,2, 128,6, 139,9, 155,4,1, 156,0, 157,2.
ПРИМЕР 20: (3-фторфенил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
(3-фторфенил)амид 4-(2,4-дигидроксифенил)-пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением 3-фторфенилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,46 (м, 2H); 1,69 (д, J=11,6 Гц, 2H); 2,82 (т, J=11,4 Гц, 2H); 2,90 (м, 1H); 4,22 (д, J=13,1 Гц, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,27 (д, J=2,4 Гц, 1H); 6,70 (м, 1H); 6,81 (д, J=8,3 Гц, 1H); 7,24 (м, 2H); 7,47 (д, J=18 Гц, 1H); 8,70 (с, 1H); 9,00 (с, 1H); 9,17 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 31,8, 34,7, 44,7, 102,4, 106,0, 107,6, 114,9, 122,2, 126,8, 129,6, 142,7, 154,5, 155,2, 156,1, 162,1.
ПРИМЕР 21: ((R)-1-фенилэтил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
((R)-1-фенил-этил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением ((R)-1-изоцианатоэтил)бензола.
1H ЯМР (DMSO, 400 мГц): 1,35 (д, J=7,1 Гц, 3H); 1,38 (м, 2H); 1,62 (м, 2H); 2,82 (т, J=13 Гц, 2H); 2,83 (м, 1H); 4,22 (д, J=12,3 Гц, 2H); 4,84 (м, 1H); 6,13 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,73 (д, J=7,9 Гц, 1H); 6,78 (д, J=8,3 Гц, 1H); 7,18 (м, 1H); 7,32 (м, 4H); 8,96 (с, 1H); 9,13 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 22,8, 31,7, 31,8, 44,4, 49,3, 102,4, 106,0, 122,5, 125,9, 126,1, 126,7, 127,9, 146,3, 155,2, 156,0, 156,6.
ПРИМЕР 22: метилфениламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
1H ЯМР (DMSO, 400 мГц): 1,28 (м, 2H); 1,48 (д, J=12 Гц, 2H); 2,62 (т, J=12,6 Гц, 2H); 2,77 (м, 1H); 3,09 (с, 3H); 3,80 (д, J=13 Гц, 2H); 6,13 (дд, J=8,4 & 2,4 Гц, 1H); 6,22 (д, J=2,4 Гц, 1H); 6,70 (д, J=7,9 Гц, 1H); 7,11 (м, 3H); 7,35 (м, 2H); 8,96 (с, 1H); 9,09 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 31,2, 34,4, 38,8, 46,0, 102,3, 106,0, 122,2, 122,6, 123,6, 126,6, 129,2, 146,7, 155,1, 156,0, 160,0.
ПРИМЕР 23: пиридин-2-иламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
a) 4-нитрофениловый эфир пиридин-2-илкарбаминовой кислоты
Растворяют 0,5 г 2-аминопиридина в 10-мл дихлорметана, а затем добавляют 1,18 г 4-нитрофенилхлорформиата, а также 1,85 мл N,N-диизопропилэтиламина. Реакционную смесь перемешивают в течение одного часа при температуре окружающей среды. В реакционную смесь добавляют 50 мл воды, а затем смесь экстрагируют 50 мл дихлорметана. Растворители выпаривают, а затем твердое вещество используют на следующем этапе без дополнительной очистки.
b) пиридин-2-иламид 4-(2,4-бис(бензилокси)фенил)пиперидин-1-карбоновой кислоты
0,5 г 4-(2,4-бис(бензилокси)фенил)пиперидинхлорида суспендируют в 5 мл диметилформамида, а затем добавляют 0,43 мл N,N-диизопропилэтиламина, а также 0,38 г 4-нитрофенилового эфира пиридин-2-илкарбаминовой кислоты в растворе 2 мл диметилформамида. Реакционную смесь перемешивают в течение 24 часов при 80°C. Ее нагревают при 80°C в течение 24 часов. Добавляют 50 мл воды, а затем реакционную смесь экстрагируют 50 мл этилацетата. Растворители выпаривают, а затем остаток подвергают хроматографии на силикагеле (гептан/этилацетат 70/30). Получают 20 мг пиридин-2-иламида 4-(2,4-бис(бензилокси)фенил)пиперидин-1-карбоновой кислоты.
c) пиридин-2-иламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
20 мг пиридин-2-иламида 4-(2,4-бис(бензилокси)фенил)пиперидин-1-карбоновой кислоты растворяют в 20 мл этилацетата, а затем добавляют 1 мл метанола. Добавляют 10 мг 10% палладия на угле, а затем реакционную смесь перемешивают в течение 18 часов в атмосфере водорода. Смесь фильтруют и затем остаток кристаллизуют из смеси этилацетата/гептана. Получают 5 мг пиридин-2-иламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты. Выход: 39%
1H ЯМР (DMSO, 400 мГц): 1,458 (м, 2H); 1,68 (м, 2H); 2,85 (м, 3H); 4,26 (д, J=13,6 Гц, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,25 (д, J=2,4 Гц, 1H); 6,81 (д, J=7,9 Гц, 1H); 6,95 (м, 1H); 7,66 (м, 1H); 7,78 (д, J=7,9 Гц, 1H); 8,21 (м, 1H); 8,97 (с, 1H); 9,09 (с, 1H), 9,15 (с, 1H).
ПРИМЕР 24: ((S)-1-фенилэтил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
((S)-1-фенил-этил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением ((S)-1-изоцианатоэтил)бензола.
1H ЯМР (DMSO, 400 мГц): 1,35 (д, J=7,1 Гц, 3H); 1,38 (м, 2H); 1,62 (м, 2H); 2,82 (т, J=13 Гц, 2H); 2,83 (м, 1H); 4,22 (д, J=12,3 Гц, 2H); 4,84 (м, 1H); 6,13 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,73 (д, J=7,9 Гц, 1H); 6,78 (д, J=8,3 Гц, 1H); 7,18 (м, 1H); 7,32 (м, 4H); 8,96 (с, 1H); 9,13 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 22,8, 31,7, 31,8, 44,4, 49,3, 102,4, 106,0, 122,5, 125,9, 126,1, 126,7, 127,9, 146,3, 155,2, 156,0, 156,6.
ПРИМЕР 25: ((S)-1-фенилпропил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
((S)-1-фенилпропил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением ((S)-1-изоцианатопропил)бензола.
1H ЯМР (DMSO, 400 мГц): 0,82 (т, J=7,1 Гц, 3H); 1,37 (м, 2H); 1,67 (м, 4H); 2,67 (м, 2H); 2,83 (м, 1H); 4,12 (д, J=12,3 Гц, 2H); 4,56 (м, 1H); 6,13 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,65 (д, J=7,9 Гц, 1H); 6,77 (д, J=8,3 Гц, 1H); 7,18 (м, 1H); 7,29 (м, 4H); 8,96 (с, 1H); 9,11 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 11,4, 29,3, 31,7, 34,7, 44,5, 55,8, 102,4, 106,0, 122,5, 126,1, 126,4, 126,7, 127,9, 145,4, 155,1, 156,0, 156,9.
ПРИМЕР 26: (R)-2-амино-1-[4-(2,4-дигидроксифенил)-пиперидин-1-ил]-3-фенилпропан-1-он
a) бензиловый эфир {(R)-1-бензил-2-[4-(2,4-бис(бензилокси)фенил)пиперидин-1-ил]-2-оксоэтил}карбаминовой кислоты
В 50-мл круглодонной колбе растворяют 0,615 г Z-L-фенилаланина в 10-мл диметилформамида, и добавляют 0,43 г 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC), а также 0,305 г 1-гидроксибензотриазола (HOBT), и затем реакционную смесь перемешивают в течение 5 минут при температуре окружающей среды.
Добавляют 1 г 4-(2,4-бис(бензилокси)фенил)пиперидингидрохлорида, а также 0,36 мл диизопропиламина. Реакционную смесь перемешивают в течение 1 часа при температуре окружающей среды. Реакционную смесь промывают 20 мл 5% лимонной кислоты, а затем экстрагируют 20 мл этилацетата, органическую фазу промывают 20 мл 1 М раствора гидроксида натрия, и органическую фазу сушат над сульфатом магния. После выпаривания растворителей, неочищенный продукт подвергают хроматографии на силикагеле. Получают 1,23 г бензилового эфира {(R)-1-бензил-2-[4-(2,4-бис(бензилокси)фенил)пиперидин-1-ил]-2-оксоэтил}карбаминовой кислоты.
b) (R)-2-амино-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-3-фенилпропан-1-он
В 25-мл круглодонной колбе растворяют 1,23 г бензилового эфира {(R)-1-бензил-2-[4-(2,4-бис(бензилокси)фенил)пиперидин-1-ил]-2-оксоэтил}карбаминовой кислоты в 15 мл метанола, а также 15 мл этилацетата в присутствии 0,25 г 10% палладия на угле. Реакционную смесь перемешивают в течение 18 часов в атмосфере водорода. Реакционную смесь фильтруют. Остаток подвергают хроматографии на силикагеле (дихлорметан/метанол 95/5). Получают 0,625 г (R)-2-амино-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-3-фенилпропан-1-она. Выход=64%.
1H ЯМР (DMSO, 400 мГц): 0,6 (м, 1H); 1,09 (м, 1H); 1,30-1,75 (м, 5H); 2,56-2,97 (м, 4 H); 3,94 (м, 2H); 4,51 (д, J=12,8 Гц, 1H); 6,11 (м, 1H); 6,24 (м, 1H); 6,57 & 6,77 (д, J=8,3 Гц, 1H); 7,18-7,40 (м, 5H); 8,97 (с, 1H); 9,11 & 9,15 (с, 1H).
13C ЯМР (DMSO, 100 мГц): (затруднение вращения) 31,6, 32,3, 31,1, 34,6, 42,0, 42,2, 42,7, 45,3, 45,6, 51,3, 51,6, 102,3, 105,9, 121,9, 126,0, 126,7, 127,9, 128,1, 129,4, 138,5, 155,0, 156,0, 172,6.
ПРИМЕР 27: 1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-3-фенилпропан-1-он
1-[4-(2,4-дигидроксифенил)-пиперидин-1-ил]-3-фенилпропан-1-он получают способом, аналогичным способу из примера 11c, но с применением 3-фенилпропионилхлорида.
1H ЯМР (DMSO, 400 мГц): 1,33 (м, 2H); 1,63 (м, 2H); 2,50-2,70 (м, 3H); 2,80-3,0 (м, 4 H); 3,92 (д, J=12,8 Гц, 1H); 4,53 (д, J=12,8 Гц, 1H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,75 (д, J=7,9 Гц, 1H); 7,15-7,29 (м, 5H); 8,97 (с, 1H); 9,11 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 30,9, 31,6, 32,2, 33,9, 34,5, 42,0, 45,8, 102,4, 106,0, 122,1, 125,8, 126,7, 128,2, 128,4, 141,5, 155,2, 156,1, 169,5.
ПРИМЕР 28: 2-фторбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
2-фторбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением 2-фторбензилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,40 (м, 2H); 1,63 (м, 2H); 2,76 (т, J=13 Гц, 2H); 2,84 (м, 1H); 4,02 (д, J=12,3 Гц, 2H); 4,28 (д, J=5,5 Гц, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,73 (д, J=7,9 Гц, 1H); 7,03 (т, J=5,6 Гц, 1H); 7,16 (м, 2H); 7,28 (м, 2H); 8,96 (с, 1H); 9,13 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 31,7, 34,7, 37,0, 44,4, 102,4, 106,0, 114,7, 122,4, 124,1, 126,7, 127,7, 128,2, 129,0, 155,2, 156,0, 157,2, 158,6, 161,0.
ПРИМЕР 29: 3-фторбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
3-фторбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением 3-фторбензилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,38 (м, 2H); 1,63 (м, 2H); 2,73 (т, J=13 Гц, 2H); 2,86 (м, 1H); 4,04 (д, J=12,3 Гц, 2H); 4,23 (д, J=5,5 Гц, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,79 (д, J=7,9 Гц, 1H); 7,06 (м, 4H); 7,34 (м, 1H); 8,96 (с, 1H); 9,13 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 31,8, 24,7, 43,1, 44,5, 102,5, 106,1, 113,0 & 113,2, 113,5 & 113,7, 122,5, 123,0, 126,8, 130,0, 144,6, 155,3, 156,1, 157,3.
ПРИМЕР 30: 4-фторбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
4-фторбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением 4-фторбензилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,38 (м, 2H); 1,63 (м, 2H); 2,71 (т, J=13 Гц, 2H); 2,84 (м, 1H); 4,04 (д, J=12,3 Гц, 2H); 4,21 (д, J=5,5 Гц, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,78 (д, J=7,9 Гц, 1H); 7,05 (т, J=5,6 Гц, 1H); 7,13 (м, 2H); 7,28 (м, 2H); 8,96 (с, 1H); 9,13 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 31,7, 34,7, 42,8, 44,4, 102,4, 106,0, 114,7, 122,4, 126,7, 128,8, 137,4, 155,2, 156,0, 157,2, 159,7 & 162,1.
ПРИМЕР 31: бензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
Бензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением бензилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,41 (м, 2H); 1,63 (м, 2H); 2,72 (т, J=13 Гц, 2H); 2,85 (м, 1H); 4,02 (д, J=12,3 Гц, 2H); 4,24 (д, J=5,5 Гц, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,79 (д, J=7,9 Гц, 1H); 7,05 (т, J=5,6 Гц, 1H); 7,24 (м, 5H); 7,28 (м, 2H); 8,96 (с, 1H); 9,13 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 31,7, 34,7, 43,5, 44,4, 102,4, 106,0, 122,4, 126,3, 126,7, 126,9, 128,0, 141,2, 155,2, 156,0, 157,3.
ПРИМЕР 32: 2-метилбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
2-метилбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением 2-метилбензилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,40 (м, 2H); 1,62 (м, 2H); 2,27 (с, 3H); 2,73 (т, J=13 Гц, 2H); 2,85 (м, 1H); 4,10 (д, J=12,3 Гц, 2H); 4,22 (д, J=5,5 Гц, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,79 (д, J=7,9 Гц, 1H); 6,90 (т, J=5,6 Гц, 1H); 7,09-7,20 (м, 4H); 7,28 (м, 2H); 9 (уш.с, 1H); 9,12 (уш.с, 1H).
13C ЯМР (DMSO, 100 мГц): 18,6, 31,8, 34,7, 41,4, 44,5, 102,4, 106,0, 122,4, 125,5, 126,2, 126,7, 126,9, 129,6, 135,0, 138,7, 155,2, 156,0, 157,3.
ПРИМЕР 33: 3-метилбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
3-метилбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением 3-метилбензилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,40 (м, 2H); 1,62 (м, 2H); 2,28 (с, 3H); 2,72 (т, J=13 Гц, 2H); 2,86 (м, 1H); 4,02 (д, J=12,3 Гц, 2H); 4,20 (д, J=5,5 Гц, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,78 (д, J=7,9 Гц, 1H); 7,00-7,06 (м, 4H); 7,18 (т, J=7,6 Гц, 1H); 8,99 (с, 1H); 9,13 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 21,0, 31,7, 34,7, 43,4, 44,5, 102,4, 106,0, 122,5, 124,1, 126,7, 126,9, 127,6, 127,9, 136,9, 141,1, 155,2, 156,0, 157,3.
ПРИМЕР 34: 4-метилбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
4-метилбензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением 4-метилбензилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,41 (м, 2H); 1,62 (м, 2H); 2,27 (с, 3H); 2,71 (т, J=13 Гц, 2H); 2,84 (м, 1H); 4,08 (д, J=12 Гц, 2H); 4,19 (д, J=5,5 Гц, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,78 (д, J=7,9 Гц, 1H); 6,99 (т, J=5,6 Гц, 1H); 7,12 (2д, J=8 Гц, 4H); 8,96 (с, 1H); 9,13 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 20,8, 31,9, 34,9, 43,4, 44,6, 102,6, 106,2, 122,7, 126,9, 127,2, 128,7, 135,4, 138,4, 155,4, 156,3, 157,5.
ПРИМЕР 35: 2-метоксибензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
2-метоксибензиламид 4-(2,4-дигидроксифенил)-пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением 2-метоксибензилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,41 (м, 2H); 1,63 (м, 2H); 2,74 (т, J=13 Гц, 2H); 2,86 (м, 1H); 3,79 (с, 3H); 4,11 (д, J=12,3 Гц, 2H); 4,22 (д, J=5,5 Гц, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,79-6,95 (м, 4H); 7,13-7,22 (м, 2H); 9,00 (уш.с, 1H); 9,14 (уш.с, 1H).
13C ЯМР (DMSO, 100 мГц): 31,7, 34,7, 38,3, 44,5, 55,2, 102,4, 106,0, 110,1, 119,9, 122,5, 126,7, 126,9, 127,3, 128,6, 155,2, 156,1, 156,3, 157,4.
ПРИМЕР 36: 3-метоксибензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
3-метоксибензиламид 4-(2,4-дигидроксифенил)-пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением 3-метоксибензилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,41 (м, 2H); 1,63 (м, 2H); 2,72 (т, J=13 Гц, 2H); 2,86 (м, 1H); 3,73 (с, 3H); 4,09 (д, J=12,3 Гц, 2H); 4,21 (д, J=5,5 Гц, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,79 (м, 4H); 7,03 (т, J=5,6 Гц, 1H); 7,22 (т, J=8 Гц, 1H); 9,02 (уш.с, 1H); 9,10 (уш.с, 1H).
13C ЯМР (DMSO, 100 мГц): 31,7, 34,7, 43,4, 44,5, 54,9, 102,4, 106,0, 111,6, 112,6, 119,1, 122,5, 126,7, 129,0, 142,9, 155,2, 156,0, 157,3, 159,2.
ПРИМЕР 37: 4-метоксибензиламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
4-метоксибензиламид 4-(2,4-дигидроксифенил)-пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением 4-метоксибензилизоцианата.
1H ЯМР (DMSO, 400 мГц): 1,41 (м, 2H); 1,62 (м, 2H); 2,70 (т, J=13 Гц, 2H); 2,84 (м, 1H); 3,72 (с, 3H); 4,08 (д, J=12 Гц, 2H); 4,16 (д, J=5,5 Гц, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,78 (д, J=7,9 Гц, 1H); 6,87 (д, J=8 Гц, 2H); 7,12 (т, J=5,6 Гц, 1H); 7,18 (д, J=8 Гц, 2H); 9,06 (с, 2H).
13C ЯМР (DMSO, 100 мГц): 31,7, 34,7, 42,9, 44,4, 55,0, 102,4, 106,0, 113,4, 122,4, 126,7, 128,3, 133,2, 155,2, 156,1, 157,3, 157,9.
ПРИМЕР 38: ((S)-1-п-толилэтил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
((S)-1-п-толилэтил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением ((S)-1-изоцианатоэтил)-4-метилбензола.
1H ЯМР (DMSO, 400 мГц): 1,35 (д, J=7,1 Гц, 3H); 1,38 (м, 2H); 1,62 (м, 2H); 2,26 (с, 3H); 2,67 (т, J=13 Гц, 2H); 2,83 (м, 1H); 4,11 (д, J=12,3 Гц, 2H); 4,84 (м, 1H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,67 (д, J=7,9 Гц, 1H); 6,77 (д, J=8,3 Гц, 1H); 7,09 (д, J=8 Гц, 2H); 7,20 (д, J=8 Гц, 2H); 8,96 (с, 1H); 9,12 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 18,5, 20,6, 22,9, 31,8, 34,7, 44,4, 49,0, 102,4, 106,0, 122,5, 125,8, 126,7, 128,5, 135,0, 143,2, 155,2, 156,0, 156,6.
ПРИМЕР 39: [(S)-1-(4-фторфенил)этил]амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
[(S)-1-(4-фторфенил)этил]амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением 1-фтор-4-((S)-1-изоцианатоэтил)бензола.
1H ЯМР (DMSO, 400 мГц): 1,35 (д, J=7,1 Гц, 3H); 1,38 (м, 2H); 1,62 (м, 2H); 2,67 (т, J=13 Гц, 2H); 2,83 (м, 1H); 4,09 (д, J=12,3 Гц, 2H); 4,84 (м, 1H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,74 (д, J=7,9 Гц, 1H); 6,78 (д, J=8,3 Гц, 1H); 7,09 (т, J=8,9 Гц, 2H); 7,35 (м, 2H); 8,96 (с, 1H); 9,12 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 22,8, 31,7, 34,7, 44,4, 48,7, 102,4, 106,0, 114,5, 122,4, 126,7, 127,8, 142,4, 155,2, 156,0, 156,5, 160,7 (д, J=241 Гц).
ПРИМЕР 40: (S)-индан-1-иламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
(S)-индан-1-иламид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением (S)-1-изоцианатоиндана.
1H ЯМР (DMSO, 400 мГц): 1,38 (м, 2H); 1,62 (м, 2H); 1,86 (м, 1H); 2,36 (м, 1H); 2,68-2,93 (м, 5H); 4,13 (д, J=12,3 Гц, 2H); 5,23 (м, 1H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,71 (д, J=7,9 Гц, 1H); 6,80 (д, J=8,3 Гц, 1H); 7,20 (м, 4H); 9,07 (уш.с, 2H).
13C ЯМР (DMSO, 100 мГц): 29,6, 31,7, 33,2, 34,7, 44,5, 55,3, 102,4, 106,0, 122,5, 123,9, 124,3, 126,1, 126,7, 126,9, 142,6, 145,4, 155,2, 156,0, 157,4.
ПРИМЕР 41: ((S)-1-нафтален-1-илэтил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
((S)-1-нафтален-1-илэтил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением 1-((S)-1-изоцианатоэтил)нафталена.
1H ЯМР (DMSO, 400 мГц): 1,37 (м, 2H); 1,49 (д, J=7,1 Гц, 3H); 1,62 (м, 2H); 2,70 (т, J=13 Гц, 2H); 2,84 (м, 1H); 4,14 (т, J=12 Гц, 2H); 5,66 (м, 1H); 6,13 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,75 (д, J=7,9 Гц, 1H); 6,91 (д, J=7,7 Гц, 1H); 7,53 (м, 4H); 7,79 (д, J=8 Гц, 1H); 7,93 (д, J=8 Гц, 1H); 8,16 (д, J=8 Гц, 1H); 8,97 (с, 1H); 9,13 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 22,0, 31,7, 34,6, 44,6, 45,5, 102,4, 106,0, 122,2, 122,5, 123,3, 125,3, 125,4, 125,9, 126,7, 126,7, 128,5, 130,4, 133,3, 141,8, 155,2, 156,0, 156,5.
ПРИМЕР 42: ((S)-1-нафтален-2-илэтил)амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
((S)-1-нафтален-2-илэтил)амид 4-(2,4-дигидроксифенил)-пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 23a, но с применением (S)-1-нафтален-2-илэтиламина, а затем повторяя последовательность 23b и 23c.
1H ЯМР (DMSO, 400 мГц): 1,35 (м, 2H); 1,46 (д, J=7,1 Гц, 3H); 1,62 (м, 2H); 2,70 (т, J=13 Гц, 2H); 2,85 (м, 1H); 4,14 (д, J=12,9 Гц, 2H); 5,01 (м, 1H); 6,13 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,77 (д, J=7,9 Гц, 1H); 6,85 (д, J=7,7 Гц, 1H); 7,43-7,50 (м, 3H); 7,77 (с, 1H); 7,85 (м, 3H); 8,97 (с, 1H); 9,13 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 22,6, 31,2, 34,6, 44,5, 49,5, 102,4, 106,0, 122,5, 123,8, 125,1, 125,3, 125,9, 126,7, 127,4, 127,5, 131,9, 132,8, 143,8, 155,2, 156,0, 156,7.
ПРИМЕР 43: [(S)-1-(4-метоксифенил)этил]амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
[(S)-1-(4-метоксифенил)этил]амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением 1-((S)-1-изоцианатоэтил)-4-метоксибензола.
1H ЯМР (DMSO, 400 мГц): 1,33 (д, J=7,1 Гц, 3H); 1,38 (м, 2H); 1,62 (м, 2H); 2,66 (т, J=13 Гц, 2H); 2,83 (м, 1H); 3,72 (с, 3H); 4,06 (д, J=12,3 Гц, 2H); 4,79 (м, 1H); 6,13 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,64 (д, J=7,9 Гц, 1H); 6,78 (д, J=8,3 Гц, 1H); 6,85 (д, J=8,6 Гц, 2H); 7,23 (д, J=8,6 Гц, 2H); 8,96 (с, 1H); 9,13 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 22,9, 31,7, 34,7, 44,4, 48,6, 55,0, 102,4, 106,0, 113,3, 122,5, 126,7, 127,0, 138,2, 155,2, 156,0, 156,6, 157,7.
ПРИМЕР 44: [(S)-1-(3-метоксифенил)этил]амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
[(S)-1-(3-метоксифенил)этил]амид 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты получают способом, аналогичным способу из примера 12a, но с применением 1-((S)-1-изоцианатоэтил)-3-метоксибензола.
1H ЯМР (DMSO, 400 мГц): 1,33 (д, J=7,1 Гц, 3H); 1,38 (м, 2H); 1,62 (м, 2H); 2,68 (т, J=13 Гц, 2H); 2,84 (м, 1H); 3,73 (с, 3H); 4,10 (д, J=12,3 Гц, 2H); 4,81 (м, 1H); 6,13 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,70-6,79 (м, 5H); 7,20 (т, J=8,1 Гц, 1H); 8,96 (с, 1H); 9,13 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 22,9, 31,8, 34,6, 44,4, 49,3, 54,9, 102,4, 106,0, 111,3, 111,8, 118,2, 122,5, 126,7, 129,0, 148,0, 155,2, 156,0, 156,7, 159,1.
ПРИМЕР 45: (S)-2-амино-1-[4-(2,4-дигидроксифенил)-пиперидин-1-ил]-3-фенилпропан-1-он
(S)-2-амино-1-[4-(2,4-дигидроксифенил)-пиперидин-1-ил]-3-фенилпропан-1-он получают способом, аналогичным способу из примера 26, но с применением Z-D-фенилаланина.
1H ЯМР (DMSO, 400 мГц): 0,6 (м, 1H); 1,09 (м, 1H); 1,30-1,75 (м, 5H); 2,56-2,97 (м, 4H); 3,94 (м, 2H); 4,51 (д, J=12,8 Гц, 1H); 6,11 (м, 1H); 6,24 (м, 1H); 6,57 & 6,77 (д, J=8,3 Гц, 1H); 7,18-7,40 (м, 5H); 8,97 (с, 1H); 9,11 & 9,15 (с, 1H).
13C ЯМР (DMSO, 100 мГц): (затруднение вращения) 31,6, 32,3, 31,1, 34,6, 42,0, 42,2, 42,7, 45,3, 45,6, 51,3, 51,6, 102,3, 105,9, 121,9, 126,0, 126,7, 127,9, 128,1, 129,4, 138,5, 155,0, 156,0, 172,6.
ПРИМЕР 46: ((S)-1-фенилэтил)амид 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
a) 1,5-бис(бензилокси)-2-фтор-4-нитробензол
2,82 г (70,6 ммоль, 2,5 экв.) 60% гидрида натрия добавляют в раствор 7,6 г (70,6 ммоль, 2,5 экв.) бензилового спирта в 100 мл тетрагидрофурана. Реакционную смесь перемешивают при температуре окружающей среды в течение 1,5 часов, а затем в раствор в 50 мл тетрагидрофурана по каплям добавляют 5,0 г (28,2 ммоль, 1 экв.) 1,2,4-трифтор-5-нитробензола. Реакционную смесь кипятят с обратным холодильником в течение 3 часов. Реакционную смесь обрабатывают 150 мл 1 М соляной кислоты и экстрагируют этилацетатом. Органические фазы объединяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и выпаривают. Остаток подвергают хроматографии на силикагеле, проводя элюирование гептаном/этилацетатом 90/10. Получают 1,68 г 1,5-бис(бензилокси)-2-фтор-4-нитробензола. Выход=17%.
b) 1,5-бис(бензилокси)-2-фтор-4-аминобензол
508 мг (9,5 ммоль, 2 экв.) хлорида аммония с последующими 2,23 г (34,2 ммоль, 7,2 экв.) порошка цинка добавляют в раствор 1,68 г (4,75 ммоль, 1 экв.) 1,5-бис(бензилокси)-2-фтор-4-нитробензола в 50 мл воды. Реакционную смесь кипятят с обратным холодильником в течение 4 часов. Охлажденную реакционную смесь экстрагируют этилацетатом. Органические фазы объединяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и выпаривают. Остаток подвергают хроматографии на силикагеле, проводя элюирование гептаном/этилацетатом 85/15. Получают 930 мг 1,5-бис(бензилокси)-2-фтор-4-аминобензола. Выход=61%.
c) 1,5-бис(бензилокси)-2-фтор-4-йодбензол
7 мл 6M соляной кислоты добавляют в раствор 3,20 г (9,9 ммоль, 1 экв.) 1,5-бис(бензилокси)-2-фтор-4-аминобензола в 40 мл N,N-диметилформамида, охлаждают до 0°C. В раствор в 7 мл воды добавляют 683 мг (9,9 ммоль, 1 экв.) нитрита натрия, и реакционную смесь перемешивают при 0°C в течение 1 часа. В раствор в 8 мл воды добавляют 1,64 г (9,9 ммоль, 1 экв.) иодида калия, с последующими 190 мг (1,0 ммоль, 0,1 экв.) иодида меди, а затем реакционную смесь перемешивают при температуре окружающей среды в течение ночи. Реакционную смесь обрабатывают насыщенным раствором хлорида аммония и экстрагируют этилацетатом. Органические фазы объединяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и выпаривают. Остаток подвергают хроматографии на силикагеле, проводя элюирование гептаном/дихлорметаном 75/25. Получают 3,59 г 1,5-бис(бензилокси)-2-фтор-4-йодбензола. Выход=68%.
d) трет-бутиловый эфир 4-(2,4-бис(бензилокси)-5-фторфенил)пиперидин-1-карбоновой кислоты
В раствор 3,59 г (8,26 ммоль, 1 экв.) 1,5-бис(бензилокси)-2-фтор-4-йодбензола в 40 мл тетрагидрофурана добавляют 4,0 мл (9,9 ммоль, 1,2 экв.) 2,5 М н-бутиллития в гексане, охлаждают до -70°C. Реакционную смесь перемешивают при -70°C в течение 25 минут и в раствор в 20 мл тетрагидрофурана добавляют 1,97 г (9,9 ммоль, 1,2 экв.) 1-boc-4-пиперидона. Реакционную смесь перемешивают при -70°C в течение 1 часа и затем оставляют на ночь для возвращения к температуре окружающей среды. В реакционную смесь добавляют 30 мл насыщенного раствора хлорида аммония, после чего в нее добавляют 4 мл 2 М соляной кислоты, после чего перемешивают в течение 20 минут и затем экстрагируют этилацетатом. Органические фазы объединяют, сушат над сульфатом магния и выпаривают. Остаток подвергают хроматографии на силикагеле, проводя элюирование гептаном/этилацетатом 95/5, затем гептаном/этилацетатом 75/25 (с 0,1% TEA).
Получают 860 мг смеси трет-бутилового эфира 4-(2,4-бис(бензилокси)-5-фторфенил)пиперидин-1-карбоновой кислоты (25%) и 1-boc-4-пиперидона в форме желтого масла, которое кристаллизуется. Выход=5%.
e) трет-бутиловый эфир 4-(5-фтор-2,4-дигидроксифенил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты
Смесь 860 мг (0,42 ммоль, 1 экв.) 35% трет-бутилового эфира 4-(2,4-бис(бензилокси)-5-фторфенил)пиперидин-1-карбоновой кислоты в 10-мл этилацетата в присутствии 200 мг 10% палладия на угле перемешивают при температуре окружающей среды при давлении водорода 500 кПа в течение 17 часов. Добавляют 5 мл метанола и реакционную смесь перемешивают при температуре окружающей среды при давлении водорода 500 кПа в течение 29 часов. Реакционную смесь фильтруют через фильтровальную бумагу и фильтрат выпаривают. Остаток подвергают хроматографии на силикагеле, проводя элюирование гептаном/этилацетатом 60/40. Получают 192 мг трет-бутилового эфира 4-(5-фтор-2,4-дигидроксифенил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты. Выход=100%.
f) трет-бутиловый эфир 4-(2,4-бис(бензилокси)-5-фторфенил)пиперидин-1-карбоновой кислоты
241 мг (1,74 ммоль, 3 экв.) карбоната калия (325 меш) добавляют в раствор 181 мг (0,58 ммоль, 1 экв.) трет-бутилового эфира 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты в 3 мл ацетона. По каплям добавляют 152 мкл (1,28 ммоль, 2,2 экв.) бензилбромида. Реакционную смесь нагревают при 50°C в течение 20 часов. Растворитель выпаривают, а затем остаток обрабатывают смесью вода/этилацетат. Водную фазу экстрагируют этилацетатом и органические фазы объединяют, промывают раствором гидрокарбоната натрия, а затем насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и выпаривают. Остаток подвергают хроматографии на силикагеле, проводя элюирование гептаном/этилацетатом 85/15.
Получают 188 мг трет-бутилового эфира 4-(2,4-бис(бензилокси)-5-фторфенил)пиперидин-1-карбоновой кислоты. Выход=66%.
g) 4-(2,4-бис(бензилокси)-5-фторфенил)пиперидин
280 мкл (3,7 ммоль, 10 экв.) трифторуксусной кислоты добавляют в раствор 184 мг (0,37 ммоль, 1 экв.) трет-бутилового эфира 4-(2,4-бис(бензилокси)-5-фторфенил)пиперидин-1-карбоновой кислоты в 3 мл дихлорметана. Реакционную смесь перемешивают при температуре окружающей среды в течение 1 часа. Реакционную смесь обрабатывают 10-мл воды, а затем экстрагируют дихлорметаном. Органические фазы объединяют, промывают насыщенным раствором гидрокарбоната натрия, а затем насыщенным раствором хлорида натрия, сушат над сульфатом магния и выпаривают. Получают 150 мг 4-(2,4-бис(бензилокси)-5-фторфенил)пиперидина. Выход=100%.
h) ((S)-1-фенилэтил)амид 4-(2,4-бис(бензилокси)-5-фторфенил)пиперидин-1-карбоновой кислоты
65 мкл (0,45 ммоль, 1,2 экв.) (S)-(-)-фенилэтилизоцианата добавляют в раствор 147 мг (0,37 ммоль, 1 экв.) 4-(2,4-бис(бензилокси)-5-фторфенил)пиперидина в 3 мл тетрагидрофурана в присутствии 64 мкл (0,37 ммоль, 1 экв.) диметилэтиламина. Реакционную смесь перемешивают при температуре окружающей среды в течение 50 минут. Реакцию останавливают добавлением 5 мл воды, а затем экстрагируют этилацетатом. Органические фазы объединяют и сушат над сульфатом магния. Растворитель выпаривают и остаток подвергают хроматографии на силикагеле, проводя элюирование гептаном/этилацетатом 60/40. Получают 178 мг фениламида 4-(2,4-бис(бензилокси)-5-фторфенил)пиперидин-1-карбоновой кислоты. Выход=89%.
i) ((S)-1-фенилэтил)амид 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
Смесь 174 мг (0,32 ммоль, 1 экв.) фениламида 4-(2,4-бис(бензилокси)-5-фторфенил)пиперидин-1-карбоновой кислоты в 1 мл этилацетата и 2 мл метанола в присутствии 51 мг (30% по массе) 10% палладия на угле перемешивают при температуре окружающей среды при атмосферном давлении водорода в течение 8 часов. Реакционную смесь фильтруют через фильтровальную бумагу и фильтрат выпаривают. Остаток подвергают хроматографии на силикагеле, проводя элюирование гептаном/этилацетатом 30/70. Получают 83 мг ((S)-1-фенилэтил)амида 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты. Выход=72%.
1H ЯМР (DMSO, 400 мГц): 1,35-1,45 (м, 5H); 1,53 (м, 2H); 2,67 (т, J=13 Гц, 2H); 2,83 (м, 1H); 4,11 (д, J=12,3 Гц, 2H); 4,83 (м, 1H); 6,43 (д, J=8,0 Гц, 1H); 6,73 (м, 2H); 7,14-7,40 (м, 5H); 9,11 (с, 1H); 9,40 (с, 1H).
13C ЯМР (DMSO, 100 мГц): 23,0, 31,6, 34,6, 44,2, 49,3, 104,5, 113,3 (д, J=19 Гц), 122,4, (д, J=5 Гц), 125,9, 126,1, 127,9, 142,4, 144,6 (д, J=228 Гц), 146,3, 150,4, 155,5.
ПРИМЕР 47: (R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилэтанон
(R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилэтанон получают способом, аналогичным способу из примера 26, но с применением (R)-гидроксифенилуксусной кислоты.
1H ЯМР (DMSO, 400 мГц): (затруднение вращения) 0,6 (м, 0,5H); 1,30-1,70 (м, 3,5H); 2,5-3 (м, 2H); 4,0 (м, 1H); 4,51 (м, 1H); 5,37-5,57 (м, 2H); 6,07 (м, 1H); 6,24 (м, 1H); 6,48 & 6,72 (2д, J=8,2 Гц, 1H); 7,29-7,38 (м, 5H); 8,98 (2с, 1H); 9,11 (2с, 1H)
13C ЯМР (DMSO, 100 мГц): (затруднение вращения) 30,9 & 31,4, 31,5 & 31,9, 34,1 & 34,4, 42,9, 45,2, 71,1, 102,4, 105,9, 121,8, 126,3, 126,4, 126,9, 127,5, 128,1, 128,3, 128,4, 128,9, 140,5, 155,1, 156,1, 170,0.
ПРИМЕР 48: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилэтанон
(S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилэтанон получают способом, аналогичным способу из примера 26, но с применением (S)-гидроксифенилуксусной кислоты.
1H ЯМР (DMSO, 400 мГц): (затруднение вращения) 0,6 (м, 0,5H); 1,30-1,70 (м, 3,5H); 2,5-3 (м, 2H); 4,0 (м, 1H); 4,51 (м, 1H); 5,37-5,57 (м, 2H); 6,07 (м, 1H); 6,24 (м, 1H); 6,48 & 6,72 (2д, J=8,2 Гц, 1H); 7,29-7,38 (м, 5H); 8,98 (2с, 1H); 9,11 (2с, 1H)
13C ЯМР (DMSO, 100 мГц): (затруднение вращения) 30,9 & 31,4, 31,5 & 31,9, 34,1 & 34,4, 42,9, 45,2, 71,1, 102,4, 105,9, 121,8, 126,3, 126,4, 126,9, 127,5, 128,1, 128,3, 128,4, 128,9, 140,5, 155,1, 156,1, 170,0.
ПРИМЕР 49: (R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-3-фенилпропан-1-он
(R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-3-фенилпропан-1-он получают способом, аналогичным способу из примера 26, но с применением (R)-2-гидрокси-3-фенилпропионовой кислоты.
1H ЯМР (DMSO, 400 мГц): (затруднение вращения) 1,04-1,70 (м, 4H); 2,50-3,34 (м, 5H); 4,02 (м, 1H); 4,52 (м, 2H); 4,97 (м, 1H); 6,14 (д, J=8,2 Гц, 1H); 6,25 (м, 1H); 6,67 & 6,782 (2д, J=8,2 Гц, 1H); 7,14-7,28 (м, 5H); 8,97 (2с, 1H); 9,15 (2с, 1H).
13C ЯМР (DMSO, 100 мГц): (затруднение вращения) 31,6 & 31,7, 34,5 & 34,7, 40,3 & 40,6, 42,5, 45,6, 68,6 & 68,9, 102,5, 106,1, 122,1, 126,1, 126,8, 128,1, 129,6, 138,1 & 138,4, 155,3, 156,2, 171,0.
ПРИМЕР 50: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-3-фенилпропан-1-он
(S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-3-фенилпропан-1-он получают способом, аналогичным способу из примера 26, но с применением (S)-2-гидрокси-3-фенилпропионовой кислоты.
1H ЯМР (DMSO, 400 мГц): (затруднение вращения) 1,04-1,70 (м, 4H); 2,50-3,34 (м, 5H); 4,02 (м, 1H); 4,52 (м, 2H); 4,97 (м, 1H); 6,14 (д, J=8,2 Гц, 1H); 6,25 (м, 1H); 6,67 & 6,782 (2д, J=8,2 Гц, 1H); 7,14-7,28 (м, 5H); 8,97 (2с, 1H); 9,15 (2с, 1H).
13C ЯМР (DMSO, 100 мГц): (затруднение вращения) 31,6 & 31,7, 34,5 & 34,7, 40,3 & 40,6, 42,5, 45,6, 68,6 & 68,9, 102,5, 106,1, 122,1, 126,1, 126,8, 128,1, 129,6, 138,1 & 138,4, 155,3, 156,2, 171,0.
ПРИМЕР 51: Анализ ингибирования тирозиназной активности
Активность ингибиторов измеряют, используя лизат клеток B16F1 (линия меланомы мышей). В присутствии субстрата L-тирозина, тирозиназа, присутствующая в этих клетках, катализирует гидроксилирование L-тирозина с получением L-DOPA, а затем окисление L-DOPA с получением допахинона. В присутствии MBTH (3-метил-2-бензотиазолинонгидразона) допахинон захватывается так, что образует розовый комплекс, поглощающий при 520 нм.
Клетки B16F1 культивируют в среде DMEM + 10% фетальная телячья сыворотка + 10-9 M α-MSH в течение 4 суток при 37°C в 7% CO2. Их обрабатывают трипсином, промывают в PBS, подсчитывают и осаждают. Осадок обрабатывают при 107 клеток/мл в лизирующем буфере (10 мМ фосфат натрия, pH 6,8 - 1% Igepal) и суспензию обрабатывают ультразвуком в течение 10 секунд. После центрифугирования в течение 30 минут при 4000 об./мин. полученный супернатант составляет клеточный лизат, используемый в качестве источника тирозиназы в ферментативном анализе.
Анализы проводят в двух повторах в 384-луночных планшетах в общем объеме 50 мкл. Каждая лунка содержит:
- 40 мкл раствора, содержащего 1,25 мМ L-тирозин, 6,25 мкМ L-DOPA (кофактор) и 3,75 мМ MBTH в буфере B (62,25 мМ фосфат натрия, pH 6,8 - 2,5% диметилформамид),
- 5 мкл ингибитора, разведенного в DMSO,
- 5 мкл клеточного лизата, разведенного до 1/2 в 50 мМ буфере Tris-HCl, pH 7,5.
Планшет инкубируют при 37°C и через 6 часов инкубации проводят спектрофотометрическое сканирование при 520 нм. Во избежание любого возможного поглощения продуктами, в системе используют скорректированную оптическую плотность (оптическая плотность на момент 6 час - оптическая плотность на момент ноль).
Ингибиторы оценивают в терминах «доза-ответ» с тем, чтобы подсчитать IC50 (доза, ингибирующая 50% ферментативной активности).
В каждый эксперимент добавляют несколько внутренних контролей:
- контроль 100% активности: 5 мкл ингибитора заменяют 5 мкл DMSO,
- контроль 50% активности: 5 мкл ингибитора заменяют 5 мкл фенилтиомочевины при 300 мкМ в DMSO,
- контроль 0% активности: субстрат L-тирозин заменяют буфером B.
Результаты, полученные для соединения по изобретению, приведены в таблице A:
ПРИМЕР 52: Анализ ингибирования меланогенеза
Ингибирование меланогенеза измеряют в клетках меланомы человека MNT1 в соответствии с протоколом, адаптированным из Reigner et al., Cell Mol. Biol. (1999) 45:969-980. Анализ основан на одновременном включении 2 радиоактивно меченных маркеров:14C-тиоурацил включается во вновь синтезирующийся меланин и отражает меланогенез, тогда как3H-лейцин включается в белки и отражает жизнеспособность клеток, и, таким образом, тестируют токсичность соединений.
Клетки MNT1 высевают в 96-луночные планшеты в присутствии тестируемых соединений и радиоактивных изотопов. После инкубации в течение 24 час при 37°C клетки промывают и измеряют количество 2 радиоактивных изотопов. Тестируемые соединения оценивают в терминах «доза-ответ» с тем, чтобы подсчитать IC50 для ингибирования меланогенеза на основании включения14C, которое стандартизуют по включению3H. Также на основании включения3H рассчитывают IC50 клеточной токсичности.
Таким образом, этот анализ делает возможным различать продукты, которые специфически ингибируют меланогенез от продуктов, которые являются цитотоксическими для меланоцитов.
ПРИМЕР 53: Препараты
Этот пример иллюстрирует различные препараты на основе соединений по изобретению.
Реферат
Настоящее изобретение относится к новым 4-(азациклоалкил)бензол-1,3-диоловым соединениям, соответствующим общей формуле (I). Соединения общей формулы (I), приведенной ниже:где: R1 представляет собой: - C-C-алкиловый радикал, - C-C-циклоалкиловый радикал, - ариловый радикал, - ариловый радикал, замещенный одной или несколькими группами, выбранными из C-Cалкила, C-Cалкоксигруппы, атома фтора и трифторметильной группы, - аралкиловый радикал, - C-C-алкокси радикал, -аминовый радикал, соответствующий структуре (а):где R2 представляет собой: - водород, - C-C-алкиловый радикал, - C-C-циклоалкиловый радикал, - ариловый радикал, - ариловый радикал, замещенный одной или несколькими группами, выбранными из C-Cалкила, C-Cалкоксигруппы, атома фтора и трифторметильной группы, - пиридиловый радикал, - аралкиловый радикал, - радикал, соответствующий структуре (b):где значение р может представлять собой 1 или 2, - радикал, соответствующий структуре (с)где R4 представляет собой: - карбоксиметиловый, -СООСН, или карбоксиэтиловый, -COOEt, радикал, - C-C-алкиловый радикал, - водород, и R5 представляет собой: - незамещенный ариловый радикал или ариловый радикал, замещенный одной или несколькими группами, выбранными из C-Cалкила, C-Cалкоксигруппы, атома фтора и трифторметильной группы, - C-C-циклоалкиловый радикал, - пиридил, и R3 представляет собой: - водород, - C-C-алкиловый радикал; или R1 также может представлять собой радикал, соответствующий формуле (d):где R6 представляет собой: - водород, - C-C-алкиловый радикал, - C-C-циклоалкиловый радикал, - ариловый радикал, - ариловый радикал, замещенный одной или несколькими группами, выбранными из C-Cалкила, C-Cалкоксигруппы, атома фтора и трифтормети
Формула
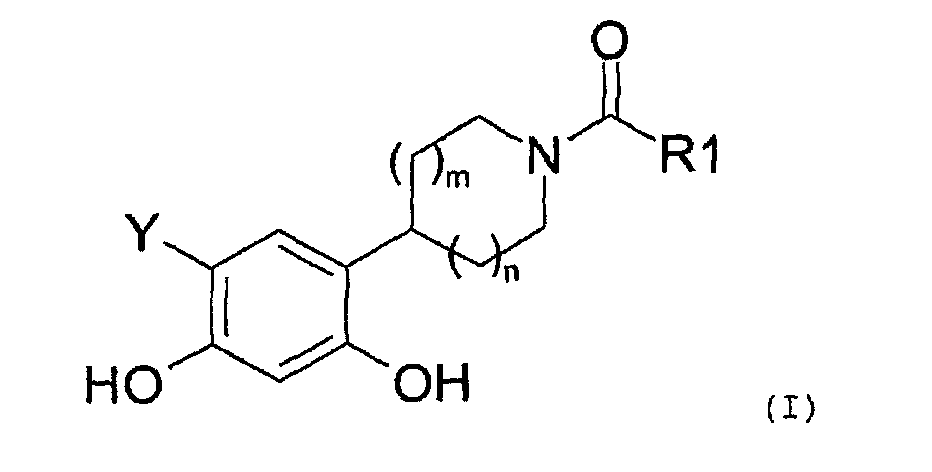
где R1 представляет собой:
- С1-С5-алкиловый радикал,
- С3-С6-циклоалкиловый радикал,
- ариловый радикал,
- ариловый радикал, замещенный одной или несколькими группами, выбранными из C1-C5 алкила, a C1-C5 алкоксигруппы, атома фтора и трифторметильной группы,
- аралкиловый радикал,
- С1-С5-алкокси радикал,
- аминовый радикал, соответствующий структуре (а):

где R2 представляет собой:
- водород,
- С1-С5-алкиловый радикал,
- С3-С6-циклоалкиловый радикал,
- ариловый радикал,
- ариловый радикал, замещенный одной или несколькими группами, выбранными из C1-C5 алкила, a C1-C5 алкоксигруппы, атома фтора и трифторметильной группы,
- пиридиловый радикал,
- аралкиловый радикал,
- радикал, соответствующий структуре (b):

где значение р может представлять собой 1 или 2, - радикал, соответствующий структуре (с)

где R4 представляет собой:
- карбоксиметиловый, -СООСН3, или карбоксиэтиловый, -COOEt, радикал,
- C1-С3-алкиловый радикал,
- водород,
и R5 представляет собой:
- незамещенный ариловый радикал или ариловый радикал, замещенный одной или несколькими группами, выбранными из C1-C5 алкила, C1-C5 алкоксигруппы, атома фтора и трифторметильной группы,
- С3-С6-циклоалкиловый радикал,
- пиридил,
и R3 представляет собой:
- водород,
- С1-С5-алкиловый радикал;
или R1 также может представлять собой радикал, соответствующий формуле (d):

где R6 представляет собой:
- водород,
- С1-С5-алкиловый радикал,
- С3-С6-циклоалкиловый радикал,
- ариловый радикал,
- ариловый радикал, замещенный одной или несколькими группами, выбранными из C1-C5 алкила, C1-C5 алкоксигруппы, атома фтора и трифторметильной группы,
- пиридиловый радикал,
- аралкиловый радикал,
R7 представляет собой:
- водород,
- С1-С5-алкиловый радикал, и
R8 представляет собой:
- водород,
- гидроксил,
- аминовый радикал,
- C1-С3-алкокси радикал;
Y представляет собой водород или фтор, и
значение m и n может представлять собой 0, 1 или 2,
а также изомерные и энантиомерные формы соединений формулы (I).
- R1 представляет собой аралкиловый радикал или аминовый радикал, соответствующий структуре (а):

где R2 представляет собой:
- С1-С5-алкиловый радикал,
- аралкиловый радикал или
- радикал, соответствующий структуре (с):

где R4 представляет собой:
- карбоксиметиловый, -СООСН3, или карбоксиэтиловый, -COOEt, радикал,
- C1-С3-алкиловый радикал,
и R5 представляет собой:
- незамещенный ариловый радикал или ариловый радикал, замещенный одной или несколькими группами, выбранными из C1-C5 алкила, C1-C5 алкоксигруппы, атома фтора и трифторметильной группы, и
R3 представляет собой водород,
- Y представляет собой атом водорода или фтора,
- m=1 и n=1,
а также изомерные и энантиомерные формы соединений формулы (I).
1: трет-бутилового эфира 3-(2,4-дигидроксифенил)азетидин-1-карбоновой кислоты
2: [3-(2,4-дигидроксифенил)азетидин-1-ил]фенилметанона
3: пентиламида 3-(2,4-дигидроксифенил)азетидин-1-карбоновой кислоты
4: трет-бутилового эфира 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
5: изобутилового эфира 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
6: циклогексиламида 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
7: фениламида 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
8: (4-фторфенил)амида 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
9: (4-трифторметилфенил)амида 3-(2,4-дигидроксифенил)пирролидин-1-карбоновой кислоты
10: этилового эфира 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
11: [4-(2,4-дигидроксифенил)пиперидин-1-ил]фенилметанона
12: бутиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
13: пропиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
14: 1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]бутан-1-она
15: 1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-метилпропан-1-она
16: фениламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
17: (4-фторфенил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
18: п-толиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
19: фенэтиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
20: (3-фторфенил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
21: ((R)-1-фенилэтил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
22: метилфениламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
23: пиридин-2-иламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
24: ((S)-1-фенилэтил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
25: ((S)-1-фенилпропил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
26: (R)-2-амино-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-3-фенилпропан-1-она
27: 1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-3-фенилпропан-1-она
28: 2-фторбензиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
29: 3-фторбензиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
30: 4-фторбензиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
31: бензиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
32: 2-метилбензиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
33: 3-метилбензиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
34: 4-метилбензиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
35: 2-метоксибензиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
36: 3-метоксибензиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
37: 4-метоксибензиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
38: ((S)-1-п-толилэтил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
39: [(S)-1-(4-фторфенил)этил]амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
40: (S)-индан-1-иламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
41: ((S)-1-нафтален-1-илэтил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
42: ((S)-1-нафтален-2-илэтил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
43: [(S)-1-(4-метоксифенил)этил]амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
44: [(S)-1-(3-метоксифенил)этил]амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
45: (S)-2-амино-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-3-фенилпропан-1-она
46: ((S)-1-фенилэтил)амида 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
47: (R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилэтанона
48: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилэтанона
49: (R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-3-фенилпропан-1-она
50: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-3-фенилпропан-1-она
51: (R)-2-амино-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-(4-фторфенил)этанона
52: (R)-2-амино-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-фенилэтанона
53: (S)-2-амино-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-фенилэтанона
54: (R)-2-амино-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-(4-трифторметилфенил)этанона
55: 2-амино-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-фенилбутан-1-она
56: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-метокси-2-фенилэтанона
57: ((S)-1-циклогексилэтил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
58: (1,2,3,4-тетрагидронафтален-1-ил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
59: метилового эфира (R)-{[4-(2,4-дигидроксифенил)пиперидин-1-карбонил]амино}фенилуксусной кислоты
60: (пиридин-3-илметил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
61: (пиридин-4-илметил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
62: бензиламида 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
63: бутиламида 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
64: (3-фторфенил)амида 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
65: фенэтиламида 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
66: метилового эфира (R)-{[4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбонил]амино}фенилуксусной кислоты
67: (S)-индан-1-иламида 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
68: [(S)-1-(4-метоксифенил)этил]амида 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
69: ((S)-1-циклогексилэтил)амида 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
70: (R)-1-[4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилэтанона
71: (S)-1-[4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилэтанона
72: (R)-2-амино-1-[4-(5-фтор-2,4-дигидроксифенил)-пиперидин-1-ил]-2-фенилэтанона
73: (S)-2-амино-1-[4-(5-фтор-2,4-дигидроксифенил)-пиперидин-1-ил]-2-фенилэтанона
74: (R)-1-[4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилпропан-1-она
75: (S)-1-[4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилпропан-1-она
76: (R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилпропан-1-она
77: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилпропан-1-она
78: метилового эфира (R)-{[4-(2,4-дигидроксифенил)пиперидин-1-карбонил]амино}-(4-фторфенил)уксусной кислоты
79: метилового эфира (S)-{[4-(2,4-дигидроксифенил)пиперидин-1-карбонил]амино}-(4-фторфенил)уксусной кислоты
80: (R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-метил-3-фенилпропан-1-она
81: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-метил-3-фенилпропан-1-она
82: (пиридин-3-илметил)амида4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
83: (пиридин-4-илметил)амида 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
84: ((R)-1-фенилэтил)амида (5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
85: (R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилбутан-1-она
86: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-фенилбутан-1-она
87: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-(4-фторфенил)-2-гидроксиэтанона
88: (R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-(4-фторфенил)-2-гидроксиэтанона
89: (S)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-(3-метоксифенил)этанона
90: (R)-1-[4-(2,4-дигидроксифенил)пиперидин-1-ил]-2-гидрокси-2-(3-метоксифенил)этанона
91: циклогексилметиламида 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
92: циклогексилметиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
93: (2-этилбутил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
94: (2-этилбутил)амида 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
95: циклопентилметиламида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
96: циклопентилметиламида 4-(5-фтор-2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
97: (6-метилпиридин-3-илметил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
98: (4-метилпиридин-3-илметил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
99: (5-метилпиридин-3-илметил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
100: (2-метилпиридин-3-илметил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
101: (2,6-диметилпиридин-4-илметил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
102: (2-пиридин-2-илэтил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
103: (2-пиридин-3-илэтил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты
104: (2-пиридин-4-илэтил)амида 4-(2,4-дигидроксифенил)пиперидин-1-карбоновой кислоты.







Комментарии