Антагонисты интегриновых рецепторов и их применение - RU2721907C2
Код документа: RU2721907C2
Чертежи


















Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение в целом относится к области химии и медицины и более конкретно к антагонистам интегриновых рецепторов и способам их применения.
УРОВЕНЬ ТЕХНИКИ
Последовательность RGD трипептида присутствует в составе многих белков и играет важную роль в клеточной адгезии. Примеры белков, в которых присутствует последовательность RGD трипептида, включают коллаген, фибронектин, витронектин, фактор Виллебранда (ФВ), некоторые дизинтегрины и некоторые дискоидины.
Интегрины представляют собой гетеродимерные рецепторы на поверхности клеток и опосредуют адгезию между клетками и внеклеточным матриксом (ВКМ) путем связывания их с лигандами, имеющими доступную для связывания последовательность RGD. Нормальное интегрин-RGD связывание, как предполагается, играет важную роль в экспрессии генов, участвующих в росте клеток, миграции и выживании. Нарушения регулирования такого роста клеток, миграции и выживания может привести к ряду болезненных состояний, включая тромбоз, воспаление и рак. Таким образом, RGD пептиды изучались как потенциальные мимитики белков клеточной адгезии, а также рассматривалась их способность связываться с интегринами для терапевтических целей, таких как ингибирование клеточной адгезии, клеточной миграции, клеточной пролиферации, клеточной дифференциации, апоптоза, ангиогенеза, развития опухолей, для ингибирования проникновения микробов в клетки, для использования их мультимерных форм как внутренних агентов лучевой терапии, а также визуализирующих рак агентов и в качестве лекарственного противоракового средства.
В глазах интегрины влияют на целый ряд процессов, в том числе на развитие глаза, миграцию клеток, заживление и некоторые патологические процессы. Интегрины также могут модулировать воспаление и тромбоз в тканях глаза. При введении интравитреально пептид RGD, как сообщается, может быть причиной задней витреоретинальной отслойки в моделях на животных и, таким образом, может быть полезен в лечении некоторых заболеваний сетчатки и/или в облегчении в удалении стекловидного тела в ходе витрэктомии. См. Olivera, L.B. и др., RGD Peptide-Assisted Vitrectomy to Facilitate Induction of a Posterior Vitreous Detachment: a New Principe in Pharmacological Vitreolysis; Current Eye Research (8): 333-40 (25 декабря 2002).
Интегрины, как известно, используются различными вирусами, покрытыми и не покрытыми оболочкой, и бактериями при инфицировании клеток-хозяев. Schornberg, Kathryn L.; α5β1-Integrin Controls Ebolavirus Entry by Regulating Endosomal Cathespins; Proc. Nat. Acad. Sci. USA; Vol. 106, No. 19, стр. 8003-8008 (2009).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым соединениям, содержащим R-G-Cys-вую кислоту (например, R-G-NH-CH(CH2-SO3H)COOH или Arg-Gly-NH-СН(СН2-SO3H)СООН) и ее производные (включая фармацевтически приемлемые соли, гидраты, стереоизомеры, мультимеры, циклические формы, линейные формы, конъюгаты с лекарственными средствами, пролекарства и их производные).
Настоящее изобретение также относится к композициям и способам терапевтического или профилактического ингибирования интегриновых рецепторов у субъекта, представляющим собой человека или животного. Такое ингибирование интегриновых рецепторов может быть использовано для лечения или предупреждения неоваскуляризации или образования кровеносных сосудов в опухолевых или других тканях (например, в сетчатке глаза), для лечения или предупреждения вирусных заболеваний, сдерживания различных вирусных болезней, включая диабетическую ретинопатию и различные состояния, вовлекающие нежелательную неоваскуляризацию для предупреждения или лечения ингибирования клеточной адгезии к RGD сайтам связывания или предоставления других диагностических или терапевтических агентов против RGD сайтов связывания у субъекта (человека или животного) путем введения субъекту эффективного количества композиции, содержащей пептид R-G-Cys-овой кислоты или его производное (включая фармацевтически приемлемые соли, гидраты, стереоизомеры, мультимеры, циклические формы, линейные формы, конъюгаты с лекарственными средствами, пролекарства и их производные). Конкретные примеры R-G-C-ового пептида по настоящему изобретению включают линейную форму Arg-Gly-NH-CH(CH2-SO3H)COOH и циклическую форму Arg-Gly-NH-CH(CH2-SO3H)СООН) (пример, упомянутый здесь, как Соединение 2).
Общие формулы производных R-G-Cys-овой кислоты по настоящему изобретению включают, но не ограничиваясь этим, соединения, соответствующие Общим формулам I-VII, представленным ниже:
Общая формула I:
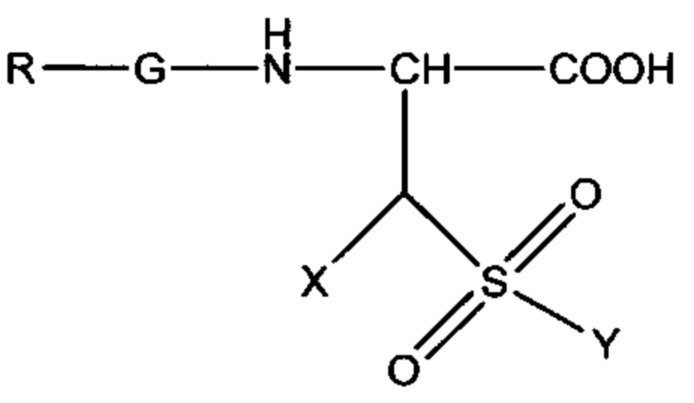
где X выбран из: Н, C1 - С6 алкила, Ph или SO3H, и Y=ОН или NH2.
Общая формула II:
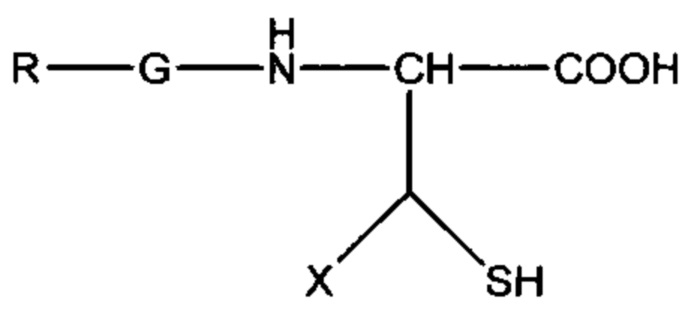
где X выбран из: Н, C1 - С6 алкила, Ph или SO3H.
Общая формула III:
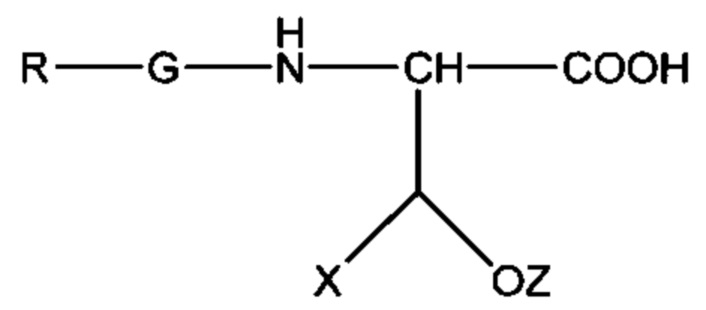
где X выбран из: Н, C1 - С6 алкила, Ph или SO3H, и где Z выбран из: Н или SO3H.
Общая формула IV:

где X выбран из: Н, C1 - С6 алкила, Ph или SO3H; Y выбран из: ОН или NH2.
Общая формула V:

где X выбран из: Н, C1 - С6 алкила, Ph или SO3H.
Общая формула VI:

где X выбран из: Н, C1 - С6 алкила, Ph или SO3H.
Общая формула VII:
X1-R-G-Cys-овая кислота-Х
где X и X1 выбраны из: циклического или линейного -Phe-Val-Ala, -Phe-Leu-Ala, -Phe-Val-Gly, -Phe-Leu-Gly, -Phe-Pro-Gly, -Phe-Pro-Ala, -Phe-Val или любой соли любой комбинации D-изомера или L-изомера Arg, Gly, Cys, Phe, Val, Ala, Leu, Pro, Thr.
Примеры циклических форм Общей формулы VII включают, но не обязательно ограничиваются:

где X' выбран из: Н, C1 - С6 алкила, Ph или SO3H, a Z выбран из Н или Me; Y выбран из ОН, NH2.
Сульфокислоты являются более сильными кислотами, чем соответствующие карбоновые кислоты. Более высокая полярность группы сульфокислоты приводит к усилению межмолекулярных связей. Например, RG-Цистеиновая кислота, которая имеет более поляризованную О-Н связь, может образовывать более сильные водородные связи, чем RG-Аспарагиновая кислота (RGD пептид), который имеет относительно менее поляризованную О-Н связь, с амидными группами белков в интегриновом сайте связывания и/или сильнее взаимодействует с ионами металлов в составе интегринового сайта связывания.
Как раскрыто более подробно в данном описании, был синтезирован и испытан на животных один конкретный пример Общей формулы VII, Глицинил-Аргинил-Глицинил-Цистеин-Треонил-Пролин-СООН (GRG Цистеиновая кислота ТП; далее именуется как Соединение 1). Было обнаружено, что он является эффективным в индуцировании задней отслойки стекловидного тела (PVD) от поверхности сетчатки путем ингибирования взаимодействий интегрин - внеклеточный матрикс (ВКМ). Как описано также более подробно в данном описании, Соединение 1 было протестировано в модели заживления раны с использованием эндотелиальных клеток пупочной вены человека (HUVEC), и было показано, что оно ингибирует клеточную адгезию на 74% в течение 12 часов по сравнению с ингибированием на 40% циклическим RGD пептидом. Эти исследования показывают и подтверждают, что Глицинил-Аргинил-Глицинил-Цистеин-Треонил-Пролин-СООН может связывать интегрин даже сильнее, чем RGD пептид.
Последовательность пептида RG Cys-овой кислоты, который может существовать как в L-форме, так и в D-форме, является конкурентным ингибитором интегрин-ВКМ взаимодействий. Последовательность пептида RG Cys-овой кислоты может быть представлена протеаза-устойчивыми производными или циклическими производными, или производными пролекарств, либо может быть связана с системами доставки лекарств или моноклональных антител.
Композиции по настоящему изобретению пригодны для ингибирования ангиогенеза, что может быть использовано для лечения воспаления, заживления ран, тромбоза, раковых метастаз и опухолей. Дальнейшее полезное применение может быть найдено в офтальмологии, включая лечение пролиферативной или непролиферативной диабетической ретинопатии, разжижения стекловидного тела, индукции задней витреоретинальной отслойки (PVD), патогенеза витреоретинальных заболеваний, таких как идиопатический макулярный разрыв, отек макулы, плавающие помутнения, витреомакулярная тракция, возрастная дегенерация желтого пятна, влажная дегенерация макулы, хориоидальная неоваскуляризация, витреоретинальная хирургия, окклюзия вен и профилактика образования рубцов при хирургии глаукомы. Кроме того, мультимерные и/или радиоактивно-меченные композиции по настоящему изобретению пригодны в качестве диагностических/визуализирующих агентов для обнаружения опухолей и в качестве радиотерапевтических препаратов для лечения опухолей, а также в качестве переносчиков противораковых лекарств, благодаря их свойствам нацеливания на опухоль.
Биоматериалы, включающие пептид RGCys-новой кислоты, также могут обеспечивать синтетическое адгезивное микроокружение для увеличения времени жизни и роста клеток и для инжениринга живых тканей при использовании в тканевой инженерии и в регенеративной медицине. Благодаря своему свойству связывать интегриновые рецепторы адгезии, пептиды RG Cys-новой кислоты могут обеспечивать стимулирующий адгезию сигнал при их связывании с биоматериалом или подложкой. Материалы на основе RG Cys-новой кислоты опосредуют клеточную адгезию, распространение и миграцию клеток. Кроме того, интегрин-опосредованная клеточная адгезия способствует пролиферации и выживанию клеток и играет ключевую роль в сборке и организации многоклеточных структур и тканей.
Препараты для лечения макулярной дегенерации, как Луцентис и Авастин, основаны на ингибировании VEGF, который в противном случае вызывает рост новых сосудов, ангиогенез и, как следствие, способствует отеку макулы. Было известно, что малый пептид RGD может индуцировать апоптоз посредством ингибирования взаимодействия с внеклеточным матриксом благодаря конкурентному связыванию, как показано Бруксом и соавт. в Патенте США №6,500,924.
RGD пептид-связывающий и распознающий мотив можно найти в белках внеклеточного матрикса и интегринах, которые связывают внутриклеточный цитоскелет клеток с ВКМ путем распознавания RGD эпитопов адгезии. См., например, Foos, R.Y., Invest. Opthalmol. Vis. Sci. (1972) 11, 801-808. Клетки, без присоединения ВКМ, как правило, подвергаются апоптозу.
В общем, взаимодействие между фибробластами и гликопротеиновыми компонентами внеклеточного матрикса вызывает формирование рубца, опосредованное, прежде всего, взаимодействием RGD-содержащей аминокислотной последовательности с интегринами клеточной поверхности. Также известно, что RGD последовательность участвуют во взаимодействиях клетка - ВКМ при воспалительных и гомеостатических реакциях (см. Hershkoviz СМ. и соавт., Invest. Opthalmol. Vis. Sci. (1994), 35, 2585-2591), а интегрины играют важную роль в миграции клеток при заживлении ран или патологических процессах и модуляции воспаления и тромбоза. Таким образом, эффективные антагонисты интегрина, такие как RGD пептиды, могут быть очень полезны в качестве фармакологических агентов как противовоспалительных, анти-метастатических или анти-тромботических агентов (см. Elner S.G., Elner V.M., IOVS (1996) 37:696-701). В литературе также сообщается, что CD44 рецептор гиалуроновой кислоты опосредует взаимодействия клетка-клетка и клетка-матрикс благодаря своей аффинности к гиалуроновой кислоте, а также, возможно, благодаря своей аффинности к другим лигандом, таким как остеопонтин, коллаген и матриксные металлопротеазы (ММП).
Адгезия к гиалуронану играет важную роль в миграции клеток, росте опухоли и ее прогрессировании и также вовлекается в активацию, рециркуляцию и хоминг лимфоцитов, а также в кроветворение. Измененная экспрессия или дисфункция вызывает многочисленные патогенные проявления (см., например, Jiang D., Annu. Rev. Cell. Dev. Biol. (2007) 23: 435-461; и Knudson, W. и др., Matrix Bio. (2002), 21: 15-23).
Недавно было показано, что взаимодействие CD44 и клеточных матриксных компонентов (например, НА) играет важную роль в развитии различных воспалительных заболеваниях, и нарушение взаимодействий гиалуронан-СБ44 может привести к улучшению хориоидальной неоваскуляризации (см. Hiroshi Mochimaru и др., Invest. Ophthalmol. Vis. Sci. (2009) 50: 4410-4415).
Эти сведения показывают, что молекулы адгезии, такие как RGD пептид или CD44, в межклеточных взаимодействиях и взаимодействиях клетка-ВКМ играют важную роль в развитии многих патогенных заболеваний, и ингибирование таких взаимодействий может стать новой терапевтической целью в лечении этих заболеваний.
Для синтетических пептидов также было показано связывание их с интегринами и факторами роста. Для циклических пентапептидов, содержащих RGD последовательность, было установлено ингибирование связывания витронектина с αvβ3 интегрином (см. Michael A. Dechantsreiter и др., J. Med. Chem. (1999) 42: 3033-3040), и обоих витронектина и фибронектина с αvβ3 и αvIIbβ3 интегринами (см. Roland Haubner и соавт., J. Am. Chem. Soc., (1996) 118:7461 -7472). Было показано, что такое ингибирование может найти применение в лечении многочисленных несвязанных заболеваний. В исследованиях на хомяках показано, что эти циклические пентапептиды задерживают рост и метастазирование опухоли по сравнению с контрольными животными (см. М. A. Buerkle и др., British J. Cancer (2002) 86:788-795). Для таких пентапептидов также показано уменьшение связывания серповидных красных кровяных клеток с эндотелием сосудов и улучшение гемодинамического поведения (см. Eileen М. Finnegan и др., J. Am. Physiol. Heart Circ. Physiol. (2007) 293: H1038- H1045). Другой циклический пептид, содержащий RGD последовательность, показал сильное связывание с α4β1, интегрином, известным как играющий важную роль в связывании лейкоцитов при воспалительных и иммунных ответах (см. Pina М. Cardarelli и соавт., J. Biol. Chem. (1994) 269:18668-18673). Синтетические сульфатированные тетрапептиды показали сильное связывание с VEGF (см. Maynard, J.A. Hubbell, Acta Biomaterialia (2005) 1: 451-459).
Кроме того, важным и полезным приложением является то, что димерный RGD пептид, конъюгированный с лекарственным средством, показан как пригодный для интегрин-нацеленной доставки лекарств в опухоль (см. Chen и соавт., J. Med. Chem., (2005)48(4): 1098-1 106).
В другом не менее важном и полезном приложении мультимерные радиоактивно меченные RGD пептиды показаны как пригодные в качестве диагностических/визуализирующих агентов для выявления опухолей и в качестве агентов для лучевой терапии для опухоль-специфичного нацеливания и лечения их путем нацеливание на интегрин αvβ3 (см. Zi-Bo Li и др., J. Nucl. Medicine (2007) 48: 1162-1171).
В офтальмологии образование рубцов при заживлении ран фибробластами является одной из основных проблем, в частности, глаукомы. Это связано с взаимодействиями между фибробластами и гликопротеиновыми компонентами ВКМ. Распознавание ВКМ гликопротеинов происходит через интегрины на поверхности клетки, которые являются специфичными для эпитопов адгезии, таких как последовательность Arg-Gly-Asp (или RGD). RGD последовательность, которая присутствует в составе некоторых белков плазмы крови, в том числе фибронектина (FN) и витронектина (VN), участвует во взаимодействиях клетка - ВКМ, которые возникают при воспалительных и гомеостатических реакциях. Ингибирование взаимодействия между фибробластами и гликопротеинами ВКМ уменьшает образование рубцов (см. Rami Hershkoviz др., Invest. Ophthalmol. Vis. Sci. (1994) 35: 2585-2591).
Фибриллы коллагена в задней коре стекловидного тела связаны с витреоретинальной поверхностью, в частности, с внутренней пограничной мембраной поверхности сетчатки (см. Sebag J., Eye (1992), 6: 541 -552). В связи с присоединением к стекловидному телу, диску зрительного нерва, вдоль основных сосудов сетчатки и с лицевой стороны, весь задний полюс играет важную роль в патогенезе витреоретинальных заболеваний, таких как идиопатический макулярный разрыв, витреомакулярный тракционный синдром, пролиферативная диабетическая ретинопатия и т.д. (Akiba J. Quiroz М.А. и соавт., Ophthalmol. (1990) 97, 1619-1655).
Ингибирование ангиогенеза, как было ранее показано, может повлиять на диабетическую ретинопатию и макулярную дегенерацию, которые являются результатом разрастания кровеносных сосудов глаза. При этих заболеваниях сосуды нарушают нормальную структуру глаза или блокируют доступ света к задней части глаза. Новые кровеносные сосуды являются первичной патологией, а прекращение роста кровеносных сосудов может предотвратить слепоту. Таким образом, ангиоингибирование может обеспечить не только лечение этих заболеваний, но и вылечить их полностью. Кроме того, было предположено, что отделение стекловидного тела от сетчатки может облегчить макулярную тракцию, что снижает риск образования макулярного разрыва. Соответственно, ингибирование на задней поверхности стекловидного тела фибронектина и ламинина, связывающих интегрины на витреоретинальной поверхности, может предотвратить образование новых сосудов сетчатки глаза при диабетической ретинопатии и окклюзии вен сетчатки (см. Akiba J. Quiroz MA, Ophthalmol. (1990) 97, 1619-1655; Kelly N.E. и др., Arch. Ophthalmol. (1991) 109, 654-659, и Kado M. и др., J. Am. Ophthalmol. (1988) 105: 20-24)
В последние годы хирургические процедуры стекловидного тела значительно улучшились с целью уменьшить витреоретинальную тракцию и уменьшить отек сетчатки. Несмотря на непрерывное совершенствование хирургической техники и приборов, по-прежнему остается трудоемким атравматическое удаление коры стекловидного тела у ряда пациентов, особенно у больных диабетической ретинопатией и педиатрических пациентов, из-за осложнений, таких как разрывы или отслойка сетчатки и повреждение нервных волокон сетчатки (см. Sebag J., Arch. Clin. Exp. Ophthalmol. (1987) 225: 89-93; и Han D.P. и др., Arch. Ophthalmol. (1998) 106: 998-1000) и т.д. Таким образом, является весьма желательным менее травматичный подход селективного отделения поверхности стекловидного тела без повреждения сетчатки. В последние годы в литературе указывались различные фармакологические агенты для отделения витреоретинальной поверхности (см. Trese М.Т., Eye (2002) 16: 365 - 368; Gandorfer А. и др., J. Am. Ophthalmol. (2002) 133: 156-159, и Hesse L. и др., Eye Res. (2000) 70: 31-39). Фармакологический витреолизис с использованием ферментов, таких как гиалуронидаза (см. патент США №6,863,886 Karageozian и др.) и аутологичный плазмин (Sakuma Т. и др., Nippon Ganka Gakkai Zassi (2003) 107: 709-718), ранее был изучен для облечения расщепления внеклеточного матрикса и индуцирования задней отслойки стекловидного тела. Тем не менее, неспецифические разрушения прилегающих тканей ферментами затрудняют их терапевтическое применение. В последние годы новый подход с использованием неферментативных фармакологических агентов, таких как мочевина (см. Nickerson С.и др., J. Biomechanics (2008) 41: 1840-1846, и Macromol. Symp. (2005): 183-189) и пептид RGD (см. Leonardo В. и др., Curr. Eye Res. (2002) 25: 333-340), был исследован, принимая во внимание влияние на разделение витреоретинальной поверхности. Было показано, что синтетический аналог пептида RGD конкурирует за RGD мотив в белках ВКМ, нарушая интегрин - ВКМ взаимодействия и ослабляя их in vitro (Williams J.A., Pathol. Bio. (1992) 40: 813-821; Gehlsen K.P. и др., J. Cell Biol. (1988) 106: 925-930; Pierschbacher M.D. и др., J. Biol. Chem., (1987) 262: 17294-17298, и Zhon L.L. и др., IOVS (1996) 37: 104-113) и in vivo. Таким образом, интравитреальные инъекции растворимых RGD пептидов приводят к высвобождению RGD-эпитопов из нерастворимых белков ВКМ на поверхности сетчатки, как следствие, облегчая неферментативную PVD в моделях на кроликах.
Очевидно, что эти результаты показывают, что витреоретинальная поверхность включает в себя интегриновое соединение с RGD мотивом ВКМ, а также адгезию коллагена коры стекловидного тела на внутренней пограничной ламеле (ВПЛ). RGD пептиды и их производные способствуют миграции эпителиальных клеток в ране (см. P.M. Merz и др., J. Burn Care Res. (1996) 17: 199-206), а также поддерживают свою биологическую активность при введении в составе синтетических биоматериалов, таких как гидрогели (см. MP Lutolf и др., Proc. Nat. Acad. Sci. (2003) 100: 5413-5418, а также MP Lutolf и др., Nature Biotechnol. (2003) 21: 513 - 518), других полимерных матриц (см. Horng-Ban Lin и др., J. Biomed. Materials Res. (2004) 28: 329-342), так поверхностных пленок на твердых субстратах (D.M. Ferris и др., Biomaterials (1999) 20: 2323-2331). RGD пептиды также способствуют повышению адгезии эпителиальных или эндотелиальных клеток сосудистых протезов (см. K. Walluscheck и др., Eur. J.Vascular and Endovascular Surgery (1996) 12: 321 -330) и других искусственных органов (см. Jeschke, Brigette, Biomaterials (2002) 23: 3455-3463), покрытых этой пептидной последовательностью, и было показано, что они обеспечивают поддержание возобновления роста нервов (см. М. Rafiuddin Ahmed и др., Brain Res. (2003) 993:208-6). Биологически активная поверхность протеза может содержать синтетические волокна смолы или полимеры.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фигуре 1 показано влияние трех пептидов, а именно циклического RGD-пептида, пептида RGCys-новой кислоты и RGE пептида, на кинетику заживление ран.
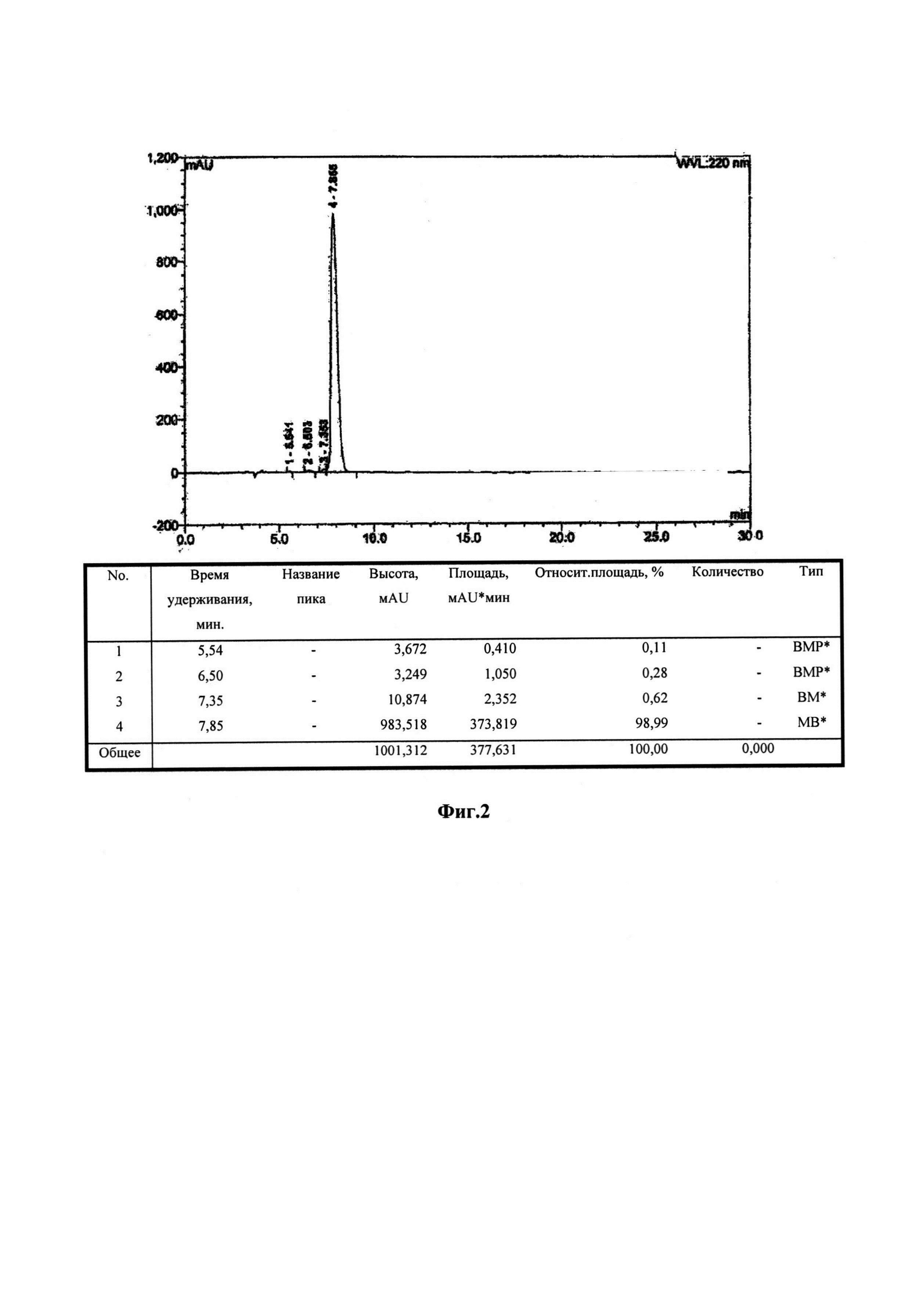
На Фигуре 2 показана ВЭЖХ хроматограмма RGC пептида.
На Фигуре 3 показаны масс-хроматограммы Electrospray пептид RGCys-новой кислоты.
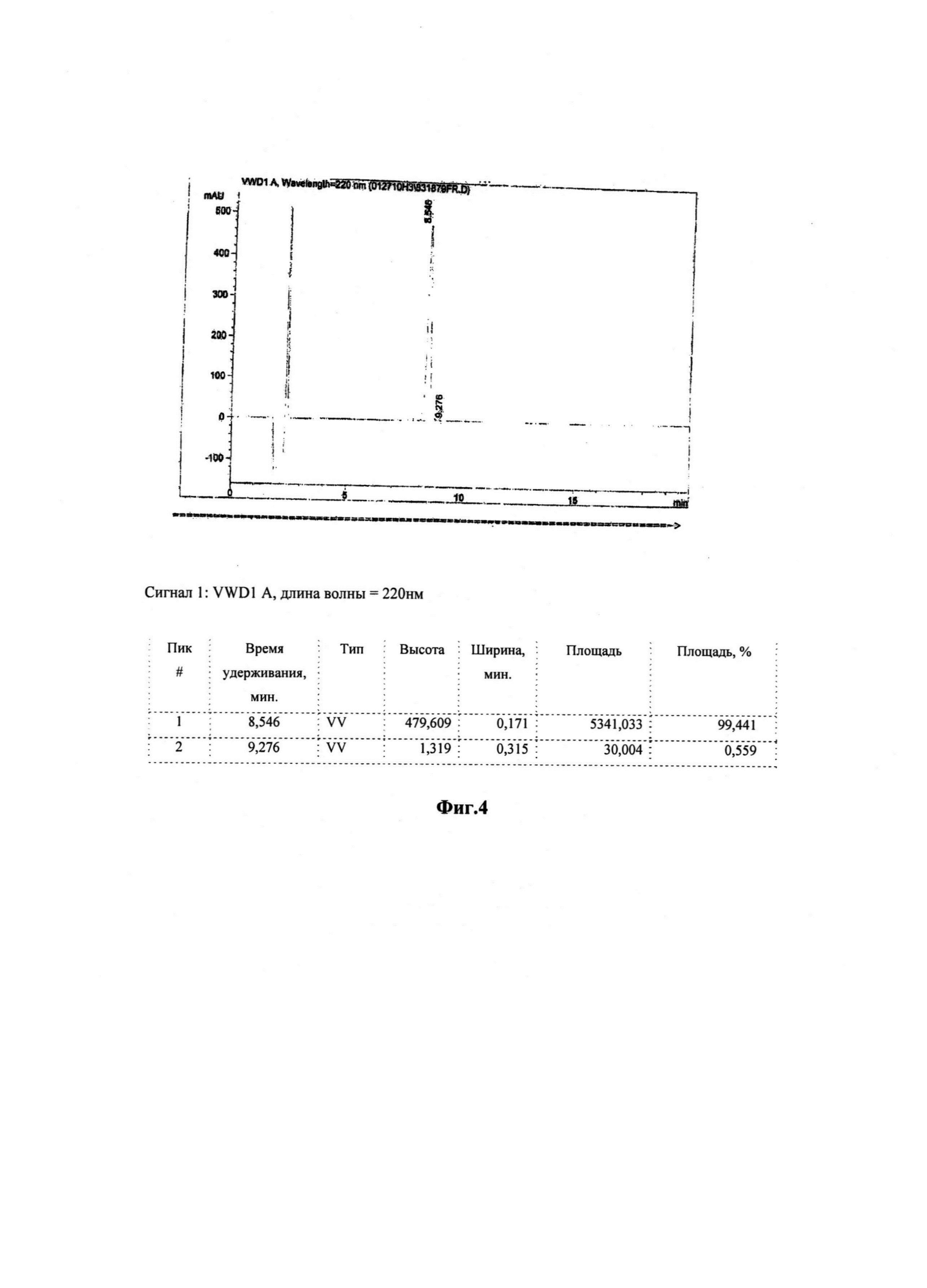
На Фигуре 4 показаны ВЭЖХ хроматограммы циклического пептида RGCys-новой кислоты (Соединение 2).
На Фигуре 5 показаны масс-хроматограммы Electrospray циклического пептида RGCys-новой кислоты (Соединение 2).
Фигура 6 представляет схематический чертеж, иллюстрирующий механизм действия соединений по настоящему изобретению.
Фигура 7А и Фигура 7В представляют схематические чертежи, дополнительно иллюстрирующие механизм действия соединений по настоящему изобретению.
Фигура 8 представляет диаграмму, показывающую общую площадь неоваскуляризации в мышиной модели CNV на 14 день после введения различных доз Соединения 1 и контроля (только носитель).
Фигура 9 представляет столбчатую диаграмму для сравнения измеренной площади неоваскуляризации в мышиной модели ROP после введения различных доз Соединения 1 и контроля (только носитель).
Фигуры 10A-10J представляют графическое и диаграммное представление результатов клинического исследования множественных доз человека Соединения 1.
Фигуры 11А-11С представляют столбчатые диаграммы, сравнивающие эффекты ранибизумаба и Соединения 1 по одному или в комбинации на неоваскуляризацию сетчатки у трансгенных VEGF-продуцирующих мышей.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым соединениям, в том числе соединениям Общих формул I по VII, указанным выше. Конкретные примеры включают линейные формы Arg-Gly-NH-CH(CH2-SO3H)COOH и циклическую форму Arg-Gly-NH-CH(CH2-SO3H)COOH (пример, упомянутый здесь как Соединение 2), а также их производные, в том числе
фармацевтически приемлемые соли, гидраты, стереоизомеры, мультимеры, циклические формы, линейные формы, многомерные формы, конъюгаты с лекарственным средством, пролекарства и их производные.
Синтез Соединений 1 и 2
Может быть проведен традиционный твердофазный синтез пептидов (SPPS, см. R.B. Merrifield, J. Am. Chem. Soc. (1963) 85(14):2149-2154), известней специалистам в данной области техники. SPPS является предпочтительным методом синтеза благодаря высокой производительности. В общем, первый этап твердофазного пептидного синтеза заключается в сборке пептидной цепи с протекторными производными аминокислот на полимерной подложке. На втором этапе этой технологии проводят отщепление пептида от подложки с одновременным расщеплением всех боковых протекторных групп, получая незрелый свободный пептид. Общий принцип SPPS заключается в повторяющихся циклах связывания-депротекции. Свободный N-концевой амин пептида, прикрепленного к твердофазной подложке, соединяется с отдельной N-протекторной аминокислотной единицей. Эта единица затем подвергается депротекции, открывая новый N-концевой амин, к которому далее может быть присоединена аминокислота. См. "Asymmetric Synthesis", Von G.M. Coppola и H.F. Schuster; John Wiley & Sons, Нью-Йорк 1987, где описаны стратегии синтеза, протекции и депротекции, а также "Greene's Protective Groups in Organic Synthesis", Peter G.M. Wuts и Theodora W.Greene, (2-е издание) J. Wiley & Sons, 1991, где описаны стратегии протекции и депротекции.
Из двух основных используемых форм твердофазного синтеза пептидов - Fmoc (9-флуоренилметилоксикарбонил; щелочная лабильная альфа-амино-протекторная группа) и t-Boc (трет-бутилоксикарбонил; кислотная лабильная протекторная группа), предпочтительнее в синтезе пептидов по настоящему изобретению использование Fmoc. Для каждого отдельного способа применяются различные смолы и стадии протекции боковых аминокислот и последовательные стадии расщепления/депротекции. После отщепления от подложки пептиды, как правило, очищают с помощью обратно-фазовой ВЭЖХ с использованием колонок, таких как С-18, С-8 и С-4.
Пример твердофазного синтеза пептидов
Ниже приведен план этапов синтеза пептидов на Wang смоле в качестве твердого носителя, используя щелочную лабильную 9-флуоренилметилоксикарбонил (Fmoc) протекторную группу.
Fmoc депротекции
Вводят 0,08 ммоль Fmoc-Pro-Wang смолы в колонку, оснащенную пластиковой крышкой. Промывают смолу дважды порциями DMF (диметилформамидом) по 3 мл в течение 1 минуты для каждой. Затем добавляют около 3 мл 20% пиперидина в DMF, в результате чего происходит снятие Fmoc в течение 15 минут. В течение этого времени круговыми движениями мягко перемешивают или взбалтывают колонку для обеспечения полного смешивания. После завершения реакции (около 15 мин.) содержимое сливают, а смолу снова смывают DMF (4×3 мл).
Присоединение амидной связи
Желаемую Fmoc-защищенную аминокислоту, Fmoc-Thr-TBU (3 экв.; по отношению к нагрузке смоле, как указывается поставщиком) и DIEA (6 экв.) в DCM (0,5 М по отношению к аминокислоте) затем добавляют к смоле. Смесь охлаждают до -20°С в течение 20 минут. Далее, к реакционной среде добавляют бензотриазол-1-ил-окситрипирролидинофосфониум гексафторфосфат (РуВОР), пептид, другие реагенты, используемые в твердофазном синтезе пептидов (3 экв.). После встряхивания при - 20°С в течение 8 часов реакционную смесь сливают, и смолы промывают DCM (3х).
После Fmoc депротекции с использованием 20% пипердина в DMF (15 мин.) и промывкой DMF (3 раза) протектируется Fmoc следующая аминокислота (3экв., по отношению к используемой смоле), РуВор (также, как указано выше).
Отщепление
Для получения пептида в форме свободной кислоты эфирная связь расщепляется с использованием сильнокислотной среды, например, TFA (трифторуксусная кислота). Смолу обрабатывают 2-3 мл раствора трифторуксусной кислоты и воды 95:5. Осторожно перемешивают смолу в течение 25 минут. Затем сливают колонку и тщательно собирают фильтрат в коллекторный стеклянный сосуд.
Синтез Соединения 1 (GRG Цистеиновая кислота ТП):

Этап 1. Загрузка смолы: о-хлоротритил смола предварительно нагружалась пролином, используемым в качестве стартового материала.
Этап 2. Сборка пептида: для сборки пептида используется Fmoc синтез. Протекторные аминокислоты активированы РуВОР, а концевые группы Fmoc удалены с помощью 20% пиперидина в DMF. Следующие протекторные аминокислоты используются в порядке, в котором они представлены ниже:
a. Fmoc-Thr-TBU (Fmoc треонин-t-бутиловый эфир)
b. Fmoc-Цистеиновая кислота-Pfp (Fmoc-Цистеиновая кислота-пентафтор фениловый эфир)
c. Fmoc-Gly (Fmoc глицин)
d. Fmoc-Arg-Pbf (Nα-Fmoc-Nω)-(2,2,4,6,7 пентаметилдигидробензофуран-5-сульфонил)-L-аргинин)
e. Fmoc-Gly (Fmoc-глицин)
Этап 3. Отщепление пептида от смолы: полученный пептид отщепляется от твердой подложки и протекторные группы удалятся раствором 85,5% TFA, 5% раствором фенола, 2% воды, 5% тиоанизола, и 2,5% этандитиола.
Этап 4. Очистка: для очистки полученного пептида RGCys-овой кислоты используется высокоэффективная жидкостная хроматография (ВЭЖХ).
Количество Соединения 1, приготовленного, в соответствии с описанным выше, было проанализировано с помощью высокоэффективной жидкостной хроматографии, обеспечивая >98% область/область по чистоте [ВЭЖХ условия: Буфер А: 0,1% трифторуксусная кислота (TFA) в воде; Буфер В: 0,1% TFA в ацетонитриле; Подвижная фаза (ПФ) А: 97% буфера А и 3% буфера В, Подвижная фаза В: 79% буфера А и 21% буфера В; Подвижная фаза С: 50% буфера А и 50% буфера В, градиент см. ниже Таблицу 1; скорость потока: 1,0 мл/мин; колонка: Water Symmetry® С18, 5μ, 4,6×250 мм, температура колонки: 30°С; детектор: УФ@ 220 нм; объем введенного образца: 20,0 мкл; подготовка образца: 20 мкл образца, разведенного в 1,0 мл Подвижной фазы А [около 0,5 мг/мл)]. Соответствующее хроматограммы ВЭЖХ показаны на Фиг. 2. Кроме того, молекулярная масса очищенного Соединения 1, полученного путем последовательного добавления соответствующих аминокислот для синтеза пептидной последовательности, была определена с помощью электроспрей масс-спектрометрии и составила 638,3 а.е.м. (теоретическая масса: 637,7 а.е.м.), подтверждая идентичность Соединению 1. Электроспрей масс-спектрограммы Соединения 1 показана на Фиг. 3.

Синтез Соединения 2 (Цикло-RGCys-овая кислота fN(СН3)V):

Этап 1. Загрузка смолы: о-хлоротритил смола используется в качестве исходного материала. Fmoc-N-метил-L-Val присоединяется к смоле.
Этап 2. Сборка пептида: Fmoc синтез используется для сборки пептида. Протекторные аминокислоты активированы РуВОР, а концевые группы Fmoc удалены с помощью 20% пиперидина в DMF. Следующие протекторные аминокислоты используются в порядке, в котором они представлены ниже:
a. Fmoc-Phe (Fmoc-фенилаланин)
b. Fmoc-цистеиновая кислотно-Pfp (Fmoc-цистеиновая кислота - пентафтор фениловый эфир)
c. Fmoc-Gly (Fmoc-глицин)
d. Fmoc-Arg-Pbf (Nα-Fmoc-Nω-(2,2,4,6,7пентаметилдигидробензофуран-5-сульфонил)-L-аргинин)
Этап 3. Отщепление пептида из смолы: пептид отщепляется от твердой поддержки с помощью уксусной кислоты /TFA/ DCM (1:3:3)
Этап 4. Циклизация и депротекция для получения желаемого циклического пептида: циклизация через in situ активацию с использованием дифенилфосфорилазида и бикарбоната натрия при сильном разбавлении. Боковые цепи депротектируются с использованием 85,5% TFA, 5% раствор фенола, 2% воды, 5% тиоанизола, 2,5% этандитиола.
Этап 5. Очистка: для очистки используется ВЭЖХ.
Количество Соединения 2, приготовленного в соответствии с описанным выше, было проанализировано с помощью высокоэффективной жидкостной хроматографии как >99% область/область по чистоте (ВЭЖХ условия: Подвижная фаза А: 0,1% трифторуксусная кислота в воде, В: 0,1% TFA в (80% ацетонитрил плюс 20% воды); градиент от 26% до 36% в течение 20 минут; скорость потока: 1,0 мл/мин; колонка Phenomenex C18(2) 4,6×150 мм, 5μ, 100А, детектор УФ@ 220 нм; объем введенного образца: 100,0 мкл). Соответствующее хроматограммы ВЭЖХ показаны на Фиг. 4. Кроме того, молекулярная масса очищенного Соединения 2, полученного путем последовательного добавления соответствующих аминокислот для синтеза пептидной последовательности, была определена с помощью электроспрей масс-спектрометрии и составила 625,3 а.е.м. (теоретическая масса: 625,77 а.е.м.), подтверждая идентичность Соединению 2. Электроспрей масс-спектрограмма Соединения 2 показана на Фиг. 5.
Способы ингибирования клеточной адгезии
Настоящее изобретение также относится к способам ингибирования клеточной адгезии к RGD сайтам связывания у субъекта, являющегося человеком или животным, путем введения субъекту эффективного количества R-G-Cys-овой кислоты (например, линейной формы R-G-NH-CH(CH2-SO3H)COOH или циклической формы RG-NH-CH(CH2-SO3H)COOH) или их производных (в том числе, фармацевтически приемлемых солей, гидратов, стереоизомеров, мультимеров, циклических форм, линейных форм, конъюгатов с лекарственными средствами, пролекарств и их производных).
Заявитель обнаружил, что синтетические пептиды RG Cys-овой кислоты по настоящему изобретению вызывают апоптоз путем конкурентного ингибирования прикрепления клетки к компонентам ВКМ. Таким образом, представленные синтетические пептиды RG Cys-овой кислоты и их производные могут быть использованы в качестве действующих антагонистов интегрина как лечебное средство против ангиогенеза, воспаления, раковых метастаз, тромбоза, профилактики и лечения рубцов, а также фармакологических агентов витреолизиса. Кроме того, важным аспектом настоящего изобретения является то, что предусмотрена улучшенная направленность на α, β интегрины с применением мультимерных и радиомеченных RGC пептидов для использования в качестве радиотерапевтических средств для обнаружения опухолей (диагностические или визуализирующие агенты) и их лечения. Еще одним важным аспектом является улучшенные функции конъюгатов RGC пептидов и мультимерных конъюгатов RGC пептидов в качестве переносчиков лекарственных средств, например, как переносчиков противораковых лекарств для эффективной нацеленности на опухоль.
Как описано в здесь, сульфокислоты в составе RGC-пептидов являются более сильными кислотами, чем соответствующие карбоновые кислоты в RGD-пептидах. Такая высокая полярность группы сульфокислоты приводит к усилению межмолекулярных связей. Например, RG-Цистеиновая кислота, которая имеет более поляризованную О-Н связь, может образовывать более сильные водородные связи, чем RG-Аспарагиновая кислота, которая обладает относительно менее поляризованной О-Н связью, с амидными группами и/или с аминокислотами боковых цепей белка в интегриновом сайте связывания и/или имеет более сильные взаимодействия с ионами металлов в интегриновом сайте связывания. Таким образом, новые RGC пептиды и их производные по настоящему изобретению представляют улучшенные соединения и композиции по сравнению с соответствующим RGC пептидами в распознавании и связывании интегриновым рецептором.
Кроме того, у больных сахарным диабетом с хронической гипергликемией, связанной с повышенным IOP, открытая угловая глаукома, в частности, как сообщается, связана с накоплением фибронектина в трабекулярной сетчатой ткани, избыток фибронектина, как полагают, препятствуют оттоку жидкости (см. Oshitari, Т, и соавт., Am. J. Ophthalmol. (2007) 143:363-365). Вовлечение фибронектина в взаимодействия клетка-ВКМ в трабекулярной сети указывает на начальную стадию открытой угловой глаукомы (см. Mark С. Filla и др., Invest. Ophthalmol. Vis. Sci. (2002) 43:151-161; и Cheryl R. Harm и др., Ophthalmic Res. (2001) 33: 314-324). Также сообщалось, что эндотелиальные клетки канала Шлемма взаимодействуют с внеклеточным матриксом, оказывая влияние на облегчение оттока (см. Cindy K. Bahler и др., Invest. Ophthalmol. Vis. Sci. (2004) 45: 2246-2254). В связи с ингибированием оттока жидкости при наличии избыточных компонентов внеклеточного матрикса, таких как фибронектин, применение пептидов RGCys-овой кислоты и ее производных может быть пригодным для лечения повышенного IOP у больных сахарным диабетом.
Предпочтительный пептид RG Cys-овой кислоты может быть слитым полипептидом, циклическим или линейным полипептидом, производным полипептида, в том числе производным пептида RG Cys-овой кислоты или ассоциированным или связанным с системами доставки лекарственных препаратов или других лекарствами, таких как, например, противораковые препараты, мультимерный RGC пептид, моноклональное антитело, содержащее последовательность RG Cys-овой кислоты, которое иммунореактивно к сайту связывания интегрина, или его функциональный фрагмент.
Полипептиды, содержащие RG Cys-овую кислоту, могут иметь последовательности, соответствующие аминокислотной последовательности природного адгезионного сайта связывания интегрина, таких, как присутствующие в фибриногене, фибронектине, витронектине, факторе Виллебранда, ламинине, тромбоспондине и другим им подобным лигандам.
Настоящая пептидная последовательность состоит из трех аминокислот, имея терминальные гуанидино-, сульфоновую и карбоксильную группы и их производных, связанных и/или ассоциированных с системами доставки лекарств, в том числе пептидных фрагментов, гликопротеинов и полимерных групп, таких как ПЭГ, плуроник и других полимерных групп, а также липосом и наночастиц. Фармацевтические композиции, содержащие их, для лечения различных патологических расстройств включают инъекции, гели, суспензии, мази, твердые и жидкие лекарственные формы.
Интегриновые рецепторы, связанные с мотивом клеточной адгезии, такие как фибронектин, витронектин, ламинин, фибриноген, тромбоспондин и фактор Виллебранда, представляют собой целевой эпитоп пептида RG Cys-овой кислоты и ее производных. Трипептид, RG Cys-овая кислота, была обнаружен как узнаваемая минимальная аминокислотная последовательность связывающих доменов клетки. Эта последовательность может также участвовать в иммунных функциях, несвязанных с интегринами. Таким образом, было обнаружено, что синтетическая последовательность RG Cys-овой кислоты имитирует RGD связывающий домен клетки, а также то, что замена на α-углерод аспарагиновой кислоты дает более сильное сродство к целевому интегрину. Сульфокислоты в пептидах RG Cys-овой кислоты являются более сильными кислотами, чем соответствующие карбоновые кислоты в RGD-пептидах. Такая повышенная полярность группы сульфокислоты приводит к усилению межмолекулярных связей. Например, RG-Цистеиновая кислота, которая имеет более поляризованную О-Н связь, может образовывать более сильные водородные связи, чем RG-Аспарагиновая кислота, которая обладает относительно менее поляризованной О-Н связью, с амидными группами и/или аминокислотами боковых цепей в интегриновом сайте связывания и/или сильнее взаимодействует с ионами металлов в составе интегринового сайта связывания.
Наиболее общими формулами последовательностей RG Cys-овой кислоты по настоящему изобретению являются следующие:
Формула А:

где Х=-CH(R1)-S(=O)2-Y;
-CH(R1)-SH;
-CH(R1)-OZ;
-CH(R1)S(=O)Y;
-CH(R1)-O-S(=O)2-OX1 и
-CH(R1)-O-P(=O)2-OX1;
где Y=OX1, NH2; X1=-H, C1-С6 линейный алкил, фенил;
R1=H, C1-С6 линейный алкил, фенил или SO3H;
Z=Н, SO3H.
Формула В:

где X=-CH(R1)-S(=O)2-Y;
-CH(R1)-SH;
- CH(R1)-OZ;
-CH(R1)S(=O)Y;
-CH(R1)-O-S(=O)2-OX1 и
-CH(R1)-O-P(=O)2-OX1;
где Y=OX1, NH2; X1=-H, C1-С6 линейный алкил, фенил;
R1=H, C1-С6 линейный алкил, фенил или SO3H;
Z=Н, SO3H и
А2 выбран из: -Phe-Val-Ala, -Phe-Leu-Ala, -Phe-Val-Gly, -Phe-Leu-Gly, -Phe-Pro-Gly, -Phe-Pro-Ala, -Phe-Val или их соли или N-алкилированного производного. Также может быть использована любая комбинация D-формы или L-формы Arg, Gly, Cys, Phe, Val, Ala, Leu, Pro, Thr, также как и циклические формы, представленные ниже.
Примеры циклических форм включают:
Формула С:
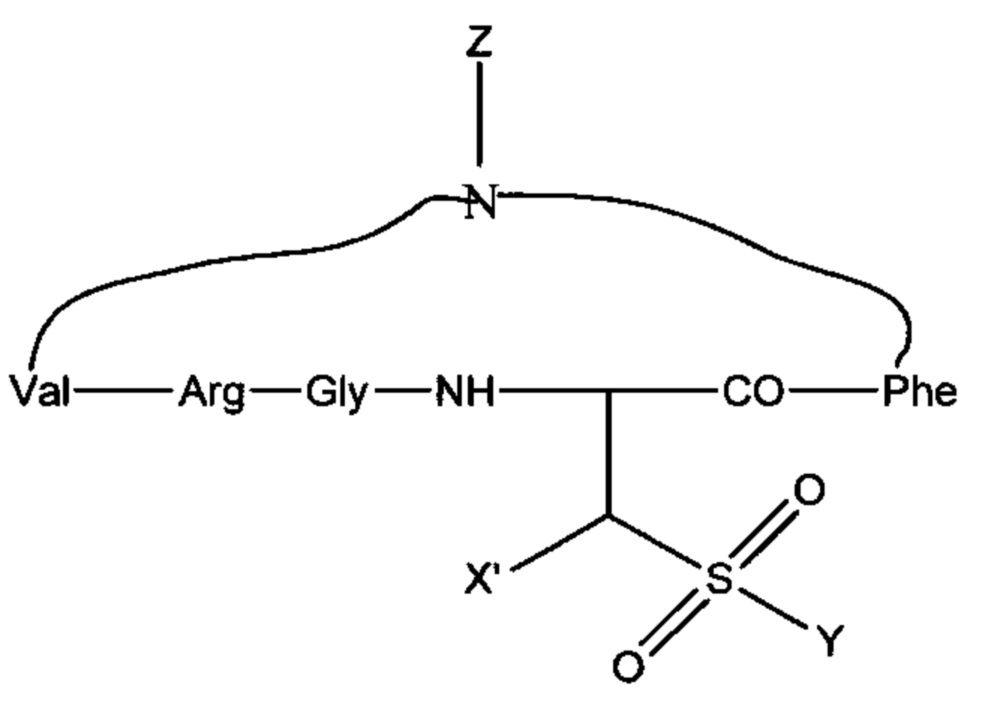
где X' выбран из: Н, C1-C6 алкила, Ph, SO3H; Y=ОН, NH2 и Z=Н, СН3.
Циклические формы также включают пента- и гепта- пептиды, такие как, например, конкретное соединение Общей формулы С, а именно, Соединение 2 (Цикло-RGCys-овая кислота fN(СН3)V), представленная ниже:

Формула А охватывает Общие формулы I-VI, описанные здесь. Формула В включает Общую формулу VII, описанную здесь.
Формула D:
A1-Arg-Gly-NH-CH(X)-CO-A2
где X=-CH(R1)-S(=O)2-Y;
-CH(R1)-SH;
-CH(R1)-OZ;
CH(R1)S(=O)Y;
-CH(R1)-O-S(=O)2-OX1 и
-CH(R1)-O-P(=O)2-OX1;
где Y=OX1, NH2; X1=-H, C1-С6 линейный алкил, фенил;
R1=H, C1-С6 линейный алкил, фенил или SO3H
Z=Н, SO3H и
A1 и А2 выбраны из: -Phe-Val-Ala, -Phe-Leu-Ala, -Phe-Val-Gly, -Phe- Leu-Gly, -Phe-Pro-Gly, -Phe-Pro-Ala, -Phe-Val или их соли или N-алкилированного производного. Также может быть использована любая комбинация D-формы или L-формы Arg, Gly, Cys, Phe, Val, Ala, Leu, Pro, Thr, также как и циклические формы, представленные ниже.
Замещенные последовательности RG Cys-овой кислоты включают аналоги циклической RG Cys-овой кислоты.
RG Cys-овая кислота и ее производные могут применяться подкожно, дерматологически, офтальмологически и системно, с использованием системы доставки лекарств или любых фармацевтически приемлемых форм дозирования инъекций, либо твердых препаратов или мазей.
Соединения по настоящему изобретению могут быть введены любым способом, который подходит для обеспечения предполагаемого терапевтического эффекта, включая, но не ограничиваясь этим: пероральный, ректальный, внутривенный, внутриартериальный, внутрикожный, подкожный, внутримышечный, интратекальный, подъязычный, щечной, интраназальный, чресслизистый, трансдермальный, местный, внутриглазной, интравитреальный, другие энтеральные, другие парентеральные и/или другой (-ие) возможный(-ые) путь(-и) введения.
Соединения по настоящему изобретению могут быть введены в любой дозе, которая обеспечивает предполагаемый терапевтический эффект, избегая неблагоприятных или токсических эффектов. Обычная доза, в которой могут быть введены соединения по настоящему изобретению, для человека находятся в диапазоне примерно от 1 нг/кг до 1,0 г/кг.
Там, где это возможно и целесообразно, соединения по настоящему изобретению необязательно могут быть подготовлены в форме липосом или наночастиц (например, нанокапсул). Формирование и использование липосом, в общем, известно специалистам в данной области. Липосомы образуются из фосфолипидов, диспергированных в водной среде так, что они самопроизвольно образуют многослойные концентрические двухслойные везикулы, иногда называемые многослойными везикулами (MLV). MLV, как правило, имеют диаметр от 25 нм до 4 мкм. При использовании ультразвука MLV формируют небольшие однослойные везикулы (SUV) примерно от 200 до 500 ангстрем в диаметре, ядра которых содержат водный раствор. В общем, при распылении в водной среде фосфолипиды могут образовывать различные структуры, помимо липосом, в зависимости от молярного соотношения липидов к воде. При низком молярном соотношении липидов к воде образуют липосомы. Физические характеристики липосом зависит от рН, тоничности и наличия или отсутствия двухвалентных катионов. Липосомы могут взаимодействовать с клетками с помощью различных механизмов, в том числе 1) эндоцитоза (например, фагоцитоз липосом клетками, такими как макрофаги и нейтрофилы), адсорбции на поверхности клетки, 2) взаимодействие с компонентами клеточной поверхности, 3) слияние с плазматической клеточной мембраной путем включения липосом в липидный бислой в мембране или 4) передача липосомальных липидов клеточной или субклеточной мембране, или наоборот. Возможны вариации липосомальных препаратов в зависимости от того, каков механизм(ы) взаимодействия липосом с клетками в придаточных пазухах носа, слизистой оболочки носа, и т.д.
Нанокапсула представляет собой наночастицу, которая состоит из корпуса и пространства, в котором могут быть размещены желаемые вещества. Методы формирования нанокапсул известны в уровне техники. Можно получить полимерные нанокапсулы конкретных размеров и форм. Они могут быть изготовлены как монодисперсные частицы, которые имеют определенные физические и химические свойства и, таким образом, могут быть адаптированы для облегчения высвобождения терапевтических или диагностических веществ в ответ на конкретные бимолекулярные целевые механизмы, такие как рН, количество жидкости слизистой или других условий в придаточных носовых пазухах или в другой области уха, носа или горла, где они высвобождаются. Нанокапсулы могут быть использованы в настоящем изобретении, как "умные лекарственные средства", которые имеют специфические химические рецепторы или сайты связывания, которые будут связываться со специфическими клетками-мишенями (например, раковыми клетками или клетками, связанных с воспалительными условиями).
Ниже приведены не ограничивающие примеры лекарственных средств для фармацевтических препаратов, содержащие соединения по настоящему изобретению. Также включены примеры по безопасности и/или эффективности, показанные при использовании примерного RGC пептида или производные в ингибировании клеточной адгезии. Используемые здесь термины "RG Cys-овый пептид", "RGC пептид", "RG Cys-пептид" и "соединения по настоящему изобретению" должны восприниматься как синонимы композиций, содержащих последовательности RG Cys-овой кислоты и их производные, в том числе, но не ограничиваясь, тех, которые определены Общими формулами I-VII и Соединениями 1 и 3-5, как описано здесь.
Методы терапии, направленной на интегриновые рецепторы, для лечения заболеваний глаз
Среди множества потенциальных терапевтических применений композиций по настоящему изобретению представлены лечение определенных заболеваний глаз, которые характеризуются избыточной васкуляризацией сетчатки (здесь, как правило, обозначаются как "неоваскулярное заболевание глаз"). Следующие неограничивающие примеры рассматривают применения композиций по настоящему изобретению как в отдельности, так и в комбинации с другими агентами для лечения таких неоваскулярных расстройств глаз.
При использовании в данной патентной заявке следующие обозначения и аббревиатуры имеют следующие значения:
АЕ Нежелательное явление
Allegro Allegro Ophthalmics, LLC
AMD Возрастная макулярная дегенерация
BCVA Острота зрения с максимальной коррекцией
CNV Хориоидальная неоваскуляризация
CRA Специалист по клиническим исследованиям
DME Диабетический отек макулы
DR Диабетическая ретинопатия
Сухая AMD Сухая возрастная макулярная дегенерация
ERG Электроретинография
ETDRS Исследования раннего лечения диабетической ретинопатии
FDA Управление по контролю пищевых продуктов и лекарственных средств
GCP Надлежащая клиническая практика
IOP Внутриглазное давление/Тонометрия
IRB Экспертный совет
ОСТ Оптическая когерентная томография
OD Правый глаз
OS Левый глаз
PI Главный исследователь
PDR Пролиферативная диабетическая ретинопатия
PVD Задняя отслойка стекловидного тела
РВО Окклюзия вены сетчатки
SAE Серьезное нежелательное явление
SC Координатор исследования
USP Фармакопея США
VEGF Фактор роста эндотелия сосудов
Влажная AMD Влажная возрастная макулярная дегенерация.
Возрастная макулярная дегенерация (AMD) является основной причиной слепоты в западном мире, и пациенты с этим заболеванием страдают от необратимого повреждения макулы или центральной части сетчатки. Сухая AMD вызывает медленно прогрессирующую потерю зрения, в то время как влажная AMD может привести к резкому ухудшению центрального зрения. Влажная AMD служит причиной подавляющего большинства острой потери зрения у пострадавших пациентов, однако обе формы являются одними из основных проблем здравоохранения в 21 веке. Приблизительно 1,5 миллионов американцев имеют хориоидальную неоваскуляризацию (CNV), вторичную по отношению к AMD, и каждый год развиваются 200 000 новых случаев. Документально подтверждено, что распространенность, частота заболеваемости и темпы прогрессирования AMD увеличиваются с возрастом. В Соединенных Штатах Америки люди в возрасте старше 65 составляют одну из крупнейших групп населения, и эта демографическая категория, согласно прогнозам, значительно возрастет в ближайшие десятилетия. Населения в возрасте старше 85 в США, как ожидается, удвоится к 2020 году. Таким образом, AMD представляет серьезную проблему общественного здравоохранения в Соединенных Штатах Америки. В частности, влажная AMD является наиболее значимым фактором, вызывающим ухудшение зрение у пациентов с AMD. Влажная AMD характеризуется хориоидальным ангиогенезом, т.е. развитием аномальных кровеносных сосудов в сетчатке. Эти сосуды просачивают жидкость, кровоточат и превращаются в сосудисто-волокнистую рубцовую ткань. Этот процесс разрушает вышележащих фоторецепторы и вызывает острую потерю зрения. Существует хорошее доказательство того, что снижение хориоидальной перфузии приводит к дисфункции пигментного эпителия сетчатки (ПЭС) и потере фоторецепторов при AMD. Диабетический макулярный отек (DME) является результатом утолщения центральной части сетчатки из-за повреждения капилляров сетчатки при диабете. DME является ведущей причиной слепоты у населения трудоспособного возраста и также вызывает от легкого до умеренного ухудшения зрения в этой группе населения, а также у людей, которые уже не могут работать. Применение лазера к поврежденным капиллярам в утолщенной сетчатке было основой лечения на протяжении более 25 лет. Недавние результаты клинических исследований диабетической ретинопатии показали, что в глазах со сниженной остротой зрения в результате DME, вовлекающей центр макулы, анти-VEGF терапия с помощью Луцентис в сочетании с фокальной/решетчатой лазерной терапией, обеспечивает превосходные результаты улучшения зрения и приемлемый профиль безопасности по сравнению с предьщущим стандартом лечения только лазером. Молекулярные события, происходящие при развитии пред-ретинальной и хориоидальной неоваскуляризации, полностью не выяснены, однако как играющий важную роль в этом процессе был показан фактор роста эндотелия сосудов (VEGF). Интегрины α5β1, αvβ3 и αvβ5 также вовлечены в процесс ангиогенеза, и, как известно, экспрессируются в неоваскулярной ткани глаза пациентов с влажной AMD и PDR. Существует также ряд других молекул, которые играют важные роли: bFGF, IL-8, PDGF, различные протеазы, включая активатор плазминогена и матриксные металлопротеиназы, хемокины и других воспалительные медиаторы. Пролиферации эндотелиальных клеток, повышенная проницаемость сосудов, воспаление и избыточное продуцирование VEGF являются одними из основных патологических изменений во влажной AMD и DME.
Настоящее изобретение относится к новым классом лекарственных препаратов для сосудистых заболеваний сетчатки, включая влажную AMD, DR и DME. Соединения по настоящему изобретению имеют множество механизмов действия против сосудистых заболеваний сетчатки, в том числе а) вызывают анти-ангиогенез непосредственно путем ингибирования продукции VEGF, b) вызывают ингибирование VEGF-2 рецептора, с) вызывают отрицательное регулирование или ингибирование тирозинкиназы и d) вызывают разжижение стекловидного тела и заднюю отслойку стекловидного тела, тем самым, позволяя диффузию VEGF из глаза. Механизмы действия могут быть использованы непосредственно как таковые (например, путем терапии с использованием только соединения(ий) по настоящему изобретению) или же могут быть аддитивным или дополнительным ингибированием существующего VEGF (например, путем комбинирования терапии с использованием соединения(ий) по настоящему изобретению в сочетании с композицией, которая связывает, улавливает, удаляет или иным образом удерживает эффект VEGF, который уже был продуцирован, примеры которых включают, но необязательно ограничиваются ими: Авастин, Луцентис и/или Эйлеа). Авастин (бевацизумаб) представляет собой анти-VEGF моноклональное антитело. Луцентис (ранибизумаб) представляет собой фрагмент рекомбинантного гуманизированного моноклонального антитела изотипа IgG1 каппа. Эйлеа (афлиберцепт) представляет собой рекомбинантный слитый белок, состоящий из частей рецепторов 1 и 2 фактора роста эндотелия сосудов (VEGF) человека.
Благодаря отрицательной регуляции продукции VEGF, в отличие от ограничения подачи ранее существовавшего VEGF, соединения по настоящему изобретению обладают уникальным механизмом действия, что позволяет гораздо раньше вмешаться в ангиогенный каскад по сравнению с существующими стандартами лечения. Это схематически показано на Фиг. 6. Помимо работы на более ранней стадии ангиогенного каскада, соединения по настоящему изобретению связывают многочисленные интегриновые субъединицы, в отличие от моноклональных антител, которые в 500 раз больше и специфичны только к одной субъединице интегрина, как показано на Фиг. 7А. В отличие от этого, олигопептид способен связывать гораздо более эффективно с множество интегриновых субъединиц, участвующих в ангиогенезе, как показано на Фиг. 7В.
Примеры неоваскулярных заболеваний глаз, которые потенциально могут быть подвергнуты лечению соединениями по настоящему изобретению, включают Диабетическую ретинопатию (DR), Дабетический макулярный отек (DME) и Возрастную макулярную дегенерацию (AMD). Имеющиеся в настоящее время фармацевтические схемы лечения этих заболеваний включают некоторые лекарственные препараты, которые связывают, улавливают, исключают или иным образом удерживают эффект VEGF, который уже был продуцирован (как правило, обозначенные здесь как Ловушки VEGF). Коммерчески доступные примеры таких "Ловушек VEGF" включают бевацизумаб (Авастин), ранибизумаб (Луцентис) и афлиберцепт (Эйлеа). Бевацизумаб описан как анти-VEGF моноклональное антитело. Ранибизумаб описан как фрагмент рекомбинантного гуманизированного моноклонального антитела изотипа IgG1 каппа. Афлиберцепт описан как рекомбинантный слитый белок, состоящий из частей рецепторов 1 и 2 фактора роста эндотелия сосудов (VEGF) человека. При таких схемах лечения на основе анти-VEGF антител обычно вводят повторные интравитреальные инъекции с интервалами от 4 до 6 недель, возможно неограниченно, учитывая значительные неудобства, стоимость и кумулятивный риск инфекции.
В отличие от существующих Ловушек VEGF, композиции по настоящему изобретению имеют несколько механизмов действия против неоваскулярных заболеваний глаз, а именно: анти-ангиогенеза путем непосредственного ингибирования продукции VEGF, ингибирования VEGF-2 рецептора, отрицательной регуляции тирозинкиназы и индукции разжижения стекловидного тела и задней отслойки стекловидного тела (что способствует диффузии VEGF или других вредных агентов от сетчатки и из глаза). Некоторые примеры, приведенные ниже, описывают применение Соединения 1 в отдельности и в комбинации с другими агентами (Ловушками VEGF) в лечении неоваскулярных заболеваний глаз.
Следует иметь в виду, что в дополнение к лечению неоваскулярных заболеваний глаз композиции по настоящему изобретению также полезны при лечении различных других заболеваний глаз, которые вызывают или не вызывают неоваскуляризацию сетчатки. Примеры заболеваний глаз, которые можно лечить композициями по настоящему изобретению, включают, но необязательно ограничиваются ими, влажную возрастную макулярную дегенерацию, диабетический отек макулы, пролиферативную или непролиферативную диабетическую ретинопатию, разжижение стекловидного тела, индукцию задней витреоретинальной отслойки (PVD), патогенез витреоретинальных заболеваний, таких как идиопатический разрыв макулы, витреомакулярная тракция, возрастная дегенерация макулы, неоваскуляризация сосудистой оболочки, витреоретинальная хирургия, окклюзии вен, хориоидальная неоваскуляризация, ишемия зрительного нерва, рубеоз радужки и предотвращение образования рубцов при хирургии глаукомы.
Фармацевтические композиции
Ниже приведены примеры фармацевтических препаратов I-Х, которые содержат пептиды RGC-овой кислоты по настоящему изобретению, такие как любой из тех, которые определены Общими формулами I-VII, или любое Соединение 1-5, как описано здесь.



Сравнение PVD-индуцированных эффектов RGD пептидов и Глицил-Аргинил-Глицил-Цистеин-Треонил-Пролин-СООН (GRG Цистеиновая кислота ТП; Соединение 1) на кроликах
В этом примере эффекты PVD-индицирования RGD пептидами и Глицил-Аргинил-Глицил-Цистеин-Треонил-Пролин-СООН (пептид RG Cys-овой кислоты; GRG Cys-овая кислота ТП; Соединение 1) сравнивались на кроликах. Протокол этого исследования был следующим:
Протокол:
Животная модель
a) 20 самцов и самок кроликов
b) весом примерно 1,5 - 2,5 кг
c) разделены на 2 группы
i) 10 кроликам интравитреально вводили 2,5% RGD раствор с рН=6,5
a) в 10 правых глаз вводили 2,5% RGD раствор
b) 5 левых глаз использовались как BSS контроль
c) в 5 левых глаз вводили 2,5% RGD + 0,02% ЭДТА с рН=6,5
ii) 10 кроликам интравитреально вводили 2,5% RGCys-овый раствор с рН=6,5
а) в 10 правых глаз вводили 2,5% RGCys-овый раствор с рН=6,5
b) в 10 левых глаз вводили 2,5% RGCys-овый раствор + 0,02% ЭДТА с рН=6,5
Активные реагенты
d) Натрия ЭДТА - 99,0 - 100,5% от Spectrum Chemical Corp.
e) RG Cys-овая кислота - cGMP от поставщика (чистота > 98%).
f) RGD - cGMP от поставщика (чистота > 98%).
g) BSS раствор
И RG Cys-овая кислота, RGD, RG Cys-овая кислота + натрия ЭДТА, RGD + натрия ЭДТА, и BSS раствор вводили в полость стекловидного тела за 24 часа до препарирования. Кролики (10 мг/кг массы тела) подвергались анестезии с помощью внутримышечной инъекции 2,0 мл 1:1 ксилазина (100 мг/мл) и кетамина гидрохлорида (100 мг/мл). Зрачки расширяли с помощью местного введения циклопенталата гидрохлорида 1% и фенилэфрина гидрохлорида 10%.
Все животные были первоначально осмотрены с помощью биомикроскопии с использованием щелевой лампы и непрямой офтальмоскопии для того, чтобы исключить всех животных, у которых уже имеются витреоретинальные нарушения. Интравитреальные инъекций 0,10 см3 вводились на 2 мм позади края роговицы в верхнем носовом квадранте с использованием 30-мерной иглы и 1,0 см3 шприца. Были приняты меры по избежанию повреждения линзы или сетчатки.
Двадцать четыре часа после инъекции и непосредственно перед началом механической витрэктомии было проведено ультразвуковое В-сканирование с целью определения состояния задней поверхности стекловидного тела, а также степени разжижения стекловидного тела. Двухпортовую витрэктомию pars plana проводили с использованием инфузионного волоконно-оптического световода и ножа для стекловидного тела, соединенного с витреотомом. Через 30 секунд коровой витрэктомии нож для стекловидного тела направляется на перипапиллярную поверхность сетчатки, где с использованием низкочастотных аспирации (< 30 ммГц) проводят разделение задней коровой поверхности стекловидного тела от поверхности сетчатки в 4 квадрантах. Были пересажены склеротомы и проведено послеоперационное ультразвуковое В-сканирование с целью определения наличия и степени любого присутствующего PVD в каждом секторе. Животных усыпляли с помощью внутрисердечной инъекции натрия фенобарбитала, и глаза были немедленно инокулированы.
Классификация по разжижению стекловидного тела и PVD для оценки степени PVD проведена на основе послеоперационного ультразвукового В-сканирования:
Степень 0. а) отслоение задней поверхности стекловидного тела не наблюдается.
б) разжижение стекловидного тела
Степень 1. а) стекловидное тело отслаивается в 2 или менее квадрантах.
б) разжижение стекловидного тела
Степень 2. а) стекловидное тело отслаивается в 3 или более квадрантах, но с сохранением фокального соединения вдоль медуллярных лучей
б) разжижение стекловидного тела
Степень 3. а) стекловидное тело полностью отслаивается от поверхности сетчатки
б) разжижение стекловидного тела
Все глаза прорезались острой бритвой в верхнем полюсе, прилегающем к гладкой части ресничного тела, непосредственно после инокулирования для обеспечения быстрого проникновения фиксатором. Были приняты меры по избежанию повреждения прилегающих сетчатки и хрусталика. Глаза были погружены в 2% параформальдегид плюс 2,5% глутаральдегид в течение как минимум 24 часов при температуре 4 градуса Цельсия. Один задний сегмент был удален, дегидратирован в метаноле и высушен в углекислом газе до критической точки, покрыт напылением золота и отснят с помощью сканирующего электронного микроскопа.
Результаты:
Инъекция: 2,5% RG Cys-овой кислоты
Группа 1. Исходно все животные не имели PVD в обоих глазах

Инъекция: 2,5% RGD
Группа 2. Исходно все животные не имели PVD в обоих глазах

Инъекция: 2,5% RG Cys-овая кислота + 0,02% Na ЭДТА
Группа 3. Исходно все животные не имели PVD в обоих глазах

Инъекция: 2,5% RGD + 0,02% Na ЭДТА
Группа 4. Исходно все животные не имели PVD в обоих глазах

Результаты этого исследования показывают, что RGD и RG Cys-овая кислота (GRG цистеиновая кислота ТП; Соединение 1) имеют аналогичные свойства, а инъекция 2,5% RG Cys-овой кислоты интравитреально вызывает полное отделение стекловидного тела от сетчатки в течение 24 часов, и добавление к стекловидному телу RGD и RG Cys-овой кислоты у кроликов полностью в разжижает его.
В целом, активность RG Cys-овой кислоты эквивалентна или чуть лучше, чем RGD при стимулировании полного PVD у кроликов и разжижении стекловидного тела. Возможно, это связано с его сильной конкурирующей связывающей способностью к сайтам связывания интегрина при его взаимодействии с внеклеточным матриксом, чем RGD. Как описано в данной работе, сульфокислоты являются более сильными кислотами, чем соответствующие карбоновые кислоты. Такая высокая полярность группы сульфокислоты приводит к усилению межмолекулярных связей. Например, RG- Цистеиновая кислота, которая имеет более поляризованные О-Н связи, может образовывать более сильные водородные связи, чем RG-Аспарагиновой кислоты, которая обладает относительно менее поляризованными О-Н связями, с амидными группами и/или аминокислотами боковых цепей в интегриновом сайте связывания и/или сильнее взаимодействует с ионами металлов в составе интегринового сайта связывания. Результаты также показывают, что при введении соединения с 0,02% натрия эдетатом, активность ни RGD, ни RG Cys-овой кислоты не изменяется.
Результаты также показывают, что нет никаких побочных эффектов при интравитреальном введении соединений RG Cys-овой кислоты Соединения 1 или RGD соединения.
Исследование безопасности множественных инъекций пептида RG Cys-овой кислоты Соединение 1 (GRG цистеиновой кислоты ТП) в глаза кроликов
В этом примере в глаза 5 самцов и 4 самок новозеландских кроликов весом примерно 1,5 - 2,5 кг вводили множественные инъекции пептида RGCys-оновой кислоты Соединение 1, и глаза были протестированы так, как описано в следующих параграфах.
Протокол исследования был следующим:
А) Исходное состояние: В начале исследования правые и левые глаза всех 9 кроликов были обследованы путем биомикроскопии с помощью щелевой лампы и офтальмоскопии для подтверждения того, что животные исходно не имеют витреоретинальных нарушений. Кроме того, проводились ультразвуковое β-сканирование, а также ERG сканирование на левых и правых глазах всех 9 животных для получения базовых значений.
Б) Экспериментальное лечение: затем все 9 кроликов получили интравитреальные инъекции либо RGC раствора, либо физиологического раствора (контроль). Растворы для лечения были подготовлены следующим образом:
Раствор RGCys-овой кислоты: 2,5 мг/100 мкл раствора RGCys-овой кислоты (Соединение 1), содержащего 0,02 мг динатрия ЭДТА + 0,80 мг хлорида натрия и USP стерильной воды для инъекций с рН 6,5.
Физиологический раствор (контроль): USP изотонический стерильный физиологический раствор, имеющий скорректированный рН 6,5.
Режим дозирования был следующим:
1) В правый глаз каждого из 9 кроликов вводили интравитреально 100 2,5 мг/100 мкл раствора RGCys-овой кислоты (общая введенная доза Соединения 1 = 2,5 мг).
2) В левый глаз каждого из 9 кроликов вводили интравитреально 100 мкл физиологического раствора (контроль).
3) На следующий день после начальных интравитреальных инъекций правые и левые глаза всех 9 кроликов были осмотрены путем биомикроскопии с использованием щелевой лампы и непрямой офтальмоскопии для оценки побочных эффектов инъекции.
4) На 7-й день после 1ой инъекции правые и левые глаза всех 9 кроликов вновь осматривали путем биомикроскопии с использованием щелевой лампы и непрямой офтальмоскопии для оценки побочных эффектов инъекции. Кроме того, проводилось ERG сканирование правых и левых глаз всех животных для определения изменений по отношению к исходному состоянию.
5) Группа из 3 кроликов под номерами 901, 904 и 909 выбрана случайным образом, и на правых и левых глазах этих трех выбранных животных проводилась механическая витрэктомия для определения состояния задней поверхности стекловидного тела.
6) Три случайно выбранных животных под номерами 901, 904 и 909 подвергали эвтаназии с помощью внутрисердечной инъекции натрия фенобарбитала, и немедленно извлекали глаза. Все глаза подвергались прорезанию острой бритвой верхнем полюсе, прилегающем к гладкой части ресничного тела, непосредственно после извлечения для обеспечения быстрого проникновения фиксатором. Были приняты меры по избежанию повреждения прилегающих сетчатки и хрусталика. Глаза были погружены в 2% параформальдегида плюс 2,5% глютаральдегида в течение как минимум 24 часов при температуре 4 градуса Цельсия. Один задний сегмент был удален, обезвожен в метаноле и высушен в углекислом газе до критической точки, покрыт напылением из золота и отснят с помощью сканирующего электронного микроскопа. Другие образцы были подвергнуты гистопатологическому анализу.
Остальным 6 кроликам под номерами 902, 903, 905, 906, 907 и 908 ввели вторую инъекцию через 7 дней после первой инъекции.
1) В правый глаз каждого из 6 оставшихся кроликов вновь вводили интравитреально 100 2,5 мг/100 мкл раствора RGCys-овой кислоты (общая введенная вторая доза Соединения 1 = 2,5 мг).
2) В левый глаз каждого из 6 оставшихся кроликов вновь вводили интравитреально 100 мкл физиологического раствора (контроль).
3) На следующий день после 2ой интравитреальной инъекции правые и левые глаза всех 6 оставшихся кроликов были вновь осмотрены путем биомикроскопии с использованием щелевой лампы и непрямой офтальмоскопии для оценки побочных эффектов инъекции.
4) На 7-й день после 2ой инъекции извлеченные правые и левые глаза всех 6 кроликов были осмотрены путем биомикроскопии с использованием щелевой лампы и непрямой офтальмоскопия для оценки наличия побочных эффектов от инъекций. Кроме того, было проведено ERG сканирование левых и правых глаз всех животных для определения наличия изменений относительно исходного состояния.
5) Три кролика под номерами 902, 903 и 907 выбрали случайным образом из оставшихся 6 животных и подвергли витрэктомии на правых и левых глазах для определения состояния задней поверхности стекловидного тела.
6) Три случайно выбранных животных под номерами 902, 903, и 907 затем были умерщвлены с помощью внутрисердечной инъекции натрия фенобарбитала, и были немедленно извлечены глаза. Все глаза прорезались острой бритвой в верхнем полюсе, прилегающем к гладкой части ресничного тела, непосредственно после извлечения для обеспечения быстрого проникновения фиксатором. Были приняты меры по избежанию повреждения прилегающих сетчатки и хрусталика. Глаза погружались в раствор 2% параформальдегида плюс 2,5% глутаральдегида в течение как минимум 24 часов при температуре 4 градуса Цельсия. Один задний сегмент был удален, обезвожен в метаноле и высушен в углекислом газе до критической точки, покрыт напылением из золота и сфотографирован с помощью сканирующего электронного микроскопа. Другие образцы были подвергнуты гистопатологической экспертизе.
Оставшейся группе из 3 кроликов под номерами 905, 906, и 908 была затем введена третья инъекция, через 14 дней после первой инъекции, а именно:
1) в правый глаз каждого из 3 оставшихся кроликов быол вновь введено интравитреально 100 2,5 мг/100 мкл раствора RGCys-овой кислоты (общая введенная доза 2,5 мг Соединения 1).
2) в левый глаз каждого из 3 оставшихся кроликов было вновь введено интравитреально 100 мкл физиологического раствора (контроль).
3) На следующий день после 3ей интравитреальной инъекции правые и левые глаза всех 6 оставшихся кроликов были осмотрены путем биомикроскопии с использованием щелевой лампы и непрямой офтальмоскопии для проверки наличия побочных эффектов от инъекции.
4) На 7-й день после 3ей инъекции правые и левые глаза всех 3 оставшихся кроликов были осмотрены путем биомикроскопии с использованием щелевой лампы и непрямой офтальмоскопии для проверки наличия побочных эффектов от инъекции. Кроме того, было проведено ERG сканирование левых и правых глаз всех животных для проверки наличия изменения по сравнению с исходным состоянием.
5) Проводилась механическая витрэктомии на правых и левых глазах 3 оставшихся животных (под номерами 905, 906 и 908) для определения состояния задней поверхности стекловидного тела.
6) Три оставшихся животных (под номерами 905, 906 и 908) были подвергнуты эвтаназии с помощью внутрисердечной инъекции натрия фенобарбитала, и были немедленно извлечены глаза. Все глаза прорезались острой бритвой в верхнем полюсе, прилегающем к гладкой части ресничного тела, непосредственно после извлечения для обеспечения быстрого проникновения фиксатором. Были приняты меры по избежанию повреждения прилегающих сетчатки и хрусталика. Глаза погружались в раствор 2% параформальдегида плюс 2,5% глутаральдегида в течение как минимум 24 часов при температуре 4 градуса Цельсия. Один задний сегмент был удален, обезвожен в метаноле и высушен в углекислом газе до критической точки, покрыт напылением из золота и отснят с помощью сканирующего электронного микроскопа. Другие образцы были подвергнуты гистопатологической экспертизе.
3) Активные реагенты
Активные химические реагенты, используемые в этом исследовании, были следующими:
а. Динатрия ЭДТА - 99,0 - 100,5% от Spectrum Chemical Corp.
б. Пептид RGCys-овой кислоты (Соединение 1)
в. USP стерильный изотонический физиологический раствор.
4) Исследуемые препараты
а) Раствор RGCys-овой кислоты: 2,5 мг/100 мкл раствора RGCys-овой кислоты, содержащий 0,02 мг динатрия ЭДТА + 0,80 мг хлорида натрия и USP стерильной воды для инъекций, доведенный до рН 6,5. Стерильный фильтр 0,22 μ в пробирке 2,0 мл.
б) Физиологический раствор (контроль): USP изотонический стерильный физиологический раствор, доведенный до рН 6,5. Профильтрованный через стерильный фильтр 0,22 μ фильтр в стерильную пробирку.
5) Анестезия для инъекций препарата.
а. Внутримышечные инъекции 2,0 мл 1:1 ксилазина (100 мг/мл) и кетамина гидрохлорид (100 мг/мл).
б. Зрачки расширяли с помощью местного применения циклопентотал гидрохлорида 1% и фенилэфрина гидрохлорида 10%.
6) Подготовка интравитреальных инъекций:
Стерильный флакон с раствором RGCys-овой кислоты, содержащим 2,5 мг/100пл и изотонический стерильный физиологический раствор, доведенный до рН 6,5. Перед введением исследователь удостоверяется в том, что в шприце на 1,0 см3 содержится 0,10 см3 (100 микролитров) раствора.
7) Процедура инъекций:
До тех пор пока интравитреальные инъекции не приведут к такому уровню расстройства зрения, при котором нарушается нормальная повседневная активность кроликов, влияние инъекции считается недействительным, согласно решению по животным руководства Ассоциации исследований в области зрения и офтальмологии.
Как раствор RGCys-овой кислоты, так и стерильные физиологические растворы вводили в полость стекловидного тела после завершения начального обследования кроликов путем биомикроскопии с использованием щелевой лампы, офтальмоскопии и ERG. Кролики (10 мг/кг массы тела) были анестезированы внутримышечной инъекцией 2,0 мл 1:1 раствора ксилазина (100 мг/мл) и кетамина гидрохлорида (100 мг/мл). Зрачки были расширены местным введением циклопентотала гидрохлорида 1% и фенилэфрина гидрохлорида 10%.
Все животные были изначально осмотрены путем биомикроскопии с использованием щелевой лампы и непрямой офтальмоскопии для того, чтобы исключить тех животные, у которых уже имеются витреоретинальные нарушения. Интравитреальные инъекции 0,10 см3 вводили на 2 мм позади края роговицы в верхнем носовом квадранте с использованием 30-мерной иглы и 1,0 см3 шприца. Были приняты меры по избежанию повреждения хрусталика или сетчатки.
Через семь дней после инъекции животным осуществляли механическую витрэктомию. Двухпортовую витрэктомию pars plana проводили с использованием инфузионного волоконно-оптического световода и ножа для стекловидного тела, соединенного с витреотомом. Через 30 секунд коровой витрэктомии нож для стекловидного тела направляется на перипапиллярную поверхность сетчатки, где с использованием низкочастотных аспирации (<30 ммГц) проводят разделение задней коровой поверхности стекловидного тела от поверхности сетчатки в 4 квадрантах. Животных усыпляли с помощью внутрисердечной инъекции натрия фенобарбитала, и немедленно извлекали глаза.
Все глаза прорезались острой бритвой в верхнем полюсе, прилегающем к гладкой части ресничного тела, непосредственно после извлечения для обеспечения быстрого проникновения фиксатором. Были приняты меры по избежанию повреждения прилегающих сетчатки и хрусталика. Глаза погружались в раствор 2% параформальдегида плюс 2,5% глутаральдегида в течение как минимум 24 часов при температуре 4 градуса Цельсия. Один задний сегмент был удален, обезвожен в метаноле и высушен в углекислом газе до критической точки, покрыт напылением из золота и отснят сканирующим электронным микроскопом.
Анализ результатов
Данные о безопасности препаратов между глазами, обработанными раствором RGCys-овой кислоты и стерильным физиологическим раствором, анализировали с помощью следующих методов:
i) биомикроскопии с использованием щелевой лампы;
ii) офтальмоскопии;
iii) ERG;
iv)гистопатологии и
v) электронной микроскопии.
Профиль безопасности:
Первое интравитреальное введение 100 мкл 2,5% раствора RGCys-овой кислоты группе из девяти кроликов под номерами 901, 902, 903, 904, 905, 906, 907, 908, 909 не вызвало никаких значительных проявлений токсичности на протяжении всего времени. Не было никаких существенных различий в побочных эффектах между группами, получавшими 2,5% раствор RGCys-овой кислоты и изотонический физиологический раствор. Отсутствие токсичности было определено при клиническом обследовании, непрямой офтальмоскопии и ультразвуковом β-сканировании, а также механической витрэктомии.
Биомикроскопия с использованием щелевой лампы была проведена так, как описано в литературе, на веках, конъюнктиве и склере, роговице, эндотелиальных изменениях, переднекамерной реакции, радужной оболочки, хрусталике и капсуле, а также передней поверхности стекловидного тела для обнаружения признаков воспаления, и показала почти полное отсутствие воспалительных реакции при интравитреальных инъекциях 100 мкл 2,5% раствора RGCys-овой кислоты и изотонического физиологического раствора. Для всех изученных значений и во всех исследуемых группах не наблюдалось никаких признаков существенной токсичности, индуцированной тестируемым образцом.
На протяжении всего исследования также проводилась клиническая оценка заднего сегмента для того, чтобы удостоверится в отсутствии существенных проявлений токсичности для сетчатки. Непрямая офтальмоскопия, а также микроскопия щелевой лампой для оценки дна были проведены в каждый момент времени исследования, уделяя особое внимание проявлению любых признаков токсичности для сетчатки. Задний сегмент оценивался на любые изменения в плотности стекловидного тела, на разжижение стекловидного тела, прикрепления стекловидного тела и возможность кровотечения. Сетчатку оценивали на предмет токсичности для ретинального пигментного эпителия, сосудов сетчатки с возможностью кровоизлияния в сетчатку глаза, экссудаты, разрывов или отслоения сетчатки. Изменения в ретинальном пигментном эпителии относительно исходного состояния не наблюдались, для всех исследуемых значений и во всех исследуемых группах не было зафиксировано никаких признаков значительных изменений задних сегментов, индуцированных тестируемым образцом. Важно отметить, что ERG сканирование, которое было проведено на девяти животных до интравитреальных инъекций, а также ERG сканирование, которое было проведено на всех животных на 1 день и 7 день после инъекции, не показало никаких признаков существенных изменений или токсичности, индуцированных тестируемым образцом.
Второе интравитреальное введение 100 мкл 2,5% раствора RGCys-овой кислоты группе из шести кроликов под номерами 902, 903, 905, 906, 907, 908 не повлияло на появление токсичности за все время исследования. Не выявлено никаких существенных различий в побочных эффектах между группами, получавшими 2,5% раствор RGCys-овой кислоты и изотонический физиологический раствор. Отсутствие токсичности определялось при клиническом обследовании, непрямой офтальмоскопии и ультразвуковом β-сканирование, а также механической витрэктомии.
Биомикроскопия с использованием щелевой лампы была проведена так, как описано в литературе, и была сфокусирована на веках, конъюнктиве и склере, роговице, эндотелиальных изменениях, переднекамерной реакции, радужной оболочке, хрусталике и капсуле, а также передней поверхности стекловидного тела для обнаружения признаков воспаления, и показала почти полное отсутствие воспалительных реакции при интравитреальных инъекциях 100 мкл 2,5% раствора RGCys-овой кислоты и изотонического физиологического раствора. Для всех изученных значений и во всех исследуемых группах не наблюдалось никаких признаков существенной токсичности, индуцированной тестируемым образцом.
На протяжении всего исследования также проводилась клиническая оценка заднего сегмента для того, чтобы удостоверится, что нет никаких существенных проявлений токсичности для сетчатки. Непрямая офтальмоскопия, а также микроскопия щелевой лампой для оценки дна были проведены в каждый момент времени исследования, уделяя особое внимание проявлению любых признаков токсичности для сетчатки. Задний сегмент оценивался на изменения в плотности стекловидного тела, разжижение стекловидного тела, соединение стекловидного тела и возможность кровотечения. Сетчатку оценивали на предмет токсичности для ретинального пигментного эпителия, сосудов сетчатки с возможностью кровоизлияния в сетчатку глаза, экссудаты, разрывов или отслоения сетчатки. Изменения в ретинальном пигментном эпителии относительно исходного состояния за 7 дней до повторного лечения не наблюдались, для всех исследуемых значений и во всех исследуемых группах не было зафиксировано никаких признаков значительных изменений задних сегментов, индуцированных тестируемым образцом. Важно отметить, что ERG сканирование, которое было проведено на шести животных во второй раз после интравитреальных инъекций, а также ERG сканирование, которое было проведено на всех животных на 8 день и 14 день после инъекции, не показало никаких признаков существенных изменений или токсичности, индуцированных тестируемым образцом.
Третье интравитреальное введение 100 мкл 2,5% раствора RGCys-овой кислоты группе из трех кроликов под номерами 905, 906, 908 не повлияло на появление токсичности за все время исследования. Не выявлено никаких существенных различий в побочных эффектах между группами, получавшими 2,5% раствор RGCys-овой кислоты и изотонический физиологический раствор. Отсутствие токсичности определялось при клиническом обследовании, непрямой офтальмоскопии и ультразвуковом β-сканирование, а также механической витрэктомии.
Биомикроскопия с использованием щелевой лампы была проведена так, как описано в литературе, и была сфокусирована на веках, конъюнктиве и склере, роговице, эндотелиальных изменениях, переднекамерной реакции, радужной оболочки, хрусталике и капсуле, а также передней поверхности стекловидного тела для обнаружения признаков воспаления, и показала почти полное отсутствие воспалительных реакции при интравитреальных инъекциях 100 мкл 2,5% раствора RGCys-овой кислоты и изотонического физиологического раствора. Для всех изученных значений и во всех исследуемых группах не наблюдалось никаких признаков существенной токсичности, индуцированной тестируемым образцом.
На протяжении всего исследования также проводилась клиническая оценка заднего сегмента для того, чтобы удостоверится в отсутствии существенных проявлений токсичности для сетчатки. Непрямая офтальмоскопия, а также микроскопия щелевой лампой для оценки дна проводились в каждый момент времени исследования, уделяя особое внимание проявлению любых признаков токсичности для сетчатки. Задний сегмент оценивался на любые изменения в плотности стекловидного тела, разжижение стекловидного тела, соединение стекловидного тела и возможность кровотечения. Сетчатку оценивали на предмет токсичности для ретинального пигментного эпителия, сосудов сетчатки с возможностью кровоизлияния в сетчатку глаза, экссудаты, разрывов или отслоения сетчатки. Изменения в ретинальном пигментном эпителии относительно исходного состояния за 14 дней до третьего лечения не наблюдались, для всех исследуемых значений и во всех исследуемых группах не было зафиксировано никаких признаков значительных изменений задних сегментов, индуцированных тестируемым образцом. Важно отметить, что ERG сканирование, которое было проведено на шести животных в третий раз после интравитреальных инъекций, а также ERG сканирование, которое было проведено на всех животных на 15 день и 21 день после инъекции, не показало никаких признаков существенных изменений или токсичности, индуцированные тестируемым образцом.
Противо-адгезионные свойства пептидов RGCys-овой кислоты: кинетические исследования заживления ран с помощью Соединения 1 (GRG цистеиновой кислоты ТП), циклического RGD и RGE
В этом примере в модели заживления ран было продемонстрировано, что пептиды RGCys-овой кислоты обладают противовоспалительными адгезионными свойствами и, следовательно, могут предотвратить развитие многих патологических витреоретинальных заболеваний и подавлять метастазы меланомы и раковых клеток толстой кишки у человека.
Для тестирования анти-адгезионных свойств пептидов RGCys-овой кислоты in vitro был проведен ранозаживляющим анализ с использованием эндотелиальных клеток пупочной вены человека (HUVEC). HUVEC были посеяны и выращены до образования плотного монослоя на поверхности, покрытой фибронектином. Раны (царапины) были сделаны путем протаскивания кончика пипетки по монослою HUVEC. Затем клетки инкубировали в свежей питательной среде, содержащей пептид RGCys-овой кислоты (Соединение 1, 10 мМ), а области ран сфотографированы в пяти различных областях в различные моменты времени (0, 4, 8, 12, 16, 20, 24 часов) для определения кинетики закрытия раны. Уровень закрытия раны был количественно определен по отношению к первоначальной площади раны, которые вновь занимались HUVEC путем клеточной адгезии, миграции и пролиферации.
В контрольных исследованиях вместо RGCys-овой кислоты (Соединение 1) были использованы следующие пептиды: циклический RGD-пептид (1 мМ, положительный контроль) и RGE пептид (1 мМ, отрицательный контроль).
Влияние пептидов на кинетику заживления ран представлено на рисунке 1. Результаты приведены в процентах от первоначальной площади. Уровни погрешностей соответствуют стандартному отклонению размера раны в 2 - 6 независимых испытаниях. Результаты показывают, что пептид RG Cys-овой кислоты ингибирует заживление ран HUVEC на 70% после 24 часов, в то время как циклический RGD (пептид на основе RGD, N-метилированный циклический RGDf-N(Me)V; Циленгитид) ингибирует заживление ран HUVEC на 45% после 24 часов. Они оба сравнивались с отрицательным контролем пептида RGE, который препятствует заживлению ран HUVEC 0% через 24 часа. Эффект RGCys-овой кислоты (Соединение 1) количественно сопоставим с активностью пептидов на основе RGD, общепризнанного ингибитора интегрин-связывающей активности. Кроме того, пептид RGCys-овой кислоты проявляет сходные свойства с активностью пептида на основе RGD, не вызывая апоптоз клеток HUVEC. Оба циклический RGC и Соединение 1 в данном анализе являются потенциальными интегриновыми ингибиторами.
Клеточное взаимодействие с ВКМ через фокальную адгезию является важнейшим элементом миграции клеток, определяющим скорость закрытия раны. В двумерной клеточной миграции передний край клетки с растущей ламеллиподией формирует новые спайки с субстратом, в то время как спайки на заднем конце отделяются после сжатия цитоскелета.
Как описано в данной работе, сильной адгезией между стекловидным телом и сетчаткой можно объяснить возможное развитие многих патологических витреоретинальный заболеваний, таких как витреомакулярный тракционный синдром, пролиферативная диабетическая ретинопатия, макулярный разрыв, возрастная макулярная дегенерация и плавающие тельца. Таким образом, весьма желателен атравматической неинвазивный подход по достижению задней поверхности стекловидного тела, помимо механического отделения стекловидного тела от внутренней поверхности сетчатки (см. Tezel, Т.Н. и др., Retina (1998) 18:7-15; и Verstraeten, Т.С.и др., Arch. Ophthalmol. (1993) 111: 849-854).
Как описано в настоящем документе, считается, что компоненты ВКМ, в частности, коллагеновые фибриллы кортикального слоя стекловидного тела, прикрепляются ко внутренней поверхности сетчатки за счет интегриновых сайтов связывания (см. Foos, R.Y., Invest. Ophthalmol. Vis. Sci. (1972) 11: 801 -808) во внутренней пограничной ламелле (ВПЛ). Известно также, что основные адгезивные гликопротеины ВПЛ в глазах, такие как фибронектин и ламилин, крепко связаны с интегринами (см. Cutis, Т.М. и др., Am. J. Physiol. (1995) 269: L248-L260; Elner, S.C. и др., IOVS (1996) 37:696-701; и Horman, S.M. и др., Am. J. Physiol. (1995) 269. L248-L260) через последовательности RGD (Arg-Gly-Asp), а некоторые интегрины связывают RGD мотив, присутствующий в белках ВКМ. Кроме того, известно, что фибронектин связывается с некоторыми другими интегринами помимо ανβ3, в то время как витронектин является ανβ3-специфичным.
Основное соединение интегринов с ВКМ включает последовательность Arg-Gly-Asp (RGD), где последовательность RGD связывается в небольшой полости, расположенной между α- и β-субъединицами на вершине интегрина (см. Xiong и др., Science (2002) 296: 151-155). Такая связь позволяет модулировать различные сигнальные пути клетки, в том числе клеточную адгезию, миграцию, дифференциацию, ангиогенез и заживление ран (см. Ruoslahti Е., и др., Science (1987) 238.. 491-497; и J. Clin. Invest. (1991) 87: 1-5).
Поскольку внеклеточный матрикс стекловидного тела, в частности фибриллы коллагена, соединены через интегриновые сайты связывания с клеточной сетчаткой, интравитреальные инъекции пептидов RGCys-овой кислоты (олигопептидов) могут работать как RGD мотив внеклеточного матрикса стекловидного тела и клеточной сетчатки путем конкурентного связывания с теми же интегриновыми рецепторными сайтами.
Некоторые исследователи (см. Ruoslahti, Е. и др., Science (987) 238: 491 - 497; Hynes, R.A., и др., Cell (1992) 68: 303 -322, и Humphries, M.J., J. Cell Sci. (1990) 97: 585 -592) показали, что многие интегрины (ανβ3, α5β1, α11β3 и др.) могут ингибироваться небольшими пептидами, которые обладают последовательностями RGD мотива. Также хорошо описано, что ανβ3 и α5β1 интегрины, также как и витронектин и фибронектин, проявляют чрезмерную активность в опухолях, таких как клетки меланомы человека (см. Nip, J., J. Clin. Invest., (1992) 90: 1406-1413), клетки рака молочной железы человека (см. Rong, L. и др., Invest. Ophthalmol. Vis. Sci. (2009) 50: 5988 -5996), а пигментированные эпителиальные клетки сетчатки человека (Peter С. Brooks и др., J. Clin. Invest., (1995) 96: 1815 - 1822). Таким образом, было продемонстрировано, что существует хорошая корреляция между метастатическими потенциалами клеток меланомы человека и адгезией клеток меланомы к витронектину лимфатических узлов через ανβ3 интегриновый рецептор, a также показано, что адгезия ингибируется RGD-содержащими пептидами (Nip, J., J. Clin. Invest., (1992) 90: 1406-1413). Это показывает, что RGD пептиды могут быть важными анти-ангиогенными агентами.
Кроме того, на линии раковых клеток толстой кишки человека было продемонстрировано, что в случае увеличения клеточной адгезии, возрастает метастатическая активность (Lehmann, М., Cancer Res. (1994), 54. 2102-2107). Поэтому агенты, препятствующие адгезии клеток, эффективно подавляют рак толстой кишки и меланомы с метастазами.
На основании результатов исследования заживления ран, где было показано, что RGCys-овая кислота ингибирует адгезию клеток, и экстраполяции метастатического потенциала RGC в моделях меланомы и рака толстой кишки, можно сделать вывод, что пептиды RGCys-овой кислоты и их производные могут эффективно подавлять опухолевые метастазы, например, меланомы и рака толстой кишки.
Использование пептидов RGCys-овой кислоты для направленности или доставки агентов к опухоли
В этом примере рассмотрен димерный пептид RGCys-овой кислоты - Паклитаксел конъюгат (Соединение 3), показанный ниже. Эта композиция является пригодной в качестве противоопухолевого агента. Димерный пептид RGCys-овой кислоты селективно связывается с интегриновыми рецепторами, экспрессия которых повышена в некоторых раковых клетках, и является полезным для лечения некоторых метастазирующих типов рака, таких как, например, метастазирующий рак молочной железы, путем ингибирования клеточной адгезии.
Соединение 3:

Синтез и механизмы действия, биораспределения и опухолевой селективности соответствующих RGD аналогов Соединения 3 описаны Chen, X. и др.;. Synthesis and Biological Evaluation of Dimeric RGD Peptede-Paclitaxel Conjugate as a Model for Integrin-Targeted Drug Delivery; J. Med. Chem., (2005) 48 (4): 1098-1106).
Хотя Соединение 3 содержит определенный противоопухолевый агент, Паклитаксел, связанный с димерным пептидом RGCys-овой кислоты, должно быть понятно, что это воплощение настоящего изобретения включает в себя все мономерные или многомерные формы пептидов RGCys-овой кислоты, связанных с любым возможным диагностическим или терапевтическим агентом, который может быть использован для диагностики, визуализации или лечения опухоли или других интегрин-содержащих тканей или структур. Примеры противоопухолевых веществ, которые могут быть конъюгированы с мономерными или мультимерными пептидами RGCys-овой кислоты в соответствии с настоящим изобретением могут включать противоопухолевые агенты (например, химиотерапевтические препараты, модификаторы биологической реакции, ингибиторы васкуляризации, блокаторы рецепторов гормонов, криотерапевтические агенты или другие вещества, которые разрушают или подавляют неоплазию или опухоль), такие как алкилирующие агенты или другие вещества, которые напрямую уничтожают раковые клетки через разрушение их ДНК (например, циклофосфамид, изофосфамид), нитрозомочевина или другие вещества, которые уничтожают раковые клетки путем ингибирования изменений, необходимых для репарации ДНК в клетках (например, кармустин (BCNU) и ломустин (CCNU)), антиметаболиты и другие вещества, которые блокируют рост раковых клеток, влияя на определенные функции клетки, как правило, синтез ДНК (например, 6-меркаптопурин и 5-фторурацил (5FU), противоопухолевые антибиотики и другие соединения, которые действуют путем связывания или интеркаляции в ДНК и предупреждения синтеза РНК (например, доксорубицин, даунорубицин, эпирубицин, идарубицин, митомицин-С и блеомицин), растительные (например, Vinca) алкалоидов и другие противоопухолевые препараты, полученные из растений (например, винкристин и винбластин), стероидные гормоны, ингибиторы гормонов, антагонисты рецепторов гормонов и другие вещества, которые влияют на рост гормон-зависимых типов рака (например, тамоксифен, герцептин, ингибиторы ароматазы, такие как аминоглутетамид и форместан, триазол ингибиторы, такие как летрозол и анастразол, стероидные ингибиторы, такие как экземестан), анти-ангиогенестические белки, малые молекулы, агенты генной терапии и/или другие вещества, которые подавляют ангиогенез и васкуляризацию опухолей (например, мет-1, мет-2, талидомид), бевацизумаб (Авастин), скваламин, эндостатин, ангиостатин, Ангиозим, АЕ-941 (Неовастат), СС-5013 (Ревимид), Medi-522 (Витаксин), 2-метоксиэстрадиол (2МЕ2, Панзем), карбоксиамидотриазол (CAI), пролекарство комбретастатина А4 (СА4Р), SU6668, SU1 1248, BMS-275291, COL-3, EMD 121974, IMC-1C11, IM862, TNP-470, целекоксиб (Целебрекс), рофекоксиб (Vioxx), интерферон альфа, интерлейкин-12 (IL-12) или соединения, указанных в Science Vol.289, стр. 1197-1201 (17 августа 2000), который включен в настоящее описание посредством ссылки, модификаторы биологических реакций (например, интерферон, бацилла Кальметта-Герена (БЦЖ), моноклональные антитела, интерлюкин 2, гранулоциты колониестимулирующий фактор (GCSF) и т.д., PGDF рецепторы, герцептин, аспарагиназа, бусулфан, карбоплатин, цисплатин, кармустин, хлорамбуцил, цитарабин, дакарбазина, этопозид, флукарбазон, флуорорацил, гемцитабин, гидроксимочевина, ифосфамид, иринотекан, ломустин, мелфалан, меркаптопурин, метотрексат, тиогуанин, тиотепа, томудекс, топотекан, треосульфан, винбластин, винкристин, митоазитрон, оксалиплатин, прокарбазин, стрептоцин, таксол, таксотер, аналоги, представители одного и того же класса и производные этих соединений, а также других противоопухолевые агенты, не перечисленные здесь.
64CU-меченные мультимерные пептиды RGCys-овой кислоты для визуализации интегрин-экспрессирующих опухолей
В этом примере показано, что64CU-меченные тетрамерные и октамерные пептиды RGCys-овой кислоты по настоящему изобретению (Соединений 4 и 5, соответственно) могут использоваться в качестве радиотерапевтических агентов для визуализации и диагностики (например, радиомечения опухоли для PET сканирования), а также для направленности или доставки терапевтических агентов в опухоли или других клетки, которые экспрессируют интегрины, такие как опухоли, экспрессирующие ανβ3 интегрины.
Соединение 4:
Соединение 5:

Синтез и механизмы действия, биораспределения, селективности для опухоли и РЕТ-связанное использование соответствующих RGD аналогов Соединений 4 и 5 было описано Li, Z. и соавт.,64CU-Labeled Tetrameric and Octameric RGD Peptides for small animal PET of Tumor ανβ3 Integral Expression; J. Nucl. Med. 48 (7), стр. 1162-1171 (2007).
Супрессия хориоидальной неоваскуляризации (CNV) in vivo Соединением 1
В этом примере Соединение 1 тестировалось в опубликованной мышиной модели CNV. См. Umeda N, Kachi S, Akiyama H, Zahn G, Vossmeyer D, Stragies R, Campochiaro P., "Suppression and Regression of Choroidal Neovascularization by Systemic Administration of an α5β1 Integrin Antagonist", Molecular Pharmacology: 2006, 69, 1820-1828.
Мышам в этом исследовании делали лазерный разрыв мембраны Бруха с последующей инъекцией одной дозы СОЕДИНЕНИЯ 1 в концентрации 1,0 мкг/1 мкл, 25 мкг/1 мкл и 50 мкг/1 мкл, а также носитель сразу же после лазерной обработки. Через четырнадцать дней после обработки лазером площадь CNV измеряли путем анализа изображений. Размер CNV поражений оказался несколько меньше в глазах, обработанных СОЕДИНЕНИЕМ 1 в концентрации 1,0 мкг/1 мкл и 50 мкг/1 мкл. Фигура 8 представляет график, показывающий общую площадь неоваскуляризации в мышиной модели CNV через 14 дней после обработки различными дозами Соединения 1 и контролем (только носитель).
Концентрация 25 мкг/1 мкл Соединения 1 показала статистически значимое 43%-ное уменьшение CNV по сравнению с глазами, обработанными носителем. Это говорит о том, что единичная инъекция 25 мкг/1 мкл Соединения 1 достаточна для существенного ингибирования CNV.
In-vivo исследование - Rop модель диабетической ретинопатии
В этом примере Соединение 1 было протестировано в мышиной модели ишемической ретинопатии для того, чтобы исследовать возможность подавления пред-ретинальной неоваскуляризации.
Мышам, имевшим ишемическую ретинопатию, вводили интравитреально одну дозу Соединения 1 с концентрацией 0,125 мкг/1 мкл, 12,5 мкг/1 мкл, 25,0 мкг/1 мкл и 50,0 мкг/1 мкл (группы В, D, F и Н, соответственно), а также носитель (BSS) (Контроли 1, 2, 3 и 4) на 12 день после рождения. На 17 день после рождения, через 5 дней после интравитреальной инъекции, площадь неоваскуляризации измерялась путем анализа изображений. Фигура 9 представляет столбчатую диаграмму, сравнивающую измеренную площадь неоваскуляризации у мышей, получавших указанные разные дозы Соединения 1 или контроля (только носитель). Как показано на Фиг. 9, размер поражений неоваскуляризации оказался несколько меньше в глазах, обработанных (В) 0,125 мкг/1 мкл. Однако группы D (12,5 мкг/1 мкл), F (25,0 мкг/1 мкл) и Н (50,0 мкг/1 мкл) все показали значительное уменьшение и, как было обнаружено, все три концентрации показали статистически значимые результаты по сравнению с Контролем 2, 3 и 4.
Результаты данного исследования показывают, что единичной инъекции Соединения 1 12,5 мкг/1 мкл, 25,0 мкг/1 мкл и 50,0 мкг/1 мкл достаточно для существенного ингибирования пред-ретинальной неоваскуляризации.
Токсикология Соединения 1 на животных
Следующие Таблицы А-Е резюмируют данные токсичности на животных, полученные из следующих исследований:

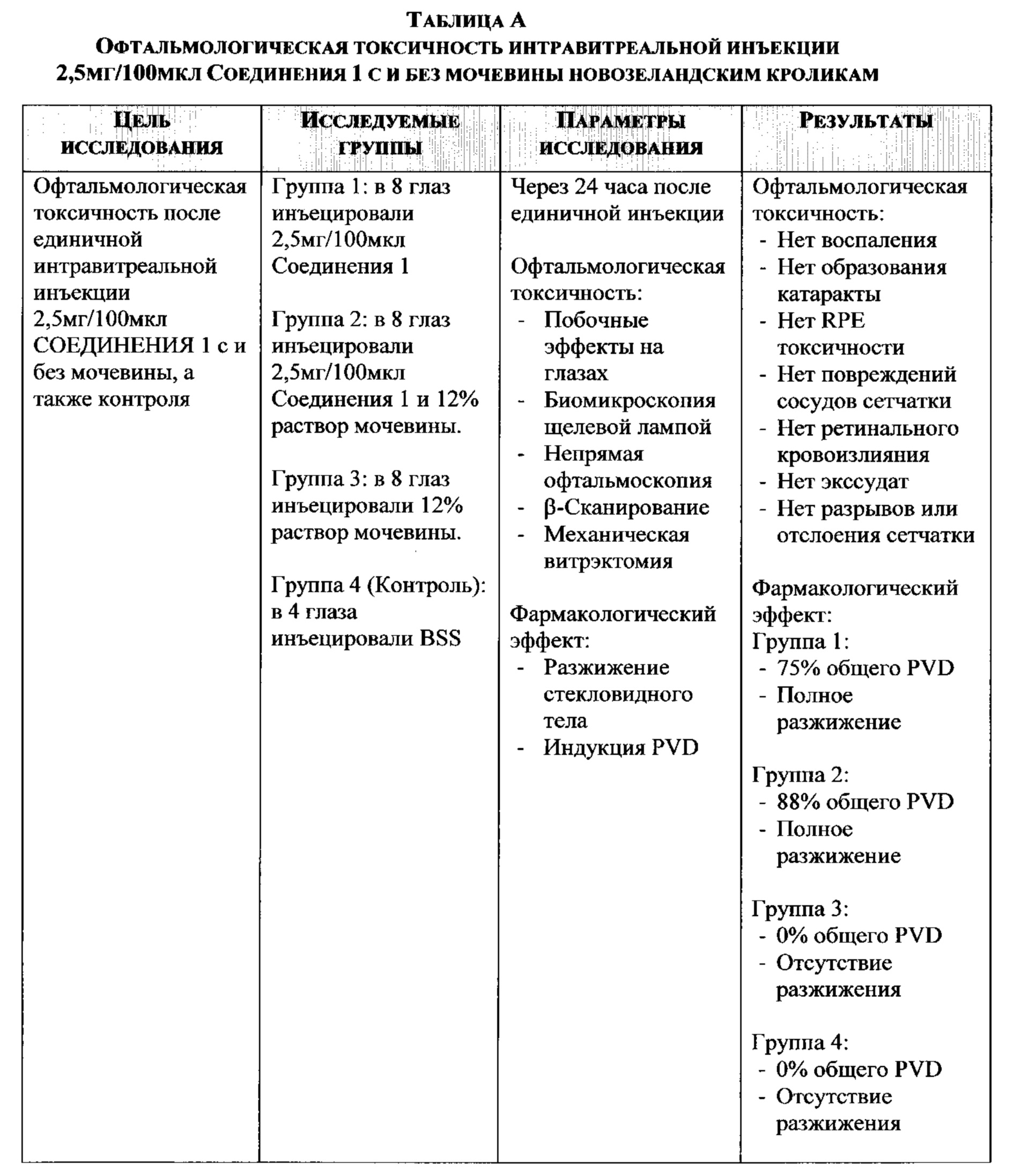




Исследование множественной дозы на человеке
Пятнадцать пациентов - людей с поздней стадии DME получали ежемесячно три интравитреальных инъекции Соединения 1 в составе множественной инъекции Фазы 1 Исследования безопасности для человека. Не было никаких Серьезных нежелательных явлений и Значительных нежелательных явлений. Хотя это исследование было в первую очередь исследованием безопасности, также оценивали эффективность. У восьми пациентов улучшилось три или более линий в BCVA (представляют 53% пациентов) и у четырех пациентов зрение улучшилось от почти официально признанной слепоты до функционального зрения в диапазоне от 20/40 до 20/60. Кроме того, значительное улучшение анатомии желтого пятна на ОСТ наблюдалось у восьми пациентов в пределах от 30% до 80%. Эти улучшения в BCVA и ОСТ центральной толщины желтого пятна сохранялись в течение 90 дней наблюдения после лечения. Эти результаты были достигнуты, несмотря на то, что эти пациенты страдали DME на поздней стадии и многие из них были признаны неподдающимися современным методам лечения как Авастином, так и лазерной коагуляции. Следующая Таблица F резюмирует эти исследования пациентов, ранее подвергавшихся лечению Авастином или фотокоагуляционной лазерной терапии:

Дополнительные характеристики и результаты этого исследования показаны в представленной Таблице F, в чертежах и диаграммах на Рисунках 10A-10I и описаны в нижеприведенных параграфах.
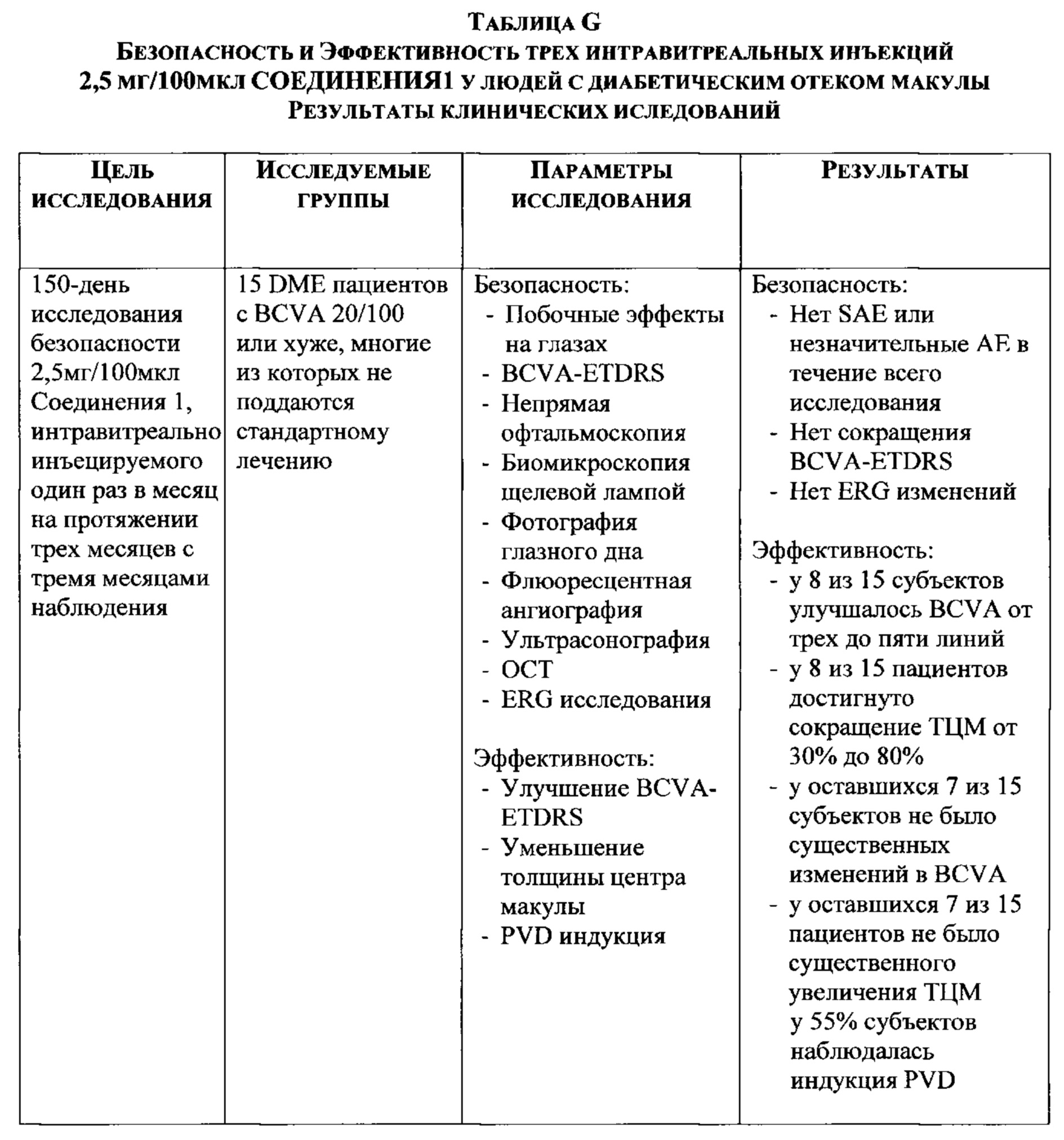
Целью фазы 1 исследования было оценить безопасность и эффективность начальной офтальмологической интравитреальной инъекции Соединения 1 человеку в качестве субъекта с терминальной стадией диабетического макулярного отека (DME). Первичной конечной точкой исследования было наблюдение токсичности, ограничивающей дозу. Вторичной конечной точкой данного исследования было наблюдение клинического эффекта снижения диабетического макулярного отека в BCVA (ETDRS линии) и ОСТ толщины центра макулы.
В этом открытом исследовании набрали пятнадцать человек с терминальной стадией хронической DME. Субъекты при включении в исследование имели BCVA 20/100 или хуже, в первую очередь, по причине DME и не проходили анти-VEGF лечение или фокально-лазерное лечение в течение 90 дней до их включения в это исследование. Многие субъекты исследования были невосприимчивы к предшествующему лечению Авастином. Субъекты исследования получали ежемесячно три интравитреальных инъекции 2,5 мг СОЕДИНЕНИЯ 1 и наблюдались ежемесячно в течение еще 3 месяцев. Анализ безопасность сопровождался оценкой BCVA, оценкой с использованием щелевой лампы, анализом глазного дна при осмотре с расширенным зрачком, измерением IOP, OCT, FA, фотографией глазного дна, ультразвуковым В-сканированием и ERG.
В общей сложности в данное исследование были включены 15 субъектов. В целом, все испытуемые переносили исследуемый препарат СОЕДИНЕНИЕ 1 очень хорошо. При этом не было зафиксировано воспалительных реакций ни в передней камере, ни в стекловидном теле. Не было отмечено устойчивых повышений в IOP. В ходе этого исследования не было отмечено декомпенсации роговицы или прогрессирования катаракты. В ходе этого исследования не было отмечено разрывов сетчатки или отслоения сетчатки, однако при ультразвуковом В-сканировании наблюдали высокую частоту (55%) задней отслойки стекловидного тела, как показано в предыдущих исследованиях на кроликах. Кроме того, на протяжении этих исследований не наблюдалось окклюзии сосудов. Ни у одного из 15 субъектов не было никаких серьезных нежелательных явлений или значительных нежелательных явлений.
У 53% (8 из 15) субъектов отмечено увеличение BCVA на 3 или более линий на 90 день исследования после введения 3 интравитреальных инъекций. Ни в одном из исследований ни один субъект не показал потерю BCVA по сравнению с исходным уровнем. Интересно, что в той же пропорции субъектов (53% или 8 из 15) было отмечено значительное снижение ОСТ толщины центра макулы по меньшей мере на 30%. Максимальное снижение отека макулы составило 505 мкм (с 608 до 103), почти 80%-ное снижение отека макулы. Улучшение в BCVA обычно сопровождается улучшением в снижении отека макулы ОСТ. Один исследуемый субъект показал прогрессирование диабетического макулярного отека по сравнению с исходным уровнем, первоначально во время курса лечения состояние улучшилось, но позже болезнь прогрессировала по сравнению с исходной толщиной макулы ОСТ в 150 день исследования, через 3 месяца после интравитреальной терапии. BCVA этого субъекта исследования исходно улучшились на 5 линий, но позже на 150 день исследования регрессировали к исходному уровню.
В этом исследовании, как показано графически на Фиг. 10A-10J, с помощью BCVA, ОСТ толщины центра макулы, отсутствия воспалительной реакции или патологии сетчатки при клиническом обследовании, FA, В-сканирования или ERG было показано устойчивость в отсутствии токсичности. В целом, СОЕДИНЕНИЕ 1 переносилось очень хорошо.
Интересно, что несмотря на терминальную стадию состояния субъектов исследования и небольшой размер исследования, представлен четкий клинический показатель эффективности с улучшениями в BCVA, сопровождающимися анатомическими улучшениями в ОСТ толщины центра макулы. Кроме того, клинические улучшения проявлялись по меньшей мере в течение 90 дней после последнего интравитреального введения Соединения 1 почти у всех исследуемых субъектов, которые показали улучшение. Авторы полагают, что для дальнейшей оценки и подтверждения безопасности и эффективности этого нового класса анти-ангиогенных лекарственных препаратов и лучшего понимания особенностей его нового механизма действия требуется более масштабное исследование.
Эффекты Рабинизумаба и Соединения 1 по отдельности и в комбинации у трансгенных мышей, экспрессирующих VEGF человека
Трансгенных мышей, у которых человеческий VEGF находится под контролем промотора родопсина в фоторецепторах (rho/VEGF мыши), случайным образом распределяли в отдельные группы лечения и проводили исследования с предоставлением следующих сопоставлений:

Для каждого животного были сделаны измерения площади субретинальная неоваскуляризации перед введением с использованием анализа изображения скрытым наблюдателем. Каждое животное получало назначенное лечение в одной внутриглазной инъекции. Через семь дней после введения дозы были снова сделаны измерения площади субретинальная неоваскуляризации, которые сравнивались со значениями до введения дозы с целью определения изменений площади субретинальной неоваскуляризации. Кроме того, животных умерщвляли и сетчатку отслаивали, иммуноокрашивали GSA лектином и исследовали с помощью флуоресцентной микроскопии.
Фиг. 11А представляет столбчатую диаграмму для сравнения среднего изменения площади субретинальной неоваскуляризации у животных, получавших 25 мкг Соединения 1 (5 животных) по сравнению с животными, получавшими комбинацию 10 мк ранибизумаба + 25 мкг Соединения 1 (5 животных). У животных, получавших комбинацию 10 мк ранибизумаба + 25 мкг Соединения 1, показано на 35,34% большее снижение площади субретинальной неоваскуляризации, чем у животные, получавших только 25 мкг Соединения 1. Эти данные свидетельствуют о том, что в испытанных дозах комбинация ранибизумаба и Соединения 1 была более эффективной в снижении субретинальная неоваскуляризации, чем только Соединение 1.
Фиг. 11В представляет столбчатую диаграмму для сравнения среднего изменения площади субретинальной неоваскуляризации у животных, получавших 10 мкг ранибизумаба (5 животных) по сравнению с животными, получавшими комбинацию 10 мк ранибизумаба + 25 мкг Соединения 1 (5 животных). У животных, получавших комбинацию 10 мк ранибизумаба + 25 мкг Соединения 1, показано на 34,70% большее снижение площади субретинальной неоваскуляризации, чем у животные, получавших только 10 мкг ранибизумаба. Эти данные свидетельствуют о том, что в испытанных дозах комбинация ранибизумаба и Соединения 1 была более эффективной в снижении субретинальная неоваскуляризации, чем только Соединение 1.
Фиг. 11С представляет столбчатую диаграмму для сравнения среднего изменения площади субретинальной неоваскуляризации у животных, получавших 25 мкг Соединения 1 (3 животных) по сравнению с животными, получавшими фосфатный буферный раствор (носитель/контроль) (3 животных). У животных, получавших 25 мкг Соединения 1, показано на 37,06% большее снижение площади субретиналыюй неоваскуляризации, чем у контрольных животных. Эти данные свидетельствуют о том, что в испытанных дозах Соединение 1 было более эффективным, чем контроль, в снижении субретинальной неоваскуляризации.
Фиг. 11D представляет столбчатую диаграмму для сравнения среднего изменения площади субретинальной неоваскуляризации у животных, получавших 10 мкг ранибизумаба (3 животных) по сравнению с животными, получавшими фосфатный буферный раствор (носитель/контроль) (3 животных). У животных, получавших 10 мкг ранибизумаба, показано на 38,96% большее снижение субретинальной площади неоваскуляризации, чем у контрольных животных. Эти данные свидетельствуют о том, что в испытанных дозах ранибизумаб был более эффективным, чем контроль, в снижении субретинальной неоваскуляризации.
Таким образом, при дозировках, испытанных в этих сравнительных исследованиях, ранибизумаб и Соединение 1 каждый вызывал статистически значимое снижение площади субретинальной неоваскуляризации при введении по отдельности. Однако комбинация ранибизумаба и Соединения 1 вызвала значительно большее снижение площади субретинальной неоваскуляризации, чем ранибизумаб или Соединение 1 в отдельности. На основании этих данных комбинированная терапия с использованием Соединения 1 (или другого интегрин-ингибирующего соединения по настоящему изобретению) в комбинации с Ловушкой VEGF (например, ранибизумабом) имеет потенциальную клиническую пользу для пациентов, страдающих неоваскулярными заболеваниями глаз.
Как используется здесь, любая ссылка на лечение заболевания или расстройства не должна толковаться как включающая предупреждение или профилактику заболевания или расстройства до того, как оно появилось или было обнаружено, а также лечение заболевания или расстройства после того, как оно появилось или было обнаружено.
Реферат
Изобретение относится к области фармацевтики и медицины, а именно к офтальмологии, и предназначено для лечения отека макулы. Фармацевтическая композиция для лечения отека макулы содержит интегрин-ингибирующий пептид, который состоит из Глицинил-Аргинил-Глицинил-Цистеиновая кислота-Треонил-Пролин-СООН или его фармацевтически приемлемой соли. В одном воплощении, указанный пептид представляет собой линейный пептид и имеет структурную формулу:Использование изобретения обеспечивает лечение отека макулы путем ингибирования ангиогенеза. 10 з.п. ф-лы, 8 табл., 11 ил.
Формула


Комментарии