Состав fgf-18 в альгинатных/коллагеновых гидрогелях - RU2698210C2
Код документа: RU2698210C2
Чертежи














Описание
Область изобретения
Изобретение относится к области фармацевтических составов. Более конкретно изобретение относится к белковым составам фактора роста фибробластов 18 (FGF-18) в альгинатных/коллагеновых гидрогелях и к способам получения таких гидрогелей/составов.
Предшествующий изобретению уровень техники
Фактор роста фибробластов 18 (FGF-18) является представителем семейства белков факторов роста фибробластов (FGF), родственным с FGF-8 и FGF-17. Представители семейства FGF характеризуются гепарин-связывающими доменами. Такой предполагаемый гепарин-связывающий домен был идентифицирован для FGF-18. Предполагают, что передача сигнала, опосредованная рецептором, инициируется после связывания лиганда FGF в комплексе с поверхностно-клеточными гепаринсульфатпротеогликанами.
Показано, что FGF-18 является фактором пролиферации для хондроцитов и остеобластов (Ellsworth et al., 2002; Shimoaka et al., 2002). FGF-18 был предложен для лечения нарушений хрящевой ткани, таких как остеоартрит (ОА) и повреждения хрящевой ткани (ПХТ), или отдельно (WO2008/023063) или в комбинации с гиалуроновой кислотой (WO2004/032849).
Из уровня техники известны фармацевтические композиции, содержащие полипептид FGF. WO2012172072 описывает лиофилизированный состав, содержащий FGF-18, где указанная композиция содержит FGF-18, буфер, сурфактант полоксамер и сахар в качестве стабилизатора. Указанный лиофилизированный состав с FGF-18 показывает многообещающие результаты в лечении ОА или ПХТ. Распространенный режим дозирования с использованием указанного лиофилизированного состава представляет собой цикл лечения по одной инъекции раз в неделю в течение трех недель. Цикл лечения можно повторять.
В случае ПХТ, основной недостаток настоящего состава заключается в том, что, после однократного введения внутрь сустава (в.с.), присутствие FGF-18 в синовиальной жидкости может вызывать неконтролируемый рост хрящевой ткани также в здоровых участках. Это может вызывать, конечно, нежелательные эффекты, такие как сниженная подвижность сустава. Избирательная доставка FGF-18 на уровень участка-мишени может способствовать росту хрящевой ткани только в поврежденной области. В частности, доставка FGF-18 на уровень поврежденной области была бы весьма полезной для лечения ПХТ в сочетании с микропереломами. Микроперелом представляет собой хирургическую технику для восстановления суставного хряща, которая работает путем создания небольших переломов в подлежащей кости. Это приводит к высвобождению плюрипотентных мезенхимальных стволовых клеток из костного мозга (Ringe J. et al., 2012). Заполнение отверстия в хряще инъекционным гелем, содержащим FGF-18, будет направлять клетки внутрь геля, который, в свою очередь, будет действовать как механическая подложка для роста клеток и одновременно как резервуар для лекарственного средства. По этой причине, было бы предпочтительным, если бы FGF-18 не высвобождался из геля, а оставался заключенным в матрицу.
Типичным подходом в технологии культивирования тканей является удерживание факторов роста в 3D-матрице, т.е. в каркасе, который может быть или имплантирован, или инъецирован, в зависимости от механических свойств, для того чтобы принять форму акцепторного участка. Необходимыми характеристиками каркаса являются биосовместимость и рассасываемость. Дополнительно, каркасы должны быть способны обеспечивать клеткам идеальное окружение для роста, пролиферации, и восстановления формы поврежденной ткани. В идеале, матрица должна иметь механические свойства, схожие со свойствами, исходной ткани и должна обладать микропористостью, подходящей для клеток-хозяев (взаимосвязанные поры достаточного размера) (Tessmar and Göpferich, 2007).
Например, WO2012113812 описывает каркас из нановолокна, покрытый, по меньшей мере, одним слоем полианионов и одним слоем поликатионов. Терапевтические молекулы, такие как FGF18, можно включать в каркас. В частности, терапевтическая молекула может формировать полианионный слой. Указанный каркас может необязательно дополнительно включать остеобласты внутри коллагенового гидрогеля и хондроциты внутри альгинатного гидрогеля, каждый гидрогель осаждается на каркас с покрытием. Указанный каркас предназначен для имплантации in situ, посредством хирургической операции.
Гидрогели представляют собой трехмерные сети из цепей гидрофильного полимера, способные поглощать и удерживать большие количества воды. Их основной отличительной чертой является то, что они способны набухать или усыхать, но не растворяться в водной среде. Таким образом, в их матрице возможно задерживать активную молекулу (Активный Фармацевтический Ингредиент, т.е. АФИ), которая затем медленно высвобождается или удерживается, в зависимости от наличия специфических взаимодействий между матрицей и АФИ (Lo Presti et al., 2011). Преимуществом использования инъекционных гидрогелей для лечения заболеваний хрящевой ткани, является возможность инъецировать каркас путем артроскопии в дефектный участок хряща, без необходимости какого-либо инвазивного хирургического вмешательства при использовании твердых каркасов.
Среди разнообразных гидрогелей, которые уже известны, некоторые составы основаны на полимерах, способных проходить процесс гелеобразования в ответ на конкретный физический или химический импульс. Эти полимеры присутствуют в виде вязких инъекционных жидкостей, которые после введения превращаются в макроскопические гели в ответ на стимулы окружающей среды в месте инъекции, такие как изменения температуры, pH или ионной силы. Композицию состава можно регулировать для того чтобы получить гидрогели с различными характеристиками, такими как вязкоупругие свойства, микропористость и т.п. (WO2008063418; Lo Presti et al., 2011; C. Dispenza et al, 2011). При приготовлении фармацевтической композиции, содержащей биологически активный белок, указанная композиция может быть составлена таким образом, что активность белка поддерживается в течение соответствующего периода времени. Потеря активности/стабильности белка может быть результатом химической или физической нестабильности белка, в частности, из-за денатурации, агрегации или окисления. Полученные продукты, таким образом, могут быть фармацевтически неприемлемыми. Хотя известно, что использование эксципиента (-ов) и/или гидрогеля (-ей) повышает стабильность указанного белка, стабилизирующие воздействия этих эксципиентов сильно зависят от полимера в гелях, природы эксципиентов и самого биологически активного белка.
Остается потребность в дополнительных составах, содержащих FGF-18 в качестве активного ингредиента, при этом указанные составы одновременно сохраняют биоактивность активного ингредиента и подходят для использования в виде инъекции, предпочтительно внутрисуставной инъекции, и позволяют уменьшить число инъекций, необходимых для лечения. Такая отличительная черта позволяла бы снизить риск инфекций и повышала комфорт пациента, поскольку не требуется ни хирургического вмешательства, ни инвазивной имплантации. Указанные составы могут быть полезны для введения при лечении заболеваний хрящевой ткани у пациента, таких как остеоартрит или повреждения хрящевой ткани.
Сущность изобретения
Объектом настоящего изобретения является создание нового состава, содержащего белок FGF-18. Более конкретно, указанный состав представляет собой гомогенный гидрогель, содержащий FGF-18, где указанный гидрогель предпочтительно является ионо-чувствительным гидрогелем, и более предпочтительно, альгинатным/коллагеновым гелем. Изобретение также относится к способам для получения гомогенного гидрогеля по настоящему изобретению. Описанный в настоящем документе гидрогель, содержащий FGF-18, может быть полезным для введения при лечении заболеваний хрящевой ткани. Особый интерес представляет альгинатный/коллагеновый гидрогель, дополнительно содержащий белок FGF-18.
В первом аспекте, изобретение относится к гидрогелю (т.е. к составу геля), который является гомогенным, содержащему или включающему альгинат, коллаген, FGF-18, сахар в качестве средства, придающего изотоничность/стабилизатора, а также соль. Этот состав предлагается в виде двухкомпонентной системы гелеобразования, каждый компонент находится в жидкой форме, когда они разделены. Альтернативно, компонент системы гелеобразования, содержащий альгинат, может быть в лиофилизированной форме. Один из компонентов содержит или представляет собой жидкость или лиофилизированную композицию из альгината, коллагена, FGF-18, и сахара (раствор 1). Компоненты образуют гомогенную композицию. Второй компонент содержит или представляет собой соль, также в жидкой форме (раствор 2). Как только 2 компонента системы для гелеобразования (раствор 1 и раствор 2) смешивают (или комбинируют) друг с другом, образуется гель. Указанный гель также является гомогенным. В предпочтительном варианте осуществления стабилизатор представляет собой сахар или сахарный спирт, такой как сахароза, маннит, трегалоза, D-сорбит, и соль представляет собой дикатионную соль (такую как магниевая соль, соль меди, соль цинка или кальциевую соль, например, хлорид кальция). В предпочтительном варианте осуществления в первом компоненте системы гелеобразования (т.е. в растворе 1), концентрация альгината находится на уровне или приблизительно от 1 до 5% масс., предпочтительно на уровне или приблизительно от 2,5 до 4,5, даже предпочтительно на уровне или приблизительно 3 или 4% масс., коллаген находится в концентрации на уровне или приблизительно от 0,1 до 5 мкг/мл, предпочтительно на уровне или приблизительно 1 или 2 мкг/мл, концентрация сахарозы находится на уровне или приблизительно 10-100 мг/мл, предпочтительно на уровне или приблизительно 30-70 мг/мл, такая как на уровне или приблизительно 30, 40, 50, 60 или 70 мг/мл, даже предпочтительно 70 мг/мл; концентрация раствора соли во втором компоненте системы гелеобразования (т.е. в растворе 2), находится на уровне или приблизительно от 1 до 20 мг/мл, предпочтительно 10 мг/мл. При смешивании вместе, объемное соотношение раствора 1 к раствору 2 составляет от 5:1 до 1:2, более предпочтительно на уровне 2:1 (в случае лиофилизированного состава, объем раствора 1 учитывают до процесса лиофилизации). Предпочтительно, FGF-18 выбран из группы, состоящей из: 1) полипептида, содержащего или включающего зрелую форму FGF-18 человека, которая соответствует последовательности, содержащей или включающей последовательность от остатка 28(Glu) до остатка 207(Ala) из SEQ ID NO: 1, 2) полипептида, содержащего или включающего укороченную форму FGF-18 человека, содержащую или включающую последовательность от остатка 28 (Glu) до остатка 196 (Lys) из SEQ ID NO:1, и 3) полипептида, содержащего или включающего SEQ ID NO:2. Более предпочтительно, FGF-18 представляет собой сприфермин, определение которого дано ниже. Первый компонент системы гелеобразования может дополнительно содержать буфер и/или другие эксципиенты по выбору.
Раствор 1 предпочтительно предназначен для совместного введения путем инъекции с раствором 2 для образования гидрогеля in situ.
Во втором аспекте, изобретение относится к способу для получения гомогенного гидрогеля FGF-18, включающему стадии:
1) получения раствора 1, содержащего или включающего FGF-18, вместе с альгинатом, коллагеном и средством, придающим изотоничность/стабилизатором,
2) получения раствора 2, содержащего или состоящего из соли, и
3) совместной инъекции обоих растворов для образования геля,
где средство, придающее изотоничность/стабилизатор представляет собой сахар или сахарный спирт, такой как сахароза, маннит, трегалоза или D-сорбит, и соль представляет собой дикатионную соль (такую как магниевая соль, соль меди, соль цинка или кальциевую соль, например, хлорид кальция). Предпочтительно pH конечного состава сохраняется на уровне или приблизительно от 6 до 8, и более конкретно на уровне или приблизительно 7. В предпочтительном варианте осуществления, FGF-18 выбран из группы, состоящей из: 1) полипептида, содержащего или состоящего из зрелой формы FGF-18 человека, которая соответствует последовательности, содержащей или включающей последовательность от остатка 28(Glu) до остатка 207(Ala) из SEQ ID NO: 1, 2) полипептида, содержащего или состоящего из укороченной формы FGF-18 человека, содержащую или состоящую из последовательности от остатка 28 (Glu) до остатка 196 (Lys) SEQ ID NO:1, и 3) полипептида, содержащего или состоящего SEQ ID NO:2. Более предпочтительно, FGF-18 представляет собой сприфермин, определение которого дано ниже. Раствор 1 может дополнительно содержать буфер и/или другие эксципиенты по выбору.
В третьем аспекте, изобретение относится к промышленному изделию для фармацевтического или ветеринарного применения, содержащему:
1) первый контейнер, содержащий альгинат, коллаген, белок FGF-18 и средство, придающее изотоничность/стабилизатор (раствор 1) (указанная композиция является гомогенной), и
2) второй контейнер, содержащий соль (раствор 2),
где средство, придающее изотоничность/стабилизатор представляет собой сахар или сахарный спирт, такой как сахароза, маннит, трегалоза или D-сорбит, и соль представляет собой дикатионную соль (такую как магниевая соль, соль меди, соль цинка или кальциевую соль, например, хлорид кальция). Предпочтительно, FGF-18 выбран из группы, состоящей из: 1) полипептида, содержащего или состоящего из зрелой формы FGF-18 человека, которая соответствует последовательности, содержащей или состоящей из последовательности от остатка 28(Glu) до остатка 207(Ala) SEQ ID NO: 1, 2) полипептида, содержащего или состоящего из укороченной формы FGF-18 человека, содержащей или состоящей из последовательности от остатка 28 (Glu) до остатка 196 (Lys) из SEQ ID NO:1, и 3) полипептида, содержащего или включающего SEQ ID NO:2. Более предпочтительно, FGF-18 представляет собой сприфермин, определение которого дано ниже. Раствор 1 может дополнительно содержать буфер и/или другие эксципиенты по выбору. Содержимое каждого контейнера затем смешивают друг с другом in situ при одновременном введении путем инъекции. Предпочтительно, первый контейнер и второй контейнер промышленного изделия представляют собой два отсека двухкамерной системы или системы для двойной инъекции.
Определения
- Применяемый в настоящем документе термин «белок FGF-18» или «FGF-18», предназначен для белка, сохраняющего, по меньшей мере, одну биологическую активность белка FGF-18 человека. FGF-18 может быть нативным в его зрелой форме, или в его укороченной форме. Виды биологической активности белка FGF-18 человека включают, в частности, повышение активности остеобластов (см. WO98/16644) или усиление формирования хряща (см. WO2008/023063).
Нативный, или дикого типа, FGF-18 человека представляет собой белок, который экспрессируется хондроцитами суставного хряща. FGF-18 человека был изначально обозначен zFGF-5 и полностью описан в WO98/16644. SEQ ID NO:1 соответствует аминокислотной последовательности нативного FGF-18 человека, с сигнальным пептидом, состоящим из аминокислотных остатков от 1(Met) до 27(Ala). Зрелая форма FGF-18 человека соответствует аминокислотной последовательности от остатка 28(Glu) до остатка 207(Ala) SEQ ID NO: 1 (180 аминокислот).
FGF-18 в настоящем изобретении можно получать рекомбинантным способом, таким, как описанный в заявке WO2006/063362. В зависимости от экспрессирующих систем и условий, FGF-18 в настоящем изобретении экспрессируется рекомбинантной клеткой-хозяином, начиная с метионина (остаток Met) или с сигнальной последовательности для секреции. При экспрессии в прокариотическом хозяине, таком как E. coli, FGF-18 содержит дополнительный остаток Met на N-конце своей последовательности. Например, аминокислотная последовательность FGF-18 человека, при экспрессии в E.coli, начинается с остатка Met на N-конце (положение 1) с последующими остатками от 28(Glu) до остатка 207(Ala) SEQ ID NO: 1.
- Применяемый в настоящем документе термин «укороченная форма» FGF-18, относится к белку, который содержит остатки или состоит из остатков с 28(Glu) по 196(Lys) SEQ ID NO: 1. Предпочтительно, укороченная форма белка FGF-18 представляет собой полипептид, обозначенный «trFGF-18» (170 аминокислот), который начинается с остатка Met (на N-конце) с последующими аминокислотными остатками 28(Glu)-196(Lys) человеческого FGF-18 дикого типа. Аминокислотная последовательность trFGF-18 показана в SEQ ID NO:2 (аминокислотные остатки от 2 до 170 SEQ ID NO:2 соответствуют аминокислотным остаткам от 28 до 196 SEQ ID NO:1). trFGF-18 представляет собой рекомбинантную укороченную форму FGF-18 человека, вырабатываемую E.coli (см. WO2006/063362). Международным непатентованным названием (INN) для этой конкретной формы FGF-18 является сприфермин. Показано, что сприфермин демонстрирует активности, аналогичные зрелому FGF-18 человека, например, он повышает пролиферацию хондроцитов и накопление хрящевой ткани, что приводит к восстановлению и реконструкции ряда хрящевых тканей (см. WO2008/023063).
- термины «активная молекула» и «активный ингредиент» относятся к Активному Фармацевтическому Ингредиенту, т.е. АФИ. Предпочтительно АФИ, в контексте настоящего изобретения, представляет собой FGF-18.
- термины «гель» или «гидрогель» в этой заявке применяют взаимозаменяемо. Они относятся к трехмерной матрице, или каркасу, подходящему в качестве фармацевтического состава. Они не являются твердыми каркасами.
- термин «гомогенный» означает, что различные компоненты состава смешивают, перемешивают или расплавляют друг с другом, т.е. они не образуют раздельные слои компонентов.
- термин «альгинат», также известный как альгиновая кислота или альгин, относится к любой форме альгината. Это хорошо известный гелирующий агент, особенно при использовании с дикатионной солью. Одна из форм, которую можно использовать в контексте настоящего изобретения, представляет собой альгинат натрия.
- термин «коллаген» относится к группе природных белков. Хотя существует около 30 различных форм коллагенов, основной формой является коллаген типа I. Коллаген типа I, а также коллаген типа II, являются предпочтительными формами, которые можно использовать в контексте настоящего изобретения. Однако можно использовать другие формы коллагена.
- термин «альгинатный/коллагеновый» при применении в настоящей заявке относится к комбинации альгината и коллагена.
- термин «дикатионная соль» относится в качестве неограничивающих примеров к соли, содержащей, например, магний, медь, цинк или кальций. Он включает хлорид магния, хлорид меди, хлорид цинка или хлорид кальция. Предпочтительно, дикатионная соль по изобретению не является ни поликатионной солью, ни полученной из поликатионного компонента (такого, как описанные в WO2012/113812).
- Применяемый в настоящем документе термин "стабильный" раствор или состав, представляет собой раствор или состав, где степень деградации, модификации, агрегации, потери биологической активности и т.п. белков, находящихся в нем, контролируется в приемлемой степени и не увеличивается неприемлемым образом с течением времени. Предпочтительно, состав сохраняет, по меньшей мере, более чем 80% активности FGF-18 в течение периода, по меньшей мере, 12 месяцев при комнатной температуре. Стабилизированный состав по настоящему изобретению, содержащий FGF-18, предпочтительно имеет срок годности, по меньшей мере, приблизительно 12 месяцев, 18 месяцев, более предпочтительно, по меньшей мере, 20 месяцев, еще более предпочтительно приблизительно 24 месяца, при хранении при комнатной температуре или при 2-8°C, например. Способы для наблюдения за стабильностью состава FGF-18 по настоящему изобретению доступны в данной области.
- Применяемый в настоящем документе термин "стабилизирующий агент", «стабилизатор» или «средство для придания изотоничности», представляет собой соединение, которое физиологически переносимо и придает составу подходящую стабильность/тоничность. Оно предотвращает, в частности, непосредственно поток воды через мембраны клеток, которые контактируют с составом. Во время процесса сушки вымораживанием (лиофилизации), стабилизатор также эффективен в качестве криопротектора (т.е. лиопротектора). Соединения, такие как глицерин, широко используют для таких целей. Другие подходящие стабилизаторы в качестве неограничивающих примеров включают, аминокислоты или белки (например, глицин или альбумин), соли (например, хлорид натрия), и сахара или сахарные спирты (например, декстрозу, маннит, трегалозу, сахарозу, D-сорбит или лактозу). По настоящему изобретению, предпочтительным стабилизатором/средством для придания тоничности является сахар, даже более предпочтительно сахароза.
- Применяемый в настоящем документе термин «буфер»", относится к растворам соединений, о которых известно, что они безопасны в составах для фармацевтического или ветеринарного использования и которые имеют свойство поддерживать или контролировать pH состава в желаемом для состава диапазоне pH. Приемлемые буферы для контроля pH в пределах от умеренно кислого pH до умеренно основного pH в качестве неограничивающих примеров включают фосфатный, ацетатный, цитратный, аргининовый, Трис и гистидиновый буферы. "Трис" относится к 2-амино-2-гидроксиметил-1,3,-пропандиолу, и к его любой фармакологически приемлемой соли. Предпочтительным буфером может быть гистидиновый буфер.
- Применяемый в настоящем документе термин "растворитель", относится к жидкому растворителю, или водному, или неводному. Выбор растворителя зависит, в частности, от растворимости соединения лекарственного средства в указанном растворителе и от способа введения. Водный растворитель может состоять исключительно из воды, или может состоять из воды плюс одного или нескольких смешивающихся растворителей, и может содержать растворенные вещества, такие как сахара, буферы, соли или другие эксципиенты. Наиболее широко используемые неводные растворители представляют собой короткоцепочечные органические спирты, такие как метанол, этанол, пропанол, короткоцепочечные кетоны, такие как ацетон, и полиспирты, такие как глицерин. По настоящему изобретению, предпочтительный растворитель представляет собой водный растворитель, такой как вода или физиологический раствор.
- Применяемый в настоящем документе термин "флакон" или «контейнер», относится в широком смысле к резервуару, подходящему для сохранения альгината/коллагена в жидкой форме, или в лиофилизированной форме. Аналогично, он может хранить жидкую смесь солей. Примеры флакона, который можно использовать в настоящем изобретении, включают шприцы, ампулы, картриджи или другой подобный резервуар, подходящий для доставки состава FGF-18 пациенту путем инъекции, предпочтительно путем внутрисуставной инъекции. Альтернативно, флаконы, хранящие раствор альгината/коллагена и флакон, хранящий соль, представлены в виде двух отсеков двухкамерной системы (шприц или картридж, например, двухкамерный шприц или устройство для инъекций с двумя иглами и т.п.). Флаконы, подходящие для упаковки продуктов для внутрисуставного введения хорошо известны и общепризнаны в данной области.
- Применяемый в настоящем документе термин «заболевание хрящевой ткани» охватывает нарушения, возникшие в результате повреждений из-за травмы или хондропатии. Примеры заболеваний хрящевой ткани, которые можно лечить введением состава FGF-18, описываемого в настоящем документе, включают, но не ограничиваются ими, артрит, такой как остеоартрит или ревматоидный артрит, и повреждения хрящевой ткани.
- термин «остеоартрит» применяют для обозначения наиболее распространенной формы артрита. Он может быть вызван разрушение хряща. Кусочки хряща могут откалываться и вызывать боль и опухание в суставе между костями. Со временем хрящ может стираться полностью, и кости будут тереться друг о друга. Остеоартрит может поражать любой сустав, но, как правило, затрагивает руки и опорные суставы, такие как бедренные, коленные, голеностопные и позвоночные. В предпочтительном примере, остеоартрит может быть остеоартритом колена или остеоартритом бедра. Специалист имеет полное представление о классификациях остеоартрита, которые используют в данной области, в частности о системе оценки Международного общества по изучению остеоартрита (OARSI) (см. например Custers et al., 2007). Остеоартрит является одним из предпочтительных заболеваний хрящевой ткани, которые можно лечить введением составов FGF-18 по настоящему изобретению.
- применяемый в настоящем документе термин «повреждение хрящевой ткани» представляет собой заболевание хрящевой ткани или повреждение хряща, возникшее, в частности, в результате травмы. Повреждения хрящевой ткани могут возникать в результате травматического механического разрушения, в частности, в дополнение к аварии или хирургическому вмешательству (такому, как техника микропереломов). Также в рамках этого определения рассматриваются повреждения, связанные со спортом, или истирание тканей сустава, связанные со спортом.
- термин «мкг» или «mcg» используется взаимозаменяемо и относится к разделу единиц СИ для массы.
Подробное описание изобретения
Основным объектом по настоящему изобретению является состав альгинатного/коллагенового геля (или гидрогеля), содержащий или состоящий из альгината, коллагена, белка FGF-18, сахара в качестве стабилизатора и соли. Указанный гидрогель является гомогенным. Гидрогель может дополнительно содержать буфер, и/или другие эксципиенты по выбору. В предпочтительном варианте осуществления стабилизатор представляет собой сахар или сахарный спирт, такой как сахароза, маннит, трегалоза или D-сорбит, и соль представляет собой дикатионную соль, такую как магниевая соль, соль меди, соль цинка или кальциевая соль (например, хлорид кальция). Указанный гидрогель подходит для инъекции на уровне хряща. Предпочтительно, белок FGF-18 выбран из группы, состоящей из: 1) полипептида, содержащего или состоящего из зрелой формы FGF-18 человека, которая соответствует последовательности, содержащей или состоящей из последовательности от остатка 28(Glu) до остатка 207(Ala) из SEQ ID NO: 1, 2) полипептида, содержащего или состоящего из укороченной формы FGF-18 человека, содержащего или состоящего из последовательности от остатка 28(Glu) до остатка 196(Lys) из SEQ ID NO:1, и 3) полипептида, содержащего или состоящего из SEQ ID NO:2. Более предпочтительно, FGF-18 представляет собой сприфермин.
Преимуществом использования инъекционных гидрогелей для лечения заболеваний хрящевой ткани, является возможность инъецировать каркас (или компонент каркаса), уже содержащий FGF-18, в дефектный участок хряща, без необходимости какого-либо инвазивного хирургического вмешательства, как при использовании твердых каркасов. Предпочтительно, такую инъекцию гидрогеля производят путем артроскопии.
Наиболее предпочтительно, гомогенные гидрогели по настоящему изобретению, получают из двух растворов, одного, содержащего полимер (в настоящем документе альгинатная система; раствор 1) и другого, содержащего ионы (в настоящем документе в форме соли; раствор 2), и они формируются in situ, после инъекции, путем смешивания (или комбинирования) двух растворов. Смешивание (или комбинирование) двух растворов предпочтительно производят путем совместной инъекции. Раствор 1 может дополнительно содержать буфер и/или другие эксципиенты по выбору.
В предпочтительном варианте осуществления настоящее изобретение относится к применению гомогенных жидких полимерных растворов, способных проходить процесс гелеобразования сразу после введения из-за изменений концентрации ионов. В альтернативном варианте осуществления полимерный раствор может быть в лиофилизированной форме. Когда полимерный раствор находится в такой лиофилизированной форме, указанный раствор может необязательно дополнительно содержать лиопротектор. Известные лиопротекторы представляют собой, например, сахара, и полиoлы, в основном, такие как сахароза, маннит, трегалоза или D-сорбит.
Если раствор 1 будет находиться в лиофилизированной форме, лиофилизацию предпочтительно проводят с использованием общепринятых способов.
Концентрация FGF-18 в растворе 1 предпочтительно находится на уровне или приблизительно от 0,1 до 300 мкг/мл, предпочтительно на уровне или приблизительно 0,1, 1, 5, 10, 20, 30, 40, 50, 54, 60, 70, 80, 90, 100, 150, 200, 250 или 300 мкг/мл. Более предпочтительно FGF-18 находится в концентрации на уровне или приблизительно от 0,1 до 100 мкг/мл, даже более предпочтительно на уровне или приблизительно от 10 до 60 мкг/мл. FGF-18 можно добавлять более 5%, для того чтобы предотвратить возможные потери белка, которые могут происходить во время составления композиции. Например, для концентрации FGF-18 30 мкг/мл, соединение можно добавлять в количестве 31,5 мкг/мл.
Гелеобразующий компонент в растворе 1, т.е. альгинат, находится в концентрации на уровне или приблизительно от 1 до 5% масс., предпочтительно на уровне или приблизительно от 2,5 до 4,5% масс., даже предпочтительно на уровне или приблизительно 3 или 4% масс.
Стабилизатор в настоящем изобретении предпочтительно представляет собой сахар или сахарный спирт, такой как сахароза, маннит, трегалоза или D-сорбит. Предпочтительный сахар представляет собой сахарозу. Предпочтительно, концентрация стабилизатора в растворе 1 находится на уровне или приблизительно от 10 до 100 мг/мл, более предпочтительно на уровне или приблизительно 30-70 мг/мл, такая как на уровне или приблизительно 30, 40, 50, 60 или 70 мг/мл, даже предпочтительно на уровне или приблизительно 70 мг/мл.
Коллаген по настоящему изобретению, в растворе 1, находится в концентрации на уровне или приблизительно от 0,1 до 5 мкг/мл, более предпочтительно на уровне или приблизительно от 1 до 2 мкг/мл, более конкретно на уровне или приблизительно 1 или 2 мкг/мл.
Соль, во втором компоненте системы гелеобразования (т.е. в растворе 2), предпочтительно представляет собой дикатионную соль, такую как магниевая соль, соль меди, соль цинка или кальциевая соль (например, хлорид кальция). Концентрация раствора соли находится на уровне или приблизительно от 1 до 20 мг/мл, предпочтительно на уровне или приблизительно 10 мг/мл.
В предпочтительном варианте осуществления раствор 1, содержит или включает в себя FGF-18 с концентрацией на уровне или приблизительно 0,1-100 мкг/мл, альгинат на уровне или приблизительно 4% масс., сахарозу на уровне или приблизительно 70 мг/мл и коллаген на уровне или приблизительно 2 мкг/мл; и раствор 2, содержит или включает в себя дикатионную соль (такую, как хлорид кальция) на уровне или приблизительно 10 мг/мл. Раствор 1 может дополнительно содержать буфер и/или другие эксципиенты по выбору. Раствор 1 является гомогенным.
При смешивании друг с другом объемное соотношение раствор 1: раствор 2 составляет от 5:1 до 1:2, более предпочтительно на уровне 2:1 (в случае лиофилизированного состава объем раствора 1 учитывают до процесса лиофилизации).
После смешивания друг с другом, конечные концентрации каждого компонента предпочтительно являются следующими:
- FGF-18: от 0,00006 до 0,2% масс./об., такая как 0,0036% масс./об. (когда FGF-18 составляет 0,1-300 мкг/мл перед смешиванием, на основании концентрации FGF-18, приведенной в разделе Примеры);
- альгинат: от 0,6 до 3,33% масс./об., такая как 2,67% масс./об. (когда альгинат составляет 4% масс./об. перед смешиванием);
- коллаген: в диапазоне от 0,00006 до 0,003% масс./об., такая как 0,000133% масс./об. (когда коллаген составляет 2 мкг/мл перед смешиванием);
- стабилизатор: от 0,6 до 6% масс./об., такая как 4,67% масс./об. (когда сахароза, например, составляет 70 мг/мл перед смешиванием);
- дикатионная соль: от 0,033 до 0,66% масс./об., такая как 0,33% масс./об. (когда соль составляет 10 мг/мл перед смешиванием).
В предпочтительном варианте осуществления pH конечного состава сохраняется на уровне или приблизительно от 6 до 8, и более конкретно на уровне или приблизительно 7.
Изобретение дополнительно относится к способу для получения гомогенных гидрогелей с FGF-18, включающему этапы:
1) получения первого раствора (раствор 1), содержащего или представляющего собой FGF-18, вместе с альгинатом, коллагеном и стабилизатором,
2) получение второго раствора (раствор 2), содержащего или представляющего собой соль, и
3) совместной инъекции обоих растворов для образования геля,
где стабилизатор представляет собой сахар или сахарный спирт, такой как сахароза, маннит, трегалоза или D-сорбит, и соль представляет собой дикатионную соль (такую как магниевая соль, соль меди, соль цинка или кальциевую соль, например, хлорид кальция). Раствор 1 может дополнительно содержать буфер и/или другие эксципиенты по выбору. Раствор 1 является гомогенным. В предпочтительном варианте осуществления pH конечного состава сохраняется на уровне или приблизительно от 6 до 8, и более конкретно на уровне или приблизительно 7. Предпочтительно, FGF-18 выбран из группы, состоящей из: 1) полипептида, содержащего или включающего зрелую форму FGF-18 человека, которая соответствует последовательности, содержащей или включающей последовательность от остатка 28(Glu) до остатка 207(Ala) из SEQ ID NO: 1, 2) полипептида, содержащего или включающего укороченную форму FGF-18 человека, содержащую или включающую последовательность от остатка 28(Glu) до остатка 196(Lys) из SEQ ID NO:1, и 3) полипептида, содержащего или включающего SEQ ID NO:2. Более предпочтительно, FGF-18 представляет собой сприфермин, как определено в настоящем документе.
Каждое из соединений (т.е. FGF-18, альгинат, коллаген, стабилизатор и соль) можно использовать с любой концентрацией, любым pH, и/или любыми соотношениями, описанными выше. Предпочтительно, соотношение раствор 1:раствор 2 (объем к объему, т.е. объемное соотношение) находится на уровне или приблизительно от 1:2 до 5:1, более предпочтительно на уровне или приблизительно 2:1 (в случае лиофилизированного состава объем раствора 1 учитывают до процесса лиофилизации).
Если раствор 1 гидрогеля по изобретению находится в лиофилизированной форме, он должен быть восстановлен перед этапом 3) (т.е. перед совместной инъекцией).
В третьем аспекте, изобретение относится к промышленному изделию для фармацевтического или ветеринарного применения, содержащему:
1) первый контейнер, содержащий или включающий в себя альгинат, коллаген, белок FGF-18 и стабилизатор (раствор 1), и
2) второй контейнер, содержащий или включающий в себя соль (раствор 2),
где стабилизатор представляет собой сахар или сахарный спирт, такой как сахароза, маннит, трегалоза или D-сорбит, и соль представляет собой дикатионную соль (такую как магниевая соль, соль меди, соль цинка или кальциевую соль, например, хлорид кальция). Раствор 1 может дополнительно содержать буфер и/или другие эксципиенты по выбору. Раствор 1 является гомогенным. Предпочтительно, FGF-18 выбран из группы, состоящей из: 1) полипептида, содержащего или включающего зрелую форму FGF-18 человека, которая соответствует последовательности, содержащей или включающей последовательность от остатка 28(Glu) до остатка 207(Ala) из SEQ ID NO: 1, 2) полипептида, содержащего или включающего укороченную форму FGF-18 человека, содержащую или включающую последовательность от остатка 28(Glu) до остатка 196(Lys) из SEQ ID NO:1, и 3) полипептида, содержащего или включающего SEQ ID NO:2. Более предпочтительно, FGF-18 представляет собой сприфермин, как определено в настоящем документе.
Каждое из соединений (т.е. FGF-18, альгинат, коллаген, стабилизатор и соль) можно использовать с любой концентрацией, любым pH, и/или любыми соотношениями, описанными выше. Предпочтительно, соотношение раствор 1:раствор 2 (объемное соотношение) находится на уровне или приблизительно от 1:2 до 5:1, более предпочтительно на уровне или приблизительно 2:1 (в случае лиофилизированного состава объем раствора 1 учитывают до процесса лиофилизации).
Предпочтительно, контейнер, содержащий состав FGF-18, и контейнер, содержащий соль, относятся к двум отсекам двухкамерной системы или системы для двойной инъекции (шприца или картриджа, например).
Если полимерный раствор (т.е. раствор 1) находится в лиофилизированной форме, промышленное изделие может дополнительно включать третий контейнер, содержащий или включающий растворитель, такой как вода или физиологический раствор (например, 0,9% масс./об. хлорида натрия для инъекций), необходимый для восстановления.
Также описан упаковочный материал, предоставляющий инструкции по формированию гидрогеля по настоящему изобретению, предпочтительно in situ.
Важно, что авторами изобретения неожиданно было показано (см. раздел Примеры), что если гели были сформированы с использованием шприца с разъемом, который позволяет одновременно инъецировать два раствора, при любой концентрации полимеров не наблюдали оставшейся жидкой фазы. На самом деле, связанная с контекстом инъекция двух растворов позволяет более быстро и более гомогенно смешивать два потока, приводя к мгновенному гелеобразованию.
Различные компоненты гидрогеля по изобретению можно хранить в течение, по меньшей мере, приблизительно от 12 месяцев до приблизительно 24 месяцев. При предпочтительных условиях хранения, перед первым использованием, составы хранят вдали от яркого света (предпочтительно, в темноте), при температуре охлаждения (на уровне или приблизительно 2-8°C).
Гидрогель по изобретению должен быть приготовлен во время инъекции.
Если раствор 1 гидрогеля по изобретению находится в лиофилизированной форме, он должен быть восстановлен перед использованием. Предпочтительно, его восстанавливают в стерильных условиях растворителем, таким как вода или физиологический раствор (например, 0,9% масс./об. хлорида натрия для инъекций) перед использованием, т.е. перед комбинированием (или смешиванием) с раствором 2, и, таким образом, перед инъекцией. После восстановления, объем предпочтительно является таким же, как и перед лиофилизацией, таким как приблизительно от 0,5 мл до 5 мл, более предпочтительно на уровне или приблизительно 0,5, 1 или 2 мл. Систему необходимо оставить для растворения и гомогенизации, например, в течение 30 минут, прежде чем она будет готова для инъекции. Указанный раствор должен быть использован предпочтительно в течение одного часа после восстановления.
Настоящее изобретение относится к гомогенным гидрогелям, содержащим FGF-18, в частности, для однократного использования, подходящим для фармацевтического или ветеринарного использования. Гидрогели по настоящему изобретению, содержащие FGF-18, можно использовать для введения для улучшения восстановления хрящевой ткани или для лечения заболевания хрящевой ткани, такого как остеоартрит или повреждения хрящевой ткани.
Эти гомогенные гидрогели подходят для использования для инъекций и альтернативных систем доставки. В особенно предпочтительном варианте осуществления составы по изобретению предназначены для внутрисуставной (в.с.) инъекции. Их можно вводить путем прямой инъекции в поврежденное место, где гель предпочтительно образуется in situ. В предпочтительном варианте осуществления настоящего изобретения, в.с. введение производят в сустав, выбранный из сустава бедра, колена, плеча, запястья, лодыжки, позвоночника, ноги, пальца руки, пальца ноги, руки, плеча, ребер, лопатки, голеней, пяток и среди точек окостенения позвоночника. Еще в одном предпочтительном варианте осуществления в.с. введение производят в тазобедренный или коленный сустав.
Следующие примеры предназначены для дополнительной иллюстрации получения составов и гидрогелей по изобретению. Объем изобретения не может быть истолкован как состоящий исключительно из следующих примеров.
Описание чертежей:
Фигура 1: Тест развертки по частоте, проведенный на геле-плацебо (без FGF) на основе 3% масс. альгината, с FGF-18 54 мкг/мл в растворе альгината (с FGF (54)) и с FGF-18 540 мкг/мл в растворе альгината (с FGF (540)).
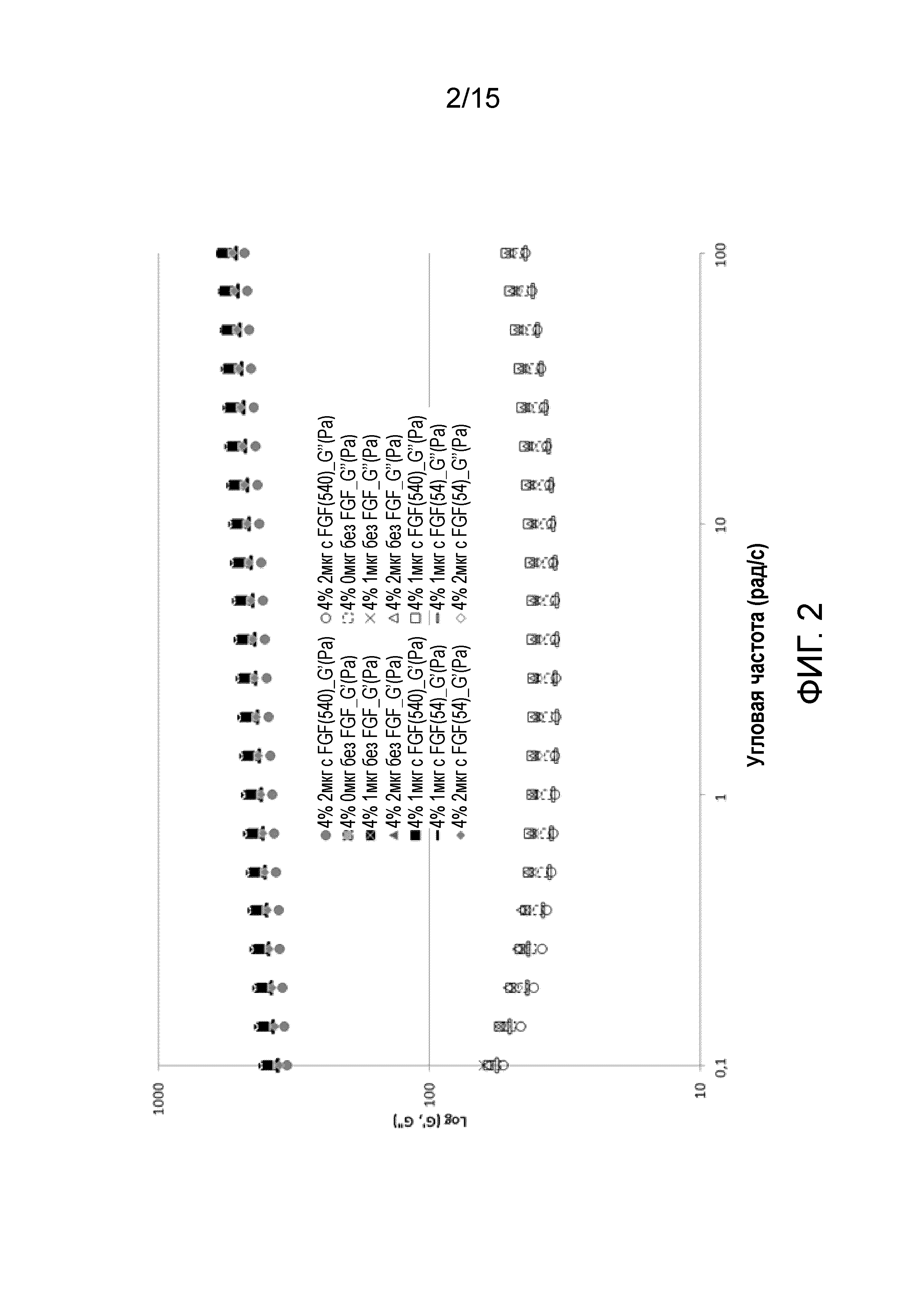
Фигура 2: Тест развертки по частоте, проведенный на гелях на основе 4% масс. альгината: плацебо (без FGF), с FGF-18 54 мкг/мл в растворе альгината (с FGF (54)) и с FGF-18 540 мкг/мл в растворе альгината (с FGF (540)).
фигура 3: Тест развертки по частоте, проведенный на гелях на основе 3% масс. альгината фармацевтической степени чистоты (ФЧ): плацебо (без FGF), с FGF-18 54 мкг/мл в растворе альгината (с FGF (54)) и с FGF-18 540 мкг/мл в растворе альгината (с FGF (540)).
фигура 4: Тест развертки по частоте, проведенный на гелях на основе 4% масс. альгината ФЧ: плацебо (без FGF), с FGF-18 54 мкг/мл в растворе альгината (с FGF (54)) и с FGF-18 540 мкг/мл в растворе альгината (с FGF (540)).
фигура 5: Степень набухания кандидатных гелей на основе альгината, плацебо (без FGF) и с активным веществом (с FGF), приготовленных с альгинатом натрия, не ФЧ.
фигура 6: Степень набухания гелей на основе альгината, плацебо (без FGF) и с активным веществом (с FGF), без коллагена типа I, приготовленных с с альгинатом натрия, не ФЧ.
фигура 7: Степень набухания кандидатных гелей на основе альгината, плацебо (без FGF) и с активным веществом (с FGF), приготовленных с альгинатом натрия ФЧ.
фигура 8: Биотест FGF-18 в геле с 4% масс. альгината с 2 мкг/мл коллагена типа I.
фигура 9: Изображения сканирующей электронной микроскопии (СЭМ (100×) для гелей на основе альгината из жидких растворов полимеров с концентрацией 3% масс. или 4% масс., содержащих 0, 1 или 2 мкг/мл коллагена типа I и 54 мкг/мл FGF-18.
фигура 10: Вид в разрезе трехмерного изображения, полученного путем лазерной конфокальной сканирующей микроскопии (ЛКСМ) для (a) геля на основе альгината с 2 мкг/мл коллагена типа I после инкубации с клетками HTB94 в течение 72 часов и (b) геля на основе альгината без коллагена после инкубации с клетками HTB94 в течение 144 часов. Белые пятна - клетки HTB94, меченые Родамином B. Справа: верхняя часть геля; слева: нижняя часть геля.
фигура 11: Последовательность FGF-18 человека, соответствующая SEQ ID NO:1 (a) и последовательность сприфермина, соответствующая SEQ ID NO:2 (b).
фигура 12: Изменение pH лиофилизированного (сушка вымораживанием) состава с течением времени в трехмесячном тесте на стабильность при нормальных условиях хранения (5°C), ускоренных условиях (25°C) и неблагоприятных условиях (40°C).
фигура 13: Изменение % содержания влаги лиофилизированного (сушка вымораживанием) состава с течением времени в трехмесячном тесте на стабильность при нормальных условиях хранения (5°C), ускоренных условиях (25°C) и неблагоприятных условиях (40°C).
фигура 14: Изменение содержания FGF-18 в лиофилизированном (сушка вымораживанием) составе с течением времени в трехмесячном тесте на стабильность при нормальных условиях хранения (5°C), ускоренных условиях (25°C) и неблагоприятных условиях (40°C).
фигура 15: Изменение содержания альгината в лиофилизированном (сушка вымораживанием) составе с течением времени в трехмесячном тесте на стабильность при нормальных условиях хранения (5°C), ускоренных условиях (25°C) и неблагоприятных условиях (40°C).
фигура 16: a) изменение характеристической вязкости, рассчитанное в виде среднего ± стандартное отклонение в пределах скорости сдвига 10-50 сек-1, лиофилизированного (сушка вымораживанием) состава с течением времени в трехмесячном тесте на стабильность при нормальных условиях хранения (5°C), ускоренных условиях (25°C) и неблагоприятных условиях (40°C). Фигура 16b: влияние скорости сдвига на характеристическую вязкость при сдвиге лиофилизированного (сушка вымораживанием) состава в нулевой точке времени и после трехмесячного теста на стабильность при нормальных условиях хранения (5°C), ускоренных условиях (25°C) и неблагоприятных условиях (40°C).
фигура 17: Оценка механических свойств. Фигура 17a: изменение динамического модуля упругости (G’) лиофилизированного (сушка вымораживанием) состава с течением времени в трехмесячном тесте на стабильность при нормальных условиях хранения (5°C), ускоренных условиях (25°C) и неблагоприятных условиях (40°C). XXX. фигура 17 b: Тест развертки по частоте, проведенный на лиофилизированном (сушка вымораживанием) составе в нулевой точке времени и после трехмесячного теста на стабильность при нормальных условиях хранения (5°C), ускоренных условиях (25°C) и неблагоприятных условиях (40°C).
Описание последовательностей:
SEQ ID NO.1: Аминокислотная последовательность нативного FGF-18 человека.
SEQ ID NO.2: Аминокислотная последовательность рекомбинантного укороченного FGF-18 (сприфермина).
Примеры
Материалы
Рекомбинантный укороченный FGF-18 (trFGF-18 или сприфермин) в настоящих примерах был приготовлен своими силами путем экспрессии в E.coli в соответствии со способом, описанным в заявке WO2006/063362. В следующих примерах, сприфермин и FGF-18 используют взаимозаменяемо.
Другие основные вещества, использованные в примерах, были следующими:
- Альгинат натрия, Sigma Aldrich A2158,
- Альгинат натрия, FMC BioPolymer Keltone LVCR (PharmaGrade Альгинат),
- Сахароза, Merck 1,07653,9029,
- Коллаген типа I из кожи человека, CalbioChem 234149, и CalbioChem 234138,
- Хлорид кальция (CaCl2), Merck 1,02382,0250,
- δ-лактон D-(+)-глюконовой кислоты, Sigma Aldrich G4750,
- Хитозан 75% степень деацетилирования (СД) высокомолекулярный (ВММ), Sigma Aldrich 419419,
- Хитозан 95% СД низкомолекулярный (НММ), Faravelli 43000,
- Хитозан 95% СД ВММ, Heppe medical 24711.
Следующие примеры описывают получение и характеристики двух типов гидрогелей, т.е. ионо-чувствительного и температуро-чувствительного гидрогелей. Ионо-чувствительные гидрогели, в частности, были приготовлены с альгинатом натрия, способным образовывать гидрогели в присутствии двухвалентных катионов, в то время как температуро-чувствительные гидрогели, в частности, были приготовлены с хитозаном, хорошо известным полисахаридом, чувствительным к температуре (Tomme et al., 2008). Оба полимера, использованных в этом исследовании, представляют собой биосовместимые природные полисахариды.
Для того чтобы четко различать в этом разделе состав перед процессом гелеобразования и состав после образования геля, первый обозначают как «жидкий раствор», а последний обозначают как «гель», соответственно.
Способы
Время гелеобразования и температура
Время гелеобразования оценивали для всех составов путем «теста на опрокидывание». Гели получали в стеклянных чашках Петри диаметром 3 см и инкубировали при различных температурах. В предопределенные интервалы времени, чашки Петри наклоняли, и временем гелеобразования считалось время, при котором состав не показывал никакой текучести.
Механические свойства
Реологические свойства гидрогелей исследовали с использованием реометра AR 2000 (TA Instrument) с конической геометрией (1° наклона) с диаметром 40 мм. На обеих пластинах применяли абразивные диски во избежание скольжения образцов во время теста. Толщина всех образцов находилась в пределах приблизительно 1-2 мм, в зависимости от объема образца. Уловитель для растворителя применяли для поддержания влагонасыщенной атмосферы, чтобы предотвратить испарение растворителя во время измерения.
После полного набухания гидрогелей из их исходных жидких растворов в чашках Петри, образцы помещали на реометр и уравновешивали при 37°C в течение 2 минут. Затем, образцы анализировали при помощи тестов развертки по частоте в диапазоне частот от 0,1 до 100 рад/с. Колебательное напряжение устанавливали 10 Па, и динамический модуль упругости, G', и модуль потерь, G'', записывали как функцию частоты.
Анализ параметров набухания
Одним из характерных свойств гидрогелей является их способность набухать в присутствии водного раствора из-за их гидрофильной природы. Для того чтобы оценить параметры набухания гелей, их погружали в раствор искусственной синовиальной жидкости (ИСЖ) и взвешивали с течением времени. Эксперименты проводили в трех повторах в 12-луночных планшетах, снабженных навесными вставками с мембраной на дне с порами 0,4 мкм.
Для этого теста выбирали только альгинатные гели. Гели получали во флаконах на 5 мл, смешивая 200 мкл раствора хлорида кальция и 400 мкл раствора жидкого полимера, приготовленного, как описано в примере 2, и инкубировали при 37°C в течение 30 минут. Гели затем перемещали в предварительно взвешенные пустые вставки. Вставки с образцами гелей взвешивали и соответствующую массу рассматривали как референсную массу в нулевой точке времени. Вставки, содержащие гели, помещали в планшет и добавляли 1,5 мл ИСЖ в лунку, убедившись, что пористое дно вставки погружено в раствор. Планшет хорошо закрывали пленкой Parafilm, чтобы избежать испарения, и инкубировали при 37°C в орбитальном шейкере. В предопределенные моменты времени, вставки, содержащие гели, удаляли из лунок. Избыток ИСЖ удаляли, промокая пористое дно фильтровальной бумагой, и затем взвешивали вставки с гелями. Растворы в лунках собирали, хранили при -80°C и заменяли свежей ИСЖ. Композиция ИСЖ была следующей: 1× буфер PBS, pH 7,3, F68 (т.е. полоксамер 188) 0,25 г/л, сывороточный альбумин человека (САЧ) 1% масс., PenStrep 1% масс. Перед использованием ИСЖ фильтровали через 0,22 мкм фильтры. Результаты описывали в виде степени набухания, т.е. соотношения между массой во временной точке t и массой в точке t=0.
Анализ сканирующей электронной микроскопией (СЭМ)
Способ сканирующей электронной микроскопии применяли для анализа трехмерной структуры полимерной сети сразу после формирования геля. Активные гели на основе альгината получали в стеклянных чашках Петри с диаметром 3 см, следуя способу, который описан в абзаце, относящемся к разделу «время гелеобразования», смешивая 1 мл раствора жидкого полимера и 0,5 мл раствора кальция. Полученные гели затем инкубировали при 37°C в течение 30 минут. Получали шесть образцов из раствора жидкого полимера с концентрацией 3% масс. или 4% масс. альгината, в обоих случаях содержащего 0, 1 или 2 мкг/мл коллагена типа I. Гели затем лиофилизировали в течение 48 часов. Цикл лиофилизации включал этап замораживания, этап первичной сушки и этап вторичной сушки. Во время этапа замораживания использовали быстрое снижение температуры от комнатной температуры до - 45°C, с последующей стадией при -45°C в течение 4 часов. Затем следовал этап первичной сушки, когда температура быстро повышалась от -45°C до -10°C со скоростью 1°C/мин при приложенном давлении 50 миллиторр, с последующей стадией при -10°C и при 50 миллиторр в течение 24 часов и 30 минут. Этап вторичной сушки включал две стадии: первое быстрое повышение температуры от -10°C до 21°C со скоростью 1°C/мин при приложенном давлении 50 миллиторр, с последующей стадией при 21°C и при 50 миллиторр в течение 12 часов и 30 минут, а затем второе быстрое повышение температуры от 21°C до 37°C со скоростью 1°C/мин при приложенном давлении 50 миллиторр, с последующей стадией при 37°C и при 50 миллиторр в течение 6 часов. Наконец были достигнуты комнатная температура и атмосферное давление. Затем каждый образец окрашивали и анализировали посредством СЭМ.
Исследование высвобождения in vitro
Образцы, использованные для тестов набухания, также анализировали в тестах высвобождения in vitro. В частности, собранные фазы, хранившиеся при -80°C (как описано в вышеизложенном разделе «Анализ параметров набухания») анализировали посредством ВЭЖХ. Выбранные образцы анализировали также посредством Biacore (данные не показаны).
Тест на модели на животных ex vivo
Предварительные тесты на модели на животных ex vivo проводили для исследования способности альгинатного состава прикрепляться к настоящему коленному суставу. Тестируемый состав был выбран на основании результатов анализа прорастания клеток, описанного в примере 9. В частности, использованная модель состояла из верхней части большеберцовой кости и нижней части бедренной кости, составляющих колено коровы. В обеих частях колена с использованием бура были сделаны отверстия глубиной 1 см и диаметром 0,4 см для того чтобы имитировать отверстия, производимые хирургами при выполнении микроперелома. Отверстия затем были заполнены составом с 4% масс. альгината, содержащим 1,3 мкг/мл коллагена типа I и 36 мкг/мл FGF-18, в виде конечных концентраций в геле. Тест проводили с использованием клапана для вливания для того чтобы соединить два различных шприца, один, содержащий альгинатный раствор, и другой, содержащий раствор кальция. Поршни двух шприцов нажимали одновременно, таким образом, что клапан позволял растворам смешиваться. Состав инъецировали в отверстия, как в вертикальном, так и в перевернутом положениях, чтобы подтвердить возможность введения в различных возможных реальных сценариях in vivo. После приблизительно 2 часов инкубации при 37°C, гель удаляли из отверстия, чтобы подтвердить его статус путем визуального осмотра.
Биоанализ in vitro
96-луночный планшет для люминометрии (анализируемый планшет) покрывают 50 мкл/лунку 4% раствором альгината натрия и 25 мкл/лунку 10 мг/мл раствора CaCl2, и инкубируют в течение 30 минут при 37°C, 5% CO2, чтобы позволить сформироваться основному гидрогелю.
A 96-луночный планшет (планшет со стандартами) заполняют 160 мкл/лунку средой для анализа от ряда B до ряда H. Затем, референсный стандарт FGF-18 и образцы разбавляют до 10 мкг/мл в среде для анализа и добавляют в виде трех повторов (100 мкл/лунку) в ряд A, считая группы столбцов как повторы. С использованием мультиканальной пипетки проводят серийные разведения 1:5 из лунки в ряду A в лунку в ряд H, перенося 40 мкл из ряда A в ряд H.
Разведения референсного стандарта FGF-18 из планшета со стандартами переносят в покрытый основным гидрогелем 96-луночный планшет (анализируемый планшет) в количестве 25 мкл/лунку и инкубируют в течение 1 часа при 37°C и 5% CO2.
Клеточные культуры BaF3/FGFR3c, посеянные в количестве 10,000,000 во флакон 75 см2 и истощенные в течение 24 часов перед анализом, разбавляют до 800,000 клеток/мл средой для анализа, а затем добавляют 25 мкл/лунку (20,000 клеток/лунку) в каждую лунку в планшет, покрытый основным гидрогелем, с FGF-18 в течение 48 часов при 37°C и 5% CO2.
Добавляют 100 мкл/лунку реагента «ATPlite 1 step» для выявления пролиферации, медленно перемешивают планшет и читают испускаемую люминесценцию при помощи счетчика люминисценции.
Пример 1: Предварительные составы
Во время работы с предварительными составами или альгинат, или хитозан смешивали с другими эксципиентами для того чтобы получить водные растворы с приемлемой осмоляльностью для внутрисуставных инъекций (целевая: 350 мОсм/кг). Жидкие растворы затем тестировали по времени гелеобразования и температуре. Составы, способные образовывать гидрогели в пределах 5 минут и/или при температуре приблизительно 37°C, далее дополняли FGF-18 в различных концентрациях (данные не показаны).
Пример 2: Получение ионо-чувствительных гелей (альгинатных)
Общие положения
Использовали альгинат натрия для получения ионо-чувствительного геля, поскольку в присутствии двухвалентных катионов, работающих как сшивающее средство между цепями полимера, таких как Ca2+, он способен формировать полимерную сеть, образуя гидрогель. Состав состоит из двух растворов, одного, содержащего полимер, и другого, содержащего ионы. При смешивании друг с другом растворы образуют гель.
Раствор кальция был одинаковым для гелей-плацебо и гелей с активным веществом и представлял собой раствор хлорида кальция CaCl2 в воде milliQ с концентрацией 10 мг/мл. В раствор жидкого полимера, в дополнение к альгинату, добавляли коллаген типа I и активную молекулу (в данном случае, сприфермин), а также сахарозу для коррекции величины осмоляльности. Раствор жидкого полимера с плацебо получали следующим образом: получали раствор сахарозы в воде milliQ с концентрацией 70 мг/мл и использовали для растворения альгината натрия с концентрацией или 3% масс. или 4% масс. при перемешивании. После растворения альгината, добавляли при перемешивании раствор коллагена типа I, растворенного в соляной кислоте и разведенного в воде milliQ до концентрации 30 мкг/мл или 60 мкг/мл, для того чтобы получить концентрацию коллагена в растворе жидкого полимера 1 мкг/мл или 2 мкг/мл, соответственно. Для получения жидкого раствора полимера с активным веществом, растворяли альгинат в концентрации 3% масс. или 4% масс. в растворе сахарозы в воде milliQ с концентрацией 70 мг/мл, содержащем сыпучий FGF-18 с концентрацией 54 мкг/мл. Затем эту же процедуру повторяли для плацебо с последующим добавлением коллагена типа I. Гели получали при смешивании жидкого раствора полимера с раствором кальция в соотношении 2:1 (объем:объем). Перед дальнейшим определением характеристик гели инкубировали при 37°C в течение 30 минут.
Предварительный скрининг составов с плацебо:
После проверки того, что физиологического количества ионов недостаточно для того чтобы способствовать процессу гелеобразования, в качестве сшивающего средства был выбран двухвалентный катион Ca2+ в форме хлорида кальция. Для того чтобы избежать использования кальция, который возможно ответственен за нежелательное явление кальцификации, также тестировали хлорид магния, но попытка оказалась менее удачной.
Затем проводили скрининг возможных составов и выбирали предварительный состав с плацебо. Во время скрининга рассматривали и изменяли различные параметры, такие как концентрация альгината, концентрация CaCl2, соотношение между объемами растворов полимера и кальция, наличие других эксципиентов, таких как δ-лактон D-(+)-глюконовой кислоты, которая используется в качестве ингибитора при гелеобразовании, или САЧ, который добавляют к PBS для лучшей имитации физиологических условий. Выявлено, что присутствие САЧ или D-глюконовой кислоты не оказывает достоверного эффекта на полученный гель, и, таким образом, их удалили, чтобы избежать добавления бесполезных компонентов.
Также наблюдали, что оптимальная концентрация альгината среди тестируемых величин находилась в пределах от 2,5% масс. до 4,5% масс., и, в частности, от 3% масс. до 4% масс. Фактически, более низкие концентрации альгината, а именно 1% масс. или 2% масс., были неприменимы, поскольку не наблюдали завершенного гелеобразования. С другой стороны, слишком высокая концентрация альгината (5% масс.) приводила к очень вязкому жидкому раствору полимера, с которым очень трудно работать.
Выбранный предварительный состав с плацебо состоял из жидкого раствора альгината с концентрацией 3% масс. в воде и раствора кальция в виде CaCl2 с концентрацией 10 мг/мл в PBS в соотношении 2:1 (об:об).
Добавление FGF-18
Для получения состава с активным веществом, проводили тесты с добавлением FGF-18 в два раствора. Во всех последующих тестах соотношение между двумя растворами сохраняли постоянным на уровне 2:1 об/об раствора альгината к раствору кальция. Добавление FGF-18 к раствору альгината вызвало явление осаждения, видимое при визуальном наблюдении. В качестве возможного раствора, растворяли альгинат в буфере PBS, содержащем 0,25 г/л поверхностно-активного вещества F68. Осаждение, однако, все еще происходило. Чтобы преодолеть этот недостаток, FGF-18 добавляли к буферу перед растворением альгината. Таким образом, избежали осаждения в растворе полимера, и белок был гомогенно распределен, но физическая консистенция полученного геля выглядела нарушенной, по сравнению с плацебо, приготовленным на воде. Кроме того, все равно было обнаружено микроскопическое осаждение при анализе остаточной жидкой фазы после образования геля. Дальнейшие исследования подтвердили, что осаждение вызвано взаимодействием между CaCl2 и PBS, вероятно, приводящему к образованию фосфата кальция. По этой причине, PBS был удален как из жидкого раствора полимера, так и из раствора кальция, и в качестве растворителя использовали только воду milliQ.
Оптимизация состава
Рассматривали повышение концентрации альгината до 4% масс. для получения гелей с более плотным размером ячеек. Это должно придавать материалу способность более длительной устойчивости in vivo и наделить более длительным удержанием инкапсулированного белка. Также исследовали уменьшение содержания кальция для снижения возможных побочных эффектов: было обнаружено, что минимальное необходимое количество для получения геля при сохранении неизменными всех других параметров составило 4 мг/мл. Поскольку смешивание растворов кальция и полимера приводит к немедленному образованию геля, невозможно измерить pH и осмоляльность конечного состава. Таким образом, осмоляльность жидкого раствора полимера корректировали до уровня ~300 мОсм/кг с использованием 70 мг/мл сахарозы. Эта добавка приводила к изменению в образовании геля, с остаточной жидкой фазой, которую не наблюдали в отсутствие сахарозы. Была выдвинута гипотеза, что сахароза вмешивается в образование геля за счет взаимодействия или с альгинатом, или с кальцием. Таким образом, снова установили концентрацию кальция на уровне 10 мг/мл, что привело к образованию геля без остаточной жидкости и осадка.
Измеряли pH раствора полимера, получили значение 7,0. Раствор кальция показал значение pH 5,3 и осмоляльность приблизительно 170 мОсм/кг.
Количество белка, загруженного в жидкий раствор полимера, было установлено на уровне 54 мкг/мл.
Наконец, добавляли коллаген типа I к раствору жидкого полимера для улучшения способности геля к прорастанию клеток, как описано у Rayatpisheh et al. (2011). Тестировали две различных концентрации, 1 и 2 мкг/мл, в соответствии с литературными данными (Tsai et al., 1998).
В конце этого предварительного скрининга, выбрали четыре кандидатных состава. Для всех составов, раствор кальция состоял из 10 мг/мл хлорида кальция в воде MilliQ, в то время как растворы полимера отличались по содержанию альгината и коллагена типа I, как показано в таблице 1.
Все эксперименты проводили с использованием легкодоступного альгината натрия, предоставленного Sigma Aldrich. В последней части исследования альгинат натрия имел те же самые характеристики, но был сертифицирован как имеющий фармакологическую степень чистоты (ФЧ) и был приобретен у FMC BioPolymer Keltone. Затем четыре кандидатных состава были заново приготовлены с использованием альгината ФЧ, и их сравнивали с составами не ФЧ, получая сравнимые результаты в отношении визуального наблюдения. Гели, полученные с альгинатом ФЧ и не ФЧ, также сравнивали по их набуханию и механическим свойствам.
Предполагается, что хотя эксперименты проводили с хлоридом кальция, аналогичные результаты могут быть получены с любыми другими дикатионными солями, такими как магниевая соль, соль меди или соль цинка.
Пример 3: Получение температуро-чувствительных гелей (хитозановых)
Общие положения
Для скрининга хитозановых составов, препараты жидких растворов полимера были сделаны из трех различных хитозанов: 95% степени деацетилирования (СД) с высокой молекулярной массой (ВММ), 95% СД с низкой ММ (НММ) и 75% СД с высокой ММ (ВММ). Жидкие растворы полимера получали, постепенно добавляя хитозан к 0,1N раствору уксусной кислоты при интенсивном перемешивании или при 5°C или при 25°C. Количество полимера рассчитывали таким образом, чтобы получить конечную концентрацию полимера в жидком растворе полимера, равную 1% масс., 1,5% масс. или 2% масс. После полного растворения хитозана добавляли раствор KH2PO4 с концентрацией 10 мМ, 100 мМ или 500 мМ в воде milliQ при перемешивании для получения конечной концентрации в жидком растворе полимера 1 мМ, 10 мМ или 50 мМ. Наконец, добавляли раствор β-Глицерофосфата (β-GP) в концентрации 20% масс. в воде milliQ для того чтобы скорректировать pH конечного жидкого раствора до величины 6,0, 6,5 или 7,0. Конечная концентрация β-GP в жидком растворе полимера находилась в диапазоне от 0,5% масс. до 7% масс., для принятых составов. Не всегда было возможно достигнуть желаемого значения pH,поскольку было необходимо очень большое количество β-GP, что приводило к превышению заданного значения осмоляльности 350 мОсм/Кг или получению геля уже при комнатной температуре. Жидкие растворы полимера, при необходимости, инкубировали затем при 37°C до образования геля. Измеряли осмоляльность всех проверенных составов, удаляя составы с осмоляльностью выше, чем 350 мОсм/Кг, т.е. составы с конечными концентрациями β-GP выше, чем 2,5% масс.
Предварительный скрининг составов с плацебо:
Температуро-чувствительные гели основаны на полимерном материале, который подвергается переходам раствор-гелеобразование (золь-гель) при изменении температуры местного окружения. Описано, что хитозан способен подвергаться переходам золь-гель при изменениях температуры, но на процесс сильно влияет молекулярная масса (ММ) полимера, его степень деацетилирования (СД), концентрация полимера в растворе, температура, время и скорость смешивания при растворении полимера, конечный pH раствора и присутствие других эксципиентов.
Таким образом, требовался исчерпывающий скрининг различных возможных комбинаций. Следует заметить, что хитозан может быть растворен только в воде при кислом pH. Повышение pH приводит к его агрегации и осаждению. Способом преодоления этой проблемы является использование β-GP для повышения pH с одновременным сохранением хитозана в растворе.
Исследование вначале было сосредоточено на высокомолекулярном хитозане с 75% СД. Получали несколько жидких растворов полимера в 0,1N соляной кислоте, отличающихся по конечной концентрации хитозана, от 1% масс. до 2,5% масс., конечной концентрации β-GP, от 1,6% масс. до 50% масс. (1,6, 5, 5,6, 8, 30, 50%), различным эксципиентам, а именно, желатин, глюкозамин, гиалуроновая кислота, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза, трегалоза, и различным конечным значениям pH, от 6,0 до 7,0. Описано, что эти эксципиенты играют роль в индукции образования геля (Cheng et al., 2010; Schuetz et al., 2008; Yan et al, 2010).
Только один из исследованных составов был способен к образованию геля при 37°C после 5 минут инкубации, но количество β-GP было выше, чем 8% масс., которое описано в литературе как предел, выше которого наблюдается цитотоксичность (Ahmadi et al., 2008). Таким образом, все последующие составы получали с учетом этого ограничения. Скрининг продолжили с хитозаном с большей величиной СД. Первые испытания проводили на основе низкомолекулярного хитозана с 95% СД. Растворы полимера получали всегда в 0,1N соляной кислоте, растворяя полимер при интенсивном перемешивании при 5°C или при 25°C.
После полного растворения полимера, добавляли остальные эксципиенты, добавляя β-GP только в конце. β-GP отвечал за увеличение значения pH, а затем, способствовал процессу гелеобразования. Первые испытания были сосредоточены на составах, на основе только хитозана и β-GP в различных сочетаниях относительных концентраций. Наблюдали, что при использовании высоких концентраций хитозана (2% или 3% масс.) и высоких концентраций β-GP (8% масс.), образование геля происходит уже при комнатной температуре, и в некоторых случаях также при 5°C.
При снижении концентрации любого из компонентов, состав остается жидким, даже после долгой инкубации при 37°C. Только в одном случае было отмечено образование геля, но через 2 часа инкубации при 37°C, слишком долгое время для целей этого исследования. Таким образом, для улучшения состава было необходимым добавление эксципиента. Выбрали гидроксиэтилцеллюлозу (ГЭЦ) как наиболее подходящий эксципиент и проводили дальнейший скрининг. Во время этой оценки, концентрация хитозана находилась в диапазоне от 1,5% масс. до 2% масс. и начальная концентрация ГЭЦ составляла 0,5% масс., но в этих условиях, раствор полимера становился гелем даже при комнатной температуре во время добавления β-GP, если его концентрация была выше 1,8% масс. Жидкий раствор, способный становиться гелем при 37°C после 13 минут инкубации, получили со следующей композицией: 1,5% масс. хитозана, 0,5% масс. ГЭЦ и 1,7% масс. β-GP.
Оптимизация состава
В попытке улучшить этот состав, были проведены следующие испытания, сохраняющие концентрацию β-GP почти постоянной на уровне значений 1,65-1,7% масс., концентрация хитозана варьировала от 1,5% масс. до 1,8% масс. и количество ГЭЦ постепенно снижали до 0,1% масс.
При помощи этой стратегии выбрали несколько кандидатных составов. Однако исследование в этом направлении не продолжали, поскольку было выявлено, что эксципиент ГЭЦ может содержать загрязнитель, описанный как цитотоксическое вещество, и, с другой стороны, ответственный за изменение процесса гелеобразования в присутствии хитозана (Hoemann et al., 2007). Остальные эксципиенты, которые были протестированы в предыдущих экспериментах, такие как желатин или глюкозамин, не дали положительных результатов.
Затем начали работу по заключительному скринингу, с использованием трех типов хитозанового полимера, которые отличались по молекулярной массе и СД: высокомолекулярный хитозан с 75% СД, высокомолекулярный хитозан с 95% СД и низкомолекулярный хитозан с 95% СД. Также планировали работу на низкомолекулярном хитозане с 85% СД, но этот материал не был доступен до конца исследования. В этой работе каждый хитозан тестировали в трех установленных концентрациях, 1, 1,5 и 2% масс., и получали растворы полимера таким образом, чтобы конечные значения pH составляли 6,0, 6,5 и 7,0. Для того чтобы уменьшить количество β-GP, который использовали для повышения значения pH раствора, полимер растворили в 0,1N уксусной кислоте, вместо 0,1N HCl, использованной в предыдущих экспериментах. Также наблюдали за осмоляльностью конечного раствора и сохраняли ее ниже значения ~350 мОсм/кг. Таким образом, удаляли составы, которые требовали слишком большого количества β-GP для достижения желаемого pH, что приводило также к слишком высокому значению осмоляльности. В этих скрининговых тестах также исследовали вклад ионной силы, поскольку было описано, что присутствие солей может вносить положительный вклад в процесс гелеобразования (Filion et al., 2007).
Поскольку следует избегать натриевых солей из-за возможных взаимодействий с белком, выбрали KH2PO4 и добавили к раствору полимера в конечной концентрации 1 мМ, 10 мМ или 50 мМ. Хитозан с 75% СД не дал положительных результатов и был полностью исключен. Также ВММ хитозан с 95% СД не дал положительных результатов: концентрации хитозана выше, чем 1% масс. требуют слишком большого количества β-GP для достижения установленных значений pH, что приводит к превышению установленного значения осмоляльности, и составы с 1% масс. не способны к формированию геля при 37°C. Два кандидатных состава выбирали из НММ хитозана с 95% СД, поскольку они проходят через переход золь-гель при 37°C, но получение этих растворов полимера было совершенно не воспроизводимо. Фактически, наблюдали, что время, необходимое для получения геля и физические макроскопические характеристики жидких растворов полимера значительно меняются в зависимости от времени, потраченного на растворение полимера, от скорости смешивания во время растворения полимера и во время смешивания эксципиентов и, наконец, от температуры и объема приготовленного раствора.
Такая высокая вариабельность результатов привела к решению прекратить исследования этого полимера.
Пример 4: Время гелеобразования и температура
Все составы, исследованные в этой работе, были спланированы для использования в качестве гелей, образующихся in situ. Таким образом, важным требованием было быстрое время гелеобразования, как для ионо-, так и для температуро-чувствительных гелей. Это было особенно важно для выявления состава с хорошими гелеобразующими свойствами, но у которого процесс гелеобразования не слишком быстрый (позволяет сделать инъекцию) и не слишком медленный (нет риска потери материала). Время гелеобразования определяли тестом на переворачивание: растворы переворачивали вверх ногами и считали гель сформировавшимся, когда не наблюдали вытекания жидкости.
Составы на основе ионов
В случае составов на основе альгината, на процесс гелеобразования влияет концентрация раствора кальция и относительное соотношение между растворами кальция и альгината. Гели получали в стеклянных чашках Петри, добавляя сначала раствор альгината и, затем, раствор кальция, и пытаясь гомогенизировать два раствора насколько возможно. Если количество хлорида кальция было недостаточным, образования геля не наблюдали, даже после инкубации при 37°C в течение длительного времени. При увеличении количества сшивающего средства (кальция) и коррекции соотношения раствор полимера: раствор кальция, гель формировался практически мгновенно, сразу же, как только два раствора смешивали друг с другом. В некоторых случаях, наблюдали остаточную жидкую фазу. Время, необходимое для полного исчезновения жидкости после инкубации при 37°C, считали временем гелеобразования.
Время гелеобразования варьировало от 5 минут до 2 часов, и, в некоторых случаях, не удалось достичь полного исчезновения жидкости. Гелеобразование происходило быстрее с жидким раствором полимера с 4% масс. концентрацией альгината, чем с 3% масс. Добавление коллагена типа I не оказало никакого влияния на время гелеобразования. Результаты обобщены в таблице 2. Два кандидатных состава с 4% масс. концентрацией альгината в растворе полимера показали время гелеобразования 5 минут, в то время как два кандидата с 3% масс. раствора полимера продемонстрировали полное гелеобразование за 15 минут.
Важно, что когда гели формировали при помощи шприца с разъемом, который позволяет производить одновременную инъекцию двух растворов, не наблюдали остаточной жидкой фазы ни при какой концентрации полимера. Фактически, вытекающая из контекста инъекция двух растворов позволяет более быстро и более гомогенно смешивать два потока, приводя к мгновенному гелеобразованию.
Предполагается, что хотя эксперименты проводили с хлоридом кальция, аналогичные результаты могут быть получены с любыми другими дикатионными солями, такими как магниевая соль, соль меди или соль цинка.
Составы на основе температуры
Температуро-чувствительные гели были разработаны, чтобы быть жидкими при комнатной температуре во время этапа приготовления и обработки и становиться гелем после инъекции, то есть при 37°C в физиологических условиях. Проводили тест переворачиванием, инкубируя различные составы на основе хитозана при 5°C, 25°C и 37°C для наблюдения за временем гелеобразования как функции температуры. Результаты обобщены в таблице 3.
В зависимости от концентраций хитозана и β-GP, процесс существенно менялся. При использовании растворов, слишком концентрированных по β-GP, гелеобразование происходило уже при комнатной температуре, во время получения жидкого раствора. По этой причине, было важным не только оптимизировать состав, изменяя концентрации компонентов, но также растворять и смешивать все ингредиенты при 5°C и, затем, инкубировать жидкий раствор при 37°C. После соответствующей оптимизации, описанной в примере 3, образование геля при 37°C происходило через 15 минут, но было выявлено, что результат был невоспроизводимым. В частности, наблюдали, что на время гелеобразования влияли скорость и продолжительность смешивания, необходимые для растворения хитозана и смешивания его с другими компонентами.
Пример 5: Механические свойства
Гидрогели представляют собой группу полутвердых материалов, сделанных из сетей гидрофильного полимера с высокой способностью удержания воды. В основном, гидрогели имеют механические характеристики промежуточного соединения между вязкими жидкостями и упругими твердыми материалами (вязкоупругие свойства) (Anseth et al., 1996). Важно, что их механические свойства определяют и измеряют в условиях, которые напоминают мишень в окружении in vivo.
Динамические механические анализы способны охарактеризовать вязкоупругое поведение гидрогелей, которое отражает объединенные вязкие и упругие реакции при применении колебательного напряжения (как правило, сдвига). Вязкоупругие материалы характеризуются динамическим модулем упругости, G', и модулем потерь или модулем вязкости, G'', которые дают измерение вклада упругости и вязкости в динамическое поведение при напряжении-деформации, соответственно.
Гидрогели определяют, в реологических терминах, как вязкоупругие материалы, у которых G'>G'' и как G', так и G'' независимы от частоты колебаний (Peppas et al., 2000). В частности, чем выше G', тем выше прочность гидрогелей, и чем больше разница между G' и G'', тем меньше жидкоподобного поведения по сравнению с поведением, присущим твердым материалам. В этом разделе мы описываем исследование вязкоупругих свойств альгинатных гидрогелей путем тестов развертки по частоте с использованием реометра с конической геометрией (см. экспериментальный раздел). В тестах развертки по частоте прикладывают колебательное напряжение сдвига в диапазоне частот (0,1-100 рад/сек). Затем строят график зависимости G’ и G'' от частоты.
На фигуре 1 представлены результаты развертки по частоте для гелей с 3% масс. альгината, с различным содержанием коллагена (0, 1, 2 мкг/мл) в растворе альгината и с различным содержанием FGF-18 в растворе альгината (0, 54, 540 мкг/мл). Все образцы анализировали после 30 минут инкубации при 37°C после добавления раствора кальция. Измерения с концентрацией FGF-18 540 мкг/мл в растворе альгината были сделаны для исследования того, может ли десятикратное повышение концентрации белка повлиять на внутреннюю структуру материала.
Как видно, все образцы демонстрировали типичное поведение гелей, показывая G’>>G'', обе величины независимы от угловой частоты. Значения G’ для всех образцов находились в пределах приблизительно от 300 до 400 Па. Эти различия в G' не указывают на существенные различия в упругом ответе этих материалов. Это означает, что низкая концентрация коллагена в составе (1 или 2 мкг/мл) не влияет на механические свойства геля в нулевой временной точке. В любом случае, он может способствовать более высокой стабильности геля после инкубации, как будет показано в следующем разделе.
Также важно отметить, что присутствие FGF-18 не влияет на механические свойства материала ни при 54, ни при 540 мкг/мл в растворе альгината. Фактически, никаких значимых отличий или тенденций не может быть выявлено между плацебо и гелями с активным веществом с двумя различными концентрациями белка. Это важный параметр, поскольку позволяет получать составы с FGF-18 с широким диапазоном концентраций белка в растворе альгината (0-540 мкг/мл) без ухудшения свойств матрицы.
На фигуре 2 представлены результаты, полученные на кандидатах с 4% масс. альгината, соответствующие плацебо и плацебо без коллагена. Также в этом случае, все образцы демонстрировали типичное поведение гелей с G’>>G'', обе величины независимы от угловой частоты. Снова не было заметно никакого влияния коллагена и FGF-18, или при 54, или при 540 мкг/мл в растворе альгината, все значения G’ находились в пределах приблизительно от 380 до 500 Па. Можно было ожидать, что более высокая концентрация альгината будет приводить к более высокой частоте поперечных связей и, таким образом, модулю упругости, G’. Вместо этого, зарегистрированное различие не было явно выражено.
Во любом случае, важно подчеркнуть тот факт, что раствор кальция, добавленный к растворам с 3% масс. и 4% масс. альгината, был одинаковым. Это означает, что раствор с 3% масс. альгината подвергался действию более высокой относительной концентрации линкера для перекрестной сшивки, которая может даже привести к более плотной сети в зависимости от перегруппировок полимерных цепей в растворе.
В конце исследования стал доступен альгинат фармакологической степени чистоты (Pharma Grade, ФЧ). Для того чтобы убедиться, что степень чистоты альгината не влияет на структуру гелей, тесты развертки по частоте проводили также на гелях на основе альгината ФЧ. Результаты показаны на фигуре 3 и фигуре 4.
Результаты, полученные для альгината ФЧ, были полностью сопоставимы с результатами для альгината не ФЧ. Единственное различие заключалось в немного более широком разбросе результатов для обоих гелей, с 3% масс. и 4% масс. Это может быть связано с небольшой разницей в молекулярно-массовом распределении сырья, несмотря на то, что технические паспорта альгината ФЧ и не ФЧ описывают одинаковые технические характеристики.
В любом случае, снова нельзя было заметить конкретной тенденции или заметных различий между системами с 3% масс. и 4% масс., и немного более высокие значения G’, которые наблюдали для систем с 4% масс., были подтверждены также для сырья ФЧ.
Пример 6: Параметры набухания
Типичным параметром, который необходимо оценивать для гидрогелевых материалов, является их способность набухать или сжиматься в присутствии жидкости. Исследование проводили для того чтобы предсказать поведение материала после введения в условиях in vivo, где он будет находиться в контакте с физиологической синовиальной жидкостью.
Исследование проводили только на гелях на основе альгината, приготовленных согласно примеру 2, поскольку составы с хитозаном исключили, как объяснено в примере 3. Таким образом, четыре кандидатных геля на основе альгината инкубировали при 37°C в контакте с ИСЖ и наблюдали за их характеристиками в течение 30 суток (см. «анализ параметров набухания» в разделе Способы).
На фигуре 5 описаны параметры набухания через 1 месяц для четырех кандидатных гелей на основе альгината, как для гелей плацебо, так и для гелей с активным веществом. В качестве образца для сравнения, также тестировали те же самые гели без коллагена типа I для исследования его влияния на структурные характеристики гелей. Эти результаты показаны на фигуре 6. Фигуры 5 и 6 относятся к альгинату не фармакологической степени чистоты (не ФЧ).
В обоих случаях, чем выше была концентрация альгината, тем выше была степень набухания. Такое поведение, по-видимому, отличается от результатов, полученных путем реологических измерений. В частности, более высокие концентрации полимера должны формировать более плотную сеть, что, в свою очередь, как правило, связано с более низкой способностью поглощать водные растворы. Кстати, следует отметить, что концентрацию Ca2+ поддерживали на постоянном уровне, и, таким образом, соотношение между полимером и сшивающим средством изменялось за счет изменения концентрации полимера. Более низкая доступность перекрестно-сшивающего агента может приводить к образованию областей, где полимер не является перекрестно-сшитым, позволяя воде проникать без труда. Это могло бы объяснить различия в степенях набухания между кандидатами с 3% масс. и 4% масс. альгината, и было подтверждено изображениями СЭМ, показанными в следующем разделе.
Сравнение между фигурой 5 и фигурой 6 показывает, что присутствие коллагена типа I оказывает влияние на характеристики набухания, особенно в отношении кинетики. В то время как в отсутствие коллагена все гели увеличивают свою массу монотонно в течение приблизительно 15 суток и, затем достигают плато, присутствие коллагена, независимо от концентрации, приводит к синусоиде. Первое плато, достигаемое через 2 суток в присутствии коллагена, указывает на равновесное набухание, соответствующее максимальному количеству воды, которое гель способен удержать. Это значение было ниже, чем соответствующие значения степени набухания в отсутствие коллагена, указывая на более плотную структуру гелей, как и ожидалось после добавления коллагена. Последующее увеличение степени набухания через 15 суток инкубации указывает на начало феномена эрозии сети, с последующим поглощением раствора ИСЖ, поскольку сеть стала более свободной. Затем было достигнуто второе плато через 24 дня и сохранялось до конца периода наблюдения в 1 месяц. Дальнейшая эрозия сети, как и ожидалось, привела к дополнительной массе, таким образом, произошло увеличение степени набухания с последующим снижением, пока не произойдет полная эрозия. В отсутствие коллагена (фигура 6) наблюдали постоянное увеличение степени набухания с последующей медленной эрозией. Такое поведение, вероятно, связано с одновременной эрозией и захватом воды из-за более слабой структуры гелей.
Как уже упоминалось, не было зарегистрировано никаких различий между гелями, полученными с 1 или 2 мкг/мл коллагена типа I в растворе полимера.
Интересно, что также не наблюдали никаких различий между гелями плацебо и гелями с активным веществом. Это позволило предположить, что конечная концентрация FGF-18 в гелях, 36 мкг/мл, не влияет на внутреннюю структуру материала. Эксперименты повторили с этими же составами, на этот раз приготовленными с использованием альгината ФЧ, и результаты представлены на фигуре 7.
Как видно, результаты полностью сопоставимы с результатами для альгината не ФЧ, единственное отличие заключается в более низком отклонении между степенями набухания гелей с 3% масс. и 4% масс. альгината по сравнению с материалом не ФЧ. Эксперимент проводили в течение 50 суток для гелей с 4% масс., которые продемонстрировали ожидаемое поведение, т.е. снижение массы после второго плато, указывающее на медленную непрерывную эрозию.
Пример 7: Анализ при помощи сканирующей электронной микроскопии (СЭМ)
Изображения СЭМ получали для исследования микроскопической структуры материала после формирования геля. Анализ проводили на свежеприготовленных, а затем лиофилизированных гелях.
Сравнение образцов с наличием и отсутствием коллагена типа I при обеих концентрациях полимера, представленное на фигуре 8, выявило, что коллаген не оказывал достоверного эффекта на микропористость гелей с 3% масс. альгината и оказывал очень слабый эффект на гели с 4% масс., что проявлялось в слегка более плотной структуре при добавлении коллагена, 1 или 2 мкг/мл.
Из микрофотографий очевидно различие в пористости между двумя материалами, гель с 4% масс. альгината показывает полости большего размера, чем гель с 3% масс.. Это снова можно объяснить тем фактом, что относительная концентрация перекрестно-сшивающего линкера была выше в составе с 3% масс. альгината, чем в случае 4% масс. Это может приводить к более плотной структуре гелей с 3% масс.
Эти изображения находятся в соответствии с результатами набухания и в очевидном противоречии с анализом механических свойств. Фактически, полости большего размера, присутствующие в гелях с 4% масс. объясняют более высокую наблюдаемую степень набухания по сравнению с 3% масс. С другой стороны, чуть более высокий модуль упругости, G', наблюдаемый для 4% масс., можно объяснить присутствием не сшитых или слабо сшитых цепей альгината в больших порах, что в любом случае вносит вклад в G'.
Пример 8: Исследование высвобождения in vitro
Исследование высвобождения in vitro проводили в контексте теста на набухание, собирая принимающую фазу из каждой лунки в каждый определенный момент времени. Все образцы, полученные из гелей на основе альгината с активным веществом, анализировали путем обратно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ). Кроме того, выбранные образцы также анализировали посредством Biacore, более специфичного и чувствительного аналитического способа, в попытке найти подтверждение результатов, полученных при ОФ-ВЭЖХ.
Перед началом этого эксперимента оценивали осуществимость теста. В частности, была исследована возможность получения FGF-18 в системе лунок планшета. Фактически из предыдущих исследований известно, что белок имеет тенденцию налипать на различные пластиковые материалы, такие как полистирол, и мембраны. Получение известного количества FGF-18 оценивали при различных экспериментальных условиях. Исследовали возможные положительные влияния от присутствия поверхностно-активного вещества F68 и/или предварительной обработки лунок концентрированным раствором САЧ или FGF-18. Эксперимент проводили, добавляя раствор FGF-18 с концентрацией 500 мкг/мл во вставки и в каждую лунку в следующие растворы:
- a) раствор 1% масс. САЧ в PBS,
- b) раствор 1% масс. САЧ в PBS +F68,
- c) и d) аналогично a) и b), но с предварительной обработкой лунки концентрированным раствором САЧ,
- e) и f) аналогично a) и b) но с предварительной обработкой лунки концентрированным сыпучим FGF-18.
После инкубации при 37°C в течение 16 часов, анализировали фазы в лунках и во вставках, и выход составил приблизительно 75% для всех образцов. Таким образом, ни одна из стратегий для улучшения тестов не имела значительного положительного эффекта, поскольку выход был сопоставимым. Высвобождение in vitro затем проводили с использованием раствора с 1% масс. САЧ в PBS с 0,25 г/л F68 в качестве принимающей фазы.
Эксперименты проводили, продолжая инкубировать гели в течение 30 суток. FGF-18 не определялся ни в одной из собранных фракций ни при ВЭЖХ, ни при Biacore. Это позволяет предположить, что белок был заключен в матрицу геля в течение периода наблюдения.
Эти результаты были ожидаемыми, с учетом сильного взаимодействия, происходящего между FGF-18 и альгинатом. Фактически, принимая во внимание структуру двух молекул, вероятно, происходят и ионные и гидрофобные взаимодействия. Кроме того, FGF-18 представляет собой гепаринсвязывающий белок, демонстрирующий высокоэнергетические вторичные взаимодействия с гепарином. Альгинат представляет собой природный углевод с молекулярной структурой, сходной с гепарином, таким образом, вполне вероятно, имеет место сильное вторичное взаимодействие между двумя макромолекулами.
Для того чтобы это подтвердить, проводили эксперименты по разделению, которые показали, что только хроматографические колонки для гидрофобной хроматографии взаимодействия или покрытые гепарином были способны отделить FGF-18 от альгината.
Пример 9: Анализ прорастания клеток in vitro
Введение FGF-18 в составах, способных создавать трехмерную структуру после инъекции, как в случае с гидрогелями на основе альгината, имеет целью локализовать активную молекулу (активный фармацевтический ингредиент, АФИ) в месте инъекции. В то же время, состав создает каркас, на котором может быть закреплен растущий хрящ. По этой причине, важным требованием для выбранного геля на основе альгината является совместимость материала с хондроцитами и способность клеток прорастать в него. Таким образом, проводили исследование на прорастание клеток, цитотоксичность и хемотаксические свойства альтернативных составов на основе образования in situ гидрогелей, нагруженных FGF-18.
Анализ прорастания клеток in vitro проводили с двумя клеточными линиями хондросаркомы, хондрогенной мыши ATDC5 и клеточной линией хондросаркомы человека CRL-7891, которые широко используются для изучения поведения хондроцитов. Эксперименты проводили на гелях, приготовленных из жидких растворов с 3% масс. или 4% масс. альгината, содержащих 0, 1 или 2 мкг/мл коллагена типа I и 54 мкг/мл FGF-18.
Прорастание клеток контролировали через 24, 48, 72 и 144 часа инкубации. Удаляли гель из лунки и делали срез, помещали на стекло и наблюдали в микроскоп Axiovert 200 с объективом Zeiss A-Plan 10×/0,25. Таким образом, было возможно анализировать сечение геля и локализовать клетки на различном уровне глубины проникновения. Получали изображения и обрабатывали программным обеспечением AxioVision 4.2. Некоторые образцы анализировали также при помощи конфокальной лазерной сканирующей микроскопии (КЛСМ), с использованием FV10 Olympus, доступного на ограниченный период для демо-использования. Для этих экспериментов, гели обрабатывали раствором родамина B в PBS с концентрацией 0,2 мкг/мл, добавляли к среде в лунку за час до анализа. Родамин B применяли для окрашивания клеток, которые затем визуализировали, облучая образцы лазером с длиной волны 553 нм.
Прорастание клеток в гели на основе альгината с жидким раствором полимера с 3% масс. или 4% масс., с добавлением или без добавления коллагена, наблюдали через 24, 48, 72 и 144 часов. В каждый момент времени, делали срез геля для наблюдения за сечением геля (данные не показаны). Первое наблюдение выявило хорошую совместимость составов с клетками, поскольку гели на основе альгината, по-видимому, не токсичны для обеих клеточных линий, которые показали сравнимое поведение, даже будучи полученными от различных видов (мышь и человек).
В составах с гелями с 4% масс. альгината, внутри геля было обнаружено больше клеток и скоплений клеток.
Отличающееся поведение можно наблюдать для гелей с 4% масс. альгинатом, содержащих 2 мкг/мл коллагена типа I. По сравнению с другими составами в гель прорастало больше клеток. Кроме того, клетки не создавали скопления, но, по-видимому, хорошо распределялись по гелю в виде одиночных и четко разделенных клеток. Этот аспект, по-видимому, показывает, что они находились в здоровых условиях. Наконец, наблюдали, что они проникают в матрицу геля с течением времени. Сравнивая гели с 4% масс. с 2 мкг/мл и без коллагена, наблюдали, что прорастание было более быстрым и более гомогенным в присутствии коллагена (см. фигуру 9). Анализ, проводимый при помощи КЛСМ, подтвердил способность клеток прорастать в матрицу геля.
Пример 10: Тест на модели на животных ex vivo
Терапия на основе этих альгинатных составов может быть соединена со стратегией микропереломов. Таким образом, для того чтобы доказать совместимость гелей с этим способом было необходимо провести предварительное исследование на модели на животных ex vivo, и для этой цели использовали колено коровы.
Эксперименты проводили на кандидатном геле с 4% масс. альгината с 2 мкг/мл коллагена типа I. Этот гель выбирали среди других кандидатов, поскольку он показал наиболее обещающие результаты в отношении прорастания клеток, показанные выше.
Делали отверстия в верхней части большеберцовой кости и нижней части бедренной кости с одинаковым размером, характерным для хирургического микроперелома (1 см глубина и 4 мм диаметр). Отверстия затем заполнили кандидатным гелем путем инъекции при помощи шприца с разъемом, смешивая раствор альгината и раствор кальция во время инъекции, соответственно. Это позволяло мгновенно получить гомогенный гель без какого-либо явления вытекания. Инъекции проводили как в вертикальном, так и в перевернутом положениях, подтверждая, что в обоих случаях гель остается внутри отверстия и нет вытекания материала. Сустав также подвергали тряске и быстрым движениям, чтобы подтвердить, что гели были хорошо закреплены внутри отверстий и не наблюдается потери материала. Сустав с инъецированными гелями затем оценивали через 2 часа инкубации при 37°C: гель все еще заполнял отверстие целиком и, после удаления, имел слегка красный цвет, что указывает на то, что кровь, вытекающая после перелома, была абсорбирована гелем.
Эти предварительные результаты подтверждают применимость состава с альгинатом в стратегии микропереломов.
Пример 11: Биоанализ in vitro
Анализ клеточной пролиферации, проведенный, как описано в разделе Способы, показал, что FGF-18, удерживаемый в геле, является биоактивным с четкой кривой зависимости «доза-эффект», как показано на фигуре 10.
Заключение
Ионо-чувствительные гели получали из альгината натрия при добавлении хлорида кальция в качестве сшивающего средства, в то время как температуро-чувствительные гели получали из хитозана с добавлением β-GP для коррекции pH без какого-либо осаждения полимера.
Составы на основе альгината или хитозана тестировали с различными концентрациями полимера и рассматривали добавление других эксципиентов для коррекции pH и осмоляльности составов и, в некоторых случаях, для пользы процесса гелеобразования.
Результаты по времени гелеобразования показали, что гели на основе альгината обеспечивают чрезвычайно быстрое и воспроизводимое гелеобразование по сравнению с хитозаном. Таким образом, для дальнейшей разработки выбирали альгинатные гели.
Четыре кандидатных состава гелей выбирали для определения характеристик в отношении механических свойств, набухания, высвобождения in vitro и прорастания клеток, составы были образованы добавлением раствора хлорида кальция 10 мг/мл к раствору альгината, содержащего 3% или 4% масс. альгината, 1 или 2 мкг/мл коллагена типа I, 70 мг/мл сахарозы и 54 мкг/мл FGF-18. Соотношение объема раствора альгината к объему кальция составляло 2:1.
Концентрация коллагена или концентрация FGF-18, по меньшей мере, до 540 мкг/мл, не влияли на механические свойства кандидатных гелей. Это важная задача, поскольку целевая концентрация для FGF-18 в гидрогеле все еще не определена, что дает возможность формулировать FGF-18 в этих матрицах в широком диапазоне концентраций без ухудшения характеристик конечного геля. Никаких серьезных различий не наблюдали для модуля упругости, G' в гелях с 3% масс. и 4% масс. альгината, все представленные значения находились в пределах между приблизительно 300 и 500 Па, наибольшие значения были у гелей с 4% масс.
Все кандидатные гели показали одинаковые профили набухания, что указывает на одинаковые процессы гидратации и разрушения. Единственное различие было в абсолютных значениях, слегка выше для геля с 4% масс. альгината. Этот результат находится в соответствии с микрофотографиями СЭМ, которые свидетельствуют о большем размере пор для этих гелей.
Через 15 суток инкубации при 37°C в искусственной синовиальной жидкости все кандидаты показали начальный процесс разрушения, на что указывало увеличение массы. Фактически, начальное разрушение сети, как правило, приводит к ослаблению структуры, которая может, таким образом, накапливать большие количества воды. Через 1 месяц, непрерывное разрушение сети приводит к началу макроскопической эрозии геля, которая выражена в медленной потере массы. Кстати, через 50 суток наблюдения гели все еще не разрушились полностью, на что указывает присутствие некоторого количества геля внутри пористых вставок (величина степени набухания через 50 суток) (Lo Presti C. et al., 2011; Dang et al., 2011).
Был разработан анализ прорастания клеток. Гелевый состав, показавший наиболее многообещающие результаты прорастания клеток, содержал 4% масс. альгината и 2 мкг/мл коллагена. Этот состав, затем, выбирали для эксперимента ex vivo на адгезионныые свойства геля. Эти эксперименты ex vivo, проводимые на суставе коровы, показали, что кандидатный альгинатный гель можно вводить с использованием устройства для двойной инъекции растворов альгината и кальция, или в верхнем или в перевернутом направлении без какого-либо вытекания. Кроме того, показано, что гель идеально заполняет отверстия и прирастает к отверстиям в хряще, имитируя ситуацию с микропереломом (данные не показаны).
Анализы клеточной пролиферации показали, что FGF-18, удерживаемый в геле, является биоактивным с четкой кривой зависимости «доза-эффект». Поскольку через 50 суток наблюдения гели все еще не полностью разрушились, и поскольку эксперименты по высвобождению in vitro не показали никакого присутствия высвобожденного FGF-18 в искусственной синовиальной жидкости, это позволяет предположить, что FGF-18 будет оставаться в геле и, таким образом, будет, вероятно, более эффективным в долгосрочной перспективе воздействия на клетки, которые мигрировали в гель Таким образом, эти результаты являются перспективными.
Пример 12: Лиофилизированный состав
После получения жидкого раствора полимера, содержащего FGF18, сахар (сахарозу) и коллаген типа I (см. пример 2), раствор распределяли по флаконам. Каждый флакон (10 мл Fiolax Clear 45×24, SCHOTT forma vitrum) заполняли 2 мл жидкого раствора полимера. Все заполненные флаконы подвергались процессу лиофилизации. Подробно, в процессе предусмотрены следующие этапы:
- Фаза охлаждения от 25°C до -40°C в течение 1 часа, где начинается заморозка продукта;
- Фаза заморозки при -40°C в течение 4 часов, где продукт хранят замороженным;
- Фаза вакуума, с резким понижением давления до вакуума;
- Фаза первичной сушки с температурой, поднимающейся от -40°C до -10°C в течение 30 минут, а затем остающейся на -10°C в течение 10 часов;
- Фаза вторичной сушки с температурой, поднимающейся от -10°C до 21°C в течение 30 минут, а затем остающейся на 21°C в течение 34 часов;
- Фаза третичной сушки с температурой, поднимающейся от 21°C до 37°C в течение 16 минут, а затем остающейся на 37°C в течение 20 часов.
После того как процесс лиофилизации был завершен, флаконы закрывали пробками и хранили при 2-8°C.
Лиофилизированный продукт необходимо восстановить перед использованием для инъекции. Его было необходимо уравновесить при комнатной температуре, затем инъецировать 2 мл ВДИ (воды для инъекций) во флакон, который затем крутят и двигают, чтобы облегчить восстановление осадка. Оставляют систему для растворения и гомогенизации в течение 30 минут, после этого она готова для инъекции.
Лиофилизированный состав затем исследовали в течение трех месяцев на стабильность при 3 различных температурах: нормальные условия хранения при 5°C, при 25°C, представляющих ускоренную стабильность и при стрессовых условиях при 40°C. Анализ проводили через 0, 2, 4, 8 и 12 недель после восстановления образцов с 2 мл воды. Оценивали следующие параметры:
- pH;
- влагосодержание;
- содержание FGF18;
- содержание альгината;
- распределение ММ альгината;
- вязкость;
- механические свойства;
- способность к прорастанию клеток.
Ниже представлены основные результаты до 12 недель.
pH: Не было зарегистрировано никаких значительных изменений значения pH состава в течение времени инкубации при всех трех различных температурах. pH лиофилизированного состава был выше, чем жидкого (наиболее вероятно из-за процессов фильтрации и лиофилизации, которым он подвергался), но не менялся с течением времени. Данные, представленные на фигуре 12, указывают, что состав стабилен при нормальных условиях хранения вплоть до 12 недель.
Влагосодержание: Остаточное содержание влаги было всегда в пределах критерия приемлемости (3%). Значение было постоянным для состава, который хранили при 2-8°C, в то время как оно слегка повышалось со временем при 25°C после 12 недель инкубации, и даже больше при 40°C уже через 2 недели, как и ожидалось. Данные (см. фигуру 13) указывают на то, что состав стабилен при нормальных условиях хранения вплоть до 12 недель.
Содержание FGF18: Не наблюдали никаких значительных изменений в содержании FGF18 в составе с течением времени при всех трех различных температурах, с общим содержанием немного ниже, чем целевая концентрация 54 мкг/мл, наиболее вероятно из-за потери материала во время различных производственных этапов, и, в частности, во время фильтрации. Различия, которые наблюдали в разные моменты времени, возникали наиболее вероятно из-за вариабельности способа, который все еще находился в разработке, из-за того факта, что количество FGF18 было близко к пределу детекции способа, и также из-за вариабельности содержимого флакона, что было доказано также значительным стандартным отклонением результатов: фактически, высокая вязкость раствора не позволяла оперировать точно отмеренным объемом для заполнения в лабораторном масштабе. В основном, данные свидетельствуют о том, что состав стабилен при нормальных условиях хранения вплоть до 12 недель (см. фигуру 14).
Содержание альгината: Никаких значительных изменений не наблюдали в содержании альгината с течением времени при всех трех различных температурах. Наблюдаемые изменения были наиболее вероятно вызваны вариабельностью способа, который все еще находится в разработке, и вариабельностью содержимого флакона, поскольку вязкость раствора не позволяла производить точный процесс заполнения в лабораторном масштабе. Данные, в соответствии с фигурой 15, свидетельствуют о том, что состав стабилен при нормальных условиях хранения вплоть до 12 недель.
Распределение альгината по ММ: Никаких изменений не наблюдали на хроматографических профилях, и, таким образом, в общем молекулярно-массовом распределении полимера в составе с течением времени при всех трех различных температурах: пик указывал на широкое распределение ММ от более чем 870 кДа до приблизительно 40 кДа, с максимумом приблизительно на 520 кДа. Распределение ММ оценивали путем сравнения со стандартными образцами с хорошо известной ММ. Небольшое «плечо», выявленное в левой части пика, было приписано коллагену. Данные свидетельствуют о том, что состав стабилен при нормальных условиях хранения вплоть до 12 недель (данные не показаны).
Вязкость: Наблюдали небольшое снижение вязкости состава по сравнению с нулевой точкой времени в образцах, которые хранили при 25°C и 40°C, из-за условий ускоренного разрушения, в то время как никаких значимых отличий не наблюдали для образцов, которые хранили при нормальных условиях (2-8°C): наблюдаемые различия наиболее вероятно были связаны с вариабельностью способа и процессом заполнения. Данные свидетельствуют о том, что состав стабилен при нормальных условиях хранения вплоть до 12 недель (см. фигуру 16).
Механические свойства: лиофилизированный альгинатный состав, восстановленный водой в каждый момент времени исследования на стабильность, использовали для образования гидрогеля путем смешивания с раствором хлорида кальция. Были исследованы механические свойства полученного гидрогеля. Никаких изменений не наблюдали для динамического модуля упругости G' и, таким образом, для механических свойств с течением времени при всех трех различных температурах. Результаты, представленные на фигуре 17, свидетельствуют о том, что состав стабилен при нормальных условиях хранения вплоть до 12 недель.
Способность к прорастанию клеток: лиофилизированный альгинатный состав, восстановленный водой в каждый момент времени исследования на стабильность, использовали для образования гидрогеля путем смешивания с раствором хлорида кальция. Исследовали способность полученного геля к прорастанию клеток, инкубируя гидрогели с клетками в течение 72 часов, а затем анализируя образцы при помощи конфокальной лазерной сканирующей микроскопии. Никаких значительных изменений не наблюдали для числа живых клеток, способных проникать в матрицу гидрогеля с течением времени, при рассмотрении образцов, которые хранили при одинаковых температурных условиях (данные не показаны). В каждый момент времени, образцы, которые хранили при 40°C, показывали более высокое число проникающих клеток, чем образцы, которые хранили при 2-8°C, что свидетельствует о том, что хранение при высокой температуре вызвало частичное изменение матрицы полимера. Данные свидетельствуют о том, что состав стабилен при нормальных условиях хранения вплоть до 12 недель.
Заключение: лиофилизированный альгинатный состав показал хорошую стабильность при нормальных условиях хранения (2-8°C) вплоть до 12 недель, и, по-видимому, является, по меньшей мере, таким же стабильным, как и соответствующий жидкий состав.
Таблицы
Ссылки
1. Ellsworth et al., 2002, Osteoarthritis and Cartilage, 10: 308-320.
2. Shimoaka et al., 2002, JBC 277(9):7493-7500.
3. WO2008023063
4. WO2004032849
5. WO2012172072
6. Ringe J. Et al., 2012, Nature Reviews Rheumatology 8(8): 493-498.
7. C. Dispenza et al, 2011, Polym.. Chem., 2, 192).
8. J.K. Tessmar, A.M. Göpferich, 2007, Adv. Drug Delivery Rev. 59:274-291.
9. C. Lo Presti et al., 2011, Reactive & Functional Polymers, 71: 155-167.
10. WO2008063418
11. S.R. Van Tomme et al., 2008, Int. J. Pharm. 355: 1-18.
12. WO98/16644
13. WO2006/063362
14. Custers et al., 2007, Osteoarthritis and Cartilage, 15:1241-1248.
15. Rayatpisheh et al, 2011, J. Biomed. Mater. Res. 98A:235-244.
16. Tsai et al., 1998, Biotech. Techniques 12: 21-23.
17. Cheng et al., 2010, Tissue Engineering 16A:695-703.
18. Schuetz et al., 2008, Eur. J. Pharm.Biopharm. 68:19-25.
19. Yan et al., 2010, J.Biomat. Appl. 24:625-637.
20. Ahmadi et al., 2008, J. Biomed. Mater. Res. 86A:824-832.
21. Hoemann et al., 2007, J. Biomed. Mater Res. 83A:521-529.
22. Filion et al. 2007, Biomacromol. 8:3224-3234.
23. Anseth et al., 1996, Biomaterials 17:1647-1657.
24. Peppas et al.,2000, Eur. J. Pharm. Biopharm. 50:27-46.
25. Dang et al., 2011, Carbohydrate Polymers 83: 171-178.
26. WO2012113812.
Реферат
Группа изобретений относится к лечению заболеваний хрящевой ткани, таких как остеоартрит или повреждение хрящевой ткани. Двухкомпонентная система гелеобразования содержит первый компонент, включающий FGF-18, альгинат, коллаген и сахар в качестве стабилизатора, и второй компонент, включающий дикатионную соль. Также раскрыты способ получения двухкомпонентной системы гелеобразования и промышленное изделие для двойной инъекции. Группа изобретений обеспечивает гелеобразование in situ посредством объединения двух жидких компонентов системы в теле пациента путем инъекции двух жидких растворов. 3 н. и 10 з.п. ф-лы, 17 ил., 3 табл., 12 пр.

Комментарии