Циклические тетрапептиды и их терапевтическое применение - RU2568436C2
Код документа: RU2568436C2
Чертежи















Описание
УРОВЕНЬ ТЕХНИКИ
[0001] Иммунодепрессивные лекарственные средства широко применяют при трансплантации и для лечения аутоиммунных заболеваний. Производство таких лекарственных средств является дорогостоящим, к тому же наиболее часто применяемые из указанных лекарственных средств, такие как циклоспорин А, такролимус и рапамицин, демонстрируют нежелательные побочные эффекты. Поиск новых иммунодепрессивных лекарственных средств, лишенных побочных эффектов, особенно в классе природных пептидных иммунорегуляторов и их аналогов, представляет собой сложную задачу в области медицинской химии.
[0002] Циклолинопептид A (CLA), высоко гидрофобный циклический нонапептид, был впервые выделен из семян льна в 1959 году. CLA оказывает мощное иммунодепрессивное действие, схожее по силе с действием циклоспорина A (CsA). Было показано, что механизм действия CLA похож на механизм действия CsA, т.е. CLA формировал комплекс с циклофилином А, что приводило к инактивации кальциневрина, хотя сродство было значительно ниже (Gaymes et al., Febs Lett, 1997, 418, 224-227). CLA ингибировал как гуморальный, так и клеточный иммунный ответ, а также реакцию «трансплантат против хозяина», пролонгировал выживание аллогенных трансплантатов кожи, смягчал проявления пост-адъювантного полиартрита у крыс и гемолитической анемии у новозеландских черных мышей и сходным с CLA образом ингибировал выработку IL1 и IL-2. К сожалению, высокая гидрофобность CLA является препятствием к потенциальному применению указанного соединения в терапии.
[0003] Было обнаружено, что линейные аналоги CLA, содержащие остаток аланина в последовательно расположенных положениях пептидной цепи, обладают иммунодепрессивным действием (Wieczorek et al., Arch Immunol Ther Exp, 1992, 40, 213-216). Также было обнаружено, что активность линейных аналогов CLA постепенно снижалась по мере укорачивания пептидной цепи с N-конца, и в то же время наблюдалось увеличение в активности C-концевых тетра- и трипептидов (Siemion et al.. Arch Immunol Ther Exp, 1994, 42, 459-465). Введение в молекулу CLA одиночного гидрофильного остатка треонина не повлекло за собой улучшения растворимости в воде. Тем не менее, улучшение растворимости без потери биологической активности было достигнуто путем введения сульфогруппы в пара-положение фенольного кольца одного или двух остатков фенилаланина (Siemion et al.. Arch Immunol Ther Exp, 1992, 40, 257-261; Cebrat et al., J Peptide Res., 1997, 49, 415-420). К тому же, было обнаружено, что включение тетрапептидных (Pro-Pro-Phe-Phe) или трипептидных (Pro-Phe-Phe) фрагментов в более длинные линейные пептидные цепи, по-видимому, имеет значение для иммунодепрессивной активности (Wieczorek et al., Arch Immunol Ther Exp, 1993, 41, 291-296; Cebrat et al., Pol. JChem, 1997, 71,1401).
[0004] Ряд аналогов, в которых цис-пептидная связь между остатками пролина была заменена на 1,5-двузамещенное тетразольное кольцо (хороший миметик амидных связей в цис-положении), демонстрировали иммунодепрессивную активность, сопоставимую с таковой у CsA. (Karczmarek et al., Biopolymers, 2002, 63, 343-357). [0005] Синтетические аналоги CLA, в которых остатки лейцина в положениях 5 и/или 8 были заменены на их гидроксиметильный аналог, продемонстрировали четырехкратное увеличение растворимости в воде по сравнению с CLA, но также и 25% ослабление биологической активности по сравнению с природным CLA (Zubrzak et al., Biopolymers (Peptide Science), 2005, 80, 347-356).
[0006] Была получена серия из девяти аналогов CLA путем замены остатков пролина в CLA на β2-изопролин и β3-гомопролин. По сравнению с CsA, указанные аналоги CLA продемонстрировали сильные ингибиторные свойства при клеточном иммунном ответе. Большинство указанных аналогов практически не оказывали цитотоксического действия (Katarzynska et al., JPeptSci, 2009, 14, 1283-1294).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0007] Согласно одному из вариантов реализации настоящего изобретения предложены соединения формулы I:
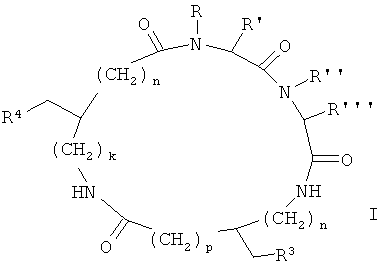
где
[0008] каждый k, m, n и p независимо представляет собой 0, 1 или 2;
[0009] каждый R и R' независимо выбран из Н и C1-3алкила или R и R', взятые вместе, представляют собой -CR1R1'-Х-CH2-, где CR1R1' присоединен к азоту остова, каждый R' и R1 независимо выбран из Н и C1-3-алкила, а Х выбран из -CH2-, -CH2CH2-, -CH(OH)-, -O-, -S- и -NH-;
[0010] каждый R” и R''' независимо выбран из Н и C1-3алкила или R” и R''', взятые вместе, представляют собой -CR2R2'-X'-CH2-, где CR2R2' присоединен к азоту остова, R2 и R2' каждый независимо выбраны из Н и C1-3-алкила, а X' выбран из -CH2-, -CH2CH2-, -CH(OH)-, -O-, -S- и -NH-; и
[0011] каждый R3 и R4 независимо выбран из арила, замещенного арила, гетероарила и замещенного гетероарила;
[0012] или фармацевтически приемлемая соль указанных соединений.
[0013] В некоторых вариантах реализации, по меньшей мере один из R3 и R4 представляет собой фенил. В некоторых вариантах реализации, по меньшей мере один из R3 и R4 представляет собой 4-гидроксифенил. В некоторых вариантах реализации, по меньшей мере один из R3 и R4 представляет собой 4-трет-бутоксифенил. В некоторых вариантах реализации, по меньшей мере один из R3 и R4 представляет собой 2-индолил. В некоторых вариантах реализации, R3 и R4 оба представляют собой фенил. В некоторых вариантах реализации, один из R3 и R4 представляет собой фенил, а другой из R3 и R4представляет собой 4-гидроксифенил. В некоторых вариантах реализации, один из R3 и R4представляет собой фенил, а другой из R и R представляет собой 4-трет-бутоксифенил. В некоторых вариантах реализации, один из R3 и R4 представляет собой фенил, а другой из R3 и R4 представляет собой 2-индолил. В некоторых вариантах реализации, атом углерода, к которому присоединен -CH2-R3, обладает абсолютной (S)-стереохимией. В некоторых вариантах реализации, атом углерода, к которому присоединен -CH2-R3, обладает абсолютной (S)-стереохимией. В некоторых вариантах реализации, атом углерода, к которому присоединен -CH2-R4, обладает абсолютной (S)-стереохимией. В некоторых вариантах реализации, атом углерода, к которому присоединен -CH2-R4, обладает абсолютной (S)-стереохимией. В некоторых вариантах реализации, один из k, m, пир равен 1, а остальные из k, m, n и p равны 0. В некоторых вариантах реализации, два из k, m, n и p равны 1, а остальные из k, m, n и p равны 0. В некоторых вариантах реализации, по меньшей мере один из k и m не равен 0. В некоторых вариантах реализации, по меньшей мере один из n и p не равен 0. В некоторых вариантах реализации, по меньшей мере один из k и m не равен 0, и по меньшей мере один из n и p не равен 0. В некоторых вариантах реализации, k и n оба равны 0. В некоторых вариантах реализации, k и n оба равны 0, один из m и p равен 0, а другой из m и p равен 1. В некоторых вариантах реализации, k и n оба равны 0 и m и p оба равны 1. В некоторых вариантах реализации, все четыре аминокислоты представляют собой L-аминокислоты. В некоторых вариантах реализации, три аминокислоты представляют собой L-аминокислоты, и одна аминокислота представляет собой D-аминокислоту. В некоторых вариантах реализации, две аминокислоты представляют собой L-аминокислоты, и две аминокислоты представляют собой D-аминокислоты. В некоторых вариантах реализации, одна аминокислота представляет собой L-аминокислоту, и три аминокислоты представляют собой D-аминокислоты. В некоторых вариантах реализации, все четыре аминокислоты представляют собой D-аминокислоты.
[0014] В некоторых вариантах реализации, R и R', взятые вместе, образуют -(CH2)3-, т.е. R1 и R1', взятые вместе, образуют -CR1R1'-Х-CH2-, где R1 и R1' оба представляют собой Н, и Х представляет собой СН2. В некоторых вариантах реализации, R" и R'", взятые вместе, образуют -(СН2)3-, т.е. R” и R''', взятые вместе, образуют -CR2R2'-X'-CH2-, где R2 и R2' оба представляют собой Н, и X' представляет собой СН2. В некоторых вариантах реализации, R и R', взятые вместе, образуют -(СН2)4-, т.е. R и R', взятые вместе, образуют CR1R1'-Х-СН2-, где R1 и R1' оба представляют собой Н, и Х представляет собой (СН2)2. В некоторых вариантах реализации, R” и R''', взятые вместе, образуют -(СН2)4-, т.е. R” и R''', взятые вместе, образуют -CR2R2'-Х-СН2-, где R2 и R2' оба представляют собой Н, и Х представляет собой (СН2)2. В некоторых вариантах реализации, R и R', взятые вместе, образуют -СН2-СН(ОН)-СН2-, т.е. R и R', взятые вместе, образуют CR1R1'-Х-СН2-, где R1 и R1' оба представляют собой Н, и Х представляет собой СН(ОН). В некоторых вариантах реализации, R” и R''', взятые вместе, образуют -СН2-СН(ОН)-СН2-, т.е. R” и R''', взятые вместе, образуют -CR2R2'-Х'-СН2-, где R2 и R2' оба представляют собой Н, и X' представляет собой СН(ОН). В некоторых вариантах реализации, когда R и R' взяты вместе, атом углерода, к которому присоединен R', обладает абсолютной (S)-стереохимией. В некоторых вариантах реализации, когда R и R' взяты вместе, атом углерода, к которому присоединен R', обладает абсолютной (R)-стереохимией. В некоторых вариантах реализации, когда R” и R''' взяты вместе, атом углерода, к которому присоединен R''', обладает абсолютной (S)-стереохимией. В некоторых вариантах реализации, когда R” и R''' объединяют, атом углерода, к которому присоединен R''', обладает абсолютной (R)-стереохимией.
[0015] В некоторых вариантах реализации, соединение выбрано из группы, состоящей из:








В некоторых вариантах реализации, соединение представляет собой соединение формулы I-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-5. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-6. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-7. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-8.
[0016] В некоторых вариантах реализации, соединение выбрано из группы, состоящей из:





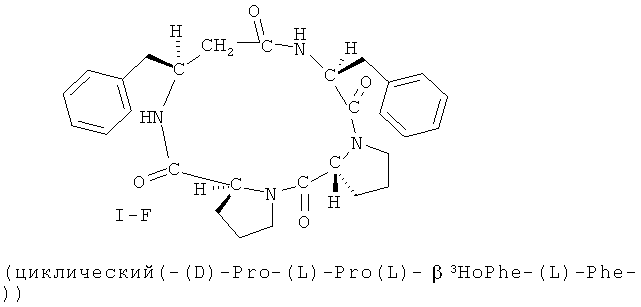







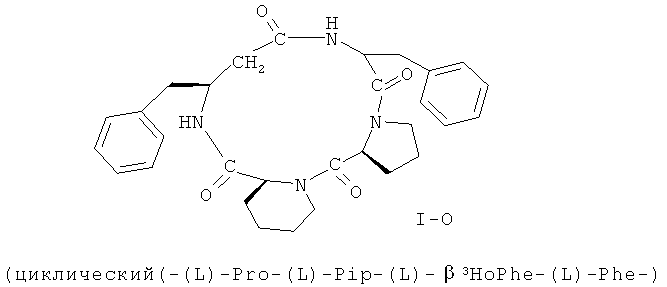

В некоторых вариантах реализации, соединение представляет собой соединение формулы I-А. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-B. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-C. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-D. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-Е. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-F. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-G. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-H. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-I. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-J. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-K. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-L. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-М. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-N. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-O. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-P.
[0017] В некоторых вариантах реализации, одна или более аминогрупп в соединении Формулы I находятся в защищенной форме.
[0018] Также согласно одному из вариантов реализации настоящего изобретения предложена фармацевтическая композиция, содержащая соединение формулы I и фармацевтически приемлемый носитель, наполнитель или разбавитель для указанной композиции. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-5. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-6. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-7. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-8. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-A. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-B. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-C. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-D. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-E. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-F. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-G. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-H. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-I. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-J. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-K. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-L. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-М. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-N. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-O. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-P.
[0019] Также согласно одному из вариантов реализации настоящего изобретения предложен способ подавления иммунного ответа у пациента, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения формулы I. В некоторых вариантах реализации, подавляемый иммунный ответ представляет собой воспаление. В некоторых вариантах реализации, подавляемый иммунный ответ представляет собой отторжение трансплантата. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-5. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-6. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-7. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-8. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-A. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-B. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-C. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-D. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-E. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-F. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-G. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-H. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-I. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-J. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-K. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-L. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-М. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-N. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-O. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-P.
[0020] Также согласно одному из вариантов реализации настоящего изобретения предложен способ лечения или предотвращения иммуноопосредованного заболевания или патологического состояния у пациента, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения формулы I. Также согласно одному из вариантов реализации настоящего изобретения предложен способ снижения профиля токсичности второго лекарственного средства, включающий введение соединения формулы I в сочетании со вторым лекарственным средством. В некоторых вариантах реализации, иммуноопосредованное заболевание или патологическое состояние выбрано из группы, состоящей из аутоиммунных заболеваний, воспалительных процессов, отторжения трансплантата и аллергических реакций. В некоторых вариантах реализации, иммуноопосредованное заболевание или патологическое состояние выбрано из псориаза, красного плоского лишая и других папулосквамозных нарушений. В некоторых вариантах реализации, иммуноопосредованное заболевание или патологическое состояние выбрано из экземы или дерматита. В некоторых вариантах реализации, экзема или дерматит выбраны из экземы, атопической экземы, себорейного дерматита и водяницы. В некоторых вариантах реализации, иммуноопосредованное заболевание или патологическое состояние представляет собой реакцию кожи на солнечный свет. В некоторых вариантах реализации, иммуноопосредованное заболевание или патологическое состояние выбрано из неспецифичного раздражения кожи и укуса насекомого. В некоторых вариантах реализации, иммуноопосредованное заболевание или патологическое состояние представляет собой крапивницу. В некоторых вариантах реализации, иммуноопосредованное заболевание или патологическое состояние выбрано из группы, состоящей из первичной опухоли кожи (например, меланомы); ревматоидного артрита (как аутоиммунного, так и вызванного инфекцией); болезни Крона; воспалительного заболевания кишечника; синдрома усиленной перистальтики; нейродегенеративного заболевания (например, множественного склероза); болезни Паркинсона; реакции трансплантат против хозяина; тяжелого псориаза и атопического дерматита. В некоторых вариантах реализации, соединение формулы I вводят в сочетании с химиотерапевтическим лекарственным средством для уменьшения токсических эффектов химиотерапевтического лекарственного средства. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-5. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-6. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-7. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-8. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-A. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-B. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-С. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-D. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-E. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-F. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-G. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-H. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-I. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-J. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-K. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-L. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-M. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-N. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-O. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-P.
[0021] Также согласно одному из вариантов реализации настоящего изобретения предложен набор, содержащий соединение формулы I, и инструкции по применению указанного соединения для (а) подавления иммунного ответа у пациента, (b) лечения или предотвращения иммуноопосредованного заболевания или патологического состояния у пациента или (с) снижения профиля токсичности второго лекарственного средства. В некоторых вариантах реализации, иммунный ответ представляет собой воспаление. В некоторых вариантах реализации, иммунный ответ представляет собой отторжение трансплантата. В некоторых вариантах реализации, иммуноопосредованное заболевание или патологическое состояние выбрано из группы, состоящей из аутоиммунных заболеваний, воспалительных процессов, отторжения трансплантата и аллергических реакций. В некоторых вариантах реализации, иммуноопосредованное заболевание или патологическое состояние выбрано из псориаза, красного плоского лишая и других папулосквамозных нарушений. В некоторых вариантах реализации, иммуноопосредованное заболевание или патологическое состояние выбрано из экземы или дерматита. В некоторых вариантах реализации, экзема или дерматит выбраны из экземы, атопической экземы, себорейного дерматита и водяницы. В некоторых вариантах реализации, иммуноопосредованное заболевание или патологическое состояние представляет собой реакцию кожи на солнечный свет. В некоторых вариантах реализации, иммуноопосредованное заболевание или патологическое состояние выбрано из неспецифичного раздражения кожи и укуса насекомого. В некоторых вариантах реализации, иммуноопосредованное заболевание или патологическое состояние представляет собой крапивницу. В некоторых вариантах реализации, иммуноопосредованное заболевание или патологическое состояние выбрано из группы, состоящей из первичной опухоли кожи (например, меланомы); ревматоидного артрита (как аутоиммунного, так и вызванного инфекцией); болезни Крона; воспалительного заболевания кишечника; синдрома усиленной перистальтики; нейродегенеративного заболевания (например, множественного склероза); болезни Паркинсона; реакции трансплантат против хозяина; тяжелого псориаза и атопического дерматита. В некоторых вариантах реализации, согласно инструкциям необходимо ввести соединение формулы I в сочетании с химиотерапевтическим лекарственным средством для уменьшения токсических эффектов химиотерапевтического лекарственного средства. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-5. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-6. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-7. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-8. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-A. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-В. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-C. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-D. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-E. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-F. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-G. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-H. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-I. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-J. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-K. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-L. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-M. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-N. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-O. В некоторых вариантах реализации, соединение представляет собой соединение формулы I-P.
[0022] Также согласно одному из вариантов реализации настоящего изобретения предложен способ получения соединения формулы I, включающий циклизацию соединения формулы II-1, II-2, II-3 или II-4, где R, R', R”, R''', R3, R4, k, m, n или p такие, как определено в формуле I (вместе называемые в дальнейшем соединениями формулы II):

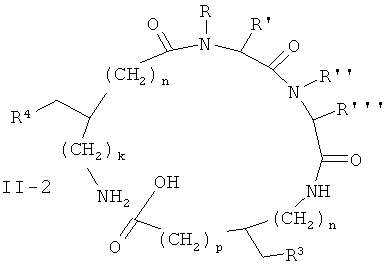


в соответствующее соединение формулы I. В некоторых вариантах реализации, способ также включает получение соединения формулы II-1, II-2, II-3 или II-4. В некоторых вариантах реализации, соединение формулы II-1, II-2, II-3 или II-4 получают путем твердофазного синтеза.
[0023] Согласно вариантам реализации настоящего изобретения также предложены соединения формул II-1, II-2, II-3 и II-4 в чистом виде, а также защищенные варианты указанных соединений (например, те, в которых одна или более аминогрупп, таких как N-концевая аминогруппа или аминогруппа боковой цепи, защищены, например, при помощи трет-бутоксикарбонила), и указанные соединения, в защищенной или незащищенной форме, связанные с твердофазной смолой. В дальнейшем, если не указано иное, или если это не подходит по контексту, в случае, когда идет отсылка к соединению формулы II или его подроду или подвиду, предполагается, что такая отсылка включает указанное соединение в форме, в которой оно (a)(i) по меньшей мере отчасти защищено или (a)(ii) полностью незащищено или лишено защиты; (b)(i) связано со смолой (1) напрямую или (2) через связующее звено или (b)(ii) не связано со смолой; или комбинация состояний (а) и (b). Более того, как указано в настоящем описании, для удобства свободные незащищенные линейные пептиды показаны в виде нейтральных молекул, а именно имеющих H2N- на N-конце и -СООН на С-конце; тем не менее, следует понимать, что действительный заряд на указанных группах, а также на любых ионизируемых группах боковой цепи (например, группы карбоксиловой кислоты или аминогруппы боковых цепей) будет зависеть от pH окружающей среды и необязательно будет таким, как показано.
[0024] В некоторых вариантах реализации, соединение формулы II выбрано из группы, состоящей из:





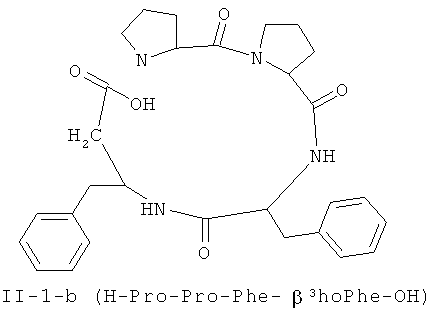


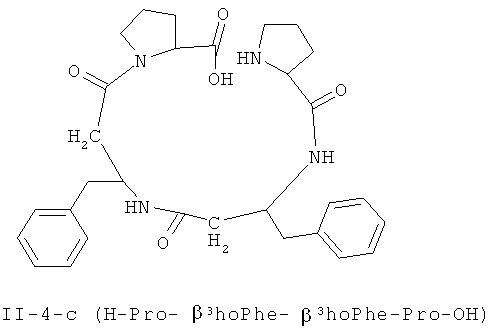




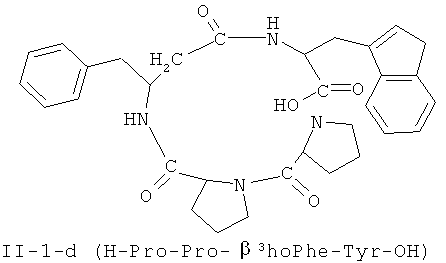










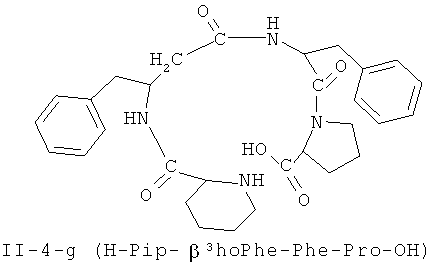



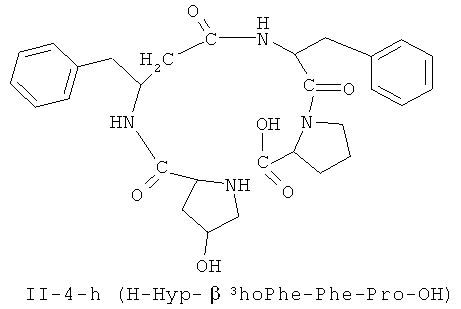



В некоторых вариантах реализации, соединение представляет собой соединение формулы II-4-a. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-1-а. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-2-a. В некоторых вариантах реализации, соединение представляв собой соединение формулы II-3-а. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-4-b. В некоторых вариантах реализации: соединение представляет собой соединение формулы II-1-b. В некоторых вариантам реализации, соединение представляет собой соединение формулы II-2-b. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-3-b. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-4-с.В некоторых вариантах реализации, соединение представляет собой соединение формулы II-1-е. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-2-c. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-3-c. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-4-d. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-1-d. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-2-d. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-3-d. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-4-е. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-1-е. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-2-e. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-3-e. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-4-f. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-1-f. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-2-f. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-3-f. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-4-g. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-1-g. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-2-g. В некоторых вариантах реализации, соединение представляет собой соединение формулы 11-3 -g. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-4-h. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-1-h. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-2-h. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-3-h.
[0025] В некоторых вариантах реализации, соединение формулы II выбрано из группы, состоящей из:




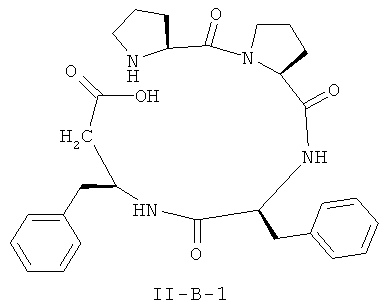










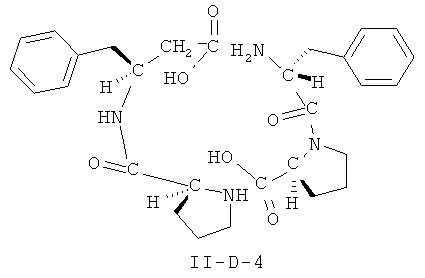


















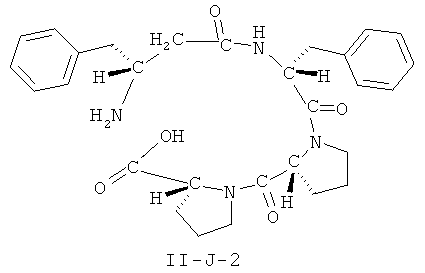







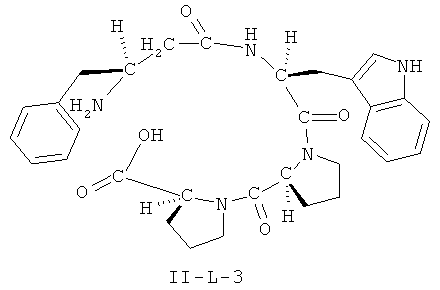

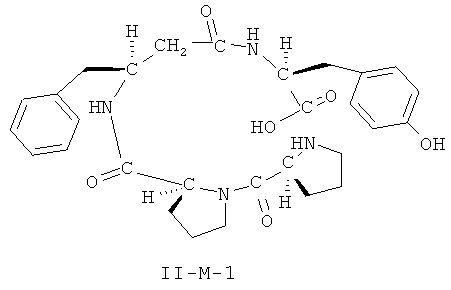





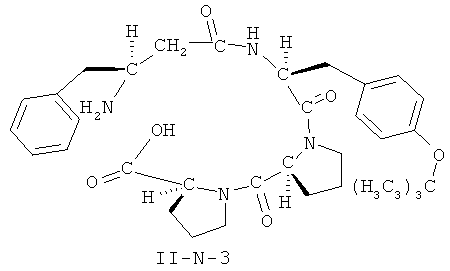
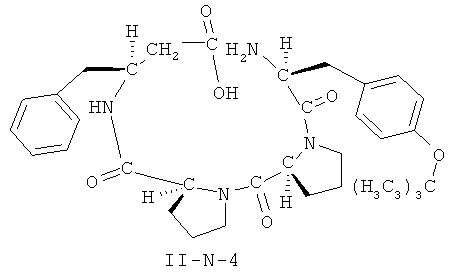




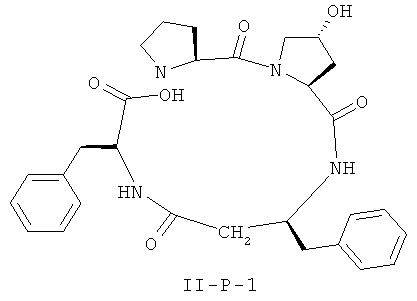



[0026] В некоторых вариантах реализации, соединение представляет собой соединение формулы II-A-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-A-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-A-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-A-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-B-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-B-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-B-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-В-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-C-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-C-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-C-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-C-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-D-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-D-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-D-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-D-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-E-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-E-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-E-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-E-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-F-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-F-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-F-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-F-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-G-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-G-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-G-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-G-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-H-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-H-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-H-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-Н-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-J-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-J-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-J-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-J-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-K-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-K-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-K-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-K-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-L-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-L-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-L-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-L-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-M-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-M-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-M-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-М-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-N-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-N-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-N-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-N-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-O-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-O-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-O-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-O-4. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-P-1. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-P-2. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-P-3. В некоторых вариантах реализации, соединение представляет собой соединение формулы II-P-4.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0027] Было обнаружено, что соединения формулы I проявляют иммунодепрессивную и/или противовоспалительную активность, в то же время проявляя меньшую токсичность по сравнению с некоторыми известными соединениями. Таким образом, соединения формулы I подходят для применения в качестве иммунодепрессивных и/или противовоспалительных агентов. В настоящем описании термин «иммуноопосредованный» относится к заболеванию или патологическому состоянию, при котором происходит излишнее реагирование иммунной системы и/или она атакует тело.
[0028] В настоящем описании термины и заместители сохраняют свои значения.
[0029] Предполагается, что «алкил» включает линейные, разветвленные или циклические насыщенные углеводородные структуры и их комбинации. Низший алкил относится к алкильным группам, состоящим из 1-6 атомов углерода. Примеры низших алкильных групп включают метил, этил, пропил, изопропил, бутил, втор- и трет-бутил и подобные. Предпочтительными являются алкильные группы, состоящие из 20 или менее атомов углерода. Циклоалкил представляет собой разновидность алкила и включает циклические углеводородные группы, состоящие из 3-8 атомов углерода. Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил, норборнил и подобные.
[0030] Углеводород, состоящий из 1-20 атомов углерода, включает алкил, циклоалкил, полициклоалкил, алкенил, алкинил, арил и их комбинации. Примеры включают бензил, фенэтил, циклогексилметил, камфорил и нафтилэтил. Предполагается, что термин «карбоцикл» включает системы колец, полностью состоящие из углерода, но в любой степени окисления. Таким образом, (C3-C10)-карбоцикл относится к таким системам, как циклопропан, бензол и циклогексен; (C8-C12)-карбополицикл относится к таким системам, как норборнан, декалин, индан и нафтален.
[0031] Алкокси или алкоксил относится к группам прямой, разветвленной, циклической конфигурации, содержащим от 1 до 8 атомов углерода, и их комбинациям, присоединенным к исходной структуре посредством атома кислорода. Примеры включают метокси, этокси, пропокси, изопропокси, циклопропилокси, циклогексилокси и подобные. Низший алкокси относится к группам, содержащим от одного до четырех атомов углерода.
[0032] Оксаалкил относится к алкильным остаткам, в которых один или более атомов углерода замещены кислородом. Примеры включают метоксипропокси, 3,6,9-триоксадецил и подобные.
[0033] Ацил относится к насыщенным, ненасыщенным и ароматическим группам прямой, разветвленной, циклической конфигурации, состоящим от 1 до 8 атомов углерода, и их комбинациям, присоединенным к исходной структуре посредством функциональной группы карбонила. Один или более атомов углерода в ацильном остатке могут быть замещены азотом, кислородом или серой, пока точкой присоединения к исходной структуре остается карбонил. Примеры включают ацетил, бензоил, пропионил, изобутирил, трет-бутоксикарбонил, бензилоксикарбонил и подобные. Низший ацил относится к группам, содержащим от одного до четырех атомов углерода.
[0034] Арил обозначает 6-членное ароматическое кольцо, бициклическую 9- или 10-членную систему ароматических колец или трициклическую 13- или 14-членную систему ароматических колец. Ароматические 6-14-членные карбоциклические кольца включают, например, бензол, нафтален, индан, тетралин и флюорен.
[0035] Гетероарил обозначает 5- или 6-членное гетероароматическое кольцо, содержащее 1-3 гетероатома, выбранных из О, N или S; бициклическую 9- или 10-членную систему гетероароматических колец, содержащую 1-3 гетероатома, выбранных из О, N или S; или трициклическую 13- или 14-членную систему гетероароматических колец, содержащую 1-3 гетероатома, выбранных из О, N или S. 5-10-членные ароматические гетероциклические кольца включают, например, имидазол, пиридин, индол, тиофен, бензопиранон, тиазол, фуран, бензимидазол, хинолин, изохинолин, хиноксалин, пиримидин, пиразин, тетразол и пиразол.
[0036] Арилалкил относится к заместителю, в котором арильный остаток присоединен к исходной структуре посредством алкила. Примерами являются бензил, фенэтил и подобные. Гетероарилалкил относится к заместителю, в котором гетероарильный остаток присоединен к исходной структуре посредством алкила. Примеры включают, например, пиридинилметил, пиримидинилэтил и подобные.
[0037] Гетероцикл обозначает циклоалкильный или арильный остаток, в котором от одного до трех атомов углерода замещены гетероатомом, выбранным из группы, состоящей из N, О и S. Гетероатомы азота и серы могут быть необязательно окислены, а гетероатом азота может быть необязательно кватернизован. Примеры гетероциклов включают пирролидин, пиразол, пиррол, индол, хинолин, изохинолин, тетрагидроизохинолин, бензофуран, бензодиоксан, бензодиоксол (обычно называемый метилендиоксифенилом, когда встречается в виде заместителя), тетразол, морфолин, тиазол, пиридин, пиридазин, пиримидин, тиофен, фуран, оксазол, оксазолин, изоксазол, диоксан, тетрагидрофуран и подобные. Следует принимать во внимание то, что гетероарил является разновидностью гетероцикла, в которой гетероцикл является ароматическим. Примеры гетероциклильных остатков дополнительно включают пиперазинил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, 2-оксоазепинил, азепинил, 4-пиперидинил, пиразолидинил, имидазолил, имидазолинил, имидазолидинил, пиразинил, оксазолидинил, изоксазолидинил, тиазолидинил, изотиазолил, хинуклидинил, изотиазолидинил, бензимидазолил, тиадиазолил, бензопиранил, бензотиазолил, тетрагидрофурил, тетрагидропиранил, тиенил, бензотиенил, тиаморфолинил, тиаморфолинилсульфоксид, тиаморфолинилсульфон, оксадиазолил, триазолил и тетрагидрохинолинил.
[0038] Замещенный алкил, арил, циклоалкил, гетероциклил и т.д. относится к алкилу, арилу, циклоалкилу или гетероциклилу, где до трех атомов Н в каждом остатке замещены алкилом, галогеном, галоалкилом, гидрокси, низшим алкокси, карбокси, карбоалкокси (также называемым алкоксикарбонилом), карбоксиамидо (также называемым алкиламинокарбонилом), циано, карбонилом, нитро, амино, алкиламино, диалкиламино, меркапто, алкилтио, сульфоксидом, сульфоном, ациламино, амидино, фенилом, бензилом, гетероарилом, фенокси, бензилокси или гетероарилокси.
[0039] Термин «галоген» обозначает фтор, хлор, бром или йод.
[0040] Следующие аббревиатуры и термины имеют указанные значения во всем описании:
Вос = трет-бутилоксикарбонил
цикло- = цикло
ДХМ = дихлорметан = метиленхлорид = CH2Cl2
DIEA = N,N-диизопропилэтиламин
DIPEA = диизопроилэтиламин
ДМФ = N,N-диметилформамид
Fmoc = 9-фторенилметоксикарбонил
HATU = гексафторфосфат O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония
HBTU = гексафторфосфат O-(бензотриазол-1-ил)-1,1,3,3-тетраметилурония
HOAc = уксусная кислота
HOAt =1-гидрокси-7-азабензотриазол
HOBt = 1-гидроксибензотриазол
Hyp = 4-гидроксипролин
Me = метил
Pip = пипеколиновая кислота
Phe = фенилаланин
Pro = пролин
РуВОР = гексафторфосфат O-(бензотриазол-1-ил)-триспирролидинфосфония
к.т. = комнатная температура
TBTU = тетрафторборат O-(бензотриазол-1-ил)-1,1,3,3-тетраметилурония
TFA = трифторуксусная кислота
t-Hyp = транс-4-гидроксипролин
Trp = триптофан
Tyr = тирозин
Tyr(tBu) = (O-трет-бутил)тирозин
[0041] Кроме того, полный список аббревиатур, используемых химиками-органиками (т.е. средними специалистами в области техники), есть в первом выпуске каждого тома Журнала органической химии (Journal of Organic Chemistry). Список, обычно приведенный в таблице, озаглавленной «Стандартный список аббревиатур», включен в настоящее описание посредством ссылки. К тому же, в отношении не встречающихся в природе аминокислот, в которых дополнительная метиленовая группа присутствует в главной цепи, для аминокислоты, содержащей дополнительный метилен (-CH2-) в главной цепи между атомом углерода, несущим боковую цепь, и конечным атомом углерода, в настоящем описании используется обозначение «β3-Ho-» (или «бета 3-гомо-»); для аминокислоты, содержащей дополнительный метилен в главной цепи между атомом углерода, несущим боковую цепь, и конечным атомом азота в настоящем описании используется обозначение «β2-Ho-» (или «бета 2-гомо-»).
[0042] Варианты реализации настоящего изобретения включают соединения формулы I в форме солей, в частности солей присоединения кислот. Подходящие соли включают соли, образованные как с органическими, так и с неорганическими кислотами. Подобные соли присоединения кислот обычно являются фармацевтически приемлемыми, хотя соли фармацевтически неприемлемых солей могут быть применены в получении и очистке указанного соединения. Таким образом, предпочтительные соли включают соли, образованные из соляной, бромистоводородной, серной, лимонной, винной, фосфорной, молочной, пировиноградной, уксусной, янтарной, щавелевой, фумаровой, малеиновой, щавелево-уксусной, метансульфоновой, этансульфоновой, n-толуолсульфоновой, бензолсульфоновой и изэтионовой кислоты. Соли соединений формулы I могут быть получены путем реагирования подходящего соединения в форме свободного основания с подходящей кислотой.
[0043] Соединения формулы I согласно вариантам реализации настоящего изобретения представляют собой циклические тетрапептиды. Синтез указанных пептидов может быть осуществлен путем циклизации соответствующих линейных пептидов, которые в свою очередь синтезированы при помощи способов, известных в области техники; см., например, Memfield, J. Am. Chem. Soc., 85:2149 (1964); Houghten, Proc. Natl. Acad. Sci. USA, 82:5132 (1985); Kelley & Winkler in Genetic Engineering Principles and Methods, Setlow, J. K, ed.. Plenum Press, N.Y., vol. 12, pp 1-19 (1990); Stewart & Young, Solid Phase Peptide Synthesis, Pierce Chemical Co., Rockford, 111. (1984); Mergler et al. (1988) Tetrahedron Letters 29:4005-4008; Mergler et al. (1988) Tetrahedron Letters 29:4009-4012; Kamber et al. (eds), Peptides, Chemistry and Biology, ESCOM, Leiden (1992) pp.525-526; Riniker et al. (1993) Tetrahedron Letters 49:9307-9320; Lloyd-Williams et al. (1993) Tetrahedron Letters 49:11065-11133; Andersson et al. (2000) Biopolymers 55:227-250; Bray, Nature Reviews 2:587-593 (2003), патенты США №№4105603, 3972859, 3842067, 3862925, 6015881, 6197927 и 7439222. Подобный синтез может быть осуществлен путем жидкофазного или твердофазного синтеза или их комбинации, как известно в области техники.
[0044] При жидкофазных способах синтеза (часто называемых способами синтеза в жидкой фазе) все реакции проводят в гомогенной фазе. Последовательные аминокислоты соединяют в растворе до формирования требуемого пептидного материала. Во время синтеза последовательные промежуточные пептиды очищают путем осаждения и/или промывания.
[0045] При твердофазном синтезе пептидов (ТФСП) первую аминокислоту или пептидную группу связывают с нерастворимой подложкой, такой как смола. Последовательные аминокислоты или пептидные группы добавляют к первой аминокислоте или пептидной группе до формирования требуемого пептидного материала. Таким образом, продуктом твердофазного синтеза является пептид, связанный с нерастворимой подложкой. Далее пептиды, синтезированные путем ТФСП, очищают от смолы, и расщепленный пептид изолируют.
[0046] Более конкретно, твердофазный синтез начинается на карбоксильном конце предполагаемого пептида путем связывания защищенной аминокислоты с инертной твердой подложкой. Инертной твердой подложкой может быть любая макромолекула, способная служить якорем для С-конца исходной аминокислоты. Обычно макромолекулярная подложка представляет собой полимерную смолу с поперечной межмолекулярной связью (например, полиамидная или полистироловая смола), как показано на фигурах 1-1 и 1-2 на страницах 2 и 4 издания Stewart & Young, см. выше. В некоторых случаях, C-концевую аминокислоту связывают с полистироловой смолой с получением бензилового эфира. Макромолекулярная подложка выбрана таким образом, чтобы пептидная «якорная» связь была стабильна при условиях, применяемых для снятия защиты α-аминогруппы защищенных аминокислот при пептидном синтезе. Если используют α-защитную группу, неустойчивую к действию оснований, предпочтительно использовать неустойчивую к действию кислот связь между пептидом и твердой подложкой. Например, эфирная смола, неустойчивая к действию кислот, эффективна при пептидном синтезе Fmoc-аминокислоты, неустойчивой к действию оснований, как описано на странице 16 издания Stewart & Young, см. выше. В качестве варианта, могут быть использованы пептидная «якорная» связь и а-защитная группа, избирательно неустойчивые к кислотному гидролизу. Например, аминометиловая смола, такая как фенилацетамидометил (Pam), хорошо работает в сочетании с пептидным синтезом Boc-аминокислоты, как описано на страницах 11-12 издания Stewart & Young, см. выше. В издании Guiller et al., Chem Rev. 2000, 100, 2091-2157 дан обзор линкеров и способов отщепления при твердофазном органическом синтезе и в комбинаторной химии, включая пептидный синтез.
[0047] После соединения исходной аминокислоты с инертной твердой подложкой, α-амино-защитную группу удаляют, например, трифторуксусной кислотой (TFA) в метиленхлориде и нейтрализацией, например, в триэтиламине (TEA). После снятия защиты α-аминогруппы исходной аминокислоты добавляют следующую α-аминозащищенную и защищенную по боковой цепи аминокислоту в синтезе. Оставшиеся α-аминозащищенные и, если это необходимо, защищенные по боковой цепи аминокислоты затем последовательно связывают в требуемом порядке путем конденсации с получением промежуточного соединения, связанного с твердой подложкой. В качестве альтернативы, некоторые аминокислоты могут быть связаны друг с другом с образованием требуемого пептида, после чего происходит добавление пептидного фрагмента к растущей твердофазной пептидной цепи.
[0048] Реакция конденсации между двумя аминокислотами или аминокислотой и пептидом, или пептидом и пептидом может быть проведена согласно обычным способам конденсации, таким как азидный способ, способ смешанного ангидрида кислот, способы DCC (N,N'-дициклогексилкарбодиимид) или DIC (N,N'-диизопропилкарбодиимид), способ активированного эфира, способ n-нитрофенилового эфира, способ ВОР (гексафторфосфат бензотриазол-1-илокси-трис[диметиламино]фосфония), способ имидоэфира N-гидроксисахарной кислоты и др., а также способ K-реагента Вудворта.
[0049] При химическом синтезе пептидов обычной практикой является защита любых реакционноспособных групп боковой цепи аминокислот подходящими защитными группами. В конечном итоге, указанные защитные группы удаляют по завершении постепенной сборки требуемой полипептидной цепи. Также распространена защита α-аминогруппы на аминокислоте или пептидном фрагменте во время реакции между C-концевой карбоксильной группой аминокислоты или пептидного фрагмента со свободной N-концевой аминогруппой растущей твердофазной полипептидной цепи с последующим выборочным удалением α-амино-защитной группы для обеспечения возможности добавления следующей аминокислоты или пептидного фрагмента к твердофазной полипептидной цепи. Соответственно, обычно при полипептидном синтезе получают промежуточное соединение, содержащее каждый из остатков аминокислот, расположенных в пептидной цепи в требуемой последовательности, причем в указанном промежуточном соединении индивидуальные остатки сохраняют защитные группы боковой цепи. Указанные защитные группы могут быть удалены примерно в одно время с получением требуемого полипептидного продукта после удаления его с твердой фазы.
[0050] α- и ω-амино боковые цепи могут быть защищены, например, бензилоксикарбонильной (сокращенно Z), изоникотинилоксикарбонильной (iNoc), o-хлорбензилоксикарбонильной [Z(2Cl) или 2-Cl-Z], n-нитробензилоксикарбонильной [Z(NO2)], n-метоксибензилоксикарбонильной [Z(OMe)], трет-бутоксикарбонильной (Boc), трет-амилоксикарбонильной (Аос), изоборнилоксикарбонильной, адамантилоксикарбонильной (Adoc), 2-(4-бифенил)-2-пропилоксикарбонильной (Bpoc), 9-фторенилметоксикарбонильной (Fmoc), метилсульфонилэтоксикарбонильной (Msc), трифторацетильной, фталильной (Pht), формильной (For), 2-нитрофенилсульфенильной (Nps), дифенилфосфинотиоильной (Ppt) и диметилфосфинотиоильной (Mpt) группами и подобными. Дополнительные примеры защитных групп боковой цепи включают ацетильную (Ас), бензоильную (Bz), трет-бутильную (t-Bu), трифенилметильную (тритил, Trt), тетрагидропиранильную, бензольную (Bzl), 2,6-дихлорбензольную, нитро, п-толуолсульфонильную (Tos), ксантильную (Хап) группу, бензильный, метиловый, этиловый и т-бутиловый эфир, а также ароматические или алифатические защитные группы уретанового типа, фотолабильные группы, такие как нитровератрилоксикарбонил (Nvoc), и группы, неустойчивые к действию фтора, такие как триметилсилилэтилоксикарбонил(ТЕОС).
[0051] Примеры амино-концевых защитных групп (также называемых N-концевыми защитными группами) включают: (1) защитные группы ацильного типа, такие как формил, акрилил (Acr), бензоил (Bz) и ацетил (Ас); (2) ароматические защитные группы уретанового типа, такие как бензилоксикарбонил (Z) и замещенные Z, такие как п-хлорбензилоксикарбонил, п-нитробензилоксикарбонил, п-бромбензилоксикарбонил, п-метоксибензилоксикарбонил; (3) алифатические уретановые защитные группы, такие как трет-бутилоксикарбонил (ВОС), диизопропилметоксикарбонил, изопропилоксикарбонил, этоксикарбонил, аллилоксикарбонил; (4)циклоалкильные защитные группы уретанового типа, такие как 9-фторенилметоксикарбонил (Fmoc), циклопентилоксикарбонил, адамантилоксикарбонил и циклогексилоксикарбонил; и (5) защитные группы тиоуретанового типа, такие как фенилтиокарбонил. Предпочтительные защитные группы включают 9-фторенилметилоксикарбонил (Fmoc), 2-(4-бифенилил)-пропил(2)оксикарбонил (Врос), 2-фенилпропил(2)-оксикарбонил (Рос) и трет-бутилоксикарбонил (Boc).
[0052] Защитные группы для функциональной карбоксильной группы представлены бензиловым эфиром (OBzl), циклогексиловым эфиром (Chx), 4-нитробензиловым эфиром (ONb), трет-бутиловым эфиром (Obut), 4-пиридилметиловым эфиром (OPic) и подобньши. Часто является предпочтительным, чтобы определенные аминокислоты, такие как аргинин, цистеин и серин, содержащие функциональную группу, отличную от амино и карбоксильной группы, были защищены подходящей защитной группой. Например, гуанидиновая группа аргинина может быть защищена нитро, п-толуолсульфонилом, бензилоксикарбонилом, адамантилоксикарбонилом, п-метоксибензосульфонилом, 4-метокси-2,6-диметилбензолсульфонилом (Nds), 1,3,5-триметилфенсульфонилом (Mts) и подобными. Тиольная группа цистеина может быть защищена п-метоксибензолом, тритилом и подобными.
[0053] Несмотря на то что возможно вводить соединения формулы I в виде чистого вещества, предпочтительным является их введение в виде фармацевтической композиции. Согласно дополнительному аспекту изобретения, в соответствии с вариантами реализации настоящего изобретения предложена фармацевтическая композиция, содержащая соединение формулы I или фармацевтически приемлемая соль или сольват указанного соединения вместе с одним или более фармацевтических носителей и необязательно одним или более терапевтических ингредиентов. Носитель (носители) должны быть «приемлемы» в том смысле, что они должны быть совместимы с другими ингредиентами состава и не должны оказывать вредного воздействия на реципиента.
[0054] Составы включают составы, подходящие для перорального, парентерального (включая подкожное, внутрикожное, внутримышечное, внутривенное и внутрисуставное), ректального и наружного (включая накожное, буккальное, сублингвальное и внутриглазное) введения. Наиболее подходящий путь введения может зависеть от патологического состояния или расстройства пациента. Для удобства составы могут быть представлены в виде единичной дозированной формы и могут быть получены любыми способами, хорошо известными в области фармацевтики. Способы получения таких составов включают стадию ассоциирования соединения формулы I или фармацевтически приемлемой соли или сольвата указанного соединения («активный ингредиент») с носителем, представляющим собой один или несколько дополнительных ингредиентов. В общем, составы получают путем равномерного и тщательного ассоциирования активного ингредиента с жидкими носителями или мелкодисперсными твердыми носителями и, если это необходимо, последующего формирования продукта в требуемый состав.
[0055] Составы, подходящие для перорального введения, в соответствии с вариантами реализации настоящего изобретения могут быть представлены в виде дискретных единиц, таких как капсулы, крахмальные капсулы и таблетки, каждая из которых содержит заранее определенное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной жидкости или неводной жидкости; или в виде жидкой эмульсии типа «масло в воде» или жидкой эмульсии типа «вода в масле». Активный ингредиент также может быть представлен в виде шарика, электуария или пасты.
[0056] Таблетка может быть изготовлена путем прессования или формовки, необязательно с одним или более дополнительных ингредиентов. Прессованные таблетки могут быть изготовлены путем прессования в подходящей машине активного ингредиента в свободнотекучей форме, такой как порошок или гранулы, необязательно смешанного со связывающим агентом, смазкой, инертным разбавителем, смазывающим, поверхностно-активным или диспергирующим агентом. Формованные таблетки могут быть изготовлены путем формования в подходящей машине смеси соединения в форме порошка, смоченного инертным жидким разбавителем. Таблетки могут быть необязательно покрыты оболочкой или помечены риской и могут быть составлены таким образом, чтобы обеспечить длительное, замедленное или контролируемое высвобождение активного ингредиента, содержащегося в них.
[0057] Составы для парентерального введения включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатики и растворенные вещества, делающие состав изотоничным крови предполагаемого реципиента. Составы для парентерального введения также включают водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Указанные составы могут быть представлены в контейнерах, содержащих единичные и множественные дозы составов, например, в запечатанных ампулах и флаконах, и могут храниться в высушенном замораживанием (лиофилизированном) состоянии, при котором требуется лишь добавить стерильный жидкий носитель, например, солевой раствор, фосфатно-солевой буфер (ФСБ) или подобные, непосредственно перед применением. Экстемпоральные растворы и суспензии для инъекций могут быть изготовлены из стерильных порошков, гранул и таблеток описанного выше типа.
[0058] Составы для ректального введения могут быть представлены в форме суппозитория с обычными носителями, такими как масло какао или полиэтиленгликоль.
[0059] Составы для местного применения через рот, например, буккально или сублингвально, включают пастилки для рассасывания, содержащие активный ингредиент в основе, содержащей вкусовые добавки, такой как сахароза и камедь или трагант, и пастилки, содержащие активный ингредиент в такой основе, как желатин и глицерин или сахароза и камедь.
[0060] Предпочтительными единичными дозированными составами являются составы, содержащие эффективную дозу активного ингредиента, как указано далее, или подходящую долю указанной дозы.
[0061] Следует понимать, что в дополнение к ингредиентам, отдельно упомянутым выше, составы согласно вариантам реализации настоящего изобретения могут включать другие агенты, распространенные в области техники, исходя из типа указанного состава, например, составы, подходящие для перорального введения, могут включать вкусовые добавки.
[0062] Как заявлено в соответствии с вариантами реализации настоящего изобретения, соединения согласно вариантам реализации настоящего изобретения могут применяться в лечении или предотвращении определенных заболеваний или патологических состояний. Термин «предотвращение» в настоящем описании относится к введению лекарственного средства заранее для предупреждения или смягчения приступа. Среднему специалисту в области медицины (для которого предназначен настоящий способ по пунктам, относящимся к применению) очевидно, что термин «предотвращение» не является абсолютным. В области медицины условлено, что указанный термин относится к профилактическому введению лекарственного средства для существенного уменьшения вероятности возникновения или степени тяжести патологического состояния, и это именно тот смысл, который вкладывается в данный термин в формуле настоящего изобретения. Обращаем внимание читателя на «Настольный справочник врача» (Physician's Desk Reference), типовое пособие в области медицины, в котором термин «предотвращение» встречается сотни раз. Специалисты в области медицины не трактуют термин в абсолютном смысле. Сходным образом, когда утверждается, что соединения согласно вариантам реализации настоящего изобретения могут быть использованы для подавления иммунного ответа, следует понимать, что «подавление» включает уменьшение степени ответа и не обязательно полностью его предотвращает.
[0063] В результате экспертизы может быть обнаружено, что соединения, которые на данный момент не исключены из формулы изобретения, являются непатентоспособными для авторов данной заявки. В таком случае, исключение видовых и родовых признаков в формуле изобретения следует считать результатом делопроизводства по настоящей заявке, и не следует считать, что оно отражает замысел авторов или описание их изобретения. В плане соединений настоящее изобретение полностью представлено соединениями формул I и II, за исключением тех соединений, которые являются достоянием общественности.
[0064] Для лучшего понимания вариантов реализации настоящего изобретения приводится ссылка на чертежи, в которых:
[0065] На фигуре 1 показано антиген-специфичное увеличение толщины уха, достигнутое в результате эксперимента, описанного в Примере 2;
[0066] На фигуре 2 показано общее число клеток в околоушных лимфатических узлах, наблюдавшееся в эксперименте, описанном в Примере 2;
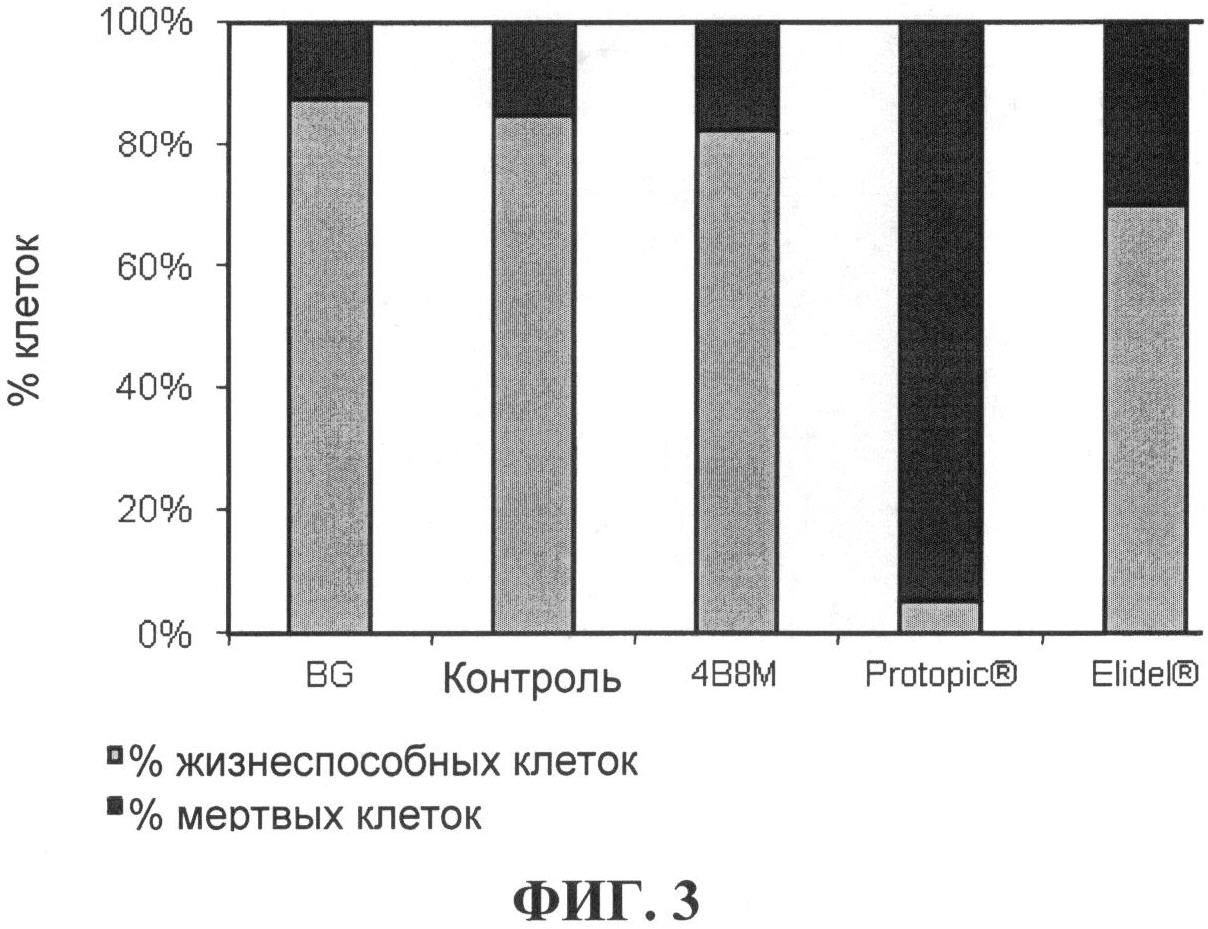
[0067] На фигуре 3 показано содержание жизнеспособных и мертвых клеток в околоушных лимфатических узлах, описанных в Примере 2;
[0068] На фигуре 4 показано число и участие типов клеток в дренирующих лимфатических узлах, зарегистрированное в эксперименте, описанном в Примере 2;
[0069] На фигуре 5 показана токсичность соединения формулы IA в отношении мононуклеарных клеток крови человека, как описано в Примере 3;
[0070] На фигуре 6 показано влияние внутрибрюшинного введения соединения формулы IA на гуморальный иммунный ответ мышей на эритроциты овцы, как описано в Примере 4;
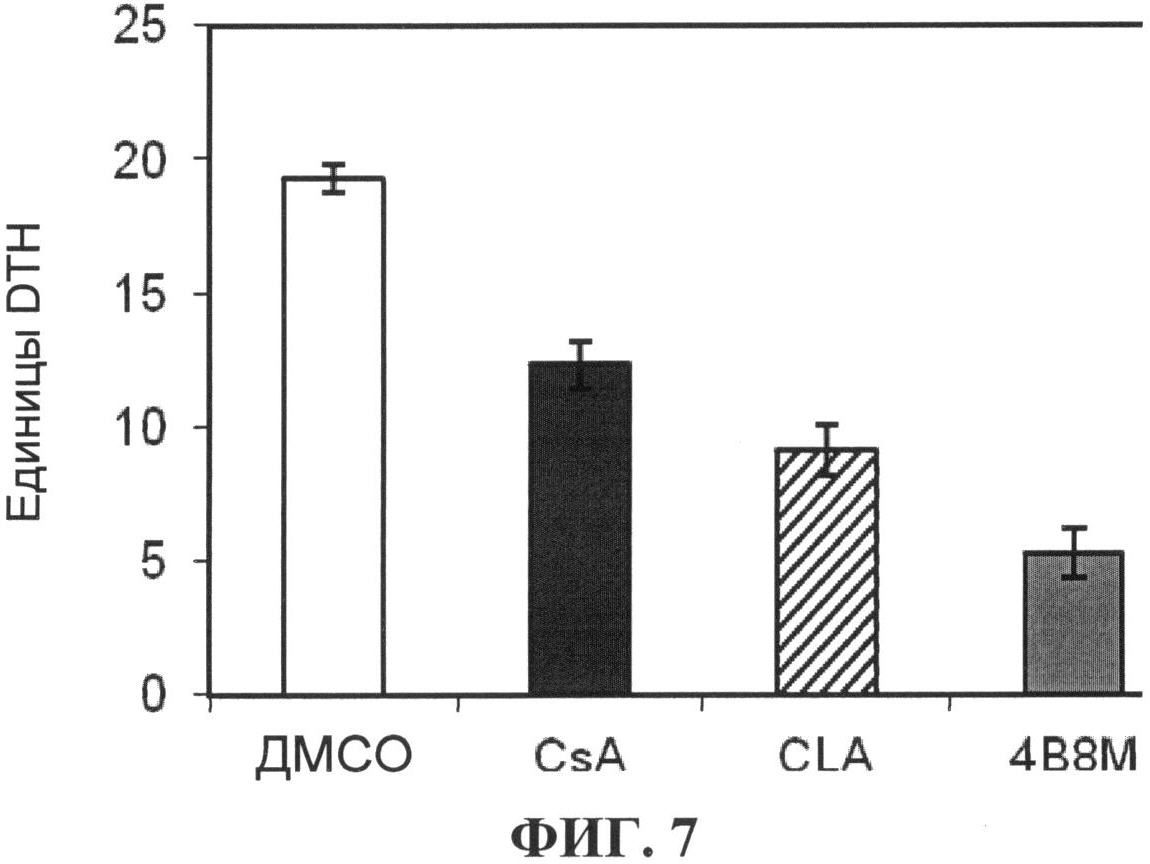
[0071] На фигуре 7 показано влияние внутрибрюшинного введения соединения формулы IA на клеточный иммунный ответ на овальбумин, как описано в Примере 5;
[0072] На фигурах 8А и 8В показано влияние пептидов согласно вариантам реализации настоящего изобретения на выживание мононуклеарных клеток периферической крови (МКПК) in vitro;
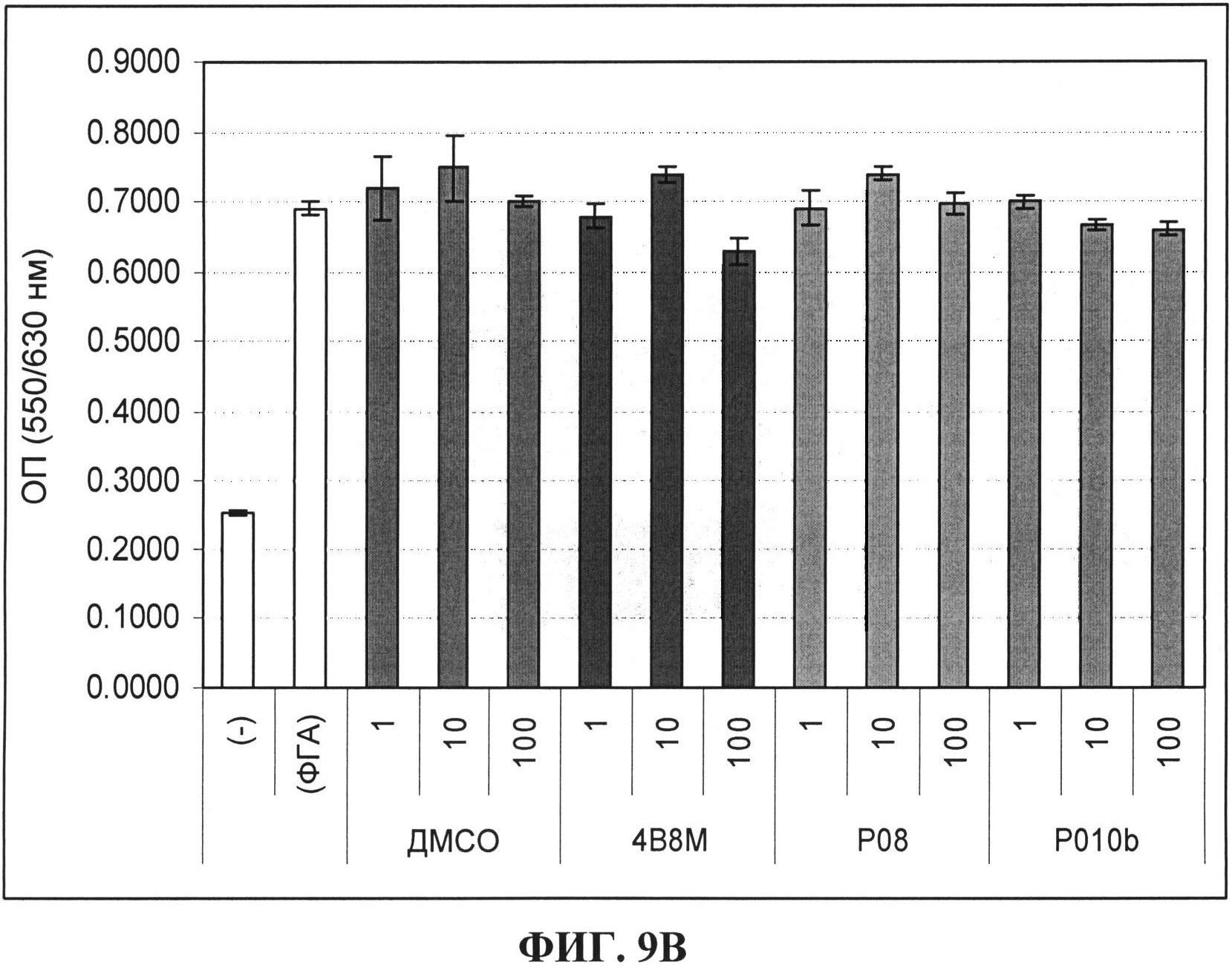
[0073] На фигурах 9А и 9В показано влияние пептидов согласно вариантам реализации настоящего изобретения на ФГА - индуцированную пролиферацию МКПК in vitro;
[0074] На фигурах 10А и 10В показано влияние ряда соединений на изменения толщины уха в ответ на антигенный стимул, как описано в Примере 7;
[0075] На фигуре 11 показана проницаемость кровеносных капилляров при тесте с использованием синего красителя Эванса, как описано в Примере 7;
[0076] На фигуре 12 показано общее число клеток в дренирующих лимфатических узлах, как описано в Примере 7;
[0077] На фигуре 13 показано действие соединений согласно настоящему изобретению на число циркулирующих лейкоцитов, как описано в Примере 7;
[0078] На фигуре 14 показаны типы лейкоцитов, присутствующих в различных случаях, как описано в Примере 7; и
[0079] На фигуре 15 приведены морфометрические данные по числу и составу клеток в ушных раковинах мышей, как описано в Примере 7.
Пример 1. Синтез циклических тетрапептидов
[0080] Циклические тетрапептиды согласно вариантам реализации настоящего изобретения могут быть синтезированы с применением известных способов синтеза пептидов, таких как жидкофазные или твердофазные способы. В целом, синтез включает две последовательные стадии: (1) синтез линейного тетрапептида и (2) его циклизация с получением циклического тетрапептида. Линейный тетрапептид может быть получен в защищенной форме и далее лишен защиты перед циклизацией.
[0081] В качестве иллюстрации, синтез линейных тетрапептидов на твердой подложке (Fmoc-L-фенилаланин, присоединенный к смоле типа Ванга, или любой из L-бета-3-гомофенилаланина или L-пролина, присоединенный к 2-хлортритиловой смоле) осуществляли согласно следующему протоколу:
1. Смолу наращивали в диметилформамиде (ДМФ) (0,25 ммоль, 10 мл/г смолы) в течение 15 минут.
2. Удаляли Fmoc-группу при помощи 20% раствора пиперидина в ДМФ (2×20 минут).
3. Смолу промывали ДМФ (3×2 минуты).
4. Смолу промывали метанолом (MeOH) (3×2 минуты).
5. Смолу промывали дихлорметаном (ДХМ) (3×2 минуты).
6. Аминокислотную или пептидную аминогруппы на смоле ацилировали путем встряхивания со смесью Fmoc-защищенной аминокислоты (4 экв.), HBTU или TBTU (4 экв) и DIPEA (4 экв.), растворенных в безводном ДМФ (4 мл/моль), в течение 20 часов.
7. Смолу промывали ДХМ (3×2 минуты).
8. Смолу промывали МеОН (3×2 минуты).
9. Смолу промывали ДХМ (3×2 минуты).
10. Для определения того, все ли аминогруппы ацилированы, проводили тест Кайзера (для всех аминокислот, кроме пролина).
[0082] Если результат теста Кайзера был отрицательным, смолу промывали ДМФ (1×2 минуты), и начинали новый цикл связывания с пункта 2 протокола. Если результат теста Кайзера был положительным, ацилирование повторяли с половиной количества реагента, примененного в первом связывании. В случае ацилирования пролина тест Кайзера не является достаточно чувствительным для определения степени ацилирования, и по этой причине в случае пролина процедуру связывания повторяли с половиной количества реагентов. В случае повторного ацилирования, проводили следующие промывания:
7А. Промывание ДХМ (3×2 минуты).
8А. Промывание МеОН (3×2 минуты).
9А. Промывание ДХМ (3×2 минуты).
[0083] После последнего связывания смолу промывали согласно пунктам 3-5 протокола. С пептида удаляли Fmoc-группу, как описано в пункте 2, и смолу снова промывали ДМФ, МеОН и ДХМ, как описано в пунктах 3-5. Перед отщеплением пептида от полимерной подложки, смолу высушивали в течение ночи в сушильном шкафу над таблетками KOH при пониженном давлении и комнатной температуре.
[0084] Пептиды отщепляли от высушенной смолы типа Ванга при помощи смеси трифторуксусной кислоты/воды/триизопропилсилана в пропорции 95:2,5:2,5 (об./об./об.; 10 мл/1 г пептидил-смолы). Полученный раствор частично выпаривали при комнатной температуре и пониженном давлении, после чего пептид осаждали при помощи 10 объемов эфира. После фильтрования неочищенный пептид растворяли в 0,05 М водной НС1 и выпаривали досуха. Остаток растворяли в воде и лиофилизировали.
[0085] Пептиды отщепляли от 2-Cl-тритиловой смолы путем обработки смесью уксусной кислоты/дихлорметана/трифторэтанола в пропорции 1:3:1 (об./об./об.; 10 мл/1 г пептидил-смолы). Полученный раствор отщепления вместе с осадками, полученными при промывании, фильтровали, выпаривали досуха при комнатной температуре и пониженном давлении, после чего осадок растворяли в минимальном объеме ДХМ, разбавляли 20 объемами гексана и вторично выпаривали (дважды). Неочищенный отделившийся пептид растворяли в воде и лиофилизировали.
[0086] После того, как лиофилизированный пептид высушивали в сушильном шкафу под вакуумом над KOH и P2O5, он был готов к циклизации.
[0087] При стандартном синтезе согласно вышеописанному протоколу, начиная с присоединения Fmoc-Phe к смоле Ванга (278 мг, 0,2 ммоль, 0,72 ммоль/г) и после последовательного связывания Fmoc-L-β3-homoPhe-OH, Fmoc-Pro-OH и снова Fmoc-Pro-ОН, выход после лиофилизации составил 91 мг (82%) неочищенного линейного пептида с чистотой 94% (ВЭЖХ).
[0088] Неочищенные пептиды циклизировали в растворе ДХМ (концентрация пептида 2×10-4 миллимоль/литр) при помощи PyBOP/HOAl/2,4,6-коллидина (3:3:5), причем исчезновение линейных предшественников прослеживали путем введения образцов реакционных растворов в аналитическую колонку для обращенно-фазовой ВЭЖХ (ОФ). В конце процесса циклизации раствор выпаривали досуха при пониженном давлении, и осадок разделяли между этилацетатом (1000 мл растворителя на 1 миллимоль пептида) и 0,5 N HCl в воде (100 мл раствора на 1 миллимоль пептида). Органическую фазу последовательно промывали 0,5 N HCl в воде (2 раза), водой (1 раз), 1 М NaHCO3 (3 раза) и водой (1 раз). Органический растворитель удаляли при пониженном давлении, и оставшееся твердое вещество растворяли в диоксане и высушивали замораживанием. Неочищенный продукт очищали в препаративной колонке с обращенной фазой Vydac C18 или Kromasil C8 (250 мм/22 мм, 100 А, 10 мкм) с использованием градиента элюирования растворителя В (0,038% TFA в 82% ацетонитрила/воды) в растворителе А (0,05% TFA в воде).
[0089] В качестве примера реакции циклизации, раствор H-Pro-Pro-β3-hPhe-Phe-OH×HCl (55,7 мг, 0,1 ммоль) в 500 мл ДХМ обрабатывали PyBOP (157 мг, 0,3 ммоль) и HOAt (40 мг, 0,3 ммоль) в присутствии 2,4,6-коллидина (67,5 мкл, 0,5 ммоль), что позволяло получить после выделения продукта и его очистки 13,5 мг (27%) циклического тетрапептида с чистотой 99%, что установлено при помощи ВЭЖХ.
[0090] Таким образом, были синтезированы соединения формул I-A-I-P. Приведенная ниже Таблица 1 содержит некоторые данные по соединениям формул I-A-I-P.
Пример 2. Терапевтическая эффективность пептида в форме 0,1% мази на модели контактной чувствительности к оксазолону у мышей линии BALB/c
[0091] Целью данного эксперимента была проверка терапевтического действия соединения I-A и его токсичности на общепринятой модели на животном. В описанном ниже эксперименте соединение формулы I-A применяли в виде терапевтического препарата в форме 0,1% масс./масс. мази на универсальной фармацевтической основе, а именно мази, состоящей из 50% вазелина и 50% ланолина. Изучали применимость препарата для уменьшения эффекторной фазы контактной чувствительности к оксазолону у мышей в сравнении со сходными препаратами, такими как такролимус (Protopic®) и пимекролимус (Elidel®), широко используемыми для лечения кожных заболеваний.
Материалы и методы
[0092] Мыши: для исследования были использованы самки мышей линии BALB/c в возрасте 8-10 недель, предоставленные Институтом лабораторной медицины, Лодзь, Польша (Institute of Laboratory Medicine, Lodz, Poland). Мышей кормили коммерческим гранулированным кормом, с неограниченным доступом к воде. Местный комитет по этике одобрил исследование.
[0093] Реагенты: крем и мазь типа «вода в масле» были предоставлены компанией Nepentes. Циклический тетрапептид (соединение I-A) был синтезирован путем, описанным выше. Protopic® (такролимус) был закуплен у компании Astellas, Ирландия; Elidel® (пимекролимус) был закуплен у компании Novartis; Hydrocortisonum® (гидрокортизон) был закуплен у компании Aflofarm Farmacja Polska, Польша. ДМСО был закуплен у компании Fluka; оксазолон, ацетон, синий краситель Эванса, краситель Гимза, краситель Май-Грюнвальда и формалин были закуплены у компании Sigma.
[0094] Контактная чувствительность к оксазолону: Тест проводили согласно изданию Noonan et al. (Int. Arch. Allergy Appl. Immunol., 1978, 56, 523-532) с некоторыми изменениями. Мышам выбривали живот (зону 2×2 см), спустя 24 часа на выбритую зону наносили 100 мкл 0,5% оксазолона в ацетоне. Реакцию контактной чувствительности вызывали спустя 5 дней путем нанесения 50 мкл 1% оксазолона в ацетоне на обе стороны ушей. Отек ушей измеряли спустя 48 часов при помощи штангенциркуля. Результаты были представлены в форме антиген-специфичного увеличения толщины уха (т.е. исходную толщину уха (BG) вычитали из измеренной толщины).
[0095] Нанесение соединений'. В показанном эксперименте соединение формулы I-A наносили местно в форме 0,1% мази на обе стороны ушей (общий объем - 50 мкл на ухо), спустя 24 и 26 часов после вызывания реакции при помощи второй дозы оксазолона. Контрольные соединения применяли сходным образом в форме коммерчески доступных препаратов.
[0096] Определение числа клеток в лимфатических узлах: Выделяли поверхностные лимфатические узлы околоушной железы, подчелюстной железы и добавочные подчелюстные лимфатические узлы, гомогенизировали их путем прижимания ситом из нержавеющей стали в фосфатно-солевом буфере (ФСБ), дважды промывали и ресуспендировали в ФСБ с 0,2% содержанием трипанового синего. Общее число клеток и число нежизнеспособных клеток определяли при помощи светового микроскопа и гемоцитометра Бюркера. Мышей, обработанных только вызывающей реакцию дозой антигена, использовали в качестве контроля.
[0097] Определение числа циркулирующих лейкоцитов и формулы крови: Мышей подвергали галотановой анестезии, осуществляли забор крови из ретроорбитального сплетения, после чего мышей умерщвляли путем смещения шейных позвонков. Число лейкоцитов крови определяли путем разбавления крови в растворе Тюрка и подсчета клеток в гемоцитометре. Мазки крови готовили на предметном стекле, высушивали и окрашивали красителями Гимза и Май-Грюнвальда. Мазки последовательно подвергали гистологическому анализу. Число циркулирующих лейкоцитов было представлено на 1 мм3, а состав клеток крови был представлен в виде процента определенного типа клеток. Мышей, обработанных только вызывающей реакцию дозой антигена, использовали в качестве контроля.
[0098] Гистологический анализ: Ушные раковины фиксировали в 4% растворе формалина в течение 48 часов, промывали в течение 24 часов, обезвоживали в серии спиртов и заключали в парафин. Парафиновые блоки нарезали при помощи микротома Micron НМ310 на секции толщиной 6 мкм. Секции окрашивали гематоксилином и эозином, а также толуидиновым синим. Гистологический анализ проводили с применением светового микроскопа Nikon Eclipse 801. На гистологических слайдах, содержащих поперечные разрезы ушных раковин, проводили морфометрические подсчеты нейтрофилов, макрофагов, лимфоцитов и тучных клеток в околососудистой и субэпителиальной соединительной ткани. Подсчет клеток осуществляли на площади 0,07 мм2 при 400x увеличении. Морфометрический анализ проводили при помощи программного обеспечения imagine software NIS-Elements (Nikon). Для каждой исследуемой группы было проведено 25 подсчетов числа нейтрофилов, макрофагов, лимфоцитов и тучных клеток.
[0099] Статистика: Результаты представлены в виде средних значений ± среднеквадратическая ошибка (СО). Для определения однородности дисперсии между группами применяли критерий Брауна-Форсайта. При однородности дисперсии проводили дисперсионный анализ (однофакторный дисперсионный анализ), после чего проводили апостериорные сравнения с критерием Тьюки для оценки значимости различий между группами. Непараметрические данные оценивали посредством дисперсионного анализа Крускала-Уоллиса, как указано в тексте. Определенный уровень значимости составил p<0,05. Статистический анализ проводили с применением программного обеспечения STATISTICA 7 для операционной системы Windows. Статистический анализ применим ко всем данным, приведенным в настоящем описании.
Результаты:
[00100] Данные, приведенные на Фигуре 1, демонстрируют терапевтическую эффективность соединения формулы I-A (обозначенного "4В8М" на Фигуре 1 и последующих фигурах) и контрольных препаратов на мышах с полностью развившейся реакцией контактной чувствительности к оксазолону. Препараты наносили местно, как описано в Методах. На Фигуре 1 показаны только антиген-специфичные увеличения толщины уха (как результат вычитания исходных значений, полученных при замерах у несенсибилизированных мышей, которым давали только вызывающую реакцию дозу (S)
антигена). Соединение I-A вызвало примерно 80% ингибирование отека уха; Protopic и Elidel® вызвали примерно 30% и 50% ингибирование соответственно.
[00101] Интенсивность воспалительных процессов в ушах должна коррелировать с количеством клеток в дренирущих лимфатических узлах. Таким образом, ингибирование воспаления должно быть связано со снижением числа клеток в дренирущих лимфатических узлах. На Фигуре 2 показано, что и соединение формулы I-A, и Elidel® уменьшили число лимфоцитов в дренирущих лимфатических узлах до уровня, зарегистрированного у несенсибилизированных мышей. Тем не менее, у мышей, обработанных Protopic®, число клеток в лимфатическом узле было сходно с таковым у необработанных мышей.
[00102] На Фигуре 3 показано соотношение между жизнеспособными и мертвыми клетками в дренирующих лимфатических узлах, выраженное в процентах. Соединение формулы I-A демонстрирует пренебрежимо малый токсический эффект по сравнению с контролем - необработанными мышами. Более высокий токсический эффект вызывает Elidel, a Protopic обладает крайне высокой токсичностью в отношении клеток лимфатических узлов.
[00103] Дополнительную информацию о терапевтической эффективности препаратов можно получить при гистологическом анализе числа и состава клеток в воспаленных ушных раковинах. На Фигуре 4 отображено число и присутствие основных типов клеток, вовлеченных в местный воспалительный процесс.На Фигуре 4, Туч. = тучные клетки, Л = лимфоциты, MØ = макрофаги, H = нейтрофилы. Ушные раковины необработанных мышей (K+) характеризуются высокой степенью инфильтрации нейтрофилов. Нанесение соединения формулы I-A почти полностью обратило изменения, наблюдаемые у контрольных мышей (нормализация числа нейтрофилов с некоторым возрастанием (S) содержания макрофагов). В свою очередь, Protopic вызвал некоторые изменения в соотношении соответствующих типов клеток без снижения общего инфильтрата клеток. Elidel® вызвал небольшое уменьшение общего числа клеток.
Пример 3. Токсичность соединения I-A в сравнении с токсичностью циклинопетида в отношении мононуклеарных клеток крови человека
[00104] Для оценки токсичности соединения формулы I-A были выбраны мононуклеарные клетки периферической крови человека (МКПК). Указанная фракция состоит примерно из 80% лимфоцитов и 20% моноцитов. В качестве контрольного соединения был выбран циклинопептид (CLA) в связи с тем, что соединение формулы I-A имеет общую часть последовательности с CLA. CLA демонстрирует иммунодепрессивные свойства, сравнимые с таковыми циклоспорина А, но является менее токсичным.
Материалы и методы
[00105] Тест на цитотоксичностъ: Производили забор венозной крови у одного донора в гепаринизированные шприцы, дважды разбавляли ее фосфатно-солевым буфером (ФСБ) и помещали на Lymphoprep® (Polfa, Kutno, Польша) (плотность 1,077 г/мл). После центрифугирования при 1200×g в течение 20 минут интерфазные мононуклеарные клетки собирали и 3 раза промывали ФСБ. Клетки ресуспендировали в стандартной среде для культивирования, состоящей из среды RPMI-1640, L-глутамина, пирувата натрия, 2-меркаптоэтанола, по 100 мкг/мл стрептомицина и пенициллина и 10% фетальной телячьей сыворотки. Клетки распределяли по 96-луночным плоскодонным культуральным планшетам при клеточной плотности 2×105/100 мкл. Соединения (формулы I-A и CLA) сначала растворяли в ДМСО (5 мг/500 мкл), затем в среде для культивирования. ДМСО, должным образом разбавленный средой для культивирования, использовали в качестве контроля. После инкубации в течение 24 ч в инкубаторе для клеточных культур определяли жизнеспособность клеток при помощи колометрического метода (Hansen et al., J Immunol Methods, 1989, 119, 203-210).
[00106] Результаты показаны на Фигуре 5 и представлены в виде средних значений оптической плотности из четырех одинаковых лунок (культуры клеток) ± СО. Как показано на Фигуре 5, соединение формулы I-A (обозначенное как "4В8М") не продемонстрировало существенной токсичности в диапазоне концентраций от 10 до 100 мкг/мл. С другой стороны, CLA продемонстрировал статистически значимый цитотоксический эффект при концентрации 40 мкг/мл.
Пример 4. Влияние пептида на гуморальный иммунный ответ на SRBC in vivo
[00107] Самки мышей линии СВА в возрасте 8-12 недель были предоставлены Институтом лабораторной медицины, Лодзь, Польша. У мышей был неограниченный доступ к воде и гранулированному корму. Местный комитет по этике одобрил исследование. Эритроциты овцы (SRBC) были предоставлены Вроцлавским Университетом Природообустройства, Польша; клетки содержали на среде RPMI-1640.
[00108] Первичный гуморальный иммунный ответ на SRBC in vivo: Мышей внутрибрюшинно иммунизировали 0,2 мл 5% суспензии SRBC (0,5 мл SRBC ресуспендировали в 10 мл 0,9% Nad). Спустя 4 дня определяли число антителообразующих клеток (AOK) в селезенке при помощи анализа местного гемолиза в агаровом геле (согласно Mishell et al., J Exp Med, 1967, 126, 423-442). Результаты представлены на Фигуре 6 в виде среднего значения по 5 мышам ± среднеквадратическая ошибка и выражены в виде числа АОК на 106 жизнеспособных селезеночных макрофагов.
[00109] Мышей иммунизировали SRBC, как описано выше, и спустя 2 часа им давали 10 или 100 мкг соединения формулы I-A. Циклоспорин A (CsA) использовали в качестве контрольного соединения. Число антителообразующих клеток к SRBC измеряли спустя 4 дня. Как показано на Фигуре 6, соединение формулы I-A обладало большим ингибирующим действием при обеих дозах, чем CsA.
Пример 5. Влияние пептида на клеточный иммунный ответ на овальбумин in vivo
[00110] Самцы мышей линии СВА в возрасте 8-12 недель были предоставлены Институтом лабораторной медицины, Лодзь, Польша. У мышей был неограниченный доступ к воде и гранулированному корму. Овальбумин был предоставлен компанией Sigma, адъюванты были предоставлены компанией Difco.
[00111] Реакция гиперчувствительности замедленного типа (DTH): Мышей подкожно сенсибилизировали в основание хвоста 5 мкг овальбумина (OVA), эмульгированного в полном адъюванте Фрейнда. Спустя 4 дня проводили иммунизацию мышей путем инъекции 50 мкг OVA в неполном адъюванте Фрейнда в подушечки задних лап. В течение последующих 24 часов производили измерения толщины подушечек лап с помощью штангенциркуля. Контрольных мышей (мышь с фоновым ответом) не сенсибилизировали, однако они получали шоковую дозу OVA. Соединение формулы I-A и контрольное соединение вводили мышам внутрибрюшинно в двух дозах по 100 мкг, за 2 часа до введения сенсибилизирующей дозы антигена и 24 часа спустя. Результаты, представленные на Фигуре 7 в виде среднего значения антиген-специфичного увеличения толщины подушечек лап, измеренного у 5 мышей и выраженного в единицах DTH (одна единица DTH=10-2 см) ± среднеквадратическая ошибка, демонстрируют, что соединение формулы I-A, введенное в двух дозах спустя 2 ч и 24 ч после иммунизации, ингибировало реакцию гиперчувствительности замедленного типа на OVA. Указанное подавляющее действие было сильнее таковых CLA и CsA.
Пример 6
[00112] Проводили тестирование циклических тетрапептидов in vitro на предмет их влияния на пролиферацию мононуклеарных клеток периферической крови человека (МКПК), вызванную фитогемагглютинином А (РИА), а также на выработку фактора некроза опухолей альфа (ФНО-α), вызванную липополисахаридом (ЛПС), культурами клеток цельной крови при диапазоне концентраций 1-100 мкг/мл. Также проводили тестирование соединений на предмет токсического воздействия на клетки МКПК человека при диапазоне концентрации 1-100 мкг/мл.
Материалы и методы:
[00113] Реагенты: среда RPMI-1640 (Cibi/Life Technologies, UK), фетальная телячья сыворотка (ФТС, Gibco), ДМСО, фитогемагглютинин А (ФГА), липополисахарид (ЛПС), полученный из штамма Е.coli 0111:B4 (Sigma), бромид 93-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразола (МТТ), SDS и ДМФ (Sigma). Среда для культивирования состояла из RPMI-1640, 10% добавления ФТС, L-глутамина, пирувата натрия, 2-меркаптоэтанола и антибиотиков (стрептомицина и пенициллина). Циклические тетрапептиды сначала растворяли в ДМСО (5 мг/мл), затем - в среде для культивирования до нужной концентрации.
[00114] Выделение МКПК: Производили забор венозной крови у одного донора (мужчина, 62 года) в гепаринизированные шприцы и дважды разбавляли ее фосфатно-солевым буфером (ФСБ). МКПК изолировали путем центрифугирования по градиенту Ficoll-uropoline (плотность 1,077 г/мл) (Lymphoprep; PAA Laboratories) при 800×g в течение 20 минут при 4°C. Интерфазные клетки, состоящие из лимфоцитов (20%) и моноцитов (80%), затем промывали три раза средой Хэнка и ресуспендировали в среде для культивирования клеток при клеточной плотности 2×106 клеток/мл.
[00115] Пролиферативный ответ МКПК на ФГА: Изолированные МКПК помещали в 96-луночные плоскодонные планшеты в 100 мкл аликвот (2×105 клеток/лунку). ФГА использовали при концентрации 5 мкг/мл. Тестирование соединений проводили при концентрации 1, 10 и 100 мкг/мл. ДМСО при должном разбавлении использовали в качестве контроля. После 4 дней инкубации в инкубаторе для клеточных культур определяли жизнеспособность клеток при помощи колометрического метода МТТ (Hansen et al., J Immunol Methods, 1989, 119, 203-210). Данные представлены в виде средних значений оптической плотности из четырех одинаковых лунок±среднеквадратическая ошибка (СО). Культуры «Контроль (-)» не содержали митогена (ФГА). Культуры «Контроль (ФГА)» содержали ФГА, но не содержали циклических тетрапептидов.
[00116] Тест на токсичность: МКПК, ресуспендированные в среде для культивирования, при клеточной плотности 2×105/100 мкл/лунку культивировали в течение 24 часов в инкубаторе для клеточных культур с циклическими тетрапептидами в концентрациях 1,10 и 100 мкг/мл. Выживаемость клеток определяли при помощи колориметрического метода МТТ (Hansen et al., J.Immunol. Methods, 1989, pp.203-210). Данные представлены в виде средних значений оптической плотности из четырех одинаковых лунок±среднеквадратическая ошибка (СО). Культуры «Контроль (-)» содержали только клетки в среде для культивирования.
[00117] Определение активности ФНО-альфа (по Espevik et al., J.Immunol. Methods. 95 (1986):99-103): Цельную кровь человека 10-кратно разбавляли средой RPMI-1640 и помещали в 24-луночные культуральные планшеты в 1 мл аликвот. К культуре добавляли ЛПС в концентрации 1 мкг/мл. Изучаемые пептиды применяли в концентрациях 1, 10 и 100 мкг/мл. После инкубации в течение ночи собирали надосадочную жидкость и замораживали ее при -20°C до определения цитокинов. Определяли активность ФНО-α при помощи биопробы. Вкратце, высевали клетки WEHI 164.13 (АТСС CRL 1751) при клеточной плотности 2×104 клеток/лунку в четырех экземплярах. Надосадочную жидкость в увеличивающихся степенях разбавления перемешивали с целевыми клетками в присутствии актиномицина D (1 мкг/мл). После инкубации в течение 20 часов, в лунки добавляли МТТ, и культуры инкубировали в течение еще 4 часов. Затем добавляли лизирующий буфер (20% SDS с 50% ДМФ, pH 4,7), и спустя 24 часа измеряли оптическую плотность при 550 нм в спекторофотометре Dynatech 5000 с опорной длиной волны 630 нм. Предел обнаружения при анализе составил примерно 2,5 пг/мл. Одна единица активности ФНО-α была определена как обратная титру разведения надосадочной жидкости, при которой наблюдалась 50% смертность клеток. Культуры, обозначенные «Контроль (-)», содержали ЛПС и не содержали ни одного из исследуемых соединений. Статистический анализ не применяли, так как данные были получены на основе одной культуры (лунки).
[00118] Колориметрический МТТ-анализ роста и гибели клеток: Анализ осуществляли по Hansen et al., J.Immunol. Methods, 1989, 119 pp.203-210. Вкратце, добавляли 25 мкл исходного раствора МТТ (5 мг/мл) на лунку в конце инкубации клеток, после чего планшеты инкубировали в течение 3 часов в инкубаторе для клеточных культур. Затем добавляли 100 мкл буфера для экстракции (20% SDS с 50% ДМФ, pH 4,7). После дополнительной инкубации в течение ночи измеряли оптическую плотность при 550 нм (Dynatech 5000).
[00119] Там, где это применимо, результаты представлены в виде средних значений ± среднеквадратическая ошибка (СО). Для определения однородности дисперсии между группами применяли критерий Брауна-Форсайта. При однородности дисперсии проводили дисперсионный анализ (однофакторный дисперсионный анализ), после чего проводили апостериорные сравнения с критерием Тьюки для оценки значимости различий между группами. Определенный уровень значимости составил p<0,05. Статистический анализ проводили с применением программного обеспечения STATISTICA 6.1 для операционной системы Windows.
Результаты
[00120] Влияние соединений на выживаемость МКПК: Влияние пептидов на выживаемость МКПК в 24-часовой культуре показано на Фигурах 8А и 8В. Пептид 4 В8М (соединение I-A) включили в исследование в качестве контрольного соединения. К контрольным культурам добавляли должным образом разбавленные дозы ДМСО. Результаты продемонстрировали отсутствие признаков токсичности соединений в изучаемом диапазоне концентраций. На фигурах, Р01 = соединение I-D, P02 = соединение I-Е, Р03 = соединение I-F, P04 = соединение I-G, P05 = соединение I-H, P06 = соединение I-J, P07=соединение I-K, P08=соединение I-L, Р10а = соединение 1-М, P10b = соединение I-N и Р11 = соединение I-O.
[00121] На Фигурах 8А и 8В показано влияние тестируемых пептидов на выживаемость МКПК. Фигура 8А: Статистика (все сравнения относительно ДМСО при должном разбавлении): 100 мкг/мл: 4 В8М NS (Р=0,9999); Р01 NS (Р=1,0000); P02 NS (Р=1,0000); Р03 NS (Р=1,0000); P04 NS (Р=0,9047); P05 NS (Р=1,0000); P06 NS (Р=0,9999); P07 NS (Р=1,0000); 10 мкг/мл: 4 В8М NS (Р=1,0000); Р01 NS (P=1,0000); P02 NS (Р=1,0000); Р03 NS (Р=1,0000); P04 NS (Р=0,9999); P05 NS (Р=1,0000); P06 NS (Р=1,0000); P07 NS (Р=1,0000); 1 мкг/мл: 4 В8М NS (Р=1,0000); Р01 NS (Р=1,0000); P02 NS (Р=1,0000); Р03 NS (Р=1,0000); P04 NS (Р=1,0000); P05 NS (Р=1,0000); P06 NS (Р=0,8253); P07 NS (Р=1,0000) (дисперсионный анализ). Фигура 8 В: Статистика (все сравнения относительно ДМСО при должном разбавлении): 100 мкг/мл: 4 В8М NS (Р=0,0669); P08 NS (Р=0,9957); Р10b NS (Р=1,0000); 10 мкг/мл: 4 В8М NS (Р=0,9999); P08 NS (Р=1,0000); Р10b NS (Р=1,0000); 1 мкг/мл: 4 В8М NS (Р=0,3176); Р08 NS (P=0,9999); P10b NS (P=1,0000) (дисперсионный анализ).
[00122] Влияние пептидов на ФГА - индуцированную пролиферацию МКПК: Влияние пептидов на ФГА - индуцированную пролиферацию МКПК показано на фигурах 9А и 9В.
Пептид 4 В8М включили в исследование в качестве контрольного соединения. К контрольным культурам добавляли должным образом разбавленные дозы ДМСО.
[00123] Фигура 9А: Влияние пептидов на ФГА - индуцированную пролиферацию МКПК: Статистика (все сравнения относительно ДМСО при должном разбавлении): 1 мкг/мл: 4 В8М NS (Р=0,9995); Р01 NS (P=1,0000); P02 NS (Р=1,0000); Р03 NS (P=1,0000); P04 NS (Р=0,9047); Р03 NS (P=0,5198); P06 NS (P=1,0000); P07 NS (Р=0,1445); 10 мкг/мл: 4В8М NS (Р=1,0000); Р01 NS (Р=0,9999); P02 NS (Р=1,0000); Р03 NS (P=0,9930); P04 NS (Р=0,4297); Р03 NS (Р=1,0000); P06 NS (Р=1,0000); P07 NS (Р=0,8647); 100 мкг/мл: 4 В8М NS (Р=1,0000); Р01 NS (Р=1,0000); P02 NS (Р=0,9982); Р03 Р=0,0001; P04 NS (Р=0,9970); Р03 NS (Р=0,2037); P06 NS (Р=0,1257); P07 NS (Р=1,0000) (дисперсионный анализ).
[00124] Фигура 9В: Влияние пептидов ФГА - индуцированную пролиферацию МКПК: Статистика (все сравнения относительно ДМСО при должном разбавлении): 1 мкг/мл: 4В8М NS (P=0,9919); P08 NS (P=0,9999); P10b NS (Р=1,0000); 10 мкг/мл: 4В8М NS (P=1,0000); P08 NS (Р=1,0000); P10b NS (Р=0,2763); 100 мкг/мл: 4 В8М NS (P=0,4941); P08 NS (P=1,0000); P10b NS (Р=0,9933) (дисперсионный анализ).
[00125] Влияние пептидов на ЛПС-индуцированную выработку ФНО-α в клеточных культурах цельной крови: Влияние пептидов на ЛПС-индуцированную выработку ФНО-α в клеточных культурах цельной крови показано в Таблицах 2А и 2В. Пептид 4В8М включили в исследование в качестве контрольного соединения. К контрольным культурам добавляли должным образом разбавленные дозы ДМСО.
Пример 7. Ингибиторный эффект соединения 1-А на воспаление уха у мышей, вызванное диизоцианатом толуола
[00126] Эффективность соединения 1-А в отношении подавления воспаления уха у мышей линии BALB/c, вызванного диизоцианатом толуола (ДИТ). В качестве контрольных соединений использовали коммерчески доступные препараты Protopic® (такролимус) и Elidel® (пимекролимус).
Материалы и методы
[00127] Мыши: самки мышей линии BALB/c в возрасте 8-10 недель были предоставлены Институтом лабораторной медицины, Лодзь, Польша. Мышей кормили коммерческим гранулированным кормом, с неограниченным доступом к воде. Местный комитет по этике одобрил исследование.
[00128] Реагенты: Соединение 1-А синтезировали способом, описанным выше; Protopic® (такролимус) был закуплен у компании Astellas, Ирландия; Elidel® (пимекролимус) был закуплен у компании Novartis; ДМСО был закуплен у компании Fluka; ДИТ, ацетон, синий краситель Эванса, краситель Гимза, трипановый синий, краситель Май-Грюнвальда, гематоксилин, эозин, толуидиновый синий и формалин были закуплены у компании Sigma.
[00129] Иммунный ответ на ДИТ. Тест проводили согласно Yamamoto, Eur. J. Pharmacol., 2006, 550, 166-172, с незначительными изменениями. Мышам выбривали живот (зону 2×2 см) и спустя 24 часа на выбритую зону наносили 100 мкл 3% ДИТ в ацетоне 3 дня подряд. Спустя 14 дней вызывали реакцию путем нанесения 50 мкл 0,3% ДИТ на обе стороны ушей. Процедуру повторяли 5 раз каждые 3 дня. Отек ушей измеряли при помощи штангенциркуля (Mitutoyo) спустя 5 ч и 24 ч после каждой иммунизации ДИТ.
[00130] Нанесение соединений. Соединение I-A наносили местно в форме 0,1% мази на обе стороны ушей (общий объем 100 мкл - 50 мкл на ухо) спустя 1 час после каждой иммунизации ДИТ. Контрольные соединения наносили сходным образом.
[00131] Определение числа клеток в лимфатических узлах. Выделяли поверхностные лимфатические узлы околоушной железы, подчелюстной железы и добавочные подчелюстные лимфатические узлы, гомогенизировали их путем прижимания ситом из нержавеющей стали в фосфатно-солевом буфере (ФСБ), дважды промывали ФСБ и ресуспендировали в ФСБ с 0,2% содержанием трипанового синего. Общее число клеток и число нежизнеспособных клеток определяли при помощи светового микроскопа и гемоцитометра Бюркера.
[00132] Определение числа циркулирующих лейкоцитов и формулы крови. Мышей подвергали галотановой анестезии, осуществляли забор крови из ретроорбитального сплетения, после чего мышей умерщвляли путем смещения шейных позвонков. Число лейкоцитов крови определяли путем разбавления крови в растворе Тюрка и подсчета клеток в гемоцитометре. Мазки крови готовили на предметном стекле, высушивали и окрашивали красителями Гимза и Май-Грюнвальда. Мазки последовательно подвергали гистологическому анализу. Число клеток было представлено на 1 мкл, а состав клеток крови был представлен в виде процента определенного типа клеток.
[00133] Тест с применением синего красителя Эванса. Мышам внутривенно вводили 1 мг синего красителя Эванса в 0,2 мл 0,9% NaCl. Спустя 30 минут мышей умерщвляли, уши отрезали, взвешивали и погружали в 50 мкл 1М KOH на 18 ч при 37°С. Краситель извлекали из ушей при помощи 450 мкл 0,2 М фосфорной кислоты и ацетона (соотношение 5:13). Образцы центрифугировали на 3000 об./мин в течение 15 минут. Оптическую плотность надосадочных жидкостей измеряли при 630 нм. Количество синего красителя Эванса (мкг/мл) определяли на основании стандартной кривой. Результаты были представлены в виде количества синего красителя Эванса на 100 мг сырой ткани. Мышей, обработанных только вызывающей реакцию дозой антигена, использовали в качестве контроля.
[00134] Гистологический анализ. Ушные раковины фиксировали в 4% растворе формалина в течение 48 часов, промывали в течение 24 часов, обезвоживали в серии спиртов и заключали в парафин. Парафиновые блоки нарезали при помощи микротома Micron HM310 на секции толщиной 6 мкм. Секции окрашивали гематоксилином и эозином, а также толуидиновым синим. Гистологический анализ проводили с применением светового микроскопа Nikon Eclipse 801. На гистологических слайдах, содержащих поперечные разрезы ушных раковин, проводили морфометрические подсчеты нейтрофилов, макрофагов, лимфоцитов и тучных клеток в околососудистой и субэпителиальной соединительной ткани. Подсчет клеток осуществляли на площади 0,07 мм2 при 400х увеличении. Морфометрический анализ проводили при помощи программного обеспечения imagine software NIS-Elements (Nikon). Для каждой исследуемой группы было проведено 25 подсчетов числа нейтрофилов, макрофагов, лимфоцитов и тучных клеток.
[00135] Статистика. Результаты представлены на Фигурах 10А и 10B в виде средних значений ± среднеквадратическая ошибка (СО). Для определения однородности дисперсии между группами применяли критерий Брауна-Форсайта. При однородности дисперсии проводили дисперсионный анализ (однофакторный дисперсионный анализ), после чего проводили апостериорные сравнения с критерием Тьюки для оценки значимости различий между группами. Непараметрические данные оценивали посредством дисперсионного анализа Крускала-Уоллиса, как указано в тексте. Определенный уровень значимости составил Р<0,05. Статистический анализ проводили с применением программного обеспечения STATISTICA 7 для операционной системы Windows.
Результаты
[00136] Влияние соединений на толщину ушей. Гуморальный иммунный ответ на ДИТ вызывали образом, описанным в Методах. На мышей местно наносили тетрапептид (формулы I-A, обозначенный 4В8М на Фигурах 10А и 10В) и контрольные соединения спустя 1 час после каждой иммунизации антигеном. Влияние обработки показано на Фигурах 10А и 10В, демонстрирующих измерения толщины уха 5 ч (Фигура 10А) и 24 ч (Фигура 10В) спустя нанесения в день проведения теста, указанный на фигуре. Контрольные ответы на ДИТ постепенно усиливались после каждой иммунизации антигеном (наиболее хорошо заметно при измерении спустя 5 ч). Результаты продемонстрировали дифференцированную эффективность соединений в уменьшении опухоли уха.
[00137] Фигура 10А: День 14: Контроль в сравнении с 4 В8М Р=0,0005; Контроль в сравнении с Protopic® P=0,0002; Контроль в сравнении с Elidel® P=0,0152; 4B8M в сравнении с Protopic® NS; 4B8M в сравнении с Elidel® NS; День 17: Контроль в сравнении с 4B8M Р=0,0001; Контроль в сравнении с Protopic® P=0,0001; Контроль в сравнении с Elidel® Р=0,0377; 4B8M в сравнении с Protopic® NS; 4B8M в сравнении с Elidel® P=0,0002; День 20: Контроль в сравнении с 4B8M Р=0,0001; Контроль в сравнении с Protopic® Р=0,0001; Контроль в сравнении с Elidel® NS; 4B8M в сравнении с Protopic® NS; 4B8M в сравнении с Elidel® P=0,0001; День 23: Контроль в сравнении с 4B8M Р=0,0001; Контроль в сравнении с Protopic® P=0,0001; Контроль в сравнении с Elidel® NS; 4B8M в сравнении с Protopic® NS; 4B8M в сравнении с Elidel® P=0,0001; День 27: Контроль в сравнении с 4B8M Р=0,0001; Контроль в сравнении с Protopic® P=0,0001; Контроль в сравнении с Elidel® Р=0,0001; 4B8M в сравнении с Protopic® NS; 4B8M в сравнении с Elidel® P=0,0001 (дисперсионный анализ). Фигура 10В: День 14: Контроль в сравнении с 4B8M Р=0,0001; Контроль в сравнении с Protopic® Р=0,0001; Контроль в сравнении с Elidel® P=0,0004; 4B8M в сравнении с Protopic® NS; 4B8M в сравнении с Elidel® NS; День 17: Контроль в сравнении с 4B8M Р=0,0001; Контроль в сравнении с Protopic® P=0,0023; Контроль в сравнении с Elidel® Р=0,0004; 4B8M в сравнении с Protopic® NS; 4B8M в сравнении с Elidel® NS; День 20: Контроль в сравнении с 4B8M Р=0,0006; Контроль в сравнении с Protopic® P=0,0003; Контроль в сравнении с Elidel® P=0,0156; 4B8M в сравнении с Protopic® NS; 4B8M в сравнении с Elidel® NS; День 23: Контроль в сравнении с 4B8M Р=0,0001; Контроль в сравнении с Protopic® P=0,0001; Контроль в сравнении с Elidel® Р=0,0039; 4B8M в сравнении с Protopic® NS; 4B8M в сравнении с Elidel® P=0,0027; День 27: Контроль в сравнении с 4B8M Р=0,0001; Контроль в сравнении с Protopic® P=0,0001; Контроль в сравнении с Elidel® Р=0,0023; 4B8M в сравнении с Protopic® NS; 4B8M в сравнении с Elidel® P=0,0016 (дисперсионный анализ).
[00138] Влияние соединений на проницаемость кровеносных сосудов: Проницаемость кровеносных капилляров представлена на Фигуре 11, которая демонстрирует проницаемость кровеносных капилляров при тесте с использованием синего красителя Эванса. Процедуру, описанную выше, проводили спустя 24 часа после пятой иммунизации ДИТ (на 28 день). Как показано на Фигуре 11, показатели проницаемости кровеносных сосудов строго коррелируют с влиянием соединений на толщину уха у мышей соответствующих групп. Статистика: BG в сравнении с Контролем Р=0,0248;
Контроль в сравнении с 4B8M (I-A) Р=0,030; Контроль в сравнении с Protopic® NS; Контроль в сравнении с Elidel® NS; 4B8M (I-A) в сравнении с Protopic® NS; 4B8M (I-A) в сравнении с Elidel® NS (дисперсионный анализ).
[00139] Влияние соединений на число клеток в дренирующих лимфатических узлах: На Фигуре 12 показано общее число клеток в дренирующих лимфатических узлах. Как показано на Фигуре 12, обработка мышей соединением I-A привела к уменьшению числа клеток в лимфатических узлах почти до естественного уровня (несенсибилизированные мыши). Статистика: BG в сравнении с Контролем Р=0,0001; Контроль в сравнении с 4B8M (I-A) Р=0,0001; Контроль в сравнении с Protopic® NS; Контроль в сравнении с Elidel® NS; 4B8M (I-A) в сравнении с Protopic® Р=0,0183; 4B8M (I-A) в сравнении с Elidel® Р=0,0001 (дисперсионный анализ Крускала-Уоллиса).
[00140] Влияние соединений на число циркулирующих лейкоцитов. На Фигуре 13 показано влияние соединений на число циркулирующих лейкоцитов; нанесение изучаемых препаратов снизило число циркулирующих лейкоцитов до уровней, наблюдаемых у контрольных, несенсибилизированных мышей. Статистика: BG в сравнении с Контролем Р=0,0001; Контроль в сравнении с 4B8M (I-A) Р=0,0001; Контроль в сравнении с Protopic® Р=0,0001; Контроль в сравнении с Elidel® Р=0,0001; 4B8M (I-A) в сравнении с Protopic® NS; 4B8M (I-A) в сравнении с Elidel® NS (дисперсионный анализ).
[00141] Влияние соединений на состав клеток крови: Состав крови у контрольных мышей с полностью развившейся реакцией на ДИТ характеризовался увеличенным содержанием нейтрофилов и эозинофилов по сравнению с контрольными, несенсибилизированными мышами (Фигура 14, на которой показано расщепление типов лейкоцитов в каждом случае). Формула крови нормализовалась после нанесения 4B8M (I-А) (уменьшение содержания нейтрофилов и эозинофилов), но не после нанесения Protopic или Elidel. Статистика: Палочкоядерные нейтрофилы (ПН): BG в сравнении с Контролем NS; Контроль в сравнении с 4B8M (I-A) NS; Контроль в сравнении с Protopic® Р=0,0500; Контроль в сравнении с Elidel® Р=0,0500; 4B8M (I-A) в сравнении с Protopic® NS; 4B8M в сравнении с Elidel® NS (дисперсионный анализ Крускала-Уоллиса); Сегментоядерные нейтрофилы (СН): BG в сравнении с Контролем Р=0,0131; Контроль в сравнении с 4B8M (I-A) NS; Контроль в сравнении с Protopic® NS; Контроль в сравнении с Elidel® NS; 4B8M (I-A) в сравнении с Protopic® Р=0,0163; 4B8M (I-A) в сравнении с Elidel® NS (дисперсионный анализ Крускала-Уоллиса); Эозинофилы (Э): BG в сравнении с Контролем Р=0,0001; Контроль в сравнении с 4B8M (I-A) Р=0,0001; Контроль в сравнении с Protopic® NS; Контроль в сравнении с Elidel® NS; 4B8M (I-A) в сравнении с Protopic® NS; 4B8M в сравнении с Elidel® Р=0,0146 (дисперсионный анализ Крускала-Уоллиса); Лимфоциты (Л): BG в сравнении с Контролем Р=0,0001; Контроль в сравнении с 4 В8М (I-A) Р=0,0043; Контроль в сравнении с Protopic® NS; Контроль в сравнении с Elidel® NS; 4 В8М (I-A) в сравнении с Protopic® Р=0,0345; 4 В8М (I-A) в сравнении с Elidel® NS (дисперсионный анализ Крускала-Уоллиса).
[00142] Влияние соединений на состав клеток в ушных раковинах: На Фигуре 15 представлены морфометрические данные о числе и составе клеток в ушных раковинах. Состав типов клеток в ушных раковинах, различающийся среди изучаемых групп мышей, показан на Фигуре 15. Преобладающими постоянно присутствующими типами клеток у контрольных несенсибилизированных мышей являются тучные клетки и нейтрофилы (10 и 5 клеток на анализируемую зону, соответственно). У сенсибилизированных контрольных мышей, не обработанных терапевтическими средствами, число тучных клеток увеличивалось в два раза, а нейтрофилов - почти в пять раз (20 и 23 клетки, соответственно). Protopic® и соединение I-A эффективно снизили число клеток до 14 и 14,8. Статистика: Н (нейтрофилы): BG в сравнении с Контролем Р=0,0001; Контроль в сравнении с 4В8М (I-A) Р=0,0151; Контроль в сравнении с Protopic® Р=0,0001; Контроль в сравнении с Elidel® NS; 4В8М в сравнении с Protopic® NS; 4В8М (I-A) в сравнении с Elidel® Р=0,0003 (дисперсионный анализ Крускала-Уоллиса); М0 (макрофаги): BG в сравнении с Контролем Р=0,0144; Контроль в сравнении с 4В8М (I-A) NS; Контроль в сравнении с Protopic® NS; Контроль в сравнении с Elidel® P=0,0255; 4 В8М в сравнении с Protopic® NS; 4В8М (I-A) в сравнении с Elidel® Р=0,0031 (дисперсионный анализ Крускала-Уоллиса); Л (лимфоциты): BG в сравнении с Контролем NS; Контроль в сравнении с 4 В8М (I-A) NS; Контроль в сравнении с Protopic® NS; Контроль в сравнении с Elidel® Р=0,0023; 4В8М в сравнении с Protopic® NS; 4В8М (I-A) в сравнении с Elidel® Р=0,0001 (дисперсионный анализ Крускала-Уоллиса); Туч. (тучные клетки): BG в сравнении с Контролем Р=0,0001; Контроль в сравнении с 4В8М (I-A) NS; Контроль в сравнении с Protopic® Р=0,0001; Контроль в сравнении с Elidel® NS; 4В8М (I-A) в сравнении с Protopic® NS; 4 В8М (I-A) в сравнении с Elidel® Р=0,0001 (дисперсионный анализ Крускала-Уоллиса).
Пример 8 - In vitro тестирование Соединений I-B и I-C
Методы
[00143] Пролиферативный ответ селезеночных макрофагов на конканавалин А (КонА): Селезенки прижимали пластиковым экраном в 0,83% растворе NH4Cl для лизирования эритроцитов (инкубация 5 минут при комнатной температуре). Затем клетки два раза промывали средой Хэнка, пропускали через колонку из стекловаты для удаления дебриса и ресуспендировали в среде для культивирования, называемой далее «средой для культивирования», состоящей из RPMI-1640 с добавлением 10% фетальной телячьей сыворотки, L-глутамина, пирувата натрия, 2-меркаптоэтанола, стрептомицина и пенициллина (100 мкг/мл). Клетки переносили в 96-луночные плоскодонные планшеты для культивирования тканей (Nunc) при клеточной плотности 2×105 клеток/100 мкл/лунку. Добавляли Кон А (2,5 мкг/мл) для вызывания пролиферации клеток. К культурам добавляли соединения в дозах 1-100 мкг/мл. После инкубации в течение трех дней определяли пролиферацию клеток при помощи колориметрического МТТ - метода (Hansen MB, J Immunol Methods, 1989, 119, 203-210). Результаты были представлены в виде средней оптической плотности (ОП) при 550 нм ± CO, вычисленной на основании четырех экземпляров(лунок).
[00144] Вторичный гуморальный иммунный ответ in vitro на эритроциты овцы (SRBQ: Мышей внутрибрюшинно сенсибилизировали 0,2 мл 5% (об./об.) суспензии SRBC. Спустя 4 дня у указанных мышей выделяли селезенку и готовили суспензии отдельных клеток путем гомогенизации в растворе ФСБ. После промывания клеток в ФСБ путем центрифугирования, клетки ресуспендировали в среде для культивирования при клеточной плотности 5×106 клеток/мл. Клетки последовательно переносили в 24-луночные культуральные планшеты в 1 мл аликвоты, и в каждую лунку добавляли 0,05 мл 0,005% SRBC в качестве антигена. Соединения добавляли к культурам в начале четырехдневного периода инкубации в диапазоне концентраций 1-100 мкг/мл. Число антитело-формирующих клеток (АФК) в культурах определяли при помощи метода местного гемолиза в агаровом геле согласно Mishell et al., JExp Med, 1967, 126, 423-442.
[00145] Тест на токсичность: Селезеночные макрофаги при клеточной плотности 2×105 клеток/100 мкл/лунку, ресуспендированные в среде для культивирования, культивировали в течение 24 часов в инкубаторе для клеточных культур с соединениями (1-100 мкг/мл). Выживаемость клеток определяли при помощи колориметрического МТТ-метода. Результаты были представлены в виде средней оптической плотности (ОП) при 550 нм, вычисленной на основании 4 лунок. Жизнеспособность клеток при соответствующих концентрациях соединений сравнивали с подходящими контрольными ДМСО-группами (100% выживаемость), согласовывающимися с соответствующими концентрациями соединений.
Результаты
[00146] При концентрациях 50-100 мкг/мл соединение I-C продемонстрировало сильный ингибирующий эффект на пролиферацию селезеночных макрофагов мыши, индуцированную конканавалином А. При 100 мкг/мл данное соединение продемонстрировало 70% токсичность по отношению к селезеночным макрофагам. При 10 мкг/мл и 100 мкг/мл соединение I-C продемонстрировало 33% и 80% подавления соответственно на модели in vitro гуморального ответа культур селезеночных макрофагов мыши на SRBC. На модели гиперчувствительности к овальбумину замедленного типа, соединение I-C продемонстрировало 26,9% ингибирования при дозе 100 мкг по сравнению с 72,7% ингибирования соединением I-A.
[00147] При концентрации 100 мкг/мл соединение I-B продемонстрировало слабое антипролиферативное влияние на пролиферацию селезеночных макрофагов, вызванную конканавалином А; при более низких концентрациях такого влияния не наблюдалось. Соединение I-B при такой концентрации имело токсичность 30%.
[00148] Несмотря на то что вышеизложенное изобретение было описано в некоторых деталях в иллюстративных целях, специалисту в области техники будет очевидно, что возможно внесение изменений и модификаций без отступления от объема описанного здесь изобретения.
Реферат
Изобретение относится к циклическим тетрапептидам формулы I, их фармацевтическим композициям, способу получения тетрапептидов формулы I и набору, содержащему соединения формулы I. Соединения предназначены для подавления иммунного ответа у пациента. 7 н. и 13 з.п. ф-лы, 15 ил., 3 табл., 8 пр.
Формула

где каждый k и n представляют собой 0, m и p независимо представляют собой 0 или 1, при условии что по меньшей мере один из m и р не равен 0;
каждый R и R′ независимо выбран из Н и C1-3 алкила или, взятые вместе, R и R′ представляют собой -CR1R1′-Х-СН2-, где CR1R1′ присоединен к азоту остова,
каждый R1 и R1′ представляет собой Н и X выбран из -СН2-, -СН2СН2- и -СН(ОН)-;
каждый R′′ и R′′′ независимо выбран из Н и C1-3 алкила или, взятые вместе, R′′ и R′′′ представляют собой -CR2R2′-Х′-СН2-, где CR2R2′ присоединен к азоту остова, каждый R2 и R2′ представляет собой Н и X′ выбран из -СН2-, -СН2СН2- и -СН(ОН)-; и
каждый R3 и R4 независимо выбран из арила, замещенного арила, гетероарила и замещенного гетероарила, где
арил представляет собой 6-членное ароматическое кольцо, бициклическую 9- или 10-членную систему ароматических колец или трициклическую 13- или 14-членную систему ароматических колец;
гетероарил представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее 1-3 гетероатома, выбранных из О, N или S; бициклическую 9- или 10-членную систему гетероароматических колец, содержащую 1-3 гетероатома, выбранных из О, N или S; или трициклическую 13- или 14-членную систему гетероароматических колец, содержащую 1-3 гетероатома, выбранных из О, N или S; и
замещенный арил и замещенный гетероарил представляют собой арил и гетероарил, соответственно, до трех атомов Н в каждом остатке замещены алкилом, галогеном, галоалкилом, гидрокси, низшим алкокси, карбокси, карбоалкокси (также называемым алкоксикарбонилом), карбоксиамидо (также называемым алкиламинокарбонилом), циано, карбонилом, нитро, амино, алкиламино, диалкиламино, меркапто, алкилтио, сульфоксидом, сульфоном, ациламино, амидино, фенилом, бензилом, гетероарилом, фенокси, бензилокси или гетероарилокси;
или фармацевтически приемлемая соль указанного соединения.




в соответствующее соединение формулы I, где R, R′, R′′, R′′, R3, R4, k, m, n и р такие, как определено в п. 1.

где k и n представляют собой 0, m и p независимо выбраны из 0 или 1, где по меньшей мере один из m и p не равен 0;
каждый R и R′ независимо выбран из Н и С1-3 алкила или, взятые вместе, R и R′ представляют собой -CR1R1′ -Х-СН2-, где CR1R1′ присоединен к азоту остова, каждый R1 и R1′ представляет собой Н и X выбран из -СН2-, -СН2СН2- и -СН(ОН)-;
каждый R′′ и R′′′ независимо выбран из Н и С1-3 алкила или, взятые вместе, R′′ и R′′′ представляют собой -CR2R2′ -Х′-СН2-, где CR2R2′ присоединен к азоту остова, каждый R2 и R2′ представляет собой Н и X′ выбран из -СН2-, -СН2СН2- и -СН(ОН)-; и
каждый R3 и R4 независимо выбран из арила, замещенного арила, гетероарила и замещенного гетероарила, где
арил представляет собой 6-членное ароматическое кольцо, бициклическую 9- или 10-членную систему ароматических колец или трициклическую 13- или 14-членную систему ароматических колец;
гетероарил представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее 1-3 гетероатома, выбранных из О, N или S; бициклическую 9- или 10-членную систему гетероароматических колец, содержащую 1-3 гетероатома, выбранных из О, N или S; или трициклическую 13- или 14-членную систему гетероароматических колец, содержащую 1-3 гетероатома, выбранных из О, N или S; и
замещенный арил и замещенный гетероарил представляют собой арил и гетероарил, соответственно, до трех атомов Н в каждом остатке замещены алкилом, галогеном, галоалкилом, гидрокси, низшим алкокси, карбокси, карбоалкокси (также называемым алкоксикарбонилом), карбоксиамидо (также называемым алкиламинокарбонилом), циано, карбонилом, нитро, амино, алкиламино, диалкиламино, меркапто, алкилтио, сульфоксидом, сульфоном, ациламино, амидино, фенилом, бензилом, гетероарилом, фенокси, бензилокси или гетероарилокси.

Комментарии