Амилоидный конъюгат, его применения и способы - RU2712750C1
Код документа: RU2712750C1
Чертежи


Описание
Область изобретения
Настоящее изобретение относится к области биохимии, более конкретно к области конъюгирования белков. Кроме того, настоящее изобретение имеет применение в области медицины и ветеринарии в лечении амилоидных заболеваний.
Предшествующий уровень техники
В уровне техники описаны разнообразные конъюгаты, полезные для активной или пассивной иммунизации пациентов с амилоидными заболеваниями, главным образом для болезни Альцгеймера. Следует отметить, что большая часть указанного уровня техники акцентирует основное внимание на выборе пептидов или транспортных белков, которые позволяют получать подходящий иммунный ответ у пациентов, и не придает большого значения или релевантности используемому сшивающему агенту. Указанный сшивающий агент часто представляют в виде перечня всех таких агентов, которые доступны или известны до настоящего времени, указывая, что любой из них можно использовать аналогичным образом, или это просто даже не указывается.
Например, в испанской заявке на патент с номером публикации ES 2246105 раскрыто предупреждение или лечение амилоидных заболеваний, в том числе болезни Альцгеймера, посредством активной иммунизации пациентов при помощи конъюгата, образованного пептидом Аβ33-40 и транспортным белком гемоцианином лимфы улитки (ниже KLH), с учетным номером 4BED в Protein Data Bank (База данных белковых структур). Также рассматривается применение указанного конъюгата для образования антител (например посредством иммунизации млекопитающих или птиц указанным конъюгатом), которые впоследствии используют в способе пассивной иммунизации для предупреждения или лечения амилоидных заболеваний, в том числе болезни Альцгеймера. В указанном патентном документе используемый сшивающий агент конкретно не указан.
Единственный документ из уровня техники, о котором осведомлены авторы изобретения и в котором сшивающий агент в конъюгате считается важным для индуцируемого иммунного ответа, представляет собой РСТ заявку на патент с номером публикации WO 2005/072777. В указанном документе раскрыты конъюгаты для активнойили пассивной иммунизации пациентов на основе сшивающего агента LPA, в отношении которого подчеркивается его способность связаться с двумя пептидами или иметь два пептида одновременно, что делает его подходящим для индуцирования приемлемого иммунного ответа у пациентов. В рамках общего пояснения конъюгата на основе LPA предполагается, что используемый пептид может представлять собой С-концевой фрагмент Аβ42 или Аβ40, и фрагменты 33-42, 35-42, 36-42, 37-42, 38-42 и 39-42 указаны конкретно и приведены в качестве примера. Кроме того, в указанном документе упоминается, что транспортный белок может представлять собой KLH. В этом же самом документе описано получение других конъюгатов с использованием другого сшивающего агента, (N-сукцинимидил-3-(2-пиридилтио)пропионата, общеизвестного как SPDP).
Краткое описание сущности изобретения После широкомасштабных и тщательных экспериментов, авторы изобретения неожиданно обнаружили, что N-гидроксисукцинимидный эфир малеимидомасляной кислоты (ниже SM), гетеробифункциональный сшивающий агент, в котором каждая его молекула связывает пептид с транспортным белком, используемый в качестве сшивающего агента для получения конъюгатов пептида CysAβ(33-40) (SEQ ID NO: 1) и KLH, дает конъюгаты, которые позволяют индуцировать улучшенный иммунный ответ по сравнению с иммунным ответом, индуцируемым конъюгатами, образованными другими гомо- или гетеробифункциональными сшивающими агентами из уровня техники, такими как SPDP, которые также обеспечивают возможность связывания пептида с транспортным белком. Такое улучшение ясно показано в примерах 1-4 настоящего описания изобретения. Кроме того, указанные примеры показывают, что указанные новые конъюгаты или фармацевтические композиции, содержащие указанные конъюгаты, вызывают:
- иммунный ответ, который является специфичным, насколько это возможно, с целью минимизации побочных эффектов, ассоциированных с (профилактической или терапевтической) вакцинотерапией;
- максимально возможный иммунный ответ с целью обеспечения эффективной иммунизации пациентов и снижения необходимых доз иммуногенного конъюгата.
Таким образом, в первом аспекте настоящее изобретение относится к конъюгату, отличающемуся тем, что сшивающий агент представляет собой SM.
В еще одном аспекте настоящее изобретение относится к композиции, содержащей конъюгат по настоящему изобретению.
В дополнительных аспектах настоящего изобретения рассматривается применение указанного конъюгата для получения лекарственного продукта, более конкретно лекарственного продукта, предназначенного для лечения или предупреждения амилоидных заболеваний.
Другой аспект настоящего изобретения относится к композициям, содержащим конъюгат по настоящему изобретению для применения в качестве лекарственного продукта, более конкретно для применения в лечении или предупреждении амилоидных заболеваний.
Кроме того, настоящее изобретение также относится к способу лечения или предупреждения амилоидного заболевания путем доставки композиции, содержащей конъюгат по настоящему изобретению.
В еще одном аспекте, настоящее изобретение относится к способу получения антител, основанному на применении конъюгата по настоящему изобретению.
Подробное описание изобретения
Определения
При использовании в данном описании изобретения, термин "амилоидное заболевание" и его множественное число относится к заболеваниям, ассоциированным с накоплением β-амилоида. Указанное накопление может в основном происходить в головном мозге, порождая заболевания, среди которых находятся болезнь Альцгеймера, болезнь Паркинсона, церебральная амилоидная ангиопатия, сосудистая деменция амилоидного происхождения и деменция с тельцами Леви. Накопление β-амилоида также может происходить в основном в скелетной мышце, порождая миозит с включениями.
При использовании в данном описании изобретения термин "пассивная иммунизация" и его множественное число относится к доставке антител или их фрагментов пациенту с целью обеспечения иммунитета у указанного пациента.
При использовании в данном описании изобретения термин "активная иммунизация" и его множественное число относится к доставке пациенту пептидов (в форме конъюгатов), действующих как иммуногены, то есть они обеспечивают возможность образования антител с целью обеспечения иммунитета у указанного пациента.
При использовании в данном описании изобретения термин "адъювант" и его множественное число относится к иммуномодулирующим веществам, которые можно комбинировать с конъюгатом по настоящему изобретению для повышения, улучшения или иного модулирования иммунного ответа у пациента.
При использовании в данном описании изобретения "пациент" и его множественное число относится к любому млекопитающему, предпочтительно человеку, которому конъюгат по настоящему изобретению или композиция, содержащая его, могут быть введены с целью лечения или предупреждения амилоидного заболевания.
При использовании в данном описании изобретения "CysAβ (33-40)" относится к последовательности в положениях 33-40 Аβ40 (SEQ ID NO: 2), в которую на N-конце был добавлен цистеин. Указанная последовательность показана в SEQ ID NO: 1 и представляет собой: CGLMVGGVV.
Описание изобретения
Первый аспект настоящего изобретения относится к конъюгату, содержащему по меньшей мере один пептид CysAβ(33-40) (SEQ ID NO: 1) и гемоцианин лимфы улитки (KLH), отличающемуся тем, что сшивающий агент, соединяющий каждый из компонентов конъюгата (каждый из указанного по меньшей мере одного пептида с KLH), представляет собой N-гидроксисукцинимидный эфир малеимидомасляной кислоты (SM).
Указанный конъюгат, в дополнение к обеспечению возможности или индуцированию эффективного и специфического иммунного ответа против Аβ40 (продуцируемые антитела являются специфичными к Аβ40 без значительного связывания с Аβ42), повышает указанный ответ по сравнению с ответом, индуцируемым другими конъюгатами, также содержащими пептид CysAβ(33-40) (SEQ ID NO: 1) и KLH, и в которых указанные элементы связаны или конъюгированы посредством другого сшивающего агента, который также допускает связывание пептида с транспортным белком.
Во втором аспекте настоящее изобретение относится к композиции, содержащей конъюгат по настоящему изобретению.
В предпочтительном воплощении композиция дополнительно содержит один или более адъювантов, которые предпочтительно выбирают из минеральных солей (таких как гидроксид алюминия, фосфат алюминия или фосфат кальция), микрочастиц и поверхностно-активных агентов [таких как неионные блок-полимерные поверхностно-активные вещества, виросомы, сапонины, белки наружной мембраны менингококков (протеосомы), иммуностимулирующие комплексы, кохлеаты, диметил-диоктадецил-аммония бромид, авридин, витамин А или витамин Е], бактериальных продуктов [таких как каркас клеточной стенки Mycobacterium phlei, мурамилдипептиды и -трипептиды (тренонил-MDP, MDP-бутиловый эфир, дипальмитоил-фосфатидилэтаноламин-МТР), монофосфориллипид А, гликопротеин Klebsiella pneumoniae, Bordetella pertussis, бацилла Кальметта-Герена, термолабильный энтеротоксин V. cholerae и Е. coli, димиколят трегалозы, CpG-олигодезоксинуклеотиды], гормонов и цитокинов (например интерлейкина-2, интерферона-α, интерферона-β, гранулоцитарно-макрофагального колониестимулирующего фактора, дегидроэпинандростерона, лиганда Flt3, 1,25-дигидроксивитамина D3, интерлейкина-1, интерлейкина-6, интерлейкина-12, гормона роста человека, β-микроглобулина и лимфотактина), одиночных антигенных конструкций (таких как множественные пептидные антигены, связанные с лизиновым ядром, или цитотоксические Т-клеточные эпитопы, связанные с эпитопами хелперных Т-клеток и пальмитоилированные на N-конце), полианионов (таких как декстраны или двухцепочечные полинуклеотиды), полиакрилатов (таких как полиметилметакрилат или акриловая кислота, сшитая аллилсахарозой), носителей [таких как столбнячный анатоксин, дифтерийный анатоксин, белки наружной мембраны менингококков группы В (протеосомы), экзотоксины A Pseudomonas, субъединица В холерного токсина, термолабильный мутирующий энтеротоксигенный энтеротоксин Е. coli, ядро вируса гепатита В, слитые белки холерного токсина А, CpG-динуклеотиды, белки теплового шока или жирные кислоты], живых векторов (таких как вирус коровьей оспы, вирус оспы канареек, аденовирус, ослабленная Salmonella typhi, бацилла Кальметта-Герена, Streptococcus gordonni, вирус простого герпеса, полиовирус вакцинного происхождения, риновирус, вирус венесуэльского энцефалита лошадей, Yersinia enterocolitica, Listeria monocytogenes, Shigella, Bordetella pertussis или Saccharomyces cerevisiae), наполнителей [таких как эмульсии вода-в-масле (например минеральные масла, такие как полный адъювант Фрейнда или неполный адъювант Фрейнда; растительные масла; сквален или сквалан); эмульсии масло-в-воде, такие как смесь сквалена, Tween-80 и Span 85; липосомы; или биоразлагаемые полимерные микросферы, например из лактидов и гликолидов, полифосфазоны, бета-глюканы или протеиноиды], других (таких как N-ацетил-глюкозамин-3-ил-ацетил-L-аланил-D-изоглутамин, гамма-инсулин и гидроксид алюминия, трансгенные растения, дендритные клетки человека, лизофосфатидилглицерин, стеарилтирозин или трипальмитоилпентапептид), или их комбинаций.
В предпочтительном воплощении второго аспекта изобретения указанный адъювант представляет собой гидроксид алюминия, и более предпочтительно гель гидроксида алюминия. Таким образом, предпочтительное воплощение второго аспекта изобретения относится к композиции, предпочтительно фармацевтической композиции, содержащей (1) конъюгат, содержащий по меньшей мере один пептид CysAβ(33-40) (SEQ ID NO: 1), связанный с гемоцианином лимфы улитки (KLH), и (2) гель гидроксида алюминия, где сшивающий агент, соединяющий каждый пептид CysAβ(33-40) с гемоцианином лимфы улитки (KLH) в конъюгате, представляет собой N-гидроксисукцинимидный эфир малеимидомасляной кислоты (SM).
Следует отметить, что, как показано в примере 5, скорости адсорбции конъюгата на геле гидроксида алюминия указанной предпочтительной композиции зависят от рН. Действительно, скорость адсорбции повышается при более низких значениях рН. Снижение от рН 7,4 до рН 7,2 или даже до 7,0 не приводит к значительно более высоким скоростям адсорбции. Адсорбция при рН 6,8 показывает скорость адсорбции около 90%. При рН 6,0 коэффициент адсорбции является самым высоким. При концентрации конъюгата, соответствующей 200 мкг/мл чистого пептида, и рН 6 остается все еще несвязанным 7% конъюгата.
На основе этих анализов, для увеличения иммуногенной активности фармацевтической композиции следует использовать значение рН от 5,8 до 7,0, чтобы повысить скорость адсорбции конъюгата на адъювант и значительно повысить его иммуногенную активность.
Таким образом, другое предпочтительное воплощение второго аспекта изобретения относится к композиции, предпочтительно фармацевтической композиции, содержащей (1) конъюгат, содержащей по меньшей мере один пептид CysAβ(33-40) (SEQ ID NO: 1), связанный с гемоцианином лимфы улитки (KLH), и (2) гель гидроксида алюминия, где сшивающий агент конъюгата, соединяющий каждый пептид CysAβ(33-40) с гемоцианином лимфы улитки (KLH), представляет собой N-гидроксисукцинимидный эфир малеимидомасляной кислоты (SM), и где рН композиции находится в диапазоне от 5,8 до 7,0, предпочтительно от 6,2 до 7,0, более предпочтительно от 5,8 до 6,2.
В еще одних предпочтительных воплощениях второго аспекта изобретения или в любом из его предпочтительных воплощений концентрация пептидов CysAβ(33-40) (SEQ ID NO: 1) в фармацевтической композиции составляет по меньшей мере 100 мкг, предпочтительно по меньшей мере 150 мкг, более предпочтительно от 150 мкг до 400 мкг, еще более предпочтительно от 160 мкг до 240 мкг, еще более предпочтительно примерно 200 мкг.
В еще одних предпочтительных воплощениях второго аспекта изобретения или в любых его предпочтительных воплощениях конъюгаты KLH-SM-CysAβ(33-40), присутствующие в фармацевтической композиции, имеют соотношение по меньшей мере 45 пептидов CysAβ(33-40) (SEQ ID NO: 1) на белок гемоцианина лимфы улитки (KLH).
В еще одном предпочтительном воплощении второго аспекта изобретения или в любом из его предпочтительных воплощений, фармацевтическая композиция содержится в стеклянных ампулах, предпочтительно 1 или 1,2 мл.
Кроме того, следует отметить, что, как отражено выше, скорости адсорбции конъюгата на геле гидроксида алюминия в композиции по второму аспекту изобретения (когда используют гель гидроксида алюминия) зависит от рН. Кроме того, неожиданно рН повышается во время хранения фармацевтической композиции после того, как она была изготовлена, таким образом снижаются скорости адсорбции, если таковые повышения достигали значений рН выше 7,0 или предпочтительно выше 6,8. Для уменьшения этого недостатка, который явно влияет на иммуногенную активность фармацевтической композиции, важно регулировать рН фармацевтической композиции в диапазоне от 5,5 до 6,5, предпочтительно от 5,8 до 6,2, более предпочтительно от 5,9 до 6,1, во время изготовления фармацевтической композиции так, чтобы хранение не влияло или минимально влияло на иммуногенную активность композиции.
Таким образом, еще одно предпочтительное воплощение второго аспекта изобретения относится к способу изготовления фармацевтической композиции, который включает следующие стадии:
а) Добавление N-гидроксисукцинимидного эфира малеимидомасляной кислоты (SM) к композиции, содержащей гемоцианин лимфы улитки (KLH), в буфере при рН от 7,0 до 9;
б) Удаление избытка N-гидроксисукцинимидного эфира малеимидомасляной кислоты из раствора со стадии (а) предпочтительно путем использования 0,02 М Na-фосфатного буфера при рН примерно от 6,6 до 7,0;
в) Добавление пептидов CysAβ(33-40) (SEQ ID NO: 1) в DMSO к раствору со стадии (б) при рН от 6,6 до 7,0 с получением конъюгатов;
г) Удаление свободного пептида со стадии (в) предпочтительно посредством использования 0,01 М PBS-буфера при рН от 6,6 до 7,0;
д) Возможно фильтрование раствора со стадии (г) предпочтительно с использованием фильтра примерно 0,2 мкм;
е) Регулирование рН раствора со стадии (г) или (д) до диапазона от 5,5 до 6,5, предпочтительно от 5,8 до 6,2, более предпочтительно от 5,9 до 6,1, еще более предпочтительно примерно 6,0; и
ж) Добавление геля гидроксида алюминия к раствору со стадии (е) после того как рН был отрегулирован.
В третьем аспекте в настоящем изобретении раскрыто применение композиции, содержащей конъюгат по настоящему изобретению, для получения лекарственного препарата. Предпочтительно указанная композиция представляет собой композицию, идентифицированную во втором аспекте изобретения или в любом из его предпочтительных воплощений. Также в предпочтительном воплощении указанный лекарственный продукт предназначен для применения в лечении или предупреждении амилоидного заболевания, более предпочтительно амилоидного заболевания, выбранного из болезни Альцгеймера, болезни Паркинсона, церебральной амилоидной ангиопатии, сосудистой деменции амилоидного происхождения, миозита с включениями и деменции с тельцами Леви. В наиболее предпочтительном воплощении указанный лекарственный продукт применяют для предупреждения или лечения болезни Альцгеймера.
В четвертом аспекте настоящее изобретение относится к способу лечения или предупреждения амилоидного заболевания у пациента, нуждающегося в этом, включающему доставку терапевтически эффективного количества композиции, содержащей конъюгат по настоящему изобретению. Предпочтительно, указанная композиция представляет собой композицию, идентифицированную во втором аспекте изобретения или в любом из его предпочтительных воплощений. Также в предпочтительном воплощении указанный амилоидное заболевание представляет собой амилоидное заболевание, выбранный из болезни Альцгеймера, болезни Паркинсона, церебральной амилоидной ангиопатии, сосудистой деменции амилоидного происхождения, миозита с включениями и деменции с тельцами Леви, еще более предпочтительно болезни Альцгеймера.
В заключительном аспекте в настоящем изобретении раскрыт способ получения антител, характеризующийся тем, что он включает стадию иммунизации для иммунизации млекопитающих или птиц с помощью композиции, содержащей конъюгат по настоящему изобретению. Предпочтительно, указанная композиция представляет собой композицию, идентифицированную во втором аспекте изобретения или в любом из его предпочтительных воплощений. Следует иметь в виду, что млекопитающие, используемые в таком способе, могут представлять собой жвачных животных, семейство лошадиных, зайцеобразных, приматов (предпочтительно людей) или любое другое млекопитающее, которое позволяет получать подходящие количества сыворотки для экстракции или получения достаточных количеств антител. Следует иметь в виду, что птицы, используемые в способе по настоящему изобретению, представляют собой любые курообразные птицы, водоплавающие птицы, голуби и горлицы или любую другую птицу, которая позволяет получить подходящие количества сыворотки для экстракции или получения достаточных количеств антител. Кроме того предполагается защита антител, полученных или получаемых посредством способа согласно заключительному аспекту изобретения, а также их использование в изготовлении фармацевтической композиции для применения в лечении амилоидного заболевания, выбранного из болезни Альцгеймера, болезни Паркинсона, церебральной амилоидной ангиопатии, сосудистой деменции амилоидного происхождения, миозита с включениями и деменции с тельцами Леви, еще более предпочтительно болезни Альцгеймера.
Таким образом, в настоящем изобретении предложен конъюгат, образованный с использованием сшивающего агента SM, и композиции, содержащие его, которые обеспечивают возможность индуцирования более значительного иммунного ответа по сравнению с конъюгатами, образованными с помощью других сшивающих агентов из уровня техники.
Кроме того, иммунный ответ, индуцированный указанными конъюгатами по настоящему изобретению или композициями, содержащими указанные конъюгаты, является специфичным в отношении Аβ40, то есть он позволяет генерировать специфические анти-Аβ40 антитела без генерирования анти-Аβ42 антител.
Для лучшего понимания настоящее изобретение описано более подробно ниже со ссылкой на прилагаемые графические материалы, представленные в качестве примера, и со ссылкой на иллюстративные неограничивающие примеры.
Пример 1. Получение конъюгатов KLH-SM-CysAβ(33-40).
Для получения этих конъюгатов использовали KLH в качестве транспортного белка, SM в качестве сшивающего агента и CysAβ(33-40) (SEQ ID NO: 1) в качестве иммуногенного пептида (пептид с остатками 33-40 амилоидного пептида, к которому на N-конце был добавлен цистеин).
Связывание происходило между остатками лизина в KLH и цистеином, добавленным на N-терминальном конце пептида. В этом случае сначала осуществляли связывание сшивающего агента с KLH (стадия активации KLH) и на второй стадии к активированному KLH добавляли иммуногенный пептид, чтобы могло происходить конъюгирование.
Протокол, которого придерживались выше, является следующим:












10/6725000 (средняя молекулярная масса KLH)=1,48×10-6 ммоль KLH
1,48×10-6 ммоль KLH × 1724 активных сайтов=2,55×10-3 ммоль пептида, необходимого, чтобы закрыть все активные сайты.
Вводили 3-кратный избыток пептида для поддержания реакции конъюгирования: требовалось 2,55×10-3×3=7,65×10-3 ммоль пептида.
требовалось 7,65×10-3 × молекулярная масса пептида (834,4 Да)=мг пептида (6,38 мг пептида) (с использованием необходимых коэффициентов перевода).



Пример 2. Сравнение иммунного ответа конъюгатов KLH-сшивающий агент-CisAβ(33-40), индуцированного с использованием разных сшивающих агентов.
В этом случае сравнивали силу иммунного ответа, индуцированного у мышей (4 на группу) с помощью следующих конъюгатов:


Испытание на силу иммунного ответа проводили на мышах линии BALB/c. Следовали следующему протоколу:
1. За неделю до первой инокуляции брали кровь у всех мышей, участвующих в исследовании, для получения преиммунной сыворотки.
2. В зависимости от группы, в которую распределяли каждую мышь (смотри Таблицу 1 в отношении разных анализируемых групп), каждой мыши инокулировали соответствующую вакцину раз в неделю в течение трех недель подряд.
3. Через неделю после третьей иммунизации еще раз брали кровь у каждой из мышей, участвующих в исследовании, для определения ответа, полученного в сыворотке.

Доза пептида, введенная мышам в каждой из групп, показанных в Таблице 1, отражена в Таблице 2 ниже.

В Таблице 3 показана сводная таблица результатов в отношении силы иммунного ответа, полученных для разных групп (анализируя сыворотки мышей, полученные через неделю после завершения схемы лечения или схемы вакцинации, описанных в настоящем примере), вместе с наблюдаемым усилением иммунного ответа (показатель кратности иммунного ответа, возросшего через неделю после завершения схемы лечения, по сравнению с преиммунным ответом). Определение иммунного ответа производили на сыворотке, полученной от каждой мыши, посредством непрямого ELISA (твердофазный иммуноферментный анализ), согласно протоколу, известному в уровне техники, в отношении которого следует отметить, что планшеты для ELISA рассеивали пептид Аβ40. После выполнения соответствующих стадий промывания, блокирования, последующего промывания, инкубирования с подлежащими анализу образцами плазмы/сыворотки (серийные разведения 1:3, начиная с разведения 1:30), и дополнительного промывания, каждую лунку инкубировали с антителами HRP к мышиному IgG (H+L) (разведение вторичных антител в растворе носителя при рН 8 составляло 1:2000). После инкубирования с указанным антителом и промывки лунок планшет проявляли путем добавления 100 мкл на лунку раствора ABTS (диаммония 2,2'-азинобис-[3-этилбензотиазолинсульфонат]; Roche; номер: 102946001) с 0,375 мг/мл в буфере ABTS (Roche; номер: 11112597001). Этот субстрат зеленел при взаимодействии с пероксидазой, связанной с вторичным антителом. Интенсивность цвета зависела от количества антител, связанных с планшетом. Реакционную смесь инкубировали в течение 55 минут при комнатной температуре и в темноте, и затем считывали поглощение на планшетном ридере ELISA при 405 нм. Полученные результаты для оптической плотности анализировали с помощью программы GraphPad Prism 3.02. Для анализа использовали уравнение "One Site Competition" (Односайтовой конкуренции):

Данные по ЕС50, которая представляет собой точку перегиба кривой, то есть точку, в которой получали 50% максимального наблюдаемого эффекта, получали в вышеуказанном анализе. В данном случае ее интерпретировали как разведение сыворотки, при котором 50% пептида, присутствующего в лунке, связано с антителом, присутствующим в сыворотке.
Таблица 3. Результаты в отношении среднего иммунного ответа, полученные для каждой группы исследования. Они включают результаты для сыворотки после лечения вакциной (через 1 неделю после трех инъекций согласно протоколу, описанному в данном примере) и рост, наблюдаемый между указанной точкой и преиммунным ответом (до начала реализации схемы лечения). Средняя преиммунная ЕС50 равнялась 18,11.

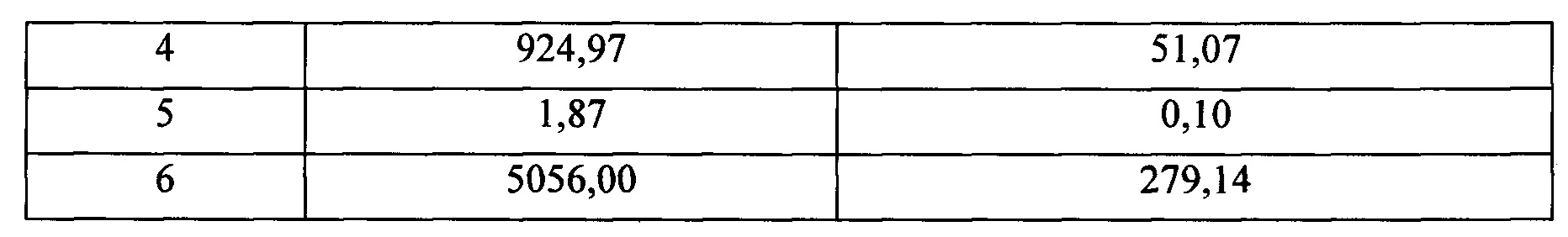
С учетом результатов, показанных в Таблице 3, и конъюгата, используемого в каждой из групп исследования, может быть сделано следующее заключение:



Изложенное выше показывает, что использование SM в качестве сшивающего агента для получения конъюгатов KLH-сшивающий areHT-CysAβ(33-40) обеспечивает получение вакцин с иммунным ответом, который является неожиданно более сильным независимо от того, использовали указанный конъюгат с адъювантом или без адъюванта.
Пример 3. Сравнение степени конъюгирования (связывания пептида с KLH) конъюгатов KLH-сшивающий агент-СуsАβ(33-40), образованных с использованием разных сшивающих агентов.
Как в случае Примера 2, конъюгаты, для которых сравнивали степени конъюгирования или количество связанных пептидов на молекулу транспортного белка (KLH), представляли собой:


В Таблице 4 показана сводная таблица результатов экспериментов, полученных в выполненном эксперименте по связыванию пептида с транспортным белком.
Таблица 4. Описание анализируемых конъюгатов и количество молекул пептида, связанных с каждой молекулой KLH, наблюдаемое при помощи масс-спектроскопии. Что касается указанных связей, в таблице указаны одно или два значения в зависимости от того, одну или две партии соответствующего конъюгата анализировали.

Как показано в Таблице 4, то что KLH были от разных производителей, не влияло на полученные в результате связи. В отличие от этого, сшивающий агент в действительности оказывал огромное влияние на полученные результаты, поскольку SM обеспечивал получение в два раза большего количества связей или даже более, то при использовании SM в качестве сшивающего агента в два раза больше пептидных молекул связывается с каждой молекулой KLH. Этот результат является удивительным и неожиданным, при условии, что используемый пептид включает цистеин на N-конце для взаимодействия со сшивающими агентами. Согласно известному уровню техники, включение указанного цистеина должно делать возможной эффективное конъюгирование пептида и эквивалентно в отношении любого из сшивающих агентов, известных из уровня техники. Однако в данном случае наблюдали, что SM обеспечивает более эффективную реакцию конъюгирования, чем SPDP.
Эти результаты связывания сделали возможным объяснение части результатов, показанных в Примере 2 (то есть части улучшения, наблюдаемого в индукции иммунного ответа и последующего образования антител). Тем не менее, указанные результаты по иммунному ответу не полностью сопоставимы с полученными результатами по связыванию, что также является удивительным ввиду указанных полученных результатов, и указывает на то, что сшивающий агент вносит вклад в усиление иммунного ответа не только путем опосредования большего связывания пептида с транспортным белком.
Пример 4. Анализы иммунного ответа у кроликов и специфичность образовавшихся антител.
Анализ активности вакцин, содержащих конъюгаты KLH-SM-CysAβ(33-40), проводили на кроликах. В этом случае кроликов вакцинировали суммарно 200 мкг связанного пептида, где указанные 200 мкг были связаны с транспортным белком (выбранная доза зависела от предварительных исследований). Каждому кролику инокулировали 1 мл вакцины с заранее установленной дозой, используя 2% Alhydrogel® (гель гидроксида алюминия) в качестве адъюванта.
Животных обрабатывали ранее указанной дозой посредством подкожной инъекции вакцины один раз в неделю в течение 3 недель подряд, забирая кровь за неделю до начала протокола вакцинации и через неделю после его завершения.
Титрование образовавшихся антител и анализ их специфичности выполняли посредством ELISA согласно протоколу, известному в уровне техники и кратко указанному в Примере 2, со следующими различиями:


Реагенты для проявления представляли собой реагенты, указанные в Примере 2, и, следовательно, планшеты считывали также при 405 нм и к результатам применяли то же самое уравнение. Из анализа получали данные по ЕС50, которая представляет собой точку перегиба кривой, то есть точку, в которой было получено 50% максимального наблюдаемого эффекта. Как показано в Примере 2, указанный результат интерпретировали как разведение сыворотки, при котором 50% пептида, присутствующего в лунке, связывалось с антителом, присутствующим в сыворотке.
Согласно вышеуказанному протоколу титрования, все полученные образцы титровали для обнаружения антител к пептиду Аβ40 и Аβ42. Полученные результаты показаны в табличной форме в Таблицах 5 и 6.


Исходя из того, что показано в Таблицах 5 и 6, сделан вывод, что конъюгат по настоящему изобретению (KLH-SM-CysAβ(33-40)) позволяет не только получать сильный иммунный ответ у кроликов, но также указанный ответ специфичен в отношении Aβ40 (без значительного гуморального ответа на Аβ42), то есть в иммунном ответе образуются специфичные к анти-Аβ40 антитела, которые не связываются с Аβ42.
Результаты, включенные в Примеры 1-4, доказывают и подтверждают технические преимущества и эффекты, объясненные выше в описании изобретения, доказывая, что использование SM в качестве сшивающего агента позволяет получить конъюгаты KLH-сшивающий aгeнт-CysAβ(33-40), которые индуцируют более сильный иммунный ответ по сравнению со случаем, когда используется другой сшивающий агент из уровня техники. Кроме того, конъюгаты KLH-SM-CisAβ(33-40) позволяют индуцировать сильные иммунные ответы у мышей и кроликов, специфичные к Аβ40 (без значительного гуморального ответа на Аβ42), то есть в указанных иммунных ответах образуются специфические анти-Аβ40 антитела, которые не связываются с Аβ42. Указанные примеры подтверждают полезность конъюгата по настоящему изобретению в лечении амилоидных заболеваний, предпочтительно болезни Альцгеймера, у млекопитающих, предпочтительно у людей.
Пример 5. Исследования адсорбции конъюгатов KLH-SM-CysAβ(33-40) на геле гидроксида алюминия.
1,35 мг/мл пептида является эквивалентом 14,4 мг/мл конъюгата KLH-SM-CysAβ(33-40).


В этих исследованиях определяли влияние концентрации конъюгата на скорость адсорбции, а также влияние рН на скорость адсорбции. В первом эксперименте исследовали скорость адсорбции разных концентраций конъюгата на определенном количестве гидроксида алюминия (0,35% соответствует разрешенной дозе 1,25 мг Аl на разовую дозу) и при определенном рН 7,4 (физиологический рН). В физиологических условиях исследования (рН 7,4) в супернатанте было обнаружено 12-18% свободного конъюгата. Уменьшение количества пептида до 100 мкг пептида не дает более высоких скоростей адсорбции.
Во втором исследовании определяли влияние рН на скорость адсорбции. Изменяли рН (от рН 6,0 до рН 7,4) при определенных концентрациях конъюгата (в расчете на 100 мкг, 150 мкг и 220 мкг чистого пептида /мл). Как показано в результатах, показанных выше, скорость адсорбции зависит от рН. Действительно, скорость адсорбции повышается при более низких значениях рН (смотри таблицы): снижение от рН 7,4 до рН 7,2 или даже 7,0 не вызывает значительно более высоких скоростей адсорбции. Адсорбция при рН 6,8 демонстрирует скорость адсорбции примерно 90%. При рН 6,0 коэффициент адсорбции является самым высоким. При концентрации конъюгата в расчете на 200 мкг/мл чистого пептида и рН 6, 7% конъюгата остается все еще несвязанным.
На основании этих анализов, для повышения иммуногенной активности фармацевтической композиции по изобретению, для повышения скорости адсорбции конъюгата на адъювант предпочтительно следует использовать значение рН от 5,8 до 7,0.
Хотя изобретение описано в отношении предпочтительных воплощений, эти воплощения не должны рассматриваться как ограничение изобретения, которое будет определяться посредством самой широкой интерпретации следующей ниже формулы изобретения.
Реферат
Изобретение относится к фармацевтической композиции, которая наряду с тем, что делает возможным или вызывает эффективный и специфичный иммунный ответ против Аβ40 (продуцируемые антитела специфичны к Аβ40 без значительного связывания с Aβ42), повышает указанный ответ по сравнению с ответом, вызванным другими конъюгатами, также содержащими пептид CysAβ(33-40) и KLH (гемоцианин лимфы улитки), где указанные элементы связаны или конъюгированы посредством другого сшивающего агента, который также обеспечивает возможность связывания пептида с транспортным белком. 3 н. и 16 з.п. ф-лы, 7 табл., 5 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ лечения болезни альцгеймера
Способ лечения или предупреждения заболевания, ассоциированного с отложением амилоидных белков (варианты)
Способ лечения болезни альцгеймера
Композиция, включающая амилоидный пептид аβ-1-6, присоединенный к вирусоподобной частице и адъюванту

Комментарии