Стабилизированный аморфный карбонат кальция для лечения мышечной дистрофии - RU2757419C2
Код документа: RU2757419C2
Чертежи










Описание
ОБЛАСТЬ ТЕХНИКИ
[0001] Согласно настоящему изобретению предложен стабилизированный аморфный карбонат кальция (АКК) для лечения некоторых мышечных, неврологических и связанных с бесплодием заболеваний или состояний. Кроме того, стабилизированный АКК может применяться в другой вспомогательных репродуктивных технологий, например, для улучшения роста эмбрионов млекопитающих или для улучшения качества спермы.
УРОВЕНЬ ТЕХНИКИ
[0002] В доклинических и клинических моделях биодоступности было показано, что введение АКК приводило к увеличению биодоступности кальция (Meiron et al., J Bone Miner Res. 2011, 26(2):364-72, Shaltiel et al., Health 5, 2013, 18-29, и Vaisman et al, Journal of Bone and Mineral Research, 2014, 29 (10), pp 2203-2209), эффекту, важному, в частности, для облегчения связанных с мальабсорбцией кальция состояний и расстройств. Пероральное введение АКК приводило к положительному эффекту на параметры костей, продемонстрированному антирезорбтивным действием, анаболическими эффектами и поддержанием механической прочности кости в модели предотвращения остеопороза (Shaltiel et al.). В WO 2013/088440 описаны композиции с аморфным карбонатом кальция для применения в лечении мальабсорбции кальция и ассоциированных с мальабсорбцией расстройств, заболеваний и состояний, и для увеличения минеральной плотности кости при ассоциированных с мальабсорбцией кальция и метаболизмом костей расстройств.
[0003] В WO 2005/115414 описаны подходящие для перорального введения композиции, содержащие стабильный АКК, а также способ лечения остеопороза, остеомаляции и родственных заболеваний. В WO 2008/041236 описаны составы, содержащие аморфный или микрокристаллический карбонат кальция, эффективные в лечении различных патологических состояний, в том числе пролиферативных заболеваний, неврологических расстройств и скелетно-мышечных расстройств. В WO 2009/053967 описаны композиции, содержащие аморфный карбонат кальция (АКК) и по меньшей мере одну фосфорилированную аминокислоту или фосфорилированный пептид. Указанные композиции могут применяться для лечения различных перечисленных в указанных источниках заболеваний.
[0004] Повреждения нервов часто встречаются в клинической практике. Существует множество примеров, когда повреждение (поражение) периферического нерва, вызванное несчастным случаем или т.п., не может быть полностью устранено. Также существует множество клинических примеров, когда периферический нерв приходится ампутировать в результате хирургических операций в целом. Хотя центральная нервная система (ЦНС) отличается медленным и слабым самовосстановлением нервных волокон, периферическая нервная система (ПНС) обладает способностью к восстановлению нервов посредством быстрой регенерации нервных волокон. Исследования восстановления функциональности ПНС после повреждения стали быстро растущей областью, посвященной поиску подходящих способов облегчения и направления аксональной регенерации.
[0005] При попытках добиться регенерации поврежденных периферических нервов были разработаны различные подходы. Одна из таких техник включает фактическое сшивание проксимального и дистального концов разорванного нерва. Активно разрабатывалось применение различных трубчатых соединений, вшиваемых между проксимальной и дистальной культями нерва, для направления разорванных регенерирующих аксонов.
[0006] Дополнительные заболевания, удовлетворительные методы лечения для которых в настоящее время отсутствуют, связаны с мышечной дистрофией. Мышечная дистрофия представляет собой группу заболеваний мышц, ослабляющих скелетно-мышечную систему и затрудняющих движение. Мышечные дистрофии характеризуются прогрессирующей слабостью скелетных мышц, дефектами мышечных белков и гибелью мышечных клеток и тканей. Одним из таких заболеваний является мышечная дистрофия Дюшенна (МДД), смертельное заболевание, связанное с истощением мышечной ткани и поражающее приблизительно одного из 3500 мальчиков. Ожидаемая продолжительность жизни мальчиков с дистрофией Дюшенна ограничена приблизительно 20 годами. Указанное расстройство вызвано мутацией гена дистрофина; было идентифицировано множество разных мутаций, ведущих к дисфункции белка дистрофина. Оно характеризуется прогрессирующей атрофией и дегенерацией скелетных мышц (Shin et al., Int J Biochem Cell Biol. 2013, 45(10):2266-79), в которые также вовлечен аномальный гомеостаз кальция. Медицинское ведение мышечных дистрофий включало применение кортикостероидов; однако помимо обеспечения существенных благоприятных эффектов длительное лечение кортикостероидами может приводить к остеопорозу. Даже без применения кортикостероидов мышечная дистрофия Дюшенна приводит к сниженной подвижности, которая непосредственно ассоциирована с повышенной вероятностью переломов и пониженной минеральной плотностью кости (Nanette et al., Phys Med Rehabil Clin N Am. 2012, 23(4):773-99).
[0007] В настоящее время отсутствуют удовлетворительные методы лечения МДД или повреждения нервов; уменьшение тяжести симптомов и улучшение качества жизни пациента, страдающего указанными состояниями, может рассматриваться как достижение.
[0008] Область вспомогательных репродуктивных технологий (ВРТ) посвящена решению проблемы как мужского, так и женского бесплодия. Одной из основных техник является оплодотворение in vitro (экстракорпоральное оплодотворение, ЭКО). Состав клеточных культуральных сред может значимо влиять на оплодотворение и эмбриональное развитие и, соответственно, на исход указанной процедуры. Коэффициент результативности ЭКО в основном связан с числом перенесенных эмбрионов, а также такими факторами, как качество эмбриона. Изменение культуральных сред может значимо влиять на развитие эмбриона in vitro. Поскольку повышение качества эмбрионов и числа эмбрионов, достигающих поздних стадий развития, может увеличивать вероятность успешного зачатия, определение оптимальных условий для развития эмбриона in vitro может увеличивать эффективность процесса ЭКО в целом.
[0009] «Мужской фактор» бесплодия определен как изменение концентрации, и/или подвижности, и/или морфологии сперматозоидов по меньшей мере в одном образце из двух анализов спермы, собранных с интервалом 1 и 4 недели. У человека он обуславливает 40-50% бесплодия и затрагивает приблизительно 7% всех мужчин. Мужское бесплодие обусловлено, как правило, недостатками семени или качеством семени, что отражается в низкой численности, подвижности, а также аномальной морфологии сперматозоидов (Kumar and Singh, 2015, J. Hum. Reprod. Sci., 8(4): 191-196).
[0010] Большинство техник BPT, например, внутриматочное осеменение или стандартная процедура ЭКО, требуют по меньшей мере нормальной подвижности сперматозоидов. В настоящее время существует ряд способов отбора сперматозоидов, например, классическую технику флотации с промыванием применяют для выбора наиболее подвижных клеток на основании естественной подвижности сперматозоидов. Выбранные сперматозоиды могут быть впоследствии использованы в процедуре ЭКО. Были предложены многочисленные техники для улучшения качества спермы in vitro. Результаты экспериментов in vitro предполагают, что витамин Ε может защищать сперматозоиды от окислительного повреждения и потери подвижности, а также улучшать показатели эффективности спермы в анализе на проникновение в яйцеклетку хомяка (Agarwal & Sekhon, Human Fertility, December 2010, 13(4): 217-225). Bhoumik с соавторами (Bhoumik et al., Cell Biochem. Biophys., 2014, 70: 1177-1183) продемонстрировали, что добавление ионов Са2+ в не содержащие кальций среды обеспечивает до 20% увеличения поступательной подвижности сперматозоидов.
[0011] Частота встречаемости мужского бесплодия по всему миру увеличивается (Kumar and Singh), и все большее число пар прибегает ко вспомогательных репродуктивных технологий. Соответственно, существует потребность в новых способах улучшения подвижности сперматозоидов in vitro.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0012] Неожиданным образом было обнаружено, что аморфный карбонат кальция (АКК) может оказывать положительное влияние, улучшая регенерацию, развитие, созревание и дифференцировку клеток. Настоящее изобретение отчасти основано на неожиданном открытии того факта, что АКК ускоряет регенерацию нервных волокон, способствует образованию мышечных трубочек, улучшает качество спермы и способствует развитию эмбрионов, в том числе, но не ограничиваясь перечисленным, увеличивает число эмбрионов, достигающих поздних этапов развития.
[0013] Согласно одному аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая аморфный карбонат кальция (АКК), стабилизированный по меньшей мере одним стабилизирующим агентом, для применения в лечении заболевания или состояния, связанного с нервно-мышечными дефектами. В соответствии с конкретными вариантами реализации указанное заболевание или состояние выбрано из мышечной дистрофии и аксонального дефекта. Согласно некоторым вариантам реализации указанная фармацевтическая композиция предназначена для применения в лечении аксонального дефекта, например, аксонального повреждения. Согласно другому варианту реализации указанная фармацевтическая композиция предназначена для применения в лечении мышечной дистрофии, такой как мышечная дистрофия Дюшенна. В соответствии с дополнительным аспектом настоящего изобретения предложен способ лечения заболевания или состояния, выбранный из мышечной дистрофии и аксонального дефекта у нуждающегося в этом субъекта, включающий введение указанному субъекту фармацевтически приемлемой композиции, содержащей аморфный карбонат кальция (АКК), стабилизированный по меньшей мере одним стабилизирующим агентом.
[0014] Согласно другому аспекту настоящего изобретения предложен способ оплодотворения in vitro, включающий (а) оплодотворение in vitro ооцита млекопитающего; и (b) культивирование in vitro указанного эмбриона или эмбрионов, при этом этап (а), этап (b) или оба этапа, (а) и (b), осуществляют в клеточной культуральной среде, содержащей АКК, стабилизированный по меньшей мере одним стабилизирующим агентом. Указанный способ, согласно некоторым вариантам реализации, может дополнительно содержать этап созревания ооцита in vitro в клеточной культуральной среде, содержащей АКК, стабилизированный по меньшей мере одним стабилизирующим агентом, перед этапом (а). Согласно некоторым вариантам реализации указанное млекопитающее выбрано из человека и не являющегося человеком млекопитающего.
[0015] В соответствии с определенными аспектами согласно настоящему изобретению предложен способ улучшения или повышения качества спермы, включающий воздействие на сперму аморфным карбонатом кальция (АКК), стабилизированным по меньшей мере одним стабилизирующим агентом. Согласно некоторым вариантам реализации указанный способ включает воздействие на сперму или приведение спермы в контакт с АКК, стабилизированным по меньшей мере одним стабилизирующим агентом. В соответствии с одним вариантом реализации сперма представляет собой сперму человека. Согласно другому варианту реализации улучшение качества спермы включает повышение подвижности спермы, повышение поступательной подвижности сперматозоидов, увеличение численности сперматозоидов, соответственно, способ согласно настоящему изобретению включает повышение подвижности спермы, повышение поступательной подвижности сперматозоидов, увеличение численности сперматозоидов.
[0016] Согласно другому варианту реализации настоящего изобретения предложен способ разделения сперматозоидов, несущих Х- и Y-хромосомы, включающий: (а) приведение в контакт образца спермы с АКК, стабилизированным по меньшей мере одним стабилизатором, (b) выполнение процедуры флотации, (с) получение фракции, содержащей подвижные сперматозоиды, и (d) разделение верхней фазы и нижних фаз фракции, полученной на этапе (с), при этом верхняя фаза обогащена несущей Y-хромосому спермой, а нижняя фаза обогащена несущей Х-хромосому спермой.
[0017] В соответствии еще с одним аспектом настоящего изобретения предложена фармацевтическая композиция, содержащая аморфный карбонат кальция (АКК), стабилизированный по меньшей мере одним стабилизатором, для применения в лечении мужского бесплодия.
[0018] В соответствии с некоторыми аспектами настоящего изобретения предложен способ лечения мужского бесплодия у нуждающегося в этом субъекта, включающий введение указанному субъекту фармацевтической композиции, содержащей эффективное количество аморфного карбоната кальция (АКК), стабилизированного по меньшей мере одним стабилизатором.
[0019] В соответствии с любыми из вышеперечисленных аспектов АКК стабилизирован по меньшей мере одним стабилизирующим агентом. В соответствии с одним вариантом реализации указанный стабилизирующий агент выбран из полифосфата, фосфорилированных аминокислот, органических кислот, фосфорилированных, фосфонированных, сульфатированных или сульфонированных органических соединений, фосфорных или серных сложных эфиров гидроксикарбоновых кислот, бисфосфоната, сахаридов и их производных, белков, фосфорилированных белков, естественных и синтетических биополимеров и их производных, и любых их комбинаций.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0020] На фиг. 1 показан эффект разных источников кальция на спраутинг нейронов из культивированных срезов дорсальных корешковых ганглиев спинного мозга (СМ-ДКГ). Иммунофлуоресцентное окрашивание (антителом против нейрофиламентов) нервных волокон, выращенных из срезов СМ-ДКГ, на которые воздействовали следующими соединениями кальция [концентрация Са2+ = 2 мМ]: (А) АКК-этидроновая кислота; (В) АКК-фосфосерин; (С) гастролит; (D) кристаллический карбонат кальция (ККК); и (Е) раствор CaCl2 (контроль). Исходное увеличение х100.
[0021] На фиг. 2 показан эффект (А) АКК, стабилизированного этидроновой кислотой и (В) раствора CaCl2 (контроль) на спраутинг нейронов из клеток головного мозга, культивируемых на хитозановых микроносителях (ХМ). Представлено иммунофлуоресцентное окрашивание нервных волокон (антителом против нейрофиламентов), выращенных из агрегатов клеток головного мозга с хитозаном (ХМ), через 30 дней в культуре в присутствии 2 мМ либо АКК-этидроновой кислоты, либо CaCl2.
[0022] На фиг. 3 показан эффект АКК на формирование мышечных трубочек культурах здоровых скелетных мышц. Исходное увеличение х40. На культуры скелетных мышц воздействовали следующими соединениями кальция (конечная концентрация Са2+ = 2 мМ): АКК этидроновая кислота; АКК АДФ; гастролит; кристаллический карбонат кальция (ККК); и раствор CaCl2 (контроль). Культуры фиксировали через 4 и 7 дней и окрашивали по Гимза. Для обработанных АКК клеток наблюдалось улучшение образования мышечных трубочек в культурах скелетных мышц.
[0023] На фиг. 4 показан эффект АКК в культуральной среде на ранее образование мышечных трубочек в культурах линии клеток mdx. Показано окрашивание по Гимза культур, на которые воздействовали средой, содержащей CaCl2, АКК-ЭТ и АКК фосфосерин (АКК-ФС). Исходное увеличение - x100.
[0024] На фиг. 5 показаны уровни креатининкиназы (КК), измеренные в мышечных клетках линии mdx, на которые воздействовали двумя составами с АКК (АКК-ЭТ и АКК ФС), в сравнении с CaCl2.
[0025] На фиг. 6 показан эффект АКК (АКК ФС, АКК ПФ в сравнении с контролем (CaCl2)) на образование мышечных трубочек в первичных культурах клеток мышей mdx (окрашивание по Гимза; исходное увеличение Х50).
[0026] На фиг. 7 показан эффект АКК на формирование мышечных трубочек в первичных культурах клеток мышей mdx, продемонстрированный иммуноокрашиванием миозина; контроль (CaCl2); АКК-ФС, АКК-полифосфат(АКК-ПФ). Исходное увеличение - XI00.
[0027] На фиг. 8 показаны значения креатининкиназы у мышей (дикого типа и mdx), которым перорально вводили разные типы кальциевых добавок.
[0028] На фиг. 9 показан эффект введения стабилизированного АКК мышам mdx на показатели эффективности в тесте на удержание при помощи четырех конечностей.
[0029] На фиг. 10 показан эффект стабилизированного АКК на развитие эмбрионов мышей in vitro в одностадийной среде с разной концентрацией АКК.
[0030] На фиг. 11 показан эффект стабилизированного АКК на развитие эмбрионов мышей in vitro в одностадийной среде.
[0031] На фиг. 12 показан эффект стабилизированного АКК на развитие эмбрионов мышей in vitro в среде для дробления.
[0032] На фиг. 13 показано окрашивание ализариновым красным остеобластов после 10 дней в культуре в зависимости от обработки различными средами. В среды добавляли дополнительные 1 мМ Са2+ из: А - АКК, В - CaCl2; или использовали С-контроль, без добавления Са2+.
[0033] На фиг. 14 показано окрашивание остеобластов на щелочную фосфатазу после 10 дней в культуре в зависимости от обработки различными средами. В среды добавляли дополнительные 1 мМ Са2+ из: А - АКК, В - CaCl2, или использовали С-контроль, без добавления Са2+.
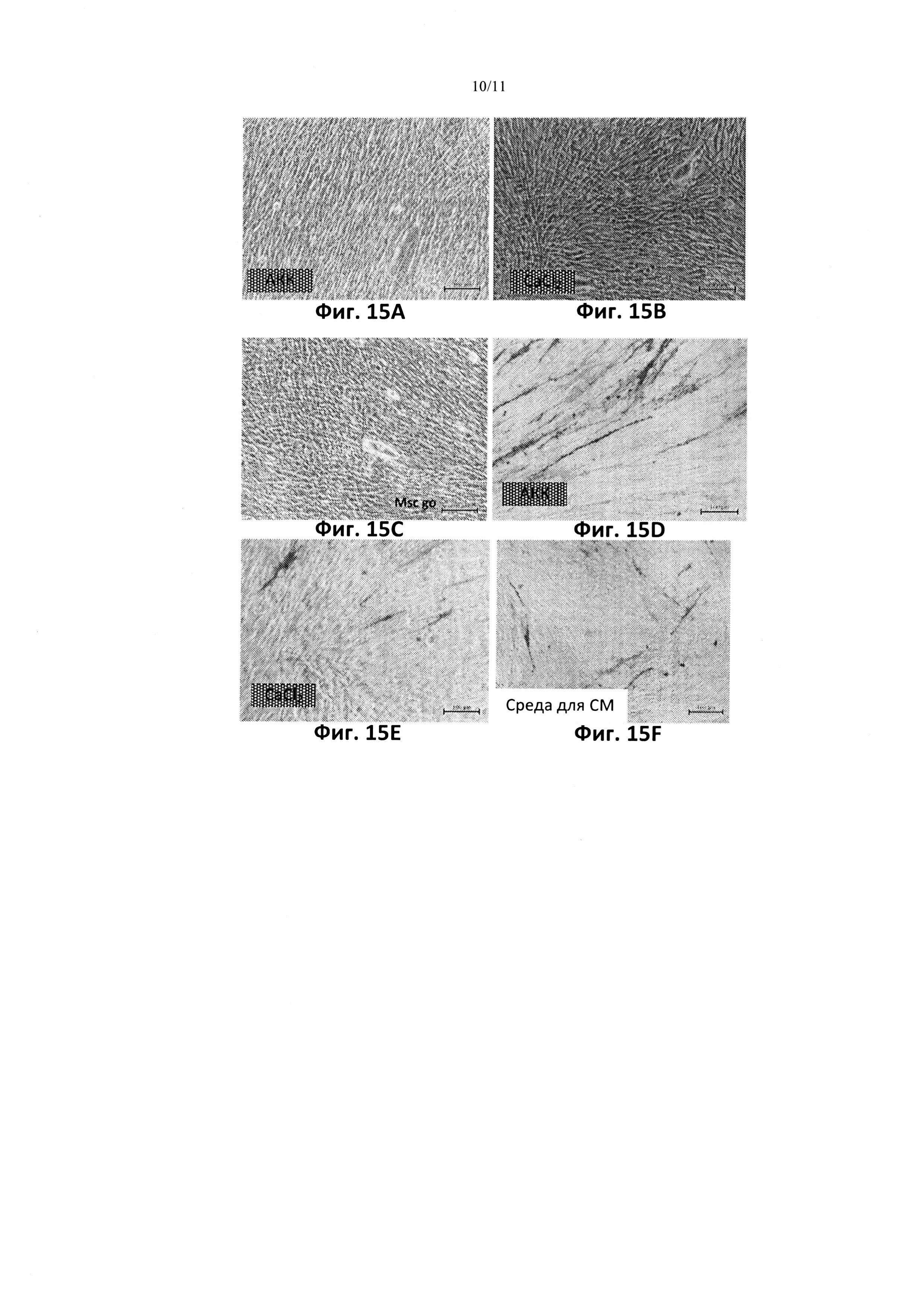
[0034] На фиг. 15 показано окрашивание ализариновым красным (А-С) и окрашивание на щелочную фосфатазу (D-F) клеток линий mdx, культивированных на средах с добавлением разных источников дополнительного 1 мМ Са2+: А и D АКК, В и Ε CaCl2, или С и F контроль, без добавления Са2+.
[0035] На фиг. 16 показан эффект стабилизированного АКК на культивируемые in vitro яичники (А), где зернистые клетки, окружающие ооциты, были интактными, в сравнении с контролем (В) (без АКК в среде), где наблюдались неинтактные зернистые клетки и ооцит на стадии зародышевого пузырька.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0036] Настоящее изобретение раскрывает неожиданные преимущества АКК для роста клеток и созревания. Указанные особенности наблюдались в различных системах роста клеток, согласно приведенным ниже в настоящем документе примерам.
[0037] В соответствии с некоторыми конкретными аспектами настоящего изобретения предложена фармацевтическая композиция, содержащая аморфный карбонат кальция (АКК), стабилизированный по меньшей мере одним стабилизирующим агентом, для применения в лечении заболевания или состояния, выбранного из нервно-мышечного заболевания или состояния. Согласно конкретным вариантам реализации указанное заболевание может быть выбрано из мышечной дистрофии и аксонального дефекта. В соответствии с некоторыми другими конкретными аспектами настоящего изобретения АКК, стабилизированный по меньшей мере одним стабилизирующим агентом, может применяться во вспомогательных репродуктивных технологий (ВРТ). В соответствии с одним вариантом реализации ВРТ представляет собой оплодотворение in vitro. Согласно другому варианту реализации ВРТ включает улучшение качества спермы.
[0038] Согласно любому аспекту настоящего изобретения, индивидуально и в совокупности, применяют следующую терминологию и используются специфические показатели согласно определению в настоящем документе ниже:
[0039] Термины «фармацевтическая композиция» и «фармацевтически приемлемая композиция» используются в настоящем документе взаимозаменяемо и относятся к композиции, содержащей АКК, стабилизированный по меньшей мере одним стабилизатором согласно описанию в настоящем документе ниже, введенным в состав совместно с одним или более фармацевтически приемлемыми носителями.
[0040] Термины «фармацевтически приемлемый носитель», или «фармацевтически приемлемое вспомогательное вещество» в настоящем документе относятся ко всем и каждому растворителям, дисперсионным средам, консервантам, антиоксидантам, покрытиям, изотоническим и замедляющим абсорбцию агентам, поверхностно-активным веществам, буферам и т.п., совместимым с фармацевтическим введением. Применение таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области техники. Указанные композиции могут содержать другие активные агенты, обеспечивающие добавочные, дополнительные или улучшенные терапевтические функции.
[0041] Согласно некоторым вариантам реализации указанное заболевание или состояние представляет собой аксональный дефект, соответственно, согласно настоящему изобретению предложена фармацевтическая композиция, содержащая АКК, стабилизированный по меньшей мере одним стабилизирующим агентом, для применения в лечении аксонального дефекта.
[0042] Термин «лечение» в настоящем документе относится к осуществлению этапов для получения благоприятных или требуемых результатов, в том числе клинических результатов. Благоприятные или требуемые клинические результаты включают, не ограничиваясь перечисленными, облегчение или смягчение одного или более симптомов, ассоциированных с состоянием. Стабилизированный АКК:
[0043] В соответствии с любым из вышеперечисленных вариантов реализации АКК стабилизирован по меньшей мере одним стабилизирующим агентом. Термины «аморфный карбонат кальция», и «АКК» используются в настоящем документе взаимозаменяемо и относятся к некристаллической аморфной форме карбоната кальция, стабилизированной по меньшей мере одним стабилизирующим агентом. Термины «стабилизирующий агент» и «стабилизатор» используются в настоящем документе взаимозаменяемо и относятся к любому веществу, которое вносит вклад в сохранение карбоната кальция в аморфном состоянии при получении АКК, приготовлении составов, хранении и/или применении. Согласно некоторым вариантам реализации указанный стабилизирующий агент представляет собой один агент. Согласно другим вариантам реализации предусмотрено применение нескольких стабилизирующих агентов. Термины «стабилизированный АКК» и «АКК, стабилизированный по меньшей мере одним стабилизатором» могут применяться взаимозаменяемо согласно некоторым вариантам реализации.
[0044] АКК может быть получены из естественного источника или химически синтезирован. Термины также включают естественным образом стабилизированный АКК, такой как АКК, полученный из гастролита.
[0045] Термин «естественный АКК» в настоящем документе относится к любому АКК, выделенному или происходящему из естественному источнику. Неограничивающие примеры природных источников АКК включают гастролиты пресноводных ракообразных.
[0046] Термин «синтетический АКК» в настоящем документе относится к любому АКК, полученному и/или извлеченному человеком ex vivo.
[0047] Стабилизатор может содержать молекулу, содержащую одну или более функциональных групп, выбранных из гидроксильных, карбоксильных, сложноэфирных, аминных, фосфиновых, фосфоновых, фосфатных, сульфонильных, сульфатных или сульфиновых групп, но не ограничивающихся перечисленными. Несущие гидроксильные группы соединения, скомбинированные с гидроксидом, необязательно также несут другие функции, такие как карбоксильные и т.п., однако гидроксил при этом не подвергается этерификации.
[0048] Согласно некоторым вариантам реализации указанный стабилизатор отличается низкой токсичностью или отсутствием токсичности для клеток или организма млекопитающих, и, в частности, человека. В соответствии с другими вариантами реализации указанный стабилизатор подходит для пищевого, нутрицевтического или фармацевтического применения.
[0049] Согласно некоторым вариантам реализации указанный стабилизирующий АКК агент представляет собой, независимо в каждом случае, органическую кислоту; фосфорилированное, фосфонированное, сульфатированное или сульфонированное органическое соединение; фосфорный или серный сложный эфир гидроксикарбоновой кислоты; органоаминное соединение; органическое соединение, содержащее гидроксил; фосфороорганическое соединение или его соль; фосфорилированные аминокислоты и их производные, бисфосфонат; фосфороорганическое соединение; органофосфонатное соединение; органический полифосфат, неорганический полифосфат, неорганическую фосфористую кислоту, органическое соединение, содержащее несколько функциональных групп согласно определению выше; неорганическое фосфатное и полифосфатное соединение; органическое соединение, содержащее полифосфатную цепь; органическое поверхностно-активное вещество; имеющий существенное биологическое значение неорганический ион; сахариды и их производные, белки, фосфорилированные белки, естественные и синтетические биополимеры и их производные, или любую их комбинацию. Согласно некоторым вариантам реализации указанный стабилизатор может обладать также фармацевтической активностью, как, например, бисфосфонат или АТФ.
[0050] Соответственно, согласно одному варианту реализации указанный стабилизирующий агент выбран из группы, состоящей из полифосфата, такого как неорганический полифосфат, органических кислот, фосфорилированных, фосфонированных, сульфатированных или сульфонированных органических соединений, фосфорных или серных сложных эфиров гидроксикарбоновых кислот, фосфорилированных аминокислот, бисфосфоната, органического полифосфата, сахаридов и их производных, белков, пептидов, фосфорилированных белков, фосфорилированных пептидов, и любых их комбинаций. Согласно другому варианту реализации указанный стабилизирующий агент выбран из группы, состоящей из фосфосерина, аденозинтрифосфата, аденозиндифосфата, фитиновой кислоты, лимонной кислоты, этидроновой кислоты, пирофосфата, полифосфата, трифосфата, этанола, гексаметафосфата, хитина и любой их комбинации.
[0051] Согласно некоторым вариантам реализации указанный стабилизатор представляет собой органическую кислоту. В соответствии с определенными вариантами реализации указанная органическая кислота выбрана из аскорбиновой, лимонной, молочной или уксусной кислоты, щавелевой кислоты, малоновой кислоты, глутаконовой кислоты, янтарной кислоты, малеиновой кислоты, молочной кислоты, глутаминовой кислоты, аконитовой кислоты и необязательно включает соединения, содержащие по меньшей мере две карбоксильных группы, необязательно с молекулярной массой, не превышающей 250 г/моль, такие как лимонная кислота, винная кислота, яблочная кислота и т.п. В соответствии с одним конкретным вариантом реализации указанный стабилизатор представляет собой лимонную кислоту.
[0052] Согласно другому варианту реализации указанный стабилизатор представляет собой фосфорный сложный эфир гидроксикарбоновых кислот, такой как фосфоенолпируват.Согласно другому варианту реализации указанные фосфорные или серные сложные эфиры гидроксикарбоновых кислот содержат аминокислоты. Примерами таких сложных эфиров являются фосфосерин, фосфотреонин, сульфосерин, сульфотреонин и фосфокреатин.
[0053] Согласно другому варианту реализации указанный стабилизатор представляет собой сахарид. В соответствии с одним вариантом реализации указанные сахариды выбраны из моно-, ди-, три-, олиго- и полисахаридов, таких как сахароза, манноза, глюкоза, хитозан и хитин. Стабилизатор может представлять собой, согласно некоторым вариантам реализации, полиатомный спирт, такой как глицерин. Согласно другому варианту реализации указанный стабилизатор представляет собой аминокислоту, такую как серии или треонин. Каждая возможность представляет собой отдельный вариант реализации настоящего изобретения.
[0054] Неограничивающим примером естественных и синтетических биополимеров и производных являются полинуклеотиды и гликопротеины.
[0055] Некоторые специфические неограничивающие примеры таких стабилизаторов АКК, одобренных для употребления в пищу, обнаруживаемых в естественных пищевых продуктах или в организме человека, включают фитиновую кислоту, лимонную кислоту, двуосновный пирофосфат натрия, соль аденозин-5'-монофосфат (АМФ) натрия, соль аденозин-5'-дифосфат (АДФ) натрия и гидрат динатриевой соли аденозин-5'-трифосфата (АТФ), фосфосерин, фосфорилированные аминокислоты, поверхностно-активные вещества пищевого качества, стеароиллактилат натрия; и их комбинации.
[0056] Согласно некоторым вариантам реализации указанный стабилизатор содержит по меньшей мере один компонент, выбранный из фосфорных или серных сложных эфиров гидроксикарбоновых кислот, таких как фосфоенолпируват, фосфосерин, фосфотреонин, сульфосерин или сульфотреонин, и сахариды, выбранные из моно-, ди-, три-, олиго- и полисахаридов, например, сахарозы, маннозы, глюкозы. Несущее гидроксил соединение может дополнительно содержать по меньшей мере один щелочной гидроксид, такой как гидроксид натрия, гидроксид калия и т.п. Фосфорилированные кислоты могут присутствовать в олигопептидах и полипептидах. Согласно другим вариантам реализации настоящего изобретения указанный стабилизатор представляет собой органическую кислоту, выбранную из монокарбоновой кислоты или поликарбоновой кислоты, например, дикарбоновой кислоты или трикарбоновой кислоты. Каждая возможность соответствует отдельному варианту реализации настоящего изобретения. Указанная органическая кислота может соответствовать определению выше.
[0057] Согласно некоторым вариантам реализации настоящего изобретения указанный стабилизатор АКК выбран из фосфорилированных аминокислот, полиолов и их комбинаций. Согласно некоторым вариантам реализации указанный стабильный АКК содержит фосфорилированное соединение в качестве стабилизатора, причем фосфорилирование осуществляют на гидроксильной группе органического соединения. Согласно некоторым вариантам реализации указанный стабильный АКК содержит стабилизатор, выбранный из группы, состоящей из лимонной кислоты, фосфосерина, фосфотреонина и их комбинаций. Неограничивающие примеры стабилизаторов, содержащих фосфатные, фосфитные, фосфонатные группы и соли, или их сложные эфиры, включают фитиновую кислоту, диметилфосфат, триметилфосфат, пирофосфат натрия, тетраэтилпирофосфат, рибулозобисфосфат, этидроновую кислоту и другие медицинские бисфосфонаты, 3-соль фосфоглицериновой кислоты, глицеральдегид-3-фосфат, соль 1-дезокси-D-ксилулозо-5-фосфат натрия, диэтилентриаминпентакис(метилфосфоновую кислоту), нитрилотри(метилфосфоновую кислоту), пентанатриевую соль 5-фосфо-D-рибозо-1-дифосфата, натриевую соль аденозин-5'-дифосфата, гидрат динатриевой соли аденозин-5'-трифосфата, α-D-галактозамин-1-фосфат, тринатриевую соль 2-фосфо-L-аскорбиновой кислоты, пентагидрат дикалиевой соли α-D-галактозо-1-фосфата, α-D-галактозамин-1-фосфат, О-фосфорилэтаноламин, гидрат динатриевой соли, пентанатриевую соль 2,3-дифосфо-D-глицериновой кислоты, гидрат мононатриевой соли фосфо(енол)пировиноградной кислоты, D-глицеральдегид-3-фосфат, литиевую соль sn-глицерин-3-фосфата, динатриевую соль D-(-)-3-фосфоглицериновой кислоты, натриевую соль D-глюкозо-6-фосфата, фосфатидную кислоту, соль ибандронат натрия, фосфоноуксусную кислоту, DL-2-амино-3-фосфонопропионовую кислоту; или их комбинации. Имеющие существенное биологические значение неорганические ионы могут включать, в том числе, Na, K, Mg, Zn, Fe, Ρ, S, Ν; Ρ или S в фазе оксидов; или N в виде аммония или нитрогрупп.
[0058] Указанный стабилизатор может дополнительно включать фосфонатные соединения, такие как, не ограничиваясь перечисленными, бисфосфонаты, полифосфаты, например, не ограничиваясь перечисленными, пирофосфат или полифосфонаты или органические полифосфаты, такие как, не ограничиваясь перечисленными, аденозиндифосфат (АДФ) или аденозинтрифосфат (АТФ).
[0059] Необязательно, АКК стабилизирован комбинацией фосфосерина и лимонной кислоты. Согласно другому варианту реализации АКК стабилизирован трифосфатом и лимонной кислотой.
[0060] Указанный АКК может быть стабилизирован более чем одним стабилизатором, например, двумя стабилизаторами. Согласно некоторым вариантам реализации указанный первый стабилизатор и указанный второй стабилизатор являются аналогичными. Согласно другим вариантам реализации указанный первый стабилизатор и указанный второй стабилизатор включают разные стабилизаторы. Каждый из указанных первого и второго стабилизаторов может независимо соответствовать определению выше в настоящем документе. Указанный стабильный АКК может содержать более чем два стабилизатора, при этом указанные стабилизаторы могут быть одинаковыми или разными. Указанный стабильный АКК может содержать более чем два стабилизатора, при этом указанные один или более стабилизаторов добавляют к АКК во время образования и осаждения АКК; таким образом, они представляют собой «внутренние» стабилизаторы, а другие один или более стабилизаторов добавляют на поверхность частиц АКК после их образования; таким образом, они представляют собой «внешние» стабилизаторы. Дополнительные примеры стабильных АКК и их состава можно найти в международных патентных заявках WO 2009/053967, WO 2014/024191 и WO 2016/193982.
[0061] Согласно некоторым вариантам реализации указанный стабилизирующий агент представляет собой белок или пептид. Согласно одному варианту реализации указанный белок или пептид представляет собой естественным образом полученный и очищенный белок или пептид. Согласно другому варианту реализации указанный белок представляет собой полученный синтетическим путем белок. Согласно некоторым вариантам реализации указанный белок выбран из белков GAP65, GAP22, GAP21 и GAP12. Согласно другому варианту реализации указанные белки выбраны из CqCDA1, хотиназы 2, бета-N-ацетилглюкозаминидазы, ГАМФ-подобного, хитин-связывающего белка, CqCBP, САР10, GAP 18,2, GAP 02526, CqHc1, CqHc2, CqHc3, CqHc4, CqHc5, CqHc6, CqHc7, криптоцианина 1, циклофилина, цистатина 1, цистатина 2, LPS-BP, белка LEA и кристацианина; необязательно, указанные белки происходят из С.quadricarinatus. В соответствии с определенными вариантами реализации указанные белки представляют собой фосфорилированные белки.
[0062] Согласно некоторым вариантам реализации указанный стабилизирующий агент выбран из полифосфата, фосфорилированных аминокислот, органических кислот, фосфорилированных, фосфонированных, сульфатированных или сульфонированных органических соединений, фосфорных или серных сложных эфиров гидроксикарбоновых кислот, бисфосфоната, сахаридов, их производных, белков, фосфорилированных белков, естественных и синтетических биополимеров и их производных, и любых их комбинаций. Согласно другим вариантам реализации указанный стабилизирующий агент выбран из фосфосерина, трифосфата, аденозинтрифосфата, аденозиндифосфата, фитиновой кислоты, лимонной кислоты, этидроновой кислоты, пирофосфата, этанола, гексаметафосфата, хитина и любой их комбинации.
[0063] Согласно некоторым вариантам реализации указанный стабилизирующий агент выбран из органических кислот, фосфорилированных органических кислот, фосфорных или серных сложных эфиров гидроксикарбоновых кислот, фосфорилированных аминокислот, бисфосфоната, органического полифосфата, сахаридов, их производных, белков; и любых их комбинаций.
[0064] Согласно некоторым вариантам реализации указанный по меньшей мере один стабилизатор выбран из группы, состоящей из полифосфата, бисфосфоната, фосфорилированной аминокислоты, лимонной кислоты и любой их комбинации. Согласно некоторым вариантам реализации добавляют более одного стабилизатора, например, 2, 3 или 4 стабилизатора.
[0065] Согласно некоторым вариантам реализации указанный стабилизатор представляет собой полифосфат или его фармацевтически приемлемые соли. Согласно некоторым вариантам реализации указанный полифосфат представляет собой физиологически совместимую водорастворимую полифосфатную соль, выбранную из группы, состоящей из полифосфата натрия, калия и любого другого имеющего существенное значение катиона. Согласно одному варианту реализации указанный полифосфат представляет собой органический или неорганический полифосфат. Термин «полифосфат» в настоящем документе относится к полимерным сложным эфирам РО4. Согласно некоторым вариантам реализации указанный полифосфат представляет собой физиологически совместимую водорастворимую полифосфатную соль, выбранную из группы, состоящей из полифосфата натрия и калия. Согласно некоторым вариантам реализации указанный полифосфат представляет собой неорганический полифосфат или его фармацевтически приемлемые соли. Неограничивающими примерами такой соли являются соли Na, K, Mg, Μn и Ζn. Согласно некоторым вариантам реализации указанный неорганический фосфат содержит 2-10 фосфатных групп, например, 2, 3, 4, 5, 6, 7, 8, 9 или 10 фосфатных групп. Согласно некоторым вариантам реализации указанный полифосфат выбран из пирофосфата, трифосфата и гексаметафосфата. В соответствии с одним вариантом реализации указанный стабилизатор представляет собой пирофосфат или его фармацевтически приемлемые соли, такие как пирофосфат натрия. Согласно другому варианту реализации указанный стабилизатор представляет собой трифосфат или его фармацевтически приемлемые соли, такие как трифосфат натрия. Термин «трифосфат» и «три полифосфат» используются в настоящем документе взаимозаменяемо. В соответствии с дополнительным вариантом реализации указанный стабилизатор представляет собой гексаметафосфат или его фармацевтически приемлемую соль, такую как гексаметафосфат натрия.
[0066] Согласно некоторым вариантам реализации указанный стабилизатор представляет собой бисфосфонат или его фармацевтически приемлемые соли. Неограничивающими примерами такой соли являются соли Na, K, Mg, Μn и Ζn.
[0067] Термин «бисфосфонат» в настоящем документе относится к органическим соединениям, содержащим две фосфонатные (РО(ОН)2) группы. Термин также относится к соединениям, содержащим остов РО3-органический компонент-РО3. Наиболее типичные примеры представлены рядом бисфосфонатов, применяемых в качестве фармацевтических средств для лечения остеопороза. Согласно некоторым вариантам реализации указанный бисфосфонат выбран из группы, состоящей из этидроновой кислоты, золедроновой кислоты, медроновой кислоты, алендроновой кислоты и их фармацевтически приемлемой соли. Согласно некоторым вариантам реализации указанный стабилизатор представляет собой этидроновую кислоту или ее фармацевтически приемлемую соль. Согласно другому варианту реализации указанный стабилизатор представляет собой золедроновую кислоту или ее фармацевтически приемлемую соль. В соответствии с дополнительным вариантом реализации указанный стабилизатор представляет собой медроновую кислоту или ее фармацевтически приемлемую соль. В соответствии с определенными вариантами реализации указанный стабилизатор представляет собой алендроновую кислоту или ее фармацевтически приемлемую соль.
[0068] В соответствии с определенными вариантами реализации указанный стабилизатор представляет собой фосфорилированную аминокислоту. В соответствии с одним вариантом реализации указанная фосфорилированная аминокислота представляет собой фосфосерин. Согласно другому варианту реализации указанная фосфорилированная аминокислота представляет собой фосфотреонин.
[0069] Согласно некоторым вариантам реализации в состав АКК входит комбинация описанных выше стабилизаторов.
[0070] Согласно некоторым вариантам реализации указанный стабилизатор представляет собой полифосфат или бисфосфонат согласно определению выше в настоящем документе, и молярное отношение атомов Ρ стабилизатора и атомов Са АКК (молярное отношение Р:Са) составляет от приблизительно 1:90 до 1:1. Согласно одному варианту реализации указанное молярное отношение Р:Са составляет от приблизительно 1:40 до приблизительно 1:1. Согласно дополнительному варианту реализации указанное молярное отношение Р:Са составляет от приблизительно 1:35 до приблизительно 1:2. Согласно некоторым вариантам реализации указанное молярное отношение Р:Са составляет от приблизительно 1:30 до приблизительно 1:3. Согласно некоторым вариантам реализации указанное молярное отношение Р:Са составляет от приблизительно 1:28 до приблизительно 1:3. Согласно другим вариантам реализации указанное молярное отношение Р:Са составляет от приблизительно 1:25 до приблизительно 1:4. Согласно дополнительному варианту реализации указанное молярное отношение Р:Са составляет от приблизительно 1:20 до приблизительно 1:5. Согласно другому варианту реализации указанное молярное отношение Р:Са составляет от приблизительно 1:20 до приблизительно 1:6. Согласно конкретному варианту реализации указанное молярное отношение Р:Са составляет от приблизительно 1:15 до приблизительно 1:5. Согласно другому конкретному варианту реализации указанное молярное отношение Р:Са составляет от приблизительно 1:25 до приблизительно 1:5. Согласно некоторым вариантам реализации такой полифосфат представляет собой пирофосфат, трифосфат, гексаметафосфат или его фармацевтически приемлемую соль. В соответствии с другой вариантами реализации указанный бисфосфонат представляет собой алендроновую кислоту, этидроновую кислоту, золедроновую кислоту или медроновую кислоту, и молярное отношение Р:Са соответствует определению выше в настоящем документе.
[0071] Согласно некоторым вариантам реализации содержание кальция (содержание Са) в стабилизированном АКК, содержащем полифосфат или бисфосфонат, составляет от приблизительно 1% по массе до приблизительно 39% по массе, от приблизительно 5% по массе до приблизительно 39% по массе, от приблизительно 10% до приблизительно 39% по массе, от приблизительно 15% до приблизительно 39% по массе, от приблизительно 20% по массе до приблизительно 38% по массе, от приблизительно 25% по массе до приблизительно 38% по массе, или от приблизительно 30 до приблизительно 38%. Термины «содержание Са» и «содержание кальция» применяются в настоящем документе взаимозаменяемо и относятся к содержанию кальция в итоговой композиции АКК.
[0072] Согласно некоторым вариантам реализации молярное отношение Р:Са составляет от приблизительно 1:40 до приблизительно 1:1, и содержание Са составляет от приблизительно 20% по массе до приблизительно 39% по массе. Согласно некоторым вариантам реализации указанное молярное отношение составляет от 1:28 до приблизительно 1:3, и содержание Са составляет от приблизительно 30% по массе до приблизительно 38% по массе. Согласно другому варианту реализации указанное молярное отношение составляет от 1:25 до приблизительно 1:5, и содержание Са составляет от приблизительно 30% по массе до приблизительно 36% по массе.
[0073] Согласно некоторым вариантам реализации указанный стабилизатор выбран из группы, состоящей из полифосфата, фосфорилированной аминокислоты, бисфосфоната, лимонной кислоты, винной кислоты и любой их комбинации. В соответствии с одним вариантом реализации указанный полифосфат выбран из группы, состоящей из трифосфата, пирофосфата и гексаметафосфата, указанная фосфорилированная аминокислота представляет собой фосфосерин или фосфотреонин, и указанный бисфосфонат выбран из группы, состоящей из алендроната, этидроновой кислоты, золедроновой кислоты и медроновой кислоты.
[0074] Согласно некоторым вариантам реализации стабилизированный АКК содержит менее чем 20% по массе, менее чем 15% по массе, менее чем 10% по массе, или менее чем 5% по массе стабилизирующего агента. Согласно некоторым вариантам реализации стабилизированный АКК содержит до 5% по массе стабилизирующего агента.
[0075] В соответствии с одним вариантом реализации средний диаметр первичных частиц стабилизированного АКК составляет от приблизительно 10 нм до приблизительно 5 мкм. Согласно другому варианту реализации средний диаметр первичных частиц АКК составляет от приблизительно 30 нм до приблизительно 400 нм. В соответствии с еще одним вариантом реализации средний диаметр первичных частиц АКК составляет от приблизительно 30 нм до 350 нм. В соответствии с определенный вариантами реализации средний диаметр первичных частиц АКК составляет от приблизительно 35 нм до 300 нм, от 40 нм до приблизительно 250 нм, от приблизительно 45 нм до приблизительно 200 нм, от приблизительно 50 нм до приблизительно 150 нм; или от приблизительно 60 нм до приблизительно 100 нм. В соответствии с еще одним вариантом реализации средний диаметр первичных частиц АКК составляет от приблизительно 30 нм до 00 нм. В соответствии с еще одним вариантом реализации первичные частицы АКК агрегированы и средний диаметр указанных агрегатов составляет от 0,5 мкм до 300 мкм. В соответствии с одним дополнительным вариантом реализации диаметр агрегатов первичных частиц АКК составляет от приблизительно 1 до приблизительно 100 мкм, от приблизительно 10 до приблизительно 50 мкм; или от приблизительно 20 до приблизительно 40 мкм. Согласно другому варианту реализации средний диаметр агрегатов первичных частиц АКК составляет от 1 мкм до 10 мкм. Фармацевтические композиции и маршруты введения:
[0076] В соответствии с любым из вышеописанных вариантов реализации фармацевтическая композиция согласно настоящему изобретению может вводиться с использованием любого известного маршрута введения. Термин «введение» вещества, соединения, агента или фармацевтической композиции субъекту может относиться к введению с применением одного из множества способов, известных специалистам в данной области техники. Например, соединение, агент или композиция могут быть введены энтерально или парентерально. Энтеральное введение относится к введению через желудочно-кишечный тракт, в том числе, орально, сублингвально или ректально. Парентеральное введение включает введение внутривенно, внутрикожно, внутримышечно, внутрибрюшинно, подкожно, через глаза, сублингвально, интраназально, путем ингаляции, интраспинально, интрацеребрально и чрескожно (путем абсорбции, например, через кожные протоки). Также подходящим может быть введение соединения или агента с применением перезаряжаемых или биоразлагаемых полимерных устройств или других устройств, например, пластырей и насосов, или составов, обеспечивающих продолжительное, медленное или контролируемое высвобождение указанного соединения или агента. Введение может также быть осуществлено, например, однократно, несколько раз и/или на протяжении одного или более продолжительных периодов. Согласно некоторым вариантам реализации введение включает и прямое введение, в том числе самостоятельное введение, и непрямое введение, включающее назначение лекарственного средства или продукта лечебного питания. Например, согласно настоящему изобретению, лечащий врач, который инструктирует пациента относительно самостоятельного введения лекарственного средства или продукта лечебного питания, или относительно введения ему указанного лекарственного средства или продукта лечебного питания другим лицом, и/или предоставляющий пациенту назначение лекарственного средства или продукта лечебного питания, осуществляет введение указанного лекарственного средства или продукта лечебного питания указанному пациенту. Согласно некоторым вариантам реализации фармацевтическая композиция представляет собой фармацевтический пищевой продукт или дополнение к пище.
[0077] Согласно одному варианту реализации фармацевтическую композицию, содержащая стабилизированный АКК, вводят посредством системного введения. Например стабилизированный АКК может вводиться перорально, сублингвально или ректально. Как вариант, указанный стабилизированный АКК может вводиться внутривенно, внутрикожно, внутримышечно, внутрибрюшинно, подкожно, через глаза, сублингвально, интраназально, путем ингаляции, интраспинально, интрацеребрально и чрескожно. Согласно одному специфическому варианту реализации стабилизированный АКК вводят перорально.
[0078] Фармацевтическая композиция согласно настоящему изобретению может быть получена любым известным способом. В частности, с применением способа, известного в данной области техники, может быть получен состав с указанной фармацевтической композицией, обеспечивающий быстрое, непрерывное или отложенное высвобождение активного ингредиента после введения. Согласно одному конкретному варианту реализации указанная фармацевтическая композиция представлена в состав твердой лекарственной формы, выбранной из таблеток, капсул, порошка или гранул. Согласно другому варианту реализации указанная фармацевтическая композиция введена в состав жидкой или полужидкой лекарственной формы, выбранной из эликсира, настойки, суспензии, сиропа, эмульсии или геля. Указанная фармацевтическая композиция может быть введена в полутвердые составы, например, камедь.
[0079] Фармацевтические композиции предназначенные для перорального применения, могут быть получены в соответствии с любым известным в данной области техники способом получения фармацевтических композиций, и могут дополнительно содержать один или более агентов, выбранных из подслащивающих агентов, вкусоароматических агентов, красящих агентов и консервирующих агентов для обеспечения получения фармацевтически удачных и приятных на вкус составов. Таблетки содержат активный агент в смеси с нетоксичными фармацевтически приемлемыми вспомогательными веществами, подходящими для получения таблеток. Указанные вспомогательные вещества могут представлять собой, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие агенты и агенты для улучшения распадаемости, например, кукурузный крахмал или альгиновую кислоту; связующие вещества; и смазывающие агенты. Таблетки необязательно имеют покрытия, нанесенные с применением известных техник, для задержки разложения и абсорбции в желудочно-кишечном тракте, с обеспечением таким образом продолжительного высвобождения лекарственного средства на протяжении более длинного периода времени.
Нервно-мышечные заболевания или состояния:
[0080] В соответствии с одним вариантом реализации настоящего изобретения предложена фармацевтическая композиция, содержащая аморфный карбонат кальция (АКК), стабилизированный по меньшей мере одним стабилизирующим агентом, для применения в лечении аксонального дефекта.
[0081] Термин «аксональный дефект» относится к любому дефекту, повреждению или повреждению аксональной части нервной клетки периферической или центральной нервной системы. Повреждение нервов может происходить либо в результате травмы, либо в результате заболевания. Травматическое повреждение нервов, такое как синдром запястного канала, вызвано сжатием нервов. Другие виды травм, такие как падение и автомобильные аварии, могут приводить к разрыву нервов. Наносящие ущерб нервам заболевания включают рассеянный склероз, диабет, спинальный дизрафизм и полиомиелит. Рассеянный склероз, например, вызывает разрушение изолирующего слоя миелина, окружающего аксоны. Согласно некоторым вариантам реализации настоящего изобретения указанный дефект или указанное повреждение может происходить с головным мозгом, спинным мозгом, афферентными и эфферентными нервами, выходящими из спинного мозга, и с периферическими нервами.
[0082] Согласно некоторым вариантам реализации лечение аксональных дефектов включает лечение аксонального повреждения, например, повреждения аксонов. В соответствии с некоторыми дополнительными вариантами реализации лечение аксонального повреждения включает улучшение регенерации и/или восстановления поврежденного нерва. Согласно другому варианту реализации лечение аксонального повреждения включает улучшение регенерации нервов. Согласно некоторым вариантам реализации лечение аксонального дефекта включает лечение дефекта, который является результатом заболевания, такого как рассеянный склероз.
[0083] Согласно некоторым вариантам реализации указанный аксональный дефект представляет собой аксональное повреждение, соответственно, фармацевтическая композиция согласно настоящему изобретению предназначена для применения в лечении аксонального повреждения, например, аксонального повреждения.
[0084] Согласно одному варианту реализации лечение аксонального повреждения включает улучшение регенерации и/или восстановления поврежденного нерва.
[0085] Термины «нейрональная регенерация» и «регенерация нервов» в настоящем документе могут применяться взаимозаменяемо и относятся к восстановлению функций поврежденного нерва. В частности, они включают восстановление сигнализации через нерв за счет заживления поврежденного участка, повторное разрастание аксональных и дендритных нейронных волокон периферической или центральной нервной системы. Согласно некоторым вариантам реализации регенерация нервов относится к спраутингу из поврежденных нейронных волокон.
[0086] Согласно некоторым вариантам реализации вводимая местно фармацевтическая композиция введена в жидкий или полужидкий состав согласно определению выше в настоящем документе. Согласно одному варианту реализации указанный жидкий или полужидкий состав выбран из суспензии, эмульсии, коллоида или геля. Согласно одному конкретному варианту реализации стабилизированный АКК вводят в виде суспензии.
[0087] Дефектный или поврежденный нерв может представлять собой нерв периферической нервной системы (ПНС) или центральной нервной системы (ЦНС). Соответственно, согласно одному варианту реализации фармацевтическая композиция согласно настоящему изобретению предназначена для лечения повреждения нервов центральной нервной системы. Согласно другому варианту реализации фармацевтическая композиция согласно настоящему изобретению предназначена для лечения повреждения периферической нервной системы. Согласно некоторым вариантам реализации настоящего изобретения фармацевтическая композиция согласно настоящему изобретению предназначена для лечения повреждения головного мозга, спинного мозга, афферентных и эфферентных нервов, выходящих из спинного мозга, или периферических нервов.
[0088] В соответствии с одним вариантом реализации указанную фармацевтическую композицию вводят местно. Согласно одному более специфическому варианту реализации указанную фармацевтическую композицию вводят поблизости от поврежденного нерва. Согласно некоторым вариантам реализации указанную фармацевтическую композицию вводят путем инъекции, инфузии или посредством насоса.
[0089] В соответствии с одним вариантом реализации указанную фармацевтическую композицию, содержащую АКК, стабилизированный по меньшей мере одним стабилизирующим агентом, выбранным из фосфосерина, трифосфата, аденозинтрифосфата, аденозиндифосфата, фитиновой кислоты, лимонной кислоты, этидроновой кислоты, пирофосфата, этанола, гексаметафосфата, хитина и любой их комбинации, применяют в лечении аксонального дефекта, такого как аксональное повреждение.
[0090] Согласно некоторым вариантам реализации указанное заболевание или расстройство представляет собой мышечную дистрофию. Соответственно, согласно одному варианту реализации настоящего изобретения предложена фармацевтически приемлемая композиция, содержащая стабилизированный АКК, для применения в лечении мышечной дистрофии.
[0091] Термин «мышечная дистрофия» в настоящем документе относится к любому из нескольких дегенеративных расстройств, заболеваний или состояний, характеризующихся прогрессирующей слабостью и ломкостью скелетных мышц. Многие из указанных заболеваний возникают в результате мутаций в генах, кодирующих белки дистрофин-гликопротеинового комплекса (ДГК). Согласно одному варианту реализации мышечная дистрофия относится к заболеванию, идентифицированному как мышечная дистрофия Дюшенна, Беккера, тазово-плечевая, врожденная, плече-лопаточно-лицевая, миотоническая, окулофарингеальная, дистальная мышечная дистрофия, или мышечная дистрофия Эмери-Дрейфуса. Согласно одному конкретному варианту реализации указанная мышечная дистрофия представляет собой мышечную дистрофию Дюшенна (МДД). Соответственно, согласно одному варианту реализации фармацевтически приемлемая композиция согласно настоящему изобретению предназначена для применения в лечении МДД.
[0092] Согласно одному варианту реализации термин «лечение» относится к облегчению или смягчению одного или более симптомов, ассоциированных с мышечной дистрофией, отсрочкой или замедлением указанного нарушения. Согласно некоторым вариантам реализации лечение мышечной дистрофии включает содействие образованию мышечных трубочек. Термин «образование мышечных трубочек» в настоящем документе относится к процессу, в ходе которого миобласты сливаются в многоядерные волокна, мышечные трубочки. Согласно некоторым вариантам реализации термин «лечение» мышечной дистрофии дополнительно включает также уменьшение периода времени до начала спонтанной сократительной активности указанных мышечных трубочек. Период времени до начала спонтанной сократительной активности определяют как время, необходимое миобластам для слияния и начала спонтанных сокращений.
[0093] В соответствии с принципами настоящего изобретения АКК стабилизирован по меньшей мере одним стабилизирующим агентом согласно описанию выше в настоящем документе. В соответствии с одним вариантом реализации стабилизированный АКК представляет собой естественный АКК, полученный из естественного источника, например, из гастролита, или химически синтезированный.
[0094] В соответствии с одним вариантом реализации настоящего изобретения предложена фармацевтическая композиция, содержащая АКК, стабилизированный по меньшей мере одним стабилизирующим агентом, для применения в лечении МДД, при этом указанный стабилизирующий агент выбран из фосфосерина, трифосфата, аденозинтрифосфата, аденозиндифосфата, фитиновой кислоты, лимонной кислоты, этидроновой кислоты, пирофосфата, этанола, гексаметафосфата, хитина и любой их комбинации. Согласно некоторым вариантам реализации указанный стабилизирующий агент выбран из фосфосерина, трифосфата, бисфосфоната и их комбинации с лимонной кислотой. В соответствии с одним вариантом реализации указанную фармацевтическую композицию вводят посредством системного введения, например, перорально.
[0095] Согласно другому аспекту настоящего изобретения предложено применение АКК, стабилизированного по меньшей мере одним стабилизирующим агентом, для получения медикамента для лечения заболевания или состояния, выбранного из аксонального дефекта и мышечной дистрофии. Вспомогательные репродуктивные технологии:
[0096] В соответствии с некоторыми аспектами настоящего изобретения АКК, стабилизированный по меньшей мере одним стабилизирующим агентом, может применяться во вспомогательных репродуктивных технологий (ВРТ).
[0097] Согласно другому аспекту настоящего изобретения предложен способ оплодотворения in vitro, включающий (а) оплодотворение in vitro ооцита млекопитающего; и (b) культивирование in vitro указанного эмбриона или эмбрионов, при этом этап (а), этап (b) или оба этапа, (а) и (b), осуществляют в клеточной культуральной среде, содержащей АКК, стабилизированный по меньшей мере одним стабилизирующим агентом. В соответствии с одним вариантом реализации настоящего изобретения предложен способ оплодотворения in vitro, включающий (а) оплодотворение in vitro ооцита млекопитающего; и (b) культивирование in vitro указанного эмбриона или эмбрионов в клеточной культуральной среде, содержащей АКК, стабилизированный по меньшей мере одним стабилизирующим агентом. Согласно другому варианту реализации настоящего изобретения предложен способ оплодотворения in vitro, включающий (а) оплодотворение in vitro ооцита млекопитающего в клеточной культуральной среде, содержащей АКК, стабилизированный по меньшей мере одним стабилизирующим агентом; и (b) культивирование in vitro указанного эмбриона или эмбрионов. Согласно другим вариантам реализации оба этапа, т.е. (а) оплодотворение in vitro ооцита млекопитающего; и (b) культивирование in vitro указанного эмбриона или эмбрионов, осуществляют в клеточной культуральной среде, содержащей АКК, стабилизированный по меньшей мере одним стабилизирующим агентом.
[0098] Согласно некоторым вариантам реализации указанный клеточные культуральные среды на этапах (а) и (b) могут, согласно одному варианту реализации, представлять собой разные среды. Согласно другому варианту реализации указанные среды могут быть представлены одной и той же средой.
[0099] Термин «эмбрион» в настоящем документе относится к оплодотворенному ооциту млекопитающего, т.е. зиготе, и к многоклеточному организму, развивающемуся из указанной зиготы на самых ранних этапах развития.
[0100] В соответствии с принципами настоящего изобретения культивирование эмбриона в клеточной культуральной среде, содержащей АКК, улучшает развитие эмбриона. Термины «эмбриогенез» и «развитие эмбриона» используются в настоящем документе взаимозаменяемо и относятся к процессу, в ходе которого образуется и развивается эмбрион, начиная со стадии зиготы, превращаясь в эмбрион, как известно в данной области техники, и включает этапы достижения стадии дробления, компактизации, образования бластоцисты или хетчинга бластоцисты. Термины «дробление», «компактизация» бластоцисты и «хетчинг» в настоящем документе относятся к терминам, широко используемым в эмбриологии. Термин «дробление» относится к делению клеток в раннем эмбрионе. Получение кластера клеток того же размера, что и оригинальная зигота. Разные клетки, образующиеся в результате дробления, называют бластомерами. Термин «компактизация» в настоящем документе относится к стадии, на которой делящиеся клетки, происходящие из зиготы, максимизируют взаимные контакты за счет поляризации и адгезии, образуя компактную сферу, которая сохраняет целостность за счет плотных соединений. Термин «бластоциста» в настоящем документе относится к структуре, развивающейся после стадии компактизации и содержащей внутреннюю клеточную массу, которая затем образует эмбрион, внешний слой бластоцисты, который окружает внутреннюю клеточную массу, и наполненную жидкостью полость, называемую бластоцелем. Термин «хетчинг» в настоящем документе относится к стадии, на которой эмбрион выходит из своей внешней оболочки (zona pellucida, «блестящая оболочка»).
[0101] Термин «улучшение развития эмбриона» в настоящем документе относится к способствованию (облегчению), улучшению или повышению скорости и/или эффективности процесса развития, а также к доле успешно выросших и созревших эмбрионов. Указанное улучшение измеряют относительно контрольного образца, подвергаемого той же процедуре, но без АКК в клеточной культуральной среде. Соответственно, согласно одному варианту реализации указанный способ включает культивирование in vitro указанного эмбриона или эмбрионов в клеточной культуральной среде, содержащей АКК, стабилизированный по меньшей мере одним стабилизирующим агентом, с улучшением, за счет этого, развития эмбриона и/или улучшением качества эмбрионов.
[0102] Термин «качество эмбрионов» в настоящем документе относится к оценке развития эмбриона с применением любого известного и приемлемого способа. Оценка эмбриона может отличаться в зависимости от выбранной стадии эмбриона и критериев оценки качества эмбриона. Существует несколько этапов оценки предымплантационного качества эмбриона. Некоторые из указанных способов описаны Nasiri и Eftekhari-Yazdi (CellJournal, 2015, 16(4), 392-405). Согласно одному варианту реализации улучшение качества эмбрионов включает увеличение доли эмбрионов, достигающих стадии компактизации, образования бластоцисты или хетчинга блестящей оболочки.
[0103] Термин «клеточная культуральная среда», «ростовая среда» и «культуральная среда» используются в настоящем документе взаимозаменяемо и относятся к клеточной культуральной среде, используемой для поддержания или способной к поддержанию роста клеток, тканей или органов. Клеточная культуральная среда может быть жидкой, твердой или полутвердой. Разные клеточные культуральные среды могут обладать разными свойствами и содержать разные соли и питательные вещества, однако все среды являются изотоническими и характеризуются осмотическим давлением, подходящим для роста клеток. Соответственно, указанная клеточная культуральная среда представляет собой изотоническую клеточную культуральную среду. Согласно одному конкретному варианту реализации указанная «ростовая среда» подходит для роста эмбрионов. Клеточная культуральная среда для эмбрионов хорошо известна в данной области техники, и ее состав может варьировать в соответствии, например, со стадией эмбриона; специалист в данной области техники знает, как адаптировать клеточную культуральную среду в соответствии с имеющимися требованиями. В соответствии с любым из вышеупомянутых вариантов реализации АКК, стабилизированный по меньшей мере одним стабилизатором, может быть добавлен к любой известной среде, подходящей для роста или развития ооцитов и/или эмбрионов. Неограничивающими примерами являются среды для монокультур, такие как SAGE 1-Step™, и/или среды для последовательного культивирования, такие как Quinns Advantage™ Sequential Media (ORIGIO).
[0104] Согласно некоторым вариантам реализации указанный способ включает этап созревания ооцита in vitro в клеточной культуральной среде, содержащей АКК, стабилизированный по меньшей мере одним стабилизирующим агентом, перед этапом
(a). Соответственно, согласно одному варианту реализации настоящего изобретения предложен способ оплодотворения in vitro, включающий (а) созревание ооцита in vitro;
(b) оплодотворение ооцита млекопитающего in vitro; и (с) культивирование указанного эмбриона или эмбрионов in vitro, при этом этапы (а) и (b), этапы (а) и (с) или этапы (а), (b) и (с) осуществляют в клеточной культуральной среде, содержащей АКК, стабилизированный по меньшей мере одним стабилизирующим агентом.
[0105] В соответствии с принципами настоящего изобретения культивирование ооцита в клеточной культуральной среде, содержащей АКК, стабилизированный по меньшей мере одним стабилизатором, улучшает созревание ооцита, соответственно, указанный способ включает улучшение созревания ооцита. Термин «созревание ооцита» относится к процессу и к каждому из этапов процесса, в ходе которого ооцит прогрессирует из незрелого состояния, в котором оплодотворение невозможно, в мейотически зрелый ооцит, который может быть оплодотворен, способный продуцировать жизнеспособный эмбрион. Улучшение созревания ооцита относится к ускорению указанного процесса, а также к увеличению вероятности достижения ооцитом зрелой стадии. Соответственно, согласно одному варианту реализации указанный способ включает улучшение созревания ооцита. Согласно другим вариантам реализации указанный способ включает созревание ооцита и эмбриона в клеточной культуральной среде, содержащей АКК, стабилизированный по меньшей мере одним стабилизатором, с улучшением, за счет этого, созревания ооцита и развития эмбриона.
[0106] Термин «улучшение» в настоящем документе относится к содействию, улучшению, преумножению, как правило, увеличению показателей роста, измеряемому относительно контрольного образца, культивируемого на той же среде, но без АКК.
[0107] В соответствии с любым из вышеперечисленных вариантов реализации конечная концентрация стабилизированного АКК в клеточной культуральной среде составляет от приблизительно 0,1 до приблизительно 20 мМ, от приблизительно 0,5 до приблизительно 15 мМ, от приблизительно 1 до приблизительно 10 мМ, от приблизительно 2 до приблизительно 8 мМ, от приблизительно 3 мМ до приблизительно 6 мМ или от приблизительно 4 мМ до приблизительно 5 мМ. В соответствии с одним вариантом реализации указанный АКК добавляют в конечной концентрации, составляющей от приблизительно 0,8 мМ до приблизительно 5 мМ, или от приблизительно 1,3 мМ до приблизительно 3,5 мМ, или в конечной концентрации, составляющей от приблизительно 1,7 мМ до приблизительно 2,6 мМ. Согласно более конкретному варианту реализации стабилизированный АКК присутствует в концентрации, составляющей от 0,5 до приблизительно 4 мМ, от приблизительно 1 до приблизительно 3 мМ, от приблизительно 1,5 до приблизительно 2,5, или приблизительно 1, 1,5, 2 или 2,5 мМ. Согласно некоторым вариантам реализации концентрация стабилизированного АКК в клеточной культуральной среде составляет от приблизительно 0,0001% (масса/объем) до приблизительно 1% (масса/объем), от приблизительно 0,0005% (масса/объем) до приблизительно 0,5% (масса/объем), о приблизительно 0,001% (масса/объем) до приблизительно 0,1% (масса/объем), от приблизительно 0,005% (масса/объем) до приблизительно 0,05% (масса/объем), от приблизительно 0,01% (масса/объем) до приблизительно 0,03% (масса/объем).
[0108] В соответствии с одним вариантом реализации приведение в контакт стабилизированного АКК с ооцитом и/или эмбрионом улучшает развитие эмбриона и/или созревание ооцита приблизительно на 10% - приблизительно на 300%, приблизительно 20% - приблизительно на 250%, приблизительно на 30% -приблизительно на 200%, приблизительно 40% приблизительно на 150%, приблизительно 60% приблизительно на 100%; или приблизительно на 70% приблизительно на 90%. Улучшение на 100% означает, что указанный показатель, например, пролиферация увеличивается в 2 раза; улучшение на 200% означает, что указанный показатель, например, развитие эмбриона, увеличивается в 3 раза, и так далее. Согласно некоторым вариантам реализации приведение в контакт стабилизированного АКК с ооцитом и/или эмбрионом улучшает развитие эмбриона и/или созревание ооцита на 50% - приблизительно на 300%, приблизительно на 100% - приблизительно на 250%, приблизительно на 150% - приблизительно на 250%.
[0109] Согласно некоторым вариантам реализации улучшение созревания ооцита и/или улучшение развития эмбриона улучшает исход ЭКО. Соответственно, в соответствии с одним вариантом реализации настоящего изобретения предложен способ улусшения процедуры ЭКО, включающий воздействие на ооцит, воздействие на эмбрион(ы) или воздействие и на ооцит, и на эмбрион, стабилизированным АКК. Согласно другому варианту реализации указанный способ дополнительно включает получение по меньшей мере одного ооцита от млекопитающего женского пола и/или имплантация указанного эмбриона или эмбрионов млекопитающему женского пола.
[0110] Согласно любому из вышеупомянутых вариантов реализации эмбрион и/или ооцит представляет собой эмбрион и/или ооцит человека или не являющегося человеком млекопитающего. Согласно одному конкретному варианту реализации указанный эмбрион и/или ооцит представляет собой эмбрион и/или ооцит человека. Согласно другим вариантам реализации указанный эмбрион и/или ооцит представляет собой эмбрион и/или ооцит не являющегося человеком млекопитающего. Неограничивающими примерами эмбриона и/или ооцита не являющегося человеком млекопитающего являются эмбрионы и/или ооциты сельскохозяйственных животных, домашних животных, грызунов, зайцеобразных, летучих мышей и приматов. Согласно одному варианту реализации указанный не принадлежащий человеку эмбрион представляет собой эмбрион сельскохозяйственных животных, например, крупного рогатого скота, свиней, овец, коз, лошадей, мулов, ослов, буйволов или верблюдов. Согласно одному конкретному варианту реализации указанный эмбрион и/или ооцит представляет собой эмбрион и/или ооцит крупного рогатого скота. Согласно некоторым другим вариантам реализации эмбрион и/или ооцит домашнего животного представляет собой эмбрион и/или ооцит кошки или собаки; эмбрион и/или ооцит грызуна представляет собой эмбрион и/или ооцит мыши, крысы, морской свинки или хомяка; эмбрион и/или ооцит зайцеобразных представляет собой эмбрион и/или ооцит кролика; и эмбрион и/или ооцит примата представляет собой эмбрион и/или ооцит обезьяны, например, макак или человекообразной обезьяны, такой как шимпанзе.
[0111] В соответствии с любым из вышеперечисленных вариантов реализации, АКК, стабилизированный по меньшей мере одним стабилизатором, может быть добавлен в любую известную среду, подходящую для развития или созревания ооцитов и/или эмбрионов. Примерами таких сред являются среды для монокультур, такие как SAGE 1-Step™, или среды для последовательного культивирования, такие как Quinns Advantage™ Sequential Media (ORIGIO).
[0112] В соответствии с одним вариантом реализации настоящего изобретения предложен способ оплодотворения in vitro, включающий (а) оплодотворение in vitro ооцита млекопитающего; и (b) культивирование in vitro указанного эмбриона или эмбрионов, при этом этап (а), этап (b) или оба этапа, (а) и (b), осуществляют в клеточной культуральной среде с добавлением АКК, стабилизированного по меньшей мере одним стабилизирующим агентом, выбранным из фосфосерина, трифосфата, этидроновой кислоты, пирофосфата, этанола, хитина, гексаметафосфата, лимонной кислоты; и комбинации фосфосерина, трифосфата, этидроновой кислоты или гексаметафосфата с лимонной кислотой. Согласно другому варианту реализации указанный способ включает этап созревания ооцита in vitro в клеточной культуральной среде, содержащей АКК, стабилизированный по меньшей мере одним стабилизирующим агентом, перед этапом (а). Соответственно, согласно одному варианту реализации настоящего изобретения предложен способ улучшения оплодотворения in vitro, включающий (а) созревание ооцита in vitro (b) оплодотворение ооцита млекопитающего in vitro; и (с) культивирование указанного эмбриона или эмбрионов in vitro, при этом этапы (а) и (b), этапы (а) и (с), или этапы (а), (b) и (с) осуществляют в клеточной культуральной среде, содержащей АКК, стабилизированный по меньшей мере одним стабилизирующим агентом. В соответствии с одним вариантом реализации среды, подходящие для роста эмбрионов, представляют собой среды для монокультур, такие как SAGE 1-Step™, или среды для последовательного культивирования, такие как Quinns Advantage™ Sequential Media (ORIGIO). В соответствии с одним вариантом реализации указанный АКК добавляют в конечной концентрации, составляющей от приблизительно 0,8 мМ до приблизительно 5 мМ, или от приблизительно 1,3 мМ до приблизительно 3,5 мМ, или в конечной концентрации, составляющей от приблизительно 1,7 мМ до приблизительно 2,6 мМ. В соответствии с одним вариантом реализации указанный способ включает улучшение созревания ооцита и/или улучшение развития эмбрионов. Согласно другому варианту реализации указанный способ включает улучшение качества эмбрионов и, соответственно, увеличение уровней успешности ЭКО.
[0113] Согласно некоторым вариантам реализации настоящего изобретения предложен способ получения эмбриона in vitro, включающий (а) оплодотворение ооцита или ооцитов in vitro; и (b) культивирование эмбриона или эмбрионов in vitro в культуральной среде для эмбрионов, содержащей АКК, стабилизированный по меньшей мере одним стабилизирующим агентом. Согласно некоторым вариантам реализации указанный способ включает получение по меньшей мере одного ооцита от млекопитающего женского пола до этапа (а).
[0114] Согласно одному аспекту настоящего изобретения предложен способ улучшения качества спермы, при этом указанный способ включает воздействие на сперму эффективным количеством аморфного карбоната кальция (АКК), стабилизированного по меньшей мере одним стабилизирующим агентом.
[0115] Термины «сперма» и «сперматозоиды» в настоящем документе взаимозаменяемы и относятся к мужским репродуктивным клеткам. Термин «образец спермы» относится к одному или более образцам, содержащим сперму. Образец спермы может представлять собой семенную жидкость, полученную от субъекта, или обработанная семенная жидкость, сжиженная семенная жидкость, осажденная и необязательно ресуспендированная сперма, и т.п.
[0116] В соответствии с одним вариантом реализации улучшение качества спермы выбрано из группы, состоящей из повышения подвижности сперматозоидов, повышения поступательной подвижности сперматозоидов, увеличения численности сперматозоидов и любой комбинации перечисленного.
[0117] Термин «подвижность сперматозоидов» в настоящем документе относится к фракции двигающихся сперматозоидов среди всех сперматозоидов в определенном образце. Термин «поступательная подвижность» в настоящем документе относится к фракции сперматозоидов, двигающихся в относительно постоянном направлении. Термины «повышение подвижности сперматозоидов» и «повышение поступательной подвижности сперматозоидов» в настоящем документе относятся к увеличению фракции подвижных сперматозоидов и сперматозоидов, характеризующихся поступательной подвижностью, соответственно. Соответственно, согласно одному варианту реализации настоящего изобретения предложен способ улучшения подвижности сперматозоидов. Согласно другому варианту реализации настоящего изобретения предложен способ улучшения поступательной подвижности сперматозоидов. Оценка подвижности, поступательной подвижности и стадии созревания сперматозоидов может быть проведена любым известным в данной области техники способом. Например, оценка подвижности может быть проведена с применением метода компьютеризированного анализа спермы (CASA, «computer-assisted sperm analysis») (Amann & Waberski, 2014, Theriogenology, 81: 5-17).
[0118] Согласно некоторым вариантам реализации увеличение численности сперматозоидов включает увеличение численности сперматозоидов в ходе процедуры оценки подвижности или поступательной подвижности. В соответствии с одним вариантом реализации указанная процедура оценки подвижности или поступательной подвижности представляет собой процедуру флотации.
[0119] Термин «улучшение» применяют согласно определению в настоящем документе. Согласно некоторым вариантам реализации повышение подвижности сперматозоидов, повышение поступательной подвижности сперматозоидов, увеличение численности сперматозоидов включает повышение подвижности спермы, повышение поступательной подвижности сперматозоидов, увеличение численности сперматозоидов приблизительно на 10% приблизительно на 600%, приблизительно на 20% - приблизительно на 500%, приблизительно на 30% - приблизительно на 400%, приблизительно на 40% приблизительно на 300%, приблизительно на 50% приблизительно на 200, приблизительно на 60% - приблизительно на 150%, или приблизительно на 70% приблизительно на 100%. Улучшение на 100% означает, что указанный показатель, например, подвижность, увеличивается в 2 раза. Согласно некоторым вариантам реализации происходит улучшение подвижности или численности сперматозоидов приблизительно на 100% приблизительно на 500%, приблизительно 120% приблизительно на 400%, приблизительно 150% приблизительно на 300%.
[0120] В соответствии с любым из вышеперечисленных вариантов реализации сперма представляет собой сперму человека или не являющегося человеком млекопитающего. Согласно некоторым вариантам реализации указанное не являющееся человеком млекопитающее выбрано из группы, состоящей из сельскохозяйственных животных, домашних животных, грызунов, диких животных и приматов.
[0121] Согласно одному варианту реализации животные, относящиеся к сельскохозяйственным животным, выбраны из крупного рогатого скота, свиней, овец, коз, лошадей, мулов, ослов, буйволов и верблюдов. Согласно некоторым другим вариантам реализации домашнее животное представляет собой кошку или собаку, грызун представляет собой крысу, мышь, морскую свинку или хомяка, зайцеобразное представляет собой кролика, и примат представляет собой обезьяну, такую как макака, или человекообразную обезьяну, такую как шимпанзе.
[0122] Согласно другому варианту реализации сперма представляет собой сперму не являющегося млекопитающим животного. В соответствии с некоторыми вариантами реализации указанное не являющееся млекопитающим животное выбрано из группы, состоящей из рыб, насекомых и птиц.
[0123] В соответствии с одним вариантом реализации сперма представляет собой сперму человека.
[0124] В соответствии с любым из вышеперечисленных вариантов реализации воздействие на клетки АКК, стабилизированным по меньшей мере одним стабилизирующим агентом, включает добавление указанного АКК в клеточную культуральную среду. Термины «воздействие» и «приведение в контакт» используются в настоящем документе взаимозаменяемо и относятся к помещению или перенесению клеток в среду с условиями, включающими такой компонент, как стабилизированный АКК, или к добавлению компонента, например, стабилизированного АКК, в среду, в которой выращивают или культивируют указанные клетки, или к добавлению стабилизированного АКК в среду, в которую помещают сперму. Согласно некоторым вариантам реализации воздействие стабилизированным АКК включает приведение клеток в контакт с АКК в организме субъекта.
[0125] В соответствии с любым из вышеперечисленных вариантов реализации АКК, стабилизированный по меньшей мере одним стабилизатором, может быть добавлен в любую известную среду, подходящую для манипуляций со спермой или созревания сперматозоидов. Согласно некоторым вариантам реализации указанная среда выбрана из среды для разделения сперматозоидов, например, ISolate®, PureCeption™, Multipurpose Handling Medium® (MHM®), среды для промывания спермы, например, среды для промывания спермы Quinns™, универсальной рабочей среды Multipurpose Handling Medium® (MHM®) и модифицированной среды HTF с гентамицином - HEPES, и среды для капацитации, такой как среда Бигера-Виттена-Виттингема (BWW), среды F10 Хэма и модифицированной среды Тироде (HSM).
[0126] В соответствии с любым из вышеперечисленных вариантов реализации конечная концентрация стабилизированного АКК в клеточной культуральной среде составляет от приблизительно 0,1 до приблизительно 20 мМ, приблизительно 0,5 до приблизительно 15 мМ, от приблизительно 1 до приблизительно 10 мМ, от приблизительно 2 до приблизительно 8 мМ, от приблизительно 3 мМ до приблизительно 6 мМ или от приблизительно 4 мМ до приблизительно 5 мМ. В соответствии с одним вариантом реализации АКК добавляют в конечной концентрации, составляющей от приблизительно 0,8 мМ до приблизительно 5 мМ или от приблизительно 1,3 мМ до приблизительно 3,5 мМ, или в конечной концентрации, составляющей от приблизительно 1,7 мМ до приблизительно 2,6 мМ. Согласно более конкретному варианту реализации стабилизированный АКК присутствует в концентрации, составляющей от 0,5 до приблизительно 4 мМ, от приблизительно 1 до приблизительно 3 мМ, от приблизительно 1,5 до приблизительно 2,5, или приблизительно 1, 1,5, 2 или 2,5 мМ. Согласно некоторым вариантам реализации концентрация стабилизированного АКК в клеточной культуральной среде составляет от приблизительно 0,0001% (масса/объем) до приблизительно 1% (масса/объем), от приблизительно 0,0005% (масса/объем) до приблизительно 0,5% (масса/объем), от приблизительно 0,001% (масса/объем) до приблизительно 0,1% (масса/объем), от приблизительно 0,005% (масса/объем) до приблизительно 0,05% (масса/объем), от приблизительно 0,01% (масса/объем) до приблизительно 0,03% (масса/объем).
[0127] В соответствии с любым из вышеперечисленных вариантов реализации указанный способ дополнительно включает применение спермы для ЭКО или для внутриматочного осеменения.
[0128] В соответствии с дополнительным аспектом согласно настоящему изобретению предложен способ разделения сперматозоидов, несущих Х- и Y-хромосомы, включающий: (а) приведение в контакт образца спермы с АКК, стабилизированным по меньшей мере одним стабилизатором, (b) выполнение процедуры оценки поступательной подвижности, (с) получение фракции, содержащей подвижные сперматозоиды, и (d) разделение верхней фазы и нижних фаз фракции, полученной на этапе (с), при этом верхняя фаза обогащена несущей Y-хромосому спермой, а нижняя фаза обогащена несущей Х-хромосому спермой. Указанный способ охватывает разделение сперматозоидов, содержащих Х-хромосому, и сперматозоидов, содержащих Y-хромосому.
[0129] В соответствии с одним вариантом реализации процедура оценки поступательной подвижности представляет собой процедуру флотации. Процедура флотации хорошо известная в данной области техники. В целом, образец спермы помещают на дно пробирки, покрывают средой для спермы, пробирку инкубируют до приблизительно 1 часа при 37°С, чтобы позволить подвижным сперматозоидам переместиться из образца в среду для спермы. Затем среду для спермы собирают и разделяют на верхнюю фазу, обогащенную несущей Y-хромосому спермой, и нижнюю фазу, обогащенную несущей Х-хромосому спермой. Согласно некоторым вариантам реализации может быть использовано короткое время инкубации, например, 10-30 мин.
[0130] Согласно некоторым вариантам реализации указанный способ дополнительно включает применение указанной верхней фазы и/или указанной нижней фазы для ЭКО или для внутриматочного осеменения.
[0131] В соответствии с некоторыми аспектами настоящего изобретения предложено применение АКК, стабилизированного по меньшей мере одним стабилизирующим агентом, во вспомогательных репродуктивных технологий (ВРТ). Согласно некоторым вариантам реализации ВРТ выбрана из оплодотворения in vitro (ЭКО), выбора пола и улучшения качества спермы.
[0132] В соответствии с одним вариантом реализации настоящего изобретения предложено применение АКК, стабилизированного по меньшей мере одним стабилизирующим агентом, для ЭКО. В соответствии с одним вариантом реализации стабилизированный АКК добавляют в культуру клеток на стадии, выбранной из созревания ооцита in vitro, оплодотворения ооцита млекопитающего in vitro, культивирования эмбриона или эмбрионов in vitro; или любой комбинации перечисленного. Соответственно, согласно одному варианту реализации стабилизированный АКК добавляют в клеточную культуральную среду на стадии культивирования эмбриона или эмбрионов in vitro. Согласно другому варианту реализации стабилизированный АКК добавляют в клеточную культуральную среду на стадии созревания ооцита. В соответствии с дополнительным вариантом реализации стабилизированный АКК добавляют во время созревания ооцитов и во время культивирования эмбриона или эмбрионов in vitro. В соответствии с одним вариантом реализации стабилизированный АКК улучшает созревание ооцитов и/или развитие эмбриона.
[0133] Согласно другому варианту реализации настоящего изобретения предложено применение АКК, стабилизированного по меньшей мере одним стабилизирующим агентом, для улучшения качества спермы. Согласно некоторым вариантам реализации улучшение качества спермы выбрано из группы, состоящей из повышения подвижности сперматозоидов, повышения поступательной подвижности сперматозоидов, увеличения численности сперматозоидов и любой комбинации перечисленного. Согласно некоторым вариантам реализации сперма, полученная указанным способом, может применяться для внутриматочного осеменения или для ЭКО.
[0134] Согласно другому варианту реализации настоящего изобретения предложено применение АКК, стабилизированного по меньшей мере одним стабилизирующим агентом, в технике выбора пола. В соответствии с одним вариантом реализации указанная техника выбора пола включает этап обогащения образца спермы спермой, несущей один тип половой хромосомы. Указанный этап включает (а) приведение образца спермы в контакт с АКК, стабилизированным по меньшей мере одним стабилизатором, (b) выполнение процедуры флотации, (с) получение фракции, содержащей подвижные сперматозоиды, и (d) разделение верхней фазы и нижних фаз фракции, полученной на этапе (с), при этом верхняя фаза обогащена несущей Y-хромосому спермой, а нижняя фаза обогащена несущей Х-хромосому спермой.
[0135] Согласно другому варианту реализации настоящего изобретения предложен АКК, стабилизированный по меньшей мере одним стабилизирующим агентом, для применения во вспомогательных репродуктивных технологий (ВРТ). Согласно некоторым вариантам реализации ВРТ выбрана из оплодотворения in-vitro (ЭКО), выбора пола, улучшения качества спермы.
[0136] В соответствии с одним вариантом реализации стабилизированный АКК предназначен для применения при ЭКО. В соответствии с одним вариантом реализации стабилизированный АКК предназначен для применения на стадии, выбранной из созревания ооцита in vitro, оплодотворения ооцита млекопитающего in vitro, культивирования эмбриона или эмбрионов in vitro; и любой комбинации перечисленного. Согласно некоторым вариантам реализации стабилизированный АКК добавляют в среду, выбранную из среды для созревания ооцита in vitro, среды для оплодотворения ооцита млекопитающего in vitro и среды для культивирования эмбриона или эмбрионов in vitro, согласно определению выше в настоящем документе.
[0137] Согласно другому варианту реализации стабилизированный АКК предназначен для применения при улучшении качества спермы. Согласно некоторым вариантам реализации указанный способ включает воздействие на сперму стабилизированным АКК. Согласно некоторым вариантам реализации улучшение качества спермы выбрано из группы, состоящей из повышения подвижности сперматозоидов, повышения поступательной подвижности сперматозоидов, увеличения численности сперматозоидов; и любой комбинации перечисленного. Согласно некоторым вариантам реализации сперма, полученная указанным способом, может быть использована для внутриматочного осеменения или ЭКО.
[0138] В соответствии с дополнительным вариантом реализации стабилизированный АКК предназначен для применения в технике выбора пола. В соответствии с одним вариантом реализации стабилизированный АКК применяют для разделения сперматозоидов, несущих Х- и Y-хромосомы, путем: (а) приведения образца спермы в контакт с АКК, стабилизированным по меньшей мере одним стабилизатором, (b) выполнения процедуры флотации, (с) получения фракции, содержащей подвижные сперматозоиды, и (d) разделения верхней фазы и нижних фаз фракции, полученной на этапе (с), при этом верхняя фаза обогащена несущей Y-хромосому спермой, а нижняя фаза обогащена несущей Х-хромосому спермой.
[0139] В соответствии с любым из вышеперечисленных вариантов реализации приведение ооцитов или спермы в контакт со стабилизированным АКК включает добавление стабилизированного АКК в клеточную культуральную среду согласно определению выше в настоящем документе.
[0140] В соответствии с любым из вышеперечисленных вариантов реализации конечная концентрация стабилизированного АКК в клеточной культуральной среде составляет от приблизительно 0,1 до приблизительно 20 мМ, от приблизительно 0,5 до приблизительно 15 мМ, от приблизительно 1 до приблизительно 10 мМ, от приблизительно 2 до приблизительно 8 мМ, от приблизительно 3 мМ до приблизительно 6 мМ или от приблизительно 4 мМ до приблизительно 5 мМ. В соответствии с одним вариантом реализации АКК добавляют в конечной концентрации, составляющей от приблизительно 0,8 мМ до приблизительно 5 мМ или от приблизительно 1,3 мМ до приблизительно 3,5 мМ, или в конечной концентрации, составляющей от приблизительно 1,7 мМ до приблизительно 2,6 мМ. Согласно более конкретному варианту реализации стабилизированный АКК присутствует в концентрации, составляющей от 0,5 до приблизительно 4 мМ, от приблизительно 1 до приблизительно 3 мМ, от приблизительно 1,5 до приблизительно 2,5, или приблизительно 1, 1,5, 2 или 2,5 мМ. Согласно некоторым вариантам реализации концентрация стабилизированного АКК в клеточной культуральной среде составляет от приблизительно 0,0001% (масса/объем) до приблизительно 1% (масса/объем), от приблизительно 0,0005% (масса/объем) до приблизительно 0,5% (масса/объем), от приблизительно 0,001% (масса/объем) до приблизительно 0,1% (масса/объем), от приблизительно 0,005% (масса/объем) до приблизительно 0,05% (масса/объем), от приблизительно 0,01% (масса/объем) до приблизительно 0,03% (масса/объем).
[0141] Согласно другому аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая аморфный карбонат кальция (АКК), стабилизированный по меньшей мере одним стабилизатором, для применения в лечении мужского бесплодия.
[0142] Согласно некоторым вариантам реализации мужское бесплодие выбрано из мужского бесплодия, вызванного низкой численностью сперматозоидов, и мужского бесплодия, вызванного низкой подвижностью сперматозоидов. Термин «низкая подвижность сперматозоидов» относится к состоянию, при котором число подвижных сперматозоидов для ВМО составляет менее чем 5 млн.
[0143] Согласно некоторым вариантам реализации указанная фармацевтическая композиция может вводиться любым известным способом согласно описанию выше в настоящем документе. В соответствии с одним вариантом реализации указанную фармацевтическую композицию вводят перорально.
[0144] Согласно одному аспекту настоящего изобретения предложен способ лечения мужского бесплодия у нуждающегося в этом субъекта, включающий введение указанному субъекту фармацевтической композиции, содержащей аморфный карбонат кальция (АКК), стабилизированный по меньшей мере одним стабилизатором.
[0145] Согласно другому аспекту настоящего изобретения предложен способ лечения заболевания или состояния, выбранного из мышечной дистрофии и аксонального дефекта, у нуждающегося в этом субъекта, включающий введение указанному субъекту фармацевтически приемлемой композиции, содержащей аморфный карбонат кальция (АКК), стабилизированный по меньшей мере одним стабилизирующим агентом.
[0146] Термины «фармацевтически приемлемая композиция», «АКК», «стабилизирующий агент», «аксональный дефект» и «мышечная дистрофия» соответствуют определению выше в настоящем документе.
[0147] В соответствии с одним вариантом реализации настоящего изобретения предложен способ лечения аксонального дефекта у нуждающегося в этом субъекта, включающий введение указанному субъекту фармацевтически приемлемой композиции, содержащей терапевтически эффективное количество АКК, стабилизированного по меньшей мере одним стабилизирующим агентом. В соответствии с одним вариантом реализации указанный аксональный дефект представляет собой аксональное повреждение, например, повреждение аксонов. В соответствии с определенный вариантами реализации указанный аксональный дефект или повреждение относится к нервам центральной нервной системы или к нервам периферической нервной системы. Согласно некоторым вариантам реализации лечение аксонального повреждения включает улучшение восстановления и/или регенерации поврежденного нерва.
[0148] Согласно некоторым вариантам реализации введение включает введение фармацевтически приемлемой композиции системно или местно, согласно описанию выше. Согласно некоторым вариантам реализации системное введение включает энтеральное введение, т.е. через желудочно-кишечный тракт, например, орально, сублингвально или ректально, и парентеральное введение, например, внутривенно, внутрикожно, внутримышечно, внутрибрюшинно, подкожно, через глаза, сублингвально, интраназально, путем ингаляции, интраспинально, интрацеребрально и чрескожно. В соответствии с одним вариантом реализации указанную фармацевтическую композицию вводят перорально. В соответствии с другими вариантами реализации введение осуществляют местно, в частности, поблизости от дефектного, поврежденного или поврежденного нерва. В соответствии с одним вариантом реализации указанную фармацевтически приемлемую композицию вводят местно путем инъекции, инфузии или посредством насоса.
[0149] Согласно другому варианту реализации настоящего изобретения предложен способ лечения мышечной дистрофии у нуждающегося в этом субъекта, включающий введение указанному субъекту фармацевтически приемлемой композиции, содержащей терапевтически эффективное количество АКК, стабилизированного по меньшей мере одним стабилизирующим агентом. Согласно некоторым вариантам реализации указанная мышечная дистрофия выбрана из группы, состоящей из мышечной дистрофии Дюшенна, Беккера, тазово-плечевой, врожденной, плече-лопаточно-лицевой, миотонической, окулофарингеальной, дистальной мышечной дистрофии и мышечной дистрофии Эмери-Дрейфуса. Согласно одному конкретному варианту реализации указанная мышечная дистрофия представляет собой мышечную дистрофию Дюшенна (МДД).
Способы улучшения роста клеток:
[0150] В соответствии с некоторыми аспектами настоящего изобретения предложен способ улучшения роста клеток, включающий воздействие на клетки АКК, стабилизированным по меньшей мере одним стабилизатором.
[0151] Термин «рост» в настоящем документе охватывает что-либо из пролиферации, созревания, размножения, регенерации, дифференцировки, развития и любой комбинации перечисленного, и может применяться в различных значениях в соответствии с типом клеток.
[0152] Согласно определению выше в настоящем документе термин «улучшение» относится к облегчению (способствованию), улучшению, преумножению, как правило, увеличению показателей роста, измеряемому относительно контрольного образца, культивируемого на той же среде, но без АКК. Соответственно, согласно одному варианту реализации указанный способ включает улучшение пролиферации, улучшение созревания, улучшение размножения, улучшение регенерации, улучшение созревания и/или улучшение дифференцировки клеток. Согласно одному варианту реализации улучшение роста включает улучшение качества клеток, например, улучшение качества эмбрионов. Согласно другому варианту реализации улучшение роста включает улучшение двух или более из вышеперечисленных показателей, например, улучшение пролиферации и дифференцировки.
[0153] В соответствии с любым из вышеперечисленных вариантов реализации указанные клетки представляют собой эукариотические клетки. Согласно некоторым вариантам реализации указанный эукариотические клетки выбраны из клеток животных, растений и насекомых.
[0154] В соответствии с одним вариантом реализации указанные клетки представляют собой клетки животных. Согласно некоторым вариантам реализации указанные клетки животных представляют собой клетки человека или не являющегося человеком млекопитающего. В соответствии с определенными вариантами реализации указанное не являющееся человеком млекопитающее выбрано из сельскохозяйственных животных, такого как крупный рогатый скот, свиней, овец, коз, лошадей, мулов, ослов, буйволов или верблюдов; домашнего животного, например, кошки или собаки; грызуна, такого как мышь, крыса, морская свинка или хомяк; зайцеобразного, такого как кролик; и приматов, таких как обезьяна (например, макаки), или человекообразной обезьяны (например шимпанзе).
[0155] В соответствии с дополнительными вариантами реализации указанные клетки выбраны из нервных, мышечных, эпителиальных, костных, жировых, стволовых клеток, гамет, клеток крови и эмбрионов.
[0156] В соответствии с одним вариантом реализации настоящего изобретения предложен способ улучшения роста мышечных клеток. В соответствии с другими вариантами реализации улучшение роста мышечных клеток включает улучшение образования мышечных трубочек.
[0157] Термин «образование мышечных трубочек» в настоящем документе относится к процессу, в ходе которого миобласты сливаются в многоядерные волокна, мышечные трубочки.
[0158] Согласно некоторым вариантам реализации указанный способ включает также уменьшение периода времени до начала спонтанной сократительной активности указанных мышечных трубочек. Период времени до начала спонтанной сократительной активности определен как время, необходимое миобластам для слияния и начала спонтанного сокращения.
[0159] Согласно одному варианту реализации миоциты, образовавшиеся из указанных миобластов, выбраны из скелетных миоцитов или сердечных миоцитов. Согласно более конкретному варианту реализации миоциты представляют собой скелетные миоциты.
[0160] Согласно некоторым вариантам реализации указанный способ включает улучшение образования мышечных трубочек и/или появления сократительной способности скелетной мышечной клетки, например, в случае мышечной дистрофии Дюшенна.
[0161] В соответствии с другими вариантами реализации указанный способ включает улучшение роста нервных клеток. Согласно одному варианту реализации улучшение роста нервных клеток включает улучшение и ускорение регенерации нервных клеток. Соответственно, согласно одному варианту реализации указанный способ включает улучшение повторного разрастания аксональных и дендритных нейронных волокон периферической и центральной нервной системы, и/или спраутинга из поврежденных нейронных волокон.
[0162] Согласно некоторым вариантам реализации указанный способ включает улучшение созревания клетки, например, улучшение созревания ооцита in vitro. Согласно некоторым вариантам реализации указанный ооцит выбран из ооцита человека и ооцита не являющегося человеком млекопитающего. Указанное не являющееся человеком млекопитающее выбрано из сельскохозяйственных животных, например, крупного рогатого скота, свиней, овец, коз, лошадей, мулов, ослов, буйволов или верблюдов; домашнего животного, например, кошки или собаки; грызуна, такого как мышь, крыса, морская свинка или хомяк; зайцеобразных, например, кролика; и приматов, таких как обезьяна (например, макаки) или человекообразная обезьяна (например, шимпанзе).
[0163] В соответствии с другими вариантами реализации указанный способ включает улучшение качества эмбрионов, культивируемых in vitro, или улучшение развития эмбриона. Термин «качество эмбрионов» применяют выше в тексте настоящего документа. Согласно одному варианту реализации улучшение качества эмбрионов включает увеличение доли эмбрионов, достигающих стадии, выбранной из группы, состоящей из этапов компактизации, образования бластоцисты и хетчинга бластоцисты. Согласно другому варианту реализации улучшение качества эмбрионов включает ускорение нормального эмбриогенеза, определяемое на основании времени достижения стадии, выбранной из группы, состоящей из стадий компактизации, образования бластоцисты и хетчинга бластоцисты.
[0164] Согласно некоторым вариантам реализации указанный эмбрион выбран из эмбриона человека или эмбриона не являющегося человеком млекопитающего. Указанное не являющееся человеком млекопитающее выбрано из сельскохозяйственных животных, например, крупного рогатого скота, свиней, овец, коз, лошадей, мулов, ослов, буйволов или верблюдов; домашнего животного, например, кошки или собаки; грызуна, такого как мышь, крыса, морская свинка или хомяк; зайцеобразного, такого как кролик; и приматов, таких как обезьяна (например, макака) или человекообразная обезьяна (например, шимпанзе).
[0165] Улучшение пролиферации, созревания, размножения, регенерации, развития и/или дифференцировки клеток, тканей или органов может быть определена как процент улучшения по сравнению с контролем согласно определению выше в настоящем документе. Соответственно, в соответствии с одним вариантом реализации клеточная культуральная среда с добавлением стабилизированного АКК способна улучшать показатели роста приблизительно на 10% приблизительно на 600%, приблизительно 20% - приблизительно на 500%, приблизительно на 30% -приблизительно на 400%, приблизительно на 40% - приблизительно на 300%, приблизительно на 50% - приблизительно на 200, приблизительно на 60% -приблизительно на 150%; или приблизительно на 70% - приблизительно на 100%. Улучшение на 100% означает, что указанный показатель, например, пролиферация, увеличивается в 2 раза; улучшение на 200% означает, что указанный показатель, например, развитие эмбриона, увеличивается в 3 раза, и так далее. Согласно некоторым вариантам реализации происходит улучшение указанных показателей роста приблизительно на 100% - приблизительно на 500%, приблизительно на 120% - приблизительно на 400%, приблизительно на 150% - приблизительно на 300%.
[0166] Согласно некоторым вариантам реализации указанный способ включает улучшение дифференцировки стволовых клеток. В соответствии с одним вариантом реализации указанный способ включает улучшение пролиферации стволовых клеток. В соответствии с дополнительным вариантом реализации указанный способ включает улучшение дифференцировки и пролиферации стволовых клеток. Термин «стволовые клетки» относится к клеткам, которые обладают способностью к пролиферации и дифференцировке в разные типы клеток. Согласно некоторым вариантам реализации указанные стволовые клетки выбраны из эмбриональных, хориальных, амниотических, гематопоэтических, мезенхимальных, нервных, глиальных стволовых клеток, стволовых клеток взрослых и индуцированных плюрипотентных стволовых клеток. В соответствии с одним вариантом реализации указанные стволовые клетки представляют собой эмбриональные стволовые клетки. Согласно другому варианту реализации указанный стволовые клетки представляют собой гематопоэтические стволовые клетки. В соответствии с дополнительным вариантом реализации указанные стволовые клетки представляют собой мезенхимальные стволовые клетки. В соответствии с еще одним вариантом реализации указанные стволовые клетки представляют собой плюрипотентные стволовые клетки стволовые клетки. Согласно некоторым вариантам реализации указанные стволовые клетки представляют собой стволовые клетки человека. Согласно другому варианту реализации указанные стволовые клетки представляют собой стволовые клетки не являющегося человеком млекопитающего. В соответствии с одним вариантом реализации указанный способ включает улучшение дифференцировки стволовых клеток, таких как МВА13, в остеобласты.
[0167] Согласно некоторым вариантам реализации указанная клеточная культуральная среда подходит для роста клеток животных, растений или насекомых. В соответствии с одним вариантом реализации указанная клеточная культуральная среда может представлять собой естественную среду или искусственную среду. Согласно некоторым вариантам реализации указанная естественная среда включает биологическую жидкость, выбранную из плазмы, сыворотки, лимфы, сыворотки пуповинной крови человека и амниотической жидкости. Согласно другому варианту реализации указанная естественная среда включает экстракты тканей, такие как экстракт печени, селезенки, опухолей, лейкоцитов и костного мозга, экстракт бычьего эмбриона и эмбрионов курицы. В соответствии с дополнительным вариантом реализации указанная естественная среда включает коагулянты или сгустки плазмы. Согласно некоторым вариантам реализации указанная среда представляет собой искусственную среду с добавками. В соответствии с одним вариантом реализации указанная искусственная среда представляет собой сбалансированный раствор солей. Примерами сбалансированного раствора солей являются ФСБ, фосфатно-солевой буфер Дульбекко (DPBS), сбалансированный солевой раствор Хенкса (HBSS), сбалансированный солевой раствор Эрла (EBSS), раствор Тироде Т6, среда Виттена (WM1), среда Пула Р1, среда Квина HTF и среда Гарднера G1. Согласно другому варианту реализации указанная искусственная среда представляет собой базальную среду. Согласно некоторым вариантам реализации указанная среда может также содержать добавки, как хорошо известно в данной области техники. В соответствии с одним вариантом реализации в указанную среду добавляют сыворотку, например, фетальную бычью сыворотку. В соответствии с дополнительным вариантом реализации указанная искусственная среда представляет собой сложную среду.
[0168] Термин «базальная среда» в настоящем документе относится к питательной смеси неорганических солей, Сахаров, аминокислот, необязательно также содержащей витамины, органические кислоты и/или буферы. Базальные среды совместно с добавками обеспечивают питательные вещества, необходимые для поддержания жизни, роста и регенерации клеток. Выбранная для применения базальная среда должна подходить для культуры.
[0169] В соответствии с одним вариантом реализации указанная искусственная среда представляет собой не содержащую сыворотки среду. В соответствии с дополнительным вариантом реализации указанная искусственная среда представляет собой клеточную культуральную среду с пониженным содержанием сыворотки. Согласно другому варианту реализации указанная искусственная среда представляет собой не содержащую белка среду.
[0170] Примерами клеточных сред, в которые может быть добавлен стабилизированный АКК и использован в соответствии с настоящим изобретением, являются модифицированная по способу Дульбекко среда Игла (DMEM), минимальная эссенциальная среда Игла (ЕМЕМ), среда RPMI 1640 (разработанная в Мемориальном институте Розуэлл-Парк (Roswell Park Memorial Institute)) и базальная среда Игла (ВМЕ). Дополнительными примерами сред, подходящих для применения в соответствии с настоящим изобретением, являются питательные смеси Хэма, такие как среда Хэма F-10, среда Хэма F-12, DMEM/F-12 (DMEM и среда Хэма F-12). Другими примерами являются среда Дульбекко, модифицированная по способу Исков (IMDM), Opti-MEM и среда MEM в модификации Глазго (GMEM). Примерами сред, подходящих для роста клеток насекомых, являются среда для клеток насекомых IPL-41, среда Шнайдера для клеток дрозофилы, среда для клеток насекомых Грейса, не содержащая сыворотки среда для клеток насекомых, Sf-900, ТС-10, среда для клеток насекомых Шейлдса и Санга М3, среда ТС-100 для клеток насекомых, среда TNM-FH для клеток насекомых; и IPL-10. Примерами сред, подходящих для роста эмбрионов, являются среды для монокультур, такие как SAGE 1-Step™, или среды для последовательного культивирования, такие как Quinns Advantage™ Sequential Media (ORIGIO). Примерами сред, подходящих для роста клеток растений, являются среды Мурасиге-Скуга (MS), В5, N6 и среда Нича.
[0171] Другими примерами сред являются модифицированная среда, среда NCTC, среда MegaCell, среда Клейкомба, среда Клика, среда L-15, среда 199, среда MCDB, среда Эймса, среда BGJb (модификация Фиттона-Джексона), среда Клика, среда CMRL-1066, модифицированная среда Маккоя 5А, среда NCTC, среда Свима S-77, среда Веймаута, среда Ε Уильяма и среды для оплодотворения in vitro, такие как Global®, GM501, SSM™, среда для дробления K-SICM, среда для бластоцист K-SIBM, среда для дробления Quinns Advantage®, среда для бластоцист Quinns Advantage®, среда для ЭКО FERTICULT™, среда FERTICULT™ G3, IVC-TWO™, IVC-THREE™, ЕСМ®, MultiBlast®, EmbryoAssist™, BlastAssist™, ISM1, ISM2, G-1™PLUS, G-2™PLUS, IVF™ и CCM™. Дополнительными примерами сред являются среды для разделения спермы, такие как ISolate®, PureCeption™, универсальная среда Multipurpose Handling Medium® (MHM®), среды для промывания спермы, такие как среда для промывания спермы Quinns™, Multipurpose Handling Medium® (MHM®) или модифицированная среда HTF с гентамицином, и среда для созревания, которая обеспечивает получение из культуры незрелых ооцитов полностью развившихся эмбрионов, подходящие для переноса.
[0172] Соответственно, в соответствии с одним вариантом реализации указанная клеточная культуральная среда выбрана из DMEM, RPMI 1640, MEM, IMDM, среды L-15 (среды Лейбовица), среды MCDB, среды 199, Opti-MEM и DMEM/F-12, среды Шнайдера для клеток дрозофилы, среды для клеток насекомых Грейса, IPL-41, среды для клеток насекомых Sf-900, не содержащей сыворотки среды для клеток насекомых, среды для клеток насекомых Шейлдса и Санга МЗ, среды для клеток насекомых ТС-100, среды для клеток насекомых TNM-FH, среды Хэма F-12, среды Хэма F-10, GMEM, среды Эймса, базальной среды Игла (ВМЕ), среды Клейкомба, среды Клика, минимальной эссенциальной среды в модификации Глазго (GMEM), среды MegaCell, модифицированной среды Маккоя 5А, среды NCTC, среды Ε Уильяма, среды Веймаута, среды ТС-10 и IPL-10. Согласно другому варианту реализации указанная клеточная культуральная среда выбрана из DMEM, RPMI 1640, MEM, IMDM, Opti-MEM, GMEM, среды Хэма F-12 и DMEM/F-12, среды Шнайдера для клеток дрозофилы, среды для клеток насекомых Грейса, Sf-900, ТС-10, среды IPL-10 и среды для разделения, промывания или созревания спермы, например, выбранной из ISolate®, PureCeption™, Multipurpose Handling Medium® (MHM®), среды для промывания спермы Quinns™, Multipurpose Handling Medium® (MHM®) и модифицированной среды HTF с гентамицином.
[0173] Согласно любому из вышеописанных вариантов реализации термин «содержащий» или «включающий» включает значение «состоящий из» и может быть на него заменен.
[0174] В настоящем документе термин «приблизительно» в отношении измеряемого значения, такого как количество, продолжительность периода времени и т.п., охватывает вариации, отклоняющиеся от указанного значения на +/-10%, или +/-5%, +/-1%, или даже на +/-0,1%.
[0175] После ознакомления с представленным выше общим описанием настоящего изобретения, его лучшее понимание может быть достигнуто после обращения к представленным ниже примерам, приведенным для иллюстрации и не предназначенным для ограничения настоящего изобретения.
ПРИМЕРЫ
Пример 1. Эффекты АКК на совместные культуры СМ-ДКГ
[0176] Способы
[0177] Культуральная среда
[0178] Культуральная среда состояла из: 90% модифицированной по Дульбекко среды Игла / питательной смеси F-12 (DMEM-F12), истощенной по кальцию (среда без ионов кальция, (специальный состав), 10% термоинактивированной фетальной бычьей сыворотки (ФБС), 6 г/л D-глюкозы, 2 мМ глутамина, 25 мкг/мл гентамицина и 0,05 нг/мл инсулиноподобного фактора роста 1 (ИФР-I) (все приобретены у Biological Industries, Израиль).
[0179] NVR-Gel в качестве субстрата для культивирования нейронов
[0180] Гель для реконструкции нервной и сосудистой ткани (NVR-Gel, разработка NVR Labs) состоит из двух основных компонентов: высокомолекулярная гиалуроновая кислота (ГК, 3×106 Да, BTG, Израиль) и ламинин (Sigma). Для культивирования нервных клеток 1% NVR-Gel разводили культуральной средой до конечной концентрации, составляющей 0,3-0,5%. Указанный гель имеет текстуру вязкой жидкости, обеспечивает легкую и успешную адгезию внедренных клеток или эксплантатов к пластиковой или стеклянной подложке, и трехмерное разрастание нервного волокна.
[0181] Получение культур нервной ткани
[0182] Все эксперименты были проведены и одобрены локальным этическим комитетом, признанным израильскими властями, для контроля экспериментов на животных. Стационарные органотипические культуры дорсальных корешковых ганглиев (ДКГ) и спинного мозга (СМ), а также культуры диссоциированных клеток головного мозга получали из плодов крысы (15 дней гестации, инбредные крысы линии Льюис, Harlan, Израиль). Непосредственно после препарирования получали небольшие фрагменты выделенных тканей на устройстве для получения срезов тканей Мак-Илвейна (толщиной 400 мкм). В указанных исследованиях использовали две стратегии культивирования тканей. Согласно первому способу срезы тканей помещали непосредственно в 12-луночные культуральные планшеты, содержащие 1 мл культуральной среды, содержащей 0,3-0,5% геля NVR-Gel. Согласно второму способу срезы тканей дополнительно обрабатывали для диссоциации раствором трипсина-ЭДТК в течение 30 минут, и промывали культуральной средой. Затем диссоциированные клетки добавляли в суспензию порошка хитозана или порошка гастролита (микроносители, ХМ) и инкубировали в суспензии при 37°С в течение 4 дней. Затем образовавшиеся агрегаты флотирующих клеток с ХМ собирали и помещали в 12-луночные культуральные планшеты, содержащие 1 мл культуральной среды, содержащей 0,3-0,5% геля NVR-Gel.
[0183] Источник дополнительного Са2+
[0184] Источники Са2+ (перечисленные ниже) в конечной концентрации, составляющей 1 или 2 мМ, однократно добавляли в гель на стадии посева, а затем добавляли в питательную среду при каждой следующей подкормке. Использовали следующие источники кальция: АКК этидроновая кислота (АКК-ЭТ) (свежая суспензия); АКК-фосфосерин (АКК-ФС) (свежая суспензия); гастролит (растворенный в ОД Μ НС1, а затем нейтрализованный 1М NaOH); порошок гастролита; ККК водная суспензия кристаллического карбоната кальция (коммерческий порошок наночастиц); и раствор CaCl2 контроль.
[0185] Мониторинг культур осуществляли с применением фазово-контрастной микроскопии ежедневно, с момента через 24 часа после начала культивирования и далее.
[0186] Суспензии свежих составов с АКК состояли из частиц, образующих стабильную суспензию. Гастролит представляет собой естественный АКК, выделяемый из крабов, и может быть приобретен только в виде сухого порошка. В указанной форме другие его характерные компоненты (такие как ионы кальция и белки) недоступны для клеток. Для увеличения их биодоступности порошок гастролита растворяли в 0,1 Μ HCl (имитирующей кислотность, существующую в желудке), а затем нейтрализовали 1М NaOH.
[0187] Иммунофлуоресцентное окрашивание культур нейронов
[0188] После удаления культуральной среды культуры дорсальных корешковых ганглиев (ДКГ) промывали забуференным фосфатом солевым раствором (ФСБ) и фиксировали в 4% параформальдегиде в течение 15 минут, после чего повторно промывали ФСБ. Фиксированные клетки пермеабилизировали с применением 0,1% Triton Х-100 в ФСБ, а затем иммуноблокировали (чтобы избежать неспецифического окрашивания) 1% бычьем сывороточном альбумине (БСА) в ФСБ в течение 1 часа при комнатной температуре. Затем образцы инкубировали с антителами кролика против нейрофиламентов (NF, Novus Biologicals, 1:500) для визуализации разрастания нейритов. Первичные антитела разводили в 0,1% БСА и 0,05% Tween-20 в ФСБ (буфер для разведения) и инкубировали с образцами в течение ночи при 4°С. После промывания 0,05% Tween-20 в ФСБ (промывочный буфер) образцы ДКГ инкубировали в течение 1 часа при комнатной температуре с конъюгированными с Alexa-Fluor-594 вторичными антителами осла против IgG кролика (Jackson ImmunoResearch, США, 1:800 в буфере для разведения). Наконец, указанные образцы повторно промывали промывочным буфером, и заливали заливочной средой (Immco Diagnostic, США). Все изображения наблюдали с применением микроскопа Olympus 1X70.
[0189] Результаты
[0190] Изучали эффект различных составов с кальцием на совместные культуры СМ-ДКГ. В целом, указанные культуры содержали срезы СМ толщиной 400 мкм с прикрепленными или отделенными срезами ДКГ. Можно сказать, что все изученные составы с АКК (АКК-ЭТ, АКК ФС и гастролит) значимо улучшали регенерацию нейронных волокон по сравнению с ККК и CaCl2. В таблице 1 представлена часть эксплантатов (из 6), которые демонстрировали спраутинг нервных волокон через 4 дня культивирования в присутствии различных составов с кальцием (концентрация Са2+ = 2 мМ) или в присутствии стабилизаторов по отдельности (стабилизатор (приготовленный из 5% стокового раствора) добавляли в концентрации 0,05% в каждую лунку). Видно, что наиболее интенсивный спраутинг наблюдался в культурах, на которые воздействовали АКК-ЭТ (100% эксплантатов), за ними следовали культуры, обработанные АКК-ФС и гастролитом (66,6% эксплантатов). ККК и СаСЬ индуцировали спраутинг нейронов только у 50% эксплантатов, а стабилизаторы по отдельности - даже у меньшего процента (0-33%) Во время стабилизации культур (после первой недели культивирования) регенерировавшие нервные волокна удлинялись, утолщались и разветвлялись, с образованием нейронных сетей, в основном в культурах, на которые воздействовали различными составами с АКК (фиг. 1)


Пример 2. Эффекты АКК на культуры головного мозга
[0191] Исследовали эффект АКК на культуры агрегатов клеток головного мозга и ХМ, высаженных в гель через 4 дня в суспензии (см. часть примера 1, посвященную способам). Результаты представлены на фиг. 2 и показывают, что АКК улучшал регенерацию нервных волокон в значимо большей степени, чем хлорид кальция. Это заметно, в частности, при сравнении числа и длины нервных волокон при применении двух вариантов обработки.
Пример 3 - Эффекты составов АКК на здоровые клетки скелетных мышц
[0192] Способы
[0193] Получение культур скелетных мышц
[0194] Стационарные культуры скелетных мышц получали от здоровых новорожденных крыс возрастом 1 день (Спрег-Доули, Harlan, Израиль). Мышечную ткань вырезали из задних конечностей и тщательно измельчали. Проводили расщепление трипсином-ЭДТК, аккуратно перетирая. Через 30 минут собирали супернатант, содержащий диссоциированные клетки, и добавляли свежую смесь трипсин-ЭДТК. Указанную процедуру повторяли два или более раз. Затем все супернатанты объединяли, центрифугировали и ресуспендировали клеточный осадок в среде для пролиферации. Клетки высевали в покрытые желатином 12-луночные культуральные планшеты в количестве 1×105 клеток/лунку, каждая из которых содержала 1 мл среды для пролиферации. Через два дня среду заменяли на среду для слияния, которую затем заменяли два раза в неделю. Мониторинг культур осуществляли с применением фазово-контрастной микроскопии ежедневно, с момента через 24 часа после начала культивирования и далее. В заранее заданные дни культуры фиксировали в метаноле в течение 20 минут и затем окрашивали по Гимза для оценки числа мышечных трубочек, образовавшихся со временем в культурах.
[0195] Культуральные планшеты, покрытые желатином
[0196] Стоковый 1% раствор свиного желатина в воде стерилизовали автоклавированием. После охлаждения 500 мкл указанного раствора добавляли в каждую лунку 12-луночного культурального планшета. После инкубации в течение 20 минут при комнатной температуре удаляли избыток раствора и высевали клетки.
[0197] Среда для пролиферации
[0198] Для стадии пролиферации клетки культивировали в DMEM/F12 (содержащей 1 мМ Са2+) с 10% ФБС, 25 мкг/мл гентамицина и 2 мМ L-глутамином.
[0199] Среда для слияния
[0200] Для стадии слияния среду для пролиферации заменяли на среду для слияния, которую получали следующим образом: DMEM/F12 (содержащую 1 мМ Са2+), 2% сыворотки лошади (ЛС), 2 мМ L-глутамин, 25 мкл/мл гентамицина и 4 единицы/100 мл инсулина (все приобретены у Biological Industries, Израиль).
[0201] Перечень протестированных составов с кальцием
[0202] Среду для слияния обогащали различными составами с кальцием, перечисленными в таблице 2, при концентрации Са2+, составляющей 1 мМ (поскольку указанная среда уже содержала 1 мМ ионов кальция, конечная концентрация Са2+ составляла 2 мМ). Контрольные культуры культивировали без дополнительного добавления кальция, или использовали культуры, обогащенные свободным (растворимым) стабилизатором. Эксперимент маскировали путем маркировки различных составов с кальцием исключительно произвольными номерами.
[0203] Указанные компоненты добавляли одним из следующих способов: (i) использовали водные суспензии сухого материала; (ii) использовали водную суспензию свежего материала (до высушивания); или (iii) растворяли в НС1 (для имитации кислотности, существующей в желудке. После завершения растворения полученные растворы нейтрализовали 1М NaOH).

[0204] Результаты
[0205] Эффект сухого АКК на здоровые скелетные мышцы
[0206] На первой стадии использовали сухой порошок АКК. Указанный порошок (представленный в таблице 2 со стабилизаторами, используемыми при приготовлении) суспендировали в воде, а затем добавляли в культуральные среды в концентрации 1 мМ. Поскольку указанная среда уже содержала 1 мМ ионов кальция, конечная концентрация Са2+ составляла 2 мМ. Результаты, некоторые из которых показаны на фиг. 3 (слева), показали, что в культурах, на которые воздействовали АКК, наблюдалось ранее образование множества мышечных трубочек уже первые 4 дня культивирования, без значимых различий при применении разных составов АКК. В контрольных культурах, на которые воздействовали добавленным ККК или CaCl2, образование мышечных трубочек наблюдалось позже. Через 7 дней в культурах, обработанных АКК, наблюдались многочисленные длинные утолщенные мышечные волокна, тогда как в культурах, обработанных ККК и CaCl2, развивалось меньшее число более тонких и коротких мышечных волокон (фиг. 3; справа).
[0207] Также отмечено, что в культурах, на которые воздействовали составами с АКК, сокращения мышц наблюдались уже на 7 день после высевания, тогда как в культурах, на которые воздействовали добавленным ККК или CaCl2, сокращения мышц возникали только через 10 дней или позже.
[0208] Из описанных выше полученных in vitro результатов было сделано заключение, что все составы с АКК улучшают образование мышечных трубочек и раннюю мышечную сократительную способность в культурах здоровых поперечнополосатых мышц.
Пример 4 - Оценка эффекта АКК на мышечные клетки линии с мышечной дистрофией Дюшенна - исследования in vitro
[0209] Способы
[0210] Получение клеток Mdx
[0211] Влияние разных составов с кальцием исследовали на клетках линии mdx (модель мышечной дистрофии Дюшенна), любезно предоставленных (почетным) профессором Научного института имени Вейцмана (Израиль) Давидом Яффе (David Yaffe).
[0212] Клетки линии Mdx высевали в покрытый желатином 12-луночный культуральный планшет в количестве 3×104 клеток/лунку, каждая из которых содержала 1 мл среды для пролиферации. Через два дня (~ 66% конфлюэнтности) указанную среду заменяли на среду для слияния, которую заменяли два раза в неделю. Различные составы с кальцием по отдельности добавляли в указанную среду для слияния в соответствии с описанной в таблице 3 обработкой. Культуры обогащали различными составами с кальцием, при концентрации Са2+ 1 мМ. Поскольку указанная среда уже содержала 1 мМ ионов кальция, конечная концентрация Са2+ составляла 2 мМ.

[0213] Мониторинг эффектов протестированных составов с кальцием на пролиферацию клеток, слияние с образованием мышечных трубочек и мышечные сокращения осуществляли ежедневно с применением фазово-контрастной микроскопии. В заранее заданные дни культуры фиксировали в метаноле в течение 20 минут и затем окрашивали по Гимза для оценки числа мышечных трубочек, образующихся со временем в культурах.
[0214] Анализ на креатинкиназу (КК) в культуре мышечных клеток
[0215] В культурах мышечных клеток КК представляет собой индикатор образования мышечных трубочек, и увеличение уровня КК (в клеточных культуральных планшетах) прямо коррелирует с прогрессирующим образованием мышечных трубочек в культурах мышц. В заранее заданные дни клетки собирали из лунок с культурой (с применением резинового скребка) и держали в 1 мл ФСБ (без Са2+) при -70°С до анализа. Для измерения КК образцы клеток размораживали и физически лизировали с применением ультразвукового аппарата для высвобождения КК из мышечных трубочек в мышцах. Концентрацию КК определяли с применением набора для анализа активности креатинкиназы (набор с реагентом для определения креатинкиназы с N-ацетилцистеином (CK-NAC Reagent Set), Curtiss, Chem-Index Inc, Хайалиа, Флорида, США).
[0216] Результаты
[0217] Результаты описанных выше экспериментов представлена на фиг. 4 и 5. Как ясно видно, добавление АКК улучшал слияние клеток и образование мышечных трубочек лучше, чем добавление стандартного источника ионов кальция (CaCl2). Указанный неожиданный результат был продемонстрирован как в биохимическом (активность КК), так и в морфологическом (микроскопическом) анализе (фиг. 4 и 5). Кроме того, в культурах, на которые воздействовали составами с АКК, сокращения мышц наблюдались уже на 7 день после высевания, тогда как в контроле они появлялись только через 10 дней или позже. Соответственно, было сделано заключение, что добавление АКК потенциально подходит для лечения пациентов с МДД.
Пример 5 - Эффект источников Кальция на первичные клетки мышей mdx
[0218] Способ
[0219] Экстракция первичных клеток
[0220] Бедренные мышцы извлекали из задних конечностей новорожденных (возрастом 1 день) мышей mdx в стерильных условиях, и промывали в ФСБ для удаления избытка клеток крови. Мышцы измельчали с получением фрагментов небольшого размера. Для ферментативного расщепления фрагменты мышц помещали в мензурку, содержащую раствор трипсина-ЭДТК (0,25 мМ). Для обеспечения разделения клеток указанную смесь помещали на мешалку, работающую при комнатной температуре, и аккуратно перемешивали в течение 20 минут. Бульон собирали и центрифугировали при 300×g в течение 5 минут. Осадокресуспендировали в DMEM, содержащем ФБС.Этапы трипсинизации повторяли в течение 3 или более циклов. Все супернатанты объединяли в одной пробирке. Разделение клеток определяли визуально (с применением фазово-контрастной микроскопии). Плотность клеток определяли с применением гемоцитометра.
[0221] Клетки высевали в 12-луночный планшет в концентрации 2×105 клеток/лунку. Использовали среду DMEM/F12 без Са2+ с добавлением 15% ФБС, 2 мМ L-глутамином и гентамицином (25 мкг/мл). Кальций добавляли в среду отдельно в соответствии с описанной в таблице 4 обработкой. На 2 день (~ 66% конфлюэнтности) среду заменяли на среду для слияния (DMEM/F12 без Са2+ с добавлением 10% ЛС, инсулина (4 единиц/100 мл) и гентамицина (25 мкг/мл)). Среду заменяли каждые 3 дня.

[0222] Качественный мониторинг пролиферации и слияния клеток проводили ежедневно. Культуры фиксировали на 2, 3, 4, 5 и 7 дни и окрашивали по Гимза, или с применением антитела к миозину.
[0223] Результаты
[0224] Результаты представлены на фиг.6 и 7. Благоприятный эффект составов с АКК был продемонстрирован образованием мышечных трубочек, в частности, в ранние моменты времени, на 3 и 4 дни, по сравнению с контролем. Различия в образовании мышечных трубочек становились неразличимыми на 5 и 7 дни. Наблюдалась выраженная корреляция между окрашиванием по Гимза и окрашиванием на миозин.
Пример 6 - Оценка эффекта АКК на мышечную дистрофию у мышей -исследования in vivo
[0225] Экспериментальным мышам вводили перорально (с пищей или питьем) контрольные или тестируемые средства. Указанные контрольные или тестируемые средства повторно вводили ежедневно до окончания исследования (через 12 недель).

[0226] Тестовая система:
[0227] Вид: мышь
[0228] Линия Mdx: C57/BI 10ScSn/DMD mdx/J
[0229] Линия дикого типа: C57BL/6JOIaHsd.
[0230] Пол и возраст: самцы возрастом 3 недели в начале исследования
[0231] Масса тела: Разброс массы тела животных в начале исследования не должен превышать ±5% от среднего значения массы тела для данного пола.
[0232] Содержание: Животных до начала исследования содержали в полиэтиленовых клетках размером 42,5 × 26,5 × 18,5 см, с верхней решеткой из нержавеющей стали, облегчающей доставку гранулированного корма, питьевой водой в пластиковом флаконе, с насыпанными опилками (Harlan Teklad Aspen/ Sani-Chips Bedding) в качестве материала подстилки. Материал подстилки заменяли вместе с клеткой по меньшей мере один раз в неделю.
[0233] Идентификация: Ушная бирка и маркировка на клетках.
[0234] Окончание: В конце исследования животных умерщвляли путем асфиксии с применением СО2.
[0235] Обоснование: Мыши MDX представляют собой распространенную модель на животных для оценки мышечной дистрофии Дюшенна (МДД).
[0236] Определение начала исследования
[0237] Первое введение контрольных или тестируемых средств определяли как «День 1».
[0238] Определение конца исследования
[0239] Исследование заканчивали через 12 недель после начала.
[0240] Гуманная конечная точка
[0241] Животных, находившихся в состоянии агонии, и животных, демонстрировавших сильную боль или устойчивые признаки сильного дистресса, умерщвляли из гуманных соображений. Животных, у которых наблюдалось снижение массы тела более чем на 20% от исходной массы тела, регистрировали.
[0242] Введение тестируемых средств
[0243] Животным вводили АКК с пищей или питьем. Животным вводили ККК с пищей. Контроль вводили при кормлении. Контрольные или тестируемые средства повторно вводили ежедневно до окончания исследования.
[0244] Тесты и оценки
[0245] Наблюдения за заболеваемостью и смертностью
[0246] Наблюдения за признаками заболеваемости и смертности проводили ежедневно и при окончании исследования.
[0247] Измерения массы тела
[0248] Измерения массы тела регистрировали один раз в неделю и при окончании исследования, через 12 недель.
[0249] Взятие крови и подготовка плазмы для определения уровней креатининкиназы (КК):
[0250] При окончании исследования брали образец крови у всех животных под легкой анестезией кетамином/ксилазином, непосредственно из ретро-орбитального синуса.
[0251] 200 мкл крови собирали в пробирку с желтой крышкой, содержащей гелевый активатор свертывания. Пробирки выдерживали при комнатной температуре в течение по меньшей мере 30 минут для свертывания и центрифугировали при комнатной температуре в течение 10 минут при 4000 об/мин. Образцы сыворотки хранят при 2-4°С до доставки для анализа на КК в лабораториях A.M.L.
[0252] Креатининкиназа - результаты
[0253] Результат теста на креатининкиназу представлен на фиг. 8 и демонстрирует отчетливый тренд. У всех мышей mdx наблюдались повышенные значения КК относительно дикого типа, что указывает на разрушение мышц. Однако указанное повышение было значимо более умеренным в группе, получавшей АКК с пищей (группа 4М), по сравнению с группой, получавшей только обычный корм (группа 2М; t-тест Стьюдента, Р-значение = 0,034). Хотя у мышей в группе 3М, получавших ККК, также наблюдалось более умеренное повышение уровней КК по сравнению с мышами из группы 2М (без лечения), указанное различие не было статистически значимым (t-тест Стьюдента, Р-значение = 0,45).
[0254] Группа 5М, получавшая АКК с питьем, демонстрировала результаты, аналогичные результатам для группы 3М, получавшей ККК с пищей (21,164±8,391 и 21,676±14,508 МЕ/мл, соответственно). Без связи с какой-либо теорией или механизмом действия предполагается, что причиной различия результатов между группами 4М (АКК с пищей) и 5М (АКК с питьем) может быть гетерогенность суспензии АКК и, соответственно, неравномерность введения АКК. Тем не менее, ясно, что введение АКК значимо смягчало симптомы МДД у мышей MDX.
Пример 7 - Оценка эффекта потребления АКК на дистрофию мышц у мышей MDX.
[0255] В настоящем примере тестировали эффект АКК, стабилизированного разными стабилизаторами, на мышах mdx (в модели мышечной дистрофии Дюшенна на грызунах).
[0256] Тестируемые объекты
[0257] Мышам вводили стабилизированный АКК перорально (с кормом) ежедневно или путем В/Б инъекций, последовательно, шесть раз в неделю. Контрольные или тестируемые средства вводили аналогичным образом.
[0258] Тестовая система:
[0259] Вид: мышь
[0260] Линия Mdx: C57/BI 10ScSn/DMD mdx/J
[0261] Линия дикого типа: C57BL/6JOIaHsd.
[0262] Пол и возраст: самцы возрастом 3-5 недель в начале исследования
[0263] Масса тела: Разброс массы тела животных в начале исследования не должен превышать ±15%% от среднего значения массы тела для данного пола.
[0264] Размер групп: см. таблицу 1, дизайн исследования
[0265] Число групп: 6 (см. таблицу 6)


[0266] Экспериментальная процедура:
[0267] Мышь MDX представляет собой модель для оценки мышечной дистрофии Дюшенна (МДД) на животных.
[0268] Определение конца исследования: Исследование заканчивают через 24 недели после начала для групп 1-4 и через 12 недель после начала для групп 5-6.
[0269] Введение тестируемых средств
[0270] Всем животным (за исключением контроля) вводили стабилизированный АКК либо с пищей (ежедневно), либо путем В/Б инъекций (последовательно шесть раз в неделю).
[0271] Тесты и оценки
[0272] Наблюдение за клиническими признаками
[0273] Наблюдения за животными для отслеживания клинических признаков осуществляли один раз в неделю до окончания исследования.
[0274] Осуществляли наблюдения за любыми изменениями со стороны кожи, шерсти, глаз, слизистых оболочек, дыхательной системы, наличием секретов и экскретов (например, диареи). Также отслеживали изменения походки, положения тела и ответ на хендлирование, а также возникновение измененного поведения, дрожи, конвульсий, сна и комы.
[0275] Регистрировали все наблюдаемые аномалии, признаки токсичности, агонии и смерти до окончания исследования.
[0276] Животных, умерщвленных из соображений гуманности во время тестирования, при интерпретации результатов тестирования считали умершими во время тестирования.
[0277] Измерения массы тела
[0278] Измерения массы тела проводили один раз в неделю, вскоре после проведения теста на удержание при помощи четырех конечностей. Также массу тела измеряли в начале и при окончании исследования.
[0279] Функциональный тест Тест на удержание при помощи четырех конечностей (Тест на захват)
[0280] Тест на удержание при помощи четырех конечностей использовали для отслеживания силы мышц и для определения нервно-мышечного нарушения и двигательной координации. Указанный тест использовали для определения эффективности АКК.
[0281] В тесте на удержание при помощи четырех конечностей применяют систему с проволочной сеткой для измерения способности мышей демонстрировать продолжительное напряжение конечностей, противостоящее силе гравитации. Измеряют время висения в секундах, а также минимальный удерживающий импульс (Удерживающий импульс = Масса тела × Время висения, [Ν сек], коэффициент преобразования - 9,806 × 103 Н/г).
[0282] Тест на захват (тест на удержание при помощи четырех конечностей) выполняли в соответствии с протоколом TREAT-NMD SOP# DMD_M.2.1.005. Вкратце:
[0283] Мышь (минимальный возраст - 4 недели) помещали на сетку сверху (размер ячеек сетки - приблизительно 1×1 см2) и позволяли адаптироваться в указанной окружающей среде в течение 3-5 секунд.
[0284] Сетку переворачивали таким образом, чтобы мышь оказалась внизу. Сетку располагали на высоте по меньшей мере 35 см от пола клетки. Для обеспечения мягкого приземления под сетку помещали достаточное количество мягкой подстилки (5-7 см). Мыши возрастом 4-24 недели естественным образом пытаются остаться на сетке и избежать падения на пол. Указанная высота недостаточна для того, чтобы животное получило повреждения, и достаточна для того, чтобы стимулировать избегание падения.
[0285] Каждый период подвешивания должен начинаться с захвата сетки мышью всеми 4 конечностями. Время висения измеряли с помощью секундомера и регистрировали.
[0286] Максимальная продолжительность теста составляла до 600 секунд, или его повторяли 3 раза с перерывом продолжительностью по меньшей мере 2 минуты.
[0287] Максимальное время висения использовали для оценки удерживающего импульса.
[0288] Тест на удержание при помощи четырех конечностей выполняли каждую неделю на протяжении всего эксперимента.
[0289] Взятие крови и подготовка плазмы для определения уровней креатининкиназы (КК):
[0290] При окончании исследования у всех животных берут образцы крови под легкой анестезией (кетамин/ксилазин) непосредственно из ретро-орбитального синуса.
[0291] 200 мкл крови собирают в пробирку с желтой крышкой, содержащей гелевый активатор свертывания. Пробирки выдерживали при комнатной температуре в течение по меньшей мере 30 минут для свертывания и центрифугировали при комнатной температуре в течение 10 минут при 4000 об/мин. Образцы сыворотки хранят при 2-4°С до доставки для анализа на КК в лабораториях A.M.L.
[0292] Окончание исследования и некропсия
[0293] После терминального забора крови животных умерщвляют путем асфиксии диоксидом углерода и осуществляют исследование основных тканей и систем органов для выявления макропатологий.
[0294] Сбор скелетных мышц
[0295] Во время некропсии собирают выбранные мышцы (диафрагму, сердечную и икроножную мышцы) у всех животных. Мышцы всех животных консервируют в 10% нейтральном забуференном формалине (приблизительно 4% раствор формальдегида) в течение по меньшей мере 24 часов для последующего гистопатологического анализа.
[0296] Результаты
[0297] Масса тела мышей во всех группах увеличивалась. Не было обнаружено значимых различий средней массы тела в какой-либо из групп.
[0298] Функциональный тест - Тест на удержание при помощи четырех конечностей - промежуточные результаты
[0299] Было обнаружено значимое различие удерживающих импульсов (УИ) в обеих группах mdx, которым перорально вводили составы с АКК (стабилизатор 1 фосфосерин, стабилизатор 2 трифосфат) от УИ в контрольной группе, которая получала стандартный корм (содержащий кальций), см. фиг. 9. Указанное различие наблюдалось уже на вторую неделю исследования, когда УИ получавших лечение АКК мышей 2-кратно превышал УИ в контрольной группе. Указанные различия увеличивались в ходе исследования и достигали стадии плато приблизительно через 6-8 недель. На фиг. 9 видно, что УИ получавших лечение АКК мышей приблизительно в 2-3,8 раз превышал УИ в контрольной группе.
Пример 8. Улучшение эмбрионального развития в среде с добавлением АКК
[0300] Материалы и способы
[0301] Самцов мышей СВ А скрещивали с самками мышей BL С57. Мышей содержали в условиях 12-часового фотопериодического цикла с неограниченным доступом к воде и пищей. Приблизительно через 6-8 недель после получения потомства каждой самке мыши инъецировали в/б 5МЕ гонадотропина сыворотки жеребой кобылы (ГСЖК).
[0302] Через 48 часов каждой самке мыши инъецировали В/Б 5МЕ хорионического гонадотропина человека (ХГЧ). Затем проверенных на фертильность самцов размещали совместно с суперовулирующими самками. На следующее утро самок мышей исследовали на предмет наличия копулятивных пробок. Самок с копулятивными пробками умерщвляли через 24 часа (приблизительно через 36 часов после совокупления) и извлекали из маточных труб эмбрионы на стадии 2 клеток следующим образом: маточные трубы препарировали в среде для дробления Quinn's Advantage (SAGE, Origio, Дания) и эмбрионы переносили в каплях объемом 20 мкл со средой для дробления Quinn's Advantage (SAGE, Origio, Дания), покрытой минеральным маслом, и культивировали при 37,0°С с 5% СО2 и атмосферным кислородом. Собранные эмбрионы продолжали расти, т.о., в культуре in vitro (IVC), до стадии бластоцисты/хетчинга. Для тестирования эффекта аморфного карбоната кальция в среду для дробления Quinn's Advantage («среда для дробления» здесь и далее в настоящем документе) добавляли разные добавки, т.е. аморфный карбонат кальция, стабилизированный полифосфатом (АКК ПФ), кристаллическим карбонатом кальция (ККК), полифосфатом (ПФ), фосфосерином (ФС) или карбонатом натрия (NaCO3). Все добавки добавляли в виде свежеприготовленной суспензии; добавки с АКК получали в асептических условиях. Необработанную среду для дробления (без добавления какой-либо добавки) применяли в качестве контрольной (идентифицирована как Конт-Q). Эмбрионы оценивали ежедневно, проводя микроскопические наблюдения для детекции следующих этапов: 2 клетки, стадия компактизации, образование бластоцист и стадия хетчинга. Рассчитывали долю (в процентах) эмбрионов, достигающих каждой стадии (число эмбрионов на стадии 2 клеток принимали за 100%).
[0303] Результаты
[0304] Развитие эмбрионов на среде для дробления с добавлением 1,7 мМ аморфного карбоната кальция, стабилизированного ПФ (АКК-ПФ), сравнивали с контролем (Конт-Q - развитие в необработанной среде). Число эмбрионов на каждой стадии развития и соответствующая им доля от первоначального числа эмбрионов (последнее значение приведено в круглых скобках) представлены в таблице 7.

Пример 9.
[0305] Развитие эмбриона в среде для дробления с добавлением 1,7 мМ либо АКК-ПФ, либо хлорида кальция (CaCl2) тестировали в двух отдельных тестах (А и В). В тесте А эмбрионы культивировали до стадии бластоцисты, а в тесте В - до стадии хетчинга. Число эмбрионов на каждой стадии развития и соответствующая им доля от первоначального числа эмбрионов (в круглых скобках) представлены в таблице 8 (тест А) или таблице 9 (тест В).


Пример 10.
[0306] Развитие эмбриона в среде для дробления с добавлением 1,7 мМ CaCl2, 1,7 мМ АКК-ПФ или 0,85 мМ АКК-ПФ (среда с


Пример 11.
[0307] Развитие эмбрионов на среде для дробления с добавлением 1,7 мМ CaCl2, 1,7 мМ или 0,85 мМ АКК-ПФ (АКК-ПФ 0,85) тестировали и сравнивали с развитием в необработанной среде. Число эмбрионов на каждой стадии развития и соответствующая им доля от первоначального числа эмбрионов (в круглых скобках) представлены в таблице 11.

Пример 12
[0308] В указанном эксперименте умерщвляли 4 самки мышей возрастом 5 месяцев. Собирали эмбрионы каждой мыши согласно описанию в разделе «Материалы и способы», однако не объединяли; эмбрионы из каждой маточной трубы каждой мыши культивировали в среде для дробления с добавлением либо 1,7 мМ CaCl2, либо или 1,7 мМ АКК ПФ по отдельности. Таким способом авторы настоящего изобретения могли также оценить различия между мышами, поскольку эмбрионы каждой самки представляли собой сиблингов. Число эмбрионов на каждой стадии развития и соответствующая им доля от первоначального числа эмбрионов (в круглых скобках) представлены в таблице 12.


Пример 13
[0309] В указанном эксперименте умерщвляли 7 самок мышей возрастом 6 месяцев. Собирали эмбрионы от каждой мыши согласно описанию в разделе «Материалы и способы», однако эмбрионы мышей №1 и №2 не объединяли, а культивировали по отдельности, согласно примеру 5. Эмбрионы от мыши №1 культивировали либо в необработанной среде для дробления, либо в среде с добавлением 2,6 мМ АКК-ПФ (АКК-ПФ 2,6). Эмбрионы от мыши №2 культивировали в среде для дробления с добавлением 1,3 мМ или 0,6 мМ АКК ПФ (идентифицирована как АКК ПФ 1,3 и АКК-ПФ 0,6, соответственно). Все эмбрионы от мышей №№3-7 объединяли и культивировали с 1,6 мМ полифосфата (ПФ). Кроме того, вычисляли диаметры и объемы бластоцист. Число эмбрионов на каждой стадии развития и соответствующая им доля от первоначального числа эмбрионов (в круглых скобках) представлены в таблице 13.

[0310] Было обнаружено, что диаметр прошедших хетчинг бластоцист, которые культивировали с 2,6 мМ АКК ПФ, был на 28% больше, чем в контроле, а объем в 2 раза больше, чем в контроле.
Пример 14.
[0311] В указанном эксперименте умерщвляли 7 самок мышей возрастом 6 месяцев. Собирали эмбрионы каждой мыши согласно описанию в разделе «Материалы и способы» (Пример 6). Эмбрионы объединяли и разделяли на 5 групп, которые культивировали в необработанной среде для дробления (Конт-Q), или в среде с добавлением 2,6 мМ, 1,3 мМ, 0,6 мМ АКК-ПФ (идентифицирована как АКК-ПФ 2,6, АКК ПФ 1,3 и АКК ПФ 0,6, соответственно), или в среде с добавлением 1,6 мМ полифосфата (ПФ). Число эмбрионов на каждой стадии развития и соответствующая им доля от первоначального числа эмбрионов (в круглых скобках) представлены в таблице 14.

Пример 15.
[0312] В указанном эксперименте умерщвляли 6 самок мышей возрастом 6 месяцев. Собирали эмбрионы каждой мыши согласно описанию в разделе «Материалы и способы». Эмбрионы объединяли и разделяли на 3 группы: одна служила в качестве контроля (Конт-Q), а в двух других группах эмбрионы культивировали в среде для дробления с добавлением 3,3 мМ АКК-ПФ (АКК-ПФ 3,3) или с 3,3 мМ коммерчески доступного нанометрического кристаллического карбоната кальция (ККК). Все три среды получали в асептических условиях. Число эмбрионов на каждой стадии развития и соответствующая им доля от первоначального числа эмбрионов (в круглых скобках) представлены в таблице 15.

Пример 16
[0313] В указанном эксперименте умерщвляли 6 самок мышей возрастом 7 месяцев. Собирали эмбрионы от каждой мыши согласно описанию в разделе «Материалы и способы» (Пример 6). Эмбрионы объединяли и культивировали в среде для дробления с добавлением 1,7 мМ CaCl2, 1,7 мМ АКК-ПФ, 0,8 мМ АКК-ПФ (АКК-ПФ 0,8) или 1,7 мМ фосфосерина (ФС). Число эмбрионов на каждой стадии развития и соответствующая им доля от первоначального числа эмбрионов (в круглых скобках) представлены в таблице 16.

[0314] Можно видеть, что в указанном конкретном эксперименте добавление хлорида кальция оказывало отрицательный эффект на эмбриональное развитие, приводя к более низким процентным значениям бластоцист и прошедших хетчинг бластоцист.
Пример 17.
[0315] В указанном эксперименте умерщвляли 6 самок мышей возрастом 6 месяцев. Собирали эмбрионы каждой мыши согласно описанию в разделе «Материалы и способы» (Пример 6), однако эмбрионы от мыши №1 и 2 не объединяли, а культивировали по отдельности, как в эксперименте с сиблингами (см. пример 10). Эмбрионы от самки №1 культивировали в необработанной среде для дробления или в среде с добавлением 1,7 мМ нанометрического кристаллического карбоната кальция (ККК). Эмбрионы от мыши №2 культивировали в среде с добавлением 1,7 мМ АКК-ПФ или 1,7 мМ карбоната натрия (NaCO3). Все эмбрионы от мышей №№3-6 объединяли и культивировали в необработанной среде или в среде с добавлением 1,7 мМ NaCO3 или 1,7 мМ АКК-ПФ. Кроме того, вычисляли диаметр и объем бластоцист (см. таблицу 17).

[0316] Можно видеть, что добавление карбоната натрия приводило к выраженно неудовлетворительному эмбриональному развитию по сравнению с контролем или средой с добавлением АКК-ПФ. Было также обнаружено, что диаметр прошедших хетчинг эмбрионов, которые культивировали в среде для дробления с добавлением 2,6 мМ АКК ПФ, был на 28% больше, а объем в 2 раза больше по сравнению с контролем.
Пример 18. Получение состава АКК с 10% ТФ и 1% лимонной кислоты (АКК, стабилизированного 10% трифосфата и 1% лимонной кислоты) для применения в качестве добавки к клеточной культуральной среде.
[0317] 36 мл 3% раствора хлорида кальция смешивали с 4 мл 0,27% раствора лимонной кислоты и с 10 мл 0,5406% раствора трифосфата. Затем добавляли 40 мл 1,9485% раствора карбоната натрия для осаждения АКК. 10 мл стабилизирующего раствора, содержащего 0,5406% трифосфата добавляли в суспензию АКК с получением стабилизированной суспензии АКК. Полученную суспензию применяли в качестве добавки для среды Quinn's™ для дробления или среды Quinn's™ 1-Step.Указанную суспензию добавляли до достижения конечной концентрации АКК, равной 1,7 или 3,4 мМ. Как вариант, указанную суспензию фильтруют с применением воронки Бюхнера, осадок промывают водой и затем высушивают, например, в печи. Указанный порошок добавляют в среду для дробления до достижения конечной концентрации 1,7 или 3,4 мМ.
Пример 19.
[0318] В указанном эксперименте умерщвляли 4 самки мышей возрастом 6-8 недель. Собирали эмбрионы каждой мыши согласно описанию в разделе «Материалы и способы». Стабилизированный АКК (АКК, стабилизированный 10% трифосфата и 1% лимонной кислоты) получали согласно описанию в примере 16. Эмбрионы от каждой самки разделяли и культивировали одну их часть в необработанной среде SAGE 1-Step™, в вторую часть в среде SAGE 1-Step™ с добавлением 1,7 мМ АКК-ПФ или 3,4 мМ АКК-ПФ. Как можно видеть на фиг.10, добавление стабилизированного АКК оказывало положительный эффект на эмбриональное развитие, приводя к более высоким процентным значениям бластоцист и прошедших хетчинг бластоцист, в частности, при применении 3,4 мМ АКК. Неожиданным образом, необходимость переноса в любую другую среду для увеличения уровней прошедших хетчинг бластоцист отсутствовала.
Пример 20.
[0319] В двух разных экспериментах умерщвляли по 3 самки мышей возрастом 6 8 недель (в каждом эксперименте). Собирали эмбрионы каждой мыши согласно описанию в разделе «Материалы и способы». Стабилизированный АКК (АКК, стабилизированный 10% трифосфата и 1% лимонной кислоты) получали согласно описанию в примере 17. В одном эксперименте (эксперимент А) эмбрионы от каждой самки разделяли и культивировали одну часть в необработанной среде SAGE 1-Step™, а вторую часть - в среде SAGE 1-Step™ с добавлением 3,4 мМ АКК-ПФ. Во втором эксперименте (эксперимент В) эмбрионы от каждой самки разделяли и культивировали одну часть в необработанной среде для дробления (SAGE), а вторую часть - в среде для дробления с добавлением 3,4 мМ АКК-ПФ. Результаты указанных экспериментов представлены на фиг. 11 (эксперимент А) и фиг.12 (эксперимент В).
[0320] Как можно видеть по результатам экспериментов, добавление стабилизированного АКК оказывало положительный эффект на эмбриональное развитие, приводя к более высоким процентным значениям для бластоцист и прошедших хетчинг бластоцист, в частности. Неожиданным образом, необходимость переноса в любую другую среду для увеличения уровней прошедших хетчинг бластоцист отсутствовала для обеих сред.
Пример 21. Получение составов с АКК для применения в качестве добавки к клеточной культуральной среде.
[0321] Получали композиции АКК, стабилизированного разными стабилизаторами (трифосфат (ТФ), гексаметафосфат (ГМФ), пирофосфат (Пир), фосфосерин (ФС), этидроновая кислота (ЭТ), золедроновая кислота (ЗК); или медроновая кислота (МК)). В ходе типичной процедуры растворы кальция (300 мл воды, 24 г хлорида кальция и стабилизатор) и раствор карбоната (200 мл воды и 17,3 г карбоната натрия) смешивали для осаждения АКК. Раствор стабилизатора (100 мл воды и стабилизатор; состав стабилизаторов в растворах кальция и стабилизатора приведен в таблице 18) добавляли в суспензию АКК с получением стабилизированной суспензии АКК. Указанная суспензия может применяться в качестве добавки. Затем АКК фильтровали с применением воронки Бюхнера, и осадок промывали водой. Суспензию высушивали с получением порошка. Указанный порошок может быть добавлен в качестве добавки в клеточную культуральную среду или ресуспендирован в водной среде и добавлен в виде суспензии.

[0322] Согласно другим примерам указанные композиции получали согласно описанию выше, с добавлением лимонной кислоты в растворы кальция для получения 1% лимонной кислоты в итоговой композиции. Указанную суспензию применяют непосредственно в качестве добавки для культуральной среды. Как вариант, указанную суспензию затем промывали водой и высушивали для получения порошка. Указанный порошок может быть добавлен к любой клеточной культуральной среде или ресуспендирован в водной среде.
[0323] Пример 22. Рост стволовых клеток МВА13 (Стромальные клетки костного мозга) с образованием остеобластов
Материал и способы
[0324] Через два дня после размораживания клетки МВА-13 (полученные от профессора Дова Ципори (Dov Zipori), Научный институт имени Вейцмана) ресуспендировали в растворе рекомбинантного трипсина и высевали в 96-луночный планшет (день «О») в концентрации 1×104 клеток/лунку, используя базальную среду для MCK Nutristem® XF (Biological Industries, кат. №05-200-1 А) с добавлением среды со смесью добавок для мезенхимальных стволовых клеток (MCK) (Biological Industries, кат. №05-201-06) в соотношении 50 мл:300 мкл. Ряды А-Н колонок 1-4 96-луночного планшета предварительно покрывали раствором для прикрепления МСК, разведенным ФСБ (без Са2+, Mg2+), в соотношении 1:100, для высевания клеток. Ряды А-Н колонок 5-8 96-луночного планшета предварительно покрывали 0,1% желатином в течение 30 минут при комнатной температуре.
[0325] На 2 день, после достижения более 80% конфлюэнтности клеток (~48 ч), среду заменяли на остеогенную среду для быстрой дифференцировки MSCgo (кат. №05-442-1 В), содержащую факторы, способствующие остеобластической дифференцировке. После замены среды в ряды А С добавляли дополнительно 1 мМ кальция (до общей концентрации кальция 2,488 мМ), происходящего из аморфного карбоната кальция (АКК), стабилизированного 10% трифосфата +1% лимонной кислоты; в ряды D-F добавляли дополнительно 1 мМ кальция (до общей концентрации кальция 2,488 мМ), происходящего из хлорида кальция; в ряд G планшета добавляли среду MSCgo (общая концентрация кальция 1,488 мМ). В ряд Η планшета добавляли питательную базальную среду для MCK NutriStem® XF + смесь добавок (общая концентрация кальция 1,488 мМ).
[0326] На 4 день среду заменяли на свежие составы с АКК.
[0327] Параллельно в контрольный планшет также высевали клетки линий MDX, происходящие из поврежденных мышц мышей MDX. Окрашивание указанных клеток использовали для задания фонового окрашивания внутреннего кальция клеток, а также для элиминации возможности окрашивания отложений кальция при обработке АКК. Перед посевом лунки покрывали желатином, который применяют в качестве стандартного субстрата для прикрепления клеток MDX. Клетки MDX высевали в 24-луночный планшет в концентрации 3×104 клеток/лунку. День посева определен как «0 день».
[0328] На 2 день среду в лунках заменяли следующим образом:
[0329] В колонки 1 и 2 добавляли среду для спинного мозга (СМ), которую готовили самостоятельно (указанная среда содержит 0,6% по массе D-глюкозы, 2 мМ L-глутамин, 25 мкг/мл гентамицина, В27, N2, 0,1 мг/мл БСА, Hepes, 10% ФБС, DMEM/F12 и ИФР-1, 50 нг/мл) + 1 мМ кальция, происходящего из АКК (общая концентрация кальция 2 мМ); в колонки 3 и 4 добавляли среду для СМ + 1 мМ кальция, происходящего из CaCl2; в колонки 5 и 6 добавляли среду для СМ. Оба типа клеток (МВА13 и MDX) культивировали до 10 дней.
[0330] Фиксацию (4% параформальдегидом в течение 20 минут) содержимого нескольких лунок каждого типа выполняли на 5, 7 и 10 день после замены среды, т.е. на 7, 9 и 12 день исследования.
[0331] После фиксации клеток использовали два типа реагентов для окрашивания внеклеточного кальция или отложения в кости для оценки функциональности остеобластов: (i) ализариновый красный (Sigma А55333) и (ii) щелочную фосфатазу (субстратная система ВСГР/NBT otDAKO, К0598), следующим образом:
[0332] Процедура окрашивания ализариновым красным рН доводили до 4,2. Клетки двукратно промывали ФСБ и фиксировали холодным метанолом в течение 5 минут, а затем повторно промывали ФСБ. Раствор ализарина в концентрации, составляющей 2%, использовали в течение 15-20 минут. После инкубации с окрашиванием образцы промывали водой 2-3 раза для устранения неспецифического окрашивания.
[0333] Окрашивание на щелочную фосфатазу - клетки промывали ФСБ 1 или 2 раза и затем фиксировали 4% параформальдегидом в течение 20 минут. После этого промывали 3 раза ФСБ и, после удаления остатков ФСБ, использовали 3 капли раствора из набора BCIP/NBT для покрытия клеток, в том числе заполняя одну пустую лунку, не содержащую каких-либо клеток, в качестве контроля для количественной оценки анализа. Инкубацию с набором для анализа щелочной фосфатазы выполняли в течение 1 часа, а затем промывали дистиллированной водой.
[0334] Результаты
[0335] Приведены результаты для клеток, которые культивировали в течение 10 дней и подвергали как окрашиванию ализарином, так и окрашиванию на щелочную фосфатазу. При наблюдениях, проведенных ранее чем через 10 дней, практически невозможно было детектировать какое-либо отложение кальция при применении обоих способов окрашивания.
[0336] За состоянием клеток наблюдали под световым микроскопом (без фиксации) в два момента времени, на 2 и 4 дни. Оба наблюдения показали, что состояние клеток, которые высевали на лунки, предварительно покрытые раствором для прикрепления МСК, не было хорошим; указанные клетки приобретали округлую форму. Напротив, состояние клеток, которые высевали на лунки, предварительно покрытые желатином, было хорошим. Тем не менее, было принято решение продолжить использование обоих типов предварительного покрытия. Представленные ниже результаты и процедуры окрашивания относятся к клеткам, культивируемым на желатине, который использовали в качестве субстрата для прикрепления.
[0337] При окрашивании ализариновым красным отложения кальция детектируют по оранжево-красному цвету.
[0338] При окрашивании ализариновым красным наблюдался очень сильный сигнал в образцах остеобластических клеток с добавлением АКК по сравнению с образцами с добавлением CaCl2, в которых наблюдался только слабый сигнал (фиг. 13). Помимо указанного сигнала на указанной фигуре можно видеть окрашивание больших кальциевых бляшек, которые не наблюдаются при каком-либо из контрольных вариантов обработки.
[0339] При окрашивании ализариновым красным клеток, культивируемых в среде для быстрой дифференцировки MSCgo также наблюдалось некоторое окрашивание отложения кальция, однако размер отложений и их количество значимо ниже, а морфология напоминает морфологию и количество, наблюдаемые в клетках при добавлении CaCl2. Отложение кальция не наблюдалось в клетках, культивируемых в среде с добавками для MCK NutriStem® XF (добавки для МСК; данные не показаны). Среду с добавками для MCK NutriStem® XF обычно используют, чтобы индуцировать пролиферацию клеток, а не дифференцировку. Действительно, наблюдалось значительное число клеток, но не отложение кальция.
[0340] Указанное наблюдение предполагает, что обработка АКК улучшает дифференцировку клеток МВА13 в остеобласты и увеличивает отложение кальция в клетках, т.е. улучшает их функциональность.
[0341] Другим независимым маркером остеобластической дифференцировки является щелочная фосфатаза. Максимальная экспрессия указанного фермента происходит в фазе созревания матрикса клеток. Окрашивание на щелочную фосфатазу применяли в качестве дополнительного способа детекции дифференцировки и функциональности остеобластов, с целью верификации результата, полученного при окрашивании ализарином.
[0342] Окрашивание на щелочную фосфатазу показано черным цветом; результаты представлены на фиг. 14. В клетках МВА13, обработанных АКК, наблюдался интенсивный сигнал по сравнению с другими вариантами обработки. Так, окрашивание на щелочную фосфатазу подтверждает, что дифференцировка остеобластов лучше проходит в культурах, обработанных АКК.
[0343] Окрашивание ализарином клеток MDX, обработанных обогащенной АКК средой, через 10 дней после посева продемонстрировало отсутствие значительных различий окрашивания при разных вариантах обработки (см. фиг. 15А-С). Указанные результаты подтверждают, что окрашивание остеобластов ализариновым красным обусловлено отложением кальция указанным остеобластом, а не отложением АКК, вызванным собственно обработкой (т.е. не является экспериментальным артефактом).
[0344] Окрашивание щелочной фосфатазы в клетках линий MDX (фиг. 15D-F) продемонстрировало, что формирования кости не происходило. Интересно, что окрашивание щелочной фосфатазы улучшало образование мышечных трубочек, наблюдаемое в обработанных АКК клетках, по сравнению с клетками, культивируемыми на среде с добавлением CaCl2, или в контроле.
[0345] Выводы
[0346] Оба независимых вида окрашивания, окрашивание ализариновым красным и окрашивание на щелочную фосфатазу через 10 дней после посева на разную среду, показали существенно более выраженное окрашивание отложений в остеобластических клетках, которые культивировали в среде с добавлением АКК, по сравнению с использованными контролями.
[0347] Хотя при культивировании клеток в присутствии АКК наблюдались отложение больших кальциевых бляшек, такое отложение не наблюдалось в клетках, культивируемых в среде с добавлением CaCl2. Более сильный сигнал может указывать на большую функциональность, поскольку окрашивание продемонстрировало более выраженное отложение бляшек. Результат, полученный при окрашивании клеток MDX, предполагает, что указанные бляшки возникают не в результате добавления АКК, а являются непосредственным результатом функционирования остеобластов.
Пример 23 - АКК для улучшения подвижности сперматозоидов
[0348] Материалы и способы
[0349] Получение суспензии АКК
[0350] 36 мл 3% раствора хлорида кальция смешивали с 4 мл 0,3% раствора лимонной кислоты и с 10 мл 0,5% раствора трифосфата. Затем добавляли 40 мл 2% раствора карбоната натрия для осаждения АКК. В суспензию АКК добавляли 10 мл стабилизирующего раствора, содержащего 0,5% трифосфата, с получением стабилизированной суспензии АКК. Концентрация элементарного кальция в полученной суспензии составляла 75 мМ.
[0351] Взятие спермы
[0352] Сперму собирали 3 раза от одного барана (эксп. 1) или дважды от 3 баранов (эксп. 2 и 3), и оценивали концентрацию и подвижность при комнатной температуре. Сперму разводили до концентрации 50 млн сперматозоидов/мл в синтетической жидкости маточных труб (SOF), содержащей: 107,70 мМ NaCl, 7,16 мМ KCl, 1,19 мМ KH2PO4, 1,71 мМ CaCl2, 0,49MM MgCl2, 25,07 мМ NaHCO3, 3,30 мМ лактат Na и 1,50 мМ глюкозу (10) в воде Milli-Q. Осмолярность должна составлять 270 мОсм, а рН - 7,55.
[0353] Затем оценивали подвижность спермы с применением CASA (Theriogenology, 2014, Volume 81, Issue 1, Pages 5-17) и охлаждали до 4°С со скоростью 1°С /мин.
[0354] Процедура флотации
[0355] Процедуру флотации выполняли при 38°С, сырую сперму (10 мкл) помещали во флакон Eppendorf объемом 1 мл и инкубировали в течение приблизительно 1 часа в среде SOF, которую вводили в трубочках объемом 0,25 мл (CBS, Франция). Через 40-60 минут сперму, которая проникла в трубочку, помещали на предметное стекло и оценивали с применением CASA.
[0356] Результаты
[0357] Подвижность свежесобранной спермы тестировали согласно описанию в разделе «Материалы и способы» при добавлении или без добавления аморфного карбоната кальция. Результаты представлены в таблице 19.


[0358] Можно видеть, что сперма с добавлением АКК обладала значительно более высокой поступательной подвижностью по сравнению с необработанной спермой.
Пример 24. Эффект АКК на подвижность сперматозоидов в эксперименте с флотацией
[0359] Для оценки эффекта АКК на подвижность сперматозоидов проводили стандартный эксперимент с флотацией в присутствии 17 мкл/мл и 34 мкл/мл суспензии АКК (1,3 и 2,6 мМ элементарного Са, соответственно). Жизнеспособные сперматозоиды подсчитывали через 1 час, результаты обобщены в таблице 20.

[0360] Ясно видно, что добавление АКК значимо увеличивало число жизнеспособных сперматозоидов во всех эксперимента. В образцах с добавлением АКК число жизнеспособных сперматозоидов было в 2 7 раз выше, чем в образцах из необработанной среды.
Пример 25. Эффект концентрации АКК на подвижность сперматозоидов в эксперименте с флотацией
Эффект концентрации АКК на подвижность спермы тестировали в эксперименте с флотацией, с применением 3 разных образцов для каждой концентрации АКК. Результаты обобщены в таблице 21.

[0361] Было отмечено, что добавление 17 мкл/мл суспензии АКК в раствор синтетической жидкости маточных труб (SOF) и инкубация при 38°С в течение 1 часа увеличивали концентрацию подвижной спермы по меньшей мере в 3 раза. Интересно, что более высокая концентрация АКК не снижала концентрацию подвижной спермы после флотации. Было сделан вывод, что АКК улучшал концентрацию спермы после процедуры флотации и не оказывал какого-либо двухфазного эффекта в отношении ионного кальция. Любая концентрация АКК выше минимальной эффективной дозы увеличивает подвижность.
Пример 26. АКК сохраняет яичники in vitro
[0362] Материал и способы
[0363] У мышей (возрастом 6 недель) собирали яичники, разделенные на фрагменты размером 0,4 мм × 0,4 мм. Яичники культивировали в 12-луночных планшетах. Культуральная среда состояла из: 90% модифицированной до Дульбекко среды Игла - питательной смеси F-12 (DMEM-F12), истощенной по кальцию (среда без ионов кальция, специальный состав), 10% фетальной бычьей сыворотки (ФБС), 2 мМ глутамина, 25 мкг/мл гентамицина и 0,3-0,5% геля NVR-Gel с добавлением или без добавления стабилизированного 3,4 мМ АКК-ПФ. Через 48 ч культивирования добавляли в емкость для культивирования добавляли 5МЕ ГСЖК (гонадотропина сыворотки жеребой кобылы.
[0364] Результаты
[0365] На фиг. 16 можно видеть, что вторичные фолликулы развивались через 2 недели культивирования in vitro в присутствии стабилизированного АКК, и зернистые клетки, окружающие ооциты, были интактными. Напротив, во вторичных фолликулах в контрольной группе наблюдаются неинтактные зернистые клетки и ооцит на стадии зародышевого пузырька. В группе АКК наблюдалось значительно больше фолликулов, что указывает на то, что добавление АКК в культуральную среду обеспечивает лучший и более быстрый рост фолликулов.
[0366] Хотя настоящее изобретение было описано в настоящем документе путем описания предпочтительных вариантов его реализации, оно может быть модифицировано без отступления от существа и предмета заявленного изобретения, определяемого прилагаемой формулой изобретения.
Реферат
Изобретение относится к медицине. Способ лечения мышечной дистрофии у нуждающегося в этом субъекта включает введение указанному субъекту фармацевтически приемлемой композиции, содержащей аморфный карбонат кальция (АКК), стабилизированный по меньшей мере одним стабилизирующим агентом. Мышечная дистрофия выбрана из группы, состоящей из мышечной дистрофии Дюшенна, Беккера, тазово-плечевой, врожденной, плече-лопаточно-лицевой, миотонической, окулофарингеальной, дистальной мышечной дистрофии и мышечной дистрофии Эмери-Дрейфуса. Изобретение заключается в обеспечении средства и способа лечения указанного заболевания, а именно расширении ассортимента технических средств. 7 з.п. ф-лы, 26 ил., 21 табл., 26 пр.

Комментарии