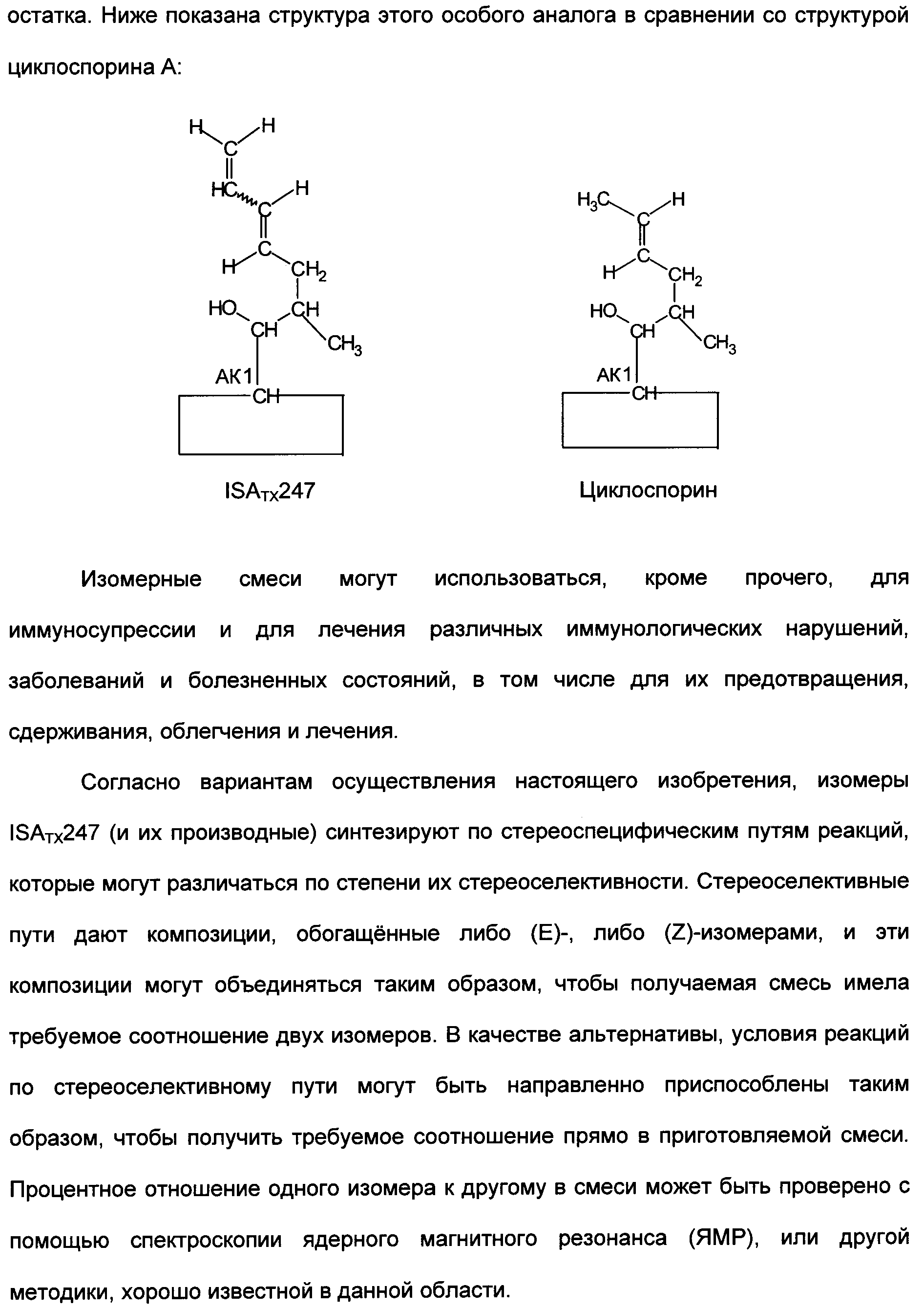
Смесь аналогов циклоспорина и ее применение в качестве иммуномодулирующего агента - RU2337106C2
Код документа: RU2337106C2
Чертежи










Показать все 17 чертежа(ей)
Описание
Текст описания приведен в факсимильном виде.
























































































Реферат
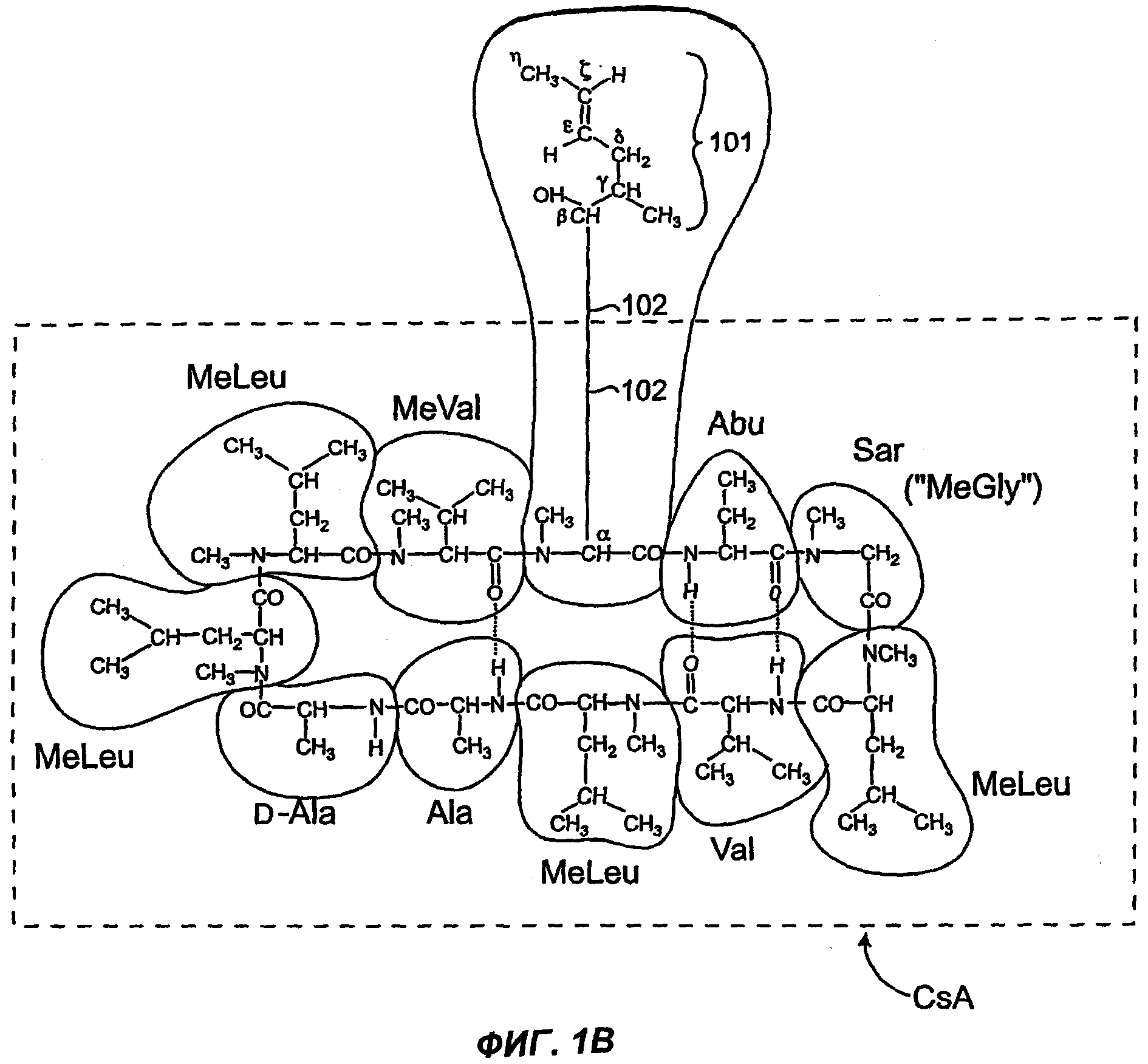
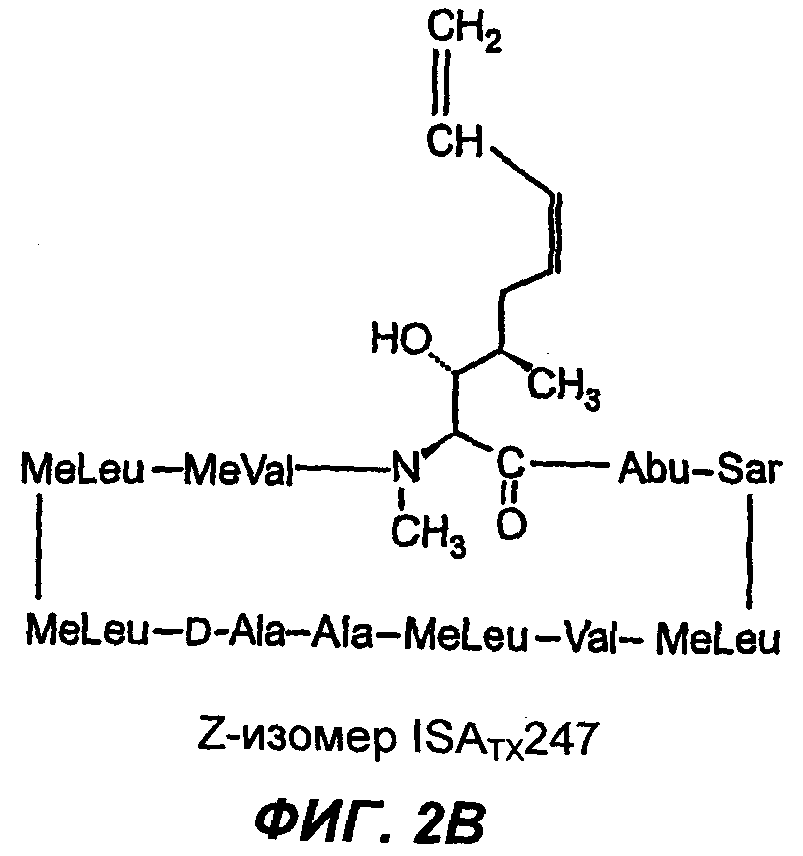
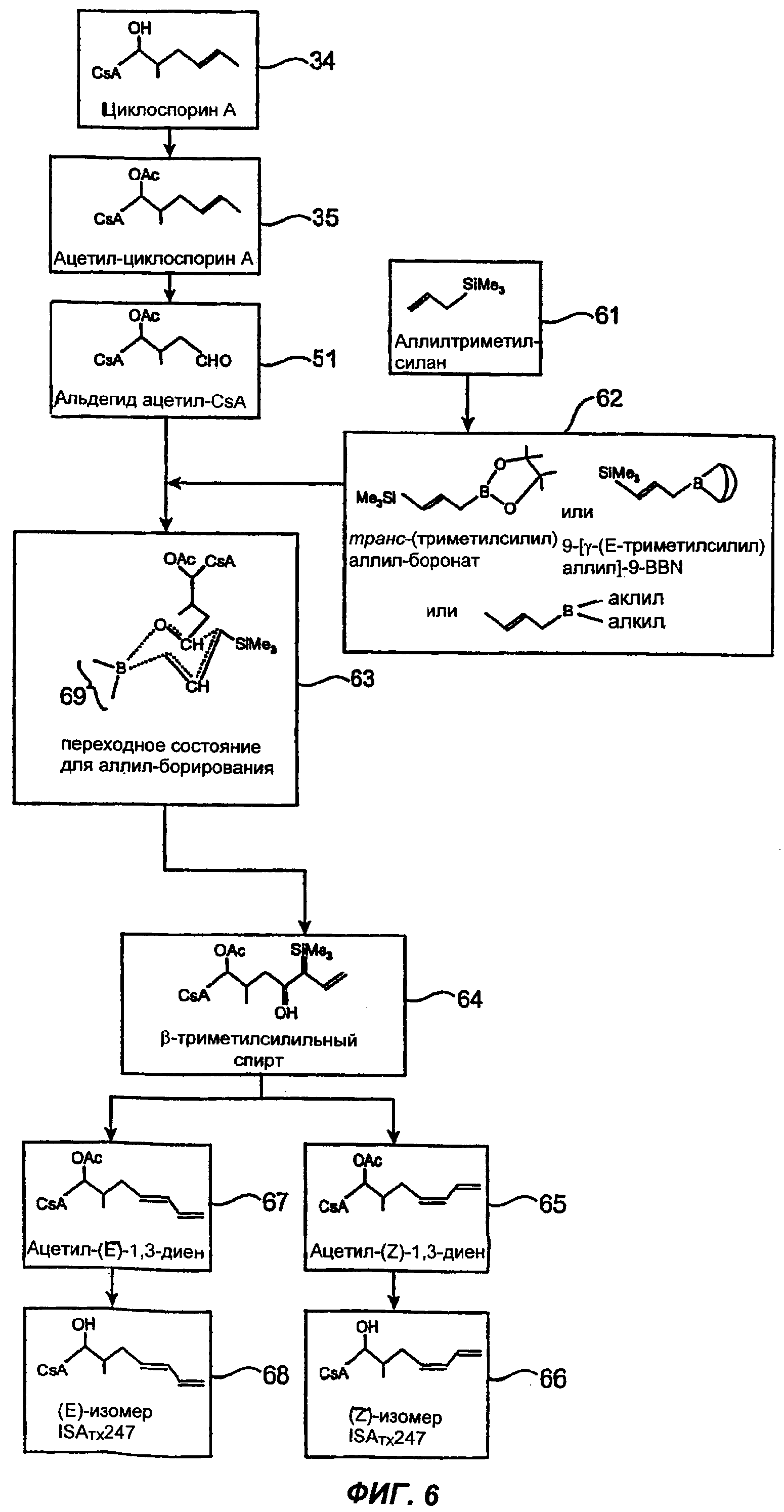
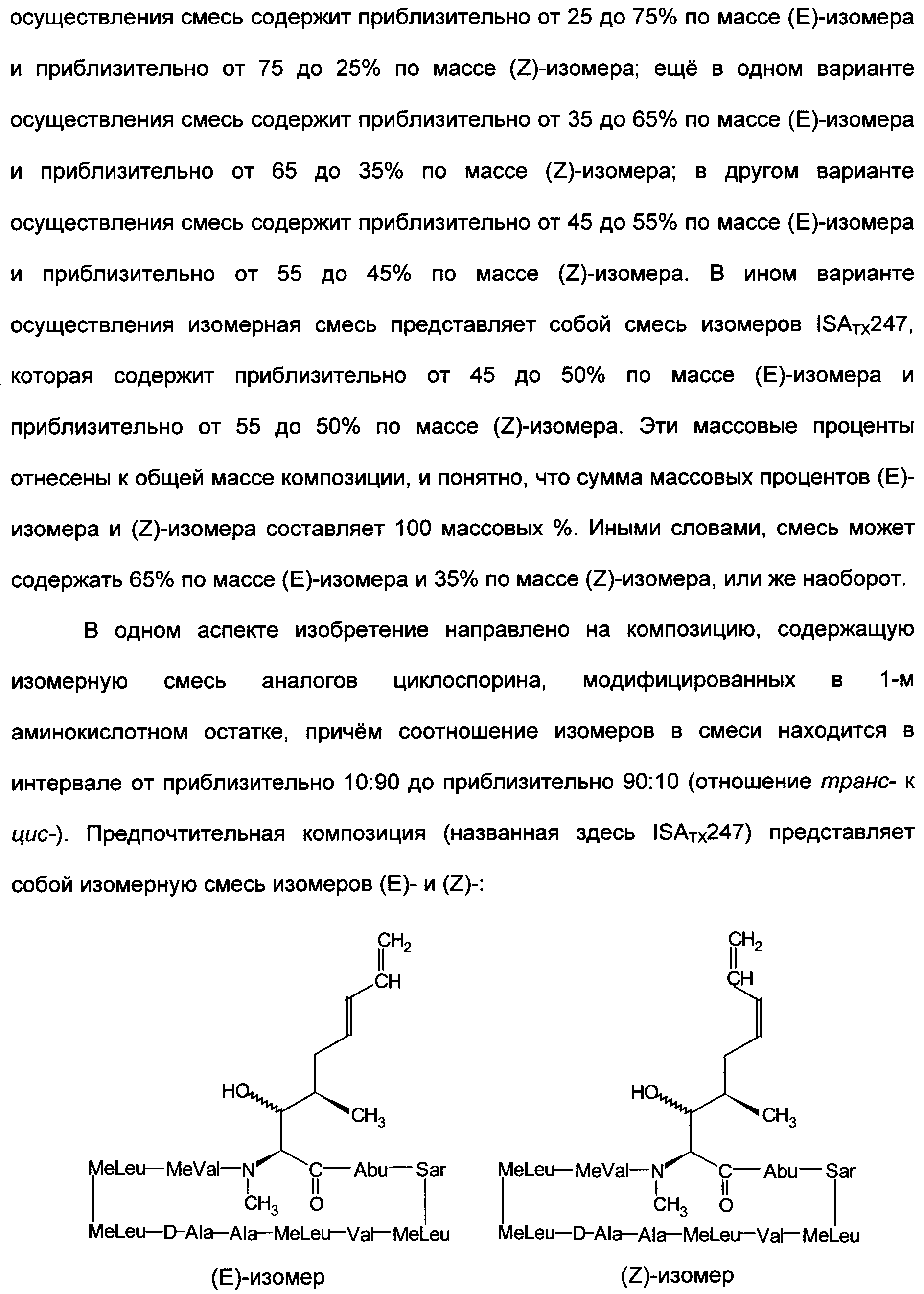
Изобретение относится к композициям, включающим изомерную смесь аналога циклоспорина А, модифицированного в 1-м аминокислотном остатке заместителем 1,3-диеном, где изомеры представляют собой изомеры Е- и Z-:

Изобретение также относится к фармацевтическим композициям, обладающим иммуносупрессорной активностью, применению композиций для изготовления лекарственного средства и к способу осуществления иммуносупрессии. 11 н. и 66 з.п. ф-лы, 7 табл., 13 ил.
Формула
1. Композиция, включающая изомерную смесь аналога циклоспорина А, модифицированного в 1-м аминокислотном остатке заместителем 1,3-диеном, где интервал содержания 1,3-диенового заместителя в изомерной смеси составляет от приблизительно 10% до приблизительно 95% для Е-изомера и от приблизительно 90% до приблизительно 5% для Z-изомера.
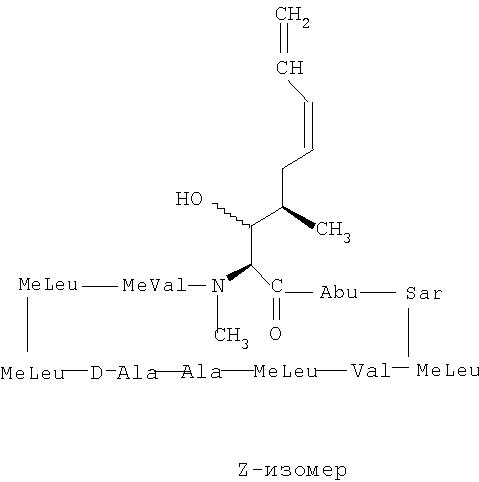
2. Композиция по п.1, отличающаяся тем, что недейтерированные изомеры представляют собой изомеры Е- и Z-, как они определены ниже:


3. Композиция по п.2, отличающаяся тем, что изомерная смесь содержит от приблизительно 15% до приблизительно 85% Е-изомера и от приблизительно 85% до приблизительно 15% Z-изомера.
4. Композиция по п.2, отличающаяся тем, что изомерная смесь содержит от приблизительно 25% до приблизительно 75% Е-изомера и от приблизительно 75% до приблизительно 25% Z-изомера.
5. Композиция по п.2, отличающаяся тем, что изомерная смесь содержит от приблизительно 35% до приблизительно 65% Е-изомера и от приблизительно 65% до приблизительно 35% Z-изомера.
6. Композиция по п.2, отличающаяся тем, что изомерная смесь содержит от приблизительно 45% до приблизительно 55% Е-изомера и от приблизительно 55% до приблизительно 45% Z-изомера.
7. Композиция по п.2, отличающаяся тем, что изомерная смесь содержит от приблизительно 45% до приблизительно 50% Е-изомера и от приблизительно 55% до приблизительно 50% Z-изомера.
8. Композиция по п.2, отличающаяся тем, что изомерная смесь содержит от приблизительно 50% до приблизительно 55% Е-изомера и от приблизительно 50% до приблизительно 45% Z-изомера.
9. Композиция по п.2, отличающаяся тем, что изомерная смесь содержит от приблизительно 55% до приблизительно 65% Е-изомера и от приблизительно 45% до приблизительно 35% Z-изомера.
10. Композиция по п.2, отличающаяся тем, что изомерная смесь содержит от приблизительно 65% до приблизительно 75% Е-изомера и от приблизительно 35% до приблизительно 25% Z-изомера.
11. Композиция по п.2, отличающаяся тем, что изомерная смесь содержит от приблизительно 75% до приблизительно 85% Е-изомера и от приблизительно 25% до приблизительно 15% Z-изомера.
12. Композиция по п.2, отличающаяся тем, что изомерная смесь содержит от приблизительно 85% до приблизительно 90% Е-изомера и от приблизительно 15% до приблизительно 10% Z-изомера.
13. Композиция по п.2, отличающаяся тем, что изомерная смесь содержит от приблизительно 90% до приблизительно 95% Е-изомера и от приблизительно 10% до приблизительно 5% Z-изомера.
14. Фармацевтическая композиция, обладающая иммуносупрессорной активностью, содержащая изомерную смесь аналога циклоспорина А в соответствии с любым из пп.1-13 и фармацевтически приемлемый наполнитель.
15. Фармацевтическая композиция по п.14, отличающаяся тем, что фармацевтически приемлемый наполнитель содержит жидкий раствор, содержащий поверхностно-активное вещество, этанол, липофильный и/или амфифильный растворитель.
16. Фармацевтическая композиция по п.14, отличающаяся тем, что фармацевтически приемлемый наполнитель содержит жидкий раствор, содержащий d-альфа-токоферил-полиэтиленгликоль 1000 сукцинат (витамин Е, TPGS), масло триглицерида со средней длиной цепи (МСТ), твин 40 и этанол.
17. Фармацевтическая композиция по п.14 в форме желатиновой капсулы, содержащей жидкий раствор, содержащий поверхностно-активное вещество, этанол, липофильный и/или амфифильный растворитель.
18. Фармацевтическая композиция по п.16 в виде дозированной формы на один прием.
19. Фармацевтическая композиция по п.17 в виде дозированной формы на один прием.
20. Фармацевтическая композиция по п.19, отличающаяся тем, что она содержит от приблизительно 5 мг до приблизительно 500 мг активного ингредиента.
21. Фармацевтическая композиция по п.14, отличающаяся тем, что она содержит приблизительно 50 мг изомерной смеси.
22. Фармацевтическая композиция по п.15, отличающаяся тем, что раствор содержит приблизительно 50 мг/мл изомерной смеси.
23. Фармацевтическая композиция по п.16, отличающаяся тем, что раствор содержит 50 мг/мл изомерной смеси.
24. Фармацевтическая композиция по п.14, отличающаяся тем, что она находится в форме, пригодной для перорального введения.
25. Способ осуществления иммуносупрессии, включающий введение реципиенту изомерной смеси аналога циклоспорина А в соответствии с любым из пп.1-13.
26. Способ по п.25, отличающийся тем, что указанный реципиент является человеком.
27. Способ по п.25, отличающийся тем, что количество вводимой изомерной смеси аналога циклоспорина А составляет от приблизительно 0,05 мг на килограмм веса тела в день до приблизительно 50 мг на килограмм веса тела в день.
28. Способ по п.27, отличающийся тем, что количество вводимой изомерной смеси аналога циклоспорина А составляет от приблизительно 0,1 мг на килограмм веса тела в день до приблизительно 10 мг на килограмм веса тела в день, вводимых перорально два раза в день.
29. Способ по п.27, отличающийся тем, что количество вводимой изомерной смеси аналога циклоспорина А составляет от приблизительно 0,5 мг/кг/день до приблизительно 10 мг/кг/день.
30. Способ по п.29, отличающийся тем, что количество вводимой изомерной смеси аналога циклоспорина А составляет от приблизительно 2 мг/кг/день до приблизительно 6 мг/кг/день, вводимых перорально два раза в день.
31. Способ по п.30, отличающийся тем, что количество вводимой изомерной смеси аналога циклоспорина А составляет от приблизительно 0,5 мг/кг/день до приблизительно 3 мг/кг/день, вводимых перорально два раза в день.
32. Способ по п.25, отличающийся тем, что указанная иммуносупрессия предназначена для предотвращения, лечения или облегчения отторжения трансплантата органа или ткани.
33. Способ по п.32, отличающийся тем, что указанный трансплантат выбран из группы, состоящей из трансплантатов сердца, легкого, объединенных сердца-легкого, печени, почки, поджелудочной железы, кожи, кишечника и роговицы.
34. Способ п.25, отличающийся тем, что указанная иммуносупрессия предназначена для лечения или облегчения опосредованного Т-клетками отторжения.
35. Способ по п.25, отличающийся тем, что указанная иммуносупрессия предназначена для лечения или облегчения реакции «трансплантат против хозяина».
36. Способ по п.32, отличающийся тем, что указанное отторжение трансплантата органа или ткани является следствием трансплантации костного мозга.
37. Способ по п.25, отличающийся тем, что указанная иммуносупрессия предназначена для предотвращения, лечения или облегчения отторжения ксенотрансплантата.
38. Способ по п.37, отличающийся тем, что указанное отторжение ксенотрансплантата выбрано из группы, состоящей из острого, подострого и хронического отторжения органа, происходящего в том случае, когда донор органа принадлежит к иному биологическому виду, чем реципиент.
39. Способ по п.37, отличающийся тем, что указанное отторжение ксенотрансплантата представляет собой отторжение, опосредованное В-клетками или антителами.
40. Способ по п.25, отличающийся тем, что указанная иммуносупрессия предназначена для предотвращения, лечения или облегчения аутоиммунного заболевания или болезненного состояния, или воспалительного заболевания или болезненного состояния.
41. Способ по п.40, отличающийся тем, что указанное заболевание или болезненное состояние выбрано из группы, состоящей из артрита, ревматоидного артрита, хронического прогрессирующего артрита, деформирующего артрита и других ревматических заболеваний.
42. Способ по п.40, отличающийся тем, что указанное заболевание или болезненное состояние выбрано из группы, состоящей из гематологических расстройств, гемолитической анемии, гипопластической анемии, истинной эритроцитарной анемии, идиопатической тромбоцитопении, системной красной волчанки, полихондрии, склеродемы, гранулематоза Вегенера, дерматомиозита, хронического активного гепатита, миастении, псориаза, синдрома Стивенса-Джонсона, синдрома идиопатической мальабсорбции, (аутоиммунного) воспаления кишечника, язвенного колита, болезни Крона, эндокринной офтальмопатии, болезни Грейвса, саркоидоза, рассеянного склероза, первичного цирроза печени, юношеского диабета (сахарного диабета I типа), увеита (предшествующего и последующего), кератоконъюнктивита (keratoconjunctivitis sicca и vernal keratoconjunctivitis), интерстициального склероза легких, псориазного артрита, гломерулонефрита, идиопатического нефротического синдрома, нефропатии минимальных изменений и юношеского дерматомиозита.
43. Способ по п.40, отличающийся тем, что указанное заболевание или болезненное состояние выбрано из группы, состоящей из псориаза, контактного дерматита, атопического дерматита, очаговой алопеции, полиморфной эритемы, герпетиформного дерматита, склеродермии, витилиго, ангиита гиперчувствительности, крапивницы, буллезного пемфигоида, красной волчанки, пузырчатки, врожденного буллезного эпидермолиза, других воспалительных или аллергических болезненных состояний кожи, воспалительных болезненных состояний легких и дыхательных путей, астмы, аллергий и пневмокониоза.
44. Композиция, как она определена в любом из пп.1-13, обладающая иммуносупрессорной активностью.
45. Применение композиции, как она определена в любом из пп.1-13, для изготовления лекарственного средства для обеспечения иммуносупрессии с целью предотвращения отторжения аллотрансплантата или ксенотрансплантата, предпочтительно почки, сердца, печени, или предотвращения или лечения аутоиммунных болезненных состояний, в частности, ревматоидного артрита или псориаза.
46. Применение изомерной смеси аналога циклоспорина А в соответствии с любым из пп.1-13 для получения лекарственного средства для создания иммуносупрессии при введении реципиенту.
47. Применение по п.46, отличающееся тем, что реципиент является человеком.
48. Композиция, включающая изомерную смесь аналога циклоспорина А, модифицированного в 1-м аминокислотном остатке заместителем 1,3-диеном, характеризующаяся тем, что изомерная смесь содержит не менее чем приблизительно 55% Е-изомера и не более чем приблизительно 45% Z-изомера.
49. Композиция по п.48, отличающаяся тем, что недейтерированные изомеры представляют собой изомеры Е- и Z-, как они определены ниже:
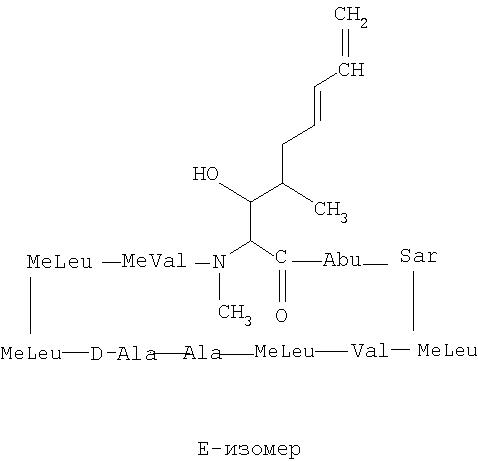

50. Композиция по п.49, отличающаяся тем, что изомерная смесь содержит от приблизительно 55% до приблизительно 65% Е-изомера и от приблизительно 45% до приблизительно 35% Z-изомера.
51. Композиция по п.49, отличающаяся тем, что изомерная смесь содержит от приблизительно 65% до приблизительно 75% Е-изомера и от приблизительно 35% до приблизительно 25% Z-изомера.
52. Композиция по п.49, отличающаяся тем, что изомерная смесь содержит от приблизительно 75% до приблизительно 85% Е-изомера и от приблизительно 25% до приблизительно 15% Z-изомера.
53. Композиция по п.49, отличающаяся тем, что изомерная смесь содержит от приблизительно 85% до приблизительно 90% Е-изомера и от приблизительно 15% до приблизительно 10% Z-изомера.
54. Композиция по п.49, отличающаяся тем, что изомерная смесь содержит от приблизительно 90% до приблизительно 95% Е-изомера и от приблизительно 10% до приблизительно 5% Z-изомера.
55. Композиция по п.49, отличающаяся тем, что изомерная смесь содержит не менее 95% Е-изомера и не более 5% Z-изомера.
56. Композиция, включающая изомерную смесь аналога циклоспорина А, модифицированного в 1-м аминокислотном остатке заместителем 1,3-диеном, характеризующаяся тем, что изомерная смесь содержит не более чем приблизительно 45% Е-изомера и не менее чем приблизительно 55% Z-изомера.
57. Композиция по п.56, отличающаяся тем, что недейтерированные изомеры представляют собой изомеры Е- и Z-, как они определены ниже:


58. Фармацевтическая композиция, обладающая иммуносупрессорной активностью, содержащая изомерную смесь аналога циклоспорина А в соответствии с любым из пп.48-57 и фармацевтически приемлемый наполнитель.
59. Фармацевтическая композиция по п.58, отличающаяся тем, что фармацевтически приемлемый наполнитель содержит жидкий раствор, содержащий поверхностно-активное вещество, этанол, липофильный и/или амфифильный растворитель.
60. Фармацевтическая композиция по п.58, отличающаяся тем, что фармацевтически приемлемый наполнитель содержит жидкий раствор, содержащий d-альфа-токоферил-полиэтиленгликоль 1000 сукцинат (витамин Е TPGS), масло триглицерида со средней длиной цепи (МСТ), твин 40 и этанол.
61. Фармацевтическая композиция по п.58 в форме желатиновой капсулы, содержащей жидкий раствор, содержащий поверхностно-активное вещество, этанол, липофильный и/или амфифильный растворитель.
62. Фармацевтическая композиция по п.60 в виде дозированной формы на один прием.
63. Фармацевтическая композиция по п.59 в виде дозированной формы на один прием.
64. Фармацевтическая композиция по п.62, отличающаяся тем, что она содержит от приблизительно 5 мг до приблизительно 500 мг активного ингредиента.
65. Фармацевтическая композиция по п.63, отличающаяся тем, что она содержит от приблизительно 5 мг до приблизительно 500 мг активного ингредиента.
66. Фармацевтическая композиция по п.61, отличающаяся тем, что она содержит приблизительно 50 мг изомерной смеси.
67. Фармацевтическая композиция по п.59, отличающаяся тем, что раствор содержит 50 мг/мл изомерной смеси.
68. Фармацевтическая композиция по п.60, отличающаяся тем, что раствор содержит 50 мг/мл изомерной смеси.
69. Фармацевтическая композиция по п.58, отличающаяся тем, что она находится в форме, пригодной для перорального введения.
70. Фармацевтическая композиция для осуществления иммуносупрессии при введении реципиенту, включающая изомерную смесь аналога циклоспорина А в соответствии с любым из пп.48-57.
71. Фармацевтическая композиция по п.70, отличающаяся тем, что указанный реципиент является человеком.
72. Фармацевтическая композиция по любому из пп.59 или 60, отличающаяся тем, что фармацевтическая композиция содержит изомерную смесь аналога циклоспосрина А в количестве от приблизительно 0,05 мг на килограмм веса тела в день до приблизительно 50 мг на килограмм веса тела в день.
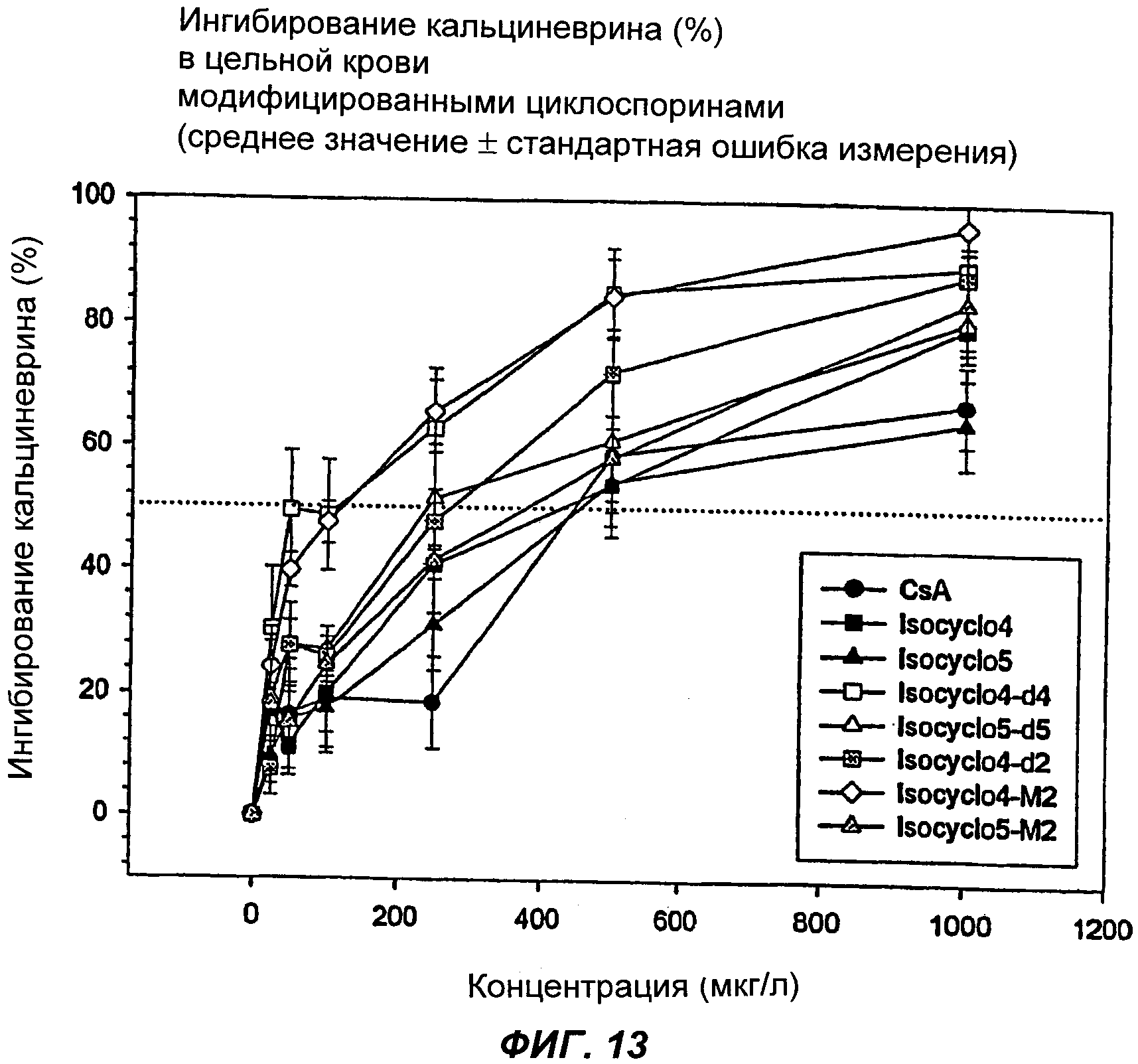
73. Фармацевтическая композиция по любому из пп.48-57 для осуществления иммуносупрессии, включающая изомерную смесь аналога циклоспорина А, характеризующаяся тем, что указанная фармацевтическая композиция имеет пониженную токсичность по сравнению с циклоспорином.
74. Фармацевтическая композиция по п.58, отличающаяся тем, что она пригодна для лечения заболевания или состояния, выбранного из группы, состоящей из артрита, ревматоидного артрита, хронического прогрессирующего артрита, деформирующего артрита и других ревматических заболеваний.
75. Фармацевтическая композиция по п.58, отличающаяся тем, что она пригодна для лечения заболевания или состояния, выбранного из группы, состоящей из гематологических расстройств, гемолитической анемии, гипопластической анемии, истинной эритроцитарной анемии, идиопатической тромбоцитопении, системной красной волчанки, полихондрии, склеродемы, гранулематоза Вегенера, дерматомиозита, хронического активного гепатита, миастении, псориаза, синдрома Стивенса-Джонсона, синдрома идиопатической мальабсорбции, (аутоиммунного) воспаления кишечника, язвенного колита, болезни Крона, эндокринной офтальмопатии, болезни Грейвса, саркоидоза, рассеянного склероза, первичного цирроза печени, юношеского диабета (сахарного диабета I типа), увеита (предшествующего и последующего), кератоконъюнктивита (keratoconjunctivitis sicca и vernal keratoconjunctivitis), интерстициального склероза легких, псориазного артрита, гломерулонефрита, идиопатического нефротического синдрома, нефропатии минимальных изменений и юношеского дерматомиозита.
76. Фармацевтическая композиция по п.58, отличающаяся тем, что она пригодна для лечения заболевания или состояния, выбранного из группы, состоящей из псориаза, контактного дерматита, атопического дерматита, очаговой алопеции, полиморфной эритемы, герпетиформного дерматита, склеродермии, витилиго, ангиита гиперчувствительности, крапивницы, буллезного пемфигоида, красной волчанки, пузырчатки, врожденного буллезного эпидермолиза, других воспалительных или аллергических болезненных состояний кожи, воспалительных болезненных состояний легких и дыхательных путей, астмы, аллергий и пневмокониоза.
77. Применение композиции, как она определена в любом из пп.48-57, для изготовления лекарственного средства для обеспечения иммуносупрессии с целью предотвращения отторжения аллотрансплантата или ксенотрансплантата, предпочтительно почки, сердца, печени, или предотвращения или лечения аутоиммунных болезненных состояний, в частности, ревматоидного артрита или псориаза.

Комментарии