Пероральная композиция целекоксиба для лечения боли - RU2745196C2
Код документа: RU2745196C2
Чертежи




Описание
Родственные заявки
Данная заявка претендует на приоритет предварительной заявки США №62/342874, поданной 27 мая 2016 года, полное раскрытие которой включено в настоящий документ посредством этой ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к стабильной пероральной жидкой фармацевтической композиции целекоксиба или его фармацевтически приемлемых солей. Целекоксиб присутствует в композициях, как описано в настоящем документе, не показывает осаждения при подвергании воздействию среды, имитирующей желудочный сок натощак (FaSSGF), при рН 2,0, температуре 37°С ± 0,5°С и перемешивании со скоростью 50 об/мин в течение по меньшей мере 60 минут. Также, изобретение относится к способу получения и способу применения указанной композиции целекоксиба.
Уровень техники
Нестероидные противовоспалительные лекарственные средства (NSAID) обычно применяют для лечения острой боли, воспалительной боли, висцеральной боли, «прорывной» боли, ноцицептивной боли, невропатической боли, дисменореи, послеоперационной боли, острой послеродовой боли, послеоперационного обезболивания, хронической боли при остеоартрите, ревматоидном артрите и боли, вызванной другими заболеваниями и причинами.
Целекоксиб одобрен в США под торговым названием CELEBREX® в виде капсул для орального применения, и применяется при лечении остеоартрита, ревматоидного артрита, ювенильного ревматоидного артрита, анкилозирующего спондилита, острой боли, хронической боли, первичной дисменореи и семейного аденоматозного полипоза. Он доступен в дозах 50 мг, 100 мг, 200 мг и 400 мг.
Целекоксиб описан в патенте США 5466823, переуступленном компании Searle, в котором описан класс 1,5-диарилпиразолов и их солей, а также способы получения таких соединений.
Целекоксиб химически обозначается как 4-[5-(4-метилфенил)-3-(трифторметил)-1Н-пиразол-1-ил]бензолсульфонамид и представляет собой диарил-замещенный пиразол. Эмпирическая формула представляет собой C17H14F3N3O2S и молекулярная масса равна 381,38; химическая структура представляет собой следующую:

В патенте США №5466823 содержатся общие ссылки на составы для введения 1,5-диарилпиразолов, включая перорально доставляемые лекарственные формы, такие как таблетки и капсулы.
В патенте США 5760068 описан класс 1,5-диарилпиразольных соединений, включая целекоксиб, которые являются селективными ингибиторами циклооксигеназы-2 и могут быть введены для лечения, помимо других состояний и нарушений, патологических состояний, связанных с ревматоидным артритом и остеоартритом.
Целекоксиб представляет собой гидрофобное и высокопроницаемое лекарственное средство, принадлежащее классу II Биофармацевтической классификационной системы. Целекоксиб представляет собой нейтральную молекулу, которая практически нерастворима в воде, что приводит к высокой изменчивости в абсорбции и, следовательно, имеет ограниченную биологическую доступность после перорального введения. Он также имеет пресистемный метаболизм.
Целекоксиб имеет растворимость в воде примерно 5 мкг/мл при температуре в интервале от 5°С до 40°С, которая не зависит от рН при рН < 9. Целекоксиб трудно растворяется и диспергируется, что затрудняет его быструю абсорбцию в желудочно-кишечном тракте при пероральном введении, например, в форме капсул. Пероральное введение ассоциируется с отсроченным началом желаемого фармакологического действия. Известно, что при пероральном введении для достижения максимальных концентраций в плазме целекоксиба требуется приблизительно 3 часа и, следовательно, он имеет отсроченное начало действия после введения. Кроме того, прием пищи дополнительно влияет на абсорбцию лекарственного средства. Однако острая боль, как в случае боли, вызванной мигренью, хирургическим вмешательством, травмой, камнями в почках и артритом, требует немедленного или быстрого ослабления.
Таким образом, в данной области остается неудовлетворенная потребность в композициях целекоксиба или его фармацевтических солях, которые обеспечивают более быстрое ослабление боли.
Раскрытие изобретения
В настоящей заявке предлагаются композиции и способы введения таких композиций, включающих целекоксиб или его фармацевтические соли, которые могут легко растворяться и/или диспергироваться для быстрой абсорбции в желудочно-кишечном тракте для обеспечения более быстрого ослабления боли.
В некоторых вариантах осуществления, раскрытых в настоящем документе, предлагаются стабильные пероральные жидкие фармацевтические композиции, содержащие терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция не проявляет какого-либо осаждения в среде, имитирующей желудочный сок натощак (Fasted-State Simulated Gastric Fluid, FaSSGF), при рН 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин при измерении через 60 минут.
В некоторых вариантах осуществления композиция по существу не содержит ингибиторов осаждения, выбранных из группы, состоящей из привитого сополимера поливинилкапролактам-поливинилацетат-полиэтиленгликол (SOLUPLUS®), блоксополимеров полиоксиэтилена-полиоксипропилена, плюроников, поливинилпирролидона и целлюлозных полимеров, включая гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. В некоторых вариантах осуществления по меньшей мере один солюбилизатор представляет собой полиэтоксилированное касторовое масло (доступное как KOLLIPHOR EL®), лаурилмакроголглицерид (доступный как GELUCIRE® 44/14) или их комбинацию.
В некоторых вариантах осуществления по меньшей мере один среднецепочечный глицерид представляет собой глицерил трикаприлат/трикапрат (доступный как CAPTEX® 300), глицерилмонокаприлат (доступный как CAPMUL® MCM C8) или их комбинацию. В некоторых вариантах осуществления по меньшей мере один полярный растворитель выбран из группы, состоящей из пропиленгликоля, полиэтиленгликолей, имеющих молекулярную массу в диапазоне от 400 до 1000, глицерина, C2-C8 моно- и полиспиртов (например, этанол), C7-C18 спиртов линейной или разветвленной конфигурации, воды и их смесей.
В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба составляет от около 1 мас.% до около 80 мас.% целекоксиба в расчете на общую массу композиции. В некоторых вариантах осуществления по меньшей мере один солюбилизатор присутствует в количестве от около 10 мас.% до около 70 мас.% в расчете на общую массу композиции.
В некоторых вариантах осуществления массовое соотношение по меньшей мере одного солюбилизатора к целекоксибу изменяется от около 4,0:1,0 до около 4,0:1,0. В некоторых вариантах осуществления по меньшей мере один полярный растворитель присутствует в количестве от около 20 мас.% до около 80 мас.% в расчете на общую массу композиции. В некоторых вариантах осуществления массовое соотношение по меньшей мере одного солюбилизатора по меньшей мере к одному полярному растворителю изменяется от около 0,60:1,00 до около 1,8:1,00.
В некоторых вариантах осуществления по меньшей мере один среднецепочечный глицерид присутствует в количестве от около 5 мас.% до около 75 мас.% в расчете на общую массу композиции. В некоторых вариантах осуществления композиция имеет средний размер капель масла не более 500 нм при тестировании в 250 мл среды, имитирующей желудочный сок натощак (FaSSGF) при рН 2,0, температуре 37°C ± 0,5°C и при перемешивании со скоростью 50 об/мин.
В некоторых вариантах осуществления композиция имеет вязкость от около 20 сП до около 1000 сП. В некоторых вариантах осуществления композиция имеет плотность от около 0,8 г/см3 до около 2 г/см3. В некоторых вариантах осуществления композиция имеет коэффициент пропускания по меньшей мере 40%. В некоторых вариантах осуществления композиция имеет рН от около 3 до около 7.
В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба по меньшей мере на около 40% меньше по сравнению со стандартными композициями целекоксиба, такими как CELEBREX® 400 мг в форме пероральных капсул. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба составляет около 240 мг. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба по меньшей мере на около 55% меньше по сравнению со стандартными композициями целекоксиба, такими как CELEBREX® 400 мг в виде пероральных капсул. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба составляет около 180 мг. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба по меньшей мере на около 70% меньше по сравнению со стандартными композициями целекоксиба, такими как CELEBREX® 400 мг в виде пероральных капсул.
В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба составляет около 120 мг. В некоторых вариантах осуществления предлагаются стабильные пероральные жидкие фармацевтические композиции, которые при пероральном введении субъекту-человеку натощак обеспечивают по меньшей мере один из следующих фармакокинетических параметров:
AUC(0-15 мин) от около 10 нг.ч/мл до около 80 нг.ч/мл;
AUC(0-30 мин) от около 80 нг.ч/мл до около 400 нг.ч/мл;
AUC(0-1 час) от около 400 нг.ч/мл до около 1500 нг.ч/мл;
AUC(0-2 час) от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
AUC(0-t) по меньшей мере около 2000 нг.ч/мл;
AUC(0-∞) по меньшей мере около 2000 нг.ч/мл; и
Tlag не более 8 минут.
В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции содержат: a) терапевтически эффективное количество целекоксиба; b) по меньшей мере одно фармацевтически приемлемое вспомогательное вещество; c) по меньшей мере один солюбилизатор в количестве от около 35 мас.% до около 45 мас.%; и d) по меньшей мере один полярный растворитель в количестве от около 25 мас.% до около 42 мас.%, при этом солюбилизатор и полярный растворитель содержатся в массовом соотношении от около 0,60:1 до около 1,8:1; и при этом стабильная пероральная жидкая фармацевтическая композиция имеет вязкость от около 20 сП до около 1000 сП и плотность от около 0,8 г/см3 до около 2 г/см3.
В некоторых вариантах осуществления, раскрытых в настоящем документе, предлагаются стабильные пероральные жидкие фармацевтические композиции, содержащие от около 100 мг до 250 мг целекоксиба, по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид и по меньшей мере один полярный растворитель, при этом композиция: a) высвобождает не менее чем около 70% целекоксиба за период времени, составляющий 10 минут; или b) высвобождает не менее чем около 80% целекоксиба за период времени, составляющий 15 минут, в 900 мл 0,01N HCl с 0,5% лаурилсульфатом натрия при тестировании в аппарате USP типа 2 с грузилами при 50 об/мин и 37°С.
В некоторых вариантах осуществления композиция по существу не содержит ингибиторов осаждения, выбранных из группы, состоящей из привитого сополимера поливинилкапролактам-поливинилацетат-полиэтиленгликоль (SOLUPLUS®), блоксополимеров полиоксиэтилена-полиоксипропилена, плюроников, поливинилпирролидона и целлюлозных полимеров, включая гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. В некоторых вариантах осуществления по меньшей мере один солюбилизатор представляет собой полиэтоксилированное касторовое масло (доступно как KOLLIPHOR EL®), лаурилмакроголглицерид (доступный как GELUCIRE® 44/14) или их комбинацию. В некоторых вариантах осуществления по меньшей мере один среднецепочечный глицерид представляет собой глицерил трикаприлат/трикапрат (доступный как CAPTEX® 300), глицерилмонокаприлат (доступный как CAPMUL® MCM C8) или их комбинацию.
В некоторых вариантах осуществления по меньшей мере один полярный растворитель выбран из группы, состоящей из пропиленгликоля, полиэтиленгликолей, имеющих молекулярную массу в диапазоне от 400 до 1000, глицерина, C2-C8 моно- и полиспиртов (например, этанол), C7-C18 спиртов линейной или разветвленной конфигурации, воды и их смесей.
В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба составляет от около 1 мас.% до около 80 мас.% целекоксиба в расчете на общую массу композиции. В некоторых вариантах осуществления по меньшей мере один солюбилизатор присутствует в количестве от около 10 мас.% до около 70 мас.% в расчете на общую массу композиции. В некоторых вариантах осуществления массовое соотношение по меньшей мере одного солюбилизатора к целекоксибу варьирует от около 4,0:1,0 до около 20:1,0.
В некоторых вариантах осуществления по меньшей мере один полярный растворитель присутствует в количестве от около 20 мас.% до около 80 мас.% в расчете на общую массу композиции. В некоторых вариантах осуществления массовое соотношение по меньшей мере одного солюбилизатора к по меньшей мере одному полярному растворителю варьирует от около 0,60:1,00 до около 1,8:1,00.
В некоторых вариантах осуществления по меньшей мере один среднецепочечный глицерид присутствует в количестве от около 5 мас.% до около 75 мас.% в расчете на общую массу композиции. В некоторых вариантах осуществления композиция имеет средний размер капель масла не более 500 нм при тестировании в 250 мл среды, имитирующей желудочный сок натощак (FaSSGF) при рН 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин.
В некоторых вариантах осуществления композиция имеет вязкость от около 20 сП до около 1000 сП. В некоторых вариантах осуществления композиция имеет плотность от около 0,8 г/см3 до около 2 г/см3. В некоторых вариантах осуществления композиция имеет коэффициент пропускания по меньшей мере 40%. В некоторых вариантах осуществления композиция имеет рН от около 3 до около 7.
В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба по меньшей мере на около 40% меньше по сравнению со стандартными композициями целекоксиба, такими как CELEBREX® 400 мг в форме пероральных капсул. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба составляет около 240 мг. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба по меньшей мере на около 55% меньше по сравнению со стандартными композициями целекоксиба, такими как CELEBREX® 400 мг в виде пероральных капсул. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба составляет около 180 мг. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба по меньшей мере на около 70% меньше по сравнению со стандартными композициями целекоксиба, такими как CELEBREX® 400 мг в виде пероральных капсул. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба составляет около 120 мг.
В некоторых вариантах осуществления предлагаются стабильные пероральные жидкие фармацевтические композиции, которые при пероральном введении субъекту-человеку натощак обеспечивают по меньшей мере один из следующих фармакокинетических параметров:
AUC(0-15 мин) от около 10 нг.ч/мл до около 80 нг.ч/мл;
AUC(0-30 мин) от около 80 нг.ч/мл до около 400 нг.ч/мл;
AUC(0-1 час) от около 400 нг.ч/мл до около 1500 нг.ч/мл;
AUC(0-2 час) от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
AUC(0-t) по меньшей мере около 2000 нг.ч/мл;
AUC(0-∞) по меньшей мере около 2000 нг.ч/мл; и
Tlag не более чем около 8 минут.
В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции содержат: a) терапевтически эффективное количество целекоксиба; b) по меньшей мере одно фармацевтически приемлемое вспомогательное вещество; c) по меньшей мере один солюбилизатор в количестве от около 35 мас.% до около 45 мас.% и d) по меньшей мере один полярный растворитель в количестве от около 25 мас.% до около 42 мас.%, при этом солюбилизатор и полярный растворитель присутствуют в массовом соотношении от около 0,60:1 до около 1,8:1; и при этом стабильная пероральная жидкая фармацевтическая композиция имеет вязкость от около 20 сП до около 1000 сП и плотность от около 0,8 г/см3 до около 2 г/см3.
В некоторых вариантах осуществления, раскрытых в настоящем документе, предлагаются способы лечения боли у субъекта-человека, при этом способ включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор в количестве от около 35 мас.% до около 45 мас.%, по меньшей мере один полярный растворитель в количестве от около 25 мас.% до около 42 мас.%, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом стабильная пероральная жидкая фармацевтическая композиция по существу не содержит ингибиторов осаждения.
В некоторых вариантах осуществления боль связана с мигренью. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба является достаточным для освобождения субъекта от боли в течение 2 часов после введения стабильной пероральной жидкой фармацевтической композиции. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба является достаточным, чтобы привести к частичному ослаблению боли у субъекта в течение 2 часов после введения стабильной пероральной жидкой фармацевтической композиции. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к освобождению от боли в течение 2 часов после введения по меньшей мере у 25% субъектов-людей, подвергнутых лечению. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к частичному ослаблению боли в течение 2 часов после введения по меньшей мере у 45% субъектов-людей, подвергнутых лечению.
В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к увеличению процента подвергнутых лечению субъектов-людей, получивших освобождение от боли через 2 часа после введения, который по меньшей мере на 40% больше по сравнению с процентом субъектов-людей, подвергнутых лечению плацебо. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к увеличению процента подвергнутых лечению субъектов-людей с частично ослабленной болью через 2 часа после введения, который по меньшей мере на 10% больше по сравнению с процентом субъектов-людей, подвергнутых лечению плацебо. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к увеличению процента подвергнутых лечению субъектов-людей, освобожденных от боли через 2 часа после введения, который по меньшей мере на 10% больше по сравнению с процентом субъектов-людей, подвергнутых лечению коммерчески доступными средствами для лечения боли, связанной с мигренью, такими как VIOXX 25 (25 мг), VIOXX 50 (50 мг) и CAMBIA 50 (50 мг). В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к увеличению процента подвергнутых лечению субъектов-людей с частично ослабленной болью через 2 часа после введения, который по меньшей мере на 10% больше по сравнению с процентом субъектов-людей, подвергнутых лечению коммерчески доступными средствами для лечения боли, связанной с мигренью, такими как VIOXX 25 (25 мг), VIOXX 50 (50 мг) и CAMBIA 50 (50 мг).
В некоторых вариантах осуществления, раскрытых в настоящем документе, способы обеспечения освобождения от боли у субъекта-человека, страдающего болью, включают введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба. В некоторых вариантах осуществления, раскрытых в настоящем документе, способы обеспечения освобождения от боли у субъекта-человека, страдающего болью, включают введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба.
В некоторых вариантах осуществления, раскрытых в настоящем документе, способы обеспечения освобождения от боли через 2 часа после введения субъекту-человеку, страдающему болью, включают введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба. В некоторых вариантах осуществления, раскрытых в настоящем документе, способы обеспечения освобождения от боли через 2 часа после введения субъекту-человеку, страдающему болью, включают введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба.
В некоторых вариантах осуществления способ обеспечения частичного освобождения от боли менее чем через около 2 ч после введения субъекту-человеку, страдающему болью, включает введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба. В некоторых вариантах осуществления способ обеспечения частичного ослабления боли менее чем через около 2 ч после введения субъекту-человеку, страдающему болью, включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба.
В некоторых вариантах осуществления способ обеспечения частичного ослабления боли менее чем через около 2 часа после введения субъекту-человеку, страдающему болью, включает введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом указанное частичное ослабление боли сохраняется в течение по меньшей мере около 4 часов. В некоторых вариантах осуществления способ обеспечения частичного ослабления боли менее чем через около 2 ч после введения субъекту-человеку, страдающему болью, включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом указанное частичное ослабление боли сохраняется в течение по меньшей мере около 4 часов.
В некоторых вариантах осуществления способ обеспечения частичного ослабления боли менее чем через около 2 часа после введения субъекту-человеку, страдающему болью, включает введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом указанное частичное ослабление боли представляет собой уменьшение интенсивности боли на ≥ 1 уровень согласно сообщениям субъекта-человека, страдающего болью, по сравнению с оценкой до введения по 4-бальной шкале оценки боли от 0 (без боли) до 3 (сильная боль). В некоторых вариантах осуществления способ обеспечения частичного ослабления боли менее чем через около 2 ч у субъекта-человека, страдающего болью, включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом указанное частичное ослабление боли представляет собой уменьшение интенсивности боли на ≥ 1 уровень согласно сообщениям субъекта-человека, страдающего болью, по сравнению с оценкой до введения по 4-бальной шкале оценки боли от 0 (без боли) до 3 (сильная боль).
В некоторых вариантах осуществления, раскрытых в настоящем документе, способ обеспечения освобождения от боли у субъекта-человека, страдающего болью, включает введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом освобождение от боли сохраняется в течение по меньшей мере от около 2 часов до около 24 часов. В некоторых вариантах осуществления, раскрытых в настоящем документе, способ обеспечения освобождения от боли у субъекта-человека, страдающего болью, включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом указанное освобождение от боли сохраняется в течение по меньшей мере от около 2 часов до около 24 часов.
В некоторых вариантах осуществления способ уменьшения наиболее беспокоящих симптомов у субъекта-человека, страдающего мигренью, включает введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом указанные наиболее беспокоящие симптомы уменьшаются в течение около 2 часов после введения указанной композиции. В некоторых вариантах осуществления способ уменьшения наиболее беспокоящих симптомов у субъекта-человека, страдающего мигренью, включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом указанные наиболее беспокоящие симптомы уменьшаются в течение около 2 часов после введения указанной композиции.
В одном аспекте вышеуказанного варианта осуществления способ обеспечивает сохранение освобождения от наиболее беспокоящих симптомов, связанных с мигренью, в течение по меньшей мере около 2-24 часов. В некоторых вариантах осуществления способ уменьшения наиболее беспокоящих симптомов у субъекта-человека, страдающего мигренью, включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом указанный способ обеспечивает сохранение освобождения от наиболее беспокоящих симптомов, связанных с мигренью, в течение по меньшей мере около 2-24 часов.
В некоторых вариантах осуществления, раскрытых в настоящем документе, предлагается применение стабильной пероральной жидкой фармацевтической композиции, раскрытой в любом из вариантов осуществления в данной заявке, для лечения боли у субъекта. В некоторых вариантах осуществления стабильная пероральная жидкая фармацевтическая композиция содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор в количестве от около 35 мас.% до около 45 мас.%, по меньшей мере один полярный растворитель в количестве от около 25 мас.% до около 42 мас.%, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом стабильная пероральная жидкая фармацевтическая композиция по существу не содержит ингибиторов осаждения. В некоторых вариантах осуществления боль связана с мигренью.
В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба является достаточным для освобождения субъекта от боли в течение 2 часов после введения стабильной пероральной жидкой фармацевтической композиции. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба является достаточным для того, чтобы привести к частичному ослаблению боли у субъекта в течение 2 часов после введения стабильной пероральной жидкой фармацевтической композиции.
В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к освобождению от боли через 2 часа по меньшей мере у 25% подвергнутых лечению субъектов-людей. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к частичному ослаблению боли через 2 часа по меньшей мере у 45% подвергнутых лечению субъектов-людей. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к увеличению процента подвергнутых лечению субъектов-людей, освобожденных от боли через 2 часа, который составляет по меньшей мере 40% по сравнению с процентом субъектов-людей, подвергнутых лечению плацебо. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к увеличению процента подвергнутых лечению субъектов-людей с частичным ослаблением боли через 2 часа, который составляет по меньшей мере 10% по сравнению с процентом субъектов-людей, подвергнутых лечению плацебо.
В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к увеличению процента подвергнутых лечению субъектов-людей, освобожденных от боли через 2 часа, который составляет по меньшей мере 10% по сравнению с процентом субъектов-людей, подвергнутых лечению коммерчески доступными средствами для лечения боли, связанной с мигренью, такими как VIOXX 25 (25 мг), VIOXX 50 (50 мг) и CAMBIA 50 (50 мг). В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к увеличению процента подвергнутых лечению субъектов-людей с частично ослабленной болью через 2 часа, который составляет по меньшей мере 10% по сравнению с процентом субъектов-людей, подвергнутых лечению коммерчески доступными средствами для лечения боли, связанной с мигренью, такими как VIOXX 25 (25 мг), VIOXX 50 (50 мг) и CAMBIA 50 (50 мг).
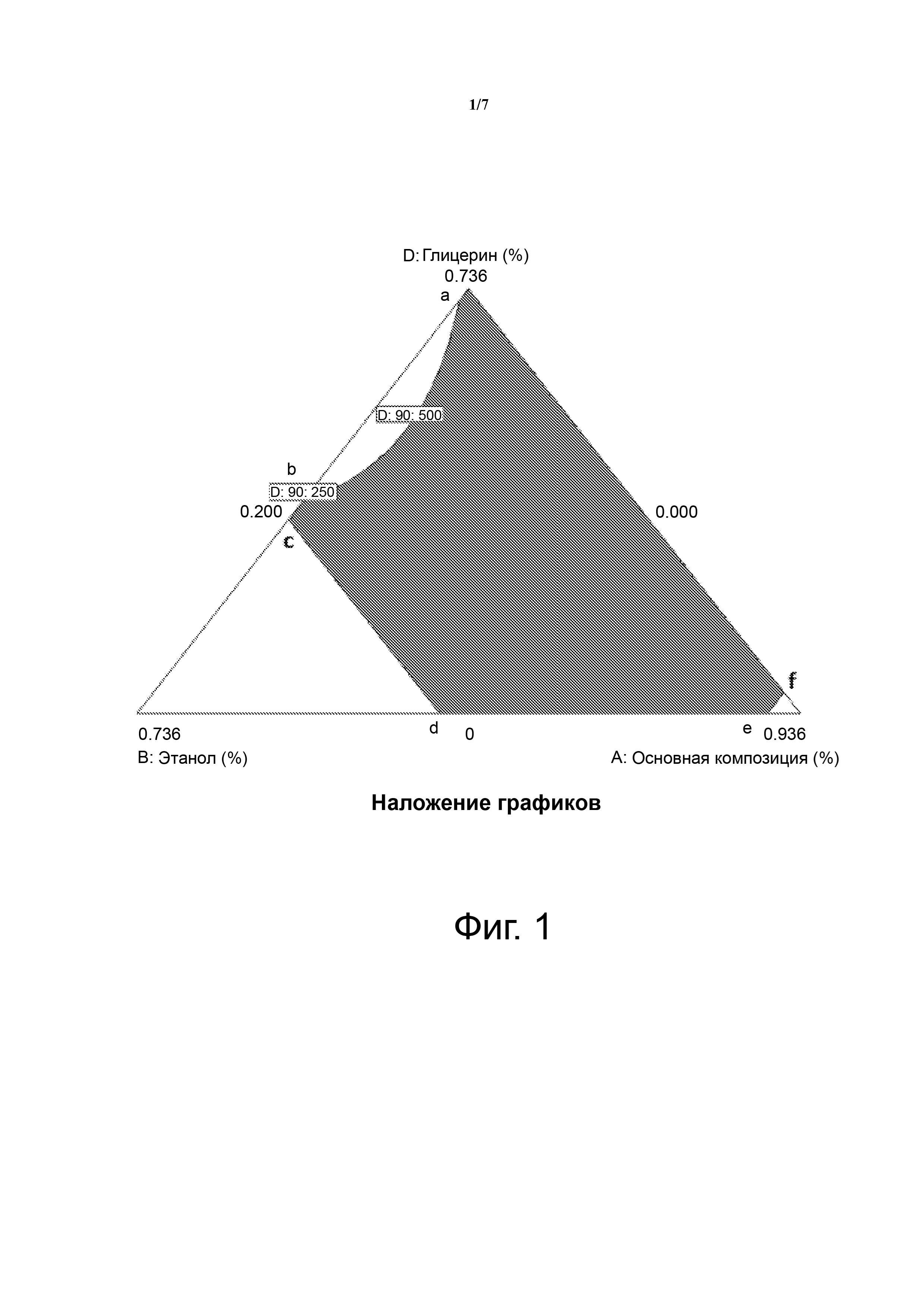
В некоторых вариантах осуществления, раскрытых в настоящем документе, предлагаются стабильные пероральные жидкие фармацевтические композиции целекоксиба, содержащие (i) терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид; и (ii) полярный растворитель, содержащий смесь этанола и глицерина; при этом композиция находится в заштрихованной области фазовой диаграммы, как показано на фигуре 1, при этом границы стабильной композиции определяются заштрихованной областью или областью, расположенной между соединительными линиями между шестью точками (a, b, c, d, e и f), при этом композиция содержит примерно 1-80 мас.% целекоксиба и соответствует массовому процентному соотношению основная композиция:этанол:глицерин 0,200:0,024:0,712 для a, 0,200:0,376:0,360 для b, 0,200:0,400:0,336 для c, 0,536:0,400:0,000 для d, 0,900:0,036:0,00 для e, и 0,900:0,00:0,036 для f.
В некоторых вариантах осуществления указанная композиция не проявляет какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при рН 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин при измерении через 60 минут. В некоторых вариантах осуществления композиция по существу не содержит ингибиторы осаждения, выбранные из группы, состоящей из привитого сополимера поливинилкапролактам-поливинилацетат-полиэтиленгликол (SOLUPLUS®), блок-сополимеров полиоксиэтилена-полиоксипропилена, плюроников, поливинилпирролидона и целлюлозных полимеров, включая гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. В некоторых вариантах осуществления по меньшей мере один солюбилизатор представляет собой полиэтоксилированное касторовое масло (доступное как KOLLIPHOR EL®), лаурил макроголглицерид (доступный как GELUCIRE® 44/14) или их комбинацию. В некоторых вариантах осуществления по меньшей мере один среднецепочечный глицерид представляет собой глицерил трикаприлат/трикапрат (доступный как CAPTEX® 300), глицерилмонокаприлат (доступный как CAPMUL® MCM C8) или их комбинацию.
В некоторых вариантах осуществления по меньшей мере один полярный растворитель выбран из группы, состоящей из пропиленгликоля, полиэтиленгликолей, имеющих молекулярную массу от 400 до 1000, глицерина, C2-C8моно- и полиспиртов (например, этанола), C7-C18 спиртов линейной или разветвленной конфигурации, воды и их смесей.
В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба составляет от около 1 мас.% до 80 мас.% целекоксиба в расчете на общую массу композиции.
В некоторых вариантах осуществления по меньшей мере один солюбилизатор присутствует в количестве от около 10 мас.% до около 70 мас.% в расчете на общую массу композиции. В некоторых вариантах осуществления массовое соотношение по меньшей мере одного солюбилизатора к целекоксибу варьирует от около 4,0:1,0 до около 20:1,0. В некоторых вариантах осуществления по меньшей мере один полярный растворитель присутствует в количестве от около 20 мас.% до около 80 мас.% в расчете на общую массу композиции. В некоторых вариантах осуществления массовое соотношение по меньшей мере одного солюбилизатора по меньшей мере к одному полярному растворителю варьирует от около 0,60:1,00 до около 1,8:1,00.
В некоторых вариантах осуществления по меньшей мере один среднецепочечный глицерид присутствует в количестве от около 5 мас.% до около 75 мас.% в расчете на общую массу композиции. В некоторых вариантах осуществления композиция имеет средний размер капель масла не более 500 нм при тестировании в 250 мл среды, имитирующей желудочный сок натощак (FaSSGF), при рН 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин. В некоторых вариантах осуществления композиция имеет вязкость от около 20 сП до около 1000 сП. В некоторых вариантах осуществления композиция имеет плотность от около 0,8 г/см3 до около 2 г/см3. В некоторых вариантах осуществления композиция имеет коэффициент пропускания по меньшей мере 40%. В некоторых вариантах осуществления композиция имеет рН от около 3 до около 7.
В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба по меньшей мере на около 40% меньше по сравнению со стандартными композициями целекоксиба, такими как CELEBREX® 400 мг в виде пероральных капсул. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба составляет около 240 мг. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба по меньшей мере на около 55% меньше по сравнению со стандартными композициями целекоксиба, такими как CELEBREX® 400 мг в виде пероральных капсул. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба составляет около 180 мг. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба по меньшей мере на около 70% меньше по сравнению со стандартными композициями, такими как CELEBREX® 400 мг в виде пероральных капсул. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба составляет около 120 мг.
В некоторых вариантах осуществления предлагаются стабильные пероральные жидкие фармацевтические композиции, которые при пероральном введении субъекту-человеку в условиях натощак обеспечивает по меньшей мере один из следующих фармакокинетических параметров:
AUC(0-15 мин) от около 10 нг.ч/мл до около 80 нг.ч/мл;
AUC(0-30 мин) от около 80 нг.ч/мл до около 400 нг.ч/мл;
AUC(0-1 час) от около 400 нг.ч/мл до около 1500 нг.ч/мл;
AUC(0-2 час) от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
AUC(0-t) по меньшей мере около 2000 нг.ч/мл;
AUC(0-∞) по меньшей мере около 2000 нг.ч/мл; и
Tlag не более 8 минут.
В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции содержат: a) терапевтически эффективное количество целекоксиба; b) по меньшей мере одно фармацевтически приемлемое вспомогательное вещество; c) по меньшей мере один солюбилизатор в количестве от около 35 мас.% до около 45 мас.%; и d) по меньшей мере один полярный растворитель в количестве от около 25 мас.% до около 42 мас.%, при этом солюбилизатор и полярный растворитель присутствуют в массовом соотношении от около 0,60:1 до около 1,8:1; и при этом стабильная пероральная жидкая фармацевтическая композиция имеет вязкость от около 20 сП до около 1000 сП, и плотность от около 0,8 г/см3 до около 2 г/см3.
В некоторых вариантах осуществления, раскрытых в настоящем документе, предлагаются способы лечения боли у субъекта-человека, при этом способ включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один полярный растворитель, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом стабильная пероральная жидкая фармацевтическая композиция по существу не содержит ингибиторов осаждения, при этом терапевтически эффективное количество целекоксиба является достаточным для освобождения субъекта от боли по меньшей мере на 24 часа после введения стабильной пероральной жидкой фармацевтической композиции.
В некоторых вариантах осуществления стабильная пероральная жидкая фармацевтическая композиция содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор в количестве от около 35 мас.% до около 45 мас.%, по меньшей мере один полярный растворитель в количестве от около 25мас.% до около 42 мас.%, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом стабильная пероральная фармацевтическая композиция по существу не содержит ингибиторов осаждения.
В некоторых вариантах осуществления боль связана с мигренью. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба является достаточным для освобождения субъекта от боли в течение 2 часов после введения стабильной пероральной жидкой фармацевтической композиции. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба является достаточным для того, чтобы привести к частичному ослаблению боли у субъекта в течение 2 часов после введения стабильной пероральной жидкой фармацевтической композиции. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к освобождению от боли по меньшей мере на 24 часа после лечения по меньшей мере у 25% подвергнутых лечению субъектов-людей. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к освобождению от боли по меньшей мере на 24 часа после лечения по меньшей мере у 45% подвергнутых лечению субъектов-людей. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к увеличение процента подвергнутых лечению субъектов-людей, у которых боль отсутствовала в течение по меньшей мере 24 часов после лечения, который составил по меньшей мере 40% по сравнению с процентом субъектов-людей, подвергнутых лечению плацебо. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к увеличению процента подвергнутых лечению субъектов-людей, у которых боль отсутствовала в течение по меньшей мере 24 часов после лечения, который составляет по меньшей мере 10% по сравнению с процентом субъектов-людей, подвергнутых лечению коммерчески доступными средствами для лечения боли, связанной с мигренью, такими как VIOXX 25 (25 мг), VIOXX 50 (50 мг) и CAMBIA 50 (50 мг).
В некоторых вариантах осуществления, раскрытых в настоящем документе, предлагаются способы лечения боли у субъекта-человека, при этом способ включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один полярный растворитель, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом стабильная пероральная жидкая фармацевтическая композиция по существу не содержит ингибиторов осаждения, обеспечивает по меньшей мере 30%, по меньшей мере 40% или по меньшей мере 50% субъектов-людей, не имеющих какого-либо наиболее беспокоящего симптома через 2 часа.
В некоторых вариантах осуществления, раскрытых в настоящем документе, предлагаются способы лечения боли у субъекта-человека, при этом способ включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один полярный растворитель, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом стабильная пероральная жидкая фармацевтическая композиция по существу не содержит ингибиторов осаждения, при этом терапевтически эффективное количество целекоксиба является достаточным для освобождения субъекта от наиболее беспокоящих симптомов в течение 2 часов после введения стабильной пероральной жидкой фармацевтической композиции. В некоторых вариантах осуществления стабильная пероральная жидкая фармацевтическая композиция содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор в количестве от около 35 мас.% до около 45 мас.%, по меньшей мере один полярный растворитель в количестве от около 25 мас.% до около 42 мас.%, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом стабильная пероральная жидкая фармацевтическая композиция по существу не содержит ингибиторов осаждения. В некоторых вариантах осуществления боль связана с мигренью.
В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба является достаточным для освобождения субъекта от боли в течение 2 часов после введения стабильной пероральной жидкой фармацевтической композиции. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба является достаточным для того, чтобы привести к частичному ослаблению боли у субъекта в течение 2 часов после введения стабильной пероральной жидкой фармацевтической композиции. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к освобождению от наиболее беспокоящих симптомов в течение 2 часов после лечения по меньшей мере у 25% подвергнутых лечению субъектов-людей. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к освобождению от наиболее беспокоящих симптомов в течение 2 часов после лечения по меньшей мере у 45% подвергнутых лечению субъектов-людей. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к увеличению процента подвергнутых лечению субъектов-людей, освободившихся от наиболее беспокоящих симптомов в течение 2 часов после лечения, который составляет по меньшей мере 40% по сравнению с процентом субъектов-людей, подвергнутых лечению с помощью плацебо. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к увеличению процента подвергнутых лечению субъектов-людей, освободившихся от наиболее беспокоящих симптомов в течение 2 часов после лечения, который составляет по меньшей мере 10% по сравнению с процентом субъектов-людей, подвергнутых лечению коммерчески доступными средствами для лечения боли, связанной с мигренью, такими как VIOXX 25 (25 мг), VIOXX 50 (50 мг) и CAMBIA 50 (50 мг).
Краткое описание чертежей
На фиг. 1 показана тройная фазовая диаграмма. Заштрихованная область представляет собой «область А стабильной композиции» и образована соединительными линиями между точками (a, b, c, d, e, a, и f).
На фиг. 2 показана тройная фазовая диаграмма. Заштрихованная область представляет собой «область В стабильной композиции» и образована соединительными линиями между точками (a, b, c, d, e и f).
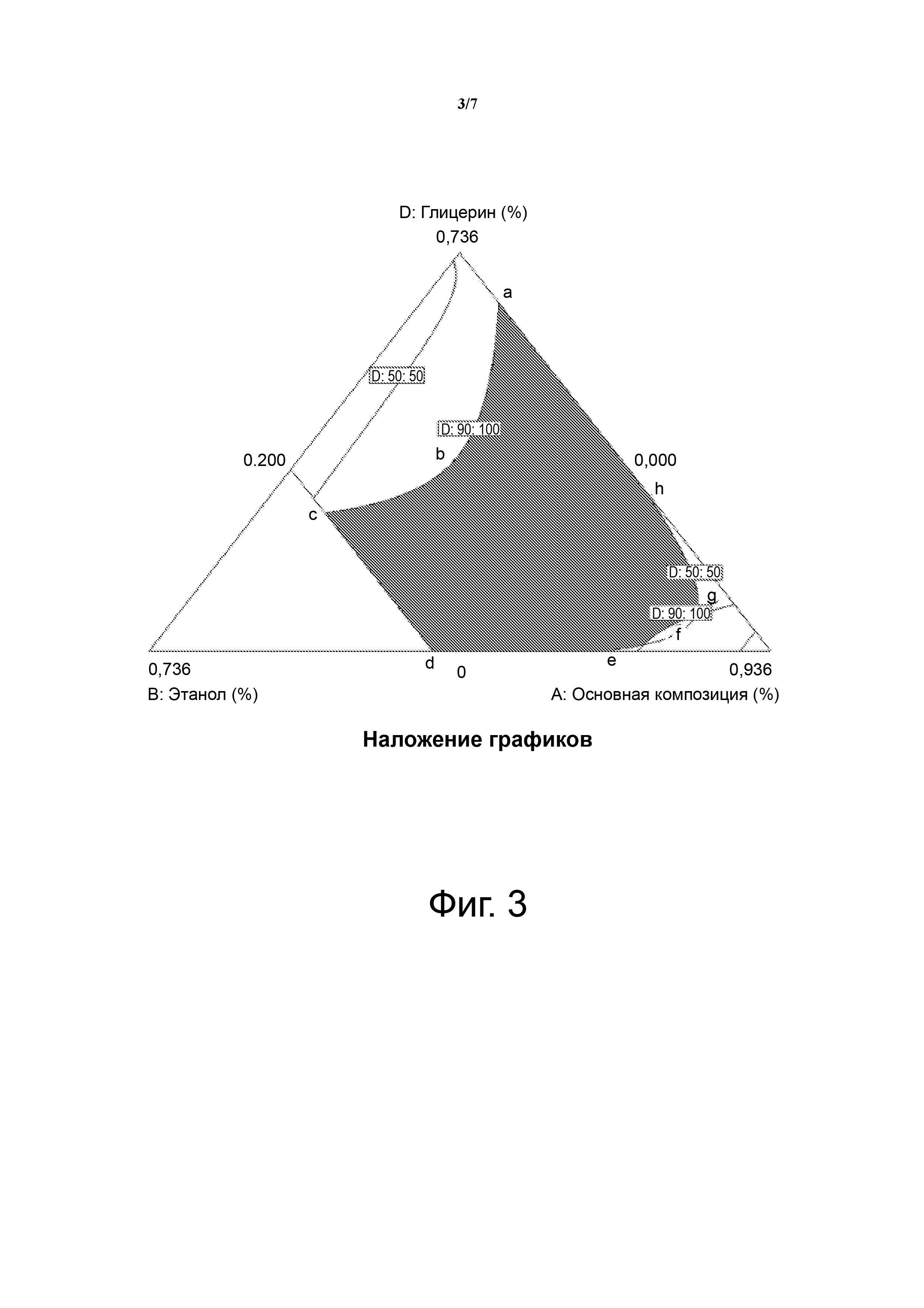
На фиг. 3 показана тройная фазовая диаграмма. Заштрихованная область представляет собой «область С стабильной композиции» и образована соединительными линиями между точками (a, b, c, d, e, f, g и h).
На фиг. 4 показано освобождение от боли у процента субъектов-людей через 2 часа после введения согласно Примеру 3 120 мг целекоксиба (Лечение-1) по сравнению с VIOXX 25, VIOXX 50 и CAMBIA 50.
На фиг. 5 показан процентное ослабление боли у процента субъектов-людей через 2 часа после введения согласно Примеру 3 120 мг целекоксиба (Лечение-1) по сравнению с VIOXX 25, VIOXX 50 и CAMBIA 50.
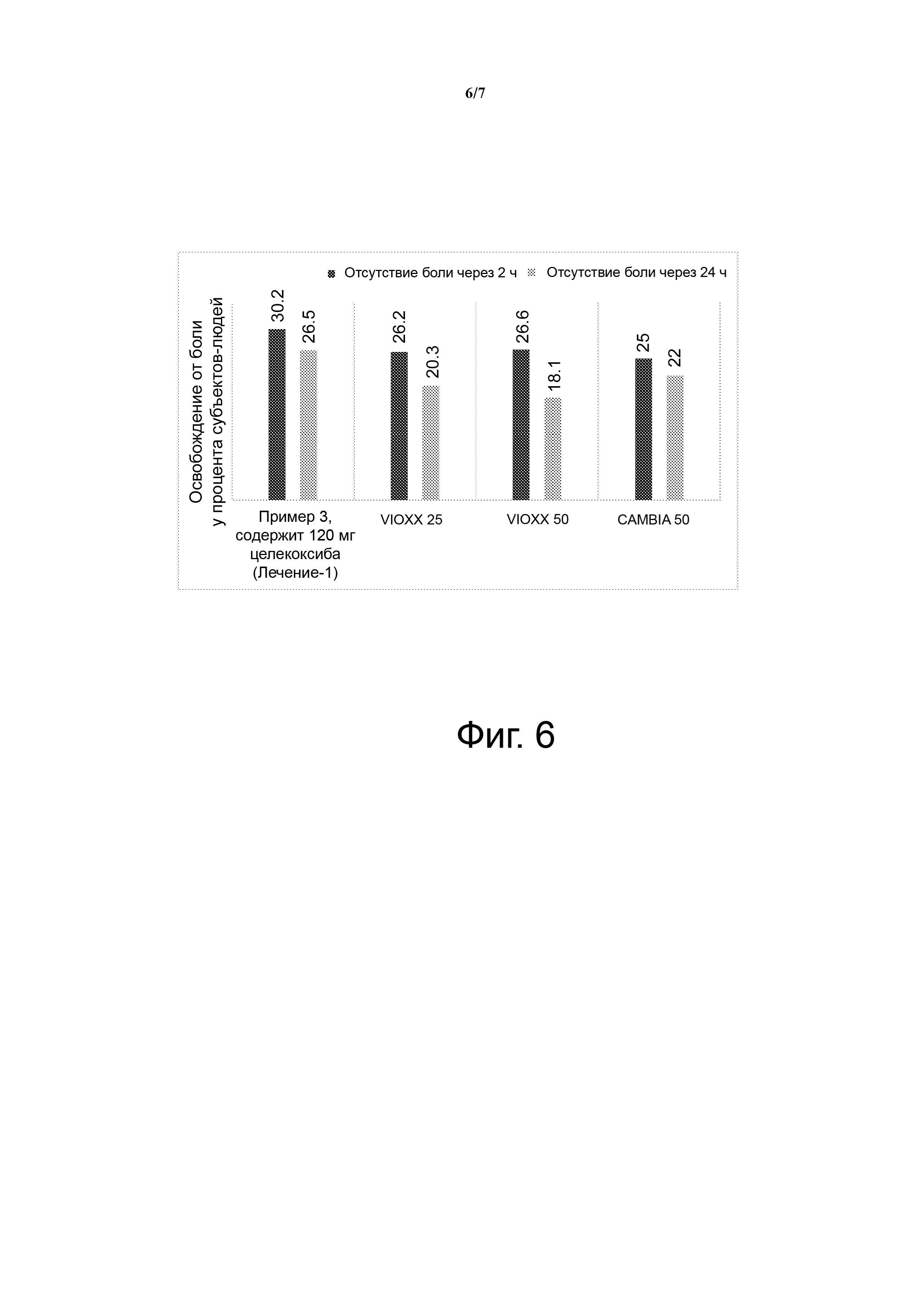
На фиг. 6 показано освобождение от боли у процента субъектов-людей через 2 часа и освобождение от боли через 24 часа после введения согласно Примеру 3 120 мг целекоксиба (Лечение-1) по сравнению с VIOXX 25, VIOXX 50 и CAMBIA 50.
На фиг. 7 показано освобождение от наиболее беспокоящих симптомов (MBS) у процента субъектов-людей через 2 часа после введения согласно Примеру 3 120 мг целекоксиба (Лечение-1).
Осуществление изобретения
Определения
Если не указано иначе, все технические и научные термины, использованные в настоящем документе, имеют те же самые значения, которые обычно понятны специалисту в данной области техники.
Используемый в настоящем документе термин «содержащий» является открытым и означает указанные элементы или их эквиваленты по структуре или функции и любой другой элемент или элементы, которые не указаны. Термины «имеющий» и «включающий» также должны рассматриваться как открытые, если контекст не предполагает иное.
Все диапазоны, указанные в настоящем документе, включают конечные точки, включая те, которые указывают диапазон «между» двумя значениями. В качестве иллюстрации, числовой диапазон от 1 до 5 должен интерпретироваться как включающий не только недвусмысленно указанные значения от 1 до 5, но также включающий отдельные значения и поддиапазоны в указанном диапазоне. Таким образом, включенными в этот числовой диапазон являются отдельные значения, например 2, 3 и 4, и поддиапазоны, например от 1 до 3, от 2 до 4 и от 3 до 5 и т.д., а также отдельно 1, 2, 3, 4 или 5. Этот же принцип применим для диапазонов, обозначающих только одно числовое значение как минимум или максимум.
Термины, используемые в настоящем документе, следует понимать как охватывающие множественное, а также единственное число. Например, ссылка на «вспомогательное вещество» включает ссылку на одно или несколько таких вспомогательных веществ, и ссылка на «носитель» включает ссылку на один или несколько таких носителей.
Термины, такие как «около», «вплоть до», «как правило», «по существу» и подобные термины, следует истолковывать как модифицирующие термин или значение таким образом, что оно не является абсолютным. Такие термины будут определяться обстоятельствами и условиями, которые они модифицируют, как те термины, которые понимаются специалистами в данной области. Эти термины указывают на аппроксимацию или некоторую величину отклонения, а не идеальную и абсолютную величину. Эти термины включают по меньшей мере степень ожидаемой экспериментальной ошибки, технической ошибки и погрешности измерения для данного эксперимента, способа или прибора, используемого для измерения значения. Эти термины могут относиться к более высокой переносимости отклонения в зависимости, например, от используемой экспериментальной методики. Указанные отклонения от указанного значения известны специалистам в данной области и находятся в рамках настоящего изобретения.
Используемый в настоящем документе термин «свободный от» конкретного соединения или композиций, или вспомогательных веществ относится к отсутствию какой-либо отдельно добавленной порции указанного соединения или композиции, или вспомогательных веществ. Термин «по существу не содержит» означает, что присутствует менее чем 1% (масса/масса) конкретного соединения или композиций, или вспомогательных веществ, при этом присутствующее количество не влияет на любое функциональное значение композиции.
«Целекоксиб», используемый в настоящем документе, охватывает форму основания, а также его фармацевтически приемлемые соли, комплексы, полиморфы, гидраты, сольваты, энантиомеры или рацематы. Твердая форма целекоксиба, используемая в композиции согласно настоящему изобретению, не является критической. Например, целекоксиб может быть аморфным или кристаллическим.
Используемый в настоящем документе термин «фармацевтически приемлемые соли» относится к таким солям, которые, в рамках проведенного медицинского заключения, пригодны для использования в контакте с тканями человека и низших животных без излишней токсичности, раздражения, аллергической реакции и т.д., которые хорошо известны в данной области. Эти соли могут быть получены in situ во время окончательного выделения и очистки соединений согласно изобретению, или отдельно проведением реакции фармацевтически активного вещества в виде свободного основания с подходящей органической или неорганической кислотой.
Используемый в настоящем документе термин «эффективное количество» или «терапевтически эффективное количество» лекарственного средства относится к нетоксичному, но достаточному количеству лекарственного средства для достижения терапевтических результатов в лечении состояния, для которого лекарственное средство, как известно, должно быть эффективным. В данном случае эффективное количество представляет собой некоторое количество целекоксиба, которое является достаточным для лечения боли у пациента, нуждающегося в этом, то есть обеспечивает некоторую степень анальгезии для уменьшения по меньшей мере ощущения боли у пациента.
Термин «жидкая композиция» относится к жидкой композиции, которую принимают внутрь, смешивая с водной или подходящей средой или без дополнительного смешивания перед пероральным введением.
Термин «стабильная композиция(и)», используемый в настоящем документе, относится к композиции, которая не демонстрирует какого-либо осаждения в среде, имитирующей желудочный сок (FaSSGF), при рН 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин по меньшей мере в течение 60 мин. Также, термин «стабильная композиция(и)» относится к композиции, которая после подвергания оценке стабильности при 40°С и 75% RH (относительная влажность) или 25°С и 60% RH (относительная влажность) практически не содержит примесей или содержит не более 5% примесей, или содержит примеси на уровнях, которые являются приемлемыми для регулирующих органов, таких как US FDA.
Термин «ингибитор осаждения», используемый в настоящем документе, относится к фармацевтически приемлемому вспомогательному веществу, которое предотвращает осаждение целекоксиба при пероральном введении субъекту-человеку, или при тестировании в среде, имитирующей желудочный сок, например, Fasted-State Simulated Gastric Fluid (FaSSGF), при рН 2,0, 37°С при перемешивании. Примеры ингибиторов осаждения включают: привитой сополимер поливинилкапролактам-поливинилацетат-полиэтиленгликоль (SOLUPLUS®), блок-сополимеры полиоксиэтилена и полиоксипропилена, плюроники, поливинилпирролидон и целлюлозные полимеры, включая гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Нецеллюлозные полимеры, которые ингибируют осаждение, также могут быть включены в возможные ингибиторы осаждения.
Используемый в настоящем документе термин «среда, имитирующая желудочный сок натощак (Fasted-State Simulated Gastric Fluid, FaSSGF)» относится к стандартному анализу in vitro, который используют для имитации среды желудочного сока натощак для оценки стабильности (или растворимости или пригодности) лекарственных форм для перорального введения. Композиция FaSSGF представляет собой 0,1N HCl с 0,05% SLS и pH, отрегулированным с помощью NaOH/HCl.
Используемый в настоящем документе термин «стандартная пероральная композиция целекоксиба» или «стандартная композиция» относится к пероральным капсулам целекоксиба, представленным на рынке под торговым названием CELEBREX® фирмы G.D. Searle LLC в США, или его фармацевтическим эквивалентам или его терапевтическим эквивалентам, или одобренным позже лекарственным средствам, обозначенным АВ по оценкам US FDA согласно Approved Drug Products with Therapeutic Equivalence Evaluations (34th edition), или лекарственным средствам, получившим разрешение на маркетинг US FDA посредством подачи Abbreviated New Drug Application (ANDA) путем установления биоэквивалентности такому Продукту. В некоторых вариантах осуществления CELEBREX® включает его терапевтические или фармацевтические эквиваленты, одобренные US FDA. CELEBREX® является торговой маркой, зарегистрированной и принадлежащей фирме G.D. Searle LLC (Division of Pfizer Inc. NY), NY 10017, USA. В некоторых других вариантах осуществления «стандартная пероральная композиция целекоксиба» или «стандартная композиция» также включает пероральные капсулы целекоксиба, представленные на рынке под торговым названием ZYCEL® фирмы Zydus Cadila, Zydus Tower, Ahmedabad, India. CELEBREX® доступен в виде пероральных капсул, содержащих целекоксиб в дозе 50 мг, 100 мг, 200 мг и 400 мг. ZYCEL® представлен в виде пероральных капсул, содержащих целекоксиб в дозе 100 мг и 200 мг.
Используемый в настоящем документе термин «боль» относится к боли, такой как указанная в настоящем документе острая боль; боль, связанная с мигренью; кластерная головная боль; невропатическая боль; послеоперационная боль; хроническая боль в пояснице; герпетическая невралгия; фантомная боль в ампутированной конечности; центральная боль; зубная боль; невропатическая боль; боль, устойчивая к опиоидным средствам; висцеральная боль; хирургическая боль; боль, вызванная повреждением кости; боль во время родовых схваток и родоразрешения; боль, вызванная ожогами, в том числе солнечными ожогами; послеродовая боль; боль при стенокардии; и боль, связанная с мочеполовым трактом, в том числе цистит; боль, вызванная артритом; боль, вызванная воспалением; боль, вызванная остеоартритом; боль, вызванная ювенильным ревматоидным артритом; боль, вызванная анкилозирующим спондилитом; боль, вызванная первичной дисменореей; «прорывная» боль; или любой вид боли, связанной с раком.
Используемый в настоящем документе термин «лечение» включает лечение и/или профилактику физического и/или психического состояния, или улучшение, или устранение однажды диагностированного состояния, или ослабление характерных симптомов такого состояния.
Используемый в настоящем документе термин «млекопитающее» относится к классу млекопитающих высших позвоночных. Термин «млекопитающее» включает, но без ограничения, человека.
Используемый в настоящем документе термин «отсутствие боли» или «освобождение от боли» относится к сообщениям пациента об отсутствии боли по цифровой шкале оценки боли в диапазоне от 0 (нет боли) до 3 (сильная боль), в соответствии с Guidelines for controlled trials of drugs in migraine: Third edition. A guide for investigators” Tfelt-Hansen P, Pascual J, Ramadan N, et al. Cephalalgia, 2012; 32(1):6-38.
Используемый в настоящем документе термин «ослабление головной боли» или «частичное ослабление боли», или «частично ослабленная» или «ослабление боли» относится к сообщениям пациента о боли, интенсивность которой ≥ 1 уровень ниже по сравнению с оценкой перед дозированием по цифровой шкале оценки боли в диапазоне от 0 (нет боли) до 3 (сильная боль), в соответствии с “Guidelines for controlled trials of drugs in migraine: Third edition. A guide for investigators” Tfelt-Hansen P, Pascual J, Ramadan N, et al. Cephalalgia, 2012; 32(1):6-38.
Когда термин «сохраняется» используется в настоящем документе в отношении отсутствия боли или ослабления боли в течение некоторого периода времени, указанный период времени измеряется от начала освобождения от боли, ослабления боли. Например, если отсутствие боли сохраняется в течение по меньшей мере 2 часов, то этот период времени измеряется от момента времени после введения, когда пациент не испытывает боли. Таким образом, если пациент не испытывает боли через 2 часа после введения, то период времени, в течение которого сохраняется отсутствие боли, измеряется с момента времени, составляющего 2 часа после введения.
Дополнительно к «боли» или «головной боли», испытываемой пациентом, страдающим мигренью, пациент обычно страдает другими «наиболее беспокоящими симптомами», которые являются уникальными для пациента и основаны на сообщении пациента, выявляющего такие наиболее беспокоящие симптомы, как понимается в данной области. Такие симптомы включают, но без ограничения, тошноту, рвоту, фотофобию (светочувствительность) и фонофобию (звукочувствительность). Другие примеры таких симптомов включают, но без ограничения, чувствительность к запаху, чувствительность к прикосновению, размытое зрение и другие визуальные явления, головокружение, обморок, вертиго и изменения настроения.
Стабильные пероральные жидкие фармацевтические композиции
В некоторых вариантах осуществления в настоящем изобретении предлагаются стабильные пероральные жидкие фармацевтические композиции, содержащие терапевтически эффективное количество целекоксиба. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, содержат по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечнй глицерид, по меньшей мере один полярный растворитель и/или по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
Без привязки к какой-либо конкретной теории предполагается, что стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, продемонстрировали улучшенные характеристики солюбилизации, например, при пероральном введении субъекту-человеку. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, описанные в настоящем документе, не показали какого-либо осаждения в среде, имитирующей желудочный сок (SGF), в течение длительного времени. Например, стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, не показывают какого-либо осаждения в среде, имитирующей желудочный сок (SGF), в течение по меньшей мере 10 минут, по меньшей мере 20 минут, по меньшей мере 30 минут, по меньшей мере 40 минут, по меньшей мере 50 минут, по меньшей мере 60 мин, по меньшей мере 90 мин, по меньшей мере 2 ч, по меньшей мере 3 ч, по меньшей мере 4 ч, по меньшей мере 5 ч, по меньшей мере 6 ч, по меньшей мере 12 ч, по меньшей мере 24 ч или более. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, не показывают какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), в течение длительного времени. Например, стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, не показывают какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), в течение по меньшей мере 10 мин, по меньшей мере 20 мин, по меньшей мере 30 мин, по меньшей мере 40 мин, по меньшей мере 50 мин, по меньшей мере 60 мин, по меньшей мере 90 мин, по меньшей мере 2 ч, по меньшей мере 3 ч, по меньшей мере 4 ч, по меньшей мере 5 ч, по меньшей мере 6 ч, по меньшей мере 12 ч, по меньшей мере 24 ч или более.
В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, не показывают какого-либо осаждения в среде с низким значением рН. Например, стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, не показывают какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при рН 1,0-6,0 в течение по меньшей мере 10 мин, по меньшей мере 20 мин, по меньшей мере 30 мин, по меньшей мере 40 мин, по меньшей мере 50 мин, по меньшей мере 60 мин, по меньшей мере 90 мин, по меньшей мере 2 ч, по меньшей мере 3 ч, по меньшей мере 4 ч, по меньшей мере 5 ч, по меньшей мере 6 ч, по меньшей мере 12 ч, по меньшей мере 24 ч или более. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, не показывают какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при рН 1,0-5,0 в течение по меньшей мере 10 мин, по меньшей мере 20 мин, по меньшей мере 30 мин, по меньшей мере 40 мин, по меньшей мере 50 мин, по меньшей мере 60 мин, по меньшей мере 90 мин, по меньшей мере 2 ч, по меньшей мере 3 ч, по меньшей мере 4 ч, по меньшей мере 5 ч, по меньшей мере 6 ч, по меньшей мере 12 ч, по меньшей мере 24 ч или более. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, не показывают какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при рН 1,0-4,0 в течение по меньшей мере 10 мин, по меньшей мере 20 мин, по меньшей мере 30 мин, по меньшей мере 40 мин, по меньшей мере 50 мин, по меньшей мере 60 мин, по меньшей мере 90 мин, по меньшей мере 2 ч, по меньшей мере 3 ч, по меньшей мере 4 ч, по меньшей мере 5 ч, по меньшей мере 6 ч, по меньшей мере 12 ч, по меньшей мере 24 ч или более. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, не проявляют какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при рН 1,0-3,0 в течение по меньшей мере 10 мин, по меньшей мере 20 мин, по меньшей мере 30 мин, по меньшей мере 40 мин, по меньшей мере 50 мин, по меньшей мере 60 мин, по меньшей мере 90 мин, по меньшей мере 2 ч, по меньшей мере 3 ч, по меньшей мере 4 ч, по меньшей мере 5 ч, по меньшей мере 6 ч, по меньшей мере 12 ч, по меньшей мере 24 ч или более. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, не проявляют какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при рН 2,0-3,0 в течение по меньшей мере 10 мин, по меньшей мере 20 мин, по меньшей мере 30 мин, по меньшей мере 40 мин, по меньшей мере 50 мин, по меньшей мере 60 мин, по меньшей мере 90 мин, по меньшей мере 2 ч, по меньшей мере 3 ч, по меньшей мере 4 ч, по меньшей мере 5 ч, по меньшей мере 6 ч, по меньшей мере 12 ч, по меньшей мере 24 ч или более. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, не показывают какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при рН 2,0 в течение по меньшей мере 10 мин, по меньшей мере 20 мин, по меньшей мере 30 мин, по меньшей мере 40 мин, по меньшей мере 50 мин, по меньшей мере 60 мин, по меньшей мере 90 мин, по меньшей мере 2 ч, по меньшей мере 3 ч, по меньшей мере 4 ч, по меньшей мере 5 ч, по меньшей мере 6 ч, по меньшей мере 12 ч, по меньшей мере 24 ч или более.
Без привязки к какой-либо конкретной теории, стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, по существу не содержат каких-либо ингибиторов осаждения. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, полностью свободны от каких-либо ингибиторов осаждения. В некоторых вариантах осуществления композиция целекоксиба согласно настоящему изобретению по существу не содержит ингибиторов осаждения, таких как блоксополимеры полиоксиэтилена-полиоксипропилена, плюроники, поливинилпирролидон, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке по существу не содержат ингибиторов осаждения, включая привитой сополимер поливинилкапролактам-поливинилацетат-полиэтиленгликол (SOLUPLUS®), блоксополимеры полиоксиэтилена-полиоксипропилена, плюроники, поливинилпирролидон, целлюлозные полимеры, включая гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу, и нецеллюлозные полимеры.
В некоторых вариантах осуществления в настоящей заявке предлагается стабильная пероральная фармацевтическая композиция, содержащая терапевтически эффективное количество целекоксиба, при этом указанная композиция обеспечивает средний размер капель масла не более 500 нм при тестировании в 250 мл среды, имитирующей желудочный сок натощак (FaSSGF), при рН 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин.
В некоторых вариантах осуществления в настоящей заявке предлагается стабильная пероральная фармацевтическая композиция, содержащая терапевтически эффективное количество целекоксиба, при этом указанная композиция не показывает какого-либо осаждения в среде растворения или среде, имитирующей желудочный сок натощак (FaSSGF), при рН 2,0, температуре 37°C ± 0.5°C и перемешивании со скоростью 50 об/мин при измерении через 30 мин или 60 мин, или 90 мин, или 120 мин, или 180 мин, или 240 мин; и указанная композиция по существу не содержит ингибиторов осаждения, таких как блоксополимеры полиоксиэтилена-полиоксипропилена, плюроники, поливинилпирролидон, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза.
В некоторых вариантах осуществления в настоящей заявке предлагается стабильная пероральная жидкая фармацевтическая композиция, содержащая терапевтически эффективное количество целекоксиба, при этом указанная композиция не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при рН 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин при измерении через 30 мин или 60 мин, или 90 мин, или 120 мин, или 180 мин, или 240 мин; и указанная композиция по существу не содержит ингибиторов осаждения, таких как блоксополимеры полиоксиэтилена-полиоксипропилена, плюроники, поливинилпирролидон, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза.
В некоторых вариантах осуществления в настоящей заявке предлагается стабильная пероральная фармацевтическая композиция, содержащая терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при рН 2,0, температуре 37°C ± 0.5°C и перемешивании со скоростью 50 об/мин при измерении через 30 мин или 60 мин, или 90 мин, или 120 мин, или 180 мин, или 240 мин; и указанная композиция по существу не содержит ингибиторов осаждения, таких как блоксополимеры полиоксиэтилена-полиоксипропилена, плюроники, поливинилпирролидон, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза.
В некоторых вариантах осуществления в настоящей заявке предлагается стабильная пероральная жидкая фармацевтическая композиция, содержащая терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при рН 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин при измерении через 30 мин или 60 мин, или 90 мин, или 120 мин, или 180 мин, или 240 мин; и указанная композиция по существу не содержит ингибиторов осаждения, таких как блоксополимеры полиоксиэтилена-полиоксипропилена, плюроники, поливинилпирролидон, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза.
Пероральная фармацевтическая композиция целекоксиба согласно настоящей заявке может быть составлена в форме раствора, суспензии, эмульсии или жидкой смеси.
Среднецепочечные глицериды
В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции согласно настоящей заявке, кроме того, содержат по меньшей мере один среднецепочечный глицерид. Используемый в настоящем документе среднецепочечный глицерид может относиться к среднецепочечному моноглицериду, среднецепочечному биглицериду и/или среднецепочечному триглицериду (МСТ). МСТ представляют собой триглицериды, жирные кислоты которых имеют алифатический хвост из 6-12 атомов углерода. МСТ состоят из глицеринового скелета и трех жирных кислот. В случае МСТ, 2 или 3 из цепей жирных кислот, присоединенных к глицерину, являются среднецепочечными по длине. Иллюстративные среднецепочечные жирные кислоты включают капроновую кислоту, каприловую кислоту, каприновую кислоту, лауриновую кислоту и т.д. Следует понимать, что среднецепочечные глицериды, такие как МСТ, могут повышать растворимость стабильных пероральных жидких фармацевтических композиций, раскрытых в настоящем документе, при пероральном введении субъекту-человеку, или в среде, имитирующей желудочный сок, например, среде, имитирующей желудочный сок натощак (FaSSGF).
Среднецепочечный глицерид может присутствовать в стабильных пероральных жидких фармацевтических композициях, раскрытых в настоящем документе, в различных концентрациях. Например, стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, могут содержать среднецепочечный глицерид в количестве по меньшей мере 10 мас.%, по меньшей мере 20 мас.%, по меньшей мере 30 мас.%, по меньшей мере 40 мас.%, по меньшей мере 50 мас.%, по меньшей мере 60 мас.%, по меньшей мере 70 мас.%, по меньшей мере 80 мас.%, по меньшей мере 90 мас.% или массовый процент между любыми двумя из указанных выше значений в расчете на общую массу композиции.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат по меньшей мере один среднецепочечный глицерид в количестве от около 5 мас.% до около 75 мас.% или от около 5 мас.% до около 65 мас.%, или от около 5 мас.% до около 55 мас.%, или от около 5 мас.% до около 45 мас.%, или от около 5 мас.% до около 35 мас.% в расчете на общую массу композиции.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке, кроме того, содержат среднецепочечные глицериды, имеющие по меньшей мере один среднецепочечный моно- или ди- или триглицерид, или их смеси.
Подходящие примеры среднецепочечного моно- или ди- или триглицерида (MCT), используемого в композициях согласно настоящей заявке, хорошо известны в данной области. Неограничивающие примеры среднецепочечного моно-или ди- или триглицерида (МСТ) включают, но без ограничения, жирные кислоты как с четным, так и нечетным числом атомов углерода, такие как жирные кислоты, содержащие С4 (масляная кислота, бутановая кислота), С5 (валериановая кислота), С6 (капроновая кислота, гексановая кислота), C7 (гептановая кислота), C8 (каприловая кислота, октановая кислота), C9 (пеларгоновая кислота), С10 (каприновая кислота, декановая кислота), С11 (ундекановая кислота) или C12 (лауриновая кислота, додекановая кислота), и глицериновые сложные эфир жирных кислот с четным и нечетным числом атомов углерода (содержащей от двух до двенадцати атомов углерода), такие как глицерилмонокаприлат, глицерилдикаприлат, пропиленгликоль гептаноат, глицерилмонокапрат, глицерил каприлат/капрат, среднецепочечные моно- и диглицериды, доступные как CAPMUL MCM®, пропиленгликоль монокаприлат и дикаприлат, глицерилтрикаприлат, глицерин трикаприлат/капрат, глицерил трикаприлат/трикапрат, глицерил трикаприлат/трикапрат, PEG-8 каприловые/каприновые глицериды. Кроме того, среднецепочечный глицеридный компонент может представлять собой композицию, содержащую природные моно- или ди- или триглицериды, например, полученные из молочного жира, соевого масла, кокосового масла и т.п.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат по меньшей мере один среднецепочечный глицерид, выбранный из группы, состоящей из лауроилмакроголглицеридов, глицерилмонокаприлата, глицерил трикаприлата/трикапрата или их смесей.
Альтернативно, указанный глицеридный компонент может содержать по меньшей мере один промышленно полученный глицерид или смесь встречающихся в природе и промышленно полученных глицеридов. Указанный глицерид может быть получен переэтерификацией С4-С12 жирных кислот, таких как каприлокапроил макрогол-8 глицериды.
Полярные растворители
В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции согласно настоящей заявке, кроме того, содержат по меньшей мере один полярный растворитель. Без привязки к какой-либо конкретной теории, добавление полярного растворителя в композиции целекоксиба согласно настоящей заявке дополнительно помогает отсрочить начало времени осаждения. В некоторых вариантах осуществления начало осаждения является отсроченным по меньшей мере на около 1-10 часов по сравнению с композициями целекоксиба, которые по существу не содержат полярного растворителя. В некоторых вариантах осуществления полярный растворитель может отсрочить начало осаждения по меньшей мере примерно на 1 час, по меньшей мере примерно на 2 часа, по меньшей мере примерно на 3 часа, по меньшей мере примерно на 4 часа, по меньшей мере примерно на 5 часов, по меньшей мере примерно на 6 часов или более.
Подходящие примеры полярного растворителя, которые могут быть использованы в настоящей заявке, выбраны из группы, включающей пропиленгликоль, полиэтиленгликоли, имеющие молекулярную массу от 400 до 1000, глицерин, С2-С8 моно- и полиспирты, такие как этанол, и т.д., С7-С18 спирты линейной или разветвленной конфигурации, воду и любую их комбинацию.
Полярный растворитель может присутствовать в стабильных пероральных жидких фармацевтических композициях, раскрытых в настоящем документе, в различных концентрациях. Например, стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, могут содержать полярный растворитель в количестве по меньшей мере 10 мас.%, по меньшей мере 20 мас.%, по меньшей мере 30 мас.%, по меньшей мере 40 мас.%, по меньшей мере 50 мас.%, по меньшей мере 60 мас.%, по меньшей мере 70 мас.%, по меньшей мере 80 мас.%, по меньшей мере 90 мас.% или массовый процент между любыми двумя из указанных выше значений в расчете на общую массу композиции.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат полярный растворитель в количестве от около 20 мас.% до около 80 мас.% или от около 20 мас.% до около 70 мас.%, или от около 20 мас.% до около 60 мас.%, или от около 20 мас.% до около 50 мас.%, или от около 20 мас.% до около 40 мас.% в расчете на общую массу композиции.
Солюбилизаторы
В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции согласно настоящей заявке содержат по меньшей мере. один солюбилизатор, выбранный из группы неионных, анионных, катионных и цвиттерионных поверхностно-активных веществ или их смесей.
Подходящие неограничивающие примеры солюбилизатора(ов), используемого в композициях согласно настоящей заявке, включают, но без ограничения, полиэтоксилированные жирные кислоты, такие как сложные эфиры лауриновой кислоты, олеиновой кислоты и стеариновой кислоты, сложные диэфиры жирных кислот и полиэтиленгликоля (PEG), такие как PEG-20 дилаурат, смеси сложных моно- и диэфиров жирных кислот и PEG, продукты переэтерификации масла спиртом, такие как PEG-35 касторовое масло, полиоксил 35 касторовое масло, полиоксил 40 гидрогенизированное касторовое масло и т.д., обработанные полиглицерином жирные кислоты, такие как полиглицерилолеат и т.д., сложные эфиры жирных кислот и пропиленгликоля , такие как монолаурат пропиленгликоля и т.д., смеси сложных эфиров пропиленгликоля и сложных эфиров глицерина, такие как сложные эфиры олеиновой кислоты и пропиленгликоля и глицерина, и т.д., стеролы и производные стеролов, такие как PEG-24-холестериновый эфир и т.д., сложные сорбитановые эфиры полиэтиленгликоля и жирных кислот, такие как PEG-20 монолаурат сорбитана и т.д., алкиловые эфиры полиэтиленгликоля, такие как PEG-3 олеиловый эфир и т.д., сложные эфиры сахаров, такие как монопальмитат сахарозы и т.д., соединения полиэтиленгликоля с алкилфенолами, такие как октоксинол-1 и т.д., сложные эфиры сорбитана и жирных кислот, такие как монолаурат сорбитана, сложные эфиры низших спиртов и жирных кислот, такие как этилолеат и т.д., анионные поверхностно-активные вещества включают соли жирных кислот и соли желчных кислот. Дополнительные иллюстративные солюбилизаторы включают, но без ограничения: полиоксиэтилен-алкиловые эфиры; сложные эфиры жирных кислот и полиэтиленгликоля; сложные эфиры жирных кислот, глицерина и полиэтиленгликоля; сложные эфиры полиоксиэтиленсорбитана и жирных кислот; сложные эфиры полиглицерина и жирных кислот; полиоксиэтиленовые глицериды; полиоксиэтиленовые растительные масла; полиоксиэтиленовые гидрогенизированные растительные масла, алкилглюкозиды; алкилмальтозиды; алкилтиоглюкозиды; лаурилмакроголглицериды. Ионные поверхностно-активные вещества включают олеат натрия, лаурилсульфат натрия, лаурилсаркозинат натрия, диоктилсульфосукцинат натрия, холат натрия и таурохолат натрия; Gelucire® 44/14 и т.д.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат по меньшей мере один солюбилизатор, выбранный из группы, состоящей из рицинолеата полиэтиленгликоля, рицинолеата макроголглицерина Ph.Eur., полиоксил 35 касторового масла, лауроил полиоксил-32 глицеридов, лауроил макрогол-32 глицеридов, полиоксил 40 гидрогенизированного касторового масла, полиоксил 35 касторового масла, PEG-40 гидрогенизированного касторового масла или их смесей.
По меньшей мере один солюбилизатор может присутствовать в стабильных пероральных жидких фармацевтических композициях, раскрытых в настоящем документе, в различных концентрациях. Например, стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, могут содержать по меньшей мере один солюбилизатор в количестве по меньшей мере 10 мас.%, по меньшей мере 20 мас.%, по меньшей мере 30 мас.%, по меньшей мере 40 мас.%, по меньшей мере 50 мас.%, по меньшей мере 60 мас.%, по меньшей мере 70 мас.%, по меньшей мере 60 мас.%, по меньшей мере 70 мас.%, по меньшей мере 60 мас.%, по меньшей мере 70 мас.%, по меньшей мере 60 мас.%, по меньшей мере 70 мас.%, по меньшей мере 60 мас.%, по меньшей мере 70 мас.%, по меньшей мере 80 мас.%, по меньшей мере 90 мас.% или массовом проценте между любыми двумя из указанных выше значений в расчете на общую массу композиции. В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит по меньшей мере один солюбилизатор в количестве от около 10 мас.% до около 70 мас.% или от около 20 мас.% до около 60 мас.%, или от около 20 мас.% до около 50 мас.%, или от около 30 мас.% до около 40 мас.% в расчете на общую массу композиции.
В некоторых аспектах вышеуказанных вариантов осуществления композиция целекоксиба согласно настоящей заявке содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00.
В другом аспекте вышеуказанных вариантов осуществления настоящая заявка обеспечивает стабильную жидкую пероральную фармацевтическую композицию целекоксиба, содержащую терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор и по меньшей мере один полярный растворитель, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00.
В некоторых аспектах вышеуказанных вариантов осуществления настоящая заявка обеспечивает стабильную пероральную жидкую фармацевтическую композицию целекоксиба, содержащую терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00.
В одном аспекте вышеуказанных вариантов осуществления композиции согласно настоящей заявке содержат целекоксиб в количестве от около 1 мас.% до около 80 мас.% или от около 2 мас.% до около 70 мас.%, или от около 2 мас.% до около 50 мас.%, или от около 2 мас.% до около 40 мас.%, или от около 2 мас.% до около 8 мас.% в расчете на общую массу композиции.
В некоторых вариантах осуществления настоящая заявка обеспечивает стабильную пероральную жидкую фармацевтическую композицию целекоксиба, содержащую терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и целекоксиб в массовом соотношении от около 4,0:1,0 до около 20:1,0.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат по меньшей мере один среднецепочечный глицерид и целекоксиб в массовом соотношении от около 2,0:1,0 до около 20:1,0. В некоторых вариантах осуществления композиции согласно настоящей заявке содержат по меньшей мере один среднецепочечный глицерид и целекоксиб в массовом соотношении от около 2,0:1,0 до около 10,0:1,0.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат по меньшей мере один солюбилизатор и по меньшей мере один среднецепочечный глицерид в массовом соотношении от около 0,05:1,0 до около 20:1,0. В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит по меньшей мере один солюбилизатор и по меньшей мере один среднецепочечный глицерид в соотношении от около 0,05:1,0 до около 10,0:1,0.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит по меньшей мере один солюбилизатор и целекоксиб в массовом соотношении от около 4,0:1,0 до около 20:1,0.
В некоторых вариантах осуществления в настоящей заявке предлагается фармацевтическая композиция целекоксиба, содержащая:
а. терапевтически эффективное количество целекоксиба;
b. по меньшей мере один солюбилизатор в количестве от около 35 мас.% до около 45 мас.%;
с. по меньшей мере один полярный растворитель в количестве от около 25 мас.% до около 42 мас.%; и
d. по меньшей мере одно фармацевтически приемлемое вспомогательное вещество,
при этом указанный солюбилизатор и полярный растворитель присутствуют в массовом соотношении от около 0,60:1,00 до около 1,8:1,00 и не показывают какого-либо осаждения в среде, имитирующий желудочный сок натощак (FaSSGF) при рН 2,0, температуре 37°C ± 0.5°C и перемешивании со скоростью 50 об/мин в течение по меньшей мере 60 мин.
Улучшенные фармакокинетические параметры
Стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, могут иметь различные фармакокинетические параметры. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, могут иметь улучшенный фармакокинетический параметр по сравнению со стандартной пероральной композицией целекоксиба, такой как AUC(0-15 мин), AUC(0-30 мин), AUC(0-1 час), AUC(0-2 час), AUC(0-t), AUC(0-∞), Tlag, Tmax, и т.д.
В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, при пероральном введении субъекту-человеку натощак обеспечивают значение Tlag, которое составляет не более 60 минут, не более 30 минут, не более 20 минут, не более 10 минут, не более 8 минут, не более 6 минут, не более 5 минут, не более 4 минут, не более 3 минут, не более 2 минут, не более 1 минуты или меньше. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, при пероральном введении субъекту-человеку натощак обеспечивают значение Tmax, которое составляет менее чем около 120 минут, менее чем около 90 минут, менее чем около 80 минут, менее чем около 70 минут, менее чем около 60 минут, менее чем около 50 минут, менее чем около 40 минут, менее чем около 30 минут, менее чем около 20 минут или меньше. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, при пероральном введении субъекту-человеку натощак обеспечивают значение AUC(0-15 мин), которое составляет по меньшей мере около 1 нг.ч/мл, по меньшей мере около 2 нг.ч/мл, по меньшей мере около 5 нг.ч/мл, по меньшей мере около 10 нг.ч/мл, по меньшей мере около 20 нг.ч/мл, по меньшей мере около 30 нг.ч/мл, по меньшей мере около нг.ч/мл, по меньшей мере около 50 нг.ч/мл, по меньшей мере около 100 нг.ч/мл, по меньшей мере около 200 нг.ч/мл или более, или находится в диапазоне между любыми двумя из указанных выше значений. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, при пероральном введении субъекту-человеку натощак обеспечивают значение AUC(0-30 мин), которое составляет по меньшей мере около 10 нг.ч/мл, по меньшей мере около 20 нг.ч/мл, по меньшей мере около 30 нг.ч/мл, по меньшей мере около 40 нг.ч/мл, по меньшей мере около 50 нг.ч/мл, по меньшей мере около 60 нг.ч/мл, по меньшей мере около 70 нг.ч/мл, по меньшей мере около 80 нг.ч/мл, по меньшей мере около 90 нг.ч/мл, по меньшей мере около 100 нг.ч/мл, по меньшей мере около 200 нг.ч/мл, по меньшей мере около 500 нг.ч/мл или более, или находится в диапазоне между любыми двумя из указанных выше значений. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, при пероральном введении субъекту-человеку натощак обеспечивают значение AUC(0-1 час), которое составляет по меньшей мере около 100 нг.ч/мл, по меньшей мере около 200 нг.ч/мл, по меньшей мере около 300 нг.ч/мл, по меньшей мере около 400 нг.ч/мл, по меньшей мере около 500 нг.ч/мл, по меньшей мере около 600 нг.ч/мл, по меньшей мере около 700 нг.ч/мл, по меньшей мере около 800 нг.ч/мл, по меньшей мере около 900 нг.ч/мл, по меньшей мере около 1000 нг.ч/мл, по меньшей мере около 1500 нг.ч/мл, по меньшей мере около 2000 нг.ч/мл, по меньшей мере около 3000 нг.ч/мл, по меньшей мере около 4000 нг.ч/мл или более, или находится в диапазоне между любыми двумя из указанных выше значений. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, при пероральном введении субъекту-человеку натощак обеспечивают значение AUC(0-2 час), которое составляет по меньшей мере около 500 нг.ч/мл, по меньшей мере около 600 нг.ч/мл, по меньшей мере около 700 нг.ч/мл, по меньшей мере около 800 нг.ч/мл, по меньшей мере около 900 нг.ч/мл, по меньшей мере около 1000 нг.ч/мл, по меньшей мере около 1500 нг.ч/мл, по меньшей мере около 2000 нг.ч/мл, по меньшей мере около 3000 нг.ч/мл, по меньшей мере около 4000 нг.ч/мл, по меньшей мере около 5000 нг.ч/мл, по меньшей мере около 6000 нг.ч/мл, по меньшей мере около 7000 нг.ч/мл, по меньшей мере около 8000 нг.ч/мл, или более, или находится в диапазоне между любыми двумя из указанных выше значений. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, при пероральном введении субъекту-человеку натощак обеспечивают значение AUC(0-t), которое составляет по меньшей мере около 500 нг.ч/мл, по меньшей мере около 600 нг.ч/мл, по меньшей мере около 700 нг.ч/мл, по меньшей мере около 800 нг.ч/мл, по меньшей мере около 900 нг.ч/мл, по меньшей мере около 1000 нг.ч/мл, по меньшей мере около 1500 нг.ч/мл, по меньшей мере около 2000 нг.ч/мл, по меньшей мере около 3000 нг.ч/мл, по меньшей мере около 4000 нг.ч/мл, по меньшей мере около 5000 нг.ч/мл, по меньшей мере около 6000 нг.ч/мл, по меньшей мере около 7000 нг.ч/мл, по меньшей мере около 8000 нг.ч/мл или более, или находится в диапазоне между любыми двумя из указанных выше значений. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, при пероральном введении субъекту-человеку натощак обеспечивают значение AUC(0-∞), которое составляет по меньшей мере около 500 нг.ч/мл, по меньшей мере около 600 нг.ч/мл, по меньшей мере около 700 нг.ч/мл, по меньшей мере около 800 нг.ч/мл, по меньшей мере около 900 нг.ч/мл, по меньшей мере около 1000 нг.ч/мл, по меньшей мере около 1500 нг.ч/мл, по меньшей мере около 2000 нг.ч/мл, по меньшей мере около 3000 нг.ч/мл, по меньшей мере около 4000 нг.ч/мл, по меньшей мере около 5000 нг.ч/мл, по меньшей мере около 6000 нг.ч/мл, по меньшей мере около 7000 нг.ч/мл, по меньшей мере около 8000 нг.ч/мл или более, или находится в интервале между любыми двумя из указанных выше значений.
В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, при пероральном введении субъекту-человеку натощак имеют скорость высвобождения не менее 50%, не менее 60%, не менее 70%, не менее 80%, не менее 90% за период времени, равный 10 минутам. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, при пероральном введении субъекту-человеку натощак имеют скорость высвобождения не менее 50%, не менее 60%, не менее 70%, не менее 80%, не менее 90% за период времени, равный 15 мин. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, имеют скорость высвобождения не менее 50%, не менее 60%, не менее 70%, не менее 80%, не менее 90% за период времени, равный 10 минут, в 900 мл 0,01N HCl с 0,5% лаурилсульфата натрия (SLS) при тестировании в аппарате USP Типа 2 с грузилами при 50 об/мин и 37°С. В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, имеют скорость высвобождения не менее 50%, не менее 60%, не менее 70%, не менее 80%, не менее 90% за период времени, составляющий 15 минут, в 900 мл 0,01N HCl с 0,5% лаурилсульфата натрия (SLS) при тестировании в аппарате USP Типа 2 с грузилами при 50 об/мин и 37°С.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат уменьшенную дозу целекоксиба, при этом указанная композиция обеспечивает сходные или более высокие значения AUC(0-15 мин), AUC(0-30 мин), AUC(0-1 час) и AUC(0-2 час)по сравнению со стандартными композициями целекоксиба, такими как пероральные капсулы CELEBREX®.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат уменьшенную дозу целекоксиба, при этом указанная композиция обеспечивает значение AUC(0-15 мин), которое по меньшей мере в 50 раз выше по сравнению со стандартными композициями целекоксиба, такими как пероральные капсулы CELEBREX®.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат уменьшенную дозу целекоксиба, при этом указанная композиция обеспечивает значение AUC(0-30 мин), которое по меньшей мере в 12 раз выше по сравнению со стандартными композициями целекоксиба, такими как пероральные капсулы CELEBREX®.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат уменьшенную дозу целекоксиба, при этом указанная композиция обеспечивает значение AUC(0-1 час), которое по меньшей мере в 5 раз выше по сравнению со стандартными композициями целекоксиба, такими как пероральные капсулы CELEBREX®.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат уменьшенную дозу целекоксиба, при этом указанная композиция обеспечивает значение AUC(0-2 час), которое по меньшей мере в 1,5 раз выше по сравнению со стандартными композициями целекоксиба, такими как пероральные капсулы CELEBREX®.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат уменьшенную дозу целекоксиба, при этом указанная композиция обеспечивает сходные или более высокие значения AUC(0-15 мин), AUC(0-30 мин), AUC(0-1 час) и AUC(0-2 час)по сравнению со стандартными композициями целекоксиба, содержащими 400 мг целекоксиба, такими как пероральные капсулы CELEBREX® 400 мг.
В некоторых вариантах осуществления в настоящей заявке предлагается пероральная жидкая фармацевтическая композиция, содержащая терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает по меньшей мере один из следующих фармакокинетических параметров:
- AUC(0-15 мин)от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин)от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час)от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час)от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞)по меньшей мере около 2000 нг.ч/мл; и
- Tlagне более 8 минут.
В некоторых вариантах осуществления в настоящей заявке предлагается пероральная жидкая фармацевтическая композиция, содержащая терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00 и при пероральном введении субъекту-человеку натощак обеспечивает по меньшей мере один из следующих фармакокинетических параметров:
- AUC(0-15 мин)от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин)от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час)от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час)от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞)по меньшей мере около 2000 нг.ч/мл; и
- Tlagне более 8 минут.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция
а) высвобождает не менее 70% за период времени, составляющий 10 минут; или
b) высвобождает не менее 80% за период времени, составляющий 15 минут,
в 900 мл 0.01N HCl с 0,5% лаурилсульфата натрия (SLS) при тестировании в аппарате USP Типа 2 с грузилами при 50 об/мин и 37°С.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция
а) высвобождает не менее 70% за период времени, составляющий 10 минут; или
b) высвобождает не менее 80% за период времени, составляющий 15 минут,
в 900 мл 0.01N HCl с 0,5% лаурилсульфата натрия (SLS) при тестировании в аппарате USP Типа 2 с грузилами при 50 об/мин и 37°С.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-15 мин), которое составляет по меньшей мере около 10 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-15 мин), которое составляет от около 10 нг.ч/мл до около 80 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку в условиях натощак обеспечивает значение AUC(0-30 мин), которое составляет около 80 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-30 мин), которое составляет от около 80 нг.ч/мл до около 400 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-1 час),которое составляет по меньшей мере около 400 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-1 час), которое составляет от около 400 нг.ч/мл до около 1500 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-2 час), которое составляет по меньшей мере около 1000 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-2 час), которое составляет от около 1000 нг.ч/мл до около 4000 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-t), которое составляет по меньшей мере около 2000 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-∞), которое составляет по меньшей мере около 2000 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение Tlag, которое составляет не более 10 минут.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение Tlag, которое составляет не более 8 минут.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение Tlag, которое составляет не более 5 минут.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение Tmax, которое составляет менее чем около 90 минут.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение Tmax, которое составляет не менее чем около 60 минут.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00; и указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-15 мин), которое составляет по меньшей мере около 10 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00; и указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-15 мин), которое составляет от около 10 нг.ч/мл до около 80 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00; и указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-30 мин), которое составляет по меньшей мере около 80 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00; и указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-30 мин), которое составляет от около 80 нг.ч/мл до около 400 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00; и указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-1h), которое составляет по меньшей мере около 400 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00; и указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-1h), которое составляет от около 400 нг.ч/мл до около 1500 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержат терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00; и указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-2h), которое составляет по меньшей мере около 1000 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00; и указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-2h), которое составляет от около 1000 нг.ч/мл до около 4000 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00; и указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-t),которое составляет по меньшей мере около 2000 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00; и указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение AUC(0-∞), которое составляет по меньшей мере около 2000 нг.ч/мл.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00; и указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение Tlag, которое составляет не более чем 10 минут.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00; и указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение Tlag, которое составляет не более 8 минут.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00; и указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение Tlag, которое составляет не более 5 минут.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в массовом соотношении от около 0,60:1,00 до около 1,8:1,00; и указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает значение Tmax, которое составляет менее чем около 90 минут.
Улучшенные физические свойства
В некоторых вариантах осуществления стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, обладают улучшенными физическими свойствами, такими как размер капель, вязкость и т.д. Величины D50 и D90 представляют собой медиану или 50-й процентиль и 90-й процентиль распределения капель масла по размерам, соответственно, измеренные по объему. Это означает, что термин «D50» определяется как размер в нм (нанометрах), ниже которого располагается 50 процентов капель масла на объемной основе, и, аналогично, термин «D90» определяется как размер в нм (нанометрах), ниже которого располагается 90% капель на объемной основе. Размер капель масла может быть определен, например, с помощью рассеяния лазерного света с использованием анализатора размера частиц, такого как прибор Zetasizer™, доступный от фирмы Malvern Instruments Ltd.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин в течение по меньшей мере 60 минут, и указанная композиция имеет средний размер капель масла не более 500 нм.
На тройной фазовой диаграмме (фигура 1) показана «область А стабильной композиции». «Область А стабильной композиции» определяется заштрихованной областью или областью между соединительными линиями между шестью точками (a, b, c, d, e и f). Любая композиция, которая находится вне этой области, не образует приемлемую композицию, поскольку время начала осаждения составляет менее чем 60 минут; размер капель масла D50 составляет более чем около 250 нм, или размер капель масла D90 составляет более чем около 500 нм.
В одном варианте осуществления предлагается стабильная композиция целекоксиба согласно настоящей заявке, которая содержит:
а) терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид; и
b) полярный растворитель, содержащий смесь этанола и глицерина;
при этом композиция находится в заштрихованной области фазовой диаграммы, как показано на фигуре 1, при этом границы стабильной композиции определяются заштрихованной областью или областью между соединительными линиями между шестью точками (a, b, c, d, e и f), при этом композиция содержит от около 1 мас.% до около 80 мас.% целекоксиба и соответствует массовому процентному соотношению основная композиция:этанол:глицерин, равному 0,200:0,024:0,712 для a, 0,200:0,376:0,360 для b, 0,200:0,400:0,336 для c, 0,536:0,400:0,000 для d, 0,900:0,036:0,00 для e и 0,900:0,00:0,036 для f.
На фигуре 2 изображена тройная фазовая диаграмма, которая показывает «область В стабильной композиции». «Область В стабильной композиции» определяется заштрихованной областью или областью между соединительными линиями между шестью точками (a, b, c, d, e и f). Любая композиция, которая находится вне этой области, не образует приемлемую композицию, поскольку время начала осаждения составляет менее 60 минут; размер капель масла D50 составляет более чем около 125 нм, или размер капель масла D90 составляет более чем около 250 нм.
В одном варианте осуществления предлагается стабильная композиция целекоксиба согласно настоящей заявке, которая содержит:
а) терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид; и
b) полярный растворитель, содержащий смесь этанола и глицерина;
при этом композиция находится в заштрихованной области фазовой диаграммы, как показано на фигуре 2, при этом границы стабильной композиции определяются заштрихованной областью или областью между соединительными линиями между шестью точками (a, b, c, d, e и f), при этом композиция содержит от около 1 мас.% до около 80 мас.% целекоксиба и соответствует массовому процентному соотношению основная композиция:этанол:глицерин, равному 0,226:0,000:0,710 для a, 0,235:0,371:0,330 для b, 0,236:0,400:0,300 для c, 0,536:0,400:0.000 для d, 0,865:0,071:0,000 для e и 0,836: 0,000:0,100 для f.
Показана тройная фазовая диаграмма (фигура 3), на которой изображена «область С стабильной композиции». «Область С стабильной композиции» определяется заштрихованной областью или областью между соединительными линиями между шестью точками (a, b, c, d, e, f, g и h). Любая композиция, которая находится вне этой области, не образует приемлемую композицию, поскольку время начала осаждения составляет менее чем 60 минут; размер капель масла D50 составляет более чем около 50 нм, или размер капель масла D90 составляет более чем около 100 нм.
В одном варианте осуществления предлагается стабильная композиция целекоксиба согласно с настоящей заявке, которая содержит:
с) терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид; и
d) полярный растворитель, содержащий смесь этанола и глицерина;
при этом композиция находится в заштрихованной области фазовой диаграммы, как показано на фигуре 3, при этом границы стабильной композиции определяются заштрихованной областью или областью между соединительными линиями между восьмью точками (a, b, c, d, e, f, g и h), при этом композиция содержит от около 1 мас.% до около 80 мас.% целекоксиба и соответствует массовому процентному соотношению основная композиция:этанол:глицерин, равному 0,300:0,000:0,636 для a, 0,385:0,206:0,345 для b, 0,283:0,399:0,254 для c, 0,536:0,400:0,000 для d, 0,745: 0,191:0.000 для e, 0,778: 0,144:0,014 для f, 0,817:0,056:0,063 для g и 0,636:0,000:0,300 для h.
В некоторых вариантах осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции» в пределах области фазовых диаграмм, при этом композиции содержат уменьшенную дозу целекоксиба, при этом уменьшенная доза целекоксиба обеспечивает сходные или более высокие значения AUC(0-15 мин), AUC(0-30 мин), AUC(0-1 час) и AUC(0-2 час) по сравнению со стандартными композициями целекоксиба, такими как пероральные капсулы CELEBREX®.
В другом аспекте вышеуказанных вариантов осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом композиции по существу не содержат ингибиторов осаждения, таких как, блоксополимеры полиоксиэтилена-полиоксипропилена, плюроники, поливинилпирролидон, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза.
В другом аспекте вышеуказанных вариантов осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом композиции
а) высвобождают не менее 70% за период времени, составляющий 10 минут; или
b) высвобождают не менее 80% за период времени, составляющий 15 минут,
в 900 мл 0.01N HCl с 0,5% лаурилсульфата натрия (SLS) при тестировании в аппарате USP Типа 2 с грузилами при 50 об/мин и 37°С.
В другом аспекте вышеуказанных вариантов осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом указанная композиция представлена в форме раствора, суспензии, эмульсии или жидкой смеси.
В другом аспекте вышеуказанных вариантов осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом указанная композиция имеет вязкость от около 20 сП до около 1000 сП и имеет плотность от около 0,8 г/см3 до около 2 г/см3.
В другом аспекте вышеуказанных вариантов осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом указанная композиция имеет коэффициент пропускания по меньшей мере 40%.
В другом аспекте вышеуказанных вариантов осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом указанная композиция имеет значение рН от около 3 до около 7.
В некоторых вариантах осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом указанная композиция
с) высвобождает не менее 70% за период времени, составляющий 10 минут; или
а) высвобождает не менее 80% за период времени, составляющий 15 минут,
в 900 мл 0,01N HCl с 0,5% лаурилсульфата натрия (SLS) при тестировании в аппарате USP 2 Типа с грузилами при 50 об/мин и 37°С.
В некоторых вариантах осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом композиция после перорального введения субъекту-человеку натощак обеспечивает значение AUC(0-15 мин), которое составляет по меньшей мере около 10 нг.ч/мл.
В некоторых вариантах осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом композиция после перорального введения субъекту-человеку натощак обеспечивает значение AUC(0-15 мин), которое составляет от около 10 нг.ч/мл до около 80 нг.ч/мл.
В некоторых вариантах осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом указанная композиция после перорального введения субъекту-человеку натощак обеспечивает значение AUC(0-30 мин), которое составляет по меньшей мере около 80 нг.ч/мл.
В некоторых вариантах осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом указанная композиция после перорального введения субъекту-человеку натощак обеспечивает значение AUC(0-30 мин), которое составляет от около 80 нг.ч/мл до около 400 нг.ч/мл.
В некоторых вариантах осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом указанная композиция после перорального введения субъекту-человеку натощак обеспечивает значение AUC(0-1час), которое составляет по меньшей мере около 400 нг.ч/мл.
В некоторых вариантах осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом указанная композиция после перорального введения субъекту-человеку натощак обеспечивает значение AUC(0-1 час), которое составляет от около 400 нг.ч/мл до около 1500 нг.ч/мл.
В некоторых вариантах осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом указанная композиция после перорального введения субъекту-человеку натощак обеспечивает значение AUC(0-2 час), которое составляет по меньшей мере около 1000 нг.ч/мл.
В некоторых вариантах осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом композиция после перорального введения субъекту-человеку натощак обеспечивает значение AUC(0-2 час), которое составляет от около 1000 нг.ч/мл до около 4000 нг.ч/мл.
В некоторых вариантах осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом указанная композиция после перорального введения субъекту-человеку натощак обеспечивает значение AUC(0-t), которое составляет по меньшей мере около 2000 нг.ч/мл.
В некоторых вариантах осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом указанная композиция после перорального введения субъекту-человеку натощак обеспечивает значение AUC(0-∞), которое составляет по меньшей мере около 2000 нг.ч/мл.
В некоторых вариантах осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом указанная композиция после перорального введения субъекту-человеку натощак обеспечивает значение Tlag, которое составляет не более 8 минут.
В некоторых вариантах осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом указанная композиция после перорального введения субъекту-человеку натощак обеспечивает значение Tmax, которое составляет менее чем около 90 минут.
В некоторых вариантах осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом указанная композиция после перорального введения субъекту-человеку натощак обеспечивает по меньшей мере один из следующих фармакокинетических параметров:
- AUC(0-15 мин)от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин)от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час)от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час)от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞)по меньшей мере около 2000 нг.ч/мл; и
- Tlagне более 8 минут.
В некоторых вариантах осуществления стабильные композиции изображены в виде «области А стабильной композиции», «области В стабильной композиции» и «области С стабильной композиции», показанных в заштрихованной области фазовых диаграмм, при этом указанная композиция, содержащая уменьшенную дозу целекоксиба, после перорального введения субъекту-человеку натощак обеспечивает по меньшей мере один из следующих фармакокинетических параметров:
- AUC(0-15 мин)от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин)от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час)от около 400 нг.ч/мл до около 1500 нг.ч/мл ;
- AUC(0-2 час)от около 1000 нг.ч/мл до около 4000 нг.ч/мл ;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл ;
- AUC(0-∞)по меньшей мере около 2000 нг.ч/мл; и
- Tlagне более 8 минут.
Стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, могут содержать капли масла с различным средним размером. В некоторых вариантах осуществления композиция обеспечивает средний размер капель масла, который составляет не более 500 нм, не более 250 нм, не более 100 нм, не более 50 нм.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке является стабильной и не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин в течение по меньшей мере 60 минут, и указанная композиция имеет средний размер капель масла не более 500 нм.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке является стабильной и не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин в течение по меньшей мере 60 минут, и указанная композиция имеет средний размер капель масла не более 250 нм.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке является стабильной и не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин в течение по меньшей мере 60 минут, и указанная композиция имеет средний размер капель масла не более 100 нм.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке является стабильной и не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин в течение по меньшей мере 60 минут, и указанная композиция имеет средний размер капель масла не более 50 нм.
Стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, могут иметь различную вязкость. В некоторых вариантах осуществления стабильная пероральная жидкая композиция целекоксиба согласно настоящей заявке имеет вязкость, которая составляет около 20 сП, около 40 сП, около 60 сП, около 80 сП, около 100 сП, около 200 сП, около 500 сП, около 1000 сП или находится в диапазоне между любыми двумя из указанных выше значений.
Стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, могут иметь различную плотность. В некоторых вариантах осуществления стабильная пероральная жидкая композиция целекоксиба согласно настоящей заявке имеет плотность, которая составляет от около 0,8 г/см3 до около 2 г/см3.
В некоторых вариантах осуществления композиция обеспечивает средний размер капель масла, который составляет не более 500 нм или не более 250 нм, или не более 100 нм, или не более 50 нм.
В некоторых вариантах осуществления стабильная пероральная жидкая композиция согласно настоящей заявке имеет вязкость, которая составляе от около 20 сП до около 1000 сП.
В некоторых вариантах осуществления стабильная пероральная жидкая композиция согласно настоящей заявке имеет плотность, которая составляет от около 0,8 г/см3 до около 2 г/см3.
В некоторых вариантах осуществления стабильная пероральная жидкая композиция согласно настоящей заявке имеет коэффициент пропускания по меньшей мере 40%.
В некоторых вариантах осуществления стабильная пероральная жидкая композиция согласно настоящей заявке имеет рН от около 3 до около 7.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке, кроме того, содержат воду в количестве менее чем около 10% в расчете на общую массу композиции.
Стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, могут иметь различные коэффициенты пропускания. В некоторых вариантах осуществления стабильная пероральная жидкая композиция целекоксиба согласно настоящей заявке имеет коэффициент пропускания по меньшей мере 40%. В некоторых вариантах осуществления стабильная пероральная жидкая композиция целекоксиба согласно настоящей заявке имеет коэффициент пропускания более 40%.
Стабильные пероральные жидкие фармацевтические композиции, раскрытые в настоящем документе, могут иметь различные значения рН. В некоторых вариантах осуществления стабильная пероральная жидкая композиция целекоксиба согласно настоящему изобретению имеет рН от около 3 до около 7.
В некоторых вариантах осуществления в настоящей заявке предлагается стабильная пероральная жидкая фармацевтическая композиция целекоксиба, содержащая:
а. терапевтически эффективное количество целекоксиба;
b. по меньшей мере один солюбилизатор в количестве от около 35 мас.% до около 45 мас.%;
с. по меньшей мере один полярный растворитель в количестве от около 25 мас.% до около 42 мас.%; и
d. по меньшей мере одно фармацевтически приемлемое вспомогательное вещество,
при этом указанный солюбилизатор и полярный растворитель присутствуют в массовом соотношении от около 0,60:1,00 до около 1,8:1,00, и при этом указанная композиция имеет вязкость от около 20 сП до около 1000 сП и плотность от около 0,8 г/см3 до около 2 г/см3.
Улучшенная стабильность
В некоторых вариантах осуществления настоящая заявка относится к композиции, содержащей терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин в течение по меньшей мере 60 минут.
В некоторых вариантах осуществления стабильная пероральная жидкая композиция целекоксиба согласно настоящей заявке по существу не содержит ингибиторов осаждения, таких как блоксополимеры полиоксиэтилена-полиоксипропилена, плюроники, поливинилпирролидон, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза.
В некоторых вариантах осуществления в настоящей заявке предлагается стабильная пероральная фармацевтическая композиция, содержащая терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин при измерении через 30 мин или 60 мин, или 90 мин, или 120 мин, или 180 минут, или 240 минут; и указанная композиция по существу не содержит ингибиторов осаждения, таких как блоксополимеры полиоксиэтилена-полиоксипропилена, плюроники, поливинилпирролидон, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза.
В некоторых вариантах осуществления в настоящей заявке предлагается стабильная пероральная жидкая фармацевтическая композиция, содержащая терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин при измерении через 30 мин или 60 мин, или 90 мин, или 120 минут, или 180 минут, или 240 минут; и указанная композиция по существу не содержит ингибиторов осаждения, таких как блоксополимеры полиоксиэтилена-полиоксипропилена, плюроники, поливинилпирролидон, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза.
В некоторых вариантах осуществления композиция обеспечивает средний размер капель масла, который составляет не более 500 нм или не более 250 нм, или не более 100 нм, или не более 50 нм.
В некоторых вариантах осуществления стабильная пероральная жидкая композиция согласно настоящей заявке имеет вязкость, которая составляет от около 20 сП до около 1000 сП.
В некоторых вариантах осуществления стабильная пероральная жидкая композиция согласно настоящей заявке имеет плотность, которая составляет от около 0,8 г/см3 до около 2 г/см3.
В некоторых вариантах осуществления стабильная пероральная жидкая композиция согласно настоящей заявке имеет коэффициент пропускания по меньшей мере 40%.
В некоторых вариантах осуществления стабильная пероральная жидкая композиция согласно настоящей заявке имеет рН от около 3 до около 7.
В некоторых вариантах осуществления в настоящей заявке предлагается стабильная пероральная жидкая фармацевтическая композиция целекоксиба, содержащая:
а. терапевтически эффективное количество целекоксиба;
b. по меньшей мере один солюбилизатор в количестве от около 35 мас.% до около 45 мас.%;
с. по меньшей мере один полярный растворитель в количестве от около 25 мас.% до около 42 мас.%; и
d. по меньшей мере одно фармацевтически приемлемое вспомогательное вещество,
при этом указанный солюбилизатор и полярный растворитель присутствуют в массовом соотношении от около 0,60:1,00 до около 1,8:1,00 и при этом указанная композиция не показывает осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин в течение по меньшей мере 60 минут.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор и по меньшей мере один среднецепочечный глицерид, при этом указанная композиция не показывает осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин в течение по меньшей мере 60 минут.
В некоторых вариантах осуществления настоящая заявка относится к композиции, содержащей терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин в течение по меньшей мере 60 минут.
В некоторых вариантах осуществления в настоящей заявке предлагается стабильная пероральная фармацевтичекая композиция, содержащая терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин при измерении через 30 мин или 60 мин, или 90 мин, или 120 минут, или 180 минут, или 240 минут; и указанная композиция по существу не содержит ингибиторов осаждения, таких как блоксополимеры полиоксиэтилена-полиоксипропилена, плюроники, поливинилпирролидон, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза.
В некоторых вариантах осуществления в настоящей заявке предлагается стабильная пероральная жидкая фармацевтичекая композиция, содержащая терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF) при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин при измерении через 30 мин или 60 мин, или 90 мин, или 120 минут, или 180 минут, или 240 минут; и указанная композиция по существу не содержит ингибиторов осаждения, таких как блоксополимеры полиоксиэтилена-полиоксипропилена, плюроники, поливинилпирролидон, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза.
В некоторых вариантах осуществления в настоящей заявке предлагается фармацевтичекая композиция, содержащая терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин в течение по меньшей мере 60 минут.
В некоторых вариантах осуществления в настоящей заявке предлагается стабильная пероральная фармацевтичекая композиция, содержащая терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин при измерении через 30 мин или 60 мин, или 90 мин, или 120 минут, или 180 минут, или 240 минут; и указанная композиция по существу не содержит ингибиторов осаждения, таких как блоксополимеры полиоксиэтилена-полиоксипропилена, плюроники, поливинилпирролидон, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза.
В некоторых вариантах осуществления в настоящей заявке предлагается стабильная пероральная жидкая фармацевтичекая композиция, содержащая терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин при измерении через 30 мин или 60 мин, или 90 мин, или 120 минут, или 180 минут, или 240 минут; и указанная композиция по существу не содержит ингибиторов осаждения, таких как блоксополимеры полиоксиэтилена-полиоксипропилена, плюроники, поливинилпирролидон, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза.
В некоторых вариантах осуществления пероральная жидкая композиция согласно настоящей заявке имеет вязкость от около 20 сП до около 1000 сП.
В некоторых вариантах осуществления пероральная жидкая композиция согласно настоящей заявке имеет плотность от около 0,8 г/см3 до около 2 г/см3.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин в течение по меньшей мере 240 минут.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке по существу не содержит ингибиторов осаждения, таких как блоксополимеры полиоксиэтилена-полиоксипропилена, плюроники, поливинилпирролидон, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза.
В некоторых вариантах осуществления в настоящем изобретении предлагается композиция, содержащая терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество; при этом указанная композиция обеспечивает средний размер капель масла не более 500 нм при подвергании воздействию среды, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин, при измерении через 30 мин или 60 мин, или 90 мин, или 120 мин, или 180 мин, или 240 мин.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество; и при этом указанная композиция не показывает какого-либо осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин в течение по меньшей мере 240 мин.
Уменьшенная доза
Наблюдалось, что пероральная жидкая композиция целекоксиба согласно настоящей заявке проявляет повышенную биодоступность (AUC(0-15 мин), AUC(0-30 мин), AUC(0-1 час), AUC(0-2 час)), и требуется меньшая доза по сравнению со стандартной композицией целекоксиба, такой как пероральные капсулы CELEBREX®. Таким образом, пероральные композиции с более низкой дозой или уменьшенной дозой целекоксиба, которые могут достигать таких же или лучших терапевтических эффектов, наблюдаемых для более высоких доз стандартных композиций целекоксиба, желательны для сведения к минимуму побочных эффектов целекоксиба.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат уменьшенную дозу целекоксиба, при этом уменьшенная доза целекоксиба обеспечивает такие же или более высокие терапевтические эффекты по сравнению со стандартной композицией целекоксиба, такой как пероральные капсулы CELEBREX®.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит уменьшенную дозу целекоксиба, при этом уменьшенная доза целекоксиба обеспечивает сходные или более высокие значения AUC(0-15 мин), AUC(0-30 мин), AUC(0-1 час) и AUC(0-2 час)по сравнению со стандартной композицией целекоксиба, такой как пероральные капсулы CELEBREX®.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит уменьшенную дозу целекоксиба, при этом уменьшение дозы целекоксиба составляет по меньшей мере 20% по сравнению со стандартными композициями целекоксиба, такими как пероральные капсулы CELEBREX®.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит уменьшенную дозу целекоксиба, при этом уменьшение дозы целекоксиба составляет по меньшей мере 30% по сравнению со стандартными композициями целекоксиба, такими как пероральные капсулы CELEBREX®.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат уменьшенную дозу целекоксиба, при этом уменьшение дозы целекоксиба составляет по меньшей мере 40% по сравнению со стандартными композициями целекоксиба, такими как пероральные капсулы CELEBREX®.
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке содержат уменьшенную дозу целекоксиба, при этом уменьшение дозы целекоксиба составляет по меньшей мере 50% по сравнению со стандартными композициями целекоксиба, такими как пероральные капсулы CELEBREX®.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит уменьшенную дозу целекоксиба, при этом уменьшение дозы целекоксиба составляет по меньшей мере 60% по сравнению со стандартными композициями целекоксиба, такими как пероральные капсулы CELEBREX®.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит уменьшенную дозу целекоксиба, при этом уменьшение дозы целекоксиба составляет по меньшей мере 70% по сравнению со стандартными композициями целекоксиба, такими как пероральные капсулы CELEBREX®.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит уменьшенную дозу целекоксиба, при этом уменьшение дозы целекоксиба составляет по меньшей мере 80% по сравнению со стандартными композициями целекоксиба, такими как пероральные капсулы CELEBREX®.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит уменьшенную дозу целекоксиба, при этом уменьшение дозы целекоксиба составляет по меньшей мере 40% по сравнению со стандартными композициями целекоксиба, содержащими 400 мг целекоксиба, такими как пероральные капсулы CELEBREX® 400 мг.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит уменьшенную дозу целекоксиба, при этом уменьшение дозы целекоксиба составляет по меньшей мере 55% по сравнению со стандартными композициями целекоксиба, содержащими 400 мг целекоксиба, такими как пероральные капсулы CELEBREX® 400 мг.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит уменьшенную дозу целекоксиба, при этом уменьшение дозы целекоксиба составляет по меньшей мере 70% по сравнению со стандартными композициями целекоксиба, содержащими 400 мг целекоксиба, такими как пероральные капсулы CELEBREX® 400 мг.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит уменьшенную дозу целекоксиба, при этом указанная уменьшенная доза составляет от около 100 мг до 250 мг целекоксиба.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит уменьшенную дозу целекоксиба, при этом указанная уменьшенная доза составляет около 240 мг.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит уменьшенную дозу целекоксиба, при этом указанная уменьшенная доза составляет около 180 мг.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит уменьшенную дозу целекоксиба, при этом указанная уменьшенная доза составляет около 120 мг.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит уменьшенную дозу целекоксиба, при этом уменьшение дозы целекоксиба составляет по меньшей мере 70% по сравнению со стандартными композициями целекоксиба, содержащими 400 мг целекоксиба, такими как пероральные капсулы CELEBREX® 400 мг.
В некоторых вариантах осуществления композиция целекоксиба согласно настоящей заявке содержит уменьшенную дозу целекоксиба, при этом указанная уменьшенная доза составляет от около 100 мг до 250 мг целекоксиба.
В некоторых вариантах осуществления стабильная пероральная жидкая композиция целекоксиба согласно настоящей заявке по существу не содержит ингибиторов осаждения, таких как блоксополимеры полиоксиэтилена- полиоксипропилена, плюроники, поливинилпирролидон, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза.
В некоторых вариантах осуществления в настоящей заявке предлагается пероральная жидкая фармацевтическая композиция, содержащая уменьшенную дозу целекоксиба, при этом указанная уменьшенная доза содержит от около 100 мг до 250 мг целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает по меньшей мере один из следующих фармакокинетических параметров:
- AUC(0-15 мин)от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин)от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час)от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час)от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞)по меньшей мере около 2000 нг.ч/мл; и
- Tlagне более 8 минут.
В некоторых вариантах осуществления в настоящей заявке предлагается пероральная жидкая фармацевтическая композиция, содержащая уменьшенную дозу целекоксиба, при этом указанная уменьшенная доза содержит от около 100 мг до 250 мг целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в соотношении от около 0,60:1,00 до около 1,8:1,00 и при пероральном введении субъекту-человеку натощак обеспечивает по меньшей мере один из следующих фармакокинетических параметров:
- AUC(0-15 мин)от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин)от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час)от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час)от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞)по меньшей мере около 2000 нг.ч/мл; и
- Tlagне более 8 минут.
В некоторых вариантах осуществления в настоящей заявке предлагается пероральная жидкая фармацевтическая композиция целекоксиба, при этом указанная композиция содержит от около 100 мг до 250 мг целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит солюбилизатор и полярный растворитель в соотношении от около 0,60:1,00 до около 1,8:1,00 и при пероральном введении субъекту-человеку натощак обеспечивает по меньшей мере один из следующих фармакокинетических параметров:
- AUC(0-15 мин)от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин)от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час)от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час)от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞)по меньшей мере около 2000 нг.ч/мл; и
- Tlagне более 8 минут.
Фармацевтически приемлемые вспомогательные вещества, вкусовые агенты и подсластители
В некоторых вариантах осуществления композиции целекоксиба согласно настоящей заявке могут, кроме того, содержать по меньшей мере один вкусовой агент или маскирующий вкус агент. Эти вкусовые агенты или маскирующие вкус агенты хорошо известны в данной области или одобрены US FDA.
Неограничивающий иллюстративный перечень вкусовых агентов/маскирующих вкус агентов включает: природные и синтетические ароматизирующие жидкости, такие как летучие масла, синтетические ароматические масла, ароматизирующие ароматические масла, жидкости, олеосмолы или экстракты, полученные из растений, листьев, цветков, фруктов, стеблей и их комбинаций. Неограничивающие репрезентативные примеры летучих масел включают масло кудрявой мяты, масло корицы, винтергреновое масло (метилсалицилат), масло перечной мяты, ментол, гвоздичное масло, лавровое масло, анисовое масло, масло эвкалипта, масло тимьяна, масло листьев кедра, масло мускатного ореха, масло перца душистого, масло шалфея, экстракт мускатного ореха, масло горького миндаля и масло кассии. Также, искусственные, натуральные или синтетические ароматизаторы, включая фруктовые ароматизаторы, такие как ваниль, и цитрусовые масла, включая лимон, апельсин, виноград, лайм и грейпфрут, и фруктовые эссенции, включая яблоко, грушу, персик, виноград, клубнику, малину, вишню, алычу, ананас, абрикос, банан, и другие полезные ароматизаторы включают альдегиды и сложные эфиры, такие как бензальдегид (вишня, миндаль), цитраль, то есть альфоцитраль (лимон, лайм), нераль, то есть бета-цитраль (лимон, лайм), деканаль (апельсин, лимон), альдегид С-8 (цитрусовые плоды), альдегид С-9 (цитрусовые плоды), альдегид С-12 (цитрусовые плоды), толилальдегид (вишня, миндаль), 2,6-диметилоктаналь (зеленые плоды) и 2-додеканеналь (цитрус, мандарин), вкус жевательной резинки, их смеси и т.п.
Неограничивающий иллюстративный перечень подсластителей включает: сахара, такие как сахароза, глюкоза (кукурузный сироп), декстроза, инвертный сахар, фруктоза и их смеси, сахарин и его различные соли, такие как соль натрия или кальция; цикламиновую кислоту и ее различные соли, такие как натриевая соль; дипептидные подсластители, такие как аспартам, ацесульфам К, и другие подсластители, такие как Magnasweet, сукралоза, их смеси и т.п.
Способы лечения боли
В некоторых вариантах осуществления настоящая заявка относится к способу лечения боли у субъекта-человека путем перорального введения стабильной пероральной жидкой фармацевтической композиции, раскрытой в настоящем документе. В некоторых вариантах осуществления композиция содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция не показывает осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин в течение по меньшей мере 60 мин.
В некоторых вариантах осуществления настоящая заявка относится к способу лечения боли у субъекта-человека путем перорального введения композиции, содержащей терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один полярный растворитель, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция не показывает осаждения в среде, имитирующей желудочный сок натощак (FaSSGF), при pH 2,0, температуре 37°C ± 0,5°C и перемешивании со скоростью 50 об/мин в течение по меньшей мере 60 мин.
В некоторых вариантах осуществления композиция обеспечивает средний размер капель масла не более 1000 нм или не более 500 нм, или не более 250 нм, или не более 100 нм, или не более 50 нм.
В некоторых вариантах осуществления настоящая заявка относится к способу лечения боли у субъекта-человека путем перорального введения композиции, содержащей терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция содержит указанный солюбилизатор и полярный растворитель в соотношении от около 0,60: 1,00 до около 1,8: 1,00.
В некоторых вариантах осуществления настоящая заявка относится к способу лечения боли у субъекта-человека путем перорального введения композиции, содержащей терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид, по меньшей мере один полярный растворитель и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом указанная композиция по существу не содержит ингибиторов осаждения, таких как блоксополимеры полиоксиэтилена и полиоксипропилена, плюроники, поливинилпирролидон, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза.
В некоторых вариантах осуществления настоящая заявка относится к способу лечения боли у субъекта-человека путем перорального введения композиции, содержащей терапевтически эффективное количество целекоксиба, при этом композиция имеет коэффициент пропускания по меньшей мере 40%.
В некоторых вариантах осуществления настоящая заявка относится к способу лечения боли у субъекта-человека путем перорального введения композиции, содержащей
терапевтически эффективное количество целекоксиба, при этом композиция имеет рН от около 3 до около 7.
В некоторых вариантах осуществления настоящая заявка относится к способу лечения боли у субъекта-человека путем введения пероральной жидкой фармацевтической композиции целекоксиба, содержащей:
а) терапевтически эффективное количество целекоксиба;
b) по меньшей мере один солюбилизатор в количестве от около 35 мас.% до около 45 мас.%; и
с) по меньшей мере один полярный растворитель в количестве от около 25 мас.% до около 42 мас.%;
d) по меньшей мере одно фармацевтически приемлемое вспомогательное вещество;
при этом указанный солюбилизатор и полярный растворитель присутствуют в соотношении от около 0,60:1,00 до около 1,8:1,00, и при этом указанная композиция имеет вязкость от около 20 сП до около 1000 сП и плотность от около 0,8 г/см3 до около 2 г/см3.
В некоторых вариантах осуществления настоящая заявка относится к способу лечения боли у субъекта-человека путем введения пероральной жидкой фармацевтической композиции целекоксиба, содержащей:
а) уменьшенную дозу целекоксиба, при этом уменьшение дозы целекоксиба составляет по меньшей мере 20% по сравнению со стандартными композициями целекоксиба;
b) по меньшей мере один солюбилизатор в количестве от около 35 мас.% до около 45 мас.%; и
с) по меньшей мере один полярный растворитель в количестве от около 25 мас.% до около 42 мас.%;
d) по меньшей мере одно фармацевтически приемлемое вспомогательное вещество;
при этом указанный солюбилизатор и полярный растворитель присутствуют в соотношении от около 0,60:1,00 до около 1,8:1,00, и при этом указанная композиция имеет вязкость от около 20 сП до около 1000 сП и плотность от около 0,8 г/см3 до около 2 г/см3.
В некоторых вариантах осуществления настоящая заявка относится к способу лечения боли у субъекта-человека путем введения пероральной жидкой фармацевтической композиции целекоксиба, при этом указанная композиция обеспечивает по меньшей мере один из следующих фармакокинетических параметров при пероральном введении субъекту-человеку натощак:
- AUC(0-15 мин)от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин)от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час)от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час)от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞)по меньшей мере около 2000 нг.ч/мл; и
- Tlagне более 8 минут.
В некоторых вариантах осуществления настоящая заявка относится к способу освобождения от боли у субъекта-человека, страдающего болью, путем введения пероральной фармацевтической композиции целекоксиба, при этом указанная композиция обеспечивает по меньшей мере один из следующих фармакокинетических параметров при пероральном введении субъекту-человеку натощак:
а) AUC(0-15 мин)от около 10 нг.ч/мл до около 80 нг.ч/мл;
b) AUC(0-30 мин)от около 80 нг.ч/мл до около 400 нг.ч/мл;
c) AUC(0-1 час)от около 400 нг.ч/мл до около 1500 нг.ч/мл;
d) AUC(0-2 час)от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
e) AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
f) AUC(0-∞)по меньшей мере около 2000 нг.ч/мл; и
g) Tlagне более 8 минут.
В некоторых вариантах осуществления настоящая заявка относится к способу обеспечения освобождения от боли у субъекта-человека, страдающего болью, при этом указанный способ включает введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом субъект освобождается от боли через 2 часа после введения, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает по меньшей мере один из следующих фармакокинетических параметров:
- AUC(0-15 мин) от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин) от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час) от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час) от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞) по меньшей мере около 2000 нг.ч/мл; и
- Tlag не более 8 минут.
В некоторых вариантах осуществления настоящая заявка относится к способу обеспечения частичного ослабления боли у субъекта-человека, страдающего болью, при этом указанный способ включает введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, в результате чего субъект получает ослабление боли менее чем через 2 часа после введения, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает по меньшей мере один из следующих фармакокинетических параметров:
- AUC(0-15 мин) от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин) от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час) от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час) от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞) по меньшей мере около 2000 нг.ч/мл; и
- Tlag не более 8 минут.
В некоторых вариантах осуществления настоящая заявка относится к способу обеспечения частичного ослабления боли менее чем через около 2 ч у субъекта-человека, страдающего болью, путем введения пероральной фармацевтической композиции целекоксиба, при этом указанная композиция обеспечивает по меньшей мере один из следующих фармакокинетических параметров при пероральном введении субъекту-человеку в условиях натощак:
- AUC(0-15 мин)от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин)от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час)от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час)от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞)по меньшей мере около 2000 нг.ч/мл; и
- Tlagне более 8 минут.
В некоторых вариантах осуществления настоящая заявка относится к способу уменьшения наиболее беспокоящих симптомов у субъекта-человека, страдающего мигренью, путем введения пероральной фармацевтической композиции целекоксиба, при этом указанная композиция обеспечивает по меньшей мере один из следующих фармакокинетических параметров при пероральном введении субъекту-человеку натощак:
- AUC(0-15 мин)от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин)от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час)от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час)от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞)по меньшей мере около 2000 нг.ч/мл; и
- Tlagне более 8 минут.
В некоторых вариантах осуществления настоящая заявка относится к способу уменьшения наиболее беспокоящих симптомов у субъекта-человека, страдающего мигренью, при этом указанный способ включает введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, в результате чего субъект получает уменьшение наиболее беспокоящих симптомов, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает по меньшей мере один из следующих фармакокинетических параметров:
- AUC(0-15 мин) от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин) от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час) от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час) от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞) по меньшей мере около 2000 нг.ч/мл; и
- Tlag не более 8 минут.
В некоторых вариантах осуществления настоящая заявка относится к способу обеспечения освобождения от боли у субъекта-человека, страдающего болью, путем введения пероральной жидкой фармацевтической композиции целекоксиба, при этом указанная композиция обеспечивает по меньшей мере один из следующих фармакокинетических параметров при пероральном введении субъекту-человеку натощак:
- AUC(0-15 мин)от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин)от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час)от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час)от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞)по меньшей мере около 2000 нг.ч/мл; и
Tlagне более 8 минут.
В некоторых вариантах осуществления настоящая заявка относится к способу обеспечения освобождения от боли у субъекта-человека, страдающего болью, при этом указанный способ включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом субъект освобождается от боли через 2 часа после введения, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает по меньшей мере один из следующих фармакокинетических параметров:
- AUC(0-15 мин) от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин) от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час) от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час) от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞) по меньшей мере около 2000 нг.ч/мл; и
Tlag не более 8 минут.
В некоторых вариантах осуществления настоящая заявка относится к способу обеспечения частичного ослабления боли менее чем через около 2 ч у субъекта-человека, страдающего болью, путем введения пероральной жидкой фармацевтической композиции целекоксиба, при этом указанная композиция обеспечивает по меньшей мере один из следующих фармакокинетических параметров при пероральном введении субъекту-человеку натощак:
- AUC(0-15 мин)от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин)от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час)от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час)от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл ;
- AUC(0-∞)по меньшей мере около 2000 нг.ч/мл; и
- Tlagне более 8 минут.
В некоторых вариантах осуществления настоящая заявка относится к способу обеспечения частичного ослабления боли у субъекта-человека, страдающего болью, при этом указанный способ включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, в результате чего субъект получает ослабление боли менее чем через около 2 ч после введения, при этом указанная композиция при пероральном введении субъекту-человеку натощак обеспечивает по меньшей мере один из следующих фармакокинетических параметров:
- AUC(0-15 мин) от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин) от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час) от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час) от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞) по меньшей мере около 2000 нг.ч/мл; и
Tlag не более 8 минут.
В некоторых вариантах осуществления настоящая заявка относится к способу уменьшения наиболее беспокоящих симптомов у субъекта-человека, страдающего мигренью, путем введения пероральной жидкой фармацевтической композиции целекоксиба, при этом указанная композиция обеспечивает по меньшей мере один из следующих фармакокинетических параметров при пероральном введении субъекту-человеку натощак:
- AUC(0-15 мин)от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин)от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час)от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час)от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞)по меньшей мере около 2000 нг.ч/мл; и
- Tlagне более 8 минут.
В некоторых вариантах осуществления настоящая заявка относится к способу уменьшения наиболее беспокоящих симптомов у субъекта-человека, страдающего мигренью, при этом указанный способ включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, в результате чего субъект получает уменьшение наиболее беспокоящих симптомов, при этом указанная композиция при пероральном введении субъекту-человеку в условиях натощак обеспечивает по меньшей мере один из следующих фармакокинетических параметров:
- AUC(0-15 мин) от около 10 нг.ч/мл до около 80 нг.ч/мл;
- AUC(0-30 мин) от около 80 нг.ч/мл до около 400 нг.ч/мл;
- AUC(0-1 час) от около 400 нг.ч/мл до около 1500 нг.ч/мл;
- AUC(0-2 час) от около 1000 нг.ч/мл до около 4000 нг.ч/мл;
- AUC(0-t)по меньшей мере около 2000 нг.ч/мл;
- AUC(0-∞) по меньшей мере около 2000 нг.ч/мл; и
- Tlag не более 8 мин.
В некоторых вариантах осуществления настоящая заявка относится к способу лечения боли у субъекта-человека путем перорального введения композиции, содержащей терапевтически эффективное количество целекоксиба, при этом композиция имеет коэффициент пропускания по меньшей мере 40%.
В некоторых вариантах осуществления настоящая заявка относится к способу лечения боли у субъекта-человека путем перорального введения композиции, содержащей терапевтически эффективное количество целекоксиба, при этом композиция имеет рН от около 3 до около 7.
В некоторых вариантах осуществления композицию согласно настоящей заявке применяют для лечения или ослабления боли у пациентов, нуждающихся в этом, включая, но без ограничения, острую боль; боль, связанную с мигренью; кластерную головную боль; невропатическую боль; послеоперационную боль; хроническую боль в пояснице; герпетическую невралгию; фантомную боль в ампутированной конечности; центральную боль; зубную боль; невропатическую боль; боль, устойчивую к опиоидным средствам; висцеральную боль; хирургическую боль; боль, вызванную повреждением кости; боль, вызванную артритом; боль, вызванную воспалением; боль, вызванную остеоартритом; боль, вызванную ювенильным ревматоидным артритом; боль, вызванную анкилозирующим спондилитом; боль, вызванную первичной дисменореей; боль во время родовых схваток и родоразрешения; боль, вызванную ожогами, в том числе солнечными ожогами; послеродовую боль; боль при стенокардии; и боль, связанную с мочеполовым трактом, включая цистит; «прорывную» боль; или любой вид боли, связанной с раком, при этом термин также относится к ноцицептивной боли или ноцицепции.
Способы лечения боли, связанной с мигренью
В некоторых вариантах осуществления настоящая заявка относится к способу обеспечения освобождения от боли у субъекта-человека, страдающего болью, при этом указанный способ включает введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, в результате чего пациент получает освобождение от боли через 2 часа после введения. В некоторых вариантах осуществления настоящая заявка относится к способу лечения боли, связанной с мигренью, у субъекта-человека путем перорального введения стабильной пероральной жидкой фармацевтической композиции, как описано в настоящем документе. В некоторых вариантах осуществления, раскрытых в настоящем документе, способы обеспечения освобождения от боли у субъекта-человека, страдающего болью, включают введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба. В некоторых вариантах осуществления, раскрытых в настоящем документе, способы обеспечения освобождения от боли у субъекта-человека, страдающего болью, включают введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба. В некоторых вариантах осуществления, раскрытых в настоящем документе, способы обеспечения освобождения от боли через 2 часа у субъекта-человека, страдающего болью, включают введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба. В некоторых вариантах осуществления, раскрытых в настоящем документе, способы обеспечения освобождения от боли через 2 часа у субъекта-человека, страдающего болью, включают введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба.
В некоторых вариантах осуществления настоящая заявка относится к способу обеспечения частичного ослабления боли у субъекта-человека, страдающего болью, при этом указанный способ включает введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, в результате чего пациент получает ослабление боли менее чем через около 2 ч после введения. В некоторых вариантах осуществления способ обеспечения частичного ослабления боли менее чем через около 2 ч у субъекта-человека, страдающего болью, включает введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба. В некоторых вариантах осуществления способ обеспечения частичного ослабления боли менее чем через 2 часа у субъекта-человека, страдающего болью, включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба. В некоторых вариантах осуществления способы приводят к освобождению от боли через 2 часа по меньшей мере у 25%, по меньшей мере у 26%, по меньшей мере у 27%, по меньшей мере у 28%, по меньшей мере у 29%, по меньшей мере у 30%, по меньшей мере у 31%, по меньшей мере у 32%, по меньшей мере у 33%, по меньшей мере у 34%, по меньшей мере у 35% или более подвергнутых лечению субъектов. В некоторых вариантах осуществления способы приводят к увеличению процента подвергнутых лечению субъектов-людей, освобожденных от боли через 2 часа, который составляет по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или более, по сравнению с процентом субъектов-людей, получавших плацебо. В некоторых вариантах осуществления способы приводят к частичному ослаблению боли через 2 часа по меньшей мере у 45%, по меньшей мере у 50%, по меньшей мере у 60%, по меньшей мере у 65%, по меньшей мере у 66%, по меньшей мере у 67%, по меньшей мере у 68%, по меньшей мере у 69%, по меньшей мере у 70%, по меньшей мере у 71%, по меньшей мере у 72%, по меньшей мере у 73%, по меньшей мере у 74%, по меньшей мере у 75% или более подвергнутых лечению субъектов-людей. В некоторых вариантах осуществления способы приводят к увеличению процента подвергнутых лечению субъектов-людей с частично ослабленной болью через 2 часа, который составляет по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70% или более, по сравнению с процентом субъектов-людей, получавших плацебо.
В некоторых вариантах осуществления настоящая заявка относится к способу лечения боли, связанной с мигренью, у субъекта-человека путем перорального введения субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба. В некоторых вариантах осуществления способы приводят к освобождению от боли через 2 часа по меньшей мере у 25%, по меньшей мере у 26%, по меньшей мере у 27%, по меньшей мере у 28%, по меньшей мере у 29%, по меньшей мере у 29%, по меньшей мере у 30%, по меньшей мере у 31%, по меньшей мере у 32%, по меньшей мере у 33%, по меньшей мере у 34%, по меньшей мере у 35% или более подвергнутых лечению субъектов-людей. В некоторых вариантах осуществления способы приводят к увеличению процента подвергнутых лечению субъектов-людей, освобожденных от боли через 2 часа, который составляет по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или более, по сравнению с процентом субъектов-людей, получавших плацебо. В некоторых вариантах осуществления способы приводят к частичному ослаблению боли через 2 часа по меньшей мере у 45%, по меньшей мере у 50%, по меньшей мере у 60%, по меньшей мере у 65%, по меньшей мере у 66%, по меньшей мере у 67%, по меньшей мере у 68%, по меньшей мере у 69%, по меньшей мере у 70%, по меньшей мере у 71%, по меньшей мере у 72%, по меньшей мере у 73%, по меньшей мере у 74%, по меньшей мере у 75% или более подвергнутых лечению субъектов-людей. В некоторых вариантах осуществления способы приводят к увеличению процента подвергнутых лечению субъектов-людей с частично ослабленной болью через 2 часа, который составляет по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70% или более, по сравнению с процентом субъектов-людей, получавших плацебо.
В некоторых вариантах осуществления способ обеспечения частичного ослабления боли менее чем через около 2 часа у субъекта-человека, страдающего болью, включает введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом указанное частичное ослабление боли сохраняется в течение по меньшей мере около 4 часов. В некоторых вариантах осуществления способ обеспечения частичного ослабления боли менее чем через около 2 часа у субъекта-человека, страдающего болью, включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом указанное частичное ослабление боли сохраняется в течение по меньшей мере около 4 часов. В некоторых вариантах осуществления способ обеспечения частичного ослабления боли менее чем через около 2 часа у субъекта-человека, страдающего болью, включает введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом указанное частичное ослабление боли представляет собой снижение интенсивности боли по меньшей мере на ≥ 1 уровень согласно сообщениям субъекта-человека, страдающего болью, по сравнению с оценкой перед дозированием по цифровой шкале оценки боли в диапазоне от 0 (отсутствие боли) до 3 (сильная боль). В некоторых вариантах осуществления способ обеспечения частичного ослабления боли менее чем через около 2 часа у субъекта-человека, страдающего болью, включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом указанное частичное ослабление боли представляет собой снижение интенсивности боли по меньшей мере на ≥ 1 уровень согласно сообщениям субъекта-человека, страдающего болью, по сравнению с оценкой перед дозированием по цифровой шкале оценки боли в диапазоне от 0 (отсутствие боли) до 3 (сильная боль).
В некоторых вариантах осуществления настоящая заявка относится к способам, включающим введение композиции, как описано в настоящем документе, что приводит к освобождению от боли через 2 часа по меньшей мере у 26%, по меньшей мере у 27%, по меньшей мере у 28% или по меньшей мере у 29%, или по меньшей мере у 30% подвергнутых лечению людей.
В некоторых вариантах осуществления настоящая заявка относится к способам, включающим введение композиции, как описано в настоящем документе, что приводит к частичному ослаблению боли через 2 часа по меньшей мере у 63% подвергнутых лечению субъектов.
В некоторых вариантах осуществления способы применения стабильной пероральной жидкой фармацевтической композиции, как раскрыто в настоящем документе, приводят к увеличению процента подвергнутых лечению субъектов-людей, освобожденных от боли через 2 часа, то есть по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70% или более, по сравнению с процентом субъектов-людей, подвергнутых лечению коммерчески доступными средствами для лечения боли, связанной с мигренью, такими как VIOXX 25 (25 мг), VIOXX 50 (50 мг) и CAMBIA 50 (50 мг). В некоторых вариантах осуществления способы приводят к увеличению процента подвергнутых лечению субъектов-людей с частично ослабленной болью через 2 часа, то есть по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65% , по меньшей мере 70% или более, по сравнению с процентом субъектов-людей, подвергнутых лечению коммерчески доступными средствами для лечения боли, связанной с мигренью, такими как VIOXX 25 (25 мг), VIOXX 50 (50 мг) и CAMBIA 50 (50 мг). В некоторых вариантах осуществления способы приводят к увеличению процента подвергнутых лечению субъектов-людей, освободившихся от боли через 2 часа, то есть по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60% , по меньшей мере 65%, по меньшей мере 70% или более, по сравнению с процентом субъектов-людей, подвергнутых лечению коммерчески доступными средствами для лечения боли, связанной с мигренью, такими как VIOXX 25 (25 мг), VIOXX 50 (50 мг) и CAMBIA 50 (50 мг).
В некоторых вариантах осуществления способы, включающие введение композиции, как описано в настоящем документе, приводят к увеличению процента подвергнутых лечению субъектов-людей, освобожденных от боли через 2 часа, то есть по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70% или более, по сравнению с процентом субъектов-людей, подвергнутых лечению коммерчески доступными средствами для лечения боли, связанной с мигренью, такими как VIOXX 25 (25 мг), VIOXX 50 (50 мг) и CAMBIA 50 (50 мг).
В некоторых вариантах осуществления, раскрытых в настоящем документе, предлагаются способы лечения боли у субъекта-человека, при этом способ включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один полярный растворитель, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом стабильная пероральная жидкая фармацевтическая композиция по существу не содержит ингибиторов осаждения, при этом терапевтически эффективное количество целекоксиба является достаточным для освобождения субъекта от боли или частичного ослабления боли, которое продолжается в течение по меньшей мере 4 часов, по меньшей мере 6 часов, по меньшей мере 8 часов, по меньшей мере 10 часов, по меньшей мере 12 часов, по меньшей мере 16 часов, по меньшей мере 18 часов, по меньшей мере 24 часов, по меньшей мере 48 часов или более, после введения стабильной пероральной жидкой фармацевтической композиции. В некоторых вариантах осуществления стабильная пероральная жидкая фармацевтическая композиция содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор в количестве от около 35 мас.% до около 45 мас.%, по меньшей мере один полярный растворитель в количестве от около 25 мас.% до около 42 мас.%, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом стабильная пероральная фармацевтическая композиция по существу не содержит ингибиторов осаждения. В некоторых вариантах осуществления боль связана с мигренью. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба является достаточным для освобождения субъекта от боли в пределах 2 часов после введения стабильной пероральной жидкой фармацевтической композиции. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба является достаточным для частичного ослабления боли у субъекта в пределах 2 часов после введения стабильной пероральной жидкой фармацевтической композиции. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к получению освобождения от боли, которое продолжается в течение по меньшей мере 24 часов после лечения, по меньшей мере у 25% подвергнутых лечению субъектов-людей. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к получению освобождения от боли, которое продолжается в течение по меньшей мере 24 часов после лечения по меньшей мере у 45% подвергнутых лечению субъектов-людей. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к увеличению процента подвергнутых лечению субъектов-людей, получивших освобождение от боли, которое продолжается в течение по меньшей мере 24 часов после лечения, то есть по меньшей мере 40% по сравнению с процентом субъектов-людей, подвергнутых лечению плацебо. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к увеличению процента подвергнутых лечению субъектов-людей, получивших освобождение от боли, которое продолжается в течение по меньшей мере 24 часов после лечения, то есть составляет по меньшей мере 10% по сравнению с процентом субъектов-людей, подвергнутых лечению коммерчески доступными средствами для лечения боли, связанной с мигренью, такими как VIOXX 25 (25 мг), VIOXX 50 (50 мг) и CAMBIA 50 (50 мг). В некоторых вариантах осуществления, раскрытых в настоящем документе, способы освобождения от боли у субъекта-человека, страдающего болью, включают введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом указанное освобождение от боли сохраняется в течение по меньшей мере около 2-24 часов. В некоторых вариантах осуществления, раскрытых в настоящем документе, способы обеспечения освобождения от боли у субъекта-человека, страдающего болью, включают введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом указанное освобождение от боли сохраняется в течение по меньшей мере около 2-24 часов.
В некоторых вариантах осуществления настоящая заявка относится к способу уменьшения наиболее беспокоящих симптомов у субъекта-человека, страдающего мигренью, при этом указанный способ включает введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, в результате чего субъект получает уменьшение наиболее беспокоящих симптомов. В некоторых вариантах осуществления, раскрытых в настоящем документе, предлагаются способы лечения боли у субъекта-человека, при этом способ включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор, по меньшей мере один полярный растворитель, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом стабильная пероральная жидкая фармацевтическая композиция по существу не содержит ингибиторов осаждения, при этом терапевтически эффективное количество целекоксиба является достаточным для освобождения субъекта от наиболее беспокоящих симптомов, таких как тошнота, фонофобия и фотофобия в течение 10 мин, 20 мин, 30 мин, 60 мин, в течение 2 часов, в течение 4 часов, в течение 6 часов, в течение 12 часов после введения стабильной пероральной жидкой фармацевтической композиции. В некоторых вариантах осуществления способ уменьшения наиболее беспокоящих симптомов у субъекта-человека, страдающего мигренью, включает введение субъекту стабильной пероральной фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом указанные наиболее беспокоящие симптомы уменьшаются в течение примерно 2 часов после введения указанной композиции. В некоторых вариантах осуществления способ уменьшения наиболее беспокоящих симптомов у субъекта-человека, страдающего мигренью, включает введение субъекту стабильной пероральной жидкой фармацевтической композиции, содержащей терапевтически эффективное количество целекоксиба, при этом указанные наиболее беспокоящие симптомы уменьшаются в течение примерно 2 часов после введения указанной композиции. В некоторых вариантах осуществления стабильная пероральная жидкая фармацевтическая композиция содержит терапевтически эффективное количество целекоксиба, по меньшей мере один солюбилизатор в количестве от около 35 мас.% до около 45 мас.%, по меньшей мере один полярный растворитель в количестве от около 25 мас.% до около 42 мас.%, по меньшей мере один среднецепочечный глицерид и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, при этом стабильная пероральная фармацевтическая композиция по существу не содержит ингибиторов осаждения. В некоторых вариантах осуществления боль связана с мигренью. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба является достаточным для освобождения субъекта от боли в течение 2 часов после введения стабильной пероральной жидкой фармацевтической композиции. В некоторых вариантах осуществления терапевтически эффективное количество целекоксиба является достаточным для частичного ослабления боли в течение 2 часов после введения стабильной пероральной жидкой фармацевтической композиции. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к освобождению от наиболее беспокоящих симптомов в течение 2 часов после лечения по меньшей мере у 25% подвергнутых лечению людей. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к освобождению от наиболее беспокоящих симптомов в течение 2 часов после лечения по меньшей мере у 45% подвергнутых лечению людей. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к увеличению процента подвергнутых лечению пациентов, освобожденных от наиболее беспокоящих симптомов в течение 2 часов после лечения, то есть по меньшей мере 40%, по сравнению с процентом субъектов-людей, получивших лечение плацебо. В некоторых вариантах осуществления введение стабильной пероральной жидкой фармацевтической композиции приводит к увеличению процента подвергнутых лечению субъектов-людей, освобожденных от наиболее беспокоящих симптомов в течение 2 часов после лечения, то есть по меньшей мере 10%, по сравнению с процентом субъектов-людей, подвергнутых лечению коммерчески доступными средствами для лечения боли, связанной с мигренью, такими как VIOXX 25 (25 мг), VIOXX 50 (50 мг) и CAMBIA 50 (50 мг).
Некоторые варианты осуществления способов, описанных в настоящем документе, кроме того, включают получение отчета от субъекта после введения. Отчет может представлять собой, например, отчет об уровне боли после введения. Такой уровень боли можно сравнить с уровнем боли, о котором сообщал субъект до введения, и, в этом отношении, некоторые варианты осуществления способов, кроме того, включают получение отчета от субъекта до введения. Дополнительно к отчету об уровне боли после введения, от субъекта после введения могут быть получены другие отчеты, например, о моменте времени наступления ослабления боли, моменте времени наступления освобождения от боли, моменте времени наступления освобождения от наиболее беспокоящих симптомов, периоде времени, в течение которого сохраняется ослабление боли, периоде времени, в течение которого сохраняется освобождение от боли, и периоде времени, в течение которого сохраняется освобождение от наиболее беспокоящих симптомов.
В некоторых вариантах осуществления пероральные жидкие композиции согласно настоящей заявке могут быть представлены в жидкой форме, упакованной в бутылки или любые другие подходящие контейнеры для перорального введения. Жидкую композицию можно принимать внутрь, смешивая или не смешивая дополнительно с водной или подходящей средой перед пероральным введением.
В некоторых вариантах осуществления пероральные жидкие композиции согласно настоящей заявке могут быть распределены в контейнер, такой как саше, ампула, шприц или капельница, или пробирка, или бутылка (например, пробирка или бутылка, которую можно выдавить для доставки ее содержимого), необязательно в фиксированной дозе, содержимое которого можно принимать непосредственно внутрь или примешивать, или диспергировать в пище или жидкости.
В некоторых вариантах осуществления композиции согласно настоящей заявке могут быть составлены в виде капсулы, которая является пригодной для перорального введения. Композиция может быть помещена в твердую или мягкую желатиновую капсулу или капсулы HPMC, или капсулы, изготовленные из любых других фармацевтически приемлемых материалов.
В некоторых вариантах осуществления композиция согласно настоящей заявке может быть распылена на инертной подложке, которая может представлять собой порошок или множество частиц, таких как гранула, пеллета, шарик, сфера, крупинка, микрокапсула, миллисфера, нанокапсула, наносфера или микросфера.
Субстрат представляет собой тонко измельченную (молотую, микронизированную, наноразмерную, осажденную) форму молекулярных агрегатов инертных добавок или составной агрегат из нескольких компонентов, или физическую смесь агрегатов добавок. Такие субстраты могут быть образованы из различных материалов, известных в данной области, таких как, например, сахара, такие как лактоза, сахароза или декстроза; полисахариды, такие как мальтодекстрин или декстраты; крахмалы; целлюлозные полимеры, такие как микрокристаллическая целлюлоза или микрокристаллическая целлюлоза/натрийкарбоксиметилцеллюлоза; неорганические вещества, такие как дикальцийфосфат, гидроксиапатит, трикальцийфосфат, тальк или диоксид титана; и полиолы, такие как маннит, ксилит, сорбит или циклодекстрин.
ПРИМЕРЫ
Следующие примеры представлены для иллюстрации, но не для ограничения изобретения.
Хотя изобретение проиллюстрировано следующими примерами, оно не должно рассматриваться как ограниченное ими, а скорее, изобретение охватывает общую область, как описано выше. Различные модификации и варианты осуществления могут быть сделаны без отступления от его сущности и объема.
Примеры 1-3: Стабильные пероральные композиции целекоксиба, используемые в исследованиях
Композиции, содержащие целекоксиб, получали, как представлено в Таблице 1.
Таблица 1. Стабильные пероральные жидкие фармацевтические композиции, используемые в исследованиях.
Методика получения:
1. Целекоксиб добавляли к солюбилизаторам (лауроилмакрогоцилглицериды, полиоксил 35 касторовое масло и PEG-40 гидрогенизированное касторовое масло) и тщательно перемешивали с получением однородной смеси.
2. Далее к смеси, полученной на стадии 1, добавляли среднецепочечные глицериды (каприловый/каприновый триглицерид и глицерилкаприлат).
3. К смеси, полученной на стадии 2, добавляли другие ингредиенты, такие как вкусовые агенты и подсластители, и хорошо перемешивали.
4. К композиции, полученной на стадии 3, добавляли пропиленгликоль и тщательно перемешивали при слабом нагревании при 30°C ± 5°C до получения однородной дисперсии и охлаждали раствор до 25-30°С при перемешивании.
5. К композиции, полученной на стадии 4, добавляли очищенную воду и хорошо перемешивали до получения прозрачного раствора.
6. Композицию, полученную на стадии 5, помещали в стеклянную бутыль янтарного цвета с 18-мм крышкой с защитой от вскрытия детьми.
Пример 4: Оценка начала осаждения стабильной пероральной композиции
Композиции из примеров 1, 2 и 3 оценивали на начало времени осаждения.
2 мл композиций, содержащих 100 мг целекоксиба, добавляли по каплям в 250 мл FaSSGF, рН 2,0, при 37°С, при перемешивании и отмечали начало осаждения.
Таблица 2: Время начала осаждения.
Пример 5: Оценка профиля высвобождения при растворении стабильных пероральных композиций
Исследование растворения целекоксиба проводили, используя 2 мл композиций из примеров 1, 2 и 3, содержащих 100 мг целекоксиба, в стандартной среде растворения USP в следующих условиях: USP аппарат II с лопастями; среда растворения (900 мл 0,01N HCl, содержащая 0,5% лаурилсульфата натрия) при скорости 50 об/мин и температуре 37°С.
Таблица 3. Растворение стабильной пероральной композиции в стандартной среде растворения USP
Пример 6: Оценка физических свойств стабильных пероральных композиций
Было установлено, что композиция по примеру 3 является стабильной после подвергания ее условиям оценки стабильности, представляющим собой 25°C/60%RH и 40°C/75%RH. Композицию также оценивали на вязкость, плотность, рН, размер капель масла.
Таблица 4. Физическая оценка стабильной пероральной композиции
Пример 7: Биодоступность стабильной пероральной композиции
Четырехстороннее рандомизированное перекрестное исследование для сравнения биодоступности композиции по примеру 3 (пероральный раствор целекоксиба) в дозах 120 мг, 180 мг и 240 мг по сравнению с капсулами CELEBREX® (целекоксиб) 400 мг и определения пропорциональности дозе композиций по примеру 3 у здоровых добровольцев натощак.
В каждый период исследования однократную дозу композиции целекоксиба вводили перорально, утром, после 10-часового ночного голодания. Введение осуществляли следующим образом:
Терапия-1: Композиция по примеру 3, содержащая 120 мг Целекоксиба, вводимая перорально добровольцам с последующими приблизительно 240 мл воды.
Терапия 2: Композиция по примеру 3, содержащая 180 мг Целекоксиба, вводимая перорально добровольцам с последующими приблизительно 240 мл воды.
Терапия 3: Композиция по примеру 3, содержащая 240 мг Целекоксиба, вводимая перорально добровольцам с последующими приблизительно 240 мл воды.
Терапия-4: Пероральную капсулу CELEBREX® в дозе 400 мг (1 × 400 мг) вводили вместе с приблизительно 240 мл воды.
Результаты:
Определяли концентрации целекоксиба в плазме и другие фармакокинетические параметры. Наблюдаемые фармакокинетические параметры приведены в таблице 5.
Таблица 5. Фармакокинетические параметры после введения стабильной пероральной композиции
аМедиана (диапазон)
Пример 8: Исследование лечения мигрени с использованием стабильной пероральной композиции
Трехстороннее двойное слепое рандомизированное перекрестное исследование было разработано для определения эффективности композиции по примеру 3 (пероральный раствор целекоксиба) в дозах 120 мг и 240 мг по сравнению с плацебо при лечении мигрени. Было отобрано 60 субъектов с историей 2-6 эпизодов мигрени.
В каждый период исследования перорально вводили однократную дозу стабильной пероральной композиции утром после 10-часового ночного голодания. Введение осуществляли следующим образом:
Терапия-1: Композиция по примеру 3, содержащая 120 мг Целекоксиба, вводимая перорально добровольцам с последующими приблизительно 240 мл воды.
Терапия-2: Композиция по примеру 3, содержащая 240 мг Целекоксиба, вводимая перорально добровольцам с последующими приблизительно 240 мл воды.
Терапия-3: Плацебо вводили перорально субъектам с последующими примерно 240 мл воды.
Субъектов наблюдали в отношении боли через 2 часа и 24 часа, и наиболее беспокоящих симптомов (MBS) через 2 часа после введения.
Исследуемое лекарственное средство использовали однократно при появлении боли, связанной с мигренью, от умеренной до тяжелой (определяемой как головная боль у пациента, оцениваемая баллом 2 или 3 по шкале от 0 до 3), во время каждого приступа мигрени, но не позднее чем через 1 час после появления умеренной боли, связанной с мигренью.
Пациентов просили оценить тяжесть их головной боли по шкале от 0 (отсутствие боли) до 3 (сильная боль), что является рекомендованным способом получения оценки головной боли у пациента (Ref: Guidelines for controlled trials of drugs in migraine: Third edition. A guide for investigators” Tfelt-Hansen P, Pascual J, Ramadan N, et al. Cephalalgia, 2012; 32(1):6-38).
Оценки получали непосредственно до приема исследуемого лекарственного средства (время 0) и через 10, 15, 20 и 30 минут, и 1, 2, 1,5, 2, 24 и 48 часов после приема. Пациент производил запись оценок в дневнике для каждого приступа мигрени, подвергнутого лечению во время исследования. Также, использовали шкалу оценки тяжести для оценки повторного возникновения головной боли после ее отсутствия в течение 24 часов после дозирования. Также, любое повторное возникновение головной боли после ее отсутствия фиксировали с использованием шкалы оценки тяжести головной боли в течение 24 часов после приема исследуемого лекарственного средства; симптомы (тошнота, фотофобия и фонофобия); прием средства скорой помощи (дата, время); функциональная неспособность; и удовлетворенность пациента (до использования средства скорой помощи).
Результаты вышеописанного клинического исследования показаны на фигуре 4, фигуре 5, фигуре 6, фигуре 7 и в таблицах 6 и 7.
Таблица 6: Анализ первичной эффективности в отношении освобождения от головной боли: популяция ITT, наблюдаемые случаи, общий лечебный период
Сокращения: ITT = Intent-to-treat (группа «все рандомизированные пациенты, получившие не менее одной дозы исследуемого препарата»)
Примечание: Частоту ответа (%) рассчитывали как число пациентов, которые отвечали в заданный момент времени, деленое на число пациентов с непропущенной оценкой в этот момент времени.
Примечание: P-значения получали из теста McNemar на независимых парах. '-' означает, что тест не может быть выполнен из-за отсутствия парных данных. Точный критерий применяли, когда имелось менее 20 дискордантных пар.
Таблица 7. Анализ вторичной эффективности в отношении наиболее беспокоящего симптома: ITT-популяция, перенос данных последнего наблюдения
Сокращения: ITT = Intent-to-treat (группа «все рандомизированные пациенты, получившие не менее одной дозы исследуемого препарата»)
Примечание: Частоту ответа (%) рассчитывали как число пациентов, которые отвечали в заданный момент времени, деленое на число пациентов с непропущенной оценкой в этот момент времени.
Примечание: P-значения получали из теста McNemar на независимых парах. '-' означает, что тест не может быть выполнен из-за отсутствия парных данных. Точный критерий применяли, когда имелось менее 20 дискордантных пар.
По меньшей мере в некоторых из ранее описанных вариантов осуществления, один или более элементов, используемых в одном варианте осуществления, могут быть взаимозаменяемо использованы в другом варианте осуществления, за исключением тех случаев, когда это невозможно технически. Специалисты в данной области техники должны принимать во внимание, что различные другие пропуски, добавления и модификации могут быть внесены в способы и структуры, описанные выше, без отступления от объема заявленного изобретения. Подразумевается, что все такие модификации и изменения находятся в пределах объема изобретения, определенного прилагаемой формулой изобретения.
Относительно использования практически любых терминов во множественном и/или единственном числе в настоящем документе, специалисты в данной области могут переводить из множественного числа в единственное число и/или из единственного числа во множественное согласно контексту и/или варианту применения. Различные перестановки единственного/множественного числа могут быть специально изложены в настоящем документе для ясности.
Специалистам в данной области будет понятно, что, в целом, термины, используемые в настоящем документе и особенно в прилагаемой формуле изобретения (например, основных частях прилагаемой формулы изобретения), обычно понимаются как «открытые» термины (например, термин «включающий» следует трактовать как «включающий, но без ограничения», термин «имеющий» следует толковать как «имеющий по меньшей мере», термин «включает» следует трактовать как «включает, но без ограничения», т.д.). Специалистам в данной области будет понятно, что если во введенном в пункт формулы изобретения перечислении имеется в виду конкретное число, то такое значение перечисления должно быть явно приведено в пункте формуле, а при отсутствии такого перечисления этого значения нет. Например, для облегчения понимания в следующей прилагаемой формуле изобретения могут содержаться вводные фразы «по меньшей мере один» и «один или более» с целью ввода упоминаний в формуле. Однако использование таких фраз не должно истолковываться таким образом, чтобы подразумевать, что введение упоминаний в формулу с помощью неопределенных артиклей «a» или «an», ограничивает любой конкретный пункт, содержащий такое введенное в него перечисление, до примеров осуществления, содержащих только одно такое перечисление, даже если тот же пункт включает вводные фразы «один или более» или «по меньшей мере один», и неопределенные артикли «a» или «an» (например, «а» и/или «an» следует толковать как «по меньшей мере один» или «один или более»); то же справедливо и для применения определенных артиклей, используемых для введения перечисления в пункты формулы. Кроме того, даже если конкретное число введенного в пункт формулы перечисления указано однозначно, специалисты будут понимать, что такое перечисление следует толковать, как означающее по меньшей мере указанное число (например, только лишь перечисление «двух перечислений» без других добавлений означает по меньшей мере два перечисления или более). Кроме того, в тех случаях, когда используется условие, подобное условию «по меньшей мере одно из А, B и C, и т.д.», такая конструкция в общем подразумевается в смысле, в котором специалист непременно поймет это условие (например, «система, имеющая по меньшей мере одно из А, В, и С» обязательно включает, но не сводится к системам, которые имеют А, только В, только С, А и В вместе, А и С вместе, В и С вместе, и/или А, В и С вместе, и т.д.). В тех случаях, когда используется условие, подобное условию «по меньшей мере одно из А, B или C и т.д.», такая конструкция в общем подразумевается в смысле, в котором специалист непременно поймет это условие (например, «система, имеющая по меньшей мере одно из А, В, или С» обязательно включает, но не сводится к системам, которые имеют только А, только B, только С, А и В вместе, А и С вместе, В и С вместе и/или А, В и С вместе, и т.д.). Кроме того, специалист поймет, что практически любое альтернативное слово и/или фразу, представляющую два или более альтернативных термина либо в описании, либо в формуле изобретения, либо на чертежах, следует понимать как предусматривающую возможность включения одного из терминов, любого из терминов, или обоих терминов. Например, фраза «A или B» будет пониматься как включающая возможности «А» или «В», или «А» и «В».
Кроме того, там, где признаки или аспекты раскрытия описаны как группы Маркуша, специалисты в данной области определят, что раскрытие также тем самым описывается как любой частный член или подгруппа членов группы Маркуша.
Как это будет понятно специалистам в данной области для любых и всех целей, в частности при условии наличия письменного описания, все диапазоны, раскрытые в настоящем документе, также охватывают любые и все возможные поддиапазоны и комбинации указанных поддиапазонов. Любой из указанных диапазонов может быть легко признан как полностью описывающий и дающий возможность разделения одного и того же диапазона по меньшей мере на одинаковые половины, трети, четверти, пятые части, десятые части и т.д. В качестве неограничивающего примера каждый описанный в настоящем документе диапазон может быть легко разделен в нижнюю треть, среднюю треть и верхнюю треть и т.д. Как также будет понятно специалистам в данной области, все выражения, такие как «вплоть до», «по меньшей мере», «более чем», «менее чем» и т.п. обозначают указанное количество и относятся к диапазонам, которые могут быть впоследствии разделены на поддиапазоны, как описано выше. В заключение, специалистам в данной области будет понятно, что диапазон включает каждый отдельный элемент. Таким образом, например, группа, имеющая 1-3 компонента, относится к группам, имеющим 1, 2 или 3 компонента. Аналогично, группа, имеющая 1-5 компонентов, относится к группам, имеющим 1, 2, 3, 4 или 5 компонентов, и т.д.
Реферат
Группа изобретений относится к медицине, а именно к неврологии, и может быть использована для освобождения от боли субъекта-человека через 2 часа после введения стабильной пероральной жидкой фармацевтической композиции, содержащей целекоксиб в количестве от 120 до 240 мг, по меньшей мере один глицерид со средней длиной цепи и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество. При этом при введении натощак композиция обеспечивает один из указанных фармакокинетических параметров: AUC(0-15 мин)от 10 нг.ч/мл до 80 нг.ч/мл; AUC(0-30 мин)от 80 нг.ч/мл до 400 нг.ч/мл; AUC(0-1 час)от 400 нг.ч/мл до 1500 нг.ч/мл; AUC(0-2 час)от 1000 нг.ч/мл до 4000 нг.ч/мл; AUC(0-t)по меньшей мере 2000 нг.ч/мл; AUC(0-∞)по меньшей мере 2000 нг.ч/мл; и Tlagне более 8 минут. Также заявлен способ частичного ослабления боли у субъекта-человека. Группа изобретений позволяет быстро ослабить боль за счет легкого растворения и быстрой абсорбции фармацевтической композиции в желудочно-кишечном тракте. 2 н. и 7 з.п. ф-лы, 7 табл., 8 пр., 7 ил.
Формула
Документы, цитированные в отчёте о поиске
Композиции, включающие трамадол и целекоксиб для лечения боли
Патенты аналоги
Композиции, включающие трамадол и целекоксиб для лечения боли

Комментарии