Препараты tpp1 и способы лечения заболевания cln2 - RU2733464C2
Код документа: RU2733464C2
Чертежи




















































Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[001] Настоящим в соответствии с 35 U.S.C 119(e) испрашиваем приоритет Предварительной заявки на выдачу патента США № 62/300171, поданной 26 февраля 2016 года, и Предварительной заявки на выдачу патента США № 62/158789, поданной 8 мая 2015 года, раскрытие каждой из которых включено в данный документ посредством ссылки в полном объеме.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[002] Данная заявка содержит в качестве отдельной части описания список последовательностей в машиночитаемой форме (49443_SeqListing.txt; 8137 байт, созданный 11 апреля 2016 года), который включен посредством ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
[003] Данное изобретение относится к препаратам, содержащим рекомбинантную трипептидилпептидазу-1 человека, и их применению при лечении заболевания нейрональным цероидным липофусцинозом и связанных с ним физиологических симптомов.
УРОВЕНЬ ТЕХНИКИ
[004] Заболевание нейрональным цероидным липофусцинозом (CLN2) представляет собой редкое генетическое заболевание, которое характеризуется дефицитом лизосомального фермента трипептидилпептидазы-1 (TPP1), вызванным мутацией в гене TPP1. Заболевание CLN2 наследуется как аутосомно-рецессивное расстройство с предполагаемой частотой 0,5 на 100000 живорожденных детей. В отсутствие TPP1 запасные вещества лизосом, обычно метаболизируемые ферментом, накапливаются во многих органах, а накопление в центральной нервной системе приводит к нейродегенеративным симптомам, характерным для заболевания CLN2. Протекание заболевания CLN2 в отсутствие лечения хорошо охарактеризовано, естественная динамика заболевания удивительно последовательна и предсказуема, о чем свидетельствуют данные естественной динамики для независимых популяций пациентов в Северной Америке и Европе.
[005] Заболевание CLN2 имеет преимущественно «классический» поздний инфантильный фенотип. Дети с заболеванием CLN2 обычно развиваются нормально до 3 лет, когда появляются первые симптомы. Чаще всего у пациентов с CLN2 возникнет первый неспровоцированный приступ и начнется отставание в прохождении нормальных стадий развития речевой функции. В возрасте 3 лет у всех пациентов наблюдаются один или более признаков заболевания, включая, например, судороги, деменцию, потерю двигательной функции, двигательное расстройство, слепоту, неуклюжесть, атаксию и снижение когнитивных способностей. С самого начала проявления клинических симптомов заболевание протекает быстро и агрессивно, что в целом приводит к полной потере речи, когнитивной функции, походки, тонкой моторики, функции продолговатого мозга и зрения в течение от 2 до 4 лет, что делает пациентов неподвижными, немыми и слепыми. Пациент остается в вегетативном состоянии до смерти, обычно наступающей между 6 и 12 годами.
[006] Для оценки тяжести заболевания CLN2 клиническими специалистами были разработаны две количественные рейтинговые шкалы, которые применялись в исследованиях естественной динамики: (1) Гамбургская шкала (Steinfeld et al., Am J Med Genet. 2002; 112(4):347-54); и (2) шкала Медицинского колледжа Вейл Корнелл (МКВК) (Worgall et al., Neurology. 2007; 69(6):521-35). Структура и методология оценки двух шкал аналогичны. Обе шкалы измеряют потерю ранее достигнутых важных неврологических «вех» развития у пациентов с CLN2, причем каждый балл снижения по шкале оценки заболевания представляет собой фундаментальную веху прогрессирующей деградации.
[007] Анализ течения заболевания у пораженных CLN2 детей в отсутствие лечения показывает, что после начала заболевания, они предсказуемо утрачивают речь и походку в возрасте 3 лет, с потерей в среднем, 2,1 события «вех» развития (например, снижение на 2,1 балла по шкале оценки заболевания) ежегодно. Обычно деградация речи предшествует деградации походки, так что первый год характеризуется потерей понятной речи и прогрессированием до атаксической походки, второй год характеризуется потерей вставания и внятного языка, а третий год характеризуется потерей любой двигательной активности или коммуникации.
[008] Рекомбинантная трипептидилпептидаза-1 человека (rhTPP1) разрабатывается в качестве возможного терапевтического средства при заболевании CLN2. Белок rhTPP1 вырабатывается в культуре клеток в виде зимогена (профермента), который не обладает ферментативной активностью. Профермент автоматически активируется при кислом значении рН (и лизосомальными протеазами) при захвате лизосомой. Зрелый нативный белок TPP1 представляет собой лизосомальную серинпротеазу и у млекопитающих является единственным известным членом семейства седолизина (серинкарбоксилпептидазы), характеризующегося в высокой степени консервативной каталитической триадой Ser-Glu-Asp (SED). Каталитическая триада в rhTPP1 образована S456, E253 и D341. Основной активностью фермента является трипептидилэкзопептидазная с широким спектром специфичности в отношении субстратов. Воздействие фермента на его субстрат приводит к последовательному высвобождению трипептидов на N-конце белкового субстрата (Oyama et al., J Biochem. 2005; 138(2):127-34). Кроме того, сообщалось о вторичной, значительно более слабой эндопротеолитической активности с оптимальным значением рН 3 (Lin et al., J Biol Chem. 2001; 276(3):2249-55).
[009] Единственные коммерчески доступные для лечения CLN2 терапевтические средства являются симптоматическими и поддерживающими; в данное время не существует одобренных терапевтических возможностей для замедления или остановки неумолимого прогрессирования CLN2, а тем более для обращения вредных последствий заболевания (Mole, S.E., and Williams, R.E., 2010, GeneReviews; Chang et al., in The Neuronal Ceroid Lipofuscinoses (Batten Disease); 2011, Oxford Univ Press). Сохранение двигательной, речевой функции и/или способности видеть для таких детей было бы клинически значимым преимуществом как для пациентов, так и для родителей/опекунов. Таким образом, существует потребность в новых методах лечения CLN2, которые уменьшают или предотвращают ухудшение физиологических функций в связи с заболеванием.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0010] Данное изобретение относится к препаратам, наборам, способам и медицинскому применению, которые содержат рекомбинантную трипептидилпептидазу-1 человека (rhTPP1) для лечения заболевания нейрональным цероидным липофусцинозом (CLN2) и лечения или предотвращения одного, или более физиологических симптомов, связанных с началом заболевания. В одном аспекте данное изобретение относится к препарату, содержащему rhTPP1 для интрацеребровентрикулярного, интратекального или внутриглазного введения. Необязательно, rhTPP1 содержит аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 2 или ее фрагмент, например, в концентрации около 30 мг/мл в препарате. Значение рН препарата может составлять около 6,5. Препарат может дополнительно содержать любое из калия хлорида в концентрации от около 0,01 мг/мл до около 1 мг/мл, магния хлорида гексагидрата в концентрации от около 0,01 до около 1 мг/мл, кальция хлорида дигидрата в концентрации от около 0,01 мг/мл до около 1 мг/мл, двухосновного натрия фосфата гептагидрата в концентрации от около 0,01 до около 1 мг/мл, одноосновного натрия фосфата моногидрата в концентрации от около 0,01 мг/мл до около 1 мг/мл, натрия хлорида в концентрации от около 1 мг/мл до около 20 мг/мл; или комбинации любого или всего вышеперечисленного. Необязательно, препарат не содержит консервантов и/или является стабильным при температуре около 5 °C, например, в течение по меньшей мере около 6 месяцев. В одном варианте реализации изобретения препарат содержит rhTPP1 в концентрации около 30 мг/мл, двухосновный натрия фосфат гептагидрат в концентрации около 0,11 мг/мл, одноосновный натрия фосфат моногидрат в концентрации около 0,08 мг/мл, натрия хлорид в концентрации около 8,77 мг/мл, калия хлорид в концентрации около 0,22 мг/мл, магния хлорид гексагидрат в концентрации около 0,16 мг/мл и кальция хлорид дигидрат в концентрации около 0,21 мг/мл.
[0011] В другом аспекте данного изобретения предлагается способ лечения заболевания CLN2, или одного или более симптомов, связанных с заболеванием CLN2, включающий введение около 10 мл композиции, содержащих дозу около 300 мг rhTPP1, субъекту, нуждающемуся в этом, причем композицию вводят субъекту на протяжении около 4 часов. Кроме того, в изобретении предлагается композиция, содержащая rhTPP1, для применения при лечении заболевания CLN2 или одного, или более симптомов, связанных с заболеванием CLN2, у субъекта, включающего около 10 мл композиции, содержащих дозу около 300 мг rhTPP1, причем дозу следует вводить субъекту на протяжении около 4 часов. В изобретении дополнительно предлагается применение rhTPP1 для производства лекарственного средства для лечения заболевания CLN2 или одного, или более симптомов, связанных с заболеванием CLN2, причем лекарственное средство содержит около 10 мл композиции, содержащих дозу около 300 мг rhTPP1, и, при этом, дозу следует вводить субъекту на протяжении около 4 часов. В одном аспекте композицию, содержащую rhTPP1, вводят субъекту через катетер. За введением композиции необязательно следует промывка катетера путем введения промывочного раствора в количестве до около 5 мл, предпочтительно в количестве около 3 мл, более предпочтительно в количестве около 2 мл. Кроме того, в изобретении предлагается способ предотвращения или замедления развития одного или более симптомов заболевания CLN2, включающий введение около 10 мл композиции, содержащих дозу около 300 мг rhTPP1 субъекту, нуждающемуся в этом, причем у субъекта необязательно присутствует семейный анамнез заболевания CNL2, и, при этом, композицию вводят субъекту на протяжении около 4 часов. В одном аспекте композицию, содержащую rhTPP1, вводят субъекту через катетер. За введением композиции необязательно следует промывка катетера путем введения промывочного раствора в количестве до около 5 мл, предпочтительно в количестве около 3 мл, более предпочтительно в количестве около 2 мл. Композицию можно вводить интратекально, интрацеребровентрикулярно и/или внутриглазным способом, причем ее можно вводить каждую вторую неделю. Необязательно композицию вводят интрацеребровентрикулярно или интратекально, причем вводят без удаления спинномозговой жидкости у субъекта непосредственно перед введением композиции, содержащей rhTPP1. В другом варианте реализации изобретения композицию можно вводить изоволюметрическим способом, т.е. с удалением определенного объема СМЖ у пациента, который приблизительно равен объему композиции, вводимой после этого интратекально.
[0012] В одном аспекте данного изобретения предлагается способ лечения заболевания CLN2 или одного, или более симптомов, связанных с заболеванием, причем способ включает введение rhTPP1 субъекту, нуждающемуся в этом, в дозе и/или с частотой, эффективной для сохранения физиологической функции или замедления, или уменьшения степени ухудшения физиологической функции у субъекта, притом, что физиологическая функция представляет собой речевую функцию, двигательную функцию, зрение или функцию питания. В изобретении дополнительно предлагается композиция, содержащая rhTPP1, для применения при лечении заболевания CLN2 или одного, или более симптомов, связанных с этим заболеванием, у субъекта, причем композиция содержит дозу rhTPP1, эффективную для сохранения физиологической функции или замедления, или уменьшения степени ухудшения физиологической функции у субъекта, притом, что физиологическая функция представляет собой речевую функцию, двигательную функцию, зрение или функцию питания. Кроме того, в изобретении предлагается применение rhTPP1 для производства лекарственного средства для лечения заболевания CLN2 или одного, или более симптомов, связанных с заболеванием, причем лекарственное средство содержит дозу rhTPP1, эффективную для сохранения физиологической функции или замедления, или уменьшения степени ухудшения физиологической функции у субъекта, притом, что физиологическая функция представляет собой речевую функцию, двигательную функцию, зрение или функцию питания.
[0013] В другом аспекте данного изобретения предлагается способ лечения заболевания CLN2 у субъекта или одного, или более симптомов, связанных с заболеванием у субъекта, причем способ включает введение rhTPP1 субъекту, нуждающемуся в этом, в дозе и/или с частотой, эффективной для улучшения физиологической функции у субъекта, притом, что физиологическая функция представляет собой речевую функцию, двигательную функцию, зрение или функцию питания. В изобретении дополнительно предлагается композиция, содержащая rhTPP1, для применения при лечении заболевания CLN2 или одного, или более симптомов, связанных с этим заболеванием, у субъекта, причем композиция содержит дозу rhTPP1, эффективную для улучшения физиологической функции у субъекта, притом, что физиологическая функция является речевой функцией, двигательной функцией, зрением или функцией питания. В изобретении дополнительно предлагается применение rhTPP1 для производства лекарственного средства для лечения заболевания CLN2 или одного, или более симптомов, связанных с заболеванием, причем лекарственное средство содержит дозу rhTPP1, эффективную для улучшения физиологической функции у субъекта, притом, что физиологическая функция представляет собой речевую функцию, двигательную функцию, зрения или функцию питания. В другом аспекте изобретения предлагается способ лечения заболевания CLN2 у субъекта или одного или более симптомов, связанных с заболеванием, у субъекта, причем способ включает введение rhTPP1 субъекту, нуждающемуся в этом, в дозе и/или с частотой, эффективной для предотвращения или лечения неврологического симптома заболевания, при котором неврологический симптом представляет собой уменьшение объема головного мозга, уменьшение объема серого вещества в головном мозге, припадок или увеличение объема внутричерепной спинномозговой жидкости. В изобретении дополнительно предлагается композиция, содержащая rhTPP1, для применения при лечении заболевания CLN2 или одного или более симптомов, связанных с этим заболеванием, у субъекта, причем композиция содержит дозу rhTPP1, эффективную для предотвращения или лечения неврологического симптома заболевания, притом, что неврологический симптом представляет собой уменьшение объема головного мозга, уменьшение объема серого вещества в головном мозге, припадок или увеличение объема внутричерепной спинномозговой жидкости. В изобретении дополнительно предлагается применение rhTPP1 для производства лекарственного средства для лечения заболевания CLN2 или одного или более симптомов, связанных с заболеванием, причем лекарственное средство содержит дозу rhTPP1, эффективную для предотвращения или лечения неврологического симптома заболевания, притом, что неврологический симптом представляет собой уменьшение объема головного мозга, уменьшение объема серого вещества в головном мозге, припадок или увеличение объема внутричерепной спинномозговой жидкости. Необязательно у субъекта присутствует семейный анамнез заболевания CLN2.
[0014] В другом аспекте данного изобретения предлагается способ предотвращения или уменьшения степени связанного с CLN2 ухудшения двигательной функции/походки у субъекта, причем способ включает введение субъекту терапевтически эффективной дозы rhTPP1. В изобретении дополнительно предлагается композиция, содержащая терапевтически эффективную дозу rhTPP1, для применения при предотвращении или уменьшении степени связанного с CLN2 ухудшения двигательной функции/походки у субъекта. В изобретении дополнительно предлагается применение терапевтически эффективной дозы rhTPP1 для производства лекарственного средства для предотвращения или уменьшения степени связанного с CLN2 ухудшения двигательной функции/походки у субъекта. В одном аспекте способ включает введение дозы rhTPP1, эффективно предотвращающей или уменьшающей степень снижения балла оценки клинического заболевания у субъекта по сравнению с предыдущим баллом оценки, определенным до или во время лечения, например, по данным измерения с применением шкалы оценки заболевания МКВК для походки или Гамбургской шкалы оценки заболевания для двигательной функции.
[0015] В другом аспекте данного изобретения предлагается способ предотвращения или уменьшения степени связанного с CLN2 ухудшения речевой функции у субъекта, причем способ включает введение субъекту терапевтически эффективной дозы rhTPP1. В изобретении дополнительно предлагается композиция, содержащая терапевтически эффективную дозу rhTPP1, для применения при предотвращении или уменьшении степени связанного с CLN2 ухудшения речевой функции у субъекта. В изобретении дополнительно предлагается применение терапевтически эффективной дозы rhTPP1 для производства лекарственного средства для предотвращения или уменьшения степени связанного с CLN2 ухудшения речевой функции у субъекта. В одном аспекте способ включает введение дозы rhTPP1, эффективно предотвращающей или уменьшающей степень снижения балла оценки клинического заболевания у субъекта по сравнению с предыдущим баллом оценки, определенным до или во время лечения, например, по данным измерения с применением шкалы оценки заболевания МКВК или Гамбургской шкалы оценки заболевания для речевой функции.
[0016] В другом аспекте данного изобретения предлагается способ предотвращения или уменьшения степени связанного с CLN2 ухудшения зрения у субъекта, причем способ включает введение субъекту терапевтически эффективной дозы rhTPP1. В изобретении дополнительно предлагается композиция, содержащая терапевтически эффективную дозу rhTPP1, для применения при предотвращении или уменьшении степени связанного с CLN2 ухудшения зрения у субъекта. В изобретении дополнительно предлагается применение терапевтически эффективной дозы rhTPP1 для производства лекарственного средства для предотвращения или уменьшения степени связанного с CLN2 ухудшения зрения у субъекта. В одном аспекте способ включает введение дозы rhTPP1, эффективно предотвращающей или уменьшающей степень снижения балла оценки клинического заболевания у субъекта по сравнению с предыдущим баллом оценки, определенным до или во время лечения, например, по данным измерения с применением Гамбургской шкалы оценки заболевания для зрительной функции.
[0017] В другом аспекте данного изобретения предлагается способ предотвращения или уменьшения степени связанного с CLN2 уменьшения объема головного мозга у субъекта, причем способ включает введение субъекту терапевтически эффективной дозы rhTPP1. В изобретении дополнительно предлагается композиция, содержащая терапевтически эффективную дозу rhTPP1, для применения при предотвращении или уменьшении степени связанного с CLN2 уменьшения объема головного мозга у субъекта. В изобретении дополнительно предлагается применение терапевтически эффективной дозы rhTPP1 для производства лекарственного средства для предотвращения или уменьшения связанного с CLN2 уменьшения объема головного мозга у субъекта. В одном аспекте способ включает введение дозы rhTPP1, эффективно предотвращающей или уменьшающей степень уменьшения объема головного мозга и/или уменьшения объема серого вещества по сравнению с предыдущим объемом, определенным до или во время лечения.
[0018] В одном аспекте данного изобретения предлагается набор, включающий препарат, который содержит rhTPP1, описанную в данном документе, и промывочный раствор. Промывочный раствор может содержать любой из препаратов по изобретению, без rhTPP1. Например, промывочный раствор может содержать двухосновный натрия фосфат гептагидрат в концентрации около 0,11 мг/мл, одноосновный натрия фосфат моногидрат в концентрации около 0,08 мг/мл, натрия хлорид в концентрации около 8,77 мг/мл, калия хлорид в концентрации около 0,22 мг/мл, магния хлорид гексагидрат в концентрации около 0,16 мг/мл и кальция хлорид дигидрат в концентрации около 0,21 мг/мл. Необязательно, набор дополнительно включает резервуар для имплантации и катетер. Необязательно, набор может включать один или более элементов, выбранных из группы, состоящей из удлинительной линии, встроенного фильтра, иглы порта, по меньшей мере одного (необязательно двух) шприца, по меньшей мере одной (необязательно двух) иглы шприца и их комбинации.
[0019] Приведенное выше краткое описание сути изобретения не предназначено для определения каждого аспекта данного изобретения, и другие признаки и преимущества данного изобретения станут очевидными из последующего подробного описания, включая графические материалы. Данное описание является связанным как единый документ, и необходимо понимать, что включены все комбинации признаков, описанных в данном документе, даже если комбинация признаков не содержится в одном и том же предложении, абзаце или разделе данного документа. Кроме того, описание включает в качестве дополнительного аспекта все варианты реализации изобретения, более узкие по своему охвату, чем варианты реализации изобретения, конкретно упомянутые выше. Что касается аспектов изобретения, описанных или заявленных с помощью форм единственного числа, необходимо понимать, что эти термины означают «один или более», если контекст не требует недвусмысленно более ограниченного значения. Что касается элементов, описанных как один или более в наборе, необходимо понимать, что включены все комбинации в наборе. Если аспекты изобретения описываются как «обладающие» признаком, то варианты реализации изобретения также предполагаются «состоящими из» или «по сути состоящими из» признака. Дополнительные признаки и варианты реализации изобретения будут очевидны для специалистов в данной области техники из полного описания данной заявки, причем все такие признаки включены в качестве аспектов изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0020] На Фиг. 1 проиллюстрирована аминокислотная последовательность зимогена rhTPP1 без связанного сигнального пептида. Просегмент фермента представляет собой первые 176 аминокислотных остатков, а длина зрелого фермента составляет 368 аминокислот, начиная с позиции 177.
[0021] На Фиг. 2 представлено клиническое прогрессирование субъектов с заболеванием CLN2 в отсутствие лечения согласно исследованию естественной динамики, причем проиллюстрирован объединенный балл для двигательной и речевой функции от 0 до 6 согласно Гамбургской шкале как функция возраста пациента. Приведены медиана, квартиль и распределение 10%/90%; в дополнение к среднему значению и 95% доверительному интервалу.
[0022] На Фиг. 3A-3F представлены результаты клинической оценки 24 пациентов, накопленные за время лечения и демонстрирующие комплексный балл для двигательной и речевой функции от 0 до 6 согласно Гамбургской шкале. Открытые круги представляют балл CLN2, полученный до или при первой инфузии 300 мг rhTPP1, тогда как замкнутые круги представляют балл CLN2, полученный после первой инфузии 300 мг rhTPP1. Проиллюстрированы как объединенный балл (круги), так и вклад двигательной функции/походки (квадраты) и речевой функции (треугольники) в объединенный балл. День анализа 1 представляет собой дату первой инфузии.
[0023] На Фиг. 4А-4I сравнивается изменение балла CLN2 у 9 пациентов, получавших rhTPP1, и пациентов с естественной динамикой в отсутствие лечения, сопоставленных с леченными субъектами по объединенному баллу для двигательной и речевой функции от 0 до 6 согласно Гамбургской шкале оценки заболевания (обозначены приставкой «HAM»). Результаты пациентов, получавших лечение, представлены сплошной линией на каждой панели по сравнению с результатами для пациентов с естественной динамикой в отсутствие лечения, которые представлены пунктирной линией.
[0024] На Фиг. 5 представлено распределение клинических изменений по сравнению с начальным значением для сопоставленных нелеченных пациентов с естественной динамикой (круги) в течение периода лечения пациента по сравнению с участниками исследования (квадраты).
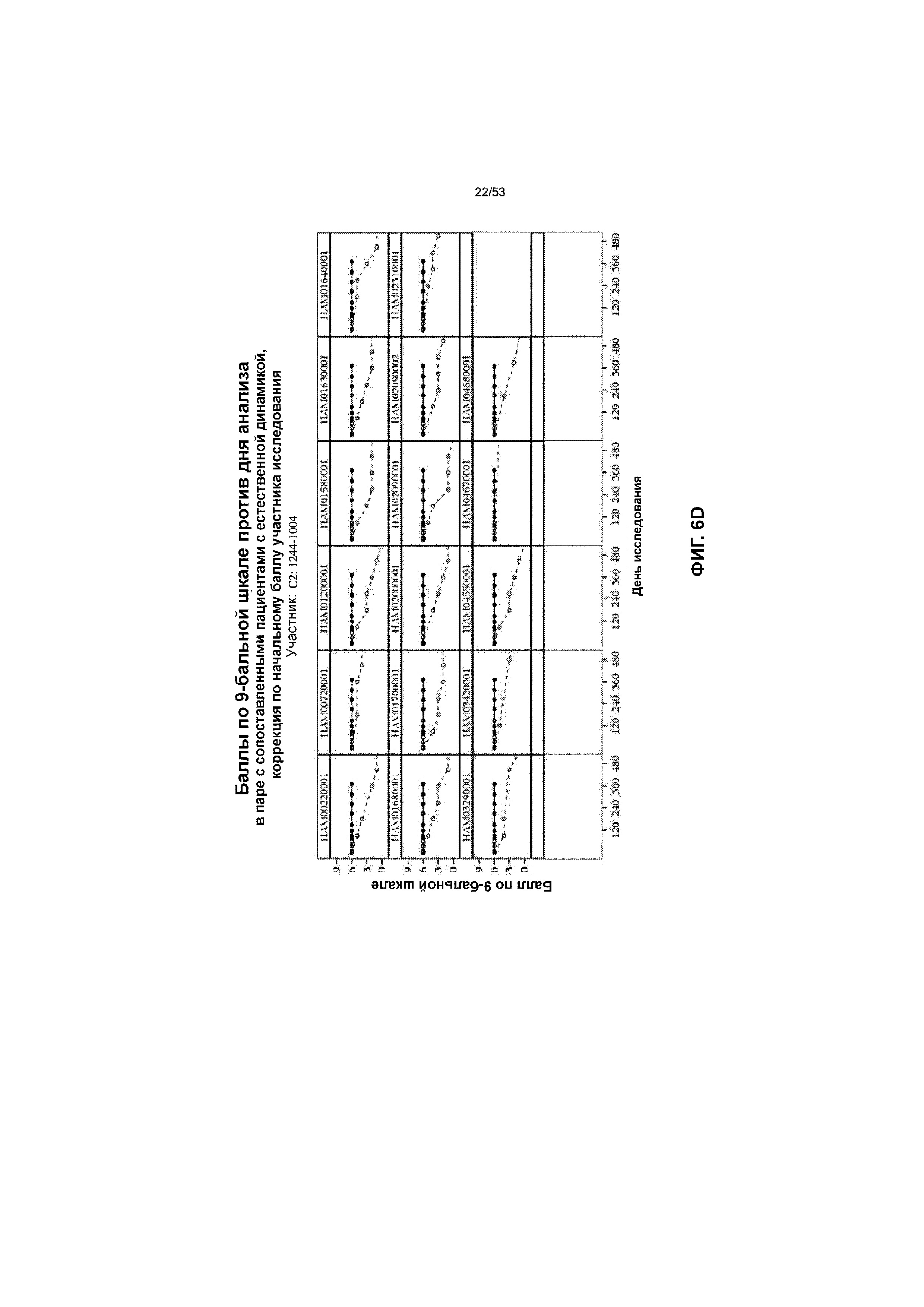
[0025] На Фиг. 6A-6I представлены изменения балла CLN2 для 9 пациентов, получавших rhTPP1, по сравнению с нелеченными пациентами с естественной динамикой, сопоставленными по объединенному баллу оценки заболевания для двигательной/речевой функции и зрения от 0 до 9 согласно Гамбургской шкале. Результаты пациентов, получавших лечение, представлены сплошной линией на каждой панели по сравнению с результатами для пациентов с естественной динамикой в отсутствие лечения, которые представлены пунктирной линией.
[0026] На Фиг. 7 представлен объем (верхняя панель) и доля (нижняя панель) спинномозговой жидкости для всех 24 пациентов, для которых проводились измерения на протяжении периода лечения. Каждая строка представляет одного пациента.
[0027] На Фиг. 8A-8L представлен объем головного мозга 24 пациентов, получавших лечение. Значения объема (верхняя панель) и доли (нижняя панель) белого вещества представлены как разница между объемом всего головного мозга (штриховая линия) и СМЖ и серым веществом (пунктирная линия), а объем серого вещества представлен как разница между СМЖ и серым веществом (пунктирная линия) и СМЖ (сплошная линия).
[0028] На Фиг. 9А и 9В представлено среднее изменение балла CLN2 для пациентов, получавших rhTPP1, и нелеченных пациентов с естественной динамикой. На Фиг. 9А проиллюстрирован балл CLN2 для 23 пациентов, получавших 300 мг rhTPP1 в течение 48 недель (пунктирная линия), и нелеченной когорты с естественной динамикой из 41 пациента (сплошная линия). На Фиг. 9В представлено изменение балла CLN2 по сравнению с начальным значением для 23 пациентов, получавших 300 мг rhTPP1 в течение 48 недель.
[0029] На Фиг. 10A-10L представлены результаты клинической оценки 24 пациентов, накопленные на протяжении периода лечения, которые иллюстрируют объединенный балл для двигательной функции (квадраты), речевой функции (треугольники), припадков (кресты) и зрения (звездочки) от 0 до 12 согласно Гамбургской шкале (левая панель) и объединенный балл для походки (квадраты), речевой функции (треугольники), миоклонуса (кресты) и питания (звездочки) от 0 до 12 согласно шкале МКВК (правая панель). Открытые круги представляют объединенный балл CLN2, полученный до или при первой инфузии 300 мг rhTPP1, тогда как замкнутые круги представляют объединенный балл CLN2, полученный после первой инфузии 300 мг rhTPP1.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0030] Следующие определения могут быть полезны для специалиста в данной области в понимании изобретения. Если не указано иное, то научные и технические термины, используемые в данном документе, имеют значение, обычно придаваемое им специалистами в данной области техники. В тех случаях, когда приведен диапазон значений, необходимо понимать, что в изобретение включено каждое промежуточное значение до десятой доли нижнего предела, если контекст явно не диктует иного, между верхним и нижним пределом указанного диапазона и любым другим заявленным или промежуточным значением в указанном заявленном диапазоне. Верхний и нижний пределы таких меньших диапазонов могут быть независимо включены в меньшие диапазоны с учетом любого специально исключенного предела в указанном диапазоне.
[0031] Термин «семейный анамнез» относится к субъекту, у которого есть кровный родственник с диагнозом заболевания CLN2, например, родной брат/сестра, родитель, дед/бабушка, прадед/прабабушка и т.д.
[0032] Термин «фрагмент» относится, в одном аспекте, к рекомбинантному белку, содержащему часть аминокислотной последовательности профермента rhTPP1, представленной в SEQ ID NO: 1 и на Фиг 1. Например, фрагмент может содержать по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 90% или по меньшей мере около 95% аминокислотной последовательности, представленной в SEQ ID NO: 1. В другом аспекте фрагмент может содержать полноразмерную (длиной 368 аминокислот, аминокислоты 177-544 из SEQ ID NO: 1) аминокислотную последовательность зрелого фермента TPP1, представленную в SEQ ID NO: 2, ее часть и/или по меньшей мере каталитическую триаду, образованную аминокислотными остатками S456, E253 и D341. Фрагмент сохраняет каталитическую активность. Например, фрагмент проявляет активность трипептидилэкзопептидазы и/или проявляет каталитическую активность, которая приводит к последовательному высвобождению трипептидов на N-конце белкового субстрата. В некоторых аспектах «фрагмент» профермента rhTPP1 содержит по меньшей мере 500 аминокислот подряд из SEQ ID NO: 1, по меньшей мере 450 аминокислот подряд из SEQ ID NO: 1, по меньшей мере 400 аминокислот подряд из SEQ ID NO: 1, по меньшей мере 368 аминокислот из SEQ ID NO: 1, по меньшей мере 350 аминокислот из SEQ ID NO: 1 или по меньшей мере 300 аминокислот подряд из SEQ ID NO: 1. В других аспектах «фрагмент» профермента rhTPP1 содержит по меньшей мере 350 аминокислот подряд из SEQ ID NO: 2, по меньшей мере 325 аминокислот подряд из SEQ ID NO: 2, по меньшей мере 300 аминокислот подряд из SEQ ID NO: 2, по меньшей мере 275 аминокислот подряд из SEQ ID NO: 2, по меньшей мере 250 аминокислот подряд из SEQ ID NO: 2 или по меньшей мере 200 аминокислот подряд из SEQ ID NO: 2.
[0033] Термин «интрацеребровентрикулярный» относится к введению композиции в систему желудочков головного мозга, например, с помощью инъекции, инфузии или имплантации (например, в желудочек головного мозга).
[0034] Термин «внутриглазной способ» относится к введению композиции в область глаза, например, с помощью инъекции, инфузии или имплантации (например, в глазное яблоко) или местному/офтальмологическому введению (например, с помощью крема, мази, геля или жидких капель).
[0035] Термин «интратекальный» относится к введению композиции в поясничную область, например, с помощью инъекции, инфузии или имплантации (например, в субарахноидальное пространство спинного мозга).
[0036] Термин «терапевтически эффективный» относится к любой терапевтической пользе, которая возникает в результате применения способов лечения по данному изобретению. Например, такой эффект может быть полезным эффектом, который проявляется в соответствующей ткани- или органе-мишени, причем такой полезный физиологический эффект сравнивается с таким же физиологическим параметром, измеренным в отсутствие ферментзаместительной терапии. Указанным терапевтическим эффектом может быть любое уменьшение или устранение одного, или более клинических или субклинических проявлений заболевания CLN2. Например, терапевтически эффективное лечение улучшает, устраняет, замедляет, предотвращает или уменьшает степень ухудшения одной или более физиологических функций и/или неврологического симптома CLN2, описанных в данном документе.
[0037] Термин «стабильный» или «стабилизированный» относится к препарату, содержащему белок, в котором белковый компонент по существу сохраняет свою физическую, функциональную и/или химическую стабильность при хранении в течение длительного времени. Стабильность может быть измерена при выбранной температуре в течение выбранного периода времени. Предпочтительно препарат является стабильным при комнатной температуре (около 30°C) или при около 40°C в течение по меньшей мере 1 месяца и/или является стабильным при температуре от около 2°C до около 8°C в течение по меньшей мере 1 года и предпочтительно по меньшей мере 2 лет. Например, степень деградации или агрегации белка во время хранения может применяться в качестве показателя стабильности белка. Таким образом, «стабильным» препаратом может быть такой, в котором менее чем около 20%, более предпочтительно менее чем около 10% и наиболее предпочтительно менее чем около 5% белкового компонента присутствует в препарате в деградированной или агрегированной форме после хранения. «Стабильные» препараты по существу сохраняют функциональные или терапевтические характеристики недавно приготовленного препарата. Различные аналитические методы измерения стабильности белка доступны в уровне техники и рассматриваются, например, в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991), и Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993).
[0038] Термин «предупреждает» или «уменьшает» или его грамматические эквиваленты при использовании со ссылкой на предотвращение или уменьшение одного, или более симптомов или физиологических последствий заболевания CLN2 у субъекта означает, что скорость уменьшения такого/таких симптома(ов) у леченного субъекта с CLN2 меньше, чем у нелеченного субъекта с CLN2. В этом отношении нелеченный субъект с CLN2 может быть тем же субъектом, которого в дальнейшем лечат композицией по данному изобретению или может соответствовать средней скорости ухудшения целевого(ых) симптома(ов), наблюдаемой на основе результатов исследования естественной динамики, описанного в данном документе.
[0039] В юрисдикциях, которые запрещают патентование способов, осуществляемых на теле человека, значение «введения» rhTPP1 или его препарата в организм субъекта-человека относится к медицинскому применению rhTPP1 или его препарата, например, rhTPP1 или его препарата для применения при лечении заболевания CLN2, как описано в данном документе, или к применению rhTPP1 для производства лекарственного средства для лечения заболевания CLN2, как описано в данном документе. Предусматривается самая широкая интерпретация в разумных пределах, которая согласуется с законами или правилами, определяющими охраноспособный объект. В юрисдикциях, которые не запрещают патентование методов, осуществляемых на теле человека, «введение» rhTPP1 или его препарата включает как способы, осуществляемые на теле человека, так и вышеупомянутые виды действий.
[0040] В данном изобретении предлагаются препараты и наборы, содержащие rhTPP1, и способы их применения для лечения заболевания CLN2. Введение rhTPP1 позволяет захват белка клетками с помощью катионнезависимого маннозо-6-фосфатного рецептора (КН-МФР) и локализацию в лизосомах клеток по всей центральной нервной системе. Захват фермента в лизосомы и последующая активация способствуют усилению катаболизма запасных веществ в пораженных тканях, уменьшает прогрессирующее накопление лизосомальных запасных веществ и останавливает прогресс заболевания. Препараты и способы по изобретению обеспечивают терапевтические преимущества, которые превосходят преимущества одобренных на сегодняшний день терапевтических средств.
[0041] Препараты
[0042] В изобретении предлагается препарат, содержащий rhTPP1, для интрацеребровентрикулярного, интратекального, и/или внутриглазного введения. В одном аспекте rhTPP1 содержит SEQ ID NO: 1 или ее фрагмент. Белки rhTPP1, пригодные для применения в препаратах и способах, описанных в данном документе, а также способы получения белков rhTPP1 описаны в патентах США №№ 6302685 и 8277800, включенных в настоящий документ посредством ссылки в полном объеме.
[0043] В одном аспекте rhTPP1 содержит аминокислотную последовательность из SEQ ID NO: 1 (аминокислоты 1-544 из аминокислотной последовательности, представленной на Фиг. 1) или ее фрагмент, обладающий каталитической активностью. В другом аспекте rhTPP1 содержит аминокислотную последовательность из SEQ ID NO: 2 (аминокислоты 177-544 из аминокислотной последовательности, представленной на Фиг. 1) или ее фрагмент, обладающий каталитической активностью. В еще одном аспекте rhTPP1 обладает обнаружимой ферментативной активностью или процессируется in vivo до формы фермента, которая обладает обнаружимой ферментной активностью (т.е. является «функциональной») и обладает по меньшей мере около 70% идентичностью последовательности с SEQ ID NO: 1 или SEQ ID NO: 2. Например, функциональный rhTPP1 обладает идентичностью по меньшей мере около 70%, по меньшей мере около 75%, по меньшей мере около 80%, по меньшей мере около 85%, по меньшей мере около 90%, по меньшей мере около 95% или по меньшей мере около 97% с SEQ ID NO: 1 или SEQ ID NO: 2. В одном аспекте препарат представляет собой жидкий препарат, который содержит rhTPP1 в концентрации от около 1 мг/мл до около 100 мг/мл, например, от около 10 мг/мл до около 50 мг/мл, от около 25 мг/мл до около 40 мг/мл или от около 30 мг/мл до около 60 мг/мл. В различных аспектах препарат содержит rhTPP1 в концентрации от около 1 мг/мл до около 100 мг/мл, от около 5 мг/мл до около 80 мг/мл, от около 10 мг/мл до около 50 мг/мл, от около 20 мг/мл до около 40 мг/мл, от около 25 мг/мл до около 35 мг/мл, более конкретно около 1 мг/мл, около 10 мг/мл, около 20 мг/мл, около 30 мг/мл, около 40 мг/мл, около 50 мг/мл, около 60 мг/мл, около 70 мг/мл, около 80 мг/мл, около 90 мг/мл или около 100 мг/мл. В одном аспекте рН препарата составляет от около 5,5 до около 7,5 или от около 6,0 до около 7,0, например, около 5,5, около 6,0, около 6,5, около 7,0 или около 7,5.
[0044] В одном аспекте изобретения препарат по изобретению, содержащий rhTPP1, дополнительно содержит одно или более вспомогательные вещества, которые поддерживают уровень ключевого электролита в спинномозговой жидкости (СМЖ) или жидкости глаза. Например, в одном аспекте, помимо rhTPP1 или его фрагмента, препарат дополнительно содержит калия хлорид в концентрации от около 0,01 мг/мл до около 1 мг/мл, например, от около 0,1 мг/мл до около 0,5 мг/мл, от около 0,2 мг/мл до около 0,8 мг/мл, от около 0,2 мг/мл до около 0,4 мг/мл, от около 0,15 мг/мл до около 0,25 мг/мл или от около 0,05 мг/мл до около 0,3 мг/мл. В другом аспекте препарат дополнительно содержит магния хлорид гексагидрат в концентрации от около 0,01 мг/мл до около 1 мг/мл, например, от около 0,1 мг/мл до около 0,5 мг/мл, от около 0,1 мг/мл до около 0,8 мг/мл, от около 0,1 мг/мл до около 0,3 мг/мл, от около 0,15 мг/мл до около 0,25 мг/мл или от около 0,05 мг/мл до около 0,3 мг/мл. В другом аспекте препарат дополнительно содержит кальция хлорид дигидрат в концентрации от около 0,01 мг/мл до около 1 мг/мл, например, от около 0,1 мг/мл до около 0,5 мг/мл, от около 0,2 мг/мл до около 0,8 мг/мл, от около 0,15 мг/мл до около 0,25 мг/мл, от около 0,1 мг/мл до около 0,3 мг/мл или от около 0,05 мг/мл до около 0,3 мг/мл. В еще одном аспекте препарат содержит комбинацию всего или любого из вышеперечисленного.
[0045] В другом аспекте препарат, содержащий rhTPP1, дополнительно содержит один или более буферных агентов. Например, в различных аспектах препарат дополнительно содержит двухосновный натрия фосфат гептагидрат в концентрации от около 0,01 мг/мл до около 1 мг/мл, например, от около 0,1 мг/мл до около 0,5 мг/мл, от около 0,05 мг/мл до около 0,4 мг/мл или от около 0,1 мг/мл до около 0,3 мг/мл; и/или одноосновный натрия фосфат моногидрат в концентрации от около 0,01 мг/мл до около 1 мг/мл, например, от около 0,01 мг/мл до около 0,2 мг/мл, от около 0,05 мг/мл до около 0,3 мг/мл, или от около 0,08 мг/мл до около 0,4 мг/мл.
[0046] В другом аспекте препарат дополнительно содержит изотонический агент, такой как натрия хлорид, в концентрации от около 1 мг/мл до около 20 мг/мл, например, от около 1 мг/мл до около 10 мг/мл, от около 5 мг/мл до около 15 мг/мл или от около 8 мг/мл до около 20 мг/мл. Другие буферные агенты и изотонические агенты, известные из уровня техники, являются пригодными и могут шаблонно применяться в препаратах по данному изобретению.
[0047] В одном аспекте препарат, содержащий около 30 мг/мл rhTPP1, дополнительно содержит двухосновный натрия фосфат гептагидрат в концентрации около 0,11 мг/мл, одноосновный натрия фосфат моногидрат в концентрации около 0,08 мг/мл, натрия хлорид в концентрации около 8,77 мг/мл, калия хлорид в концентрации около 0,22 мг/мл, магния хлорид гексагидрат в концентрации около 0,16 мг/мл, кальция хлорид дигидрат в концентрации около 0,21 мг/мл и разбавитель, такой как вода для инъекций.
[0048] Препараты rhTPP1 по данному изобретению являются стабильными и могут храниться в течение длительного периода времени без неприемлемого изменения качества, активности и чистоты. В одном аспекте препарат является стабильным при температуре около 5°C (например, от 2°C до 8°C) в течение по меньшей мере 1 месяца, например, по меньшей мере 1 месяц, по меньшей мере 3 месяца, по меньшей мере 6 месяцев, не менее чем 12 месяцев, не менее чем 18 месяцев, не менее чем 24 месяца или более. В другом аспекте препарат является стабильным при температуре ниже или равной около -20°C, в течение по меньшей мере 6 месяцев, например, по меньшей мере 6 месяцев, по меньшей мере 12 месяцев, по меньшей мере 18 месяцев, по меньшей мере 24 месяца, не менее чем 36 месяцев или более. В другом аспекте препарат является стабильным при температуре ниже или равной около -40°C в течение по меньшей мере 6 месяцев, например, по меньшей мере 6 месяцев, по меньшей мере 12 месяцев, по меньшей мере 18 месяцев, по меньшей мере 24 месяца, не менее 36 месяцев или более. В другом аспекте препарат является стабильным при температуре ниже или равной около -60°C в течение по меньшей мере 6 месяцев, например, по меньшей мере 6 месяцев, по меньшей мере 12 месяцев, по меньшей мере 18 месяцев, по меньшей мере 24 месяца, по меньшей мере 36 месяцев или более.
[0049] В одном аспекте препарат по изобретению не содержит консервантов и/или не содержит стабилизаторов и, таким образом, не содержит ничего из тимеросала, фенилмеркуратных солей, хлоргексидина, фенола, бензойной кислоты, сорбиновой кислоты, парабенов, спиртов или других консервантов, обычно встречающиеся в парентеральных или офтальмологических препаратах.
[0050] В другом аспекте препарат по данному изобретению может содержать один или более консервантов, стабилизаторов или вспомогательных веществ. В связи с этим из уровня техники известны многочисленные примеры хорошо известных и широко применяемых консервантов, стабилизаторов и вспомогательных веществ, пригодных для белоксодержащих препаратов для интратекального или ИЦВ введения. Более конкретно, примеры таких добавок к ферментсодержащим препаратам для применения путем интратекального или ИЦВ введения описаны в WO 2013/096899, которая включена в настоящий документ посредством ссылки.
[0051] Способы
[0052] В изобретении предлагаются способы лечения заболевания CLN2, включающие введение терапевтически эффективного количества препарата, содержащего описанную в данном документе rhTPP1, субъекту, нуждающемуся в этом. В изобретении дополнительно предлагается композиция, содержащая rhTPP1, для применения при лечении заболевания CLN2, описанного в данном документе, и применение rhTPP1 для производства лекарственного средства для лечения заболевания CLN2, описанного в данном документе. В одном аспекте степень тяжести и прогрессирование заболевания CLN2 и терапевтическое преимущество введения rhTPP1 у пациента могут быть измерены с применением Гамбургской или МКВК шкалы оценки клинического заболевания. Как Гамбургская, так и МКВК шкала состоят из четырех связанных с заболеванием блоков, которые оцениваются в баллах по субшкалам от 0 до 3 баллов, где 3 балла соответствуют норме, 2 балла соответствуют отклонению от нормы с сохранением функциональности, 1 балл соответствует отклонению от нормы с заметным ухудшением функциональности, и 0 баллов соответствует отсутствию остаточной функции. Два из четырех блоков, походка/двигательная функция и речевая функция, являются общими для двух шкал, причем им присуща высокая степень достоверности содержимого. Каждая шкала в целом фиксирует происходящие изменения как функцию прогрессирования заболевания, а также контроля заболевания. Шкалы частоты припадков, речевой функции и зрения охватывают прогрессирование заболевания. Частота припадков, двигательные нарушения и питание зависят от решений по уходу, в частности противосудорожных препаратов и контроля питательной трубки. Клинический прогресс часто оценивают с применением объединенных субшкал речевой функции и походки, таким образом, что оценка 6 баллов соответствует норме для данного возраста, а 0 баллов - полной потере функции. В Табл. 1 приведены МКВК и Гамбургская шкалы заболевания CLN2.
ТАБЛИЦА 1
[0053] В различных аспектах изобретения предлагается способ лечения заболевания CLN2 или одного, или более клинических симптомов заболевания CLN2, причем способ включает введение композиции, содержащей терапевтически эффективное количество rhTPP1, субъекту, нуждающемуся в этом, применение rhTPP1 для производства лекарственного средства для лечения заболевания CLN2 у субъекта или rhTPP1 для применения при лечении заболевания CLN2 у субъекта.
[0054] В данном изобретении дополнительно предлагаются способы предотвращения одного или более клинических симптомов заболевания CLN2, включающие введение препарата, содержащего описанную в данном документе rhTPP1, субъекту, нуждающемуся в этом, причем у субъекта необязательно присутствует семейный анамнез заболевания CLN2. В различных аспектах изобретения предлагается способ предотвращения одного или более клинических симптомов заболевания CLN2, включающий введение композиции, содержащей терапевтически эффективное количество rhTPP1, субъекту, нуждающемуся в этом, применение rhTPP1 для производства лекарственного средства для предотвращения одного или более клинических симптомов заболевания CLN2 у субъекта или rhTPP1 для применения при предотвращении одного или более клинических симптомов заболевания CLN2 у субъекта, причем у субъекта необязательно присутствует семейный анамнез заболевания CLN2.
[0055] Кроме того, в изобретении предлагаются способы лечения заболевания CLN2, включающие введение rhTPP1 субъекту, нуждающемуся в этом, в дозе, эффективной для сохранения физиологической функции или замедления, или уменьшения степени ухудшения физиологической функции у субъекта, причем физиологическая функция представляет собой речевую функцию, двигательную функцию, зрение или функцию питания. В изобретении дополнительно предлагается применение rhTPP1 для производства лекарственного средства для сохранения физиологической функции или замедления или уменьшения степени ухудшения физиологической функции у субъекта с CLN2, и rhTPP1 для применения с целью сохранения физиологической функции или замедления или уменьшения степени ухудшения физиологической функции у субъекта с заболеванием CLN2; причем физиологическая функция представляет собой речевую функцию, двигательную функцию, зрение или функцию питания.
[0056] В одном аспекте способ лечения субъекта с заболеванием CLN2 или семейным анамнезом заболевания CLN2 включает введение дозы rhTPP1 эффективной для сохранения речевой функции или замедления, или уменьшения степени ухудшения речевой функции у субъекта. В одном аспекте ухудшение речевой функции представляет собой уменьшение по меньшей мере на один балл по сравнению с результатами предыдущей оценки, полученными до или во время лечения, по данным измерения с помощью шкалы оценки МКВК или Гамбургской шкалы оценки. Как в шкале МКВК, так и в Гамбургской шкале оценка 3 балла указывает на нормальную речевую функцию; 2 балла указывают на отклонение в речевой функции (понятная речь); 1 балл указывает на слабо/труднопонятную речь; а 0 баллов указывает на неразборчивую речь или ее отсутствие. В одном аспекте доза rhTPP1 является эффективной для сохранения баллов речевой функции субъекта на том же уровне, что и результаты предыдущей оценки, полученные до или во время лечения, например, 3 балла, 2 балла или 1 балл. В другом аспекте доза rhTPP1 является эффективной для замедления или уменьшения степени связанного с CLN2 ухудшения речевой функции у субъекта, что может быть продемонстрировано путем сохранения балла оценки речевой функции на том же уровне в течение более длительного периода времени или менее выраженного снижения балла оценки речевой функции по сравнению с тем, чего можно было бы ожидать, учитывая естественную динамику заболевания.
[0057] В другом аспекте способ лечения субъекта с CLN2 или семейным анамнезом CLN2 включает введение дозы rhTPP1, эффективной для сохранения двигательной функции или замедления, или уменьшения степени ухудшения двигательной функции у субъекта. В одном аспекте ухудшение двигательной функции представляет собой снижение по меньшей мере на один балл по сравнению с результатами предыдущей оценки, полученными до или во время лечения, по данным измерения с помощью шкалы баллов МКВК или Гамбургской шкалы баллов. Для оценки двигательной функции можно применять субшкалу клинической оценки походки из шкалы МКВК или субшкалу двигательной функции из Гамбургской шкалы. Как в шкале МКВК, так и в Гамбургской шкале оценка 3 балла указывает на нормальную походку; 2 балла указывают на отклонение от нормы с сохранением независимой походки, например, с частыми падениями или очевидной неуклюжестью; 1 балл указывает на нарушения походки, требующие посторонней помощи, например, невозможность ходить без посторонней помощи или только ползание; и 0 баллов указывает на неподвижность/неспособность субъекта к передвижению, например, в основном субъект прикован к постели. В одном аспекте доза rhTPP1 является эффективной для сохранения баллов оценки двигательной функции субъекта на уровне результатов предыдущей оценки, полученных до или во время лечения, например, 3 балла, 2 балла или 1 балл. В другом аспекте доза rhTPP1 является эффективной для замедления или уменьшения степени связанного с CLN2 ухудшения двигательной функции у субъекта, что может быть продемонстрировано путем поддержания баллов двигательной функции на том же уровне в течение более длительного периода времени или менее выраженного снижения баллов двигательной функции по сравнению с тем, что можно было бы ожидать, учитывая естественную динамику заболевания.
[0058] В еще одном аспекте способ лечения субъекта с CLN2 или семейным анамнезом CLN2 включает введение дозы rhTPP1 эффективной для сохранения зрения или замедления, или уменьшения степени ухудшения зрения у субъекта. В одном аспекте ухудшение зрения представляет собой уменьшение по меньшей мере на один балл по сравнению с результатами предыдущей оценки, полученными до или во время лечения, по данным измерения с помощью Гамбургской шкалы оценки заболевания. Согласно Гамбургской шкале, оценка 3 балла указывает на то, что субъект распознает желаемый объект и хватает его; 2 балла указывают на нарушение координации при хватании объектов; 1 балл указывает на то, что субъект реагирует на свет, а 0 баллов указывают на отсутствие у субъекта реакции на зрительные стимулы. В одном аспекте доза rhTPP1 является эффективной для сохранения баллов оценки зрения субъекта на уровне результатов предыдущей оценки, полученных до или во время лечения, например, 3 балла, 2 балла или 1 балл. В другом аспекте доза rhTPP1 является эффективной для замедления или уменьшения степени ухудшения зрения у субъекта с CLN2, что может быть продемонстрировано сохранением баллов оценки зрения на том же уровне в течение более длительного периода времени или менее выраженным ухудшением зрения по сравнению с тем, что можно было бы ожидать, учитывая естественную динамику заболевания.
[0059] В другом аспекте способ лечения субъекта с CLN2 или семейным анамнезом CLN2 включает введение дозы rhTPP1, эффективной для сохранения функции питания или замедления, или уменьшения степени ухудшения функции питания у субъекта. В одном аспекте ухудшение функции питания представляет собой уменьшение по меньшей мере на один балл по сравнению с результатами предыдущей оценки, полученными до или во время лечения, по данным измерения с помощью шкалы оценки МКВК. Согласно шкале МКВК оценка 3 балла указывает на отсутствие дисфункции глотания; 2 балла указывают на легкую дисфункцию глотания; 1 балл указывает на умеренную дисфункцию глотания, а 0 баллов указывает на то, что субъект зависит от гастростомической трубки. В одном аспекте доза rhTPP1 является эффективной для сохранения результатов оценки функции питания у субъекта на уровне результатов предыдущей оценки, полученных до или во время лечения, например, 3 балла, 2 балла или 1 балл. В другом аспекте доза rhTPP1 является эффективной для замедления или уменьшения степени связанного с CLN2 ухудшения функции питания у субъекта, что может быть продемонстрировано сохранением функции питания на том же уровне в течение более длительного периода времени или менее выраженным снижением результатов оценки функции питания, по сравнению с тем, что можно было бы ожидать, учитывая естественную динамику заболевания.
[0060] В изобретении дополнительно предлагаются способы лечения заболевания CLN2, включающие введение rhTPP1 субъекту, нуждающемуся в этом, в дозе, эффективной для улучшения физиологической функции, причем физиологическая функция представляет собой речевую функцию, двигательную функцию, зрение или функцию питания. В изобретении дополнительно предлагается применение rhTPP1 для производства лекарственного средства для улучшения физиологической функции у субъекта с CLN2, или rhTPP1 для применения с целью улучшения физиологической функции у субъекта с CLN2; причем физиологическая функция представляет собой речевую функцию, двигательную функцию, зрение или функцию питания. Учитывая прогрессирующий дегенеративный характер заболевания, улучшение речевой функции, двигательной функции, зрения и/или функции питания, указывающее на то, что испытуемый восстановил утраченную функцию, является особенно желательным, но его трудно достичь с помощью существующих возможностей лечения.
[0061] В одном аспекте способ лечения субъекта с заболеванием CLN2 включает введение дозы rhTPP1, эффективной для улучшения речевой функции у субъекта. В одном аспекте улучшение речевой функции представляет собой увеличение по меньшей мере на один балл по сравнению с результатами предыдущей оценки, полученными до или во время лечения, по данным измерения с помощью шкалы баллов МКВК или Гамбургской шкалы баллов. Например, результаты оценки субъекта могут повыситься с 1 балла или 2 баллов до оценки 3 балла, что означает возвращение к нормальной речевой функции, или улучшиться с 1 балла до 2 баллов.
[0062] В другом аспекте способ лечения субъекта с заболеванием CLN2 включает введение дозы rhTPP1 эффективной для улучшения двигательной функции у субъекта. В одном аспекте улучшение двигательной функции представляет собой увеличение по меньшей мере на один балл по сравнению с результатами предыдущей оценки, полученными до или во время лечения, по данным измерения с помощью шкалы оценки МКВК или Гамбургской шкалы оценки заболевания. Например, результаты оценки субъекта могут повыситься с 1 балла или 2 баллов до оценки 3 балла, что означает возвращение к нормальной походке или улучшиться с 1 балла до 2 баллов.
[0063] В одном аспекте способ лечения субъекта с заболеванием CLN2 включает введение дозы rhTPP1 эффективной для улучшения зрения у субъекта. В одном аспекте улучшение зрения представляет собой увеличение по меньшей мере на один балл по сравнению с результатами предыдущей оценки, полученными до или во время лечения, по данным измерения с помощью Гамбургской шкалы оценки заболевания. Например, результаты оценки субъекта могут повыситься с 1 балла или 2 баллов до оценки 3 балла или улучшиться с 1 балла до 2 баллов.
[0064] В другом аспекте способ лечения субъекта с заболеванием CLN2 включает введение дозы rhTPP1, эффективной для улучшения функции питания у субъекта. В одном аспекте улучшение функции питания представляет собой увеличение по меньшей мере на один балл по сравнению с результатами предыдущей оценки, полученными до или во время лечения, по данным измерения с помощью шкалы оценки заболевания МКВК. Например, результаты оценки субъекта могут повыситься с 1 балла или 2 баллов до оценки 3 балла, что означает возвращение к нормальному глотанию, или улучшиться с 1 балла до 2 баллов.
[0065] Кроме того, в изобретении предлагаются способы лечения заболевания CLN2, включающие введение rhTPP1 субъекту, нуждающемуся в этом, в дозе, эффективной для предотвращения или лечения неврологических симптомов заболевания, причем неврологический симптом представляет собой припадок, уменьшение объема головного мозга, уменьшение объема серого вещества в головном мозге или увеличение объема внутричерепной спинномозговой жидкости (СМЖ). В изобретении дополнительно предлагается применение rhTPP1 для производства лекарственного средства для предотвращения или лечения неврологического симптома у субъекта с CLN2 или семейным анамнезом CLN2, и rhTPP1 для применения в предотвращении или лечении неврологического симптома у субъекта с CLN2 или семейным анамнезом CLN2; причем неврологический симптом представляет собой припадок, уменьшение объема головного мозга, уменьшение объема серого вещества в головном мозге или увеличение объема внутричерепной СМЖ.
[0066] В одном аспекте способ лечения субъекта с CLN2 или семейным анамнезом CLN2 включает введение дозы rhTPP1, эффективной для сохранения или уменьшения количества припадков у субъекта. В одном аспекте доза является эффективной для уменьшения количества припадков в месяц, возникающих у субъекта. В другом аспекте доза является эффективной для увеличения баллов оценки припадков по крайней мере на один балл по сравнению с результатами предыдущей оценки, полученными до или во время лечения, с применением Гамбургской шкалы оценки заболевания. Согласно гамбургской шкале, оценка 3 балла указывает на отсутствие припадков в течение 3 месяцев; 2 балла указывают на 1-2 припадка в течение 3 месяцев; 1 балл указывает на 1 припадок в месяц; и 0 баллов - на более чем 1 припадок в месяц. В одном аспекте доза rhTPP1 является эффективной для сохранения количества припадков у субъекта на уровне результатов предыдущей оценки, полученных до или во время лечения, например, 3 балла, 2 балла или один балл. В другом аспекте доза rhTPP1 является эффективной для сохранения или уменьшения количества припадков у субъекта, что может быть продемонстрировано путем сохранения количества припадков в месяц в течение более длительного периода времени или менее выраженным снижением балла припадков по сравнению с тем, что можно было бы ожидать, учитывая естественную динамику заболевания.
[0067] В другом аспекте способ лечения субъекта с CLN2 или семейным анамнезом CLN2 включает введение дозы rhTPP1, эффективной для сохранения объема головного мозга или замедления, или снижения степени уменьшения объема головного мозга у субъекта. Атрофия головного мозга увеличивается по мере прогрессирования заболевания, что приводит к уменьшению объема головного мозга и сопутствующему увеличению объема и относительной доли внутричерепной СМЖ. Объем головного мозга можно измерить с помощью способов, известных из уровня техники, включая способы визуализации, такие как магнитно-резонансная томография (МРТ), компьютерная томография (КТ/КТ), позитронно-эмиссионная томография (ПЭТ), однофотонная эмиссионная компьютерная томография (ОЭКТ), электроэнцефалография (ЭЭГ), магнитоэнцефалография (МЭГ) и спектроскопия в ближней инфракрасной области (СБИО). В одном аспекте доза rhTPP1 является эффективной для замедления или снижения степени связанного с CLN2 уменьшения объема головного мозга у субъекта, что может быть продемонстрировано путем сохранения объема головного мозга в течение более длительного периода времени или менее выраженного уменьшения объема головного мозга по сравнению с тем, что можно было бы ожидать, учитывая естественную динамику заболевания.
[0068] В другом аспекте способ лечения субъекта с CLN2 или семейным анамнезом CLN2 включает введение дозы rhTPP1, эффективной для сохранения объема серого вещества в головном мозге или замедления, или снижения степени уменьшения объема серого вещества в головном мозге субъекта. Потеря серого вещества из-за атрофии головного мозга происходит по мере прогрессирования заболевания, что приводит к уменьшению процентной доли объема серого вещества в объеме головного мозга. Объем серого вещества в головном мозге можно оценить с применением способов, известных из уровня техники, например, способов визуализации, таких как МРТ, КТ/КТ, ПЭТ, ОЭКТ, ЭЭГ, МЭГ и СБИО. В одном аспекте доза rhTPP1 является эффективной для замедления или снижения степени уменьшения объема серого вещества у субъекта, что может быть продемонстрировано путем сохранения объема серого вещества в течение более длительного периода времени или менее выраженного уменьшения объема серого вещества в процентах от объема головного мозга по сравнению с тем, что можно было бы ожидать, учитывая естественную динамику заболевания.
[0069] В другом аспекте способ лечения субъекта с CLN2 или семейным анамнезом CLN2 включает введение дозы rhTPP1, эффективной для сохранения объема внутричерепной СМЖ или замедления увеличения объема внутричерепной СМЖ у субъекта. Объем внутричерепной СМЖ увеличивается, как и доля в общем объеме СМЖ, в результате атрофии головного мозга. Объем и долю внутричерепной СМЖ можно оценить с применением способов, известных из уровня техники, например, способов визуализации, таких как МРТ и КТ/КТ. В одном аспекте доза rhTPP1 является эффективной для замедления или снижения степени увеличения объема внутричерепной СМЖ у субъекта, что может быть продемонстрировано путем сохранения объема внутричерепной СМЖ в течение более длительного периода времени или менее выраженного увеличения объема внутричерепной СМЖ как процента от общего объема СМЖ по сравнению с тем, что можно было бы ожидать с учетом естественной динамики заболевания.
[0070] Приведенные выше способы, композиции для применения и применение могут дополнительно включать любые из следующих признаков, отдельно и в комбинации.
[0071] В одном аспекте способ, композиция для применения или применение по изобретению включают введение препарата, композиции или дозы, содержащих rhTPP1, субъекту непрерывно или беспрерывно на протяжении по меньшей мере около 1 часа, например, по меньшей мере около 1 часа, по меньшей мере около 2 часов, по меньшей мере около 3 часов, по меньшей мере около 4 часов, по меньшей мере около 5 часов, по меньшей мере около 6 часов или более. В другом аспекте способ или применение по изобретению включает введение препарата, композиции или дозы, содержащих от около 20 мг до около 500 мг, от около 30 мг до около 500 мг, от около 50 мг до около 500 мг, от около 100 мг до около 500 мг, от около 200 мг до около 400 мг, от около 250 мг до около 350 мг или от около 275 мг до около 325 мг rhTPP1, субъекту, нуждающемуся в этом, например, около 20 мг, около 30 мг, около 50 мг, около 100 мг, около 200 мг, около 300 мг, около 400 мг или около 500 мг rhTPP1. В одном аспекте способ или применение по изобретению включает введение препарата, композиции или дозы объемом около 20 мл или менее, около 15 мл или менее, около 10 мл или менее, около 7,5 мл или менее, или около 5 мл или менее, например, около 20 мл, около 15 мл, около 10 мл, около 9 мл, около 8 мл, около 7 мл, около 6 мл, около 5 мл, около 4 мл, около 3 мл около 2 мл, около 1 мл или около 0,5 мл на дозу или введение.
[0072] В различных аспектах, способ, композиция для применения или применение по изобретению включают введение препарата, композиции или дозы, содержащих rhTPP1, субъекту со скоростью, меньшей или равной около 2,5 мл препарата, композиции или дозы в час; меньшей или равной около 75 мг rhTPP1 в час; или меньшей или равной около 75 мг rhTPP1 на 2,5 мл препарата или композиции в час. Препарат, композицию или дозу необязательно вводят непрерывно или беспрерывно в течение периода по меньшей мере около 4 часов.
[0073] В одном аспекте способ, композиция для применения или применение по изобретению включают введение препарата, композиции или дозы, содержащих rhTPP1, один раз в неделю или реже, например, один раз в неделю, один раз в две недели или ежемесячно. Более конкретно, способ, композиция для применения или применение по изобретению включают введение препарата, композиции или дозы, содержащих rhTPP1, один раз в каждые 7 дней, 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней, 14 дней, 15 дней, 16 дней, 17 дней, 18 дней, 19 дней, 20 дней, 21 день, 22 дня, 23 дня, 24 дня, 25 дней, 26 дней, 27 дней, 28 дней, 29 дней, 30 дней или 31 день. В одном аспекте препарат, композицию или дозу вводят интрацеребровентрикулярно. В другом аспекте композицию, препарат или дозу вводят интратекально. В еще одном аспекте препарат, композицию или дозу вводят внутриглазным способом. В одном аспекте, препарат, композицию или дозу вводят интрацеребровентрикулярно или интратекально, а также внутриглазным способом. Интрацеребровентрикулярное введение позволяет проникновение в глубокие структуры серого вещества головного мозга, такие как таламус, стриатум и средний мозг, благодаря физиологии потока СМЖ, когда вентрикулярное введение позволяет протекание в третий и четвертый желудочки, а также просачивание сквозь нейропиль полушарий головного мозга, вдоль небольшого градиента давления от желудочка в субарахноидальное пространство. Интратекальное и интрацеребровентрикулярное введение рекомбинантного фермента для лечения лизосомальных болезней накопления описано в патенте США № 7442372, который включен в данном документе посредством ссылки в полном объеме.
[0074] Препарат, композиция или доза rhTPP1 по изобретению могут быть введены в виде однократной инъекции болюса дозы или серии инъекций (например, в головной мозг, поясничную область или глаз), или в виде непрерывной или беспрерывной инфузии, например, с помощью инфузионного насоса или другого имплантированного устройства. В одном аспекте препарат, композицию или дозу rhTPP1 вводят с помощью инфузионной системы, содержащей трубку, встроенный фильтр (например, около 0,2 мкм), резервуар (например, интратекальный или интрацеребровентрикулярный) и катетер. Часто, если композицию вводят интратекально или интрацеребровентрикулярно, до введения препарата у субъекта удаляют объем СМЖ, сравнимый с объемом вводимой композиции, чтобы предотвратить побочные эффекты, возникающие в результате искусственного увеличения внутримозгового или внутриоболочечного давления. Однако, как описано в Примере 3, в данном документе показано, что препарат, композицию или дозу rhTPP1 по изобретению можно вводить без удаления объема СМЖ у субъекта непосредственно перед введением препарата, композиции или дозы rhTPP1.
[0075] В одном аспекте способ или применение по изобретению включает введение субъекту с CLN2 около 10 мл препарата, композиции или дозы, содержащих около 300 мг rhTPP1, интрацеребровентрикулярно на протяжении около 4 часов каждые две недели.
[0076] Препараты и композиции по данному изобретению могут быть введены субъекту, нуждающемуся в этом непосредственно (т.е. не изоволюметрически) или могут быть введены после предварительного удаления определенного объема СМЖ у субъекта, причем указанный определенный объем приблизительно такой же, как объем вводимой последовательно композиции (т.е. изоволюметрически).
[0077] В одном аспекте способ, композиция для применения или применение по изобретению дополнительно включают введение субъекту промывочного раствора после введения rhTPP1. Промывочный раствор вводят таким же способом, что и rhTPP1, с помощью той же системы введения (например, инфузионной системы), чтобы удалить оставшуюся в системе введения rhTPP1 и обеспечить введение субъекту полной предусмотренной дозы rhTPP1. В одном аспекте промывочный раствор вводят (например, с помощью того же катетера, который ранее использовался для введения композиции, содержащей rhTPP1) субъекту в количестве от около 0,5 мл до около 5 мл, например, около 0,5 мл, около 1 мл, около 2 мл, около 3 мл или около 5 мл. В одном аспекте промывочный раствор содержит те же компоненты, что и препарат или композиция, содержащие rhTPP1, но без rhTPP1. В одном аспекте промывочный раствор содержит двухосновный натрия фосфат гептагидрат в концентрации около 0,11 мг/мл, одноосновный натрия фосфат моногидрат в концентрации около 0,08 мг/мл, натрия хлорид в концентрации около 8,77 мг/мл, калия хлорид в концентрации около 0,22 мг/мл, магния хлорид гексагидрат в концентрации около 0,16 мг/мл, кальция хлорид дигидрат в концентрации около 0,21 мг/мл и разбавитель, такой как вода для инъекций.
[0078] Наборы
[0079] В изобретении дополнительно предлагаются наборы, содержащие препарат rhTPP1, описанный в данном документе, в дозе и форме, подходящих для введения пациенту. В одном аспекте набор включает препарат, содержащий около 30 мг/мл rhTPP1, двухосновный натрия фосфат гептагидрат в концентрации около 0,11 мг/мл, одноосновный натрия фосфат моногидрат в концентрации около 0,08 мг/мл, натрия хлорид в концентрации около 8,77 мг/мл, калия хлорид в концентрации около 0,22 мг/мл, магния хлорид гексагидрат в концентрации около 0,16 мг/мл, кальция хлорид дигидрат в концентрации около 0,21 мг/мл и разбавитель, такой как вода для инъекций. В одном аспекте набор дополнительно содержит инструкции для интрацеребровентрикулярного, интратекального и/или внутриглазного введения терапевтических композиций по данному изобретению в дополнение к терапевтическому препарату. В другом аспекте набор дополнительно содержит промывочный раствор, описанный в данном документе. В еще одном аспекте набор дополнительно включает систему для введения композиции, содержащую любые или все из следующих компонентов: трубку, встроенный фильтр, резервуар для имплантации и катетер. В одном аспекте набор может включать катетеры, резервуары или другие устройства, предварительно заполненные терапевтическими препаратами по данному изобретению. Например, конкретно включены катетеры, предварительно заполненные около 100 мг rhTPP1, около 200 мг rhTPP1, около 300 мг rhTPP1, около 400 мг rhTPP1 или около 500 мг rhTPP1 в виде фармацевтически приемлемого препарата. В качестве альтернативы, набор может включать многоразовые катетеры, резервуары или другие устройства и подходящие количества фермента для заполнения таких устройств.
[0080] В некоторых вариантах реализации изобретения наборы по данному изобретению могут включать один или более из следующих компонентов: удлинительная линия (например, продукт номер 536040, Smiths Medical, Дублин ОН), встроенный фильтр (например, продукт номер FS116, Smiths Medical), иглы порта (например, продукт номер 21-2737-24, Smiths Medical), шприц или два или более шприцов (например, продукт номер 309604, Becton Dickinson, Франклин-Лейкс, Нью-Джерси) или игла шприца или две или более игл шприца (например, продукт номер 305196, Becton Dickinson).
[0081] Данное изобретение будет более понятным со ссылкой на следующие Примеры, которые приведены в качестве иллюстрации и не предназначены для ограничения.
ПРИМЕРЫ
[0082] В следующих примерах описаны препарат, содержащий rhTPP1, для интрацеребровентрикулярного (ИЦВ) введения и результаты введения препарата пациентам-людям в сравнении с сопоставленными нелеченными пациентами с естественной динамикой.
Пример 1
Препарат rhTPP1 для интрацеребровентрикулярного введения
[0083] RhTPP1 получен в генномодифицированной линии клеток-хозяев СНО и очищен с помощью стандартных хроматографических способов, как описано в патенте США № 6302685 и Sleat et al. 1997, Science 277:1802-1805, которые включены в настоящий документ посредством ссылки в полном объеме. RhTPP1 был получен как неактивный профермент, который автоматически активировался при кислых значениях рН при захвате лизосомой. Рассчитанная средняя молекулярная масса профермента rhTPP1 составляет около 59 кДа. Кажущаяся молекулярная масса зрелого фермента составляет около 46 кДа. Аминокислотная последовательность профермента rhTPP1 представлена в SEQ ID NO: 1 и проиллюстрирована на Фиг. 1. Просегмент фермента представляет собой первые 176 аминокислотных остатков, а длина зрелого фермента составляет 368 аминокислот, начиная с положения 177, и представлена в SEQ ID NO: 2.
[0084] Препарат rhTPP1, применяемый в Примерах, представлял собой стерильный раствор для ИЦВ инфузии. Это была прозрачная жидкость, от бесцветной до бледно-желтого цвета, содержащая белок rhTPP1 в концентрации 30 мг/мл. Препарат упаковывали в систему контейнер/укупорочный элемент, состоящую из флакона прозрачного боросиликатного стекла типа 1, закупоренного пробкой из бутилового каучука, покрытой фторполимером, и покрытой алюминиевым колпачком под обкатку. Препарат хранили при температуре -40°C ± 10°C и поставляли в замороженном виде. Целевое значение рН препарата составляло 6,5.
[0085] Состав препарата rhTPP1, применяемого в примерах, приведен в таблице 2.
ТАБЛИЦА 2
[0086] Препарат rhTPP1 был тщательно разработан, чтобы имитировать показатели СМЖ человека, такие как концентрация основных электролитов, аналогичная содержащейся в СМЖ человека in vivo, причем препарат не содержал каких-либо обычных консервантов или стабилизаторов в качестве вспомогательных веществ. После введения препарата rhTPP1 не сообщалось и не наблюдалось никаких существенных проблем безопасности, т.е. серьезных побочных эффектов, которые не могли бы быть предсказаны заранее.
[0087] Исследования стабильности были проведены в условиях длительного хранения (≤ -60 °С) и ускоренного старения (5 ± 3 °С) в соответствии с рекомендациями Международного Совета по Гармонизации (МСГ) и в соответствии с протоколом контроля стабильности «температура-время». Образцы для исследования стабильности хранились в небольших бутылях, содержащих те же материалы, что и полномасштабная упаковка. Данные стабильности, полученные для вспомогательных и клинических серий, показали, что препарат rhTPP1 был стабильным при ≤ -60°C в течение по меньшей мере 36 месяцев и при 5 ± 3°C в течение по меньшей мере 6 месяцев, что было неожиданным, учитывая, что в составе препарата отсутствуют консерванты и стабилизаторы, обычно применяемые в фармацевтических продуктах. В Табл. 3 приведены результаты исследования стабильности.
ТАБЛИЦА 3
Пример 2
Исследование естественной динамики
[0088] Количественная оценка естественной динамики заболевания CLN2 была проведена на когорте, включающей 41 нелеченного пациента с CLN2. Гамбургскую шкалу применяли для оценки неврологических и функциональных блоков, затронутых заболеванием, согласно возрасту.
[0089] Количественное описание клинического ухудшения при естественной динамике CLN2 у субъектов в отсутствие лечения проиллюстрировано на Фиг. 2. Анализ естественной динамики показал ясную и предсказуемую связь возраста с тяжестью заболевания. После появления двигательных и речевых симптомов, по сути, наблюдалось быстрое линейное ухудшение, в результате которого дети в среднем теряли около 2 «вех» развития в год (линейная скорость снижения составляла 2,1 балла в год). В целом наблюдалось предсказуемое течение, однако были случаи «позднего начала», которые составляли менее 20% популяции в когорте. У таких пациентов наблюдалась тенденция к более позднему появлению симптомов и более длительному периоду легкой стадии заболевания, но затем происходило быстрое и активное ухудшение, обычно на 2-3 года позже, чем при классической форме.
[0090] Результаты количественной оценки клинического прогрессирования в когорте согласно Гамбургской шкале подтверждали путем наложения результатов клинической оценки для независимой (пациенты и оценивающие) когорты из МКВК (n=49). Хотя клиническое описание независимых когорт CLN2 сходное, это было первым подтверждением выраженной количественной зависимости для прогрессирования заболевания в отдельных группах пациентов. В обеих когортах пациентов с CLN2 присутствовало значимое большинство с классической формой позднего инфантильного начала и прогрессирования и меньшая часть детей с фенотипом «позднего начала», обычно с ранними проявлениями заболевания скорее в возрасте 5 лет, чем в 3 года. Шкала оценки двигательной (походка) и речевой функции воспроизводимо охватывала неврологическое ухудшение у пациентов с CLN2. Исходя из вышеприведенных результатов анализа, когорта субъектов исследования естественной динамики была определена как подходящая контрольная популяция без лечения, а средняя скорость ухудшения симптома заболевания CLN2 в указанной нелеченной популяции с естественной динамикой может применяться в качестве эффективного и информативного референтного показателя для любой предотвращения или снижения скорости ухудшения симптома у субъекта, страдающего заболеванием CLN2, которые вызваны введением композиции по данному изобретению.
Пример 3
Фаза 1/Фаза 2 Открытое исследование с повышением дозы у пациентов с CLN2
[0091] Исследование представляло собой открытое клиническое исследование для оценки безопасности, переносимости и эффективности лечения препаратом hTPP1 по изобретению детей с заболеванием CLN2 с ведением через ИЦВ катетер в дозе 300 мг (общий объем 10 мл) каждую вторую неделю. Исследование предназначалось для оценки безопасности и переносимости, начиная с низких доз (30 мг и 100 мг), для всех пациентов доза была повышена до высокой ожидаемой терапевтической дозы (300 мг) после того, как более низкие дозы были признаны безопасными независимым комитетом по мониторингу данных. Продолжительность исследования для всех включенных в исследование пациентов составила 48 недель лечения стабильной ожидаемой терапевтической дозой 300 мг ИЦВ каждую неделю. Первичные цели исследования заключались в оценке безопасности и переносимости препарата rhTPP1 по изобретению, вводимого субъектам с заболеванием CLN2 с помощью имплантированного резервуара и канюли ИЦВ, и в оценке эффективности с применением специфичной шкалы оценки заболевания CLN2 по сравнению с данными естественной динамики после 12 месяцев лечения. Вторичные цели исследования заключались в оценке влияния лечения на показатели атрофии головного мозга по сравнению с данными естественной динамики заболевания CLN2 после 12 месяцев лечения.
[0092] Основными критериями включения в исследование были диагноз CLN2 и возраст на момент включения по крайней мере 3 года. Пациентов, у которых результаты оценки в начальной точке составляли менее 3 на момент скрининга (с применением объединенного бала двигательной/речевой функции 0-6 по Гамбургской шкале), исключали из исследования. Пациенты, не достигшие 3-летнего возраста, скорее всего, не будут прогрессировать из-за возраста, а не в связи с лечением, на что указывает горизонтальная линия на кривой прогресса. Пациенты с оценкой 2 или менее на момент скрининга также демонстрировали менее линейные, более вариабельные показатели и считались потенциально более резистентными к лечению из-за стадии заболевания. Таким образом, группу лечения просто определяли по возрасту и баллам оценки, чтобы включить раннее и в высокой степени предсказуемое ухудшение.
[0093] Средний возраст на момент регистрации составлял 4,0 года, девочек немного больше чем мальчиков, преимущественно кавказского происхождения. Клинический балл CLN2 на момент скрининга и в начальной точке приведен в Табл. 4 ниже, которая демонстрирует балл двигательной/речевой функции по Гамбургской шкале для каждой когорты исследования и итоговые данные как на момент скрининга, так и в начальной точке.
ТАБЛИЦА 4
[0094] В целом, наблюдался перекос в баллах CLN2 до лечения в направлении более поздней стадии заболевания. Учитывая быстрое прогрессирование заболевания и трудности с точным определением, ожидался перекос в сторону более низких показателей. Кроме того, наблюдалось некоторое снижение балла в момент скрининге и в период (до двух недель) до оценки в начальной точке (непосредственно перед установкой резервуара ИЦВ). У четырех пациентов, которые на момент скрининга набрали 3 балла, произошло ухудшение к моменту начала исследования, а два пациента, которые на момент скрининга получили 4 балла, потеряли один балл со снижением до 3 в начальной точке исследования. Два пациента, которые были включены в исследование с баллом 6 (т.е., в основном норма), были братьями и сестрами пораженных детей. Распределение, демографические показатели и характеристики популяции субъектов приведены в Табл. 5 ниже.
ТАБЛИЦА 5
a Включенный пациент 1287-1007 получил одну дозу и отозвал согласие из-за невозможности соблюдать процедуры исследования
b Распределение аналогично популяции с естественной динамикой
*Обычные генотипы: c.622C> T и c.509-1G>C
[0095] Все включенные в исследование пациенты получали стабильную дозу 300 мг ИЦВ один раз в неделю. Когорта 1 получала ≥ 1 месяца 30 мг ИЦВ каждую неделю, с последующим повышением дозы до 100 мг ИЦВ каждую вторую неделю в течение ≥ 4 недель, тогда как для Когорты 2 начальная доза составляла 100 мг ИЦВ каждую вторую неделю в течение ≥ 4 недель. Как для Когорты 1, так и для Когорты 2 дозу повышали до 300 мг ИЦВ один раз в две недели, а для всех последующих пациентов, включая Когорту 3, введение начинали по схеме стабильной дозы 300 мг ИЦВ каждую вторую неделю и продолжали в течение≥ 48 недель. Дозу 300 мг вводили в виде инфузии объема 10 мл в течение около 4 часов через катетер ИЦВ. Объем СМЖ, например, эквивалентный количеству вводимого препарата rhTPP1, не удаляли непосредственно перед началом инфузии, что было нетипичным, но неожиданно не вызывало никаких побочных эффектов. Сразу после введения дозы 300 мг пациенту вводили промывочный раствор в количестве около 2 мл через тот же катетер ИЦВ. Состав промывочного раствора был идентичен составу из Табл. 2, но не содержал rhTPP1. Болюсная доза 300 мг фермента на одно введение была значительно выше, чем в предыдущих схемах ферментзаместительной терапии с интратекальным или ИЦВ введением и, таким образом, профили безопасности и эффективности, наблюдаемые после введения такой высокой дозы лекарственного средства, не могли быть предсказаны заранее. Более конкретно, введение болюсной дозы 300 мг rhTPP1 без сопутствующих серьезных, неконтролируемых побочных эффектов заранее не могло быть предсказано.
Результаты
[0096] Влияние лечения на результаты клинической оценки походки и речевой функции: Инструментом первичной оценки для количественной оценки клинической тяжести была объединенная субшкала походки и речевой функции от 0 до 6 баллов, общая для Гамбургской и МКВК шкал оценки заболевания. По этой шкале зафиксировано предсказуемое, быстрое и прогрессирующее клиническое ухудшение у пациентов с естественной динамикой в отсутствие лечения, которое использовали в качестве референтного показателя для первичного анализа эффективности.
[0097] Балл оценки заболевания для походки/речевой функции 23 пациентов с длительностью лечения более чем 42 недели проиллюстрирован на Фиг. 3A-3F. Среди 23 пациентов, 3 пациента (1244-1001, 1244-1002 и 1244-1003) были из Когорты 1 (C1), 3 пациента (1244-1004, 1244-1006 и 1287-1005) были из Когорты 2 (C2), 3 пациента (1244-1008, 1244-1009, 1244-1010) были из Когорты 3 (C3) и 14 пациентов (0119-1020, 0146-1021, 0146-1022, 0146-1023, 1244-1011, 1244-1012, 1244-1017, 1244-1024, 1323-1013, 1323-1014, 1323-1015, 1323-1016, 1323-1018 и 1323-1019) были из группы Только Стабильной Дозы 300 мг (ТСД). Как и ожидалось, дефицит речевой функции, как правило, был более выраженным, чем дефицит походки. Результаты оценки в начальной точке не распределялись случайным образом; у 12 пациентов присутствовал значительный прогресс заболевания с комбинированным баллом оценки в начальной точке 3 балла, а у 2 пациентов общий балл оценки составил 6 баллов. Учитывая быстрый прогресс и трудности с точным определениям заболевания, дети часто поступают с очевидным ухудшением или как братья и сестры детей с очевидным ухудшением.
[0098] После лечения препаратом rhTPP1 по изобретению (показано в Табл. 2 выше), результаты оценки заболевания CLN2 для походки/речевой функции стабилизировались, как проиллюстрировано на Фиг. 3А-3F. У одиннадцати из 23 пациентов не возникало необратимого ухудшения на протяжении периода лечения. У четырех пациентов на ранних стадиях лечения было ухудшение на один балл, но после этого не возникало необратимого ухудшения. Результаты двух пациентов (1244-1008 и 1323-1013) снизились на один балл, с 3 до 2 баллов, в промежутке между скринингом и начальной точкой исследования, но дополнительного снижения балла во время лечения не наблюдалось. Основываясь на результатах, у всех пациентов присутствовал очевидный эффект лечения, независимо от когорты (начальная доза) или балла оценки в начальной точке. У ряда пациентов наблюдалось обратимое снижение балла оценки. Например, у пациента 1287-1005 (Фиг. 3B) зарегистрировано снижение балла оценки на 2 балла в течение первого месяца лечения, что выглядело как потеря походки и речевой функции. Тем не менее, у этого пациента зарегистрировано улучшение на один балл на 60-й день лечения, после чего не наблюдалось никаких изменений до 440 дня анализа. Восстановленный балл представлял собой возвращение речи, что подчеркивало клиническую важность изменений в один балл.
[0099] Ни у одного из 2 пациентов с баллом 6 в начале исследования не зарегистрировано снижения баллов оценки. У семи из 12 пациентов с начальным баллом 3 не было необратимого снижения, а состояние 2 оставалось стабильным после первоначального снижения на один балл. Таким образом, эффект лечения был очевидным у пациентов со значительными дефицитами и прогрессом заболевания.
[00100] Как было показано в исследовании естественной динамики CLN2, средний показатель ухудшения в нелеченной популяции с естественной динамикой оценивался как 2,1 балла ежегодно. Таким образом, у всех пациентов из группы лечения присутствовали улучшенные баллы оценки по сравнению с ожидаемыми результатами для нелеченной популяции с естественной динамикой.
[00101] Чтобы установить более четкую взаимосвязь в ходе заболевания между леченными и сопоставленными нелеченными пациентами с естественной динамикой, состояние каждого пациента в исследовании сопоставлялось с нелеченными пациентами с естественной динамикой по показателям начального балла CLN2, возраста и генотипа. Хотя не существует четких подгрупп или факторов, позволяющих прогнозировать прогресс заболевания CLN2, эти параметры наиболее часто используются для определения тяжести заболевания. Состояние получавших лечение пациентов индивидуально сравнивали с каждым участником Когорты естественной динамики, у которого присутствовал сходный начальный балл оценки для походки/речевой функции, как проиллюстрировано на Фиг. 4А-4I. Состояние пациентов-участников исследования сопоставляли с начальным показателем CLN2 следующим образом: для конкретного пациента с конкретным начальным показателем были идентифицированы все пациенты с естественной динамикой, для которых был зарегистрирован один или более результат оценки CLN2 с таким же баллом CLN2. Если исходный балл оценки CLN2 у пациента составлял 2, 3, 4 или 5, то профиль CLN2-против-времени каждого пациента с естественной динамикой сдвигали во времени влево или вправо, чтобы наложить его на начальный балл пациента-участника исследования. Если у пациента с естественной динамикой присутствовали несколько результатов оценки, равные начальному баллу оценки CLN2 пациента-участника исследования, то для сдвига во времени применяли среднюю временную точку для нескольких результатов оценки. Если исходный балл CLN2 у пациента-участника исследования составлял 6 баллов, то последний результат оценки 6 баллов пациента с естественной динамикой использовали для сдвига во времени. Анализ чувствительности проводили с применением других критериев соответствия, причем результаты этого анализа соответствовали анализу с подбором по баллам.
[00102] На Фиг. 4А-4I проиллюстрированы результаты субъектов, получавших лечение препаратом rhTPP1 по изобретению, нанесенные на график против данных сопоставленных, нелеченных пациентов с естественной динамикой. Леченные субъекты и нелеченные пациенты с естественной динамикой были подобраны по баллу оценки заболевания с применением объединенных субшкал походки и речевой функции от 0 до 6 баллов. Баллы оценки каждого сравнивали на протяжении одного года лечения. У пациентов, получивших rhTPP1, наблюдалось преимущество лечения, по сравнению со всеми членами сопоставленной группы нелеченных пациентов с естественной динамикой. У субъекта 1244-1001 (Фиг. 4A) наблюдалось снижение балла оценки с 3 баллов до 2 баллов после 120 дней лечения, но один балл восстановился, и после этого изменений не было. У субъекта 1244-1002 (Фиг. 4B) наблюдалось повышение балла оценки с 3 баллов до 4 баллов, снижение с 4 баллов до 2 баллов и повышение c 2 баллов до 3 баллов, что в общем привело к сохранению балла оценки заболевания в конце исследования по сравнению с 1 днем. У субъектов 1244-1003 (Фиг. 4C) и 1244-1010 (Фиг. 4I) на протяжении всего исследования сохранялся балл оценки 6 баллов, т.е., нормальная двигательная и речевая функция. У субъектов 1244-1004 (Фиг. 4D) и 1244-1009 (Фиг. 4H) на протяжении всего исследования сохранялся балл оценки 3 балла. У субъекта 1244-1006 (Фиг. 4E) было зарегистрировано первоначальное снижение балла оценки с 3 баллов до 2 баллов, затем один балл восстановился перед повторным снижением с 3 баллов до 2 баллов без каких-либо дальнейших изменений. У субъекта 1244-1008 (Фиг. 4G) зарегистрировано первоначальное снижение балла оценки от 3 баллов до 2 баллов, без дальнейших изменений.
[00103] В отличие от всех получавших лечение субъектов, у большинства нелеченных пациентов с естественной динамикой имело место необратимое снижение балла оценки с 3 баллов до 0 баллов к концу периода сравнения, что указывает на прогресс до полного отсутствия походки и речевой функции. Анализ соответствия демонстрирует преимущества лечения для тех пациентов, у которые сохранялся балл оценки заболевания, а также для тех, у кого присутствовало первоначальное снижение балла оценки с последующей стабилизацией.
[00104] Наиболее сложный ответ (Субъект 1287-1005) проиллюстрирован на Фиг. 4F. Хотя у этого пациента было зарегистрировано быстрое снижение на 2 балла по сравнению с начальным показателем 3 балла, до уровня 1 балл в первый месяц исследования, пациент смог восстановить один балл, и его состояние стабилизировалось на отметке 2 балла. Интерпретация такого течения была уточнена путем сопоставления с нелеченными пациентами с естественной динамикой. Клинический прогресс был хуже у 15 из 18 сопоставленных по баллу нелеченных пациентов с естественной динамикой, и таким же, как и у 2 сопоставленных по баллу нелеченных пациентов с естественной динамикой (один сопоставленный нелеченный пациент с естественной динамикой не был доступен для оценки). Клиническое течение у нелеченных пациентов всегда ухудшалось, часто с небольшим промежутком времени между потерей «вех» развития. Никогда не наблюдалось восстановления утраченной функции и последующей стабилизации. Соответственно, сопоставление для наиболее сложного профиля пациента, получавшего лечение, также продемонстрировало очевидное преимущество лечения.
[00105] На Фиг. 5 проиллюстрировано распределением клинических изменений от начального уровня у сопоставленных нелеченных пациентов с естественной динамикой на протяжении продолжительности лечения сопоставленного пациента по сравнению с участниками исследования. Как было указано ранее, у 7 из 9 (> 75%) пациентов не было изменений в начальных баллах оценки заболевания. Для указанных 7 пациентов на протяжении периода лечения, у всех сопоставленных нелеченных пациентов с естественной динамикой зарегистрировано снижение по меньшей мере на один балл, но более распространенным было снижение на несколько баллов, т.е., от 2 баллов до 4 баллов. В качестве примера, пациенту 1244-1001 был сопоставлен 1 пациент, который потерял один балл, 3 пациента, которые потеряли 2 балла и 14 пациентов, которые потеряли все 3 доступных балла оценки для речевой функции/походки. Таким образом, за тот же период времени у леченного пациента не было изменений, но у 14 из 18 (> 75%) нелеченных пациентов с естественной динамикой была полностью утрачена походка и речевая функция. Наблюдался эффект дна с начальным показателем 3 балла, при котором многие сопоставленные нелеченные пациенты с естественной динамикой потеряли все доступные баллы оценки, однако, важно, что у 2 пациентов с показателем 6 баллов (пациенты 1244-1003 и 1244-1010) указанные сопоставленные пациенты также демонстрировали активное ухудшение, в некоторых случаях со снижением 4 и 5 баллов на протяжении периода лечения. Это наблюдение было клинической демонстрацией существенного лечебного эффекта; большинство детей, получавших лечение, сохранили начальные результаты клинической оценки в контексте сопоставления с нелеченными пациентами с естественной динамикой, у которых происходила активная потеря речевой функции и независимой походки за тот же период времени, причем у многих из них функция была утрачена полностью. У остальных 2 пациентов, которые потеряли один балл (субъекты 1287-1005 и 1287-1006), результаты клинической оценки в период лечения по-прежнему были лучше, чем у подавляющего большинства сопоставленных пациентов. В общей сложности, у 97% сопоставленных по баллам нелеченных пациентов с естественной динамикой были худшие баллы оценки, чем у пациентов, получавших лечение.
[00106] С применением нескольких критериев соответствия (например, начальное значение, возраст и генотип), почти в 100% сравнение показало благоприятный эффект лечения по сравнению с сопоставленными нелеченными пациентами с естественной динамикой. Средняя разница в лечении по критериям соответствия у всех пациентов, получавших лечение, по сравнению с пациентами с естественной динамикой варьировалась от 1,9 до 2,1 балла, в зависимости от применяемых критериев соответствия.
[00107] На Фиг. 9А проиллюстрировано среднее изменение балла оценки двигательной/речевой функции для пациентов, получавших лечение в течение ≥ 48 недель (n=21, пунктирная линия) и когорты естественной динамики (n=41, сплошная линия). Среднее снижение баллов оценки заболевания для пациентов, получавших лечение, составляло 0,43 (стандартное отклонение 0,839), при среднем снижении 0,00 баллов за 48 недель. Напротив, среднее снижение балла оценки заболевания для когорты естественной динамики составляло 2,09 (стандартное отклонение 0,966), при среднем снижении на 1,87 балла за 48 недель. В целом было отмечено значительное уменьшение (p <0,0001) на 79% ожидаемого клинического ухудшения для получавших лечение пациентов. На Фиг. 9В проиллюстрировано изменение показателей двигательной/речевой функции у пациентов (n=23) по данным последнего измерения в период от введения первой дозы 300 мг (начальное значение) до введения последней дозы 300 мг в точке времени ≥ 48 недель. В целом, у 65% (15 из 23) пациентов присутствовало улучшение или отсутствовал клинический прогресс заболевания во время лечения, а 87% (20 из 23) пациентов функционировали лучше во время лечения (т.е., изменение балла составило -1 или менее) по сравнению с нелеченными субъектами из исследования естественной динамики. Указанные анализы единогласно подтвердили вывод о том, что имела место поразительная и клинически значимая стабилизация показателей CLN2 у леченных пациентов по сравнению с сопоставимыми членами нелеченной группы естественной динамики, которая демонстрировала быстрое и предсказуемое ухудшение.
[00108] Влияние лечения на результаты клинической оценки зрения: У нелеченных пациентов с CLN2 потеря зрения происходит позже, чем ухудшение речевой функции языка и походки, однако, как только заболевание становится симптоматическим, оно протекает предсказуемо быстро и прогрессирует до слепоты. Таким образом, сохранение зрения является важным результатом лечения. Потеря зрения может быть зафиксирована на субшкале от 0 до 3 баллов аналогично другим субшкалам, для которых 3 соответствует норме, а 0 - функциональной слепоте. В течение периода лечения для большинства пациентов, получавших лечение, не было зарегистрировано случаев необратимой потери функции на субшкале оценки зрения. Когда состояние получавших лечение пациентов сопоставляли с нелеченными субъектами с естественной динамикой, сопоставленными по баллу, возрасту и генотипу, с применением объединенных субшкал походки, речевой функции и зрения (от 0 до 9 баллов), было ясно, что нелеченные пациенты с естественной динамикой потеряли дополнительное количество баллов по сравнению с получавшей лечение группой.
[00109] На Фиг. 6А-6I представлены результаты для девяти субъектов, получавших лечение препаратом rhTPP1 по изобретению, нанесенные на график против данных сопоставленных нелеченных пациентов с естественной динамикой, сопоставленных по баллу оценки заболевания, с применением объединенной субшкалы походки, речевой функции и зрения от 0 до 9 баллов. У субъекта 1244-1001 (Фиг. 6A) присутствовало снижение балла оценки на один балл, с 6 до 5 баллов, но вскоре балл восстановился до 6 баллов, после чего изменений не наблюдалось. У субъекта 1244-1002 (Фиг. 6B) присутствовало повышение результата оценки с 5 баллов до 6 баллов, с последующим снижением с 6 баллов до 4 баллов, и затем с повышением с 4 баллов до 5 баллов, в результате сохранился общий балл оценки заболевания на конец исследования по сравнению с 1 днем. У субъектов 1244-1003 (Фиг. 6C) и 1244-1010 (Фиг. 6I) результат оценки 9 баллов сохранялся на протяжении всего исследования, что указывало на нормальную походку, речевую функцию и зрение; у субъектов 1244-1004 (Фиг. 6D) и 1244-1009 (Фиг. 6H) результат оценки 6 баллов сохранялся на протяжении всего исследования, а у субъекта 1244-1008 (Фиг. 6G) результат оценки 5 баллов сохранялся на протяжении всего исследования. У субъекта 1244-1006 (Фиг. 6E) присутствовало начальное снижение результата оценки на один балл, с 6 баллов до 5 баллов, с последующим дополнительным снижением до 4 баллов и восстановлением одного балла до 5 баллов, без дальнейших изменений. У субъекта 1287-1005 (Фиг. 6F) присутствовало снижение результата оценки с 6 баллов до 4 баллов, за которым следовало повышение с 4 баллов до 5 баллов и снижение до 4 баллов, с последующим повторным восстановлением одного балла до окончательного результата оценки 5 баллов.
[00110] Добавление субшкалы зрения не приводило к изменениям у девяти пациентов в течение периода лечения. Тем не менее, у сопоставленных по баллам нелеченных пациентов с естественной динамикой, потеря зрения вносила значительный вклад в объединенный балл. Многие сопоставленные нелеченные пациенты с естественной динамики и разницей более чем в 3 балла по сравнению с получавшими лечение пациентами, демонстрировали вклад ухудшения зрения в объединенный балл за период исследования. Добавление субшкалы зрения, таким образом, увеличивало разницу между получавшими лечение пациентами и сопоставленными нелеченными пациентами с естественной динамикой. Поскольку не наблюдалось необратимого снижения балла оценки заболевания у сопоставленных нелеченных пациентов с естественной динамикой, наблюдаемый терапевтический эффект rhTPP1 относился к остановке прогресса заболевания, причем стабилизация функции может быть расширена с двигательной функции/походки и речевой функции, до включения клинического блока зрения.
[00111] Влияние лечения на общие результаты оценки заболевания: Состояние пациентов дополнительно оценивали в ходе исследования с применением комбинированной 12-бальной шкалы, содержащей все пункты Гамбургской или МКВК шкалы. Оценки по 12-балльной шкале представляли собой сумму отдельных баллов пациента для (1) двигательной функции/походки, (2) речевой функции, (3) припадков/миоклонуса и (4) зрения/питания. На Фиг. 10A-10L проиллюстрированы результаты субъектов, получавших лечение препаратом rhTPP1 по изобретению, полученные с применением комбинированной Гамбургской (слева) и МКВК (справа) шкалы от 0 до 12 баллов. У шестнадцати из 23 пациентов не было необратимого снижения по меньшей мере по одной шкале, а у 8 балл по меньшей мере по одной шкале повысился в конце периода лечения по сравнению с начальным значением, что подтвердило общий терапевтический эффект при лечении пациентов, получавших rhTPP1.
[00112] Влияние лечения на объем головного мозга: для оценки вторичной конечной точки у пациентов, получавших лечение, применяли МРТ. Течение заболевания характеризуется атрофией, потерей клеток и аномалиями сигналов. Эти параметры соотносятся с возрастом пациента и баллом оценки заболевания индивидуально или в виде составной оценки. Таким образом, существует общее мнение о том, что прогресс заболевания коррелирует с МРТ показателями атрофии, и показано, что при заболевании CLN2 многие параметры МРТ коррелируют с возрастом и тяжестью заболевания (Dyke et al., AJNR Am J Neuroradiol. 2013;34(4):884-9); (Paniagua et al., Clin Neuroradiol. 2013; 23(3):189-96). База данных изображений, которая поддерживает эти выводы, основана на корреляции поперечного сечения у значительного количества пациентов, однако отсутствуют МРТ изображения продольного сечения у того же пациента. Таким образом, нет возможности сопоставлять результаты МРТ для продольного сечения у участников исследования с аналогичной базой данных для естественной динамики.
[00113] Для анализа показателей пациентов, получавших лечение, зарегистрированные параметры МРТ были стандартизированы для всех аппаратных платформ в исследовательских центрах. Данные были получены локально, отредактированы для идентификации информации и переданы в центральную лабораторию визуализации. Изображения были рандомизированы таким образом, что у независимого радиолога не было информации о пациенте или связи во времени с начальным значением. Изменения объема головного мозга реконструировали на основе рандомизированных независимых центральных данных. Данные были проанализированы для сравнения исследований продольного сечения с начальным значением получавшей лечение популяции. На Фиг. 7 приведены сводные результаты измеренных с помощью МРТ объемов головного мозга у получавших лечение пациентов. Атрофия головного мозга приводит к увеличению объема и доли внутричерепной СМЖ. Рост этих показателей атрофии у пациентов с CLN2 коррелирует с возрастом и тяжестью заболевания. Графики объема и доли СМЖ в продольном сечении для получавших лечение пациентов дополнительно указывали на то, что при измерении параметров СМЖ зарегистрированы незначительные изменения, если они были вообще. Результаты МРТ объема у всех пациентов выглядели постоянными и соответствовала стабилизации балла оценки.
[00114] На Фиг. 8А-8L проиллюстрированы результаты оценки объема головного мозга в продольном сечении с помощью МРТ у пациентов, получавших лечение. Активная нейродегенерация у пациентов с CLN2 характеризуется преобладающей потерей серого вещества и компенсаторным увеличением объема СМЖ. Однако, в оцениваемый период наблюдался в высокой степени стабильный объем головного мозга, и не наблюдалось доказательств нейродегенеративного процесса у пациентов, получавших лечение. Объем серого вещества, приведенный на Фиг. 8А-8L, как разница между графиком СМЖ и серого вещества (пунктирная линия) и графиком СМЖ (сплошная линия) на каждой из верхних и нижних панелей, был стабильным на протяжении всего исследования у каждого из леченных пациентов. Сравнение изменения объема серого вещества коры в процентах от общего объема головного мозга для результатов последнего измерения до первой инфузии 300 мг (начальное значение) и результатов последнего измерения в точке ≥ 48 недель лечения приведено в Табл. 6 ниже.
ТАБЛИЦА 6
Изменение объема коры в продольном сечении составляет -1% в год у нормальных детей в возрасте 4-12 лет, но -12,5% в год у нелеченных пациентов с CLN2. В ходе лечения rhTPP1 объем СМЖ, серого вещества и белого вещества оставался относительно постоянным, уменьшая на 89% потерю объема коры в связи с заболеванием.
[00115] Побочные эффекты: Один пациент был исключен из исследования из-за неспособности соблюдать протокол. Остальные 23 пациента продолжали участие в исследовании и получали лечение лекарственным средством rhTPP1, который вводили ИЦВ. Не зарегистрировано смертельных случаев, связанной с лечением отмены препарата или преждевременного завершения участия в исследовании из-за причин, связанных с безопасностью. Чтобы свести к минимуму влияние имплантации устройства, всем пациентам вводили препарат в течение недели после хирургического вмешательства. Из 325 инфузий по какой-либо причине было прервано только 5 (1,5%), из них только 2 (0,6%) были прерваны по причинам, связанным с побочными эффектами. Наиболее частые побочные эффекты, не связанные с заболеванием CLN2, которые наблюдались в исследовании: повышенная температура, гиперчувствительность и инфекция верхних дыхательных путей (каждый у 25% пациентов в целом). В общем, эти реакции были легкими, самоограниченными и контролируемыми с медицинской точки зрения. Определенные исследователем реакции гиперчувствительности были связаны с небольшим количеством периферических проявлений, которые с медицинской точки зрения контролировались комбинацией жаропонижающих, антигистаминных и/или стероидов. Лабораторные данные продемонстрировали отсутствие клинически значимых изменений в периферических показателях. В СМЖ у некоторых пациентов наблюдался легкий, временный плеоцитоз без изменений уровня глюкозы или белка в СМЖ. Таким образом, оценка параметров безопасности показала, что лечение препаратом rhTPP1 с введением ИЦВ инфузией переносилось всеми пациентами.
Заключение
[00116] Клинические исследования показали, что у каждого пациента, получавшего лечение более 36 недель, присутствовал значительный клинический эффект, характеризующийся полной остановкой прогресса заболевания CLN2, что составляло максимальный эффект лечения, поскольку в данных временных рамках усиление функции у пациентов с умеренным прогрессом и активной дегенерацией не ожидается.
[00117] Этот вывод был еще более убедительным при сопоставлении показателей пациентов с данными из базы данных естественной динамики на основе нескольких параметров, включая начальный балл оценки заболевания, возраст и генотип. Такое сопоставление показало, что в течение того же периода времени, когда у получавших лечение субъектов прогресс заболевания останавливался при лечении лекарственным средством rhTPP1, у сопоставленных нелеченных пациентов с естественной динамикой наблюдалась значительная потеря функции. Таким образом, у всех пациентов, получавших лечение, наблюдалась остановка прогресса заболевания по сравнению с активным прогрессом заболевания у сопоставленных нелеченных пациентов с естественной динамикой. Средний показатель снижения для нелеченной популяции с естественной динамикой оценивался как 2,1 балла каждый год на основе имеющихся данных естественной динамики, причем каждый балл снижения представлял потерю значимой «вехи» развития физиологической функции. Для большинства пациентов, включенных в исследование, сохранение 2 баллов означало сохранение возможности самостоятельно передвигаться и осмысленной коммуникации.
[00118] В целом, результаты показали приемлемый профиль безопасности/переносимости для препарата rhTPP1 и способа лечения по изобретению. Ни один из участников не прекратил участие в исследовании или лечение из-за побочного эффекта. Один пациент отказался от участия в исследовании после получения одной дозы терапевтического средства из-за неспособности соблюдать протокол. Анализ ФК и иммуногенности показал высокую степень доставки в ЦНС и отсутствие образования антител в СМЖ.
[00119] Приведенные выше примеры демонстрируют, что композиции и способы, включающие rhTPP1, которые описаны в данном документе, представляют собой эффективные средства предупреждения или лечения заболевания CLN2 и/или одного или более клинических симптомов CLN2. При заболевании, клиническое течение которого характеризуется быстрым, неумолимым и необратимым нейродегенеративным прогрессом заболевания, остановка прогресса заболевания, особенно у каждого получавшего лечение пациента, представляет собой значительный и неожиданный клинический результат.
[00120] Все публикации, патенты и патентные заявки, процитированные в данном документе, включены в настоящий документ посредством ссылки, как если бы каждая отдельная публикация или патентная заявка были специально и индивидуально указаны как включенные посредством ссылки. Хотя вышеизложенное изобретение было описано с определенной степенью детальности для иллюстрации и примера в целях ясности понимания, для специалистов в данной области техники будет очевидно, что в свете данного документа могут быть сделаны некоторые изменения и модификации без выхода за пределы концепции изобретения или объем прилагаемой формулы изобретения.
Реферат
Группа изобретений относится к области медицины и предназначена для лечения заболевания нейрональным цероидным липофусцинозом (CLN2). Препарат для лечения CLN2-заболевания содержит рекомбинантную трипептидилпептидазу-1 человека (rhTPP1), причем rhTPP1 содержит аминокислотную последовательность SEQ ID NO: 1 или ее фрагмент. Указанный препарат содержит rhTPP1 в концентрации от 25 мг/мл до 35 мг/мл, калия хлорид в концентрации от 0,01 мг/мл до 1 мг/мл, магния хлорид гексагидрат в концентрации от 0,01 мг/мл до 1 мг/мл и кальция хлорид дигидрат в концентрации от 0,01 мг/мл до 1 мг/мл, рН составляет 6,5. Указанный препарат предназначен для производства лекарственного средства для лечения заболевания нейрональным цероидным липофусцинозом (CLN2). Также обеспечивается композиция для лечения CLN2-заболевания, содержащая дозу rhTPP1, эффективную для сохранения физиологической функции или замедления или снижения степени ухудшения физиологической функции у субъекта, причем физиологическая функция является речевой функцией, двигательной функцией, зрением или функцией питания, причем rhTPP1 содержит аминокислотную последовательность SEQ ID NO: 1 или ее фрагмент. Указанная композиция содержит rhTPP1 в концентрации от 25 мг/мл до 35 мг/мл, калия хлорид в концентрации от 0,01 мг/мл до 1 мг/мл, магния хлорид гексагидрат в концентрации от 0,01 мг/мл до 1 мг/мл и кальция хлорид дигидрат в концентрации от 0,01 мг/мл до 1 мг/мл, и где рН композиции составляет 6,5. Использование группы изобретений обеспечивает эффективную остановку прогрессирования заболевания CLN2 при лечении субъектов с CLN2 или у которых имеется семейный анамнез CLN2. 4 н. и 9 з.п. ф-лы, 10 ил., 6 табл., 3 пр.

Комментарии