Введение сконструированных т-клеток для лечения рака центральной нервной системы - RU2757308C2
Код документа: RU2757308C2
Чертежи




















































Описание
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Иммунотерапии на основе опухолеспецифичных Т-клеток, включающие терапии с использованием сконструированных Т-клеток и размноженных ex vivo или отобранных Т-клеток, были исследованы для противоопухолевого лечения. В некоторых случаях Т-клетки, используемые в таких терапиях, не остаются активными in vivo в течение достаточно длительного периода. В некоторых случаях опухолеспецифичность Т-клеток является относительно низкой. В некоторых случаях сконструированные Т-клетки имеют недостаточный доступ к опухоли. Поэтому в данной области существует потребность в опухолеспецифичных противораковых терапиях с более эффективной противоопухолевой функцией.
Лечение раковых заболеваний центральной нервной системы может быть особенно затруднительным. Например, лечение злокачественной глиомы (MG, от англ. «malignant glioma») высокой степени злокачественности, включая анапластическую астроцитому (АА - (от англ. «anaplastic astrocytoma») степени злокачественности III) и мультиформную глиобластому (GBM - (от англ. «glioblastoma multiforme») степени злокачественности IV), остается значительным терапевтическим вызовом. Доступные в настоящее время терапевтические возможности имеют ограниченный излечивающий потенциал, и только менее 5% пациентов живут дольше пяти лет после исходной постановки диагноза.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В данном документе описаны способы лечения злокачественных опухолей в центральной нервной системе посредством введения композиций, содержащих Т-клетки (например, Т-клетки с CAR (от англ. «chimeric antigen receptor» - «химерный рецептор антигена»), инфильтрирующие в опухоль лимфоциты (TIL, от англ. «tumor infiltrating lymphocytes»), Т-клетки со сконструированным TCR (от англ. «Т Cell Receptor» - «рецептор Т-клетки») или клоны Т-клеток), в спинномозговую жидкость (СМЖ) пациента. Т-клетки включают Т-клетки, которые были подвергнуты манипуляции, например, посредством введения молекулы нуклеиновой кислоты, экспрессирующей желательный рецептор, посредством размножения ex vivo выделенных или генетически модифицированных Т-клеток или посредством селекции ex vivo поднабора Т-клеток, полученных от пациента или донора, или посредством комбинации двух или более этих методик. Введение в центральную нервную систему (ЦНС) может осуществляться, например, путем введения в систему желудочков или в центральную полость позвоночного столба. Введение в ЦНС в том виде, в котором данный термин используется в данном документе, отличается и от внутриопухолевого введения (инъекция или инфузия в саму опухоль), и от введения в полость, созданную резекцией опухоли. Однако описанные в данном документе способы введения в ЦНС можно объединять с внутриопухолевым и/или пострезекционным внутриполостным введением.
Описанное в данном документе введение в ЦНС обеспечивает инфузию относительно больших объемов композиции, содержащей Т-клетки, например, 1 мл - 2 мл или более в одной инфузии. Таким образом, в одной инфузии можно ввести несколько миллионов Т-клеток.
Таким образом, раскрыт способ лечения пациента, у которого была диагностирована злокачественная опухоль центральной нервной системы, который включает инфундирование композиции, содержащей эффективное количество Т-клеток, в анатомический компартмент пациента, у которого была диагностирована злокачественная опухоль центральной нервной системы, причем данный анатомический компартмент содержит спинномозговую жидкость (СМЖ). Данный способ включает инфузию композиции, например, в систему желудочков или часть центрального канала спинного мозга. В одном воплощении раскрытого способа злокачественная опухоль центральной нервной системы включает первичную опухоль или метастазирующую опухоль, находящуюся где-то в центральной нервной системе, включая часть мозга, позвоночный столб или тому подобное. Предпочтительно данный анатомический компартмент содержит непрерывный объем по меньшей мере примерно 50, 100 или 150 мл спинномозговой жидкости.
Подвергнутые манипуляции Т-клетки, инфундированные в способах, описанных в данном документе, нацелены на опухолевые антигены, например, на белок поверхности и внутриклеточные белки. Злокачественные опухоли, которые лечат, могут представлять собой первичные опухоли или вторичные опухоли, происходящие из-за раковых заболеваний, возникающих где-либо еще в организме. Поскольку введение в спинномозговую жидкость обеспечивает Т-клеткам доступ в области за пределами местного сайта инъекции, описанные в данном документе способы можно использовать для атаки и уменьшения размера опухолей, удаленных от места инъекции, но находящихся в пределах ЦНС. Т-клетки со сконструированным TCR получают посредством введения генов TCRαβ в Т-клетки (например, аутологичные Т-клетки), с последующим размножением Т-клеток ex vivo и инфузией Т-клеток пациенту. Инфузия Т-клеток со сконструированным TCR придает реактивность в отношении опухоли пациентам, опухоль которых экспрессирует подходящий антиген и элемент ограничения HLA (от англ. «human leukocyte antigen» - «антиген лейкоцитов человека»). TCR может быть нацелен на любой из целого ряда опухолевых антигенов, включая, например, ассоциированный с меланомой антиген, распознаваемый Т-клетками 1 (MART-1, от англ. «melanoma-associated antigen recognized by T cells 1»), гликопротеин (gp, от англ. «glycoprotein») 100, карциноэмбриональный антиген (CEA, от англ. «carcinoembryonic antigen»), p53, ассоциированный с меланомой антиген (MAGE-АЗ, от англ. «melanoma-associated antigen») и антиген плоскоклеточной карциномы пищевода New York (NYESO, от англ. «New York esophageal squamous cell carcinoma antigen»).
В данном документе описан способ лечения пациента, у которого диагностирована злокачественная опухоль центральной нервной системы, включающий введение в спинномозговую жидкость (СМЖ) пациента композиции, содержащей эффективное количество Т-клеток.
В разных воплощениях: Т-клетки представляют собой аутологичные или аллогенные Т-клетки; Т-клетки подвергнуты манипуляции ex vivo посредством одного или более чем одного из следующих: размножение, фракционирование или трансфекция молекулой рекомбинантной нуклеиновой кислоты; Т-клетки включают клетки, которые были трансфицированы молекулой рекомбинантной нуклеиновой кислоты, кодирующей полипептид, который связывается с антигеном опухолевой клетки; данный полипептид представляет собой химерный рецептор антигена; композиция вводится интравентрикулярно; композиция вводится в центральный канал спинного мозга; введение осуществляется в левый желудочек или правый желудочек; композиция содержит по меньшей мере 1×106 клеток; композиция, содержащая Т-клетки, вводится по меньшей мере два раза; введение отличается по общему числу введенных Т-клеток; введения осуществляются с повышением дозы; введения осуществляются с уменьшением дозы; Т-клетки содержат Т-клетки с CAR; Т-клетки содержат аутологичные инфильтрирующие в опухоль лимфоциты; Т-клетки содержат Т-клетки со сконструированным TCR; злокачественная опухоль представляет собой диффузную инфильтрирующую опухоль; злокачественная опухоль представляет собой первичную опухоль мозга; один или более чем один очаг опухоли уменьшается в размере по меньшей мере на 25%; злокачественная опухоль возникает из первичного рака, выбранного из следующих: рак молочной железы, рак легкого, рак головы и шеи и меланома; способ осуществляется после резекции опухоли; способ дополнительно включает внутриопухолевое введение композиции, содержащей Т-клетки; злокачественная опухоль представляет собой вторичную опухоль мозга; способ дополнительно включает внутриопухолевое введение композиции, содержащей терапевтические Т-клетки, экспрессирующие химерный рецептор антигена, который связывается с белком, экспрессируемым на поверхности клеток глиобластомы; пациент ранее подвергался резекции опухолевого поражения; антиген опухоли выбран из группы, состоящей из IL13Rα2 (от англ. «interleukin 13 receptor, alpha 2» - «рецептор альфа 2 интерлейкина-13»), HER2 (от англ. «human epidermal growth factor receptor 2» - «рецептор 2 эпидермального фактора роста человека»), PSCA (от англ. «prostate stem cell antigen» - «антиген стволовой клетки простаты»), EGFR (от англ. «epidermal growth factor receptor» - «рецептор эпидермального фактора роста»), EGFRvIII, EphA2, NY-ESO-1 и CD19; Т-клетки содержат как CD4+ клетки, так и CD8+ клетки; Т-клетки подвергнуты размножению ex vivo; Т-клетки содержат по меньшей мере 10% клеток Тем; по меньшей мере 40%, 50%, 60%, 70% или более инфундированных клеток представляют собой CD4+; по меньшей мере 40%, 50%, 60%, 70% или более инфундированных клеток экспрессируют рецептор поверхности клетки, который нацелен на антиген опухоли (например, IL13Rα2); и доза клеток основывается на числе инфундированных клеток, которые экспрессируют рецептор клеточной поверхности, который нацелен на антиген опухоли (например, IL13Rα2).
В некоторых воплощениях Т-клетки содержат Т-клетки с CAR, которые нацелены на IL13Rα2, и эти клетки содержат молекулу нуклеиновой кислоты, кодирующую химерный рецептор антигена, содержащий: человеческий IL-13 (от англ. «interleukin 13» - «интерлейкин-13») или его вариант, имеющий 1-10 аминокислотных модификаций; трансмембранный домен, выбранный из следующих: трансмембранный домен CD4 или его вариант, имеющий 1-10 аминокислотных модификаций, трансмембранный домен CD8 или его вариант, имеющий 1-10 аминокислотных модификаций, трансмембранный домен CD28 или его вариант, имеющий 1-10 аминокислотных модификаций, и трансмембранный домен CD3ζ, или его вариант, имеющий 1-10 аминокислотных модификаций; по меньшей мере один костимулирующий домен; и домен сигнализации CD3ζ, или его вариант, имеющий 1-10 аминокислотных модификаций. В некоторых воплощениях: костимулирующий домен выбран из группы, состоящей из следующих: костимулирующий домен CD28 или его вариант, имеющий 1-10 аминокислотных модификаций, костимулирующий домен 4-1ВВ или его вариант, имеющий 1-10 аминокислотных модификаций, и костимулирующий домен ОХ40 или его вариант, имеющий 1-10 аминокислотных модификаций; вариант человеческого IL13 имеет 1-10 аминокислотных модификаций, которые увеличивают специфичность связывания в отношении IL13Rα2 относительно IL13Rα1; человеческий IL-13 или его вариант представляет собой вариант IL-13, содержащий аминокислотную последовательность SEQ ID NO: 3 с 1-5 аминокислотными модификациями, при условии что аминокислота в положении 11 SEQ ID NO: 3 отличается от Е; химерный рецептор антигена содержит два разных костимулирующих домена, выбранных из группы, состоящей из следующих: костимулирующий домен CD28 или его вариант, имеющий 1-10 аминокислотных модификаций, костимулирующий домен 4-1 ВВ или его вариант, имеющий 1-10 аминокислотных модификаций, и костимулирующий домен ОХ40 или его вариант, имеющий 1-10 аминокислотных модификаций; химерный рецептор антигена содержит два разных костимулирующих домена, выбранных из группы, состоящей из следующих: костимулирующий домен CD28 или его вариант, имеющий 1-2 аминокислотные модификации, костимулирующий домен 4-1ВВ или его вариант, имеющий 1-2 аминокислотные модификации, и костимулирующий домен ОХ40 или его вариант, имеющий 1-2 аминокислотные модификации; химерный рецептор антигена содержит человеческий IL-13 или его вариант, имеющий 1-2 аминокислотные модификации; трансмембранный домен, выбранный из следующих: трансмембранный домен CD4 или его вариант, имеющий 1-2 аминокислотные модификации, трансмембранный домен CD8 или его вариант, имеющий 1-2 аминокислотные модификации, трансмембранный домен CD28 или его вариант, имеющий 1-2 аминокислотные модификации, и трансмембранный домен CD3ζ или его вариант, имеющий 1-2 аминокислотные модификации; костимулирующий домен; и домен сигнализации CD3ζ или его вариант, имеющий 1-2 аминокислотные модификации; CAR содержит спейсерную область, расположенную между IL-13 или его вариантом и трансмембранным доменом; данная спейсерная область содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 4, 14-20, 50 и 52; химерный рецептор антигена содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 10 и 31-48.
В некоторых воплощениях Т-клетки экспрессируют химерный рецептор антигена, который связывается с HER2, и содержат молекулу нуклеиновой кислоты, кодирующую химерный рецептор антигена, содержащий: последовательность, нацеленную на HER2; трансмембранный домен, выбранный из следующих: трансмембранный домен CD4 или его вариант, имеющий 1-5 аминокислотных модификаций, трансмембранный домен CD8 или его вариант, имеющий 1-5 аминокислотных модификаций, трансмембранный домен CD28 или его вариант, имеющий 1-5 аминокислотных модификаций, и трансмембранный домен CD3C, или его вариант, имеющий 1-5 аминокислотных модификаций; костимулирующий домен, выбранный из костимулирующего домена CD28 или его варианта, имеющего 1-5 аминокислотных модификаций, и костимулирующего домена 4-1 ВВ или его варианта, имеющего 1-5 аминокислотных модификаций; и домен сигнализации CD3ζ или его вариант, имеющий 1-5 аминокислотных модификаций. В некоторых воплощениях домен, нацеленный на HER2, представляет собой scFv (от англ. «single chain fragment variable» - «одноцепочечный вариабельный фрагмент») против HER2; причем scFv против HER2 содержит аминокислотную последовательность:

или ее вариант, имеющий 1-5 аминокислотных модификаций; химерный рецептор антигена содержит: последовательность, нацеленную на HER2; трансмембранный домен, выбранный из следующих: трансмембранный домен CD4 или его вариант, имеющий 1-2 аминокислотные модификации, трансмембранный домен CD8 или его вариант, имеющий 1-2 аминокислотные модификации, трансмембранный домен CD28 или его вариант, имеющий 1-2 аминокислотные модификации, и трансмембранный домен CD3ζ или его вариант, имеющий 1-2 аминокислотные модификации; костимулирующий домен, выбранный из костимулирующего домена CD28 или его варианта, имеющего 1-2 аминокислотные модификации, и костимулирующего домена 4-1ВВ или его варианта, имеющего 1-2 аминокислотные модификации; и домен сигнализации CD3ζ или его вариант, имеющий 1-2 аминокислотные модификации; молекула нуклеиновой кислоты экспрессирует полипептид, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 26 и 27 или ее варианта, имеющего 1-5 аминокислотных модификаций.
В данном документе также описан способ лечения пациента, у которого диагностирована злокачественная опухоль центральной нервной системы, включающий инфундирование композиции, содержащей эффективное количество Т-клеток, в анатомический компартмент пациента, у которого диагностирована злокачественная опухоль центральной нервной системы, причем данный анатомический компартмент содержит спинномозговую жидкость (СМЖ). В разных воплощениях данный анатомический компартмент содержит часть системы желудочков; данный анатомический компартмент содержит часть центрального канала спинного мозга; злокачественная опухоль центральной нервной системы включает опухоль мозга; злокачественная опухоль центральной нервной системы включает метастазирующую опухоль; анатомический компартмент содержит непрерывный объем спинномозговой жидкости по меньшей мере примерно 50 мл; анатомический компартмент содержит непрерывный объем спинномозговой жидкости по меньшей мере примерно 100 мл; и анатомический компартмент содержит непрерывный объем спинномозговой жидкости по меньшей мере примерно 150 мл.
Среди раковых заболеваний, которые можно лечить способами, описанными в данном документе, находятся первичные злокачественные опухоли ЦНС и вторичные злокачественные опухоли, возникающие из-за ракового заболевания, локализованного где-либо еще, например, следующего: острый лимфобластный лейкоз (ALL, от англ. «Acute Lymphoblastic Leukemia»), острый миелоидный лейкоз (AML, от англ. «Acute Myeloid Leukemia»), адренокортикальная карцинома, раковые заболевания, связанные с синдромом приобретенного иммунодефицита человека (СПИД), анальный рак, рак аппендикса, астроцитомы, атипичная тератоидная/палочковидная опухоль, опухоль центральной нервной системы, базальноклеточная карцинома, рак желчного протока, рак мочевого пузыря, рак кости, остеосаркома и злокачественная фиброзная гистиоцитома, глиома ствола мозга, опухоли мозга, рак молочной железы, бронхиальные опухоли, лимфома Беркитта, карциноидные опухоли, раковые заболевания центральной нервной системы, рак шейки матки, хордома, хронический лимфоцитарный лейкоз (CLL, от англ. «Chronic Lymphocytic Leukemia»), хронический миелогенный лейкоз (CML, от англ. «Chronic Myelogenous Leukemia»), хронические миелопролиферативные расстройства, рак толстой кишки, колоректальный рак, краниофарингиома, кожная Т-клеточная лимфома, эмбриональные опухоли, раковые заболевания центральной нервной системы, рак эндометрия, эпендимобластома, эпендимома, рак пищевода, эстезионейробластома, опухоли семейства саркомы Юинга, экстракраниальная эмбрионально-клеточная опухоль, опухоль внегонадных половых клеток, рак внепеченочного желчного протока, рак глаза, фиброзная злокачественная гистиоцитома кости и остеосаркома, рак желчного пузыря, гастральный рак (рак желудка), желудочно-кишечная карциноидная опухоль, желудочно-кишечные стромальные опухоли (GIST, от англ. «Gastrointestinal Stromal Tumor») - см. саркома мягких тканей, опухоль половых клеток, гестационная трофобластическая опухоль, глиома, волосатоклеточный лейкоз, рак головы и шеи, рак сердца, печеночно-клеточный рак (рак печени), гистиоцитоз, лимфома Ходжкина, подглоточный рак, внутриглазная меланома, опухоли островков поджелудочной железы (эндокринной части поджелудочной железы), саркома Калоши, рак почки, гистиоцитоз клеток Лангерганса, рак гортани, лейкоз, рак губ и полости рта, рак печени (первичный), лобулярная карцинома in situ (LCIS, от англ. «Lobular Carcinoma In Situ»), рак легкого, лимфома, макроглобулинемия, рак молочной железы у мужчин, злокачественная фиброзная гистиоцитома кости и остеосаркома, медуллобластома, медуллоэпителиома, меланома, карцинома из клеток Меркеля, мезотелиома, метастатический плоскоклеточный рак шеи со скрытой первичной карциномой срединного тракта с участием гена NUT, рак рта, синдромы множественной эндокринной неоплазии, множественная миелома/плазмоклеточная опухоль, грибовидный микоз, миелодиспластические синдромы, миелодиспластические/миелопролиферативные новообразования, миелогенный лейкоз, хронический миелогенный лейкоз (CML), острый миелоидный лейкоз (AML), множественная миелома, миелопролиферативные расстройства, рак полости носа и околоносовой пазухи, носоглоточный рак, нейробластома, неходжкинская лимфома, немелкоклеточный рак легкого, рак полости рта, ротоглоточный рак, остеосаркома и злокачественная фиброзная гистиоцитома кости, рак яичника, рак поджелудочной железы, папилломатоз, параганглиома, рак околоносовой пазухи и полости носа, рак паращитовидной железы, рак пениса, рак гортани, феохромоцитома, опухоли паренхиматической ткани шишковидной железы промежуточной степени дифференциации, пинеобластома и супратенториальные примитивные нейроэктодермальные опухоли, опухоль гипофиза, неоплазма плазматических клеток/множественная миелома, плевролегочная бластома, рак молочной железы во время беременности, первичная лимфома центральной нервной системы (ЦНС), рак предстательной железы, рак прямой кишки, почечноклеточный рак (рак почки), рак почечной лоханки и мочеточника, переходно-клеточный рак, ретинобластома, рабдомиосаркома, рак слюнной железы, саркома, синдром Сезари, мелкоклеточный рак легкого, рак тонкой кишки, саркома мягкой ткани, плоскоклеточная карцинома, плоскоклеточный рак шеи, рак желудка (желудочный рак), супратенториальные примитивные нейроэктодермальные опухоли, Т-клеточная лимфома, кожный рак, рак яичка, рак глотки, тимома и карцинома вилочковой железы, рак щитовидной железы, переходно-клеточный рак почечной лоханки и мочеточника, трофобластная опухоль, рак мочеточника и почечной лоханки, рак уретры, рак матки, саркома матки, рак влагалища, рак вульвы, макроглобулинемия Вальденстрема и опухоль Вильмса.
В некоторых воплощениях злокачественное новообразование, которое лечат согласно раскрытым способам, включает опухоль. В некоторых воплощениях лечение приводит к по меньшей мере 50%-ному уменьшению объема опухоли, по меньшей мере 60%-ному уменьшению объема опухоли, по меньшей мере 70%-ному уменьшению объема опухоли, по меньшей мере 80%-ному уменьшению объема опухоли или по меньшей мере 90%-ному уменьшению объема опухоли. И в некоторых воплощениях лечение приводит к устранению злокачественной опухоли.
В некоторых воплощениях пациент не испытывает какой-либо токсичности степени 3 или выше.
В некоторых воплощениях пациенту назначают схему лечения стероидами до лечения композицией, содержащей эффективное количество Т-клеток, и в некоторых воплощениях в схеме лечения стероидами происходит уменьшение до более низкой дозы после лечения.
В некоторых воплощениях пациент имеет повышенную ожидаемую продолжительность жизни по сравнению с пациентом, получающим стандартное лечение, включающее лучевую терапию, терапию низкомолекулярными лекарственными средствами, терапевтические средства на основе антител или их комбинацию. И в некоторых воплощениях, при которых у пациента, получающего стандартное лечение (SOC, от англ. «standard of care»), может ожидаться выживание примерно 15 месяцев с момента исходной постановки диагноза (общая выживаемость или OS (от англ. «overall survival»), у пациента, получающего раскрытое лечение, может ожидаться OS 15, 20, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 месяцев или более. В некоторых воплощениях у пациента, получающего заявленное лечение, может ожидаться OS 42, 48, 54, 60, 66, 72, 78, 84, 90 месяцев или более.
В некоторых воплощениях композиция содержит по меньшей мере 2×106 Т-клеток или 2×106 Т-клеток, экспрессирующих рецептор поверхности клетки, нацеленный на опухолевый антиген, тогда как в некоторых воплощениях композиция содержит по меньшей мере 1×106 Т-клеток или 1×106 Т-клеток, экспрессирующих рецептор поверхности клетки, нацеленный на опухолевый антиген. В некоторых воплощениях композиция содержит по меньшей мере 5×106 Т-клеток или 5×106 Т-клеток, экспрессирующих рецептор поверхности клетки, нацеленный на опухолевый антиген, тогда как в некоторых воплощениях композиция содержит по меньшей мере 10×106 Т-клеток или 10×106 Т-клеток, экспрессирующих рецептор поверхности клетки, нацеленный на опухолевый антиген. В некоторых воплощениях раскрытые способы включали повторные введения композиций, например, повторное введение композиции по меньшей мере пять раз, повторное введение композиции по меньшей мере десять раз или повторное введение композиции, пока пациент не получит общую дозу по меньшей мере 90×106 Т-клеток или Т-клеток, экспрессирующих рецептор поверхности клетки, нацеленный на опухолевый антиген. В некоторых воплощениях введение повторяют один раз в неделю или один раз каждые две недели. В некоторых воплощениях повторные введения продолжают на протяжении 15-недельного курса.
В данном документе также раскрываются способы увеличения уровня по меньшей мере одного цитокина или хемокина в спинномозговой жидкости (СМЖ) пациента, включающие введение композиции, содержащей эффективное количество Т-клеток в СМЖ пациента со злокачественной опухолью центральной нервной системы, где уровень по меньшей мере одного цитокина или хемокина в СМЖ увеличивается после введения композиции, содержащей эффективное количество Т-клеток, по сравнению с исходным уровнем по меньшей мере одного цитокина или хемокина до введения.
В некоторых воплощениях раскрытых способов уровень по меньшей мере одного цитокина или хемокина в СМЖ после введения увеличивается в 10 раз или 5 раз по сравнению с исходным уровнем.
В некоторых воплощениях уровень по меньшей мере пяти или по меньшей мере десяти цитокинов или хемокинов увеличивается после введения композиции, содержащей эффективное количество Т-клеток, по сравнению с исходным уровнем по меньшей мере пяти цитокинов или хемокинов до введения. В некоторых воплощениях по меньшей мере один цитокин или хемокин включает EGF (от англ. «Epidermal Growth Factor» - «эпидермальный фактор роста»), эотаксин, FGF (от англ. «Fibroblast Growth Factor» - «фактор роста фибробластов»), G-CSF (от англ. «Granulocyte Colony Stimulating Factor» - «гранулоцитарный колониестимулирующий фактор»), GM-CSF (от англ. «Granulocyte Macrophage Colony-Stimulating Factor» - «гранулоцитарно-макрофагальный колониестимулирующий фактор»), HGF (от англ. «Hepatocyte Growth Factor» - «фактор роста гепатоцитов»), IFN-α (от англ. «lnterferon alpha» - «интерферон-альфа»), IFN-γ (от англ. «lnterferon gamma» - «интерферон-гамма»), IL-10 (от англ. «lnterleukin 10» - «интерлейкин-10»), IL-12, IL-13, IL-15, IL-17, IL-1Rα (от англ. «interleukin 1 receptor, alpha» - «рецептор альфа интерлейкина-1»), IL-10, IL-2, IL-2R, IL-4, IL-5, IL-6, IL-7, IL-8, IP-10, МСР-1 (от англ. «monocyte chemoattractant protein» - «моноцитарный хемоаттрактантный белок»), MIG, MIP-1α, MIP-1β, RANTES (хемокин, экспрессируемый и секретируемый Т-клетками при активации), TNF-α (от англ. «tumor necrosis factor alpha» - «фактор некроза опухолей-альфа») или VEGF (от англ. «vascular endothelial growth factor» - «фактор роста эндотелия сосудов»). В некоторых воплощениях увеличение экспрессии цитокина или хемокина представляет собой местное увеличение (т.е. специфичное в отношении СМЖ).
В данном документе также раскрыты способы поддержания повышенного числа Т-клеток в течение по меньшей мере примерно пяти суток по сравнению с исходным числом, наблюдаемого в спинномозговой жидкости (СМЖ) пациента, у которого диагностирована злокачественная опухоль центральной нервной системы, включающие инфундирование эффективного количества Т-клеток в СМЖ пациента, у которого диагностирована злокачественная опухоль центральной нервной системы, при которых наблюдаемое повышенное число Т-клеток по сравнению с исходным числом, наблюдаемым до стадии инфузии, поддерживается в течение по меньшей мере примерно пяти суток.
В некоторых воплощениях эффективное количество Т-клеток (или Т-клеток, экспрессирующих рецептор поверхности клетки, который нацелен на антиген опухоли) варьирует от примерно 1×106 клеток до примерно 100×106 клеток, и в некоторых воплощениях эффективное количество Т-клеток варьирует от примерно 2×106 клеток до примерно 50×106 клеток.
В некоторых воплощениях наблюдаемое повышенное число Т-клеток поддерживается в течение по меньшей мере примерно шести суток, или наблюдаемое число Т-клеток не возвращается к исходному числу в течение примерно семи суток.
В некоторых воплощениях наблюдаемые Т-клетки включают инфундированные Т-клетки (например, Т-клетки, экспрессирующие CAR), и в некоторых воплощениях наблюдаемые Т-клетки включают эндогенные Т-клетки.
В данном документе также раскрыты способы увеличения числа Т-клеток в спинномозговой жидкости (СМЖ) пациента, включающие введение композиции, содержащей эффективное количество Т-клеток, в СМЖ пациента со злокачественной опухолью центральной нервной системы, где число Т-клеток, выявляемых в СМЖ, увеличивается по сравнению с уровнями до введения.
В некоторых воплощениях число Т-клеток, выявляемых в СМЖ, увеличивается по сравнению с уровнями до введения в течение вплоть до семи суток после введения. В некоторых воплощениях Т-клетки, выявляемые в СМЖ, включают эндогенные Т-клетки и Т-клетки, экспрессирующие CAR, и/или Т-клетки Типа 1, и/или Т-клетки Типа 2.
В некоторых воплощениях Т-клетки, выявляемые в СМЖ, содержат Т-клетки CD3+, и в некоторых воплощениях Т-клетки, выявляемые в СМЖ, содержат зрелые миелоидные популяции CD14+ CD11b+ HLA-DR+. В некоторых воплощениях в СМЖ после введения композиции выявляются В-клетки CD19+ и гранулоциты CD11b+ CD15+.
В некоторых воплощениях в СМЖ после введения композиции выявляются реактивные лимфоциты, моноциты и макрофаги.
Также в данном документе раскрыты способы определения пригодности пациента со злокачественной опухолью для лечения Т-клеткой с CAR, специфичным в отношении IL-13Rα2, включающие определение того, демонстрирует ли балл, приписанный образцу от пациента, экспрессию IL-13Rα2 выше заданного порогового уровня.
В некоторых воплощениях балл, приписанный образцу, рассчитывается посредством определения иммунореактивности подвергнутого резекции образца опухоли от пациента, у которого диагностирована злокачественная опухоль, посредством иммуногистохимического окрашивания данного образца с использованием маркера IL-13Rα2, проведения анализа силы окрашивания и расчета балла на основе силы окрашивания, где балл, который соответствует интенсивности окрашивания в образце от умеренной до сильной, указывает то, что лечение Т-клеткой с CAR, специфичным в отношении IL-13Rα2, является подходящим для пациента. В некоторых воплощениях данный балл включает подсчет числа клеток, которые имеют слабую, умеренную или сильную интенсивность окрашивания, и приписывание каждой интенсивности веса (балл Н, способ количественного измерения иммуногистохимических результатов, основывается на следующей формуле: (3 × процентная доля сильно окрашенных клеток)+(2 × процентная доля умеренно окрашенных клеток)+(1 × процентная доля слабо окрашенных клеток), которая приводит к результату в интервале от 0 до 300. В некоторых случаях пациент имеет балл Н, который: больше, чем 50, 50-100, больше, чем 100, 100-200, больше, чем 200, 200-300 или больше, чем 250 для релевантного антигена, ассоциированного с опухолью. В некоторых воплощениях также определяется экспрессия Ki67 в образце посредством иммуногистохимического окрашивания.
В данном документе также раскрыты способы лечения пациента со злокачественной опухолью, включающие введение пациенту, у которого диагностирована злокачественная опухоль, композиции, содержащей эффективную дозу Т-клеток с CAR, специфичным в отношении IL-13Rα2, где IL-13Rα2 экспрессируется у пациента на уровне, превышающем заданный пороговый уровень.
В некоторых воплощениях заданный пороговый уровень экспрессии IL-13Rα2 был ранее идентифицирован как подходящий для лечения, включающего терапию Т-клетками с CAR, специфичными в отношении IL-13Rα2.
TIL представляют собой инфильтрирующие опухоль лимфоциты, которые могут быть выделены у пациента или донора, размножены ex vivo и повторно инфундированы пациенту, нуждающемуся в этом.
Т-клетки с CAR экспрессируют химерные рецепторы Т-клеток, которые содержат внеклеточный домен, трансмембранную область и внутриклеточный домен сигнализации. Данный внеклеточный домен включает часть, которая связывается с клеткой-мишенью и, возможно, спейсер, содержащий, например, часть в виде человеческого домена Fc. Трансмембранная часть включает подходящий трансмембранный домен, например, трансмембранный домен CD4, трансмембранный домен CD8, трансмембранный домен CD28, трансмембранный домен CD3 или трансмембранный домен 4-1ВВ. Внутриклеточный домен сигнализации включает домен сигнализации из дзета цепи человеческого комплекса CD3 (CD3ζ) и один или более чем один костимулирующий домен, например, костимулирующий домен 4-1ВВ. Часть внеклеточного домена, связывающаяся с клеткой-мишенью (например, scFv или лиганд), дает возможность CAR, при экспрессии на поверхности Т-клетки, направлять активность Т-клетки на те клетки, которые экспрессируют молекулу поверхности клетки-мишени, например, HER2 или IL-13Rα2 - рецептор, экспрессируемый на поверхности опухолевых клеток, включая клетки злокачественной глиомы.
Целый ряд разных Т-клеток, например, специфичные для пациента, аутологичные Т-клетки, можно конструировать для экспрессии TCR или CAR. Можно использовать разные поднаборы Т-клеток. Кроме того, CAR может экспрессироваться в других иммунных клетках, таких как клетки NK (от англ. «natural killer cells» - «природные киллеры»). Когда пациента лечат иммунной клеткой, экспрессирующей CAR или TCR, данная клетка может быть аутологичной или аллогенной Т-клеткой. В некоторых случаях используемые клетки представляют собой центральные Т-клетки памяти (TCM) CD4+ и CD8+, которые являются CD45RO+CD62L+, и применение таких клеток может улучшать долговременное выживание клеток после адоптивного переноса по сравнению с применением других типов специфичных для пациента Т-клеток. Клетки TCM могут включать клетки CD4+ и клетки CD8+.
Среди CAR, полезных в способах, описанных в данном документе, находятся CAR, которые нацелены на IL13Rα2. Такие CAR могут включать IL13, имеющий аминокислотную модификацию, такую как мутация E13Y, которая увеличивает специфичность связывания.
Т-клетки, используемые в способах, описанных в данном документе, могут содержать молекулу нуклеиновой кислоты, кодирующую химерный рецептор антигена (CAR), где данный химерный рецептор антигена содержит: человеческий IL-13 или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций; трансмембранный домен, выбранный из следующих: трансмембранный домен CD4 или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций, трансмембранный домен CD8 или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций, трансмембранный домен CD28 или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций, и трансмембранный домен CD3ζ или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций; костимулирующий домен; и домен сигнализации CD3ζ или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций.
Включение костимулирующего домена, такого как костимулирующий домен 4-1 ВВ (CD137) или CD28, последовательно с CD3ζ во внутриклеточной области обеспечивает получение Т-клеткой костимулирующих сигналов. Таким образом, в разных воплощениях, костимулирующий домен выбран из группы, состоящей из следующих: костимулирующий домен CD28 или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций, костимулирующий домен 4-1ВВ или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций, и костимулирующий домен ОХ40 или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций. В некоторых воплощениях присутствует костимулирующий домен 4-1ВВ или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций.
В дополнительных воплощениях данных способов CAR, экспрессируемый Т-клетками, содержит: вариант человеческого IL13, имеющий 1-10 аминокислотных модификаций, которые увеличивают специфичность связывания в отношении IL13Rα2 по сравнению с IL13Rα1; человеческий IL-13 или его вариант представляет собой вариант IL-13, содержащий аминокислотную последовательность SEQ ID NO: 3 с 1-5 аминокислотными модификациями, при условии, что аминокислота в положении 11 SEQ ID NO: 3 отличается от Е; два разных костимулирующих домена, выбранных из группы, состоящей из следующих: костимулирующий домен CD28 или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций, костимулирующий домен 4-1ВВ или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций, и костимулирующий домен ОХ40 или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций; два разных костимулирующих домена, выбранных из группы, состоящей из следующих: костимулирующий домен CD28 или его вариант, имеющий 1-2 аминокислотные модификации, костимулирующий домен 4-1ВВ или его вариант, имеющий 1-2 аминокислотные модификации, и костимулирующий домен ОХ40 или его вариант, имеющий 1-2 аминокислотные модификации; человеческий IL-13 или его вариант, имеющий 1-2 аминокислотные модификации; трансмембранный домен, выбранный из следующих: трансмембранный домен CD4 или его вариант, имеющий 1-2 аминокислотные модификации, трансмембранный домен CD8 или его вариант, имеющий 1-2 аминокислотные модификации, трансмембранный домен CD28 или его вариант, имеющий 1-2 аминокислотные модификации, и трансмембранный домен CD3ζ или его вариант, имеющий 1-2 аминокислотные модификации; костимулирующий домен; и домен сигнализации CD3ζ, или его вариант, имеющий 1-2 аминокислотные модификации; спейсерную область, расположенную между IL-13 или его вариантом и трансмембранным доменом (например, спейсерная область содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 4, 14-20, 50 и 52); причем спейсер содержит шарнирную область IgG; спейсерная область содержит 10-150 аминокислот; домен сигнализации 4-1ВВ содержит аминокислотную последовательность SEQ ID NO: 6; домен сигнализации CD3ζ содержит аминокислотную последовательность SEQ ID NO: 7; и линкер из 3-15 аминокислот, который расположен между костимулирующим доменом и доменом сигнализации CD3ζ или его вариантом. В некоторых воплощениях, где имеются два костимулирующих домена, один представляет собой костимулирующий домен 4-1ВВ, а другой - костимулирующий домен, выбранный из CD28 и CD28gg.
В некоторых воплощениях способов, описанных в данном документе, Т-клетки содержат молекулу нуклеиновой кислоты, которая экспрессирует полипептид, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 10 и 31-48; химерный рецептор антигена содержит область IL-13/IgG4/CD4t/4-1 ВВ, содержащую аминокислотную последовательность SEQ ID NO: 11, и домен сигнализации CD3ζ, содержащий аминокислотную последовательность SEQ ID NO: 7; и химерный рецептор антигена содержит аминокислотную последовательность SEQ ID NO: 10 и 31-48.
Также раскрыты способы, включающие внутрижелудочковое введение популяции человеческих Т-клеток, трансдуцированных вектором, содержащим экспрессионную кассету, кодирующую химерный рецептор антигена, где химерный рецептор антигена содержит: человеческий IL-13 или его вариант, имеющий 1-10 аминокислотных модификаций; трансмембранный домен, выбранный из следующих: трансмембранный домен CD4 или его вариант, имеющий 1-10 аминокислотных модификаций, трансмембранный домен CD8 или его вариант, имеющий 1-10 аминокислотных модификаций, трансмембранный домен CD28 или его вариант, имеющий 1-10 аминокислотных модификаций, и трансмембранный домен CD3ζ, или его вариант, имеющий 1-10 аминокислотных модификаций; костимулирующий домен; и домен сигнализации CD3ζ или его вариант, имеющий 1-10 аминокислотных модификаций. В разных воплощениях: популяция человеческих Т-клеток содержит вектор, экспрессирующий химерный рецептор антигена, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 10 и 31-48; данная популяция человеческих Т-клеток содержит центральные Т-клетки памяти (клетки Тем) (например, по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80% клеток представляют собой клетки Тем; по меньшей мере 10%, 15%, 20%, 25%, 30% или 35% Т-клеток или клеток TCM являются CD4+, и по меньшей мере 10%, 15%, 20%, 25%, 30% или 35% Т-клеток или клеток TCM являются CD8+ клетками).
Также описан способ лечения рака у пациента, включающий введение в ЦНС популяции аутологичных или аллогенных человеческих Т-клеток, (например, аутологичных или аллогенных Т-клеток, содержащих клетки Тем. например, по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80% клеток представляют собой клетки Тем; по меньшей мере 15%, 20%, 25%, 30%, 35% клеток TCM являются CD4+, и по меньшей мере 15%, 20%, 25%, 30%, 35% клеток TCM являются CD8+ клетками), трансдуцированных вектором, содержащим экспрессионную кассету, кодирующую химерный рецептор антигена, где химерный рецептор антигена содержит аминокислотную последовательность, выбранную из SEQ ID NO: 10 и 31-48. В разных воплощениях: популяция человеческих Т-клеток содержит центральные Т-клетки памяти; раковое заболевание представляет собой глиобластому; и транедуцированные человеческие Т-клетки были получены способом, включающим получение Т-клеток от пациента, обработку Т-клеток с выделением центральных Т-клеток памяти и транедуцирование по меньшей мере части центральных клеток памяти вирусным вектором, содержащим экспрессионную кассету, кодирующую химерный рецептор антигена, где химерный рецептор антигена содержит аминокислотную последовательность, выбранную из SEQ ID NO: 10 и 31-48.
Также описан способ, в котором Т-клетки, введенные пациенту, содержат молекулу нуклеиновой кислоты, кодирующую полипептид, содержащий аминокислотную последовательность, которая является по меньшей мере на 95% идентичной аминокислотной последовательности, выбранной из SEQ ID NO: 10 и 31-48; молекулу нуклеиновой кислоты, кодирующую полипептид, содержащий аминокислотную последовательность, которая является идентичной аминокислотной последовательности, выбранной из SEQ ID NO: 10 и 31-48, за исключением присутствия не более чем 5 аминокислотных замен, делеций или вставок; молекулу нуклеиновой кислоты, кодирующую полипептид, содержащий аминокислотную последовательность, которая является идентичной аминокислотной последовательности, выбранной из SEQ ID NO: 10 и SEQ ID NO: 10 и 31-48, за исключением присутствия не более чем 5 аминокислотных замен; и молекулу нуклеиновой кислоты, кодирующую полипептид, содержащий аминокислотную последовательность, которая является идентичной аминокислотной последовательности, выбранной из SEQ ID NO: 10 и 31-48, за исключением присутствия не более чем 2 аминокислотных замен.
В данном документе описан способ лечения пациента посредством введения в СМЖ Т-клеток, содержащих молекулу нуклеиновой кислоты, кодирующую химерный рецептор антигена (CAR), где химерный рецептор антигена содержит scFv, нацеленный на HER2 (например, содержит аминокислотную последовательность

или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций; спейсерную область; трансмембранный домен, выбранный из следующих: трансмембранный домен CD4 или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций, трансмембранный домен CD8 или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций, трансмембранный домен CD28 или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций, и трансмембранный домен CD3ζ или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций; костимулирующий домен; и домен сигнализации CD3ζ или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций.
В разных воплощениях костимулирующий домен выбран из группы, состоящей из следующих: костимулирующий домен CD28 или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций, костимулирующий домен 4-1ВВ или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций, и костимулирующий домен ОХ40 или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций. В некоторых воплощениях присутствует костимулирующий домен 4-1ВВ или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций.
В дополнительных воплощениях Т-клетки, введенные пациенту, экспрессируют CAR, который содержит: scFv, нацеленный на HER2 (например, гуманизированный scFv); два разных костимулирующих домена, выбранных из группы, состоящей из следующих: костимулирующий домен CD28 или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций, костимулирующий домен 4-1ВВ или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций, и костимулирующий домен ОХ40 или его вариант, имеющий 1-10 (например, 1 или 2) аминокислотных модификаций; два разных костимулирующих домена, выбранных из группы, состоящей из следующих: костимулирующий домен CD28 или его вариант, имеющий 1-2 аминокислотные модификации, костимулирующий домен 4-1 ВВ или его вариант, имеющий 1-2 аминокислотные модификации, и костимулирующий домен ОХ40 или его вариант, имеющий 1-2 аминокислотные модификации; человеческий IL-13 или его вариант, имеющий 1-2 аминокислотные модификации; трансмембранный домен, выбранный из следующих: трансмембранный домен CD4 или его вариант, имеющий 1-2 аминокислотные модификации, трансмембранный домен CD8 или его вариант, имеющий 1-2 аминокислотные модификации, трансмембранный домен CD28 или его вариант, имеющий 1-2 аминокислотные модификации, и трансмембранный домен CD3ζ или его вариант, имеющий 1-2 аминокислотные модификации; костимулирующий домен; и домен сигнализации CD3ζ или его вариант, имеющий 1-2 аминокислотные модификации; спейсерную область, расположенную между IL-13 или его вариантом и трансмембранным доменом (например, спейсерная область содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 4, 14-20, 50 и 52); причем спейсер содержит шарнирную область IgG; спейсерная область содержит 10-150 аминокислот; домен сигнализации 4-1ВВ содержит аминокислотную последовательность SEQ ID NO: 6; домен сигнализации CD3ζ содержит аминокислотную последовательность SEQ ID NO: 7; и линкер из 3-15 аминокислот, который расположен между костимулирующим доменом и доменом сигнализации CD3ζ или его вариантом. В некоторых воплощениях, где имеются два костимулирующих домена, один представляет собой костимулирующий домен 4-1ВВ, а другой - костимулирующий домен, выбранный из CD28 и CD28gg.
В некоторых воплощениях Т-клетки, введенные пациенту, содержат молекулу нуклеиновой кислоты, которая экспрессирует полипептид, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 53-56.
Также раскрыты способы, включающие внутрижелудочковое введение популяции человеческих Т-клеток, трансдуцированных вектором, содержащим экспрессионную кассету, кодирующую химерный рецептор антигена, содержащий: scFv, нацеленный на HER2; трансмембранный домен, выбранный из следующих: трансмембранный домен CD4 или его вариант, имеющий 1-10 аминокислотных модификаций, трансмембранный домен CD8 или его вариант, имеющий 1-10 аминокислотных модификаций, трансмембранный домен CD28 или его вариант, имеющий 1-10 аминокислотных модификаций, и трансмембранный домен CD3ζ или его вариант, имеющий 1-10 аминокислотных модификаций; костимулирующий домен; и домен сигнализации CD3ζ или его вариант, имеющий 1-10 аминокислотных модификаций. В разных воплощениях: популяция человеческих Т-клеток содержит вектор, экспрессирующий химерный рецептор антигена, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 53-56; популяция человеческих Т-клеток содержит центральные Т-клетки памяти (клетки TCM) (например, по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80% клеток представляют собой клетки Тем; по меньшей мере 10%, 15%, 20%, 25%, 30% или 35% Т-клеток или клеток TCM являются CD4+, и/или по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% Т-клеток или клеток TCM являются CD8+ клетками).
Также описан способ лечения рака у пациента, включающий внутрижелудочковое введение популяции аутологичных или аллогенных человеческих Т-клеток (например, аутологичных или аллогенных Т-клеток, содержащих клетки Тем; например, по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80% клеток представляют собой клетки TCM; по меньшей мере 15%, 20%, 25%, 30%, 35% клеток TCM являются CD4+, и/или по меньшей мере 15%, 20%, 25%, 30%, 35% клеток Тем являются CD8+ клетками), трансдуцированных вектором, содержащим экспрессионную кассету, кодирующую химерный рецептор антигена, где химерный рецептор антигена содержит аминокислотную последовательность, выбранную из SEQ ID NO: 53-56. В разных воплощениях: популяция человеческих Т-клеток содержит центральные Т-клетки памяти; раковое заболевание представляет собой глиобластому; и транедуцированные человеческие Т-клетки были получены способом, включающим получение Т-клеток от пациента, обработку Т-клеток с выделением центральных Т-клеток памяти и трансдуцирование по меньшей мере части центральных клеток памяти вирусным вектором, содержащим экспрессионную кассету, кодирующую химерный рецептор антигена, где химерный рецептор антигена содержит аминокислотную последовательность, выбранную из SEQ ID NO: 53-56.
Также описан способ лечения рака у пациента, включающий внутрижелудочковое введение популяции аутологичных или аллогенных человеческих Т-клеток (например, аутологичных или аллогенных Т-клеток, содержащих клетки TCM, содержащие: молекулу нуклеиновой кислоты, кодирующую полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности, выбранной из SEQ ID NO: 53-56; молекулу нуклеиновой кислоты, кодирующую полипептид, содержащий аминокислотную последовательность, которая идентична аминокислотной последовательности, выбранной из SEQ ID NO: 53-56, за исключением присутствия не больше чем 5 аминокислотных замен, делеций или вставок; молекулу нуклеиновой кислоты, кодирующую полипептид, содержащий аминокислотную последовательность, которая идентична аминокислотной последовательности, выбранной из SEQ ID NO: 53-56, за исключением присутствия не больше чем 5 аминокислотных замен; и молекулу нуклеиновой кислоты, кодирующую полипептид, содержащий аминокислотную последовательность, которая идентична аминокислотной последовательности, выбранной из SEQ ID NO: 53-56, за исключением присутствия не больше чем 2 аминокислотных замен.
Некоторые CAR, описанные в данном документе, например, CAR IL13(EQ)BBζ и CAR IL13(EQ)CD28-ВВζ, имеют некоторые полезные характеристики по сравнению с некоторыми другими CAR, нацеленными на IL13. Например, они имеют улучшенную селективность в отношении IL13Rα, вызывают меньшую продукцию цитокинов Th2, в частности, меньшую продукцию IL13.
Т-клетки, экспрессирующие CAR, нацеленный на IL13Rα2, могут быть полезными в лечении раковых заболеваний, таких как глиобластома, а также других раковых заболеваний, которые экспрессируют IL13Rα2. Таким образом, данное раскрытие включает способы лечения ракового заболевания с использованием Т-клеток, экспрессирующих CAR, описанный в данном документе.
Т-клетки, экспрессирующие CAR, нацеленный на HER2, могут быть полезными в лечении раковых заболеваний, таких как глиобластома, а также другого ракового заболевания, которое экспрессирует HER2, например, рака молочной железы, который распространился в центральную нервную систему. Таким образом, данное раскрытие включает способы лечения рака с использованием Т-клеток, экспрессирующих CAR, описанный в данном документе.
CAR, описанный в данном документе, может включать спейсерную область, расположенную между нацеливающим доменом и трансмембранным доменом. Можно использовать целый ряд разных спейсеров. Некоторые из них включают по меньшей мере часть человеческой области Fc, например, шарнирную часть человеческой области Fc или домен СН3 или их варианты. В Таблице 1 ниже приведены разные спейсеры, которые можно использовать в CAR, описанных в данном документе.


Некоторые спейсерные области включают всю шарнирную область или часть шарнирной области иммуноглобулина (например, IgG1, IgG2, IgG3, IgG4), т.е. последовательность, которая попадает между доменами СН1 и СН2 иммуноглобулина, например, шарнирную область Fc IgG4 или шарнирную область CD8. Некоторые спейсерные области включают домен СНЗ иммуноглобулина или и домен СН3, и домен СН2. Последовательности, происходящие из иммуноглобулина, могут включать одну или более чем одну аминокислотную модификацию, например, 1, 2, 3, 4 или 5 замен, например, замены, которые уменьшают связывание вне мишени.
Термин «аминокислотная модификация» относится к аминокислотной замене, вставке и/или делеции в последовательности белка или пептида. «Аминокислотная замена» или «замена» относится к замене аминокислоты в конкретном положении в последовательности родительского пептида или белка другой аминокислотой. Замену можно делать для изменения аминокислоты в полученном в результате белке неконсервативным образом (т.е. посредством замены кодона аминокислоты, принадлежащей к группе аминокислот, имеющих конкретный размер или характеристику, на аминокислоту, принадлежащую к другой группе) или консервативным образом (т.е. посредством замены кодона аминокислоты, принадлежащей к группе аминокислот, имеющих конкретный размер или характеристику, на аминокислоту, принадлежащую к той же самой группе). Такое консервативное изменение обычно приводит к меньшему изменению в структуре и функции образующегося белка. Следующее представляет собой примеры разных групп аминокислот: 1) аминокислоты с неполярными группами R: аланин, валин, лейцин, изолейцин, пролин, фенилаланин, триптофан, метионин; 2) аминокислоты с незаряженными полярными группами R: глицин, серин, треонин, цистеин, тирозин, аспарагин, глутамин; 3) аминокислоты с заряженными полярными группами R (отрицательно заряженными при рН 6,0): аспарагиновая кислота, глутаминовая кислота; 4) основные аминокислоты (положительно заряженные при рН 6,0): лизин, аргинин, гистидин (при рН 6,0). Другая группа может представлять собой те аминокислоты, которые имеют фенильные группы: фенилаланин, триптофан и тирозин.
В CAR, экспрессируемых клетками, используемыми в способах, описанных в данном документе, можно использовать целый ряд трансмембранных доменов. Таблица 2 включает примеры подходящих трансмембранных доменов. При наличии спейсерной области трансмембранный домен располагается ближе к карбоксильному концу относительно спейсерной области.

Многие из CAR, экспрессируемых клетками, используемыми в способах, описанных в данном документе, включают один или более чем один (например, два) костимулирующих домена. Данный(ые) костимулирующий(ие) домен(ы) располагается(ются) между трансмембранным доменом и доменом сигнализации CD3ζ. Таблица 3 содержит примеры подходящих костимулирующих доменов наряду с последовательностью домена сигнализации CD3ζ.


ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
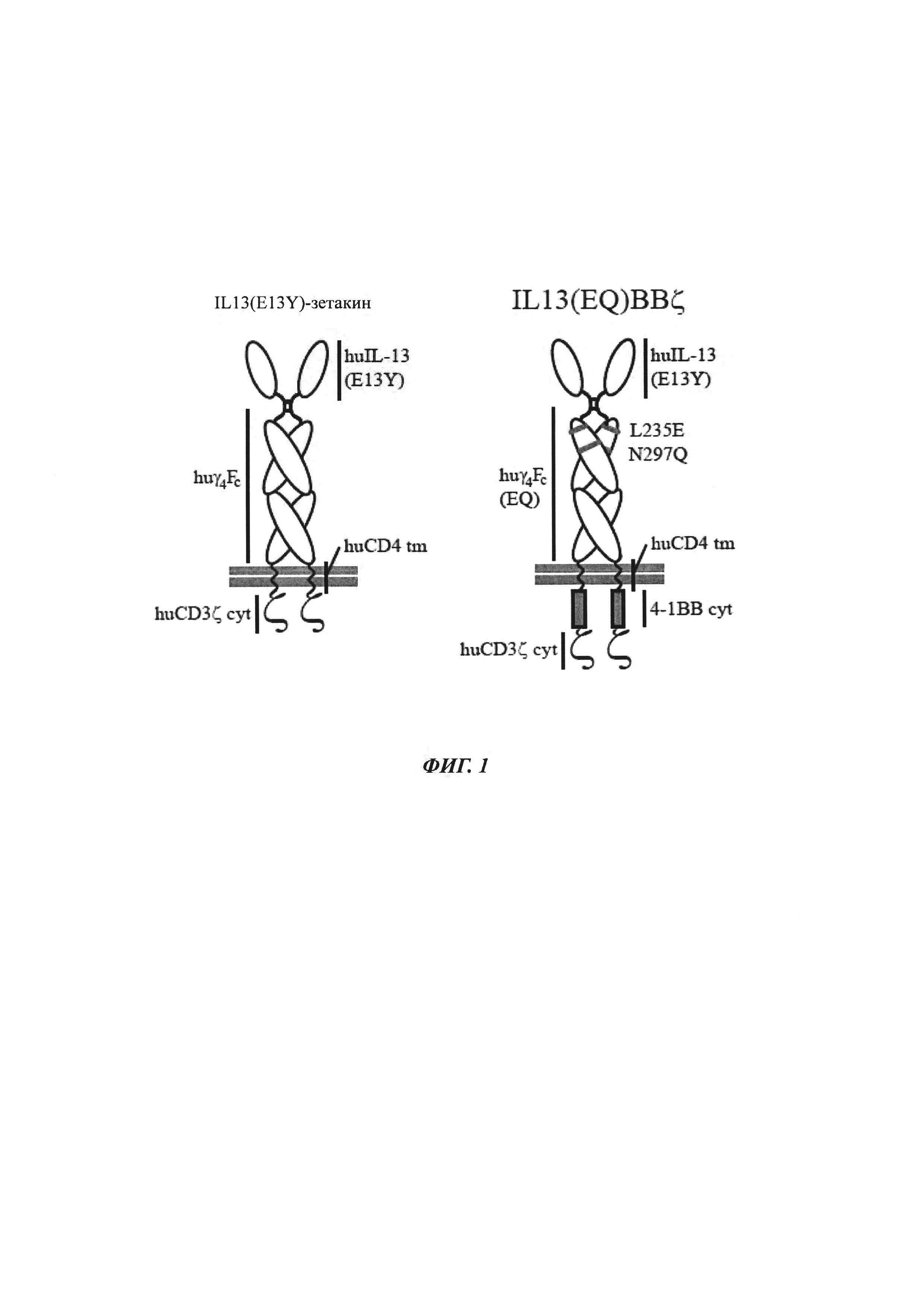
Фиг. 1 представляет собой схематическое изображение CAR IL13(E13Y)-зетакин (слева), состоящего из следующих частей: IL13Rα2-специфичный вариант человеческого IL-13 (huIL-13(E13Y)), спейсер на основе Fc человеческого IgG4 (huγ4Fc), человеческий трансмембранный CD4 (huCD4 tm) и человеческая цитоплазматическая цепь CD3ζ (huCD3ζ cyt), как указано. Также показан CAR IL13(EQ)BBζ, который является таким же, что и IL13(E19Y)-зетакин, за исключением двух точечных мутаций - L235E и N297Q, показанных красным, которые расположены в домене СН2 спейсера IgG4, и добавления костимулирующего цитоплазматического домена 4-1ВВ (4-1ВВ cyt).
На Фиг. 2А-В показаны определенные векторы и открытые рамки считывания. А представляет собой диаграмму кДНК открытой рамки считывания из 2670 нуклеотидов конструкции IL13(EQ)BBZ-T2ACD19t, где указаны IL13Rα2-специфичный лиганд - IL13(E13Y), шарнирная область Fc IgG4(EQ), трансмембранный домен CD4, цитоплазматический домен сигнализации 4-1ВВ, трехглициновый линкер и цитоплазматический домен сигнализации CD3ζ CAR IL13(EQ)BBZ, а также последовательность перескакивания рибосомы Т2А и усеченная последовательность CD19. Также показаны последовательность человеческого рецептора альфа GM-CSF и сигнальная последовательность CD19, которые управляют поверхностной экспрессией CAR IL13(EQ)BBζ и CD19t. Б представляет собой диаграмму последовательностей, фланкированных длинными концевыми повторами (указанными «R»), которые будут встраиваться в геном хозяина. В представляет собой карту плазмиды IL13(EQ)BBZ-T2A-CD19t_epHIV7.
На Фиг. 3 показана конструкция pHIV7.
На Фиг. 4 показаны элементы pHIV7.
На Фиг. 5 показана схема продукции TCM IL13(EQ)BBC/CD19t+.
На Фиг. 6А-В показаны результаты анализа проточной цитометрией экспрессии поверхностного трансгена и маркера Т-клеток. TCM IL13(EQ)BBζ/CD19t+ HD006.5 и HD187.1 совместно окрашивали антителом против IL13, конъюгированным с РЕ (от англ. phycoerythrin - фикоэритрин), и антителом против CD8, конъюгированным с FITC (от англ. «fluorescein isothiocyanate» - «флуоресцеинизотиоцианат»), для выявления клеток CD8+ CAR+ и CD4+ (т.е. CD8-негативных) CAR+ (А), или антителом против CD19, конъюгированным с РЕ, и антителом против CD4, конъюгированным с FITC, для выявления клеток CD4+ CD19t+ и CD8+ (т.е. CD4-негативных) CAR+ (Б). TCM IL13(EQ)BBζ/CD19t+ HD006.5 и HD187.1, окрашенные конъюгированными с флуорохромом антителами против CD3, TCR, CD4, CD8, CD62L и CD28 (серые гистограммы) или изотипическими контролями (черные гистограммы) (В). Во всех случаях процентные содержания основываются на жизнеспособных лимфоцитах (негативных в отношении DAPI (от англ. 4',6-diamidino-2-phenylindole - 4',6-диамидин-2-фенилиндол), дающих окрашивание, превышающее изотипический контроль.
На Фиг. 7А-Г показаны результаты экспериментов, сравнивающих пути доставки Т-клеток CAR+ (в.ч. (внутричерепной) по сравнению с в.в. (внутривенный)) для больших развившихся опухолей. TS (от англ. «tumoral sample» - «образец опухоли») EGFP-ffLuc+ РВТ030-2 (1×105) имплантировали в правую часть переднего мозга мышей NSG. В сутки 19 и 26 мышам в.в. инъецировали через хвостовую вену либо 5×106 TCM CAR+ IL13(EQ)BBζ+ (всего 11,8×106 клеток; n равно 4), либо TCM имитации (11,8×106 клеток; n равно 4). В качестве альтернативы, в сутки 19, 22, 26 и 29 мышам в.ч. инъецировали либо 1×106 TCM CAR+ IL13(EQ)BBζ+ (всего 2,4×106 клеток; n равно 4), либо TCM имитации (2,4×106 клеток; n равно 5). Средний поток ffLuc (фотоны/с) с течением времени показывает то, что TCM IL13(EQ)BBζ, доставленные в.ч. путем, опосредуют регрессию опухолей в случае 19-суточных опухолей. По сравнению с этим, Т-клетки, доставленные в.в., не показывают уменьшения опухолевой нагрузки по сравнению с необработанными контролями или контролями с имитирующими TCM (А). Кривая выживаемости Каплана-Мейера демонстрирует улучшенную выживаемость для мышей, в.ч. обработанных TCM IL13(EQ)BBZ, по сравнению с мышами, обработанными TCM CAR+, введенными в.в. (p равно 0,0003, логранговый критерий) (Б). Репрезентативное окрашивание Н&Е (от англ. «hematoxylin and eosin» - «гематоксилин и эозин») IHC (от англ. «immunohistochemistry» «иммуногистохимия») на CD3 мышей, обработанных TCM IL13(EQ)BBZ+ в.в. (В) по сравнению с в.ч. (Г). Т-клетки CD3+ были выявлены только в группе, обработанной в.ч., причем для мышей, обработанных в.в., не было выявлено клеток CD3+в опухоли или окружающей мозговой паренхиме.
На Фиг. 8А-Б показаны результаты исследований, показывающих то, что Т-клетка CAR+, инъецированная внутричерепным путем, либо внутриопухолево (в.ч.о.), либо внутрижелудочково (в.ч.ж.), может транспортироваться в опухоли на противоположном полушарии. TS EGFP-ffLuc+ РВТ030-2 (1×105) стереотаксически имплантировали в правую и левую часть переднего мозга мышей NSG. На 6-й день мышам в.ч. инъецировали в место правой опухоли 1,0×106 TCM IL13(EQ)BBζ+ (всего 1,6×106 клеток; 63% CAR; n равно 4). Схема экспериментальной модели многоочаговой глиомы (A). IHC CD3 показывает Т-клетки, инфильтрующие места правой и левой опухоли (Б).
На Фиг. 9 показана аминокислотная последовательность IL13(EQ)BBζ/CD19t+ (SEQ ID NO: 10).
На Фиг. 10 показано сравнение последовательностей IL13(EQ)41BBζ [IL13{EQ}41BBζ T2A-CD19t_epHIV7; pF02630] (SEQ ID NO: 12) и CD19Rop_epHIV7 (pJ01683) (SEQ ID NO: 13).
На Фиг. 11 показана аминокислотная последовательность IL13(EmY)-CD8h3-CD8tm2-41BB Дзета (SEQ ID NO: 31 с сигнальным пептидом GMCSFRa (рецептор a гранулоцитарно-макрофагального колониестимулирующего фактора); SEQ ID NO: 39 - без сигнального пептида GMCSFRa).
На Фиг. 12 показана аминокислотная последовательность IL13(EmY)-CD8h3-CD28tm-CD28gg-41BB-Дзета (SEQ ID NO: 32 с сигнальным пептидом GMCSFRa; SEQ ID NO: 40 - без сигнального пептида GMSCFRa).
На Фиг. 13 показана аминокислотная последовательность IL13(EmY)-IgG4(HL-CH3)-CD4tm-41BB-Дзета (SEQ ID NO: 33 с сигнальным пептидом GMCSFRa; SEQ ID NO: 41 - без сигнального пептида GMCSFRa).
На Фиг. 14 показана аминокислотная последовательность IL13(EmY)-IgG4(L235E,N297Q)-CD8tm-41BB-Дзета (SEQ ID NO: 34 с сигнальным пептидом GMCSFRa; SEQ ID NO: 42 - без сигнального пептида GMCSFRa).
На Фиг. 15 показана аминокислотная последовательность IL13(EmY)-Линкер-CD28tm-CD28gg-41BB-Дзета (SEQ ID NO: 35 с сигнальным пептидом GMCSFRa; SEQ ID NO: 43 - без сигнального пептида GMCSFRa).
На Фиг. 16 показана аминокислотная последовательность IL13(EmY)-HL-CD28m-CD28gg-41BB-Дзета (SEQ ID NO: 36 с сигнальным пептидом GMCSFRa; SEQ ID NO: 44 - без сигнального пептида GMSCFRa).
На Фиг. 17 показана аминокислотная последовательность IL13(EmY)-IgG4(HL-CH3)-CD28tm-CD28gg-41BB-Дзета (SEQ ID NO: 37 с сигнальным пептидом GMSCFRa; SEQ ID NO: 45 - без сигнального пептида GMCSFRa).
На Фиг. 18 показана аминокислотная последовательность IL13(EmY)IgG4(L235E,N297Q)-CD28tm-CD28gg-41BB-Дзета (SEQ ID NO: 38 с сигнальным пептидом GMCSFRa; SEQ ID NO: 46 - без сигнального пептида GMCSFRa).
На Фиг. 19 показана аминокислотная последовательность IL13(EmY)-CD8h3-CD8tm-41BB-Дзета (SEQ ID NO: 47 с сигнальным пептидом GMCSFRa; SEQ ID NO: 48 - без сигнального пептида GMCSFRa).
На Фиг. 20 показана аминокислотная последовательность Her2scFv-IgG4(L235E, N297Q)-CD28tm-CD28gg-Дзета-T2A-CD19t. Разные домены перечисляются по порядку под последовательностью и указываются чередующимся подчеркиванием или неподчеркиванием. Последовательность зрелого CAR (SEQ ID NO: 26) не включает сигнальный пептид GMCSFRa, последовательность перескакивания рибосомы Т2А или усеченный CD19.
На Фиг. 21 показана аминокислотная последовательность Her2scFv-IgG4(L235E,N297Q)-CD28tm-41BB-Дзета-T2A-CD19t. Разные домены перечисляются по порядку под последовательностью и указываются чередующимся подчеркиванием или неподчеркиванием. Последовательность зрелого CAR (SEQ ID NO: 27) не включает сигнальный пептид GMCSFRa, последовательность перескакивания рибосомы Т2А или усеченный CD19.
На Фиг. 22А-Г показаны HER2-cneu.ncpH4Hbie конструкции CAR и данные по размножению Т-клеток с CAR.
На Фиг. 23А-Г показана характеристика in vitro Т-клеток с HER2-специфичным CAR против линий клеток рака молочной железы.
На Фиг. 24А-Е показан результат исследований по противоопухолевой активности in vitro Т-клеток с HER2-специфичным CAR.
На Фиг. 25А-И показан результат исследований по противоопухолевой эффективности in vivo местных доставленных внутриопухолево Т-клеток с HER2-специфичным CAR.
На Фиг. 26А-Г показаны результаты исследований по местной доставке Т-клеток с HER2-специфичным CAR в человеческой ортотопической модели ксенотрансплантата ВВМ.
На Фиг. 27А-Г показаны результаты исследований по внутрижелудочковой доставке Т-клеток с HER2-специфичным CAR.
На Фиг. 28 схематически показаны положения инъекции опухолевых клеток и инъекции Т-клеток с CAR для исследования внутриопухолевой и внутрижелудочковой инъекции Т-клеток с CAR, нацеленным на IL13α2R, в мышиной модели глиобластомы.
На Фиг. 29А-В показаны результаты исследований, демонстрирующие регрессию развившихся ксенотрансплантатов глиомной опухоли после введения TCM IL13(EQ)BBζ/CD19t+. Опухолевые клетки ffLuc+ РВТ030-2 (1×105) стереотаксически имплантировали в правую и левую часть переднего мозга мышей NSG. В сутки 6 мышам либо в.ч.о., либо в.ч.ж. инъецировали 1×106 Тем IL13(EQ)BBζ (всего 1,6×106 клеток; 63% CAR+), как описано на Фиг. 4.1 выше. А, репрезентативные мыши из каждой группы, демонстрирующие относительную опухолевую нагрузку, определенную с использованием прижизненной визуализации Xenogen. Б, средний поток Xenogen левого и правого полушарий мозга (интересующая область, ROI) от мышей (n равно 4-5) каждой группы, где каждый из последующих столбиков представляет сутки 5, 9, 12, 15 и 19 соответственно. *, p меньше 0,05 по сравнению с соответствующей ROI и сутками/столбиком необработанной группы РВТ030-2 с использованием непарного t-критерия Стьюдента. В, средний поток Xenogen всего мозга через 13 суток после инъекции Т-клеток. *, p равно 0,0407 при сравнении группы в.ч.ж. с необработанной группой РВТ030-2 с использованием непарного t-критерия Стьюдента. Эти данные являются репрезентативными для трех отдельных экспериментов с многоочаговой GBM.
На Фиг. 30 показаны результаты исследований, демонстрирующие то, что клетки huCD3+ выявляются в правой и левой опухоли мозга/полушарии после в.ч.о. и в.ч.ж. введения TCM IL13(EQ)BBζ/CD19t+. Опухолевые клетки ffLuc+ РВТ030-2 (1×105) стереотаксически имплантировали в правую и левую часть переднего мозга мышей NSG. В сутки 6 мышам либо в.ч.о. (левые изображения), либо в.ч.ж. (правые изображения) инъецировали 1×106 TCM IL13(EQ)BBζ+ (всего 1,6×106 клеток; 63% CAR+). Через одну неделю (верхние изображения) и две недели (нижние изображения) после введения Т-клеток 2-3 мышей из каждой группы умерщвляли, отбирали мозги, заливали в парафин и осуществляли IHC с антителом против человеческого CD3 для выявления Т-клеток. Показаны репрезентативные IHC изображения левых и правых участков опухоли от мышей каждой группы (в.ч.о.: m406 и m410; в.ч.ж.: m414 и m415). На вкладках показаны изображения потока Xenogen мышей в день умерщвления и отбора мозга.
На Фиг. 31 схематически показан ход получения Т-клеток с CAR и обработка для клинического испытания Т-клеток с CAR для лечения глиобластомы (А), и приведено несколько схем дозирования (Б).
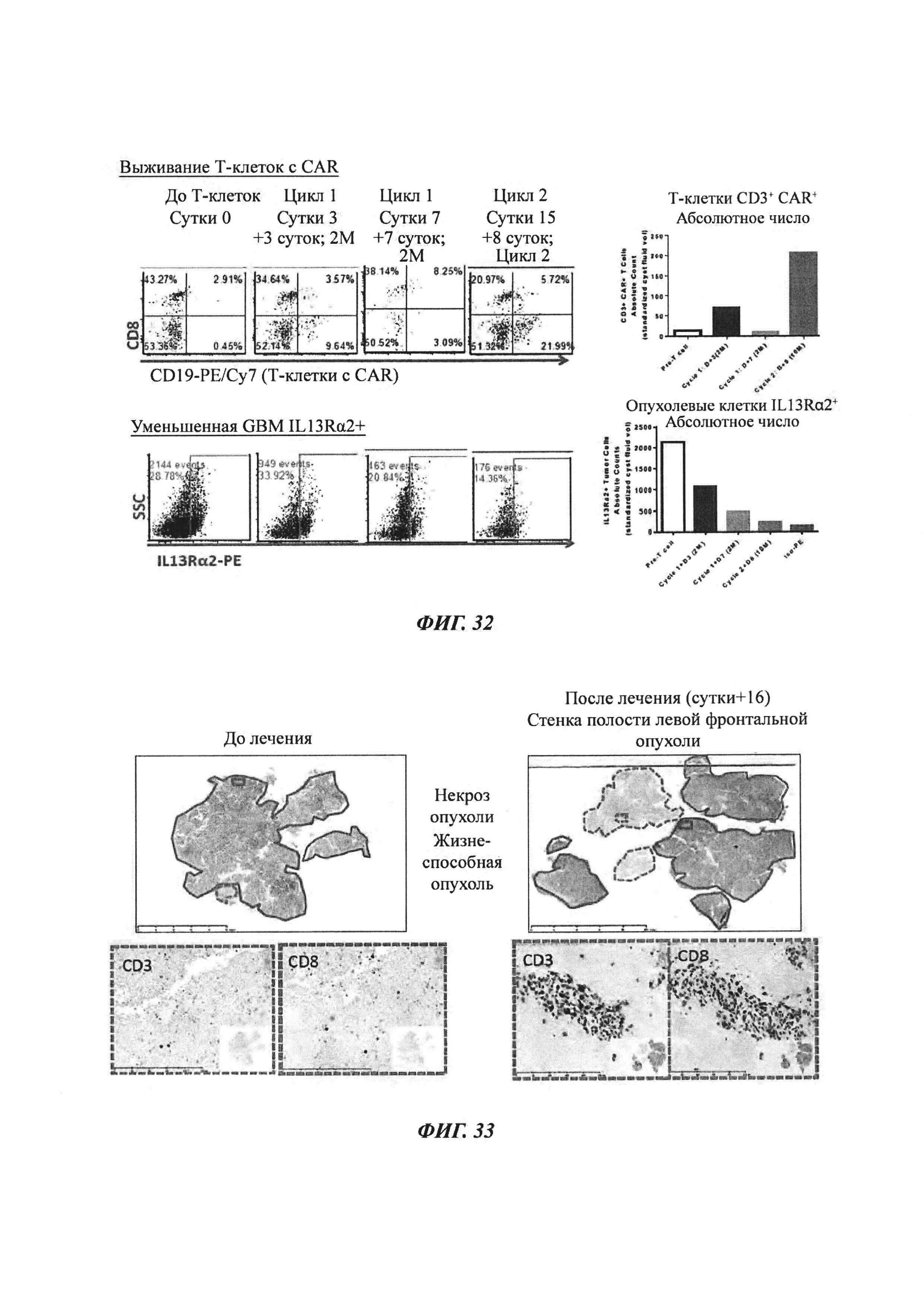
На Фиг. 32 представлен анализ выживания Т-клеток с CAR при отслеживании по CD19 (А) и присутствия клеток GBM при отслеживании по экспрессии IL13Rα2 (Б).
На Фиг. 33 представлены результаты визуализации от пациента UPN097 в области катетера, используемого для внутриопухолевого введения.
Фиг. 34 представляет собой ряд графиков, показывающих уровни разных цитокинов на протяжении хода лечения для одного пациента.
Фиг. 35А-В представляют собой изображения, показывающие регрессию рецидивирующей многоочаговой глиобластомы, включающей метастазы в спинном мозге, после внутрижелудочковой доставки Т-клеток с CAR, нацеленным на IL13Rα2. Пациента, демонстрирующего рецидивирующую многоочаговую GBM, включающую один метастатический участок в спинном мозге и обширное лептоменингеальное заболевание, лечили шестью местными инфузиями TCM IL13BBζ в полость резекции наибольшего рецидивного очага опухоли (1 цикл 2 М и 5 циклов 10 М Т-клеток CAR+). В то время как сайт инъекции Т-клеток с CAR оставался стабильным без доказательства рецидива заболевания в течение более 7 недель, другие очаги заболевания, удаленные от места инъекции Т-клеток с CAR, продолжали прогрессировать (данные не показаны). Данный пациент затем получал пять еженедельных внутрижелудочковых (в.ч.ж.) инфузий TCM IL13BBζ (1 цикл 2 М и 4 цикла 10 М Т-клеток CAR+). Показаны изображения МРТ (магнитно-резонансная томография) и/или ПЭТ (позитронно-эмиссионная томография) (А) поперечного среза мозга, (Б) сагиттального среза мозга и (В) поперечного (наверху) и фронтального (внизу) срезов спинного мозга до (слева) и через одну неделю после (справа) завершения в.ч.ж. терапии, с участками опухолевого поражения, указанными на каждом изображении красными стрелками.
На Фиг. 36А-Б показаны схемы лечения с регистрацией NCT02208362 и протоколом сочувственного применения. Регистрация NCT02208362 была установлена в сутки 0 (А), с инициацией протокола сочувственного применения в сутки 107 (Б). NovoTTF-100А - переносное медицинское устройство, которое доставляет малоинтенсивные переменные электрические поля промежуточной частоты посредством неинвазивных одноразовых электродов для отведения с черепа; FGFR (от англ. «fibroblast growth factor receptor») - рецептор фактора роста фибробластов; МРТ - магнитно-резонансная томография, со всеми из которых работали на головном мозге, если не указано иное; в.п. - внутриполостное; ПЭТ - позитронно-эмиссионная томография, проводимая на указанных участках; в.ж. - внутрижелудочковое.
На Фиг. 37А-В показана иммуногистохимия первичных и рецидивирующих опухолей. Опухоль, резецированная при исходной постановке диагноза (А), и рецидив опухоли (Т1), резецированный во время постановки катетера Рикхэма согласно NCT02208362 (Б, В). Показано иммунохимическое окрашивание с использованием либо IL13Pα2-специфичного, либо Ki67-специфичного DAB (от англ. «domain antibody» - «доменное антитело») с контрастным окрашиванием гематоксилином, с красными прямоугольниками, очерчивающими последовательные увеличенные изображения, идущие слева направо.
На Фиг. 38А-Б показана идентификация опухолевого поражения. (А) Осуществление идентификации характеристик поражений GBM Т1-Т8. (Б) Сканы МРТ мозга, показывающие сайты Т1-Т7.
На Фиг. 39А-В показано то, что область резецированной опухоли остается стабильной, без доказательства прогрессирования/рецидива заболевания после внутри полостной доставки TCM IL13BBζ. (А) Анализ проточной цитометрией клеточного продукта TCM IL13BBζ. Верхний ряд - транедукция указанной конструкцией управляла координированной поверхностной экспрессией CAR IL13BBζ (выявленного с использованием антитела против IL13) и маркера CD19t (выявленного с использованием антитела против CD19) через последовательность перескакивания рибосомы Т2А. В среднем ряду показаны профили окрашивания маркеров Т-клеток: TCR-α/β, CD3, CD4 и CD8, а также маркеров истощения LAG-3, TIM-3, KLRG1 и PD-1; в нижнем ряду показаны профили окрашивания маркеров клеток памяти CD62L, CD45RO, CCR7, CD27 и CD28, а также маркера наивных Т-клеток CD45RA. (Б) Схема лечения согласно NCT02208362. После того, как пациент испытал рецидив и был подвергнут вырезанию опухоли с размещением внутриполостного (в.п.) катетера Рикхэма, вводили 6 циклов в.п.доз клеток (1 цикл с 2×106 и 5 циклов с 10×106 клеток CAR+) с одной неделей отдыха между циклами 3 и 4. Красная стрелка - место доставки Тем IL13BBζ. (В) Желтые круги на МРТ-сканах мозга показывают место резецированной опухоли, где был размещен катетер (Т1), а также места только резецированных опухолей в лобной доле (Т2, Т3) и вновь возникающие опухолевые участки (Т6, Т7) на протяжении 51-суточного периода в.п.лечения.
На Фиг. 40А-Д показана регрессия рецидивирующей многоочаговой глиобластомы, включающей метастазы в спинном мозге, после внутрижелудочковой доставки Т-клеток с CAR, нацеленным на IL13Rα2. (А) Схема лечения при протоколе сострадательного применения. После того как пациент подвергся размещению внутрижелудочкового (в.ж.) катетера Рикхэма, вводили 5 циклов в.ж. доз клеток (1 цикл с 2×106 и 4 цикла с 10×106 клеток CAR+, указанные как циклы 7-11) с одной неделей отдыха между циклами 9 и 10. Красная стрелка - место доставки TCM IL13BBζ. Изображения МРТ и/или ПЭТ (Б) поперечных срезов головного мозга, (В) сагиттальных срезов головного мозга и (Г) поперечных (верх) и фронтальных (низ) срезов спинного мозга до (слева) и через одну неделю после (справа) завершения в.ж. терапии с местами опухолевого поражения, указанными на каждом изображении желтыми кругами. (Д) Максимальные площади поражения для нерезецированных опухолей Т4-Т8 показывают их соответствующие уменьшения с течением времени при использовании в.ж. терапии.
На Фиг. 41 показана регрессия рецидивирующей многоочаговой GBM после в.ж. доставки Т-клеток с CAR, нацеленным на IL13Rα2. Показаны максимальные площади поражения для нерезецированных опухолей Т4-Т7.
На Фиг. 42А-В показан анализ клеточных инфильтратов и цитокинов из образцов спинномозговой жидкости (СМЖ). (А) Число клеточных инфильтратов СМЖ демонстрировало скачок после в.ж. циклов 9, 10 и 11, с полученным проточной цитометрией доказательством В-клеток CD19+, и CAR+ (т.е. CD19t+), и несконструированных Т-клеток CD3+, гранулоцитов CD11b+ CD15+ и моноцитов CD11b+ CD14+ HLA-DR+. (Б) Оценка популяции Т-клеток CD3+ в СМЖ на присутствие генномодифицированных Т-клеток (т.е. CD19t+). Отсортированные на CD3 клетки из СМЖ, отобранные в указанные сутки циклов 9, 10 и 11, совместно окрашивали на CD19 и CD8 (верхние гистограммы). Затем процентные доли иммунореактивных клеток использовали для расчета общего числа Т-клеток CD3+ и клеток CD19+ CD3+ (TCM IL13BBζ) на мл СМЖ в каждый момент времени. (В) Кратность изменения уровней цитокинов с использованием циклов 7-11 в.ж. лечения. Показаны только те цитокины из 30-плексного анализа, которые демонстрировали 10-кратное или большее изменение по сравнению с уровнями до обработки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Ниже описаны структура, конструирование и характеристика разных Т-клеток с CAR, и их применение в лечении раковых заболеваний центральной нервной системы. Химерный рецептор антигена (CAR) представляет собой рекомбинантную биомолекулу, которая содержит, как минимум, внеклеточный домен распознавания, трансмембранную область и внутриклеточный домен сигнализации. Термин «антиген», следовательно, не ограничивается молекулами, с которыми связываются антитела, но относится к любой молекуле, которая может специфично связываться с мишенью. Например, CAR может включать лиганд, который специфично связывается с рецептором клеточной поверхности. Внеклеточный домен распознавания (также именуемый внеклеточным доменом, или просто по элементу распознавания, который он содержит) содержит элемент распознавания, который специфично связывается с молекулой, присутствующей на клеточной поверхности клетки-мишени. Трансмембранная область заякоривает CAR в мембране. Внутриклеточный домен сигнализации содержит домен сигнализации из дзета цепи человеческого комплекса CD3 и, возможно, содержит один или более чем один костимулирующий домен сигнализации. CAR могут и связываться с антигеном, и трансдуцировать активацию Т-клеток, независимо от ограничения МНС (от англ. «major histocompatibility complex» - «главный комплекс гистосовместимости»). Таким образом, CAR представляют собой «универсальные» иммунорецепторы, которые могут лечить популяцию пациентов с антигенпозитивными опухолями, независимо от их генотипа HLA. Адоптивная иммунотерапия с использованием Т-лимфоцитов, которые экспрессируют опухолеспецифичный CAR, может быть мощной терапевтической стратегией для лечения рака.
В некоторых случаях CAR, описанные в данном документе, могут быть получены с использованием вектора, в котором после открытой рамки считывания CAR следует последовательность перескакивания рибосомы Т2А и усеченный CD19 (CD19t), у которого отсутствует цитоплазматический хвост сигнализации (усеченный по аминокислоте 323). При данной организации коэкспрессия CD19t предоставляет инертный неиммуногенный поверхностный маркер, который обеспечивает точное измерение генномодифицированных клеток и делает возможной позитивную селекцию генномодифицированных клеток, а также эффективное отслеживание клеток и/или визуализацию терапевтических Т-клеток in vivo после адоптивного переноса. Коэкспрессия CD19t предоставляет маркер для иммунологического нацеливания на трансдуцированные клетки in vivo с использованием клинически доступных антител и/или иммунотоксических реактивов для селективного устранения терапевтических клеток и, посредством этого, функционирования в качестве суицидного переключателя.
Раскрытые способы лечения с использованием Т-клеток с CAR могут осуществляться при разных дозах и в разных временных рамках. Например, пациент, получающий инфузию, введение или инъекцию Т-клеток с CAR (например, Т-клеток с IL13Rα2-специфичным CAR), может получать одну дозу, содержащую от 1×106 до 15×106 клеток. Другими словами одна доза для применения в раскрытых способах может содержать 1×106, 2×106, 3×106, 4×106, 5×106, 6×106, 7×106, 8×106, 9×106, 10×106, 11×106, 12×106, 13×106, 14×106 или 15×106 клеток. На протяжении всего курса лечения пациент может получать совокупную или общую дозу клеток от 20×106 до 150×106 Т-клеток. Например, пациент может получать примерно 20×106, примерно 25×106, примерно 30×106, примерно 35×106, примерно 40×106, примерно 45×106, примерно 50×106, примерно 55×106, примерно 60×106, примерно 65×106, примерно 70×106, примерно 75×106, примерно 80×106, примерно 85×106, примерно 90×106, примерно 95×106, примерно 100×106, примерно 105×106, примерно 110×106, примерно 115×106, примерно 120×106, примерно 125×106, примерно 130×106, примерно 135×106, примерно 140×106, примерно 145×106 или примерно 150×106 или более Т-клеток на протяжении курса лечения. В некоторых воплощениях пациент может получать общую дозу по меньшей мере 90×106 Т-клеток. В одном воплощении пациент может получать общую дозу 94×106 Т-клеток.
Кроме того, данные дозы могут вводиться согласно разным схемам и расписаниям. Например, раскрытые способы могут включать инфузию, введение или инъекцию один раз в сутки, один раз каждые двое суток, один раз каждые трое суток, один раз каждые четверо суток, один раз каждые пять суток, один раз каждые шесть суток, раз в неделю, один раз каждые две недели, один раз каждые три недели, один раз каждые четыре недели, один раз в месяц, один раз в каждые два месяца, один раз в каждые три месяца или один раз в каждые шесть месяцев. В некоторых воплощениях раскрытые способы могут включать непрерывную инфузию, например, из носимого насоса. Аналогичным образом, общее время курса лечения может составлять примерно 5 недель, примерно 10 недель, примерно 15 недель, примерно 20 недель, примерно 25 недель, примерно 30 недель, примерно 35 недель, примерно 40 недель, примерно 45 недель, примерно 50 недель, примерно 55 недель, примерно 60 недель, примерно 65 недель, примерно 70 недель, примерно 75 недель или более. Пациент может получать 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20, или более инфузий, введений или инъекций Т-клеток на протяжении курса лечения согласно раскрытым способам. Например, в одном воплощении пациент может получать 11 инфузий Т-клеток на протяжении 15-недельного курса.
Лечение рака и, более конкретно, глиомоподобной глиобластомы, согласно раскрытым способам может приводить ко многим терапевтическим эффектам. Например, лечение раскрытыми Т-клетками с CAR может приводить к увеличению уровня цитокинов и хемокинов в СМЖ пациента, которого лечат согласно раскрытым способам. Экспрессия цитокинов и/или хемокинов может возрастать по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 99% или по меньшей мере на 100%, или экспрессия цитокинов и/или хемокинов может возрастать по меньшей мере в 1 раз, по меньшей мере в 2 раза, по меньшей мере в 3 раза, по меньшей мере в 4 раза, по меньшей мере в 5 раз, по меньшей мере в 6 раз, по меньшей мере в 7 раз, по меньшей мере в 8 раз, по меньшей мере в 9 раз или по меньшей мере в 10 раз по сравнению с исходными уровнями при измерении до лечения композицией, содержащей Т-клетки с CAR. Данное увеличение экспрессии может наблюдаться для 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, или более цитокинов или хемокинов.
В частности, в результате лечения Т-клетками с CAR, как раскрыто в данном документе, может увеличиваться экспрессия по меньшей мере одного из EGF, эотаксина, FGF, G-CSF, GM-CSF, HGF, IFN-α, IFN-γ, IL-10, IL-12, IL-13, IL-15, IL-17, IL-1Rα), IL-1β, IL-2, IL-2R, IL-4, IL-5, IL-6, IL-7, IL-8, IP-10, MCP-1, MIG, MIP-1α, MIP-1β, RANTES, TNF-α или VEGF. Кроме того, увеличение экспрессии цитокина и/или хемокина может быть местным (т.е. данное увеличение наблюдается только в ЦНС и СМЖ, тогда как уровни цитокинов и хемокинов в сыворотке остаются неизменными).
Лечение согласно раскрытым способам также может приводить к увеличению уровня Т-клеток, выявляемых в СМЖ. В то время как по меньшей мере некоторые из Т-клеток, выявляемых в СМЖ после лечения, вероятно будут Т-клетками, экспрессирующими CAR, также может происходить увеличение уровня эндогенных Т-клеток, которые рекрутируются в СМЖ. Не желая быть связанными теорией, данное увеличение уровня эндогенных Т-клеток может быть результатом рекрутирования Т-хелперных клеток типа 1 и типа 2 из-за увеличения местных уровней цитокинов. Кроме того, выявляемые Т-клетки могут содержать Т-клетки CD3+, а также зрелые миелоидные популяции CD14+ CD11b+ HLA-DR+, В-клетки CD19+ и гранулоциты CD11b+ CD15+ и/или реактивные лимфоциты, моноциты и макрофаги.
Увеличение числа Т-клеток в СМЖ может выявляться в течение конкретного периода времени после лечения согласно раскрытым способам. Выявляемое увеличение Т-клеток в СМЖ может сохраняться или поддерживаться в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30, или более суток после введения композиции, содержащей Т-клетки. Например, увеличение числа Т-клеток, наблюдаемых в СМЖ, может не возвращаться к исходным уровням (т.е. числу Т-клеток, выявляемых до лечения) в течение примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 суток. Число Т-клеток, выявляемых в СМЖ, может возрастать по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 99% или по меньшей мере на 100%, или по меньшей мере в 1 раз, по меньшей мере в 2 раза, по меньшей мере в 3 раза, по меньшей мере в 4 раза, по меньшей мере в 5 раз, по меньшей мере в 6 раз, по меньшей мере в 7 раз, по меньшей мере в 8 раз, по меньшей мере в 9 раз, по меньшей мере в 10 раз, по меньшей мере в 11 раз, по меньшей мере в 12 раз, по меньшей мере в 13 раз, по меньшей мере в 14 раз или по меньшей мере в 15 раз по сравнению с исходными уровнями при измерении до лечения композицией, содержащей Т-клетки с CAR.
Ход получения Т-клеток с CAR и лечения показан на Фиг. 31. Одновременно с процессом изготовления участники исследования подвергались резекции их опухоли(ей) с последующим размещением катетера Рикхэма и исходной визуализацией.
Пациент UPN097 подвергся резекции опухоли и лечению в цикле 1 2×106 клеток и в цикле 2 10×106 клеток. И в цикле 1, и в цикле 2 клетки вводили в полость, оставленную резекцией. После второго цикла пациент UPN097 был выведен из исследования из-за быстрого прогрессирования опухоли.
Пациента UPN109 лечили в цикле 1 2×106 клеток и в циклах 2 и 3 10×106 клеток. После периода отдыха пациента UPN109 лечили в циклах 4, 5 и6 10×106 клеток. В циклах 1-6 клетки вводили внутрь опухоли. В цикле 7 пациента лечили 2×106 клеток. В циклах 8 и 9 пациента лечили 10×106 клеток. В циклах 7-10 введение было внутрижелудочковым.
Термин «внутрижелудочковое» в том виде, в котором он используется в данном документе, относится к пространству внутри желудочковой системы, в частности, мозговых желудочков. Соответственно, термины «внутрижелудочковое» и «интрацеребровентрикулярное» могут использоваться во всем данном раскрытии взаимозаменяемо. Соответственно, термины «внутрижелудочковое введение» или «внутрижелудочковая инъекция» относятся к доставке композиции в желудочки головного мозга (т.е. мозговые желудочки). Мозговые желудочки представляют собой ряд взаимосвязанных, заполненных жидкостью пространств, которые находятся в сердцевине переднего мозга и ствола мозга. Данная система содержит четыре желудочка: правый и левый боковые желудочки (по одному из которых находится в каждом полушарии мозга), третий желудочек и четвертый желудочек.
Раскрытые способы включают разные пути введения композиций, содержащих Т-клетки. Например, в некоторых воплощениях раскрытые композиции могут доставляться или вводиться внутрижелудочковым путем. В некоторых воплощениях раскрытые композиции могут доставляться или вводиться в канал спинного мозга (т.е. подоболочечная доставка). В некоторых воплощениях раскрытые композиции могут доставляться или вводиться в эпидуральное пространство спинного мозга (т.е. эпидуральная доставка). В некоторых воплощениях раскрытые композиции могут доставляться или вводиться непосредственно в опухоль (т.е. внутриопухолевая доставка). В некоторых воплощениях раскрытые композиции могут доставляться или вводиться в полость, образованную резекцией опухолевой ткани (т.е. внутриполостная доставка). Кроме того, в некоторых воплощениях раскрытые способы могут включать комбинацию вышеупомянутых путей введения. Например, пациент может получать по меньшей мере одну дозу композиции, содержащей Т-клетки, посредством внутриполостной доставки с последующей по меньшей мере одной дозой композиции через внутрижелудочковую доставку.
На Фиг. 32А представлен анализ выживания Т-клеток с CAR при отслеживании по CD19. Данный анализ показывает хорошее выживание Т-клеток через 8 суток после цикла 2. На Фиг. 32Б показано меньшее присутствие клеток GBM при отслеживании по экспрессии IL13Rα2.
На Фиг. 33А и Фиг. 33Б показаны результаты визуализации от пациента UPN097 в области катетера, используемого для внутриопухолевого введения. На Фиг. 33А можно видеть то, что до лечения присутствует мало Т-клеток CD3+ или CD8+. На Фиг. 33Б, которая представляет собой образец в сутки 16 после лечения, отобранный из стенки левой фронтальной опухолевой полости, показана большая площадь некротической опухоли и значительное присутствие клеток CD3+ и CD8+.
Глиомы экспрессируют рецепторы IL13 и, в частности, высокоаффинные рецепторы IL13. Однако, в отличие от рецептора IL13, глиомные клетки сверхэкспрессируют уникальную цепь IL13Rα2, способную к связыванию с IL13 независимо от потребности в IL4Rβ или γc44. Подобно его гомологу - IL4, IL13 имеет плеотропную иммунорегулирующую активность вне ЦНС. И IL13 и IL4 стимулируют продукцию IgE В-лимфоцитами и подавляют продукцию провоспалительных цитокинов макрофагами. Подробные исследования с использованием авторадиографии с радиоактивно меченым IL13 продемонстрировали обильное связывание IL13 почти на всех исследованных тканях злокачественной глиомы. Данное связывание является высокогомогенным в пределах срезов опухоли и в анализе одиночных клеток. Однако анализ с молекулярным зондом, специфичным в отношении мРНК IL13Rα2, не выявил экспрессии глиомоспецифичного рецептора нормальными элементами мозга, и авторадиография с радиоактивно меченым IL13 также не могла выявлять специфичного связывания IL13 в нормальной ЦНС. Данные исследования свидетельствуют о том, что общий рецептор IL13Rα1/IL4β/γc выявляемо не экспессируется в нормальной ЦНС. Следовательно, IL13Rα2 является очень специфичной мишенью клеточной поверхности для глиомы и подходящей мишенью для CAR, сконструированного для лечения глиомы.
Некоторые пациенты могут быть более подходящими, чем другие, для получения раскрытых способов лечения. Например, те пациенты со злокачественными опухолями, у которых высоко экспрессируется IL13Rα2, могут получать особенную пользу от лечения раскрытыми Т-клетками с CAR. Пригодность пациента может быть определена посредством окрашивания образца резецированной опухоли от пациента для определения количества экспрессии IL-13Rα2. Данный образец может быть подвергнут бальной оценке на основе числа клеток, демонстрирующих слабую, умеренную или сильную интенсивность окрашивания. Определение уровня экспрессии Ki67 также может быть полезным для определения агрессивности заболевания. Как только было определено то, что пациент хорошо подходит для получения раскрытых Т-клеток с CAR, данного пациента можно лечить согласно раскрытым способам.
Связывание терапевтических молекул на основе IL13 с широко экспрессируемым рецепторным комплексом IL13Rα1/IL4β/γc, однако, имеет потенциал опосредования нежелательных токсичностей для нормальных тканей вне ЦНС и, таким образом, ограничивает системное введение данных агентов. Аминокислотная замена в альфа-спирали A IL13 в положении 13 природной глутаминовой кислоты на тирозин селективно уменьшает аффинность IL13 к рецептору IL13Rα1/IL4β/γc. Связывание данного мутанта (именуемого IL13(E13Y)) с IL13Rα2, однако, было повышенным относительно IL13 дикого типа. Таким образом, данный минимально измененный аналог IL13 одновременно увеличивает специфичность и аффинность IL13 в отношении глиомных клеток. Следовательно, CAR, описанный в данном документе, включает IL13, содержащий мутацию (от Е до Y или от Е до некоторой другой аминокислоты, такой как K или R, или L, или V) в положении аминокислоты 13 (согласно нумерации Debinski et al. 1999 Clin Cancer Res 5:3143s). Однако IL13, имеющий природную последовательность, также может быть использован и может быть полезным, особенно в ситуациях, когда модифицированные Т-клетки подлежат местному введению, как, например, посредством инъекции непосредственно в опухолевую массу.
Кроме того, известно то, что глиомы обычно дают плохой прогноз для пациента. Например, мультиформная глиобластома (GBM) представляет собой обычное злокачественное раковое заболевание ЦНС. 1-летние и 2-летние показатели относительной выживаемости для GBM составляют 29,6% и 9,0% соответственно. Только 3,4% пациентов с диагнозом GBM живут более 5 лет. Кроме того, обычным является рецидив после хирургической резекции и/или лечения другими традиционными терапевтическими средствами. Современные традиционные виды лечения включают лучевую терапию, низкомолекулярные лекарственные средства (например, темозоломид, иринотекан, иматиниба мезилат, эрлотиниб и гидроксимочевина) и биологические средства, такие как антитела (например, бевацизумаб), но не ограничиваются ими.
Раскрытые способы лечения улучшают клинический прогноз у пациентов по сравнению с современными стандартами. Например, раскрытые способы могут увеличивать 1-летнюю, 2-летнюю и 5-летнюю выживаемость. В некоторых воплощениях 1-летняя выживаемость пациента, которого лечат согласно раскрытым способам, может составлять по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 99% или по меньшей мере 100%. В некоторых воплощениях 2-летняя выживаемость пациента, которого лечат согласно раскрытым способам, может составлять по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 99% или по меньшей мере 100%. В некоторых воплощениях 5-летняя выживаемость пациента, которого лечат согласно раскрытым способам, может составлять по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 99% или по меньшей мере 100%.
В некоторых воплощениях раскрытые способы также увеличивают ожидаемую продолжительность жизни пациента по сравнению с другим пациентом, получающим традиционные виды лечения или лечение SOC, включая лучевую терапию, терапию низкомолекулярными лекарственными средствами, терапевтические биологические средства, подобные терапевтическим антителам, или их комбинацию. В некоторых воплощениях, при которых для пациента, получающего лечение SOC, можно ожидать выживаемость в течение примерно 15 месяцев с момента исходной постановки диагноза (общая выживаемость или OS), для пациента, получающего раскрытое лечение, можно ожидать OS 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 месяцев или более. В некоторых воплощениях для пациента, получающего заявленное лечение, можно ожидать OS 42, 48, 54, 60, 66, 72, 78, 84, 90 месяцев или более.
Раскрытые способы могут улучшать прогноз пациента через целый ряд клинических результатов. Например, раскрытые способы могут приводить к уменьшению объема опухоли у пациента, которого лечат композицией, содержащей Т-клетки. В некоторых воплощениях раскрытые способы лечения могут приводить к уменьшению объема опухоли на по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 99% или по меньшей мере 100%. В некоторых воплощениях опухоли у пациента могут быть полностью устранены, и пациент может быть излечен от злокачественной опухоли.
Кроме того, раскрытые способы являются безопасными и хорошо переносимыми. Пациенты, которых лечат согласно раскрытым способам, могут не испытывать значительных побочных эффектов и, кроме того, могут иметь возможность прерывать прием вспомогательных лекарственных средств. Например, в некоторых воплощениях раскрытые способы не будут приводить к каким-либо токсичностям степени 3 или выше согласно общим критериям токсичности (СТС, от англ. «Common Toxicity Criteria») Национального института рака (NCI, от англ. «National Cancer Institute)). СТС дают количественную шкалу от 0 до 5, причем 0 обозначает отсутствие нежелательных явлений, 1 означает легкие, 2 означает умеренные, 3 означает тяжелые и нежелательные, 4 означает угрожающие жизни или вызывающие инвалидность, и 5 означает смерть. Таким образом, побочные эффекты и/или токсичности могут включать события, подобные легким или умеренным головным болям, слабости, боли в мышцах и небольшим расстройствам нервной системы, таким как обонятельная аура, но токсичности высокой степени будут исключены.
Стероиды, подобные дексаметазону, обычно используются в клиническом контроле глиом для предупреждения неврологических побочных эффектов, подобных отеку мозга. Раскрытые способы лечения могут уменьшать потребность в таких вспомогательных видах лечения. Например, при получении пациентом схемы стероидов (например, дексаметазона) до лечения согласно раскрытым способам, у данного пациента может быть возможным снижение дозы стероидной схемы или полное прерывание стероидной схемы без испытания клинически вредных эффектов.
В метастазах рака молочной железы в мозге может экспрессироваться HER2. Некоторые из CAR, описанных в данном документе, которые являются полезными в лечении злокачественной глиомы, нацелены на HER2.
CAR, описанные в данном документе, могут быть получены любыми способами, известными в данной области, хотя предпочтительно их получают с использованием методик генной инженерии. Нуклеиновые кислоты, кодирующие несколько областей химерного рецептора, могут быть получены и собраны в полную кодирующую последовательность посредством стандартных методик молекулярного клонирования, известных в данной области (скрининг геномной библиотеки, полимеразная цепная реакция (ПЦР), лигирование с помощью праймеров, сайт-направленный мутагенез и т.д.), в зависимости от того, что является удобным. Образующуюся кодирующую область предпочтительно вставляют в экспрессионный вектор и используют для трансформации подходящей экспрессионной линии клеток-хозяев, предпочтительно линии клеток Т-лимфоцитов и наиболее предпочтительно линии клеток аутологичных Т-лимфоцитов.
Разные поднаборы Т-клеток, выделенные у пациента, включающие поднаборы не подвергавшихся селекции РВМС (от англ. «peripheral mononuclear blood cell» - «одноядерные клетки периферической крови») или обогащенных Т-клеток CD3, или обогащенных CD3, или Т-клеток памяти, можно трансдуцировать вектором для экспрессии CAR. Центральные Т-клетки памяти представляют собой один полезный поднабор Т-клеток. Центральная Т-клетка памяти может быть выделена из одноядерных клеток периферической крови (РВМС) посредством отбора на клетки CD45RO+/CD62L+ с использованием, например, прибора CliniMACS® для иммуномагнитной селекции клеток, экспрессирующих желательные рецепторы. Клетки, обогащенные центральными Т-клетками памяти, можно активировать антителами против CD3/CD28, трансдуцировать, например, лентивирусным вектором SIN, который управляет экспрессией CAR, а также усеченного человеческого CD19 (CD19t) - неиммуногенного поверхностного маркера как для выявления in vivo, так и для потенциальной селекции ex vivo. Активированные/генетически модифицированные центральные Т-клетки памяти можно размножать in vitro с использованием IL-2/IL-15 и затем криоконсервировать.
Пример 1: конструирование и структура IL13α2-специФичного CAR
Структура полезного IL13Rα2-специхического CAR описывается ниже. Последовательность CAR с оптимизированными кодонами содержит связанный с мембраной лиганд IL-13, мутировавший в одном сайте (E13Y) для уменьшения потенциального связывания с IL13Rα1, спейсер на основе Fc IgG4, содержащий две мутации (L235; N297Q), которые значительно уменьшают опосредованное рецептором Fc распознавание, трансмембранный домен CD4, костимулирующий цитоплазматический домен сигнализации 4-1ВВ и цитоплазматический домен сигнализации CD3ζ. Последовательность перескакивания рибосомы Т2А отделяет эту последовательность CAR IL13(EQ)BBζ от CD19t - инертного неиммуногенного маркера клеточной поверхности для выявления/селекции. Данная связь на основе Т2А приводит к координированной экспрессии и IL13(EQ)BBζ, и CD19t от одного транскрипта. Фиг. 1А представляет собой схематический рисунок открытой рамки считывания из 2670 нуклеотидов, кодирующей конструкцию IL13(EQ)BBZ-T2ACD19t. На данном рисунке показаны все: IL13Pα2-специфичный лиганд - IL13(E13Y), Fc IgG4(EQ), трансмембранный домен CD4, цитоплазматический домен сигнализации 4-1ВВ, трехглициновый линкер и цитоплазматический домен сигнализации CD3ζ CAR IL13(EQ)BBZ, а также последовательность перескакивания рибосомы Т2А и последовательность усеченного CD19. Также показаны последовательность человеческого рецептора GM-CSF альфа и сигнальная последовательность CD19, которые управляют поверхностной экспрессией CAR IL13(EQ)BBZ и CD19t. Таким образом, конструкция IL13(EQ)BBZ-T2ACD19t включает последовательность IL13Rα2-специфичного химерного иммунорецептора с оптимизированным шарниром и костимулирующим доменом (обозначенного IL13(EQ)BBZ), последовательность перескакивания рибосомы Т2А и последовательность CD19t.
Последовательность IL13(EQ)BBZ получали слиянием последовательностей лидерного пептида человеческого рецептора альфа GM-CSF, лиганда - IL13(E13Y), L235E/1V297Q-модифицированной шарнирной области Fc IgG4 (где данная двойная мутация препятствует распознаванию FcR), трансмембранного CD4, цитоплазматического домена сигнализации 4-1ВВ и цитоплазматического домена сигнализации CD3ζ. Данную последовательность синтезировали de novo после оптимизации кодонов. Последовательность Т2А получали в результате расщепления плазмиды, содержащей Т2А. Последовательность CD19t получали из последовательности, охватывающей последовательность лидерного пептида с трансмембранными компонентами (т.е. пары оснований 1-972) плазмиды, содержащей CD19. Все три фрагмента: 1) IL13(EQ)BBZ, 2) Т2А и 3) CD19t клонировали в сайт множественного клонирования лентивирусного вектора epHIV7. При трансфекции в подходящие клетки данный вектор интегрирует последовательность, схематически показанную на Фиг. 1Б, в геном клетки-хозяина. На Фиг. 1В приведен схематический рисунок 9515 пар оснований самой плазмиды IL13(EQ)BBZ-T2A-CD19t_epHIV7.
Как схематически показано на Фиг. 2, CAR IL13(EQ)BBZ в нескольких важных отношениях отличается от ранее описанного CAR, специфичного в отношении IL13Rα2, именуемого IL13(E13Y)-зетакин (Brown et al. 2012 Clinical Cancer Research 18:2199). IL13(E13Y)-зетакин состоит из следующих частей: IL13Ra2-специфичный мутеин человеческого IL-13 (huIL-13(E13Y)), спейсер на основе Fc человеческого IgG4 (huγ4Fc), человеческий трансмембранный CD4 (huCD4 tm) и человеческая цитоплазматическая цепь CD3ζ (huCD3ζ cyt), как показано. В отличие от этого, IL13(EQ)BBζ имеет две точечные мутации - L235E и N297Q - которые располагаются в домене СН2 спейсера на основе IgG4, и костимулирующий цитоплазматический домен 4-1ВВ (4-1ВВ cyt).
Пример 2: конструирование и структура epHIV7, используемого для экспрессии IL13Rα2-специфического CAR
Плазмида pHIV7 представляет собой родительскую плазмиду, из которой был получен клинический вектор IL13(EQ)BBZ-T2A-CD19t_epHIV7 в исследовательской лаборатории терапевтических средств на основе Т-клеток (TCTRL - от англ. Т cell Therapeutics Research Laboratory) в City of Hope (СОН). Вектор epHIV7, используемый для экспрессии CAR, получали из вектора pHIV7. Важно то, что в данном векторе для управления экспрессией CAR используется человеческий промотор EF1. И 5'-, и 3'-последовательности данного вектора получали из pv653RSN, который был ранее получен из провируса НХВс2. Вытесняемые последовательности полипуринового тракта ДНК (сРРТ) получали из штамма pNL4-3 HIV-I (от англ. human immunodeficiency virus I - вирус иммунодефицита человека-I) из репозитория реактивов NIH AIDS (от англ. National Institute of Health for AIDS - Национальный институт здравоохранения по СПИД). Последовательность посттранскрипционного регуляторного элемента лесного сурка (WPRE - от англ. woodchuck post-transcriptional regulatory element) была описана ранее.
Конструирование pHIV7 схематически показано на Фиг. 3. Вкратце, pv653RSN, содержащую 653 п. о. из gag-pol плюс 5'- и 3'-длинные концевые повторы (LTR - от англ. long-terminal repeat) с расположенным между ними геном SL3-неомицинфосфотрансферазы (Neo), субклонировали в pBluescript следующим образом: на стадии 1 из последовательностей от 5' LTR до элемента, отвечающего на rev (RRE - от англ. rev-responsive element), делали p5'HIV-1 51, и затем 5' LTR модифицировали посредством удаления последовательностей выше TATA бокса и лигировали сначала с энхансером CMV (от англ. Cytomegalovirus - цитомегаловирус) и затем с репликатором SV40 (p5'HIV-2). На стадии 2 после клонирования 3'LTR в pBluescript с получением p3'HIV-1 делали делецию 400 п. о. в 3'LTR энхансере/промоторе для удаления цис-регуляторных элементов в U3 HIV и образования p3'HIV-2. На стадии 3 фрагменты, выделенные из p5'HIV-3 и p3'HIV-2, лигировали с получением pHIV-3. На стадии 4 p3'HIV-2 дополнительно модифицировали посредством удаления дополнительных расположенных выше последовательностей HIV с получением p3'HIV-3, и фрагмент из 600 п.о. BamHI-Sall, содержащий WPRE, добавляли к p3'HIV-3 с получением p3'HIV-4. На стадии 5 уменьшали размер RRE pHIV-3 посредством ПЦР и лигировали с 5' фрагментом из pHIV-3 (не показан) и с p3'HIV-4 с получением pHIV-6. На Стадии 6 фрагмент BgIII-BamHI из 190 п. о., содержащий вытесняемую последовательность ДНК сРРТ из pNL4-3 (55) HIV-1, амплифицировали из pNL4-3 и помещали между последовательностями RRE и WPRE в pHIV6 с получением pHIV-7. Данную родительскую плазмиду - pHIV7-GFP (GFP - от англ. Green Fluorescent Protein -зеленый флуоресцентный белок) использовали для упаковки родительского вектора с использованием четырехплазмидной системы.
Упаковочный сигнал - пси (ψ) - требуется для эффективной упаковки вирусного генома в вектор. RRE и WPRE усиливают транспорт РНК-транскрипта и экспрессию трансгена. Было продемонстрировано то, что вытесняемая последовательность в комбинации с WPRE усиливает эффективность трансдукции лентивирусного вектора в клетках млекопитающих.
Хелперные функции, требующиеся для продукции вирусного вектора, разделяются на три отдельные плазмиды для уменьшения вероятности образования компетентного к репликации лентивируса посредством рекомбинации: 1) pCgp кодирует белок gag/pol, требующийся для сборки вирусного вектора; 2) pCMV-Rev2 кодирует белок Rev, который действует на последовательность RRE для помощи в транспортировке вирусного генома для эффективной упаковки; и 3) pCMV-G кодирует гликопротеин вируса вези кул остоматита (VSV - от англ. vesicular stomatitis virus), который требуется для инфективности вирусного вектора.
Имеется минимальная гомология последовательности ДНК между геномом вектора, кодируемого pHIV7, и хелперными плазмидами. Области гомологии включают область упаковочного сигнала из приблизительно 600 нуклеотидов, расположенную в последовательности gag/pol хелперной плазмиды рСдр; последовательность промотора CMV во всех трех хелперных плазмидах и последовательность RRE в хелперной плазмиде pCgp. Весьма маловероятно то, что из-за гомологии в данных областях мог бы быть генерирован компетентный к репликации рекомбинантный вирус, так как это потребовало бы многочисленных событий рекомбинации. Кроме того, у любых образующихся рекомбинантов отсутствовали бы функциональные последовательности LTR и tat, требующиеся для лентивирусной репликации.
Промотор CMV заменяли промотором EF1α-HTLV (EF1p), и новая плазмида была названа epHIV7 (Фиг. 4). EF1p имеет 563 п.о. и его вводили в epHIV7 с использованием NruI и NheI, затем промотор CMV вырезали.
Из данной системы удаляли лентивирусный геном, исключая gag/pol и rev, которые необходимы для патогенности вируса дикого типа и требуются для продуктивной инфекции клеток-мишеней. Кроме того, конструкция вектора IL13(EQ)BBZ-T2A-CD19t_epHIV7 не содержит интактного промотора 3'LTR, таким образом, полученная в результате экспрессируемая и обратно транскрибированная ДНК провирусного генома в клетках-мишенях будет иметь неактивные LTR. В результате данной конструкции последовательности, происходящие из HIV-1, не будут транскрибироваться из провируса, и только терапевтические последовательности будут экспрессироваться от соответствующих им промоторов. Ожидается то, что удаление промоторной активности LTR в векторе SIN значительно уменьшает возможность непреднамеренной активации генов хозяина. В Таблице 4 обобщены разные регуляторные элементы, присутствующие в IL13(EQ)BBZ-T2A-CD19t_epHIV7.

Пример 3: получение векторов для трансдукции Т-клеток пациента
Для каждой плазмиды (IL13(EQ)BBZ-T2A-CD19t_epHIV7; pCgp; pCMV-G и pCMV-Rev2) получают семенной банк, который используется для инокуляции ферментера с получением достаточных количеств плазмидной ДНК. Данную плазмидную ДНК тестируют на идентичность, стерильность и присутствие эндотоксина перед ее применением в производстве лентивирусного вектора.
Вкратце, клетки размножали от рабочей клетки 293Т (WCB - от англ. Working Cell Bank), которая была протестирована для подтверждения стерильности и отсутствия вирусного загрязнения. Сосуд с клетками 293Т от WCB 293Т оттаивали. Клетки выращивали и размножали до наличия достаточного числа клеток для посева в подходящее число 10-слойных клеточных фабрик (CF - от англ. cell factory) для продукции вектора и поддержания линии клеток. Для продукции можно использовать одну линию клеток.
Лентивирусный вектор продуцировали в подпартиях из вплоть до 10 CF. Две подпартии можно продуцировать в ту же самую неделю, приводя к продукции приблизительно 20 л лентивирусного супернатанта/неделю. Материал, продуцированный из всех подпартии, объединяли на протяжении последующей фазы переработки для того, чтобы произвести одну партию продукта. Клетки 293Т высевали в CF в среду 293Т (DMEM (от англ. «Dulbecco modified Eagle's medium» -«среда Игла, модифицированная по Дульбекко») с 10% FBS (от англ. «fetal bovine serum» - «фетальная телячья сыворотка»)). Фабрики помещали в инкубатор при 37°С и горизонтально выравнивали для получения равномерного распределения клеток на всех слоях CF. Через двое суток клетки трансфицировали четырьмя лентивирусными плазмидами, описанными выше, с использованием способа с CaPO4, который включает смесь Tris:EDTA (от англ. «ethylenediaminetetraacetic acid» - «этилендиаминтетрауксусная кислота»), 2 М CaCl2, 2× HBS (от англ. «HEPES buffered saline» - «физиологический раствор, забуференный HEPES») и четырех ДНК плазмид. В сутки 3 после трансфекции супернатант, содержащий секретированные лентивирусные векторы, отбирали, очищали и концентрировали. После удаления супернатанта из CF из каждой CF отбирали клетки конца продуцирования. Клетки из каждой фабрики трипсинизировали и отбирали центрифугированием. Клетки ресуспендировали в среде для замораживания и криоконсервировали. Данные клетки позднее использовали для тестирования на лентивирус, компетентный в отношении репликации (RCL, от англ. «replication-competent lentivirus»).
Для очистки и приготовления векторов в виде препарата неочищенный супернатант осветляли мембранной фильтрацией для удаления клеточных обломков. ДНК клетки-хозяина и остаточную плазмидную ДНК деградировали посредством расщепления эндонуклеазой (Benzonase®). Вирусный супернатант осветляли от клеточных обломков с использованием 0,45 мкм фильтра. Осветленный супернатант отбирали в предварительно взвешенный контейнер, в который добавляют Benzonase((конечная концентрация 50 U/мл). Эндонуклеазное расщепление остаточной плазмидной ДНК и геномной ДНК хозяина проводили при 37°С в течение 6 ч. Для удаления остаточных низкомолекулярных компонентов из неочищенного супернатанта использовали исходное концентрирование супернатанта, обработанного эндонуклеазой, посредством ультрафильтрации с тангенциальным потоком (TFF - от англ. «tangential flow filtration»), концентрируя вирус примерно в 20 раз. Осуществляли циркуляцию осветленного, обработанного эндонуклеазой вирусного супернатанта через картридж с полыми волокнами с NMWCO (от англ. «nominal molecular weight cut off» - «номинальный порог отсечения молекулярной массы») 500 кДа при скорости потока, подобранной для поддержания скорости сдвига примерно 4000 с-1 или меньше при максимизации скорости потока. Во время процесса концентрирования запускают диафильтрацию супернатанта, обработанного нуклеазой, для поддержания эффективности картриджа. С использованием 4%-ной лактозы в PBS (от англ. «phosphate-buffered saline» -«фосфатно-солевой буферный раствор») в качестве диафильтрационного буфера устанавливали скорость замены пермеата 80%. Вирусный супернатант доводили до целевого объема, представляющего 20-кратное концентрирование неочищенного супернатанта, и диафильтрацию продолжали в течение 4 дополнительных смен объема со скоростью замены пермеата 100%.
Дальнейшее концентрирование вирусного продукта осуществляли с применением методики высокоскоростного центрифугирования. Каждую подпартию лентивируса осаждали с использованием центрифуги Sorvall RC-26 plus при 6000 об./мин (6088 RCF (от англ. «relative centrifugal force» - «относительная сила центрифугирования») при 6°С в течение 16-20 ч. Вирусный осадок из каждой подпартии затем растворяли в 50 мл объеме 4%-ной лактозой в PBS. Растворенный осадок в данном буфере представляет собой конечную композицию вирусного препарата. Весь процесс концентрирования вектора приводил приблизительно к 200-кратному уменьшению объема. После завершения получения всех подпартии материал затем помещали при -80°С, при тестировании образцов из каждой подпартии на стерильность. После подтверждения стерильности образца подпартии подвергали быстрому оттаиванию при 37°C с частым встряхиванием. Материал затем объединяли и вручную аликвотировали в боксе биологической безопасности Класса II Типа А/В3 в блоке для вирусного вектора. Использовали конфигурацию заполнения 1 мл концентрированного лентивируса в стерильных криососудах класса 6 USP (от англ. «United States Pharmacopoeia» - «Фармакопея США») с наружной резьбой и О-кольцом. Системы контроля качества (QS, от англ. «Quality System») Центра разработки прикладных технологий (CATD, от англ. «Center for Applied Technology Development») в СОН выпустили все материалы согласно политике и стандартным рабочим методикам для CBG и в соответствии с современными надлежащими производственными практиками (cGMP, от англ. «current Good Manufacturing Practice»).
Для обеспечения чистоты препарата лентивирусного вектора его тестировали на остаточные загрязнения ДНК хозяина и перенос остаточной ДНК хозяина и плазмид. Наряду с другими тестами идентичность вектора оценивали посредством полимеразной цепной реакции, сопряженной с обратной транскрипцией (ПЦР-ОТ), чтобы обеспечить присутствие правильного вектора. Для вектора, предназначенного для применения в данном исследовании, все критерии выпуска были удовлетворены.
Пример 4: получение Т-клеток. подходящих для применения в ACT
Т-лимфоциты получают от пациента посредством лейкафереза, и подходящий поднабор аллогенных или аутологичных Т-клеток, например, центральных Т-клеток памяти (Тсм) генетически изменяют для экспрессии CAR, затем вводят обратно пациенту посредством любых клинически приемлемых способов для достижения противораковой терапии.
Подходящие Тсм могут быть получены следующим образом. Продукты афереза, полученные от участников исследования, подписавших информированное согласие, разделяют на фиколе, промывают и инкубируют в течение ночи. Клетки затем обедняют в отношении популяций моноцитов, регуляторных Т-клеток и наивных Т-клеток с использованием реактивов против CD14, против CD25 и против CD45RA уровня качества GMP (Miltenyi Biotec) и прибора для разделения CliniMACS™. После обеднения негативную фракцию клеток обогащают в отношении клеток Тсм CD62L+с использованием DREG56-биотина (клинический уровень качества СОН) и микрошариков против биотина (Miltenyi Biotec) на приборе для разделения CliniMACS™.
После обогащения клетки Тсм готовят в полной X-Vivo15 плюс 50 IU (от англ. «international units» - «международные единицы»)/мл IL-2 и 0,5 нг/мл IL-15 и переносят в тефлоновый мешок для культуры клеток, где они стимулируются шариками Dynal ClinEx(Vivo CD3/CD28. Вплоть до пяти суток после стимуляции клетки трансдуцируют лентивирусным вектором IL13(EQ)BBZ-T2A-CD19t_epHIV7 при множественности заражения (MOI - от англ. multiplicity of infection) от 1,0 до 0,3. Культуры поддерживают в течение вплоть до 42 суток с добавлением полной X-Vivo15 и цитокинов IL-2 и IL-15, как требуется для размножения клеток (поддерживая плотность клеток от 3×105 до 2×106 жизнеспособных клеток/мл и осуществляя дополнение цитокинами каждый понедельник, среду и пятницу культивирования). При данных условиях клетки типично размножаются до приблизительно 109 клеток в пределах 21 суток. В конце периода культивирования клетки отбирают, дважды промывают и готовят в виде препарата в криоконсервирующей среде клинического уровня качества (Cryostore CS5, BioLife Solutions).
В день(дни) инфузии Т-клеток криоконсервированный и выпущенный продукт подвергают оттаиванию, промывают и готовят в виде препарата для повторной инфузии. Криоконсервированные сосуды, содержащие выпущенный клеточный продукт, удаляют из хранилища с жидким азотом, подвергают оттаиванию, охлаждают и промывают промывочным буфером на основе PBS/2% человеческого сывороточного альбумина (HSA, от англ. «human serum albumin»). После центрифугирования супернатант удаляют, и клетки ресуспендируют в инфузионном разбавителе на основе нормального физиологического раствора, не содержащего консервантов (PFNS, от англ. «Preservative-Free Normal Saline»)/2% HSA. Образцы удаляют для контроля качества.
С использованием производственной платформы, описанной выше, проводили два квалификационных цикла на клетках, добытых от здоровых доноров. Каждому продукту доклинического квалификационного цикла присваивали номер человеческого донора (HD, от англ. «human donor») - HD006.5 и HD187.1. Важно то, что, как показано в Таблице 5, эти квалификационные циклы обеспечивали размножение более чем в 80 раз в течение 28 суток, и размноженные клетки экспрессировали трансгены IL13(EQ)BBγ/CD19t.


Пример 5: анализ проточной цитометрией экспрессии поверхностного трансгена и маркера Т-клеток в Тещ IL13(EQ)BBγ/CD19t+
Два продукта доклинического квалификационного цикла, описанных в Примере 4, использовали в доклинических исследованиях, как описано ниже. На Фиг. 6А-В показаны результаты анализа проточной цитометрией экспрессии поверхностного трансгена и маркера Т-клеток. Тсм IL13(EQ)BBy/CD19t+ HD006.5 и HD187.1 совместно окрашивали антителом против IL13, конъюгированным с РЕ, и антителом против CD8, конъюгированным с FITC, для выявления клеток CD8+ CAR+ и CD4+ (т.е. CD4-негативных) CAR+ (Фиг. 6А), или антителом против CD19, конъюгированным с РЕ, и антителом против CD4, конъюгированным с FITC, для выявления клеток CD4+ CD19t+ и CD8+ (т.е. CD4-негативных) CAR+ (Фиг. 6Б). Тсм IL13(EQ)BBγ/CD19t+ HD006.5 и HD187.1 окрашивали конъюгированными с флуорохромом антителами против CD3, TCR, CD4, CD8, CD62L и CD28 (серые гистограммы) или изотипическими контролями (черные гистограммы) (Фиг. 6В). На каждой из Фиг. 6А-В процентные содержания указываются на основе жизнеспособных лимфоцитов (негативных в отношении DAPI), дающих окрашивание, превышающее окрашивание изотипического контроля.
Пример 6: сравнение пути доставки Т-клеток с CAR для лечения больших инициированных TS опухолей РВТ
Ниже описаны исследования, в которых сравнивается влияние пути доставки - внутривенного (в.в.) или внутричерепного (в.ч.) - на противоопухолевую активность против линий инвазивной первичной РВТ. В пилотных исследованиях (данные не показаны) неожиданно наблюдали то, что введенные в.в. Тсм IL13(EQ)BBζ+ не давали терапевтической пользы по сравнению с PBS для лечения против маленьких (сутки 5) опухолей РВТ030-2 EGFP:ffLuc. Это отличалось от надежной терапевтической эффективности, наблюдаемой с Т-клетками CAR+, введенными в.ч. Рассуждая о том, что в сутки 5 опухоли РВТ030-2 возможно были слишком маленькими для того, чтобы рекрутировать терапевтические Т-клетки с периферии, было сделано сравнение в.в. относительно в.ч. доставки против больших опухолей РВТ030-2 EGFP:ffLuc в сутки 19. Для этих исследований мышей с пересаженной РВТ030-2 обрабатывали либо двумя в.в. инфузиями (5×106 Тсм CAR+; сутки 19 и 26), либо четырьмя в.ч. инфузиями (1×106 Тсм CAR+; сутки 19, 22, 26 и 29) Тсм IL13(EQ)BBZ, либо имитирующими Тсм (без CAR). В данном случае также не было терапевтической пользы при отслеживании визуализацией Xenogen или посредством анализа выживаемости Каплана-Мейера для в.в. введенных Т-клеток CAR+ (Фиг. 7А и 7Б). В отличие от этого наблюдали мощную противоопухолевую активность для в.ч. введенных Тсм IL13(EQ)BBζ+ (Фиг. 7А-Б). Затем отбирали мозги у когорты мышей через 7 суток после инъекции Т-клеток и оценивали на человеческие Т-клетки CD3+ посредством IHC. Неожиданно для мышей, в.в. обработанных либо имитирующими Тсм, либо Тсм IL13(EQ)BBζ, не было выявляемых человеческих Т-клеток CD3+ в опухоли или в других областях мозга мыши, где типично находятся человеческие Т-клетки (т.е. мягкая и паутинная оболочки мозга) (Фиг. 7В), свидетельствуя о недостатке тропизма в опухоль. Это отличается от значительного числа Т-клеток, выявляемого у мышей с в.ч. обработкой (Фиг. 7Г).
Цитокины, происходящие из опухоли, в частности MCP-1/CCL2, являются важными в рекрутировании Т-клеток в опухоль. Таким образом, оценивали опухолевые клетки РВТ030-2, и было обнаружено то, что данная линия продуцирует высокие уровни MCP-1/CCL2, сравнимые с клетками U251T (данные не показаны) -глиомной линией, для которой ранее было показано то, что она привлекает в.в. введенные эффекторные Т-клетки CD8+ к в.ч. пересаженным опухолям. Злокачественные глиомы представляют собой высокоинвазивные опухоли, и часто являются многоочаговыми по проявлению. В описанных выше исследованиях установлено то, что Тсм IL13BBZ могут устранять инфильтрующие опухоли, такие как РВТ030-2, и опосредовать долговременную надежную противоопухолевую активность. Также оценивали способность доставленных интракраниально Т-клеток с CAR транспортироваться к многоочаговому заболеванию. Для данного исследования TS РВТ030-2 EGFP:ffLuc имплантировали как в левое, так и в правое полушарие (Фиг. 8А), а Т-клетки CAR+ инъецировали только в правый опухолевый участок. Обнадеживающим было то, что у всех оценивавшихся мышей (n равно 3) авторы изобретения выявляли Т-клетки посредством IHC на CD3 через 7 суток после инфузии Т-клеток как в месте инъекции (т.е. правая опухоль), так и в пределах опухоли на левом полушарии (Фиг. 8Б). Эти данные дают доказательство того, что Т-клетки CAR+ способны транспортироваться к и инфильтрировать очаги опухоли в удаленных участках. Аналогичные результаты также наблюдали во второй модели опухоли с использованием линии клеток глиомы U251T (данные не показаны).
Пример 7: аминокислотная последовательность IL13(EQ)BBζ/CD19t
Полная аминокислотная последовательность IL13(EQ)BBζ/CD19t показана на Фиг. 9. Полная последовательность (SEQ ID NO: 1) включает: 22-аминокислотный сигнальный пептид GMCSF (SEQ ID NO: 2), 112-аминокислотную последовательность IL-13 (SEQ ID NO: 3; аминокислотная замена E13Y показана жирным шрифтом); 229-аминокислотную последовательность IgG4 (SEQ ID NO: 4; с аминокислотными заменами L235E и N297Q, показанными жирным шрифтом); 22-аминокислотную трансмембранную последовательность CD4 (SEQ ID NO: 5); 42-аминокислотную последовательность 4-1ВВ (SEQ ID NO: 6); 3-аминокислотный Gly линкер; 112-аминокислотную последовательность CD3((SEQ ID NO: 7); 24-аминокислотную последовательность Т2А (SEQ ID NO: 8) и 323-аминокислотную последовательность CD19t (SEQ ID NO: 9).
Последовательность зрелого химерного рецептора антигена (SEQ ID NO: 10) включает: 112-аминокислотную последовательность IL-13 (SEQ ID NO: 3; аминокислотная замена E13Y показана жирным шрифтом); 229-аминокислотную последовательность IgG4 (SEQ ID NO: 4; с аминокислотными заменами L235E и N297Q, показанными жирным шрифтом); 22-аминокислотную последовательность CD4 (SEQ ID NO: 5); 42-аминокислотную последовательность 4-1ВВ (SEQ ID NO: 6); 3-аминокислотный Gly линкер; 112-аминокислотную последовательность CD3ζ (SEQ ID NO: 7). В пределах данной последовательности CAR (SEQ ID NO: 10) находится последовательность IL-13/IgG4/CD4t/4-1BB (SEQ ID NO: 11), которая включает: 112-аминокислотную последовательность IL-13 (SEQ ID NO: 3; аминокислотная замена E13Y показана жирным шрифтом); 229-аминокислотную последовательность IgG4 (SEQ ID NO: 4; с аминокислотными заменами L235E и N297Q, показанными жирным шрифтом); 22-аминокислотную последовательность CD4 (SEQ ID NO: 5) и 42-аминокислотную последовательность 4-1ВВ (SEQ ID NO: 6). Последовательность IL-13/IgG4/CD4t/4-1ВВ (SEQ ID NO: 11) может быть связана со 112-аминокислотной последовательностью CD3ζ (SEQ ID NO: 7) линкером, таким как Gly Gly Gly линкер. Последовательности CAR (SEQ ID NO: 10) может предшествовать 22-аминокислотный сигнальный пептид GMCSF (SEQ ID NO: 2).
На Фиг. 10 показано сравнение последовательностей IL13(EQ)41BB([IL13{EQ}41BBζ T2A-CD19t_epHIV7; pF02630] (SEQ ID NO: 12) и CD19Rop_epHIV7 (pJ01683) (SEQ ID NO: 13).
Пример 8: аминокислотная последовательность дополнительного CAR, нацеленного на IL13Rα2
На Фиг. 11-18 показаны аминокислотные последовательности дополнительного CAR, нацеленного на IL13Rα2. В каждом случае отмечены разные домены, за исключением GlyGlyGly спейсера, расположенного между определенными внутриклеточными доменами. Каждый включает человеческий IL13 с заменой Glu на Tyr (SEQ ID NO: 3; аминокислотная замена E13Y показана выделением). В экспрессионном векторе, используемом для экспрессии данных CAR, экспрессируемая аминокислотная последовательность может включать 24-аминокислотную последовательность Т2А (SEQ ID NO: 8) и 323-аминокислотную последовательность (SEQ ID NO: 9) для обеспечения координированной экспрессии последовательности усеченного CD19 на поверхности клеток, экспрессирующих CAR.
Набор CAR, содержащих домен в виде человеческого IL13(E13Y), домен CD28 tm, костимулирующий домен CD28gg, костимулирующий домен 4-1ВВ и домен CD3ζ, остова CAR и включающих либо спейсер HL (22 аминокислоты), спейсер на основе шарнира CD8 (48 аминокислот), спейсер на основе IgG4-HL-CH3 (129 аминокислот) или спейсер на основе IgG4(EQ) (229 аминокислот), тестировали на их способность опосредовать IL13Rα2-специфичное умерщвление при оценке в анализе не основе 72-часового сокультивирования. За исключением HL (22 аминокислоты), который, по-видимому, имел плохую экспрессию CAR в данной системе, все были активными.
Пример 9: структура двух HER2-специфических CAR
Один CAR, содержащий описанный в данном документе scFv против HER2, называется Her2scFv-IgG4(L235E, N297Q)-CD28tm-CD28gg-Дзета-T2A-CD19t. Данный CAR включает целый ряд важных элементов, включающих: scFv, нацеленный на HER2; область Fc IgG4, которая мутирована в двух сайтах в пределах области СН2 (L235E; N297Q) таким образом, который уменьшает связывание рецепторами Fc (FcR); трансмембранный домен CD28, костимулирующий домен CD28 и домен активации CD3ζ. На Фиг. 20 представлена аминокислотная последовательность данного CAR, включающая последовательность усеченного CD19, используемую для отслеживания экспрессии CAR, и последовательность перескакивания рибосомы Т2А, которая обеспечивает продукцию CAR без слияния с последовательностью усеченного CD19. Как показано на Фиг. 21, незрелый CAR включает: сигнальный пептид GMCSFR, scFv против HER2, IgG4, который действует в качестве спейсера, трансмембранный домен CD8, костимулирующий домен 4-1ВВ, который включает изменение последовательности от LL до GG, последовательность из трех Gly, стимулирующий домен CD3 дзета. Данный транскрипт также кодирует рибосомную последовательность Т2А и последовательность усеченного CD19, которые не являются частью последовательности белка CAR. Зрелый CAR является идентичным незрелому CAR, но у него отсутствует сигнальный пептид GMCSF.
Пример 10: экспрессия CAR, нацеленного на HER2
Фиг. 22А представляет собой схематическую диаграмму двух HER2-специфичных конструкций CAR, показанных на Фиг. 20 и Фиг. 21. В HER2(EQ)28ζ scFv связывается с мембраной модифицированным линкером на основе Fc IgG4 (двойной мутант, L235E; N297Q), и он содержит трансмембранный домен CD28, внутриклеточный костимулирующий домен CD28 и цитолитический домен CD3ζ. Последовательность перескакивания рибосомы Т2А отделяет CAR от усеченного белка CD19 (CD19t), используемого для отслеживания клеток. HER2(EQ)BBζ является аналогичным, за исключением того, что костимулирующим доменом является 4-1ВВ, а не CD28, и трансмембранный домен представляет собой трансмембранный домен CD8, а не трансмембранный домен CD28. Человеческие центральные Т-клетки памяти (Тсм) трансфицировали лентивирусным вектором, экспрессирующим либо HER2(EQ)28ζ, либо HER2(EQ)BBζ. На Фиг. 22Б показаны репрезентативные данные FACS (от англ. «fluorescence activated cell sorting» - «флуоресцентная сортировка клеток») фенотипа поверхности человеческих Тсм. На Фиг. 22В показаны результаты анализов на экспрессию CD19 и белка L в Тсм, трансфицированных лентивирусным вектором, экспрессирующим либо HER2(EQ)28ζ, либо HER2(EQ)BBζ. Как можно видеть из данных результатов, эффективность трансфекции, оцениваемая по экспрессии CD19, была аналогичной для обоих CAR. Однако экспрессия белка L была ниже для HER2(EQ)BBζ, чем для HER2(EQ)28ζ, свидетельствуя о том, что CAR HER2(EQ)BBζ является менее стабильным, чем HER2(EQ)BBζ. Анализ размножения клеток (Фиг. 22Г) показывает то, что ни один из CAR не препятствует размножению Т-клеток.
Пример 11: характеристика in vitro CAR, нацеленных на HER2
Для характеристики HER2(EQ)28ζ и HER2(EQ)BBζ использовали целый ряд линий клеток рака молочной железы, включающих HER2-негативные линии (лимфома LCL, MDA-MB-468, глиома U87), линии с низкой экспрессией HER2 (MDA-MB-361, 231BR) и линии с высокой экспрессией HER2 (SKBR3, ВТ474, ВВМ1). На Фиг. 23А показан уровень экспрессии HER2 каждой из этих линий. Для характеристики дегранулирования CD107a и продукции IFNγ использовали проточную цитометрию (сортирующую Т-клетки CAR+) на Т-клетках имитации (нетрансдуцированные), с CAR HER2(EQ)28ζ или HER2(EQ)BBζ после 5 ч сокультивирования либо с опухолевыми клетками MDA-MB-361 (с низкой экспрессией HER2), либо с опухолевыми клетками ВВМ1 (с высокой экспрессией HER2). Результаты данного анализа представлены на Фиг. 23Б. Аналогичные исследования проводили с другими линиями клеток рака молочной железы, и результаты обобщаются на Фиг. 23В. Продукцию IFNγ Т-клетками с CAR против HER2 после 24 ч культивирования с рекомбинантным белком HER2 или опухолями-мишенями измеряли ELISA (от англ. enzyme-linked immunosorbent assay - твердофазный иммуноферментный анализ), и результаты данного анализа показаны на Фиг. 23Г.
Пример 12: противоопухолевая активность in vitro CAR, нацеленного на HER2
Проточную цитометрию использовали для оценки умерщвления опухолевых клеток после 72 ч сокультивирования Т-клеток имитации (нетрансдуцированные), с CAR HER2(EQ)28ζ или HER2(EQ)BBζ с опухолями-мишенями. Результаты данного анализа представлены на Фиг. 24А. Измеряли индукцию PD-1 и LAG-3 в общем пуле Т-клеток с CAR после 72 ч сокультивирования с HER2-негативными клетками MDA-MB-468 или HER2-позитивными клетками ВВМ1, и результаты данного анализа представлены на Фиг. 24Б. Измеряли индукцию PD-1 в Т-клетках с CAR CD8+ после 72 ч сокультивирования с опухолями-мишенями, которые являются HER2-негативными (лимфома LCL, MDA-MB-468, глиома U87), с низкой экспрессией HER2 (MDA-MB-361, 231 BR) или с высокой экспрессией HER2 (SKBR3, ВТ474, ВВМ1), и результаты данного анализа представлены на Фиг. 24 В. Данные исследования свидетельствуют о том, что HER2(EQ)BBζ вызывает меньшую индукцию PD-1, чем HER2(EQ)28ζ. Измеряли умерщвление опухолевых клеток при отношении эффектор:опухоль (Е:Т), варьирующем от 0,25:1 до 2:1, и для Т-клеток с CAR HER2(EQ)28ζ или HER2(EQ)BBζ. Результаты данного анализа представлены на Фиг. 24Г, которая показывает то, что и HER2(EQ)28ζ, и HER2(EQ)BBζ являются эффективными в умерщвлении опухолевых клеток in vitro. Оцениваемую посредством CFSE (от англ. «carboxyfluorescein succinimidyl ester» «сукцинимидиловый эфир карбоксифлуоресцеина») пролиферацию Т-клеток с CAR против HER2 измеряли проточной цитометрией после 72 ч сокультивирования с клетками MDA-MB-468 или ВВМ1. Результаты данного анализа представлены на Фиг. 24Д, которая показывает то, что Т-клетки с CAR HER2(EQ)BBζ пролиферируют более активно, чем Т-клетки с CAR HER2(EQ)28ζ.
Пример 13: противоопухолевая активность in vivo CAR, нацеленного на HER2
Активность доставленных внутриопухолево Т-клеток с CAR против HER2 оценивали в полученной от пациента модели метастазов из молочной железы в мозг.Фиг.25А-26В представляют собой окрашивание опухолей Н&Е. Мышей обрабатывали инъекцией непосредственно в опухоль Т-клеток имитации (нетрансдуцированных) или с CAR HER2(EQ)BBζ. На Фиг. 25Г-25Е показаны результаты оптической визуализации опухолей, а на Фиг. 25Ж-25И - кривые выживаемости Каплана-Мейера для мышей, местно обработанных в сутки 3, либо 8, либо 14 после инъекции опухоли. Данные исследования показывают то, что Т-клетки с CAR HER2(EQ)BBζ имеют мощную противоопухолевую эффективность in vivo при инъецировании непосредственно в опухоль.
Для оценки противоопухолевой эффективности в моделях человеческих ксенотрансплантатов метастазов из молочной железы в мозг клетки ВВМ1 (0,2 М) или ВТ474 (0,15 М) вводили внутричерепной инъекцией мышам NSG. В сутки 8 после инъекции опухоли внутриопухолево инъецировали Т-клетки с HER2(EQ)28ζ или HER2(EQ)BBζ, или Т-клетки имитации (нетрансдуцированные) (1 М). Опухоли ВВМ1 (Фиг. 26А) и ВТ474 (Фиг. 26Б) отслеживали посредством оптической визуализации на основе люциферазы. Кривые Каплана-Мейера представлены на Фиг. 26В и Фиг. 26Г.
Для оценки Т-клеток с CAR HER2(EQ)28ζ и HER2(EQ)BBζ также использовали происходящую от пациента, являющегося человеком, ортотопическую модель ксенотрансплантата метастазов из молочной железы в мозг. На Фиг. 27А проиллюстрирована область имплантации опухоли посредством стереотаксической инъекции клеток ВВМ1 (0,2 М) и внутрижелудочковой доставки Т-клеток. Окрашивание опухолей показано на Фиг. 27Б. В сутки 14 после инъекции опухоли внутриопухолево инъецировали Т-клетки (0,5 М) с HER2(EQ)28ζ, HER2(EQ)BBζ или Т-клетки имитации (нетрансдуцированные). Рост опухоли отслеживали посредством оптической визуализации на основе люциферазы. На Фиг. 27В показаны средние значения потока для каждой группы обработки, и на Фиг. 27Г представлена кривая выживаемости Каплана-Мейера для каждой группы обработки.
Пример 14: сравнение внутричерепного и внутриопухолевого введения Тсм, экспрессирующих CAR, нацеленный на IL13Rα2
Два разных пути внутричерепной (в.ч.) доставки - внутриопухолевую (в.ч.о.) и внутрижелудочковую (в.ч.ж.) - оценивали в мышиной модели глиобластомы на безопасность in vivo, транспорт и эффективность Т-клеток с CAR, полученных из линий клеток, обогащенных Тсм, которые были трансдуцированы лентивирусным вектором IL13(EQ)BBZ-T2A-CD19t_epHIV7 и размножены in vitro, как предложено для клинического лечения глиобластомы (GBM). Безопасность in vivo и функциональную эффективность данных клеток, введенных либо в.ч.о., либо в.ч.ж., исследовали у иммунодефицитных мышей NSG с использованием IL13Rα2+ первичной сферической линии опухоли GBM с низким числом пассажей РВТ030-2, которая была генетически модифицирована для экспрессии репортерного гена люциферазы светляка (ffLuc).
Линии клеток Тсм, которые были обогащены из РВМС посредством селекции с использованием CliniMACS™/AutoMACS, лентитранедуцировали лентивирусом IL13(EQ)BBZ-T2A-CD19t_epHIV7, размножали и затем криоконсервировали с использованием способов, аналогичных способу, описанному выше. Свежеоттаявшие Т-клетки с CAR, введенные либо в.ч.о., либо в.ч.ж., затем оценивали на потенциальную токсичность, их способность к транспортировке во многоочаговые опухоли GBM и их эффективность в осуществлении контроля роста in vivo в.ч. пересаженной IL13Rα2+ линии клеток GBM РВТ030-2. Для оценки общей токсичности мышей ежесуточно осматривали на общее состояние здоровья, включая массу тела и концентрацию внимания. Проверяли опухолевую нагрузку, измеренную визуализацией Xenogen; и также осуществляли иммуногистохимию (IHC) для выявления рекрутирования/инфильтрации опухолей Т-клетками на поднаборе мышей.
Самцам мышей NSG (10-12-недельным) стереотаксически в.ч. инъецировали 1×105 клеток ffLuc+ РВТ030-2 как в правое, так и в левое противоположное полушарие в сутки 0 и давали приживаться в течение 6 суток. Мышей затем группировали на основе размера опухоли, определенного визуализацией Xenogen для равных распределений размера опухолей на группу. Группы мышей затем оставляли необработанными (n равно 4) или обрабатывали в.ч.о. (правое полушарие, n равно 8) или в.ч.ж. (n равно 8) 1×106 Тсм CAR+IL13(EQ)BBζ/CD19t+ (Фиг. 28). Рост опухоли РВТ030-2 отслеживали с течением времени посредством визуализации Xenogen и количественного измерения потока ffLuc (фотоны/с). В разные моменты времени мышей из каждой группы умерщвляли, их мозги отбирали, заливали в парафин и проводили иммуногистохимию (IHC) для оценки присутствия клеток, экспрессирующих человеческий CD3 (т.е. человеческих Т-клеток). В частности, из каждой группы, обработанной Т-клетками с CAR, умерщвляли трех мышей через одну неделю после введения Т-клеток (сутки 13 эксперимента), и, таким образом, данных мышей не включали в анализ визуализации Xenogen Фиг. 29; и затем двух мышей в каждой из групп мышей умерщвляли через две недели после введения Т-клеток (сутки 21 эксперимента).
В то время как это не было исследованием выживаемости, и, таким образом, всех мышей умерщвляли в конкретные моменты времени для оценки транспорта Т-клеток в мозги (описано ниже), данных мышей ежесуточно отслеживали на какие-либо очевидные признаки угнетения или общей токсичности. Мыши, обработанные одной из двух схем в.ч.о. или в.ч.ж., не демонстрировали какой-либо потери массы тела и были бодрыми, проворными и реагирующими на протяжении всего эксперимента. Таким образом, независимо от пути введения Т-клеток, не было признаков каких-либо неблагоприятных эффектов, ассоциированных с терапией.
Как показано на Фиг. 29А-В, в.ч.о. доставка Тсм IL13(EQ)BBζ/CD19t+, как и ожидалось, демонстрировала надежную противоопухолевую активность против опухолей РВТ030-2. Однако в.ч.ж. доставка Тсм IL13(EQ)BBζ/CD19t+, по-видимому, обеспечивала большую терапевтическую пользу против в.ч. пересаженных опухолей РВТ030-2, чем терапевтическая польза, наблюдаемая с использованием в.ч.о. доставки, особенно против опухолевого поражения в противоположном (левом) полушарии.
Для определения того, влиял ли путь введения на способность Т-клеток мигрировать к месту опухоли, проводили IHC анализ Т-клеток CD3+ на мозгах мышей из каждой группы в одну и две недели после введения Т-клеток. Как показано на Фиг. 30, человеческие Т-клетки CD3+ были обнаружены как в левом, так и в правом месте опухоли у мышей, которые получали Т-клетки, введенные либо в.ч.о. или в.ч.ж. Эти данные являются репрезентативными для 3 мышей в каждой группе в одну неделю и для 2 мышей в каждой группе в две недели после введения Т-клеток.
Это исследование демонстрирует то, что и внутриопухолевое, и внутрижелудочковое введение Т-клеток хорошо переносилось в данной модели мышей NSG. Кроме того, многоочаговая противоопухолевая эффективность in vivo и IHC выявление Т-клеток в местах опухолей могут наблюдаться при использовании и в.ч.о., и в.ч.ж. доставки Тсм клеток квалификационного цикла, которые были трансдуцированы вектором IL13(EQ)BBZ-T2A-CD19t_epHIV7. Данное исследование дополнительно свидетельствует о том, что Т-клетки, доставленные в.ч.ж., могут иметь большую эффективность, чем Т-клетки, доставленные в.ч.о.
Пример 15: клиническое испытание фазы I, оценивающее Т-клетки с CAR против IL-13Rα2 в отношении лечения глиобластомы
В данном примере описаны исходные данные клинического испытания, оценивающего безопасность, осуществимость и биоактивность еженедельных внутричерепных инфузии аутологичных Тсм IL13BBζ у пациентов с рецидивирующей IL13Rα2+ GBM. Как более подробно описано ниже, зарегистрированные пациенты подвергаются лейкаферезу для отбора аутологичных РВМС, и, одновременно с изготовлением IL13BBζ+ Тсм, осуществляют биопсию или резекцию опухоли с установкой резервуара/катетерного устройства. После исходной MP и ПЭТ визуализации и восстановления от хирургического вмешательства пациентов лечат по 4-недельной терапевтической схеме, состоящей из 3 еженедельных внутричерепных инфузии Тсм IL13BBζ+ с последующей одной неделей отдыха для оценки токсичности и заболевания. Полученные к настоящему времени результаты для этой первой когорты с низкой дозой из трех пациентов с резекцией свидетельствуют о том, что местная доставка Тсм IL13BBζ после хирургической резекции является безопасной и хорошо переносимой без токсичностей степени 3 или выше, приписываемых наблюдаемой терапии, и важно то, что они демонстрируют раннее доказательство противоопухолевой активности после введения Т-клеток с CAR. Для всех пациентов, у которых был доступен образец, Т-клетки с CAR были выявлены в жидкости опухолевой кисты или в спинномозговой жидкости (СМЖ) посредством проточной цитометрии в течение минимум 7 суток после лечения. Особый интерес представлял один пациент с выявленной рецидивирующей многоочаговой GBM, включающей один метастатический участок в спинном мозге и обширное заболевание мягкой и паутинной оболочек. Данного пациента исходно лечили согласно протоколу шестью местными инфузиями Тсм IL13BBζ в резекционную полость наибольшего метастатического очага опухоли в задней височно-затылочной области. Обнадеживающим было то, что данное место инъекции Т-клеток с CAR оставалось стабильным без доказательства рецидива заболевания в течение 7 недель, тогда как другие очаги заболевания, удаленные от места инъекции Т-клеток с CAR, продолжали прогрессировать. Данного пациента затем лечили по протоколу сочувственного применения пятью еженедельными внутрижелудочковыми инфузиями Тсм IL13BBζ без каких-либо других терапевтических вмешательств. Через одну неделю после последней внутрижелудочковой инфузии Т-клеток с CAR все внутричерепные и спинномозговые опухоли регрессировали с наибольшим уменьшением более чем 75% по объему, и данный пациент оставался клинически стабильным в течение четырех месяцев после начала лечения Т-клетками с CAR.
CAR IL13(EQ)BBζ, использованный в данном исследовании, описывается выше. Последовательность незрелого CAR, включающая маркер - CD19t - показана на Фиг. 9. Полная незрелая последовательность (SEQ ID NO: 1) включает: 22-аминокислотный сигнальный пептид GMCSF (SEQ ID NO: 2), 112-аминокислотную последовательность IL-13 (SEQ ID NO: 3; аминокислотная замена E13Y показана жирным шрифтом); 229-аминокислотную последовательность IgG4 (SEQ ID NO: 4; с аминокислотными заменами L235E и N297Q, показанными жирным шрифтом); 22-аминокислотную трансмембранную последовательность CD4 (SEQ ID NO: 5); 42-аминокислотную последовательность 4-1ВВ (SEQ ID NO: 6); 3-аминокислотный Gly линкер; 112-аминокислотную последовательность CD3ζ (SEQ ID NO: 7); 24-аминокислотную последовательность Т2А (SEQ ID NO: 8) и 323-аминокислотную последовательность CD19t (SEQ ID NO: 9).
Аутологичные клетки от каждого пациента использовали для получения клеток Тсм CD8+ CD4+, которые затем трансфицировали лентивирусным вектором, описанным выше, экспрессирующим IL13(EQ)BBζ. Вкратце, Тем обогащали из одноядерных клеток периферической крови (РВМС) с использованием устройства CliniMACS® для иммуномагнитного отбора Тсм CD45RO+/CD62L+. Данные клетки активировали шариками Dynal против CD3/CD28, транедуцировали лентивирусным вектором SIN, который управляет экспрессией CAR IL13(EQ)BBζ. Активированные/генетически модифицированные клетки Тсм IL13(EQ)BBζ/CD19t+ размножали in vitro с использованием IL-2/IL-15 и затем криоконсервировали.
Лечение двух пациентов, которые оба страдали от возвратной/рецидивной GBM, описывается ниже. Внутриполостное введение Т-клеток с CAR проводили вручную в течение примерно 5-10 минут через катетер Рикхэма с последующей промывкой вплоть до 1,0 мл нормального физиологического раствора, не содержащего консервантов (PFNS), доставленного посредством конвекционной усиленной доставки (CED, от англ. «convection enhanced delivery») со скоростью 0,5 мл/ч. Внутрижелудочковое введение Т-клеток с CAR проводили вручную в течение приблизительно 5-10 минут через катетер Рикхэма, помещенный в боковой желудочек. После этого следовала промывка вплоть до 0,5 мл нормального физиологического раствора, не содержащего консервантов (PFNS), доставленного посредством методики выталкивания вручную в течение 5-10 минут.Промывка PFNS подразумевает очистку линии введения и выталкивание остающихся Т-клеток с CAR через катетер.
Ход получения и лечения Т-клетками с CAR показан на Фиг. 31. Одновременно с процессом изготовления участники исследования были подвергнуты резекции их опухоли(ей) с последующим размещением катетера Рикхэма и исходной визуализацией.
Пациент UPN097 был подвергнут резекции опухоли и лечению в цикле 1 с использованием 2×106 клеток и в цикле 2 с использованием 10×106 клеток. И в цикле 1, и в цикле 2 клетки вводили в полость, оставленную резекцией. После второго цикла пациент UPN097 был выведен из исследования из-за быстрого прогрессирования опухоли.
Пациента UPN109 лечили в цикле 1 с использованием 2×106 клеток и в циклах 2 и 3 с использованием 10×106 клеток. После периода отдыха пациента UPN109 лечили в циклах 4, 5 и 6 10×106 клеток. В циклах 1-6 клетки вводили внутрь опухоли. В цикле 7 пациента лечили 2×106 клеток. В циклах 8 и 9 пациента лечили 10×106 клеток. В циклах 7-10 введение было внутрижелудочковым.
На Фиг. 32А представлен анализ выживания Т-клеток с CAR при отслеживании посредством CD19. Данный анализ показывает хорошее выживание Т-клеток через 8 суток после цикла 2. На Фиг. 32Б показано уменьшенное присутствие клеток GBM при отслеживании по экспрессии IL13Rα2 на клетках.
На Фиг. 33А и Фиг. 33Б показаны результаты визуализации от пациента UPN097 в области катетера, используемой для внутриопухолевого введения. На Фиг. 33А можно видеть то, что до лечения присутствует мало Т-клеток CD3+ или CD8+. Фиг. 33Б, которая представляет собой образец, отобранный из стенки левой фронтальной полости опухоли в сутки 16 после обработки, показывает большую площадь некротической опухоли и значительное присутствие клеток CD3+ и CD8+.
Как показано на Фиг. 34А-Г, на протяжении двух циклов лечения происходило увеличение уровня IFN-гамма (цитокин Th1), тогда как уровни IL-13 (цитокин Th2) значимо не изменялись (Фиг. 34А и Фиг. 34Б). Уровень IL-6 -цитокина, связанного с опухолью - уменьшался на протяжении цикла 1 и оставался на более низком уровне на протяжении цикла 2 (Фиг. 34В). Уровень IL-8 - другого цитокина, связанного с опухолью - уменьшался на протяжении цикла 1, но возрастал к его уровню до цикла 1 на протяжении цикла 2 (Фиг. 34Г).
Пациент UPN109 демонстрировал рецидивирующую многоочаговую GBM, включающую один метастатический участок в спинном мозге и обширное заболевание мягкой и паутинной оболочки. Как описано выше, данного пациента лечили шестью местными инфузиями Тсм IL13BBζ в резекционную полость наибольшего рецидивного очага опухоли. В то время как место инъекции Т-клеток с CAR оставалось стабильным без доказательства рецидива заболевания в течение более 7 недель, другие очаги заболевания, удаленные от места инъекции Т-клеток с CAR, продолжали прогрессировать (данные не показаны). Данный пациент затем получил пять еженедельных внутрижелудочковых инфузий Тсм IL13BBζ, как описано выше. На Фиг. 35А-Б представлены изображения МРТ и/или ПЭТ поперечного среза мозга (Фиг. 35A) и сагиттального среза мозга (Фиг. 35Б). На Фиг. 35В представлены поперечный (наверху) и фронтальный (внизу) срезы спинного мозга до (слева) и через одну неделю после (справа) завершения внутрижелудочковой терапии с местами опухолевого поражения, указанными на каждом изображении красными стрелками.
Пример 16: описание случая по внутрижелудочковому введению
У 50-летнего мужчины исходно была диагностирована опухоль мозга низкой степени злокачественности в правой височной доле после проявления больших эпилептических припадков. После четырех месяцев отслеживания эта правая височная опухоль демонстрировала повышенное увеличение при выявлении МРТ, и данный пациент был подвергнут резекции опухоли, которая подтвердила диагноз глиомы (GBM) IV степени злокачественности по шкале Всемирной организации здравоохранения (ВОЗ). Данный пациент затем получал соответствующую стандарту лечения вспомогательную протонную лучевую терапию до общей дозы 59,4 кобальтовых грей-эквивалентов с сопутствующим введением темозоломида (140 мг ежесуточно) с последующими 4 циклами темозоломида с сопутствующим применением прибора Novocure (NovoTTF-100А) в течение трех месяцев. Через шесть месяцев после резекции первичной опухоли изображения ПЭТ и МРТ демонстрировали доказательство прогрессирования заболевания.
Данного пациента затем лечили аутологичными Т-клетками с CAR, нацеленными на IL13Rα2 (Фиг. 36), после подтверждения экспрессии IL13Ra2 в первичной опухоли правой височной доли посредством IHC с баллом Н 100 (Фиг. 37). Затем отбирали одноядерные клетки периферической крови (РВМС) посредством лейкафереза с последующим обогащением Тсм CD4+ CD8+ посредством двухэтапной методики селекции на основе обеднения, как описано ранее. Во время изготовления Тсм IL13BBζ пациента лечили по отдельному клиническому протоколу, оценивающему ингибитор фактора роста фибробластов (NCT01975701), и у него по ходу терапии происходило прогрессирование заболевания с усиливающимися симптомами головных болей, спутанности сознания и дезориентации. Кроме того, у данного пациента была уменьшена доза стероидов до инъекций Т-клеток.
Через десять месяцев после резекции первичной опухоли данный пациент был подвергнут другой хирургической резекции в отношении трех из пяти идентифицированных прогрессирующих поражений GBM (Фиг. 38), включая наибольшее поражение в правой задней височно-затылочной области (Т1), куда был установлен резервуар/катетерное устройство, и два поражения в правой лобной доле (Т2, Т3). Две дополнительные опухоли в левой височной области не были хирургически удалены (Т4, Т5). Через шесть суток после хирургической резекции пациент получал две 4-недельные схемы лечения, причем каждая состояла из трех еженедельных внутриполостных (в.п.) инфузии Тсм IL13BBζ с последующей одной неделей для оценки токсичности и оценки заболевания. Данного пациента лечили, начиная с низкой дозы 2×106 Т-клеток CAR+, с последующими пятью инфузиями 10×106 Т-клеток CAR+ (Фиг. 39). После этих шести в.п. инфузии по протоколу сочувственного применения в правый боковой желудочек помещали второй катетер, позволяя пациенту получить пять дополнительных циклов внутрижелудочкового (в.ж.) лечения Тсм IL13BBζ, вновь начиная при низкой дозе 2×106 Т-клеток с CAR, с последующими четырьмя инфузиями 10×106 Т-клеток с CAR (Фиг. 40).
Из-за ограниченного количества терапевтического продукта были возможными только пять циклов в.ж. инфузии. В целом, данный пациент получил 11 инфузии клеток с общей дозой 94×106 Т-клеток CAR+. Курс лечения охватывал 15 недель с неделями оценки на токсичность и анализ заболевания (т.е. МРТ и ПЭТ визуализация), происходящими после каждого третьего цикла и после конечных двух в.ж. инфузии. На протяжении этого курса лечения Т-клетками с CAR пациент не получал других терапевтических вмешательств, и в данном документе приводятся данные вплоть до 190-суточного периода оценки, охватывающие 11 циклов инфузии. Затем изготовляли второй продукт - Тсм IL13BBζ, и, начиная с суток 192, данный пациент продолжал получать в.ж. инфузии данного второго изготовленного продукта приблизительно каждые 3 недели.
Пример 17: схема исследования
Данные исследования, включая протокол сочувственного применения, были одобрены экспертным советом организации, и пациент предоставил письменное информированное согласие. Пригодность включала предшествующий гистологически подтвержденный диагноз IL13Rα2+ глиомы IV степени злокачественности, которая теперь является рецидивирующей, возраст больше 18 лет с оценкой общего состояния по шкале Карновского (KPS, - от англ. «Karnofsky performance status») больше 60, адекватную сердечно-легочную функцию и ожидаемое время жизни больше 4 недель. Данный пациент должен был завершить исходную лучевую терапию по меньшей мере за 12 недель до регистрации и не должен был иметь каких-либо других активных злокачественных опухолей, инфекций или интеркуррентных заболеваний, или получать другие исследовательские агенты, или требовать больше, чем 2 мг TID (3 раза в сутки) дексаметазона на протяжении Т-клеточной терапии.
Данного пациента исходно лечили согласно продолжающемуся исследованию фазы I авторов изобретения (NCT02208362) для оценки безопасности и осуществимости еженедельных внутричерепных инфузии аутологичных Т-клеток с CAR, нацеленным на IL13Rα2 (Тсм IL13BBζ), у пациентов с диагнозом возвратной/рецидивирующей IL13Rα2+ глиомы высокой степени злокачественности (степени злокачественности III и IV ВОЗ). Это сравнительное исследование с Т-клетками, вводимыми либо непосредственно в опухоль (группа 1 - внутриопухолевое), либо в полость резекции опухоли (группа 2 -внутриполостное). После завершения шести циклов внутриполостной инфузии (в.п.) данного пациента затем лечили согласно отдельному протоколу сочувственного применения, допускающему внутрижелудочковую (в.ж.) доставку Тсм IL13BBζ.
Пример 18: изготовление и инфузия клеточного продукта
В данном документе подробно описан лентивирусный вектор, кодирующий 4-1ВВ костимулирующий CAR, нацеленный на IL13Rα2 - IL13BBζ. Вкратце, последовательность CAR с оптимизированными кодонами содержит связанный с мембраной лиганд - человеческий IL-13, мутированный в одном сайте (E13Y) для уменьшения потенциального связывания с IL13Rα1, спейсер на основе Fc человеческого IgG4, содержащий две мутации (L235E; N297Q), которые предупреждают опосредованное рецептором Fc распознавание, человеческий трансмембранный домен CD4, человеческий костимулирующий цитоплазматический домен сигнализации 4-1ВВ и человеческий цитоплазматический домен сигнализации CD3ζ. Последовательность перескакивания рибосомы - Т2А затем отделяет данную последовательность CAR IL13BBζ от последовательности усеченного человеческого CD19 (CD19t) - инертного неиммуногенного маркера поверхности клетки.
Для изготовления Тсм IL13BBζ в сутки лейкафереза РВМС выделяли посредством центрифугирования в градиенте плотности через Ficoll-Paque (GE Healthcare) с последующими двумя промывками в PBS/EDTA. РВМС затем один раз промывали в PBS, ресуспендировали в среде X Vivo 15 (Bio Whittaker), содержащей 10% фетальной телячьей сыворотки (FCS - от англ. «fetal calf serum») (Hyclone), переносили в 300 см3 мешок для переноса и хранили на 3-мерном вращающем устройстве при комнатной температуре (RT). На следующие сутки 5×109 РВМС инкубировали в 300 см3 мешке для переноса с микрошариками клинического уровня качества против CD14 (1,25 мл), против CD25 (2,5 мл) и против CD45RA (2,5 мл) (Miltenyi Biotec) в течение 30 минут при RT в X Vivo15, содержащей 10% FCS. Затем немедленно осуществляли обеднение клетками CD14+, CD25+ и CD45RA+ с использованием режима обеднения CliniMACS™ согласно инструкциям изготовителя (Miltenyi Biotec). После центрифугирования немеченую негативную фракцию клеток ресуспендировали в буфере PBS/EDTA CliniMACS™ (Miltenyi Biotec), содержащем 0,5% человеческого сывороточного альбумина (HSA) (CSL Behring), и затем метили биотинилированным-DREG56 mAb (моноклональное антитело) клинического уровня качества (COHNMC CBG) в объеме 0,6 мл в течение 30 минут при RT. Клетки затем промывали и ресуспендировали в конечном объеме 100 мл PBS/EDTA CliniMACS™, содержащем 0,5% HSA, и переносили в новый 300 см3 мешок для переноса. После 30 минут инкубации с 1,25 мл микрошариков против биотина (Miltenyi Biotec), фракцию CD62L+ (Тсм) очищали с использованием позитивной селекции на CliniMACS™ согласно инструкциям изготовителя и ресуспендировали в X Vivo15, содержащей 10% FCS.
В пределах 2 часов обогащения 26,9×106 Тем стимулировали соответствующим GMP увеличителем объема для человеческих Т-клеток CD3/CD28 Dynabeads® (Invitrogen) в соотношении 1:3 (Т-клетка:шарик) и транедуцировали IL13BBζ-T2A-CD19t_epHIV7 клинического уровня качества при MOI 0,3 в 5,5 мл X Vivo15, содержащей 10% FCS с 5 мкг/мл протамина сульфата (АРР Pharmaceutical), 50 U/мл rhIL-2 и 0,5 нг/мл rhIL-15 в мешке для культуры ткани 32 Vuelife (AFC), который размещали в горизонтальном положении на стеллаже для культуры при 37°С, 5% CO2. Затем поддерживали культуры с добавлением X Vivo15 с 10% FCS по мере необходимости для сохранения плотности клеток от 4×105 до 2×106 жизнеспособных клеток/мл с дополнением цитокинами (конечная концентрация 50 U/мл rhIL-2 и 0,5 нг/мл rhIL-15) каждые понедельник, среду и пятницу культуры. На основе объема культуры Т-клетки переносили в мешки 730 Vuelife (AFC). Через семь суток после лентивирусной трансдукции Dynabeads CD3/CD28 удаляли с использованием магнита для мешка Dynal ClinEx Vivo Magnetic Particle Concentrator, и Т-клетки, не содержащие шариков, сливали в новый мешок 730 Vuelife. Культуры размножали до получения приблизительно 4,53×108 клеток при определении Guava РСА, во время которой культуры отбирали, промывали в Isolyte (Braun) с 2% HSA, затем ресуспендировали в Cryostor CS5 (BioLife Solutions) приблизительно в концентрации 1,3×107 клеток/мл для криоконсервации с использованием Mr. Frosty (Nalgene) и переносного морозильника с контролируемой скоростью (Custom Biogenics). Анализы контроля качества включали жизнеспособность, активность (экспрессия CD19t), идентичность (экспрессия CD3), число копий трансгена (кПЦР (количественная полимеразная цепная реакция) WPRE), тестирование компетентного в отношении репликации вируса (кПЦР VSV-G и формальное тестирование RCL в Университете Индианы), остаточное число шариков и стерильность.
Как отмечено выше, последовательность перескакивания рибосомы Т2А затем отделяет эту последовательность IL13BBζ от CD19t - инертного неиммуногенного маркера поверхности клетки, маркирующего трансдукцию клетки (Фиг. 39А). Данная связь Т2А приводит к координированной экспрессии и IL13BBζ, и CD19t от одного транскрипта.
В данном документе также подробно описываются способы изготовления для иммуномагнитного обогащения центральных Т-клеток памяти (Тсм) CD62L+ CD45RA- CD4+ CD8+, лентивирусной трансдукции и размножения ex vivo. Продукт в виде криоконсервированных Тсм IL13BBζ конца процесса (ЕОР - от англ. «end-of-process») подвергался тестированию для контроля качества при выпуске согласно клиническому протоколу. Для каждой инфузии Т-клетки оттаивали, промывали и готовили в виде другого препарата в конечном объеме 0,5 мл в фармацевтическом нормальном физиологическом растворе, не содержащем консервантов (PFNS), с 2% человеческого сывороточного альбумина (HSA). Клетки вручную инъецировали в резервуар Рикхэма с использованием иглы для бабочек 21 калибра для доставки объема 0,5 мл за 5-10 минут с последующей промывкой вплоть до 1 мл PFNS, доставленной посредством конвекционной усиленной доставки (CED) со скоростью 0,5 мл в час.
Пример 19: клиническая визуализация
Послегадолиниевые взвешенные последовательности MPT Т1 головного и спинного мозга получали на сканере Siemens Viro 3 Tesla. Поражения измеряли на аксиальных взвешенных изображениях MPT Т1, полученных после введения Multihance. Визуализацию с использованием 18-F-фтордезоксиглюкозы (18-F-FDG, от англ. «18-F-fluorodeoxyglucose») проводили с использованием сканера GE Discovery DST НР60 РЕТ-СТ (70 см аксиальное поле зрения, толщина среза 3,75 мм). Максимальные стандартизированные значения поглощения (SUV, от англ. «standardized uptake value») были получены с использованием программы Vital Images Vitrea версии 6.7.2. Области очагов опухоли, усиливающие контраст, были очерчены радиологом для измерений площади наибольшей опухоли (мм2), и рассчитывали объемы опухолей (см3).
Банки криоконсервированных клеток - аутологичных Тсм IL13BBζ контроля качества при выпуске оттаивали и готовили в виде другого препарата для инфузии посредством промывки два раза физиологическим раствором с фосфатным буфером (PBS) с 2% HSA, и ресуспендировали в фармацевтическом нормальном физиологическом растворе, не содержащем консервантов, с 2% HSA. Доставка терапевтических Т-клеток с CAR либо в полость резекции глиомы (в.п.), либо в боковой желудочек (в.ж.) достигалась с использованием резервуара для вентрикулостомии Holter™ Rickham (Codman) желудочковым катетером (Integra Pudenz) и тонким зондом. Для в.п.доставки систему резервуара/катетера вставляли во время резекции опухоли, и кончик катетера частично внедряли в резекционную стенку для того, чтобы обеспечивать доставку клеток как в полость, так и в околоопухолевую мозговую ткань. Осуществляли послеоперационную визуализацию (КТ (компьютерная томография) и МРТ) для подтверждения положения катетера и степени резекции опухоли.
Пример 20: Тсм IL13BBζ демонстрируют фенотип, подобный центральным Т-клеткам памяти
Обогащенные Тсм (36×106) стимулировали ex vivo, лентивирусно трансдуцировали и размножали с получением всего 638×106 клеток за 17 суток. Конечный Т-клеточный продукт (CD3+ и TCR+) состоял из поднаборов Т-клеток CD4 (74%) и CD8 (16%) и экспрессировал IL13BBζ и CD19t с совместным окрашиванием на генномодифицированные продукты в отношении обоих белков поверхности клетки (Фиг. 39А). Т-клеточный продукт с CAR демонстрировал фенотип центральных Т-клеток памяти, экспрессируя CD45RO (97%), CD62L (57%), CCR7 (28%), CD28 (97%) и CD27 (59%) (Фиг. 39А). Данный продукт также экспрессировал некоторые маркеры истощения, включающие TIM-3 (65%) и LAG-3 (49%), но не значимые уровни PD-1 и KLRG1 (Фиг. 39А).
Пример 21: безопасность и переносимость повторных внутричерепных инфузий Тсм IL13BBζ
Пациента лечили еженедельными инфузиями Тсм IL13BBζ вводимыми через резервуарное/катетерное устройство посредством двух разных путей внутричерепной доставки, которыми является внутри полостная (в.п.) доставка после резекции опухоли (циклы 1-6) и внутрижелудочковая (в.ж.) доставка в спинномозговую жидкость (СМЖ) (циклы 7-11). Данные 11 внутричерепных инфузии с максимальной дозой клеток 10×106 Т-клеток CAR+ хорошо переносились без токсичности степени 3 или выше (общие критерии токсичности NCl) с возможным отнесением или более высокой степенью отнесения к наблюдаемой терапии. Легкие отмеченные события после инфузии Т-клеток с CAR включают следующие:


Пример 22: клинический ответ
Во время лечения опухоль пациента демонстрировала характеристики высокоагрессивной рецидивирующей GBM с характеристиками плохого прогноза. Это включало доказательство рецидива в пределах шести месяцев с момента первичной постановки диагноза после стандартного лечения, демонстрацию многоочаговых опухолевых поражений, включающих поражения спинного мозга и обширное заболевание мягкой и паутинной оболочки (Фиг. 38), гистологические характеристики дедифференцированной GBM и высокую скорость пролиферации опухоли с более чем 60% клеток, дающих позитивное окрашивание на Ki67 (Фиг. 37Б). Экспрессия в опухоли IL13Rα2 при оценке посредством IHC на FFPE (от англ. «formalin-fixed and paraffin-embedded» - «зафиксированная формалином и залитая в парафин») резецированной опухолевой ткани была аналогичной между первичными и рецидивирующими опухолями с баллом Н 100 и 80 соответственно (Фиг. 37). Внутриопухолевая экспрессия IL13Rα2 для рецидивирующей опухоли была гетерогенной, причем 10% клеток демонстрировали высокую интенсивность окрашивания (2-3+), 60% демонстрировали низкую экспрессию (1+) и 30% клеток не окрашивались выше фона (0+). Потенциальный интерес представляет то, что наивысшие уровни экспрессии IL13Rα2 часто наблюдались в областях опухоли с псевдопалисадным некрозом (Фиг. 37А) - данная картина экспрессии была отмечена для других GBM опухолей.
После внесения в клинический протокол данный пациент подвергался хирургической резекции в отношении трех из пяти рецидивных поражений (Фиг. 38), и резервуарное/катетерное устройство было помещено в полость резекции наибольшего рецидивного очага (Т1) в правой задней височно-затылочной области. Данного пациента исходно лечили согласно протоколу шестью еженедельными внутриполостными (в.п.) инфузиями Т-клеток CAR+ (2×106 - цикл 1; 10×106 -циклы 2-6) (Фиг. 1Б), и во время данного периода времени височно-затылочное опухолевое поражение (Т1) оставалось стабильным в течение более 45 суток после хирургического вмешательства без доказательства прогрессирующего заболевания (Фиг. 39В). Однако МРТ выявила то, что другие нерезецированные очаги опухоли в левых височных долях (Т4 и Т5), а также новое рецидивное поражение рядом с опухолью 3 (Т6) и поражение в обонятельной борозде (Т7) продолжали прогрессировать на протяжении того же самого периода времени (Фиг. 39В). Дополнительно также были выявлены метастатические поражения в спинном мозге, включающие одну большую опухоль (270 мм2) и более чем один маленький очаг опухоли (меньше 1 см2). Данные результаты, будучи смешанными, являлись обнадеживающими в том, что они свидетельствовали о том, что Тсм IL13BBζ возможно предупреждали рецидив заболевания в резецированной задней височно-затылочной области, однако, они также свидетельствовали о том, что местная в.п.доставка не была достаточной для эффективного контроля прогрессирования опухоли в удаленных положениях от места инфузии.
На основе этих данных и при поддержке доклинических исследований, показывающих то, что в.ж. доставленные Т-клетки с CAR могут транспортироваться во многоочаговую GBM в мышиных моделях NSG (данные не показаны), данный пациент был включен в протокол сочувственного применения, и его лечили пятью еженедельными в.ж. инфузиями Тсм IL13BBζ без каких-либо других терапевтических вмешательств (2×106 - цикл 7; 10×106 - циклы 8-11) (Фиг. 40А). Через одну неделю после трех в.ж. инфузии (цикл 9; сутки 133) все опухолевые поражения демонстрировали кардинальную регрессию, и после последней в.ж. инфузии (цикл 11; сутки 156) большинство внутричерепных и спинномозговых опухолей регрессировали более чем на 70% как по измерению максимальной площади, так и объема (Фиг. 40Б-Д, Таблица 7 ниже и Фиг. 41). Последующая MP и ПЭТ визуализация через шесть недель после последней в.ж. инфузии (сутки 190), во время которых пациент не получал другого терапевтического вмешательства, показала продолжающееся регрессирование заболевания со всеми опухолями, уменьшающимися на 78% или более как при измерениях максимальной площади, так и объема (Фиг. 40Б-Д, Таблица 7 ниже и Фиг. 41). В этот момент времени - 190 суток не было возможным различение между остаточным радиографическим доказательством заболевания по сравнению с воспалением, рубцеванием и/или расширением твердой мозговой оболочки. В.ж. доставка Тсм IL13BBζ вызывала почти полное устранение всех метастатических опухолей в спинном мозге с 97%-ным уменьшением максимальной площади для самого большого поражения и лишь одним видимым маленьким очагом опухоли из более чем десяти, присутствующих до в.ж. лечения. На протяжении курса в.ж. лечения и при совпадении с регрессированием опухоли пациент смог уменьшить системный прием дексаметозона от 2 мг дважды в сутки до 0,5 мг один раз в сутки. Данный пациент оставался клинически стабильным и вернулся к нормальной жизнедеятельности и трудовой активности, таким образом, подтверждая надежность данного опосредованного Т-клетками с CAR противоопухолевого ответа. Данные результаты демонстрируют то, что лечение Тсм IL13BBζ опосредовало почти полный ответ на основе строгих критериев RANO.


Выделенное жирным, сравниваемые значения для определения максимального % уменьшения
NA, поражение не могло быть идентифицировано
О, поражение возможно идентифицировать визуально, но значение было ниже значения, задаваемого параметрами программы
ND, визуализацию не осуществляли
Пример 23: выживание Т-клеток с CAR и воспалительный ответ ЦНС
Для выяснения иммунологических изменений, ассоциированных с противоопухолевыми ответами, наблюдаемыми после в.ж. инфузии Тсм IL13BBζ (Циклы 6-11), СМЖ оценивали на клеточные инфильтраты, выживание Т-клеток CAR+ и уровни цитокинов. Сразу после каждой в.ж. инфузии (т.е. сутки 1-2 циклов 6-11) число клеток на мл СМЖ возрастало в 7,0 плюс/минус 3,6 раза по сравнению с уровнями до инфузии (сутки 0 каждого цикла) и возрастало в 153 плюс/минус 128 раз по сравнению с уровнями до в.ж. введения (Ц7С0) (цикл 7, сутки 0) (Фиг. 42). Общее число клеток в СМЖ типично снижалось на протяжении 7-суточного цикла лечения. При оценке для Ц9С2 клеточные инфильтраты включали большую долю Т-клеток CD3+ - как эндогенных, так и экспрессирующих CAR, а также зрелых миелоидных популяций CD14+ CD11b+ HLA-DR+ (Фиг. 42А). Были выявлены только редкие В-клетки CD19+ и гранулоциты CD11b+ CD15+ (Фиг. 42А). В соответствии с данными проточной цитометрии цитопатология СМЖ в Ц11С1 описала присутствие реактивных лимфоцитов, моноцитов и макрофагов.
Выживание Т-клеток с CAR также отслеживали по ходу в.ж. лечения. Из-за низкого выхода клеток в СМЖ для циклов 7 и 8, данный анализ был сосредоточен на оценке цикла 9 и временных точек непосредственно после циклов 10 и 11. Важно то, что Т-клетки CAR+ были выявлены во все оцениваемые моменты времени (Фиг. 42Б), включая Ц9С0, что соответствует 7 суткам после цикла 8, таким образом, демонстрируя выживание терапевтических клеток в течение по меньшей мере 7-8 суток после инфузии. Однако число Т-клеток с CAR в СМЖ после инфузии уменьшалось в более поздних циклах (Ц10С1 и Ц11С1), когда опухолевая нагрузка также была значительно пониженной (Фиг. 40Б). Примечательно то, что значимое размножение Т-клеток с CAR в СМЖ на протяжении цикла 9 не было отмечено, причем число клеток CAR+ возрастало в 1,6 раза через 2 суток (Ц9С2) с момента до инфузии (Ц9С0) и затем снижалось в 2,3 раза к суткам 8 (Ц9С8).
Присутствие иммунных клеток, включая Т-клетки CAR+, после каждой инфузии соответствовало значимым повышениям уровней цитокинов в СМЖ. 5 Измеренные уровни и рассчитанная кратность изменения по сравнению с исходным уровнем для 30 измеренных цитокинов представлены в Таблицах 9 и 10 ниже. Примечательно то, что уровни 11 цитокинов возрастали более чем в 10 раз от исходного уровня до в.ж. введения (Ц7С0) сразу после инфузий Тсм IL13BBζ, включая цитокины IFNγ, TNF, IL-2, IL-10, IL-5, IL-6 и IL-8 и хемокины CXCL9/MIG, CXCL10/IP-10 и CCR2/MCP-1, и растворимый рецептор цитокинов IL-1Rα (Фиг. 3В). Семь других цитокинов демонстрировали больше, чем 5-кратное увеличение от исходного уровня (Ц7С0), включая G-CSF, IL-12, IL2-R, IL-4, IL-7 и М1Р-1b. Воспалительными цитокинами, которые демонстрировали наибольшую кратность увеличения уровня сразу после инфузии Тсм IL13BBζ по сравнению с моментом до в.ж. введения (Ц7С0), были IL-2 (больше, чем в 90 раз для Ц9С2) и IFN-γ, индуцибельные хемокины CXCL9 и CXCL10 (больше, чем в 40 раз для Ц8С1, Ц9С2, Ц10С1 и Ц11С2). Данные цитокины возвращались почти к исходным уровням в пределах 7 суток между циклами лечения. Цитокины, которые не показывали значимого увеличения уровня после инфузии Т-клеток с CAR, включают IL-13,
20 RANTES и VEGF (Таблицы 9 и 10).




Значения, выделенные жирным - значение «OOR <» из Таблицы 10 было заменено наименьшим измеримым значением для данного цитокина для того, чтобы обеспечивать расчет кратности изменений.
* - цитокины, для которых кратность увеличения больше 10 наблюдалась по меньшей мере один раз.
Эти иммунологические изменения в СМЖ были местными, так как не наблюдалось значимых изменений уровней цитокинов (Таблица 11) и выявляемых Т-клеток CAR+ посредством кПЦР и проточной цитометрии (данные не показаны) в периферической крови. Изменения в СМЖ не могли сравниваться с изменениями в полости резецированного опухолевого поражения 1 (Т1) из-за невозможности получения жидкости кисты из полости на протяжении хода в.п.лечения.

Пример 24: обработка и анализ образцов пациента
Материал резекции опухолей собирали посредством отдела патологии СОН согласно клиническому протоколу.
Иммуногистохимию (IHC) на IL13Rα2 проводили на 5 мкм срезах зафиксированных в формалине залитых в парафин образцов, как описано ранее, и IHC на Ki67 осуществляли аналогичным образом, за исключением демаскировки антигена посредством нагревания при рН 8,0 и инкубации с разведением 1:75 антитела против Ki67 (Dako Corp). Иммунореактивность IL-13Rα2 была подвергнута балльной оценке клиническим нейропатологом и была количественно измерена на основе процентной доли опухолевых клеток, демонстрирующих слабую (1+), умеренную (2+) или сильную (3+) интенсивность цитоплазматического и Гольджи-подобного окрашивания. Балл Н получается по формуле: (3× процентная доля сильно окрашенных клеток) + (2× процентная доля умеренно окрашенных клеток) + процентная доля слабо окрашенных клеток, давая интервал от 0 до 300. Балл Н может быть переведен в систему бальной оценки интенсивности, описанную в критериях регистрации следующим образом: 0 представляет негативную (балл Н 0), 1+ - низкую (балл Н 1-100), 2+ - умеренную (балл Н 101-200) и 3+ - высокую (балл Н 201-300). Критериями для включения было по меньшей мере 20% клеток с бальной оценкой интенсивности окрашивания 1+ (больше 20%, 1+), представляющих балл Н 20. Для IHC окрашивания на IL-13Rα2 использовали подходящие позитивный (яички) и негативный (предстательная железа) контроли. Знак «+» отражает присутствие мембранного окрашивания. Данный анализ проводили в отделе патологии Национального медицинского центра City of Норе, и он рассматривался как исследовательский. Данная лаборатория сертифицирована согласно Поправкам 1988 г. улучшения работы клинических лабораторий (CLIA, от англ. «Clinical Laboratory Improvement Amendments») как квалифицированная для выполнения высокосложных клинических лабораторных анализов.
Образцы периферической крови отбирали в пробирки вакутейнер плюс/минус EDTA. Образцы с EDTA центифугировали с фиколом сразу при получении, и одноядерные клетки периферической крови (РВМС, от англ. «peripheral blood mononuclear cells») замораживали в Cryostor CS5 при -80°С и затем переносили в жидкий азот для долговременного хранения. Образцам без EDTA давали свертываться в течение 2-3 часов при комнатной температуре; сыворотку отбирали центрифугированием, аликвотировали на 100-200 мкл ал и квоты для однократного применения и хранили при -80°С. Спинномозговую жидкость (СМЖ) отбирали из в.ж. резервуара в 3 см3 шприц, осаждали центрифугированием, а супернатанты аликвотировали и хранили при -80°С. Клетки СМЖ ресуспендировали в HBSS-/-(Corning CellGro) с 2% FCS и азидом натрия для немедленного анализа проточной цитометрией, причем остающиеся клетки ресуспендировали и замораживали в Cryostor CS4 при -80°С и затем переносили в жидкий азот для долговременного хранения.
Фенотипирование клеточной поверхности иммунных клеток проводили посредством проточной цитометрии с использованием антител, конъюгированных с флуорохромом, специфичных в отношении CD3, CD4, CD11b, CD14, CD19, CD27, CD28, CD62L, CD45RA, CD45RO, IL-13, TCR-α/β (BD Biosciences), KLRG1, CD15 (BioLegend), HLA-DR, PD1 (eBiosciences), CD8 (Fisher Scientific), LAG-3 (Lifespan Biosciences), CCR7 или TIM-3 (R&D Systems), и соответствующих им изотипических контролей.
Образцы сыворотки и СМЖ участников исследования анализировали посредством набора цитокиновых шариков. Анализы проводили с использованием 30-плексного группового набора человеческих цитокинов (Invitrogen) и FLEXMAP 3® (Luminex).
--->
SEQUENCE LISTING
<110> CITY OF HOPE
<120> ADMINISTRATION OF ENGINEERED T CELLS FOR TREATMENT OF CANCERS IN
THE CENTRAL NERVOUS SYSTEM
<130> 40056-0028WO1
<140> PCT/US2017/016711
<141> 2017-02-06
<150> 62/309,348
<151> 2016-03-16
<150> 62/292,152
<151> 2016-02-05
<160> 59
<170> PatentIn version 3.5
<210> 1
<211> 889
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 1
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
130 135 140
Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro
145 150 155 160
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
165 170 175
Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn
180 185 190
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
195 200 205
Glu Glu Gln Phe Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
210 215 220
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
225 230 235 240
Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys
245 250 255
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
260 265 270
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
275 280 285
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
290 295 300
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
305 310 315 320
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
325 330 335
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
340 345 350
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Met Ala Leu Ile Val
355 360 365
Leu Gly Gly Val Ala Gly Leu Leu Leu Phe Ile Gly Leu Gly Ile Phe
370 375 380
Phe Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
385 390 395 400
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
405 410 415
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val
420 425 430
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
435 440 445
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
450 455 460
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
465 470 475 480
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
485 490 495
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
500 505 510
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
515 520 525
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg Leu Glu
530 535 540
Gly Gly Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu
545 550 555 560
Glu Asn Pro Gly Pro Arg Met Pro Pro Pro Arg Leu Leu Phe Phe Leu
565 570 575
Leu Phe Leu Thr Pro Met Glu Val Arg Pro Glu Glu Pro Leu Val Val
580 585 590
Lys Val Glu Glu Gly Asp Asn Ala Val Leu Gln Cys Leu Lys Gly Thr
595 600 605
Ser Asp Gly Pro Thr Gln Gln Leu Thr Trp Ser Arg Glu Ser Pro Leu
610 615 620
Lys Pro Phe Leu Lys Leu Ser Leu Gly Leu Pro Gly Leu Gly Ile His
625 630 635 640
Met Arg Pro Leu Ala Ile Trp Leu Phe Ile Phe Asn Val Ser Gln Gln
645 650 655
Met Gly Gly Phe Tyr Leu Cys Gln Pro Gly Pro Pro Ser Glu Lys Ala
660 665 670
Trp Gln Pro Gly Trp Thr Val Asn Val Glu Gly Ser Gly Glu Leu Phe
675 680 685
Arg Trp Asn Val Ser Asp Leu Gly Gly Leu Gly Cys Gly Leu Lys Asn
690 695 700
Arg Ser Ser Glu Gly Pro Ser Ser Pro Ser Gly Lys Leu Met Ser Pro
705 710 715 720
Lys Leu Tyr Val Trp Ala Lys Asp Arg Pro Glu Ile Trp Glu Gly Glu
725 730 735
Pro Pro Cys Val Pro Pro Arg Asp Ser Leu Asn Gln Ser Leu Ser Gln
740 745 750
Asp Leu Thr Met Ala Pro Gly Ser Thr Leu Trp Leu Ser Cys Gly Val
755 760 765
Pro Pro Asp Ser Val Ser Arg Gly Pro Leu Ser Trp Thr His Val His
770 775 780
Pro Lys Gly Pro Lys Ser Leu Leu Ser Leu Glu Leu Lys Asp Asp Arg
785 790 795 800
Pro Ala Arg Asp Met Trp Val Met Glu Thr Gly Leu Leu Leu Pro Arg
805 810 815
Ala Thr Ala Gln Asp Ala Gly Lys Tyr Tyr Cys His Arg Gly Asn Leu
820 825 830
Thr Met Ser Phe His Leu Glu Ile Thr Ala Arg Pro Val Leu Trp His
835 840 845
Trp Leu Leu Arg Thr Gly Gly Trp Lys Val Ser Ala Val Thr Leu Ala
850 855 860
Tyr Leu Ile Phe Cys Leu Cys Ser Leu Val Gly Ile Leu His Leu Gln
865 870 875 880
Arg Ala Leu Val Leu Arg Arg Lys Arg
885
<210> 2
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 2
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro
20
<210> 3
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 3
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
<210> 4
<211> 229
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 4
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Gln Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 5
<211> 22
<212> PRT
<213> Homo sapiens
<400> 5
Met Ala Leu Ile Val Leu Gly Gly Val Ala Gly Leu Leu Leu Phe Ile
1 5 10 15
Gly Leu Gly Ile Phe Phe
20
<210> 6
<211> 42
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 6
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 7
<211> 112
<212> PRT
<213> Homo sapiens
<400> 7
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 8
<211> 24
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 8
Leu Glu Gly Gly Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp
1 5 10 15
Val Glu Glu Asn Pro Gly Pro Arg
20
<210> 9
<211> 323
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 9
Met Pro Pro Pro Arg Leu Leu Phe Phe Leu Leu Phe Leu Thr Pro Met
1 5 10 15
Glu Val Arg Pro Glu Glu Pro Leu Val Val Lys Val Glu Glu Gly Asp
20 25 30
Asn Ala Val Leu Gln Cys Leu Lys Gly Thr Ser Asp Gly Pro Thr Gln
35 40 45
Gln Leu Thr Trp Ser Arg Glu Ser Pro Leu Lys Pro Phe Leu Lys Leu
50 55 60
Ser Leu Gly Leu Pro Gly Leu Gly Ile His Met Arg Pro Leu Ala Ile
65 70 75 80
Trp Leu Phe Ile Phe Asn Val Ser Gln Gln Met Gly Gly Phe Tyr Leu
85 90 95
Cys Gln Pro Gly Pro Pro Ser Glu Lys Ala Trp Gln Pro Gly Trp Thr
100 105 110
Val Asn Val Glu Gly Ser Gly Glu Leu Phe Arg Trp Asn Val Ser Asp
115 120 125
Leu Gly Gly Leu Gly Cys Gly Leu Lys Asn Arg Ser Ser Glu Gly Pro
130 135 140
Ser Ser Pro Ser Gly Lys Leu Met Ser Pro Lys Leu Tyr Val Trp Ala
145 150 155 160
Lys Asp Arg Pro Glu Ile Trp Glu Gly Glu Pro Pro Cys Val Pro Pro
165 170 175
Arg Asp Ser Leu Asn Gln Ser Leu Ser Gln Asp Leu Thr Met Ala Pro
180 185 190
Gly Ser Thr Leu Trp Leu Ser Cys Gly Val Pro Pro Asp Ser Val Ser
195 200 205
Arg Gly Pro Leu Ser Trp Thr His Val His Pro Lys Gly Pro Lys Ser
210 215 220
Leu Leu Ser Leu Glu Leu Lys Asp Asp Arg Pro Ala Arg Asp Met Trp
225 230 235 240
Val Met Glu Thr Gly Leu Leu Leu Pro Arg Ala Thr Ala Gln Asp Ala
245 250 255
Gly Lys Tyr Tyr Cys His Arg Gly Asn Leu Thr Met Ser Phe His Leu
260 265 270
Glu Ile Thr Ala Arg Pro Val Leu Trp His Trp Leu Leu Arg Thr Gly
275 280 285
Gly Trp Lys Val Ser Ala Val Thr Leu Ala Tyr Leu Ile Phe Cys Leu
290 295 300
Cys Ser Leu Val Gly Ile Leu His Leu Gln Arg Ala Leu Val Leu Arg
305 310 315 320
Arg Lys Arg
<210> 10
<211> 889
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 10
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
130 135 140
Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro
145 150 155 160
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
165 170 175
Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn
180 185 190
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
195 200 205
Glu Glu Gln Phe Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
210 215 220
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
225 230 235 240
Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys
245 250 255
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
260 265 270
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
275 280 285
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
290 295 300
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
305 310 315 320
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
325 330 335
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
340 345 350
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Met Ala Leu Ile Val
355 360 365
Leu Gly Gly Val Ala Gly Leu Leu Leu Phe Ile Gly Leu Gly Ile Phe
370 375 380
Phe Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
385 390 395 400
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
405 410 415
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val
420 425 430
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
435 440 445
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
450 455 460
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
465 470 475 480
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
485 490 495
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
500 505 510
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
515 520 525
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg Leu Glu
530 535 540
Gly Gly Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu
545 550 555 560
Glu Asn Pro Gly Pro Arg Met Pro Pro Pro Arg Leu Leu Phe Phe Leu
565 570 575
Leu Phe Leu Thr Pro Met Glu Val Arg Pro Glu Glu Pro Leu Val Val
580 585 590
Lys Val Glu Glu Gly Asp Asn Ala Val Leu Gln Cys Leu Lys Gly Thr
595 600 605
Ser Asp Gly Pro Thr Gln Gln Leu Thr Trp Ser Arg Glu Ser Pro Leu
610 615 620
Lys Pro Phe Leu Lys Leu Ser Leu Gly Leu Pro Gly Leu Gly Ile His
625 630 635 640
Met Arg Pro Leu Ala Ile Trp Leu Phe Ile Phe Asn Val Ser Gln Gln
645 650 655
Met Gly Gly Phe Tyr Leu Cys Gln Pro Gly Pro Pro Ser Glu Lys Ala
660 665 670
Trp Gln Pro Gly Trp Thr Val Asn Val Glu Gly Ser Gly Glu Leu Phe
675 680 685
Arg Trp Asn Val Ser Asp Leu Gly Gly Leu Gly Cys Gly Leu Lys Asn
690 695 700
Arg Ser Ser Glu Gly Pro Ser Ser Pro Ser Gly Lys Leu Met Ser Pro
705 710 715 720
Lys Leu Tyr Val Trp Ala Lys Asp Arg Pro Glu Ile Trp Glu Gly Glu
725 730 735
Pro Pro Cys Val Pro Pro Arg Asp Ser Leu Asn Gln Ser Leu Ser Gln
740 745 750
Asp Leu Thr Met Ala Pro Gly Ser Thr Leu Trp Leu Ser Cys Gly Val
755 760 765
Pro Pro Asp Ser Val Ser Arg Gly Pro Leu Ser Trp Thr His Val His
770 775 780
Pro Lys Gly Pro Lys Ser Leu Leu Ser Leu Glu Leu Lys Asp Asp Arg
785 790 795 800
Pro Ala Arg Asp Met Trp Val Met Glu Thr Gly Leu Leu Leu Pro Arg
805 810 815
Ala Thr Ala Gln Asp Ala Gly Lys Tyr Tyr Cys His Arg Gly Asn Leu
820 825 830
Thr Met Ser Phe His Leu Glu Ile Thr Ala Arg Pro Val Leu Trp His
835 840 845
Trp Leu Leu Arg Thr Gly Gly Trp Lys Val Ser Ala Val Thr Leu Ala
850 855 860
Tyr Leu Ile Phe Cys Leu Cys Ser Leu Val Gly Ile Leu His Leu Gln
865 870 875 880
Arg Ala Leu Val Leu Arg Arg Lys Arg
885
<210> 11
<211> 405
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 11
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
115 120 125
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
130 135 140
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
145 150 155 160
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
165 170 175
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Gln Ser
180 185 190
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
195 200 205
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
210 215 220
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
225 230 235 240
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
245 250 255
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
260 265 270
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
275 280 285
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
290 295 300
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
305 310 315 320
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
325 330 335
Leu Ser Leu Gly Lys Met Ala Leu Ile Val Leu Gly Gly Val Ala Gly
340 345 350
Leu Leu Leu Phe Ile Gly Leu Gly Ile Phe Phe Lys Arg Gly Arg Lys
355 360 365
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
370 375 380
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
385 390 395 400
Gly Gly Cys Glu Leu
405
<210> 12
<211> 9515
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 12
gttagaccag atctgagcct gggagctctc tggctaacta gggaacccac tgcttaagcc 60
tcaataaagc ttgccttgag tgcttcaagt agtgtgtgcc cgtctgttgt gtgactctgg 120
taactagaga tccctcagac ccttttagtc agtgtggaaa atctctagca gtggcgcccg 180
aacagggact tgaaagcgaa agggaaacca gaggagctct ctcgacgcag gactcggctt 240
gctgaagcgc gcacggcaag aggcgagggg cggcgactgg tgagtacgcc aaaaattttg 300
actagcggag gctagaagga gagagatggg tgcgagagcg tcagtattaa gcgggggaga 360
attagatcga tgggaaaaaa ttcggttaag gccaggggga aagaaaaaat ataaattaaa 420
acatatagta tgggcaagca gggagctaga acgattcgca gttaatcctg gcctgttaga 480
aacatcagaa ggctgtagac aaatactggg acagctacaa ccatcccttc agacaggatc 540
agaagaactt agatcattat ataatacagt agcaaccctc tattgtgtgc atcaaaggat 600
agagataaaa gacaccaagg aagctttaga caagatagag gaagagcaaa acaaaagtaa 660
gaaaaaagca cagcaagcag cagctgacac aggacacagc aatcaggtca gccaaaatta 720
ccctatagtg cagaacatcc aggggcaaat ggtacatcag gccatatcac ctagaacttt 780
aaatgcatgg gtaaaagtag tagaagagaa ggctttcagc ccagaagtga tacccatgtt 840
ttcagcatta tcagaaggag ccaccccaca agatttaaac accatgctaa acacagtggg 900
gggacatcaa gcagccatgc aaatgttaaa agagaccatc aatgaggaag ctgcaggcaa 960
agagaagagt ggtgcagaga gaaaaaagag cagtgggaat aggagctttg ttccttgggt 1020
tcttgggagc agcaggaagc actatgggcg cagcgtcaat gacgctgacg gtacaggcca 1080
gacaattatt gtctggtata gtgcagcagc agaacaattt gctgagggct attgaggcgc 1140
aacagcatct gttgcaactc acagtctggg gcatcaagca gctccaggca agaatcctgg 1200
ctgtggaaag atacctaaag gatcaacagc tcctggggat ttggggttgc tctggaaaac 1260
tcatttgcac cactgctgtg ccttggatct acaaatggca gtattcatcc acaattttaa 1320
aagaaaaggg gggattgggg ggtacagtgc aggggaaaga atagtagaca taatagcaac 1380
agacatacaa actaaagaat tacaaaaaca aattacaaaa attcaaaatt ttcgggttta 1440
ttacagggac agcagagatc cagtttgggg atcaattgca tgaagaatct gcttagggtt 1500
aggcgttttg cgctgcttcg cgaggatctg cgatcgctcc ggtgcccgtc agtgggcaga 1560
gcgcacatcg cccacagtcc ccgagaagtt ggggggaggg gtcggcaatt gaaccggtgc 1620
ctagagaagg tggcgcgggg taaactggga aagtgatgtc gtgtactggc tccgcctttt 1680
tcccgagggt gggggagaac cgtatataag tgcagtagtc gccgtgaacg ttctttttcg 1740
caacgggttt gccgccagaa cacagctgaa gcttcgaggg gctcgcatct ctccttcacg 1800
cgcccgccgc cctacctgag gccgccatcc acgccggttg agtcgcgttc tgccgcctcc 1860
cgcctgtggt gcctcctgaa ctgcgtccgc cgtctaggta agtttaaagc tcaggtcgag 1920
accgggcctt tgtccggcgc tcccttggag cctacctaga ctcagccggc tctccacgct 1980
ttgcctgacc ctgcttgctc aactctacgt ctttgtttcg ttttctgttc tgcgccgtta 2040
cagatccaag ctgtgaccgg cgcctacggc tagcgccgcc accatgctgc tgctggtgac 2100
cagcctgctg ctgtgcgagc tgccccaccc cgcctttctg ctgatccctg gccccgtgcc 2160
ccctagcacc gccctgcgct acctgatcga ggaactggtg aacatcaccc agaaccagaa 2220
agcccccctg tgcaacggca gcatggtgtg gagcatcaac ctgaccgccg gcatgtactg 2280
tgccgccctg gaaagcctga tcaacgtgag cggctgcagc gccatcgaga aaacccagcg 2340
gatgctgtcc ggcttctgcc cccacaaggt gtccgccgga cagttcagca gcctgcacgt 2400
gcgggacacc aagatcgagg tggcccagtt cgtgaaggac ctgctgctgc acctgaagaa 2460
gctgttccgg gagggccggt tcaacgagag caagtacggc cctccctgcc ccccttgccc 2520
tgccccagag ttcgagggcg gacccagcgt gttcctgttc ccccccaagc ccaaggacac 2580
cctgatgatc agccggaccc ctgaggtgac ctgcgtggtg gtggacgtga gccaggaaga 2640
tcctgaggtc cagttcaatt ggtacgtgga cggcgtggag gtgcacaacg ccaagaccaa 2700
gcccagggaa gagcagttcc agagcaccta ccgggtggtg tccgtgctga ccgtgctgca 2760
ccaggactgg ctgaacggca aagaatacaa gtgcaaggtg tccaacaagg gcctgcccag 2820
cagcatcgag aaaaccatca gcaaggccaa gggccagcct cgggagcccc aggtgtacac 2880
cctgccccct tcccaggaag agatgaccaa gaatcaggtg tccctgacct gcctggtgaa 2940
gggcttctac cccagcgaca tcgccgtgga gtgggagagc aacggccagc ccgagaacaa 3000
ctacaagacc accccccctg tgctggacag cgacggcagc ttcttcctgt acagcaggct 3060
gaccgtggac aagagccggt ggcaggaagg caacgtcttt agctgcagcg tgatgcacga 3120
ggccctgcac aaccactaca cccagaagag cctgtccctg agcctgggca agatggccct 3180
gatcgtgctg ggcggcgtgg ccgggctgct gctgttcatc ggcctgggca tctttttcaa 3240
acggggcaga aagaaactcc tgtatatatt caaacaacca tttatgagac cagtacaaac 3300
tactcaagag gaagatggct gtagctgccg atttccagaa gaagaagaag gaggatgtga 3360
actgggcgga gggcgggtga agttcagccg gtccgccgac gcccctgcct accagcaggg 3420
ccagaaccag ctgtacaacg agctgaacct gggcaggcgg gaggaatacg acgtgctgga 3480
caagcggaga ggccgggacc ctgagatggg cggcaagcct cggcggaaga acccccagga 3540
aggcctgtat aacgaactgc agaaagacaa gatggccgag gcctacagcg agatcggcat 3600
gaagggcgag cggaggcggg gcaagggcca cgacggcctg tatcagggcc tgtccaccgc 3660
caccaaggat acctacgacg ccctgcacat gcaggccctg cccccaaggc tcgagggcgg 3720
cggagagggc agaggaagtc ttctaacatg cggtgacgtg gaggagaatc ccggccctag 3780
gatgccacct cctcgcctcc tcttcttcct cctcttcctc acccccatgg aagtcaggcc 3840
cgaggaacct ctagtggtga aggtggaaga gggagataac gctgtgctgc agtgcctcaa 3900
ggggacctca gatggcccca ctcagcagct gacctggtct cgggagtccc cgcttaaacc 3960
cttcttaaaa ctcagcctgg ggctgccagg cctgggaatc cacatgaggc ccctggccat 4020
ctggcttttc atcttcaacg tctctcaaca gatggggggc ttctacctgt gccagccggg 4080
gcccccctct gagaaggcct ggcagcctgg ctggacagtc aatgtggagg gcagcgggga 4140
gctgttccgg tggaatgttt cggacctagg tggcctgggc tgtggcctga agaacaggtc 4200
ctcagagggc cccagctccc cttccgggaa gctcatgagc cccaagctgt atgtgtgggc 4260
caaagaccgc cctgagatct gggagggaga gcctccgtgt gtcccaccga gggacagcct 4320
gaaccagagc ctcagccagg acctcaccat ggcccctggc tccacactct ggctgtcctg 4380
tggggtaccc cctgactctg tgtccagggg ccccctctcc tggacccatg tgcaccccaa 4440
ggggcctaag tcattgctga gcctagagct gaaggacgat cgccctgcca gagatatgtg 4500
ggtaatggag acgggtctgt tgttgccccg ggccacagct caagacgctg gaaagtatta 4560
ttgtcaccgt ggcaacctga ccatgtcatt ccacctggag atcactgctc ggccagtact 4620
atggcactgg ctgctgagga ctggtggctg gaaggtctca gctgtgactt tggcttatct 4680
gatcttctgc ctgtgttccc ttgtgggcat tcttcatctt caaagagccc tggtcctgag 4740
gaggaaaaga taatctagac ccgggctgca ggaattcgat atcaagctta tcgataatca 4800
acctctggat tacaaaattt gtgaaagatt gactggtatt cttaactatg ttgctccttt 4860
tacgctatgt ggatacgctg ctttaatgcc tttgtatcat gctattgctt cccgtatggc 4920
tttcattttc tcctccttgt ataaatcctg gttgctgtct ctttatgagg agttgtggcc 4980
cgttgtcagg caacgtggcg tggtgtgcac tgtgtttgct gacgcaaccc ccactggttg 5040
gggcattgcc accacctgtc agctcctttc cgggactttc gctttccccc tccctattgc 5100
cacggcggaa ctcatcgccg cctgccttgc ccgctgctgg acaggggctc ggctgttggg 5160
cactgacaat tccgtggtgt tgtcggggaa atcatcgtcc tttccttggc tgctcgcctg 5220
tgttgccacc tggattctgc gcgggacgtc cttctgctac gtcccttcgg ccctcaatcc 5280
agcggacctt ccttcccgcg gcctgctgcc ggctctgcgg cctcttccgc gtcttcgcct 5340
tcgccctcag acgagtcgga tctccctttg ggccgcctcc ccgcatcgat accgtcgact 5400
agccgtacct ttaagaccaa tgacttacaa ggcagctgta gatcttagcc actttttaaa 5460
agaaaagggg ggactggaag ggctaattca ctcccaaaga agacaagatc tgctttttgc 5520
ctgtactggg tctctctggt tagaccagat ctgagcctgg gagctctctg gctaactagg 5580
gaacccactg cttaagcctc aataaagctt gccttgagtg cttcaagtag tgtgtgcccg 5640
tctgttgtgt gactctggta actagagatc cctcagaccc ttttagtcag tgtggaaaat 5700
ctctagcaga attcgatatc aagcttatcg ataccgtcga cctcgagggg gggcccggta 5760
cccaattcgc cctatagtga gtcgtattac aattcactgg ccgtcgtttt acaacgtcgt 5820
gactgggaaa accctggcgt tacccaactt aatcgccttg cagcacatcc ccctttcgcc 5880
agctggcgta atagcgaaga ggcccgcacc gatcgccctt cccaacagtt gcgcagcctg 5940
aatggcgaat ggaaattgta agcgttaata ttttgttaaa attcgcgtta aatttttgtt 6000
aaatcagctc attttttaac caataggccg aaatcggcaa aatcccttat aaatcaaaag 6060
aatagaccga gatagggttg agtgttgttc cagtttggaa caagagtcca ctattaaaga 6120
acgtggactc caacgtcaaa gggcgaaaaa ccgtctatca gggcgatggc ccactacgtg 6180
aaccatcacc ctaatcaagt tttttggggt cgaggtgccg taaagcacta aatcggaacc 6240
ctaaagggag cccccgattt agagcttgac ggggaaagcc ggcgaacgtg gcgagaaagg 6300
aagggaagaa agcgaaagga gcgggcgcta gggcgctggc aagtgtagcg gtcacgctgc 6360
gcgtaaccac cacacccgcc gcgcttaatg cgccgctaca gggcgcgtca ggtggcactt 6420
ttcggggaaa tgtgcgcgga acccctattt gtttattttt ctaaatacat tcaaatatgt 6480
atccgctcat gagacaataa ccctgataaa tgcttcaata atattgaaaa aggaagagta 6540
tgagtattca acatttccgt gtcgccctta ttcccttttt tgcggcattt tgccttcctg 6600
tttttgctca cccagaaacg ctggtgaaag taaaagatgc tgaagatcag ttgggtgcac 6660
gagtgggtta catcgaactg gatctcaaca gcggtaagat ccttgagagt tttcgccccg 6720
aagaacgttt tccaatgatg agcactttta aagttctgct atgtggcgcg gtattatccc 6780
gtattgacgc cgggcaagag caactcggtc gccgcataca ctattctcag aatgacttgg 6840
ttgagtactc accagtcaca gaaaagcatc ttacggatgg catgacagta agagaattat 6900
gcagtgctgc cataaccatg agtgataaca ctgcggccaa cttacttctg acaacgatcg 6960
gaggaccgaa ggagctaacc gcttttttgc acaacatggg ggatcatgta actcgccttg 7020
atcgttggga accggagctg aatgaagcca taccaaacga cgagcgtgac accacgatgc 7080
ctgtagcaat ggcaacaacg ttgcgcaaac tattaactgg cgaactactt actctagctt 7140
cccggcaaca attaatagac tggatggagg cggataaagt tgcaggacca cttctgcgct 7200
cggcccttcc ggctggctgg tttattgctg ataaatctgg agccggtgag cgtgggtctc 7260
gcggtatcat tgcagcactg gggccagatg gtaagccctc ccgtatcgta gttatctaca 7320
cgacggggag tcaggcaact atggatgaac gaaatagaca gatcgctgag ataggtgcct 7380
cactgattaa gcattggtaa ctgtcagacc aagtttactc atatatactt tagattgatt 7440
taaaacttca tttttaattt aaaaggatct aggtgaagat cctttttgat aatctcatga 7500
ccaaaatccc ttaacgtgag ttttcgttcc actgagcgtc agaccccgta gaaaagatca 7560
aaggatcttc ttgagatcct ttttttctgc gcgtaatctg ctgcttgcaa acaaaaaaac 7620
caccgctacc agcggtggtt tgtttgccgg atcaagagct accaactctt tttccgaagg 7680
taactggctt cagcagagcg cagataccaa atactgttct tctagtgtag ccgtagttag 7740
gccaccactt caagaactct gtagcaccgc ctacatacct cgctctgcta atcctgttac 7800
cagtggctgc tgccagtggc gataagtcgt gtcttaccgg gttggactca agacgatagt 7860
taccggataa ggcgcagcgg tcgggctgaa cggggggttc gtgcacacag cccagcttgg 7920
agcgaacgac ctacaccgaa ctgagatacc tacagcgtga gctatgagaa agcgccacgc 7980
ttcccgaagg gagaaaggcg gacaggtatc cggtaagcgg cagggtcgga acaggagagc 8040
gcacgaggga gcttccaggg ggaaacgcct ggtatcttta tagtcctgtc gggtttcgcc 8100
acctctgact tgagcgtcga tttttgtgat gctcgtcagg ggggcggagc ctatggaaaa 8160
acgccagcaa cgcggccttt ttacggttcc tggccttttg ctggcctttt gctcacatgt 8220
tctttcctgc gttatcccct gattctgtgg ataaccgtat taccgccttt gagtgagctg 8280
ataccgctcg ccgcagccga acgaccgagc gcagcgagtc agtgagcgag gaagcggaag 8340
agcgcccaat acgcaaaccg cctctccccg cgcgttggcc gattcattaa tgcagctggc 8400
acgacaggtt tcccgactgg aaagcgggca gtgagcgcaa cgcaattaat gtgagttagc 8460
tcactcatta ggcaccccag gctttacact ttatgcttcc ggctcgtatg ttgtgtggaa 8520
ttgtgagcgg ataacaattt cacacaggaa acagctatga ccatgattac gccaagctcg 8580
aaattaaccc tcactaaagg gaacaaaagc tggagctcca ccgcggtggc ggcctcgagg 8640
tcgagatccg gtcgaccagc aaccatagtc ccgcccctaa ctccgcccat cccgccccta 8700
actccgccca gttccgccca ttctccgccc catggctgac taattttttt tatttatgca 8760
gaggccgagg ccgcctcggc ctctgagcta ttccagaagt agtgaggagg cttttttgga 8820
ggcctaggct tttgcaaaaa gcttcgacgg tatcgattgg ctcatgtcca acattaccgc 8880
catgttgaca ttgattattg actagttatt aatagtaatc aattacgggg tcattagttc 8940
atagcccata tatggagttc cgcgttacat aacttacggt aaatggcccg cctggctgac 9000
cgcccaacga cccccgccca ttgacgtcaa taatgacgta tgttcccata gtaacgccaa 9060
tagggacttt ccattgacgt caatgggtgg agtatttacg gtaaactgcc cacttggcag 9120
tacatcaagt gtatcatatg ccaagtacgc cccctattga cgtcaatgac ggtaaatggc 9180
ccgcctggca ttatgcccag tacatgacct tatgggactt tcctacttgg cagtacatct 9240
acgtattagt catcgctatt accatggtga tgcggttttg gcagtacatc aatgggcgtg 9300
gatagcggtt tgactcacgg ggatttccaa gtctccaccc cattgacgtc aatgggagtt 9360
tgttttggca ccaaaatcaa cgggactttc caaaatgtcg taacaactcc gccccattga 9420
cgcaaatggg cggtaggcgt gtacggaatt cggagtggcg agccctcaga tcctgcatat 9480
aagcagctgc tttttgcctg tactgggtct ctctg 9515
<210> 13
<211> 8732
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 13
gttagaccag atctgagcct gggagctctc tggctaacta gggaacccac tgcttaagcc 60
tcaataaagc ttgccttgag tgcttcaagt agtgtgtgcc cgtctgttgt gtgactctgg 120
taactagaga tccctcagac ccttttagtc agtgtggaaa atctctagca gtggcgcccg 180
aacagggact tgaaagcgaa agggaaacca gaggagctct ctcgacgcag gactcggctt 240
gctgaagcgc gcacggcaag aggcgagggg cggcgactgg tgagtacgcc aaaaattttg 300
actagcggag gctagaagga gagagatggg tgcgagagcg tcagtattaa gcgggggaga 360
attagatcga tgggaaaaaa ttcggttaag gccaggggga aagaaaaaat ataaattaaa 420
acatatagta tgggcaagca gggagctaga acgattcgca gttaatcctg gcctgttaga 480
aacatcagaa ggctgtagac aaatactggg acagctacaa ccatcccttc agacaggatc 540
agaagaactt agatcattat ataatacagt agcaaccctc tattgtgtgc atcaaaggat 600
agagataaaa gacaccaagg aagctttaga caagatagag gaagagcaaa acaaaagtaa 660
gaaaaaagca cagcaagcag cagctgacac aggacacagc aatcaggtca gccaaaatta 720
ccctatagtg cagaacatcc aggggcaaat ggtacatcag gccatatcac ctagaacttt 780
aaatgcatgg gtaaaagtag tagaagagaa ggctttcagc ccagaagtga tacccatgtt 840
ttcagcatta tcagaaggag ccaccccaca agatttaaac accatgctaa acacagtggg 900
gggacatcaa gcagccatgc aaatgttaaa agagaccatc aatgaggaag ctgcaggcaa 960
agagaagagt ggtgcagaga gaaaaaagag cagtgggaat aggagctttg ttccttgggt 1020
tcttgggagc agcaggaagc actatgggcg cagcgtcaat gacgctgacg gtacaggcca 1080
gacaattatt gtctggtata gtgcagcagc agaacaattt gctgagggct attgaggcgc 1140
aacagcatct gttgcaactc acagtctggg gcatcaagca gctccaggca agaatcctgg 1200
ctgtggaaag atacctaaag gatcaacagc tcctggggat ttggggttgc tctggaaaac 1260
tcatttgcac cactgctgtg ccttggatct acaaatggca gtattcatcc acaattttaa 1320
aagaaaaggg gggattgggg ggtacagtgc aggggaaaga atagtagaca taatagcaac 1380
agacatacaa actaaagaat tacaaaaaca aattacaaaa attcaaaatt ttcgggttta 1440
ttacagggac agcagagatc cagtttgggg atcaattgca tgaagaatct gcttagggtt 1500
aggcgttttg cgctgcttcg cgaggatctg cgatcgctcc ggtgcccgtc agtgggcaga 1560
gcgcacatcg cccacagtcc ccgagaagtt ggggggaggg gtcggcaatt gaaccggtgc 1620
ctagagaagg tggcgcgggg taaactggga aagtgatgtc gtgtactggc tccgcctttt 1680
tcccgagggt gggggagaac cgtatataag tgcagtagtc gccgtgaacg ttctttttcg 1740
caacgggttt gccgccagaa cacagctgaa gcttcgaggg gctcgcatct ctccttcacg 1800
cgcccgccgc cctacctgag gccgccatcc acgccggttg agtcgcgttc tgccgcctcc 1860
cgcctgtggt gcctcctgaa ctgcgtccgc cgtctaggta agtttaaagc tcaggtcgag 1920
accgggcctt tgtccggcgc tcccttggag cctacctaga ctcagccggc tctccacgct 1980
ttgcctgacc ctgcttgctc aactctacgt ctttgtttcg ttttctgttc tgcgccgtta 2040
cagatccaag ctgtgaccgg cgcctacggc tagcgccgcc accatgctgc tgctggtgac 2100
cagcctgctg ctgtgcgagc tgccccaccc cgcctttctg ctgatccccg acatccagat 2160
gacccagacc acctccagcc tgagcgccag cctgggcgac cgggtgacca tcagctgccg 2220
ggccagccag gacatcagca agtacctgaa ctggtatcag cagaagcccg acggcaccgt 2280
caagctgctg atctaccaca ccagccggct gcacagcggc gtgcccagcc ggtttagcgg 2340
cagcggctcc ggcaccgact acagcctgac catctccaac ctggaacagg aagatatcgc 2400
cacctacttt tgccagcagg gcaacacact gccctacacc tttggcggcg gaacaaagct 2460
ggaaatcacc ggcagcacct ccggcagcgg caagcctggc agcggcgagg gcagcaccaa 2520
gggcgaggtg aagctgcagg aaagcggccc tggcctggtg gcccccagcc agagcctgag 2580
cgtgacctgc accgtgagcg gcgtgagcct gcccgactac ggcgtgagct ggatccggca 2640
gccccccagg aagggcctgg aatggctggg cgtgatctgg ggcagcgaga ccacctacta 2700
caacagcgcc ctgaagagcc ggctgaccat catcaaggac aacagcaaga gccaggtgtt 2760
cctgaagatg aacagcctgc agaccgacga caccgccatc tactactgcg ccaagcacta 2820
ctactacggc ggcagctacg ccatggacta ctggggccag ggcaccagcg tgaccgtgag 2880
cagcgagagc aagtacggcc ctccctgccc cccttgccct gcccccgagt tcctgggcgg 2940
acccagcgtg ttcctgttcc cccccaagcc caaggacacc ctgatgatca gccggacccc 3000
cgaggtgacc tgcgtggtgg tggacgtgag ccaggaagat cccgaggtcc agttcaattg 3060
gtacgtggac ggcgtggagg tgcacaacgc caagaccaag cccagggaag agcagttcaa 3120
cagcacctac cgggtggtgt ccgtgctgac cgtgctgcac caggactggc tgaacggcaa 3180
agaatacaag tgcaaggtgt ccaacaaggg cctgcccagc agcatcgaga aaaccatcag 3240
caaggccaag ggccagcctc gggagcccca ggtgtacacc ctgccccctt cccaggaaga 3300
gatgaccaag aatcaggtgt ccctgacctg cctggtgaag ggcttctacc ccagcgacat 3360
cgccgtggag tgggagagca acggccagcc cgagaacaac tacaagacca ccccccctgt 3420
gctggacagc gacggcagct tcttcctgta cagcaggctg accgtggaca agagccggtg 3480
gcaggaaggc aacgtcttta gctgcagcgt gatgcacgag gccctgcaca accactacac 3540
ccagaagagc ctgtccctga gcctgggcaa gatggccctg atcgtgctgg gcggcgtggc 3600
cgggctgctg ctgttcatcg gcctgggcat ctttttccgg gtgaagttca gccggtccgc 3660
cgacgcccct gcctaccagc agggccagaa ccagctgtac aacgagctga acctgggcag 3720
gcgggaggaa tacgacgtgc tggacaagcg gagaggccgg gaccctgaga tgggcggcaa 3780
gcccaggcgg aagaaccctc aggaaggcct gtataacgaa ctgcagaaag acaagatggc 3840
cgaggcctac agcgagatcg gcatgaaggg cgagcggcgg aggggcaagg gccacgacgg 3900
cctgtaccag ggcctgagca ccgccaccaa ggatacctac gacgccctgc acatgcaggc 3960
cctgcccccc aggtgacccg ggctgcagga attcgatatc aagcttatcg ataatcaacc 4020
tctggattac aaaatttgtg aaagattgac tggtattctt aactatgttg ctccttttac 4080
gctatgtgga tacgctgctt taatgccttt gtatcatgct attgcttccc gtatggcttt 4140
cattttctcc tccttgtata aatcctggtt gctgtctctt tatgaggagt tgtggcccgt 4200
tgtcaggcaa cgtggcgtgg tgtgcactgt gtttgctgac gcaaccccca ctggttgggg 4260
cattgccacc acctgtcagc tcctttccgg gactttcgct ttccccctcc ctattgccac 4320
ggcggaactc atcgccgcct gccttgcccg ctgctggaca ggggctcggc tgttgggcac 4380
tgacaattcc gtggtgttgt cggggaaatc atcgtccttt ccttggctgc tcgcctgtgt 4440
tgccacctgg attctgcgcg ggacgtcctt ctgctacgtc ccttcggccc tcaatccagc 4500
ggaccttcct tcccgcggcc tgctgccggc tctgcggcct cttccgcgtc ttcgccttcg 4560
ccctcagacg agtcggatct ccctttgggc cgcctccccg catcgatacc gtcgactagc 4620
cgtaccttta agaccaatga cttacaaggc agctgtagat cttagccact ttttaaaaga 4680
aaagggggga ctggaagggc taattcactc ccaaagaaga caagatctgc tttttgcctg 4740
tactgggtct ctctggttag accagatctg agcctgggag ctctctggct aactagggaa 4800
cccactgctt aagcctcaat aaagcttgcc ttgagtgctt caagtagtgt gtgcccgtct 4860
gttgtgtgac tctggtaact agagatccct cagacccttt tagtcagtgt ggaaaatctc 4920
tagcagaatt cgatatcaag cttatcgata ccgtcgacct cgaggggggg cccggtaccc 4980
aattcgccct atagtgagtc gtattacaat tcactggccg tcgttttaca acgtcgtgac 5040
tgggaaaacc ctggcgttac ccaacttaat cgccttgcag cacatccccc tttcgccagc 5100
tggcgtaata gcgaagaggc ccgcaccgat cgcccttccc aacagttgcg cagcctgaat 5160
ggcgaatgga aattgtaagc gttaatattt tgttaaaatt cgcgttaaat ttttgttaaa 5220
tcagctcatt ttttaaccaa taggccgaaa tcggcaaaat cccttataaa tcaaaagaat 5280
agaccgagat agggttgagt gttgttccag tttggaacaa gagtccacta ttaaagaacg 5340
tggactccaa cgtcaaaggg cgaaaaaccg tctatcaggg cgatggccca ctacgtgaac 5400
catcacccta atcaagtttt ttggggtcga ggtgccgtaa agcactaaat cggaacccta 5460
aagggagccc ccgatttaga gcttgacggg gaaagccggc gaacgtggcg agaaaggaag 5520
ggaagaaagc gaaaggagcg ggcgctaggg cgctggcaag tgtagcggtc acgctgcgcg 5580
taaccaccac acccgccgcg cttaatgcgc cgctacaggg cgcgtcaggt ggcacttttc 5640
ggggaaatgt gcgcggaacc cctatttgtt tatttttcta aatacattca aatatgtatc 5700
cgctcatgag acaataaccc tgataaatgc ttcaataata ttgaaaaagg aagagtatga 5760
gtattcaaca tttccgtgtc gcccttattc ccttttttgc ggcattttgc cttcctgttt 5820
ttgctcaccc agaaacgctg gtgaaagtaa aagatgctga agatcagttg ggtgcacgag 5880
tgggttacat cgaactggat ctcaacagcg gtaagatcct tgagagtttt cgccccgaag 5940
aacgttttcc aatgatgagc acttttaaag ttctgctatg tggcgcggta ttatcccgta 6000
ttgacgccgg gcaagagcaa ctcggtcgcc gcatacacta ttctcagaat gacttggttg 6060
agtactcacc agtcacagaa aagcatctta cggatggcat gacagtaaga gaattatgca 6120
gtgctgccat aaccatgagt gataacactg cggccaactt acttctgaca acgatcggag 6180
gaccgaagga gctaaccgct tttttgcaca acatggggga tcatgtaact cgccttgatc 6240
gttgggaacc ggagctgaat gaagccatac caaacgacga gcgtgacacc acgatgcctg 6300
tagcaatggc aacaacgttg cgcaaactat taactggcga actacttact ctagcttccc 6360
ggcaacaatt aatagactgg atggaggcgg ataaagttgc aggaccactt ctgcgctcgg 6420
cccttccggc tggctggttt attgctgata aatctggagc cggtgagcgt gggtctcgcg 6480
gtatcattgc agcactgggg ccagatggta agccctcccg tatcgtagtt atctacacga 6540
cggggagtca ggcaactatg gatgaacgaa atagacagat cgctgagata ggtgcctcac 6600
tgattaagca ttggtaactg tcagaccaag tttactcata tatactttag attgatttaa 6660
aacttcattt ttaatttaaa aggatctagg tgaagatcct ttttgataat ctcatgacca 6720
aaatccctta acgtgagttt tcgttccact gagcgtcaga ccccgtagaa aagatcaaag 6780
gatcttcttg agatcctttt tttctgcgcg taatctgctg cttgcaaaca aaaaaaccac 6840
cgctaccagc ggtggtttgt ttgccggatc aagagctacc aactcttttt ccgaaggtaa 6900
ctggcttcag cagagcgcag ataccaaata ctgttcttct agtgtagccg tagttaggcc 6960
accacttcaa gaactctgta gcaccgccta catacctcgc tctgctaatc ctgttaccag 7020
tggctgctgc cagtggcgat aagtcgtgtc ttaccgggtt ggactcaaga cgatagttac 7080
cggataaggc gcagcggtcg ggctgaacgg ggggttcgtg cacacagccc agcttggagc 7140
gaacgaccta caccgaactg agatacctac agcgtgagct atgagaaagc gccacgcttc 7200
ccgaagggag aaaggcggac aggtatccgg taagcggcag ggtcggaaca ggagagcgca 7260
cgagggagct tccaggggga aacgcctggt atctttatag tcctgtcggg tttcgccacc 7320
tctgacttga gcgtcgattt ttgtgatgct cgtcaggggg gcggagccta tggaaaaacg 7380
ccagcaacgc ggccttttta cggttcctgg ccttttgctg gccttttgct cacatgttct 7440
ttcctgcgtt atcccctgat tctgtggata accgtattac cgcctttgag tgagctgata 7500
ccgctcgccg cagccgaacg accgagcgca gcgagtcagt gagcgaggaa gcggaagagc 7560
gcccaatacg caaaccgcct ctccccgcgc gttggccgat tcattaatgc agctggcacg 7620
acaggtttcc cgactggaaa gcgggcagtg agcgcaacgc aattaatgtg agttagctca 7680
ctcattaggc accccaggct ttacacttta tgcttccggc tcgtatgttg tgtggaattg 7740
tgagcggata acaatttcac acaggaaaca gctatgacca tgattacgcc aagctcgaaa 7800
ttaaccctca ctaaagggaa caaaagctgg agctccaccg cggtggcggc ctcgaggtcg 7860
agatccggtc gaccagcaac catagtcccg cccctaactc cgcccatccc gcccctaact 7920
ccgcccagtt ccgcccattc tccgccccat ggctgactaa ttttttttat ttatgcagag 7980
gccgaggccg cctcggcctc tgagctattc cagaagtagt gaggaggctt ttttggaggc 8040
ctaggctttt gcaaaaagct tcgacggtat cgattggctc atgtccaaca ttaccgccat 8100
gttgacattg attattgact agttattaat agtaatcaat tacggggtca ttagttcata 8160
gcccatatat ggagttccgc gttacataac ttacggtaaa tggcccgcct ggctgaccgc 8220
ccaacgaccc ccgcccattg acgtcaataa tgacgtatgt tcccatagta acgccaatag 8280
ggactttcca ttgacgtcaa tgggtggagt atttacggta aactgcccac ttggcagtac 8340
atcaagtgta tcatatgcca agtacgcccc ctattgacgt caatgacggt aaatggcccg 8400
cctggcatta tgcccagtac atgaccttat gggactttcc tacttggcag tacatctacg 8460
tattagtcat cgctattacc atggtgatgc ggttttggca gtacatcaat gggcgtggat 8520
agcggtttga ctcacgggga tttccaagtc tccaccccat tgacgtcaat gggagtttgt 8580
tttggcacca aaatcaacgg gactttccaa aatgtcgtaa caactccgcc ccattgacgc 8640
aaatgggcgg taggcgtgta cggaattcgg agtggcgagc cctcagatcc tgcatataag 8700
cagctgcttt ttgcctgtac tgggtctctc tg 8732
<210> 14
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 14
Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly
1 5 10
<210> 15
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 15
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 16
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 16
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Gly Gly Gly Ser
1 5 10 15
Ser Gly Gly Gly Ser Gly
20
<210> 17
<211> 39
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 17
Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn
1 5 10 15
Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro Leu
20 25 30
Phe Pro Gly Pro Ser Lys Pro
35
<210> 18
<211> 48
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 18
Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
1 5 10 15
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
20 25 30
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 19
<211> 45
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 19
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 20
<211> 129
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 20
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Gly Gly Gly Ser
1 5 10 15
Ser Gly Gly Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
20 25 30
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
35 40 45
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
50 55 60
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
65 70 75 80
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
85 90 95
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
100 105 110
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
115 120 125
Lys
<210> 21
<211> 21
<212> PRT
<213> Homo sapiens
<400> 21
Leu Cys Tyr Leu Leu Asp Gly Ile Leu Phe Ile Tyr Gly Val Ile Leu
1 5 10 15
Thr Ala Leu Phe Leu
20
<210> 22
<211> 27
<212> PRT
<213> Homo sapiens
<400> 22
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 23
<211> 21
<212> PRT
<213> Homo sapiens
<400> 23
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr
20
<210> 24
<211> 23
<212> PRT
<213> Homo sapiens
<400> 24
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr
20
<210> 25
<211> 24
<212> PRT
<213> Homo sapiens
<400> 25
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr Cys
20
<210> 26
<211> 27
<212> PRT
<213> Homo sapiens
<400> 26
Ile Ile Ser Phe Phe Leu Ala Leu Thr Ser Thr Ala Leu Leu Phe Leu
1 5 10 15
Leu Phe Phe Leu Thr Leu Arg Phe Ser Val Val
20 25
<210> 27
<211> 41
<212> PRT
<213> Homo sapiens
<400> 27
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 28
<211> 41
<212> PRT
<213> Homo sapiens
<400> 28
Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 29
<211> 42
<212> PRT
<213> Homo sapiens
<400> 29
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 30
<211> 42
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 30
Ala Leu Tyr Leu Leu Arg Arg Asp Gln Arg Leu Pro Pro Asp Ala His
1 5 10 15
Lys Pro Pro Gly Gly Gly Ser Phe Arg Thr Pro Ile Gln Glu Glu Gln
20 25 30
Ala Asp Ala His Ser Thr Leu Ala Lys Ile
35 40
<210> 31
<211> 362
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 31
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg
130 135 140
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
145 150 155 160
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
165 170 175
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
180 185 190
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Lys Arg Gly
195 200 205
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
210 215 220
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
225 230 235 240
Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg
245 250 255
Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn
260 265 270
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
275 280 285
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
290 295 300
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
305 310 315 320
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
325 330 335
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
340 345 350
Ala Leu His Met Gln Ala Leu Pro Pro Arg
355 360
<210> 32
<211> 410
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 32
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg
130 135 140
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
145 150 155 160
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
165 170 175
Leu Asp Phe Ala Cys Asp Phe Trp Val Leu Val Val Val Gly Gly Val
180 185 190
Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp
195 200 205
Val Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met
210 215 220
Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala
225 230 235 240
Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Gly Gly Gly Lys Arg Gly
245 250 255
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
260 265 270
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
275 280 285
Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg
290 295 300
Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn
305 310 315 320
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
325 330 335
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
340 345 350
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
355 360 365
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
370 375 380
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
385 390 395 400
Ala Leu His Met Gln Ala Leu Pro Pro Arg
405 410
<210> 33
<211> 442
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 33
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
130 135 140
Cys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Gly Gln Pro Arg
145 150 155 160
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
165 170 175
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
180 185 190
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
195 200 205
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
210 215 220
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
225 230 235 240
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
245 250 255
Leu Ser Leu Ser Leu Gly Lys Met Ala Leu Ile Val Leu Gly Gly Val
260 265 270
Ala Gly Leu Leu Leu Phe Ile Gly Leu Gly Ile Phe Phe Lys Arg Gly
275 280 285
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
290 295 300
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
305 310 315 320
Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg
325 330 335
Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn
340 345 350
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
355 360 365
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
370 375 380
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
385 390 395 400
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
405 410 415
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
420 425 430
Ala Leu His Met Gln Ala Leu Pro Pro Arg
435 440
<210> 34
<211> 541
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 34
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
130 135 140
Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro
145 150 155 160
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
165 170 175
Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn
180 185 190
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
195 200 205
Glu Glu Gln Phe Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
210 215 220
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
225 230 235 240
Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys
245 250 255
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
260 265 270
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
275 280 285
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
290 295 300
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
305 310 315 320
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
325 330 335
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
340 345 350
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Ile Tyr Ile Trp Ala
355 360 365
Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr
370 375 380
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
385 390 395 400
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
405 410 415
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys
420 425 430
Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln
435 440 445
Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu
450 455 460
Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg
465 470 475 480
Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met
485 490 495
Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly
500 505 510
Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp
515 520 525
Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
530 535 540
<210> 35
<211> 373
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 35
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly
130 135 140
Met Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser
145 150 155 160
Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg
165 170 175
Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro
180 185 190
Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe
195 200 205
Ala Ala Tyr Arg Ser Gly Gly Gly Lys Arg Gly Arg Lys Lys Leu Leu
210 215 220
Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu
225 230 235 240
Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys
245 250 255
Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
260 265 270
Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
275 280 285
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
290 295 300
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
305 310 315 320
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
325 330 335
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
340 345 350
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
355 360 365
Ala Leu Pro Pro Arg
370
<210> 36
<211> 385
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 36
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
130 135 140
Cys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Met Phe Trp Val
145 150 155 160
Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr
165 170 175
Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Gly Gly
180 185 190
His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg
195 200 205
Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg
210 215 220
Ser Gly Gly Gly Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys
225 230 235 240
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
245 250 255
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly
260 265 270
Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln
275 280 285
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
290 295 300
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
305 310 315 320
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
325 330 335
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
340 345 350
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
355 360 365
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
370 375 380
Arg
385
<210> 37
<211> 492
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 37
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
130 135 140
Cys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Gly Gln Pro Arg
145 150 155 160
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
165 170 175
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
180 185 190
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
195 200 205
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
210 215 220
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
225 230 235 240
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
245 250 255
Leu Ser Leu Ser Leu Gly Lys Met Phe Trp Val Leu Val Val Val Gly
260 265 270
Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile
275 280 285
Phe Trp Val Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met
290 295 300
Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro
305 310 315 320
Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Gly Gly Gly Lys
325 330 335
Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg
340 345 350
Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro
355 360 365
Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 38
<211> 592
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 38
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
130 135 140
Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro
145 150 155 160
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
165 170 175
Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn
180 185 190
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
195 200 205
Glu Glu Gln Phe Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
210 215 220
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
225 230 235 240
Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys
245 250 255
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
260 265 270
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
275 280 285
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
290 295 300
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
305 310 315 320
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
325 330 335
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
340 345 350
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Met Phe Trp Val Leu
355 360 365
Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val
370 375 380
Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Gly Gly His
385 390 395 400
Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys
405 410 415
His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser
420 425 430
Gly Gly Gly Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln
435 440 445
Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser
450 455 460
Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly
465 470 475 480
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
485 490 495
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
500 505 510
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
515 520 525
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
530 535 540
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
545 550 555 560
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
565 570 575
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
580 585 590
<210> 39
<211> 340
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 39
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
115 120 125
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
130 135 140
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
145 150 155 160
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
165 170 175
Ser Leu Val Ile Thr Leu Tyr Lys Arg Gly Arg Lys Lys Leu Leu Tyr
180 185 190
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
195 200 205
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
210 215 220
Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
225 230 235 240
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
245 250 255
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
260 265 270
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
275 280 285
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
290 295 300
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
305 310 315 320
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
325 330 335
Leu Pro Pro Arg
340
<210> 40
<211> 388
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 40
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
115 120 125
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
130 135 140
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
145 150 155 160
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
165 170 175
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser
180 185 190
Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly
195 200 205
Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala
210 215 220
Ala Tyr Arg Ser Gly Gly Gly Lys Arg Gly Arg Lys Lys Leu Leu Tyr
225 230 235 240
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
245 250 255
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
260 265 270
Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
275 280 285
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
290 295 300
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
305 310 315 320
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
325 330 335
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
340 345 350
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
355 360 365
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
370 375 380
Leu Pro Pro Arg
385
<210> 41
<211> 420
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 41
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Gly Gly Gly Ser
115 120 125
Ser Gly Gly Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
130 135 140
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
145 150 155 160
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
165 170 175
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
180 185 190
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
195 200 205
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
210 215 220
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
225 230 235 240
Lys Met Ala Leu Ile Val Leu Gly Gly Val Ala Gly Leu Leu Leu Phe
245 250 255
Ile Gly Leu Gly Ile Phe Phe Lys Arg Gly Arg Lys Lys Leu Leu Tyr
260 265 270
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
275 280 285
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
290 295 300
Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
305 310 315 320
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
325 330 335
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
340 345 350
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
355 360 365
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
370 375 380
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
385 390 395 400
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
405 410 415
Leu Pro Pro Arg
420
<210> 42
<211> 519
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 42
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
115 120 125
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
130 135 140
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
145 150 155 160
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
165 170 175
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Gln Ser
180 185 190
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
195 200 205
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
210 215 220
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
225 230 235 240
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
245 250 255
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
260 265 270
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
275 280 285
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
290 295 300
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
305 310 315 320
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
325 330 335
Leu Ser Leu Gly Lys Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
340 345 350
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Lys Arg Gly Arg Lys Lys
355 360 365
Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr
370 375 380
Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly
385 390 395 400
Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp
405 410 415
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
420 425 430
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
435 440 445
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
450 455 460
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
465 470 475 480
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
485 490 495
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
500 505 510
Met Gln Ala Leu Pro Pro Arg
515
<210> 43
<211> 351
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 43
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Met Phe Trp Val Leu Val
115 120 125
Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala
130 135 140
Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Gly Gly His Ser
145 150 155 160
Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His
165 170 175
Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Gly
180 185 190
Gly Gly Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
195 200 205
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
210 215 220
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg
225 230 235 240
Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln
245 250 255
Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp
260 265 270
Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro
275 280 285
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
290 295 300
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
305 310 315 320
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
325 330 335
Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
340 345 350
<210> 44
<211> 363
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 44
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Gly Gly Gly Ser
115 120 125
Ser Gly Gly Gly Ser Gly Met Phe Trp Val Leu Val Val Val Gly Gly
130 135 140
Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe
145 150 155 160
Trp Val Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn
165 170 175
Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr
180 185 190
Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Gly Gly Gly Lys Arg
195 200 205
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
210 215 220
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
225 230 235 240
Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser
245 250 255
Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr
260 265 270
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
275 280 285
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
290 295 300
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
305 310 315 320
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
325 330 335
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
340 345 350
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
355 360
<210> 45
<211> 470
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 45
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Gly Gly Gly Ser
115 120 125
Ser Gly Gly Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
130 135 140
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
145 150 155 160
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
165 170 175
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
180 185 190
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
195 200 205
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
210 215 220
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
225 230 235 240
Lys Met Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr
245 250 255
Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys
260 265 270
Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg
275 280 285
Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp
290 295 300
Phe Ala Ala Tyr Arg Ser Gly Gly Gly Lys Arg Gly Arg Lys Lys Leu
305 310 315 320
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
325 330 335
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
340 345 350
Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
355 360 365
Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
370 375 380
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
385 390 395 400
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
405 410 415
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
420 425 430
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
435 440 445
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
450 455 460
Gln Ala Leu Pro Pro Arg
465 470
<210> 46
<211> 570
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 46
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
115 120 125
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
130 135 140
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
145 150 155 160
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
165 170 175
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Gln Ser
180 185 190
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
195 200 205
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
210 215 220
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
225 230 235 240
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
245 250 255
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
260 265 270
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
275 280 285
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
290 295 300
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
305 310 315 320
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
325 330 335
Leu Ser Leu Gly Lys Met Phe Trp Val Leu Val Val Val Gly Gly Val
340 345 350
Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp
355 360 365
Val Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met
370 375 380
Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala
385 390 395 400
Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Gly Gly Gly Lys Arg Gly
405 410 415
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
420 425 430
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
435 440 445
Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg
450 455 460
Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn
465 470 475 480
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
485 490 495
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
500 505 510
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
515 520 525
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
530 535 540
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
545 550 555 560
Ala Leu His Met Gln Ala Leu Pro Pro Arg
565 570
<210> 47
<211> 363
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 47
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg
130 135 140
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
145 150 155 160
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
165 170 175
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
180 185 190
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Gly Gly Gly Lys Arg
195 200 205
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
210 215 220
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
225 230 235 240
Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser
245 250 255
Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr
260 265 270
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
275 280 285
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
290 295 300
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
305 310 315 320
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
325 330 335
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
340 345 350
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
355 360
<210> 48
<211> 341
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 48
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
115 120 125
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
130 135 140
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
145 150 155 160
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
165 170 175
Ser Leu Val Ile Thr Gly Gly Gly Lys Arg Gly Arg Lys Lys Leu Leu
180 185 190
Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu
195 200 205
Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys
210 215 220
Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
225 230 235 240
Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
245 250 255
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
260 265 270
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
275 280 285
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
290 295 300
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
305 310 315 320
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
325 330 335
Ala Leu Pro Pro Arg
340
<210> 49
<211> 245
<212> PRT
<213> Homo sapiens
<400> 49
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Ser Thr Ser Gly
100 105 110
Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Glu Val Gln
115 120 125
Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
130 135 140
Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His
145 150 155 160
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile
165 170 175
Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg
180 185 190
Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met
195 200 205
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp
210 215 220
Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser
245
<210> 50
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 50
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
1 5 10 15
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
20 25 30
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
35 40 45
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
50 55 60
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
65 70 75 80
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
85 90 95
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
100 105
<210> 51
<211> 229
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 51
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Gln Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 52
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 52
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro
1 5 10
<210> 53
<400> 53
000
<210> 54
<400> 54
000
<210> 55
<400> 55
000
<210> 56
<400> 56
000
<210> 57
<211> 28
<212> PRT
<213> Homo sapiens
<400> 57
Met Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser
1 5 10 15
Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 58
<211> 1027
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 58
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Gly Ser Thr Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
145 150 155 160
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile
165 170 175
Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
180 185 190
Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala
195 200 205
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn
210 215 220
Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
245 250 255
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Glu Ser Lys Tyr Gly
260 265 270
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser
275 280 285
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
290 295 300
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
305 310 315 320
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
325 330 335
Lys Thr Lys Pro Arg Glu Glu Gln Phe Gln Ser Thr Tyr Arg Val Val
340 345 350
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
355 360 365
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
370 375 380
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
385 390 395 400
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
405 410 415
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
420 425 430
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
435 440 445
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
450 455 460
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
465 470 475 480
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
485 490 495
Met Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser
500 505 510
Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg
515 520 525
Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro
530 535 540
Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe
545 550 555 560
Ala Ala Tyr Arg Ser Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala
565 570 575
Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
580 585 590
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
595 600 605
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
610 615 620
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
625 630 635 640
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
645 650 655
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
660 665 670
His Met Gln Ala Leu Pro Pro Arg Leu Glu Gly Gly Gly Glu Gly Arg
675 680 685
Gly Ser Leu Leu Thr Cys Gly Asp Val Glu Glu Asn Pro Gly Pro Arg
690 695 700
Met Pro Pro Pro Arg Leu Leu Phe Phe Leu Leu Phe Leu Thr Pro Met
705 710 715 720
Glu Val Arg Pro Glu Glu Pro Leu Val Val Lys Val Glu Glu Gly Asp
725 730 735
Asn Ala Val Leu Gln Cys Leu Lys Gly Thr Ser Asp Gly Pro Thr Gln
740 745 750
Gln Leu Thr Trp Ser Arg Glu Ser Pro Leu Lys Pro Phe Leu Lys Leu
755 760 765
Ser Leu Gly Leu Pro Gly Leu Gly Ile His Met Arg Pro Leu Ala Ile
770 775 780
Trp Leu Phe Ile Phe Asn Val Ser Gln Gln Met Gly Gly Phe Tyr Leu
785 790 795 800
Cys Gln Pro Gly Pro Pro Ser Glu Lys Ala Trp Gln Pro Gly Trp Thr
805 810 815
Val Asn Val Glu Gly Ser Gly Glu Leu Phe Arg Trp Asn Val Ser Asp
820 825 830
Leu Gly Gly Leu Gly Cys Gly Leu Lys Asn Arg Ser Ser Glu Gly Pro
835 840 845
Ser Ser Pro Ser Gly Lys Leu Met Ser Pro Lys Leu Tyr Val Trp Ala
850 855 860
Lys Asp Arg Pro Glu Ile Trp Glu Gly Glu Pro Pro Cys Val Pro Pro
865 870 875 880
Arg Asp Ser Leu Asn Gln Ser Leu Ser Gln Asp Leu Thr Met Ala Pro
885 890 895
Gly Ser Thr Leu Trp Leu Ser Cys Gly Val Pro Pro Asp Ser Val Ser
900 905 910
Arg Gly Pro Leu Ser Trp Thr His Val His Pro Lys Gly Pro Lys Ser
915 920 925
Leu Leu Ser Leu Glu Leu Lys Asp Asp Arg Pro Ala Arg Asp Met Trp
930 935 940
Val Met Glu Thr Gly Leu Leu Leu Pro Arg Ala Thr Ala Gln Asp Ala
945 950 955 960
Gly Lys Tyr Tyr Cys His Arg Gly Asn Leu Thr Met Ser Phe His Leu
965 970 975
Glu Ile Thr Ala Arg Pro Val Leu Trp His Trp Leu Leu Arg Thr Gly
980 985 990
Gly Trp Lys Val Ser Ala Val Thr Leu Ala Tyr Leu Ile Phe Cys Leu
995 1000 1005
Cys Ser Leu Val Gly Ile Leu His Leu Gln Arg Ala Leu Val Leu
1010 1015 1020
Arg Arg Lys Arg
1025
<210> 59
<211> 1021
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 59
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Gly Ser Thr Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
145 150 155 160
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile
165 170 175
Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
180 185 190
Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala
195 200 205
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn
210 215 220
Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
245 250 255
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Glu Ser Lys Tyr Gly
260 265 270
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser
275 280 285
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
290 295 300
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
305 310 315 320
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Phe Val His Asn Ala
325 330 335
Lys Thr Lys Pro Arg Glu Glu Gln Phe Gln Ser Thr Tyr Arg Val Val
340 345 350
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Phe Tyr
355 360 365
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
370 375 380
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
385 390 395 400
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
405 410 415
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
420 425 430
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
435 440 445
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
450 455 460
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
465 470 475 480
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
485 490 495
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
500 505 510
Ser Leu Val Ile Thr Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
515 520 525
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
530 535 540
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly
545 550 555 560
Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln
565 570 575
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
580 585 590
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
595 600 605
Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
610 615 620
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly
625 630 635 640
Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser
645 650 655
Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro
660 665 670
Pro Arg Leu Glu Gly Gly Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys
675 680 685
Gly Asp Val Glu Glu Asn Pro Gly Pro Arg Met Pro Pro Pro Arg Leu
690 695 700
Leu Phe Phe Leu Leu Phe Leu Thr Pro Met Glu Val Arg Pro Glu Glu
705 710 715 720
Pro Leu Val Val Lys Val Glu Glu Gly Asp Asn Ala Val Leu Gln Cys
725 730 735
Leu Lys Gly Thr Ser Asp Gly Pro Thr Gln Gln Leu Thr Trp Ser Arg
740 745 750
Glu Ser Pro Leu Lys Pro Phe Leu Lys Leu Ser Leu Gly Leu Pro Gly
755 760 765
Leu Gly Ile His Met Arg Pro Leu Ala Ile Trp Leu Phe Ile Phe Asn
770 775 780
Val Ser Gln Gln Met Gly Gly Phe Tyr Leu Cys Gln Pro Gly Pro Pro
785 790 795 800
Ser Glu Lys Ala Trp Gln Pro Gly Trp Thr Val Asn Val Glu Gly Ser
805 810 815
Gly Glu Leu Phe Arg Trp Asn Val Ser Asp Leu Gly Gly Leu Gly Cys
820 825 830
Gly Leu Lys Asn Arg Ser Ser Glu Gly Pro Ser Ser Pro Ser Gly Lys
835 840 845
Leu Met Ser Pro Lys Leu Tyr Val Trp Ala Lys Asp Arg Pro Glu Ile
850 855 860
Trp Glu Gly Glu Pro Pro Cys Val Pro Pro Arg Asp Ser Leu Asn Gln
865 870 875 880
Ser Leu Ser Gln Asp Leu Thr Met Ala Pro Gly Ser Thr Leu Trp Leu
885 890 895
Ser Cys Gly Val Pro Pro Asp Ser Val Ser Arg Gly Pro Leu Ser Trp
900 905 910
Thr His Val His Pro Lys Gly Pro Lys Ser Leu Leu Ser Leu Glu Leu
915 920 925
Lys Asp Asp Arg Pro Ala Arg Asp Met Trp Val Met Glu Thr Gly Leu
930 935 940
Leu Leu Pro Arg Ala Thr Ala Gln Asp Ala Gly Lys Tyr Tyr Cys His
945 950 955 960
Arg Gly Asn Leu Thr Met Ser Phe His Leu Glu Ile Thr Ala Arg Pro
965 970 975
Val Leu Trp His Trp Leu Leu Arg Thr Gly Gly Trp Lys Val Ser Ala
980 985 990
Val Thr Leu Ala Tyr Leu Ile Phe Cys Leu Cys Ser Leu Val Gly Ile
995 1000 1005
Leu His Leu Gln Arg Ala Leu Val Leu Arg Arg Lys Arg
1010 1015 1020
<---
Реферат
Изобретение относится к области биотехнологии, конкретно к Т-клеткам, экспрессирующим химерный антигенный рецептор, связывающийся с антигеном опухолевых клеток, и может быть использовано в медицине. Т-клетки могут быть использованы в способе лечения пациента, у которого диагностирована злокачественная опухоль центральной нервной системы, включающем внутрижелудочковое введение Т-клеток, что обеспечивает эффективную иммунотерапию опухоли ЦНС. 16 з.п. ф-лы, 42 ил., 11 табл., 24 пр.

Комментарии