Трансплантация нервных клеток для лечения нейродегенеративных состояний - RU2434636C2
Код документа: RU2434636C2
Чертежи



Описание
Описанные способы относятся к способам лечения заболеваний посредством трансплантации клеток, которые являются единственно благоприятными для указанных способов лечения. В частности, описанные способы представляют собой способы лечения нейродегенеративных состояний с использованием нервных стволовых клеток (NSC).
Нейродегенеративные расстройства характеризуются состояниями с повреждением нейронов в результате заболевания, наследственных состояний или повреждения, такого как травматическое или ишемическое повреждение спинного или головного мозга.
Спинномозговая цепь, которая управляет сокращением скелетной мускулатуры конечностей, включает в себя возбуждающие двигательные нейроны и ингибирующие ГАМК-эргические (т.е. продуцирующие ГАМК) и глицинергические (т.е. продуцирующие глицин) вставочные нейроны. Двигательный нейрон представляет собой нерв, который происходит из переднего рога серого вещества спинного мозга. Аксон двигательного нейрона исходит из сегмента спинного мозга в качестве эфферентного двигательного волокна, которое иннервирует мышечные волокна. Импульсы, которые проводит двигательный нейрон, стимулируют сокращение мышечных волокон. ГАМК, гамма-аминомасляная кислота, представляет собой натуральный метаболит нервной системы млекопитающих, который действует как нейромедиатор, ингибирующий или ослабляющий проведение нервом электрического потенциала. Утрата ГАМК-эргических вставочных нейронов приводит к дисрегуляции ингибирующей тональности вызванных двигательным нейроном мышечных сокращений. В отсутствие контроля, осуществляемого ингибирующими вставочными нейронами в отношении возбуждающих нейронов, наблюдается перевозбуждение возбуждающих нейронов, приводящее к спастическому неконтролируемому сокращению или неконтролируемой ригидности мышц конечностей. Утрата двигательных нейронов приводит к вялой параплегии, при которой субъекты не могут сокращать мышцы и вследствие этого не способны двигаться.
Одним из случаев, при котором ГАМК-эргические вставочные нейроны спинного мозга повреждаются, является осложнение, связанное с преходящим пережатием нисходящей грудной или торакоабдоминальной аорты. Указанное пережатие является необходимым этапом при оперативных вмешательствах на сосудах для устранения аневризм грудной или торакоабдоминальной аорты. Во время пережатия часть спинного мозга лишается кровоснабжения и может становиться ишемической. В зависимости от продолжительности ишемии последующая нейродегенеративная дисфункция может выражаться нейродегенеративно, как парапарез или как полностью развившаяся спастическая или вялая параплегия.
В то время как механизм, приводящий к индуцированной ишемией дегенерации нейронов, известен лишь отчасти и может включать в себя избыточное высвобождение/активность возбуждающих аминокислот, простагландинов и/или кислородных свободных радикалов, популяция нейронов спинного мозга, которую поражает преходящий ишемический инсульт, хорошо известна. Например, гистопатологический анализ спинного мозга, взятого от животных с полностью развившейся спастической параплегией, показывает селективную утрату малых ингибирующих нейронов; однако альфа-мотонейроны персистируют в ранее ишемических спинальных сегментах. Описана сходная патология нейронов спинного мозга у людей с ишемическим повреждением спинного мозга.
Напротив, у животных с вялой параплегией наблюдаются паннекротические нейродегенеративные изменения, поражающие как малые ингибирующие и возбуждающие вставочные нейроны, так и вентральные двигательные нейроны. В течение периода нейрональной дегенерации после спинальной ишемии также наблюдается вызванная повреждением активация локальной микроглии и воспалительные изменения, такие как инфильтрация макрофагами, как при очаговой или глобальной ишемии головного мозга. В зависимости от распространенности повреждения воспалительные изменения обычно достигают пика между двумя и семью днями после ишемического инсульта, а затем наблюдается постепенное исчезновение элементов воспаления в течение двух-четырех недель постишемического периода.
В последние два-три десятилетия прилагались значительные усилия для того, чтобы на экспериментальных животных оценить терапевтический потенциал трансплантации в спинной мозг ряда материалов. Так, клеточные линии или остро выделенную ткань спинного мозга плода доставляли в поврежденные области, а также использовали прямую спинальную генную терапию для облегчения нейродегенеративной дисфункции на нескольких моделях повреждения спинного мозга, включая механическое травматическое повреждение, химическое повреждение спинного мозга, или на генетически измененных животных с прогрессивной α-мотонейрональной дегенерацией (ALS-трансгенные мыши или крысы).
В целом, исследования демонстрируют долгосрочное выживание и сохранение нейрональных фенотипов в трансплантатах, полученных из фетальной ткани, но не из клеток-предшественников нейронов, которые размножались in vitro. Фактически были продемонстрированы лишь ограниченная нейрональная дифференцировка и созревание клеток-предшественников нейронов, размножавшихся in vitro и трансплантированных в механически или химически поврежденный спинной мозг. Клетки дифференцировались, главным образом, в клеточные типы, не относящиеся к нейронам. В то время как механизм указанной, преимущественно не являющейся нейрональной, дифференцировки не вполне понятен, существует гипотеза о том, что имеет место, вероятно, локальное высвобождение провоспалительных цитокинов (таких как TNFα и TGFβ) на участке ранее имевшегося повреждения.
Нейродегенерация представляет собой особенно проблематичное биологическое окружение для клеточной терапии, а сигналы гибели клеток, имеющие место при установившемся нейродегенеративном заболевании (Rothstein et аl., 1992; Howland et al., 2002; Turner et al., 2005), могут быть не совместимыми с выживанием трансплантата. Помимо этого, спинной мозг взрослого организма рассматривается как утративший клетки и/или сигналы, обеспечивающие регенерацию (Park et al., 2002), и большинство исследований трансплантации NSC показали слабую или ограниченную дифференцировку (Сао et al., 2002; Yan et al., 2004).
Одной из главных проблем клеточной терапии является низкая выживаемость трансплантированных клеток (менее 5%). Все трансплантированные клетки в настоящее время погибают в значительных количествах вскоре после инъекции in vivo. Так, с целью доставки эффективной дозы клеток конечную дозу необходимо инъецировать по меньшей мере 20 раз. Это, в свою очередь, требует гораздо больших масштабов производства клеток, что создает дополнительные регуляторные и экономические препятствия. Кроме того, выживаемость указанных клеток in vivo невозможно было сохранить. Неспособность продемонстрировать воспроизводимое введение эффективных доз клеточной терапии препятствует получению разрешения применять указанную терапию от правительства и других регулирующих органов, таких как Управление по контролю за продуктами и лекарствами США.
Дополнительные проблемы возникают при лечении нейродегенеративных заболеваний и состояний, которые захватывают большую область тела, ткани или органа, такую как нервная система в целом, а не единичный локализованный участок. Например, в случае ALS нейродегенерация включает в себя медленную гибель двигательных нейронов на всем протяжении спинного мозга, а также нейронов двигательной коры. Подобно этому, при большинстве лизосомальных заболеваний нейрональная деструкция захватывает большинство областей головного и спинного мозга. Болезнь Альцгеймера захватывает большую часть головного мозга. Даже при более локализованных нейродегенеративных заболеваниях, таких как болезнь Паркинсона и болезнь Хантингтона, пораженная область полосатого тела является достаточно большой, гораздо больше, чем область трансплантации, которая может быть достигнута хирургическим путем. Таким образом, клеточная терапия при нейродегенеративных заболеваниях, как ожидается, потребует осуществления более обширных процедур трансплантации.
Таким образом, существует потребность в улучшенных способах лечения нейродегенеративных состояний. Существует потребность также в улучшенных способах культивирования и трансплантации нервных стволовых клеток, исключая эмбриональные клетки человека, и недифференцированных клеток-предшественников нейронов, которые после трансплантации будут преодолевать все ранее наблюдавшиеся ограничения и приносить функциональную пользу. Таким образом, данный способ лечения нейродегенеративных состояний, in vivo, обеспечивает надежную дифференцировку нервных клеток, длительное выживание нейронов при различных дегенеративных состояниях и созревание в терапевтически важные субпопуляции нейронов в тканях взрослого организма, которые не имеют стимулов для развития, и создает широкий терапевтический интервал по сравнению с локализацией самих клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Описанные способы включают способы лечения нейродегенеративных состояний. В частности, описанные способы включают трансплантацию субъекту, который в этом нуждается, NSC, недифференцированных клеток-предшественников нейронов или клеток-предшественников нейронов, которые размножались in vitro таким образом, что клетки могут улучшить нейродегенеративное состояние. В одном варианте осуществления настоящего изобретения описанные способы включают идентификацию, выделение, размножение и подготовку донорских клеток для использования в качестве лечения нейродегенеративного состояния. Донорские клетки, предназначенные для трансплантации, можно подвергать селекции на предмет соответствия элементам или отсутствия элементов, которые вносят свой вклад в состояние, его симптомы и/или его эффекты.
Клетки описанных способов включают в себя клетки, которые после трансплантации генерируют нейроны в количестве, достаточном для того, чтобы интегрироваться в нейронную инфраструктуру для улучшения болезненного статуса или состояния. В одном варианте осуществления настоящего изобретения описанные способы включают в себя лечение нейродегенеративных заболеваний или состояний посредством трансплантации мультипотентных недифференцированных клеток-предшественников нейронов или нервных стволовых клеток, которые были выделены из центральной нервной системы млекопитающего и были размножены in vitro. Например, трансплантация размноженных нервных стволовых клеток может использоваться для улучшения функции ходьбы у субъекта, страдающего различными формами миелопатии с симптомами спастичности, ригидности, припадков, паралича или любой другой гиперактивности мышц.
Способ лечения может включать в себя доставку в поврежденную нервную область, посредством трансплантации, подходящего количества NSC, которые могут дифференцироваться в достаточное количество ГАМК-продуцирующих нейронов и/или глицин-продуцирующих нейронов, для ослабления дефектных нервных цепей, включая гиперактивные нейрональные цепи.
В одном варианте осуществления настоящего изобретения описанные способы включают в себя восстановление двигательной функции при заболевании двигательных нейронов. Подходящее количество или терапевтически эффективное количество NSC или недифференцированных клеток-предшественников нейронов, которые способны дифференцироваться в двигательные нейроны, могут доставляться по меньшей мере в одну область нейродегенерации, такую как дегенеративный спинной мозг, для восстановления двигательной функции. NSC оказывают свое терапевтическое действие путем замены дегенерировавших нервно-мышечных синапсов.
В сочетании или альтернативно, NSC оказывают свое терапевтическое действие путем экспрессии и высвобождения трофических молекул, которые защищают нейроны дегенерирующей ткани таким образом, что большее их количество выживает в течение более длительного периода времени. Полученные из NSC нейроны можно направить в вентральные корешки, чтобы иннервировать мышцы, и в данном случае NSC участвуют в экстенсивных реципрокных связях с двигательными нейронами хозяина у субъектов с дегенеративным заболеванием двигательных нейронов. Таким образом, в одном варианте осуществления настоящего изобретения NSC из фетального спинного мозга можно трансплантировать в поясничный отдел спинного мозга, где указанные клетки могут претерпевать дифференцировку в нейроны, которые образовывают синаптические контакты с нейронами хозяина и экпрессируют и высвобождают факторы роста двигательных нейронов.
В одном варианте осуществления настоящего изобретения описанные способы включают в себя получение нервных стволовых клеток или недифференцированных клеток-предшественников нейронов, которые интегрируются в ткань хозяина и поставляют один или более факторов роста нейронам хозяина, защищая их, таким образом, от дегенеративных влияний, присутствующих в ткани. Способы включают в себя введение достаточного количества NSC или недифференцированных клеток-предшественников нейронов в область спинного мозга таким образом, чтобы NSC секретировали эффективное количество по меньшей мере одного фактора роста.
В одном варианте осуществления настоящего изобретения описанные способы включают в себя создание способа применения экспериментальных животных в качестве модели для доклинической оценки стволовых клеток для замещения клеток при нейродегенеративных состояниях.
В одном варианте осуществления настоящего изобретения описанные способы включают в себя повышение эффективности дифференцировки трансплантированных NSC в нейроны. Способ включает в себя размножение в высокой степени обогащенных NSC или недифференцированных клеток-предшественников нейронов в их недифференцированном состоянии таким образом, чтобы после трансплантации достаточное количество, такое как 20%, клеток в трансплантате в дальнейшем превратилось в нейроны.
В одном варианте осуществления настоящего изобретения описанные способы включают в себя увеличение количества дифференцированных клеток без увеличения количества NSC или недифференцированных клеток-предшественников нейронов, предназначенных для трансплантации. В одном варианте осуществления настоящего изобретения способ включает в себя получение размноженной донорской популяции таким образом, чтобы после трансплантации NSC или недифференцированные клетки-предшественники нейронов продолжали делиться in vivo до десяти раз, не образуя опухоли и эффективно увеличивая общее количество доставленных клеток.
Клетки описанных способов можно выделять или получить из фетальных, неонатальных, ювенильных, взрослых или посмертных тканей млекопитающего, не относящегося к человеку. Клетки описанных способов можно выделять или получить из центральной нервной системы, крови или любого другого подходящего источника стволовых клеток, которые дифференцируются в нейроны. Клетки можно также получить из эмбриональных стволовых клеток. Например, в одном варианте осуществления настоящего изобретения клетки включают в себя нейроэпителиальные клетки, выделенные из развивающегося фетального спинного мозга. В некоторых случаях клетки-предшественники нейронов могут представлять собой недифференцированные клетки-предшественники нейронов, выделенные из специфических субобластей центральной нервной системы.
Согласно описанным способам нервные стволовые клетки размножают в культуре. В одном варианте осуществления настоящего изобретения клетки-предшественники нейронов могут представлять собой мультипотентные NSC, способные размножаться в культуре и после дифференцировки генерировать как нейроны, так и глию.
К моменту трансплантации клетки могут быть недифференцированными, преддифференцированными или полностью дифференцированными. В одном варианте осуществления настоящего изобретения клетки являются индуцированными для дифференцировки в нейрональную линию. Клетки описанных способов могут претерпевать нейрональную дифференцировку in situ в присутствии провоспалительных цитокинов и других факторов окружающей среды, существующих в поврежденной ткани.
Используя настоящие способы, можно лечить нервные цепи путем трансплантации или введения клеток в соответствующие области для облегчения заболевания, расстройства или состояния. Обычно имеет место трансплантация в нервную ткань или в ткани, не являющиеся нервными тканями, которые способствуют выживанию трансплантированных клеток. Трансплантаты NSC, используемые в описанных способах, хорошо выживают в нейродегенеративной окружающей среде, где NSC могут оказывать мощное клиническое действие в форме задержки возникновения и прогрессирования нейродегенеративных состояний или заболевания.
В некоторых случаях может иметь место трансплантация в отдаленные области тела, и клетки могут мигрировать в предназначенное для них место. Соответственно, описанные способы могут также включать в себя частичную трансплантацию NSC. Используемый в настоящем документе термин «частичная трансплантация» может относиться к имплантации размножившихся NSC лишь в часть области или в менее чем целую область нейродегенерации. Например, осуществляется частичная трансплантация NSC в поясничные сегменты спинного мозга. По крайней мере часть влияния NSC на дегенерирующие двигательные нейроны включает доставку нейротрофических агентов и трофических цитокинов к дегенерирующим двигательным нейронам хозяина посредством классических клеточных механизмов. С этой целью NSC, частично трансплантируемые в поясничные сегменты спинного мозга с использованием описанных способов, как было показано на трансгенных животных, служивших моделью заболевания двигательных нейронов, выживают, претерпевают экстенсивную нейрональную дифференцировку, способствуют выживанию и функционированию двигательных нейронов в непосредственной области трансплантации, а также в областях, отдаленных от области трансплантации.
Соответственно, описанные способы относятся к способу лечения спастичности, ригидности или состояний гиперактивности мышц. Способ включает в себя выделение по меньшей мере одной нервной стволовой клетки у млекопитающего и размножение in vitro нервной стволовой клетки до состояния размноженной популяции. Способ включает в себя также концентрирование размноженной популяции и внедрение терапевтически эффективного количества размноженной популяции по меньшей мере в одну область спинного мозга реципиента. По меньшей мере 20% размноженной популяции способны генерировать нейроны в спинном мозге реципиента.
В одном варианте осуществления настоящего изобретения состояния вызваны травматическим повреждением спинного мозга, ишемическим повреждением спинного мозга, травматическим повреждением головного мозга, инсультом, рассеянным склерозом, церебральным параличом, эпилепсией, болезнью Хантингтона, боковым амиотрофическим склерозом, хронической ишемией, наследственными состояниями или любой их комбинацией.
В одном варианте осуществления настоящего изобретения нервную стволовую клетку выделяют из источника, выбранного из группы, состоящей из центральной нервной системы, периферической нервной системы, костного мозга, периферической крови, крови пуповины и по меньшей мере одного эмбриона.
В одном варианте осуществления настоящего изобретения гестационный возраст развивающегося млекопитающего составляет от приблизительно 6,5 до приблизительно 20 недель.
В одном варианте осуществления настоящего изобретения нервную стволовую клетку выделяют из фетального спинного мозга млекопитающего, не являющегося человеком.
В одном варианте осуществления настоящего изобретения размножение нервной стволовой клетки включает в себя культивирование нервной стволовой клетки в отсутствие сыворотки.
В одном варианте осуществления настоящего изобретения размножение нервной стволовой клетки включает в себя воздействие на нервную стволовую клетку по меньшей мере одним фактором роста.
В одном варианте осуществления настоящего изобретения фактор роста выбран из группы, состоящей из bFGF, EGF, TGF-альфа, aFGF и их комбинаций.
В одном варианте осуществления настоящего изобретения терапевтически эффективное количество размноженной популяции способно генерировать по меньшей мере 1000 ГАМК-продуцирующих нейронов in vivo.
В одном варианте осуществления настоящего изобретения терапевтически эффективное количество размноженной популяции способно генерировать по меньшей мере 1000 глицин-продуцирующих нейронов in vivo.
В одном варианте осуществления настоящего изобретения по меньшей мере 40% размноженной популяции способно генерировать нейроны в спинном мозге.
В одном варианте осуществления настоящего изобретения введение терапевтически эффективного количества размноженной популяции включает инъецирование по меньшей мере части терапевтически эффективного количества во множество областей спинного мозга реципиента.
В одном варианте осуществления настоящего изобретения по меньшей мере 30% размноженной популяции способно дифференцироваться в нейроны in vitro.
В другом варианте осуществления настоящего изобретения получена нервная стволовая клетка. Нервная стволовая клетка способна лечить спастичность, ригидность или состояния гиперактивности мышц. Нервную стволовую клетку выделяют от млекопитающего и размножают in vitro до состояния размноженной популяции. Размноженную популяцию, включающую стволовые клетки, концентрируют и внедряют терапевтически эффективное количество размноженной популяции по меньшей мере в одну область спинного мозга реципиента. По меньшей мере 20% размноженной популяции способны генерировать нейроны в спинном мозге реципиента.
В другом варианте осуществления описанных способов описан способ лечения хронической боли. Способ включает в себя выделение по меньшей мере одной нервной стволовой клетки от млекопитающего и размножение in vitro нервной стволовой клетки до состояния размноженной популяции. Способ также включает в себя концентрацию размноженной популяции и внедрение терапевтически эффективного количества размноженной популяции по меньшей мере в одну область спинного мозга реципиента. По меньшей мере 20% размноженной популяции способны генерировать нейроны в спинном мозге реципиента.
В одном варианте осуществления настоящего изобретения хроническая боль вызвана травматическим повреждением спинного мозга, ишемическим повреждением спинного мозга, травматическим повреждением головного мозга, инсультом, рассеянным склерозом, церебральным параличом, эпилепсией, болезнью Хантингтона, боковым амиотрофическим склерозом, хронической ишемией, наследственными состояниями или любой их комбинацией.
В одном варианте осуществления настоящего изобретения терапевтически эффективное количество размноженной популяции способно генерировать по меньшей мере 1000 ГАМК-продуцирующих нейронов in vivo.
В одном варианте осуществления настоящего изобретения терапевтически эффективное количество размноженной популяции способно генерировать по меньшей мере 1000 глицин-продуцирующих нейронов in vivo.
В одном варианте осуществления настоящего изобретения по меньшей мере 40% размноженной популяции способно генерировать нейроны в спинном мозге.
В одном варианте осуществления настоящего изобретения введение терапевтически эффективного количества размноженной популяции включает инъецирование по меньшей мере части терапевтически эффективного количества во множество областей спинного мозга реципиента.
В одном варианте осуществления настоящего изобретения области включают в себя дорсальный рог.
В одном варианте осуществления настоящего изобретения области включают в себя интратекальное пространство.
В еще одном варианте осуществления настоящего изобретения получена нервная стволовая клетка. Нервная стволовая клетка способна лечить хроническую боль. Нервную стволовую клетку выделяют от млекопитающего и размножают in vitro до состояния размноженной популяции. Размноженную популяцию, включающую стволовые клетки, концентрируют и внедряют терапевтически эффективное количество размноженной популяции по меньшей мере в одну область спинного мозга реципиента. По меньшей мере 20% размноженной популяции способны генерировать нейроны в спинном мозге реципиента.
В другом варианте осуществления описанных способов описан способ лечения дегенерации двигательных нейронов. Способ включает в себя выделение по меньшей мере одной нервной стволовой клетки от млекопитающего и размножение in vitro нервной стволовой клетки до состояния размноженной популяции. Способ также включает в себя концентрацию размноженной популяции и внедрение терапевтически эффективного количества размноженной популяции по меньшей мере в одну область спинного мозга реципиента. По меньшей мере 20% размноженной популяции способны генерировать нейроны в спинном мозге реципиента.
В одном варианте осуществления настоящего изобретения дегенерация двигательных нейронов вызвана травматическим повреждением спинного мозга, ишемическим повреждением спинного мозга, травматическим повреждением головного мозга, инсультом, рассеянным склерозом, церебральным параличом, эпилепсией, болезнью Хантингтона, боковым амиотрофическим склерозом, хронической ишемией, наследственными состояниями или любой их комбинацией.
В одном варианте осуществления настоящего изобретения способ включает в себя выделение нервной стволовой клетки из области, содержащей много клеток по меньшей мере одного нейронального подтипа, в которой нейрональный подтип продуцирует фактор роста, эффективный для улучшения двигательного дефицита.
В одном варианте осуществления настоящего изобретения размноженная популяция включает количество нервных стволовых клеток, способных дифференцироваться в нейроны, достаточное для секреции терапевтически эффективного количества по меньшей мере одного фактора роста.
В одном варианте осуществления настоящего изобретения способ включает в себя выделение нервной стволовой клетки из области, содержащей много двигательных нейронов.
В еще одном варианте осуществления настоящего изобретения получена нервная стволовая клетка, способная лечить сирингомиелию. Нервную стволовую клетку выделяют от млекопитающего и размножают in vitro до состояния размноженной популяции. Размноженную популяцию, включающую стволовые клетки, концентрируют и внедряют терапевтически эффективное количество размноженной популяции по меньшей мере в одну область спинного мозга реципиента. По меньшей мере 20% размноженной популяции способны генерировать нейроны в спинном мозге реципиента.
В другом варианте осуществления описанных способов описан способ лечения сирингомиелии. Способ включает в себя выделение по меньшей мере одной нервной стволовой клетки от млекопитающего и размножение in vitro нервной стволовой клетки до состояния размноженной популяции. Способ также включает в себя концентрацию размноженной популяции и внедрение терапевтически эффективного количества размноженной популяции в патологическую полость спинного мозга реципиента. По меньшей мере 20% размноженной популяции способны генерировать нейроны в патологической полости спинного мозга реципиента.
В одном варианте осуществления настоящего изобретения сирингомиелия вызвана травматическим повреждением спинного мозга, ишемическим повреждением спинного мозга, травматическим повреждением головного мозга, инсультом, рассеянным склерозом, церебральным параличом, эпилепсией, болезнью Хантингтона, боковым амиотрофическим склерозом, хронической ишемией, наследственными состояниями или любой их комбинацией.
В одном варианте осуществления настоящего изобретения способ включает в себя выделение нервной стволовой клетки из области, содержащей много клеток по меньшей мере одного нейронального подтипа, в которой нейрональный подтип продуцирует фактор роста, эффективный для облегчения сирингомиелии.
В одном варианте осуществления настоящего изобретения способ включает в себя выделение нервной стволовой клетки из области, содержащей много двигательных нейронов.
В одном варианте осуществления настоящего изобретения размноженная популяция включает количество нервных стволовых клеток, способных дифференцироваться в нейроны, достаточное для секреции терапевтически эффективного количества по меньшей мере одного фактора роста.
В одном варианте осуществления настоящего изобретения терапевтически эффективное количество размноженной популяции способно генерировать по меньшей мере 1000 нейронов.
В одном варианте осуществления настоящего изобретения по меньшей мере 100000 нервных стволовых клеток размноженной популяции внедряют в патологическую полость спинного мозга реципиента.
В еще одном варианте осуществления настоящего изобретения получена нервная стволовая клетка, способная лечить сирингомиелию. Нервную стволовую клетку выделяют от млекопитающего и размножают in vitro до состояния размноженной популяции. Размноженную популяцию, включающую стволовые клетки, концентрируют и внедряют терапевтически эффективное количество размноженной популяции в патологическую полость спинного мозга реципиента. По меньшей мере 20% размноженной популяции способны генерировать нейроны в патологической полости спинного мозга реципиента.
В дополнительном варианте осуществления описанных способов описан способ размножения in vitro по меньшей мере одной нервной стволовой клетки до состояния размноженной популяции нервных стволовых клеток. Каждое размножение нервных стволовых клеток превышает тридцать клеточных удвоений без дифференцировки. Способ включает в себя разъединение нервных стволовых клеток от ткани центральной нервной системы и внесение по меньшей мере одного внеклеточного белка в культуральный сосуд. Внеклеточный белок включает по меньшей мере приблизительно 10 мкг/мл поли-D-лизина и приблизительно 1 мг/мл фибронектина. Способ включает в себя также культивирование диссоциированных нервных стволовых клеток в культуральном сосуде в отсутствие сыворотки и добавление в культуральный сосуд по меньшей мере одного фактора роста. Фактор роста выбран из группы, состоящей из bFGF, EGF, TGF-альфа, aFGF и их комбинаций. Способ включает в себя также пассирование культивированных клеток до слияния.
В одном варианте осуществления настоящего изобретения размноженные нервные стволовые клетки способны дифференцироваться в нейроны.
В одном варианте осуществления настоящего изобретения размножение нервных стволовых клеток включает в себя добавление фибронектина в культуральную среду в качестве растворимого фактора.
В одном варианте осуществления настоящего изобретения диссоциация клеток и пассирование клеток включают в себя ферментативную диссоциацию.
В одном варианте осуществления настоящего изобретения ферментативная диссоциация включает в себя воздействие на клетки трипсином.
В одном варианте осуществления настоящего изобретения терапевтически эффективное количество размноженной популяции внедряют по меньшей мере в одну область нервной системы реципиента для лечения нейродегенеративного состояния.
Таким образом, преимуществом описанных способов перед существующими фармакологическими стратегиями является создание способа для облегчения способности трансплантированных NSC секретировать трофические молекулы, которые могут быть доставлены к дегенерирующим двигательным нейронам в условиях оптимальной биодоступности.
Еще одним преимуществом настоящего изобретения является создание способа культивирования и размножения NSC из фетального спинного мозга млекопитающего для облегчения успешного приживления трансплантированных NSC в поясничный отдел спинного мозга.
Еще одно преимущество описанных способов включает создание способа достижения более высокой доли нейрональной дифференцировки популяции NSC.
Другое преимущество описанных способов включает достижение клинических эффектов от частичной трансплантации NSC.
Другие признаки и преимущества описанных способов описаны и будут очевидны из следующего подробного описания изобретения и чертежей.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
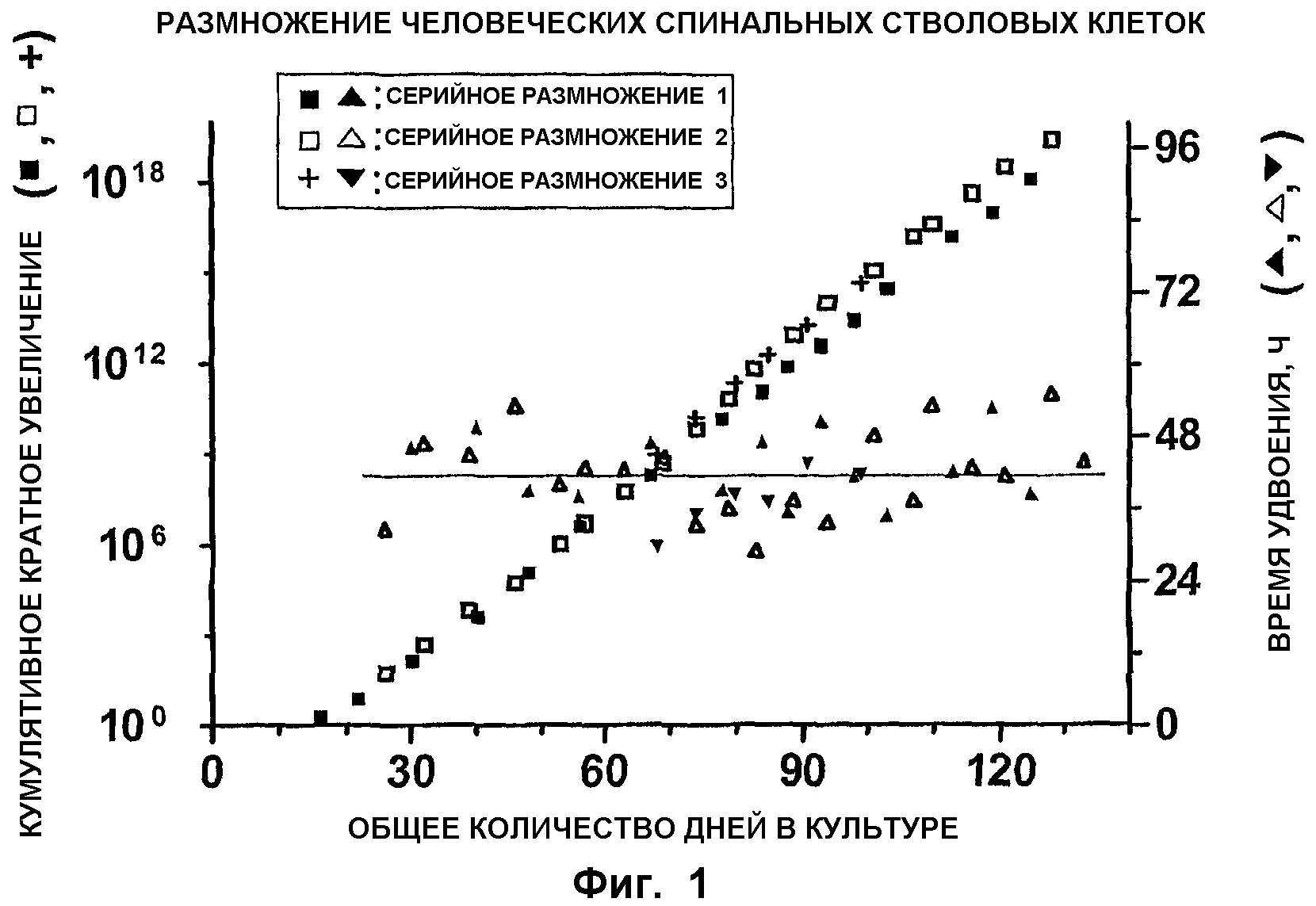
ФИГ.1. Размножение спинальных стволовых клеток. Линию спинальных недифференцированных клеток-предшественников (известных также как NSC) выделяли из ткани спинного мозга 7-8-дневных post mortem (погибших) эмбрионов и производили серийное пассирование в течение приблизительно 130 дней общего культурального периода. При каждом пассаже количество собранных клеток делили на исходное количество клеток при посеве для получения кратного увеличения количества клеток. Кумулятивное кратное увеличение (левая ось Y) получали умножением кратного увеличения при каждом пассаже. Время удвоения (правая ось Y) количества клеток при каждом пассаже рассчитывали делением кратного увеличения количества клеток на каждый культуральный период (ось X). Указанный процесс повторяли три раза (серийное размножение 1, 2 и 3).
ФИГ.2. Морфология размноженных спинальных стволовых клеток. (А) Фазово-контрастная фотография фиксированной, неокрашенной, размножающейся культуры, объектив 20х. (В) Окрашивание антинестиновыми антителами.
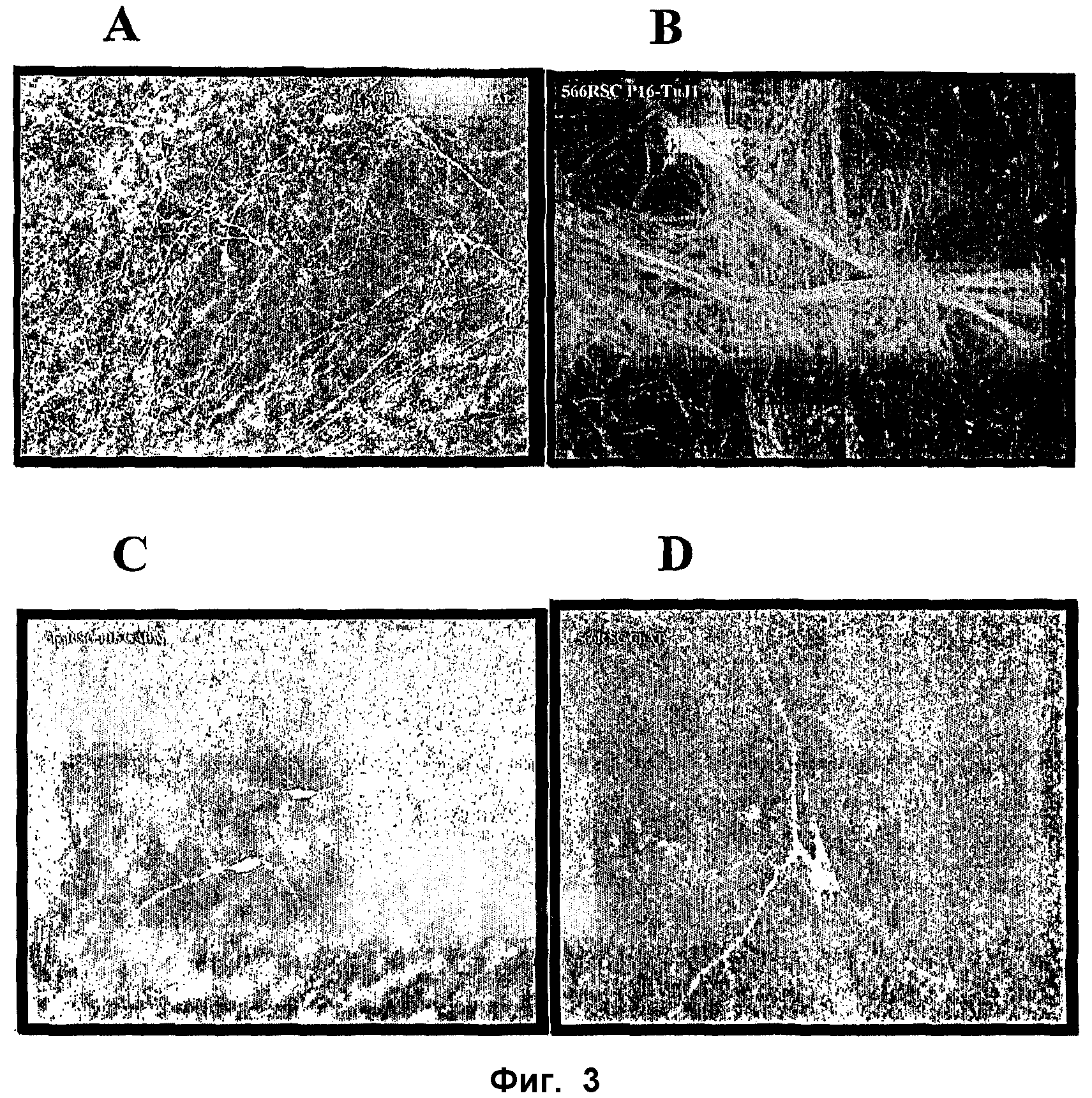
ФИГ.3. Определение характеристик дифференцированных культур, полученных из размноженных спинальных стволовых клеток. Размножившиеся клетки пассажа 15-16 дифференцировались приблизительно за 14 дней в культуре, были фиксированы и окрашены с использованием различных специфичных для нейронов антител. (А) Тау и МАР2; (В) тубулин бета типа 3; (С) ГАМК; (D) ацетилхолинтрансфераза.
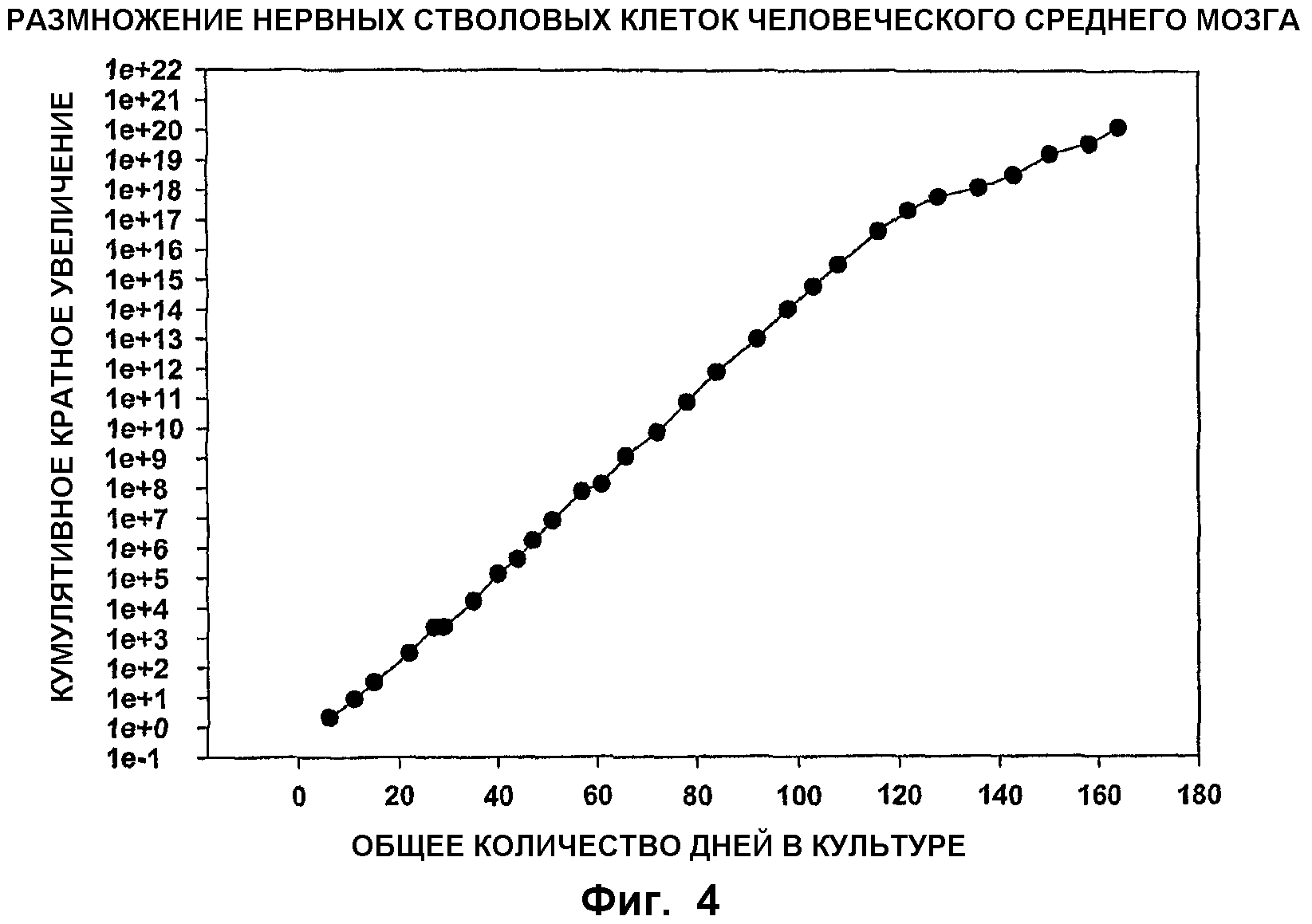
ФИГ.4. Размножение стволовых клеток среднего мозга. Линию недифференцированных клеток-предшественников среднего мозга (известных также как NSC) выделяли из ткани среднего мозга 7-8-дневных погибших (post mortem) эмбрионов и производили серийное пассирование в течение приблизительно 170 дней общего культурального периода. При каждом пассаже количество собранных клеток делили на исходное количество клеток при посеве для получения кратного увеличения количества клеток. Кумулятивное кратное увеличение (ось Y) получали умножением кратного увеличения при каждом пассаже.
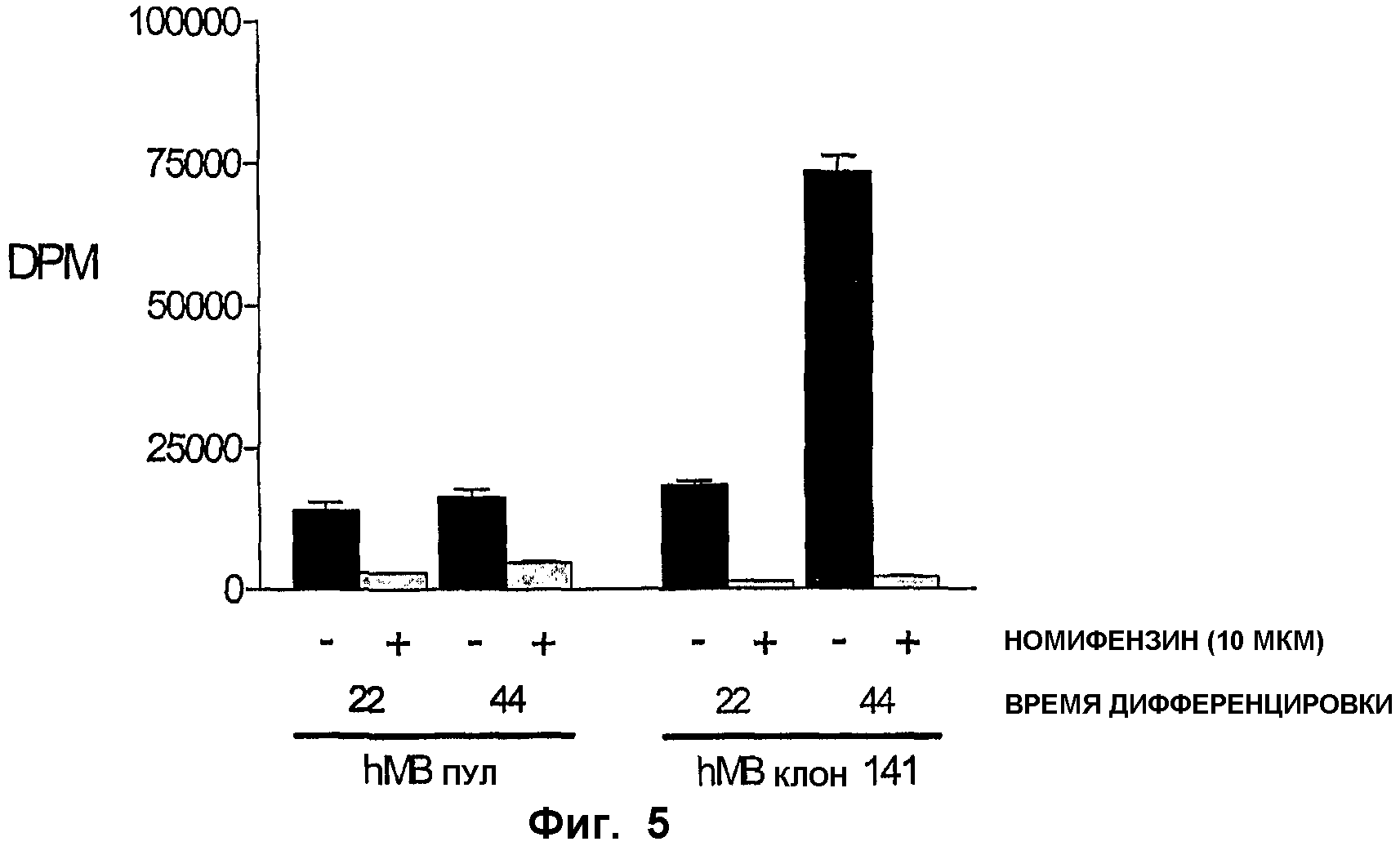
ФИГ.5. Захват дофамина размноженными стволовыми клетками среднего мозга. Активность транспорта дофамина (DAT) в живых клетках определяли в линии стволовых клеток среднего мозга и в одной ее клональной сублинии, которые дифференцировались в течение 22 или 44 дней во время исследования. Клетки инкубировали с радиоактивно меченным дофамином в присутствии (+) или отсутствие (-) ингибитора DAT номифензина (10 мкМ). Клетки промывали для удаления неинкорпорированного дофамина и лизировали с получением сцинтилляционного коктейля. Затем определяли общую радиоактивность клеток имп/мин (dpm) с использованием сцинтилляционного счетчика.
ФИГ.6. Влияние экзогенных факторов на индукцию нейрональной дифференцировки и дофаминергической дифференцировки линий стволовых клеток среднего мозга. Сохраненные в замороженном состоянии нервные стволовые клетки из двух линий стволовых клеток среднего мозга (527RMB и 796RMB) оттаивали и засевали с плотностью 40 000 клеток на лунку в 4-камерные предметные стекла в присутствии bFGF и позволяли пролиферировать в течение 6 дней. Затем bFGF удаляли и клеткам позволяли дифференцироваться в течение дополнительных 8 дней. Клетки разделяли на четыре группы в зависимости от сроков и продолжительности экспозиции в кондиционированной среде для клеток Сертоли (SCCM, в разведении 1:1, в N2). Одну группу подвергали воздействию SCCM во время пролиферации и дифференцировки (условие 1); вторую подвергали воздействию только во время пролиферации (условие 2); третью подвергали воздействию только во время дифференцировки (условие 3); а четвертую не подвергали воздействию SCCM (контроль). Среды меняли через день, а митоген добавляли ежедневно во время пролиферативной фазы. На каждое условие приходилось по четыре лунки для окраски на множество маркеров. После дифференцировки клетки фиксировали с использованием 4% параформальдегида и иммунологически окрашивали с использованием антител к МАР2аb (ФИГ.6А) и тирозин-гидроксилазы (ФИГ.6 В), а также GFAP и GalC. Иммунологически окрашенные клетки подсчитывали с использованием объектива 40х и в каждой лунке подсчитывали по меньшей мере три поля. Было выявлено мало или вовсе не выявлено клеток GFAP+ или GalC+ при анализе клеток при каждом из условий, поэтому указанные антигены были исключены из анализа.
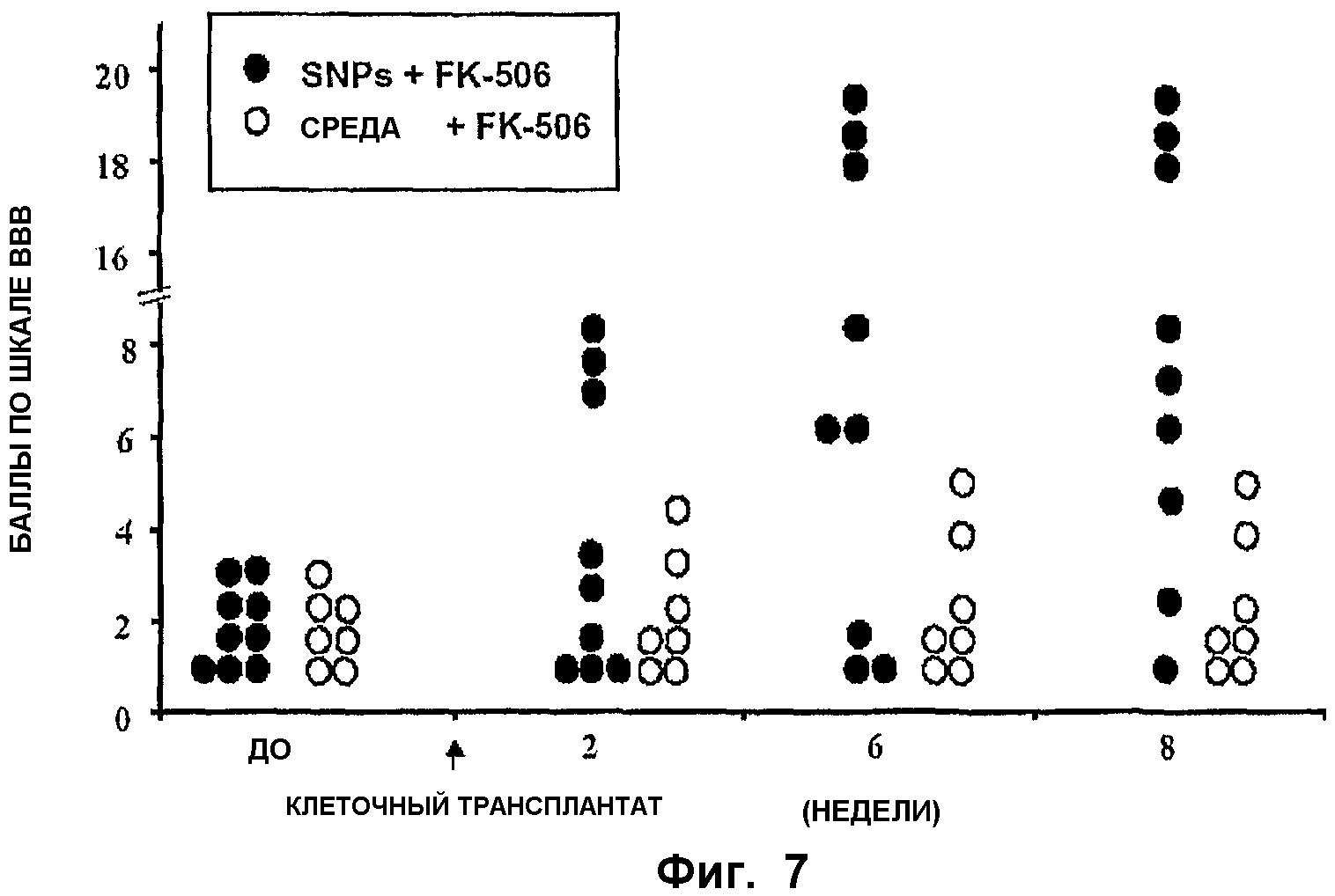
ФИГ.7. Уменьшение спастичности/ригидности и двигательных дефицитов у крыс после трансплантации спинальных стволовых клеток. Крыс со спастическими проявлениями получали с использованием ишемического повреждения поясничного отдела спинного мозга. В одной группе (черный кружок) крысам (n=9) трансплантировали спинальные стволовые клетки, размноженные в культуре (пассаж 16), в то время как другая, контрольная группа (белый кружок, n=7) получала только среды без клеток. Иммунодепрессант, FK506, вводили в количестве 1 мг/кг ежедневно обеим группам в течение всей продолжительности исследования (8 недель). Двигательную координацию отдельных животных оценивали с использованием шкалы ВВВ один раз в неделю.
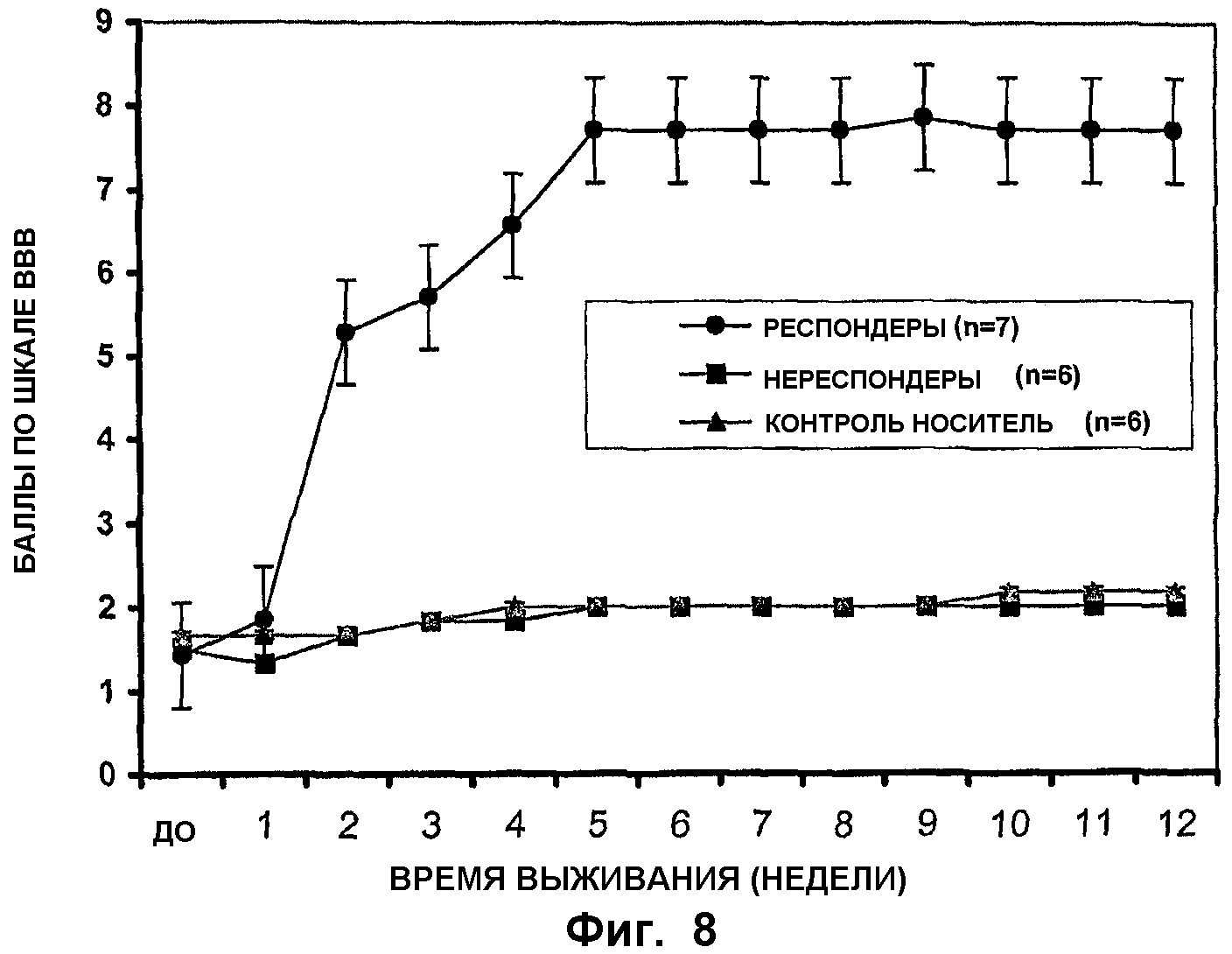
ФИГ.8. Уменьшение спастичности/ригидности и двигательных дефицитов у крыс после трансплантации спинальных стволовых клеток. Крыс со спастическими проявлениями получали с использованием ишемического повреждения поясничного отдела спинного мозга. В одной группе (черный кружок и черный квадрат) крысам (n=13) трансплантировали спинальные стволовые клетки, размноженные в культуре (пассаж 16), в то время как другая, контрольная группа (закрашенный треугольник, n=6) получала только среды без клеток. Иммунодепрессант, FK506, вводили в количестве 3 мг/кг ежедневно обеим группам в течение всей продолжительности исследования (12 недель). Двигательную координацию отдельных животных оценивали с использованием шкалы ВВВ один раз в неделю.
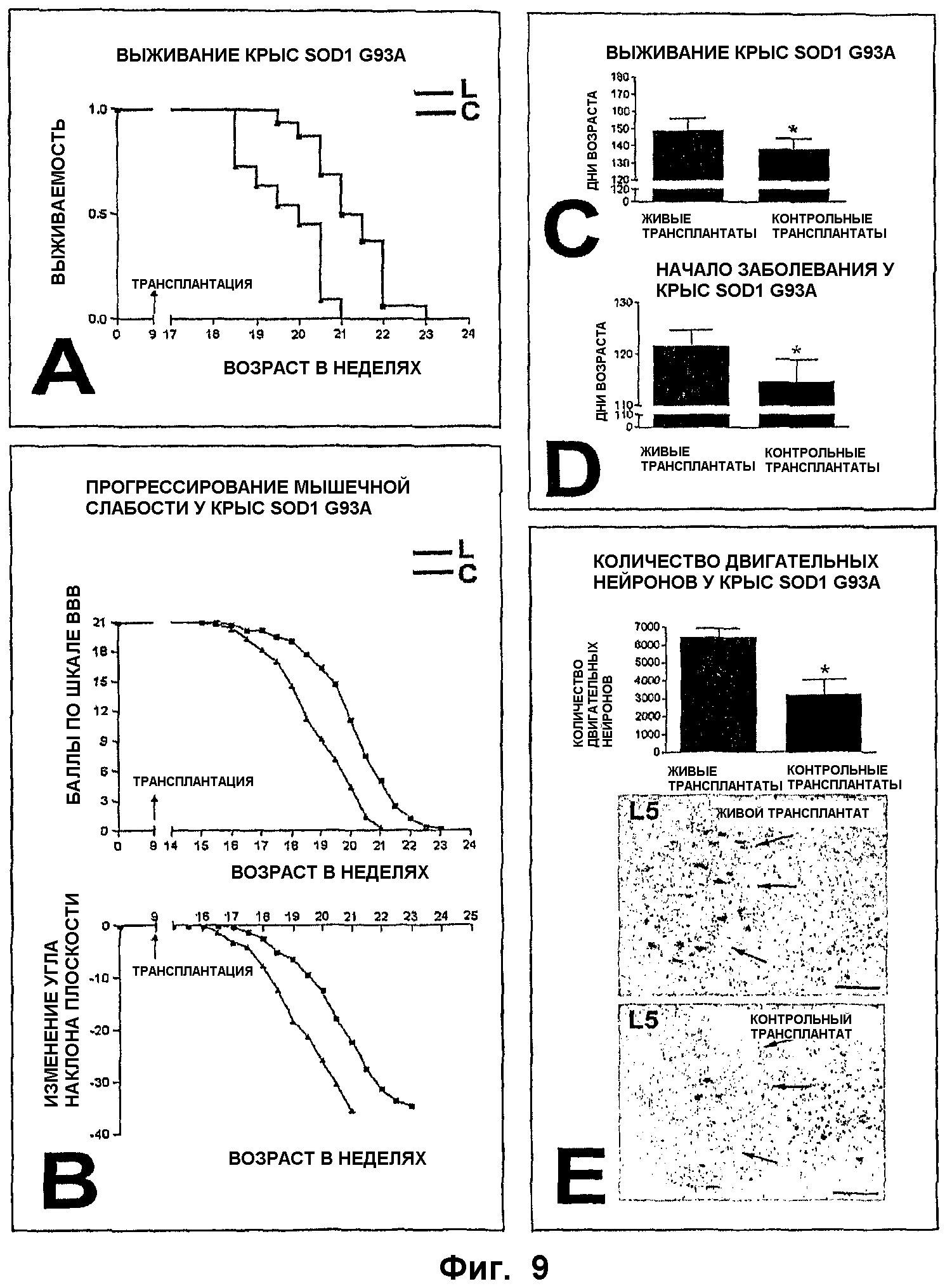
ФИГ.9. Влияние лечения NSC на тяжесть заболевания двигательных нейронов у крыс G93A SOD1, показанное с прогрессионным анализом (А-В), а также с анализом конечных результатов (С-Е) клинических и патологических параметров в случаях с трансплантатами живых клеток (L, красный) и трансплантатами (голубой) мертвых клеток (контроль, С).
А-В. Часть А представляет собой график Каплана-Мейера, показывающий значительное разделение между экспериментальными и контрольными животными в ходе наблюдений (Р=0,0003). Часть В показывает разделение по двум главным параметрам мышечной слабости (балльность по ВВВ и наклонной плоскости) между двумя группами (Р=0,00168 и 0,00125 соответственно).
С-Е. Анализ конечных результатов выживания (С), времени до начала заболевания (D) и количества двигательных нейронов (Е) у экспериментальных и контрольных крыс. Часть С показывает значимую 11-дневную разницу в продолжительности жизни между двумя группами (Р=0,0005). Часть D показывает значимую 7-дневную разницу во времени до начала заболевания между двумя группами (Р=0,0001). Часть Е показывает разницу в 3212 клеток в поясничном выступе между группами живых и мертвых NSC (Р=0,01). Вставка внизу (Е) иллюстрирует разницу в выживаемости двигательных нейронов между репрезентативной экспериментальной (вверху) и контрольной (внизу) крысой в возрасте 128 дней; стрелки указывают латеральную группу двигательных нейронов. Размер срезов: 150 мкм.
ПОДРОБНОЕ ОПИСАНИЕ
Описанные способы относятся к лечению нейродегенеративных состояний. В частности, описанные способы включают способы получения нервных стволовых клеток для трансплантации субъекту, который в этом нуждается. Получение клеток для трансплантации может включать размножение in vitro конкретной популяции клеток до уровня, достаточного для коммерческого использования в качестве средства лечения нейродегенеративных состояний. В одном варианте осуществления настоящего изобретения способ лечения дегенерировавшей или поврежденной невральной области включает в себя доставку в область эффективного количества нервных стволовых клеток, достаточного для улучшения нейродегенеративного состояния.
Используемый в настоящем документе термин «нейродегенеративное состояние» может включать в себя любое заболевание, или расстройство, или симптомы, или причины, или их эффекты, включающие повреждение или разрушение нейронов. Нейродегенеративные состояния могут включать, без ограничения, болезнь Александера, болезнь Альперса, болезнь Альцгеймера, боковой амиотрофический склероз, атаксию-телеангиэктазию, болезнь Канавана, синдром Коккейна, кортикобазальную дегенерацию, болезнь Крейтцфельда-Якоба, болезнь Хантингтона, болезнь Кеннеди, болезнь Краббе, деменцию Lewy Body, болезнь Мачадо-Джозефа, рассеянный склероз, болезнь Паркинсона, болезнь Пелицеуса-Мерцбахера, болезнь Нейманна-Пика, первичный боковой склероз, болезнь Рефсума, болезнь Сандоффа, болезнь Шильдера, болезнь Стила-Ричардсона-Ольжевски, сухотку спинного мозга или любое другое состояние, связанное с повреждением нейронов. Другие нейродегенеративные состояния могут включать или быть вызванными травматическим повреждением спинного мозга, ишемическим повреждением спинного мозга, инсультом, травматическим повреждением головного мозга и наследственными состояниями.
Описанные способы включают применение NSC для улучшения нейродегенеративного состояния. Используемый в настоящем документе термин «NSC» может также относиться к нервным или нейрональным недифференцированным клеткам-предшественникам или нейроэпителиальным клеткам-предшественникам. NSC могут быть функционально определены согласно их способности дифференцироваться в каждый из трех основных клеточных типов ЦНС: нейроны, астроциты и олигодендроциты.
В одном варианте осуществления настоящего изобретения NSC являются мультипотентными, так что каждая клетка обладает способностью дифференцироваться в нейрон, астроцит или олигодендроцит. В одном варианте осуществления настоящего изобретения NSC является бипотентной, так что каждая клетка обладает способностью дифференцироваться в два из трех клеточных типов ЦНС. В одном варианте осуществления настоящего изобретения NSC включают в себя по меньшей мере бипотентные клетки, генерирующие как нейроны, так и астроциты in vitro, и включают в себя по меньшей мере коммитированные клетки, генерирующие нейроны in vitro.
Условия роста могут влиять на направление дифференцировки клеток в сторону одного или другого клеточного типа, что указывает на то, что клетки не являются коммитированными в направлении единственной клеточной линии. При условиях культивирования, которые являются благоприятными для нейрональной дифференцировки, клетки, особенно из ЦНС млекопитающего, являются почти совершенно бипотентными в отношении нейронов и астроцитов, а дифференцировка в олигодендроциты является минимальной. Таким образом, дифференцированные клеточные культуры описанных способов могут превращаться в нейроны и астроциты. В одном варианте осуществления настоящего изобретения соотношение нейронов и астроцитов может приближаться к 50:50.
Описанные способы включают в себя получение NSC, находящихся в таких участках ЦНС млекопитающих, как нейроэпителий. Другие участки ЦНС, из которых можно выделять NSC, включают в себя вентрикулярные и субвентрикулярные зоны ЦНС и другие участки ЦНС, которые содержат митотические предшественники, а также постмитотические нейроны. В одном варианте осуществления настоящего изобретения в описанных способах можно использовать NSC, находящихся в участках ЦНС развивающихся млекопитающих.
В одном варианте осуществления настоящего изобретения NSC получают из области, которая является естественно нейрогенной для желательной популяции нейронов. Желательная популяция клеток может включать в себя клетки конкретного нейронального фенотипа, которые могут замещать или дополнить указанный фенотип, утраченный или неактивный при неврологическом состоянии.
Ряд различных нейрональных подтипов, включая подтипы, пригодные для лечения конкретных нейродегенеративных заболеваний или состояний, можно получить путем выделения NSC из различных областей или участков ЦНС и при различных гестационных возрастах во время развития плода. NSC, выделенные из различных областей или участков ЦНС и в различном гестационном возрасте, используют для оптимального размножения и способности к нейрональной дифференцировке. Одним из признаков ЦНС млекопитающих является многообразие нейрональных подтипов. Одиночная популяция NSC, например, может спонтанно генерировать лишь несколько нейрональных подтипов в культуре. Кроме того, клетки в определенном фетальном гестационном возрасте могут устанавливать физиологическую релевантность культивированных клеток.
В одном варианте осуществления описанных способов клетки для трансплантации субъектам получают из фетального эквивалента поврежденной невральной области. В одном варианте осуществления настоящего изобретения NSC выделяют из участков фетальной ЦНС в гестационном возрасте от приблизительно 6,5 до приблизительно 20 недель. В одном варианте осуществления настоящего изобретения клетки из фетального спинного мозга выделяют в гестационном возрасте от приблизительно 7 до приблизительно 9 недель. Следует принимать во внимание, что доля популяции поддающихся выделению нервных стволовых клеток может варьировать в зависимости от возраста донора. Способность клеточных популяций к размножению может также варьировать в зависимости от возраста донора. Подобная региональная и временная специфичность NSC указывает на то, что NSC ведут себя как ограниченные в своей дальнейшей судьбе недифференцированные клетки-предшественники, но не как «клетки-заготовки» или одиночная популяция клеток.
Доля популяции in vitro, включающая ГАМК-продуцирующие нейроны, обычно является постоянной и составляет приблизительно 5-10%.
NSC вентрального среднего мозга, например, отличаются от NSC, полученных из спинного мозга на одной и той же гестационной стадии. В частности, NSC из вентрального среднего мозга дают начало исключительно дофаминергическим нейронам, экспрессирующим тирозин-гидроксилазу, в то время как NSC из спинного мозга генерируют исключительно холинергические нейроны, продуцирующие ацетилхолин. Оба клеточных типа, однако, одновременно генерируют более широко распространенные глутамат- и ГАМК-продуцирующие нейроны. Таким образом, в одном варианте осуществления настоящего изобретения описанные способы включают в себя получение NSC из вентрального среднего мозга для лечения состояний, облегчаемых или ослабляемых, по крайней мере, частично, имплантацией дофаминергических нейронов, экспрессирующих тирозин-гидроксилазу. Описанные способы дополнительно включают в себя получение NSC из спинного мозга для лечения нейродегенеративных состояний, облегчаемых или ослабляемых, по крайней мере, частично, имплантацией холинергических нейронов, продуцирующих ацетилхолин.
Таким образом, для лечения двигательных расстройств, таких как болезнь Паркинсона, которая характеризуется утратой дофаминергических нейронов, вариант осуществления описанных способов включает в себя использование NSC, полученных из такой области, как вентральный средний мозг, в котором важным является нейрогенез дофаминергических нейронов. Помимо этого NSC можно получить в гестационном возрасте развития плода, во время которого важным является нейрогенез дофаминергических нейронов. Соответственно, в одном варианте осуществления настоящего изобретения описанные способы включают в себя получение NSC из вентрального среднего мозга, полученных в гестационном возрасте от приблизительно 7 до приблизительно 9 недель, для лечения двигательных расстройств.
Для лечения заболеваний двигательных нейронов, таких как боковой амиотрофический склероз или вялая параплегия, вызванных утратой вентральных двигательных нейронов, вариант осуществления описанных способов включает в себя использование NSC, полученных из такой области, как спинной мозг, в котором нейрогенез вентральных двигательных нейронов является существенным, и полученных в таком гестационном возрасте развития плода, во время которого нейрогенез вентральных двигательных нейронов является существенным. Соответственно, в одном варианте осуществления настоящего изобретения NSC выделяют из спинного мозга в гестационном возрасте от приблизительно 7 до приблизительно 9 недель для лечения заболеваний двигательных нейронов.
Следует принимать во внимание, однако, что в некоторых случаях лимиты указанной регионарной специфичности для практических целей являются довольно широкими. Так, NSC из различных областей спинного мозга, таких как шейные, грудные, поясничные и крестцовые сегменты, можно использовать взаимозаменяемым образом для имплантации и лечения в других локализациях, отличных от соответствующего места происхождения NSC. Например, NSC, полученные из шейного отдела спинного мозга, можно использовать для лечения спастичности и/или ригидности путем трансплантации клеток в поясничные сегменты пациента.
NSC также можно выделять из тканей организма после рождения и тканей взрослого организма. NSC, полученные из тканей организма после рождения и тканей взрослого организма, являются количественно эквивалентными с точки зрения их способности к дифференцировке в нейроны и глию, а также характеристик их роста и дифференцировки. Однако эффективность in vitro выделения NSC из различных тканей ЦНС организма после рождения и взрослого организма может быть значительно ниже, чем эффективность выделения NSC из фетальных тканей, которые являются прибежищем наиболее обильной популяции NSC. Тем не менее, как в случае NSC из фетальных тканей, описанные способы дают по меньшей мере приблизительно 30% NSC, полученных из источников новорожденных и взрослых организмов, для дифференцировки в нейроны in vitro. Таким образом, ткани организма после рождения и ткани взрослого организма можно использовать, как описано выше для NSC, полученных из фетальных тканей, но использование фетальных тканей является предпочтительным.
Различные нейрональные подтипы можно получить с использованием манипуляций с эмбриональными стволовыми клетками, размножающимися in vitro. Так, специфические нейрональные подтипы, на основе описанных способов, можно выделять и очищать из других, нерелевантных или нежелательных, клеток для улучшения результатов, при необходимости, и можно использовать для лечения одних и тех же нейродегенеративных состояний.
NSC в описанных способах можно получать из одного участка и трансплантировать в другой участок одного и того же субъекта в качестве аутотрансплантата. Кроме того, NSC в описанных способах можно получать от генетически идентичного донора и трансплантировать в качестве изотрансплантата. Также NSC в описанных способах можно получать от генетически неидентичного члена того же вида и трансплантировать в качестве аллотрансплантата. Альтернативно, NSC можно получать от различных видов животных и трансплантировать в качестве ксенотрансплантата. С разработкой мощных иммунодепрессантов аллотрансплантат и ксенотрансплантат предшественников нервных клеток, таких как предшественники нервных клеток свиньи, можно трансплантировать другим видам млекопитающих.
Образец ткани можно диссоциировать любым стандартным способом. В одном варианте осуществления настоящего изобретения ткань диссоциируют осторожным механическим растиранием с использованием пипетки и физиологического раствора с фосфатным буфером, не содержащего двухвалентных катионов, для получения суспензии диссоциированных клеток. Желательна диссоциация, достаточная для получения преимущественно одиночных клеток, чтобы избежать избыточной локальной плотности клеток.
Для успешного коммерческого использования NSC желательно поддержание здоровых и устойчивых культур, которые демонстрируют стабильные характеристики размножения и дифференцировки в ходе многочисленных последовательных пассажей. Как описано выше, способы культивирования можно оптимизировать, чтобы добиться длительного, стабильного размножения отдельной клеточной линии NSC из различных областей и в различном возрасте развития, в то же время сохраняя их отчетливые свойства недифференцированных предшественников.
При осуществлении указанной цели неожиданно было установлено, что стимуляция адгезии NSC к субстрату вносит свой вклад в ускорение скорости митоза NSC или недифференцированных клеток-предшественников, в результате чего получают более сильную культуру NSC или недифференцированных клеток-предшественников. В частности, помимо избегания избыточной локальной плотности клеток и поддержания концентраций митогена, было установлено, что концентрации белков внеклеточного матрикса влияют на долгосрочную способность NSC к митозу и дифференцировке. Белки внеклеточного матрикса могут включать в себя поли-D-лизин, поли-L-лизин, поли-D-орнитин, поли-L-орнитин, фибронектин и их комбинации. Другие белки внеклеточного матрикса могут включать в себя различные изотипы, фрагменты, рекомбинантные формы или синтетические миметики фибронектина, ламина, коллагена и их комбинации. Альтернативно, или помимо этого, следует принимать во внимание, что описанные способы могут включать в себя любое другое подходящее вещество, которое способно стимулировать эффективную адгезию клеток таким образом, что каждая отдельная клетка прикрепляется к культуральному субстрату в течение всей продолжительности культивирования, не демонстрируя цитотоксичности или задержки деления клеток.
Несмотря на то что белки внеклеточного матрикса могут быть эффективными в отношении стимуляции клеточной адгезии, различные аминокислотные полимеры, такие как поли-L/D-орнитин или поли-L/D-лизин, могут быть токсичными для клеток при определенных концентрациях для каждой отдельной клеточной линии.
Продолжительность инкубирования также может влиять на конечное количество полимера, отложившегося на поверхности чашки, что влияет на жизнеспособность клеток. Для NSC, используемых в описанных способах, концентрации полимера могут находиться в пределах от приблизительно 0,1 мкг/мл до приблизительно 1 мг/мл. В одном варианте осуществления настоящего изобретения 100 мкг/мл поли-D-лизина растворяют в 0,01М буфере HEPES или в воде при нейтральном значении рН и наносят на культуральный сосуд. Культуральный сосуд инкубируют при комнатной температуре в течение 1 часа. Культуральный сосуд затем тщательно ополаскивают водой и высушивают перед использованием.
Описанные способы также могут включать в себя двойное покрытие культуральных сосудов белком внеклеточного матрикса. В одном варианте осуществления настоящего изобретения культуральный сосуд обрабатывают фибронектином или производным фибронектина с последующим нанесением поли-L/D-орнитина или поли-L/D-лизина, описанным выше. В одном варианте осуществления настоящего изобретения используют фибронектиновый белок, полученный из человеческой плазмы. Следует принимать во внимание, однако, что можно использовать любую другую подходящую форму или источник фибронектинового белка, такой как свиной или бычий фибронектин, рекомбинантный фибронектин, фрагменты фибронектиновых белков, синтетические пептиды и другие химические миметики фибронектина. В одном варианте осуществления настоящего изобретения можно наносить от приблизительно 0,1 мкг/мл до приблизительно 1 мг/мл фибронектина.
В одном варианте осуществления настоящего изобретения, включающем в себя размножение NSC из ткани спинного мозга, культуральный сосуд обрабатывают 100 мкг/мл поли-D-лизина в течение периода времени, достаточного для того, чтобы внеклеточный белок связался и сформировал покрытие на культуральном сосуде. Указанный период времени может составлять приблизительно от пяти минут до трех часов. Культуральный сосуд затем можно промыть водой. После сушки на воздухе культуральный сосуд можно обработать приблизительно 25 мг/мл фибронектина в течение периода времени приблизительно от пяти минут до нескольких часов при комнатной температуре или приблизительно 1 мг/мл фибронектина в течение периода времени приблизительно от 1 часа до нескольких дней при 37°С. Впоследствии фибронектин можно удалить, а культуральный сосуд можно промыть по меньшей мере один раз или хранить в PBS до использования.
Альтернативно, фибронектин можно добавлять в ростовую среду в качестве растворимого фактора, непосредственно поставляемого клеткам. В данном варианте осуществления настоящего изобретения NSC можно размножать добавлением 1 мкг/мл фибронектина в ростовую среду, помимо или вместо обработки культуральных сосудов фибронектином. Добавление белка, способствующего прикреплению, в ростовую среду в качестве растворимого фактора во время посева клеток на планшеты является особенно выгодным для культивирования NSC в промышленном масштабе вследствие относительно короткого срока хранения сосудов с фибронектиновым покрытием. Данный способ также является подходящим для производства линии нервных стволовых клеток, требующих соблюдения значительно точных условий и обеспечения воспроизводимости так, как это требуется для протоколов цГМФ и для производства линии нервных стволовых клеток для терапевтического применения.
В одном варианте осуществления настоящего изобретения выделенные NSC добавляют в культуральный сосуд с плотностью от приблизительно 1000 до приблизительно 20000 клеток на квадратный см. Указанная плотность способствует равномерной дисперсии и адгезии отдельных клеток в культуральном сосуде, позволяется избежать локализованных концентраций клеток и обогатить культуру для NSC.
В одном варианте осуществления настоящего изобретения NSC размножают в отсутствие сыворотки. В одном варианте осуществления настоящего изобретения NSC культивируют в определенной, не содержащей сыворотки, среде, чтобы избежать воздействия на NSC концентраций сыворотки, достаточных для дестабилизации способности NSC к митозу и дифференцировке. Помимо этого, воздействие на NSC определенными факторами роста, такими как лейкозный ингибирующий фактор (LIF) или цилиарный нейротрофический фактор (CNTF), также может дестабилизировать NSC и его следует избегать.
Митогены можно добавлять в культуру на любой стадии культивирования для усиления роста NSC. Митогены могут включать в себя основной фактор роста фибробластов (bFGF), кислотный фактор роста фибробластов (aFGF), фактор роста эпидермиса (EGF), трансформирующий фактор роста-альфа (TGFα) и их комбинации.
NSC описанных способов можно выращивать и размножать по меньшей мере в двух различных культуральных формах. Одна форма культуры включает в себя агрегированную форму, обычно называемую кластерной, агрегированную форму, называемую суспензионной культурой. Другая форма культуры включает в себя диспергированную, неагрегированную форму, называемую прикрепленной культурой.
В диспергированной прикрепленной культуре NSC описанных способов клетки образуют монослой, в котором отдельные клетки сначала контактируют с культуральным субстратом непосредственно. Со временем, после периода инкубации, клетки могут спорадически образовывать кластеры, в которых по меньшей мере один дополнительный слой клеток образуется на нижнем слое, в то же самое время, когда клетки нижнего слоя в индивидуальном порядке прикрепляются к субстрату. Указанное образование кластеров наблюдается в особенности тогда, когда культуру инокулируют с высокой плотностью клеток или позволяют культуре достигать высокой плотности клеток, что в одном варианте осуществления настоящего изобретения сводится к минимуму для оптимального размножения NSC или недифференцированных клеток-предшественников или для оптимального поддержания мультипотентной способности NSC. В диспергированной прикрепленной культуре одного варианта осуществления описанных способов NSC дают возможность делиться с частотой менее приблизительно одного раза в четыре дня.
Другим отличительным признаком диспергированной прикрепленной культуры является то, что NSC описанных способов делятся с образованием дочерних клеток, каждая из которых сохраняет свою мультипотентную способность. В одном варианте осуществления настоящего изобретения диспергированная прикрепленная культура NSC описанных способов включает в себя способность к размножению, составляющую по меньшей мере 20 удвоений клеток при отсутствии значительной дифференцировки. Большинство NSC можно размножать со скоростью свыше по меньшей мере 50 удвоений клеток до того, как они утратят свой нейрогенный потенциал. В одном варианте осуществления настоящего изобретения NSC, размноженные в диспергированной прикрепленной культуре описанных способов, демонстрируют усиленную нейрональную дифференцировку, обеспечивая в одном варианте осуществления настоящего изобретения по меньшей мере приблизительно 30% нейрональную дифференцировку. Во многих случаях по меньшей мере 50% NSC дифференцируется в нейроны. Несмотря на то что диспергированная прикрепленная форма культуры является более предпочтительной формой культуры, различные способы культивирования могут позволить выделять различающиеся в естественных условиях клеточные популяции с различными потенциалами дифференцировки как in vitro, так и in vivo.
Настоящий способ также позволяет осуществлять клональное выделение NSC из ряда источников без генетической модификации или включения питающих клеток. Так, очень малое количество, предпочтительно менее 1000 клеток на квадратный сантиметр клеток, можно засевать на планшет для культивирования клеток, подготовленный, как описано выше.
В течение нескольких дней после засевания NSC клетки могут формировать хорошо изолированные колонии. Колонии можно выращивать до желательного размера, такого как по меньшей мере от приблизительно 250 до приблизительно 2000 клеток. В одном варианте осуществления настоящего изобретения по меньшей мере одну колонию клеток отбирают вручную и инокулируют индивидуально на новый планшет для культивирования клеток, например в многолуночный планшет.
Выделенные клональные популяции можно размножать серийным пассированием и использовать для создания множества линий нервных стволовых клеток. Множество подобных клональных клеточных линий было выделено из различных областей ЦНС млекопитающего, включая спинной мозг, средний мозг и задний мозг. Клональные клеточные линии являются пригодными для обогащения конкретного клеточного фенотипа, например, для обеспечения более высокой доли нейрональных подтипов. Например, клональные клеточные линии, обогащенные в отношении дофаминергических нейронов, экспрессирующих тирозин-гидроксилазу, ГАМК-эргических нейронов, холинергических нейронов и нейронов других специфических фенотипов, могут быть выделены с использованием описанных способов.
В одном варианте осуществления настоящего изобретения поликлональную или моноклональную линию нервных стволовых клеток можно индуцировать в направлении дальнейшего обогащения в отношении конкретного подтипа нейронов. Ряд факторов роста, химических агентов и природных веществ прошли скрининг на предмет выявления эффективных индукторов конкретных нейронов, таких как дофаминергические нейроны, экспрессирующие тирозин-гидроксилазу, и холинергические нейроны, продуцирующие ацетилхолин, из NSC среднего мозга или спинного мозга. Фактор, или химический агент, или их комбинацию можно ввести во время митотической фазы и/или фазы дифференцировки NSC. В одном варианте осуществления настоящего изобретения линию нервных стволовых клеток для дофаминергического фенотипа дополнительно обогатили в качестве донорской популяции для лечения болезни Паркинсона.
Различные нейрональные подтипы можно получить выделением стволовых клеток, имеющих желательный паттерн дифференцировки in vitro. Результаты in vitro могут в значительной степени воспроизводиться in vivo. Это означает, что потенциальную эффективность стволовых клеток in vivo можно предсказать по паттерну дифференцировки стволовых клеток in vitro. После инъекции живым постнатальным субъектам, NSC, как в недифференцированном, так и в преддифференцированном состоянии, во многом демонстрируют in vivo паттерн дифференцировки, наблюдаемый in vitro. Так, NSC, дающие начало нейронам, продуцирующим тирозин-гидроксилазу in vitro, также генерируют нейроны, продуцирующие тирозин-гидроксилазу, in vivo. Наоборот, NSC, не дающие начало нейронам, продуцирующим тирозин-гидроксилазу in vitro, не продуцируют нейроны, продуцирующие тирозин-гидроксилазу, in vivo.
Однако сигналы дифференцировки, присутствующие in vitro, ограничены по сравнению с условиями in vivo. Так, значительная фракция дифференцированных нейронов может не экспрессировать главный нейромедиаторный фенотип. Дополнительные сигналы, такие как сигналы с афферентными или эфферентными нейронами, или агенты, имитирующие указанные природные сигналы, можно использовать для реконфигурации дифференцированных фенотипов как во время митотической стадии NSC, так и во время их дифференцировки. NSC обладают способностью реагировать на сигналы, присутствующие in vivo, а также in vitro. Так, после трансплантации в поврежденный ишемией спинной мозг спинальные NSC генерируют значительно более высокую долю ГАМК-продуцирующих нейронов, чем in vitro. Таким образом, NSC обладают пластичностью. Указанная пластическая природа NSC является характеристикой их мульпотентности, и в качестве таковой указанную пластичность можно использовать для идентификации фенотип-индуцирующих агентов и условий, которые затем можно объединять с популяцией NSC для перенаправления ее свойств.
В одном варианте осуществления настоящего изобретения подобное перепрограммирование включает воздействие на NSC из ткани спинного мозга для получения усиленной экспрессии фенотипов двигательных нейронов. Условия воздействия включают в себя совместное культивирование NSC или их дифференцированных клеток с различными мышечными клетками или клетками, полученными из периферической нервной системы, такими как нервные клетки гребня или ганглионарные нейроны. На NSC также можно воздействовать смесями молекул, о которых известно, что они экспрессируются и вырабатываются в двигательных нейронах или в спинном мозге для усиления экспрессии NSC фенотипов двигательных нейронов.
Для того чтобы индуцировать усиление экспрессии NSC дофаминергического фенотипа среднего мозга, на NSC воздействуют такими молекулами, как литий, GDNF, BDNF, плейотропин, эритропоэтин, кондиционированная среда от клеток, таких как клетки Сертоли, или любыми другими подходящими химическими агентами или клетками, полученными путем скрининга, или их комбинациями. Указанный стимул может побудить трансплантированные NSC экспрессировать и поддерживать дофаминергический фенотип in vivo.
В одном варианте осуществления настоящего изобретения NSC описанных способов могут включать в себя преддифференцированные клетки для трансплантации. Для максимального сбора клеток и простоты процедуры для трансплантации собирают слившуюся культуру, которая включает в себя преимущественно популяцию недифференцированных клеток. Следует принимать во внимание, однако, что минимальная популяция клеток, только что начавших спонтанно дифференцироваться, также может существовать вследствие повышенной плотности клеток.
В одном варианте осуществления настоящего изобретения пассирование NSC включает в себя сбор или открепление клеток от субстрата. В одном варианте осуществления настоящего изобретения описанные способы включают в себя сбор или открепление клеток от субстрата с использованием по меньшей мере одного фермента. Ферментативной обработки можно избежать, если время клеточного цикла NSC является достаточно непродолжительным, чтобы инактивировать рецепторы митогена на поверхности клеток.
В одном варианте осуществления настоящего изобретения после сбора клеток из культуры клетки концентрируют путем кратковременного центрифугирования. Затем клетки можно дополнительно отмыть и ресуспендировать в конечном, пригодном для клинического использования, растворе, таком как физиологический раствор, физиологический раствор с фосфатным буфером, или, альтернативно, ресуспендировать в растворе для хранения или гибернации. Альтернативно, клетки можно ресуспендировать в среде для замораживания, такой как среды с диметилсульфоксидом или любым другим подходящим криопротектором, и заморозить для хранения.
Раствор для гибернации изготавливают таким образом, чтобы он поддерживал жизнеспособность живых клеток в течение продолжительного периода времени. В одном варианте осуществления настоящего изобретения раствор для хранения можно адаптировать таким образом, чтобы использовать для транспортировки живых клеток в виде готовой для применения композиции в место осуществления хирургической трансплантации для немедленного использования. Подходящие условия для транспортировки живых клеток в отдаленное учреждение также включают в себя изоляционное устройство, которое может поддерживать стабильную температуру в пределах от приблизительно 0°С до приблизительно 20°С в течение по меньшей мере 24 часов. Живые клетки, хранившиеся при температуре в пределах от приблизительно 0°С до приблизительно 8°С в течение от приблизительно 24 часов до приблизительно 48 часов, являются пригодными для трансплантации для лечения заболевания или состояния.
В одном варианте осуществления настоящего изобретения клетки концентрируют в растворе, таком как пригодные для клинического использования, гибернации или хранения растворы, описанные выше. В одном варианте осуществления настоящего изобретения клетки концентрируют до подходящей плотности клеток, которая может быть такой же, как плотность клеток для введения, или отличаться от нее. В одном варианте осуществления настоящего изобретения плотность клеток для введения может варьировать от приблизительно 1000 клеток на микролитр до приблизительно 1000000 клеток на микролитр, в зависимости от таких факторов, как место инъекции, нейродегенеративный статус места инъекции, минимальная доза, необходимая для благоприятного эффекта и соображения, касающиеся токсичности и побочных эффектов. В одном варианте осуществления настоящего изобретения описанные способы включают в себя инъецирование клеток с плотностью клеток от приблизительно 5000 клеток на микролитр до приблизительно 50000 клеток на микролитр.
Объем сред, в которых размноженные клетки суспендируют для доставки в область лечения, можно в настоящем документе назвать объемом инъекции. Объем инъекции зависит от места инъекции и дегенеративного статуса ткани. Более конкретно, нижний лимит объема инъекции можно определить посредством практических манипуляций с вязкими суспензиями с высокой плотностью клеток с использованием жидкости, а также с учетом тенденции к образованию клетками кластеров. Верхний лимит объема инъекции можно определить лимитами компрессионного сдавливания, вызываемого объемом инъекции, которое необходимо, чтобы избежать повреждения ткани хозяина, а также практическим временем оперативного вмешательства.
Низкая выживаемость донорских клеток при использовании известных способов сделала необходимой доставку большого количества клеток в относительно малую область в попытке эффективного лечения. Объем инъекции, однако, представляет собой гидростатическое давление, возникающее в ткани хозяина, а длительное время инъекции, связанное с большими объемами инъекции, увеличивает хирургический риск. Кроме того, чрезмерная инъекция донорских клеток приводит к сдавливанию и последующему повреждению паренхимальной ткани хозяина. В попытке компенсировать ограничения, накладываемые объемом, новые способы потребовали изготовления суспензий для инъекций с высокой плотностью клеток. Однако высокая плотность клеток способствует образованию плотных кластеров трансплантированных клеток и ингибирует миграцию или распространение клеток, препятствуя эффективному лечению за пределами ограниченной области и плавной интеграции в ткань хозяина.
Напротив, благодаря улучшению выживания in vivo клеток, полученных описанными способами, для инъекции требуется меньшее количество клеток. Фактически, в три-четыре раза большее количество инъецированных клеток, как было показано, существует спустя шесть месяцев после инъекции, что показывает значимое количественное выживание при использовании описанных способов. Также благодаря количественному выживанию можно достигать воспроизводимого введения желательных доз клеток. Соответственно, в одном варианте осуществления настоящего изобретения клетки концентрируют до плотности от приблизительно 1000 до приблизительно 200000 клеток на микролитр. В одном варианте осуществления настоящего изобретения от приблизительно 5000 до приблизительно 50000 клеток на микролитр использовали для эффективного приживления трансплантата. В другом варианте осуществления настоящего изобретения используют приблизительно от 10000 до 30000 клеток на микролитр. В одном варианте осуществления настоящего изобретения клетки можно доставлять в область лечения, суспендированными в объеме инъекции менее приблизительно 100 микролитров на один участок инъекции. Например, при лечении нейродегенеративных состояний у человека, когда можно производить множество инъекций билатерально вдоль спинномозгового пути, можно использовать объем инъекции от 0,1 до приблизительно 100 микролитров на участок инъекции.
Любое подходящее устройство для инъецирования клеток в желательную область можно применять в описанных способах. В одном варианте осуществления настоящего изобретения используют шприц, способный доставлять субмикролитровые объемы в течение определенного периода времени при практически постоянной скорости потока. Клетки можно загружать в устройство через иглу, или гибкий катетер, или любое другое подходящее передаточное устройство.
В одном варианте осуществления настоящего изобретения желательное место инъекции для лечения нейродегенеративного состояния включает в себя по меньшей мере одну область спинного мозга. В одном варианте осуществления настоящего изобретения клетки имплантируют по меньшей мере в один конкретный сегмент или участок спинного мозга, такой как шейный, грудной, поясничный или крестцовый отдел спинного мозга. В поясничном отделе, например, только пять пар нервных путей пересекают костный канал позвонков; при этом каждая пара нервных путей существует в позвоночнике на каждом поясничном уровне, распределенном по обширной области. Благодаря более низкой плотности нервных путей в поясничном отделе спинного мозга поясничный отдел особенно хорошо подходит для выбора безопасного участка для инъекции клеток. В одном варианте осуществления настоящего изобретения клетки имплантируют в промежуточную зону паренхимы спинного мозга.
В одном варианте осуществления настоящего изобретения клетки инъецируют приблизительно в 5-50 участков. В одном варианте осуществления настоящего изобретения клетки инъецируют приблизительно в 10-30 участков на каждой стороне канатика. По меньшей мере два участка могут разделяться расстоянием от приблизительно 100 микрон до приблизительно 5000 микрон. В одном варианте осуществления настоящего изобретения расстояние между участками инъекций составляет от приблизительно 400 до приблизительно 600 микрон. Расстояние между участками инъекций можно определить, исходя из соображений практически непрерывного и смежного присутствия донорских клеток на протяжении спинальных сегментов и из среднего объема инъекций, для которых было показано приблизительно 2-3-месячное выживание на экспериментальных животных, таких как крысы или свиньи. В одном варианте осуществления настоящего изобретения клетки инъецируют вдоль обеих сторон средней линии спинного мозга в пределах длины по меньшей мере нескольких поясничных сегментов, пригодных для лечения такого симптома, как спастичность/ригидность, или для выживания двигательных нейронов. Актуальное количество инъекций для людей можно экстраполировать, исходя из результатов, полученных на экспериментальных животных.
В одном варианте осуществления настоящего изобретения участок инъекции, являющийся мишенью, находится в сером веществе спинного мозга. Внутри серого вещества кончик иглы можно расположить таким образом, чтобы поместить NSC на конкретные уровни пластинки дуги позвоночника. Например, для доставки ГАМК/глицин-продуцирующих нейронов для лечения спастичности/ригидности NSC доставляют в область, охватывающую пластинку дуги позвоночника V-VII. Альтернативно, NSC можно доставлять в дорсальный рог серого вещества различных спинальных сегментов, от шейных до поясничных, или поблизости от него, с целью лечения невропатической боли или хронической боли. Альтернативно, NSC можно доставлять в вентральный рог серого вещества различных спинальных сегментов, от шейных до поясничных, или поблизости от него с целью лечения заболеваний двигательных нейронов, таких как ALS.
Клетки описанных способов могут генерировать большие количества нейронов in vivo. В случае, когда NSC не являются открыто преддифференцированными до трансплантации, NSC могут пролиферировать в объеме до двух-четырех делений in vivo перед дифференцировкой, что дополнительно увеличивает количество эффективных донорских клеток. После дифференцировки нейроны секретируют специфичные нейромедиаторы. Помимо этого, нейроны секретируют в среду, окружающую трансплантат in vivo, факторы роста, ферменты и другие белки или вещества, которые являются благоприятными при различных состояниях. Соответственно, ряд состояний можно лечить описанными способами благодаря способности имплантированных клеток генерировать большие количества нейронов in vivo и благодаря тому, что нейродегенеративные состояния могут вызываться или приводить к утрате элементов, включая полученные из нейронов элементы. Таким образом, субъектов, страдающих дегенерацией тканей ЦНС из-за утраты указанных полученных из нейронов элементов, таких как факторы роста, ферменты и другие белки, можно эффективно лечить описанными способами.
Состояния, реагирующие на факторы роста, ферменты и другие белки или вещества, секретируемые имплантированными нейронами, включают наследственные лизосомальные заболевания, такие как болезнь Тея-Сакса, болезнь Нейманна-Пика, болезнь Баттена, болезнь Крабба, атаксию и другие заболевания.
Кроме того, описанные способы лечения включают в себя имплантацию клеток, размноженных in vitro, которые могут замещать поврежденные или дегенерировавшие нейроны, оказывать ингибирующее или стимулирующее действие на другие нейроны и/или высвобождать трофические факторы, которые вносят свой вклад в регенерацию нейронов.
Вариант осуществления настоящего изобретения включает в себя обеспечение дополнительными двигательными нейронами в качестве замещения поврежденных или дегенерировавших нейронов. Например, описанные способы включают в себя обеспечение достаточной невральной инфраструктуры внутри патологической полости спинного мозга для заполнения образующихся полостей. Нейрональная инфраструктура является достаточной, если она способна замедлять увеличение патологической полости, связанной с сирингомиелией, вызванной травматическим повреждением спинного мозга, наследственными состояниями или любой другой причиной. Следует принимать во внимание, что обеспечение достаточной невральной инфраструктуры также помогает облегчить дальнейшие осложнения, возникающие вследствие дегенерации спинного мозга.
Не все NSC являются терапевтическими для данного заболевания. Типы нейрональных популяций, пораженных при различных заболеваниях, могут быть различными. Таким образом, терапевтически эффективная донорская популяция NSC вносит свой вклад в замещение утраченного нейронального элемента. Например, лечение спастичности, припадков, двигательных расстройств и других расстройств, связанных с гиперактивностью мышц, может включать в себя обеспечение терапевтически эффективного количества клеток, способных дифференцироваться в ингибирующие нейроны, продуцирующие ГАМК или глицин. Различающиеся популяции можно оценивать in vitro путем изучения дифференцированного нейронального фенотипа. Паттерн дифференцировки in vitro затем используется для прогнозирования эффективности клеток в отношении генерации соответствующего фенотипа in vivo, не только с точки зрения подходящего нейромедиаторного фенотипа, но также с точки зрения подходящей морфологии, миграции и других фенотипических характеристик нейронов.
В одном варианте осуществления настоящего изобретения имплантируют NSC, которые способны генерировать нейрональный подтип, соответствующий поврежденным или разрушенным нейрональным подтипам, связанным с этиологией симптомов. Например, гиперактивность возбуждающих цепей у субъектов может быть вызвана наследственными состояниями или нейрональным повреждением вследствие спинальной травмы, оперативных вмешательств на грудной/торакоабдоминальной аорте, инсульта, эпилепсии, травмы головного мозга, болезни Хантингтона, недержания мочи, гиперактивной перистальтики кишечника и других неконтролируемых сокращений мышц, вызванных повреждением или наследственными состояниями. Спастичность, припадки или другая гиперактивность наблюдаются в головном мозге, в отличие от спинного мозга, имеют различную этиологическую природу. Очаговую эпилепсию, например, как полагают, вызывает дисрегулированная гиперактивность вследствие недостатка контролируемого ГАМК тонального контроля над цепью. С данной целью описанные способы включают в себя обеспечение пораженных областей ингибирующими нейромедиаторами, такими как ГАМК или глицин, путем трансплантации размноженных in vitro NSC. В случае спастичности, припадков и другой гиперактивности, например, количество NSC, которые способны дифференцироваться в ингибирующие нейроны, такие как ГАМК-продуцирующие или глицин-продуцирующие нейроны, генерируют in vitro для трансплантации с целью ослабления по меньшей мере одной гиперактивной невральной цепи, связанной со спастичностью, припадками и другой нейрональной гиперактивностью. Описанные способы могут, таким образом, применяться для лечения эпилепсии и сходных с нейродегенеративными состояниями припадков.
Описанные способы также можно использовать для лечения пареза, паралича, спастичности, ригидности или любых других двигательных, речевых или когнитивных симптомов, вызванных церебральной ишемией. Церебральная ишемия может наблюдаться в результате инсульта головного мозга или в результате сердечного приступа, при котором циркуляция крови в головном мозге прерывается на значительный период времени. Указанная ишемия, таким образом, является аналогичной ишемии спинного мозга, описанной выше. У некоторых субъектов, перенесших инсульт, развиваются припадки центрального происхождения, а также другие дефициты, такие как потеря памяти, паралич или парез. Указанные дефициты после церебральной ишемии также, вероятно, связаны с избирательной утратой ингибирующих вставочных нейронов в гиппокампе и/или других областях головного мозга. Таким образом, описанные способы можно использовать для лечения субъектов, перенесших инсульт, страдающих парезом, параличом, спастичностью или другими двигательными, речевыми и когнитивными симптомами.
В случае пареза, вялой параплегии и других состояний, связанных с утратой контроля над мышечными сокращениями, таких как состояния, вызванные ALS, травматическим повреждением спинного мозга, ишемическим повреждением или наследственными состояниями, описанные способы включают в себя обеспечение нейрональной имплантации для получения значительного трофического влияния, замедляющего утрату двигательных нейронов. В частности, описанные способы облегчают способность трансплантированных NSC секретировать трофические молекулы, которые могут доставляться к дегенерирующим двигательным нейронам в условиях оптимальной биодоступности. Указанные трофические молекулы включают в себя подвергшиеся экзоцитозу супероксид-дисмутазы, такие как супероксид-дисмутаза (SOD1), лизосомальные ферменты и небелковые молекулы, такие как продуцируемые клетками антиоксиданты. Другие трофические факторы, секретируемые трансплантированными клетками, могут включать в себя в целом полученный из клеток нейротрофический фактор (GDNF), полученный из головного мозга нейротрофический фактор (BDNF), сосудистый фактор роста эпидермиса (VEGF), плейотропин, сосудистый фактор роста эндотелия (VEGF), эритропоэтин, мидкин, инсулин, инсулиноподобный фактор роста 1 (IGF-1) и инсулиноподобный фактор роста 2 (IGF-2) или любой другой благоприятный трофический элемент.
Другой фактор, который вносит свой вклад в способность описанных способов лечить широкий ряд нейродегенеративных состояний, включает в себя способность NSC-дифференцированных клеток обширно мигрировать вдоль существующих нейрональных волокон. Миграция трансплантированных клеток приводит к глобальному распределению и интеграции донорских нейронов и/или глии и появлению диспергированного поставщика терапевтического элемента, секретируемого указанными клетками.
Широкая миграция клеток делает возможной глобальную и стабильную доставку ключевых терапевтических белков и веществ по всей нервной системе и организму субъекта, который в этом нуждается. Таким образом, клетки описанных способов представляют собой эффективные средства доставки для терапевтических белков и веществ. Для целей указанной доставки описанные способы включают в себя трансплантацию клеток в различные участки в нервной системе, включая паренхиму ЦНС, желудочки, субдуральное, интратекальное и эпидуральное пространства, в участки периферической нервной системы, а также в области, находящиеся вне нервной системы, включая кишечник, мышцы, эндоваскулярную систему и подкожные участки.
Пример 1. Размножение нервных стволовых клеток/недифференцированных клеток-предшественников спинного мозга
Получают спинной мозг от по меньшей мере одного донора в гестационном возрасте приблизительно 7-8,5 недель. Единственную прилегающую ткань спинного мозга диссоциируют в физиологическом растворе с фосфатным буфером, не содержащем Са++ и Мg++, с использованием механического растирания. Полученную суспензию клеток затем засевают на планшеты для культур тканей, предварительно покрытые поли-L-орнитином или поли-D-лизином и человеческим фибронектином или другими белками внеклеточного матрикса. Обработанные планшеты для культур тканей инкубировали с 100 мкг/мл поли-D-лизина при комнатной температуре в течение 1 часа. Затем их отмывали три раза водой и высушивали. Затем их инкубировали с 25 мг/мл при комнатной температуре в течение 5 минут. Иногда использовали 10 мг/мл фибронектина при комнатной температуре в течение 1 часа. Иногда использовали 1 мг/мл фибронектина при температуре 37°С в течение 18 часов. Культуральные среды, состоявшие из N2 (DMEM/F12 плюс инсулин, трансферрин, селен, путресцин и прогестерон), дополняли человеческим рекомбинантным основным фактором роста фибробластов (bFGF). В одном варианте осуществления настоящего изобретения можно использовать пределы 0,1 нг/мл-100 нг/мл. В одном варианте осуществления настоящего изобретения оптимально используют 10 нг/мл bFGF.
Полученная исходная культура состоит из постмитотических нейронов и пролиферативных NSC в монослое. Впоследствии, после приблизительно пяти - двадцати дней культивирования, делящиеся нестин-позитивные NSC доминируют в культуре над неделящимися нейронами или медленно делящейся глией. Указанные условия культивирования избирательно способствуют размножению NSC. Размножающуюся популяцию NSC пассируют путем мягкого ферментативного воздействия, например, с использованием трипсина. Клетки культивируют в средах, не содержащих сыворотки или практически не содержащих сыворотки. Несмотря на то что низкую концентрацию сыворотки клетки могут переносить, лучше избежать воздействия сыворотки на клетки, поскольку сыворотка содержит множество цитокинов, таких как LIF и CNTF, которые способствуют глиальной дифференцировке NSC. Таким образом, во время пассирования используемый фермент останавливают добавлением специфичного ингибитора фермента, такого как ингибитор трипсина, а не сыворотки. При каждом пассаже подсчитывают количество собранных клеток и фракцию повторно засевают для дальнейшего размножения. Как показано на фиг.1, при использовании способа по настоящему изобретению NSC можно размножать в популяции в объеме, превышающем в 1018 раз, в то же время сохраняя их свойства роста и дифференцировки. Клетки можно размножать воспроизводимым образом. Как показано на фиг.1, серийное пассирование клеток повторяли три раза с воспроизводимой кривой роста и временем удвоения клеток. Во время размножения почти все клетки экспрессируют нестин in vivo маркер митотических нейроэпителиальных клеток и не содержат антигенов дифференцированных нейронов и глии, таких как тубулин типа 3-бета и GFAP. Клетки также иммунологически не окрашиваются на PSA-NCAM, возможный маркер коммитированных нейрональных предшественников, на 04 и GalC, маркеры олигодендроцитов, и RC2, маркер радиальной глии. Таким образом, по результатам иммунологического окрашивания NSC стабильно сохраняют свой профиль экспрессии антигенов в течение пролонгированного периода размножения. Пример морфологии и экспрессии нектина показан на фиг.2А и В соответственно.
Пример 2. Дифференцировка нервных стволовых клеток/недифференцированных клеток-предшественников спинного мозга
В любой момент во время размножения NSC культуры можно дифференцировать посредством изъятия из культуры митогена, такого как bFGF. Дифференцировка NSC происходит в течение приблизительно 1-3 дней после изъятия митогена, и отличающиеся друг от друга гетерогенные морфологии клеток являются несомненными. Приблизительно на 4-7 день дифференцировки нейрон-специфичные антигены, такие как МАР2с, тау и бета-тубулин типа III, можно визуализировать посредством иммунологического окрашивания. Приблизительно на 12-14 день удлиненные, растущие в виде пучка аксональные отростки отчетливо видны в культуре вместе с ясной поляризацией движения субклеточного белка. Приблизительно на 28 день синаптические белки, такие как синапсин и синаптофизин, локализуются в аксональных окончаниях, что проявляется в виде пятнистого окрашивания. Дополнительный питающий подслой астроцитов можно обеспечить для дальнейшей стимуляции долгосрочного созревания нейронов. Как показано на фиг.3, дифференцировка спинальных NSC генерирует смешанные культуры нейронов и глии, в которых нейроны надежно экспрессируют нейрон-специфичные антигены, такие как тау, МАР2аb (А) и бета-тубулин типа 3 (В), и включает приблизительно 50% культуры. Как показано на фиг.ЗВ, культура спонтанно генерирует длинные, собранные в пучки канатики аксонов, которые имеют протяжение в несколько сантиметров. Как показано на фиг.3С, значительная доля нейронов является ГАМК-эргической. Холинергические двигательные нейроны также присутствуют в культуре (фиг.3D). Присутствие в культуре значительного количества ГАМК-эргических нейронов прогнозирует пригодность спинальных NSC для лечения различных неврологических состояний, вызванных уменьшением выработки ГАМК в определенной цепи. Подобно этому, присутствие холинергических нейронов показывает, что спинальные NSC способны к дифференцировке в двигательные нейроны, и прогнозирует их пригодность для лечения различных заболеваний двигательных нейронов, вызванных постепенной дегенерацией двигательных нейронов. Для лечения NSC размножают в присутствии или в отсутствие других условий, усиливающих фенотип, собирают и инъецируют в нейрональную область дефицита.
Пример 3. Размножение нервных стволовых клеток/недифференцированных клеток-предшественников среднего мозга
Получают ткань среднего мозга от одного донора в гестационном возрасте 7-8,5 недель. NSC из ткани среднего мозга получают, как описано в примере 1. Клетки серийно пассируют в течение 160 дней культурального периода, а полученное размножение показано на фиг.4. В течение периода размножения NSC стабильно сохраняют свою мультипотентность и неврогенный потенциал, а также потенциал к дифференцировке в дофаминергические нейроны. Дофаминергические нейроны оценивают по нейрональной экспрессии тирозин-гидроксилазы (ТН) и транспортера дофамина (DAT).
Экспрессия DAT является маркером дофамин-продуцирующих нейронов. Экспрессию DAT нейронами можно оценить определением их способности транспортировать радиоактивно меченный дофамин через синаптическую мембрану дифференцированных нейронов в культуре. Функцию DAT дифференцированных NSC среднего мозга и моноклонально полученных NSC среднего мозга оценивают в анализе захвата радиоактивно меченного дофамина (фиг.5). Результаты анализа показывают высокую функциональную дофаминергическую активность NSC среднего мозга. Более того, они показывают, что дофаминергический фенотип можно обогатить путем выделения моноклональной популяции NSC, которая особенно склонна к образованию более высокой доли дофаминергических нейронов после дифференцировки (фиг.5).
NSC, генерирующие обогащенные дофаминергические нейроны, являются особенно пригодными для лечения болезни Паркинсона. Подобно этому, NSC, перепрограммированные на момент выделения из ткани на усиленную дифференцировку в специфический фенотип, можно использовать для выделения других специфических желательных нейронов, таких как холинергические нейроны переднего мозга, пригодные для лечения болезни Альцгеймера, спинальные холинергические нейроны, пригодные для лечения болезней двигательных нейронов, таких как ALS, серотонинергические нейроны, пригодные для лечения депрессии, и ГАМК-эргические нейроны, пригодные для лечения эпилепсии и болезни Хантингтона.
Пример 4. Дифференцировка нервных стволовых клеток/недифференцированных клеток-предшественников среднего мозга
NSC/недифференцированные клетки-предшественники среднего мозга можно дифференцировать, как описано в примере 2. Во время митотического периода NSC или во время их дифференцировки долю желательного фенотипа можно обогатить воздействием на культуру экзогенными факторами. Пример указанных факторов, способных обогащать дофаминергический фенотип из NSC среднего мозга, продемонстрирован кондиционированными средами от клеток Сертоли, как показано на фиг.6А и 6В.
В исследованиях, показанных на фиг.6А и 6В, сохраненные в замороженном состоянии стволовые клетки оттаивали и засевали с плотностью 40000 клеток на лунку на 4-ячеечные секционные предметные стекла в присутствии митогена и позволяли клеткам пролиферировать в течение 6 дней, после чего митоген удаляли, а клеткам позволяли дифференцироваться в течение 8 дней. Клетки делили на четыре группы на основе момента времени и продолжительности воздействия кондиционированной средой от клеток Сертоли (SCCM, разведение 1:1 в N2a). Одну группу подвергали воздействию SCCM во время пролиферации и дифференцировки (состояние 1); вторую подвергали воздействию только во время пролиферации (состояние 2); третью подвергали воздействию только во время дйфференцировки (состояние 3); а четвертую не подвергали воздействию SCCM (контроль или конт.). Среды меняли через день, а митоген добавляли ежедневно во время пролиферативной фазы. На каждое из состояний приходилось по четыре лунки для окрашивания на множество маркеров, и изучали три клеточные линии: 796MB, 527MB и 566SC. Клетки 566SC, которые были получены из спинного мозга, которые не имели поддающихся выявлению ТН-позитивных нейронов, на фигуре пропущены.
После дифференцировки клетки фиксировали с использованием 4% параформальдегида и иммунологически окрашивали с использованием антител к МАР2 [клон АР20 (Sigma), который распознает подтипы МАР2аb], нейрон-специфичного β-тубулина [TuJI (Covance)], и тирозин-гидроксилазы (Pel-Freez), а также GFAP (Dako) и GalC (Chemicon). Иммунологически окрашенные клетки подсчитывали с использованием объектива 40х, и в каждой лунке считали по меньшей мере три поля. Малое количество или отсутствие клеток GFAP+ или GalC+ было выявлено при анализе клеток, культивируемых при всех условиях, поэтому указанные антигены исключили из анализа. Помимо этого клетки 566SC после культивирования имели слишком большую плотность, препятствующую подсчету, при описанных условиях и не были включены в конечный анализ.
Анализ показывает, что на NSC среднего мозга можно влиять экзогенными факторами, чтобы найти белковый фактор или химические агенты, пригодные для дальнейшего обогащения в сторону дофаминергических нейронов. Таким образом, новые синтетические/натуральные химические и белковые факторы можно эффективно подвергать скринингу с использованием NSC, чтобы получить популяции, особенно пригодные для лечения по конкретному показанию, такому как болезнь Паркинсона.
Пример 5. Лечение спастичности и ригидности у крыс путем трансплантации нервных стволовых клеток/недифференцированных клеток-предшественников спинного мозга
Для того чтобы вызвать преходящую ишемию спинного мозга, использовали методику, ранее описанную у Taira (1996). Крысам Sprague Dawley (SD) давали наркоз галотаном (1,5%). Катетер 2 Fr Fogarty® проводили через левую бедренную артерию и через нисходящую грудную аорту до уровня левой подключичной артерии. Для измерения дистального артериального давления (DBP) ниже уровня окклюзии аорты хвостовую артерию канюлировали полиэтиленовым катетером (РЕ-50).
Ишемию спинного мозга индуцировали раздуванием интрааортального баллонного катетера 0,05 мл физиологического раствора. Системную гипотензию во время периода окклюзии аорты воспроизводили изъятием части артериальной крови (10,5-11 куб. см.) из сонной артерии, канюлированной катетером РЕ-50. С помощью указанного способа можно индуцировать системную гипотензию приблизительно 40 мм рт.ст. Об эффективности окклюзии свидетельствовало немедленное и сохраняющееся падение DBP, измеренного в хвостовой артерии. Спустя приблизительно 10 минут индуцированной ишемии спинного мозга баллон сдували, а кровь, изъятую из сонной артерии, реинфузировали. После стабилизации артериального давления (в пределах 20-30 минут после реинфузии) артериальные катетеры удаляли, а раны ушивали.
После индукции ишемии спинного мозга оценивали восстановление двигательной функции приблизительно с 2-дневными интервалами, с использованием локомоторной шкалы «открытое поле» из 21 пункта (шкала ВВВ). В экспериментальные группы для изучения трансплантации отбирали только тех животных, у которых сумма баллов по ВВВ составляла 0-4.
Приблизительно через 7-21 день после ишемического повреждения крысам с явлениями спастичности, у которых сумма баллов по ВВВ составляла 0-4, давали наркоз 1,5-2% галотаном в атмосферном воздухе и помещали в спинальный аппарат. Затем выполняли частичную ламинэктомию позвонков Thll-L2. Стеклянный капилляр с диаметром кончика 80-100 мкм подсоединяли к микроинъектору с регулируемым давлением. Крысам инъецировали 0,5 мкл клеточной суспензии, содержавших 5000, 10000, 15000 или 20000 нервных стволовых клеток/недифференцированных клеток-предшественников на инъекцию. Каждая крыса получала в сумме 6-8 инъекций на каждую сторону спинного мозга (слева или справа), равномерно распределенных между сегментами L2-L6. Центр инъекции направляли в центральное серое вещество (пластинки V-VII) (расстояние от дорсальной поверхности спинного мозга на уровне L3: 1 мм). После имплантации разрез санировали 3% H2O2 и смесью пенициллин/стрептомицин и ушивали в 2 слоя. Затем крыс оставляли восстанавливаться.
Иммунодепрессантное лечение с использованием FK-506 (Prograf; Fujisawa; 1 мг/кг; в/б) начинали всем животным приблизительно за 3 дня до спинальной трансплантации. После трансплантации животные получали иммунодепрессантное лечение ежедневно в течение всего периода выживания. Иммунное отторжение указанных трансплантатов можно эффективно предотвращать с использованием FK-506. Крысы выживают приблизительно в течение 2 или 7 недель (n=5 для каждого отрезка времени).
В конце периода выживания крысам давали наркоз пентобарбиталом (40 мг/кг; в/б) и транскардиально перфузировали их в течение 1-2 мин гепаринизированным физиологическим раствором, а затем - 4% параформальдегидом в 0,1М фосфатном буфере (РВ). Спинной мозг иссекали и вторично фиксировали тем же фиксатором в течение ночи при 4°С. После вторичной фиксации ткань спинного мозга подвергали криопротекции в градиенте раствора сахарозы (10, 20 и 30%) всего в течение трех дней. Затем осуществляли фронтальные, парасагиттальные или горизонтальные срезы спинного мозга (10-30 мкм). Для иммуногистохимического анализа свободно плавающие срезы (30 мкм) помещали в PBS, 0,1М (рН 7,4), содержавший 5% нормальной козьей сыворотки (NGS), 0,2% Triton X100 (ТХ), на два часа при комнатной температуре, чтобы блокировать неспецифичную белковую активность. Затем следовала инкубация в течение ночи при 4°С с различными первичными специфичными антителами.
После инкубации с первичными антителами срезы отмывали 3-кратно в PBS и инкубировали со вторичными козьими антикроличьими или антимышиными антителами, конъюгированными с флюоресцентным маркером (Alexa 488 или 594; 4 мкл/мл; Molecular Probes). Все блокирующие и антительные препараты изготавливали в 0,1М PBS/0,2%ТХ/5% NGS. Для экспериментов с двойной меткой первичные антитела от различных видов применяли одновременно, с последующим применением вторичных антител, конъюгированных с различными флюоресцентными маркерами. В контрольных экспериментах первичные антитела не применяли. Для общего ядерного окрашивания к конечным растворам вторичных антител добавляли DAPI (3 мкл/мл). После окрашивания срезы сушили при комнатной температуре и покрывали с использованием набора Prolong anti-fade kit (Molecular Probes).
Предметные стекла изучали с использованием флюоресцентного микроскопа Leica. Фотографии (512×512 пикселей) делали цифровой камерой Olympus и обрабатывали с использованием компьютерной программы Adobe Photoshop 5.5 (Adobe Systems, Mountain View, CA). Для подтверждения совместной локализации различных антител на срезах с двойным окрашиванием получали изображения с использованием системы деконволюционного микроскопа DeltaVision, включающей Photometries CCD, смонтированного на микроскопе Nikon (Applied Precision, Inc.). В целом, получили шестьдесят оптических срезов с интервалами 0,1 или 0,2 мкм. Использовали линзы 20х, 40х и 60х (NA 1.3). Осуществляли деконволюцию совокупности данных и анализировали с использованием компьютерной программы SoftWorx software (Applied Precision, Inc.) на рабочей станции Silicon Graphics Octane.
Общее количество трансплантированных нейронов, иммунореактивных для ядерного антитела NUMA, определяли с использованием стереологической, случайной и систематической выборки. Каждый десятый предварительно крашенный срез, взятый из спинальных сегментов L2-L6, использовали для стереологической количественной оценки после применения фракционной схемы выборки. Оптические изображения (толщиной 1 мкм) получали с использованием микроскопа Leica DMLB с масляным иммерсионным объективом 100х с числовой апертурой 1,3. Оптические изображения получали с использованием цифровой камеры (Olympus) и компьютерной программы ImagePro (Media Cybernetics), снабженной контролируемой StagePro моторизованной платформой Z (Media Cybernetics). Общее количество трансплантированных клеток затем подсчитывали с использованием фракционирующей формулы N=Q × 1/hsf × 1/asg × 1/ssf, где N представляет собой общее количество позитивных ядер, Q представляет собой сумму подсчитанных клеток, hfs представляет собой высоту фракции выборки, asf представляет собой площадь фракции выборки, a ssf представляет собой долю фракции выборки.
Для того чтобы получить пространственную реконструкцию трансплантированных NSC в ишемическом спинном мозге, использовали предварительно сохраненные изображения серийных срезов спинного мозга. В среднем, около 60-100 серийных срезов использовались для пространственной реконструкции. На первом этапе комплект серийных изображений открывали, используя компьютерную программу Ellipse и выстраивали в ряд с использованием с помощью специально разработанного модуля Allign (VidiTo, SK). Процесс выстраивания ряда состоял из определения двух морфологических базовых точек во всех серийных изображениях спинного мозга (первая точка: центр центрального канала; вторая точка: медиальная граница дорсального рога) и последующего компьютерного выстраивания ряда всех изображений. Для идентификации границ дорсального и вентрального рогов опускали линии на комплекты предварительно выстроенных в ряд изображений с использованием модуля Laminar Maps (Ellipse). В конечном итоге комплект предварительно выстроенных в ряд и обработанных с использованием Laminar Maps изображений использовали для пространственной реконструкции с использованием трехмерного конструктора (Media Cybernetics).
Культура спинальных NSC на крысиных астроцитах в течение двух-трех недель показала зависимое от времени созревание и развитие нейронального фенотипа в большинстве культур. Это подтверждено окрашиванием видо-специфичными антителами против NSE или МОС. Идентифицируются также многочисленные нейроны с хорошо развитым аксодендритным деревом. Большинство (85-90%) NSE-позитивных нейронов являются ГАМК-позитивными. В некоторых МОС-позитивных нейронах наблюдается экспрессия синаптофизина в аксонах и дендритах.
Наблюдается надежное выживание клеток, трансплантированных через двадцать один день после ишемического повреждения. Это выражается в виде четко идентифицируемых двусторонних трансплантатов, иммунологически реактивных в отношении NUMA, МОС или NSE, всех видоспецифичных антител. Анализ горизонтальных срезов, взятых из сегментов спинного мозга, получивших трансплантат, показал отчетливую миграцию NUMA-позитивных клеток между отдельными участками инъекций. Большинство NUMA-позитивных клеток показало совместную локализацию с МОС иммунореактивностью.
Двойная метка срезов спинного мозга с использованием антител против NUMA и ГАМК, проанализированная с использованием конфокальной микроскопии, выявила в среднем 25-35% ГАМК-позитивных клеток. Устойчивая экспрессия ГАМК-эргического фенотипа наблюдалась у всех животных, получивших трансплантат, в течение семи недель выживания.
В тот же момент времени (т.е. через семь недель после трансплантации) двойное окрашивание с использованием антител против синаптофизина и NUMA показало плотную синаптофизин-позитивную сеть внутри трансплантатов. Лишь изредка NUMA-позитивные клетки будут показывать совместную локализацию с GFAP антителом. Указанные клетки обычно располагаются на периферии трансплантатов.
Стереологическая оценка NUMA-позитивных клеток показывает в среднем 75460±5697 персистирующих трансплантированных клеток внутри отдельных трансплантатов. Это в среднем в 3-3,6 раза больше клеток, чем исходно инъецированных клеток. Антиген клеточного цикла, Ki67, является маркером клеток с активным митозом. Окрашивание срезов спинного мозга через две-семь недель после трансплантации показывает иммунореактивность в отношении hKi67 только через две недели после трансплантации. Лишь изредка (1-2 клетки/10 срезов) клетки являются Кi67-позитивными через семь недель выживания. Данные результаты показывают, что трансплантированные спинальные NSC и их предшественники размножаются в количестве, эквивалентном в среднем приблизительно трем удвоениям клеток в течение первоначального двухнедельного периода, затем они находятся в постмитотическом состоянии и стабильно интегрируются.
Объемную реконструкцию сегментов L3-L5, в которые производили трансплантацию, осуществляли с использованием изображений 40 мкм серийных срезов спинного мозга, окрашенных МОС антителами и DAPI (общее количество 150-200 срезов). Трехмерная реконструкция трансплантата показывает хорошо распознаваемый рострокаудально ориентированный МОС-позитивный имплантат, распределенный в пределах серого вещества. Как показано на фиг.7, фиг.8, функциональный эффект спинальных NSC оценивают по приживлению трансплантированных клеток и определению благоприятного действия на двигательную функцию по шкале ВВВ. Что касается степени поведенческого восстановления, наблюдавшегося в настоящем исследовании, заявители после трансплантации наблюдали три принципиальные группы. Первая: животные, которые демонстрировали наиболее сильное восстановление и способность к ходьбе (ВВВ<16); вторая: животные, которые демонстрировали улучшение в активной подвижности всех трех суставов нижних конечностей, но не были способны стоять (ВВВ около 8), и третья группа, в которой животные не демонстрировали никакого улучшения (т.е. не реагировали на лечение). В то время как причина различий в реакции на трансплантацию не ясна, заявители полагают, что тонкие различия в расположении трансплантатов с учетом того, что касается дисингибированных первичных афферентов и/или α-мотонейронов, могут играть свою роль. Кроме того, следует отметить, что животные выживали только в течение 3 месяцев настоящего исследования. Заявители полагают, что долгосрочное выживание после трансплантации и продолжение физической реабилитации, возможно, было бы связано с более высокой степенью функционального восстановления. Тем не менее, в противоположность экспериментальной группе не наблюдалось значимого восстановления ни у одного из животных, которым инъецировали только среду.
Пример 6. Лечение заболеваний двигательных нейронов у крыс путем трансплантации спинальных NSC
NSC описанных способов предоставляют как клинические, так и биологические преимущества, которые являются мощными и достоверными. С этой целью описанные способы позволяют осуществлять лечение состояний как диссеминированных по всей центральной нервной системе, таких как ALS, так и локализованных в конкретной области, как при ишемии спинного мозга, описанной выше. При ALS, хотя при трансплантации в поясничный отдел спинного мозга можно пропустить другие витальные части сегментного двигательного аппарата, т.е. шейный нервный пучок двигательных нейронов, ответственный за дыхательные движения, описанные способы имплантации NSC в спинной мозг облегчают высвобождение BDNF и GDNF других факторов из трансплантированных клеток в CSF (ликвор - прим. перев.), где может наблюдаться более широкое воздействие на двигательные нейроны хозяина по всему спинному мозгу.
Неожиданно было установлено, что частичные трансплантаты NSC в поясничные сегменты нейродегенеративного окружения спинного мозга выживают, претерпевают экстенсивную нейрональную дифференцировку и способствуют выживанию и функции двигательных нейронов как в месте имплантации, так и в других областях. NSC достоверно задерживают появление симптомов и продлевают жизнь крысам SOD1 G93A, модели человеческого ALS (бокового амиотрофического склероза).
Крыса SOD1 G93A представляет всестороннюю модель неврологической патологии и клинических симптомов особенно агрессивной формы ALS [(Nagai et al., 2001; Rowland et al., 2002)]. NSC из фетального спинного мозга млекопитающих можно трансплантировать в поясничный отдел спинного мозга крыс и мышей SOD1 G93A, где наблюдается экстенсивная дифференцировка нейронов и где дифференцированные нейроны впоследствии образуют синаптические контакты с нейронами хозяина и экспрессируют и высвобождают GDNF и BDNF. Крысиную SOD1 G93A модель, например, характеризующуюся фульминантным заболеванием двигательных нейронов, можно использовать для изучения и демонстрации благоприятных эффектов NSC при данном заболевании. С этой целью трансплантаты NSC, применяемые в описанных способах, хорошо выживают в нейродегенеративном окружении и обеспечивают мощные клинические эффекты. По меньшей мере часть указанных эффектов связана со способностью указанных трансплантатов экспрессировать и высвобождать факторы роста двигательных нейронов. Соответственно, трансплантированные NSC описанных способов задерживают начало и прогрессирование фульминантного заболевания двигательных нейронов и продлевают жизнь указанным животным более чем на десять дней, несмотря на ограниченную схему трансплантации, которая была ограничена поясничным выступом.
NSC из ткани спинного мозга плода в гестационном возрасте восемь недель, полученной post mortem, размножают в свободной от сыворотки среде, содержащей фактор роста фибробластов (FGF-2), в объеме приблизительно 10-12 пассажей до трансплантации (Jone et al., 1996). Судьба указанных клеток надежно прослеживается с помощью антител против ядерных антигенов (Yan et al., 2003). Все хирургические процедуры, использующие указанные клетки, выполнены в соответствии с протоколами, включенными в настоящий документ в качестве ссылки, которые были одобрены Комитетом по содержанию и использованию животных медицинских учреждений Джона Хопкинса, с использованием газового наркоза (энфлюран:кислород:закись азота=1:33:66) и методов асептики.
Живые или мертвые NSC трансплантировали в поясничный выступ (L4 и L5) крысам SOD1 G93A обоего пола в возрасте девяти недель (220-300 г), фиксированным на спинальном стереотаксическом устройстве Kopf под контролем микроскопа. Мертвые клетки получали повторным замораживанием и оттаиванием перед трансплантацией. Клеточные суспензии доставляли в асептических условиях посредством приблизительно восьми инъекций, направленных в вентральный рог по обе стороны вентрального рога (5×104 NSC на один участок инъекции, четыре участка инъекции на одной стороне), с помощью вытянутых-скошенных стеклянных микропипеток, соединенных посредством силиконовой трубочки, с 10 мкл микрошприцами Hamilton. Все крысы получали FK-506 (1 мг/кг и/п) для предотвращения иммунного отторжения, на оснозе пилотных данных, указывающих на то, что у нелеченых животных или животных, получающих циклоспорин, выживание трансплантата не превышает одного месяца.
Крыс испытывали на двигательную силу и массу тела два раза в неделю. Тесты на двигательную силу включали в себя локомоторную рейтинговую шкалу Basso, Beattie и Bresnahan (BBB) (Basso et al., 1995) и шкалу наклонной плоскости (Rivlin and Tator, 1977). Для тестирования по шкале BBB животных исследовали в течение приблизительно 4 или 5 минут на открытом поле. Всю локомоторную деятельность записывали и оценивали в соответствии со шкалой. Для тестирования по шкале наклонной плоскости крыс помещали на наклонный плоский мат и угол изменяли до максимального значения, при котором животные могли стабилизировать свое положение в течение приблизительно 5 секунд. Данный угол затем записывали как балл животного по шкале наклонной плоскости. Баллы по BBB и шкале наклонной плоскости анализировали посредством MANOVA с последующим тестом Fisher LSD post hoc. Начало заболевания определяли как точку, в которой масса тела начинала резко снижаться. Течение болезни как эффект типа трансплантата (трансплантат живые или мертвые клетки) анализировали сравнением возраста начала заболевания и возраста смерти в двух группах (с использованием t-критерия Стьюдента), а также посредством анализа выживания Каплана-Мейера, с последующим длительным ранговым критерием.
Крыс умерщвляли посредством перфузии-фиксации, когда их сумма баллов по BBB (см. ниже) была меньше 3, на стадии, при которой только в одном суставе наблюдалось движение или не наблюдалось движений вообще, а животное расценивалось как умирающее.
Ткани получали от животных, которых перфузировали 4% параформальдегидом с нейтральным буфером. Грудные-поясничные сегменты спинного мозга с прикрепляющимися корешками и поясничными нервами дополнительно фиксировали погружением в тот же самый фиксатор еще на четыре часа. Блоки, содержавшие трансплантированную область целиком, плюс по 1 мм по краям выше и ниже блока, подвергали криопротекции и замораживали для дальнейшей обработки. Корешки L3-S1 обрабатывали отдельно как цельные препараты или после отделения корешков с помощью стеклянных пипеток с оплавленными кончиками. Из блоков изготавливали срезы в поперечной или сагиттальной плоскости (35 мкм). Выживание и дифференцировку NSC изучали с использованием иммунофлюоресценции с двойной меткой, которая объединяет в большинстве случаев HNu, видоспецифичный маркер, с другим клеточным маркером, и осуществляли исследование, как описано у Yan et al., 2004.
Для изучения дифференцировки NSC использовали нестереологический способ подсчета общего количества HNu(+) клеток, а также клеток, меченных двойной меткой HNu и фенотипическим маркером, на случайно выбранных полях иммунофлюоресцентных препаратов заявителей, с сильным увеличением (100х). От каждого животного использовали одно поле в каждом из шести срезов области трансплантации, отделенных друг от друга интервалом ~1 мм. Количество HNu(+) и профилей с двойной меткой от всех шести подсчитанных для каждого случая полей объединяли и группировали для протокола эксперимента. Выводили средние количества клеток с одной и с двойной меткой для каждой экспериментальной группы (n=6 на группу).
Для оценки выживания двигательных нейронов у крыс, которым трансплантировали живые или мертвые клетки (n=4 для каждого случая), изучали ткани от животных, умерщвленных в возрасте 128 дней. Отбирали каждый шестой срез в области L3-S1 от каждого животного как для стереологического анализа (Yan et al., 2004) и подсчитывали α-моторные нейроны, идентифицированные как мультиполярные клетки с различимым ядром и телом диаметром >35 мкм, с использованием оптического фракционатора, как описано у Yan et al., 2004. Различия между животными, которым трансплантировали живые или мертвые клетки, анализировали с использованием t-критерия Стьюдента.
Для определения нейротрофических факторов двигательных нейронов с помощью ELISA у животных по газовым наркозам отбирают CSF из 4-го желудочка 25G шприцем. Образцы тканей, содержащие участки трансплантации и прилегающие к ним участки, иссекают поперек из 1 мм свежих срезов спинного мозга. CSF или образцы тканей обрабатывают и сначала измеряют общий белок, как описано у Sheng et al., 2003. Уровни GDNF и BDNF определяли в CSF и в образцах спинного мозга с использованием системы для иммунологического анализа Е-Мах ImmunoAssay system (Promega, Madison, WI). Поглощение ТМВ-хромогена считывали на 450 нм. Дисперсионный анализ для концентраций между образцами от живых трансплантатов, областей, прилегающих к трансплантатам, и трансплантатов мертвых клеток осуществляли с использованием одностороннего ANOVA, с последующим тестом по критерию множественного сравнения Tukey. Различия в концентрации CSF между животными, которым трансплантировали живые или мертвые клетки, анализировали с использованием t-критерия Стьюдента.
Для вестерн-блоттинга нейротрофических факторов двигательных нейронов образцы белка из CSF или спинного мозга, подготовленных как для ELISA, подвергали электрофорезу с маркерами молекулярной массы и переносили на мембраны из нитроцеллюлозы. Пятна блокировали в TBS, рН 7,4, содержавшем 5% ослиную сыворотку, а затем сначала инкубировали с антителами против GDNF и BDNF (1:500; в течение ночи, 4°С), а затем с HRP-связанным ослиным антикозьим IgG (для GDNF) и антикроличьим IgG (для BDNF) (1:2000; Jackson ImmunoResearch) (1 час, КТ). Все антитела разводили в TBS, содержавшем 5% ослиную сыворотку. Пятна проявляли с использованием хемилюминесцентного субстрата SuperSignal (Pierce) и засвечивали пленку Kodak-XAR (Eastman Kodak, Rochester, NY). Пятна затем снимали и повторно проводили блоттинг с использованием антитела против β-актина (1:500, Sigma) и HRP-связанного ослиным антимышиным IgG (1:10000, Jackson ImmunoResearch). Иммунореактивные полосы анализировали с использованием компьютерной программы Bio-Rad Quantity One (Bio-Rad Laboratories, Hercules, CA). Соотношение плотности пятен (GDNF или BDNF: β-актин) рассчитывали для животного и средние величины для групп подвергали статистическому анализу, как в случае экспериментов с использованием ELISA.
NSC в спинном мозге крыс SOD1 G93A через 22 недели после трансплантации идентифицировали путем иммунологического окрашивания видоспецифичными антителами. Положительные по окраске клетки, как показано, выживали в вентральном роге (А) и окрашивались, в большинстве своем, маркерами нейрональной линии, таким как связанный с микротрубочками эпитоп TUJ-1. NSC идентифицировали по сигнатуре ядерного белка, а их фенотипическую судьбу отслеживали с использованием двойного иммуноцитохимического анализа на ядерный белок и эпитопы, специфичные для нейронального предшественника, нейрональных и глиальных клеток. К концу экспериментов на крысах SOD1 G93A клетки NSC демонстрировали надежное приживление трансплантатов и отличное долгосрочное выживание. Большинство HNu(+) клеток (70,4±6,4%) дифференцировалось в нейрональную линию на основе их совместной локализации с TUJ-1. Приблизительно одна пятая (19,2±5,6%) HNu(+) клеток локализовались совместно с нестином и лишь очень немногие (1,3±0,9%) HNu(+) клетки были позитивными по GFAP.
Способность NSC интегрироваться в цепь хозяина изучали с использованием перикариальных маркеров для клеток трансплантата/хозяина и маркеров, селективных в отношении окончаний как хозяина, так и трансплантата. Срезы окрашивали на ядерный белок для установления происхождения трансплантата, на TUJ-1 для установления нейрональной дифференцировки и моноклональным антителом на пресинаптический белок Bassoon (BSN), которое распознает крысиные и мышиные эпитопы, но не распознает другие эпитопы. Большое количество HNu(+) клеток, TUJ-1(+) клеток, располагающихся в паренхиме, как было установлено, контактируют посредством синаптических бутонов крысиного происхождения.
По результатам конфокальной микроскопии полученные из NSC нейрональные клетки с TUJ-1(+) цитоплазмой контактируют посредством крысиных окончаний. Наоборот, препараты, окрашенные TUJ-1 и видоспецифичным синаптофизином, обнаруживают плотные терминальные поля малых бутонов, смыкающихся с нейронами хозяина, особенно с большими и малыми двигательными нейронами. Двигательный нейрон хозяина контактирует с большим количеством полученных из трансплантата бутонов. Горизонтальные срезы, окрашенные на ядерный белок и NF-70, демонстрируют большое количество полученных из трансплантата аксонов, выходящих из трансплантата налево и проходящих преимущественно вдоль белого вещества вентрального тяжа. Клетки/отростки с ChAT иммунореактивностью использовали для разграничения серого вещества от белого вещества в вентральном роге. Большое количество аксонов, меченных видоспецифичными антителами против нейрофиламентного эпитопа NF70, как было установлено, находилось в связи с местами трансплантации, что свидетельствует о том, что множество NSC дифференцировалось в запланированные нейроны; указанные аксоны демонстрируют предпочтение в отношении белого вещества вентрального рога. Трансплантаты NSC в поясничный отдел спинного мозга крыс SOD1 G93A увеличивают продолжительность жизни и задерживают гибель двигательных нейронов, а также начало и прогрессирование заболевания. Прогрессионный анализ клинических и патологических параметров в случаях с трансплантацией живых клеток (L) и мертвых клеток (контроль, С) показан на фиг.9. Животные, которым трансплантировали живые NSC, показывали достоверно более высокое выживание как по результатам теста Каплана-Мейера, так и по анализу конечных результатов. График Каплана-Мейера (фиг.9А) показывает значительное разделение между экспериментальными и контрольными животными в ходе наблюдений (Р=0,0003). Графики баллов по шкале ВВВ «открытое поле» и по тесту с наклонной плоскостью в зависимости от времени (фиг.9 В) показывают достоверно более медленное прогрессирование мышечной слабости у животных, которым трансплантировали живые NSC, по сравнению с животными, которые получали мертвые NSC.
Влияние NSC на выживание двигательных нейронов в поясничном выступе (L3-S1) крыс Тg изучали на малой группе животных, которые получали живые или мертвые NSC и были умерщвлены в возрасте 128 дней. Средняя продолжительность жизни животных, которым трансплантировали мертвые NSC, составляла 138 дней, в то время как крысы, которым трансплантировали живые NSC, жили 149 дней. Таким образом, значимая 11-дневная разница в продолжительности жизни наблюдалась между экспериментальными и контрольными крысами (Р=0,0005). Среднее время до начала заболевания составляло 115 дней для животных, которые получали мертвые клетки, и 122 дня для животных, которым трансплантировали живые NSC. Значимая 7-дневная разница по времени до начала заболевания наблюдалась между двумя группами (Р=0,0001).
Стереологически установленные количества α-двигательных нейронов составляло 6418 для животных, которые получали живые NSC, и 3206 для животных, которым трансплантировали мертвые NSC, т.е. в поясничном выступе экспериментальных животных было вдвое больше нейронов, чем у контрольных животных того же возраста. Разница в 3212 клеток в поясничном выступе между группами живых и мертвых NSC наблюдалась (Р=0,01) у репрезентативных экспериментальных и контрольных крыс в возрасте 128 дней.
Потенциальные механизмы нейропротекции, обеспечиваемой NSC дегенерирующим двигательным нейронам, включают в себя экспрессию и высвобождение двух пептидов с классическим трофическим действием на двигательные нейроны млекопитающих, [BDNF и GDNF] (Henderson et al., 1994; Koliatsos et al., 1993). Определяли экспрессию и высвобождение GDNF и BDNF в спинном мозге крыс SOD1 G93A, получавших трансплантаты. В препаратах спинного мозга и образцах CSF определяли BDNF и GDNF с помощью вестерн-блоттинга и ELISA. Концентрации GDNF в паренхиме и CSF крыс, которым трансплантировали живые клетки (L1 и L2), и животных, которым трансплантировали мертвые клетки (C), определяли с помощью ELISA. L1 представляет концентрации в участке трансплантации, в то время как L2 отражает концентрации в тканях одного сегмента выше или ниже. Дисперсия среди групп является значимой и вызывается большой разницей между группами L1 или L2 и С.
Разница концентраций в CSF между экспериментальными (живые клетки, L) и контрольными (мертвые клетки, С) группами также является значимой по результатам t-критерия. ELISA показал концентрацию 0,912±0,050 пг/мкг в участке трансплантации и 0,819±0,115 пг/мкг в одном сегменте далее в спинном мозге животных, которым трансплантировали живые NSC. У животных, которым трансплантировали мертвые NSC, указанные концентрации составляли 0,368±0,026 пг/мкг в сегментах спинного мозга, содержавших трансплантат. В CSF концентрация GDNF составляла 0,027±0,012 пг/мкл у экспериментальных животных и 0,006±0,002 пг/мкл (у контрольных животных). Эти данные показывают трехкратное увеличение экспрессии и высвобождения GDNF в спинном мозге и пятикратное увеличение секреции GDNF в CSF животных с живыми NSC.
Вестерн-блоттинг также показывает более высокую нормализованную концентрацию GDNF у животных, которым трансплантировали живые NSC. GDNF вестерн-блоттинга подтверждает паттерн увеличения по ELISA путем выявления белка 16 кДа. Вестерн-блоттинг также показывает нормализованную плотность GDNF 0,860±0,007 в трансплантатах живых клеток и 0,708±0,052 в трансплантатах мертвых клеток.
Определяли ELISA окрашивание BDNF в паренхиме и в CSF экспериментальных крыс и контролей. Анализ ELISA показал концентрацию 0,086±0,014 пк/мкг в участке трансплантации (L1) и 0,054±0,009 пг/мкг в одном сегменте далее от трансплантата у экспериментальных животных (L2). У контрольных крыс концентрация BDNF составляла 0,010+0,003 пк/мкг в сегментах, содержавших трансплантат. Разница между экспериментальными и контрольными концентрациями в CSF является значимой. В CSF концентрация BDNF составляла 0,041±0,013 пк/мкл у экспериментальных животных и 0,010±0,008 пк/мкл у контролей. Указанные данные показывают восьмикратное увеличение концентрации BDNF в спинном мозге и четырехкратное увеличение в CSF экспериментальных животных. Вместе данные ELISA предполагают более широко распространенную секрецию GDNF по сравнению с BDNF у животных, которым трансплантировали живые NSC, особенно в CSF.
Иммуноцитохимический анализ также установил, что подавляющее большинство трансплантированных HNu(+) клеток экспрессирует GDNF. Источником GDNF у животных с живыми трансплантатами являются сами трансплантированные клетки. В препаратах с двойным окрашиванием на HNu (красный цвет) и GDNF (зеленый цвет) показан избыток иммунореактивности GDNF в цитоплазме трансплантированных NSC. У животных, которые получали живые трансплантаты, наблюдается интенсивная иммунореактивность GDNF в круглых цитоплазматических структурах, напоминающих секреторные пузырьки в двигательных нейронах хозяина.
Конфокальная микроскопия двигательного нейрона хозяина, окрашенного GDNF и синаптофизином (последний для мечения полученных из трансплантата окончаний), показывает локализацию GDNF в пузырьковых структурах, но не в полученных из трансплантата окончаниях, расположенных на поверхности показанного двигательного нейрона хозяина. Срезы, окрашенные антителами против синаптофизина (для мечения всех окончаний трансплантата, иннервирующих двигательные нейроны хозяина) и GDNF, показывают отсутствие какой бы то ни было совместной локализации двух белков в бутонах, контактирующих с двигательными нейронами хозяина.
Крысы с живыми трансплантатами демонстрируют развитие путей, происходящих из трансплантата и иннервирующих структуры в центральном канале и вокруг него. В противоположность отсутствию белка GDNF в окончаниях, контактирующих с двигательными нейронами хозяина, подавляющее большинство полученных из NSC аксонов, иннервирующих центральный канал, локализуется совместно с GDNF иммунореактивностью. Широко распространенная совместная локализация синаптофизина и GDNF наблюдается в полученных из трансплантата окончаниях, иннервирующих клетки эпендимы в центральном канале. Указанные анатомические паттерны показывают, что GDNF, возможно, захватывается окончаниями двигательных нейронов хозяина, которые иннервируют трансплантат посредством ретроградного транспорта и не доставляются к указанным нейронам посредством транссинаптического переноса (Rind et al., 2005).
Очевидная резистентность трансплантированных NSC к продолжающемуся дегенеративному процессу в вентральном роге крыс SOD1 G93A является особенно многообещающей. Выживание и экстенсивная дифференцировка NSC, о которых сообщается в настоящем документе, является мощным показателем того, что воспалительная/эксцитотоксическая сигнализация, в которой участвуют двигательные нейроны, содержащие SOD1 G93A (Rothstein et al., 1992; Howland et al., 2002; Turner et al., 2005), не оказывают очевидного токсического действия на клетки. Один только этот фактор внушает оптимизм в отношении того, что касается будущих клеточных стратегий, использующих трансплантаты для восстановления двигательной функции при дегенеративном заболевании двигательных нейронов.
Пример 7. Лечение травматического повреждения спинного мозга путем трансплантации нервных стволовых клеток/недифференцированных клеток-предшественников спинного мозга.
Лечение сирингомиелии
Размноженные спинальные стволовые клетки инъецировали взрослым самкам крыс Sprague-Dawley с подавленным иммунитетом или бестимусным голым крысам с иммунодефицитом. Контузионные повреждения С4-5 наносили в обеих группах за месяц до трансплантации. Реципиенты трансплантатов (n=24) выживали в течение 60-150 дней после трансплантации. Полученные NSC образовывали большие клеточные агрегаты, состоявшие из нейронов, астроцитов и олигодендроцитов. Указанные трансплантаты неизменно и полностью заполняли каждое повреждение. Незрелого вида NeuN+/ ядро+нейроны часто включали в себя 50% популяции донорских клеток. Указанные нейроны посылали нейрофиламент+отростки через серое и белое вещество на расстояние по меньшей мере 2 см от участка трансплантации. Интенсивная иммунореактивность на синаптофизин отмечалась вблизи от нейронов как хозяина, так и трансплантата, и, по-видимому, нереактивные GFAP+клетки помещались рядом с донорскими нейронами. Далее, указанные трансплантаты поддерживали рост ТН+и 5НТ+волокон, которые, по-видимому, возникали из источников хозяина. Указанная линия NSG, таким образом, как представляется, первичными фетальными ЦНС-подобными качествами, благоприятными для интраспинального восстановления серого вещества.
Следует понимать, что различные изменения и модификации предпочтительных вариантов осуществления настоящего изобретения, описанных в настоящем документе, будут понятны специалистам. Указанные изменения и модификации могут быть осуществлены без отступления от идеи и объема описанных способов и без уменьшения их планируемых преимуществ. Таким образом, предполагается, что указанные изменения и модификации будут охватываться прилагаемой формулой изобретения.
Реферат
Заявленная группа изобретений относится к медицине, а именно к нейрохирургии и биотехнологии, и может быть использована для культивирования нервных стволовых клеток млекопитающего, исключая эмбриональные клетки человека, и для лечения спастичности, ригидности, спинного мозга или амниотрофического состояния у субъекта, нуждающегося в таком лечении. Для культивирования указанных клеток предварительно инкубируют в культуральном сосуде раствор, содержащий поли-D-лизин в концентрации от 0,1 мкг/мл до 1 мг/мл в течение от 5 минут до 3 часов. Затем ополаскивают и высушивают культуральный сосуд. Высевают нервные стволовые клетки в указанный культуральный сосуд при отсутствии сыворотки. Затем добавляют раствор фибронектина и, по меньшей мере, одного митогена в культуральный сосуд и культивируют нервные стволовые клетки при отсутствии сыворотки. Далее пассируют культивируемые нервные стволовые клетки до слияния. Для лечения указанных состояний концентрируют нервные стволовые клетки, культивированные заявленным способом. Вводят терапевтически эффективное количество указанных концентрированных нервных стволовых клеток в область ткани центральной нервной системы пациента с пониженным уровнем ГАМК-продуцирующих или глицин-продуцирующих нейронов. Заявленная группа изобретений обеспечивает эффективный способ культивирования нервных стволовых клеток млекопитающего, исключая эмбриональные клетки человека, позволяющий достичь in vitro более высокой степени нейрональной дифференцировки до уровня, достаточного для лечения заявленных состояний, и улучшения выживания in vivo таких клеток, а также эффективное лечение
Формула
высевание нервных стволовых клеток в указанный культуральный сосуд при отсутствии сыворотки; добавление раствора фибронектина и, по меньшей мере, одного митогена в культуральный сосуд и культивирование нервных стволовых клеток при отсутствии сыворотки; и пассирование культивируемых нервных стволовых клеток до слияния.

Комментарии