Активация прокаспазы-3 с помощью комбинированной терапии - RU2659936C2
Код документа: RU2659936C2
Чертежи




Описание
РОДСТВЕННЫЕ ЗАЯВКИ
В соответствии с параграфом 119(e) Кодекса законов США 35, эта заявка притязает на приоритет в отношении Предварительной патентной заявки США №61/607,098, поданной 6 марта 2012 года, которая включена в этот документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Апоптоз, или запрограммированная смерть клеток, играет центральную роль в развитии и гомеостазе всех многоклеточных организмов. Частым отличительным признаком рака является устойчивость к естественным апоптотическим сигналам. В зависимости от типа рака, эта устойчивость типично вызвана повышением или понижением количества и/или активности ключевых белков в апоптотическом каскаде или мутациями в генах, кодирующих эти белки. Подобные изменения возникают как во внутреннем пути регуляции апоптоза, связанном с митохондриями и каспазой-9, так и во внешнем пути регуляции апоптоза, включающем в себя действие "рецепторов смерти" и каспазы-8. Например, в раковых клетках наблюдалось изменение нормальных уровней белков, например, р53, Bim, Вах, Apaf-1, FLIP и многих других. Эти изменения могут приводить к нарушениям в апоптотическом каскаде, в результате которых исходные проапоптотические сигналы не передаются должным образом по каскаду и не приводят к активации исполнительных каспаз, каспазы-3 и каспазы-7.
Поскольку большинство путей регуляции апоптоза в итоге включают в себя в итоге активацию прокаспазы-3, генетические аномалии в их ранее действующих компонентах по существу являются «разрывами» апоптотических сигнальных цепей, и в результате подобные клетки пролиферируют аномально. С учетом центральной роли апоптоза в развитии рака, были предприняты усилия по разработке терапевтических средств, воздействующих на конкретные белки в апоптотическом каскаде. Например, пептидные или небольшие молекулярные биндеры, связывающиеся с членами апоптотического каскада, например, с р53 и белками в семействе Bcl или с семейством белков-ингибиторов апоптоза (IAP), обладают проапоптотической активностью, как и соединения, способствующие олигомеризации Apaf-1. При этом, однако, поскольку подобные соединения воздействуют на ранние (или на средние и высокие) позиции апоптотического каскада, формы рака с мутациями, воздействующими на белки, находящиеся ближе к концу каскада, чем его вышеупомянутые члены, могут по-прежнему быть устойчивыми к возможным положительным эффектам этих соединений.
Было бы желательно в терапевтических целях выявить небольшие молекулы, которые напрямую активируют проапоптотический белок, радикально задний по ходу в апоптотическом каскаде. Этот подход мог бы затрагивать относительно низкое положение в каскаде, что позволило бы убивать даже те клетки, которые имеют мутации, затрагивающие передние по ходу элементы апоптотического механизма. Более того, подобные терапевтические стратегии имели бы более высокую вероятность успеха, если бы этот проапоптотический белок присутствовал в раковых клетках в повышенных количествах, и/или если бы его активность в них была повышена. Таким образом, идентичность небольших молекул, способных воздействовать на передний по ходу белок-эффектор апоптоза, прокаспазу-3, оказало бы существенную помощь современной противораковой терапии.
Конверсия или активация прокаспазы-3 с образованием каспазы-3 приводит к образованию активной формы каспазы «убийцы», в дальнейшем катализирующей гидролиз многочисленных белковых субстратов. Активная каспаза-3 является гомодимером гетеродимеров и образуется в результате протеолиза прокаспазы-3. Эта протеолитическая активация in vivo типично происходит под действием каспазы-8 или каспазы-9. Для того, чтобы предотвратить преждевременную активацию зимогена (профермента), прокаспаза-3 содержит "предохранительную защелку" из 12 аминокислотных остатков, которая блокирует доступ к сайту протеолиза ETD (аминокислотной последовательности Ile-Glu-Thr-Asp). Эта "предохранительная защелка" дает возможность прокаспазе-3 противостоять автокаталитической активации и протеолизу под действием каспазы-9. Мутагенные исследования показывают, что три последовательных остатка аспарагиновой кислоты, по-видимому, являются критическими компонентами этой "предохранительной защелки". Положение "предохранительной защелки" чувствительно к pH, поэтому, как считается, после закисления внутриклеточной среды (которое возникает во время апоптоза) "предохранительная защелка" открывает доступ к сайту протеолиза, и активная каспаза-3 может образовываться либо под действием каспазы-9, либо с помощью механизма самоактивации.
В определенных типах рака уровни прокаспазы-3 повышены по сравнению с нормальными тканями. Исследование первичных изолятов от 20 пациентов с раком толстой кишки показало, что в среднем количество прокаспазы-3 в подобных изолятах было повышено в шесть раз по сравнению с соседними нераковыми тканями. Кроме того, уровень прокаспазы-3 повышен в некоторых нейробластомах, лимфомах и некоторых видах рака печени. Кроме того, была проведена систематическая оценка уровней прокаспазы-3 в панели из 60 клеточных линий, используемой при скрининге на рак в Экспериментальной Терапевтической Программе Национального института рака США (NCI), которая показала, что некоторые виды рака легких, рака почек, рака молочных желез и меланом демонстрируют значительно повышенные уровни экспрессии прокаспазы-3.
Вследствие роли активной каспазы-3 в осуществлении апоптоза, относительно высоких уровней прокаспазы-3 в некоторых типах раковых клеток и интригующего механизма подавления ее самоактивации с помощью "предохранительной защелки", небольшие молекулы, которые напрямую модифицируют прокаспазу-3, могут найти самое широкое применение в таргетной противораковой терапии.
Комбинированная терапия стала стандартным подходом при лечении раковых пациентов. Целью режимов применения лекарственных коктейлей при проведении комбинированной терапии является достижение синергического или аддитивного эффекта между используемыми химиотерапевтическими средствами, что должно способствовать сокращению длительности лечения, снижению их токсичности и повышению выживаемости пациентов. Лекарственные средства, воздействующие на один определенный биохимический путь, являются особенно подходящими кандидатами для возникновения синергии или потенциации, поскольку их действие может имитировать «синтетические летальные» генетические комбинации. Например, ингибиторы полимеразы-1 поли(АДФ-рибозы) (PARP-1), фермента, способствующего исправлению повреждений ДНК, потенциально способны давать синергический эффект при их использовании в комбинации со средствами, повреждающими ДНК, как это было показано на клеточных культурах, на животных моделях и в клинических испытаниях на людях. Однако при лечении многих форм рака по-прежнему существует потребность в более эффективных способах лечения, и новые синергические комбинации противораковых лекарственных средств помогут в достижении этой цели. Соответственно, существует потребность в выявлении новых цитотоксических средств, которые эффективно убивают раковые клетки и в то же время защищают нормальные ткани пациента от нежелательного токсического действия цитотоксического средства.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В широком смысле это изобретение описывает соединения, композиции и способы терапевтического лечения. В способах осуществления изобретение применимо для лечения различных раковых заболеваний и различных типов раковых клеток, в частности, рака молочной железы, лимфом, рака надпочечников, рака почек, меланом, лейкемий, нейробластом, рака легких, опухолей мозга и других известных науке. В настоящем изобретении описываются, в числе прочего, композиции и способы, включающие использование небольших молекул, способных индуцировать смерть клеток. В некоторых способах осуществления эти композиции и способы включают в себя использование соединений, способных прямо или опосредованно взаимодействовать с членами путей регуляции запрограммированной смерти клеток, например, прокаспазой-3. В некоторых способах осуществления эти композиции и способы обладают пониженной нейротоксичностью по сравнению с другими соединениями, которые прямо или опосредованно взаимодействуют с членами путей регуляции запрограммированной смерти клеток, например, с прокаспазой-3.
Комбинированная противораковая терапия может состоять из лекарственных средств, воздействующих на различные биохимические пути или на различные мишени в пределах одного пути, имитируя синтетические летальные генетические комбинации. Было показано, что комбинация активатора прокаспазы-3 РАС-1 и второго активного средства демонстрирует значительный синергический эффект в отношении индукции апоптотической смерти раковых клеток, часто в степени, значительно превосходящей простое аддитивное действие. Комбинация РАС-1 и второго активного средства может быть использована для эффективного снижения опухолевой нагрузки в опухолевых моделях, в которых эти соединения сами по себе дают лишь минимальный эффект или вообще не дают эффекта. Эти данные свидетельствуют об эффективности комбинации РАС-1 и второго средства в лечении рака, и, в более широком смысле, демонстрируют, что эта комбинация может обладать синергическими свойствами и может обеспечивать значительно более благоприятные результаты лечения.
Соответственно, в настоящем изобретении предложено использовать композицию, включающую в себя (а) соединение РАС-1:
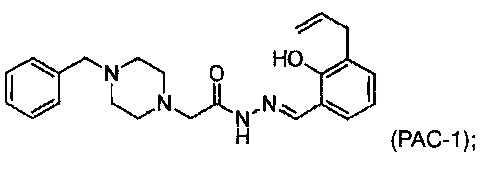
(b) второе активное средство; и (с) фармацевтически приемлемый разбавитель, наполнитель или носитель. Второе активное средство может быть, например, этопозидом, бортезомибом, ставроспорином, доксорубицином, тамоксифеном, цисплатином, карбоплатином, паклитакселом или другим химиотерапевтическим средством или иным активным средством, упомянутым в настоящем изобретении. Носитель может включать в себя воду и вспомогательные компоненты для улучшения доставки активных компонентов, например, буфер, сахар, солюбилизирующие средства, например, циклодекстрин или их различные комбинации. В одном из способов осуществления этого изобретения циклодекстрин является 2-гидроксипропил-β-циклодекстрином.
Концентрация соединения РАС-1 может составлять от приблизительно 0,2 мкМ до приблизительно 5 мМ или от приблизительно 2 мкМ до приблизительно 50 мкМ, обычно приблизительно 2,5 мкМ, около 5 мкМ, приблизительно 7,5 мкМ, около 10 мкМ, приблизительно 12,5 мкМ, приблизительно 15 мкМ, приблизительно 20 мкМ, приблизительно 25 мкМ, приблизительно 30 мкМ, приблизительно 40 мкМ или приблизительно 50 мкМ или диапазоном между любыми из вышеупомянутых значений. Концентрация второго активного средства может быть от приблизительно 1 нМ до приблизительно 1 мМ или от приблизительно 25 нМ до приблизительно 1 мМ, обычно приблизительно 1 нМ, приблизительно 2 нМ, приблизительно 3 нМ, приблизительно 5 нМ, приблизительно 10 нМ, приблизительно 25 нМ, приблизительно 50 нМ, приблизительно 100 нМ, приблизительно 250 нМ, приблизительно 500 нМ, приблизительно 750 нМ, приблизительно 900 нМ, приблизительно 1 мкМ, приблизительно 2,5 мкМ, приблизительно 5 мкМ, приблизительно 7,5 мкМ, приблизительно 10 мкМ, приблизительно 12,5 мкМ, приблизительно 15 мкМ, приблизительно 20 мкМ, приблизительно 25 мкМ, приблизительно 30 мкМ, приблизительно 40 мкМ, приблизительно 50 мкМ, приблизительно 75 мкМ, приблизительно 100 мкМ, приблизительно 125 мкМ, приблизительно 150 мкМ, приблизительно 200 мкМ, приблизительно 250 мкМ, приблизительно 300 мкМ, приблизительно 500 мкМ, приблизительно 750 мкМ или приблизительно 1 мМ или диапазоном между любыми из вышеупомянутых значений.
В одном из способов осуществления настоящего изобретения второе активное средство может являться этопозидом, и концентрация этопозида может составлять от приблизительно 0,2 мкМ до приблизительно 50 мкМ.
В другом способе осуществления второе активное средство может являться бортезомибом, и концентрация бортезомиба может составлять от приблизительно 50 нМ до приблизительно 20 мкМ.
В другом способе осуществления второе активное средство может являться ставроспорином, и концентрация ставроспорина может составлять от приблизительно 25 нМ до приблизительно 200 нМ.
В другом способе осуществления второе активное средство может являться доксорубицином, и концентрация доксорубицина может составлять от приблизительно 50 нМ до приблизительно 5 мкМ.
В другом способе осуществления второе активное средство может являться тамоксифеном, и концентрация тамоксифена может составлять от приблизительно 5 мкМ до приблизительно 50 мкМ.
В другом способе осуществления второе активное средство может являться цисплатином, и концентрация цисплатина может составлять от приблизительно 5 мкМ до приблизительно 150 мкМ.
В другом способе осуществления второе активное средство может являться карбоплатином, и концентрация карбоплатина может составлять от приблизительно 5 мкМ до приблизительно 150 мкМ.
В другом способе осуществления второе активное средство может являться паклитакселом, и концентрация паклитаксела может составлять от приблизительно 0,5 нМ до приблизительно 15 нМ.
В настоящем изобретении также предложен способ подавления роста и/или пролиферации раковых клеток, включающий в себя воздействие на раковые клетки эффективным количеством композиции, описанной в настоящем изобретении, причем это воздействие приводит к подавлению роста и/или пролиферации раковых клеток. В некоторых способах осуществления настоящего изобретения эти раковые клетки могут являться клетками лимфомы, клетками остеосаркомы, клетками рака молочных желез или клетками рака яичников. В других способах осуществления настоящего изобретения эти раковые клетки являются клетками другого типа, описанными ниже.
Кроме того, в настоящем изобретении также предложен способ индукции апоптоза в раковых клетках, включающий в себя воздействие на раковые клетки эффективным количеством соединения РАС-1:
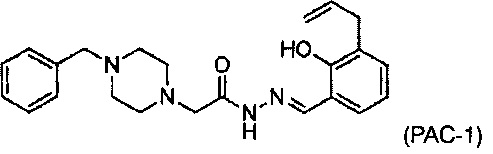
и эффективным количеством второго активного средства, отличающийся тем, что это приводит к индукции апоптоза в раковых клетках. В некоторых способах осуществления настоящего изобретения вторым активным средством является этопозид, бортезомиб, ставроспорин, доксирубицин, тамоксифен, цисплатин, карбоплатин или паклитаксел. В других способах осуществления второе активное средство является активным средством, указанным ниже. Воздействие может осуществляться in vitro или in vivo. Воздействие на раковые клетки РАС-1 и вторым активным средством может осуществляться одновременно. С другой стороны, воздействие на раковую клетку РАС-1 может осуществляться до воздействия на нее вторым активным средством, или воздействие на раковую клетку РАС-1 может осуществляться после воздействия на нее вторым активным средством.
В настоящем изобретении также предложен способ лечения рака у пациента, которому необходимо такое лечение. Этот способ включает в себя введение пациенту, одновременное или последовательное, терапевтически эффективного количества соединения РАС-1:

и эффективного количества второго активного средства и отличается тем, что это приводит к лечению рака. В некоторых способах осуществления настоящего изобретения вторым активным средством является этопозид, бортезомиб, ставроспорин, доксирубицин, тамоксифен, цисплатин, карбоплатин или паклитаксел. В других способах осуществления второе активное средство является активным средством, указанным ниже. Введение РАС-1 и второго активного средства может осуществляться одновременно. С другой стороны, введение РАС-1 может осуществляться до введения второго активного средства, или введение РАС-1 может осуществляться после введения второго активного средства. Рак может являться, например, лимфомой, остеосаркомой, раком молочной железы, раком яичников или другим типом рака, указанным в настоящем документе.
Таким образом, изобретение позволяет использовать описанные в нем композиции в медикаментозной терапии. Эта терапия может быть направлена на лечение рака, например, лимфомы, рака молочной железы, рака легких, рака поджелудочной железы, рака простаты, рака толстой кишки и других типов рака, содержащихся в настоящем изобретении. Это изобретение также позволяет использовать описанную в нем композицию для производства медикаментов для лечения заболеваний у млекопитающих, например, рака у людей. Таким образом, это изобретение позволяет использовать описанные в нем соединения для производства медикаментов, которые могут быть полезными при лечении рака у млекопитающих, в частности, у людей. Эти медикаменты могут включать в себя фармацевтически приемлемые разбавители, наполнители и/или носители.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Приведенные ниже чертежи являются частью описания изобретения; они включены для того, чтобы дополнительно продемонстрировать определенные способы осуществления или различные аспекты настоящего изобретения. В некоторых случаях способы осуществления изобретения могут быть наилучшим образом поняты после изучения прилагающихся чертежей в сочетании с их полным описанием, представленным в этом документе. Описания и прилагаемые чертежи могут подчеркивать определенный конкретный пример или определенные аспекты настоящего изобретения. Однако специалист в данной области поймет, что частично такой пример или такие аспекты могут использоваться в комбинации с другими примерами или аспектами настоящего изобретения.
Фиг. 1. Химические структуры структурно разнообразных химиотерапевтических средств: РАС-1, SPAC-1, этопозида, доксорубицина, бортезомиба, ставроспорина и тамоксифена.
Фиг. 2. Влияние РАС-1 в сочетании с этопозидом на смерть клеток линии U-937 (лимфомы). Пунктирные линии представляют уровни, соответствующие чисто аддитивному действию. Подписи соответствуют столбцам на столбчатой диаграмме следующим образом: левый столбец = 0 мкМ этопозида; средний столбец = 2,5 мкМ этопозида; правый столбец = 5 мкМ этопозида.
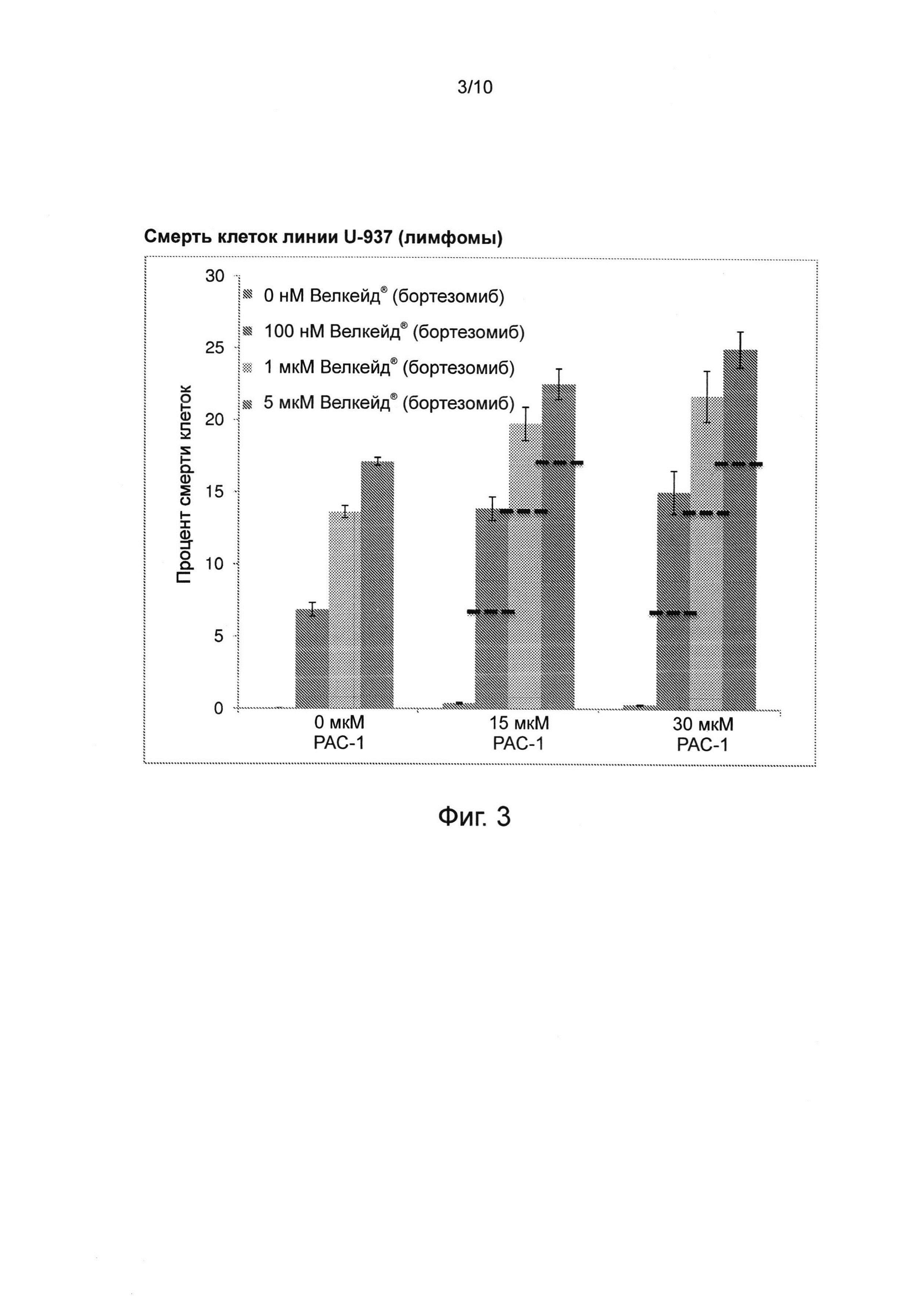
Фиг. 3. Влияние РАС-1 в сочетании с Велкейдом® (бортезомибом) на смерть клеток линии U-937 (лимфомы). При действии 0 нМ бортезомиба в сочетании с 0 мкМ РАС-1 смерти клеток не наблюдалось. Смерть клеток измерялась после нахождения в течение 6 часов в растворе бортезомиба. Пунктирные линии представляют ожидаемые уровни, соответствующие чисто аддитивному действию; таким образом, эта комбинация демонстрирует синергическое действие в терапевтически значимых концентрациях.
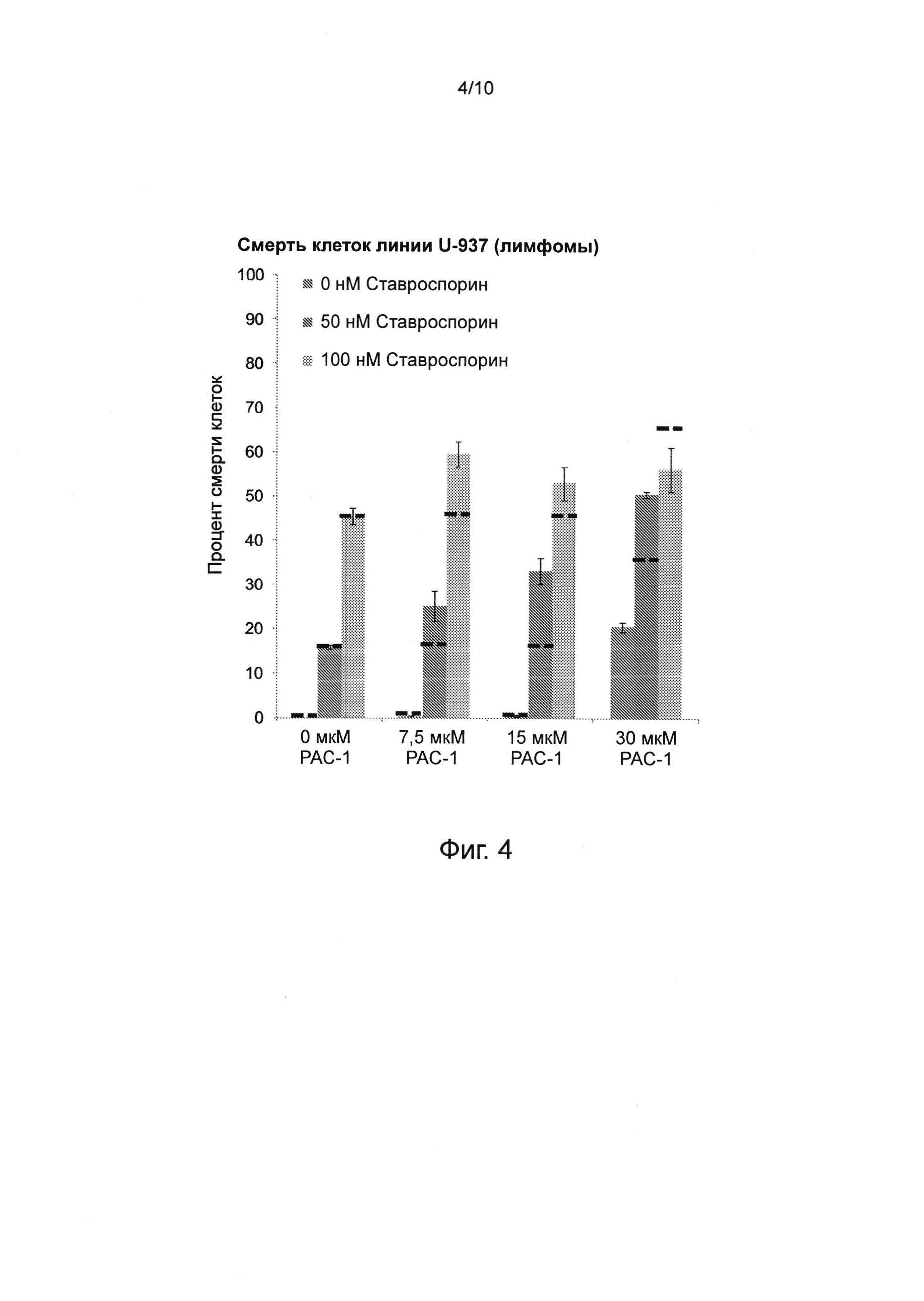
Фиг. 4. Влияние РАС-1 в сочетании со ставроспорином на смерть клеток линии U-937 (лимфомы). При действии 0 нМ бортезомиба в сочетании с 0-15 мкМ РАС-1 смерти клеток практически не наблюдалось. Смерть клеток измерялась после нахождения в течение 8 часов в растворе ставроспорина. Пунктирные линии представляют ожидаемые уровни, соответствующие чисто аддитивному действию; таким образом, эта комбинация демонстрирует синергическое действие в терапевтически значимых концентрациях.
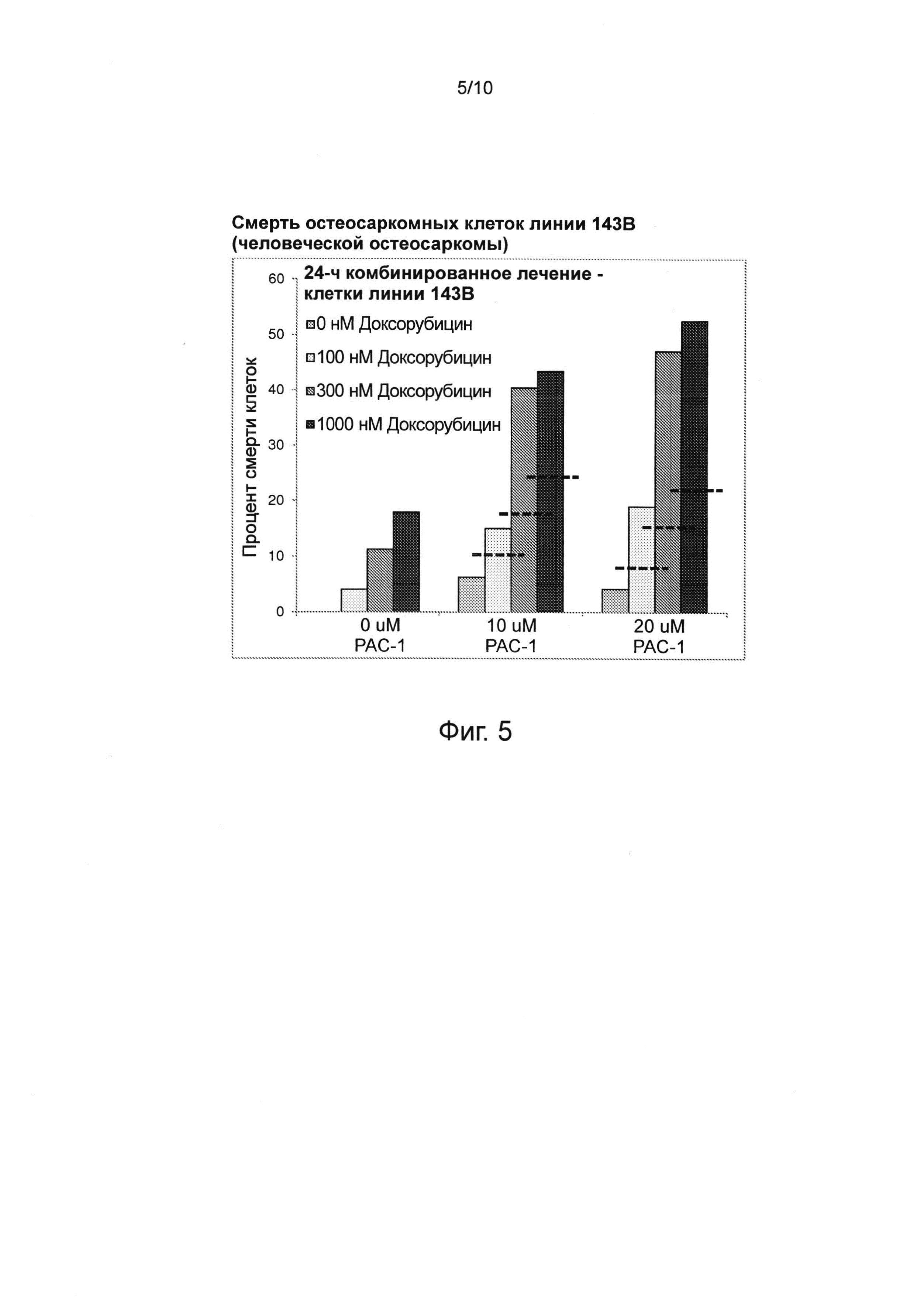
Фиг. 5. РАС-1 оказывает синергическое действие в сочетании с доксорубицином при убийстве остеосаркомных клеток линии 143 В (человеческой остеосаркомы). Подписи соответствуют столбцам на столбчатой диаграмме - верхняя подпись соответствует самому левому столбцу, а остальные подписи соответствуют оставшимся столбцам, причем порядок их расположения сверху вниз соответствует расположению столбцов слева направо. При действии 0 нМ доксорубицина в сочетании с 0 мкМ РАС-1 смерти клеток не наблюдалось. Пунктирные линии представляют ожидаемые уровни, соответствующие чисто аддитивному действию; таким образом, эта комбинация демонстрирует синергическое действие в терапевтически значимых концентрациях.
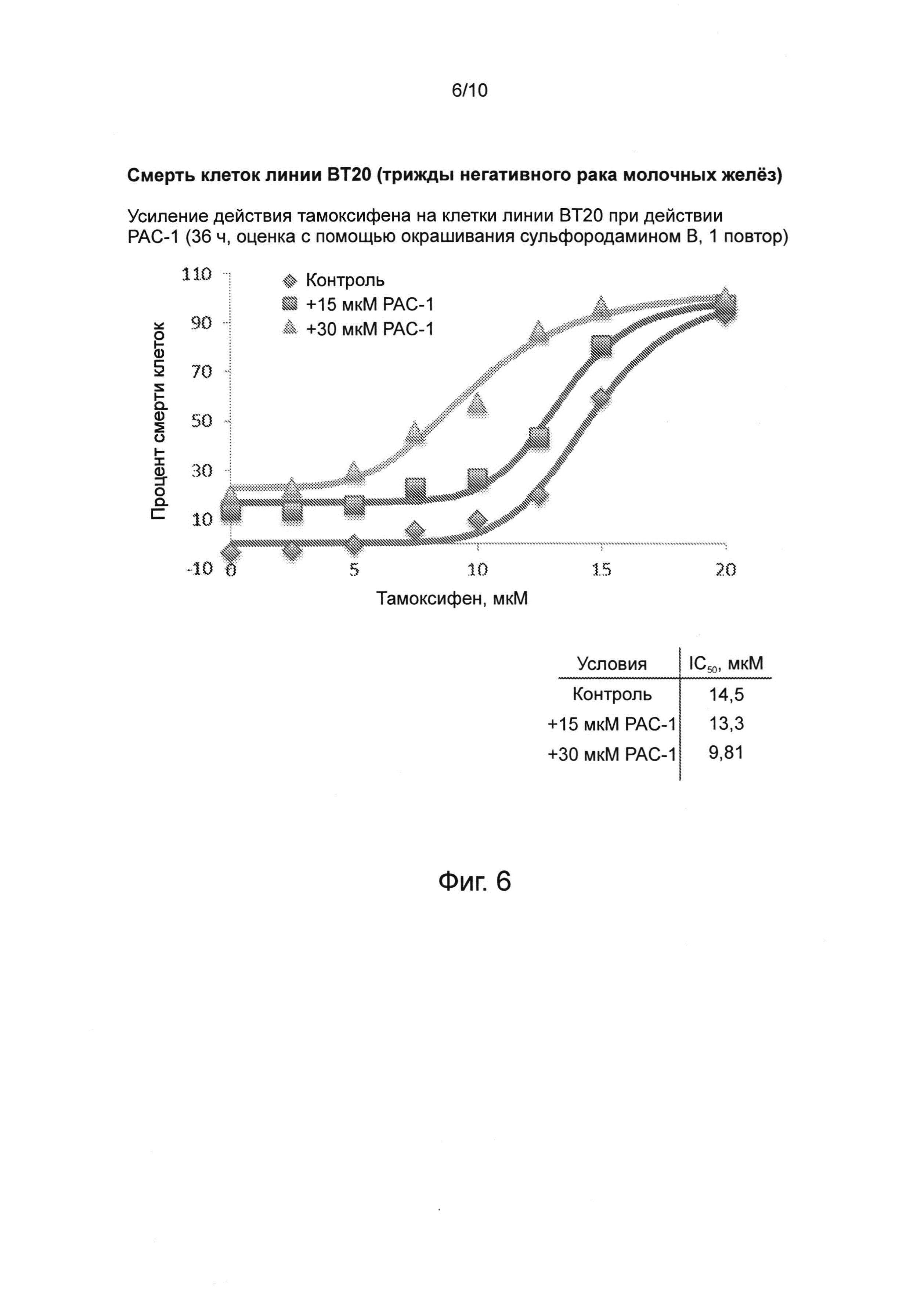
Фиг. 6. РАС-1 потенцирует действие тамоксифена в клетках линии ВТ20 (трижды негативного рака молочных желез), оценивавшееся через 36 ч при различных концентрациях РАС-1 и тамоксифена.
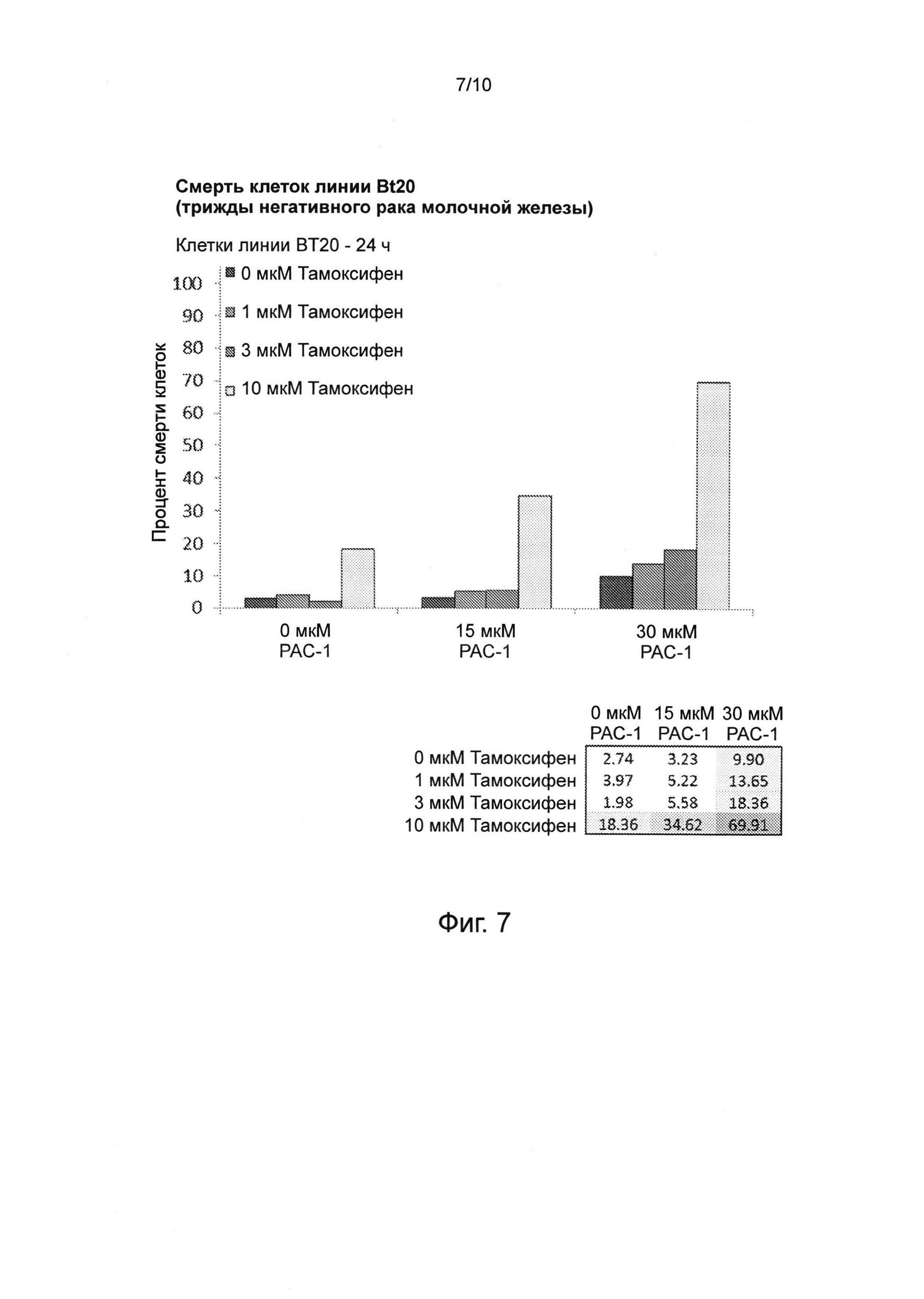
Фиг. 7. Комбинация РАС-1 и тамоксифена оказывает синергическое действие при убийстве клеток линии ВТ20 (трижды негативного рака молочной железы), оценивавшееся через 24 ч при различных концентрациях РАС-1 и тамоксифена. Подписи соответствуют столбцам на столбчатой диаграмме - верхняя подпись соответствует самому левому столбцу, а остальные подписи соответствуют оставшимся столбцам, причем порядок их расположения сверху вниз соответствует расположению столбцов слева направо.
Фиг. 8. Комбинация РАС-1 и тамоксифена оказывает синергическое действие при убийстве клеток линии MDA MB 436 (трижды негативного рака молочной железы), оценивавшееся через 24 ч при различных концентрациях РАС-1 и тамоксифена. Подписи соответствуют столбцам на столбчатой диаграмме - верхняя подпись соответствует самому левому столбцу, а остальные подписи соответствуют оставшимся столбцам, причем порядок их расположения сверху вниз соответствует расположению столбцов слева направо.
Фиг. 9. Комбинация РАС-1 и цисплатина оказывает синергическое действие при убийстве клеток линии IGROV-1 (карциномы яичников), оценивавшееся через 40 ч при различных концентрациях РАС-1 и цисплатина с помощью окрашивания Аннексином V/йодидом пропидия. Подписи соответствуют столбцам на столбчатой диаграмме - верхняя подпись соответствует самому левому столбцу (отсутствует для 0 мкМ цисплатина), а остальные подписи соответствуют оставшимся столбцам, причем порядок их расположения сверху вниз соответствует расположению столбцов слева направо.
Фиг. 10. Комбинация РАС-1 и паклитаксела оказывает синергическое действие при убийстве клеток линии IGROV-1 (карциномы яичников), оценивавшееся через 40 ч при различных концентрациях РАС-1 и паклитаксела с помощью окрашивания Аннексином V/йодидом пропидия. Подписи соответствуют столбцам на столбчатой диаграмме - верхняя подпись соответствует самому левому столбцу (отсутствует для 0 мкМ паклитаксела), а остальные подписи соответствуют оставшимся столбцам, причем порядок их расположения сверху вниз соответствует расположению столбцов слева направо.
Фиг. 11. РАС-1 оказывает синергическое действие в сочетании с карбоплатином при индукции смерти клеток линии HOS (человеческой остеосаркомы) в культуре. Клетки обрабатывались одновременно обоими соединениями в течение 8 ч, после чего среда заменялась, и колониям давали расти в течение 7 дней.
Фиг. 12. РАС-1 оказывает синергическое действие в сочетании с карбоплатином при индукции смерти клеток линии 143В (человеческой остеосаркомы) в культуре. Клетки обрабатывались одновременно обоими соединениями в течение 8 ч, после чего среда заменялась, и колониям давали расти в течение 7 дней.
ПОЛНОЕ ОПИСАНИЕ
В качестве дополнительного введения были открыты соединения, способные активировать фермент, который часто сверхэкспрессируется или просто присутствует в повышенных количествах в его неактивной форме в раковых клетках. Эти соединения способны индуцировать запрограммированную смерть клеток (апоптоз) в раковых клетках, включая те из них, в которых имеются повышенные уровни прокаспазы-3 или ее повышенная активность. Многие типы рака устойчивы к стандартной химиотерапии. Комбинированная терапия, описанная в настоящем изобретении, основана на активации прокаспазы-3 под действием РАС-1, которая дает синергический эффект в сочетании с химиотерапевтическими свойствами второго активного средства для обеспечения эффективности лечения в условиях, когда одно из активных соединений в одиночку было бы менее эффективно или совершенно неэффективно. Эти соединения могут также успешно применяться в таргетной противораковой терапии, где они могут обеспечивать преимущества в виде селективного убийства раковых клеток при сравнительно слабых отрицательных побочных воздействиях на нераковые клетки с более низкими уровнями прокаспазы-3. Эти отрицательные побочные действия могут включать в себя токсичность, в частности, нейротоксичность.
Комбинация соединений, композиций и способов, описанных в настоящем изобретении, может оказывать свое действие путем модуляции апоптоза или запрограммированной смерти клеток и иных химиотерапевтических механизмов для обеспечения эффективности при раковых клеток. В одном из способов осуществления настоящего изобретения модуляция апоптоза осуществляется с помощью индукции или активации апоптоза. В различных способах осуществления настоящего изобретения введение соединений может быть одновременным или, вместо этого, последовательным.
Таким образом, в настоящем изобретении предложены способы потенциации действия активного средства РАС-1, например, для лечения лимфом, остеосарком или рака молочных желез. Во время апоптоза зимогенная форма прокаспазы-3 активируется с помощью протеолиза с образованием каспазы-3, и эта активная каспаза-3 затем расщепляет большое количество клеточных субстратов, осуществляя программу апоптоза. Поскольку уровни белка прокаспазы-3 повышены в опухолях различных гистологических типов, прямая активация прокаспазы-3 с помощью лекарственных средств может быть высокоэффективной стратегией селективного противоракового лечения.
Некоторые соединения могут усиливать активность прокаспазы-3 и ее способность к самоактивации и индуцировать апоптоз в раковых клетках. РАС-1 (активирующее прокаспазу соединение-1, см. Фиг. 1) повышает активность прокаспазы-3 за счет образования хелатных комплексов с ионами цинка, обладающими ингибирующими свойствами, индуцирует апоптоз в раковых клетках в культуре и обладает эффективностью в многочисленных мышиных моделях опухолей. Было выявлено, что новые комбинации РАС-1 и нескольких других терапевтических средств характеризуются синергической эффективностью при лечении раковых клеток, в особенности лимфомных клеток, остеосаркомных клеток и клеток рака молочной железы, как это описано в настоящем изобретении. Поскольку РАС-1 действует на позднем этапе апоптотического каскада, оно обладает уникальной способностью оказывать синергическое действие в сочетании с широким спектром химиотерапевтических активных средств, как это описано ниже.
Определения
При использовании в настоящем документе перечисленные ниже термины имеют указанные далее значения. Все прочие термины и фразы, используемые в данном описании, имеют свои обычные значения, понятные специалистам в данной области. Эти обычные значения можно найти в технических словарях, например, в Hawley's Condensed Chemical Dictionary 14th Edition, by R.J. Lewis, John Wiley & Sons, New York, N.Y., 2001 (Кратком химическом словаре Хоули, 14-я редакция, под редакцией Р.Дж. Льюиса, издательство "Джон Уайли и сыновья", Нью-Йорк, штат Нью-Йорк, 2001).
Ссылки в описании на "один из способов осуществления", "способ осуществления" и т.д. указывают, что описанный способ осуществления может включать в себя определенный аспект, особенность, структуру, группу или характеристику, однако не обязательно, что каждый из способов осуществления обязательно должен включать в себя этот аспект, особенность, структуру, группу или характеристику. Более того, подобные фразы могут ссылаться на тот же способ осуществления, который упоминается в других частях настоящего описания, однако это не обязательно так. Кроме того, когда определенный аспект, особенность, структура, группа или характеристика описывается в связи с каким-либо способом осуществления, специалист в данной области должен быть способны отразить или связать этот аспект, особенность, структуру, группу или характеристику с другими способами осуществления, независимо от того, описаны ли они явно или нет.
Существительные в единственном числе также включают в себя соответствующие существительные во множественном числе, и наоборот, за исключением случаев, когда из контекста четко следует обратное. Таким образом, термин "соединение" может также подразумевать множество подобных соединений, т.е. под соединением X может подразумеваться множество соединений типа X. Необходимо дополнительно отметить, что элементы формулы изобретения могут быть сформулированы таким образом, чтобы исключить любые вариантные элементы. Таким образом, это утверждение предназначено для того, чтобы служить в качестве антецедентного основания для использования исключительной терминологии, например, "исключительно", "только" и т.п., в связи с перечислением элементов формулы изобретения или использованием "отрицательных" ограничений.
Термин "и/или" означает любой из далее перечисленных вариантов, любую их комбинацию или их всех. Фраза "один или более" легко понятна для специалистов в данной области, в особенности в контексте ее использования. Например, "одна или более замещающая группа на фенильном кольце" может подразумевать от одной до пяти замещающих групп или, например, от одной до четырех, если две его связи уже участвуют в образовании основных структурных связей.
Термины "около" и "приблизительно" могут означать вариацию ±5%, ±10%, ±20% или ±25% относительно указанного далее значения. Например, "около 50%" в некоторых способах осуществления настоящего изобретения может означать вариацию от 45% до 55%. Для целочисленных диапазонов термины "около" и "приблизительно" могут означать вариацию их границ в большую или меньшую сторону на одну или две единицы относительно их указанных значений. Если в данном описании не оговорено иное, в данном документе термины "около" и "приблизительно" могут подразумевать значения, например, весовых процентов, примыкающие к указанным диапазонам, эквивалентные им в контексте функциональности индивидуальных ингредиентов, композиции или способа осуществления.
Опытным специалистам будет понятно, что все числа, включая те, что выражают количества ингредиентов, свойства (например, молекулярную массу), условия реакции и т.д., являются приближенными значениями, и подразумевается, что во всех случаях они необязательно дополнены терминами "около" и "приблизительно". Эти значения могут варьироваться в зависимости от того, каких необходимых свойств пытаются достичь специалисты в данной области при использовании сведений из описания данного изобретения. Также подразумевается, что подобным значениям заведомо присуща изменчивость, автоматически возникающая на основе стандартных отклонений при проведении соответствующих тестовых измерений.
Как будет понятно специалистам в этой области, во всех случаях, особенно в случае предоставления письменного описания, все диапазоны, указанные в настоящем изобретении, также включают в себя любые их возможные поддиапазоны и их комбинации, а также индивидуальные значения, составляющие эти диапазоны, в особенности целочисленные значения. Указанный диапазон (например, весовых процентов или углеводородных групп) включает в себя каждое конкретное значение, целое число, десятичную дробь или член в пределах этого диапазона. Можно легко понять, что любой указанный диапазон в достаточной мере описывает его содержимое, и этот диапазон может быть разбит, по меньшей мере, на равные половины, трети, четверти, пятые доли или десятые доли. В качестве примера, не имеющего ограничительного характера, каждый диапазон, обсуждаемый в настоящем изобретении, может быть легко подразделен на его нижнюю треть, среднюю треть и верхнюю треть, и т.д. Как будет понятно специалистам в этой области науки, все термины, подобные "вплоть до", "по меньшей мере", "больше чем", "меньше чем", "более чем", "или более" и т.п., включают в себя указанные числа, и подобные термины обозначают диапазоны, которые в дальнейшем могут подразделяться на поддиапазоны, как это было обсуждено выше. Аналогичным образом, все соотношения, указанные в настоящем изобретении, также включают с себя все прочие соотношения, попадающие в пределы исходного более широкого соотношения.
Соответственно, конкретные значения, указываемые для радикалов, заместителей и диапазонов, приводятся исключительно в иллюстративных целях, и они не исключают другие определенные значения или иные значения в пределах указанных диапазонов для радикалов и заместителей.
Специалисты в этой области также смогут легко понять, что когда члены сгруппированы вместе неким общим образом, например, в форме группы Маркуша, то изобретение включает в себя не только всю указанную группу в целом, но и каждый член этой группы по отдельности, а также все возможные подгруппы основной группы. Кроме того, во всех отношениях, это изобретение включает в себя не только основную группу, но и основную группу за вычетом одного или нескольких ее членов. Таким образом, это изобретение предусматривает возможность явного исключения одного или нескольких членов из упомянутой в нем группы. Соответственно, оговорки могут применяться к любым из описанных категорий или способов осуществления таким образом, что любой один или любые несколько указанных элементов, видов или способов осуществления могут быть исключены из подобных категорий или воплощений, например, как при использовании в случае явного отрицательного ограничения.
Термин "воздействие/применение" означает соприкосновение или приведение в непосредственную близость или просто сближение, в том числе на клеточном или на молекулярном уровне, например, для достижения физиологической реакции, химической реакции или физического изменения, например, в растворе, в реакционной смеси, in vitro или in vivo.
Термин "одновременно" означает (1) единовременно, или (2) в различное время в рамках единого общего курса лечения.
Термин "последовательно" означает применение одного активного средства, используемого в способе, после которого следует применение другого активного средства. После применения одного активного средства следующее активное средство может быть применено непосредственно сразу после первого, или следующее активное средство может быть применено по истечении эффективного периода времени после применения первого активного средства; под "эффективным периодом времени" в данном случае понимается количество времени, отводимое на получение максимальной пользы от применения первого активного средства.
Термин "эффективное количество" означает количество, эффективное при лечении заболевания, нарушения и/или состояния или для достижения указанного эффекта, например, активации или ингибирования. Например, эффективным количеством может быть количество, эффективно снижающее прогрессию или степень тяжести состояния или симптомов, подвергающихся лечению. Определение терапевтически эффективного количества находится вполне в пределах способностей квалифицированных специалистов. Предполагается, что термин "эффективное количество" включает в себя количество соединения, описанного в настоящем изобретении, или количество комбинации соединений, описанной в настоящем изобретении, которое, например, эффективно при лечении или предотвращении заболевания или нарушения или при лечении симптомов заболевания или нарушения у пациента. Таким образом, "эффективное количество" обычно означает количество, обеспечивающее достижение желаемого эффекта. В одном из способов осуществления настоящего изобретения под эффективным количеством понимается количество активного средства, описанного в настоящем изобретении, которое эффективно, поодиночке или в комбинации с фармацевтическим носителем, после одно- или многодозового воздействия на клетки или организм, например, пациента, в подавлении роста и/или пролиферации, в том числе убийстве, или предотвращении роста гиперпролиферативных клеток. Подобное ингибирование роста или убийство может приводить к увеличению длительности выживания организма, например, пациента, сверх срока, ожидаемого в отсутствие подобного лечения, или к любому улучшению прогноза для него по сравнению с отсутствием подобного лечения.
Термины "лечить" и "лечение" включают в себя (i) предотвращение возникновения заболевания, патологического или медицинского состояния (т.е. профилактика); (ii) подавление заболевания, патологического или медицинского состояния или остановка его развития; (iii) ослабление или полное излечение заболевания, патологического или медицинского состояния; и/или (iv) ослабление симптомов, связанных с заболеванием, патологическим или медицинским состоянием. Таким образом, термины "лечить" и "лечение" могут распространяться на профилактику и могут включать в себя предотвращение, замедление, остановку или поворот вспять прогрессии или степени тяжести состояния или симптомов, подвергающихся лечению. Таким образом, термин "лечение" может включать в себя соответствующие медицинские, терапевтические и/или профилактические воздействия и процедуры. В некоторых способах осуществления настоящего изобретения термины "лечить", "лечение" и "подвергшийся лечению" могут означать (i) предотвращение роста опухоли или ее повторного роста (профилактику), (ii) ослабление или устранение симптомов или интересующего заболевания (терапию) или (iii) устранение или разрушение опухоли (излечение).
Термины "подавлять/ингибировать", "подавляющий/ингибирующий" и "подавление/ингибирование" означают замедление, остановку или поворот вспять роста или прогрессии заболевания, инфекции, состояния или группы клеток. Это ингибирование/подавление может быть больше, чем приблизительно 20%, 40%, 60%, 80%, 90%, 95% или 99%, например, по сравнению с ростом или прогрессией, возникающими в отсутствие лечения или воздействия. Кроме того, термины "индуцировать/вызывать", "ингибировать/подавлять", "усиливать/потенцировать", "поднимать", "повышать", "снижать" и т.п. означают количественные различия между двумя состояниями и могут означать по меньшей мере статистически значимые различия между двумя состояниями. Например, фраза "количество, эффективно подавляющее рост гиперпролиферативных клеток" означает, что скорость роста этих клеток может, в некоторых способах осуществления настоящего изобретения, по меньшей мере статистически достоверно отличаться от скорости роста клеток, не подвергшихся лечению. Подобные термины могут использоваться в настоящем изобретении, например, в отношении скоростей пролиферации.
Фразы "подавление/ингибирование роста и/или пролиферации" гиперпролиферативных клеток, например неопластических клеток, означают замедление, прерывание или временную или полную остановку их роста и метастазирования, и не обязательно означает полное устранение неопластического роста.
Термином "рак" обычно означается любое из группы из более чем 100 заболеваний, вызываемых неконтролируемым ростом аномальных клеток. Рак может иметь форму солидных опухолей и лимфом, и также несолидных раковых заболеваний, например, лейкемий. В отличие от нормальных клеток, которые делятся только до момента их созревания, а потом - только в случае необходимости замещения поврежденных клеток, раковые клетки способны расти и делиться бесконечно, постепенно вытесняя соседние клетки и со временем распространяясь на другие части организма.
В настоящем изобретении предложены способы для лечения рака и раковых состояний. Термином "раковое состояние" обозначаются любые состояния, при которых клетки находятся в аномальном состоянии, и состояния, характеризующиеся быстрой пролиферацией или неоплазией. Раковое состояние может быть злокачественным или незлокачественным (т.е. предраковым состоянием) по своей природе. Для более полного описания "ракового состояния" могут использоваться термины "гиперпролиферативное", "гиперпластическое", "гиперплазия", "злокачественное", "неопластическое" и "неоплазия". Эти термины могут замещать друг друга, и предполагается, что они включают в себя все типы гиперпролиферативного роста, гиперпластического роста, ракового роста и онкогенных процессов, метастатических тканей и злокачественно трансформированных клеток, тканей и органов, независимо от их гистопатологического типа, стадии инвазивности или определения злокачественности состояния (т.е. злокачественные и незлокачественные).
Термин "неоплазия" означает рост новых клеток, приводящий к потере способности реагировать на нормальные сигналы, контролирующие рост клеток, т.е. неопластический рост клеток. Термин "гиперплазия" означает клетки с аномально высокой скоростью роста. Эти термины, однако, могут замещать друг друга, поскольку из их контекста будет очевидно, что в общем случае речь идет о клетках, испытывающих аномально быстрый рост."Неоплазии" и "гиперплазии" включают в себя опухоли, которые могут являться доброкачественными, презлокачественными, карциномами in situ, злокачественными, солидными или несолидными. Примеры некоторых злокачественных состояний, находящихся в рамках настоящего изобретения, включают в себя, в частности, рак анального канала, переходноклеточный рак мочевого пузыря, рак костей, рак молочной железы, рак шейки матки, колоректальный рак, рак желудка, раковые образования головы и шеи, саркому Капоши, лейкемии, рак легких, например, бронхогенный рак легких, мелкоклеточный рак легких и немелкоклеточный рак легких, лимфома Ходжкина, неходжкинская лимфома, злокачественные лимфомы, нейробластомы, остеогенные карциномы (т.е. рак кости), раковые заболевания глаз (например, ретинобластомы и другие раковые заболевания глаз), рак яичников, рак простаты, рак почек, раковые заболевания кожи, например, меланомы, саркомы мягких тканей, рак щитовидной железы и опухоли Вильмса. Другие примеры незлокачественных гиперпролиферативных состояний (т.е. предраковых состояний), находящихся в рамках объема настоящего изобретения, включают в себя, в частности, аденомы, хондромы, энхондромы, фибромы, миомы, миксомы, невриномы, остеобластомы, остеохондромы, остеомы, папилломы и т.п.
Термины "лейкемия/лейкоз" или "лейкемический рак" означают любые раковые заболевания или неоплазии кроветворной и иммунной систем (системы крови и лимфатической системы). Эти термины означают прогрессирующие злокачественные заболевания кроветворных органов, характеризующиеся аномальной пролиферацией и созреванием лейкоцитов и их предшественников в крови и в костном мозге. Термином "миеломы" обозначаются другие типы опухолевых заболеваний клеток крови и костного мозга. Термином "лимфомы" обозначаются опухоли лимфатической ткани. Примеры лейкемий включают в себя острый миелогенный лейкоз (AML), острый лимфобластный лейкоз (ALL) и хронический миелогенный лейкоз (CML).
Как описано в настоящем изобретении, предлагаемые в нем композиции и способы могут использоваться для лечения или предотвращения различных неопластических нарушений, включая такие состояния как акральные лентигинозные меланомы, актинические кератозы, аденокарциномы, аденоидные кистозные карциномы, аденомы, аденосаркомы, аденосквамозные карциномы, астроцитарные опухоли, карциномы бартолиновых желез, базальноклеточные карциномы, карциномы бронхиальных желез, опухоли капилляров, карциноидные опухоли, карциномы, карциносаркомы, кавернозные опухоли, холангиокарциномы, хондросаркомы, папилломы/карциномы хороидного сплетения, светлоклеточные карциномы, кистозные аденомы, опухоли эндодермального синуса, гиперплазии эндометрия, эндометриальные стромальные саркомы, эндометриоидные аденокарциномы, эпендимальные опухоли, эпителиоидные опухоли, саркома Юинга, фиброламеллярные опухоли, фокальные нодулярные гиперплазии, гастриномы, герминогенные опухоли, глиобластомы, глюкагономы, гемангиобластомы, гемангиоэндотелиомы, гемангиомы, аденомы печени, печеночный аденоматоз, гепатоцеллюлярные карциномы, инсулиномы, интраэпителиальные неоплазии, интерэпителиальные сквамозноклеточные неоплазии, инвазивные сквамозноклеточные карциномы, крупноклеточные карциномы, лейомиосаркомы, злокачественные лентиго-меланомы, злокачественные меланомы, злокачественные мезотелиальные опухоли, медуллобластомы, медуллоэпителиомы, меланомы, менингеальные опухоли, мезотелиальные опухоли, метастатические карциномы, мукоэпидермоидные карциномы, нейробластомы, нейроэпителиальные аденокарциномы, узловатые меланомы, овсяноклеточные карциномы, одигодендроглиальные опухоли, остеосаркомы, опухоли, секретирующие панкреатический полипептид, папиллярные серозные аденокарциномы, пинеалоцитарные опухоли, опухоли гипофиза, плазмоцитомы, псевдосаркомы, легочные бластомы, почечноклеточные карциномы, ретинобластомы, рабдомиосаркомы, саркомы, серозные карциномы, мелкоклеточные карциномы, карциномы мягких тканей, опухоли, секретирующие соматостатин, сквамозные карциномы, сквамозноклеточные карциномы, субмезотелиальные опухоли, поверхностно распространяющиеся меланомы, недифференцированные карциномы, увеальные меланомы, веррукозные карциномы, ВИПомы, хорошо дифференцированные карциномы и опухоли Вильмса. Соответственно, композиции и способы, описанные в настоящем изобретении, могут использоваться для лечения рака мочевого пузыря, рака мозга (включая интракраниальные новообразования, например, глиомы, менингиомы, невриномы и аденомы), рака молочной железы, рака толстой кишки, рака легких (сквамозноклеточного рака легких и несквамозноклеточного рака легких), рака яичников, рака поджелудочной железы и рака простаты.
В некоторых способах осуществления настоящего изобретения комбинация РАС-1 и второго активного средства (например, химиотерапевтического средства, указанного в настоящем изобретении) может быть особенно эффективна при лечении раковых заболеваний мозга. Раковые заболевания мозга включают в себя, в частности, олигодендроглиомы и глиобластомы, в том числе, мультиформную глиобластому (GBM). Ткани, поражаемые этими раковыми клетками, могут включать в себя сам мозг (т.е. черепную коробку или спинномозговой канал), лимфатические ткани, кровеносные сосуды, черепные нервы, оболочки мозга (мягкие мозговые оболочки), череп, гипофиз и эпифиз. Конкретные формы рака мозга, поддающиеся лечению, включают в себя астроцитомы, хондромы, хондросаркомы, хордомы. лимфомы центральной нервной системы (ЦНС), краниофарингиомы, эпендимомы, ганглиоглиомы, ганглионевромы (также известные как ганглиоцитомы), глиомы, включая астроцитомы, олигодендроглиомы и эпендимомы, гемангиобластомы (также известные как сосудистые опухоли), примитивные нейроэктодермальные опухоли (PNET), такие, как медуллобластомы, менингиомы и вестибулярные шванномы (ранее известные шванномы/невриномы слуховых нервов).
Данная комбинация может также использоваться для лечения метастатических опухолей, проникающих во внутричерепное пространство из раковых опухолей, возникших в других органах тела. Эти состояния обычно называют вторичными опухолями мозга. Вторичные опухоли мозга, которые могут подвергаться лечению комбинацией РАС-1 и второго активного средства, включают в себя метастатические опухоли мозга, возникшие из рака легких, рака молочной железы, злокачественных меланом, рака почек, рака толстой кишки и других карцином.
Другие примеры раковых состояний, которые находятся в рамках настоящего изобретения, включают в себя, в частности, нейробластомы и остеогенные карциномы (т.е. рак костей или неопластические разрастания ткани в костях). Примеры злокачественных первичных костных опухолей, которые можно лечить с использованием комбинации РАС-1 и второго активного средства, включают в себя остеосаркомы, хондросаркомы, саркомы Юинга, фибросаркомы и т.п. С ее помощью также можно лечить вторичные костные опухоли, в частности, метастатические поражения, распространившиеся из других органов, включая карциномы груди, легких и простаты.
Терапевтические средства и их активность
Активирующее прокаспазу соединение-1 (РАС-1, 2-(4-бензилпиперазин-1-ил)-N-[(2-гидрокси-3-проп-2-енилфенил)метилиденамино]ацетамид) селективно индуцирует апоптоз в раковых клетках. Структура РАС-1 показана на Фиг. 1, а способы получения РАС-1 описаны в Публикации патента США №2012/0040995 (Hergenrother et al. / Хергенротер и др.).

РАС-1 повышает активность прокаспазы-3 за счет образования хелатных комплексов с ионами цинка, обладающими ингибирующими свойствами, индуцируя апоптоз в раковых клетках. РАС-1 может способствовать повышению активности и самоактивации прокаспазы-3 и индукции апоптоза в раковых клетках. РАС-1 также повышает химиотерапевтическую активность ряда других лекарственных препаратов, зачастую когда РАС-1 само по себе или второе активное средство являются менее эффективными или абсолютно неэффективными. Соответственно, открытие способности РАС-1 оказывать синергическое действие в отношении активности многочисленных классов химиотерапевтических средств стало неожиданным. Примеры классов соединений, способных давать синергический эффект в сочетании с РАС-1, включают в себя:
(a) Семейство ингибиторов/модуляторов bcl-2 (включая ингибиторы bax и bcl-х1);
(b) Модуляторы белков, содержащих мотив BIR (например, сурвивина, миметиков SMAC и т.п.);
(c) Модуляторы/стабилизаторы или ингибиторы микротрубочек или элементов цитоскелета (например, таксаны, в частности, паклитаксел и доцетаксел);
(d) Алкилирующие средства, например, циклофосфамид и DTIC, и цитотоксические антибиотики, например, доксорубицин;
(e) Средства, способные интеркалировать в ДНК (например, платины, в частности, цисплатин, карбоплатин и оксалиплатин);
(f) Средства, модулирующие аутофагию, например, темозоломид;
(g) Ингибиторы передачи сигналов в опухолевых клетках (например, ингибиторы EGFR дикого типа или их мутантных форм, braf, Ras, AKT, сМЕТ, mTOR, PI3K, BTK, члены семейства JAK/STAT, MEK);
(h) Ингибиторы/модуляторы рецепторов сигнальных систем (например, тамоксифен, антитела к EGFR, CD20, CD19 и другим, оверэкспрессируемым или обычно экспрессируемым на поверхности опухолевых клеток);
(i) Ингибиторы/модуляторы ангиогенеза (например, VEGF, VEGFR, ангиогенины, ангиостатины, белки TIE, эндостатины и т.п.);
(j) Модуляторы механизмов иммунного ответа (например, вакцины, средства для клеточной терапии, ингибиторы контрольных точек, провоспалительные цитокины/антитела, адъюванты и т.п.); и
(k) Ингибиторы протеасом, например, бортезомиб.
Примеры специфических химиотерапевтических средств (активных средств или "вторых активных средств"), которые могут оказывать благоприятное воздействие в сочетании с РАС-1, включают в себя, например, следующие активные средства: цисплатин, этопозид, иринотекан, камптостар, топотекан, паклитаксел, доцетаксел, эпотилоны, таксотер, тамоксифен, 5-фторурацил, метотрексат, темозоломид, циклофосфамид, SCH 66336, R115777, L778,123, BMS 214662, гефитиниб, гидрохлорид эрлотиниба, антитела к EGFR, иматиниб, интрон, Ara-С, цитоксан, гемцитабин, урамустин, хлорметин, ифосфамид, мелфалан, хлорамбуцил, пипоброман, триэтиленмеламин, триэтилентиофосфорамин, бусульфан, кармустин, ломустин, стрептозоцин, дакарбазин, флоксуридин, цитарабин, 6-меркаптопурин, 6-тиогуанин, фосфат флударабина, пентостатин, винбластин, винкристин, виндезин, блеомицин, доксорубицин, дактиномицин, даунорубицин, эпирубицин, идарубицин, митрамицин, дезоксикоформицин, L-аспарагиназу, тенипозид, этинилэстрадиол, диэтилстильбэстрол, тестостерон, преднизон, флуоксиместерон, пропионат дромостанолона, тестолактон, ацетат мегэстрола, метилпреднизолон, метилтестостерон, преднизолон, триамцинолон, хлортрианизен, гидроксипрогестерон, аминоглютетимид, эстрамустин, ацетат медроксипрогестерона, лейпролид, флутамид, торемифен, госерелин, гидроксимочевину, амсакрин, прокарбазин, митотан, митоксантрон, левамизол, навельбин, анастразол, летразол, капецитабин, релоксафин, дролоксафин, гексаметилмеламин, бевацизумаб, герцептин, бексксар (тозитумомаб), зевалин, тризенокс, кселоду, винорелбин, порфимер, цетуксимаб, тиотепу, альтретамин, мелфалан, трастузумаб, лерозол, фулвестрант, экземестан, фулвестрант, ифосфомид, ритуксимаб, С225, кампат, карбоплатин, прокарбазин, мехлорэтамин, циклофосфамид, камптотецин, бусульфан, нитрозомочевину, пликомицин, митомицин, ралоксифен, средства, связывающиеся с рецепторами эстрогена, навельбин, ингибиторы белковой фарнезилтрансферазы, транс-платину и метотрексат, а также любые аналоги и производные вышеперечисленных средств.
Примеры химиотерапевтически активных средств, демонстрирующих значительную активность в сочетании с РАС-1 или с производными РАС-1, включают в себя этопозид, бортезомиб, ставроспорин, доксорубицин, тамоксифен, цисплатин, карбоплатин, паклитаксел и миметик SMAC.
Комбинация с этопозидом
Этопозид - это ингибитор топоизомеразы II. Этопозид образует тройной комплекс с ДНК и ферментом топоизомеразой II, предотвращая повторное лигирование цепей ДНК, что приводит к возникновению ошибок при синтезе ДНК и способствует развитию апоптоза в раковых клетках. Комбинированное лечение клеток линии U-937 РАС-1 и этопозидом продемонстрировало значительную активность этой комбинации in vitro даже в низких микромолярных концентрациях (см. фиг. 2).
Комбинация с бортезомибом
Велкейд® (бортезомиб) связывается с каталитическими сайтами 26S протеасом с высокой аффинностью и специфичностью. В нормальных клетках протеасомы регулируют экспрессию и функции белков с помощью расщепления убиквитинилированных белков, а также очищают клетку от аномальных и неправильно сложенных белков. Хотя в этот процесс, скорее всего, вовлечены различные механизмы, ингибирование протеасом может предотвращать деградацию проапоптотических факторов, позволяя осуществлять активацию запрограммированной смерти клеток в неопластических клетках после супрессии проапоптотических сигнальных систем. Комбинированное лечение лимфомных клеток линии U-937 РАС-1 и бортезомибом продемонстрировало синергическую активность этой комбинации (см. фиг. 3).
Комбинация с ставроспорином
Основной биологической активностью ставроспорина является ингибирование активности протеинкиназ за счет предотвращения связывания АТФ с этими киназами, достигаемого вследствие высокой аффинности ставроспорина к АТФ-связывающему сайту этих киназ. Ставроспорин является прототипичным АТФ-конкурентным ингибитором активности киназ, поскольку он связывается с большим количеством киназ с высокой аффинностью, но при этом с низкой селективностью. Это отсутствие специфичности не позволяло применять его в клинической практике, однако сделало его ценным инструментом в руках исследователей, которые использовали ставроспорин для индукции апоптоза. Одним из путей, которым ставроспорин индуцирует апоптоз, является активация каспазы-3. Комбинированное лечение лимфомных клеток линии U-937 РАС-1 и ставроспорином продемонстрировало наличие синергических эффектов при низких концентрациях РАС-1, например, при 7,5 мкМ и 15 мкМ РАС-1 (см. фиг. 4).
Комбинация с доксорубицином
Доксорубицин - это антрациклиновый антибиотик, оказывающий свое цитотоксическое действие за счет интеркаляции в ДНК. Доксорубицин применяется для лечения широкого спектра раковых заболеваний, включая злокачественные заболевания крови, многие типы карцином, саркомы мягких тканей и остеосаркомы. Комбинированное лечение остеосаркомных клеток линии 143В (человеческой остеосаркомы) РАС-1 и доксорубицином показало наличие синергической активности у этой комбинации (см. фиг. 5).
Комбинация с тамоксифеном
Тамоксифен, конкурентный агонист рецепторов эстрогена, является наиболее распространенным средством для лечения рака молочных желез у мужчин, а также используется для лечения ранних и продвинутых стадий ER-положительного рака молочной железы. Применение тамоксифена одобрено для предотвращения возникновения рака молочной железы у людей с высоким риском его развития. Комбинация тамоксифена и РАС-1 обладает синергическим действием и обеспечивает более высокую эффективность убийства клеток рака молочной железы, в том числе его тамоксифен-негативных, устойчивых к тамоксифену и трижды негативных форм (см. фиг. 6-8).
Комбинация с цисплатином
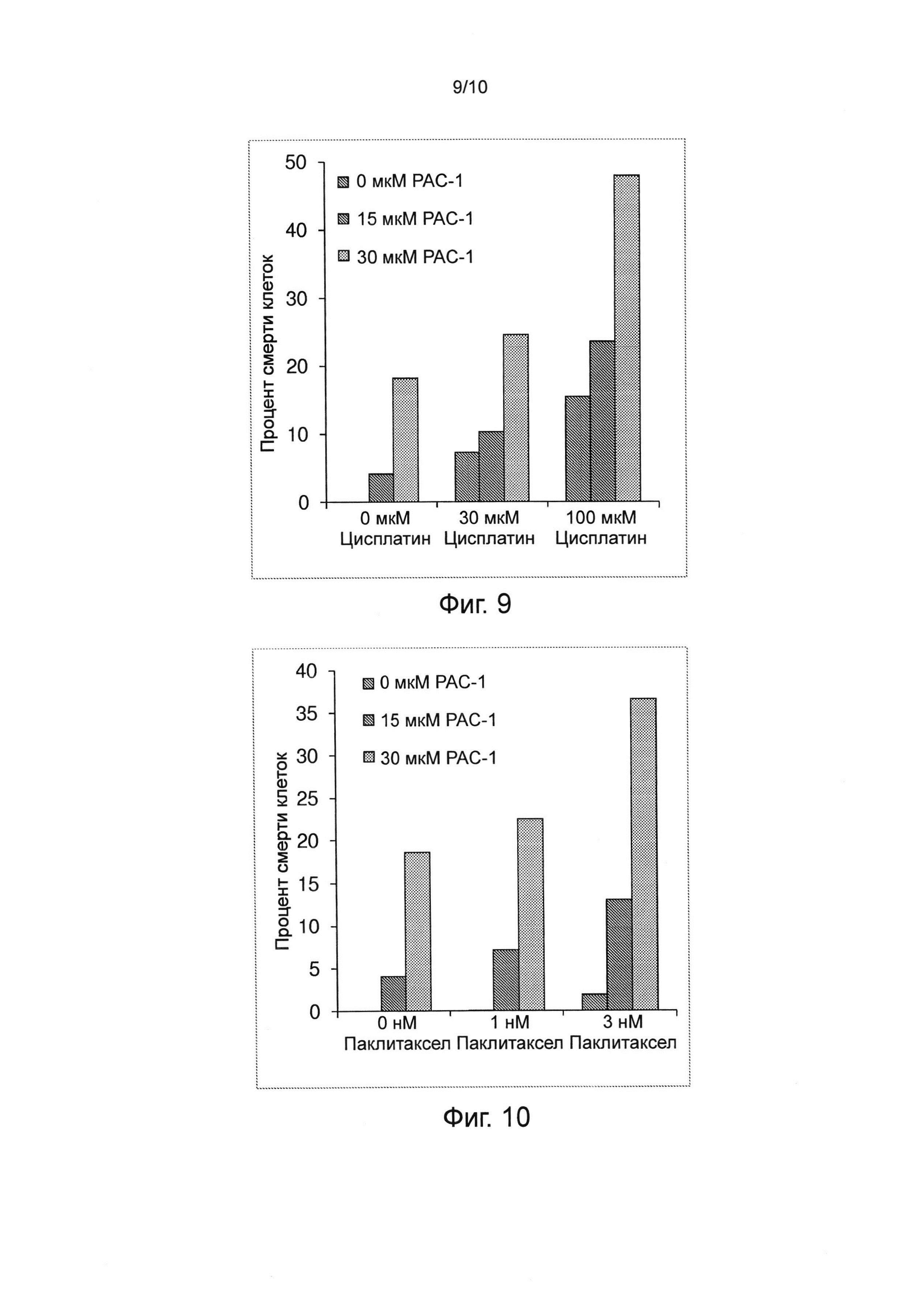
Цисплатин - это один из нескольких координационных комплексов платины, используемых в противораковой химиотерапии. Цитотоксичность соединений платины может быть обусловлена подавлением ими синтеза ДНК в раковых клетках. Цисплатин применяется для лечения различных типов рака, включая саркомы, карциномы (включая мелкоклеточный рак легких и рак яичников), лимфомы, герминогенные опухоли и рак яичек. Комбинация цисплатина и РАС-1 может обладать синергическим действием и может обеспечивать более высокую эффективность убийства клеток при этих типах лечения, а также в отношении карциномы яичников (см. фиг. 9).
Комбинация с паклитакселом
Паклитаксел, ингибитор митоза (стабилизатор микротрубочек), применяется для лечения рака легких, яичников, груди и раковых образований головы и шеи. Применение паклитаксела рекомендовано для лечения продвинутых стадий рака молочных желез после неудачного применения антрациклинов, а также рекомендовано для использования в случае ранних стадий рака молочной железы при наличии узлов. Комбинация паклитаксела и РАС-1 обладает синергической активностью действием и обеспечивает более высокую эффективность убийства клеток при этих типах лечения, а также в отношении карциномы яичников (см. фиг. 10).
Комбинация с карбоплатином
Карбоплатин - это еще один из нескольких координационных комплексов платины, используемых в противораковой химиотерапии. Карбоплатин применяется для лечения различных типов рака, в основном карцином яичников, рака легких и раковых образований головы и шеи. Комбинация карбоплатина и РАС-1 обладает синергическим действием и может обеспечивать более высокую эффективность убийства клеток при этих типах лечения, а также в отношении остеосаркомы (см. фиг. 11 и фиг. 12).
Исследования других комбинаций
Проводится изучение сенсибилизации/синергии при использовании несмертельных доз РАС-1 в сочетании со стандартными поддерживающими лекарственными средствами с использованием клеточных линий, представляющих 12 из 17 недавно определенных субтипов рака молочных желез (см. Таблицу 1).

РАС-1 в сочетании с различными стандартными поддерживающими лекарственными средствами также может обеспечивать аддитивное или синергическое действие, которое не может быть достигнуто другими способами. Примеры подобных стандартных поддерживающих лекарственных средств, изучаемых на предмет наличия комбинационных эффектов, включают в себя:
Лапатиниб, двойной ингибитор тирозинкиназ (EGFR и HER2) используется при лечении HER2-положительных форм рака и в качестве лечения первой линии при трижды негативном раке груди. Комбинация лапатиниба и РАС-1 может обеспечивать повышенную эффективность убийства клеток при этих типах лечения.
Фторурацил (5-FU) - это лекарственное средство-аналог пиримидина, используемое для лечения различных типов рака. Это суицидный ингибитор, действующий за счет необратимого ингибирования тимидилатсинтазы. Комбинация 5-FU и РАС-1 может обеспечивать повышенную эффективность убийства клеток при лечении раковых заболеваний с применением 5-FU.
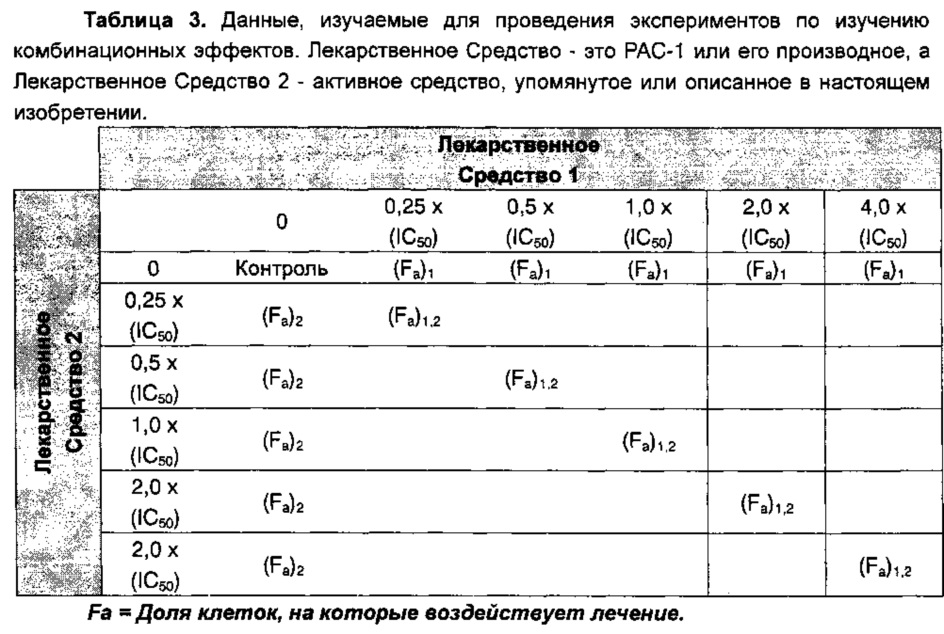
В различных способах осуществления настоящего изобретения РАС-1 может быть заменено его аналогом SPAC-1 для получения аналогичным образом усиленной аддитивной или синергической активности. Проводится исследование комбинационных эффектов SPAC-1 в сочетании с обычными способами противоракового лечения в отношении клеточных линий рака толстой кишки, рака легких и рака печени. Примеры комбинационных средств, клеточных линий и получаемых данных сведены в Таблице 2 и в Таблице 3, в которых, например, РАС-1 или SPAC-1 могут использоваться в комбинации с любым из Стандартных Средств 1-4.

Активные средства, которые можно использовать в сочетании с РАС-1 или его производным для достижения повышенной или синергической активности при подавлении роста раковых клеток или при лечении определенных видов рака, также включают в себя:
SN-38 - это активный метаболит иринотекана (аналога камптотецина, ингибитора топоизомеразы I). SN-38 в 200 раз более активен, чем сам иринотекан. Иринотекан в основном применяется для лечения рака толстой кишки, в особенности, в комбинации с другими химиотерапевтическими средствами. Комбинация SN-38 и РАС-1 может обеспечивать повышенную эффективность убийства клеток при этих типах лечения.
Оксалиплатин - это один из нескольких координационных комплексов платины, используемых в противораковой химиотерапии. Предполагается, что цитотоксичность соединений платины обусловлена подавлением ими синтеза ДНК в раковых клетках. Исследования in vivo показали, что оксалиплатин обладает противоопухолевой активностью в отношении карциномы толстой кишки за счет его (ненаправленных) цитотоксических эффектов. Комбинация оксалиплатина и РАС-1 может обеспечивать повышенную эффективность убийства клеток при этих типах лечения.
Сорафениб - это низкомолекулярный ингибитор нескольких тирозиновых протеинкиназ (VEGFR и PDGFR) и Raf. Сорафениб воздействует на МАР-киназную систему регуляции (путь регуляции, включающий в себя Raf/Mek/Erk) (МАР-киназный путь регуляции), и он одобрен для применения при лечении первичного рака почек (продвинутых стадий почечноклеточной карциномы) и продвинутых стадий первичного рака печени (гепатоцеллюлярной карциномы). Комбинация сорафениба и РАС-1 может обеспечивать повышенную эффективность убийства клеток при этих типах лечения.
Сунитиниб - это оральный низкомолекулярный ингибитор тирозинкиназных рецепторов (RTK), способный связываться с множеством мишеней. Его применение было одобрено Управлением по контролю за продуктами и лекарствами США (FDA) для лечения почечноклеточной карциномы (RCC) и стромальных опухолей желудочно-кишечного тракта (GIST), устойчивых к воздействию иматиниба. Комбинация сунитиниба и РАС-1 может обеспечивать повышенную эффективность убийства клеток при этих типах лечения.
Гемцитабин - это нуклеозидный аналог, используемый для проведения химиотерапии. Как фторурацил и другие аналоги пиримидинов, трифосфатное производное гемцитабина замещает один из строительных блоков нуклеиновых кислот, в данном случае цитидин, во время репликации ДНК. Этот процесс приводит к остановке роста опухолей, ибо к "неправильному" может быть присоединен только один дополнительный нуклеозид, и это приводит к апоптозу клеток. Другой целью воздействия гемцитабина является фермент рибонуклеотидредуктаза (RNR). Дифосфатное производное гемцитабина связывается с активным сайтом RNR и необратимо инактивирует этот фермент. После ингибирования RNR клетки не могут производить дезоксирибонуклеотиды, необходимые для репликации и репарации ДНК, и это приводит к индукции апоптоза в этих клетках. Комбинация гемцитабина и РАС-1 может обеспечивать повышенную эффективность убийства клеток при этих типах лечения.
Эрлотиниб - это лекарственный препарат, используемый для лечения немелкоклеточного рака легких, рака поджелудочной железы и нескольких других типов рака. Это ингибитор тирозинкиназ, воздействующий на рецептор эпидермального фактора роста (EGFR). Комбинация эрлотиниба и РАС-1 может обеспечивать повышенную эффективность убийства клеток при этих типах лечения.
Пеметрексед - это химиотерапевтический лекарственный препарат, применяемый для лечения плевральных мезотепиом, а также немелкоклеточного рака легких. Пеметрексед относится к классу химиотерапевтических лекарственных препаратов, называемых антиметаболитами фолиевой кислоты. Он действует за счет ингибирования трех ферментов, используемых для синтеза пуринов и пиримидинов - тимидилатсинтазы (TS), дигидрофолатредуктазы (DHFR) и глицинамид-рибонуклеотид-формилтрансферазы (GARFT). Ингибируя образование предшественников пуриновых и пиримидиновых нуклеотидов, пеметрексед предотвращает синтез ДНК и РНК, необходимый для роста и выживания нормальных и раковых клеток. Комбинация пеметрекседа и РАС-1 может обеспечивать повышенную эффективность убийства клеток при этих типах лечения.
Хотя налицо очевидная польза для стратегий противоракового лечения, использующих комбинации лекарственных средств, воздействующих на различные мишени, описанная в настоящем изобретении работа демонстрирует, что при использовании соединений, действующих через абсолютно разные механизмы, может наблюдаться чрезвычайно сильный синергический эффект. Данный подход к терапии, воздействующей на несколько мишеней, может давать особенно большие преимущества, когда его целью является активация фермента.
Применение РАС-1 безопасно у млекопитающих, и производное РАС-1 было эффективным в клиническом испытании фазы I на домашних собаках с лимфомами (Peterson et al., Cancer Res 70, 7232-7241 (2010) / Питерсон и др., Исследование рака, 2010. Т. 70, стр. 7232-7241), поэтому наблюдавшаяся синергия при использовании в сочетании с такими активными средствами, как этопозид, бортезомиб, ставроспорин, доксорубицин и тамоксифен, должна иметь важное клиническое значение. Быстро растет интерес к активации ферментов с помощью небольших молекул. Данные, описанные в настоящем изобретении, свидетельствуют, что стратегии целенаправленного воздействия с использованием РАС-1 и подобных дополнительных активных средств являются общим подходом, позволяющим многократно усилить предполагаемый биологический эффект, и они должны иметь важное клиническое значение в связи с их эффективностью.
Способы, предлагаемые в настоящем изобретении
В настоящем изобретении предложены способы селективной индукции апоптоза в раковых клетках, включающие в себя воздействие на раковые клетки комбинацией соединений, способной модифицировать молекулы прокаспазы-3 в этих раковых клетках, отличающиеся тем, что эта комбинация соединений является комбинацией РАС-1 и второго активного средства. Также предложен способ селективной индукции апоптоза в раковых клетках, включающий в себя воздействие на раковые клетки комбинацией соединений, способной модифицировать молекулы прокаспазы-3 в раковых клетках, отличающийся тем, что эта комбинация соединений является комбинацией РАС-1 и второго активного средства, и, например, отличающийся тем, что эти раковые клетки находятся в организме пациента, нуждающегося в лечении.
Настоящее изобретение предлагает дополнительные способы, в которых упоминавшаяся выше комбинация соединений является комбинацией РАС-1 и второго активного средства, и, например, используется в качестве способа раковой клетки, включающего в себя (а) выявление потенциальной чувствительности раковых клеток к лечению с использованием соединения-активатора прокаспазы; и (b) воздействие на раковые клетки эффективным количеством комбинации соединения-активатора прокаспазы и второго активного средства. Настоящее изобретение также предлагает способ лечения раковой клетки, включающий в себя (а) выявление потенциальной чувствительности раковых клеток к лечению с использованием соединения-активатора прокаспазы; и (b) воздействие на раковые клетки эффективным количеством РАС-1 и второго активного средства, отличающийся тем, что РАС-1 способно активировать по меньшей мере одну из прокаспаз, прокаспазу-3 или прокаспазу-7. Настоящее изобретение также предлагает способ индукции смерти раковых клеток (т.е. их убийства), включающий в себя воздействие на раковые клетки активным средством и соединением, способным активировать молекулы прокаспазы-3 в этих раковых клетках, например РАС-1.
Настоящее изобретение также описывает медикамент, включающий в себя эффективное количество комбинации РАС-1 и TMZ. Этот медикамент может использоваться в способе индукции апоптоза в клетках. В некоторых способах осуществления настоящего изобретения эта комбинация соединений не проходит сквозь гематоэнцефалический барьер в степени, способной вызывать заметные нейротоксические эффекты у пациента. Способы, предлагаемые в настоящем изобретении, включают в себя контакт одной или нескольких клеток с эффективным количеством комбинации соединений, описанных в настоящем изобретении, in vivo или in vitro. Таким образом, настоящее изобретение также предлагает способы лечения клеток, включающие в себя воздействие на эти клетки эффективным количеством комбинации соединений, описанных в настоящем изобретении.
Как описано в данном документе, настоящее изобретение предлагает способы лечения пациентов, опухолевые клетки которых содержат повышенные уровни прокаспазы-3. Эти способы могут включать в себя введение пациентам, чьи опухолевые клетки содержат повышенные уровни прокаспазы-3, терапевтически эффективного количества комбинации РАС-1 и второго активного средства, описанной в настоящем изобретении, или содержащей их композиции. Настоящее изобретение также предлагает способы лечения опухолевых клеток, содержащих повышенные уровни прокаспазы-3, которые включают в себя воздействие на эти опухолевые клетки терапевтически эффективным количеством комбинации РАС-1 и второго активного средства, описанной в настоящем изобретении, отличающиеся тем, что это приводит к излечению опухолевых клеток, их убийству или подавлению их роста. Эти опухоли или опухолевые клетки могут являться злокачественными опухолевыми клетками. В некоторых способах осуществления настоящего изобретения эти опухолевые клетки могут являться лимфомными клетками, остеосаркомными клетками или клетками рака молочной железы.
Для введения пациентам РАС-1 может объединяться со вторым активным средством в единую готовую лекарственную форму. Комбинированная терапия может проводиться с использованием одновременных или последовательных курсов применения входящих в нее активных средств. При последовательном применении комбинация может быть разделена на два или более последовательных введения ее компонентов.
Комбинированная терапия может обеспечивать эффект "синергии", т.е. эффект, достигаемый от применения комбинации активных ингредиентов, больший, чем сумма эффектов, достигаемых при использовании этих соединений по отдельности. Синергический эффект может быть достигнут, когда РАС-1 и второе активное средство: (1) введены в состав единой готовой лекарственной формы и применяются или вводятся одновременно в составе этой комбинированной лекарственной формы; (2) применяются поочередно или параллельно в составе раздельных готовых лекарственных форм; или (3) в форме какого-либо иного курса лечения. При введении поочередно синергический эффект может достигаться путем последовательного применения или введения этих соединений, т.е. их введения в виде отдельных таблеток, пилюль или капсул, или в виде отдельных инъекций разными шприцами. В большинстве случаев при проведении поочередной терапии эффективные дозировки каждого из активных ингредиентов могут применяться последовательно, т.е. серийно, а при проведении комбинированной терапии эффективные дозировки каждого из активных ингредиентов могут применяться совместно. Под синергическим противораковым эффектом понимается противораковый эффект, превышающий предсказанный чисто аддитивный эффект от использования индивидуальных соединений, входящих в состав соответствующей комбинации. Комбинированная терапия дополнительно описана в Патенте США №6,833,373 (McKearn et al. / МакКерн и др.), включающем в себя дополнительные активные средства, которые могут использоваться в сочетании с РАС-1, и дополнительные типы рака и других состояний, для лечения которых можно использовать РАС-1.
Соответственно, РАС-1 может применяться в комбинации с другим активным средством ("вторым активным средством") для лечения рака. Применение РАС-1 может осуществляться до или после применения второго активного средства, и отделяться от него интервалами времени, варьирующимися от минут до недель. В способах осуществления настоящего изобретения, в которых второе активное средство и РАС-1 будут применяться для воздействия на клетки по отдельности, это будет обычно осуществляться так, что последовательные воздействия не будут отделены друг от друга значительными интервалами времени, так что второе активное средство и РАС-1 будут все еще способны оказывать необходимое комбинированное воздействие на клетки-мишени. Например, в подобных случаях предполагается, что воздействие на клетки, ткани или организм двумя средствами может производиться, по существу, одновременно (т.е. может быть разделено промежутком времени длительностью менее нескольких минут). В других аспектах, второе активное средство в комбинации может применяться в пределах приблизительно 1 минуты, приблизительно 5 минут, приблизительно 10 минут, приблизительно 20 минут, приблизительно 30 минут, приблизительно 45 минут, приблизительно 60 минут, приблизительно 2 часов, приблизительно 3 часов, приблизительно 4 часов, приблизительно 6 часов, приблизительно 8 часов, приблизительно 9 часов, приблизительно 12 часов, приблизительно 15 часов, приблизительно 18 часов, приблизительно 21 часа, приблизительно 24 часов, приблизительно 28 часов, приблизительно 31 часа, приблизительно 35 часов, приблизительно 38 часов, приблизительно 42 часов, приблизительно 45 часов или приблизительно 48 часов или более до и/или после применения РАС-1. В некоторых других способах осуществления настоящего изобретения второе активное средство может применяться в пределах приблизительно 1 дня, приблизительно 2 дней, приблизительно 3 дней, приблизительно 4 дней, приблизительно 5 дней, приблизительно 6 дней, приблизительно 8 дней, приблизительно 9 дней, приблизительно 12 дней, приблизительно 15 дней, приблизительно 16 дней, приблизительно 18 дней, приблизительно 20 дней и приблизительно 21 дня до и/или после применения РАС-1. В некоторых ситуациях может быть желательным значительное увеличение длительность лечения, однако с перерывами между последовательными применениями активных средств в несколько недель (например, приблизительно в 1 неделю, приблизительно в 2 недели, приблизительно в 3 недели, приблизительно в 4 недели, приблизительно в 6 недель, приблизительно в 8 недель или более).
Введение пациентам химиотерапевтических композиций, описанных в настоящем изобретении, обычно будет осуществляться в соответствии с общими протоколами применения химиотерапевтических средств, учитывающими их токсичность, если она имеется. Ожидается, что, при необходимости, курсы лечения будут повторяться. Также предполагается, что в комбинации с вышеуказанными комбинациями могут применяться различные стандартные способы лечения или способы вспомогательной противораковой терапии, а также хирургические вмешательства. Эти способы лечения могут включать в себя, в частности, химиотерапию, иммунотерапию, генную терапию и хирургию.
Технологии приготовления лекарственных средств
Соединения, описанные в настоящем изобретении, могут быть использованы для получения лечебных лекарственных препаратов, например, посредством комбинирования этих соединений с фармацевтически приемлемыми разбавителями, наполнителями и/или носителями. Эти соединения могут добавляться к растворителю в форме солей или сольватов. Например, в случае, если эти соединения являются в достаточной степени основными или кислыми для формирования стабильных нетоксичных солей с кислотами или основаниями, если потребуется, эти соединения могут вводиться в форме их солей. Примерами фармацевтически приемлемых солей являются соли замещения, образуемые с органическими кислотами, способными образовывать физиологически приемлемые анионы, например, тозилаты, метансульфонаты, ацетаты, цитраты, малонаты, тартраты, сукцинаты, бензоаты, аскорбаты, α-кетоглутараты и β-глицерофосфаты. Также могут быть получены подходящие неорганические соли, в том числе, гидрохлориды, галиды, сульфаты, нитраты, карбонаты и бикарбонаты.
Фармацевтически приемлемые соли могут быть получены с использованием стандартных процедур, известных в науке, например, с помощью реакции в достаточной степени основного соединения, например, амина, с подходящей кислотой для получения физиологически приемлемого ионного соединения. Соли карбоновых кислот со щелочными металлами (например, натрием, калием или литием) или щелочноземельными металлами (например, кальцием) также могут быть получены аналогичными способами.
Соединения, описанные в настоящем изобретении, могут быть включены в состав лекарственных препаратов и вводиться млекопитающим, например, людям-пациентам, в различных формах. Эти формы могут быть специально адаптированы для выбранного пути их введения, например, для орального или парентерального введения, для внутривенного или внутримышечного введения, для местного применения или для введения под кожу.
Соединения, описанные в настоящем изобретении, могут вводиться системно в комбинации с фармацевтически приемлемым носителем, например, инертным разбавителем или усваиваемым съедобным носителем. Растворимость активных соединений может быть повышена с использованием циклодекстринов, например, 2-гидроксипропил-β-циклодекстрина. Для целей орального введения соединения могут быть заключены в твердую или мягкую оболочку желатиновых капсул, спрессованы в таблетки или напрямую включены в пищу, входящую в состав диеты пациентов. Соединения также могут быть смешаны с одним или несколькими наполнителями и использованы в форме таблеток для проглатывания, таблеток для рассасывания во рту, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и т.п.Подобные композиции и препараты обычно содержат по меньшей мере 0,1% активного соединения. Процентный состав композиций и препаратов может варьировать, и может условно составлять от приблизительно 1% до приблизительно 60% или от приблизительно 2% до приблизительно 25% от массы соответствующей единичной готовой лекарственной формы. Количество активного соединения в подобных терапевтически полезных композициях является таким, чтобы обеспечить достижение уровня эффективной дозировки.
Таблетки, пастилки, пилюли, капсулы и т.п. могут также содержать один или несколько из следующих ингредиентов: связующие вещества, например, трагакантовую камедь, гуммиарабик, кукурузный крахмал или желатин; наполнители, например, дикальцийфосфат; вещества для улучшения распадаемости, например, кукурузный крахмал, картофельный крахмал, альгиновую кислоту и т.п.; и любриканты, например, стеарат магния. В них также могут быть добавлены вещества-подсластители, например, сахароза, фруктоза, лактоза или аспартам, и/или ароматизаторы, например, перечная мята, метилсалицилат или вишневый ароматизатор. Если готовой лекарственной формой является капсула, она может содержать, в дополнение к материалам указанных выше типов, жидкий носитель, например, растительное масло или полиэтиленгликоль. Различные другие материалы могут использоваться в качестве покрытий или как-либо иначе модифицировать физическую форму твердой готовой лекарственной формы. Например, таблетки, пилюли и капсулы могут быть покрыты желатином, воском, шеллаком или сахаром, и т.п. Сиропы и эликсиры могут содержать активное соединение, сахарозу или фруктозу в качестве подсластителя, метил- и пропилпарабены в качестве консервантов, краситель и ароматизаторы, например, вишневый или апельсиновый ароматизатор. Любой материал, используемый для получения любых готовых лекарственных форм, должен быть фармакологически приемлемым и практически нетоксичным в используемых количествах. Кроме того, активное соединение может быть включено в состав медленно высвобождающих его препаратов и устройств.
Активное соединение может вводиться внутривенно или внутрибрюшинно посредством инъекций или с помощью капельниц. Растворы активного соединения или его солей могут быть приготовлены на воде, необязательно смешанной с нетоксичным поверхностно-активным веществом. Дисперсии могут быть приготовлены на основе глицерина, жидких полиэтиленгликолей, триацетина или их смесей или в фармацевтически приемлемом масле. При обычных условиях их хранения и использования препараты могут содержать консервант для предотвращения роста микроорганизмов.
Готовые лекарственные формы, пригодные для инъекций или введения через капельницы, могут включать в себя стерильные водные растворы, дисперсии или стерильные порошки, включающие в себя активный ингредиент, адаптированный для получения приготавливаемых для немедленного применения стерильных растворов для инъекций или для капельниц или дисперсий, необязательно заключаемых в липосомы. Конечная лекарственная форма должна быть стерильной, жидкой и стабильной в условиях ее получения и хранения. Жидкий носитель или разжижитель может являться растворителем или средой для получения жидкой дисперсии, включающей в себя, например, воду, этанол, полиол (например, глицерол, пропиленгликоль, жидкие полиэтиленгликоли и т.п.), растительные масла, нетоксичные эфирные производные глицерина и их подходящие смеси. Необходимая текучесть может поддерживаться, например, посредством формирования липосом, посредством обеспечения и поддержания необходимого размера частиц в случае дисперсии или посредством использования поверхностно-активных веществ. Предотвращение действия микроорганизмов может осуществляться с использованием различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты, тиомерсала и т.п. Во многих случаях будет предпочтительным включение в их состав изотонических средств, например, сахара, буфера или хлорид натрия. Пролонгированное всасывание препаратов для инъекций может быть достигнуто с помощью средств, замедляющих их всасывание, например, моностеарата алюминия и/или желатина.
Стерильные растворы для инъекций могут быть приготовлены посредством добавления активного соединения в необходимом количестве в подходящий растворитель в сочетании с различными другими необходимыми ингредиентами, указанными выше, после чего раствор может необязательно стерилизоваться с помощью фильтрации. В случае стерильных порошков для получения стерильных растворов для инъекций, способы их получения могут включать в себя методики вакуумной сушки и лиофилизации, которые позволяют получить порошок активного ингредиента плюс любые необходимые дополнительные ингредиенты, присутствовавшие в растворах, ранее подвергшихся стерилизации фильтрацией.
Полезные дозировки соединений, описанных в настоящем изобретении, могут быть определены путем сравнения их активности in vitro и на животных моделях in vivo. Способы экстраполяции эффективных дозировок для мышей и других животных на людей известны в науке; например, см. Патент США №4,938,949 (Borch ef al. / Борх и др.). Количество соединения или его активной соли или производного, необходимое для использования при лечении, может варьироваться не только в зависимости от конкретного соединения или его выбранной соли, но и от способа введения, природы состояния, по поводу которого проводится лечение, и возраста и состояния пациента, и оно будет в конечном итоге определяться лечащим врачом или клиницистом.
Комбинация соединений может удобным способом вводиться в виде единичных готовых лекарственных форм, например, содержащих от 100 до 5000 мг/м2, от 300 до 4000 мг/м2, от 370 до 3700 мг/м2, от 50 до 750 мг/м2 или от 750 до 4000 мг/м2 активного ингредиента на единичную готовую лекарственную форму. Каждое соединение, по отдельности или в комбинации, также может вводиться в дозировке от приблизительно 1 мг/кг до приблизительно 250 мг/кг, от приблизительно 10 мг/кг до приблизительно 100 мг/кг, от приблизительно 10 мг/кг до приблизительно 50 мг/кг, от приблизительно 50 мг/кг до приблизительно 100 мг/кг, от приблизительно 10 мг/кг до приблизительно 50 мг/кг или приблизительно 10 мг/кг, приблизительно 25 мг/кг, приблизительно 50 мг/кг, приблизительно 75 мг/кг, приблизительно 100 мг/кг или приблизительно 150 мг/кг или в виде диапазона от какого-либо одного из вышеупомянутых значений до любого другого из вышеупомянутых значений. Эти соединения также могут вводиться пациентам для обеспечения стационарных плазматических концентраций соответствующих лекарственных средств, поодиночке или в комбинации, составляющих от приблизительно 1 мкмоль/л до приблизительно 25 мкмоль/л или приблизительно 10 мкмоль/л или приблизительно 15 мкмоль/л.
В некоторых способах осуществления настоящее изобретение предлагает соединения в эффективных концентрациях от приблизительно 10 нМ до приблизительно 100 мкМ. В другом способе осуществления эффективные концентрации составляют от приблизительно 200 нМ до приблизительно 50 мкМ, от приблизительно 500 нМ до приблизительно 40 мкМ, от приблизительно 750 нМ до приблизительно 25 мкМ, от приблизительно 1 мкМ до приблизительно 20 мкМ или от приблизительно 1 мкМ до приблизительно 10 мкМ. В другом способе осуществления эффективной концентрацией считается значение, например, концентрация, соответствующая 50% активности, в тесте на прямую активацию прокаспазы, в тесте на индукцию апоптоза клеток или при клинической оценке лечения на животных. В одном из способов осуществления настоящего изобретения подобное значение меньше приблизительно 200 мкМ. В другом способе осуществления это значение меньше приблизительно 10 мкМ, но больше, чем приблизительно 10 нМ. Необходимая доза может быть удобным образом представлена в виде единственной дозы или разделена на несколько доз, вводимых через подходящие интервалы времени, например, на две, три, четыре или более меньших доз в день. Сами эти меньшие дозы могут дополнительно подразделяться, например, на несколько дискретных введений через небольшие интервалы времени.
Соединения, описанные в настоящем изобретении, могут являться эффективными противоопухолевыми средствами и могут обладать более высокой активностью и/или более низкой токсичностью по сравнению с использованием любых средств поодиночке. Настоящее изобретение предлагает терапевтические способы лечения рака у млекопитающих, которые включают в себя введение страдающим раком млекопитающим эффективного количества соединения или композиции, описанных в настоящем изобретении. Под млекопитающими в данном случае могут пониматься приматы, люди, грызуны, собачьи, кошачьи, крупный рогатый скот, мелкий рогатый скот, лошади, свиньи и т.д. Под раком в данном случае могут пониматься любые типы злокачественных новообразований, например, рак толстой кишки, рак молочных желез, меланомы и лейкемии, описанные, помимо прочего, в настоящем изобретении, и характеризующиеся в целом нежелательной пролиферацией клеток, т.е. их нерегулируемым ростом, отсутствием дифференциации, локальной инвазией в ткани и метастазированием.
Способность соединения, описанного в настоящем изобретении, лечить рак может быть определена с использованием методов анализа, хорошо известных в науке. Например, известны способы разработки протоколов лечения, оценки токсичности, анализа данных, количественного определения убийства опухолевых клеток и биологическая значимость использования скринингов трансплантируемых опухолей. Кроме того, способность соединений лечить рак может быть определена с использованием методов анализа, описанных выше и в цитируемых работах и патентных документах, ссылки на которые содержатся в настоящем изобретении.
Настоящее изобретение также предлагает использовать предлекарственные формы соединений. Любое соединение, которое будет превращаться in vivo в РАС-1 или другое активное средство, описанное в настоящем изобретении, будет являться их предлекарственной формой. В науке хорошо известны многочисленные способы получения предлекарственных форм соединений. Примеры предлекарственных форм и способов их получения можно найти, помимо прочего, в следующих работах: Design of Prodrugs, edited by H. Bundgaard, Elsevier, 1985 / Разработка предлекарственных форм, под редакцией X. Бундгаарда, издательство Elsevier, 1985; Methods in Enzymology, Vol. 42, at pp. 309-396, edited by K. Widder et. al., Academic Press, 1985 / Методы энзимологии, Т. 42, стр. 309-396, под редакцией К. Уиддера и пр., издательство Academic Press, 1985; A Textbook of Drug Design and Development, edited by Krosgaard-Larsen and H. Bundgaard, Chapter 5, "Design and Application of Prodrugs," by H. Bundgaard, at pp. 113-191, 1991 / Руководство no проектированию и разработке лекарственных средств, под редакцией Кросгаард-Ларсена и X. Бундгаарда, Глава 5, "Проектирование и применение предлекарственных форм", автор X. Бундгаард, стр. 113-191,1991; Н. Bundgaard, Advanced Drug Delivery Reviews, 1992, Vol. 8, p. 1-38 / X. Бундгаард, Обзоры прогрессивных способов доставки лекарственных средств, 1992, Т. 8, стр. 1-38; Н. Bundgaard et al., Journal of Pharmaceutical Sciences, 1988, Vol. 77, p. 285 / X. Бундгаард и др., Журнал фармацевтических наук, 1988, Т. 77, стр. 285; и Nogrady, Medicinal Chemistry: A Biochemical Approach, Oxford University Press, New York, 1985, pages 388-392 / Ногради, Медицинская химия: Биохимический подход, издательство Oxford University Press, Нью-Йорк, 1985, стр. 388-392.
Кроме того, в некоторых способах осуществления настоящего изобретения РАС-1 может быть заменено на производное РАС-1 или другой ингибитор, например, на соединение, описанное в Патенте США №7,632,972 (Hergenrother et al. / Хергенротер и др.), Публикациях патентов США №2012/0040995 (Hergenrother et al. / Хергенротер и др.) и №2007/0049602 (Hergenrother ef al. / Хергенротер и др.) и в Заявке на получение патента США №12/597,287 (Hergenrother ef al. / Хергенротер и др.). Полезные соединения, способы и методики для лечения рака, которые могут быть использованы в комбинации с описанными в настоящем изобретении, описаны в вышеупомянутых документах, а также в Патентах США №6,303,329 (Heinrikson ef al. / Хайнриксон и др.), №6,403,765 (Alnemri / Альнемри), №6,878,743 (Choong ef al. / Чунг и др.) и №7,041,784 (Wang ef al. / Ванг и др.) и в Публикации патента США №2004/0180828 (Shi / Ши).
Способы проведения тестов и оценки линий раковых клеток могут использоваться так, как это описано в работах Putt ef al., Nature Chemical Biology 2006, 2(10), 543-550 / Патт и др., Химическая биология Нэйчер, 2006. Т. 2(10), стр. 543-550; Peterson et al., J. Mol. Biol. 2009, 388, 144-158 / Питерсон и др., Молекулярно-биологический журнал, 2009. Т. 388, стр. 144-158 и Peterson et al., Cancer Res. 2010, 70(18), 7232-7241 / Питерсон и др., Изучение рака, 2010. Т. 70(18), стр. 7232-7241.
828 (Shi).
Приводимые ниже Примеры предназначены для того, чтобы проиллюстрировать вышеописанное изобретение, и не подразумевают ограничения его объема. Специалистам в данной области сразу будет понятно, что эти примеры предполагают наличие множества других способов, посредством которых данное изобретение может быть использовано на практике. Следует помнить, что в них могут быть внесены многочисленные изменения и модификации, и это не приведет к выходу за рамки объема данного изобретения.
ПРИМЕРЫ
Пример 1. Готовые лекарственные формы
Приводимые ниже лекарственные формы иллюстрируют репрезентативную выборку готовых лекарственных форм, которые могут использоваться для лечебного или профилактического применения соединений из комбинаций, описанных в настоящем изобретении (например, РАС-1 и второго активного средства), или их фармацевтически приемлемых солей и/или сольватов (далее обозначаемых как "Соединения X"):



Эти лекарственные формы могут быть приготовлены с использованием обычных процедур, хорошо известных в фармацевтике. Дополнительные преимущества дает то, что рецептуру вышеуказанных лекарственных препаратов можно варьировать в соответствии с хорошо известными фармацевтическими методиками для компенсации различных количеств и типов используемого в них активного ингредиента "Соединения X". Аэрозольная лекарственная форма (vi) может использоваться в сочетании со стандартным аэрозольным баллончиком, выдающим отмеренные дозы аэрозоля. Кроме того, указанные конкретные ингредиенты и пропорции приведены исключительно в иллюстративных целях. Ингредиенты могут быть заменены на их подходящие эквиваленты, и пропорции могут варьироваться в соответствии с желаемыми свойствами соответствующей необходимой готовой лекарственной формы.
Хотя выше были описаны конкретные способы осуществления настоящего изобретения со ссылками на другие его изложенные способы осуществления и примеры, подобные способы осуществления являются исключительно иллюстративными и не ограничивают объем настоящего изобретения. В них могут вноситься изменения и модификации в соответствии с обычным опытом в соответствующей области науки, и это не будет считаться отклонением от изобретения в его более широких аспектах, определенных в приводимой ниже формуле изобретения.
Все публикации, патенты и патентные документы включены в настоящий документ посредством ссылок, как если бы они были включены поодиночке по упоминанию. Исходя из этого, не следует предполагать никаких ограничений, не согласующихся с настоящим описанием изобретения. Настоящее изобретение было описано в отношении различных конкретных и предпочтительных способов его осуществления и методики. Тем не менее, следует понимать, что в них могут вноситься многочисленные вариации и модификации, и это не будет выходить за пределы объема настоящего изобретения и его духа.
Реферат
Группа изобретений относится к химико-фармацевтической промышленности и представляет собой композицию для терапии рака путем активации прокаспазы, содержащую соединение РАС-1:; второе активное средство, выбранное из: бортезомиб, ставроспорин, доксорубицин, тамоксифен, цисплатин, карбоплатин или паклитаксел; и фармацевтически приемлемый разбавитель, наполнитель и/или носитель, где концентрация РАС-1 составляет от 2 мкМ до 50 мкМ, а концентрация второго активного средства составляет от 1 нМ до 1 мМ. Также изобретения включают в себя способы индукции апоптоза в раковых клетках и подавления роста и/или пролиферации раковых клеток для лечения рака путем активации прокаспазы, включающие в себя воздействие на эти раковые клетки эффективным количеством композиции, описанной выше. Группа изобретений обеспечивает синергетический эффект активных агентов в композиции, что приводит к индуцированию апоптотической смерти раковых клеток, и проявляет более слабые нейротоксические эффекты, чем другие соединения и комбинации соединений в данной области медицины. 5 н. и 21 з.п. ф-лы, 12 ил., 1 пр., 3 табл.
Формула
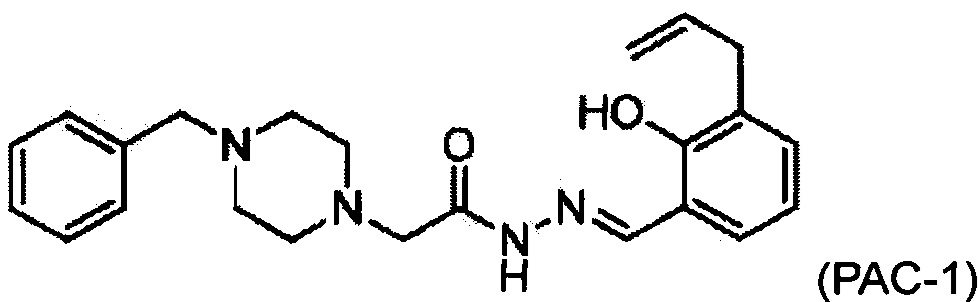



Комментарии