Стерилизация лекарственных частиц беклометазона для доставки через легкие - RU2336905C2
Код документа: RU2336905C2
Чертежи
Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способу для стерилизации нерастворимых в воде твердых лекарственных веществ в водных суспензиях, подходящих для легочного введения. В частности, изобретение относится к стерилизации паром глюкокортикоидов, таких как дипропионат беклометазона, для ингаляционной доставки.
УРОВЕНЬ ТЕХНИКИ
Способ для стерилизации порошковых форм нерастворимых в воде лекарственных веществ, суспендируемых в стерильной водной среде для легочного введения, таких как неэлектролитные кортикостероиды, глюкокортикоиды и т.п., все еще является критическим способом. Основные проблемы относятся к высоким температурам в процессе стерилизации и последующей термической нестабильности лекарственного вещества, что часто ведет к деградации с видоизменением профиля примесей и физико-химических характеристик лекарства.
Для твердых лекарственных веществ, пригодных для ингаляционной доставки, суспендированных в водных готовых формах, распределение размеров частиц, а также его сохранение в течение срока годности конечного продукта являются особенно ключевыми параметрами.
Фактически размер частицы оказывает влияние на распределение лекарства в легком и, как следствие, активность и эффективность самого лекарства. Общепринято, что средний диаметр частиц в готовой форме для ингаляционной доставки должен быть менее 10 микрон, предпочтительно приблизительно 5 микрон или менее.
Твердые неэлектролитные кортикостероиды, стероиды, а также нестероидные лекарственные средства для использования в водных суспензиях обычно стерилизуют различными путями, например подвергая воздействию газов, или посредством асептической кристаллизации, тепловой стерилизации лекарств или посредством β- и γ- облучения.
Стерилизационная обработка может вызывать неблагоприятные физические и химические изменения лекарственного вещества, и все параметры должны быть проверены и исследованы на предварительной фазе разработки способа.
В случае лекарственных веществ, предназначенных для ингаляционного использования, в дополнение к контролю физической и химической стабильности стерилизованного лекарства является критическим предотвращение какого-либо неприемлемого изменения размера частиц вследствие возможной перекристаллизации лекарства, которая является следствием многих известных способов стерилизации.
Способ паровой стерилизации твердых неэлектролитных кортикостероидов был описан O'Neill в патенте США 3962430. Способ осуществляют в насыщенном растворе хлорида натрия при температуре стерилизации. Сообщается, что хлорид натрия необходим для предотвращения перекристаллизации твердых частиц и какого-либо возможного изменения размера и формы кристалла кортикостероида при повторном охлаждении.
WO 00/25746 описывает способ получения суспензий лекарственных частиц для ингаляционной доставки и включает стерилизацию гамма-облучением, с утверждением, что суспензии дипропионата беклометазона, подвергающиеся обработке влажным паром, в условиях, аналогичных сообщенным в US 3962430 (121°С, в течение 15 минут), претерпевают значительное снижение содержания активного ингредиента со значительным нарастанием продуктов деградации (приблизительно 10-11%).
Стерилизация паром водных суспензий глюкокортикоидов также описанная Karlsson (WO 99/25359) ведет к неприемлемым изменениям размера частицы. Karlsson приводит ссылку на способ стерилизации влажным паром, описанный O'Neill в US 3962430, с утверждением, что такой способ не является пригодным для суспензий с мелкими частицами глюкокортикоидов, которые предназначаются для ингаляции, поскольку вода, вовлеченная и в нагревание, и в охлаждение, вызывает неблагоприятные изменения размеров частиц.
Для устранения проблемы изменения размера частиц Karlsson использует сухую тепловую стерилизацию, которая, во всяком случае, часто является, как известно, непригодной для твердых лекарственных веществ, так как она вызывает неблагоприятные физические и химические изменения, такие как обесцвечивание и разрушение твердых веществ уже при температурах ниже 120°С.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
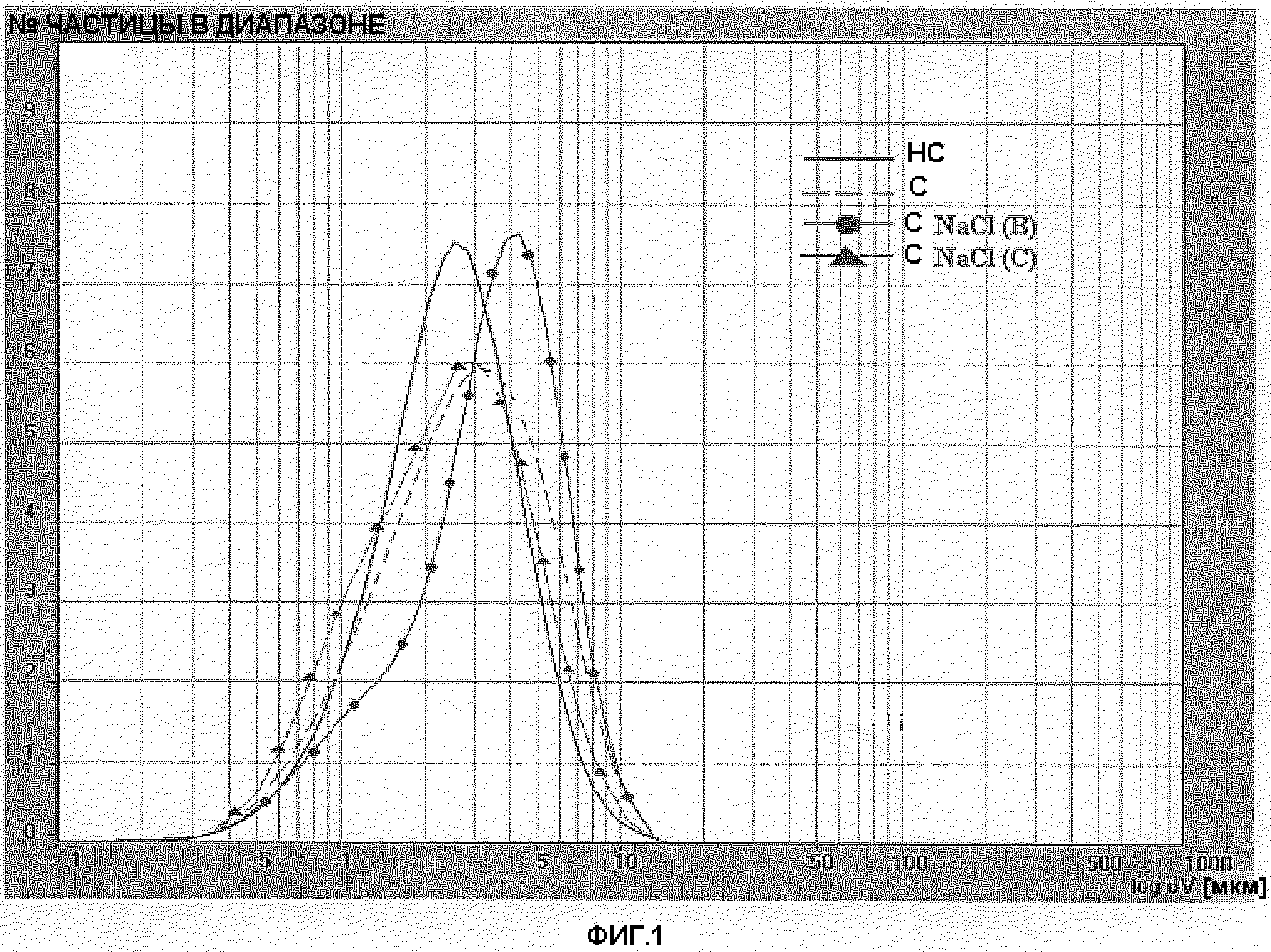
Фигура 1: Распределение размера частиц лекарственного вещества BDP серии 4 простерилизованного (С), непростерилизованного (НС) и простерилизованного в присутствии NaCl 0,420 г/мл (С NaCl(B)) и NaCl 0,570 г/мл (C NaCl(C)).
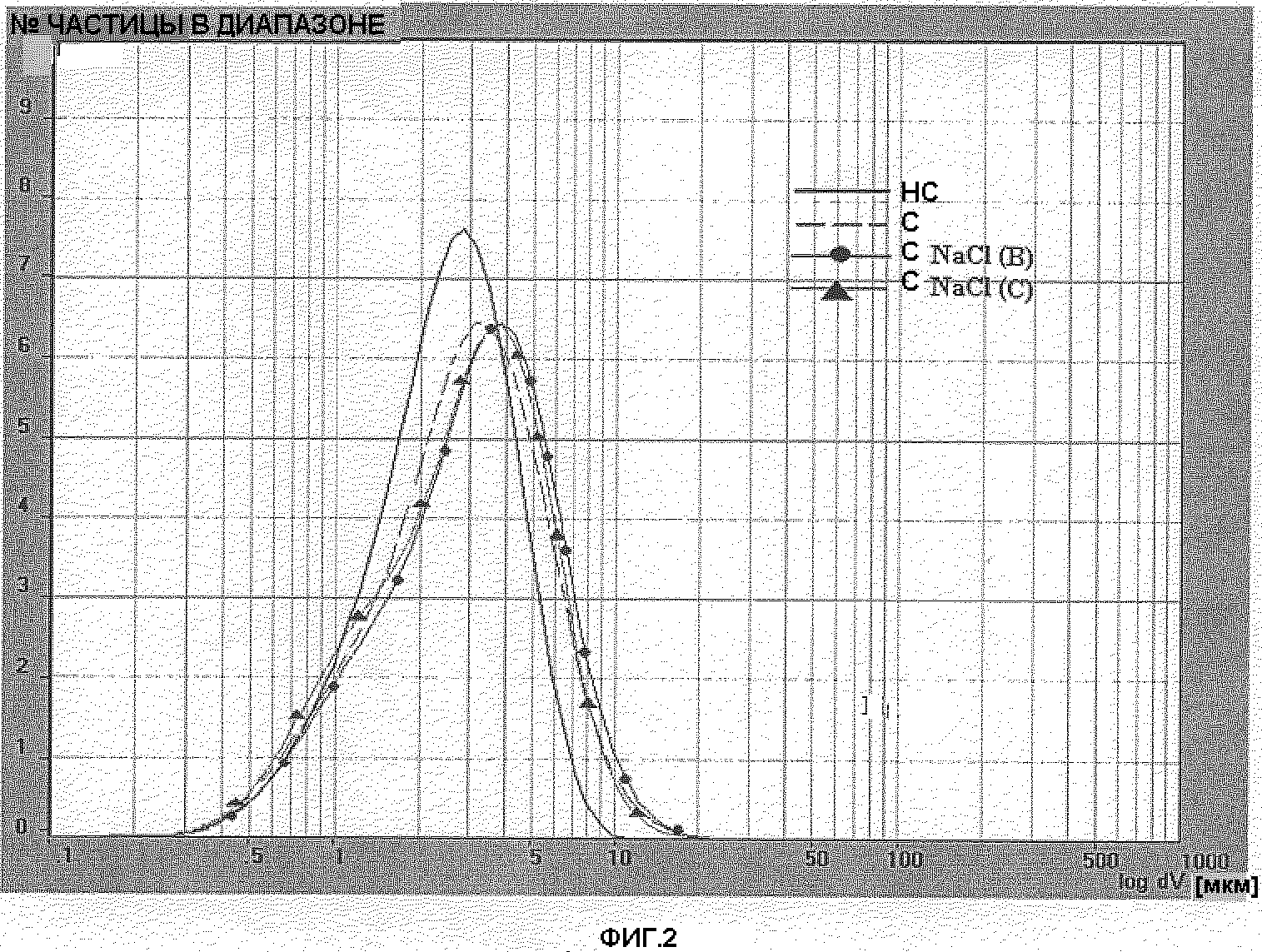
Фигура 2: Распределение размера частиц лекарственного вещества BDP серии 5 простерилизованного (С), непростерилизованного (НС) и простерилизованного в присутствии NaCl 0,420 г/мл (С NaCl(B)) и NaCl 0,570 г/мл (C NaCl(C)).
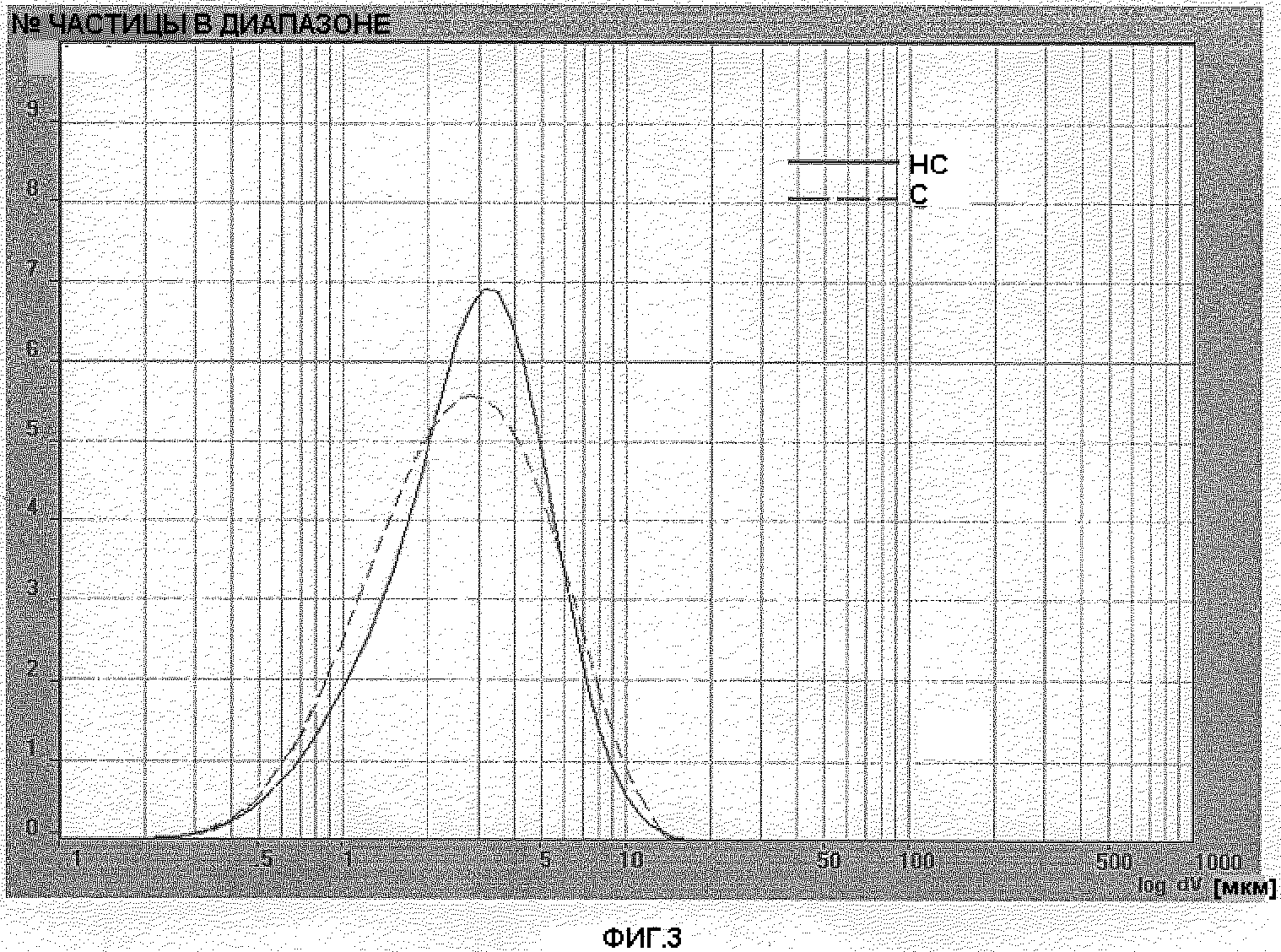
Фигура 3: Распределение размера частиц готовой формы PG038/115 (BDP серии 4 простерилизованного) и PG038/119 (BDP серии 4 непростерилизованного) после 50 дней хранения при 40°С, относительной влажности 75%.
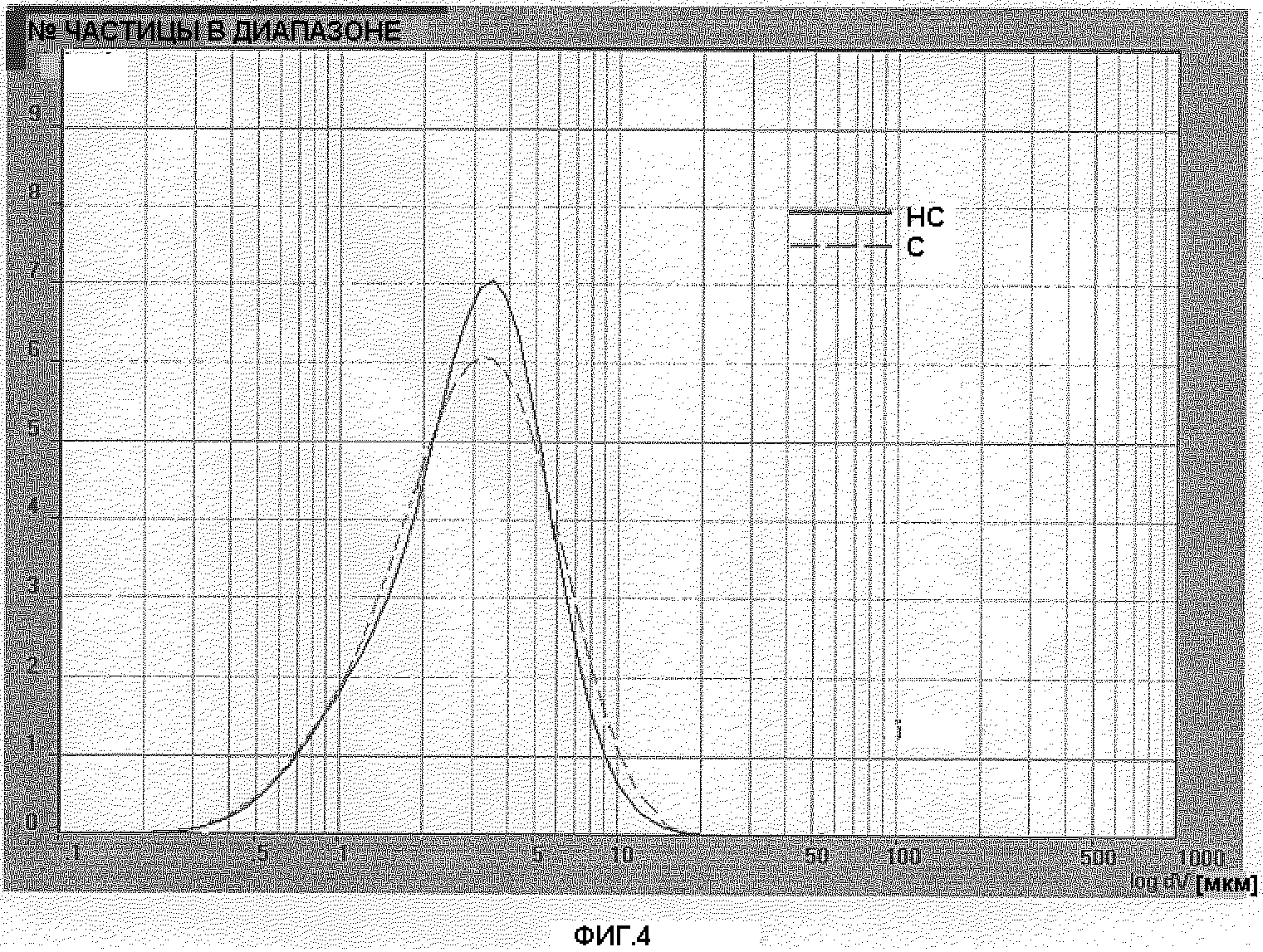
Фигура 4: Распределение размера частиц готовой формы PG038/116 (С) (BDP серии 5 простерилизованного) и готовой формы PG038/119 (НС) (BDP серии 5 непростерилизованного) после 50 дней хранения при 40°С, относительной влажности 75%.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Принимая во внимание объяснения предшествующего уровня техники, авторы неожиданно обнаружили простой и экономичный способ стерилизации твердых лекарственных веществ, в частности глюкокортикоидов, таких как дексаметазон, монометазон, флутиказон, беклометазон и их солей, с использованием водной суспензии вещества, избегая сложных и более дорогостоящих способов предшествующего уровня техники. Способ по настоящему изобретению является особенно подходящим для дипропионата беклометазона (BDP) (Prontinal® - Dompe) и использование вышеупомянутого способа на промышленных предприятиях позволяет получить легкий и менее затратный производственный процесс. Стерилизация активного ингредиента может выполняться непосредственно в реакторе получения (турбогомогенизатор, работающий как автоклав), в данном случае получение массы и перенос массы в расфасовочную машину могут быть выполнены без какого-либо контакта с окружающей средой (асептические условия). Как следствие, качественная оценка и контроль области получения, обучение и форма одежды персонала, а также очищающие методики в результате могут быть менее тяжелыми по стоимости и затраченному времени.
Таким образом, задача настоящего изобретения состоит в предоставлении способа стерилизации паром беклометазона, включающего нагревание смеси воды и микронизированного беклометазона при температуре в диапазоне между 100°С и 130°С в течение времени, достаточного для стерилизации смеси до минимального уровня гарантии стерильности (S.A.L., Sterility Assurance Level) - European Pharmacopoeia 4, 2003, 5.1. General Texts on sterility, p. 405), равного 10-6, смеси, являющейся только смесью беклометазона и воды. Соотношение микронизированный беклометазон: вода (м:м) может находиться в диапазоне между 2,5:100 и 100:2. В случае когда соотношение равно 100:2, подразумевают, что смесь является порошком микронизированного гидратированного беклометазона.
Предпочтительно беклометазон находится в форме дипропионата беклометазона.
Предпочтительно соотношение микронизированный беклометазон:вода составляет между 3:100 (приблизительно 30 мг/мл) до 10:100 (приблизительно 100 мг/мл).
Получены смеси беклометазона и воды в различных соотношениях и смеси стерилизовались при температуре приблизительно 120°С в течение времени в диапазоне от 15 до 30 минут.
Предпочтительно стерилизацию паром выполняли при 121°С в течение 20 минут.
Чистота BDP, простерилизованного соответственно настоящему изобретению, сравнивалось с чистотой исходного, непростерилизованного BDP.
Для верификации эффекта обработки паром на рост кристаллов также определялись распределение размера частиц и стабильность простерилизованного BDP в воде.
Параллельно также проводилась стерилизация BDP паром в присутствии насыщенного хлорида натрия соответственно US 3962430.
Количество хлорида натрия находилось в пределах между от 1,1 мг до 1,5 мг на 2,6 мг воды соответственно указаниям US 3962430. Сравнительные тесты далее выполнялись со смесями NaCl:BDP:вода в соотношениях 42:4:100 и 57:4:100, соответствующих водной суспензии, содержащей приблизительно 40 мг BDP и 450 мг или 570 мг хлорида натрия в 1 мл конечного объема.
Сравнение стерилизации паром в присутствии насыщенного раствора хлорида натрия выполнялось при той же температуре и в течение того же времени, что и эксперименты по стерилизации паром, выполненные соответственно настоящему изобретению.
Также производилось изучение стабильности готовых форм, подходящих для ингаляции, полученных при использовании стерилизации паром суспензии BDP по настоящему изобретению в сопоставлении с готовыми формами, содержащими непростерилизованный BDP.
Выполнялись анализ размера частиц и ВЭЖХ чистого вещества образцов после 50 дней хранения при 40°С, 75% относительной влажности.
Результаты показывают, что профиль примесей стерилизованных суспензий глюкокортикоидов по настоящему изобретению незначительно отличается от профиля примесей непростерилизованного глюкокортикоида.
Распределение размера частиц простерилизованных суспензий также не отличается от распределения размера частиц непростерилизованных глюкокортикоидов, и не отличается от размера для глюкокортикоидов, простерилизованных в насыщенном растворе хлорида натрия. Вопреки установленному в данной области техники O'Neill (US 3962430), хлорид натрия не воздействует на размер кристаллов водной суспензии дипропионата беклометазона.
В дополнение, не было найдено значительных различий в росте и распределении размеров кристаллов готовых форм простерилизованных паром глюкокортикоидов и непростерилизованных глюкокортикоидов после хранения в форсированных условиях, в течение 50 дней при 40°С, 75% относительной влажности.
ОБРАБОТКА ДАННЫХ
Экспериментальные данные, полученные в течение аналитического определения, обрабатывались посредством средства статистической функции программы Analysette 22, версия 1,70.
ЧИСТОТА ЛЕКАРСТВЕННОГО ВЕЩЕСТВА И ЛЕКАРСТВЕННОГО ПРОДУКТА
ПО ДАННЫМ ВЭЖХ
Принятые пределы содержания примесей определены в монографии о лекарственных веществах и лекарственном продукте.
Описано содержание примесей более чем 0,05% по отношению к содержанию BDP в анализируемом образце.
Проверяли чистоту вещества по ВЭЖХ простерилизованной водной суспензии BDP 4 мг/мл и 40 мг/мл в сравнении с непростерилизованным лекарственным веществом BDP.
Синтетические примеси лекарственного вещества не выявлены.
В таблице 1 описаны аналитические данные трех различных серий простерилизованных паром лекарственных веществ BDP (1,2 и 3) с концентрацией 4 мг/мл и 40 мг/мл в сравнении с соответствующим непростерилизованным BDP.
Простерилизованные образцы BDP 4 мг/мл показывают две различных неизвестных примеси (Rrt 0,60 и Rrt 1,06), не обнаруженные в соответствующем исходном лекарственном веществе. Содержание данных примесей соответственно составляет приблизительно 0,3% и 0,8%. В образцах 40 мг/мл содержание данных неизвестных примесей ниже 0,05% (соответственно международному критерию CPMP/ICH/2737/99 "Note for guidance on impurities testing: impurities new drug substances", описание пороговой величины примесей идентифицировано и ограничено 0,1%). Содержание других известных примесей в процессе стерилизации паром изменяется незначительно. Данное утверждение подтверждается данными, описанными в таблице 2, где профиль чистоты вещества простерилизованной суспензии BDP 40 мг/мл серий 4 и 5 (различный экспериментальный набор) сравнен с чистотой исходного лекарственного вещества BDP.
ВЭЖХ чистота вещества готовых форм определялась для готовых форм, описанных ниже:
- PG038/115, содержащая простерилизованный BDP серии 4;
- PG038/119, содержащая непростерилизованный BDP серии 4;
- PG038/116, содержащая простерилизованный BDP серии 5;
- PG038/120, содержащая непростерилизованный BDP серии 5.
Анализ выполнялся после получения (время ноль Т0) и после 50 дней хранения при условиях 40°С, 75% относительной влажности.
Как описано в таблицах 3 и 4, чистота готовых форм, содержащих простерилизованный BDP незначительно отличается от чистоты вещества готовых форм, содержащих соответствующий непростерилизованный BDP. Содержание примеси, определенное на Т0, незначительно отличается от содержания, определенного после 50 дней хранения при условиях 40°С, 75% относительной влажности.
ТЕСТ НА СТАБИЛЬНОСТЬ ЛЕКАРСТВЕННОГО ВЕЩЕСТВА В ВОДЕ
Тест на стабильность в воде выполнялся с простерилизованной суспензией BDP 40 мг/мл и данные сравнивались с непростерилизованным BDP. Анализируемыми сериями BDP были серия 4 и серия 5.
Существенных различий формы и размера кристаллов между простерилизованными и непростерилизованными образцами обнаружено не было.
РАСПРЕДЕЛЕНИЕ РАЗМЕРА ЧАСТИЦ ЛЕКАРСТВЕННОГО ВЕЩЕСТВА
Размер частицы, ось абсцисс, отображается как объем, эквивалентный диаметру (dv). Соответственно данному определению каждая частица неправильной формы рассматривается как сфера. Такая сфера определяется как эквивалентная сфера. Такая сфера и частица неправильной формы имеют одинаковый объем, следовательно объем сферы определяется как эквивалентная объемная сфера, и диаметр такой эквивалентной объемной сферы определяется как эквивалентный объемный диаметр. Описывается логарифмическая шкала. Число частиц в каждой группе размеров было показано на y-оси.
Распределение размера частиц определялось в простерилизованной водной суспензии BDP 40 мг/мл. Были исследованы две различные серии лекарственных веществ: серия 4 и серия 5. Дополнительно было выполнено определение распределения размера частиц одинаковых серий, простерилизованных в присутствии двух различных концентраций NaCl (0,420 г/мл и 0,570 г/мл, называемых NaCl (B) и NaCl (C) соответственно). Распределение размера частиц образцов, содержащих BDP серии 4 и BDP серии 5 соответственно, отражены на фигуре 1 и фигуре 2. Анализ простерилизованного BDP был выполнен на образце, описанном в примере 2.
Был определен процент для каждого распределения размера частиц менее 5 и 10 мкм и D[4,3] (средний эквивалентный объемный диаметр). Значение D[4,3] является индексом среднего диаметра частиц, учитывающим эквивалентный объем и массу частицы. Результаты описаны соответственно в таблице 5 для серии 4 и таблице 6 для серии 5.
Как показано на фигурах 1 и 2 и подтверждено ссылочным значением D[4,3] (таблицы 5 и 6), процесс стерилизации способствовал незначительному росту кристаллов BDP. Значение D[4,3] простерилизованного BDP было приблизительно на 0,6 микрон выше, чем непростерилизованного. Число частиц со средним диаметром менее 5 микрон (n.b. размер частицы ниже 5 микрон рассматривался как вдыхаемая фракция) было соответственно около 80% для простерилизованного BDP и 90% для непростерилизованного BDP. Число частиц со средним диаметром менее чем 10 микрон всегда было выше, чем 98%. Вопреки тому, что сообщается O'Neill (US 3962430), не наблюдалось роста размеров кристаллов до 300-400 микрон вследствие процесса стерилизации. Присутствие NaCl в двух концентрациях (предварительно перемешанного со стерилизуемым BDP) незначительно влияло на размер частицы. Профиль размера частиц простерилизованных образцов, содержащих BDP + NaCl или только BDP, незначительно отличался. Только кривая простерилизованного BDP+0,42 мг/мл NaCl (фиг. 1) была слегка смещена вправо (увеличение размера кристалла) в сравнении с кривой простерилизованного BDP.
РАСПРЕДЕЛЕНИЕ РАЗМЕРА ЧАСТИЦ ЛЕКАРСТВЕННОГО ПРОДУКТА
Для сравнения определялось распределение размера частицы в каждой готовой форме. Сравниваемые готовые формы имели одинаковую качественно-количественную композицию наполнителей (см. таблицу 9), но содержали простерилизованный BDP и непростерилизованный BDP, как описано в таблице 7.
Выполнялся анализ образца после 50 дней хранения при 40°С, 75% относительной влажности. Фигура 3 показывает распределение размера частиц готовой формы PG038/115(С) PG038/119(НС). Фигура 4 показывает распределение размера частиц готовой формы PG038/116(С) PG038/120(НС).
Значения D[4,3] и процентного содержания частиц с dv ниже 5 и 10 мкм каждого из проанализированных образцов описано в таблице 8.
Кривые профилей готовых форм, содержащих простерилизованный BDP и соответствующий непростерилизованный BDP незначительно отличаются. D[4,3] и число частиц с диаметром менее чем 5 мкм во всех готовых формах не оказывали влияния на характеристиках используемого BDP. Значение D[4,3] в готовых формах, содержащих простерилизованный BDP, было одинаковым по сравнению с готовыми формами, содержащими непростерилизованный BDP. Процентное содержание частиц с диаметром менее чем 5 микрон было соизмеримо в обеих готовых формах.
Аналогичные результаты получены с готовыми формами, содержащими BDP, простерилизованный паром: водными смесями во всех исследованных соотношениях (в пределах 2,5:100-100:2), например смесями, содержащими 400 мг BDP и 1 мл воды или смесями, содержащими 4 г BDP и 1 мл воды или даже смесями, содержащими 40 г BDP и 1 мл воды.
Наблюдался незначительный рост кристаллов в простерилизованных образцах лекарственного вещества, но диаметр частиц всегда оставался менее 20-30 микрон, и не наблюдалось частиц с размером около 300-400 микрон вопреки тому, что изложено в US 3962430. Насыщенный раствор хлорида натрия, использованный только вместо воды, не влияет на размер кристаллов, так что распределение размера частиц простерилизованного BDP незначительно отличается от распределения размера частицы BDP, простерилизованного в присутствии хлорида натрия.
Распределение размера частиц готовых форм, содержащих простерилизованный BDP и непростерилизованный BDP соответственно сравнивалось после 50 дней при одинаковом хранении в стрессовых условиях, и значительных различий между различными готовыми формами обнаружено не было.
Также было обнаружено, что микронизированные водные суспензии глюкокортикоидов могут быть эффективно простерилизованы паром в вышеупомянутых условиях без какого-либо изменения чистоты лекарственного вещества. Данный результат также был непредвиденным после объяснений WO 00/25746, которая сообщает, что приблизительно 8-9% активного ингредиента суспензий BDP, подвергнутых процессу стерилизации паром, претерпевают заметную деградацию.
Следовательно, стерилизация паром глюкокортикоидов соответственно настоящему изобретению представляет собой простейший и наиболее экономичный способ для использования на промышленных предприятиях для получения фармацевтических готовых форм глюкокортикоидов, в частности BDP, для ингаляционной доставки.
Способ стерилизации глюкокортикоидов и, в частности, дипропионата беклометазона, разработанный наряду с настоящим изобретением, предоставляет значительные экономические преимущества в развитии промышленного асептического процесса для производства стерильных глюкокортикоидов в готовых формах, подходящих для доставки через легкие.
Настоящее изобретение будет проиллюстрировано посредством последующих примеров, которые не должны быть истолкованы как ограничивающие данное изобретение.
МАТЕРИАЛЫ И СПОСОБЫ
Материалы
Оборудование
ПРИМЕР 1
Стерилизация паром водной суспензии BDP.
Используют две различные концентрации, 4 мг/мл и 40 мг/мл. Стерилизацию паром производят в автоклаве при 121°С, 20'. Используют три различные серии BDP, называемые ниже серия 1, серия 2 и серия 3.
Оценивают ВЭЖХ чистоту вещества простерилизованного BDP в сравнении с непростерилизованным BDP. Каждую серию получают следующим способом:
BDP (4 мг) суспендируют в 1 мл очищенной воды
BDP (40 мг) суспендируют в 1 мл очищенной воды.
ПРИМЕР 2
Распределение размера частиц и тест на стабильность в воде простерилизованного BDP
Распределение размера частиц и тест на стабильность в воде выполняют с простерилизованным BDP и, для сравнения, с нестерилизованным BDP. BDP стерилизуют как водную суспензию 40 мг/мл. В добавление стерилизуют водную суспензию BDP 40 мг/мл, содержащую 420 мг/мл и 570 мг/мл NaCl. В обоих случаях стерилизацию паром выполняют при 121°С 20'. Используют две различные серии BDP (серия 4 и серия 5) для каждого получения.
BDP серии 4 и BDP серии 5: 120 мг BDP суспендируют в 3 мл очищенной воды.
BDP серии 4 + NaCl (B) и BDP серии 5 + NaCl (B): 120 мг BDP и 1,26 г NaCl суспендируют в 3 мл очищенной воды.
BDP серии 4 + NaCl (С) и BDP серии 5 + NaCl (С): 120 мг BDP и 1,71 г NaCl суспендируют в 3 мл очищенной воды.
Кривые распределения размера частиц получают, используя лазерный анализатор размера частицы "Fritsch Analysette 22".
ПРИМЕР 3
Изучение стабильности готовой формы
Готовые формы, содержащие BDP, получают, используя образцы BDP, описанные в примере 2.
Номер серии готовой формы и характеристика BDP описаны в таблице 7.
Распределение размера частицы определяют после 50 дней хранения.
ВЭЖХ чистоту вещества оценивают непосредственно после приготовления и после 50 дней хранения при 40°С, 75% относительной влажности.
Качественно-количественная композиция готовой формы описана в таблице 9.
Последующее представляет собой иллюстративный способ получения готовой формы BDP таблицы 9, который выполняется в три различных фазы:
Фаза 1
Лаурат сорбитана (0,180 г) и полисорбат 20 (0,900 г) растворяют в 400 мл очищенной воды. Затем добавляют 9 мл простерилизованной водной суспензии BDP, соответствующие общему количеству 360 мг BDP.
Фаза 2
Бигидрат моногидрофосфата натрия (6,516 г), моногидрофосфат калия (3,186 г) и хлорид натрия (3,78 г) растворяют в 200 мл очищенной воды.
Фаза 3 - конечная готовая форма
Препараты фаз 1 и 2 смешивают и разбавляют 900 мл очищенной воды.
Каждую конечную готовую форму упаковывают в бутылку коричневатого стекла.
Готовые формы представляют к изучению стабильности в ускоренных условиях 40°С, 75% относительной влажности.
Другие готовые формы готовят для подтверждения применимости способа по настоящему изобретению.
Качественно-количественная композиция других готовых форм, которые были протестированы, описана в таблице 10 и таблице 11.
Реферат
Изобретение относится к области медицины, в частности к стерилизации нерастворимых в воде медицинских веществ. Способ осуществляется посредством нагревания смеси только микронизированного глюкокортикоида и очищенной воды при температуре в пределах между 100°С и 130°С в течение времени, достаточного для стерилизации смеси, в частности 20 минут. Способ является особенно эффективным и экономичным для стерилизации паром дипропионата беклометазона в готовой форме, которая предназначена для доставки через легкие. Способ позволяет осуществлять стерилизацию лекарственных частиц беклометазона в асептических условиях с меньшими временными затратами. 3 з.п. ф-лы, 4 ил., 11 табл.
Формула
Документы, цитированные в отчёте о поиске
Способ получения гелевой основы аэрозоля и способ получения аэрозоля

Комментарии