Композиции полиэтиленимин: днк для аэрозольной доставки - RU2242970C2
Код документа: RU2242970C2
Чертежи
Описание
Область изобретения
Данное изобретение относится в общем к области генной терапии и доставке фармацевтических лекарственных средств. Более конкретно, данное изобретение относится к доставке терапевтических генов аэрозолированным полиэтиленимином.
Описание известного уровня техники.
Серьезной проблемой, связанной с аэрозольной доставкой генов в легкие (в форме “голой” ДНК, вирусов или липосом), является заметное уменьшение эффективности, которое сопровождает процесс распыления (жидкости), в сравнении с результатами, получаемыми трансфекцией in vitro (Crook et al., 1996; Schwarz et al., 1996; Eastman et al., 1997a,b, 1998). Кроме того, было показано, что липиды и белки легочного сурфактанта (поверхностно-активного вещества, образующего мономолекулярный слой на альвеолярной поверхности легких) ингибируют опосредованную катионными липосомами трансфекцию (Duncan et al., 1997; Tsan et al., 1997). Эти эффекты, скорее всего, способствуют сообщению о низком уровне переноса генов in vivo аэрозолированными композициями на основе липидов и замедлили развитие систем, которые эффективно доставляют ДНК в легкие.
Недавно появилось сообщение, что композиция, содержащая один конкретный катионный липид (бис-гуанидиний-тренхолестерин; BGTC), была более стабильной во время процесса распыления, чем некоторые ранее испытанные липиды. Несмотря на это усовершенствование в трансфекции in vivo посредством аэрозоля, клинические применения такой терапии могут требовать еще более эффективных векторов доставки. В последние годы сообщалось, что поликатионы являются эффективными в трансфекции клеток in vitro и in vivo. Одним производным с заметной активностью является полиэтиленимин (PEI) (Boussif et al., 1995, 1996). Здесь сообщается, что композиции PEI-ДНК не только устойчивы к индуцируемому распылителем уменьшению эффективности трансфекции, но эта композиция является гораздо более эффективной, чем композиция на основе липидов, в трансфекции легочных тканей in vivo, так что композиции на основе полиэтиленимина являются приблизительно в 10 раз более эффективными, чем ранее оптимизированные композиции на основе липидов, при доставке in vivo при помощи струйного распылителя. Такие композиции на основе полиэтиленимина являются более эффективными в трансфекции легких, но производят относительно низкие уровни трансфекции в носовых ходах мышей. Композиции на основе полиэтиленимина являются, по-видимому, хорошими кандидатами для аэрозольной доставки генов для лечения разнообразных генетических легочных нарушений, в том числе легочных опухолей, и могут быть неинвазивным средством генетической иммунизации.
В известном уровне техники имеется недостаточно нелипидных носителей и композиций для аэрозольной доставки ДНК или терапевтических генов для применения в направленной генной терапии через дыхательные пути. Данное изобретение удовлетворяет эту давно существующую потребность и пожелание в данной области.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Аэрозольная доставка плазмидной ДНК в легкие предоставляет неинвазивное средство лечения разнообразных легочных нарушений. Однако процесс распыления часто приводит к быстрой потере эффективности трансфекции многих композиций вектор: ДНК. Вместе с конструированием аэрозольных систем доставки, пригодных для доставки ДНК, здесь сообщается, что композиции с использованием полиэтиленимина и макромолекул, таких как ДНК, приводят к высокому уровню легочной трансфекции и являются стабильными во время распыления. Композиции РЕI-ДНК обнаруживают также высокую степень специфичности в отношении легких и являются нетоксичными. Оптимальные соотношения и концентрации РЕI-ДНК были определены как для in vitro трансфекции, так и для in vivo трансфекции. Оказалось, что сывороточный фактор усиливает опосредованную PEI трансфекцию, тогда как поверхностно-активные вещества обладают минимальным ингибирующим действием.
Одной целью данного изобретения является представление катионных, нелипидных носителей и композиций для использования в аэрозольной доставке ДНК или терапевтических генов для направленной генной терапии через дыхательные пути.
В одном варианте данного изобретения обеспечен способ направленной генной терапии через дыхательные пути, предусматривающий стадию: доставки водных дисперсий через аэрозоль мелких частиц терапевтического гена, находящегося в комплексе с полиэтиленимином, через дыхательные пути индивидуума, нуждающегося в таком лечении.
В другом варианте данного изобретения представлена композиция поликатион-ДНК для доставки терапевтического гена через аэрозоль мелких частиц, содержащая полиэтиленимин и ДНК, кодирующую терапевтический ген.
Еще в одном варианте данного изобретения представлена композиция полиэтиленимин-ДНК для доставки терапевтического гена через аэрозоль мелких частиц, получаемая по способу, предусматривающему стадии: растворения ДНК, кодирующей терапевтический ген, в подходящем растворе; растворения полиэтиленимина в подходящем растворе; комплексообразования растворенной ДНК и растворенного полиэтиленимина с получением композиции полиэтиленимин-ДНК; и помещения композиции полиэтиленимин-ДНК в устройство для распыления с получением композиции полиэтиленимин-ДНК для доставки терапевтического гена посредством аэрозоля мелких частиц.
Другие и дополнительные аспекты, признаки и преимущества данного изобретения будут очевидными из следующего описания предпочтительных в настоящее время вариантов данного изобретения. Эти варианты даются для цели описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Прилагаемые чертежи были включены здесь таким образом, что вышеописываемые признаки, преимущества и цели данного изобретения будут ясными и могут быть поняты в деталях. Эти чертежи образуют часть описания. Однако следует отметить, что прилагаемые чертежи иллюстрируют предпочтительные варианты данного изобретения и не должны рассматриваться как ограничивающие объем данного изобретения.
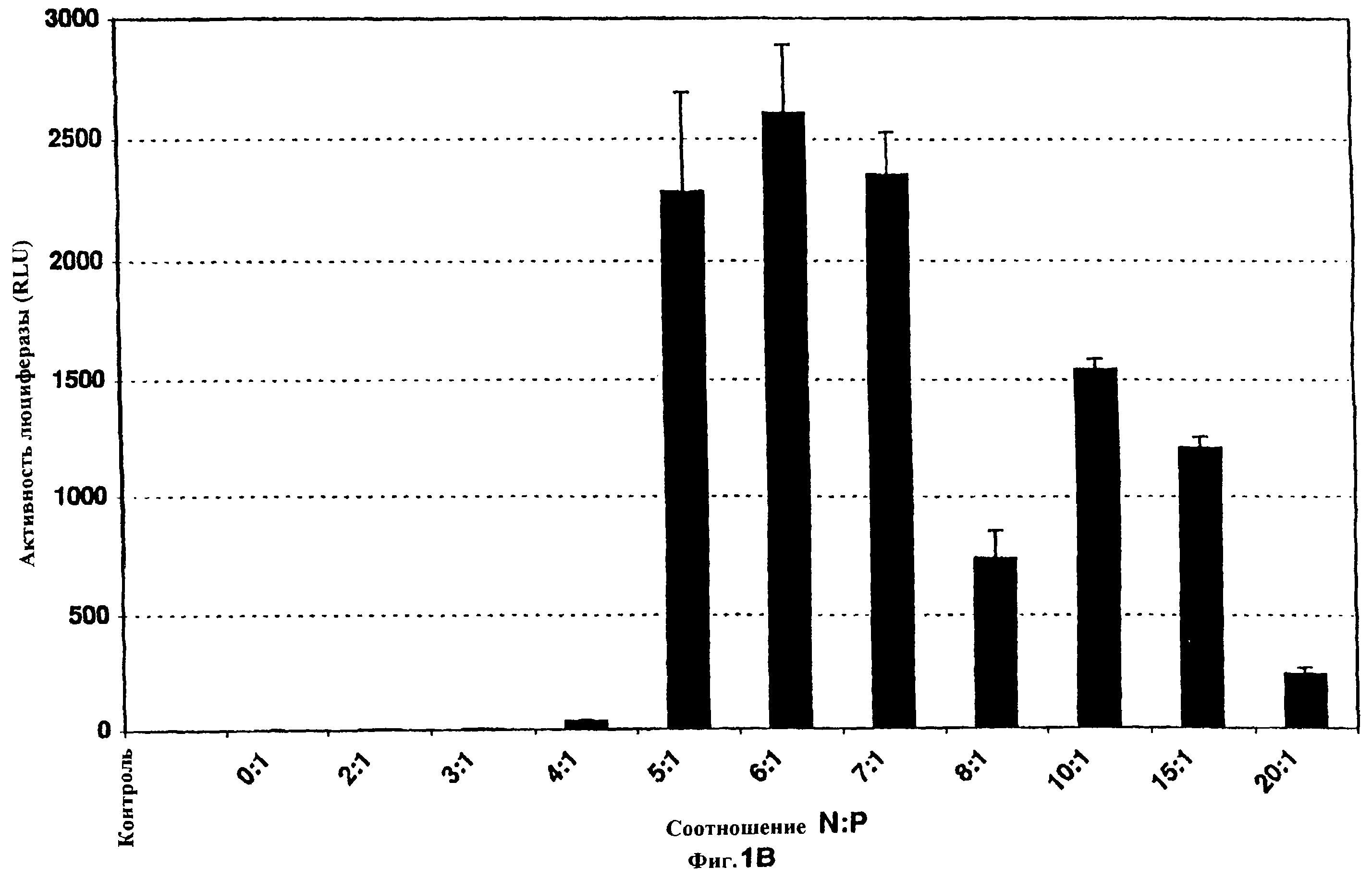
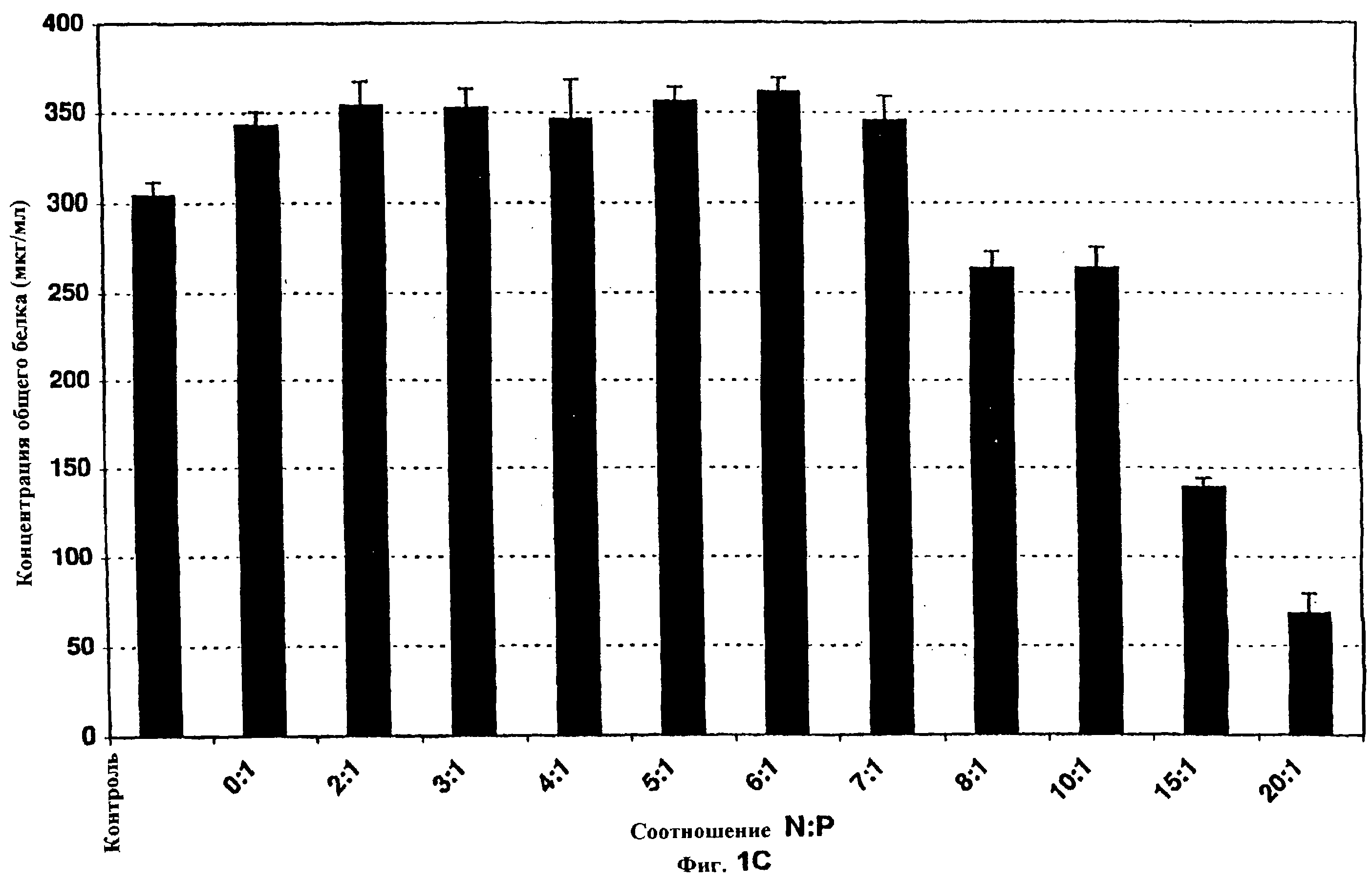
Фиг.1 показывает клетки А549 с РЕI-ДНК при различных соотношениях N:P в отсутствие сыворотки. Композиции PEI-pCMVβ и PEI-люциферазы с увеличивающимся соотношением N:P получали, как описано. Во всем эксперименте использовали постоянную концентрацию ДНК, за исключением варианта “0”, который не трансфицировали, но который подвергали воздействию в остальном идентичным изменениям среды. Клетки А549 трансфицировали в течение 6 ч и экстрагировали для определения β -галактозидазной или люциферазной активности через 48 часов после инициации трансфекции. Фиг. 1А иллюстрирует уровни β-галактозидазы, детектируемые для каждого состояния, а фиг. 1В иллюстрирует уровни люциферазы, определенные для каждого состояния. Фиг. 1С иллюстрирует уровни белка (приблизительное измерение плотности клеток и, следовательно, цитотоксичности), определенные для клеток, трансфицированных PEI-pCMVβ (из того же самого эксперимента, иллюстрированного на фиг. 1А). N=3 для всех групп. Вертикальные черточки указывают стандартную ошибку.
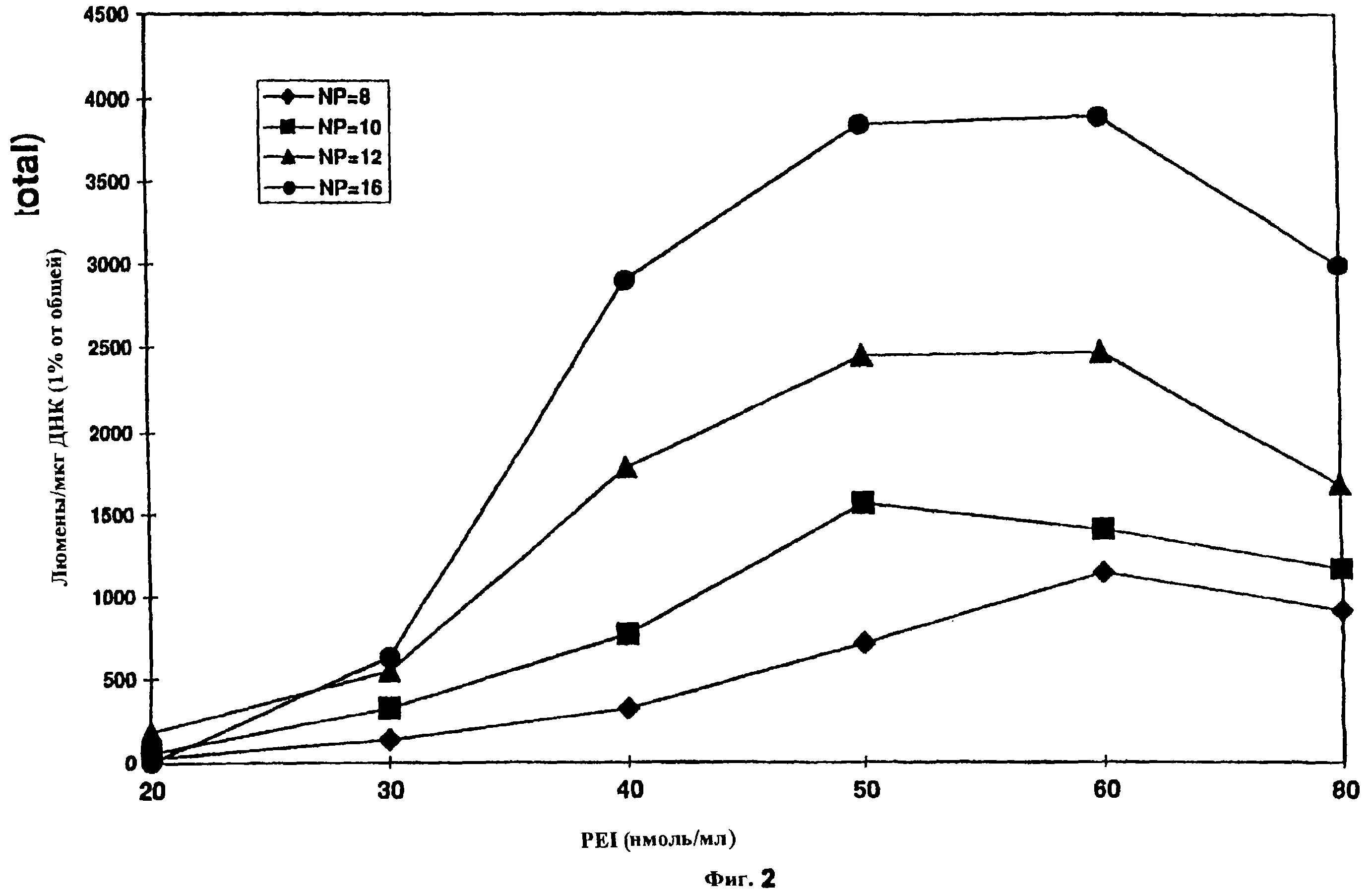
Фиг. 2 показывает трансфекцию клеток А549 увеличивающимися концентрациями РЕI-ДНК при различных соотношениях N:P в присутствии сыворотки. Готовили композиции PEI-люциферазы увеличивающейся концентрации при указанных соотношениях N:P. Клетки А549 трансфицировали в течение 6 ч и экстрагировали для определения люциферазной активности через 24 ч после инициации трансфекции. N=3 для всех групп.
Фиг. 3 показывает действия сыворотки на эффективность трансфекции PEI-pCMVβ in vitro. Клетки А549 трансфицировали постоянной концентрацией ДНК (1 мкг на лунку) и PEI (15 нмоль на лунку) при постоянном соотношении N:P 20 с указанными добавлениями в течение 6 ч и экстрагировали для определения β-галактозидазы спустя 48 ч после инициации трансфекции. N=3 для всех групп. Вертикальные черточки указывают стандартную ошибку.
Фиг. 4 показывает действия сурфактанта и BAL-жидкости на эффективность трансфекции PEI-pCMVβ in vitro. Клетки А549 трансфицировали постоянной концентрацией ДНК (1 мкг на лунку) и PEI (15 нмоль на лунку) при постоянном соотношении N:P 20 с указанными добавлениями в течение 6 ч и затем тестировали на β -галактозидазу спустя 48 ч после инициации трансфекции. N=3 для всех групп. Вертикальные черточки указывают стандартную ошибку.
Фиг. 5 показывает действие полиэтиленимина и катионного липида на стабильность трансфекции во время распыления. Композиции PEI-pCMVβ и липид-pCMVβ распыляли в течение указанных периодов времени перед взятием проб из резервуара для распыления и подвергали количественному мониторингу в тесте трансфекции in vitro (CPRG) с использованием клеток А549 в культуре, как описано. N=3 для всех групп.
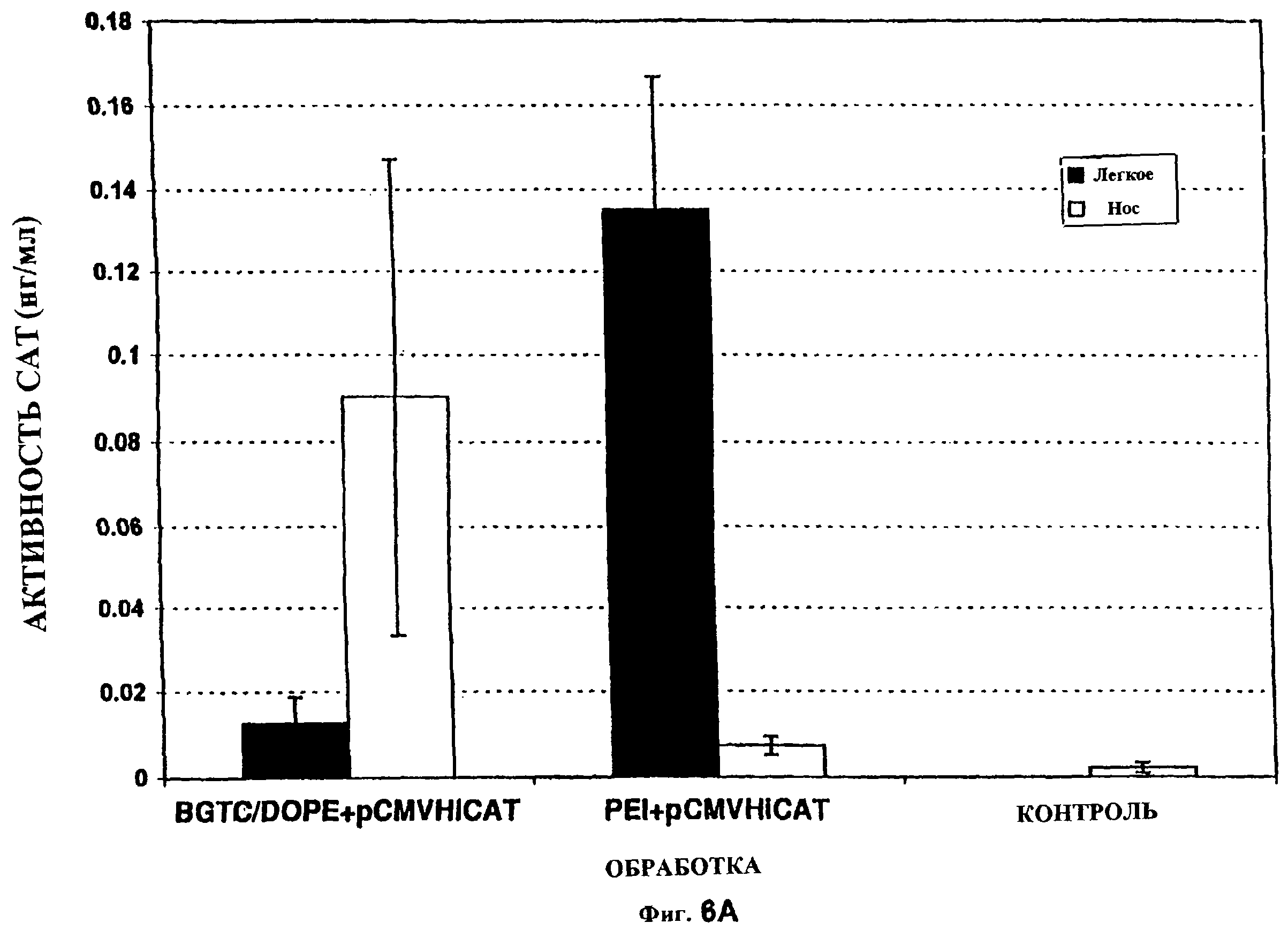
Фиг. 6 показывает интраназальную обработку in vitro мышей BALB/c. В этом эксперименте мышам вводили интраназально плазмиду pCMVHi-CAT (содержащую ген CAT), приготовленную либо с полиэтиленимином, либо с катионным липидом BGTC:DOPE (фигура 6А). Равные количества ДНК (24 мкг) вводили всем животным. Животных сначала анестезировали и раствор ДНК-вектор вводили интраназально. Животных умерщвляли спустя 48 ч после инстилляции, легкие удаляли и ткани экстрагировали и анализировали (при помощи ELISA) на экспрессию активности CAT. Идентичный эксперимент проводили с использованием экспрессионной плазмиды люциферазы (pGL3), приготовленной либо с полиэтиленимином, либо с BGTC:DOPE (фиг. 6В). Животных умерщвляли спустя 48 ч после инстилляции, легкие и носовые ткани удаляли и экстрагировали и анализировали на экспрессию люциферазы, как указано. Каждая группа обработки состояла из 6 животных. Вертикальные черточки указывают стандартную ошибку.
Фиг. 7 показывает аэрозольную обработку in vivo мышей BALB/c. В этом эксперименте животных подвергали воздействию либо РЕI-ДНК (ген хлорамфениколацетилтрансферазы), липид-ДНК (той же самой плавмиды, с той же самой концентрацией ДНК) либо не подвергали воздействию аэрозоля (контроль). Подвергание воздействию выполняли помещением животных в герметизированную камеру, соединенную с одним струйным распылителем Puritan Bennett 1600, и обеспечением 1-минутной аэрозольной обработки с последующей 9-минутной задержкой, чтобы позволить животным вдохнуть аэрозоль перед началом последующего цикла. Это повторяли до тех пор, пока не истощалась жидкость распылителя (всего 40 мл) (приблизительно 16 ч). Животных умерщвляли спустя 48 ч после окончания аэрозольной обработки, легкие удаляли и ткани экстрагировали и анализировали (при помощи ELISA) на экспрессию активности CAT. Каждая группа обработки состояла из 6 животных. Вертикальные черточки указывают стандартную ошибку.
Фиг. 8 показывает индукцию антител посредством генетической иммунизации PEI-pCMV-hGH. Группы из 5 мышей подвергали воздействию препаратом PEI-pCMV-hGH с использованием аэрозоля или интраназальной инсталляцией и результаты сравнивали с результатами, полученными с “голой” ДНК, предоставляемой внутримышечной инъекцией. Пробы сыворотки получали при 2-недельных интервалах и присутствие анти-hGH антител измеряли при помощи ELISA. Средние оптические плотности и стандартное отклонение для каждой группы показаны при разведении 1:500. Фоновая OD сывороток из неиммунизированных мышей была 0,1 в данном анализе. Вертикальные черточки представляют стандартное отклонение.
Фиг. 9 показывает сравнение между экспрессией CAT в легком под действием аэрозоля РЕI-ДНК, генерируемого с использованием воздуха или воздуха, содержащего 5% СO2. 1 мг САТ-плазмиды использовали для образования комплекса с PEI при соотношении N:P 10:1 и полученный комплекс аэрозолировали в мышей в течение 30 мин. Легкие извлекали после 24 ч и анализ CAT проводили, как описано. Величины представляют собой среднее ± SD (n=6 мышей на группу, р=0,001).
Фиг. 10 показывает, что экспрессия гена в легком аэрозолем РЕI-ДНК является зависимой от дозы. Увеличивающиеся дозы САТ-плаэмиды аэрозолировали с использованием 5% СO2 в воздухе при фиксированном соотношении N:P 10:1. Имеется увеличение как в общем количестве доставляемой ДНК, так и в концентрации доставленного РЕI-ДНК. Мышей умерщвляли после 24 ч, легкие собирали и белок CAT анализировали. Величины представляют собой среднее ± SD (n=5 мышей на группу).
Фиг. 11 показывает действие соотношений N:P на эффективность переноса РЕI-ДНК в легкие аэрозолем. Использовали различные соотношения РЕI-ДНК (N:P) с фиксированным количеством САТ-плазмиды (2 мг). Комплекс аэрозолировали с использованием 5% CO2 в воздухе. Мышей умерщвляли после 24 ч, легкие собирали и белок CAT анализировали. Величины представляют собой среднее ± SD (n=5 мышей на группу).
Фиг. 12 показывает действие соотношений N:P на экспрессию гена люциферазы в легком. Фиксированное количество люциферазной плазмиды (2 мг) доставляли при различных соотношениях N:P. Комплексы аэрозолировали с использованием 5% СО2 в воздухе. Мышей умерщвляли через 24 ч после доставки аэрозоля, легкие собирали и определяли активность люциферазы. Величины представляют собой среднее ± SD (n=5 мышей на группу).
Фиг. 13 показывает временной ход экспрессии трансгена после единственного подвергания воздействию аэрозолем PEI-ДНК. Фиг. 13А: мышей аэрозолировали 2 мг САТ-плазмиды при соотношении N:P 15:1 с использованием 5% СO2 в воздухе. Мышей умерщвляли через 24 ч, легкие собирали и немедленно замораживали. Анализ CAT выполняли после последней временной точки. Величины представляют собой среднее ± SD (n=5 мышей на временную точку). Фиг. 13В: устойчивость экспрессии CAT с использованием двух различных соотношений N:P. Обе группы мышей (n=5 мышей в каждой временной точке на группу) получали 2 мг САТ-плазмиды при соотношениях N:P 15:1 или 10:1 с использованием 5% СО2 в воздухе. Временными точками для соотношения 10:1 являются 1, 2, 3 и 6 дней после воздействия аэрозолем, а для 15:1 являются 1, 3, 7 и 10 дней после воздействия аэрозолем.
Фиг. 14 показывает тканевое распределение трансгена после единственного подвергания воздействию РЕI-ДНК. Использовали те же самые группы мышей, что и в фиг. 13 (из группы 10:1). Различные ткани собирали и немедленно замораживали. Белок CAT анализировали после последней временной точки. Величины представляют собой среднее ± SD (n=5 мышей на временную точку).
Фиг. 15 показывает опухолевый индекс для аэрозольной генной терапии меланомы B16-F10. Опухолевые клетки инъецировали в день 0 и обработку начинали в день 1. PEI-р53 и PEI-RB доставляли дважды в неделю аэрозолем в течение 3 недель. В день 24 после инъекции опухолевых клеток мышей умерщвляли и легкие взвешивали. Метастазирование легких оценивали по шкале 1-4 точки. Опухолевый индекс рассчитывали с учетом метастазирования и веса легкого (р<0,01 против контроля как для группы р53, так и для группы Rb).
Фиг. 16 показывает действия аэрозольной комбинационной терапии в отношении аденокарциномы M109. Опухолевые клетки инъецировали в день 0 и обработку начинали в день 1. PEI-р53 доставляли дважды в неделю и лекарственное средство, 9NC, также доставляли дважды в неделю в течение 4 недель. Спустя 4 недели мышей умерщвляли, легкие взвешивали и опухолевые очаги подсчитывали. Опухолевый индекс рассчитывали с учетом веса легкого, числа опухолевых очагов и размера опухолевых очагов (р<0,0001 против контроля как для группы р53, так и для группы p53+9NC).
Фиг. 17 показывает действия композиций PEI и гена р53 на рост опухоли в модели голой мыши легочного метастазирования остеосаркомы человека.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Аэрозольная доставка плазмидной ДНК в легкие предоставляет возможность прямого нанесения препаратов генов на легочные поверхности как средства лечения различных генетических легочных нарушений. Однако процесс струйного распыления быстро разрушает “голую” ДНК, вирусные векторы и многие композиции на основе липидов. Хотя было показано, что комплексообразование ДНК с катионными липидами значимо стабилизирует плазмидную ДНК, потери активности имеют место во время распыления, серьезным образом ограничивая аэрозольную доставку многих подобных комплексов. Вместе с конструированием систем аэрозольной доставки, пригодных для доставки ДНК, были разработаны композиции с использованием полиэтиленимина (PEI, поликатионного полимера) и макромолекул, таких как ДНК, которые приводят к высокому уровню легочной трансфекции (в 10-100 раз более высокому, чем в случае катионных липидов) и проявляют высокую степень стабильности во время процедур распыления. Кроме того, эти композиции на основе полиэтиленимина проявляют высокую степень специфичности в отношении легких в сравнении с ДНК-липосомным комплексом и являются нетоксичными. Оптимальные композиции полиэтиленимина и соотношения и концентрации комплекса полиэтиленимин-ДНК были определены как для in vitro, так и для in vivo трансфекции. Были исследованы свойства композиций на основе полиэтиленимина, которые делают их устойчивыми к распылению и эффективными в качестве векторов доставки ДНК для легочных участков. Термолабильный фактор в сыворотке, по-видимому, усиливает опосредованную полиэтиленимином трансфекцию, тогда как сурфактанты оказывают минимальное ингибирующее действие. Потенциальные применения этого способа включают в себя применение аэрозолированного комплекса полиэтиленимин-ДНК для генетической иммунизации.
Данное изобретение относится к доставке посредством распылителя. Ряд струйных распылителей являются доступными для доставки одной дозы или для доставки низкой дозы водной суспензии. Композиции полиэтиленимин:ДНК данного изобретения могут также доставляться посредством ультразвукового распыления. Кроме того, смеси полиэтиленимина и ДНК могут быть также выдаваться сжатым воздухом или газом в “ингаляторе с измеренными дозами”.
Конкретно, данное изобретение относится к способу нацеливающей терапии, такой как генная терапия через дыхательные пути, предусматривающему стадию доставки водных дисперсий генетической макромолекулы, такой как терапевтический ген, находящейся в комплексе с полиэтиленимином, через аэрозоль мелких частиц через дыхательные пути индивидуума, нуждающегося в таком лечении. Репрезентативные примеры генетических макромолекул, которые могут доставляться в соответствии со способами данного изобретения, включают ДНК, РНК, каталитически активные нуклеиновые кислоты, такие как рибозимы, антисмысловые олигонуклеотиды, а также другие типы модифицированных нуклеиновых кислот. Этот способ данного изобретения может быть использован для лечения индивидуума, имеющего заболевание, такое как муковисцидоз, астма, рак легкого, рак пищевода, рак ободочной кишки, лейкоз, рак молочной железы, саркома или меланома. Кроме того, генетическая макромолекула в комплексе с полиэтиленимином в водных дисперсиях может вводиться в воздушной смеси, содержащей до 10% газообразного диоксида углерода, чтобы потенциировать действия полиэтиленимина, как описано подробно ниже.
Данное изобретение относится также к композиции поликатион-генетическая макромолекула для доставки генетической макромолекулы, такой как терапевтический ген, посредством аэрозоля мелких частиц, содержащей полиэтиленимин и генетическую макромолекулу. Репрезентативные примеры генетических макромолекул, которые могут содержаться в таких композициях данного изобретения, включают в себя ДНК, РНК, каталитически активные нуклеиновые кислоты, такие как рибозимы, антисмысловые олигонуклеотиды, а также другие типы модифицированных нуклеиновых кислот.
Далее, данное изобретение относится к композиции, содержащей комплекс поликатион-генетическая макромолекула, для доставки терапевтического гена через аэрозоль мелких частиц, причем эту композицию получают по способу, предусматривающему стадии: растворения генетической макромолекулы в подходящем растворе; растворения полиэтиленимина в подходящем растворе; комплексообразования растворенной генетической макромолекулы и растворенного полиэтиленимина с образованием композиции полиэтиленимин-генетическая макромолекула; и помещения композиции полиэтиленимин-генетическая макромолекула в устройство для распыления с получением композиции полиэтиленимин-генетическая макромолекула для доставки генетической макромолекулы через аэрозоль мелких частиц. Репрезентативные примеры генетических макромолекул, которые могут содержаться в таких композициях данного изобретения, включают в себя ДНК, РНК, каталитически активные нуклеиновые кислоты, такие как рибозимы, антисмысловые олигонуклеотиды, а также другие типы модифицированных нуклеиновых кислот.
Способы доставки для вышеописываемых способов и композиций включают в себя пероральную ингаляцию и назальную ингаляцию при помощи лицевой маски или трубок для рта и при помощи кислородных боксов для детей, в ином случае используемых для подачи кислорода. Обычно, аэрозоль мелких частиц создают процессом распыления. Предпочтительно, процесс распыления проводят с использованием струйного распылителя. Кроме того, желательно, чтобы терапевтический ген содержал функционально связанные элементы, необходимые для экспрессии, и репрезентативные терапевтические гены включают в себя регуляторный ген трансмембранной проводимости муковисцидоза, ген, кодирующий супрессор опухоли, такой как р53, или ген ретинобластомы, или сконструированные варианты этих генов, гены цитокинов, таких как интерлейкин-2 или интерлейкин-12, и гены, которые могут быть использованы в качестве ДНК-вакцин, которые будут стимулировать прямую иммунную реакцию против опухолей или других инфекционных агентов. Еще одним репрезентативным терапевтическим геном является ген тимидинкиназы HSV. Обычно конечная концентрация терапевтического гена в полиэтиленимине не больше чем около 10 мкг ДНК/50 нмоль азота полиэтиленимина/мл и не меньше чем около 0,1 мкг ДНК/50 нмоль азота полиэтиленимина/мл. Кроме того, к вышеописываемой композиции может быть добавлена сыворотка. Далее, клеткоспецифический лиганд может быть ковалентно конъюгирован с полиэтиленимином, и репрезентативным клеткоспецифическим лигандом является трансферрин.
В соответствии с данным изобретением в нем могут применяться общепринятые способы молекулярной биологии, микробиологии и рекомбинантных ДНК, известные специалистам в данной области. Такие способы исчерпывающим образом описаны в литературе. См., например, Sambrook, Fritsch & Maniatis, "Molecular Cloning: A Laboratory Manual (1982); "DNA Cloning: A Practical Approach", Volumes I ana II (D.N.Glover ed. 1985); "Oligonucleotide Synthesis" (M.J.Gait ed. 1984); "Nucleic Acid Hybridization" [B.D.Hames & S.J.Higgins eds. (1985)]; "Transcription and Translation" [B.D.Hames & S.J.Higgins eds. (1984)]; "Animal Cell Culture" [R.I.Freshney, ed. (1986)]; "Immobilized Cell And Enzymes" [IRL Press, (1986)]; В.Perbal, "A Practical Guide To Molecular Cloning" (1984). Таким образом, в данном описании следующие термины будут иметь приведенные ниже значения.
“Молекула ДНК” относится к полимерной форме дезоксирибонуклеотидов (аденина, гуанина, тимина или цитозина) либо в ее одноцепочечной форме, либо в двухцепочечной спирали. Этот термин относится только к первичной и вторичной структуре этой молекулы и не ограничивает ее в отношении любых конкретных третичных форм. Так, этот термин включает в себя двухцепочечную ДНК, обнаруживаемую, inter alia, в линейных молекулах ДНК (например, рестрикционных фрагментах), вирусах, плазмидах и хромосомах.
“Генетическая молекула” будет включать ДНК, в том числе терапевтические гены, РНК, каталитически активные нуклеиновые кислоты, такие как рибозимы, антисмысловые олигонуклеотиды, а также другие типы модифицированных нуклеиновых кислот.
“Промоторная последовательность” представляет собой регуляторный участок ДНК, способный связывать РНК-полимеразу в клетке и инициировать транскрипцию кодирующей последовательности в прямом направлении (в 3"-направлении). Для целей определения данного изобретения промоторная последовательность связана с ее 3'-концом сайтом инициации транскрипции и простирается в обратном направлении транскрипции (в 5'-направлении) для включения минимального числа оснований или элементов, необходимых для инициации транскрипции при уровнях, детектируемых выше фона. В этой промоторной последовательности находится сайт инициации транскрипции, а также белоксвязывающие домены (консенсусные последовательности), ответственные за связывание РНК-полимеразы. Эукариотические промоторы часто, но не всегда, содержат “ТАТА”-боксы и “САТ”-боксы. Прокариотические промоторы содержат последовательности Шайна-Далгарно, кроме -10 и -35 консенсусных последовательностей.
“Кодирующая последовательность” ДНК является двухцепочечной ДНК-последовательностью, которая транскрибируется и транслируется в полипептид in vivo при помещении под контроль подходящих регуляторных последовательностей. Границы кодирующей последовательности определяются старт-кодоном на 5' (амино)-конце и стоп-кодоном трансляции на 3' (карбоксил)-конце. Кодирующая последовательность может включать в себя, но не ограничивается ими, прокариотические последовательности, кДНК из эукариотических мРНК, геномные последовательности ДНК эукариот (например, млекопитающих) и даже синтетические последовательности ДНК.
Регуляторными последовательностями транскрипции и трансляции являются регуляторные последовательности ДНК, такие как промоторы, энхансеры, сигналы полиаденилирования, терминаторы и т.п., которые обеспечивают экспрессию кодирующей последовательности в клетке-хозяине. “Цис-элемент” представляет собой нуклеотидную последовательность, называемую также “консенсусной последовательностью” или “мотивом”, которая взаимодействует с другими белками, которые регулируют экспрессию специфического генного локуса в прямом или обратном направлении. В кодирующую последовательность может быть также включена “сигнальная последовательность”. Эта последовательность кодирует сигнальный пептид, находящийся с N-конца данного полипептида, который взаимодействует с клеткой-хозяином и направляет этот полипептид в подходящее клеточное местоположение. Сигнальные последовательности могут быть обнаружены в связи с различными белками, нативными для прокариот и эукариот. Сигнал полиаденилирования и последовательность терминации транскрипции обычно будут локализованы с 3' стороны кодирующей последовательности.
“Регуляторная последовательность экспрессии” является последовательностью ДНК, которая контролирует и регулирует транскрипцию и трансляцию другой последовательности ДНК. Кодирующая последовательность “функционально связана” с транскрипционными и трансляционными регуляторными последовательностями и “находится под контролем” транскрипционных и трансляционных регуляторных последовательностей в клетке, когда РНК-полимераза транскрибирует кодирующую последовательность в мРНК, которая затем транслируется в белок, кодируемый данной кодирующей последовательностью.
“Ген” может включать интактный ген в том виде, в каком этот ген встречается в природе, т.е. кодирующую последовательность, запускаемую промотором и/или дополнительными последовательностями, обнаруживаемыми в природе. Альтернативно, ген может включать в себя кодирующую последовательность и гетерологичный промотор (с гетерологичными транскрипционными и/или трансляционными регуляторными последовательностями или без них) для запуска экспрессии этой кодирующей последовательности. В применении здесь, “терапевтический ген” является обычно геном, либо с его нативным промотором, либо с гетерологичным промотором, запускающим экспрессию, кодирующим белок, который обладает терапевтическим действием, например, геном, кодирующим требующийся фермент, в противном случае отсутствующий в клетке.
Обычно, экспрессирующие векторы, содержащие промоторные последовательности, которые облегчают эффективную транскрипцию и трансляцию встроенного ДНК-фрагмента, используют вместе с хозяином. Обычно экспрессирующий вектор содержит начало репликации, промотор (промоторы), терминатор (терминаторы), а также специфические гены, которые способны обеспечивать фенотипический отбор в трансформированных клетках. Трансформированные хозяева могут быть ферментированы и культивированы согласно способам, известным в данной области, для получения оптимального роста клеток.
“Гетерологичный” участок конструкции ДНК представляет собой идентифицируемый сегмент ДНК в большей ДНК-молекуле, который не обнаруживается в ассоциации с этой большей молекулой в природе. Таким образом, когда данный гетерологичный участок кодирует ген млекопитающего, этот ген будет обычно фланкирован ДНК, которая не фланкирует эту геномную ДНК млекопитающего в геноме организма-источника этой ДНК. В другом примере, кодирующая последовательность является конструкцией, где сама эта кодирующая последовательность не обнаруживается в природе (например, кДНК, где геномная кодирующая последовательность содержит интроны, или синтетические последовательности, имеющие кодоны, иные, чем кодоны нативного гена). Аллельные вариации природно встречающихся мутационных событий не приводят к появлению гетерологичного участок ДНК, определенного здесь.
“Вектор” представляет собой репликон, такой как плазмида, фаг или космида, к которому может быть присоединен другой ДНК-сегмент таким образом, чтобы вызвать репликацию присоединенного сегмента. “Репликон” представляет собой любой генетический элемент (например, плазмиду, хромосому, вирус), который функционирует в виде автономной единицы репликации ДНК in vivo; т.е. способен к репликации под его собственным контролем.
“Началом репликации” называют те последовательности ДНК, которые участвуют в синтезе ДНК.
В применении здесь, термин “аэрозоль” относится к дисперсиям в воздухе твердых или жидких частиц достаточно мелкого размера и в результате с низкими скоростями осаждения, приводящими к относительной стабильности нахождения в воздухе (Knight, V., Viral and Mycoplasmal Infections of Respiratory Tract, 1973, Lea and Febigar, Phila. PA, pp.2).
В применении здесь, термин “распыление” или “процесс распыления” относится к получению мелких аэрозолей из подачи жидкости, т.е. продукта обратного потока продуцирующего направленный распыленный туман устройства (May, 1973).
В применении здесь, термин “струйный распылитель” относится к устройству, в котором сжатый воздух расширяется в форсунку, приводя к снижению статического давления, которое засасывает жидкость из резервуара распылителя через присоединенную трубку. Эта жидкость разбивается воздушной струей в дисперсию капель с широким диапазоном размеров. Большая часть капель (около 99,92%) ударяется о стенку вмещающей их колбы и возвращаются в резервуар. Остальной небольшой процент (около 0,02%) избегает ударов и вытекает из распылителя, несомый сжатым потоком воздуха. Он и составляет мелкокапельный аэрозоль.
В применении здесь, “интраназальная инстилляция” обозначает процесс, при помощи которого жидкость вносят в нос анестезированного животного, которое является животным с искусственным носовым дыханием, так что это животное затем вдыхает эту жидкость в дыхательные пути или легкие.
Особо рассматривается, что фармацевтические композиции (PEI):ДНК данного изобретения могут быть приготовлены для аэрозольной доставки водных дисперсий в дыхательные пути индивидуума или животного. Специалист в данной области может легко определить, без чрезмерного экспериментирования, подходящие дозы аэрозольных композиций. При применении in vivo для нацеленной генной терапии композицию полиэтиленимин:ДНК данного изобретения вводят пациенту или животному в терапевтически эффективных количествах, т.е. количествах, которые эффективно экспрессируют терапевтический ген и тем самым элиминируют или ослабляют заболевание. Доза и схема приема лекарственного средства будет зависеть от характера заболевания, свойств конкретной композиции полиэтиленимин:ДНК, например ее терапевтического индекса, пациента, истории болезни пациента и других факторов. Вводимое количество композиции полиэтиленимин: ДНК будет обычно в диапазоне приблизительно 0,01-1,0 мг/кг веса тела пациента. Схема применения будет продолжаться для оптимизации эффективности по соотношению отрицательных эффектов лечения. См. Remington's Pharmaceutical Science, 17th Ed. (1990) Mack Publishing Co., Easton, Penn.; и Goodman and Gilman's: The Pharmacological Basis of Therapeutics 8th Ed (1990) Pergamon Press; которые включены здесь в качестве ссылки. Композиция или готовая форма может содержать минорные количества добавок, таких как вещества, которые усиливают изотоничность и химическую стабильность, например буферы и консерванты. Композицию полиэтиленимин:ДНК обычно готовят при концентрациях около 0,1 мкг ДНК/20 нмоль азота PEI/мл - 10 мкг ДНК/150 нмоль азота PEI/мл.
Следующие примеры приводятся для цели иллюстрации различных вариантов данного изобретения и не предназначены для ограничения каким-либо образом данного изобретения.
ПРИМЕР 1
Готовые формы PEI-ДНК
PEI (25 кД) получали из Aldrich Chemical (Milwaukee, WI). Исходный раствор PEI получали в концентрации 4,3 мг/мл (0,1 М по азоту) в забуференном фосфатом солевом растворе (ЗФР). ДНК содержит 3 нмоль фосфата на мкг и подходящие концентрации получали в ЗФР. Желаемое количество ДНК в ЗФР подвергали комплексообразованию с PEI медленным добавлением ДНК к PEI при интенсивном перемешивании вортексом этого раствора. Затем раствору давали инкубироваться при комнатной температуре в течение 15-20 мин перед использованием. Полученное соотношение реагирующих веществ выражают как азот PEI:фосфор ДНК (N:P).
ПРИМЕР 2
Плазмидная ДНК
Промотор цитомегаловируса (CMV) с репортерным геном β-галактозидазы Е. coli (pCMVβ; CLONTECH, Palo Alto, CA) и ген зеленого флуоресцентного белка медузы (pEGFP; CLONTECH) использовали для оценки экспрессии клеток млекопитающих in vitro. Трансфекцию in vivo оценивали с геном хлорамфениколаце-тилтрансферазы (pCMVHiCAT) (подарок из Genzyme, Inc., Framingham, MA). Люциферазную плазмиду (pGL3, Promega, Madison, WI), модифицированную встраиванием промотора/энхансера CMV и последовательности полиаденилирования гормона роста человека (от Michael A. Barry из Baylor), использовали в качестве репортерного гена для трансфекции как in vitro, так и in vivo. Плазмида, используемая для исследований по иммунизации, pCMV-hGH, экспрессирует гормон роста человека и была также получена от Michael A. Barry. Бактериальные культуры трансформировали указанными выше плазмидами и получали достаточные по массе количества плазмидной ДНК и очищали их с использованием реагентов и колонок для не содержащей эндотоксинов ДНК (Qiagen, Valencia, СА) и затем растворяли в не содержащей эндотоксинов воде до желаемой концентрации.
ПРИМЕР 3
Синтез катионных липидов
Катионные липиды либо синтезировали, либо получали в подарок. DC-холестерин (3-([N-[(N',N'-диметиламино)этан]карбамоил] холестерин) синтезировали согласно способам Gao и Huang (1991). Гуанидинийхолестерин(бис-гуанидиний-трен-холестерин; BGTC) синтезировали согласно способам Vigneron et al. (1996). N-(2-гидроксиэтил)-N,N-диметил-2,3-бис(тетрадецитокси)-1-пропанаминийбромид (DMRIE) получали из Vical (San Diego, СА).
ПРИМЕР 4
Получение комплексов катионный липид: нейтральный колипид-ДНК
Все готовые формы катионный липид:DOPE готовили сначала смешиванием катионного липида (5 мг/мл в хлороформе) с подходящим объемом диолеилфосфатидилэтаноламина (DOPE; Avanti Polar Lipids; 5 мг/мл в хлороформе) или холестерина (5 мг/мл в хлороформе; Sigma) и высушиванием в атмосфере азота. Смесь липидов растворяли в третбутаноле при 37°С, замораживали при -80°С и лиофилизировали в течение по меньшей мере 24 ч. Липиды хранили при -20°С до использования, в этот момент их нагревали до комнатной температуры и ресуспендировали в стерильной воде (Water for irrigation; (вода для промывания) WFI; Baxter, Deerfield, IL)) в течение по меньшей мере 30 мин перед комплексообразованием с ДНК. Лиофилизированные готовые формы BGTC:DOPE, по-видимому, являются стабильными при -20°С на протяжении периода 6-8 или более месяцев.
ПРИМЕР 5
Культура ткани
Клеточную линию А549 рака легких человека покупали из Американской коллекции типовых культур (Rockville, MD). Клетки культивировали в модифицированной минимальной среде Дульбекко (D-MEM), дополненной 10% фетальной телячьей сывороткой (ФТС), 2 мМ L-глутамином и 50 мкг/мл гентамицина (если нет иных указаний), или в среде RPMI 1640 (Gibco) с 10% ФТС. Клетки культивировали в термостате для культур клеток при 37°C и в присутствии 5% СО2. Использовали только первые 8 пассажей клеток А549.
ПРИМЕР 6
Трансфекция in vitro
Для бессывороточных трансфекций клетки высевали при 1,5×105 клеток на лунку в 12-луночных планшетах за день до трансфекции (если нет иных указаний). Клетки были приблизительно на 80% конфлюентными во время трансфекций. После завершения комплексообразования РЕ I-ДНК или липид-ДНК готовые формы РЕI-ДНК или липосомной ДНК доводили в среде Opti-mem I Reduced Serum Medium (Opti-mem; Gibco-BRL, Grand Island, NY) до конечной концентрации ДНК 1 мкг/мл. Непосредственно перед трансфекцией клетки промывали Opti-mem и затем наносили 1 мл раствора для трансфекции на лунку (3 лунки обычно трансфицировали в каждой временной точке или в каждом состоянии). Комплексы плазмида-РЕI получали при различных соотношениях азота к фосфату (N:P) на основе состава PEI (мол. масса 25000; 581 моль азота на моль) и ДНК (3 нмоль фосфата на мкг). Спустя 24 ч (за исключением случаев, где указано более короткое время трансфекции) раствор для трансфекции удаляли, клетки промывали и добавляли 1 мл дополненной среды DMEM. Затем эти клетки инкубировали в течение дополнительных 24 ч, промывали два раза за буференным фосфатом солевым раствором (ЗФР) и лизировали лизисным буфером (0,1 М Трис-HCl, 0,5% Тритон X-100 (Sigma, St. Louis, МО) и анализировали на экспрессию β-галактозидазы или люциферазы.
Для определения оптимальных соотношений азота полиэтиленимина к фосфату ДНК (N:P) и оптимальной концентрации азота полиэтиленимина для применений in vitro в присутствии сыворотки был разработан следующий протокол: 1) комплексы PEI-ДНК готовили в диапазоне соотношений N:P и давали им инкубироваться при комнатной температуре в течение 15-20 мин перед использованием; 2) клетки высевали при 105 клеток на лунку в 24-луночном формате и инкубировали при 37°С в течение ночи в 1 мл среды RPMI 1640, дополненной 10% ФТС; 3) затем объем среды в каждой лунке корректировали для получения желательной конечной концентрации азота PEI; 4) постоянный объем раствора PEI-ДНК добавляли в каждую лунку для каждого конкретного соотношения N:P; 5) планшеты инкубировали при 37°С в течение ночи и обследовали на экспрессию GFP или анализировали на экспрессию люциферазы.
ПРИМЕР 7
Действие сыворотки, сурфактанта и жидкости бронхоальвеолярного лаважа на трансфекцию PEI in vitro
Клетки А549 высевали и трансфицировали, как описано выше, за исключением того, что вместо разбавления образовавших комплексы композиций Opti-mem перед трансфекцией, их разбавляли Opti-mem, содержащей представляющий интерес реагент (сыворотку, поверхностно-активное вещество или жидкость бронхоальвеолярного лаважа). Фетальную телячью сыворотку (ФТС) получали из HyClone Laboratories, Inc. (Logan, UT), мышиную и человеческую сыворотку получали из Gibco-BRL, а синтетический сурфантант (Exosurf, содержащий в основном колфасцерилпальмитат в концентрации 81 мг/мл) получали из Burroughs Welcome Со. (Research Triangle, N.C.). Жидкость бронхоальвеолярного лаважа (BAL) получали из необработанных мышей, которых умерщвляли анестезией метоксифлураном и обескровливали через брюшную аорту. Трахею обнажали хирургически и канюлировали трубкой РЕ50 (наружный диаметр 0,965 мм, Clay Adams). С использованием общего объема 2,0 мл физиологического солевого раствора проводили лаваж легких 5 раз объемом приблизительно 1,0 мл (объем 1,0 мл одной и той же жидкости накачивали в легкие и выкачивали из легких 5 раз с использованием шприца на 3 мл, содержащего всего 2 мл). Выход обычно был 85% от 2 мл жидкости лаважа. Объединенную жидкость BAL из нескольких мышей затем лиофилизировали и реконституировали при различных концентрациях для анализа трансфекции.
ПРИМЕР 8
Количественный анализ эффективности трансфекции in vitro
После лизиса клеток концентрацию белка определяли с использованием БСА-анализа белка из Pierce (Rockford, IL). β-галактозидазную активность количественно определяли с использованием анализа с хлорфеноловым красным-β -D-галактопиранозидом (CPRG; Boehringer Mannheim, Indianapolis, IN) в формате 96-луночного планшета и считывали результаты на планшет-ридере для микротитрационных планшетов Dynatech MR5000 (Dynatech Laboratories, Inc., Chantilly, VA).
Тесты на люциферазу проводили с коммерческими реагентами в соответствии с инструкциями изготовителей (Promega, Madison, WI). Для экспрессии люциферазы в клеточных культурах среду удаляли и в каждую лунку добавляли 1 мл лизисного буфера (Promega, Madison, WI). После инкубирования планшета в течение 20 мин при комнатной температуре на роторной качалке лизаты анализировали смешиванием 1-10 мкл лизата с 50 мкл субстрата и измерением испускания света в течение 15 с в люминометре TD-20C (Turner Designs, Sunnyvale, CA).
ПРИМЕР 9
Функциональная стабильность распыленных комплексов PEI-ДНК и липосома-ДНК
Готовые формы РЕI-ДНК и липид-ДНК получали разбавлением ДНК до 80 мкг/мл в 2,5 мл WFI, добавляя подходящее количество липида в 2,5 мл WFI к ДНК или подходящего количества ДНК к PEI в ЗФР и инкубируя при комнатной температуре в течение 15-30 мин перед распылением. При указанных временных интервалах аликвоты 50-75 мкл удаляли из резервуара распылителя и готовили для трансфекции in vitro. pCMVβ использовали в качестве репортерного гена во всех этих исследованиях и функциональную стабильность плазмидной ДНК анализировали в клетках А549 в 12-луночных планшетах, как описано выше. Следует отметить, что для того, чтобы струйные распылители производили аэрозоли мелких частиц, они должны непрерывно подвергать жидкость рециркуляции, так как только незначительная фракция жидкости распылителя (менее 1%) высвобождается в виде аэрозоля с каждым прохождением через форсунку распылителя. Крупные частицы липид-ДНК (>400 им) быстро обрабатываются до более мелких размеров, так что в течение короткого периода времени размер частиц липид-ДНК в резервуаре распылителя становится очень сходным с размером частиц аэрозоля, извлекаемых из аэрозоля в приборе All Glass Impinger (AGI-4, Асе Glass Co., Vineland, NJ)).
Распылитель с двумя форсунками Puritan Bennet 1600 twin jet nebulizer (Carlsbad, CA), используемый в этом исследовании, был модифицирован удалением одной трубки из одной из двух форсунок и был назван распылителем с одной форсункой Puritan Bennet 1600 single jet (PB sj). PB sj работал при скорости тока 15 л/мин, если нет других указаний.
ПРИМЕР 10
Трансфекция in vivo с использованием комплексов PEI-ДНК и липосома-ДНК при помощи инстилляции.
Композиции PEI-ДНК и липид-ДНК получали, как описано здесь, за исключением того, что концентрацию ДНК увеличивали до 6 мкг на 40 мкл (после добавления подходящей концентрации липосом или добавления подходящей концентрации полиэтиленимина) для одной дозы инстилляции. Для минимизации вариабельности, происходящей из случайной неполной инстилляции (животные иногда выбрасывают часть инстиллированного материала), каждое животное инстиллировали в целом четыре раза: один раз утром и один раз в полдень в каждый из двух последовательных дней с использованием одного и того же количества ДНК. Животных слегка анестезировали метоксифлураном непосредственно перед введением композиции. При удерживании животных точно вертикально взятием за загривок 40 мкл медленно вносили в одну ноздрю, где жидкость ингалировалась. Животных удерживали в вертикальном положении в течение короткого периода времени, чтобы дать инстиллированной жидкости достичь легких. Эффективность легочной доставки с использованием этого подхода подтверждали с использованием радиоактивно меченых липосомных препаратов, и большая часть этого материала обнаруживается в легких после нескольких минут. Животные не проявляют заметных признаков физиологического ухудшения или расстройства в результате этой обработки, и не отмечались явные патологические последствия при макроскопическом обследовании легких и других органов. Поскольку прежняя работа показала, что оптимальное время для экспрессии инстиллированных репортерных генов было 1-2 дня после инсталляции, животных умерщвляли при 48 ч после начала первой инсталляции.
ПРИМЕР 11
Трансфекция in vivo комплексов PEI-ДНК и липосома-ДНК посредством аэрозоля
Композиции РЕI-ДНК и липид-ДНК получали, как описано здесь, за исключением того, что концентрацию ДНК увеличивали до 2 мкг на 20 мкл (после добавления подходящей концентрации липосом или полиэтиленимина) для одной дозы распылителя. Если нет других указаний, распылитель РВ sj работал при скорости тока 8 л/мин. Выходящий из распылителя поток проходил через герметизированную пластиковую клетку (13×17×30 см), в которой содержали мышей (обычно 6-8). Воздух выходил из этой клетки через фильтр НЕРА, и все устройство помещали в ламинарный бокс, вентилируемый через дополнительную фильтрацию НЕРА кнаружи. Для минимизации применения аэрозоля распылитель работал под автоматическим контролем в течение только 1 мин каждые 10 мин. После потребления первых 20 мл суспензии распылитель пополняли дополнительными 20 мл той же самой концентрации. Подвергание воздействию требовало приблизительно 12 ч, во время этого времени мышам предоставляли корм и воду и позволяли перемещаться свободно по клетке.
ПРИМЕР 12
Количественный анализ экспрессии генов in vivo
Было обнаружено, что экспрессия CAT является более чувствительным способом измерения эффективности трансфекции in vivo, чем экспрессия β-галактозидазы, которую использовали во время исследований in vitro. Животных, которых подвергали действию распыленных композиций, умерщвляли в подходящих временных точках (48 ч, если нет других указаний) и легкие и трахеи удаляли и замораживали в жидком азоте. Позже эти ткани измельчали в лизисном буфере и гомогенизировали с использованием гомогенизатора с бусинами Wig-L-Bug (Crescent Dental Mfg., Lyons, IL). Для определения трансфекции в носу носовую секцию черепа мыши вырезали из остального черепа и замораживали в жидком азоте. Замороженную носовую секцию измельчали в порошок и затем подвергали гомогенизации в лизисном буфере с использованием гомогенизатора с бусинами Wig-L-Bug. Экстракты ткани анализировали на содержание CAT с использованием коммерчески доступного набора ELISA для CAT (Boehringer Mannheim Grobh, Germany). Результаты, полученные с использованием анализа ELISA, были эквивалентными или более хорошими, чем результаты, полученные с использованием общепринятых способов ТСХ и способов с отделением органической фазы. Вследствие вариабельности, наблюдаемой в случае фактически всех исследований с аэрозолями in vivo, экспериментальные и контрольные группы обычно состояли из 6-8 животных.
Для анализа in vivo экспрессии люциферазы после инстилляции или аэрозольной доставки животных умерщвляли летальной дозой анестезии, обескровливали поперечным разрезом брюшной аорты и собирали легкие и трахею. В некоторых исследованиях собирали также ткани носа. Ткань гомогенизировали в 1 мл лизисного буфера для анализа люциферазы с использованием стеклянного измельчителя ткани с коническим основанием (Kontes Duall 23). Аликвоту 10 мкл этого гомогената добавляли к 50 мкл субстрата и измеряли испускание света.
ПРИМЕР 13
Генетическая иммунизация
Группы из 5 мышей подвергали воздействию pCMV-hGH, объединенной с PEI (отношение N:P 10), посредством аэрозоля или воздействию интраназальной плазмиды. В качестве положительной контрольной группы пять мышей получали пустую плазмиду (50 мкг в 50 мкл ЗФР) в виде внутримышечной инъекции в переднюю большеберцовую (тибиальную) мышцу. Последовательные пробы сыворотки получали при двухнедельных интервалах и анализировали при помощи ELISA на общие специфические антитела к гормону роста человека (очищенный белок hGH получали из Cal-Biochem, San Diego, CA). Пул сывороток из неиммунизированных мышей служил в качестве отрицательного контроля в каждом ELISA.
ПРИМЕР 14
Оптимизация in vitro соотношений и концентраций реагирующих веществ РЕI-ДНК.
Вследствие важности соотношения реагирующих веществ для эффективности трансфекции большинства композиций поликатион-ДНК, взаимосвязь между соотношением PEI-ДНК и трансфекцией исследовали in vitro с использованием клеток А549 в отсутствие сыворотки. Как показано на фиг. 1А, соотношение азота полиэтиленимина к фосфату ДНК (N:P) приблизительно 5 является оптимальным для трансфекции in vitro плазмидой pCMVβ, как определено по экспрессии β -галактозидазы. Трансфекция быстро падает при соотношениях ниже 4 и уменьшается, когда это отношение увеличивается выше 5. Очень сходные результаты получали с композициями PEI-люцифераза (фиг. 1В). При исследовании действий этих соотношений на уровни белка клеточных экстрактов из тех же самых экспериментов (что коррелирует грубо с плотностью клеток), наблюдали малую токсичность или отсутствие токсичности при соотношениях менее 8 (фиг. 1С). Снижение уровней белка для групп, обработанных более высокими соотношениями, возможно, свидетельствует о клеточной токсичности.
Поскольку трансфекция in vivo должна происходить в присутствии белков внеклеточной жидкости и вследствие отмеченной выше токсичности, исследовали действия на эффективность трансфекции как концентрации полиэтиленимина, так и соотношения N:P с использованием клеток А549 в культуральной среде, содержащей 10% фетальную телячью сыворотку. Фиг. 2 показывает, что соотношение N:P 16 с концентрацией PEI 50-60 нмоль/мл дает наивысшую степень трансфекции, свидетельствуя о том, что как концентрация полиэтиленимина, так и отношение полиэтиленимина к ДНК сильно влияет на эффективность трансфекции в присутствии сывороточных белков. Особенный интерес представляет то, что оптимальное соотношение N:P является более высоким в присутствии сыворотки, чем в ее отсутствие (фиг. 1В). Общая эффективность трансфекции с оптимальными условиями в присутствии сыворотки была действительно выше, чем в ее отсутствие. Тот же самый протокол оптимизации использовали в других клетках, что указывает на то, что этот относительно простой способ, применим для выполнении по индивидуальным требованиям условий трансфекции PEI для конкретного применения.
ПРИМЕР 15
Действия сыворотки и сурфантантов на эффективность трансфекции in vitro
Хотя предыдущие сообщения показали, что белки сыворотки склонны ингибировать трансфекцию, опосредованную различными катионными липидами и поликатионами, усиление, наблюдаемое здесь, при оптимальных условиях концентрации полиэтиленимина и соотношения N:P, привело к исследованию действий сыворотки на эффективность трансфекции с использованием полиэтиленимина. При испытании концентраций фетальной телячьей сыворотки от 0 до 50% было очевидно, что концентрации 5-20% усиливали трансфекцию in vitro, тогда как более высокие концентрации (50%) приводили к уменьшенной трансфекции (фиг. 3). Ингибирование, связанное с высокими концентрациями сыворотки, могло частично преодолеваться увеличивающимися концентрациями PEI:ДНК. Существовала некоторая видовая специфичность действия сыворотки, причем фетальная телячья и человеческая сыворотка, обе, приводили к сходному усилению трансфекции, тогда как мышиная сыворотка не проявляла действия. Кроличья сыворотка также приводит к усилению PEI-опосредованной трансфекции. Действие сыворотки, по-видимому, является термолабильным с полной потерей усиливающей активности, наблюдаемой при нагревании до 95°С в течение 10 мин, хотя нагревание в течение 30 мин при 56°С в последующих экспериментах не снимало усиливающего действия.
Исследовали также действие легочного сурфактанта на опосредованную PEI трансфекцию. Это выполняли с жидкостью бронхоальвеолярного лаважа из мышей (лиофилизированной и повторно гидратированной при увеличивающихся концентрациях) и синтетическим сурфактантом (Exosurf) при увеличивающихся концентрациях. Клетки подвергали воздействию концентраций BAL-жидкости, эквивалентных 6,25-12,5% концентраций нелиофилизированной BAL-жидкости (концентрированная BAL-жидкость, добавленная в каждую лунку, составляла 0,5-10% общего объема жидкости в каждой лунке соответственно). Клетки подвергали воздействию концентраций Exosurf, эквивалентных 4,05-81 мкг/мл колфасцерилпальмитата, активного агента в Exosurf. Как показано на фиг. 4, более высокие концентрации как BAL-жидкости, так и Exosurf приводили к пониженным уровням трансфекции в противоположность действиям сыворотки, тогда как более низкие концентрации сурфантанта, по-видимому, обладают небольшим действием.
ПРИМЕР 16
Действие распыления на эффективность трансфекции in vitro комплексов липосома-ДНК и PEI-ДНК
Препараты комплексов PEI-ДНК при соотношениях N:P 5 и 10 испытывали на эффективность трансфекции на протяжении 10-минутного периода распыления. В одном эксперименте, использование композиции PEI-ДНК (N:P=10) приводило в среднем к 96%, 94% и 89,6% удерживанию активности трансфекции контрольного (не подвергнутого распылению) материала в тесте in vitro с использованием клеток А549 опухоли легкого человека. Аликвоты циклически распыляемого распылителем материала удаляли из резервуара распылителя (с исходным объемом 5 мл) при интервалах 3 мин. Для сравнения, препараты PEI-ДНК, препарат DC-холестерин:DОРЕ:рСМVβ (2:2:1) и препарат DMRIE:DOPE:pCMVβ (3:3:1) распыляли досуха (приблизительно 12 мин) (фиг. 5). Композиции DС-холестерин:DОРЕ и DMRIE:DOPE, использованные здесь, были оптимизированы для трансфекции in vitro клеток А549 и используемое отношение DС-холестерин:DОРЕ аналогично отношению, сообщенному в другом месте для оптимальной трансфекции культуры клеток (Gao & Huang, 1991). Наблюдали только небольшую потерю активности β -галактозидазы в случае препарата PEI-pCHVβ (N:P=10) при скорости тока распылителя 8 л/мин, тогда как препарат DС-холестерин:DОРЕ:рСМVβ терял 60% его активности за 3 мин и был фактически неактивным после этого. Активность DMRIE:DOPE:pCMVβ уменьшалась на более чем 70% через 3 мин и на приблизительно 90% через 6 мин. При более высоких скоростях тока распылителя потеря эффективности трансфекции с композициями, содержащими другие катионные липиды (Schwarz et al., 1996), является еще более высокой. Интересно, что препарат с N:P=5 PEI-pCMVβ проявлял заметное увеличение эффективности трансфекции с увеличением распыления, что может отражать деградацию части ДНК и тем самым эффективное увеличение соотношения N:P.
ПРИМЕР 17
Сравнение эффективности трансфекции in vivo комплексов липосома-ДНК и PEI-ДНК после интраназальной инстилляции
При испытании композиций PEI-pCMV-HiCAT с использованием интраназальной инстилляции in vivo мышей BALB/c (фиг. 6А) было обнаружено, что экспрессия CAT, происходящая из PEI-ДНК, была в 10-20 раз более высокой в легких, чем полученная с использованием BGTC:DOPE:pCMV-HiCAT, наиболее стабильной и эффективной композиции с катионным липидом для трансфекции in vitro до настоящего времени. По-видимому, опосредованная PEI экспрессия является более специфической для легких, где трансфекция была приблизительно в 20 раз более высокой, чем в носу. В противоположность этому, экспрессия, опосредованная инсталлируемыми композициями на основе катионных липидов, была более высокой в носу, чем в легких. Сходные данные получали, когда животных при инстилировании комплексами PEI-люцифераза или BGTC:DOPE-люцифераза (фиг. 6В).
Интраназальную инсталляцию использовали также для сравнения эффективностей трансфекции in vivo различных композиций PEI-pCMV-HiCAT. При испытании соотношений N:P 5-20 было обнаружено, что соотношения 10-20 приводили к сравнимым уровням экспрессии CAT in vivo. Однако при увеличении концентрации PEI-ДНК (при соотношении N:P 10) в несколько раз, тем самым позволяя доставку в 3 раза более высокой дозы ДНК в том же самом инстиллируемом объеме, не наблюдали дополнительного увеличения экспрессии репортерного гена.
ПРИМЕР 18
Сравнение эффективности трансфекции in vivo комплексов липосома-ДНК и PEI-ДНК после аэрозольной доставки.
При доставке композиций PEI-pCMV-HiCAT и BGTC:DOPE:pCMV-HiCAT (с использованием идентичных концентраций ДНК) распылением полиэтиленимин был в 10 раз лучшим вектором для экспрессии в легких, чем липид (фиг. 7), что подтверждало описываемые выше открытия, полученные с использованием инсталляции.
Также в согласии с открытиями инстилляции находилось наблюдение, что аэрозольная доставка приводила к приблизительно в 20 раз более высокой трансфекции в легких, чем в носу, для композиций на основе PEI, тогда как аэрозолированная композиция BGTC:DOPE:pCMVβ приводила к сравнимым уровням экспрессии в носу и легких. Аэрозольная доставка композиций люциферазы на основе PEI опять приводила к сходным открытиям, касающимся их относительных эффективностей в легком и в носу.
ПРИМЕР 19
Генетическая иммунизация аэрозольным и инстилляционным введением PEI-ДНК-вакцин
Одним из потенциально ценных применений для аэрозольного введения экспрессирующих векторов является доставка ДНК-вакцин. Для определения, могла бы этим способом достигаться иммунизация, препарат pCMV-hGH плазмида-PEI (соотношение N:P 10) вводили при помощи аэрозоля и назальной инсталляцией и, в качестве положительного контроля, инъецировали внутримышечно “голой” ДНК. Как показано на фиг. 8, эти обработки индуцировали высокие уровни сывороточных антител к гормону роста человека во всех группах. Значительный гуморальный иммунный ответ (образование антител) присутствовал при 2 неделях, и он выходил на плато между 4 и 8 неделями. На фиг. 8 оптическая плотность показана при разведении 1:500 сыворотки в сравнении с фоном OD 0,1 в неиммунизированных животных. Средние титры этих сывороток при 8 неделях были 1:4000 для аэрозольной группы, 1:8000 для интраназальной и 1:16000 для внутримышечной групп соответственно. Однако, как показано на фиг. 8, все группы имели явно большие стандартные отклонения, сходные с предыдущими результатами с внутримышечными инъекциями. Таким образом, хотя ответные реакции индивидуальных мышей были высоковариабельными, персистенция антител на протяжении 8 недель из единственного введения препарата плазмида-РЕI предполагает, что этот способ иммунизации может иметь значимое применение при предоставлении интраназальным или аэрозольным путем.
Эффективная доставка генетического материала в легкие и дыхательные пути представляет нацеленный и неинвазивный подход к лечению большого диапазона легочных нарушений. Однако трансфекция легочных сайтов обычно была неэффективной при использовании невирусных векторов доставки ДНК для минимизации патологических и иммунных рисков, связанных с вирусной доставкой. Это вызывалось, отчасти, недоступностью легочной среды для доставки препаратов генов. Кроме того, потеря активности, связанная со струйным распылением, ограничивала ценность этой методологии для доставки ДНК к легочным мишеням (Crook et al., 1996; Schwarz et al., 1996). Данное исследование обнаружило, что комплексы ДНК с поликатионным полимером полиэтиленимином имеют существенную функциональную стабильность при доставке струйным распылением, что обеспечивает потенциальное средство доставки генов в легкое.
Другие нелипидные поликатионные полимеры, которые использовали в качестве векторов доставки ДНК, включают в себя поли-L-лизин, который опосредует только низкую степень трансфекции, но значимо улучшается конъюгированием с агентами или включением агентов для облегчения клеточного поглощения (Wu & Wu, 1988; Tang & Szoka, 1997), и дендримеры полиамидоамина (Haensler & Szoka, 1993). Кроме того, было показано, что модифицированные формы PEI, ковалентно конъюгированные с лигандами, такими как трансферрин (Kircheis et al., 1997; Ogris et al., 1998; Ogris et al., 1999), нацелены на определенные типы клеток с высокой степенью специфичности. Были даже сообщения об опосредованной PEI трансфекции в легких при системном введении композиций (Goula et al., 1998), но до настоящего времени мало внимания уделяли использованию нелипидных полимеров в качестве ДНК-векторов для аэрозольной доставки. Представленные здесь открытия показывают, что композиции на основе PEI придают значительную степень стабильности плазмидной ДНК во время процесса струйного распыления. В случае некоторых композициий на основе PEI, трансфекция, по-видимому, даже усиливается процессом распыления. Таким образом, PEI является, по-видимому, более эффективным медиатором трансфекции после доставки в легкое аэрозолем, чем катионные липиды, и имеет дополнительное преимущество, заключающееся в том, что он является относительно нетоксичным. Тот факт, что полиэтиленимин может быть легко конъюгирован с сайт-специфическими лигандами, увеличивает многосторонность доставляемых аэрозолем композиций на основе PEI.
Усиление опосредованной PEI трансфекции термолабильным сывороточным фактором (факторами) может явиться многообещающим, хотя механизм (механизмы), участвующие в нем, или последствия для доставки генов in vivo являются неизвестными в настоящее время. Тот факт, что этот эффект теряется при нагревании до 100°С, является аргументом против возможности, что он связан с небольшими термостабильными факторами, такими как стероиды. Тот факт, что на это усиление не действует температура 56°С, является аргументом против роли для системы комплемента. Идентификация этого усиливающего трансфекцию фактора окажется со временем полезным в улучшении общей эффективности доставки генов in vivo.
Различные региональные специфичности (легкое или нос) полиэтиленимина и катионного липида (BGTC:DOPE), отмеченные при использовании двух отдельных репортерных генов, является неожиданным открытием. При допущении, что размеры частиц, доставляемых из одного и того же распылителя, являются сходными, наблюдаемые различия могут быть обусловлены различиями в ответе этих двух типов частиц на действие реснитчатого эпителия или могут быть обусловлены различиями клеточной реакции в назальном и легочном сайгах. Это открытие могло бы быть важным в применениях, в которых назальная экспрессия доставляемого гена может иметь нежелательные последствия. С другой стороны, эти различные векторы доставки могут быть пригодны для различных клинических приложений. В области генетической иммунизации, открытия, сообщенные здесь, предполагают, что стойкие гуморальные ответы (образования антител) могут быть достигнуты при единственном введении плазмиды с использованием способов, которые доставляют комплекс РЕI-ДНК в легочную ткань.
Поскольку препараты PEI-ДНК могут эффективно депонироваться в периферии легких аэрозолем (Weibel generations, 17-23), опосредованная РЕI трансфекция респираторного эпителия in vivo будет подвергать плазмидную ДНК и PEI воздействию эндогенных сурфантантов и белков в альвеолярном пространстве. Действия сурфантантов на опосредованную PEI трансфекцию исследовали in vitro с использованием как синтетического сурфактанта (Exosurf), так и жидкости бронхоальвеолярного лаважа, полученной из необработанных мышей. Хотя оба этих вещества действительно приводили к зависимому от концентрации ингибированию опосредованной PEI трансфекции, действие сурфантантов может быть относительно более низким, чем эффекты, сообщаемые для переноса генов, опосредованного катионной липосомой (Duncan et al., 1997; Tsan et al., 1997). Эти сообщения утверждают, что трахеальная инсуффляция (вдыхание) плазмидной ДНК и комплексов плазмидная ДНК-катионная липосома приводила к сходным количествам экспрессии генов в легком. Гораздо более высокий уровень экспрессии в легком достигается с PEI-pCMV-HiCAT, чем только с ДНК-плазмидой при инсталляции, что обеспечивает доказательство, что легочные сурфактанты не нейтрализуют свойства переноса генов полиэтиленимина до такой степени, до какой они делают это в отношении катионных липидов или композиций катионный липид:ко-липид. Таким образом, композиции на основе PEI являются перспективной альтернативной относительно неэффективным катионным липидам в качестве невирусных носителей для лечения различных легочных нарушений посредством аэрозоля. Представленные здесь результаты показывают также перспективу в отношении доставки генетических вакцин.
ПРИМЕР 20
Животные
В следующих экспериментах использовали самок мышей BALB/c (в возрасте 5-7 недель).
ПРИМЕР 21
Плазмидная ДНК
Бактериальный ген хлорамфениколацетилтрансферазы (р4119, ссылка 15) использовали главным образом в качестве репортерного гена для измерения экспрессии трансгена. Этот ген CAT находится под контролем раннего промоторного/энхансерного элемента цитомегаловируса человека (CMV). Люциферазная плазмида (pGL3, Promega, Madison, WI), модифицированная встраиванием промоторного/энхансерного элемента CMV и последовательности полиаденилирования гормона роста человека, была получена от доктора Michael Barry (Center for Cell and Gene Therapy, Baylor). Все плазмиды очищали на колонках Qiagen (Qiagen, Valencia, CA), и они не содержали эндотоксина. Плазмиды определяли количественно по поглощению в УФ при 260 нм. Анализ на агарозном геле выявил, что эти плазмиды являются смесью в основном суперспирализованной плазмиды с небольшим количеством разорванной плазмиды.
ПРИМЕР 22
Получение комплексов PEI-ДНК
PEI (25 кДа, разветвленный) приобретали из Aldrich Chemical (Milwaukee, WI). Исходный раствор полиэтиленимина готовили в концентрации 4,3 мг/мл (0,1 М по азоту) в ЗФР, рН 7-7,5. PEI и ДНК смешивали отдельно в 5 мл воды при требуемых концентрациях. Раствор PEI медленно перемешивали на вортексе и к нему добавляли раствор ДНК до конечного объема 10 мл. Смеси давали отстояться при комнатной температуре в течение приблизительно 15-20 мин перед распылением. Полученное соотношение заряда выражали в виде соотношения азот PEI:фосфат ДНК (N:P), которое может быть рассчитано с учетом того, что ДНК имеет 3 нмоль фосфата на мкг, а 1 мкл 0,1 М раствора PEI имеет 100 нмоль аминного. азота. Соотношение 10:1 N:P соответствует 1,29:1 PEI:ДНК.
ПРИМЕР 23
Аэрозольная доставка комплексов PEI-ДНК
Мышей помещали в пластиковые клетки, которые заклеивали лентой перед аэрозольной доставкой (16). Этот способ является системой непринужденного подвергания действию аэрозоля всего тела. Комплексы PEI-ДНК аэрозолировали с использованием распылителя Aerotech II (AT-II) (CIS-US, Inc., Bedford, MA) при скорости тока 10 л/мин с использованием воздуха или воздуха, содержащего 5% CO2. AT-II представляет собой высокопроизводительный, эффективный распылитель, для которого показано получение аэрозолей в оптимальном диапазоне 1-2 мкм массового срединного аэродинамического диаметра (MMAD) для периферической легочной доставки (17, 18). Было рассчитано, что размер частиц аэрозоля PEI-ДНК был 1,6 мкм MMAD с геометрическим стандартным отклонением (GSD) 2,9, с использованием прибора Andersen Cascade Impactor (Andersen Instruments, Atlanta, GA) по описываемому ранее способу (18). Источник сухого воздуха (Aridyne 3500, Timeter, Lancaster, PA) доставляли в газовый смеситель Bird 3М (Palm Springs, CA), присоединенный к газовому компрессору и контейнеру СO2. Полученную смесь воздуха и СО2 доставляли в распылитель. Конечную концентрацию 5% СО2 в воздухе определяли с использованием раствора Fyrite (Bacharach, Pittsburgh, PA). Распыление 10 мл раствора занимало приблизительно 30 мин.
ПРИМЕР 24
Анализ CAT
Мышей анестезировали и умерщвляли после каждой временной точки и легкие и другие ткани собирали и немедленно замораживали. Набор для анализа CAT ELISA (Boehringer Mannheim Gmbh, Germany) использовали для измерения экспрессии in vivo. Ткани гомогенизировали в 700 мкл лизисного буфера для анализа CAT с использованием гомогенизатора с бусинами Wig-L-Bug (Crescent Dental Mfg., Lyons, IL). После центрифугирования гомогената 200 мкл экстракта использовали для анализа CAT ELISA, выполняемого в формате 96-луночного планшета. Поглощение считывали с использованием планшет-ридера для микротитрационных планшетов (Molecular Devices, Sunnyvale, CA). He подвергнутых воздействию мышей использовали в качестве контролей. Активность CAT выражали в нг САТ/мл экстракта ткани с использованием стандартной кривой, полученной с очищенным ферментом CAT. Чувствительность этого теста дополнительно усиливали в соответствии с предложениями изготовителя таким образом, чтобы детектировать такие низкие уровни белка CAT, как 0,1-0,3 пг на лунку.
ПРИМЕР 25
Анализ люциферазы
Мышей анестезировали и умерщвляли и легкие собирали. Набор для анализа люциферазы (Promega, Madison, WI) использовали для измерения экспрессии люциферазы. Легкие гомогенизировали в 1 мл лизисного буфера для анализа люциферазы с использованием гомогенизатора с бусинами Wig-L-Bug. После центрифугирования гомогената 10 мкл экстракта добавляли к 50 мкл субстрата люциферазы и люминесценцию считывали в течение 10 с в 96-луночном планшете на люминометре (Microlumat LB 96 Р, EG&G Berthold, Germany). He подвергнутых воздействию мышей использовали в качестве контролей. Активность люциферазы выражали в виде RLU/10 с/мл экстракта. В этой системе 107 RLU соответствует 1 нг люциферазы при применении очищенной люциферазы из Promega.
ПРИМЕР 26
Гистологический анализ срезов ткани
Мышей анестезировали изофлураном и умерщвляли обескровливанием через брюшную аорту. Легкие выделяли, канюлировали и фиксировали заполнением 10% нейтрально забуференным формалином, заливали в парафин и обрабатывали для гистологического анализа. Делали тонкие срезы при 4 мкм и наблюдали под микроскопом для наблюдения каких-либо признаков воспаления или токсичности с использованием окрашивания гематоксилином и эозином. После проведения однофакторного дисперсионного анализа (ANOVA) для сравнения этих способов производили обработку с использованием t-критерия Стъюдента (two-tailed unpaired Student's t-test). Различия считали значимыми, если р≤0,05.
ПРИМЕР 27
Распыление комплексов РЕI-ДНК с 5% СО2
Распыление комплексов РЕI-ДНК с 5% СО2 усиливает экспрессию трансгена в легком с сравнении с нормальным воздухом: вдыхание 5% CO2 в воздухе было связано с увеличением дыхательного объема воздуха и частоты дыхания у мышей и человека (19, 20, 21). Ингаляция аэрозолей, содержащих 5% СО2, могла бы приводить к более высокой ингаляции аэрозольных частиц и, соответственно, более высокой экспрессии с сравнении с экспрессией, достигаемой с аэрозолем, доставляемым воздухом. Для исследования этого комплексы PEI-ДНК доставляли мышам BALB/c аэрозолем с использованием либо нормального воздуха, либо воздуха, содержащего СО2. Фиксированное количество САТ-плазмиды (1 мг/10 мл раствора) при соотношении N:P 10:1 аэрозолировали в течение 30 мин, как указано. Легкие собирали после 24 часов и САТ-анализ проводили для определения степени трансфекции. 5% СO2 в воздухе приводит к 3-кратному увеличению (р=0,001) детектируемых уровней CAT, в сравнении с аэрозолем, распыляемым только воздухом (фиг. 9).
ПРИМЕР 28
Перенос ДНК при помощи PEI является зависимым от дозы
Для дополнительной оптимизации экспрессии трансгена соотношение N:P поддерживали константным при 10:1, а количество ДНК варьировали от 250 мкг до 4 мг на 10 мл аэрозолированного раствора. Это приводит к увеличению концентрации в резервуаре, а также количества общей ДНК, распыляемой в выпускаемом аэрозоле. Комплексы аэрозолировали с использованием 5% CO2 в воздухе с 2 мг ДНК, дающими наивысший уровень экспрессии CAT в легком (фиг. 10). Уровни CAT, измеренные с 250 мкг ДНК, статистически не отличались от уровней контрольных легких (р=0,34). Кроме того, при растворении 4 мг ДНК в 10 мл при соотношении N:P 10:1 наблюдали некоторое визуальное осаждение ДНК, которое может быть ответственным за отсутствие дополнительного увеличения уровня CAT, детектируемого в легких, в сравнении с 2 мг (р=0,51).
ПРИМЕР 29
Оптимизация соотношений PEI-ДНК
Для определения реагирующих веществ, которое было бы идеальным для аэрозольной доставки in vivo, различные соотношения PEI-ДНК (N:P) оценивали на их способность трансфицировать легкое. Количество ДНК поддерживали константным при 2 мг, а концентрацию полиэтиленимина варьировали с получением соотношений 5:1, 10:1, 12,5:1, 15:1, 17,5:1 и 20:1. Эти соотношения были выбраны на основе предварительных исследований in vitro и in vivo (с введением инстилляцией). Эти комплексы аэрозолировали с использованием 5% СO2 в воздухе. Соотношение N:P 15:1 давало наивысший уровень экспрессии CAT в легких, тогда как 5:1 приводило к очень низкому уровню экспрессии CAT (фиг. 11). Не было статистически различия между соотношениями 10:1, 12,5:1, 17,5:1 и 20:1 (р>0,1), но было значимое различие между 15:1 и 20:1 (р=0,05) и между 10:1 и 15:1 (р=0,014).
Для определения оптимального соотношения для плазмиды, иной, чем CAT, различные соотношения N:P испытывали на экспрессию гена люциферазы в легком. Оцениваемыми соотношениями были 5:1, 10:1, 15:1, 20:1, 30:1 и 40:1. Оптимальная кривая для люциферазы сдвигалась вправо в сравнении с CAT, с наивысшей экспрессией при 20:1 (р<0,05 в сравнении с другими отношениями) (фиг. 12). Это предполагает, что различные плазмиды могут требовать различных соотношений N:P.
ПРИМЕР 30
Временной ход экспрессии CAT после единственной аэрозольной доставки
Далее анализировали устойчивость экспрессии CAT после единственной аэрозольной доставки. Это является важной информацией для планирования лечебной схемы для терапевтических исследований. Два мг САТ-плазмиды аэрозолировали с использованием 5% CO2 в воздухе в мышей при двух различных соотношениях N:P 15:1 и 10:1. Различными временными точками, исследованными для группы 10:1, были 1, 2, 3 и 6 дней после подвергания действию аэрозоля. Легкие и другие ткани собирали в различных временных точках и сразу же замораживали. Все ткани анализировали одновременно после последней временной точки (6 дней). Для группы 15:1 мышей умерщвляли в дни 1, 3, 7 и 10 после аэрозольной обработки. Легкие собирали и замораживали после каждой временной точки и белок CAT анализировали после последней временной точки (день 10).
Для обоих соотношений N:P экспрессия CAT является наивысшей при 24 часах и остается константной (статистически нет различия между днем 1 и днем 3, р=0,4 для соотношения 15:1 и р=0,12 для соотношения 10:1) на протяжении 3 дней (фигура 13А и 13В). Уровень CAT снижается до приблизительно 50% максимальных уровней после недели, и значимые уровни детектируются даже после 10 дней (р=0,001 в сравнении с контролем).
ПРИМЕР 31
Тканевое распределение трансгена
Внутривенная или внутрибрюшинная доставка векторов ДНК обычно приводит к экспрессии в различных тканях. Для определения, будет ли аэрозольная доставка PEI-ДНК также приводить к системной доставке генов, различные ткани собирали из одной и той же группы мышей, которую использовали в приведенном выше эксперименте (из группы 10:1), и САТ-анализ выполняли после последней временной точки. Исследуемыми тканями были легкое, печень, селезенка, почка, вилочковая железа, мозг и кровь. Уровень CAT, детектированный в нелегочных тканях, был очень низким и не был значимо отличающимся (р>0,1 для всех тканей) от контрольных тканей (фиг. 14), что указывает на то, что аэрозольная доставка комплексов РЕI-ДНК приводит к высокоспецифической легочной экспрессии генов без присутствия системной доставки.
ПРИМЕР 32
Гистологический анализ не показывает признаков воспаления
Для определения, приводит ли аэрозольная доставка комплексов РЕI-ДНК к какому-либо типу токсичности или острому воспалению в этой системе, 2 мг САТ-плазмиды соединяли в виде комплекса с PEI при соотношении N:P 15:1 и мышей подвергали воздействию аэрозоля в течение 30 мин с использованием 5% СO2 в воздухе. Мышей умерщвляли после 24 ч и легкие фиксировали в формалине и окрашивали гематоксилином и эозином. Легкие не обнаружили какого-либо доказательства гистологического отклонения от нормы, как показано на фиг. 15. Применение 5% CO2 в воздухе для оптимизации легочной доставки генов при помощи аэрозоля PEI-ДНК является, по-видимому, безопасным и высокоспецифическим для легкого.
ПРИМЕР 33
Действия композиции PEI-противоопухолевый ген в исследованиях с животными
Фиг. 15 и 16 показывают действия композиций PEI-противоопухолевый ген в исследованиях с животными. Фиг. 15 показывает, что композиции PEI и гена р53 и PEI и гена ретинобластомы значимо снижают рост опухоли в модели меланомы животного при введении аэрозолем два раза в неделю в течение 4 недель. Фиг. 16 показывает, что композиции PEI и гена р53 и PEI, гена р53 и противоракового лекарственного средства 9-нитрокамптотецина (9-NC) значимо снижают опухолевый рост в модели аденокарциномы животного при введении аэрозолем два раза в неделю в течение 4 недель. Фиг. 17 показывает, что композиции PEI и гена р53 значимо снижают опухолевый рост в модели легочного метастазирования человеческой остеосаркомы у голой мыши (SAOS-LM6) при аэрозольной доставке композиции два раза в неделю в течение 4 недель. Аэрозольную терапию начинали через 8 недель после имплантации животному опухолевых клеток. В том же самом эксперименте, PEI отдельно и PEI в комбинации с генами CAT или IL-12 (в качестве неспецифических контролей) не приводили к ингибированию, значимо более низкому, чем необработанный контроль.
В этом исследовании применение 5% СО2 в воздухе для распыления PEI-ДНК приводит к увеличенным уровням экспрессии генов в легком в сравнении с уровнями, достигаемыми с использованием обычного воздуха во время распыления. Это могло бы быть вызвано увеличенным дыхательным и минутным объемами в присутствии 5% СO2 . Применение 5% СO2 в воздухе в аэрозоле приводит к 4-5-кратному отложению частиц лекарственное средство - липосома в легких грызунов. При использовании 5% СO2 в воздухе для доставки аэрозоля PEI-ДНК можно было наблюдать визуально, что мыши дышали глубже и более быстро, что предполагает, что повышенная экспрессия трансгена в легком могла бы быть обусловлена увеличением депонирования аэрозольных частиц. Однако, возможно, что повышенный СO2 оказывал действие на эффективность трансфекции комплексов PEI-ДНК путем изменения некоторых других физиологических параметров. На основе этих наблюдений 5% СO2 в воздухе могла бы использоваться для аэрозольной доставки комплексов другой полимер-ДНК или катионный липид-ДНК и с аналогичными результатами. 5% CO2 хорошо переносился людьми, и показано, что он увеличивает минутный объем, так что эта стратегия потенциально могла бы применяться также для пациентов с легочными заболеваниями.
Другие параметры для доставки генов аэрозолем с использованием PEI в качестве носителя были также оптимизированы. Взаимодействие зарядов между любым катионным носителем и отрицательно заряженной ДНК является важным фактором, определяющим эффективность трансфекции данного комплекса. Доставка генов аэрозолем могла бы требовать различных условий. Соотношение N:P 15:1 давало наивысшие уровни экспрессии CAT в этой системе, причем соотношение 5:1 приводило к очень низкому уровню экспрессии в сравнении с другими соотношениями.
В противоположность этому, наивысшая экспрессия для люциферазы была получена при соотношении N:P 20:1. Это могло бы быть обусловлено отличающимся размером люциферазной плазмиды, приводящим к структурно отличающемуся комплексу с PEI в сравнении с САТ-плазмидой. Это могло бы быть также обусловлено различием в чистоте плазмид и долей суперспирализованной структуры. Все-таки имеется значительное перекрывание в оптимальных соотношениях N:P этих двух плазмид. Оптимальные соотношения для различных плазмид могут быть различными. С учетом экспериментальной вариабельности соотношение между 10:1 и 20:1 должно работать подходящим образом. Соотношение ниже 10:1 не давало очень высокой трансфекции в легком.
Кривая доза-ответ экспрессии CAT показывает, что 2 мг ДНК, находящиеся в комплексе с PEI, на 10 мл аэрозолированного раствора дают наилучшую экспрессию в этой СО2-усиленной системе доставки. Экспрессия резко падает до незначительных уровней при распылении 250 мкг ДНК/10 мл раствора мышам. Четыре мг ДНК, находящиеся в комплексе с PEI (при многочисленных различных соотношениях), приводят к некоторой преципитации ДНК, и это, возможно, является причиной пониженной трансфекции. Следует отметить, что имеется увеличение как в концентрации, так и в количестве доставляемой ДНК.
Было рассчитано, что распыленный выходящий поток из распылителя Aerotech II составлял приблизительно 80%. Около 72% резервуара ДНК доставлялись в ингаляционную камеру, как определено с использованием полностью стеклянного прибора AGI, как описано выше. Остальная часть улавливалась в Т-соединителе и соединительных трубках. С учетом мышиного искусственного носового дыхания, легочной физиологии (минутного объема и депонированной фракции) и выходной концентрации аэрозоля (4,8 мкг/л) было рассчитано, что количество ДНК, отлагающееся в легких мыши, составляет приблизительно 4-5 мкг во время 30 мин подвергания воздействию аэрозоля (для исходной концентрации резервуара 2 мг ДНК/10 мл раствора). Эти расчеты основаны на вдыхании нормального воздуха, и отложение может быть более высоким в присутствии 5% СО2 в воздухе вследствие увеличения дыхательного объема и частоты дыхания.
Экспрессию CAT использовали также для мониторинга временного хода экспрессии генов. После единственного подвергания воздействию аэрозоля экспрессия CAT в легком была наивысшей при 24 ч и затем падала до приблизительно 50% от максимальных уровней после одной недели. Было очень значимое количество экспрессии (30% от максимальных уровней) даже после 10 дней. Это предполагает, что устойчивость экспрессии генов после аэрозольной доставки с использованием полиэтиленимина может быть большей, чем это адекватно для различных клинических приложений. Устойчивость экспрессии генов до дня 10 в этом исследовании является сходной с сообщенной или более высокой, чем сообщенная в других исследованиях с использованием катионных липидов для инстилляции или аэрозольной доставки генов.
Информация о тканевом распределении показывает, что экспрессия генов после аэрозольной доставки в этой системе ограничиваетя легким, что указывает на минимальную системную доставку. В противоположность легкому, ткани, такие как печень, селезенка и почка, которые обычно обнаруживают детектируемые уровни экспрессии при доставке посредством внутривенного или внутрибрюшинного введения, проявляли незначительную экспрессию или отсутствие детектируемой экспрессии CAT при доставке аэрозолем PEI-ДНК. Важно, если экспрессия представляющего интерес гена ограничивается легкими. Аэрозольная доставка позволяет распределять эти частицы неинвазивно и однородно по всем легким.
Последний, но важный результат состоит в том, что легкие не обнаруживают какого-либо признака воспаления. Не наблюдали инфильтрации воспалительных клеток или повреждения легких при обследовании тонких срезов. Хотя высокие уровни экспрессии детектируются даже спустя неделю, некоторые способы терапии могут требовать повторяемой и частой доставки генов.
5% СO2 в воздухе может увеличивать уровни экспрессии гена при доставке гена аэрозолем. Экспрессия является преобладающей в легком, и высоко значимые уровни детектируются даже спустя неделю после аэрозольной доставки. PEI является, по-видимому, также нетоксичным при концентрациях, оптимальных для экспрессии in vivo. Аэрозольная доставка комплексов разветвленный полиэтиленимин-ДНК представляет недорогую альтернативу доставке генов, опосредованной вирусными векторами и векторами на основе катионных липидов, и должна быть полезной для таких заболеваний, как муковисцидоз и рак легкого.
В описании цитируются следующие ссылки:
Boussif, O., et al. (1995) Proc. Natl. Acad. Sci. USA 92, 7297-7301.
Boussif, O., et al. (1996) Gene Therapy 3, 1074-1080.
Crook K., et al. (1996) Gene Therapy 3, 834-839.
Duncan, J.E., et al. (1997) Human Gene Therapy 8, 431-438.
Eastman S.J., et al. (1997) Human Gene Therapy 8, 765-773.
Eastman S.J., et al. (1998) HUMAN Gene Therapy 9, 43-52.
Eastman S.J, et al. (1997) Human Gene Therapy 8, 313-322.
Gao, X., & Huang, L. (1991) Biochem. Biophys. Res. Comm. 179, 280-285.
Goula, D., et al. (1998) Gene Therapy 5, 1291-1295.
Haensler, J. & Szoka, F.C. (1993) Bioconj Chem. 4:372-379.
Kircheis, R., et al. (1997) Gene Therapy 4, 409-418.
Ogris, M., et al. (1999) Gene Therapy 6, 595-605.
Ogris, M., et al. (1998) Gene Therapy 5, 1425-1433. Schwarz L.A., et al. (1996) Human Gene Therapy 7, 731-741.
Tang, M.X., & Szoka, F.C., (1997) Gene Therapy 4, 823-832.
Tsan, M. -F., et al. (1997) Human Gene Therapy 8, 817-825.
Vigneron, et al. (1996) Proc. Natl. Acad. Sci. 93, 9682-9686.
Любые патенты или публикации, упомянутые в данном описании, соответствуют уровню специалиста в данной области, к которой относится данное изобретение. Кроме того, эти патенты и публикации включены здесь в качестве ссылок в такой степени, как если бы было указано, что каждая индивидуальная публикация включена здесь в качестве ссылки.
Специалисту в данной области будет понятно, что данное изобретение хорошо приспособлено для достижения указанных целей и получения упомянутых результатов и преимуществ, а также целей, результатов и преимуществ, присущих данному изобретению. Данные примеры вместе с описываемыми здесь способами, процедурами, обработками, молекулами и специфическими соединениями, являются репрезентативными в настоящее время предпочтительными вариантами, введены в качестве примеров и не предназначены для ограничений объема данного изобретения. Изменения в них и другие применения, очевидные для специалистов в данной области, охватываются идеей данного изобретения, определенной рамками прилагаемой формулы изобретения.
Реферат
Изобретение относится к области молекулярной биологии. Изобретение демонстрирует, что поликатионные композиции не/липид:ДНК являются устойчивыми к индуцируемой распылением деградации и являются гораздо более специфическими и эффективными, чем композиции на основе липидов, в трансфекции тканей дыхательных путей in vivo. Сущность изобретения - композиции полиэтиленимина (PEI), они являются приблизительно в 10 раз более эффективными, чем прежние композиции на основе липидов, при доставке in vivo при помощи струйного распылителя. Технический результат - аэрозольные композиции на основе полиэтиленимина эффективны для генной терапии через дыхательные пути. 2 н. и 22 з.п. ф-лы, 17 ил.
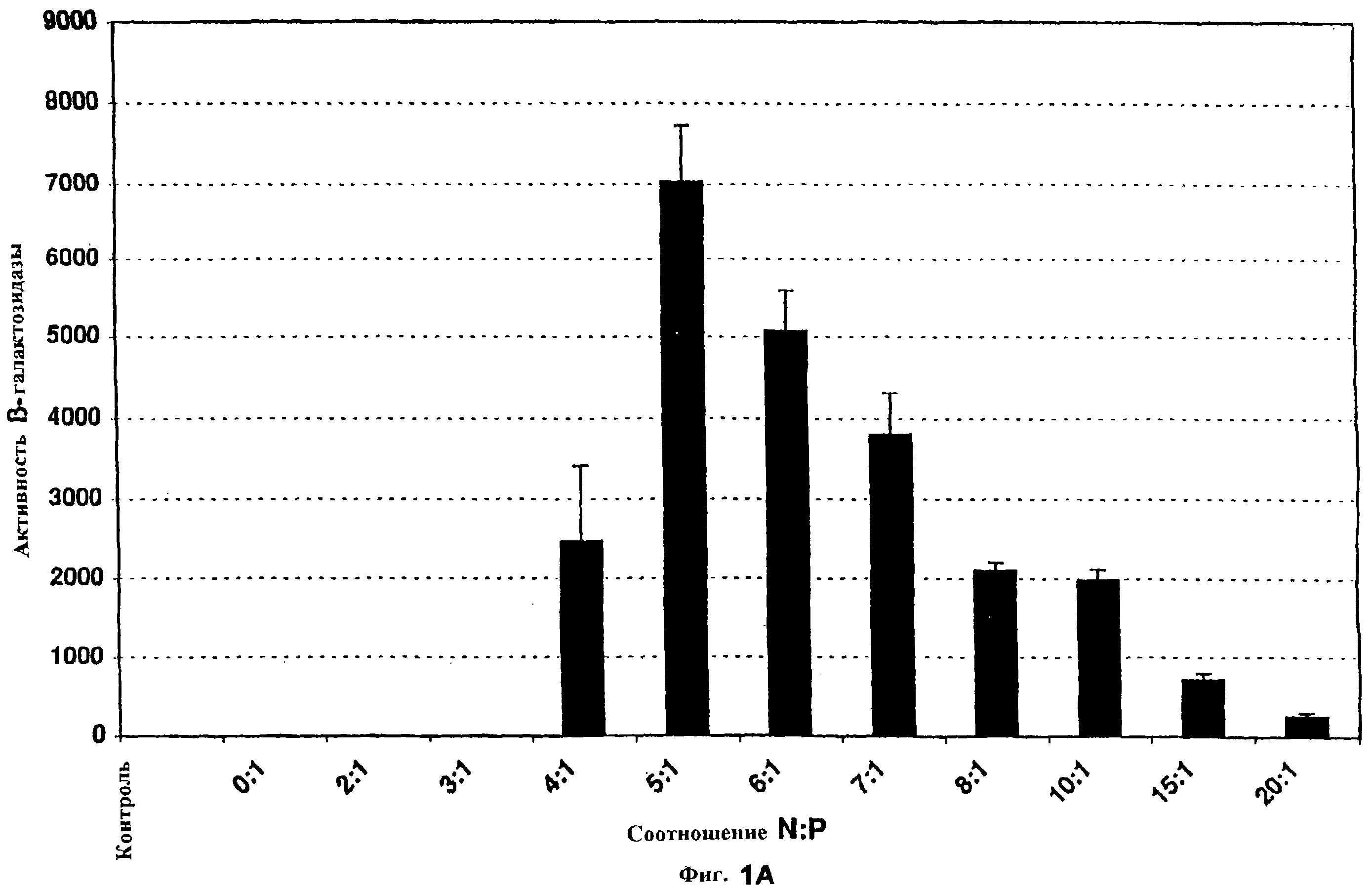

Комментарии