Липосомные аэрозоли с малым размером частиц для доставки противораковых лекарственных препаратов - RU2223749C2
Код документа: RU2223749C2
Чертежи











Описание
Область изобретения
Настоящее изобретение относится, в основном, к
области фармакологии и лечения рака. Конкретно настоящее изобретение предоставляет композиции и способы доставки аэрозолей с малым размером частиц путем ингаляции водных дисперсий липосом, несущих
противораковые лекарственные препараты, к дыхательным путям.
Описание уровня техники
Лечение липосомными аэрозолями с малым размером частиц заключается в использовании
липидрастворимых или водорастворимых противораковых лекарственных препаратов, включенных в липосомы, которые вводят из водных дисперсий в струйном распылителе (см. патент США 5049388). Аэрозоли со
средне-массовым аэродинамическим диаметром 1-3 мкм, получаемые при распылении, дают возможность целевой доставки на поверхность дыхательных путей. Нанесенные липосомы впоследствии высвобождают
лекарственный препарат в легких или в циркулирующую кровь с доставкой к внелегочной ткани. Если лекарственный препарат является липидрастворимым, он будет связываться с липидными молекулами способом,
специфичным для применяемого липида используемого противоракового лекарственного препарата, и, возможно, он будет дополнительно модифицирован различными растворимыми составляющими, которые могут быть
включены в суспендирующую водную среду. Такие растворимые составляющие могут включать буферные соли и, возможно, инозитол для увеличения синтеза и секреции поверхностно-активных фосфолипидов в
легочной ткани и для минимизации уже имеющегося респираторного дистресса или дистресса, который может возникнуть в результате лечения аэрозолем (Hallman, М., et al. Inositol Supplementation in
Premature Infants with Respiratory Distress Syndrome, N.Eng.J.Med. 1992, 326:1233-1239).
Если лекарственный препарат является водорастворимым, он может быть включен с помощью соответствующих методов в водные везикулы, которые существуют в концентрических пространствах между липидными бислоями (тонкими слоями) многослойной липосомы. Могут быть получены однослойные липосомы, однако, их способность захватывать липидрастворимые или водорастворимые лекарственные препараты снижена, так как захват ограничен одной центральной везикулой.
Аэрозольные водные капельки могут содержать одну или несколько липосом с лекарственным препаратом. Распыление приводит к изменению размеров липосом до величин, при которых липосомы легко выбрасываются из сопла распылителя. Диаметр липосом обычно уменьшается от нескольких микрон до величины, меньшей 500 нм, и может быть значительно меньше этой величины в зависимости от эксплуатационных характеристик распылителя и других переменных. Уменьшение размеров водорастворимых лекарственных препаратов, содержащихся в липосомах, приводит к высвобождению значительных количеств водорастворимого соединения, возможно 50%. Это не является противопоказанием к их применению, но означает, что вводятся две формы лекарственного препарата, и оказываемое действие включает терапевтический эффект, который производится обеими формами, если они вводятся по одной. Многие другие детали лечения липосомными аэрозолями описаны в патенте США 5049388. Более того возможно также включение более чем одного лекарственного препарата в лечение липосомным аэрозолем либо путем смешивания липосом, содержащих разные лекарственные препараты, либо путем использования липосом, в которых лекарственные препараты объединены и включены вместе в липосомы.
В описанной выше области существует дефицит составов и способов для доставки водных дисперсий липосом, содержащих противораковые препараты, в виде аэрозолей из мелких частиц. Настоящее изобретение заполняет эту давнишнюю потребность и необходимость, существующую в данной области.
Краткое содержание изобретения
Соединения липосомных аэрозолей с малым размером частиц и способы лечения настоящего изобретения подразумевают липидрастворимые или водорастворимые противораковые препараты, включенные в липосомы.
Липосомы вводят в виде водных дисперсий из струйного распылителя. Настоящее изобретение демонстрирует, что при легочном введении с помощью аэрозоля происходит более быстрая и более эффективная
системная абсорбция лекарственного препарата, чем при внутримышечном или пероральном введении.
Одним объектом настоящего изобретения является обеспечение способа лечения рака, включающего стадию доставки посредством аэрозоля с малым размером частиц, водных дисперсий противораковых препаратов к дыхательным путям пациента, нуждающегося в таком лечении. Примерами противораковых препаратов, годных к применению в этом варианте воплощения данного изобретения, являются, но не ограничиваются ими, 20-S-камптотецин, 9-нитрокамптотецин, 9-аминокамптотецин, 10, 11-метилендиоксикамптотецин, таксол, таксол-А, митотан, метотрексат, меркаптопурин, ломустин, интерферон, 5-фторурацил и этописид. В более предпочтительном варианте воплощения данного объекта противораковый лекарственный препарат выбирают из группы, состоящей из 20-S-камптотецина, 9-нитрокамптотецина, 9-аминокамптотецина, 10,11-метилендиоксикамптотецина и таксола. Кроме того, в предпочтительном варианте воплощения настоящего объекта доставку противоракового лекарственного препарата осуществляют с помощью струйного распылителя.
В другом объекте настоящего изобретения обеспечиваются липосомы для доставки противораковых лекарственных препаратов посредством аэрозолей с малым размером частиц, включающие противораковый лекарственный препарат и липид, где концентрация противоракового лекарственного препарата не превышает приблизительно 10% от общего объема препарата, и соотношение противоракового лекарственного препарата к подходящему растворителю в препарате находится в интервале приблизительно от 1: 1 до 1: 200, предпочтительно в интервале приблизительно от 1: 10 до 1: 100 и наиболее предпочтительно в интервале приблизительно от 1:10 до 1:50 (по массе). Один конкретный вариант воплощения данного объекта включает 9-нитрокамптотецин и дилауроилфосфатидилхолин в соотношении приблизительно от 1:10 до 1:50 по массе с особенно предпочтительным вариантом воплощения, содержащим 9-нитрокамптотецин и дилауроилфосфатидилхолин в соотношении приблизительно 1:50 по массе. В другом варианте воплощения обеспечиваются липосомы для доставки противораковых лекарственных препаратов посредством аэрозолей с малым размером частиц, включающие таксол и дилауроилфосфатидилхолин в соотношении приблизительно 1: 30 по массе.
В следующем варианте воплощения настоящего изобретения обеспечиваются липосомы, которые получают с помощью следующих стадий: растворение липидрастворимого противоракового лекарственного препарата в растворителе, подходящем для растворения противоракового лекарственного препарата, с получением растворенного противоракового лекарственного препарата; добавление растворенного противоракового лекарственного препарата к растворенному липиду, подходящему для состава и доставки лекарственных препаратов посредством аэрозоля, с получением раствора, в котором концентрация растворенного противоракового лекарственного препарата не превышает приблизительно 10% от общего объема раствора, и соотношение в растворе противоракового лекарственного препарата к липиду находится в интервале приблизительно от 1:1 до 1: 200, предпочтительно в интервале приблизительно от 1:10 до 1:100 и наиболее предпочтительно в интервале приблизительно от 1:10 до 1:50 (по массе); замораживание и лиофилизация раствора. На этой стадии раствор можно хранить замороженным для последующего использования или можно растворить его в стерильной воде для использования с получением суспензии, в которой концентрация противоракового лекарственного препарата в стерильной воде в суспензии составляет не более чем приблизительно 5,0 мг/мл.
Предпочтительный вариант воплощения вышеуказанного объекта предоставляет липосомальные препараты из 20-S-камптотецина (КПТ), 9-нитрокамптотецина (9-НК) и других липидрастворимых производных камптотецина, полученные с помощью следующих стадий: получение концентрированных исходных растворов упомянутых 20-S-камптотецина (КПТ), 9-нитрокамптотецина (9-НК) и других липидрастворимых производных камптотецина и липидов в совместимых растворителях; добавление соответствующих объемов 20-S-камптотецина (КПТ), 9-нитрокамптотецина (9-НК) или других липидрастворимых производных камптотецина и исходных концентрированных растворов липидов к объему т-бутанола с образованием вторичного раствора, в котором концентрация упомянутых 20-S-камптотецина (КПТ), 9-нитрокамптотецина (9-НК) и других липидрастворимых производных камптотецина не превышает 10% от упомянутого вторичного раствора, и где соотношение в упомянутом вторичном растворе лекарственного препарата к липиду находится в интервале приблизительно от 1:1 до 1:200, предпочтительно в интервале приблизительно от 1:10 до 1:100 и наиболее предпочтительно в интервале приблизительно от 1:10 до 1:50 (по массе); замораживание упомянутого вторичного раствора и лиофилизация упомянутого вторичного раствора с получением порошкообразного препарата. На этой стадии порошкообразный препарат можно хранить замороженным для последующего использования или можно растворить его в стерильной воде с получением суспензии, в которой концентрация упомянутого противоракового лекарственного препарата в упомянутой суспензии составляет не более чем приблизительно 5 мг/мл.
Более конкретный вариант воплощения предоставляет липосомы, полученные посредством следующих стадий: получение концентрированных исходных растворов противоракового лекарственного препарата, например 100 мг КПТ в 1 мл т-бутанола или 100 мг 9-НК в ДМСО, получение исходного раствора липида, например 100 мг ДЛФХ (дилауроилфосфатидилхолин) в 1 мл бутанола; добавление соответствующих объемов упомянутых концентрированных исходных растворов к объему т-бутанола с образованием вторичного раствора, где конечный объем составляет приблизительно 10 мл, объем ДМСО в любом случае не превышает 10% (об./об.) от упомянутого конечного объема, концентрация противоракового лекарственного препарата не превышает 10% (по массе) от общего объема, и где соотношение лекарственного препарата к липиду находится в интервале приблизительно от 1: 1 до 1: 200, предпочтительно в интервале приблизительно от 1:10 до 1:100 и наиболее предпочтительно в интервале приблизительно от 1:10 до 1:50 (по массе); замораживание упомянутого вторичного раствора и лиофилизация упомянутого замороженного раствора с получением порошкообразного препарата. Этот порошкообразный препарат можно хранить замороженным для последующего использования или можно растворить его в стерильной воде с получением суспензии. Обычно концентрация противоракового лекарственного препарата в суспензии составляет не более чем приблизительно 5 мг/мл.
Другой предпочтительный вариант воплощения вышеописанного объекта предоставляет липосомы, полученные посредством следующих стадий: смешивание таксола с синтетическим альфа-лецитином: дилауроилфосфатидилхолином; растворение таксол-ДЛФХ в т-бутаноле с получением препарата; замораживание и лиофилизация препарата. Липосомы получают путем добавления стерильной чистой воды при температуре выше 25oС, где конечная концентрация таксола по отношению к дилауроилфосфатидилхолину составляет приблизительно от 1:1 до 1:200, предпочтительно находится в интервале приблизительно от 1:10 до 1:100 и наиболее предпочтительно в интервале приблизительно от 1:25 до 1:40 (по массе). Кроме альфа-лецитина могут быть использованы другие природные или синтетические лецитины, включающие, но не ограничивающиеся ими, фосфатидилхолин яичного желтка, гидрированный фосфатидилхолин соевых бобов, димиристоилфосфатидилхолин, диолеоил-дипальмитоилфосфатидилхолин и дипальмитоилфосфатидилхолин.
Эффективность включения 9-НК и других производных камптотецина и противораковых лекарственных препаратов в липосомы можно протестировать путем расслоения водной дисперсии лиофилизированного липосомного лекарственного препарата на PercollTM градиенте и центрифугирования. Невключенный лекарственный препарат собирается на дне пробирки, а лекарственный препарат, включенный в липосомы, собирается на границе раздела между Percoll градиентом и водной фазой. Один качественный тест на эффективность включения представляет собой наблюдение кристаллов лекарственного препарата, когда дисперсию липосом с лекарственным препаратом рассматривают под микроскопом в поляризованном свете. Пригодными также являются другие методы, например для количественной оценки неинкапсулированного кристаллизованного препарата могут быть использованы методы аналитической ВЭЖХ.
Другие и дополнительные аспекты, признаки и преимущества настоящего изобретения станут ясны из следующего описания представленных предпочтительных вариантов воплощения данного изобретения. Эти варианты воплощения предоставлены для раскрытия сущности изобретения.
Краткое описание чертежей
Прилагаемые чертежи включены в описание изобретения для того, чтобы вышеперечисленные признаки, преимущества и объекты данного
изобретения стали ясны и понятны в деталях. Эти чертежи составляют часть подробного описания. Однако необходимо отметить, что прилагаемые чертежи иллюстрируют предпочтительные варианты воплощения
данного изобретения и не должны рассматриваться как ограничивающие объем притязаний данного изобретения.
Фиг. 1 демонстрирует эффект лечения липосомным аэрозолем с 9-НК-ДЛФХ ксенотрансплантированной голым мышам раковой опухоли молочной железы человека.
Фиг. 2 демонстрирует эффект дополнительного лечения липосомным аэрозолем с 9-НК-ДЛФХ мышей, выбранных из представленных на фиг.1.
Фиг. 3 демонстрирует эффект лечения липосомным аэрозолем с 9-НК-ДЛФХ ксенотрансплантированной голым мышам раковой опухоли прямой кишки человека (Squires).
Фиг. 4 демонстрирует воздействие лечения с использованием 9-НК-ДЛФХ с помощью липосомного аэрозоля или путем перорального введения на рост ксенотрансплантата раковой опухоли легких человека (Spark) у голых мышей, что определяют по объему опухоли.
Фиг. 5 демонстрирует выход таксол-ДЛФХ липосом (1:30; 1 мг/мл) с помощью распылителя Aerotech II.
Фиг.6 демонстрирует степень регенерации таксола из препарата, охарактеризованного в фиг.5; дозировка таксол-ДЛФХ при 15 bpm, 500 мл TV.
Подробное описание изобретения
Предоставляются следующие определения. Термины, не определенные специально, должны интерпретироваться так, как это принято в данной области. В описании изобретения термин "аэрозоли" относится к
дисперсиям в воздухе твердых или жидких частиц достаточно малого размера и, как следствие, с низкими скоростями оседания для того, чтобы взвесь в воздухе была относительно стабильной (см. Knight, V.,
Viral and Mycoplasmal Infections of the Respiratory Tract. 1973, Lea and Febiger, Phila. Pa., pp. 2). "Липосомные аэрозоли" состоят из водных капелек, в которых диспергированы одна или несколько
частиц из липосом, или липосом, содержащих один или несколько лекарственных препаратов, предназначенных для доставки к дыхательным путям человека или животных (Knight, V. and Waldrep, J.С. Liposome
Aerosol for Delivery of Asthma Medications; см. также в Кау, В., Allergy and Allergic Diseases, 1997, Blackwell Publications, Oxford, England, Vol. I, pp. 730-741). Размер аэрозольных капелек,
определенный для данной заявки, является таким, как описано в патенте США 5049338, а именно средне-массовый аэродинамический диаметр (СМАД) составляет 1-3 мкм со стандартным геометрическим отклонением
приблизительно 1,8-2,2. Однако при низких концентрациях 9-НК и, возможно, других производных камптотецина, СМАД может составлять менее чем 1 мкм, например 0,8 мкм. На основании исследований, раскрытых
в настоящем изобретении, липосомы могут составлять по существу весь объем капельки, если она уравновешена при относительной влажности окружающей среды.
Используемый в описании термин "модель легкого Weibel" относится к классификации структуры человеческого легкого, которая признает 23 последовательных ответвления дыхательных путей человека. Трахея обозначается 0, бронхи и бронхиолы простираются вплоть до ответвления 16. Эти части дыхательных путей содержат мерцательный эпителий и слизистые железы. Вместе они образуют слизистый покров. Ответвления 17-23 составляют альвеолярную часть легкого и не имеют слизистого покрова. Таким образом, частицы, отложенные здесь, не выносятся по воздушным путям так, чтобы быть проглоченными.
Используемый в описании термин "20-S-камптотецин" или "КПТ" относится к растительному алкалоиду с противораковыми свойствами.
Используемые в описании термины "9-нитрокамптотецин" или "9-НК", "9-аминокамптотецин" или "9-АК" и "10,11-метилендиоксикамптотецин" или "МДК" относятся к активным противораковым лекарственным препаратам, полученным из 20-S-камптотецина, которые являются нерастворимыми в воде, но растворимыми в некоторых липидных растворителях.
Используемый в описании термин "дилауроилфосфатидилхолин" или "ДЛФХ" обозначает липид, использующийся для получения липосом.
Настоящее изобретение направлено на способ лечения рака, включающий стадию доставки посредством аэрозоля с малым размером частиц, водных дисперсий противораковых лекарственных препаратов к дыхательным путям субъекта, нуждающегося в таком лечении. В предпочтительном варианте воплощения данного объекта противораковый лекарственный препарат выбран из группы, состоящей из 20-S-камптотецина, 9-нитрокамптотецина, 9-аминокамптотецина и 10,11-метилендиоксикамптотецина. Кроме того, в предпочтительном варианте воплощения настоящего объекта доставку противоракового лекарственного препарата осуществляют с помощью струйного распылителя.
Кроме того, речь идет о липосомах для доставки противораковых лекарственных препаратов посредством аэрозоля с малым размером частиц, включающих противораковый лекарственный препарат и липид, в которых противораковый лекарственный препарат присутствует в концентрации, не превышающей 10% от общего объема препарата, и соотношение противоракового лекарственного препарата к подходящему растворителю в заявляемом препарате находится в интервале приблизительно от 1:1 до 1:200, предпочтительно в интервале приблизительно от 1: 10 до 1:100 и наиболее предпочтительно в интервале приблизительно от 1:10 до 1: 50 (по массе). Один конкретный вариант воплощения данного объекта включает 9-нитрокамптотецин и дилауроилфосфатидилхолин в соотношении приблизительно от 1:10 до 1:50 по массе; с особенно предпочтительным воплощением, имеющим 9-нитрокамптотецин и дилауроилфосфатидилхолин в соотношении приблизительно 1:50 по массе.
Таксол представляет собой другой противораковый препарат, который является липидрастворимым и легко включается в состав липосомы. Оптимальное соотношение таксола и дилауроилфосфатидилхолина составляет приблизительно от 1: 1 до 1:200, предпочтительно находится в интервале приблизительно от 1:10 до 1:100 и наиболее предпочтительно в интервале приблизительно от 1:25 до 1: 40 (по массе). Предпочтительная форма предоставляет соотношение таксола к ДЛФХ приблизительно равное 1:30. Таксол растворяют в т-бутаноле, не используя ДМСО, который применяют для некоторых камптотецинов. В других отношениях липосомальный препарат таксола подобен липосомальным препаратам камптотецинов.
Далее настоящее изобретение направлено на липосомы для доставки противораковых лекарственных препаратов посредством аэрозолей с малым размером частиц, которые получают с помощью следующих стадий: растворение липидрастворимого противоракового лекарственного препарата в растворителе, подходящем для растворения противоракового лекарственного препарата, с получением растворенного противоракового лекарственного препарата; добавление растворенного противоракового лекарственного препарата к растворенному липиду, подходящему для состава и доставки лекарственных препаратов посредством аэрозоля с получением раствора, в котором концентрация растворенного противоракового лекарственного препарата не превышает приблизительно 10% от общего объема раствора, и соотношение в растворе противоракового лекарственного препарата к подходящему растворителю находится в интервале приблизительно от 1: 1 до 1:200; замораживание и лиофилизация раствора. На этой стадии раствор можно хранить замороженным для последующего использования или можно растворить его в стерильной воде с получением суспензии, в которой концентрация противоракового лекарственного препарата в стерильной воде в суспензии составляет не более чем приблизительно 5,0 мг/мл. Специфический вариант воплощения настоящего изобретения предоставляет липосомы, полученные с помощью следующих стадий: растворение липидрастворимого противоракового лекарственного препарата, выбранного из группы, состоящей из 20-S-камптотецина, 9-нитрокамптотецина, 9-аминокамптотецина и 10,11-метилендиоксикамптотецина, в 100% ДМСО с получением растворенного противоракового лекарственного препарата; добавление упомянутого растворенного противоракового лекарственного препарата к дилауроилфосфатидилхолину, растворенному в т-бутаноле, с получением раствора, в котором концентрация растворенного противоракового лекарственного препарата не превышает приблизительно 5% от общего объема раствора, и соотношение в растворе противоракового лекарственного препарата к дилауроилфосфатидилхолину составляет приблизительно 1:50. Раствор замораживают и лиофилизируют в течение ночи. Для использования лиофилизированный раствор суспендируют в соответствующих объемах стерильной дистиллированной воды. Кроме того, могут применяться другие способы получения липосом, известные в данной области, например вместо лиофилизации может применяться выпаривание в роторном испарителе.
9-НК-ДЛФХ аэрозоль получают путем растворения вначале лекарственного препарата в ДМСО; для этого может потребоваться нагревание до 50-60o С. Этот раствор растворяют в большем объеме т-бутанола так, чтобы объем ДМСО раствора не превышал 5-10% от общего объема объединенных т-бутанола и ДМСО. Органические растворители ДМСО и т-бутанол выпаривают из раствора на жидком азоте, получая светло-желтый порошок. Для использования во флаконы, содержащие лекарственный препарат в соответствующей концентрации, добавляют дистиллированную стерильную воду и вносят в резервуар распылителя. Использовали распылитель Aerotech IITM CIS-USA, Inc., Bedford Ма., но могут использоваться распылители с подобными аэрозольгенерирующими свойствами.
Специфический вариант воплощения настоящего изобретения направлен на липосомы, полученные посредством следующих стадий: смешивание таксола с синтетическим альфа-лецитином: дилауроилфосфатидилхолином; растворение таксол-ДЛФХ в т-бутаноле с получением раствора; замораживание и лиофилизация раствора. Липосомы получают путем добавления стерильной чистой воды при температуре выше 25oС, где конечная концентрация таксола по отношению к дилауроилфосфатидилхолину составляет приблизительно от 1:1 до 1:200, предпочтительно находится в интервале приблизительно от 1:10 до 1:100 и наиболее предпочтительно в интервале приблизительно от 1:25 до 1:40 (по массе).
Конкретно имеется в виду, что фармацевтические композиции настоящего изобретения используются для аэрозольной доставки водных дисперсий липосом, несущих противораковый лекарственный препарат, к дыхательным путям. Специалист средней квалификации в данной области может легко определить без лишних экспериментов соответствующие дозировки этих аэрозольных составов. При использовании для лечения in vivo аэрозольные составы настоящего изобретения вводят пациенту в фармацевтически эффективных количествах; т.е. в количествах, которые устраняют или уменьшают тяжесть опухоли. Как и в случае других медицинских препаратов, доза и дозировочный режим зависят от природы рака (первичной или метастазной), характеристик конкретного лекарственного препарата (например, его терапевтического индекса), пациента, истории болезни и других факторов. Количество вводимого аэрозольного состава для 9-НК обычно должно находиться в интервале приблизительно от 8 до 100 мкг/кг веса пациента/день. С другой стороны, доза и дозировочный режим будут изменяться в зависимости от факторов, известных специалистам в данной области. См. Remington's Pharmaceutical Sci., 17th Ed. (1990) Mark Publishing Co., Easton, Penn. ; and Goodman and Gilman's: The Pharmacological Basis of Therapeutics 8th Ed. (1990) Pergamon Press.
Соединения липосомных аэрозолей с малым размером частиц и способы лечения настоящего изобретения включают липид- и водорастворимые противораковые лекарственные препараты, включенные в липосомы. Липосомы вводят в водных дисперсиях из струйного распылителя. Могут использоваться различные противораковые лекарственные препараты, включая 20-S-камптотецин, 9-нитрокамптотецин, 9-аминокамптотецин, 10,11-метилендиоксикамптотецин и таксол.
Следующие примеры приведены для иллюстрации различных вариантов воплощения данного изобретения и не означают ограничения настоящего изобретения каким-либо образом.
Пример 1
Противораковые препараты КПТ и его производного 9-НК.
Представителями противораковых лекарственных препаратов настоящего изобретения являются 20-S-камптотецин и его производное 9-НК. Другие камптотецины, такие как 9-АК и 10,11-МДК, а также другие противораковые составы, известные в данной области, также обладают подходящими для использования свойствами. Все эти противораковые лекарственные препараты могут быть использованы в липосомальных составах.
Таблица 1 демонстрирует сравнение концентраций 9-НК в крови или в плазме и время пиковых концентраций, сопровождающих пероральное введение человеку, собакам или мышам. (Hinz, H.R., et al. Pharmacokinetics of the in vivo and in vitro conversion of 9-Nitro 20-(S)camptothecin to 9-Amino-20-(S)camptothecin in Humans, Dogs and Mice. Cancer Research, 1994, 54:3096-3100). Единичные пероральные дозы варьировались от 0,1 до 1,0 мг/кг для людей и собак и составляли 4,1 мг/кг для мышей. Возможны некоторые различия в фармакокинетиках КПТ и 9-НК, но вышеупомянутые различия можно предсказать, исходя из свойств обоих агентов.
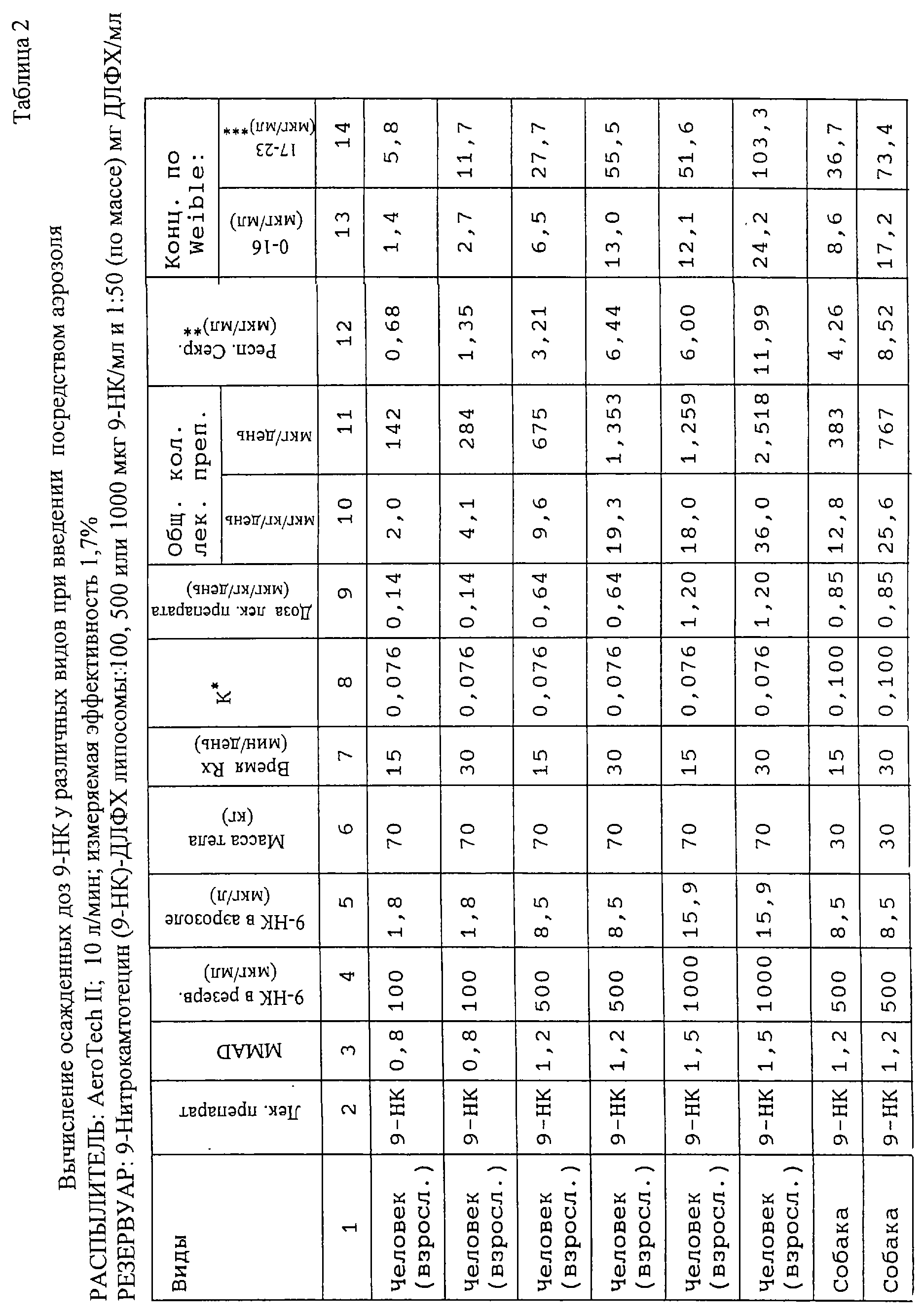
Таблица 2 описывает способ вычисления аэрозольной дозы для мышей, и это является основой для установления доз, приведенных в таблице 1. Большое количество ингалированного лекарственного препарата оседает в носоглотке мыши из-за сложной структуры носа грызунов. Подобным образом назальное вливание приводит к высокой степени осаждения в носоглотке. Осажденное вещество немедленно транспортируется к отверстию пищевода и проглатывается. Однако 10-15% ингалируемой дозы аэрозоля проникает в периферические части легких.
У людей при ротовом дыхании только небольшое количество аэрозольных частиц будет оседать во рту и фактически ничего не будет оседать в носоглотке. Вещество, осажденное в центральных дыхательных путях, возвращается к глотке посредством ресничек слизистой оболочки, где оно проглатывается. В случае первичных опухолей легких, которые часто встречаются в месте раздвоения бронхов, лекарственный препарат будет оседать на поверхности опухоли и будет непосредственно абсорбироваться опухолевой массой. Вещество, осажденное выше 16 ступени по Weibel, что находится вне ресничного эпителия, не будет двигаться вверх; таким образом, в опухолях, находящихся в периферической паренхиме легких, лекарственный препарат будет оседать в соседних областях и будет абсорбироваться непосредственно опухолевой массой. Кроме того, главное преимущество настоящего изобретения состоит в том, что осажденный вне ресничного эпителия лекарственный препарат проникает посредством капилляров в интерстициальное пространство и лимфатическую систему легких и поступает в циркуляцию.
Таблица 3 демонстрирует распределение в тканях КПТ через 15 минут после распыления липосомного аэрозоля с ДЛФХ. Рассчитанная осажденная доза составляет 486 нг на мышь. Средние концентрации в легких и в печени были сходны с меньшими концентрациями в других тестируемых тканях. Таблица 4 демонстрирует распределение в тканях в течение одного часа после интраназального вливания 7 мкг на мышь (233 мкг/кг). Лекарственный препарат быстро удаляется из легких, так что через 15 минут после прекращения распыления в легких присутствуют только незначительные количества лекарственного препарата. В печени, почках и селезенке вначале присутствуют существенные количества лекарственного препарата, которые постепенно уменьшаются на протяжении часа, в течение которого проводились исследования. Интересно, что концентрации в крови были минимальными на протяжении всего исследования. Эти исследования показывают по существу немедленное осаждение лекарственного препарата в легких при быстром выведении его к внутренним органам. Количество препарата, получаемого посредством абсорбции от проглатываемого лекарства, неопределенно.
Концентрация КПТ в липосомальном препарате в распылителе составляла 0,2 мг/мл аэрозоля, полученного с помощью распылителя Aerotech II, действующего со скоростью потока 10 л/мин (табл.4).
Таблица 4. Время-зависимое распределение КПТ в органах после интраназального введения
Таблица 5 демонстрирует распределение
лекарственного препарата в крови и внутренних органах после внутримышечной инъекции КПТ. Лекарственный препарат очень медленно рассасывается из области внутримышечного введения в течение первых 12
часов при очень маленьких концентрациях, определяемых в печени, и фактическом отсутствии препарата в других органах. Концентрации в крови были незначительными на протяжении исследования. Вводимая доза
была такой же, как и при интраназальном вливании. Эти факты демонстрируют более быструю и более эффективную системную абсорбцию лекарственного препарата после легочного введения, чем после
внутримышечного. Вероятно, что оседание в органах и сосудистых пространствах увеличивает возможность контакта с молекулами альбумина и деградации до карбоксильной формы препарата.
Для каждой временной точки обрабатывали группу из 3 животных.
Пример 2.
Стабильность липосом, состоящих из ДЛФХ и 9-НК.
Таблица 6 демонстрирует стабильность липосом с фиксированным массовым соотношением 9-НК и ДЛФХ, составляющим 1:50 (по массе), но с увеличивающимися концентрациями составляющих компонентов от 0,1 мг/мл до 1,0 мг/мл лекарственного препарата. Образцы тестировали в разных условиях после энергичного перемешивания, но перед началом распыления, через 1,5-2 минуты после распыления (образцы, взятые из жидкости, находящейся в резервуаре распылителя) и из аэрозоля, который собирали с помощью стеклянного импинжера (All-Glass Impingег. Асе Glass Co., Vineland N.J.).
Наиболее стабильным являлся препарат с наименьшей концентрацией составляющих компонентов. После распыления в резервуаре появилось небольшое количество кристаллов. Распыление вызвало десятикратное уменьшение в диаметре липосомных частиц благодаря действию сдвиговых сил, связанных с распылением. Наблюдалось дальнейшее уменьшение диаметра липосомных частиц, извлеченных из аэрозоля. Этот факт согласуется с выбором более мелких частиц для испускания в составе аэрозоля. Отсутствие кристаллов предполагает, что кристаллы не могут распыляться так же легко, как липосомы. При более больших дозах липосом после распыления происходит уменьшение размера, но частицы, извлеченные из аэрозоля, не уменьшены в размере по сравнению с частицами, которые находились в резервуаре распылителя.
Пример 3.
Кинетика раскрытия лактонового кольца.
Противоопухолевая активность некоторых камптотецинов уменьшается после растворения в водной среде. Это происходит из-за гидролизуемого альфа-гидроксилактонового кольца (кольца Е). Изменение происходит в результате ацильного расщепления, приводящего к образованию биологически неактивной карбоксилатной формы молекулы. Лактоновая циклическая форма лекарственного препарата скрыта в липосомах (Burke, T.G., Biochemistry 1993, 32:5352-5364), но карбоксильная форма лекарственного препарата имеет высокое сродство к человеческому сывороточному альбумину. Это приводит к быстрому превращению лактона в карбоксилат в присутствии человеческого сывороточного альбумина и, таким образом, к утрате противораковой активности. Осаждение в легких на поверхностях альвеол, где альбумин и/или его взаимодействие с составляющими компонентами липосом присутствует в небольших количествах, несомненно является фактором, сохраняющим противораковое действие 9-НК.
Пример 4.
Воздействие 9-НК на рост эксплантата злокачественной опухоли молочной железы человека у мышей.
Фиг.1 демонстрирует рост в области подкожного ксенотрансплантата злокачественной опухоли молочной железы в процессе лечения аэрозолем с 9-НК-ДЛФХ липосомами. В эксперименте было задействовано 6 мышей, подвергшихся лечению 9-НК, и 5 контрольных мышей. Обработку проводили 15 минут в день, пять дней в неделю. Доза составляла 8,1 мкг/кг в день. Было определено, что доза, осажденная в дыхательных путях каждой мыши, составляла 234 нг в день. Данные по размерам опухолей были нормализованы, и расхождение в размерах опухолей (% роста от начальной опухоли) в двух группах было очень значительным на 17 день обработки (Р<0,011). После этого времени контрольные мыши были умерщвлены из-за присутствия большой массы некротической опухоли. Фиг.2 демонстрирует направление событий у двух обработанных мышей, которым последовательно были введены более высокие дозы препарата, после 16 дней без обработки. Спустя несколько дней после возобновления лечения пятикратно увеличенной дозой аэрозоля с 9-НК липосомами, размер опухолей у обработанных животных быстро уменьшался, и опухоли не наблюдались на 85 день после начала лечения.
Пример 5.
Воздействие 9-НК на ксенотрансплантаты колоректального рака человека у мышей.
Подобные исследования проводили на голых мышах с ксенотрансплантатами карциномы ободочной кишки человека, они показаны на фиг.3. В эксперименте было задействовано 15 мышей, подвергшихся лечению, и 20 контрольных мышей. Десять контролей получали пустые ДЛФХ липосомы, и 10 не получали обработки. Контрольные животные, которых не обрабатывали или обрабатывали только ДЛФХ, показывали последовательное и быстрое увеличение размера опухоли до тех пор, пока они не были умерщвлены на 36 день. Общая скорость роста опухоли у контрольных мышей была в 7-11 раз выше, чем у мышей, обработанных 9-НК. Обработанных животных разделили на две группы, по 10 в каждой. Одна группа получала 77 мкг/кг/день, пять дней в неделю на протяжении всего эксперимента. Другая получала 77 мкг/кг/день, пять дней в неделю, вплоть до 35 дня, когда дозу увеличили до 153 мкг/кг/день, пять дней в неделю, вплоть до 46 дня, когда она была увеличена до 307 мкг/кг по тому же распорядку, до 61 дня. В группе, получающей более высокую дозу, наблюдали слегка меньшее увеличение размера опухоли, но различия не были статистически значительными, и данные объединены в этой фигуре. Четыре мыши в группе, обработанной ДЛФХ, были умерщвлены из-за большого размера опухоли или опухолевого некроза ранее 61 дня, и шесть мышей в группе, не получающей обработке, были умерщвлены по той же причине ранее 61 дня. В обрабатываемой группе пять мышей были умерщвлены ранее 61 дня по причине опухолевого некроза или истощения. Мыши с истощением принадлежали к группе, получавшей высокую дозу, что предполагает токсичность лекарственного препарата. Одна дополнительно обработанная мышь была умерщвлена из-за выпадения прямой кишки. Определенный терапевтический эффект обработки 9-НК (Р<0,002 ~ хи-квадрат тест) основывается на обнаруженной уменьшенной скорости роста опухоли на 28 день (Р<0,007, t тест Стъюдента, двухсторонний) и пониженной смертности.
Пример 6.
Воздействие 9-НК на ксенотрансплантаты карциномы легких человека у голых мышей.
Дополнительно проводили исследования влияния обработки 9-НК-ДЛФХ посредством липосомного аэрозоля или посредством перорального введения на рост ксенотрансплантатов рака легких человека (Spark) у голых мышей, которое определяли по объему опухоли. Обработку начинали приблизительно через две недели после имплантации опухоли. Контрольные животные показывали быстрое увеличение объема опухолей. Животные, которые получали пероральную дозировку водной суспензии липосом с лекарственным препаратом в дозах, составляющих 100 мкг/кг/день - более чем удвоенная аэрозольная дозировка, - не отвечали на обработку. См. фиг.4.
И аэрозольные, и пероральные дозы были удвоены на 13 день. Увеличение дозировки сопровождались уменьшением размера опухолей, обрабатываемых аэрозолем, но у мышей, получающих пероральную обработку, уменьшения размера опухолей не происходило. Таким образом, несмотря на тот факт, что половина или более аэрозольной дозы, введенной мышам, оседала в носу, голове, трахее и верхних бронхах и быстро переносилась системой ресничного эпителия к пищеводу, где проглатывалась, в основном ответственной за воздействие на рост опухоли являлась фракция ингалируемого препарата, которая оседала в легких.
Наиболее вероятным объяснением ясновыраженной эффективности аэрозольной доставки является быстрый доступ лекарственного препарата в циркуляцию, где он поступает в левое предсердие, затем в аорту и периферическую циркуляцию. Таким образом, лекарственный препарат будет достигать опухолей на "первом пассаже" без прохождения через печень, в которой удаляется большое количество лекарственного препарата из крови.
Пример 7.
Животные модели.
Голые мыши: для этих экспериментов использовались швейцарские иммунодефицитные голые мыши штамма NIH-1 с высокой плодовитостью, выведенные и содержащиеся в институте Stehlin (Giovella, B.C., et al., Complete Grouth Inhibition of Human Cancer Xenografts in Nude Mice by Treatment with 20-(S)-Camptothecin, Cancer Research 1991, 51:3052-3055).
Ксенотрансплантаты рака человека: человеческие гетеротрансплантаты были пересажены голым мышам. Для имплантации приблизительно 50 мг сырой массы тонко измельченной опухоли в 0,5 мл минимальной основной среды Eagles вводили подкожно в правой спинной области грудной клетки. Животных начинали обрабатывать приблизительно через 10 дней после имплантации опухолей. Опухоли раков молочной железы измеряли в двух измерениях (т.е. площадь) с помощью кронциркуля, тогда как опухоли раков ободочной кишки измеряли в трех направлениях (т.е. объем) с помощью кронциркуля.
Пример 8.
Состав липосомного аэрозоля с камптотецином и его введение.
КПТ и 9-нитрокамптотецин были предоставлены Dr. Beppino Giovanella из Stehlin Institute, Houston, Texas. ДЛФХ был получен от Avanti Polar Lipids, Pelham, AL. Распылитель Aerotech II был получен от Cis-USA, Inc., Bedford, MA.
Для получения липосом 9-НК (100 мг/мл) или КПТ (10 мг/мл) растворяли в 100% ДМСО и добавляли к ДЛФХ, растворенному в третичном бутаноле (40oС) так, чтобы конечная концентрация ДМСО не превышала 5% от общего объема, и соотношение лекарственного препарата к липиду составляло 1:50 (по массе). Конечная суспензия была прозрачной. Если происходило осаждение, то ее снова нагревали до 50-60oС. Препарат замораживали в жидком азоте и лиофилизировали в течение ночи. Для использования этот материал растворяли в стерильной воде с получением соответствующей концентрации лекарственного препарата, не превышающей 1,0 мг/мл для каждого лекарства. Эффективность включения лекарственного препарата в липосомы количественно определяли с помощью исследования под микроскопом в поляризованном свете. Невключенный лекарственный препарат наблюдали в виде кристаллов с двойным лучепреломлением. Эффективность включения определяли путем центрифугирования водных суспензий липосом в градиенте PercollTM. Одну десятую мл суспензии наслаивали на 2 мл градиента и центрифугировали при 2000 об/мин в течение 25-30 минут. Липосомы находились в промежуточном слое вода-Percoll, тогда как невключенный лекарственный препарат оседал на дне пробирки. Многие другие липиды могут заменять ДЛФХ в составе и при использовании липосом для доставки лекарственных препаратов посредством аэрозоля (Sugarman, S.M., et al., Lipidcomplexed camptothecin: formulation and initial biodistribution and anti-tumor activity studies. Cancer Chemotherapy Pharmacol. 1996, 37:531-538).
Пример 9.
Анализ ВЭЖХ.
Для количественного определения КПТ и 9-НК использовали автоматический инжектор Waters (Milford, МА) 710В Wisp и колонку Waters Nova-Pak C18 при комнатной температуре. Мобильная фаза представляла собой 30% ацетонитрила и 70% 0,1%-ной ледяной уксусной кислоты, КПТ определяли с помощью сканирующего флюоресцентного детектора Waters 470, при длине волны возбуждения, равной 370 нм, и длине волны испускания, равной 440 нм. 9-НК определяли, используя абсорбционный детектор Waters 440 и регистрацию при 254 нм. Данные анализировали с помощью программного обеспечения Waters Millenium.
Пример 10.
Измерение капелек аэрозоля.
Размер капелек аэрозоля измеряли, используя пробоотборник Andersen ACFM для измерения размера неживых частиц в окружающей среде (Andersen Instruments, Inc., Atlanta, Ga.), с помощью ранее описанных методов (Waldrep, J.С. et al. , J. Aerosol Med. 1994, 7:135-145). Среднемассовые аэродинамические диаметры и геометрические стандартные отклонения определяли, используя KaleidaGraph 2,0 (Synergy Software, Reading Pa.). Аэрозольные капельки состояли из водных суспензий липосом. Диаметры липосом измеряли в водных суспензиях с помощью Model 3300 NICOMP Laser Particle Sizer.
Пример 11.
Получение и эффективность таксол-ДЛФХ липосом, приготовленных для аэрозольной доставки.
Таксол представляет собой другой противораковый лекарственный препарат, который является липидрастворимым и легко включаемым в липосомальные композиции. Таксол непосредственно растворяли в т-бутаноле без использования ДМСО как камптотецины. Таксольные липосомальные препараты отличаются от камптотециновых.
Обнаружено, что оптимальное соотношение таксола к ДЛФХ составляло приблизительно 1:30 (по массе). Композиции, совместимые с распылением, и композиции для аэрозольной доставки получали при концентрациях таксола и ДЛФХ 1 и 30 мг/мл соответственно. Для получения оптимизированных таксол-ДЛФХ липосом 5 мг таксола смешивали со 150 мг синтетического альфа-лецитина: дилауроилфосфатидилхолина (ДЛФХ). Лекарственный препарат/ДЛФХ смешивали с 20 мл трет-бутанола при перемешивании и рабочей температуре, равной 37oС. После смешивания препарат лекарство/липид переносили с помощью пипетки в стеклянные флаконы, быстро замораживали и лиофилизировали в течение ночи для удаления трет-бутанола, получая порошок. Многослойные липосомы получали путем добавления 5 мл особо чистой воды при температуре выше, чем температура фазового перехода ДЛФХ (Тc), при 25oС, чтобы получить конечную стандартную концентрацию лекарственного препарата 1 мг таксола: 30 мг ДЛФХ в 1 мл. Смесь инкубировали в течение 30 мин при комнатной температуре с периодическим перемешиванием для получением многослойных везикулярных липосом (МВЛ). Для определения концентрации лекарственного препарата методом ВЭЖХ отбирали аликвоты.
Фиг. 5 демонстрирует распределение размеров частиц таксол-ДЛФХ липосомного аэрозоля с MMAD, равным 1,4 мкм, и геометрическим стандартным отклонением,
равным 2,0. Фиг.6 демонстрирует степень регенерации таксола из препарата, охарактеризованного на фиг.5. На модели легкого (Harvard Respirator), применяемой для измерения выхода таксола из распылителя
(Aerothech II), в качестве образца отбирают 87,75 л аэрозоля с получением 3000 мкг таксола. Таким образом, концентрация в аэрозоле составляет 34,2 мкг/л. Исходя из этой информации, может быть
рассчитана доза аэрозоля, попадающая в дыхательные пути после ингаляции,
Любые патенты или публикации, упомянутые в данном описании, показывают уровень специалистов, квалифицированных в
области, к которой относится данное изобретение. Кроме того, эти патенты и публикации включены в данное описание в качестве ссылки в той же степени, как если бы каждая индивидуальная публикация была
конкретно и индивидуально включена в качестве ссылки.
Специалист в данной области легко оценит, что настоящее изобретение хорошо приспособлено для выполнения задач и достижения упомянутых целей и преимуществ в той же степени, как и эти задачи, цели и преимущества присущи данному изобретению. Настоящие примеры наряду со способами, методиками, обработками, молекулами и конкретными соединениями, описанными в данном документе, представляющие предпочтительные варианты воплощения, являются демонстрационными без ограничения объема изобретения. Изменения к заявленному здесь и другие применения, которые могут быть произведены специалистами в данной области, охватываются духом изобретения, как определено в формуле изобретения.
Реферат
Изобретение относится к области медицины, а именно к фармакологии и лечению рака, и представляет композиции и способы доставки аэрозолей с малым размером частиц путем ингаляции водных дисперсий липосом, несущих противораковые лекарственные препараты, к дыхательным путям субъекта, нуждающегося в таком лечении. При этом лекарственным противораковым препаратом является таксол, таксол-А, 20-S-камптотецин, 9-нитрокампотецин, 9-аминокампотецин, 10,11-метилендиоксикамптотецин в концентрации, не превышающей 5,0 мг/мл; указанная липосома содержит липид дилароилфосфатидилхолин в соотношении противоракового лекарственного препарата и липида от 1:1 до 1:200 по массе. При ингаляции липосомы срезаются до диаметра менее 500 нм посредством струйного распылителя. Введение таких лекарственных препаратов путем ингаляции обеспечивает более быструю и более эффективную абсорбцию препарата, чем при других путях введения. 4 з.п.ф-лы, 6 табл., 6 ил.


Комментарии