Терапевтический препарат для ингаляции, способ его получения (варианты) - RU2148398C1
Код документа: RU2148398C1
Чертежи








Описание
Изобретение относится к терапевтическому препарату инсулина, который является пригодным для ингаляции.
Инсулин играет центральную роль в регулировании углеводного, жирового и белкового обмена в организме. Сахарный диабет (обычно называемый просто диабетом) является заболеванием, которое характеризуется нарушением регулирования обмена, в частности глюкозного обмена. У особей в нормальном состоянии повышение содержания глюкозы в крови, которое происходит сразу после приема пищи, побуждает бета-клетки поджелудочной железы выделять инсулин, пептидный гормон, в кровоток. Инсулин связывается с инсулиновыми рецепторами, расположенными на некоторых типах клеток, в особенности на мышечных клетках, и посредством этого дает клеткам сигнал увеличить скорость поглощения глюкозы в клетках. Когда содержание глюкозы в крови возвращается к нормальному, дообеденному уровню, количество инсулина в крови также падает. В отсутствие инсулина содержание глюкозы в крови поднималось бы до опасно высокого уровня (состояние, называемое гипергликемией), приводящего в результате, возможно, к смертельному исходу. Слишком высокое количество инсулина вызывает анормально низкое содержание глюкозы (гипогликемия), что также представляет опасность и может стать фатальным. У особи в нормальном состоянии присущая ей обратная связь совершает цикл, регулируя выделение инсулина и удаление его из большого круга кровообращения, и предотвращает возникновение как гипергликемического, так и гипогликемического состояния.
Сахарный диабет является заболеванием, поражающим около 3% населения Швеции. Из этих 3% приблизительно 20% страдают от диабета I типа, и остальные - от диабета II типа.
Диабет I типа, или инсулинзависимый сахарный диабет (IDDM), обычно начинается в детстве. Он характеризуется атрофией бета-клеток поджелудочной железы, что приводит в результате к снижению или прекращению продуцирования инсулина и делает пациента зависимым от инсулина, поступающего извне, чтобы выжить.
Более обычный диабет II типа, или инсулиннезависимый сахарный диабет (NIDDM), обычно встречается у пациентов старше 40 лет. Эти пациенты могут, по крайней мере, сначала, иметь нормальный или даже высокий уровень инсулина в крови, но у них обнаруживается анормально низкая скорость клеточного поглощения глюкозы в ответ на инсулин. Хотя диабет типа II часто можно лечить путем контролирования диеты пациента, введение экзогенного инсулина в дополнение к инсулину, выделяемому бета-клетками пациента, также может оказаться необходимым.
Инсулин не может быть введен перорально в эффективных дозах, так как он быстро разрушается ферментами в желудочно-кишечном тракте и низким pH в желудке, прежде чем он достигнет кровяного русла. Стандартным способом введения является подкожная инъекция изотонического раствора инсулина, обычно пациентом самому себе. Необходимость в инъекциях создает много неудобств и дискомфорт для многих больных, и в месте инъекции могут иметь место локальные реакции. Кроме того, существует анормальный нефизиологичный профиль концентрации в плазме для инъецируемого инсулина. Такой анормальный профиль концентрации в плазме является нежелательным и увеличивает риск побочных эффектов, связанных с длительным временем лечения диабета.
Вследствие этих недостатков существует необходимость в инсулине в форме, которую можно вводить иначе, чем инъекцией. При попытках получить такие различные формы инсулина было сделано много предложений. Например, предложены продукты для назального, ректального и буккального введения, причем основные усилия сконцентрированы на продуктах для назального введения. Назальное введение, однако, проблематично и дает возможность только низкой биологической доступности. В последнее время возрастающий интерес проявляется к доставке системно действующих активных лекарственных средств через легкие, и некоторые исследования включают легочную доставку инсулина. Большинство из этих исследований касается растворов или суспензий для легочной доставки, например, с помощью распылителей и находящихся под давлением дозирующих ингаляторов, и во всех случаях с ограниченным успехом.
Изобретение
В настоящее время обнаружено, что инсулин может быть включен в сухой порошкообразный препарат для
ингаляции, содержащий также вещество, которое усиливает поглощение инсулина в легких, из такого препарата инсулин может быть абсорбирован с терапевтически приемлемой скоростью и в терапевтически
приемлемом количестве. "Усиливает поглощение" означает, что количество инсулина, абсорбированное в большом круге кровообращения, в присутствии усилителя выше, чем количество инсулина, абсорбированное
в отсутствие усилителя.
Следовательно, в соответствии с настоящим изобретением, предлагается терапевтический препарат, содержащий активные соединения (A) - инсулин и (B) - вещество, которое усиливает поглощение инсулина в нижних дыхательных путях, и этот препарат имеет форму сухого порошка, подходящего для ингаляции, в котором по крайней мере 50% от общей массы активных соединений состоит из (а) первичных частиц, имеющих диаметр менее 10 мкм, например, от 0,01 до 10 мкм, предпочтительно - от 1 до 6 мкм, или (b) агломератов упомянутых частиц.
Терапевтический препарат настоящего изобретения может содержать только упомянутые активные соединения, или он может содержать другие вещества, такие как фармацевтически приемлемый носитель. Такой носитель может состоять, в значительной степени, из частиц, имеющих диаметр менее 10 мкм, так что по крайней мере 50% полученного в результате порошка в целом состоит из необязательно агломерированных первичных частиц, имеющих диаметр менее 10 мкм, с другой стороны, носитель может состоять, в значительной степени, из более крупных частиц ("крупные частицы"), так что "готовая к употреблению смесь" может быть составлена из активных соединений и упомянутого носителя. В готовой к употреблению смеси, известной, с другой стороны, как интерактивная или адгезивная смесь, мелкие частицы лекарственного препарата (в настоящем изобретении - активных соединений) довольно равномерно распределяются по поверхности крупных частиц эксципиента (в настоящем изобретении фармацевтически приемлемого носителя). В таком случае предпочтительно, чтобы активные соединения не находились в форме агломератов до образования упорядоченной смеси. Крупные частицы могут иметь диаметр свыше 20 мкм, такой как свыше 60 мкм. Вблизи этих низших пределов диаметр крупных частиц не имеет критического значения, так что могут использоваться частицы разного размера, если желательно, в соответствии с конкретными требованиями конкретной формулировки. В готовой к употреблению смеси к крупным частицам не предъявляется требование иметь одинаковый размер, но может быть выгодно, чтобы в пределах упорядоченной смеси крупные частицы имели сходный размер. Предпочтительно, крупные частицы имеют диаметр 60-800 мкм.
Поэтому в конкретном варианте своего осуществления настоящее изобретение предлагает терапевтический препарат инсулина и вещества, которое усиливает поглощение инсулина в нижних дыхательных путях, и этот препарат находится в форме сухого порошкообразного препарата, пригодного для ингаляции, в котором по крайней мере 50 мас.% составляют (а) частицы, имеющие диаметр менее 10 мкм, или (b) агломераты упомянутых частиц; в другом конкретном варианте осуществления изобретения изобретение предлагает терапевтический препарат, содержащий инсулин, вещество, которое усиливает поглощение инсулина в нижних дыхательных путях, и фармацевтически приемлемый носитель, и этот препарат находится в форме сухого порошка, пригодного для ингаляции, в котором по крайней мере 50 мас.% составляют (a) частицы, имеющие диаметр менее 10 мкм, или (b) агломераты упомянутых частиц; и в еще одном конкретном варианте осуществления настоящего изобретения предлагается терапевтический препарат, содержащий активные соединения (A)-инсулин и (B)-вещество, которое усиливает поглощение инсулина в нижних дыхательных путях, при этом по крайней мере 50% общей массы активных соединений (A) и (B) состоит из частиц, имеющих диаметр менее 10 мкм, и фармацевтически приемлемой носитель, и этот препарат находится в форме сухого порошкообразного препарата, пригодного для ингаляции, в котором упорядоченная смесь может быть составлена между активными соединениями и фармацевтически приемлемым носителем.
Предпочтительно, по крайней мере 50 мас.%, даже по крайней мере 70 мас.% или по крайней мере 80 мас.%, а предпочтительнее, по крайней мере 90 мас.% от общей массы активных соединений (A) и (B) составляют частицы, имеющие диаметр менее 10 мкм, или агломераты таких частиц, и, когда сухой порошкообразный препарат содержит носитель иной, чем в случае, когда желательной является упорядоченная смесь, предпочтительно, по крайней мере, 60 мас.% даже по крайней мере 70 мас.% или, по крайней мере 80 мас.%, предпочтительнее - 90 мас.% от общей массы сухого порошка составляют частицы, имеющие диаметр менее 10 мкм, или агломераты таких частиц.
Хотя сухой порошок для ингаляции, с или без фармацевтически приемлемого носителя, может содержать агломераты частиц, как указывается выше, во время ингаляции любые агломераты должны быть дезагломерированы с образованием порошка, в котором по крайней мере 50% составляют частицы, имеющие диаметр до 10 мкм. Агломераты могут являться результатом процесса регулируемой агломерации, или они могут быть просто результатом тесного контакта частиц порошка. В любом случае существенным является то, что агломераты способны быть дезагломерированы, например, механическими средствами в ингаляторе, или иным способом, в вышеупомянутые частицы. Вообще, предпочтительно, чтобы агломераты не образовывались в готовой к употреблению смеси. В случае готовой к употреблению смеси активные соединения должны выделяться из больших частиц во время ингаляции, либо механическими средствами в ингаляторе, либо просто при действии ингаляции, или иными способами, причем активные соединения затем осаждаются в нижних дыхательных путях, а частицы носителя - во рту.
В настоящем изобретении может быть использована любая биологически активная форма инсулина или его производное. Например, можно использовать бычий инсулин, свиньи, или биосинтетический или полусинтетический инсулин человека, или биологически активное производное инсулина человека ("модифицированный инсулин"), имеющее, например, определенные аминокислотные замещения, как описано в Brange et al., "Diabetes Care" 13: 923, 1990. Модифицированные инсулины разрабатываются для того, чтобы улучшить различные свойства, например, улучшить стабильность или получить улучшенный фармакокинетический профиль (т.е. улучшенный профиль поглощения через эпителиальные мембраны). Инсулин должен иметь низкое содержание цинка, так как цинк снижает устойчивость инсулина, уменьшая, вероятно, скорость поглощения, и также потому, что цинк может образовывать с некоторыми веществами - усилителями, применяемыми в настоящем изобретении, нежелательные нерастворимые осадки. Кроме того, инсулин должен находиться в форме сухого порошка, который быстро растворяется в водном растворе.
Вещество, которое усиливает поглощение инсулина в легких, называемое здесь также усилителем, может представлять собой любое из тех соединений, которые действуют, усиливая поглощение через слой эпителиальных клеток в нижних дыхательных путях в примыкающую сосудистую сеть легких. Усилитель может достигать этого любым из перечисленных возможных механизмов.
(1) Усиление парацеллюлярной проникающей способности инсулина путем индуцирования структурных изменений в плотных сочленениях между эпителиальными клетками.
(2) Усиление трансцеллюлярной проникающей способности инсулина путем взаимодействия с экстрагирующим белком или липидными составляющими мембраны, и разрушения посредством этого целостности мембраны.
(3) Взаимодействие между усилителем и инсулином, которое увеличивает растворимость инсулина в водном растворе. Это может происходить за счет предотвращения образования агрегатов инсулина (димеров, тримеров, гексамеров) или за счет солюбилизации молекул инсулина в мицеллах усилителя.
(4) Уменьшение вязкости или растворения слизистой барьерной выстилки альвеол и проходов легкого, за счет чего эпителиальная поверхность выставляется для прямого поглощения инсулина.
Усилители могут функционировать только по одному из упомянутых выше механизмов, или по двум, или по большему их числу. Усилитель, который действует по нескольким механизмам, более подходящ для промотирования эффективного поглощения инсулина, чем усилитель, который использует только один механизм или два. Например, поверхностно-активные вещества являются классом усилителей, которые, как полагают, действуют по всем четырем механизмам, перечисленным выше. Поверхностно-активные вещества представляют собой амфифильные молекулы, содержащие как липофильную, так и гидрофильную часть, с изменяющимся балансом между этими двумя характеристиками. Если молекула является сильно липофильной, низкая растворимость вещества в воде может ограничить его пригодность. Однако, если подавляюще доминирует гидрофильная часть, поверхностно-активные свойства молекулы могут быть минимальными. Следовательно, чтобы быть эффективным, поверхностно-активное вещество должно подводить соответствующий баланс между достаточной растворимостью и достаточной поверхностной активностью.
Другим свойством поверхностно-активного вещества, которое может быть важным, является суммарный заряд поверхностно-активного вещества при величине pH в легком (приблизительно 7,4). Изоэлектрический pH инсулина составляет 5,5. При pH 7,4 инсулин имеет отрицательный суммарный заряд. Это приводит в результате к электростатическому отталкиванию между молекулами инсулина, что, в свою очередь, предотвращает агрегацию, и посредством этого увеличивает растворимость. Если поверхностно-активное вещество также заряжено отрицательно, и, кроме того, может взаимодействовать с инсулином путем, например, гидрофобного взаимодействия, среди молекул инсулина может возникнуть дополнительное отталкивание. Следовательно, анионогенное поверхностно-активное вещество будет обладать дополнительным преимуществом (по сравнению с поверхностно-активными веществами, имеющими нейтральный или суммарный позитивный заряд при физиологическим pH) по усилению абсорбции, способствуя стабилизации инсулина в мономерном состоянии.
Ряд различных соединений, потенциально пригодных в качестве усилителей для способов настоящего изобретения, проверяют на крысах, как описано ниже в примере 5. Другие вещества с известными свойствами усиления поглощения или с физическими характеристиками, которые делают их подходящими для применения в способе настоящего изобретения, могут быть легко проверены специалистами в этой области техники in vivo или, с другой стороны, анализом in vitro, описанным в примере 6.
Возможно, что сочетание двух или большего числа веществ-усилителей также дает удовлетворительные результаты. Применение такого сочетания в способе изобретения рассматривается как находящееся в пределах изобретения.
Усилитель, применяемый в способах настоящего изобретения, будет сочетать эффективное усиление поглощения инсулина с (1) отсутствием токсичности при используемых концентрациях и (2) свойствами хорошего порошка, т.е., отсутствием липкости или воскообразной консистенции в твердом состоянии. Токсичность данного вещества может быть проверена стандартными способами, такими как МТТ-анализ, например, как описано в Int. J. Pharm. 65 (1990), 249-259. Свойства порошка данного вещества могут быть установлены из сведений, опубликованных об этом веществе, или эмпирически.
Одним весьма перспективным типом усилителя являются соли жирных кислот. Установлено, что натриевые соли насыщенных жирных кислот с длиной цепи 10 атомов углерода (т.е. капринат натрия), 12 атомов углерода (лаурат натрия) и 14 атомов углерода (миристат натрия) хорошо вписываются в способ настоящего изобретения. Обнаружено, что калиевые соли и соли лизина каприновой кислоты также являются эффективными в способе изобретения. Если длина углеродной цепи менее 10 атомов, поверхностная активность верхностно-активного вещества может быть слишком низкой, и если длина углеродной цепи превышает 14 атомов, пониженная растворимость соли жирной кислоты в воде ограничивает ее применение.
Для настоящего изобретения наиболее предпочтительным веществом, которое усиливает поглощение инсулина в нижних дыхательных путях, является капринат натрия.
Поэтому в особенно предпочтительном варианте осуществления
настоящего изобретения предлагается терапевтический препарат, содержащий активные соединения (A) - инсулин, и (B) - капринат натрия, в форме сухого порошка, пригодного для ингаляции, в котором по
крайней мере 50% от общей массы активных соединений (A) и (B) составляют (a) первичные частицы, имеющие диаметр менее 10 мкм, например, от 0,01 до 10 мкм, предпочтительно - от 1 до 6 мкм, или (b)
агломераты таких частиц; конкретно, в особенно предпочтительном варианте своего осуществления настоящее изобретение предлагает:
- терапевтический препарат инсулина и каприната натрия, причем
упомянутый препарат находится в форме сухого порошка, пригодного для ингаляции, в котором по крайней мере 50 мас.% составляют (a) частицы, имеющие диаметр менее 10 мкм, или (b) агломераты упомянутых
частиц;
- терапевтический препарат, содержащий инсулин, капринат натрия и фармацевтически приемлемый носитель, причем упомянутый препарат находится в форме сухого порошка, пригодного для
ингаляции, в котором по крайней мере 50 мас.% составляют (a) частицы, имеющие диаметр менее 10 мкм, или (b) агломераты упомянутых частиц; и
- терапевтический препарат, содержащий активные
соединения (A) - инсулин, и (B)-капринат натрия, при этом по крайней мере 50% от общей массы активных соединений (A) и (B) составляют частицы, имеющие диаметр менее 10 мкм, и фармацевтически
приемлемый носитель, причем упомянутый препарат находится в форме сухого порошка, пригодного для ингаляции, в котором из активных соединений и фармацевтически приемлемого носителя может быть
сформирована готовая к употреблению смесь.
Различные контрионы могут изменить растворимость соли насыщенной кислоты в воде, так что усилитель, содержащий углеродную цепь иную, чем из 10-14 атомов, окажется более предпочтительным, чем усилители, определение которым дается здесь выше. Соли ненасыщенных жирных кислот также могут быть пригодными для настоящего изобретения, так как они являются более водорастворимыми, чем соли насыщенных жирных кислот, и, следовательно, могут иметь более длинную углеродную цепь, чем последние, и все еще сохранять растворимость, необходимую для успешного усиления поглощения инсулина.
На пригодность в качестве усилителей в способе настоящего изобретения испытывались соли желчи и производные солей желчи. Все испытанные соли (натриевые соли урсодезоксихолата, таурохолата, гликохолата и тауродигидрофузидата) эффективно усиливают поглощение инсулина в легких.
В качестве усилителей проверялись также фосфолипиды. Обнаружено, что одноцепной фосфолипид (лизофосфатидилхолин) является эффективным усилителем, в то время как два двуцепных фосфолипида (диоктаноилфосфатидилхолин и дидеканоилфосфатидилхолин) не являются эффективными усилителями. Это можно объяснить тем фактом, что двуцепные фосфолипиды значительно менее растворимы в воде, чем их одноцепные копии; однако разумно ожидать, что двуцепные фосфолипиды с более короткой цепью, обладающие большей водорастворимостью, чем их длинноцепные аналоги, будут полезны в качестве усилителей в настоящем изобретении, так что могут использоваться как одно-, так и двуцепные фосфолипиды.
В качестве усилителя для настоящего изобретения проверялся один гликозид-октилглюкопиранозид, и обнаружено, что он обладает некоторыми свойствами усиления поглощения. Можно также ожидать, что другие алкилгликозиды, такие как тиоглюкопиранозиды и мальтопиранозиды, также обнаружат свойства усиления поглощения в способах настоящего изобретения.
Циклодекстрины и их производные эффективно усиливают назальное поглощение инсулина и могут подобным образом функционировать в легких. В способе настоящего изобретения проверен диметил β- циклодекстрин, и обнаружено, что он обладает эффектом усиления поглощения.
Другими потенциально пригодными поверхностно-активными веществами являются салицилат натрия, 5-метоксисалицилат натрия и поверхностно-активные вещества, встречающиеся в природе, такие как соли глицирризиновой кислоты, гликозиды-сапонины и ацилкарнитины.
Для ионных усилителей (например, анионогенных поверхностно-активных веществ, описанных выше) природа контриона может быть важной. Конкретный выбранный контрион может влиять на свойства порошка, растворимость, устойчивость, гигроскопичность и локальную и/или системную токсичность усилителя или любой формулировки, содержащей усилитель. Он также может действовать на устойчивость и/или растворимость инсулина, с которым его соединяют. Вообще, ожидается, что одновалентные катионы металлов, таких как натрий, калий, литий, рубидий и цезий, будут пригодны в качестве контрионов для анионогенных усилителей. Аммиак и органические амины образуют другой класс катионов, которые, как ожидается, являются подходящими для применения с анионогенными усилителями, содержащими составную часть карбоновой кислоты. Примеры таких органических аминов включают этаноламин, диэтаноламин, триэтаноламин, 2-амино-2-метилэтиламин, бетаины, этилендиамин, N,N-дибензилэтилентетраамин, аргинин, гексаметилентетраамин, гистидин, N-метилпиперидин, лизин, пиперазин, спермидин, спермин и трис(гидроксиметил)аминометан.
Так как эффективное усиление поглощения инсулина в легких наблюдалось для многих испытанных усилителей, ожидается, что еще будет обнаружено много других, которые также будут функционировать подобным образом. Микросферы крахмала эффективно усиливают биодоступность инсулина, доставленного через назальные мембраны, и они проверены в качестве усилителя в способах настоящего изобретения. Хотя доказано, что они являются малопригодными для доставки легочным путем на используемых здесь животных моделях, думается, что это произошло, главным образом, вследствие технических трудностей, и если эти трудности преодолеть, можно прийти к успешной доставке легочным путем. Хелаторы представляют собой класс усилителей, которые, как полагают, действуют посредством связывания ионов кальция. Так как ионы кальция способствуют сохранению размеров пространства между клетками и, кроме того, уменьшают растворимость инсулина, связывание этих ионов теоретически как увеличивало бы растворимость инсулина, так и увеличивало бы парацеллюлярную проникающую способность инсулина. Хотя обнаружено, что один испытанный хелатобразующий агент - натриевая соль этилендиаминтетрауксусной кислоты (ЭДТК) - является неэффективным для усиления поглощения инсулина на экспериментальной крысиной модели, может оказаться, что другие связывающие ионы кальция хелатообразователи будут более пригодными.
Вообще, желательно сохранять отношение инсулина к усилителю как можно более высоким в пределах интервала, который допускает быстрое и эффективное усиление поглощения инсулина. Это важно, чтобы свести к минимуму риск побочных эффектов, как локальных, так и системных, которые могут быть присущи усилителю. Оптимальное соотношение инсулина и усилителя может быть установлено для данного усилителя путем проверки различных пропорций на моделях in vitro, так, как описано здесь. Например, инсулин может быть соединен с капринатом натрия в следующих массовых пропорциях: 50/50, 75/25, 82,5/17,5 и 90/10. Значительное улучшение поглощения инсулина получают с 50% и 25% каприната натрия: 10% дают незначительное улучшение поглощения, и результаты с 17,5% являются промежуточными. Это указывает, что наименьшая эффективная концентрация каприната натрия для применения в способах настоящего изобретения составляет приблизительно 15-25% и, возможно, 20-25%. Другие усилители могут иметь более высокие или низкие оптимальные концентрации относительно инсулина, и, следовательно, каждый отдельный усилитель должен быть испытан отдельно. Однако на основании вышеупомянутых результатов ожидается, что оптимальное количество усилителя такого, как поверхностно-активное вещество, будет, вообще, находиться в пределах - 10-50% от смеси инсулина с усилителем, например, 15-50%, так же как 25-50%. Следует отметить, что вышеупомянутые соотношения представляют количество усилителя только относительно инсулина и не принимают в расчет какой-либо носитель или другую добавку, которая может быть включена, например, для улучшения порошковых свойств формулировки.
Количество абсорбируемого инсулина по настоящему изобретению может быть существенно выше, чем количество, абсорбируемое в отсутствие усилителя. В приведенном здесь примере 4 показывается, что терапевтический препарат по настоящему изобретению при ингаляции обнаруживает биодоступность, в три раза превышающую биодоступность при ингаляции препарата из одного инсулина.
Предпочтительно, количество инсулина, абсорбируемого по настоящему изобретению, существенно (p < 0,05) выше, чем количество, абсорбируемое в отсутствие усилителя.
Как указывается здесь выше, дополнительные вещества, обычно включаемые в терапевтические препараты, такие как фармацевтически приемлемые носители, могут включаться в терапевтический препарат настоящего изобретения. Дополнительные вещества могут включаться, например, для того, чтобы разбавить порошок до количества, которое является подходящим для доставки из конкретного порошкового ингалятора; для облегчения переработки препарата; для улучшения порошковых свойств препарата; для повышения стабильности препарата, например, с помощью антиоксидантов или регулирующих pH соединений, или для придания вкуса препарату. Никакая добавка не должна оказывать вредного воздействия на устойчивость инсулина или усилителя поглощения или неблагоприятно влиять на поглощение инсулина. Она должна быть стабильной, негигроскопичной, иметь хорошие порошковые свойства и не оказывать вредного действия на дыхательные пути. В качестве примеров возможных добавок можно упомянуть моно-, ди- и полисахариды, спирты-сахара и другие полиолы, такие как, например, лактоза, глюкоза, рафиноза, мелецитоза, лактит, мальтит, трегалоза, сахароза, маннит и крахмал. Так как редуцирующие сахара, такие как лактоза и глюкоза, имеют склонность образовывать комплексы с белками, предпочтительными добавками для применения в настоящем изобретении могут быть нередуцирующие сахара, такие как рафиноза, мелецитоза, лактит, мальтит, трегалоза, сахароза, маннит и крахмал. В зависимости от ингалятора, который применяют, общее количество таких добавок может изменяться в очень и очень широких пределах. В некоторых случаях требуется небольшое количество добавок или вовсе не требуется, в то время как, например, в случае ингалятора, требующего для работы больших объемов порошка, очень высокий процент терапевтического препарата может состоять из добавок. Нужное количество добавок будет легко определяться специалистом в этой области техники в соответствии с конкретным случаем.
Подходящим механизмом для доставки порошка в легкие пациента является портативный ингалятор, пригодный для ингаляции сухого порошка. На рынке имеется много таких приборов, предназначенных, как правило, для доставки антиастматических и противовоспалительных средств в дыхательную систему. Предпочтительным прибором является ингалятор для сухого порошка, конструкция которого предусматривает защиту порошка от влаги и в которой отсутствует риск подачи случайных больших доз; кроме того, по возможности, желательна защита порошка от света; высокая распыляемая фракция и высокое осаждение в легких в широком интервале скоростей потока; низкие отклонения дозы и распыляемой фракции; низкая задержка порошка в наконечнике; низкая адсорбция на поверхностях ингалятора; гибкость величины дозы и низкое сопротивление ингаляции. Ингалятор, предпочтительно, является однодозовым ингалятором, хотя могут также использоваться многодозовые ингаляторы, предпочтительно, такие как многодозовый, приводимый в действие дыханием ингалятор многократного использования для сухого порошка. Предпочтительно, используемый ингалятор является однодозовым, приводимым в действие дыханием ингалятором однократного применения для сухого порошка.
Описанный порошкообразный препарат может быть изготовлен несколькими способами с применением обычных технических приемов. В некоторый момент процесса может понадобиться тонко измельчить активные соединения и, при подходящем случае (т. е. когда не подразумевается упорядоченная смесь), какой-либо носитель в подходящей мельнице, например, в стройной мельнице, чтобы получить первичные частицы размера, находящегося в интервале, подходящем для максимального осаждения в нижних дыхательных путях (т.е. до 10 мкм). Например, можно смешать в сухом состоянии инсулин и порошки усилителей и носитель, при соответствующем случае, и затем тонко измельчить эти вещества вместе; с другой стороны, вещества могут быть измельчены по отдельности и затем смешаны. Когда соединения, которые смешивают, имеют различные физические свойства, такие как твердость и хрупкость, сопротивление тонкому измельчению изменяется, и они могут потребовать различного давления для разрушения до частиц подходящего размера. Поэтому, когда вещества измельчают вместе, полученный размер частиц одного из компонентов может оказаться неудовлетворительным. В таком случае будет выгодно измельчать разные компоненты отдельно и затем их смешивать.
Также можно сначала растворить компоненты, в том числе, когда не подразумевается готовая к употреблению смесь, носитель, в подходящем растворителе, например, в воде, чтобы получить смешение на молекулярном уровне. Такая процедура также позволяет регулировать величину pH на желательном уровне. Известно, что на назальное поглощение инсулина влияет величина pH препарата и абсорбция увеличивается при сдвиге либо вверх, либо вниз от изоэлектрической точки инсулина, которая находится около 5,5. Однако при pH существенно выше или ниже 5,5 инсулин может быть менее устойчивым, и, кроме того, должны быть приняты в расчет фармацевтические принятые пределы для продуктов ингаляции - от pH 3,0 до 8,5, так как продукта с pH вне этих пределов могут вызывать раздражение и сокращение дыхательных путей. Чтобы получить порошок, растворитель должен быть удален способом, который сохраняет биологическую активность инсулина. Подходящие способы сушки включают концентрацию в вакууме, открытую сушку, распылительную сушку и сушку вымораживанием. Следует избегать температур свыше 40oC при времени воздействия более нескольких минут, так как может происходить некоторое разрушение инсулина. После стадии сушки твердый материал, при необходимости, может быть измельчен до получения крупного порошка, и затем, при необходимости, тонко измельчен.
Если желательно, тонкоизмельченный порошок перед введением его в предназначенный для ингаляции прибор может быть переработан для улучшения свойств текучести, например, сухой грануляцией, с образованием сферических агломератов с превосходными эксплуатационными характеристиками. В таком случае прибор должен иметь такую форму, которая гарантирует, что агломераты, по существу, дезагломерируются прежде, чем покинут прибор, так что частицы, входящие в дыхательные пути пациента, по большей части, имеют размер в пределах желательного интервала.
Когда желательно получить готовую к употреблению смесь, активное соединение может быть переработано, например, в микронайзере, чтобы получить, если желательно, частицы с определенным интервалом размеров. Носитель также может быть переработан, чтобы получить, например, нужный размер и нужные поверхностные свойства, такие как отношение площади поверхности к массе, или определенную шероховатость, и обеспечить оптимальные силы адгезии в готовой к употреблению смеси. Такие физические требования к готовой к употреблению смеси хорошо известны, как и известны различные способы получения готовой к употреблению смеси, которая удовлетворяет упомянутым требованиям, и могут быть легко установлены специалистом в этой области техники в соответствии с конкретными условиями.
Изобретение описывается посредством примеров, которые предназначаются для иллюстрации, но не ограничивают объема изобретения.
Примеры
Пример для сравнения
Терапевтический препарат инсулина без усилителя
В химический стакан добавляют полусинтетический инсулин человека (Diosynth, 0,8 г) и воду (150 мл). Понижают pH
до 3,4 1 M HCl, а затем pH поднимают до 7,4 1 M NaOH, чтобы растворить инсулин.
Добавляют лактозу (доступную коммерчески, 9,2 г) и снова доводят pH до 7,4. Раствор перемешивают до прозрачного состояния или до состояния легкой опалесценции и концентрируют упариванием при температуре 37oC в течение двух суток.
Полученный твердый спекшийся материал дробят и просеивают через сито 0,5 мм, полученный в результате порошок измельчают на струйной мельнице до частиц размером около 2 мкм.
Пример 1
Терапевтический препарат
инсулина и каприната натрия, соотношение 75:25
В химический стакан добавляют полусинтетический инсулин человека (9,75 г) и воду (250 мл). Чтобы растворить инсулин, понижают pH до 3,4 1 M HCl,
а затем поднимают pH до 7,4 1 M NaOH.
Добавляют капринат натрия (Sigma, 3,25 г) и снова доводят pH до 7,4. Раствор перемешивают, пока он не станет прозрачным или слегка опалесцирующим, и концентрируют путем упаривания при 37oC в течение двух суток.
Полученный твердый спекшийся материал дробят и просеивают через сито 0,5 мм, полученный в результате порошок измельчают на струйной мельнице до частиц диаметром около 2 мкм.
Пример 2
Терапевтический препарат инсулина и каприната натрия с лактозой, соотношение 50:25:25
Растворяют в воде (150 мл) полусинтетический инсулин человека (7,5 г), как в примере 1. Добавляют капринат натрия (3,75 г) и лактозу (3,75 г) и выполняют процедуру примера 1, чтобы получить порошок,
состоящий, в основном, из частиц диаметром около 2 мкм.
Пример 3
Терапевтический препарат инсулина и каприната натрия с лактозой, соотношение 4:4:92
Осуществляют
процедуру примера 2, используя 0,5 г полусинтетического инсулина человека, 150 мл воды, 0,5 г каприната натрия и 11,5 г лактозы.
Исследования ингаляции
Исследование 1
Используют препарат примера 1 для исследования ингаляции на двух собаках. Препарат загружают в аппарат для ингаляции Wright Dust Feed и вводят собакам. Уровень дозировки составляет IU/кг (IU = одной
единице инсулина человека = 35 мкг инсулина человека, 100%). Измеряют показатели глюкозы в крови и инсулина в плазме через различные промежутки времени и результаты суммируют в таблицах 1 и 2.
Таблицы показывают, что формулировка инсулина с капринатом натрия заметно увеличивает уровень инсулина в плазме и снижает содержание глюкозы в крови. Максимальный показатель для инсулина в плазме и минимальный показатель для глюкозы в крови достигаются приблизительно через 15 и 60 минут, соответственно.
Исследование 2
Каждый из препаратов примера для сравнения и
примера 1 вводят четырем или пяти собакам с помощью аппарата для ингаляции Wright Dust Feed при постоянном уровне дозировки IU/кг. Определяют действие каждой формулировки на содержание инсулина в
плазме и глюкозы в крови через различные промежутки времени и результаты демонстрируют на фиг. 1 и 2. Обнаружено, что в то время как контрольная формулировка, не содержащая усилителя, по существу, не
изменяет содержания инсулина в плазме, формулировка, содержащая как инсулин, так и усилитель, увеличивает содержание инсулина в плазме от 20 мк U/мл в нулевой момент времени до 80 мк U/мл через 15 мин
после ингаляции порошка. Подобным образом, у контрольных животных зарегистрировано максимальное падение содержания глюкозы в крови порядка 0,5 ммоль/л после ингаляции инсулина без усилителя, в то
время как у животных, которым дается ингаляция инсулина с добавлением усилителя, регистрируют временное падение порядка 1,7 ммоль/л - от 4,0 ммоль/л до 2,3 ммоль/л. Таким образом, инсулин в сочетании
с усилителем - капринатом натрия быстро поглощается и выводится из большого круга кровообращения с соответствующим временным снижением содержания глюкозы в крови. И напротив, инсулин с носителем
(лактоза), но без усилителя поглощается, как можно обнаружить, только в очень небольшой степени (p = 0,0002 для инсулина с капринатом против инсулина с лактозой).
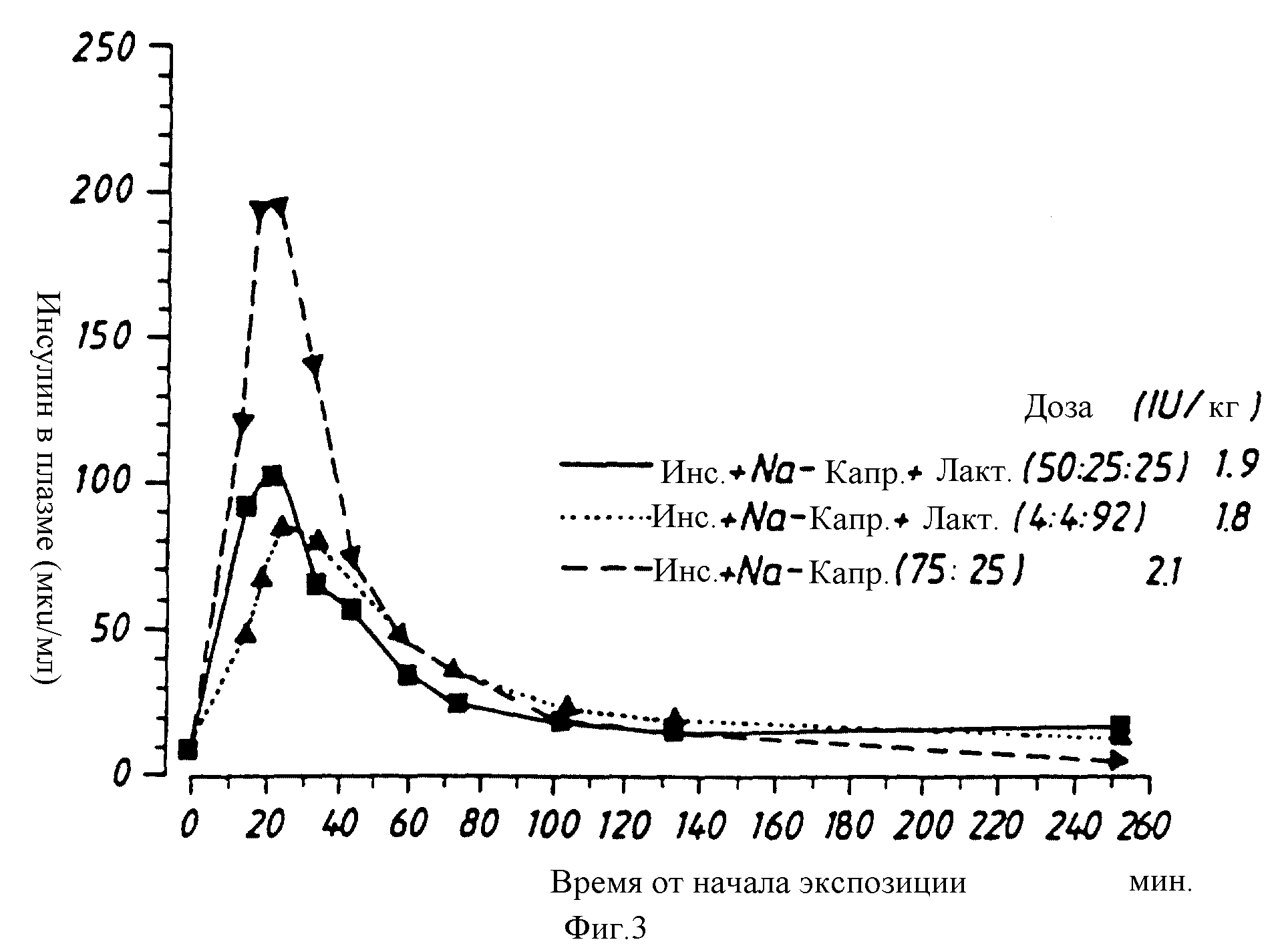
Исследование 3
Каждый из препаратов примеров 1-3 испытывают при различных уровнях дозировки на двух собаках. Введение препаратов осуществляют с помощью аппарата для ингаляции Wright Dust Feed. Через различные
промежутки времени после ингаляции измеряют содержание инсулина в плазме и глюкозы в крови. Результаты приводятся на фиг. 3-6 и показывают, что инсулин в сочетании с капринатом натрия при различных
соотношениях поглощается быстро и что максимальные величины получают через 20-30 минут, в сопровождении соответствующего падения содержания глюкозы в крови. Результаты также показывают, что при
ингаляции порошка инсулина может быть получен плазменный профиль, который больше похож на естественный физиологический профиль, чем профиль, получаемый после подкожной инъекции инсулина.
Пример 4
Инсулин и капринат натрия 75:25, смешение тонкоизмельченных порошков
Биосинтетический инсулин человека (53 г) измельчают на струйной мельнице Airfilco Jet Mill
(торговая марка Airfilco Process Plant Ltd.) под давлением азота (давление подачи 7 бар, давление в камере 5 бар) до основного среднего диаметра частиц 2,4 мкм.
Капринат натрия (170 г) измельчают на струйной мельнице Airfilco Jet Mill (ТМ) под давлением азота (давление подачи 5 бар, давление в камере 3 бара) до основного среднего диаметра частиц 1,6 мкм.
Тонкоизмельченные биосинтетический инсулин человека (45 г) и капринат натрия (14,26 г) смешивают сухим способом в соответствии со следующей процедурой. Половину инсулина загружают в смесительную установку, содержащую смесительную камеру объемом 4,4 л, разделенную ситом с размером ячеек 1 мм на два отделения с металлическим кольцом в каждом отделении, чтобы способствовать смешению и перемешиванию. Добавляют капринат натрия и всю оставшуюся часть инсулина. Смесительную камеру закрывают, переворачивают на 180 градусов и закрепляют в моторизованном устройстве для встряхивания. Включают двигатель и продолжают встряхивание приблизительно в течение двух минут до тех пор, пока инсулин и капринат натрия не пройдут через сито. Двигатель выключают и смесительную камеру переворачивают на 180 градусов, снова закрепляют на устройстве для встряхивания и снова осуществляют встряхивание до тех пор, пока весь порошок не пройдет через сито. Эту процедуру повторяют еще восемь раз, чтобы общее время встряхивания составляло приблизительно 20 мин.
Полученный таким образом препарат вводят путем ингаляции 5 собакам, используя аппарат для ингаляции Wright Dust Feed, при уровне дозировки IU/кг, и через различные промежутки времени после ингаляции определяют содержание инсулина в плазме.
Полученные результаты сравнивают с содержанием инсулина в плазме при введении пяти собакам таким же способом и при таких же уровнях дозировки биосинтетического инсулина, измельченного так, как описано выше, до основного среднего размера частиц 2,4 мкм, и с содержанием инсулина в плазме, полученным при введении пяти собакам тем же способом и при тех же уровнях дозировки, что описаны выше, терапевтического препарата инсулина и каприната натрия при соотношении 90:10. В этом случае терапевтический препарат готовят следующим образом. Полусинтетический инсулин человека подвергают гель-фильтрации для уменьшения содержания цинка от 0,52% до 0,01% относительно содержания инсулина. Инсулин (4,5 г) и капринат натрия (0,5 г) растворяют в воде (232 мл). Раствор перемешивают, пока он не станет прозрачным, и доводят pH до 7,0. Раствор концентрируют упариванием при 37oC в течение двух суток. Полученный твердый спекшийся материал дробят и просеивают через сито 0,5 мм, полученный в результате порошок измельчают на струйной мельнице до частиц со средним основным диаметром 3,1 мкм.
Результаты этого сравнения приводятся на фиг. 9. Результаты демонстрируют некоторое улучшение биодоступности инсулина для формулировки 90:10 и эффективное улучшение биодоступности инсулина для препарата 75:25 по настоящему изобретению при сравнении с одним инсулином (p = 0,0147 для различия между 75:25 и 100:0).
Пример 5
Выбор усилителей
Каждое из соединений, перечисленных в табл. 3, проверяют на крысиной модели на его способность усиливать поглощение инсулина и таким образом влиять на
уровень глюкозы в крови, используют различные формы инсулина: рекомбинантный или полусинтетический инсулин человека или быка. Каждый состав готовят так, как описано выше в примерах 1-3, высушивая и
обрабатывая раствор инсулина с усилителем, чтобы получить порошок, который можно вдыхать.
Порошок вводят крысам посредством ингаляции и затем контролируют уровень глюкозы в крови у крыс. Эти уровни сравнивают с соответствующими значениями, полученными для крыс, которым вводят ингаляцией формулировки инсулина без усилителя.
Пример 6
Выбор усилителей
Чтобы оценить способность различных соединений - усилителей промотировать перенос инсулина и других маркеров через монослой эпителиальных клеток, проводят стандартные испытания in vitro,
используя линию эпителиальных клеток CaCO-2 (доступную от American Type Culture Collection (АТСС), Rockville, MD, США) в качестве модели слоя эпителиальных клеток, который функционирует в легком,
отделяя альвеолы от легочного кровоснабжения. При этих испытаниях усилитель и инсулин или другой маркер растворяют в водном растворе при различных соотношениях и концентрациях и наносят на апикальную
сторону клеточного монослоя. После инкубации в течение 60 мин при 37oC и 95% RH (относительная влажность) определяют количество маркера на базолатеральной стороне клеток, например, применяя
маркер, помеченный радиоактивными изотопами. Для определенного усилителя (каприната натрия), проверяемого в экспериментах, представленных на фиг. 5 и 6, количество маркера (маннит, мм 360), которое
оказывается на базолатеральной стороне, зависит от концентрации используемого усилителя по крайней мере до 16 мМ каприната натрия (фиг. 7). Это справедливо даже тогда, когда к смеси усилителя с
маннитом добавляют инсулин (капринат натрия : инсулин = 1:3 по массе) (фиг. 8). Также обнаружено, что эта концентрация каприната натрия (16 мМ) промотирует абсорбцию инсулина через клеточный монослой.
Количество инсулина, которое проходит через монослой в присутствии 16 мМ каприната натрия, удваивается по сравнению с количеством инсулина в отсутствие какого-либо усилителя. Ожидается, что при более
высоких концентрациях каприната натрия проницаемость клеток будет еще более возрастать; однако возможная цитотоксичность каприната натрия может воспрепятствовать применению существенно более высоких
концентраций этого конкретного усилителя.
Такая модель in vitro проницаемости эпителиальных клеток может быть использована в качестве инструмента проверки для быстрого тестирования нужного усилителя на пригодность в способах настоящего изобретения.
Реферат
Использование: в медицине для лечения сахарного диабета. Терапевтический препарат содержит инсулин и вещество, усиливающее поглощение его в нижних дыхательных путях. Он выполнен в форме сухого порошка, пригодного для ингаляции. Порошок содержит по меньшей мере 50 мас.% инсулина и вещества, усиливающего его поглощение, в виде частиц с диаметром до 10 мкм или агломератов таких частиц. Порошок может дополнительно содержать фармацевтически приемлемый носитель. Инсулином может быть инсулин быка, свиньи, биосинтетический или полусинтетический инсулин человека или биологически активное производное инсулина человека. Вещество, усиливающее поглощение инсулина в нижних дыхательных путях - поверхностно-активное вещество, соль желчи, производное соли желчи, натриевая соль уросодезоксихолата, таурохолата, гликохолата, тауродигидрофузидата, фосфолипид, алкилгликозид и др. Препарат может находиться в устройстве для ингаляции. Способ получения препарата: получают раствор инсулина с веществом, усиливающим его поглощение в нижних дыхательных путях, растворитель удаляют и получают порошок. Порошок состоит по меньшей мере на 50% из частиц с диаметром до 10 мкм. Может быть получен твердый продукт, который затем измельчают и/или перемешивают до получения указанного порошка. 2-й вариант способа. Смешивают сухой инсулин с сухим веществом, усиливающим его поглощение. Получают порошок, который по меньшей мере на 50% состоит из частиц с диаметром до 30 мкм. Может быть получена сначала смесь, которую затем измельчают и/или перемешивают до получения указанного порошка. Перемешивание может быть осуществлено в присутствии носителя. Изобретение позволяет уменьшить неудобства и дискомфорт при лечении больных препаратами инсулина. 3 с. и 38 з.п. ф-лы, 9 ил., 3 табл.

Формула
24.06.93 по пп.1 - 34;
04.02.94 по пп.35 - 41.

Комментарии