Фармацевтическая композиция для лечения воспалительных заболеваний или заболеваний, связанных с обструкцией дыхательных путей - RU2098122C1
Код документа: RU2098122C1
Чертежи


Описание
Изобретение касается нового фармацевтического применения новых лекарственных препаратов, включающих циклоспорин в несольватированной форме, представленной орторомбическими кристаллами, кроме того, изобретение относится к новому виду кристаллического циклоспорина и новейшим лекарственным средствам, в состав которых входит циклоспорин.
Циклоспорин, известный также как циклоспорин A является
лекарственным
соединением с формулой

Циклоспорин известен и зарегистрирован под твердым знаком SANDIMMUNR или SANDIMMUNER.
В твердом состоянии циклоспорин существует как в аморфной, так и кристаллической формах. Имеются разные модификации кристаллической формы этого препарата. Первый аспект изобретения касается кристаллической формы циклоспорина, обозначенной "CY-A/X-III", CY-A/X-III/, используемый в данном описании и прилагаемой формуле изобретения, подразумевает циклоспорин в несольватированной орторомбической (P212121) кристаллической форме.
CY-A/X-III и способ его получения описаны и заявлены в патентной публикации GB под N 2211848 (A) (Заявка N 88 295563, дата представления 19 декабря 1988, дата публикации 12 июля 1989) и в широко известных в мире эквивалентах, включая, например, заявку на патент Новой Зеландии под N 227384.
Как показано в публикации о K патенте, размеры кристаллической решетки CY-A/X-III составляют: a 12,7



CY-A/X-III обладает следующими характеристиками дифракции рассеивающихся рентгеновских лучей, полученными при помощи Guinier Dewolff II камеры, с использованием CuKd излучения, λ 1,542

Согласно данным об указанной патентной публикации Великобритании циклоспорин используется или предлагался для использования в клинике в качестве иммуносупрессивных агентов для обработки реципиентов органных трансплантатов и для лечения различных аутоиммунных заболеваний. Другие аспекты исследований касались возможного использования циклоспорина как антипаразитического агента, для нормализации опухолевой резистентности к химиотерапии, например, к цитостатическим лекарственным препаратам, а также для стимуляции роста волос.
По последним данным, циклоспорин эффективен в лечении обструктивных и воспалительных заболеваний дыхательных путей, особенно астмы. Ранее были начаты клинические испытания орального применения циклоспорина для лечения астматиков, особенно тех, которые резистентны или наоборот, чувствительны к стероидной терапии астмы, в настоящее время о результатах этих исследований сообщается в литературе: см. например, Checklik et al, Allergy, 46 Art 072, (1991), Alexander et al. hancet 339 (Feb. 8 1992), 324, и далее цитируемую литературу.
В литературе появились также сообщения о применении циклоспорина в экспериментальных работах, в частности, исследованиях по трансплантации легких на животных моделях: см. например, Dowhing et al. Surgery (St. houis) 108, (2), 198 205 (1990); Zenati et al. J. Heat Trasplant 9, (1), (4/Pt2); A. 267 (1989); Burckart et al. J. Clin. Pharmacol. 29, (9), 860 (1989).
Были также представлены данные о подавлении эозинофильной инфильтрации дыхательных путей в результате легочного применения микронизированной формы циклоспорина у экспериментальных животных моделях астмы: см. например, Boufeckeur et al. Eur. J. Pharmacol. 183 (4), 1187 1188 (1990).
В соответствии с методами вышеупомянутой публикации патента под N 2211848, CY-A/X-III предлагается для использования в качестве активной составной части в галеновых препаратах, содержащих циклоспорин. Предлагаемые специфические препараты включают местнодействующие лекарства для кожного и глазного применения, а также инъецируемые формы для внутривенных вливаний, внутрираневых инъекций (например, лечения воспалительного или аутоиммунного заболевания суставов, например, ревматоидного артрита). Галеновые препараты также рекомендуются для внутреннего применения.
Один из аспектов изобретения основан на данных, согласно которым CY-A/X-III оказался поразительно и неожиданно эффективным при его применении легочным путем.
Мы уже сообщали, как об известном факте, использовании орально вводимого циклоспорина для лечения заболеваний дыхательных путей, например, астмы. Оральное применение циклоспорина, однако, при его использовании в терапии легочной болезни, например, астмы имеет явные недостатки. Циклоспорин является сильнодействующим иммуносупрессивным лекарственным препаратом, и поступление его в кровь может привести к общему понижению иммунной реактивности организма. Такого рода эффект весьма нежелателен, особенно у лиц, болезнь которых, как, например, у астматиков, может ускориться или осложниться инфекцией, например, инфекцией дыхательных путей. Кроме того, оральное введение циклоспорина обуславливает известный риск нежелательных системных побочных эффектов, например, дисфункции почек, развивающейся вследствие длительного употребления препарата.
Для преодоления указанных трудностей был бы нежелателен и целесообразен метод местного применения препарата, т.е. непосредственное его введение в дыхательные пути или легкие, предупреждая, насколько возможно, его всасывание в кровь. Однако при местном применении циклоспорина в дыхательных путях и легких возникает целый ряд проблем.
Первая из этих проблем это то, что циклоспорин является высоко гидрофобным соединением, и среда-носитель, обычно применяемая для получения галенового препарата циклоспорина, как, например, растительные масла или им подобные вещества, не подходит для ингаляционной формы лекарства. Вторая проблема связана со свойством любой дыхательной системы, заключающемся в том, что основная часть вводимого лекарственного препарата не поступает в дыхательные пути и легкие, а задерживается в полости рта или на поверхности глотки и затем поступает в желудок. Эта проблема особенно остро встает у больных с недостаточной функцией легких, как, например, у астматиков. Контрольные исследования показали, что при введении таким больным сухих веществ путем ингаляции, большая часть вводимого лекарства (80% и более) поступает в желудочно-кишечный тракт. Таким образом, сохраняется риск постоянного всасывания в кровь и побочных эффектов вследствие введения циклоспорина непосредственно в легкие. И, наконец, третья проблема заключается в обеспечении такой лекарственной формы, которая была бы эффективна в лечении данной болезни, включая дыхательные пути и легкие, т.е. которая была бы активна в месте поражения.
Согласно изобретению, обнаружен поразительный факт, заключающийся в том, что CY-A/X-III обеспечивает средство для непосредственного поступления циклоспорина в дыхательные пути и легкие, благодаря которому можно избежать указанные выше трудности и получить благоприятный эффект и выгоду от применения данного препарата.
Специфически, CY-A/X-III представляет циклоспорин в форме по существу, адаптированныой или адаптируемой к непосредственному введению в легкие, и которая высокоэффективна в лечении заболеваний или других неблагоприятных состояний легких или дыхательных путей в смысле силы и продолжительности действия. Определенно, CY-A/X-III обеспечивает такую лекарственную форму циклоспорина, которая оказывается неожиданно более пригодной для введения в легкие и распределения по их поверхности по сравнению с другими формами Циклоспорина. Еще более поразительный факт заключается в том, что использование CY-A/X-III для введения в легкие снижает риск всасывания в кровеносную систему и соответствующих побочных эффектов вследствие, например, неизбежного или случайного поступления в кровь в результате проглатывания препарата, по сравнению с использованием циклоспорина в виде других лекарственных форм.
Новым является легочный способ применения CY-A/X-III, а также лечение заболеваний и неблагоприятных состояний легких и дыхательных путей посредством
введения CY-A/X-III в легкие.
Изобретение, естественно, обеспечивает:
A1 Метод введения циклоспорина легочным путем, который отличается тем, что CY-A/X-III вводится в легкие;
A2 Метод
эффективной циклоспориновой терапии для лечения любого заболевания или неблагоприятного состояния дыхательных путей и легких, требующих такой терапии, которая включает
легочное применение CY-A/X-III;
или, в качестве альтернативы,
A3 CY-A/X-III для использования в получении лекарственного препарата для легочного пути введения.
Изобретение, отличается легочным применением CY-A/X-III, т.е. введением CY-A/X-III через дыхательные пути, путем ингаляции. Тем самым CY-A/X-III поступает в дыхательные пути и легкие, что обеспечивает местное применение препарата, ограниченное дыхательными путями и легкими.
Изобретение обеспечивает способ эффективной циклоспориновой терапии дыхательных путей и легких. Изобретение может быть использовано для лечения всех лиц, которые в нем нуждаются, т.е. которым такой тип лечения рекомендуется или показан. Изобретение может быть использовано в терапии любого заболевания или неблагоприятного состояния дыхательных путей и легких, которые чувствительны к циклоспориновой терапии или при которых лечение циклоспорином рекомендуется или показано, включая паразитарные и/или грибковые болезни, такие как кокцидиомикоз, а также нормализацию опухолевой резистентности к химиотерапевтическим лекарственным препаратам.
В частности, изобретение может быть использовано в лечении любого заболевания или нарушения дыхательных путей и легких, требующих терапии с применением иммуносупрессивных или противовоспалительных агентов. Например, сюда относятся аутоиммунные или воспалительные болезни легких, в частности, воспаление легких, аутоиммунным компонентом в его этиологии. К ним же можно отнести саркоидоз и интерстициальный фиброз легких. Метод изобретения можно также использовать для поддержания легочного трансплантата или для больных с пересадкой комплекса сердце-легкие.
Однако, наибольшее применение изобретение может найти в лечении воспалительных и обструктивных заболеваний дыхательных путей и легких, для которых характерны воспалительные процессы сопровождающиеся накоплением эозинофилов и нейтрофилов, как, например, астмы и бронхитов.
Изобретение рекомендуется для лечения астмы любого типа или генеза. Его можно использовать как в случае эндогенной астмы, так и при экзогенной форме заболевания, что особенно желательно. Препарат изобретения применяется, в частности, в терапии аллергической или атонической (т.е. IgE-опосредованной) астмы, а также неатопической астмы, как, например, бронхиальной астмы, астмы, обусловленной физическими упражнениями, профессиональной астмы, формы астмы, вызванной бактериальной инфекцией и других форм астмы, не связанных с аллергическими факторами. Необходимо отметить, что лечение астмы охватывает широкий контингент лиц, включая, например, детей младше 4 5 лет, у которых отмечается затруднительное дыхание, особенно ночью и, которые диагностируются как "астмоидные дети". Эта категория имеет важное место социальное значение и в настоящее время идентифицируется как астматики начальной или ранней стадии. В последнее время данное астматическое состояние обычно относится к "астмоидному синдрому детей".
В специфическом случае изобретение относится к терапии астмы любого типа или генеза, как указано выше, у больных, астматический статус которых зависим или резистентен в отношении стероидов.
Изобретение также используется для лечения бронхитов, и особенно связанных с ними хронических и острых обструктивных процессов в бронхах. В этом отношении, изобретение можно применять в терапии бронхитов любого типа или генеза, включая, например, острые бронхиты, арахидальные бронхиты, катаральные бронхиты, хронические бронхиты, крупозные бронхиты, паралитические бронхиты и т.д.
Изобретение можно использовать для лечения пневмокониоза (обычно, профессиональное заболевание легких воспалительного характера, часто сопровождающееся обструктивными процессами в дыхательных путях, хроническое или острое, вызываемое повторным вдыханием пыли) любого типа или генеза, включая, например, алюминоз, антракоз, асбестоз, халикоз, птилоз, сидероз, силикоз, хроническое отравление табаком и пневмокониоз от вдыхания хлопковой пыли.
Изобретение можно также применять в терапии связанных с эозонофилами поражений дыхательных путей (например, включающих патогенную инфильтрацию эозонофилами легочной ткани). Сюда относятся гиперэозинофилия, поскольку она поражает дыхательные пути и легкие, а также связанные с эозинофилами поражения дыхательных путей, являющиеся следствием или сопутствующими заболеваниями синдрома Лефлера, эозинофильная пневмония, паразитарная (в частности, многоклеточные организмы) инвазия (включая тропическую эозинофилию), бронхо-легочный аспергиллоз, нодозный полиартериит (включая синдром Чарг-Штрауса) и связанные с эозинофилами заболевания дыхательных путей, обусловленные реакцией на лекарства.
В соответствующих случаях, как, например, в случае лечения воспалительных и обструктивных процессов заболеваний дыхательных путей, данное изобретение необходимо рассматривать как относящееся к симптоматическим и профилактическим способам терапии, т.е. может быть использовано как в лечении симптомов болезни, например, воспаления, поскольку они присутствуют (симптоматическая терапия), так и в предупреждающем лечении с целью профилактики или нормализации симптомов заболевания, а также для ограничения продолжительности указанных симптомов (профилактическая терапия). Термин "лечение", используемый в данном описании и в формуле изобретения, подразумевает как симптоматическую, так и профилактическую терапию, например, в случае астмы, симптоматическое лечение применяется с целью нормализации острых воспалительных процессов и связанного с ними бронхиального пароксизма, а профилактическое лечение провозится для сокращения длительности воспаления и для облегчения будущего пароксизма.
Согласно изобретению, циклоспорин применяется в качестве CY-A/X-III. При практическом применении изобретения весь или почти весь вводимый циклоспорин, например, по крайней мере, 75% желательно 85 или 90% наиболее предпочтительно 95% и более циклоспорина, будет использоваться в качестве CY-A/X-III.
В практике использования изобретения CY-A/X-III вводится легочным путем, например, путем ингаляции с применением специального распределительного устройства (ингалятора).
Для этой цели, CY-A/X-III можно применять в любой подходящей или соответственно, тонко измельченной форме, годной для введения легочным путем, т. е. через дыхательные пути и легкие. Препарат может вводиться путем вдыхания через рот, например, в виде мелких сухих частиц, или в виде частиц, которые диспергированы или распределены в соответствующем жидком или твердом разбавителе или среде носителе (т.е. который или вводится в легкие или пригоден для легочного применения). В данной среде или разбавителе не нарушается целостность CY-A/X-III, т. е. он не подвергается разложению или превращению в какие-либо другие формы. Жидкая среда, как указывалось выше, включает летучие вещества, как, например, сжатые газы.
При применении в виде сухих частиц, CY-A/X-III используется в разведении с другим тонкоизмельченным инертным твердым носителем или разбавителем (например, глюкоза, лактоза, маннит, сорбит, рибоза, манноза, арабиноза, сахароза, галактоза, фруктоза или ксилоза), в виде покрытых частиц (с или без дополнительного инертного носителя или разбавителя, например, как было указано выше), или в любой другой форме, известной в практике применения только измельченных твердых веществ.
При введении легочным путем, CY-A/X-III удобно использовать в виде частиц со средним размером аэродинамической массы ("СРАМЧ") менее 10 мкм, желательно, менее 5 мкм, еще более предпочтительно, около 3 мкм и менее. Соответственно по крайней мере 70% желательно по крайней мере 80% еще более предпочтительно 85 90% частиц, содержащихся в препаратах CY-A/X-III в форме частиц, предназначенных для введения легочным путем, будут иметь размер менее 10 мкм, предпочтительно менее 5 мкм, еще более предпочтительно около 3 мкм и менее.
Минимальный размер частиц обычно меньше критического, хотя в норме предпочитается препарат CY-A/X-III в форме частиц со средним размером аэродинамической массы частицы менее 0,1 мкм, предпочтительно менее 0,5 мкм, более предпочтительно менее 1,0 мкм. Желательно, чтобы по крайней мере 75% предпочтительно по крайней мере 80 90% представленных частиц имели размер менее 0,1 мкм, предпочтительно, менее 0,5 мкм и более предпочтительно, менее 1,0 мкм.
Для легочного применения, CY-A/X-III характеризуется тем, что имеет средний размер аэродинамической массы частицы в пределах от 0,1 0,5 или 1,0 мкм до 10 мкм) предпочтительнее до 5 мкм. Наиболее предпочтительный средний размер аэродинамической массы частиц (СРАМЧ) находится в пределах от 1,0 до 5 мкм, например, около 3,0 мкм.
Как объясняется в дальнейшем, благодаря изобретению обнаружен поразительный факт, что препараты CY-A/X-III в форме частиц, например, подобные описанным выше, обладают прекрасными качествами для поступления их в легкие, например, в плане количества лекарственного препарата, поступающего в дыхательные пути, по сравнению с лекарственными средствами в виде частиц, включающими циклоспорин в какой-либо иной твердой форме. В этой смеси необходимо отметить, что специфические характеристики поступления в легкие в виде аэрозоля выбранного препарата CY-A/X-III, представленного материалом в виде частиц, при желании, можно изменить, используя любые известные или применяемые на практике методы, например, путем смешивания с инертными, пригодными и непригодными для вдыхания материалами, представленными частицами различного среднего размера или плотности, о чем уже сообщалось выше.
Согласно описанию в вышеуказанной публикации патента N 2211848 A, CY-A/X-III хорошо применять для получения тонко измельченных материалов, отвечающих требованиям нужного размера частиц, а также пригодных для использования в соответствии с настоящим изобретением. Эти материалы можно получить описанными здесь методами, например, методами прямой микрокристаллизации или размельчения, т.е. путем дробления, помола, ультразвука или другой микронизации исходно полученного нативного, кристаллического продукта CY-A/X-III. Однако, предпочтительно, использовать препараты CY-A/X-III, в форме частиц, полученные непосредственно при помощи методов микрокристаллизации, например, с помощью обработки ультразвуком (и, если требуется, путем отделения полученных крупных кристаллов фильтрованием, путем отделения полученных крупных кристаллов фильтрованием, например, через микрофильтр или сито), чем путем механического измельчения. Причина этого, как объясняется в вышеуказанной патентной публикации Великобритании, заключается в возможности избежать раздражения или повреждения в результате использования микрокристаллов в нативном, необработанном, неизмененном состоянии.
При желании, поверхностные свойства материала частиц CY-A/X-III можно изменить физически, например, изменить площадь поверхности частиц путем деформации или в результате других манипуляций. При использовании таких методов достигается возможность изменения свойств материала CY-A/X-III, от которых зависит поступление циклоспорина в легкие, или смачиваемости, или других характеристик материала CY-A/X-III. Эти эффекты могут быть получены, например, в результате обработки материала CY-A/X-III ультразвуком или при помощи химических методов разрушения поверхностей. Особенно интересная, специфическая форма модификации, связанная с настоящим изобретением включает трансформацию в сфероидальную форму частиц, о чем сообщается далее. Как уже ранее указывалось, материал частиц CY-A/X-III можно, при желании, подвергнуть покрытию соответствующими покрывающими агентами или смазывающими веществами с целью предупреждения или еще большего ограничения возможного раздражающего или повреждающего действия на поверхность дыхательных путей и легких.
Как сухие, так и жидкие, описанные выше галеновые препараты могут включать любые подходящие добавки или ингредиенты, известные в практике, как средства для легочного применения, например, стабилизирующие агенты, анти-оксиданты, поверхностно-активные вещества, буферные растворы, тонические регуляторы, ароматические вещества и т.д. а также пропелленты или другие вещества, способствующие лучшему распределению при ингаляции, например, помогающие распылению или размельчению, или препятствующие слипанию или склеиванию частиц.
Примеры галеновых форм, включающих CY-A/X-III, пригодных для применения в соответствии с изобретением, приводятся в разделе пример 3, представленном ниже.
Применение галеновых препаратов в соответствии с изобретением может быть эффективным при использовании любой подходящей системы, известной в практике для обеспечения поступления лекарства в сухом или жидком виде путем ингаляции, например, распылителя, размельчителя, ингалятора для сухих веществ и других, подобных им приборов. Желательно, использовать дозирующий ингалятор ("ДИ"), обеспечивающий поступление определенного количества лекарства при каждом включении. Такого типа дозирующие устройства хорошо известны в практике, к ним относятся дыхательные или индивидуальные, дозирующие ингаляторы, дозирующие ингаляторы со специальной камерой, обусловливающей уменьшение остаточных количеств препарата в верхней части глотки, а также различные дыхательные аппараты, обеспечивающие поступление сухого порошка лекарства в дыхательные органы.
Согласно сказанному ранее
изобретение также обеспечивает:
B1 Лекарственный препарат для
легочного применения, годный для введения легочным путем и включающий CY-A/X-III в качестве активного ингредиента,
B2 Лекарственный препарат согласно пункту B1, в
котором CY-A/X-III представлен в виде сухих частиц, или в виде частиц, диспергированных или распределенных в жидком или
твердой фазе или среде-носителе, пригодных для легочного применения.
Кроме того изобретение обеспечивает:
B3 Процесс получения лекарственного препарата по
вышеуказанным пунктам B1 и B2 отличающийся тем, что включает
получение CY-A/X-III, например, в соответствии с методами, описанными и заключенными в публикации патента N 2211848
(A) и в форме частиц, например, частиц с указанными выше размерами, и при
необходимости, распределенными или диспергированными описанными способами в жидкой или твердой фазах или среде-носителе,
подходящих для введения легочным путем.
Как уже отмечалось, общая проблема введения лекарств легочным путем, т. е. путем ингаляции, заключается в задержке вдыхаемого материала в пределах ротовой полости и фарингиальной области и его последующего поступления в желудочно-кишечный тракт. Риск особенно высок у астматиков и лиц с ограниченной функцией легких в результате болезни или по какой-либо другой причине.
Изобретение особенно интересно и ценно тем, что риск всасывания в желудочно кишечном тракте, например, в результате проглатывания препарата, и последующие побочные эффекты, например, генерализованная иммуносупрессия или дисфункция почек, неожиданно и значительно снижен и при введении циклоспорина в виде CY-A/X-III легочным путем, например, по сравнению с легочным применением циклоспорина в растворе, в аморфной форме или в другой кристаллической форме. Таким образом, изобретение обеспечивает эффективную терапию заболеваний дыхательных путей и легких, при этом отмечается значительное снижение всасывания лекарства в желудочно-кишечном тракте и риска побочных эффектов, обусловленных циклоспорином, или полное их отсутствие. Благодаря преимуществам указанного пути введения, можно ожидать, что изобретение обеспечит применение циклоспориновой терапии с легочным путем введения, т.е. путем ингаляции, для больных, которым любое другое лечение не приносит пользы, на основании оценки и сопоставления риска и пользы терапии. Таким образом, при необходимости, пользу от циклоспориновой терапии, предлагаемой изобретением, могут получать обширные популяции больных, которым не рекомендуется оральное лечение циклоспорином, а также противопоказано или ограничено вдыхание циклоспорина какими-либо иными способами.
Использование CY-A/X-III в соответствии с изобретением также обеспечивает высокую эффективность местного действия препарата в дыхательных путях и легких, т. е. высокий терапевтический эффект, и опять же, с существенным снижением степени системного всасывания лекарства.
Кроме того, было показано, что использование CY-A/X-III согласно изобретению имеет чрезвычайные преимущества, касающиеся методов и механики легочного введения. Так, CY-A/X-III обладает прекрасными качествами, обуславливающими доставку лекарства путем вдыхания, согласно тестированию на стандартных моделях, описанному ниже в разделе пример 4. Таким образом, результаты, полученные в ходе применения CY-A/X-III, не только превосходят результаты использования циклоспорина в аморфной или четырехугольной кристаллической форме, но и вообще результаты экспериментов по исследованию лекарственных веществ в виде сухого порошка или частиц, предназначенных для вдыхания. Тем самым изобретение обеспечивает значительную выгоду от снижения требуемых доз вдыхаемого циклоспорина.
Эксперименты на животных с применением вдыхаемого CY-A/X-III также показывают снижение тенденции к накоплению препарата в мелких бронхах и их закупорки по сравнению с результатами использования циклоспорина путем вдыхания в аморфной или тетрагональной кристаллической форме.
При использовании изобретения в практике дозы CY-A/X-III конечно, будут варьировать в зависимости от специфических условий лечения больного, который подвергается терапии (например, от веса больного, его возраста и т.д.), а также желаемого эффекта. В общем, при использовании согласно изобретению, например, для лечения болезней дыхательных путей, сопровождающихся воспалительными и обструктивными процессами, таких как астма, удовлетворительные результаты обычно отмечаются при введении в легкие одной дозы CY-A/X-III в объеме от 3 до 10 мг/кг. Таким образом, необходимая доза для крупных млекопитающих, например, человека, будет составлять примерно от 210 до 700 мг. Для регулярного применения, наиболее подходящая ежедневная доза для человека колеблется от 25 до 50 или до 400 мг в день, более желательно от 50 до 300 мг в день, например, 100 200 мг в лень.
Соответственно, дозы вводятся с помощью специального дозирующего устройства, сериями от 1 до 5 или от 1 до 2 вдуваний, ежедневно от одного до четырех раз. Таким образом, при каждом приеме вводится, примерно, от 6 12,5 до 100 мг препарата, более желательно, от 25 50 до 100 мг, причем введение производят от трех до четырех раз в день с помощью дозирующего прибора, например, способного подавать около 6 25 CY-A/X-III за один раз и от 1 до 4 раз за каждое введение.
Согласно другому аспекту изобретения получен весьма интересный факт, заключающийся в том, что кристаллический циклоспорин, включающий CY-A/X-III при определенных условиях может принимать сфероидальную форму без потери идентичности кристаллов. В частности, было обнаружено, что, например, кристаллы частиц или фрагментов нативного циклоспорина могут быть изменены таким образом, что получается кристаллический продукт, представленный частицами, часть которых имеет сфероидальную форму. Это превращение можно, например, осуществить, подвергая кристаллический циклоспорин в форме несфероидальных частиц, в дисперсной фазе действию повышенной температуры и/или давления.
Исходный материал кристаллического циклоспорина может включать циклоспорин любой кристаллической модификации. Полученный сфероидальный продукт включает циклоспорин в той же самой модификации, как и исходный материал. В частности, исходный материал может представлять собой CY-A/X-III или циклоспорин, обозначенный как CY-A/X-I. Под обозначением "CY-A/X-I", используемым в данном описании и прилагаемой формуле изобретения, подразумевается циклоспорин в тетрагональной (P41) кристаллической форме.
CY-A/X-I описывается в вышеупомянутой публикации GB патента под N 2211848 (A), а также описан и заявлен вместе с процессом его получения, например, в спецификации австрийского патента под N 353961. CY-A/X-I имеет кристаллическую решетку a b 13,8


Исходный материал в виде частиц для процедуры превращения может включать кристаллы нативного Циклоспорина, например, CY-A/X-I или CY-A/X-III микрокристаллы, или измельченный кристаллический материал в виде фрагментов или порошка.
Превращение осуществляется в дисперсной фазе т.е. с частицами исходного материала, диспергированными или распределенными в большем объеме. Если исходный материал недостаточно дисперсный, отдельные частицы могут слипаться в ходе процесса превращения, что в конце концов приведет к образованию скорее спекшейся массы, чем нужного продукта, представленного сфероидальными частицами.
Дисперсию лучше всего осуществлять в жидкой среде, в которой выбранный кристаллический материал не растворяется. Наиболее пригодной для дисперсии исходного материала является водная среда, например, вода. Для уменьшения слипания в ходе процесса превращения в среду можно добавлять поверхностно-активные вещества. Обычно удовлетворительные результаты, когда можно избежать значительных слипаний, достигаются при дисперсии, около 5% или менее желательно 1% или менее исходного кристаллического материала в воде. Альтернативные подходы к дисперсии, например, в газовой фазе или в условиях пониженной гравитации, хорошо известны специалистам.
Превращение осуществляется при повышенной температуре и/или давлении. В каждом конкретном случае, условия могут варьировать в зависимости, например, от используемых температуры и/или давления, продолжительности процедуры и размеров частиц исходного материала. Обычно температура, при которой протекает превращение, бывает ниже (например, около 20 60oC и ниже) нормальной температуры точки плавления модификации кристаллического материала, подвергаемой трансформации. Так, при нормальном или слегка повышенном давлении, например, при давлении от 1 до 2,5 атмосфер, превращение CY-A/X-I с успехом осуществляется при температуре около 60 100oC более предпочтительно при 70 90oC, например, при 80oC: трансформация CY-A/X-III также успешно выполняется при температуре около 100 140oC, желательно, в пределах 110 130oC, например, около 120oC или даже при 121oC.
Длительность процедуры превращения также варьирует в зависимости от используемых условий. Вообще, было показано, что продукт, в основном представленный сферическими частицами, можно получить из исходного материала, имеющего размер частиц в пределах, примерно от 1 мкм до 20 или 50 мкм, при использовании указанных выше условий и длительности процедуры от 1 до 5 мин, например, 2 или 3 мин. В случае удлинения продолжительности процедуры необходимо перемешивание среды, например, встряхивание, с целью предотвращения слипания.
Полученный продукт включает кристаллический циклоспорин в виде частиц, например, CY-A/X-I или CY-A/X-III при этом частицы имеют сферическую форму.
Степень приближения частиц продукта к сферической форме зависит от условий трансформации, например, продолжительности процесса. Так, поверхность частиц необязательно одинакова на всем протяжении, форма может также варьировать в зависимости от приложения, например, сдвигающих или гравитационных сил, обуславливающих растяжение или какую-либо другую деформацию частиц в ходе превращения вдоль одной или более осей, что, в свою очередь, приводит к образованию продукта, в котором отдельные частицы, например, эллипсоидной или сплющенной формы. Термины "сфероидный" и "сфероидальный", используемые в данном описании и в прилагаемой формуле изобретения, подразумевают сферическую форму частиц или форму, приближающуюся к сферической, включая, например, элиптическую форму и форму сплющенной сферы, в также формы частиц, поверхность которых неодинакова на всем ее протяжении.
Возможное слипание частиц устраняется в ходе процесса превращения, при этом размер (т. е. средний диаметр) полученных сфероидальных частиц будет определяться размером частиц исходного, используемого материала. При желании, средний размер частиц можно уменьшить в ходе процесса превращения, например, путем использования ультразвука или подачи высокого напряжения. В качестве альтернативы, частицы особенно нужного размера можно получить из уже имеющегося менее гомогенного материала путем использования методов микрофильтрации или просеивания. В целях ограничения слипания желательно использовать в качестве исходного материала кристаллы нативного циклоспорина, а не кристаллы, которые уже подверглись перемалыванию или дроблению.
Учитывая все вышесказанное, становится понятным, что процесс превращения является, по существу, механической процедурой. При этом не изменяются ни химические, ни кристаллические свойства циклоспорина: отмечаются изменения только внешнего вида продукта.
Кристаллический циклоспорин, например, CY-A/X-I или CY-A/X-III, в виде сфероидальных частиц является новым по составу веществом. Он имеет определенные преимущества при
использовании в приготовлении новых галеновых препаратов, включающих циклоспорин в качестве активного ингредиента. В частности, благодаря округлой форме, такие частицы обладают меньшей способностью
вызывать раздражение или повреждение, например, тонких тканей, а также обострение воспалительного процесса, по сравнению с измельченными частицами или микрокристаллами нативного материала. Поскольку
сфероидальным частицам присуща тенденция иметь минимальное отношение поверхность объем, они характеризуются более медленным освобождением циклоспорина в месте поступления препарата и, следовательно,
более длительным терапевтическим действием. При рассмотрении в другом аспекте изобретение обеспечивает:
C1 Кристаллический циклоспорин, например, CY-A/X-I или CY-A/X-III,
характеризующийся сфероидальной формой частиц,
C2 Процесс получения кристаллического циклоспорина в виде сфероидальных частиц, отличающийся тем, что включает трансформацию или
превращение циклоспорина, представленного частицами несфероидальной формы, т.е. циклоспорина в виде нативных или фрагментированных кристаллов (т.е. измельченных кристаллов) в дисперсной фазе.
C3 Лекарственный препарат, включающий кристаллический циклоспорин в виде сфероидальных частиц.
C4 Метод эффективной циклоспориновой терапии,
отличающийся тем, что больным вводится кристаллический циклоспорин в форме сфероидальных частиц, а также
C5 Кристаллический циклоспорин в форме сфероидальных частиц для
использования в фармацевтической практике.
Препараты, указанные в пункте C3 включают кристаллический циклоспорин в состоянии, подходящем для фармацевтического использования, например, стерильном или почти стерильном.
Хотя циклоспорин представлен в препаратах, указанных в пунктах C3 в специфической форме (т.е. в виде кристаллических или сфероидальных частиц), сами по себе лекарства могут иметь любую соответствующую консистенцию. Так, препараты, указанные в пункте C3 могут включать твердые формы, такие как порошки и грануляты, полутвердые формы, такие как гели, кремы, пасты, а также жидкие формы, например, включающие указанный циклоспориновый компонент, суспензированный или диспергированный в фармацевтически приемлемом разбавителе или среде носителе, в котором циклоспориновый компонент не растворяется.
В случае внутреннего, т.е. орального введения, как, например, CY-A/X-I, такого типа препараты могут быть представлены в компактной форме, например, в виде таблеток, включающих CY-A/X-I в форме сфероидальных частиц, когда отдельные частицы спрессованы в когезионные массы, при необходимости с примесью фармацевтически приемлемых, связывающих агентов, разбавителей и т.п. В качестве альтернативы, материал, представленный сфероидальными частицами, может быть упакован или спрессован в капсулы.
Предпочтительно, чтобы циклоспориновый компонент препаратов, указанных в пункте C3, состоял полностью или в значительной степени из кристаллического Циклоспорина в виде сфероидальных частиц.
Препараты, указанные в пункте C3, включают формы, удобные для местного применения, например, для лечения кожных покровов или глаз, а также формы для парентерального введения, например, путем инъекций, включая подкожные или внутримышечные инъекции, и, в частности, внутри-раневые или внутри-суставные инъекции. Такие инъецируемые препараты могут включать формы пролонгированного действия, например, депо-формы для внутри-мышечных или внутри-суставных инъекций, и которые характеризуются низким отношением поверхность объем указанного активного ингредиента. Такие препараты могут также включать формы для внутреннего введения, хотя они менее предпочтительны, особенно, когда активный ингредиент представлен CY-A/X-III в виде сфероидальных частиц.
К препаратам, указанным в пункте C3, принадлежат лекарственные средства для легочного применения, тип и составляющие компоненты которых относятся к данному изобретению и описаны в пунктах B1 или B2. В соответствии с данными настоящего изобретения, препараты, указанные в пункте C3 и предназначенные для легочного применения, предпочтительно должны включать CY-A/X-III чем, например, CY-A/X-I, поскольку применение последнего часто связано с повышенным риском системного всасывания.
Размер частиц в используемых препаратах согласно пункту C3 может варьировать в зависимости, например, от требуемого пути введения, а также от желаемого эффекта. Так, в случае внутримышечных инъекций в целях получения депо-эффекта использование препаратов с большим размером частиц может быть более эффективным, чем в случае лекарственных средств, предназначенных для внутри-суставного или, особенно, легочного применения.
Обычно, средний диаметр большинства частиц составляет менее 30 мкм или менее 20 мкм, желательно менее 10 мкм, еще лучше менее 5 мкм, например, около 3 мкм, однако, больший диаметр допустим, например, в случае внутримышечных инъекций.
Соответственно по крайней мере 70% предпочтительно по крайней мере 80% еще лучше от 85 до 90% частиц должны отвечать вышеуказанным требованиям к размеру частиц. Минимальный размер частиц обычно меньше критического, хотя препараты, включающие не более 25% еще лучше не более 20% или 10% частиц с размерами <0,1 мкм, <0,3 мкм или <0,5 мкм, более предпочтительны. Общая средняя величина диаметра частиц кристаллического циклоспорина согласно пункту C1 или включенных в состав препаратов, указанных в пункте C3 лежит в пределах от 0,1, 0,3 или 0,5 мкм до 10, 20 или 30 мкм.
При легочном применении размер частиц кристаллического циклоспорина, указанного в пункте C1 или входящего в состав препаратов, указанных в C3, отвечает спецификациям, сформулированным здесь ранее для легочного применения препаратов CY-A/X-III в виде частиц, при этом, обычно, более подходящим является кристаллический циклоспорин, например, CY-A/X-III или CY-A/X-II, в виде сфероидальных частиц, имеющих средний размер аэродинамической массы или средний размер диаметра в пределах от 0,1, 0,5 или, желательно, 1,0 до 10 мкм, предпочтительно, до 5 мкм, например, около 3,0 мкм.
Препараты указанные в C3, можно получать в соответствии с методами, использующими определенные, имеющиеся в практике фармакологии среды для лекарства, и рекомендуемыми для получения лекарственных средств, включающих CY-A/X-II, как изложено в вышеупомянутой публикации GB патента под N 2211848 (A) или представлено в данном описании изобретения согласно B1 и B2 или прилагаемом примере 6.
Метод изобретения по пункту C4 можно использовать для лечения любого заболевания или состояния, которым показана или подходит циклоспориновая терапия, в частности, для достижения состояния иммуносупрессии или в качестве противовоспалительного агента, например, при лечении любого заболевания, сопровождающегося воспалительным процессом, или состояния, в развитии которого участвует аутоиммунный компонент. Так, метод можно применять для поддержания органного трансплантата, например, при пересадках сердца, легких, комплекса сердце-легкие, печени, почек, поджелудочной железы, костного мозга, кожи или роговицы, для лечения артритов (например, ревматоидного артрита arthritis chronica progrediente и обезображивающего артрита), а также для лечения аутоиммунных заболеваний, при которых показана или рекомендуется циклоспориновая терапия, например, аутоиммунных заболеваний, перечисленных на стр. 2 патентной публикации GB N 2211848 A. Метод изобретения по пункту C4, особенно это касается CY-A/X-III в виде сфероидальных частиц, можно также применять для лечения любого заболевания или состояния верхних дыхательных путей или легких, о чем уже сообщалось ранее при описании изобретения согласно пункту A2, в особенности, астмы. Изобретение, согласно пункту C5, необходимо рассматривать, как имеющее широкое применение для лечения многих, ранее указанных заболеваний и состояний.
Как уже сообщалось, использование, согласно изобретению, кристаллического циклоспорина, представленного сфероидальными частицами, имеет особые преимущества при лечении заболеваний и условий, сопровождающихся воспалительными процессами, например, для лечения суставов, дыхательных путей или легких, благодаря методам, устраняющим или ограничивающим повреждение тканей или обострение воспалительного процесса.
Дозы кристаллического циклоспорина, согласно пункту C1 используемого в практике изобретения, как указано в пункте C4, конечно, варьируют в зависимости, например, от пути введения препарата, характера заболевания, тяжести болезни, больного, подвергающегося лечению, а также желаемого эффекта.
При легочном применении, например, для лечения заболеваний дыхательных путей, сопровождающихся воспалительными и обструктивными процессами, требуемые дозы будут теми же самыми или сходными с дозами, уже указанными ранее в отношении легочного применения CY-A/X-III. Нужные дозы или концентрации препарата для местного применения для лечения кожных и глазных болезней или при введении путем инъекций, например, подкожных, внутримышечных или парентеральных инъекций, в частности, внутрисуставных инъекций, будут сходными с дозами, рекомендуемыми при введении теми же способами CY-A/X-III в публикации патента под N 2211848 A.
Следующий аспект изобретения связан с обнаружением факта, что циклоспорин обладает чрезвычайно высокой растворимостью в полихлорфлюороуглеводородных пропеллентах. В частности, совершенно неожиданно оказалось, что не только аморфный циклоспорин, но также и CY-A/X-I и CY-A/X-III подвергаются быстрому растворению в этих пропеллентах. Эти данные обеспечивают возможность введения циклоспорина легочным путем в растворе, при помощи обычных, давно используемых в медицинской практике, аэрозольных методов.
Соответственно, изобретение дополнительно обеспечивает:
Д) Лекарственный препарат для легочного применения, например, для лечения любого,
указанного выше заболевания или состояния, в
частности, заболеваний дыхательных путей, характеризующихся воспалительными или обструктивными процессами, например, астмы; причем препарат включает
циклоспорин, растворенный в
полихлорфлюороуглеводородном пропилленте.
Как признано, несмотря на то, что изобретение, согласно пункту Д, обеспечивает реальную альтернативу для легочного использования циклоспорина, этот подход к введению циклоспорина по вышеуказанным причинам, например, по экологическим соображениям, обычно менее желателен. Так, метод введения циклоспорина, в растворе не обладает ни одним из преимуществ, характерных для введения CY-A/X-III, например, пониженным риском системных побочных эффектов, ценными качествами, способствующими поступлению препарата в легкие и т.д.
Полихлорфторуглеводородные пропилленты подходят для использования в данном изобретении как указано в пункте Д. К ним относятся известные в практике соединения такого типа, как перечисленные в таблице на стр. 701 в "Rompp Chemie Lexikon 90, erweiterte und Neubearbeitete Auflage", publ. Georg. Thieme Verlag, Stuttgart + New York (1989), в частности, трихлорфлюорометан, дихлорфлюорометан и 1, 1, 2-трихлоротрифлюороэтан ICl2C-CClF2I.
Концентрация циклоспорина в препаратах, согласно пункту Д, составляет 2 мг на 90 мкл полихлорфторуглеводорода или выше. Для пользования этими препаратами заполняются специальные, известные в практике полихлорфлюороуглеводородной технологии сосуды или баллоны, снабженные дозирующими устройствами для подачи аэрозолей. Применяемые ежедневные дозы сходны с дозами, указанными выше, для легочного применения CY-A/X-III, причем большая подача циклоспорина необходима обычно для компенсации относительно низких характеристик подачи препарата в легкие.
Наконец, каждый из аспектов изобретения можно продемонстрировать на стандартных животных моделях или в клинике, например, в соответствии с процедурами, описанными далее в прилагаемых примерах.
Пример 1. Влияние CY-A/X-III на эозинофилию, индуцируемую аллергенами у морских свинок
Введение.
Эозинофилия характерна для дыхательных путей больных астмой со средней и тяжелой формой заболевания (Frigas d.Gleich, I. Alergy Clin. Immunol. 77, 527 537, 1985). Эозинофилия обнаруживается в результате исследования бронхоальвеолярной жидкости, полученной после промывания дыхательных путей больных атопической астмой, и усиливается аллергическими реакциями (опосредованными IgE). Эозинофилия дыхательных путей может также развиваться и при неатопической астме и усиливаться процедурами без участия IgE (например, при контакте с аспирином).
1.1. Легочное применение.
Самцов Гималайских пятнистых морских свинок весом около 300 г сенсибилизируют к яичному белку (ЯБ) путем внутрибрюшинного (В/бр) введения 1 мл суспензии 10 мкг ЯБ, 0,25 мл В. коклюшной вакцины и Al(OH)3 (2,0 мг) в растворе (0,9% вес/объем). Процедуру повторяют дважды с трехнедельными интервалами, животных можно использовать после последней инъекции.
Пробу на чувствительность выполняли путем введения распыленного ЯБ (0,01%) в солевом растворе в камеру с последующим разбавлением чистым воздухом. Животные выдерживаются с ЯБ в течение 60 мин путем вдыхания только через нос.
У необработанных (контрольных) животных проба на ЯБ вызывает повышенное появление эозинофилов (5 10 кратное) и других клеток воспалительной реакции в дыхательных путях сенсибилизированных морских свинок, о чем свидетельствуют подсчеты клеток в бронхиолярных смывах, выполняемых следующим образом.
Животных забивают путем в/бр введения пентобарбитона (100 мг/кг). Освобождают трахею и в нее вводят канюлю.
Последовательные количества (10 мл) свободного от Ca++ и Mg++ сбалансированного солевого раствора Хенкса, содержащего сывороточный альбумин (0,3% ), ЕДТА (10 мМ и HEPES (10 мМ) вводятся в легкие и немедленно извлекаются путем незначительного сжатия ткани легкого. Процедура выполняется 6-кратно. Извлеченная жидкость собирается при комнатной температуре в пластические пробирки Фальконе (60 мл). Объем жидкости, полученный в результате б промываний, обычно превышает 50 мл (85%). Суспензию клеток центрифугируют (200 г в течение 10 мин); супернатант отбрасывают, а осадок, содержащий клетки, ресуспендируют в 1 мл добавляемого сбалансированного солевого раствора Хенкса. Общее количество клеток в собранных элюатах определяют с помощью автоматического счетчика клеток. Для дифференцированного подсчета клеток 10 мкл из 1 мл клеточной суспензии добавляют к 190 мкл жидкости Тюрка и производят подсчет в мазках, окрашенных по Дифф-Квику. Клетки идентифицируют и подсчитывают под иммерсией. В каждом мазке подсчитывают минимум 500 клеток, причем определяют общее количество каждого типа клеток.
Для определения активности ингаляции микронизированное тест вещество вводятся через нос животных при помощи аэрозольного генератора (ингалятора), снабженного форсункой и обеспечивающего подачу диспергируемого вещества в легкие, как описано Бернстейном с соавт. в "Aerosols: Science, Technology and Industrial Application of Airborne Particles", Extended Abstract, eds. B.Y.A. Lin et al. Elsevier Science, New York, 1984.
Опытные животные фиксируются таким образом, чтобы в камере с аэрозолем находился только нос зверька, не более чем за 15 минут до пробы.
В вышеописанный тест модели введение микронизированного CY-A/X-III (размер около 89% частиц составляет менее 3 мкм) приводит к значительному снижению количества эозинофилов и нейтрофилов при общих вдыхаемых дозах от 3,0 до 10,0 мг/кг по сравнению с необработанными контролями.
Введение микронизированной смеси (1 1) аморфного Циклоспорина и CY-A/X-I (размер около 90% частиц составляет менее 3 мкм) дает сравнимые результаты.
Таким образом, использование данной тест-модели позволяет заключить, что CY-A/X-III является эквипотенциальным или почти эквипотенциальным смеси аморфный Циклоспорин: CY-A/X-I при введении путем ингаляции.
1.2. Оральное введение.
Тестирование выполняется в соответствии с методами, указанными выше, однако, тест-вещество вводится оральным путем в суспензии в карбоксиметилцеллюлозе за 15 мин до пробы. В этой тест модели явное снижение эозинофильной и нейтрофильной инфильтрации отмечается только при введении оральным путем CY-A/X-III в дозах, превышающих 60 мг/кг.
В противоположность этому, сомнительные данные об ингибировании получены при оральном введении смеси (1 1) аморфного Циклоспорина и CY-A/X-I в дозах, начиная 20 мг/кг и выше, например, между 20 и 80 мг/кг.
1.3. Заключение. Сравнение эффективности CY-A/X-III и смеси аморфного циклоспорина: CY-A/X-I при введении их оральным путем, обнаруживает заметное снижение системного всасывания (примерно, трехкратное) в случае использования CY-A/X-III. Поскольку дозы CY-A/X-III, необходимые для его эффекта при введении путем ингаляции, значительно ниже (примерно, в 10 раз) доз, требуемых для эффекта от введения оральным путем, можно думать, что действие вдыхаемого CY-A/X-III не связано с всасыванием, сопровождающим выше упомянутое оральное введение препарата в ходе тест-процедуры.
Пример 2. Характеристика системного всасывания.
Самцам морских свинок (Dunkin Hartley) весом около 300 400 г оральным путем вводят циклоспорин в форме CY-A/X-III или в виде смеси аморфного циклоспорина и CY-A/X-I. В каждом случае введение осуществляется в гелевой суспензии в карбоксиметил целлюлозе. Опытные животные делятся на группы, причем животные отдельных групп получают циклоспорин, в виде CY-A/X-III в дозах 4, 20 и 40 мг/кг (группы 1 по 3), или смесь циклоспорин CY-A/X-I в дозах 4, 20 и 40 мг/кг (группы с 4 по 6). Пробы крови берут перед введением циклоспорина и через 1, 2, 4 и 6 ч после его введения и определяют уровни циклоспорина, используя стандартные методы РИА с применением моноклональных антител.
Достоверные результаты, указывающие на системное всасывание, зарегистрированы в группах с 4 по 6 в результате введения циклоспорина, о чем свидетельствовали измеренные уровни циклоспорина в крови. У животных в 1 по 3 групп всасывания не отмечено вообще или зарегистрировано значительно сниженное всасывание после введения препарата по сравнению с группами 3 и 4.
Пример 3. Галеновые препараты для ингаляции.
В каждом из следующих примеров CY-A/X-III используется в виде тонко измельченных частиц со средними размерами аэродинамической массы от 0,5 до 10,0, предпочтительно до 5,0 мкм, еще лучше около 3,0 мкм или менее. Обычно, нативные кристаллы CY-A/X-III получали с помощью методов, описанных в примерах 1 или 2 вышеупомянутой публикации ИК патента 2211848, и затем микронизировали, используя размельчительные устройства с коллоидным или воздушным током с целью получения тонко измельченного продукта со средними размерами аэродинамической массы частиц около 9,9 мкм, 5 мкм, 3 мкм или менее, например, 2 3 мкм. В качестве альтернативы, можно назвать нативный микрокристаллический CY-A/X-III со средними размерами аэродинамической массы частиц кристаллов 2 10 мкм, полученных путем кристаллизации с применением ультразвука при 10000 30000 импульсов в сек. согласно описанию в публикации ИК патента N 2 211 848.
3.1.
CY-A/X-III 25 мг
CY-A/X-III материал в виде тонкоизмельченных частиц
помещается в твердую жевательную капсулу для введения и подачи препарата, обычный ингалятор для вдыхания сухих порошкообразных веществ.
3.2.
а) CY-A/X-III 20 мг
б) лактоза (100 меш) 3 мг
Всего 25 мг
Компоненты хорошо перемешиваются с помощью обычных методик, полученный гомогенный,
порошкообразный продукт просеивается и помещается в
твердые желатиновые капсулы для непосредственного использования, как указано в 3.1.
3.3.
а) CY-A/X-III 150,0
мг
б) дистиллированная вода 10,0 мг
в)
кислый фосфорнокислый натрий (NaHPO4) 41,4 мг
г) лимонная кислота 8,0 мг
д) NaCl 74,7 мг
е) соевый
лецитин 4,0 мг
Всего 288,1 мг
Компонент (а)
суспендируют обычным способом в водном растворе, включающем компоненты с (б) по (е) и полученную суспензию помещают в резервуар
стандартного ингалятора.
Указанные выше препараты используются для легочного пути введения, например, при лечении астмы.
Пример 4. Характеристики подачи путем ингаляции препаратов CY-A/X-III, представленных частицами.
Испытание проводится путем применения парного ударного устройства, описанного в Hallworth et al. J. Pharm. Pharmacol. 39, 966 973 (1987) и методологии согласно The Britich Pharmacopoeia 1988, том II. Приложение XY II C/A-204-A 207). Исследуемый материал представляет собой измельченный на струйной мельнице препарат CY-A/X-III, содержащий 90% частиц размером менее 10 мкм. Проба подается на ударное устройство из капсул номера 3 с применением Борингер ингалятора сухих веществ.
В результате, CY-A/X-III материал характеризуется необычайно высокой степенью подачи в более низкую ударную камеру (ср. Hallworth and Britich Pharmacopoeia loc. cit.) соответствующую, высокому уровню поступления в легкие. Так, в одной из серий исследований около 42% материала освобождалось из более низкой ударной камеры.
Улучшения характеристик подачи CY-A/X-III можно достичь путем смешивания исследуемого материала с другими инертными, тонко измельченными вдыхаемыми или не вдыхаемыми формами разбавителей (например, которые упоминались здесь ранее) с целью увеличения или уменьшения среднего размера частиц или плотности смеси: CY-A/X-III + разбавитель.
Пример 5. Препарат CY-A/X-III в виде сфероидальных частиц.
CY-A/X-III в виде частиц с размерами от 3,0 до 40 мкм, представленными нативными микрокристаллами CY-A/X-III (например, имеющих внешний вид, как на фиг. 1), в 1% водной суспензии нагревают в автоклаве при 120 121oC примерно при 2,5 атм в течение 2 3 минут, после чего суспензию фильтруют и частицы высушивают. Полученный в виде частиц продукт включает CY-A/X-III, в значительной степени представленный сферическими частицами с диаметром, приблизительно, от 3,0 до 40 мкм.
При повторении процедуры с исходным CY-A/X-III материалом в виде частиц, включающим микрокристаллы обработанного ультразвуком CY-A/X-III с размерами от 1,0 до 5,0 мкм и средним размером около 3,0 мкм, с перемешиванием или взбалтыванием суспензии в ходе автоклавирования, получают CY-A/X-III в виде сфероидальных частиц со средним размером около 3 мкм. Эквивалентные результаты можно получить при замене указанного исходного материала материалом CY-A/X-I в виде несфероидальных частиц.
Пример 6. Галеновые препараты, включающие CY-A/X-III или CY-A/X-I в форме сфероидальных частиц.
6.1. Форма для внутри-раневой инъекции.
Суспензию CY-A/X-III в виде сфероидальных частиц с
размерами диаметра около 3,0 40 мкм готовят в стерильных условиях в соответствии
с методами примера 5 используя следующие градиенты:
а) CY-A/X-III в виде сфероидальных частиц 20,0 мг
б) Полисорбат 80 4,0 мг
в) Натрий карбоксиметилцеллюлоза 5,0 мг
г) NaCl 9,0 мг
д) Бензиловый спирт 9,0 мг
е) добавление воды порциями до конечного объема 1,0
мг
Полученной суспензией заполняют ампулы для внутри-раневых инъекций,
применяемых при лечении псориаза.
6.2. Инъецируемая форма для внутрисуставной инъекции.
Форму для инъекций, включающую CY-A/X-III в виде сфероидальных частиц с
диаметром в пределах от 1,0 до 5,0 мкм, полученный в соответствии с методами примера 5, готовят в стерильных
условиях, используя следующие ингредиенты:
а) Сфероидальные частицы CY-A/X-III 10,
0 мг
б) Натрий карбоксиметилцеллюлоза 10,0 мг
в) Na ЕДТА 2,0 мг
г) добавление
H2O порциями до конечного объема 1,0 мл
Полученным препаратом заполняются
ампулы, используемые для внутрисуставных инъекций при лечении ревматоидного артрита.
6.3. Ингаляционные формы, используемые, например, при лечении астмы.
Препараты готовят аналогично примерам 3.1 3.3, однако используя CY-A/X-III в виде сфероидальных частиц со средними размерами аэродинамической массы в пределах от 1,0 до 5,0 мкм, желательно, около 3 мкм или менее, полученный в соответствии с процедурой примера 5. Препараты просеивают и помещают в твердые капсулы для введения и подачи обычным ингалятором порошкообразных веществ, используемым, например, при лечении астмы.
Препараты, эквивалентные выше указанным в 6.1 6.3, можно приготовить при замене CY-A/X-III компонента компонентом CY-A/X-III в виде сфероидальных частиц.
Пример 7. Получение аэрозольного препарата, включающего Циклоспорин в растворе в среде полихлорфторуглеводородного пропиллента.
1 весовая часть циклоспорина в виде смеси (1:1) аморфного циклоспорина и CY-A/X-I или CY-A/X-III добавляется к смеси, включающей 0,65 вес. ч. Span 85, 21,22 вес. ч. Frigen 113 и 21,23 вес. ч. Frigen 11/12. Компонент циклоспорина растворяют в Frigen компонентах для получения раствора, которым заполняется резервуар обычного ингалятора, способного к подаче каждый раз, например, 1,0, 2,0, 5,0 или 10,0 мг циклоспорина, и используемого при лечении астмы.
Эффективность CY-A/X-III, используемого в соответствии с данным изобретением, возможность избежать системного всасывания и другие преимущества, изложенные в предлагаемом описании, можно также продемонстрировать в клинических испытаниях, выполненных следующим образом.
Клинические испытания.
В группу испытуемых лиц отбирают
больных с диагнозом хронической астмы, включая больных, которым необходим постоянный прием
глюкокортикостероидов с целью контролирования течения заболевая. Испытуемые лица получают CY-A/X-III в дозах
от 50 до 200 мг, например, 100 мг в день) вводимых в виде 3 4 дробных доз ежедневно.
CY-A/X-III вводится в форме частиц, включая:
порошкообразный препарат, полученный из CY-A/X-III
микрокристаллического материала в результате помола на струйной мельнице и имеющий средние
размеры аэродинамической массы частиц в пределах от 0,5 до 5,0 мкм, обычно, приблизительно 3,0 мкм; или
CY-A/X-III в виде сфероидальных частиц, например, приготовленный в соответствии с
процедурой примера 5 и имеющий размеры аэродинамической массы частиц в пределах от 1,0 до 5,0 мкм, обычно около
3,0 мкм.
CY-A/X-III подается легочным путем с использованием обычного дозирующего ингалятора для порошкообразных веществ. В ходе испытаний в определенные интервалы времени измеряют следующие параметры: принудительный вдыхаемый объем (FEV, пиковая скорость тока при дыхании (PEER), и у лиц, чувствительных к специфическим антигенам, степень обструкции дыхательных путей в результате ингаляции тестируемых доз антигена. Кроме того, в ходе испытаний осуществляется контроль за требуемыми поддерживающими дозами стероидных препаратов и использованием других противовоспалительных, антиастматических лекарственных средств. Промывание бронхов (BAL) у лиц, подвергнутых испытанию, производится перед и по завершении испытания, а также в ходе испытаний в случае значительного удлинения их периода. Пробы промывной жидкости просматриваются на наличие клеток воспалительной реакции, в частности, эозинофилов. Пробы крови берут у испытуемых лиц перед, в течение и после завершения испытаний (примерно, в 14-дневные интервалы). Все пробы исследуются по постоянным параметрам, а также в каждой из них определяются общие концентрации циклоспорина (при помощи стандартных методов РИА с использованием моноклональных антител).
Результаты обследования лиц, получавших CY-A/X-III, сравнивали с результатами в параллельных группах больных сходного астматического статуса, которым назначалась только обычная терапия. В качестве альтернативы, выполнялось испытание дублирующим слепым методом в параллельных группах больных, получавших (I) CY-A/X-III как описано выше или (II) только плацебо порошкообразный материал. Отдельные исследования предполагается проводить в течение периодов от 1 недели до 1 6 месяцев) при этом необходимо контролировать использование стероидов.
Лица, получавшие в ходе клинических испытаний CY-A/X-III, должны обладать лучшими характеристиками, касающимися функции легких, пониженным количеством клеток воспалительной реакции в промывной жидкости бронхов, а также прогрессирующим снижением доз используемых стероидов, ксантина или других противовоспалительных терапевтических средств во время исследований по сравнению с контрольными группами, которые не получали CY-A/X-III или получавшими плацебо. Уровни Циклоспорина в крови в группах лиц, получавших CY-A/X-III относительно низки или вообще ничтожны. Терапия с использованием CY-A/X-III также сочетается с достоверным отсутствием побочных эффектов и неблагоприятного влияния на показатели крови. Применение CY-A/X-III не связано с какими-либо проблемами, на что указывают как проведенные исследования, так и отзывы больных.
Реферат
Использование: легочное применение циклоспорина в форме орторомбических кристаллов (обозначенный как "CY-A/X-III"), например, для лечения заболеваний дыхательных путей, сопровождающихся обструктивными или воспалительными процессами, например, астмы; кроме того, кристаллический циклоспорин, в частности, CY-A/X-III в форме сфероидальных частиц; процесс его получения и использования в медицинской практике, например, для легочного применения. Лекарственные препараты, включающие CY-A/X-III и кристаллический Циклоспорин, в частности, CY-A/X-III в форме сфероидальных частиц, а также Циклоспорин в растворе в аэрозольных пропиллентах обеспечены данным изобретением. 7 з.п. ф-лы, 2 табл.
Формула
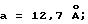
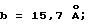

и объем на асимметрическую ячейку составляет


Комментарии