Микрочастицы дикетопиперазина с определенными удельными площадями поверхности - RU2509555C2
Код документа: RU2509555C2
Чертежи












Описание
ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Согласно 35 USC §119(e) настоящая заявка притязает на приоритет предварительной американской заявки на патент 61/186773, поданной 12 июня 2009, содержание которой включено в настоящее описание во всей полноте в виде ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Раскрыты микрочастицы дикетопиперазина с удельной площадью поверхности менее чем примерно 67 м2/г. Микрочастицы ФДКП можно использовать в качестве системы доставки лекарственных веществ или активных агентов при лечении заболевания или нарушений, например, эндокринного происхождения, в том числе диабета и ожирения.
УРОВЕНЬ ТЕХНИКИ
[0003] На протяжении многих лет доставка лекарственных веществ была одной из основных проблем, в частности когда доставляемое соединение является нестабильным в условиях, с которыми, до достижения своего целевого местоположения, оно сталкивается в желудочно-кишечном трактате при пероральном введении субъекту. Например, во многих случаях предпочтительным является пероральное введение лекарственных веществ, особенно с точки зрения легкости их введения, соблюдения пациентом режима лечения и более низкой стоимости. Однако многие соединения являются неэффективными или демонстрируют низкую или изменчивую эффективность при пероральном введении. По-видимому, это происходит из-за нестабильности лекарственных веществ в условиях пищеварительного тракта или из-за их неэффективного всасывания.
[0004] Доставка лекарственного вещества в легкие была изучена исходя из проблем, связанных с доставкой лекарственного вещества. Например, лекарственные вещества, доставляемые в легкие, как правило, разрабатывают таким образом, чтобы они воздействовали на легочную ткань, например вазодилятаторы, сурфактанты, химиотерапевтические агенты или вакцины против гриппа или других респираторных заболеваний. Другие лекарственные вещества, в том числе нуклеотидные лекарственные вещества, доставляли в легкие, так как они представляют собой ткань, которая является особенно подходящей для лечения, например, в случае генетической терапии кистозного фиброза, при которой в легкие вводят ретровирусные вектора, экспрессирующие дефектную аденозиндеаминазу.
[0005] В легкие также можно осуществлять доставку лекарственных веществ, которые являются агентами системного действия. Преимущества доставки системных агентов в легкие заключаются в их большой площади поверхности и легкости, с которой происходит всасывание поверхностью слизистой оболочки легкого. Одна из проблем, связанных со всеми формами доставки лекарственных веществ в легкие, заключается в сложности такой доставки, связанной с прохождением лекарственными веществами через все естественные барьеры, такие как реснички, выстилающие трахею, а также с введением постоянного объема и веса лекарственного вещества.
[0006] Следовательно, существует потенциал для усовершенствования доставки лекарственных веществ в легкие.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0007] Настоящее раскрытие относится к системам, микрочастицам и способам, позволяющим улучшить доставку лекарственных веществ в легкие. В раскрытых вариантах осуществления улучшенная доставка достигается путем предоставления микрочастиц дикетопиперазина (ДКП) с удельной площадью поверхности (SSA) в пределах от примерно 35 м2/г до примерно 67 м2/г. Микрочастицы ДКП с удельной площадью поверхности, находящейся в этом диапазоне, демонстрируют характеристики, благоприятные для доставки в легкие, такие как улучшенная аэродинамическая характеристика и улучшенное всасывание лекарственных веществ.
[0008] Один из раскрытых в настоящем описании вариантов осуществления включает микрочастицы дикетопиперазина с удельной площадью поверхности менее чем примерно 67 м2/г. Другой вариант осуществления включает микрочастицы дикетопиперазина с удельной площадью поверхности, находящейся в пределах от примерно 35 м2/г до примерно 67 м2/г. Другой вариант осуществления включает микрочастицы дикетопиперазина, у которых при отсутствии активного агента удельная площадь поверхности больше чем примерно 35 м2/г, но меньше чем примерно 62 м2/г после адсорбции частицами активного агента.
[0009] В другом варианте осуществления микрочастицы фумарилдикетопиперазина (ФДКП) с удельной площадью поверхности в пределах от примерно 35 м2/г до примерно 67 м2/г содержит лекарственное вещество или активный агент, причем указанную SSA определяют до добавления лекарственного вещества к частице. Присоединение активного агента к частице обычно приводит к уменьшению SSA. В различных вариантах осуществления микрочастиц ФДКП лекарственное вещество может представлять собой, например, пептид или белок, в том числе эндокринные гормоны, например инсулин, глюкагон-подобный пептид-1 (GLP-1), глюкагон, эксендин, паратиреоидный гормон, обестатин, кальцитонин, оксинтомодулин и т.п. Другой вариант осуществления микрочастиц ФДКП с удельной площадью поверхности в пределах от примерно 35 м2/г до примерно 67 м2/г может включать содержание лекарственного вещества/пептида, которое может изменяться в зависимости от условий протекания процесса синтеза для получения микрочастиц. В одном из конкретных примеров могут быть получены микрочастицы ФДКП, имеющие содержание лекарственного вещества/пептида, которое может изменяться в зависимости от целевой или доставляемой дозы. Например, в случае, если лекарственное вещество является инсулином, инсулиновый компонент может составлять примерно от 3 Ед/мг до примерно 4 Ед/мг в содержащей микрочастицы порошкообразной лекарственной форме. В некоторых вариантах осуществления лекарственное вещество адсорбируется на поверхности микрочастиц. В других вариантах осуществления таких загруженных лекарственным веществом микрочастицах SSA этих микрочастиц составляет менее чем примерно 62 м2/г.
[0010] Раскрытые здесь варианты осуществления также включают сухие порошки, содержащие микрочастицы. В одном из вариантов осуществления сухие порошки содержат микрочастицы ФДКП с удельной площадью поверхности менее чем примерно 67 м2/г. Другой вариант осуществления включает микрочастицы дикетопиперазина, у которых удельная площадь поверхности находится в пределах от примерно 35 м2/г до примерно 67 м2/г. Другой вариант осуществления включает содержащие лекарственное вещество или активный агент микрочастицы дикетопиперазина с удельной площадью поверхности в пределах от примерно 35 м2/г до примерно 62 м2/г.
[0011] В вариантах осуществления сухих порошков микрочастицы ФДКП содержат лекарственное вещество. В другом варианте осуществления сухих порошков лекарственное вещество представляет собой пептид, у которого размер молекулы и молекулярная масса могут быть различными, включая инсулин, глюкагон-подобный пептид-1, глюкагон, эксендин, паратиреоидный гормон, кальцитонин, оксинтомодулин и т.п. В одном из таких вариантов осуществления сухих порошков, в котором лекарственное вещество представляет собой инсулин, содержание инсулина в микрочастицах ФДКП составляет от примерно 3 Ед/мг до примерно 4 Ед/мг.
[0012] Другие варианты осуществления относятся к системам доставки лекарственного вещества, содержащим ингалятор, контейнер для единичной дозы лекарственного вещества в виде сухого порошка, например картридж, и порошкообразную лекарственную форму, содержащую раскрытые в настоящем описании микрочастицы и активный агент. В одном из вариантов осуществления система доставки лекарственного вещества для использования с сухими порошками включает ингаляционную систему, содержащую ингалятор с высоким сопротивлением, имеющий воздушные каналы, которые оказывают высокое сопротивление воздушному потоку, проходящему через эти каналы, для разрушения агломератов и дозирования порошкообразной лекарственной формы. В одном из вариантов осуществления значение сопротивления в ингаляционной системе составляет, например, от примерно 0,065 (√кПа)/л в мин до примерно 0,200 (√кПа)/л в мин. В некоторых вариантах осуществления сухие порошки могут эффективно подаваться путем вдоха с помощью ингаляционной системы, в которой пиковый дифференциал давления при вдохе может составлять от примерно 2 кПа до примерно 20 кПа и может создавать в результате пиковую скорость потока от примерно 7 до 70 литров в мин. В некоторых вариантах осуществления ингаляционные системы разработаны для предоставления единичной дозы путем выдачи порошка из ингалятора в виде непрерывного потока или в виде одного или нескольких импульсов выдаваемого пациенту порошка. В некоторых раскрытых в настоящем описании вариантах осуществления ингаляционная система для сухих порошков имеет заданный баланс потока массы внутри ингалятора. Например, баланс потока, при котором примерно от 10% до 70% от общего потока, выдаваемого из ингалятора пациенту, доставляется через одно или несколько дозирующих отверстий, которые позволяют потоку воздуха проходить через область, содержащую порошкообразную лекарственную форму, и причем примерно от 30% до 90% воздушного потока генерируется в других каналах ингалятора. Кроме того, обводной поток или поток, не входящий и не выходящий из области размещения порошка, такой как картридж, может снова объединяться с потоком, выходящим через дозирующее порошок отверстие внутри ингалятора, с тем, чтобы разбавлять, ускорять и в конечном счете разрушать агломераты флюидизированногопорошка до выхода из мундштука ингалятора. В одном из вариантов осуществления скорости потока в системе ингалятора, находящиеся в пределах от примерно 7 до 70 л в мин, обеспечивают в результате распыление более 75% порошкообразного содержимого контейнера или порошкообразного содержимого картриджа, в порцию весом от 1 до 30 мг. В некоторых вариантах осуществления описанная выше ингаляционная система может выпускать за один вдох вдыхаемую фракцию/порцию, составляющую более 40%, более 50%, более 60% или более 70% от дозы порошка.
[0013] В конкретных вариантах осуществления предоставляется ингаляционная система, содержащая ингалятор для сухих порошков, лекарственную форму в виде сухого порошка, содержащую микрочастицы фумарилдикетопиперазина, причем загруженные микрочастиц ФДКП имеют удельную площадь поверхности менее чем примерно 67 м2/г, и один или несколько активных агентов. В некоторых аспектах этого варианта осуществления ингаляционной системы лекарственная форма в виде сухого порошка предоставляется в картридже для единичной дозы. Альтернативно, лекарственная форма в виде сухого порошка может быть заранее загружена или засыпана в ингалятор. В этом варианте осуществления структурная конфигурация ингаляционной системы позволяет механизму разрушения агломератов в ингаляторе формировать вдыхаемые фракции, превышающие 50%; т.е. более половины от количества порошка, содержавшегося в ингаляторе (картридже), испускается в виде частиц менее чем 5,8 мкм. В одном из вариантов осуществления ингаляторы могут высвобождать во время дозирования более 85% порошкообразного лекарственного вещества, содержащегося внутри контейнера. В некоторых вариантах осуществления ингаляторы могут за один вдох высвобождать более 85% содержащегося порошкообразного лекарственного вещества. В некоторых вариантах осуществления ингаляторы могут высвобождать более 90% содержимого картриджа или содержимого контейнера за менее чем 3 секунды при разнице давлений от 2 кПа до 5 кПа в виде порции весом до 30 мг.
[0014] Раскрытые здесь варианты осуществления также включают способы. В одном из вариантов осуществления предоставляется способ лечения заболевания или расстройства, связанного с нарушениями эндокринной системы, содержащий введение нуждающемуся в этом человеку лекарственной формы в виде сухого порошка, содержащего микрочастицы ФДКП с удельной площадью поверхности менее чем примерно 67 м2/г и лекарственное вещество, подходящее для лечения указанного заболевания или расстройства. Другой вариант осуществления включает микрочастицы дикетопиперазина, у которых удельная площадь поверхности находится в пределах от примерно 35 м2/г до примерно 67 м2/г. Другой вариант осуществления включает содержащие активное вещество микрочастицы дикетопиперазина с удельной площадью поверхности менее чем примерно 62 м2/г. Один из вариантов осуществления включает способ лечения расстройства, связанного с инсулином, содержащий введение сухого порошка, содержащего описанные выше микрочастицы ФДКП нуждающемуся в этом человеку. Способ включает введение субъекту лекарственной формы в виде сухого порошка, содержащей микрочастицы фумарилдикетопиперазина, SSA которых находится в вышеуказанных диапазонах. В различных вариантах осуществления связанное с инсулином расстройство может в частности включать или исключить все или любое из следующих расстройств: предиабет, сахарный диабет типа 1 (фаза “медового месяца” (ремиссии), фаза после медового месяца, или обе), сахарный диабет типа 2, гестационный диабет, гипогликемия, гипергликемия, инсулиновая резистентность, секреторная дисфункция, нарушенная ранняя фаза секреции инсулина, потеря функции панкреатических β-клеток, потеря панкреатических β-клеток и нарушение метаболизма. В одном из вариантов осуществления сухой порошок содержит инсулин. В других вариантах осуществления сухой порошок содержит глюкагон, эксендин или GLP-1.
[0015] Другие раскрытые здесь варианты осуществления включают способы получения подходящих для введения в легкие микрочастиц в виде сухого порошка. В одном из вариантов осуществления способ содержит образование микрочастиц дикетопиперазина с удельной площадью поверхности от примерно 35 м2/г до примерно 67 м2/г в пределах 95%-ого доверительного интервала путем подбора условий изготовления для целевого получения микрочастиц с удельной площадью поверхности примерно 52 м2/г. В другом варианте осуществления подбор условий изготовления включает увеличение или уменьшение температуры или концентрации аммиака, уксусной кислоты и/или дикетопиперазина в подаваемом растворе.
[0016] Другой раскрытый здесь вариант осуществления включает способ изготовления микрочастиц, подходящих для введения в легкие в виде сухого порошка, содержащих дикетопиперазин, такой как ФДКП. В одном из вариантов осуществления микрочастицы содержат синтезирование соединения ФДКП или его композиции, причем микрочастицы имеют удельную площадь поверхности от примерно 35 м2/г до примерно 67 м2/г, и определение площади поверхности микрочастиц ФДКП путем оценки этой площади поверхности в м2/г стандартным анализатором для измерения площади поверхности. В других вариантах осуществления удельную площадь поверхности определяют после адсорбции микрочастицей активного агента вместо или дополнительно к определению площади поверхности до введения активного агента; SSA не превышает примерно 62 м2/г. В одном из вариантов осуществления синтез ФДКП включает: a) растворение композиции ФДКП в растворе с основным pH, получая раствор ФДКП; b) предоставление раствора летучей кислоты и c) смешивание раствора ФДКП с раствором летучей кислоты в смесителе с большими сдвиговыми усилиями для получения микрочастиц.
[0017] В конкретных вариантах осуществления способ получения микрочастиц ФДКП с площадью поверхности в пределах от примерно 35 м2/г до примерно 67 м2/г содержит реакцию омыления и перекристаллизацию. В одном из вариантов осуществления раскрывается способ получения микрочастиц в виде сухого порошка, подходящих для введения в легкие, включающий: a) синтез соединения или композиции ФДКП, b) растворение соединения ФДКП, полученного на стадии а), в растворе с основным pH с получением раствора ФДКП; d) предоставление раствора летучей кислоты и e) смешивание раствора ФДКП с раствором летучей кислоты в смесителе с большими сдвиговыми усилиями для получения микрочастиц. Способ также может содержать определение удельной площади поверхности частиц после их формирования.
[0018] В конкретных вариантах осуществления способ синтеза микрочастиц ФДКП с удельной площадью поверхности, не превышающей примерно 67 м2/г, содержит подачу равных масс примерно 10,5 вес.% раствора уксусной кислоты и примерно 2,5 вес.% раствора ФДКП при температуре от примерно 14°C до примерно 18°C через смеситель с большими сдвиговыми усилиями, такой как Dual-feed SONOLATOR™, под давлением 2000 psi через отверстие площадью 0,001 дюйм2 для получения суспензии. Способ может дополнительно содержать этап осаждения микрочастиц из раствора и сбора микрочастиц, образованных в резервуаре с деионизированной водой, примерно такой же массы и температуры. В этом варианте осуществления суспензия содержит примерно 0,8% твердых микрочастиц. В некоторых вариантах осуществления способ также включает концентрирование суспензии микрочастиц путем промывки микрочастиц, например, в деионизированной воде, используя способ фильтрации с тангенциальным потоком. В этом и других вариантах осуществления осадок может быть сначала сконцентрирован до примерно 4% твердых частиц, а затем промыт деионизированной водой. В некоторых вариантах осуществления суспензию обычно можно концентрировать до примерно 10% твердых частиц из расчета на исходную массу используемой композиции ФДКП. Концентрированную суспензию можно оценить на содержание твердых частиц способом сушки в сушильном шкафу. В раскрытых здесь вариантах осуществления способ дополнительно содержит определение площади поверхности частиц после их сушки.
[0019] В конкретных вариантах осуществления раскрытых в настоящем описании композиций и способов в микрочастицах дикетопиперазина с удельной площадью поверхности менее чем примерно 67 м2/г используется дикетопиперазин формулы 2,5-дикето-3,6-бис(N-X-4-аминобутил)пиперазин, в котором X выбирают из группы, состоящей из фумарила, сукцинила, малеила и глутарила. В приведенном в качестве примера варианте осуществления дикетопиперазин имеет формулу (бис-3,6-(N-фумарил-4-аминобутил)-2,5-дикетопиперазин или 2,5-дикето-3,6-бис(N-фумарил-4-амино-бутил)пиперазин.
[0020] Другой раскрытый здесь вариант осуществления включает способ изготовления микрочастиц ФДКП с удельной площадью поверхности менее чем примерно 67 м2/г , содержащих лекарственное вещество или активный агент, причем указанную удельную площадь поверхности определяют до введения в частицу лекарственного вещества. В этом варианте осуществления способ содержит добавление в суспензию микрочастиц раствора, содержащего активный агент, такой как пептид, в том числе инсулин, глюкагон, глюкагон-подобный пептид-1, оксинтомодулин, пептид YY и т.п.; добавление в суспензию водного раствора аммиака, например, для повышения pH суспензии до 4,5; проведение реакции, мгновенную заморозку полученной суспензии в жидком азоте и лиофилизацию образованных пеллет для получения сухого порошка, содержащего микрочастицы ФДКП с удельной площадью поверхности менее чем примерно 67 м2/г. В аспекте этого варианта осуществления удельная площадь поверхности микрочастиц после адсорбции микрочастицей активного агента не превышает примерно 62 м2/г.
[0021] В одном из вариантов осуществления раскрыт способ доставки инсулина нуждающемуся в этом пациенту, содержащий введение сухого порошка, содержащего микрочастицы дикетопиперазина с удельной площадью поверхности менее чем примерно 62 м2/г (67 м2/г из расчета загруженной микрочастицы), глубоко в легкие путем вдыхания пациентом сухого порошка. В аспектах этого варианта осуществления определены конкретные признаки системы ингалятора.
[0022] Другой раскрытый здесь вариант осуществления содержит способ доставки лекарственного вещества, например инсулина, нуждающемуся в этом пациенту, содержащий введение сухого порошка глубоко в легкие путем вдыхания пациентом сухого порошка; причем сухой порошок содержит микрочастицы дикетопиперазина, содержащие инсулин, где микрочастицы образованы из дикетопиперазина и имеют площадь поверхности в пределах от примерно 35 м2/г до примерно 67 м2/г. В одном из аспектов этого варианта осуществления удельная площадь поверхности микрочастиц после адсорбции на микрочастицу активного агента не превышает 62 м2/г. В аспектах этого варианта осуществления определены конкретные признаки системы ингалятора. Другие варианты осуществления включают способы лечения связанного с инсулином расстройства, содержащие введение сухого порошка, как описано выше, нуждающемуся в этом человеку. В различных вариантах осуществления связанное с инсулином расстройство может в частности включать или исключить все или любое из следующих нарушений: предиабет, сахарный диабет типа 1 (фаза “медового месяца”, фаза после медового месяца, или обе фазы), сахарный диабет типа 2, гестационный диабет, гипогликемия, гипергликемия, инсулиновая резистентность, секреторная дисфункция, нарушенная ранняя фаза секреции инсулина, потеря функции панкреатических β-клеток, потеря панкреатических β-клеток и нарушение метаболизма.
[0023] В одном из вариантов осуществления предоставляется способ лечения заболевания или расстройства, связанного с нарушением эндокринной системы, содержащий введение нуждающемуся в этом человеку лекарственной формы в виде сухого порошка, содержащей микрочастицы ФДКП с удельной площадью поверхности менее чем примерно 67 м2/г, и лекарственное вещество, подходящее для лечения указанного заболевания или расстройства. В одном из аспектов этого варианта осуществления удельная площадь поверхности микрочастиц после адсорбции активного агента на микрочастицу не превышает примерно 62 м2/г. Один из вариантов осуществления включает способ лечения связанного с инсулином расстройства, включающий введение сухого порошка, содержащего микрочастицы ФДКП, как описано выше, нуждающемуся в этом человеку. Способ включает введение субъекту лекарственной формы в виде сухого порошка, содержащей микрочастицы ФДКП с удельной площадью поверхности, не превышающей примерно 67 м2/г, и инсулин. В аспекте этого варианта осуществления удельная площадь поверхности микрочастиц после адсорбции активного агента на микрочастицу не превышает примерно 62 м2/г. В различных вариантах осуществления связанное с инсулином расстройство может, в частности, включать или исключать все или любое из следующих нарушений: предиабет, сахарный диабет типа 1 (фаза “медового месяца”, фаза после медового месяца, или обе фазы), сахарный диабет типа 2, гестационный диабет, гипогликемия, гипергликемия, инсулиновая резистентность, секреторная дисфункция, нарушенная ранняя фаза секреции инсулина, потеря функции панкреатических β-клеток, потеря панкреатических β-клеток и нарушение метаболизма.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0024] Приведенные ниже чертежи являются частью настоящего описания и включены для дополнительной иллюстрации некоторых аспектов раскрытых здесь примеров. Раскрытие может быть лучше понято со ссылкой на один или несколько этих чертежей в комбинации с подробным описанием представленных здесь конкретных вариантов осуществления.
[0025] На Фиг.1A и 1B показаны микрочастицы с высокой и низкой удельной площадью поверхности (SSA) соответственно.
[0026] На Фиг.2 показана микрочастица фумарилдикетопиперазина (ФДКП), имеющая в целом вид сферы.
[0027] На Фиг.3 показана блок-схема процесса получения ФДКП.
[0028] На Фиг.4A и 4B показана оцененная и фактическая SSA порошков, состоящих из микрочастиц/инсулина, полученных согласно блок-схеме, приведенной на Фиг.3.
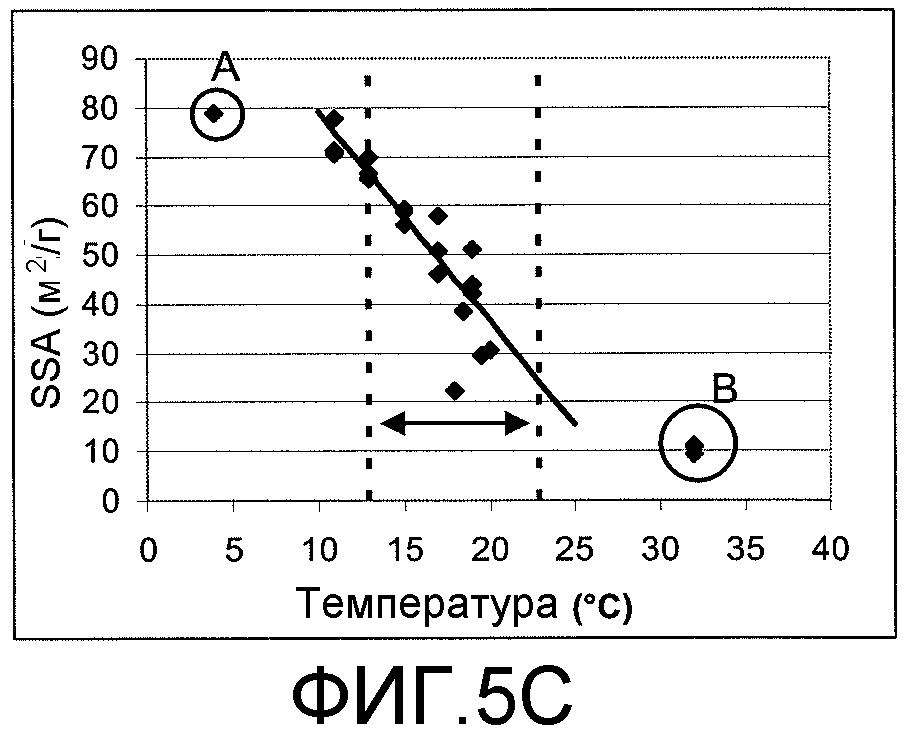
[0029] На Фиг.5A-C показана зависимость между RF/порция, SSA (микрочастиц ФДКП) и температурой подаваемого раствора.
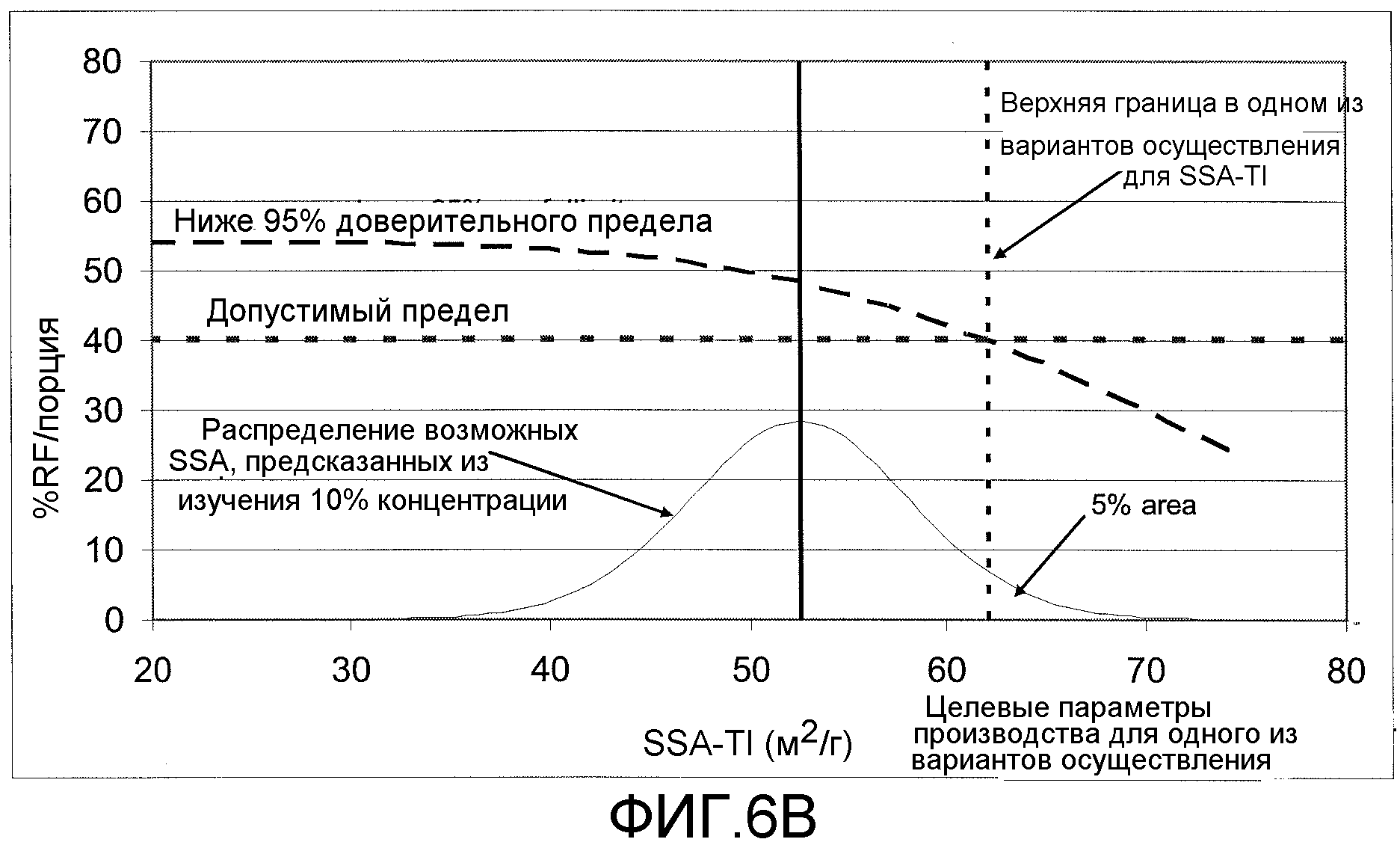
[0030] На Фиг.6A показана зависимость между параметром RF/порция и SSA порошков, состоящих из микрочастиц/инсулина, и показано, что порошки с SSA> примерно 62 м2/г имеют 5% вероятность для значений параметра RF/порция <40%. На Фиг.6B показаны целевые значения для SSA при производстве вследствие неточности прогнозирования SSA на основе подаваемых концентраций.
[0031] На Фиг.7 показан параметр RF/порция как функция SSA порошков, состоящих из микрочастиц/инсулина. Каждая точка представляет отдельную партию порошков, состоящих из микрочастиц/инсулина.
[0032] На Фиг.8A показано влияние SSA порошков, состоящих из микрочастиц/инсулина, на эффективную вязкость суспензии микрочастиц, содержащую примерно 4% твердых частиц. На Фиг.8B показано соотношение между вязкостью суспензии и эффективностью порошка.
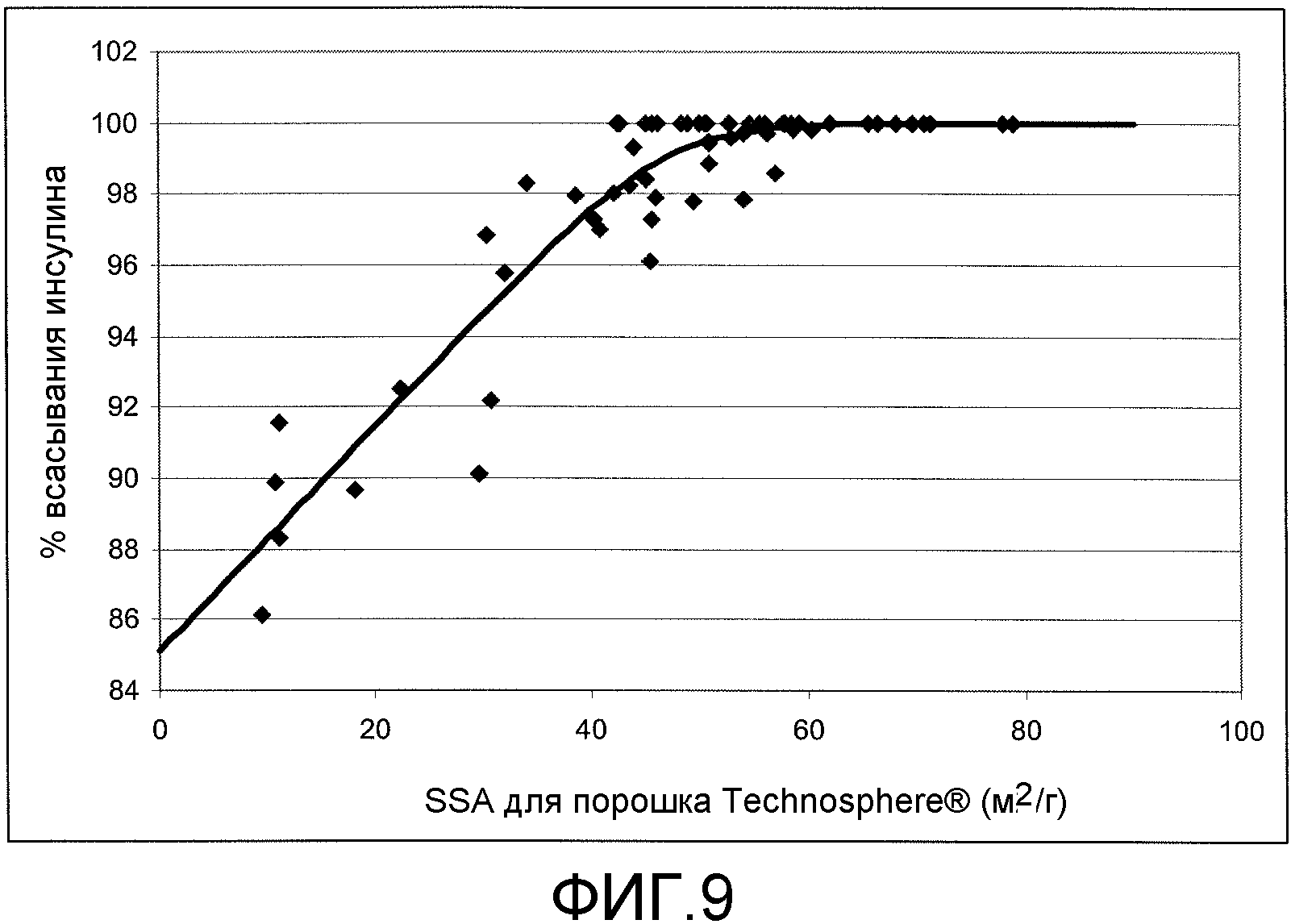
[0033] На Фиг.9 показана концентрация инсулина в осадке как функция от SSA микрочастиц ФДКП.
ПОДРОБНОЕ ОПИСАНИЕ
[0034] Как указано выше, доставка лекарственного вещества в легкие имеет много преимуществ. Однако в легкие трудно доставлять постоянный объем и вес лекарственного вещества из-за проблем, связанных с транспортировкой лекарственных веществ через естественные физические барьеры. В настоящем описании раскрыты микрочастицы дикетопиперазина с удельной площадью поверхности менее чем примерно 67 м2/г в качестве агентов доставки лекарственного вещества, способы получения микрочастиц и способы лечения с использованием этих микрочастиц.
[0035] Используемый здесь термин “микрочастица” относится к частице с диаметром от примерно 0,5 мкм до примерно 1000 мкм, независимо от ее точной внешней или внутренней структуры. Микрочастицы, имеющие диаметр от примерно 0,5 мкм до примерно 10 мкм, могут достигать легких, успешно проходя через большинство естественных барьеров. Для прохождения через изгиб в горле требуется диаметр менее чем примерно 10 мкм, а для того чтобы предотвратить выдыхание частиц, требуется диаметр примерно 0,5 мкм или более. Для глубокого проникновения в легкое (или альвеолярную область), где, как предполагается, происходит самое эффективное всасывание, предпочтительно максимизировать долю частиц, содержащихся во “вдыхаемой фракции” (RF), которая согласно общепринятому мнению представляет собой частицы с аэродинамическим диаметром от примерно 0,5 мкм до примерно 5,7 мкм, хотя, согласно некоторым ссылкам, используются несколько другие диапазоны, измеренные стандартными методами, например каскадным импактором Андерсена. Для измерения аэродинамического размера частиц можно использовать другие импакторы, такие как импактор нового поколения NEXT GENERATION IMPACTOR™ (NGI™, корпорация MSP), при этом определенная этим способом вдыхаемая фракция имеет аналогичные аэродинамические размеры, например <6,4 мкм. В некоторых вариантах осуществления для определения размера частиц применяют устройство с использованием дифракции лазерного излучения, например устройство с использованием дифракции лазерного излучения, раскрытое в американской заявке на патент 12/727179 (поданной 18 марта 2010, которая включена в настоящее описание во всей его полноте в части релевантной настоящему описанию), где для оценки эффективности ингаляционной системы измеряли волюметрический средний геометрический диаметр (VMGD) частиц. Например, в различных вариантах осуществления картриджа значение опустошения на ≥80%, 85% или 90% и VMGD испускаемых частиц ≤12,5 мкм, ≤7,0 мкм или ≤4,8 мкм могут указывать на улучшение аэродинамической характеристики. Раскрытые здесь варианты осуществления показывают, что микрочастицы ФДКП с удельной площадью поверхности менее чем примерно 67 м2/г демонстрируют характеристики, благоприятные для доставки лекарственных веществ в легкие, такие как улучшенная аэродинамическая характеристика.
[0036] Вдыхаемая фракция на порцию (RF/порция) представляет процент вылетающих частиц от полной дозы, размер которых является подходящим для доставки в легкие, которая является мерой аэродинамической характеристики микрочастиц. Как описано в настоящем документе, значение RF/порция, равное 40% или превышающее 40%, отражает приемлемые аэродинамические характеристики. В некоторых раскрытых здесь вариантах осуществления вдыхаемая фракция на порцию может превышать 50%. В приведенном в качестве примера варианте осуществления вдыхаемая фракция на порцию может доходить до примерно 80%, где примерно 80% порции вылетающих частиц имеет размер <5,8 мкм согласно измерениям с помощью стандартных методов.
[0037] Используемый здесь термин “сухой порошок” относится к мелкодисперсной композиции, которая не суспендирована и не растворена в пропелленте, носителе или другой жидкости. Это не означает обязательное полное отсутствие молекул воды.
[0038] Следует иметь в виду, что конкретное значение параметра RF/порция может зависеть от ингалятора, используемого для доставки порошка. Порошки, как правило, склонны к образованию агломератов, и кристаллические микрочастицы ДКП образуют особенно когезивные порошки. Одной из функций ингалятора для сухих порошков является разрушение агломератов порошка с тем, чтобы получающиеся в результате частицы содержали вдыхаемую фракцию, подходящую для доставки дозы при вдохе. Однако разрушение агломератов когезивных порошков обычно не бывает полным, поэтому гранулометрический состав частиц, наблюдаемый при измерении вдыхаемой фракции, доставляемой ингалятором, не будет соответствовать гранулометрическому составу первичных частиц, т.е. профиль будет сдвинут в сторону более крупных частиц. Конструкции ингаляторов различаются по своей эффективности разрушения агломератов, и таким образом абсолютное значение RF/порция, наблюдаемое для разных конструкций, также меняется. Однако оптимальное значение параметра RF/порция как функция удельной площади поверхности может быть аналогичным для разных ингаляторов.
[0039] Используемый здесь термин “примерно” применяется для указания того, что значение включает стандартное отклонение измерений, характерное для устройства или способа, используемого для определения данного значения.
[0040] Дикетопиперазины
[0041] Один из классов агентов для доставки лекарственных веществ, который использовался для решения проблемы в области фармацевтики, такой как нестабильность лекарственного вещества и/или слабая всасываемость, представляет собой 2,5-дикетопиперазины. 2,5-дикетопиперазины представлены соединением общей формулы 1, как показано ниже, где E1 и E2 представляют собой независимо N или более точно NH. В других вариантах осуществления E1 и/или E2 представляют собой независимо кислород или азот так, что, когда один из заместителей E1 или E2 является кислородом, а другой азотом, то согласно формуле получается аналог по заместителям дикетоморфолина, или, когда и E1 и E2 представляют собой кислород, то согласно формуле получается аналог по заместителям дикетодиоксана.

Формула 1
[0042] Как было показано, такие 2,5-дикетопиперазины могут использоваться для доставки лекарственного вещества, в частности, те из них, которые имеют кислые группы R1 и R2, как описано, например, в патентах США №№ 5352461 “Self-Assembling Diketopiperazine Drug Delivery System”; 5503852 “Method for Making Self-Assembling Diketopiperazine Drug Delivery System”; 6071497 “Microparticles for Lung Delivery Comprising Diketopiperazine” и 6331318 “Carbon-Substituted Diketopiperazine Delivery System”, каждая из которых включена в настоящее описание в виде ссылки во всей полноте той части, которая относится к дикетопиперазинам и доставке лекарственных веществ с помощью дикетопиперазинов. Дикетопиперазины могут быть сформированы в микрочастицы, которые включают лекарственное вещество, или микрочастицы, на которые может быть адсорбировано лекарственное вещество. Комбинация лекарственного вещества и дикетопиперазина может способствовать улучшению стабильности лекарственного вещества и/или характеристикам абсорбции. Эти микрочастицы могут вводиться различными путями введения. В виде сухих порошков эти микрочастицы можно доставлять с помощью ингаляции в определенные области дыхательной системы, включая легкие.
[0043] Такие микрочастицы обычно получают осаждением свободной кислоты (или основания) в условиях основных pH, что дает самоорганизующиеся микрочастицы, составленные из агрегированных кристаллических пластин. Стабильность частицы может быть увеличена с помощью небольшого количества сурфактанта, такого как полисорбат-80, в растворе ДКП, из которого были осаждены частицы (см., например, заявку на патент США 2007/0059373 “Method of drug formulation based on increasing the affinity of crystalline microparticle surfaces for active agents”, которая включена в настоящее описание во всей полноте в виде ссылки в части, относящейся к формированию и загрузке микрочастиц ДКП и их сухих порошков). В конечном счете растворитель может быть удален для получения сухого порошка. Соответствующие способы удаления растворителя включают лиофилизацию и сушку распылением (см., например, заявку на патент США 2007/0196503 “A method for improving the pharmaceutic properties of microparticles comprising diketopiperazine and an active agen” и патент США 6444226 “Purification and stabilization of peptide and protein pharmaceutical agents”, каждый из которых включен в настоящее описание во всей полноте в виде ссылки в части, относящейся к формированию и загрузке микрочастиц ДКП и их сухих порошков). Описанные здесь микрочастицы отличаются от микрочастиц, составленных из солей ДКП. Такие частицы обычно образуются (в противоположность высушенным) сушкой распылением, формируя сферы и/или деформированные сферы аморфной соли (в противоположность свободной кислоте или основанию) с тем, чтобы они были химически, физически и морфологически отдельными единицами. Настоящее раскрытие относится к ФДКП, которое следует рассматривать как свободную кислоту или растворенный анион.
[0044] Способы синтеза дикетопиперазинов описаны, например, у Katchalski и др., J. Amer. Chem. Soc. 68, 879-880 (1946) и Kopple и др., J. Org. Chem. 33 (2), 862-864 (1968), содержание которых полностью включено в настоящее описание в виде ссылки. 2,5-Дикето-3,6-ди(аминобутил)пиперазин (у Katchalski и др. он назван ангидридом лизина) также может быть получен через циклодимеризацию N-ε-P-L-лизина в расплавленном феноле аналогично способу Коппле (Kopple) с последующим удалением блокирующих (P)-групп с использованием соответствующих реагентов и условий. Например, CBz-защитная группа может быть удалена с помощью 4,3 М HBr в уксусной кислоте. Этот путь может быть предпочтительным, поскольку в нем используется коммерчески доступный исходный материал, реакция протекает в условиях, в которых согласно данным сохраняется стереохимия исходных материалов в продукте, и все стадии могут быть легко увеличены в объеме для использования в промышленном масштабе. Способы синтеза дикетопиперазинов также описаны в патенте США 7709639 “Catalysis of Diketopiperazine Synthesis”, который также включен в настоящее описание в виде ссылки.
[0045] Фумарилдикетопиперазин (бис-3,6-(N-фумарил-4-аминобутил)-2,5-дикето-дикетопиперазин; ФДКП) представляет собой предпочтительный дикетопиперазин для введения в легкие:
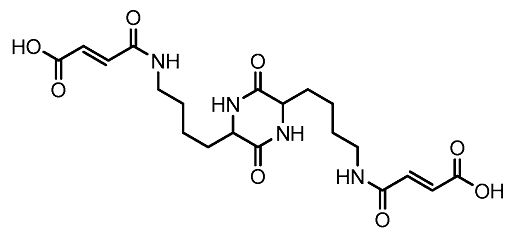
[0046] ФДКП обеспечивает благоприятную матрицу микрочастиц благодаря низкой растворимости в кислоте, которая при этом хорошо растворяется в условиях нейтрального или основного pH. Эти свойства позволяют кристаллизовать ФДКП и способствуют самоорганизации кристаллов в микрочастицы в кислых условиях. Частицы легко растворяются в физиологических условиях с нейтральным pH. Как отмечалось выше, микрочастицы, имеющие диаметр от примерно 0,5 до примерно 10 микрон, могут достигать легких, успешно преодолевая большинство естественных барьеров. Частицы такого размера могут быть легко получены из ФДКП.
[0047] Как отмечалось выше, микрочастицы, имеющие диаметр от примерно 0,5 до примерно 10 микрон, могут достигать легких, успешно преодолевая большинство естественных барьеров. Частицы такого размера могут быть легко получены из дикетопиперазинов с кислыми группами, такими как карбоксилатные группы в ФДКП (а также в родственных молекулах, таких как 2,5-дикето-3,6-ди(4-X-аминобутил)пиперазин, где X представляет собой сукцинил, глутарил или малеил). В случае осаждения в кислой среде формируются самоорганизующиеся частицы, составленные из агрегатов кристаллических пластин. Размер этих пластин связан с удельной площадью поверхности частиц, которая в свою очередь влияет на структуру, норму загрузки и аэродинамическую характеристику частиц.
[0048] Удельная площадь поверхности микрочастиц ДКП является мерой размера среднего кристалла и может использоваться для измерения относительного вклада в характеристики образования кристаллического ядра и роста микрочастицы. Удельная площадь поверхности зависит от размера кристаллов микрочастиц и плотности (ρ) матрицы микрочастицы и обратно пропорциональна характерному размеру, L, кристаллов. Удельная площадь поверхности является отличительной особенностью популяции частиц и не обязательно характеристикой каждой отдельной частицы в ней. Раскрытые здесь варианты осуществления демонстрируют, что микрочастицы с удельной площадью поверхности менее чем примерно 67 м2/г проявляют характеристики, благоприятные для доставки лекарственных веществ в легкие, такие как улучшенная аэродинамическая характеристика при использовании умеренно эффективных ингаляторов, таких как ингалятор MEDTONE®, раскрытый в патенте США 7464706 “Unit Dose Cartridge and Dry Powder Inhaler”, который включен в настоящее описание в виде ссылки в части соответствующей предмету обсуждения. Другой вариант осуществления с удельной площадью поверхности, не превышающей примерно 62 м2/г, обеспечивает более высокую гарантию того, что партия частиц будет соответствовать минимальному стандарту аэродинамической характеристики. Поскольку удельная площадь поверхности влияет также на норму загрузки/содержания лекарственного вещества, в различных вариантах осуществления требуется, чтобы для улучшенной адсорбционной способности лекарственного вещества удельная площадь поверхности превышала или была равна примерно 35 м2/г, 40 м2/г или 45 м2/г. Кроме того, когда удельная площадь поверхности падает ниже примерно 35 м2/г, наблюдается нестабильное опустошение картриджа даже при использовании высокоэффективных ингаляторов, например, раскрытых в американской заявке на патент 12/484125 “A Dry Powder Inhaler and System for Drug Delivery”, поданной 12 июня 2009, и американской заявке на патент 12/717884 “Improved Dry Powder Drug Delivery System”, поданной 4 марта 2010, содержание которых включено в настоящее описание в виде ссылки.
[0049] Верхний предел диапазона удельной площади поверхности
[0050] Верхний предел диапазона удельной площади поверхности, определенный согласно данным настоящего описания, влияет на аэродинамическую характеристику микрочастиц. Описанные здесь исследования продемонстрировали имеющуюся тенденцию к более низким значениям RF/порция, поскольку значения удельной площади поверхности превышают примерно 50 м2/г. Кроме того, когда удельная площадь поверхности увеличивается, также расширяется распределение RF/порция и увеличивается вероятность нарушения критерия выбора RF/порция, например, параметра RF/порция > 40%. Поэтому в некоторых вариантах осуществления верхний предел может быть выбран равным примерно 67 м2/г. Исходя из кривой, аппроксимированной по собранным данным для большого количества препаратов, предсказано, что это значение обеспечивает значение RF/порция, равное 40%. В других вариантах осуществления верхний предел может быть выбран равным примерно 62 м2/г. Верхний предел, равный 62 м2/г, обеспечивает микрочастицы с приемлемыми значениями параметра RF/порция в пределах 95% доверительного интервала (см. Фиг.6A).
[0051] Другая причина установления верхнего предела на удельную площадь поверхности микрочастиц заключается в том, что суспензии микрочастиц с высокой удельной площадью поверхности обычно на несколько порядков более вязкие, чем суспензии микрочастиц с более низкой удельной площадью поверхности. Это явление, вероятно, отражает усиление сил притяжения между частицами, связанное с уменьшением кристаллов. После лиофилизации более сильное притяжение может генерировать агрегаты, которые не разрушаются эффективно, потенциально уменьшая значение параметра RF/порция, поскольку вязкость суспензии имеет отрицательную корреляцию с параметром RF/порция.
[0052] Удельная площадь поверхности микрочастиц определяется для лиофилизированного не расфасованного порошка и не может быть точно предсказана из условий образования микрочастиц. Следовательно, может оказаться желательным получение удельной площади поверхности, равной примерно 52 м2/г. При удельной площади поверхности, равной примерно 52 м2/г, ожидается, что только 5% микрочастиц превысит более консервативный верхний предел 62 м2/г (Фиг.6B). В пределах этих 5% микрочастиц, которые могут превысить 62 м2/г, ожидается, что другие 5% (0,25%) покажут параметр RF/порция < 40%. Таким образом, такие условия изготовления обеспечивают микрочастицы, имеющие параметр RF/порция > 40% с более чем 99% доверительным интервалом.
[0053] Нижний предел удельной площади поверхности
[0054] Нижний предел определенного здесь диапазона удельной площади поверхности зависит от требований загрузки лекарственного вещества. Микрочастицы должны иметь удельную площадь поверхности, которая является достаточной для загрузки требуемого количества лекарственных веществ. Если адсорбируется недостаточное количество лекарственного вещества (т.е. остается в растворе), неадсорбированное лекарственное вещество может “соединять мостиковыми связями” образованные микрочастицы, приводя к образованию агрегатов. Агрегаты могут оказывать отрицательное воздействие на аэродинамические характеристики. В случае инсулина, чтобы избежать образования инсулином мостиковых связей в соответствующей терапевтической дозе, требуется более низкий предел удельной площади поверхности, равный примерно 35 м2/г. Формирование мостиковых связей также является возможной причиной указанного выше плохого опустошения картриджа, которое может наблюдаться в случае порошков с более низкой удельной площадью поверхности. Чтобы обеспечить большую гарантию возможности избежать этих проблем и возможности обеспечить максимальную загрузку, могут использоваться более высокие нижние пределы удельной площади поверхности, например 40 или 45 м2/г. Альтернативно, другие факторы, влияющие на аэродинамическую характеристику, можно поддерживать в более узких пределах допуска. На Фиг.1A показан кластер микрочастиц с высокой удельной площадью поверхности. На Фиг.1B показано соединение частиц “мостиковыми связями”, образованными инсулином, в порошке с низкой удельной площадью поверхности.
[0055] Формирование микрочастиц ФДКП.
[0056] Первая стадия в процессе получения микрочастиц ФДКП представляет собой образование микрочастиц pH-индуцированной кристаллизацией ФДКП и самоорганизацию кристаллов ФДКП в микрочастицы, имеющие в целом сферическую форму (Фиг.2). Следовательно, получение микрочастиц, по существу, представляет собой процесс кристаллизации. Избыток растворителя может быть удален промывкой суспензии, повторным центрифугированием, декантацией и ресуспендированием или диафильтрацией.
[0057] Для получения загруженных инсулином микрочастиц ФДКП инсулин может адсорбироваться непосредственно на микрочастицы по мере добавления (т.е. до лиофилизации) исходного раствора инсулина в суспензию микрочастиц ФДКП. В одном из вариантов осуществления после добавления исходного раствора инсулина также может быть выполнена стадия регулирования уровня pH. Эта стадия может инициировать адсорбцию инсулина на микрочастицы в суспензии перед дальнейшей обработкой. Увеличение pH суспензии до примерно 4,5 способствует полной адсорбции инсулина на микрочастицы в суспензии без чрезмерного вымывания ФДКП из матрицы частиц и также улучшает стабильность инсулина в нерасфасованном продукте лекарственного вещества. Суспензия может быть мгновенно заморожена в виде капель (т.е. подвергнута криогрануляции) в жидком азоте и лиофилизирована для удаления растворителя и получения сухого порошка. В альтернативных вариантах осуществления для получения сухого порошка суспензия может быть высушена распылением. На Фиг.3 приведена блок-схема процесса получения.
[0058] В одном из вариантов осуществления предоставлен производственный процесс получения заявленных микрочастиц ФДКП, содержащих инсулин. Говоря кратко, используя смеситель с большими сдвиговыми усилиями, такой как Dual-feed SONOLATOR™, или, например, смеситель с большими сдвиговыми усилиями, раскрытый в заявке на патент США 61/257311 (поданной 2 ноября 2009, содержание которой полностью включено в настоящее описание в виде ссылки), равные массы примерно 10,5 вес.% раствора уксусной кислоты и примерно 2,5 вес.% раствора ФДКП при температуре примерно 16°C± примерно 2°C (таблицы 1 и 2) можно подавать под давлением 2000 psi, используя Dual-feed SONOLATOR™, через отверстие размером 0,001 дюйм2. Осадок можно собирать в резервуаре с деионизированной водой (DI) с примерно равной массой и температурой. Полученная суспензия содержит примерно 0,8% твердых частиц. Осадок может быть сконцентрирован и промыт фильтрацией с тангенциальным потоком. Осадок может быть сначала сконцентрирован до примерно 4% твердых частиц, затем промыт деионизированной водой. Конечная концентрация суспензии может составлять примерно 10% твердых частиц из расчета на исходную массу ФДКП. Концентрированная суспензия может быть оценена на содержание твердых частиц способом сушки в сушильном шкафу.
[0059] В одном из вариантов осуществления концентрированный исходный раствор инсулина может быть приготовлен из 1 части инсулина и 9 частей примерно 2 вес.% раствора уксусной кислоты. Исходный раствор инсулина можно добавлять в суспензии с помощью гравиметрического дозирования для получения загрузки примерно 11,4 вес.% инсулина. Суспензию инсулин-ФДКП можно перемешивать по меньшей мере примерно 15 минут. В некоторых вариантах осуществления перемешивание может занимать более короткое или более длительное время. Затем суспензию инсулин-ФДКП можно титровать, используя от примерно 14 до примерно 15 вес.% водного раствора аммиака от исходного pH, равного примерно 3,5, до pH, равного примерно 4,5. Суспензия может быть мгновенно заморожена в жидком азоте, образуя пеллеты, и лиофилизирована для получения нерасфасованных содержащих инсулин микрочастиц ФДКП. Пустые микрочастицы ФДКП могут быть получены идентичным способом без стадий загрузки инсулином и регулирования pH. В одном из вариантов осуществления плотность нерасфасованного порошка ФДКП-инсулин, содержащего описанные здесь микрочастицы, составляет примерно от 0,2 г/см3 до примерно 0,3 г/см3.
Отфильтрован через фильтры с размером пор 0,2 мкм
Отфильтрован через фильтры с размером пор 0,2 мкм
[0060] Регулирование удельной площади поверхности
[0061] На распределение размера и форму кристаллов ФДКП влияет баланс между образованием ядра новых кристаллов и ростом уже имеющихся кристаллов. Оба явления находятся в сильной зависимости от концентрации и перенасыщения раствора. Характерный размер кристалла ФДКП является признаком относительной скорости образования ядра и роста. Если доминирует образование ядра, формируется множество кристаллов, но они являются относительно небольшими, поскольку все конкурируют за ФДКП в растворе. Если доминирует рост, то конкурирующих кристаллов меньше и характерный размер кристаллов больше.
[0062] Кристаллизация находится в сильной зависимости от перенасыщения, которое, в свою очередь, сильно зависит от концентрации компонентов в подаваемых потоках. Более сильное перенасыщение приводит к образованию большого количества небольших кристаллов; при более низком перенасыщении образуется меньше кристаллов, но они большие. В терминах перенасыщения: 1) увеличение концентрации ФДКП увеличивает степень перенасыщения; 2) увеличение концентрации аммиака сдвигает систему к более высокому значению pH, так, например, при pH, равном примерно 4,5, увеличивается равновесная растворимость и уменьшается перенасыщение; и 3) увеличение концентрации уксусной кислоты увеличивает перенасыщение, сдвигая конечную точку в сторону более низкого значения pH, при котором равновесная растворимость ниже. Уменьшение концентраций этих компонентов вызывают противоположные эффекты.
[0063] Температура оказывает влияние на формирование микрочастиц ФДКП опосредованно через влияние на растворимость ФДКП и кинетические характеристики образования ядра кристаллов ФДКП и их роста. При низких температурах формируются маленькие кристаллы с высокой удельной площадью поверхности. Суспензии этих частиц демонстрируют высокую вязкость, указывающую на сильное притяжение между частицами. Диапазон температур от примерно 12°C до примерно 26°C обеспечивает параметр RF/порция > 40% в пределах 95% доверительного интервала. Учитывая отношение между температурой и удельной площадью поверхности, можно использовать немного более узкий, но внутренне согласованный температурный диапазон от примерно 13°C до примерно 23°C.
[0064] Наконец, следует иметь в виду, что адсорбция активного агента на поверхности микрочастиц как правило приводит к уменьшению удельной площади поверхности. Адсорбция активного агента может заполнять, или иначе закупоривать, некоторые более узкие пространства между кристаллическими пластинами, которые составляют частицу, таким образом уменьшая удельную площадь поверхности. Кроме того, адсорбция активного агента добавляет массу микрочастице, существенно не затрагивая диаметр (размер) микрочастицы. Поскольку удельная площадь поверхности обратно пропорциональна массе микрочастицы, происходит уменьшение удельной площади поверхности.
[0065] Выбор и включение активных агентов
[0066] При условии сохранения у описанных здесь микрочастиц необходимой удельной площади поверхности менее чем примерно 67 м2/г, они могут принимать другие дополнительные характеристики, благоприятные для доставки в легкие и/или адсорбции лекарственного вещества. В патенте США 6428771 “Method for Drug Delivery to the Pulmonary System”, включенный в настоящее описание в виде ссылки, описывает доставку частиц DKP в легкие. Патент США 6444226 “Purification and Stabilization of Peptide and Protein Pharmaceutical Agents”, также включенный в настоящее описание в виде ссылки, описывают благоприятные способы адсорбции лекарственных веществ на поверхности микрочастиц. Поверхностными свойствами микрочастиц можно управлять для достижения желательных характеристик, как описано в заявке на патент США 11/532063 “Method of Drug Formulation based on Increasing the Affinity of Crystalline Microparticle Surfaces for Active Agents”, которая включена в настоящее описание в виде ссылки. В заявке на патент США 11/532065 “Method of Drug Formulation based on Increasing the Affinity of Active Agents for Crystalline Microparticle Surfaces for Active Agents”, также включенной в настоящее описание в виде ссылки, описан способ стимуляции адсорбции активных агентов на микрочастицы.
[0067] Описанные здесь микрочастицы могут содержать один или несколько активных агентов. Термин “активный агент”, используемый в настоящем описании синонимично с термином “лекарственное вещество”, относится к фармацевтическим веществам, в том числе низкомолекулярным фармацевтическим средствам, биологическим веществам и биологически активным агентам. Активные агенты могут быть естественного происхождения, рекомбинантные или синтетического происхождения, включая белки, полипептиды, пептиды, нуклеиновые кислоты, органические макромолекулы, синтетические органические соединения, полисахариды и другие сахара, жирные кислоты и липиды, а также антитела и их фрагменты, включая, без ограничения, гуманизированные или химерные антитела, F(ab), F(ab)2, только одноцепочечное антитело или слитое с другими полипептидами, или терапевтические или диагностические моноклональные антитела к раковым антигенам. Активные агенты могут охватывать множество видов биологической деятельности и классов, такие как вазоактивные агенты, нейроактивные агенты, гормоны, антикоагулянты, иммуномодулирующие агенты, цитостатические агенты, антибиотики, противовирусные средства, антигены, инфекционные агенты, медиаторы воспаления, гормоны и антигены клеточной поверхности. Более конкретно, активные агенты могут включать, без ограничения, цитокины, липокины, энкефалины, алкины, циклоспорины, анти-IL-8 антитела, IL-8 антагонисты, в том числе ABX-IL-8; простагландины, в том числе PG-12, блокаторы LTB-рецептора, в том числе LY29311, BML 284 и CP105696; триптаны, такие как суматриптан и пальмитолеат, инсулин и его аналоги, гормон роста и его аналоги, паратиреоидный гормон (PTH) и его аналоги, паратиреоидный гормон-родственный пептид (PTHrP), грелин, обестатин, энтеростатин, фактор, стимулирующий образование колоний гранулоцитов (GM-CSF), амилин, аналоги амилина, глюкагон-подобный пептид-1 (GLP-1), клопидогрель, PPACK (D-фенилаланил-L-пролил-L-аргинин хлорметилкетон), оксинтомодулин (OXM), пептид YY (3-36) (PYY), адипонектин, холецистокинин (CCK), секретин, гастрин, глюкагон, мотилин, соматостатин, мозговой натрийуретический пептид (BNP), атриальный натрийуретический пептид (ANP), IGF-1, фактор, высвобождающий гормон роста (GHRF), антагонист рецептора предшественника бета-4 интегрина (ITB4), ноцицептин, ноцистатин, орфанин FQ2, кальцитонин, CGRP, ангиотензин, вещество P, нейрокинин A, панкреатический полипептид, нейропептид Y, дельта-сон индуцирующий пептид и вазоактивный интестинальный пептид. Микрочастицы также могут использоваться для доставки других агентов, например контрастных красителей, таких как техасский красный.
[0068] Содержание лекарственного вещества, доставляемого на микрочастицах, сформированных из ФДКП с удельной площадью поверхности менее чем примерно 67 м2/г, обычно составляет более чем 0,01%. В одном из вариантов осуществления содержание лекарственного вещества, доставляемого микрочастицами с вышеуказанной удельной площадью поверхности, может находиться в пределах от примерно 0,01% до примерно 20%, что является обычным для пептидов, таких как инсулин. Например, если лекарственное вещество представляет собой инсулин, заявленные микрочастицы обычно включают 3-4 Ед/мг (примерно 10-15%) инсулина. В некоторых вариантах осуществления содержание лекарственного вещества в частицах может меняться в зависимости от формы и размера доставляемого лекарственного вещества.
[0069] При условии сохранения описанными здесь микрочастицами необходимой удельной площади поверхности, эти частицы могут приобретать другие дополнительные характеристики, благоприятные для доставки в легкие и/или адсорбции лекарственного вещества. В патенте США 6428771 “Method for Drug Delivery to the Pulmonary System”, включенном в настоящее описание в виде ссылки, описана доставка частиц ДКП в легкие. В патенте США 6444226 “Purification and Stabilization of Peptide and Protein Pharmaceutical Agents”, также включенном в настоящее описание в виде ссылки, описаны благоприятные способы адсорбции лекарственных веществ на поверхности микрочастиц. Свойствами поверхности микрочастицы можно управлять для достижения желательных характеристик, как описано в заявке на патент США 11/532063 “Method of Drug Formulation based on Increasingg the Affinity of Crystalline Microparticles Surface for Active Agents”, которая включена в настоящее описание в виде ссылки. В заявке на патент США 11/532065 “Method of Drug Formulation based on Increasingg the Affinity of Active Agents for Crystalline Microparticles Surface for Active Agents ”, которая также включена в настоящее описание в виде ссылки, описаны способы стимуляции адсорбции активных агентов на микрочастицы.
ПРИМЕРЫ
[0070] Приведенные ниже примеры включены с целью иллюстрации вариантов осуществления раскрытых микрочастиц. Специалистам в данной области техники должно быть очевидным, что раскрытые в приведенных ниже примерах способы представляют собой описанные авторами изобретения способы, которые легко применимы для практической реализации настоящего раскрытия, и таким образом рассматриваются как предпочтительные способы для практической реализации изобретения. Однако, с точки зрения приведенного здесь раскрытия, специалисты в данной области должны понимать, что в конкретных раскрытых вариантах осуществления могут быть сделаны многочисленные модификации, обеспечивая при этом подобный или аналогичный результат.
ПРИМЕР 1
[0071] I. Процедуры изготовления
[0072] A. Общие процедуры изготовления для получения микрочастиц ФДКП/инсулин
[0073] Микрочастицы получали из фумарилдикетопиперазина (ФДКП) и инсулина. ФДКП растворяли в водном NH4OH, получая раствор. Подаваемый поток этого раствора объединяли с подаваемым потоком водного раствора уксусной кислоты (HOAc) в смесителе с большими сдвиговыми усилиями для образования водной суспензии микрочастиц.
[0074] Подаваемый раствор ФДКП получали, используя примерно 2,5 вес.% раствор ФДКП, NH4OH с концентрацией примерно 1,6 вес.% (от примерно 28 до примерно 30 вес.% NH3) и примерно 0,05 вес.% полисорбат 80. Подаваемый раствор уксусной кислоты получали, используя примерно 10,5 вес.% ледяной уксусной кислоты и примерно 0,05 вес.% полисорбата 80. Перед использованием оба подаваемых раствора фильтровали через мембраны с размером пор примерно 0,2 мкм.
[0075] На Фиг.3 изображена блок-схема процесса получения заявленных микрочастиц ФДКП, содержащих инсулин. В этом варианте осуществления с помощью смесителя с большими сдвиговыми усилиями, например, Dual-Feed SONOLATOR™, или смесителя, раскрытого в американской заявке на патент 61/257311 (поданной 2 ноября 2009, раскрытие которой полностью включено в настоящее описание в виде ссылки), равное количество (по массе) каждого подаваемого раствора прокачивали через Dual-Feed SONOLATOR™ с размером отверстий #5 (0,0011 кв. дюймов). Вспомогательный насос был установлен таким образом, чтобы подавать 50% от равных скоростей потока для каждого подаваемого потока, и давление подачи составляло примерно 2000 psi. Принимающий сосуд содержал DI воду, масса которой равна массе любого из подаваемых растворов (например, через SONOLATOR™ можно прокачивать 4 кг подаваемого раствора ФДКП и 4 кг подаваемого раствора HOAc в принимающий сосуд, содержащий 4 кг DI воды).
[0076] Полученную суспензию концентрировали и промывали с помощью фильтрации с тангенциальным потоком, используя 0,2 м2 PES (полиэтерсульфоновую) мембрану. Суспензии сначала концентрировали до примерно 4% твердых частиц, затем проводили диафильтрацию DI водой и, наконец, концентрировали до примерно 16% твердых частиц с номинальными характеристиками. Фактический процент твердых частиц промытой суспензии определяли “потерей при высыхании”. Для измерения процента твердых частиц в суспензии можно использовать альтернативные способы, например раскрытые в заявке на патент США 61/332292, поданной 7 мая 2010, “Determining Percent Solids in Suspension Using Raman Spectroscopy”, включенной в настоящее описание в виде ссылки.
[0077] Исходные растворы инсулина готовили таким образом, чтобы они содержали примерно 10 вес.% инсулина (в готовом виде) в растворителе, содержащем примерно 2 вес.% HOAc в DI воде, и стерилизовали фильтрацией. Исходя из содержания твердых частиц в суспензии, соответствующее количество исходного раствора добавляли в перемешанную суспензию. Затем исходное значение рН, равное примерно 3,6, полученной суспензии микрочастица/инсулин доводили до значения pH, равного примерно 4,5, используя раствор аммиака.
[0078] Суспензию, содержащую микрочастицы ФДКП, содержащие инсулин, переносили в криогранулятор/таблетирующую машину, например, раскрытую в заявке на патент США 61/257385, поданной 2 ноября 2009, раскрытие которой полностью включено в настоящее описание в виде ссылки, и гранулировали моментальной заморозкой в жидком азоте. Ледяные пеллеты лиофилизировали, получая сухой порошок.
[0079] B. Производственная процедура получения микрочастицы ФДКП/инсулин, использованная в исследованиях со значениями 5% и 10%
[0080] В исследованиях со значениями 5% и 10% изучали влияние подаваемых концентраций на удельную площадь поверхности и аэродинамические характеристики порошка. В исследованиях со значениями 5% проводили эксперименты для определения влияния трех факторов, т.е. концентрации ФДКП, аммиака и уксусной кислоты, которое изучали с помощью 3×3 факторного эксперимента, в котором высокие и низкие уровни составляли 5% от контрольных условий. В исследованиях со значениями 10% концентрации ФДКП, аммиака и уксусной кислоты также изучали, используя 3х3 факторный эксперимент, однако высокие и низкие уровни составляли 10% от контрольных условий.
[0081] C. Конечные измерения
[0082] Вдыхаемую фракцию (RF/порция) нефасованных порошков, которая является мерой аэродинамической характеристики и гранулометрического состава микрочастиц, определяли путем тестирования с помощью каскадного импактора Андерсена. Для получения значения для параметра RF/порция картриджи заполняли нерасфасованным порошком и выдували через ингалятор MEDTONE® со скоростью примерно 30 л/мин. Порошок, собранный в каждом каскаде ингалятора, взвешивали, а общее количество собранного порошка нормализовали относительно общего количества в заполненном картридже. Следовательно, параметр RF/порция представляет собой порошок, собранный на этих каскадах импактора, и представляет вдыхаемую фракцию, деленную на количество порошка, загруженного в картридж.
[0083] Удельную площадь поверхности (SSA) микрочастиц определяли путем адсорбции азота и регистрировали в терминах площади поверхности BET (Брунауэр-Эммет-Теллер (Brunauer-Emmett-Teller)), используя анализатор удельной площади поверхности (анализатор площади поверхности и пористости MICROMERITICS® TriStar 3000). Удельная площадь поверхности зависит от размера кристаллов и плотности (ρ) матрицы микрочастиц и обратно пропорциональна характерному размеру, L, кристаллов FDKP:
[0084] II.Влияние условий подачи на удельную площадь поверхности
[0085] Удельную площадь поверхности измеряли во всех порошках, полученных в исследованиях со значениями 5% и 10%. Удельную площадь поверхности предсказали с помощью линейных регрессионных уравнений (см. Фиг.3). Стандартные отклонения предсказаний составляли ±2 м2/г для исследований со значениями 5% и ±5,6 м2/г для исследований со значениями 10%. Эти результаты соответствовали теоретическим ожиданиям: более высокие концентрации ФДКП, более высокие концентрации HOAc или более низкие концентрации аммиака увеличивали удельную площадь поверхности (были получены более мелкие кристаллы), способствуя образованию ядра кристаллов.
[0086] III. Влияние температуры
[0087] Влияние температуры на свойства частиц изучали в серии исследований, в которых характеристики подаваемого раствора, за исключением температуры, выставляли согласно условиям в контроле. Температура подаваемого раствора находилась в диапазоне от 4 до 32°C. Определяли как удельную площадь поверхности порошков микрочастиц, так и параметр RF/порция полученных порошков микрочастиц.
[0088] Зависимости между параметром RF/порция, удельной площадью поверхности и температурой показаны на Фиг.5 (параметр RF/порция определяли с инсулином, содержащим микрочастицы; удельная площадь поверхности, приведенная на графике, представляет собой удельную площадь поверхности, определенную для частиц до адсорбции инсулина). Параметр RF/порция порошков микрочастиц была максимальной при температурах, близких примерно к 18°C-19°C (Фиг. 5A). Кривая, изображенная пунктирными линиями, представляет собой односторонний нижний 95% доверительный интервал предсказания (т.е. значения, находящиеся выше кривой, ожидаются с 95% вероятностью). Температура в диапазоне от примерно 12°C до примерно 26°C обеспечивает параметр RF/порция >40% с 95% уровнем достоверности. На графике зависимости параметра RF/порция от удельной площади поверхности чистых (без лекарственного вещества) порошков микрочастиц (Фиг.5B) полученная кривая похожа на кривую для температуры. Однако порядок расположения точек обратный. (Например, образец “А” теперь появляется на правом конце оси, в то время как образец “В” расположен слева). Микрочастицы с удельной площадью поверхности 26-67 м2/г обеспечивают параметр RF/порция >40% с 95% уровнем достоверности. Учитывая связь между температурой и удельной площадью поверхности (Фиг.5C), для образования частиц был определен немного более узкий, но внутренне согласованный температурный диапазон от примерно 13°C до примерно 23°C.
[0089] IV. Влияние удельной площади поверхности на RF/порция
[0090] Имеется тенденция сдвига в сторону меньших значений параметра RF/порция при значениях удельной площади поверхности выше примерно 50 м2/г (Фиг.6A). Верхний предел, равный примерно 62 м2/г, можно использовать, все еще сохраняя 95% доверительный предел при соответствующих значениях параметра RF/порция (т.е. >40%; Фиг.6B).
[0091] На Фиг.7 показано, что с увеличением удельной площади поверхности в верхнем пределе происходит расширение распределения параметра RF/порция, и при этом присутствует более высокая вероятность несоответствия критерию RF/порция >40%. На Фиг.8a показано, что суспензии микрочастиц с высокой удельной площадью поверхности, например примерно 67 м2/г, имеют тенденцию увеличения вязкости на порядок согласно измерениям, проведенным с помощью вискозиметра Брукфильда (Brookfield Engineering Laboratories, Inc., Middleboro, Массачусетс) по сравнению с суспензией микрочастиц с более низкой удельной площадью поверхности, например, примерно <14 м2/г. На Фиг.8B показано, что вязкость суспензии обратно пропорциональна RF/порция.
[0092] V. Удельная площадь поверхности и адсорбция инсулина
[0093] Изучали зависимость между удельной площадью поверхности и адсорбцией инсулина.
[0094] Суспензии микрочастиц получали описанным выше способом для партий в исследованиях со значениями 5% и 10% и загружали инсулином на примерно 11,4%. Кроме того, также изучали микрочастицы, образованные с контрольными подаваемыми концентрациями, но температурой подаваемого раствора в пределах от примерно 4°C до примерно 32°C. Оттитрованные суспензии имели значение pH, повышающееся от примерно 3,6 до примерно 4,5, с использованием серийного добавления единичных капель 14 вес.% аммиака. Образцы оттитрованной суспензии и осадок оценивали в отношении концентрации инсулина. Все суспензии (оттитрованные и неоттитрованные) лиофилизировали для получения сухих порошков. Порошки тестировали на удельную площадь поверхности, используя MICROMERITICS® TriStar 3000.
[0095] При низкой удельной площади поверхности имеется линейная зависимость между количеством несвязанного инсулина и удельной площадью поверхности (Фиг.9). Адсорбция по меньшей мере 95% инсулина происходит, когда удельная площадь поверхности больше чем примерно 35 м2/г. Степень адсорбции инсулина продолжает увеличиваться с увеличением удельной площади поверхности до примерно 40 м2/г. Выше этой удельной площади поверхности микрочастицы адсорбировали практически весь инсулин.
[0096] Результаты этих исследований определяют благоприятные нижние и верхние пределы удельной площади поверхности микрочастиц в диапазоне от примерно 35 м2/г до примерно 62 м2/г. Предоставление микрочастиц, в которых более чем 80%, или более чем 90%, или более чем 95% микрочастиц, имеют удельную площадь поверхности в этом диапазоне, обеспечивает микрочастицы с благоприятными параметрами RF/порция и адсорбционными характеристиками лекарственного вещества в 95% доверительном пределе.
ПРИМЕР 2
[0097] Анализ геометрического размера частиц выдуваемой лекарственной формы с помощью характеристики волюметрического среднего геометрического диаметра (VMGD)
[0098] Применение дифракции с использованием лазерного рассеяния для лекарственных форм в виде сухих порошков, испускаемых из ингаляторов для сухих порошков, является общепринятым методом, используемым для характеристики уровня разрушения агломератов, возникающих в порошке. Метод относится к измерению геометрического размера, а не аэродинамического размера, что характерно для используемого в промышленности стандартного метода столкновений. Обычно геометрический размер испускаемого порошка включает волюметрическое распределение, характеризуемое средним размером частиц, VMGD. Важно то, что геометрические размеры испускаемых частиц различаются с более высоким разрешением по сравнению с аэродинамическими размерами, предоставленными способами столкновения. Предпочтительными являются более мелкие размеры, что приводит к большей вероятности доставки отдельных частиц в легочные дыхательные пути. Таким образом, различия в разрушении агломератов в ингаляторе и окончательной эффективности могут быть легче определены с помощью дифракции. В этих экспериментах ингаляторы тестировали, применяя дифракцию с использованием рассеяния лазерного излучения при давлениях, аналогичных силе реального вдоха пациента, для определения эффективности ингаляционной системы в отношении разрушения агломератов порошкообразных лекарственных форм. В частности, лекарственные формы включали когезионные порошки дикетопиперазина с загруженным активным ингредиентом - инсулином и без него. Эти порошкообразные лекарственные формы имели удельные площади поверхности, отношения изомеров и индексы Карра. В таблице 4 приведены VMGD и эффективность контейнера, опустошаемого во время тестирования. Порошки FDKP имеют индекс Карра, равный примерно 50, а TI порошка имеет индекс Карра, равный примерно 40.
[0099] Данные в таблице 4 показывают более высокую степень разрушения агломератов порошка в ингаляторах, идентифицированных как DPI2, по сравнению с системой ингалятора MEDTONE®. Лекарственные формы дикетопиперазина с площадью поверхности в пределах от 14-56 м2/г продемонстрировали эффективность опустошения, превышающую 85%, а VMGD меньше 7 микрон. Аналогично, лекарственные формы, имеющие отношение транс-изомеров в пределах от 45-66%, продемонстрировали улучшенную эффективность по сравнению с устройством-образцом. Однако стоит отметить, что даже в случае более эффективного ингалятора при <15 м2/г имеется уменьшение показателя опустошения картриджа, указывающее на падение (уменьшение) аэродинамической характеристики, поскольку содержание транс-изомера отступает от желательного диапазона, раскрытого здесь. Наконец, было показано, что эффективность системы ингалятора с лекарственными формами, охарактеризованными индексами Карра, равными 40-50, также были лучше по сравнению с устройством-образцом. Во всех случаях указанные значения VMGD были ниже 7 микрон.
[00100] Если не указано иное, все числовые значения, выражающие количество компонентов, свойства, такие как молекулярная масса, условия реакции, и т.д., используемые в описании и формуле изобретения, следует понимать как охарактеризованные во всех случаях с использованием термина “примерно”. Следовательно, если не обозначено иное, числовые параметры, указанные в описании и прилагаемой формуле изобретения, являются приблизительными значениями, которые могут измениться в зависимости от желательных свойств, которые требуется получить в настоящем изобретении. По меньшей мере, но не в качестве попытки ограничить возможность применения доктрины эквивалентов в отношении объема формулы изобретения, каждый числовой параметр следует рассматривать по меньшей мере с учетом количества значащих цифр и применения обычных методов округления. Несмотря на то, что числовые диапазоны и параметры, определяющие объем изобретения, являются приближенными значениями, числовые значения, приведенные в конкретных примерах, указаны с максимально возможной точностью. Однако любое числовое значение естественным образом содержит определенные ошибки, являющиеся результатом стандартного отклонения, присущего соответствующим им измерениям при тестировании.
[00101] Термины, указанные в грамматических формах единственного числа, используемые в контексте описания изобретения (особенно в контексте приведенной ниже формулы изобретения), следует рассматривать, как охватывающие как единственное, так и множественное число, если не указано иное, или это очевидным образом противоречит контексту. Указание диапазонов значений в настоящем документе следует рассматривать как компактный способ указания каждого отдельного значения, находящегося внутри указанного диапазона. Если не указано иное, каждое отдельное значение включено в описание, как если бы оно было бы указано отдельно. Все описанные здесь способы могут быть выполнены в любом подходящем порядке, если не указано иное или если это не находится в явном противоречии с контекстом. Использование любого из примеров, или формулировок, подразумевающих перечисление примеров (например, “такой как”), предназначено только для лучшего освещения изобретения и не предназначено для ограничения объема заявленного изобретения. Никакие формулировки, используемые в описании, не следует рассматривать как указание на какой-либо незаявленный элемент, существенный для практического осуществления изобретения.
[00102] Использование термина “или” в формуле изобретения используется для обозначения “и/или”, если в явном виде не относится только к альтернативам, или альтернативы являются взаимоисключающими, хотя раскрытие поддерживает определение, которое относится только к альтернативам и “и/или”.
[00103] Группирование альтернативных элементов или вариантов осуществления раскрытого здесь изобретения не следует рассматривать как ограничения. Каждый элемент группы может быть упомянут и заявлен отдельно или в любой комбинации с другими элементами группы или другими элементами, перечисленными в настоящем документе. Предполагается, что один или несколько элементов группы могут быть включены или удалены из группы по причинам удобства и/или патентоспособности. При осуществлении любого такого включения или удаления предполагается, что описание содержит группу в модифицированном виде, таким образом раскрывая все группы Маркуша, используемые в прилагаемой формуле изобретения.
[00104] В настоящем документе описаны предпочтительные варианты осуществления настоящего изобретения, включая наилучший способ осуществления изобретения, известный авторам изобретения. Изменения таких предпочтительных вариантов осуществления будут очевидными для специалистов в данной области техники после ознакомления с приведенным выше описанием. Авторы изобретения предполагают, что специалисты в данной области будут подходящим образом использовать такие изменения, и авторы изобретения предполагают, что изобретение может быть осуществлено иначе чем, в частности, описано здесь. Следовательно, настоящее изобретение включает все модификации и эквиваленты объекта изобретения, раскрытого в прилагаемой формуле изобретения, в части определяемой соответствующим законодательством. Кроме того, любая комбинация вышеописанных элементов во всех ее возможных вариациях охватывается изобретением, если не обозначено иное или иное в явном виде не противоречит контексту.
[00105] Раскрытые здесь конкретные варианты осуществления могут быть дополнительно ограничены использованием в формуле изобретения выражений “состоящей из” “состоящий по существу из”. В случае использования в формуле изобретения, либо в первоначальном виде, либо в уточненном виде, переходной термин “состоящий из” исключает любой элемент, стадию или компонент, не определенный в формуле изобретения. Переходной термин “по существу состоящий из” ограничивает объем формулы изобретения указанными материалами или стадиями и теми, которые существенно не затрагивают основную и новую характеристику(и). Варианты осуществления изобретения, охарактеризованные таким образом в формуле изобретения, в явном виде описаны и подтверждены настоящим описанием.
[00106] Кроме того, в тексте описания были приведены многочисленные ссылки на патенты и печатные публикации. Каждая из вышеупомянутых ссылок и публикаций включена в настоящее описание отдельно во всей полноте в виде ссылки.
[00107] Кроме того, следует иметь в виду, что варианты осуществления раскрытого здесь изобретения представляют собой иллюстративные принципы настоящего изобретения. Другие возможные модификации также находятся в объеме изобретения. Таким образом, в качестве примера, а не ограничения, альтернативные конфигурации настоящего изобретения также могут быть использованы в соответствии с приведенным здесь описанием. Таким образом, настоящее изобретение не ограничено в точности тем, как оно показано и описано.
Реферат
Настоящее изобретение относится к микрочастицам фумарилдикетопиперазина (ФДКП), которые подходят для доставки в легкие, обладающие удельной площадью поверхности от 15 м/г до 67 м/г и диаметром от 0,5 мкм до 10 мкм. Изобретение также относится к сухому порошку, включающему указанные микрочастицы, который также подходит для доставки в легкие, ингаляционной системе, содержащей ингалятор для вдыхания порошка и указанный сухой порошок, а также к способу доставки активного агента, содержащегося в сухом порошке, путем вдыхания указанного сухого порошка. Также раскрываются способы образования микрочастиц ФДКП, первый из которых включает растворение ФДКП в водном растворе аммиака, добавление кислого раствора к раствору аммиака при температуре от 12ºС до 26ºС и сбор осадка, содержащего микрочастицы ФДКП, после промывания деионизированной водой. Второй способ образования микрочастиц ФДКП включает подачу равных масс 10,5 вес.% раствора уксусной кислоты и 2,5 вес.% раствора ФДКП при температуре 14-18ºС через мешалку с большими сдвиговыми усилиями. Изобретение направлено на получение подходящих для введения в легкие микрочастиц ФДКП, которые обладают хорошей аэродинамической характеристикой и обеспечивают улучшенное всасывание лекарственных веществ. 6 н. и 12 з.п. ф-лы, 4 табл., 9 ил., 2 пр.
Формула
a) растворение фумарилдикетопиперазина в подаваемом водном растворе аммиака;
b) добавление кислого раствора к подаваемому водному раствору аммиака для получения смеси;
c) подбор производственных условий для целевого получения микрочастиц с удельной площадью поверхности, равной 52 м2/г, где подбор производственных условий включает предоставление указанного подаваемого раствора при температуре между 12°C и 26°C; и
d) сбор осадка после нескольких промываний деионизированной водой, где осадок содержит микрочастицы ФДКП с удельной площадью поверхности в пределах от 35 м2/г до 67 м2/г.

Комментарии