Композиция для местного лечения ран - RU2653488C2
Код документа: RU2653488C2
Описание
Область техники изобретения
Настоящее изобретение относится, в частности, к композициям в форме гелей и растворов, содержащим полигексаметиленбигуанид (ПГМБ), очищенную воду и триблоксополимеры полиэтиленоксида и полипропиленоксида, которые используют для лечения ран.
Предшествующий уровень техники
Лечение ран
Целостность структур, образующих кожу и слизистые оболочки, нарушается из-за различных причин. Рана представляет собой повреждение, которое возникает в результате нарушения целостности тканей тела из-за внешней травмы. Нарушение мягких тканей или открытые раны могут быть результатом множества событий, включая, но не ограничиваясь этим, травмы, ожоги, диабетические язвы, тяжелые инфекции, такие как некротический фасциит, веностаз, и язвы в результате сдавливания. Микроорганизмы присутствуют во всех типах ран, хотя количество, вирулентность, виды и смесь могут варьироваться.
Сегодня различные растворы и гели, наносимые местно, используют для дезинфекции путем очистки ран и поверхностей тела. Составы, используемые в известном уровне техники, содержат полигексаметиленбигуанид (ПГМБ) и наполнители, такие как поверхностно-активные вещества и/или гелеобразующие агенты. Однако такие антисептические компоненты способствуют заживлению ран только за счет очищения и защиты раны от патогенных микроорганизмов.
Далее полигексаметиленбигуанид упоминается как ПГМБ.
Действие существующих продуктов заключается в очищении слоев на поверхности раны, особенно при хронических ранах, и в обеспечении антисептики раны. Раневая поверхность содержит слои, такие как раневой экссудат, отрезанные и утолщенные слои фибрина, некротическая ткань и клеточный дебрис и т.д. Такие слои обеспечивают подходящую среду для патогенных микроорганизмов для заражения раны. Даже при отсутствии инфекционных микроорганизмов удаление слоев на поверхности раны, очищение и дезинфекция раны являются чрезвычайно важным фактором для ускорения процесса восстановления.
В смесях, используемых для лечения раны в предшествующем уровне техники, ПГМБ является подходящим соединением в качестве микробицидного вещества с хорошей тканевой переносимостью. Продукты для обработки раны, содержащие ПГМБ и поверхностно-активного вещества, в виде жидких или гелеобразных композиций существуют [1, 2]. Однако эти продукты могут быть причиной таких явлений, как неспособность обеспечить достаточную защиту, очистить рану от вредных веществ, облегчить боль, ускорить репродукцию клеток и регенерацию клеток, несовместимость с поддерживающим лечением, а также неспособность обеспечить достаточное количество влаги [3].
Замечено, что для лечения ран используют активные ингредиенты или эксципиенты полностью синтетического происхождения. Принимая во внимание тот факт, что острые или хронические раны могут быть системным заболеванием, использование другого синтетического вещества может представлять дополнительный риск для пациента. Повидон-йод может быть хорошим примером такого случая. Повидон-йод используют в качестве фармацевтического противомикробного и противовирусного средства против микроорганизмов, на которые действует йод. Он легко поглощается тканью и содержит йод в количестве, которое может помешать тестам на функцию щитовидной железы. Другим примером, относящимся к этому случаю, является глюконат хлоргексидина. Глюконат хлоргексидина также легко поглощается тканями и воздействует на все клетки без какого-либо исключения. Кроме того, он накапливается в печени и может повлиять на функции печени. Такие композиции с содержанием синтетического вещества влияют на функции организма и могут привести к проблемам, которые оказывают негативное влияние на здоровье человека.
Композиции с ПГМБ
Одним из патентов в литературе по данному предмету является патент ЕР 1404311 В1 [1]. Заявка под названием "Агент для обработки ран» разработана для использования в виде геля для мытья или для душа, в виде увлажняющего геля или в виде влажного раневого покрытия, в виде растворяющего геля для растворения корки или коросты на поверхности тела или раны, или для удаления повязки и для смены влажных повязок. Указанная композиция содержит ПГМБ, минимум одно поверхностно-активное вещество из производного неразветвленной жирной кислоты и гидроксиэтилцеллюлозу. Однако эта заявка не содержит какое-либо соединение, которое ускоряет репродукцию клеток, регенерацию клеток, обеспечивает противовоспалительный эффект или усиливает образование коллагена в ране. Такой ингредиент не обеспечивает никакого непосредственного вклада в процесс заживления раны, но может обеспечивать косвенный вклад путем защиты и очистки раны. Кроме того, ЕР 1404311 В1 описывает синергетические эффекты амфотерных поверхностно-активных веществ на основе полигексанида и бетаина в лечении раны [1].
Однако недавняя публикация показала, что использование указанной композиции может иметь негативное влияние на дальнейшее лечение ран [3].
В DE 10012026 В4 раскрыт гель, содержащий ПГМБ, глицерин и гидроксиэтилцеллюлозу. Было признано, что ПГМБ обладает бактерицидной активностью, а также характерной сохраняющей активностью. Цитотоксическая активность, такая как, например, у хлоргексидина, не наблюдалась. Однако эта композиция не содержит поверхностно-активного вещества, которое является важным для композиции, которая, как утверждается, используется в качестве геля для мытья или геля для душа, увлажняющего геля или в качестве влажного раневого покрытия, в качестве растворяющего геля для растворения корки или коросты на поверхности тела или раны, или для удаления повязки и для смены влажных повязок.
Композиции с поверхностно-активными веществами
Как упоминалось выше, в ЕР 1404311 В1 [1] описана композиция, содержащая ПГМБ и минимум одно поверхностно-активное вещество, которое, как указано, является производным неразветвленной жирной кислоты и преодолевает проблему DE 10012026 В4.
Поверхностно-активные вещества обычно добавляют в композиции для очистки и заживления, принимая во внимание их поверхностную активность. Поверхностно-активные вещества представляют собой соединения, которые снижают поверхностное натяжение (или натяжение на границе раздела) между двумя жидкостями или между жидкостью и твердым телом. Поверхностно-активные вещества могут действовать в качестве детергентов, смачивающих агентов, эмульгаторов, пенообразующих агентов и диспергаторов.
Следует подчеркнуть, что поверхностно-активные вещества, которые предпочтительны в сочетании с ПГМБ, являются амфотерными или неионными поверхностно-активными веществами из-за структурных характеристик ПГМБ, который нейтрализуется анионными поверхностно-активными веществами. Таким образом, при использовании анионных ПАВ нарушается бактерицидная активность ПГМБ, что нежелательно.
Поверхностно-активное вещество в ЕР 1404311 В1 предпочтительно выбирают из производного глицина и/или сульфосукцината, и/или амида на основе неразветвленной жирной кислоты. Кроме того, указано, что предпочтительным поверхностно-активным веществом для данной композиции является бетаин и, в частности, амидоалкилбетаин жирной кислоты.
Сульфосукцинатные производные жирных кислот при определенном значении рН (изоэлектрической точки) находятся в неионной форме, и в таком виде они используются в патенте ЕР 1404311 В1, хотя они и являются по структуре анионными молекулами. Неионная структура, однако, является не структурной формой, а физическим состоянием, которое меняется в зависимости от условий окружающей среды и может быть описано как псевдо-неионое состояние. Поэтому они не сопоставимы с реальными неионными поверхностно-активными веществами, которые не несут никакого отрицательного (-) или положительного (+) заряда в любом случае.
Бетаины являются цвиттерионными химическими соединениями с положительно заряженной катионной функциональной группой, такой как катион четвертичного аммония или фосфония (в общем: ониевые ионы), которая не несет атом водорода, и с отрицательно заряженной функциональной группой, такой как карбоксильная группа, которая локализована не на соседнем атоме относительно катионной группы.
Раскрыто, что сульфосукцинаты и амиды жирных кислот можно использовать в композиции либо вместе с глициновыми производными жирных кислот, либо в качестве альтернативы им. Амиды жирных кислот являются неионными молекулами. Они синтезируются посредством реакции амидирования жирной кислоты и амина.
Таким образом, ни одно из указанных выше поверхностно-активных веществ, обычно используемых в комбинации с ПГМБ, не является неионным, независимо от рН окружающей среды. Поверхностно-активные вещества, таким образом, могут взаимодействовать с ПГМБ и изменять его эффективность. Другие композиции с ПГМБ и амфотерными поверхностно-активными веществами бетаинового типа могут иметь негативное влияние на последующее лечение ран [3].
В US 2013/150451 А1 раскрыта противомикробная композиция, содержащая полимерный бигуанид, хелатирующий агент и вицинальный диол.
В работе Ryoji Yanai et al. "Effects of ionic and surfactant agents on the antimicrobial activity of polyhexamethylene biguanide", Eye and Contact Lens, Vol. 37, No. 2, 2011, раскрыто исследование противомикробной активности ПГМБ против бактерий и грибов.
Композиции с полимерами
В патентной заявке DE 102010013075 А1 раскрыты противомикробные раневые повязки, включающие полимерную подложку и композицию с противомикробным активным веществом (в частности ПГМБ) и агентом, снижающим цитотоксичность, выбранным, среди прочего, из производных бетаина. Предпочтительными полимерными подложками являются полиуретаны из-за их высокой жидкость-поглощающей способности. Таким образом, в этой заявке для изготовления раневых повязок используют хорошо известные композиции, содержащие ПГМБ и производные бетаина.
Полимеры, описанные в этой заявке, используют для получения полимерной подложки, в которую включены активный ингредиент и поверхностно-активное вещество, и, следовательно, композиция содержит раневые повязки, но не содержит агентов для лечения ран. Кроме того, области применения, то есть в качестве геля для мытья или геля для душа, в качестве увлажняющего геля или в качестве влажного раневого покрытия, в виде растворяющего геля для растворения корки или коросты на поверхности тела или раны, или для удаления повязки и для смены влажных повязок, которые заявлены в патенте ЕР 1404311 В1, не упоминаются или не заявлены в заявке на патент с номером DE 102010013075 А1. Поэтому этот патент относится только к композиции для перевязки ран, а не к композиции с агентом для лечения ран.
Растительные ингредиенты
Было определено, что лечебные свойства многих растений обусловлены конкретными химическими соединениями, которые были выделены, очищены и, во многих случаях, синтетически воспроизведены. Многие хорошо известные препараты были первоначально получены из растений. Салициловая кислота, предшественник аспирина, первоначально была выделена из коры белой ивы и растения таволги. Хинин, который используется для лечения малярии, был получен из коры хинного дерева. Винкристин, который используется в лечении рака, происходит из барвинка. Пожалуй, наиболее известными являются морфин и кодеин, которые получают из опийного мака.
Современные врачи, особенно в Соединенных Штатах, как правило, полагаются на лечение с использованием синтетических или полученных химическим путем препаратов. Вместо того, чтобы использовать целые растения или растительные экстракты для лечения, фармакологи, как правило, стремятся определить, выделить, экстрагировать и синтезировать активные вещества из растений для использования в лечении. Такой подход, однако, имеет свои недостатки. В дополнение к отдельным физиологически активным соединениям, присутствующим в растении, есть также минералы, витамины, гликозиды, масла, алкалоиды, биофлавоноиды и другие вещества, которые могут быть важны для поддержки целебных свойств конкретного растения. Эти дополнительные вещества могут обеспечить синергетический эффект, который отсутствует, когда очищенные или синтетические физиологически активные соединения используют по отдельности. Кроме того, токсичность очищенных физиологически активных соединений, как правило, выше, чем тогда, когда физиологически активные соединения присутствуют с другими растительными веществами. Эффективность различных растительных лекарственных средств, экстрактов, микстур и способов лечения хорошо известна, и терапевтические растительные продукты все чаще признаются в качестве желательных альтернатив. В патенте US 4,886,665 раскрыто применение фармацевтического препарата из экстрактов овса и крапивы. В патенте US 4,671,959 раскрыто применение смесей натуральных масел для снижения стресса. В патенте US 5,064,675 раскрыта композиция травяного экстракта, которая обеспечивает успокаивающий эффект. В патенте US 5,407,675 раскрыт травяной экстракт, используемый для лечения кожи головы. В патенте US 5,178,865 раскрыта смесь травяных экстрактов, которая ингибирует инфекцию вируса иммунодефицита человека или ВИЧ in vitro.
В патентах US 5,500,340 и US 5,294,443 раскрыто применение травяных экстрактов для иммуносупрессии и лечения аутоиммунных заболеваний.
Одним из патентов в литературе по данному предмету является заявка на патент WO 2009106963 А2 под названием «Стоматологическая композиция для профилактики и лечения стоматита и язв во рту». Указанная композиция содержит смолу мирры (Myrrh) в виде жидкого экстракта и хлорид или другие растворимые соли цинка, где к смоле мирры, к дезинфицирующему веществу и к растворимой соли цинка добавляют глицирретовую кислоту. Однако указанная композиция включает в себя жидкий экстракт мирры, который не был приготовлен в виде настойки с использованием яблочного уксуса.
Настоящее изобретение имеет дело с недостатками известного уровня техники, то есть, среди прочего, i) с относительно высокой токсичностью обычно используемых поверхностно-активных веществ, в частности производных бетаина; ii) с регулярно наблюдаемой инактивацией бактерицидных агентов, таких как ПГМБ, обычно используемыми поверхностно-активными веществами, iii) с рН-зависимой поверхностной активностью обычно используемых поверхностно-активных веществ, iv) с негативными эффектами амфотерных поверхностно-активных веществ на последующее лечение.
В заключение отметим, что методика предшествующего уровня техники, упомянутого выше, не обеспечивает решения существующих проблем, и, таким образом, требуется улучшение в соответствующей технической области.
Задача изобретения
Настоящее изобретение относится к композиции, используемой для лечения ран, которая отвечает вышеуказанным требованиям, устраняет все недостатки и предлагает некоторые дополнительные преимущества.
Предпочтительной задачей настоящего изобретения является разработка композиции, применяемой местно для лечения ран, тем самым предотвращая любые негативные последствия, которые могут повлиять на здоровье человека, по сравнению с композициями предшествующего уровня техники, в силу того, что композиция содержит полоксамеры в соответствии с настоящим изобретением, которые являются амфифильными, нетоксичными и имеют неионные свойства и, таким образом, оказывают благотворное воздействие на лечение ран, как будет описано ниже. Такие полоксамеры предпочтительно представляют собой триблоксополимеры из полиэтиленоксида и полипропиленоксида.
Другой задачей настоящего изобретения является содействие процессу заживления в среде кислого рН или щелочного рН с использованием указанных триблоксополимеров. Хронические раны имеют щелочную среду, и заживление ран начинается в кислой среде [4]. Поэтому указанные соединения облегчают процесс заживления за счет обеспечения поверхностно-активными веществами, которые работают независимо от рН окружающей среды.
Еще одна задача настоящего изобретения заключается в применении композиции, получаемой в жидкой и гелеобразной форме, для лечения острых или хронических оромукозных ран путем местного нанесения.
Еще одна задача настоящего изобретения заключается в лечении пациентов, страдающих от другого системного заболевания, с использованием полоксамеров без какого-либо токсического действия на организм. Таким образом, какие-либо риски для здоровья предотвращаются.
Аналогичная задача настоящего изобретения заключается в его применении для лечения ран путем местного нанесения, поскольку композицию изготавливают в виде раствора и в виде геля.
Другой задачей настоящего изобретения является его применение в качестве геля для ванны или душа для очистки поверхностей организма от вредных веществ в силу бактерицидного эффекта. Кроме того, также предлагается его применение в перевязке раны в форме геля и раствора, которая облегчает удаление и смену повязки.
Для решения вышеупомянутых задач настоящее изобретение включает в себя композицию в виде раствора, содержащую ПГМБ, очищенную воду (например, дистиллированную воду или деионизированную воду) и полоксамеры, для применения в местном лечении кожных и оромукозных ран.
Для решения вышеупомянутых задач настоящее изобретение предлагает способ получения жидкой композиции для местного лечения кожных и оромукозных ран, включающий стадии добавления и смешивания полигексаметиленбигуанида (ПГМБ) и очищенной воды (раствор А), и добавления и смешивания раствора А с триблоксополимерами с получением конечного продукта.
Для решения вышеупомянутых задач настоящее изобретение предлагает гелеобразную композицию, содержащую ПГМБ, очищенную воду, полоксамеры и гелеобразующий агент, для применения в местном лечении кожных и оромукозных ран.
Для решения вышеупомянутых задач настоящее изобретение предлагает способ получения гелеобразной композиции для местного лечения кожных и оромукозных ран, включающий стадии добавления гелеобразующего агента в очищенную воду и их смешивание при нагревании с последующим добавлением ПГМБ, охлаждения полученной смеси до комнатной температуры (раствор В) и, наконец, добавления и смешивания раствора В с триблоксополимерами с получением конечного продукта.
Структурные и отличительные признаки изобретения, и все предложенные преимущества будут более понятны с помощью подробного описания, приведенного ниже, и, следовательно, изобретение следует оценивать, принимая во внимание это подробное описание.
Подробное описание изобретения
В этом подробном описании предпочтительные варианты осуществления композиции, используемой для лечения ран согласно изобретению, описаны для лучшего понимания настоящего изобретения без каких-либо ограничений.
Настоящее изобретение относится к ранозаживляющей композиции, содержащей по меньшей мере одно противомикробное активное вещество и по меньшей мере один полоксамер, который является амфифильным, нетоксичным и обладает неионными свойствами.
Настоящее изобретение относится к применению полоксамеров и даже более конкретно к полоксамеру 188 в комбинации с ПГМБ для лечения людей и животных, страдающих от острых или хронических ран, например, в раневых антисептиках, в раневых ирригационных растворах, мазях, кремах, гелях, растворах и раневых повязках.
Продукты, содержащие такие активные вещества, не оказывают вредного воздействия на ткани человека. Это имеет еще большее значение, если такие продукты вступают в контакт не только со здоровой кожей, но особенно, если продукты используют для лечения ран.
Изобретение имеет две различные области применения в виде гелеобразных и жидких композиций. Основными ингредиентами, обычно используемыми в указанных гелеобразных и жидких композициях, являются следующие.
Основные ингредиенты
Полигексаметиленбигуанид (ПГМБ) (№ Cas: 32289-58-0):
Полигексаметиленбигуанид является мощным катионным антисептиком, полученным из бигуанида, с широким спектром полимерной структуры, демонстрирующим высокую совместимость с тканями. Он обладает сильным противомикробным действием из-за его свойства селективного связывания с кислыми липидами на клеточных мембранах бактерий. ПГМБ обладает широким спектром активности в отношении грамположительных и грамотрицательных бактерий, грибов, дрожжей, вирусов и биопленок. Он широко используется для лечения местных инфекций. Совместимость ПГМБ с тканями основана на его активности в отношении кислых липидов, содержащихся в клеточных мембранах бактерий, и незначительном влиянии на нейтральные липиды клеточных мембран человека. Это помогает предотвратить повреждение окружающих здоровых тканей. Поэтому его можно наносить в течение длительного периода времени из-за его низкой токсичности. Кроме того, ПГМБ с меньшей вероятностью вызывает аллергические реакции, сенсибилизацию или резистентность.
В ЕР 1404311 В1 описаны синергетические эффекты полигексанида и амфотерных поверхностно-активных веществ бетаинового типа при лечении ран [1]. Однако недавняя публикация показала, что использование указанной композиции может иметь негативное влияние на дальнейшее лечение ран [3].
В другой композиции использовали смесь полигексанида, различных поверхностно-активных веществ и некоторых эксципиентов, таких как аллантоин, которые могут присутствовать в экстракте окопника, в качестве композиции раневой повязки. Фактически, это исследование посвящено разработке композиции раневой повязки и не рассматривает синергетический эффект других биомолекул, которые присутствуют в экстракте окопника, таких как розмариновая кислота, растительный клей, таннины и инулин с алантоином [5].
Эмульгирующий агент (поверхностно-активное вещество):
Полоксамеры представляют собой триблоксополимеры полиэтиленоксида и полипропиленоксида в качестве эмульгирующего/смачивающего/ поверхностно-активного агента. Полоксамеры являются амфифильными, неионными и относительно нетоксичными поверхностно-активными веществами. Благодаря этим свойствам они являются особенно предпочтительными в настоящем изобретении. Благодаря амфифильному свойству они имеют превосходную способность очищать рану, подлежащую лечению. Из-за их поверхностно-активного характера они уменьшают поверхностное натяжение на коже, следовательно, они минимизируют адгезию микроорганизмов на ранах, таким образом, предотвращая развитие инфекции. Из-за их неионной структуры они не взаимодействуют с ПГМБ и не изменяют его эффективность, по сравнению с другими поверхностно-активными веществами, которые являются анионными или изменяют свой заряд в зависимости от окружающего рН. Из-за отсутствия токсичности они с успехом используются в композициях для лечения ран в комбинации с ПГМБ.
Полоксамеры - это амфифильные, неионные и относительно нетоксичные поверхностно-активные вещества. Полоксамеры являются синтетическими триблоксополимерами полиэтиленоксида и полипропиленоксида, и имеют следующую химическую структуру (I) и общую формулу (II) (фиг. 1),
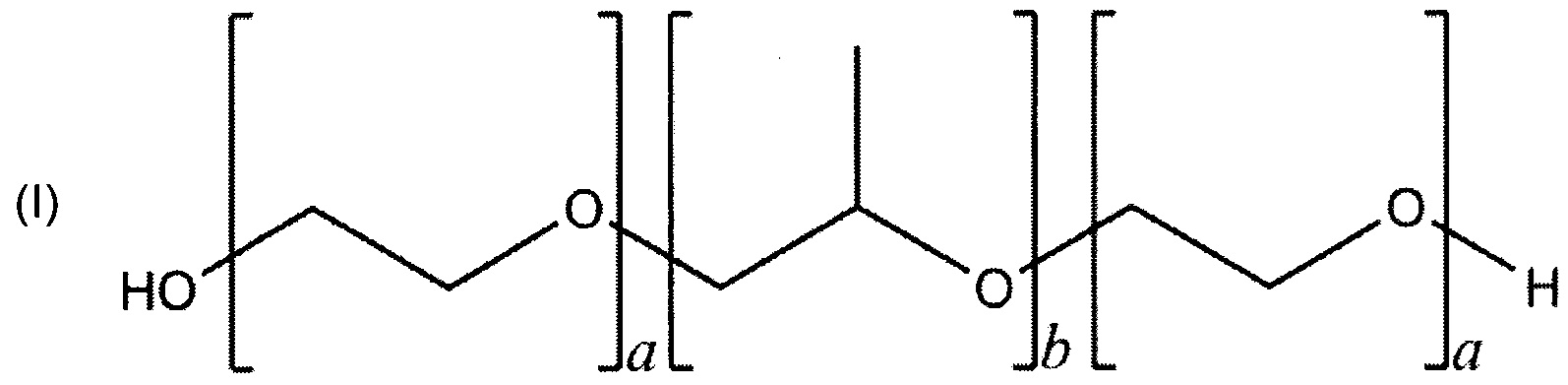

Фиг. 1: Молекулярная структура и общая формула полоксамера
Различные типы полоксамеров включены в Европейскую фармакопею PhEur 6,0 и фармакопею США USP32-NF27. В PhEur 6,0 указано, что можно добавлять подходящий антиоксидант. Типы полоксамеров отличаются количеством звеньев этиленоксида (а) и пропиленоксида (b). Как правило, 'а' находится в диапазоне от 2 до 130 и 'b' находится в диапазоне от 15 до 67, хотя следует понимать, что другие значения для 'а' и 'b' также возможны. Значения (а) и (b) в нескольких типах полоксамеров приведены в таблице 1.

Полоксамеры обычно встречаются в виде белых, воскообразных, сыпучих приллированных гранул или в виде литых твердых веществ. Они практически без запаха и вкуса. Полоксамеры являются стабильными материалами. Водные растворы стабильны в присутствии кислот, щелочей и ионов металлов. Они являются неионными сополимерами полиоксиэтилена и полиоксипропилена, используемыми главным образом в фармацевтических композициях в качестве диспергирующего агента, эмульгирующего агента, солюбилизирующего агента, лубриканта таблетки, смачивающего агента, гелеобразующего агента и загустителя. Полиоксиэтиленовый сегмент является гидрофильным, а полиоксипропиленовый сегмент является гидрофобным.
Химическое название полоксамера - α-гидро-ω-гидроксиполи(оксиэтилен)-поли(оксипропилен)поли(оксиэтиленовый) блоксополимер.
Все полоксамеры химически сходны по своему составу, отличаясь только относительными количествами пропиленоксида и этиленоксида, добавляемыми в процессе производства. Их физические и поверхностно-активные свойства изменяются в широком диапазоне, коммерчески доступно некоторое количество различных типов. Полоксамеры используют в качестве эмульгаторов во внутривенных жировых эмульсиях, а также в качестве солюбилизирующих и стабилизирующих агентов для поддержания прозрачности эликсиров и сиропов. Полоксамеры (№ Cas: 9003-11-6) также можно использовать в качестве смачивающих агентов; в мазях, основах суппозиториев и в гелях; и в качестве связующих веществ для таблеток и покрытий.
Химические свойства типов полоксамеров, включенных в PhEur 6,0 и USP32-NF27, приведены в таблице 2.

Полоксамеры представляют собой амфифильные молекулы. Полипропиленоксидный центр состоит из гидрофобного ядра, в то время как полиэтиленоксидные цепи состоят из гидрофильной части молекулы. Из-за их поверхностно-активной природы они уменьшают поверхностное натяжение на коже, следовательно, они минимизируют адгезию микроорганизмов на ранах, таким образом, предотвращают развитие инфекции.
Полоксамеры также могут быть использованы в терапевтических целях в качестве смачивающих агентов в композициях глазных капель, при лечении почечных камней, а также в качестве очищающих средств для кожных ран.
Особенно предпочтительные полоксамеры, используемые в настоящем изобретении, могут быть выбраны из полоксамера 124, полоксамера 188, полоксамера 237, полоксамера 338 и полоксамера 407, свойства которых приведены в таблице 2 выше. Среди этих полоксамеров полоксамер 188 является особенно предпочтительным.
Полоксамер 188 использовали в качестве эмульгатора для фторуглеродов, используемых в качестве искусственных заменителей крови, а также при приготовлении твердых дисперсных систем. Совсем недавно полоксамеры нашли применение в системах доставки лекарственных средств.
С терапевтической целью полоксамер 188 вводят перорально в качестве увлажняющего агента и смазки для дефекации в лечении запора; он, как правило, используется в сочетании со слабительным.
Добавление нетоксичного поверхностно-активного вещества полоксамера 188 в спонж с мелкими порами минимизирует повреждение ткани, сохраняя при этом эффективность механической очистки по удалению бактерий. Его нетоксичность предотвращает раздражение конъюнктивы пациента. Этот раневой очиститель не изменяет сопротивление раны к инфекции и заживляемость, а также не изменяет клеточные компоненты крови. Несмотря на то, что он не проявляет антибактериальной активности, он минимизирует адгезию микроорганизмов к ранам и, таким образом, предотвращает развитие инфекции.
Другими полоксамерами, которые могут быть использованы в настоящем изобретении, являются полоксамеры 338 и 407. Полоксамеры 338 и 407 используются в растворах для ухода за контактными линзами. Исследования полоксамера 407, который проявляет термообратимые свойства, для оптимизации температуры композиции продемонстрировали свойства повышения иммуномодуляции и цитотоксичности.
Компанией BASF Corp. для двух категорий полоксамеров присвоены торговые наименования, а именно, Pluronic и Kolliphor. Бренд Pluronic предназначен для использования в косметической промышленности в виде эмульгаторов типа масло-в-воде, моющих средств для мягких продуктов для лица и диспергирующего агента, в то время как бренд Kolliphor предназначен для использования в качестве медицинского средства или эксципиента лекарственного средства.
Полоксамеры используют в различных пероральных, парентеральных и местных фармацевтических композициях, и, как правило, считаются нетоксичными и не вызывающими раздражения материалами. Полоксамеры не метаболизируются в организме. Исследования токсичности на животных, на собаках и кроликах, показали, что полоксамеры не являются раздражающими и сенсибилизирующими при нанесении на глаза, десны и кожу в количестве 5% масса/объем и 10% масса/объем. В 14-дневном исследовании внутривенного введения в концентрациях до 0,5 г/кг/сутки кроликам не было отмечено явных побочных эффектов. Аналогичное исследование, проведенное с собаками, также не показало никаких неблагоприятных эффектов для уровней дозирования до 0,5 г/кг/сутки. В более долгосрочном исследовании на крысах, получавших 3% масс./масс. или 5% масс./масс. полоксамера в продуктах питания в течение 2-х лет, не продемонстрировано каких-либо существенных признаков токсичности. Однако крысы, получавшие 7,5% масс./масс. полоксамера в питании показали некоторое снижение темпа роста. Не наблюдали гемолиза клеток крови человека в течение более 18 часов при 258 QC (Контроль качества) при концентрации растворов полоксамера 0,001-10% масса/объем.
Включены в базы данных неактивных ингредиентов FDA (IV инъекции, ингаляции, офтальмологические препараты, пероральные порошки, растворы, суспензии и сиропы, препараты для местного применения).
Включены в непарентеральные лекарства, лицензированные в Великобритании. Включены в Перечень разрешенных немедицинских ингредиентов Канады.
Дополнительные эксципиенты
Дистиллированная вода
В настоящем изобретении в композициях предпочтительно используют очищенную воду. Очищенная вода может быть, в частности, получена перегонкой воды или деионизацией воды. Таким образом, очищенная вода в настоящей заявке, относится к воде, которая механически отфильтрована или обработана для очистки. Дистиллированная вода и деионизированная (ДИ) вода являются наиболее распространенными формами очищенной воды, но вода также может быть очищена с помощью других процессов, в том числе, обратного осмоса, фильтрации через уголь, микрофильтрации, ультрафильтрации, окисления ультрафиолетом или электродиализа.
В настоящем изобретении предпочтительно используют дистиллированную
воду.
Соповерхностно-активные вещества:
Композиция может дополнительно содержать дополнительные соповерхностно-активные вещества для улучшения растворимости любых растительных ингредиентов, которые могут быть добавлены (см. описание ниже), или для дополнительного снижения цитотоксичности композиции.
В патенте ЕР 1404311 В1 раскрыт синергический эффект ПГМБ и некоторых амфотерных поверхностно-активных веществ, которыми являются глициновые, сульфосукцинатные и амидные производные неразветвленной жирной кислоты. Указанный патент заявляет композицию, включающую ПГМБ и поверхностно-активное вещество на основе производного неразветвленной жирной кислоты. Кроме того, в этом патенте заявляется, что производным неразветвленной жирной кислоты должно быть глициновое, сульфосукцинатное или амидное производное. Поверхностно-активные вещества, описанные в ЕР 1404311 В1, также могут быть использованы в настоящем изобретении в качестве соповерхностно-активных веществ в комбинации с триблоксополимерами. Однако поверхностно-активные вещества, описанные в ЕР 1404311 В1, не всегда могут быть предпочтительными для композиций для лечения раны.
В настоящее время было обнаружено, что амфотерные поверхностно-активные вещества, отличные от производных неразветвленных жирных кислот, описанных в ЕР 1404311 В1, обеспечивают по меньшей мере такой же синергический эффект.
Такие поверхностно-активные вещества описаны далее и, в частности, используются в композициях согласно изобретению.
Когда поверхностно-активное вещество имеет как анионные, так и катионные группы, его называют амфотерным или цвиттер-ионным. Несмотря на то, что они несут положительные и отрицательные заряды на различных атомах в водном растворе при их изоэлектрической точке, они электрически нейтральны. В зависимости от состава и условий рН, поверхностно-активные вещества могут иметь анионные или катионные свойства. Однако некоторые амфотерные поверхностно-активные вещества устойчивы к рН, и их суммарный заряд не зависит от изменения рН. Амфотерные поверхностно-активные вещества можно классифицировать в основном на 3 группы: производные бетаина, аминоксида и имидазолия. Бетаины, с другой стороны, можно разделить на три подгруппы, а именно глицинбетаин, сультаин и фостаин. Глицинбетаин является природной формой бетаина и несет карбоксильную группу (фиг. 2а), в то время как сультаин несет сульфопропильную группу (фиг. 2b).

Фиг. 2: Общая структура алкилбетаинов (а) и алкилсультаинов (b). R: длинные цепи неразветвленной алкильной группы (насыщенной) или алкенильной группы (ненасыщенной).
Соповерхностно-активные вещества в соответствии с настоящим изобретением предпочтительно выбирают из глициновых, сульфосукцинатных и амидных производных неразветвленной жирной кислоты, алкилсультаинов, алкиламиноксидов, алкильных производных имидазолия и производных пантенола.
Из них соповерхностно-активные вещества в соответствии с настоящим изобретением более предпочтительно выбирают из алкилсультаинов, алкиламиноксидов, алкильных производных имидазолия и производных пантенола. Поверхностно-активные вещества на основе аминооксида и имидазолия также могут быть производными неразветвленных жирных кислот. С другой стороны, поверхностно-активные вещества бетаинового типа могут быть выбраны из производных жирных спиртов или жирных аминов. Противомикробная активность указанных поверхностно-активных веществ хорошо известна [6-8].
Из указанных соповерхностно-активных веществ, алкилсультаины, алкиламиноксиды, алкильные производные имидазолия и производные пантенола являются предпочтительными в качестве соповерхностно-активных веществ для композиций согласно изобретению. Алкильная группа, в любом случае может быть разветвленной или неразветвленной, имеющей 8-18 атомов углерода, предпочтительно 10-16 атомов углерода и наиболее предпочтительно 10-14 атомов углерода. Кроме того, алкильная группа может быть либо насыщенной, либо ненасыщенной углеродной цепью. Предпочтительные аминоксиды включают лаураминоксид (Cas №: 1643-20-5), лаурамидопропиламиноксид (Cas №: 61792-31-2), кокаминоксид (№ Cas: 61788-90-7), кокамидопропиламиноксид (Cas №: 68155-09-9), миристаминоксид (Cas №: 3332-27-2), сояамидопропиламиноксид (№ Cas: 223707-70-8). Предпочтительные имидазолиновые поверхностно-активные вещества включают динатрий кокоамфодиацетат (Cas №: 68650-39-5) динатрий лауроамфодиацетат (Cas №: 14350-97-1), лауроамфоацетат натрия (Cas №: 26837-33-2) динатрий кокоамфодипропионат (Cas №: 68604-71-7), кокоамфоацетат натрия (Cas №: 68334-21-4).
Кроме того, катионные поверхностно-активные вещества на основе производных пантенола также могут быть использованы в композиции. Примером такого типа катионных поверхностно-активных веществ является пантенилгидроксипропилстеардимония хлорид (Cas: 132467-76-6), показанный на фиг. 3.

Фиг. 3: Структура пантенилгидроксипропилстеардимония хлорида. R - это СН3(СН2)17-
Пантенол (Cas №: 81-13-0) представляет собой спиртовое производное пантотеновой кислоты (витамин В5), и, таким образом, является провитамином В5. Пантенол улучшает гидратацию, уменьшает зуд и воспаление кожи, и ускоряет восстановление эпидермальных ран. Помимо того, что он является производным пантенола, пантенилгидроксипропилстеардимония хлорид несет группу четвертичного аммония, которая может проявлять дополнительную противомикробную активность в композиции.
Следует отметить, что поверхностно-активные вещества на основе производных пантенола являются особенно предпочтительными в качестве соповерхностно-активных веществ в композиции согласно изобретению.
Однако выбор соповерхностно-активного вещества не ограничен до тех пор, пока он подходит для контакта с кожей и ранами, и, исключительно, не вызывает какого-либо увеличения цитотоксичности и индуцирования повреждения раны.
Гелеобразующие агенты
Гелеобразующие вещества, как правило полимеры, используют в гелеобразных композициях для уменьшения подвижности и повышения вязкости продукта. Они создают трехмерную сеть в композиции таким образом, что межмолекулярные силы связывают молекулы растворителя с полимерной сетью, и таким образом сниженная подвижность этих молекул приводит к получению структурированной системы с повышенной вязкостью [9].
Гелеобразующий агент, используемый в гелеобразной форме указанной композиции, может быть либо производным целлюлозы, либо другим коммерчески доступным гелеобразующим агентом. Предпочтительными гелеобразующими агентами являются производные целлюлозы (например, метилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, гидроксиэтилцеллюлоза) и/или полимеры модифицированной акриловой кислоты (например, карбопол (carbopol)), либо по отдельности, либо в комбинации.
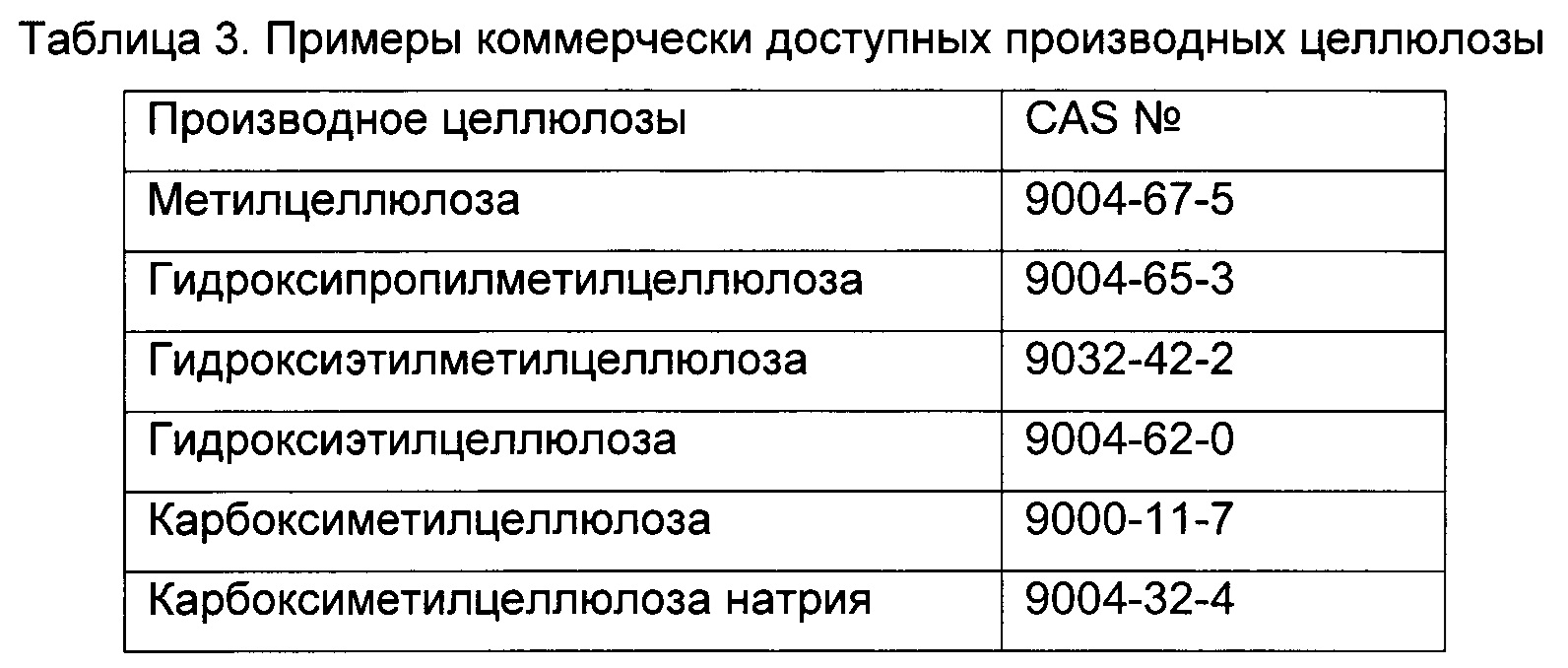
Целлюлоза, полимер β-глюкозы, является основным компонентом клеточной стенки растений. Она представляет собой линейный гомополимер конденсации, состоящий из β-1,4-связанных D-ангидроглюкопиранозных звеньев (AGU). Производные целлюлозы получают путем добавления функциональных групп полимера целлюлозы путем химического или ферментативного процесса. Есть много производных целлюлозы, которые являются коммерчески доступными и используются в композициях для нескольких целей (т.е. в качестве гелеобразующего агента, загустителя, связующего вещества, пленкообразователя). Предпочтительные производные целлюлозы и их номера CAS приведены в таблице 3. Однако любые другие производные целлюлозы могут быть также использованы для того, чтобы получить гелеобразную форму по настоящему изобретению, либо отдельно, либо в сочетании с другими гелеобразующими агентами.
Другие предпочтительные гелеобразующие агенты известны под торговым наименованием POLYOX™, которые являются неионными поли(этиленоксидными) полимерами, которые образуют гидрогели, которые инициируют и регулируют высвобождение активных ингредиентов. Из-за их неионной структуры никакого взаимодействия между активными ингредиентами композиций и POLYOX не следует ожидать.
Другим предпочтительным гелеобразующим агентом является карбоксиполиметилен (Cas №: 9007-20-9), также известный как карбопол (Carbopol), который представляет собой полимер модифицированной акриловой кислоты. В молекулярной структуре карбомера существует множество карбоксильных групп, этот признак позволяет увеличивать объем в присутствии воды. При- растворении в воде молекулы карбопола меняют свою конфигурацию и увеличивают вязкость жидкости, что приводит к образованию геля. Несмотря на то, существует несколько подтипов указанного карбомера, они доступны под торговым наименованием Carbopol®. Некоторые типы карбопола, которые могут быть использованы в композиции по настоящему изобретению, а также их номера CAS приведены в таблице 4.


Хотя предпочтительные гелеобразующие агенты должны быть в неионной форме, анионные молекулы (т.е. соль карбоксиметилцеллюлозы и карбопол) также могут быть использованы в композиции в присутствии катионного эксципиента, который может быть соповерхностно-активным веществом (например, хлорид пантенилгидроксипропилстеардимония, Cas: 132467-76-6). Фактически, исследование показало, что отрицательно заряженные полисахариды, такие как карбоксиметилцеллюлоза, связывают факторы роста, которые играют важную роль в восстановлении раны [10, 11].
Увлажнители
Сухость кожи является дополнительным фактором, ограничивающим заживление раны. Увлажнители (также называемые увлажнителями или увлажняющими агентами) представляют собой молекулы, используемые в композициях для повышения содержания влаги в коже. В дальнейшем такие компоненты будут называться увлажнителями. Увлажнители предотвращают высыхание кожи путем связывания влаги. Увлажнители могут быть выбраны из коммерчески доступных увлажнителей. Предпочтительными увлажнителями являются бета-ситостерол, инозит, глицерин, мочевина, стеарат глицерина, пантенол, пропиленгликоль, полиэтиленгликоль и его производные (т.е. метилглюцет 10 и метилглюцет 20), а также ксилит.
Другим предпочтительным увлажнителем является гидроксиэтилмочевина (мочевина, NN-(гидроксиэтил)-; Cas №: 1320-51-0), которая доступна, например под торговым наименованием Hydrovance®.
Растительные наполнители
Всемирная организация здравоохранения подсчитала, что около 80% населения мира полагается на лекарства из растительного сырья для их потребностей первичной медико-санитарной помощи. Так как растительные лекарственные средства являются наиболее часто встречающимися из этих терапевтических агентов, можно с уверенностью сказать, что большинство людей в мире полагаются на растения, как на лекарственные средства. В течение последних 25 лет, около 25% всех лекарств, отпускаемых по рецепту в США, содержат активные компоненты, полученные из растений.
Экстракт и настойку, полученные из следующих растений, используют в качестве растительного компонента в композиции:
- Экстракт травы окопника (Symphytum officinale L.) (Cas №: 84696-05-9):
Растение окопник - это многолетнее травянистое растение, которое может вырастать до 30-120 см, имеющее стебли и листья, покрытые жесткими волосками, цветущее белыми, фиолетовыми и редко розовыми цветами с середины июня до конца сентября. Корни указанного растения содержат пирролизидиновые алкалоиды. Пирролизидиновые алкалоиды (PAS) могут оказывать некоторые побочные эффекты на здоровье человека [12]. Таким образом, указанную композицию получают в виде экстракта, полученного из надземной части растения.
Как лекарственное растение, окопник имеет многовековые традиции. В настоящее время несколько рандомизированных контролируемых испытаний показали эффективность и безопасность препаратов окопника для местного лечения боли, воспаления и отека мышц и суставов при дегенеративном артрите, острой боли в мышцах спины, при растяжениях, ушибах и растяжениях после спортивных травм и несчастных случаев, у взрослых, а также у детей в возрасте 3 или 4 лет и старше [13].
Этот экстракт используется в композиции в качестве агента, который снижает цитотоксические эффекты антибактериальных активных ингредиентов. Кроме того, терапевтические свойства растения окопника, основанные на противовоспалительных и анальгетических эффектах, заключаются в том, что оно вызывает грануляцию и используется для лечения ран, поскольку оно способствует регенерации тканей [14]. Немецкая комиссия Е положительно оценила композиции, содержащие траву окопника (Symphytum officinale L.), в лечении ран. Европейское агентство по лекарственным средствам одобрило использование этого растения для кожи. Европейское научное сообщество выпустило отчет о доступности травы окопника в монографиях по фитотерапии [15]. Кроме того, окопник также описан в монографиях Hager [16].
Лечебные свойства окопника основаны на его противовоспалительном и обезболивающем действии [17]. Окопник также стимулирует грануляцию и регенерацию тканей, а также способствует образованию костной мозоли. Однако основные компоненты, определяющие активность экстрактов окопника, и молекулярные механизмы его действия не были полностью выяснены. Вероятно, аллантоин и розмариновая кислота имеют решающее значение для его фармакодинамических эффектов [18].
Далее экстракт травы окопника (Symphytum officinale L.) упоминается как растительный экстракт или растительное вещество, или растительный эксципиент.
- Настойка мирры (Commiphora molmol) (№ Cas: 84929-26-0):
Мирра (Commiphora molmol) представляет собой ароматическую смолу от ряда небольших колючих видов деревьев из рода Коммифора и является эфирным маслом, называемым живицей. Настойка используется в композиции в качестве природного антибактерицидного и антифунгицидного средства с ограниченной биодоступностью [19].
В фармацевтике мирра используется в качестве антисептического средства в жидкости для мытья рта, полосканиях и зубных пастах для профилактики и лечения заболеваний десен. Использование мирры для лечения оромукозных ран в виде настойки продемонстрировано в клинических исследованиях. Мирра в настоящее время используется в некоторых жидких мазях и заживляющих бальзамах, которые можно применять при потертостях и других мелких кожных заболеваниях. Мирра также была рекомендована в качестве обезболивающего средства при зубной боли, и может быть использована в мазях при ушибах, болях и растяжениях. Масляные камеди смолы ряда других видов Commiphora (Коммифора) также используются в качестве отдушки, в лекарственных средствах (например, в раневых повязках) и в качестве ароматических ингредиентов. Другие области применения включают лечение ран, абсцессов и кожных воспалений.
Смолистая камедь растения Commiphora molmol Engler и/или других видов Commiphora, удовлетворяющая статье Европейской Фармакопеи (01/2008:1349), используется для изготовления настойки. Сесквитерпенами, которые присутствуют в мирре, являются фуранодесма-1,3-диен, курзарен, фуранодиен, фуранодиен-6-он и метоксифураногуайа-9-ен-8-он. Сообщается, что они обладают антибактериальным, противогрибковым, обезболивающим и местным обезболивающим эффектами.
В настоящее время использование мирры в виде настойки для лечения оромукозных мелких язв и воспалительных процессов в полости рта (стоматит и гингивит) хорошо описано в недавних публикациях [20].
Другим типичным применением настойки мирры является местное нанесение на незначительные раны, ссадины, фурункулы и воспаления кожи [20]. Несмотря на то, что растворителем экстракции для настойки мирры согласно статье Ph. Eur. (01/2008: 1877) является 90% (об./об.) этанол, в этой композиции растворителем предпочтительно является яблочный уксус.
Этанол имеет тенденцию к денатурации некоторых органических соединений, что делает их неэффективными. Это является одной из причин, почему этанол является противомикробным средством. Эта тенденция может также привести к нежелательным последствиям при экстракции растительных составляющих, например, полисахаридов. Некоторые другие компоненты, среди которых распространенными являются белки, могут стать необратимо денатурированными, разделенными на очень сложные ароматические компоненты, которые денатурируются за счет присущего спиртам разделяющего действия на сложную ароматическую структуру на более простые, ставшие инертными соединения. Основной принцип органической химии учит, что денатурация биологически активных компонентов снижает или сводит на нет их исходную биологическую активность. Этот факт должен быть рассмотрен врачом и/или потребителем с точки зрения эффективности и дозировки при выборе растительных настоек на основе этанола.
Настойки на основе эфира и пропиленгликоля не пригодны для внутреннего применения, хотя они используются в препаратах для наружного применения, таких как кремы и мази для индивидуального ухода [21].
За последние 50 лет произошли огромные достижения в области технологии выращивания и экстракции, которые привели к улучшению качества растительных веществ, которые являются доступными. Исследование демонстрирует, что сырые экстракты часто имеют больший терапевтический эффект, чем изолированный «активный» компонент. Экстракт представляет собой концентрированную форму травы, полученную путем смешивания сырой травы с соответствующим растворителем и последующего удаления растворителя.
Силу растительных препаратов выражают двумя способами. С точки зрения концентрации концентрация 4:1 означает, что одна часть растительного экстракта эквивалентна или получена из четырех частей сырой травы.
Настойка обычно имеет концентрацию 1:10 об./об. (трава/растворитель) или 1:5 об./об. (трава/растворитель); а жидкий экстракт обычно имеет концентрацию 1:1 об./об. (трава/растворитель). В этой композиции, однако, концентрация настойки составляет 1:3 об./об. (трава/растворитель).
Что касается адекватной концентрации экстракта, могут быть большие различия как в качестве травы от партии к партии, так и в методах экстракции, которые могут вызвать дополнительное отклонение от стандарта. Если наиболее важный компонент растения известен, экстракт может быть проанализирован на стандартное количество этого компонента. Этот метод является общепринятым в Европе, где сырые растительные экстракты использовали и стандартизировали таким способом в течение многих лет. С помощью этого метода дозы основаны на активных компонентах.
Далее настойка мирры (Commiphora molmol) упоминается как растительный экстракт или растительное вещество, или растительный эксципиент. Композиции согласно настоящему изобретению
Композиции согласно настоящему изобретению, содержащие ПГМБ и полоксамеры
Композицию предпочтительно изготавливают в двух формах, которые представляют собой гель и раствор.
Композиция, используемая для местного и оромукозного лечения ран согласно настоящему изобретению, содержит полигексаметиленбигуанид (ПГМБ) в качестве активного агента, очищенную воду в качестве растворителя и по меньшей мере один полоксамер в соответствии с настоящим изобретением.
Полоксамеры в соответствии с настоящим изобретением являются амфифильными. Кроме того, они не токсичны и, таким образом, могут быть добавлены в композиции для лечения ран. Кроме того, полоксамеры являются неионными, такими, что они не оказывают мешающего действия на активный агент ПГМБ, по сравнению с анионными поверхностно-активными веществами, которые снижают бактерицидную активность ПГМБ из-за взаимодействия с ним. Более того, полоксамеры являются неионными, независимыми от окружающего рН. Таким образом, полоксамеры можно использовать для лечения открытых ран, которые часто имеют щелочную среду, или в сочетании с кислыми компонентами, которые используются для создания кислой среды на ране, чтобы могло начаться заживление раны.
Полоксамеры являются триблоксополимерами полиэтиленоксида и полипропиленоксида. Указанные полоксамеры являются амфифильными, нетоксичными и неионными.
Триблоксополимеры полиэтиленоксида и полипропиленоксида являются полоксамерами, которые являются особенно предпочтительными в настоящем изобретении. Особенно предпочтительные полоксамеры, используемые в настоящем изобретении, могут быть выбраны из полоксамера 124, полоксамера 188, полоксамера 237, полоксамера 338 и полоксамера 407, свойства которых приведены в таблице 2 выше. Среди этих полоксамеров полоксамер 188 является особенно предпочтительным. Однако несколько различных триблоксополимеров полиэтиленоксида и полипропиленоксида или некоторых других соповерхностно-активных веществ (т.е. пантенилгидроксипропилстеардимония хлорид, Cas: 132467-76-6), описанных выше, можно использовать в комбинации.
В предпочтительном аспекте композиция представляет собой раствор, содержащий от 0,05 до 10,0 масс. % полигексаметиленбигуанида (ПГМБ), от 0,1 до 40 масс. % триблоксополимера, и дополненный до 100% добавлением очищенной воды с получением конечного раствора для лечения ран.
В еще одном предпочтительном аспекте композиция представляет собой гель, содержащий от 0,05 до 2,0 масс. % полигексаметиленбигуанида (ПГМБ), от 0,1 до 40 масс. % триблоксополимера, от 1,0 до 10,0 масс. % увлажнителя, от 0,5 до 5,0 масс. % гелеобразующего агента, и дополненный до 100% добавлением очищенной воды с получением конечного раствора для лечения ран.
В другом предпочтительном аспекте увлажнитель выбирают из глицерина и гидроксиэтилмочевины.
В другом предпочтительном аспекте изобретения композиция содержит по меньшей мере одно соповерхностно-активное вещество. Такие соповерхностно-активные вещества могут улучшить растворимость любых растительных ингредиентов, которые могут быть добавлены, или могут дополнительно снизить цитотоксичность композиции.
Предпочтительная концентрация соповерхностно-активных веществ в любой композиции составляет от 0 до 2 масс. %, более предпочтительно от 0,01 до 2 масс. %, еще более предпочтительно от 0,05 до 1 масс. % и наиболее предпочтительно 0,1 масс. %.
Соповерхностно-активные вещества в соответствии с настоящим изобретением могут быть выбраны свободно до тех пор, пока они подходят для контакта с кожей и ранами, и не вызывают какого-либо увеличения цитотоксичности или повреждения раны.
Соповерхностно-активные вещества в соответствии с настоящим изобретением предпочтительно выбирают из глициновых, сульфосукцинатных и амидных производных неразветвленной жирной кислоты, алкилсультаинов, алкилоксидаминов, производных алкилимидазолия, производных неразветвленных жирных кислот оксидаминов и производных неразветвленных жирных кислот имидазолия. Среди них соповерхностно-активные вещества в соответствии с настоящим изобретением более предпочтительно выбирают из алкилсультаинов, алкилоксидаминов и производных алкилимидазолия. С другой стороны поверхностно-активные вещества бетаинового типа могут быть выбраны из производных жирных спиртов или жирных аминов. Алкильная группа в указанных соединениях может быть разветвленной или неразветвленной, имеющей 8-18 атомов углерода, предпочтительно 10-16 атомов углерода и наиболее предпочтительно 10-14 атомов углерода. Кроме того, алкильная группа может быть либо насыщенной или ненасыщенной углеродной цепью.
Из указанных соповерхностно-активных веществ алкилсультаины, алкиламиноксиды, производные алкилимидазолия и производные пантенола являются предпочтительными в качестве соповерхностно-активных веществ для композиций согласно изобретению. Поверхностно-активные вещества на основе производных пантенола являются особенно предпочтительными в качестве соповерхностно-активных веществ для композиций согласно изобретению.
Алкиламиноксиды предпочтительно выбирают из лаураминоксида, лаурамидопропиламиноксида, кокаминоксида, кокамидопропиламиноксида, миристаминоксида и сояамидопропиламиноксида. Производные имидазолина предпочтительно выбирают из динатрия кокоамфодиацетата, динатрия лауроамфодиацетата, лауроамфоацетата натрия, динатрия кокоамфодипропионата и кокоамфоацетата натрия. Производное пантенола предпочтительно выбирают из хлорида пантенилгидроксипропилстеардимония.
В предпочтительном аспекте композиция может дополнительно содержать вещество/вещества, полученные из растений, как описано выше. Такие вещества, полученные из растений, могут иметь полезные свойства, описанные выше в соответствующем разделе.
Таким образом, в предпочтительном аспекте композиция в форме раствора или геля дополнительно содержит вещество/вещества, полученные из растений. Вещество/вещества, полученные из указанных растений предпочтительно представляют собой экстракт травы окопника (Symphytum officinale L.) и/или настойку мирры (Commiphora molmol). Следует отметить, что композиции в соответствии с настоящим изобретением также имеют выгодные эффекты по сравнению с обычными композициями, которые не содержат таких веществ, полученных из указанных растений. Однако добавление вещества/веществ, полученных из указанных растений, может дополнительно улучшить эффект композиций в соответствии с настоящим изобретением.
Вещество/вещества, полученные из растений, предпочтительно представляют собой экстракт травы окопника и/или настойку мирры. Экстракт травы окопника предпочтительно получают из листьев растения окопника.
Однако композиции в соответствии с настоящим изобретением не требуют присутствия веществ, полученных из растений. Также композиция в форме раствора или геля, как описано выше, не содержащий каких-либо веществ, полученных из растений, может иметь желаемый эффект для лечения ран. В связи с этим следует отметить еще раз, что полоксамеры в соответствии с настоящим изобретением являются амфифильными, нетоксичными и неионными поверхностно-активными веществами и, таким образом, могут быть использованы в комбинации с ПГМБ для лечения ран с желаемыми выгодными эффектами.
Использование дополнительных веществ, полученных из растений, может, таким образом, просто дополнительно увеличить полезный эффект, уже полученный при использовании ПГМБ с полоксамерами в соответствии с настоящим изобретением.
Соответственно, в одном аспекте композиция в виде раствора или геля, таким образом, не содержит каких-либо веществ, полученных из растений. Как описано выше, вещество/вещества, полученные из растений, могут иметь полезные эффекты для лечения ран. Тем не менее было признано, что также ПГМБ только с одним полоксамером (т.е. без каких-либо веществ, полученных из растений) может иметь желаемый эффект на раны. Таким образом, можно использовать композицию, содержащую ПГМБ и полоксамер в дополнение к другим эксципиентам, таким как очищенная вода, соповерхностно-активные вещества, увлажнители и гелеобразующие агенты, без добавления каких-либо веществ, полученных из растений.
Таким образом, в предпочтительном аспекте композиция в форме раствора состоит только из полигексаметиленбигуанида (ПГМБ) в качестве активного агента, очищенной воды в качестве растворителя, по меньшей мере одного полоксамера и по меньшей мере одного поверхностно-активного вещества, выбранного из описанных выше.
В еще одном предпочтительном аспекте композиция в виде раствора состоит только из полигексаметиленбигуанида (ПГМБ) в качестве активного агента, очищенной воды в качестве растворителя и по меньшей мере одного полоксамера.
Композиция может, таким образом, состоять из от 0,05 до 10,0 масс. % ПГМБ, от 0,1 до 40 масс. % триблоксополимера, и быть дополненной до 100 масс. % добавлением очищенной воды с получением конечного раствора для лечения ран. Композиция может, таким образом, состоять из 0,1 масс. % ПГМБ, 1,0 масс. % полоксамера (такого как полоксамер 188) и 98,9 масс. % очищенной воды.
Таким образом, в предпочтительном аспекте композиция в форме геля состоит только из полигексаметиленбигуанида (ПГМБ) в качестве активного агента, очищенной воды в качестве растворителя, увлажнителя, гелеобразующего агента, по меньшей мере одного триблоксополимера и по меньшей мере одного поверхностно-активного вещества, выбранного среди описанных выше.
Композиция может, таким образом, состоять из от 0,05 до 10,0 масс. % ПГМБ, от 0,1 до 40 масс. % триблоксополимера, от 0,01 до 2 масс. % поверхностно-активного вещества, и быть дополненной до 100 масс. % добавлением очищенной воды с получением конечного раствора для лечения ран. Композиция в форме раствора может, таким образом, состоять из 0,1 масс. % ПГМБ, 1,0 масс. % полоксамера, 0,1 масс. % поверхностно-активного вещества и 98,8 масс. % очищенной воды.
В еще одном предпочтительном аспекте композиция в форме геля состоит только из полигексаметиленбигуанида (ПГМБ) в качестве активного агента, очищенной воды в качестве растворителя, увлажнителя, гелеобразующего агента и по меньшей мере одного полоксамера.
Гелеобразующие агенты предпочтительно выбирают из полимеров, обычно используемых в гелеобразных композициях для уменьшения подвижности и повышения вязкости продукта. Гелеобразующий агент предпочтительно представляет собой производное целлюлозы или другой коммерчески доступный гелеобразующий агент.Предпочтительными гелеобразующими агентами являются производные целлюлозы (например, метилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, гидроксиэтилцеллюлоза), и/или полимеры модифицированной акриловой кислоты (например, карбопол), либо по отдельности, либо в комбинации. Особенно предпочтительными гелеобразующими агентами являются метилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксиэтилметилцеллюлоза, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза и натрий карбоксиметилцеллюлоза. Другими предпочтительными гелеобразующими агентами являются неионные полимеры поли(этиленоксида). Другим предпочтительным гелеобразующим агентом является карбоксиполиметилен, также известный как карбопол, который представляет собой полимер модифицированной акриловой кислоты, предпочтительно выбранный из Carbopol 940, Carbopol 934 [USAN:NF], Carbopol 907, Carbopol 941, Carbopol Ultrez 10 и Carbopol 5984.
Хотя предпочтительные гелеобразующие агенты должны быть в неионной форме, в композициях также можно использовать анионные молекулы (т.е. карбоксиметилцеллюлозу и карбопол) в присутствии катионного эксципиента, который может представлять собой соповерхностно-активное вещество (например, пантенилгидроксипропилстеардимония хлорид).
Увлажнители предпочтительно выбирают из бета-ситостерола, инозита, глицерина, мочевины, гидроксиэтилмочевины, глицерилстеарата, пантенола, пропиленгликоля, полиэтиленгликоля и его производных (т.е. метилглюцета 10 и метилглюцета 20), и ксилита. Увлажнители еще более предпочтительно выбирают из глицерина и гидроксиэтилмочевины.
В предпочтительном варианте композиция состоит из от 0,05 до 2,0 масс. % ПГМБ, от 0,1 до 40 масс. % триблоксополимера, от 1,0 до 10,0 масс. % увлажнителя, от 0,5 до 5,0 масс. % гелеобразующего агента, и дополнена до 100 масс. % добавлением очищенной воды с получением конечного раствора для лечения ран. Композиция в форме геля может, таким образом, состоять из 0,1 масс. % ПГМБ, 1,0 масс. % триблоксополимера (такого как полоксамер 188), 8,6 масс. % глицерина, 1,8 масс. % гидроксиэтилцеллюлозы и 88,5 масс. % очищенной воды.
В другом предпочтительном аспекте композиция состоит из от 0,05 до 2,0 масс. % ПГМБ, от 0,1 до 40 масс. % полоксамера, от 0,01 до 2 масс. % соповерхностно-активного вещества, от 1,0 до 10,0 масс. % увлажнителя, от 0,5 до 5,0 масс. % гелеобразующего агента и дополнена до 100 масс. % добавлением очищенной воды с получением конечного раствора для лечения ран. Композиция в форме геля может, таким образом, состоять из 0,1 масс. % ПГМБ, 1,0 масс. % полоксамера (такого как полоксамер 188), 0,1 масс. % соповерхностно-активного вещества, 8,6 масс. % глицерина, 1,8 масс. % гидроксиэтилцеллюлозы и 88,4 масс. % очищенной воды.
Другим аспектом настоящего изобретения является способ получения композиции для лечения ран для местного и оромукозного лечения, включающий стадии добавления воды в смеситель, добавления и смешивания полигексаметиленбигуанида (ПГМБ) и очищенной воды (раствор А), и добавления и смешивания указанного раствора А с полоксамером с получением конечного продукта.
Другим аспектом настоящего изобретения является способ получения композиции для местного и оромукозного лечения для лечения ран, включающий стадии добавления гелеобразующего агента в дистиллированную воду и их смешивания с использованием нагревания, последующего добавления ПГМБ (раствор В), охлаждения указанного раствора В, и добавления и смешивания охлажденного раствора В с триблоксополимером с получением конечного продукта.
Композиция в соответствии с настоящим изобретением может содержать только вышеописанные ПГМБ и полоксамеры, очищенную воду, увлажнители (например, глицерин, инозит, пантенол, ксилит и т.д.), гелеобразующие агенты (например, карбопол, карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу, метилцеллюлозу и т.д.), то есть без каких-либо дополнительных соединений, таких как вещество/вещества, полученные из растений.
ИЛЛЮСТРАТИВНЫЕ КОМПОЗИЦИ
Композиции А, В и С, содержащие ПГМБ и полоксамеры
Ниже в качестве примера описаны две композиции согласно настоящему изобретению, одна в форме раствора и одна в форме геля. Эти композиции позже в экспериментальной части также сравнивали с обычными известными композициями.
Иллюстративная композиция А в форме раствора в соответствии с настоящим изобретением:

Иллюстративная композиция В в форме геля в соответствии с настоящим изобретением:
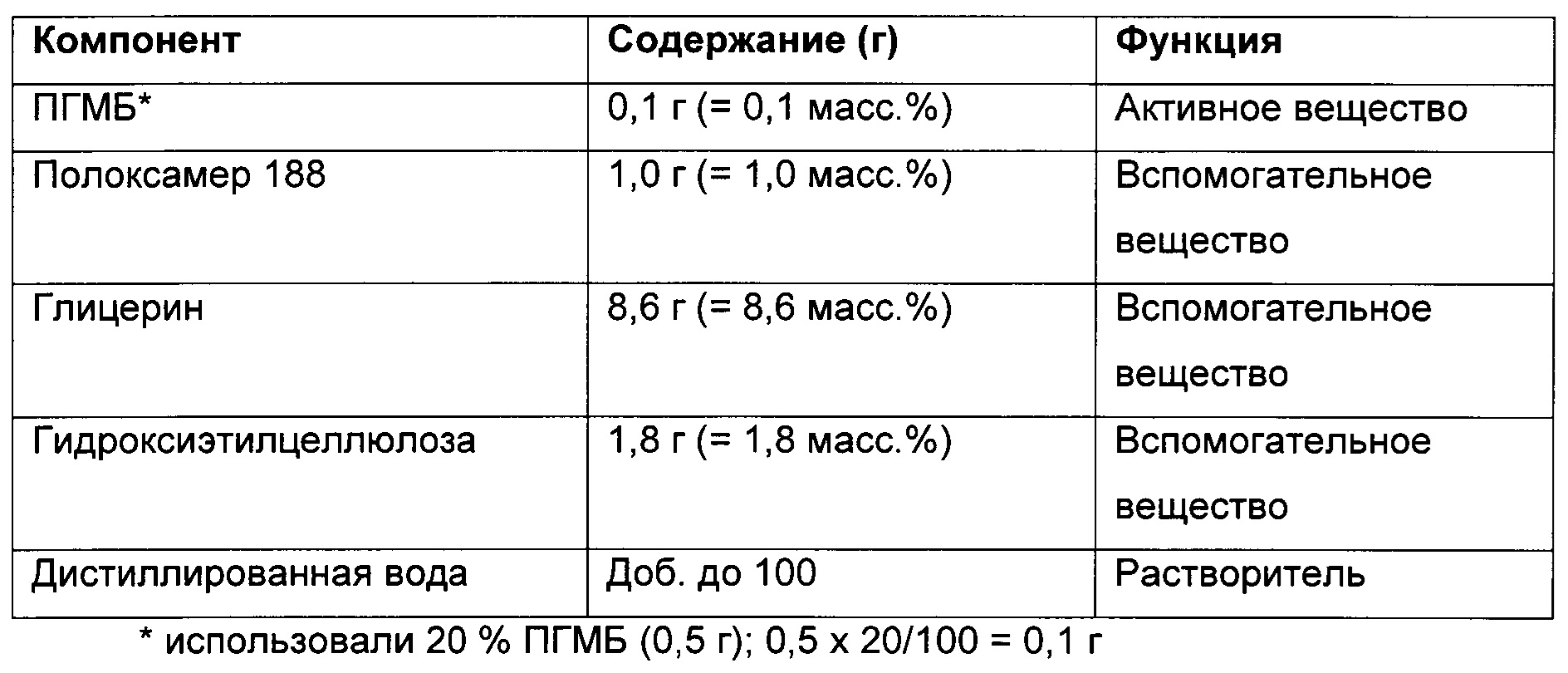
Иллюстративная композиция С в форме геля в соответствии с настоящим изобретением:


Композиции, содержащие ПГМБ, полоксамеры и соповерхностно-активные вещества
Композици согласно настоящему изобретению также могут содержать соповерхностно-активные вещества в качестве дополнительного эксципиента либо для улучшения растворимости каких-либо добавленных растительных компонентов, либо для придания композиции дополнительных синергетических эффектов. Следующие примеры, один в форме раствора и один в форме геля, описывают основную композицию с соповерхностно-активными веществами.
Сравнительный пример 1:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой раствор для очистки и/или лечения ран.
Пример 2:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой раствор для очистки и/или лечения ран.
Пример 3:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой раствор для очистки и/или лечения ран. Компонент
Сравнительный пример 4:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой раствор для очистки и/или лечения ран.
* Пантенилгидроксипропилстеардимония хлорид
Сравнительный пример 5а:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой гель для очистки и/или лечения ран.
Сравнительный пример 5b:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой гель для очистки и/или лечения ран.
Пример 6а:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой гель для очистки и/или лечения ран.
Пример 6b:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой гель для очистки и/или лечения ран.
Пример 7а:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой гель для очистки и/или лечения ран.
Пример 7b:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой гель для очистки и/или лечения ран.
Сравнительный пример 8а:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой гель для очистки и/или лечения ран.
* Пантенилгидроксипропилстеардимония хлорид
Сравнительный пример 8b:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой гель для очистки и/или лечения ран.
* Пантенилгидроксипропилстеардимония хлорид
Композиции, содержащие ПГМБ, полоксамеры и дополнительные вещества, полученные из растений
В дополнение к вышеописанным соединениям композиции могут содержать вещество/вещества, полученные из растений, как описано выше. Такие вещества, полученные из растений, могут иметь полезные свойства, описанные выше в соответствующем разделе.
Однако композиции в соответствии с настоящим изобретением не требуют присутствия веществ, полученных из растений. Также композиция в форме раствора, геля, как описано выше, не содержащая каких-либо веществ, полученных из растений, может иметь желаемый эффект для лечения ран. В связи с этим следует отметить еще раз, что полоксамеры, в частности полоксамеры, в соответствии с настоящим изобретением являются амфифильными, нетоксичными и неионными поверхностно-активными веществами и, таким образом, могут быть использованы в комбинации с ПГМБ для лечения ран с желаемыми полезными эффектами.
Использование дополнительных веществ, полученных из растений, может, таким образом, просто дополнительно увеличить полезный эффект, уже полученный с использованием ПГМБ с полоксамерами в соответствии с настоящим изобретением.
Композици в форме раствора, содержащие ПГМБ, полоксамеры и дополнительные вещества, полученные из растений
Таким образом, настоящее изобретение дополнительно включает в себя композицию в форме раствора, содержащую одно или более растительных веществ, ПГМБ, эмульгатор (полоксамер) и очищенную воду, для применения для местного лечения кожных и оромукозных ран.
Такая композиция в форме раствора предназначена для применения для приготовления смеси, содержащей ПГМБ, очищенную воду, эмульгатор и/или экстракт окопника (Symphytum officinale L.) и/или настойку мирры (Commiphora molmol), и, возможно, соповерхностно-активное вещество или смесь соповерхностно-активных веществ.
Предпочтительная концентрация экстракта окопника (Symphytum officinale L) в любой композиции в форме раствора составляет от 1,0 до 15,0% (масс./масс.), более предпочтительно от 3,0 до 12,0% (масс./масс.) и наиболее предпочтительно 10,0%) (масс./масс.).
Предпочтительная концентрация настойки мирры (Commiphora molmol) в любой композиции в форме раствора составляет от 1,0 до 20,0% (масс./масс.), более предпочтительно от 3,0 до 12,0% (масс./масс.) и наиболее предпочтительно 5,0%) (масс./масс.).
Предпочтительная концентрация полигексаметиленбигуанида (ПГМБ) в любой композиции в форме раствора составляет от 0,05 до 2,0% (масс./масс.), более предпочтительно от 0,08 до 0,3% (масс./масс.) и наиболее предпочтительно 0,1% (масс./масс.).
Предпочтительная концентрация эмульгатора в любой композиции в форме раствора составляет от 0,1 до 40,0% (масс./масс.), более предпочтительно от 0,5 до 20% (масс./масс.) и наиболее предпочтительно 1,0% (масс./масс.). Предпочтительная концентрация соповерхностно-активных веществ в любой композиции в форме раствора составляет от 0 до 2% (масс./масс.), более предпочтительно от 0,01 до 2% (масс./масс.), даже более предпочтительно от 0,05 до 1% (масс./масс.) и наиболее предпочтительно 0,1% (масс./масс.). Смесь, приготовленную путем смешивания ингредиентов, перечисленных выше, дополняют до 100 масс. % добавлением дистиллированной воды, чтобы получить конечный раствор для лечения ран.

Для выполнения вышеупомянутых задач стадии получения композиции в форме раствора заключаются в следующем: добавление и смешивание растительного вещества/веществ, полоксамера и, возможно, соповерхностно-активного вещества или смеси соповерхностно-активных веществ для получения раствора X, отдельное добавление и смешивание полигексаметиленбигуанида (ПГМБ) и дистиллированной воды для получения раствора Y и, наконец, добавление и смешивание раствора X с раствором Y с получением конечного продукта. После этого конечный раствор, полученный в результате осуществления способа, подвергают фильтрации.
Получение различных композиций в форме раствора в соответствии с изобретением, дополнительно содержащих вещества, полученные из растений, подробно описано в качестве примеров ниже.
Пример 1:
Путем смешивания обычным способом следующих перечисленных ингредиентов
получают раневой раствор для очистки и/или лечения ран.
Пример 2:
Путем смешивания обычным способом следующих перечисленных ингредиентов
получают раневой раствор для очистки и/или лечения ран.
Пример 3:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой раствор для очистки и/или лечения ран.
Композиции в форме геля, содержащие ПГМБ, полоксамеры и дополнительные вещества, полученные из растений:
Настоящее изобретение дополнительно включает гелеобразную композицию, содержащую одно или более растительных веществ, ПГМБ, эмульгатор (триблоксополимер), гелеобразующий агент, увлажнитель и очищенную воду, для применения для местного лечения кожных и оромукозных ран.
Гелеобразная композиция предназначена для применения для приготовления смеси, содержащей ПГМБ, очищенную воду, эмульгатор, гелеобразующий агент, увлажнитель и/или экстракт окопника (Symphytum officinale L.), извлекать и/или настойку мирры (Commiphora molmol), и, возможно, соповерхностно-активное вещество или смесь соповерхностно-активных веществ.
Предпочтительная концентрация экстракта окопника (Symphytum officinale L.) в любой композиции в форме геля составляет от 1,0 до 15,0% (масс./масс.), более предпочтительно от 3,0 до 12,0% (масс./масс.) и наиболее предпочтительно 10% (масс./масс.).
Предпочтительная концентрация настойки мирры (Commiphora molmol) в любой композиции в форме геля составляет от 1,0 до 20,0% (масс./масс.), более предпочтительно от 3,0 до 12,0% (масс./масс.) и наиболее предпочтительно 5,0% (масс./масс.).
Предпочтительная концентрация полигексаметиленбигуанида (ПГМБ) в любой композиции в форме геля составляет от 0,05 до 2,0% (масс./масс.), более предпочтительно от 0,08- до 0,3% (масс./масс.) и наиболее предпочтительно 0,1% (масс./масс).
Предпочтительная концентрация эмульгатора в любой композиции в форме геля составляет от 0,1 до 40,0% (масс./масс.), более предпочтительно от 0,5 до 20% (масс./масс.) и наиболее предпочтительно 1,0% (масс./масс.).
Предпочтительная концентрация гелеобразующего агента в любой композиции в форме геля составляет от 0,5 до 5,0% (масс./масс.), более предпочтительно от 1,0 до 3,0% (масс./масс.) и наиболее предпочтительно 1.8% (масс./масс.).
Предпочтительная концентрация увлажнителя в любой композиции в форме геля составляет от 1,0 до 10,0% (масс./масс.), более предпочтительно от 5,0 до 9,0% (масс./масс.) и наиболее предпочтительно 8,6% (масс./масс.).
Предпочтительная концентрация соповерхностно-активного вещества в любой композиции в форме геля составляет от 0 до 2% (масс./масс.), более предпочтительно от 0,01 до 2% (масс./масс.), даже более предпочтительно от 0,05 до 1% (масс./масс.) и наиболее предпочтительно 0,1% (масс./масс.), смесь готовят путем смешивания перечисленных выше ингредиентов и дополняют до 100% путем добавления дистиллированной воды для получения конечного геля для лечения ран.

Для выполнения вышеупомянутых задач стадии получения гелеобразной композиции являются следующими: добавление и смешивание растительного вещества/веществ, полоксамера и, возможно, соповерхностно-активного вещества или смеси соповерхностно-активных веществ с получением раствора X, отдельное добавление гелеобразующего агента в очищенную воду и их смешивание при нагревании, и последующее добавление ПГМБ с получением раствора Z, охлаждение раствора Z и, наконец, добавление и смешивание раствора X с раствором Z с получением конечного продукта. После этого конечный раствор, полученный в результате этого способа, подвергают фильтрации.
Получение различных гелеобразных композиций в соответствии с изобретением, дополнительно содержащих вещества, полученные из растений, подробно описано в качестве примеров ниже:
Пример 4а:
Путем смешивания обычным способом следующих перечисленных ингредиентов
получают раневой гель для очистки и/или лечения ран.
Пример 4b:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой гель для очистки и/или лечения ран.
Пример 5а:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой гель для очистки и/или лечения ран.
Пример 5b:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой гель для очистки и/или лечения ран.
Пример 6а:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой гель для очистки и/или лечения ран.
Пример 6b:
Путем смешивания обычным способом следующих перечисленных ингредиентов получают раневой гель для очистки и/или лечения ран.
ОБЛАСТИ ПРИМЕНЕНИЯ
Композиции согласно изобретению можно использовать для очистки, обеззараживания, орошения и увлажнения инфицированной, сухой кожи и слизистых оболочек, и кожи и слизистых оболочек с нарушенной целостностью (хронических и острых); их также можно использовать перед нанесением бинтов, марли, компрессов, раневых наполнителей и других абсорбирующих материалов.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ
Общие результаты с композициями, содержащими ПГМБ и полоксамер 188 в соответствии с композициями А и В
Было показано, что раствор (иллюстративная композиция А) в соответствии с настоящим изобретением обладает хорошими свойствами для деколонизации устойчивого к метициллину золотистого стафилококка (MRSA). Устойчивый к метициллину золотистый стафилококк является штаммом грамположительных бактерий, который вызывает пневмонию, раневые и внутрибольничные инфекции. Они устойчивы к нескольким антибиотикам. Раствор в соответствии с настоящим изобретением обладает сильным бактерицидным действием в отношении MRSA и может легко наноситься на инфицированную область.
Такие же результаты были получены для устойчивых к ванкомицину энтерококков (VRE), другого штамма грамположительных бактерий, который вызывает сильные внутрибольничные инфекции, главным образом, у пациентов с хроническим гемодиализом. Также композиция в соответствии с настоящим изобретением обладает сильным бактерицидным действием в отношении VRE и может быть легко нанесена на инфицированную область.
Кроме того, были достигнуты хорошие эффекты для грамотрицательных плеоморфных бактерий Acinetobacter baumannii, которые могут оставаться живыми в течение длительного времени в экстремальных условиях окружающей среды и являются патогенными микроорганизмами в организме человека, легко колонизируются и поражают людей с ослабленной иммунной системой в больнице. Было показано, что ПГМБ эффективно используется для антисептической обработки и дезинфекции на живых и неживых поверхностях, колонизированных Acinetobacter с множественной лекарственной устойчивостью.
Бактерицидная и противогрибковая эффективность композиций А и В
Общее описание метода испытаний для бактерицидной эффективности.
Бактерицидную активность раствора, содержащего ПГМБ и полоксамер 188, в соответствии с настоящим изобретением оценивали в соответствии с Европейским стандартом EN 13727 (2012/FprAI: 2013).
Суспензию тестируемых организмов в растворе противодействующего вещества добавляют к образцу раствора в соответствии с настоящим изобретением (разбавленного жесткой водой). Смесь выдерживают при температуре 20±1°С в течение требуемого времени контакта. В конце времени контакта отбирают аликвоту 1 мл; бактерицидную активность в этой порции немедленно нейтрализуют. Два образца по 1 мл (на стадии разбавления, разбавитель, содержащий нейтрализатор) этой суспензии распределяют по меньшей мере на 2 пластины каждый. Число выживших тестируемых организмов в тестируемой смеси вычисляют для каждого образца и определяют снижение относительно соответствующей тестируемой суспензии №. Условия эксперимента (контроль А), нетоксичность нейтрализатора (контроль В) и метод разбавления-нейтрализации (контроль С) контролируют.
Композиция в форме используемого раствора содержит 0,1 г ПГМБ, 1,0 г полоксамера 188 и 98,9 г дистиллированной воды на 100 г.
Композиция в форме используемого геля содержит 0,1 г ПГМБ, 1,0 г полоксамера 188, 8,6 г глицерина, 1,8 г гидроксиэтилцеллюлозы и 88,5 г дистиллированной воды на 100 г.
Тест с раствором в соответствии с настоящим изобретением проводили в грязных условиях (0,3% альбумина + 0,3% эритроцитов барана) с использованием Psuedomonas aeruginosa (АТСС 15442), Escherichia coli (NCTC 10538), Enterococcus hirae (ATCC 10541) и Staphylococcus aureus (ATCC 6538) в качестве тестируемых организмов. Использовали 80%, 50% и 25% испытательные растворы композиции, содержащие 0,1% ПГМБ (CAS №32289-58-0) и 1% полоксамера (CAS №9003-11-6). Значения рН составляли 6,21 (100%), 7,36 (80%), 7,35 (50%) и 6,88 (WSH). В качестве нейтрализатора использовали 4% Tween 80 + 3% сапонина + 0,4% лецитина + 0,5% ДСН (SDS) (Нейтрализатор XXIII). Результаты представлены ниже.
Кроме того, этот раствор тестировали против MRSA (ATCC 33592), VRE (DSM 17050) и Acinetobacter baumannii (ATCC 19606). Тест проводили в грязных условиях (MRSA и VRE), как описано выше, и в чистых условиях (0,3 г/л бычьего альбумина). Результаты представлены ниже.
Тест с гелем в соответствии с настоящим изобретением проводили в грязных условиях (0,3% альбумина + 0,3% эритроцитов барана) с использованием Psuedomonas aeruginosa (ATCC 15442), Escherichia coli (NCTC 10538), Enterococcus hirae (ATCC 10541) и Staphylococcus aureus (ATCC 6538) в качестве тестируемых организмов. Использовали 80%, 50%, 25% и 5% испытательные растворы композиции, содержащие 0,1% ПГМБ (CAS №32289-58-0) и 1% полоксамера (CAS №9003-11-6). Значения рН составляли 6,20 (80%), 7,19 (50%), 7,22 (25%), 7,68 (5%) и 7,05 (WSH). В качестве нейтрализатора использовали 4% Tween 80 + 3% сапонина + 0,4% лецитина + 0,5% ДСН (SDS) (Нейтрализатор XXIII). Результаты представлены ниже.
Результаты для бактерицидной активности
Раствор в соответствии с настоящим изобретением обладает бактерицидной активностью (log10 RF ≥ 5) при 20°С в грязных условиях для контрольных штаммов P. aeruginosa, Е. coli, S. aureus и Е. hirae в течение времени контакта 1 мин при концентрации продукта 80% и в течение времени контакта 5 мин при концентрации продукта 25%. Кроме того, указанный раствор обладает бактерицидной активностью (log10 RF ≥ 5) при 20°С в грязных условиях в течение 5 и 10 минут при разбавлении до 80% и 50% (об./об.) в дистиллированной воде для контрольного штамма Staphylococcus aureus (MRSA) и в течение 1, 5 и 10 минут при разбавлении до 80% и 50% (об./об.) в дистиллированной воде для контрольного штамма Enterococcus faecium (VRE). Результаты испытаний при 20°С в чистых условиях для контрольного штамма Acinetobacter baumannii показали, что раствор обладает бактерицидной активностью (log10 RF ≥ 5) в течение 5 и 10 минут при разведении до 80% и 50% (об./об.) в дистиллированной воде.
Гель в соответствии с настоящим изобретением обладает бактерицидной активностью (log10 RF ≥ 5) при 20°С в грязных условиях для контрольных штаммов P. aeruginosa, E. coli, S. aureus и E. hirae в течение времени контакта 1 мин при концентрации продукта 50%.
Общее описание метода испытаний для противогрибковой эффективности
Противогрибковую активность раствора, содержащего ПГМБ и полоксамер 188, в соответствии с настоящим изобретением оценивали в соответствии с европейским стандартом EN 13624 (2013).
Суспензию тестируемых организмов в растворе противодействующего вещества добавляют к образцу раствора в соответствии с настоящим изобретением (разбавленного жесткой водой). Смесь выдерживают при температуре 20±1°С в течение требуемого времени контакта. В конце времени контакта отбирают аликвоту 1 мл; бактерицидную активность в этой порции немедленно нейтрализуют. Два образца по 1 мл (на стадии разбавления, разбавитель, содержащий нейтрализатор) этой суспензии распределяют по меньшей мере на 2 пластины каждый. Число выживших тестируемых организмов в тестируемой смеси вычисляют для каждого образца и определяют снижение относительно соответствующей тестируемой суспензии №. Условия эксперимента (контроль А), нетоксичность нейтрализатора (контроль В) и метод разбавления-нейтрализации (контроль С) контролируют.
Используемая композиция в форме раствора содержит 0,1 г ПГМБ, 1,0 г полоксамера 188 и 98,9 г дистиллированной воды на 100 г.
Используемая композиция в форме геля содержит 0,1 г ПГМБ, 1,0 г полоксамера 188, 8,6 г глицерина, 1.8 г гидроксиэтилцеллюлозы и 88,5 г дистиллированной воды на 100 г.
Тест с раствором в соответствии с настоящим изобретением проводили в грязных условиях (0,3% альбумина + 0,3% эритроцитов барана) с использованием С. albicans (ATCC 10231) в качестве тестируемого организма. Использовали 80%, 50%) и 25% испытательные растворы композиции, содержащие 0,1% ПГМБ (CAS №32289-58-0) и 1% полоксамера (CAS №9003-11-6). Значения рН составляли 6,21 (100%), 7,36 (80%), 7,35 (50%) и 6,88 (WSH). В качестве нейтрализатора использовали 4% Tween 80 + 3% сапонина + 0,4% лецитина + 0,5% ДСН (SDS) (Нейтрализатор XXIII). Результаты представлены ниже.
Тест с гелем в соответствии с настоящим изобретением проводили в грязных условиях (0,3% альбумина + 0,3% эритроцитов барана) с использованием С. albicans (ATCC 10231) в качестве тестируемого организма. Использовали 80%, 50%, 25% и 5% испытательные растворы композиции, содержащие 0,1% ПГМБ (CAS №32289-58-0) и 1% полоксамера (CAS №9003-11-6). Значения рН составляли 6,20 (80%), 7,19 (50%), 7,22 (25%), 7,68 (5%) и 7,05 (WSH). В качестве нейтрализатора использовали 4% Tween 80 + 3% сапонина + 0,4% лецитина + 0,5% ДСН (SDS) (Нейтрализатор XXIII). Результаты представлены ниже.
Результаты противогрибковой активности
Раствор в соответствии с настоящим изобретением обладает бактерицидной активностью (log10 RF ≥ 4) при 20°С в грязных условиях для контрольного штамма С. Albicans в течение времени контакта 15 мин при концентрации продукта, начиная от 50%.
Гель в соответствии с настоящим изобретением обладает бактерицидной активностью (log10 RF ≥ 4) при 20°С в грязных условиях для контрольного штамма С. Albicans в течение времени контакта 15 мин при концентрации продукта, начиная от 25%.
Сравнение с другими композициями
Бактерицидная и противогрибковая активность
Композиции согласно настоящему изобретению имеют такую же или лучшую бактерицидную и/или противогрибковую активность по сравнению с обычно используемыми композициями.
Например, раствор в соответствии с настоящим изобретением, содержащий ПГМБ и полоксамер (например, полоксамер 188), имеет такую же или лучшую бактерицидную и/или противогрибковую активность по сравнению с ПГМБ, используемым отдельно.
Кроме того, раствор в соответствии с настоящим изобретением, содержащий ПГМБ и полоксамер (например, полоксамера 188), имеет такую же или лучшую бактерицидную и/или противогрибковую активность по сравнению с ПГМБ в сочетании с ундециленамидопропилбетаином.
Кроме того, раствор в соответствии с настоящим изобретением, содержащий ПГМБ, полоксамер (например, полоксамер 188) и соповерхностно-активное вещество или смесь соповерхностно-активных веществ, имеет такую же или лучшую бактерицидную и/или противогрибковую активность по сравнению с ПГМБ в сочетании с ундециленамидопропилбетаином или полоксамером.
Кроме того, гель в соответствии с настоящим изобретением, содержащий ПГМБ, полоксамер (например, полоксамер 188), глицерин и гидроксиэтилцеллюлозу, имеет такую же или лучшую бактерицидную и/или противогрибковую активность по сравнению с ПГМБ, который используется один с глицерином и гидроксиэтилцеллюлозой.
Кроме того, гель в соответствии с настоящим изобретением, содержащий ПГМБ, полоксамер (например, полоксамер 188), глицерин и гидроксиэтилцеллюлозу, имеет такую же или лучшую бактерицидную и/или противогрибковую активность по сравнению с ПГМБ, используемым с глицерином и гидроксиэтил целлюлозой, и ундециленамидопропилбетаином.
Кроме того, гель в соответствии с настоящим изобретением, содержащий ПГМБ, полоксамер (например, полоксамер 188), глицерин, гидроксиэтилцеллюлозу и соповерхностно-активное вещество или смесь соповерхностно-активных веществ, имеет такую же или лучшую бактерицидную и/или противогрибковую активность по сравнению с ПГМБ, используемым с ундециленамидопропилбетаином или полоксамером и глицерином, и гидроксиэтилцеллюлозой.
Кроме того, гель в соответствии с настоящим изобретением, содержащий ПГМБ, полоксамер (например, полоксамер 188), глицерин и гидроксиэтилцеллюлозу, имеет такую же или лучшую бактерицидную и/или противогрибковую активность по сравнению с ПГМБ, который используется один с глицерином и гидроксиэтилцеллюлозой.
Кроме того, гель согласно настоящему изобретению, содержащий ПГМБ, полоксамер (например, полоксамер 188), глицерин и гидроксиэтилцеллюлозу, имеет такую же или лучшую бактерицидную и/или противогрибковую активность по сравнению с ПГМБ, используемым с глицерином и гидроксиэтилцеллюлозой, и ундециленамидопропилбетаином.
Кроме того, гель согласно настоящему изобретению, содержащий ПГМБ, полоксамер (например, полоксамер 188), глицерин, гидроксиэтилцеллюлозу и соповерхностно-активное вещество или смесь соповерхностно-активных веществ, имеет такую же или лучшую бактерицидную и/или противогрибковую активность по сравнению с ПГМБ, используемым с ундециленамидопропилбетаином или полоксамером и глицерином, и гидроксиэтилцеллюлозой.
Кроме того, раствор согласно настоящему изобретению, содержащий ПГМБ, полоксамер (например, полоксамер 188), вещество/вещества, полученные из растений, и, возможно, соповерхностно-активное вещество или смесь соповерхностно-активных веществ, имеет такую же или лучшую бактерицидную и/или противогрибковую активность по сравнению с раствором, не содержащим указанного вещества/веществ, полученных из растений.
Кроме того, гель согласно настоящему изобретению, содержащий ПГМБ, полоксамер (например, полоксамер 188), глицерин, гидроксиэтилцеллюлозу, вещество/вещества, полученные из растений, и, возможно, соповерхностно-активное вещество или смесь соповерхностно-активных веществ, имеет такую же или лучшую бактерицидную и/или противогрибковую активность по сравнению с раствором, не содержащим указанного вещества/веществ, полученных из растений.
Токсичность
Композиция с ПГМБ и полоксамером имеет улучшенные свойства по сравнению с другими поверхностно-активными веществами, такими как производные бетаина. Оказалось, что полоксамеры и в частности полоксамер 188 имеют значительно более низкую токсичность, чем наиболее часто используемые поверхностно-активные вещества, такие как производные бетаина. Информация о классификации в соответствии с Регламентом ЕС и значения LD50 некоторых коммерческих поверхностно-активных веществ приведены в таблице 5.

Как было упомянуто выше, цитотоксичность является важным моментом при заживлении раны. Кроме того, эффект снижения цитотоксичности ингредиента является желательным. Было показано, что полоксамер 188 имеет свойства герметизации и регенерации мембраны на нейронах, кардиомиоцитах, фибробластах и клеток скелетных мышц [22-25]. Таким образом, полоксамер 188 предотвращает апоптоз и уменьшает цитотоксичность. Кроме того, сообщалось, что полоксамер 188 облегчает регенерацию плазматической мембраны в резидентных клетках альвеол [26].
Таким образом, выгодно использовать полоксамеры вместо обычно используемых поверхностно-активных веществ в бактерицидных или противогрибковых композициях.
Поверхностное натяжение
Кроме того, триблоксополимеры согласно настоящему изобретению, в частности полоксамеры, из-за их неионогенных свойств улучшили поверхностное натяжение по сравнению с поверхностно-активными веществами, такими как производные бетаина. Например, в случае, если значение рН в ране изменится, заряд бетаинов может измениться и, таким образом, возникнет другое поверхностное натяжение, чем перед этим. Поэтому при использовании производных бетаина желаемый бактерицидный или противогрибковый эффект не всегда воспроизводимо достигается. Триблоксополимеры согласно настоящему изобретению, с другой стороны, имеют одинаковое поверхностное натяжение, независимо от окружающего рН, и обеспечивают постоянный и надежный бактерицидный или противогрибковый эффект.
В то же время, указанные триблоксополимеры лучше минимизируют адгезию микроорганизмов на ранах.
ССЫЛКИ
1. Dahlen, N. and A.P. Kramer. 2008, Wound treatment agent. Prontomed GmbH, 32120 Hiddenhausen (DE). EP 1404311 (B1).
2. Dahlen, N. 2001, Stable aqueous gel containing polyhexamethylene biguanide, glycerol and hydroxyethyl cellulose, useful e.g. as washing or shower gel having decontaminant action or for covering wounds. Prontomed Gmbh. DE 10012026 A1. DE 2000112026.
3. Jovanovic, A., et al., The Influence of Metal Salts, Surfactants, and Wound Care Products on Enzymatic Activity of Collagenase, the Wound Debriding Enzyme. Wounds-A Compendium of Clinical Research and Practice, 2012. 24(9): p. 242-253.
4. Gethin, G., 7776 significance of surface pH in chronic wounds. Wounds uk, 2007. 3(3): p. 52.
5. Arndt, A., et al. 2013, Antimicrobial wound dressing. B. Braun Melsungen Ag. US 20130231394 A1. US 13/637,111.
6. Birnie, C.R., D. Malamud, and R.L. Schnaare, Antimicrobial Evaluation of N-Alkyl Betaines and N-Alkyl-N,N-Dimethylamine Oxides with Variations in Chain Length. Antimicrobial agents and chemotherapy, 2000. 44(9): p. 2514-2517.
7. Fraud, S., et al., Activity of amine oxide against biofilms of Streptococcus mutans: a potential biocide for oral care formulations. Journal of Antimicrobial Chemotherapy, 2005. 56(4): p. 672-677.
8. Kanjilal, S., et al., Synthesis and evaluation of micellar properties and antimicrobial activities of imidazole-based surfactants. European Journal of Lipid Science and Technology, 2009. 111(9): p. 941-948.
9. Barel, A.O., M. Paye, and H.I. Maibach, Handbook of Cosmetic Science and Technology. 2001, New York, Marcel Dekker. ISBN: 0-8247-0292-1
10. Logan, A. and D. Hill, Bioavailability: Is this a key event in regulating the actions of peptide growth factors? Journal of endocrinology, 1992. 134(2): p. 157-161.
11. Agren, M., An amorphous hydrogel enhances epithelialisation of wounds. ACTA DERMATOVENEREOLOGICA-STOCKHOLM-, 1998. 78: p. 119-122.
12. Muetterlein, R. and C.-G. Arnold, Investigations Concerning the Content and the Pattern of Pyrrolidine Alkaloids in Symphytum officinale L. PZ WISSENSCHAFT, 1993. 138: p. 119-119.
13. EMA/HMPC/572844/2009, Assessment report on Symphytum officinale L, radix, 12 July 2011, Committee on Herbal Medicinal Products (HMPC).
14. Comfrey herb and leaf (Symphyti herba/-folium), List of German Commission E Monographs (Phytotherapy), Phytotherapeutic Monographs (BGA, Commission E, Germany). July 27, 1990.
15. Symphyti radix, 2009; E/S/C/O/P Monographs: The Scientific Foundation for Herbal Medicinal Products. Supplement 2009, European Scientific Cooperative on Phytotherapy,Thieme. p. 249-254. ISBN: 1901964086
16. Staiger, C, Symphytum, 2009; HagerROM 2009: Hagers Enzyklopadie der Arzneistoffe und Drogen, W. Blaschek, S. Ebel, and E. Hackenthal, Editors., Springer-Verlag: Berlin. ISBN: 978-3-642-16227-5
17. Staiger, C, Comfrey: a clinical overview. Phytotherapy Research, 2012. 26(10): p. 1441-1448.
18. Andres, R., R. Brenneisen, and J. Clerc, Relating antiphlogistic efficacy of dermatics containing extracts of Symphytum officinale to chemical profiles PI. Med, 1989. 55: p. 643-644.
19. EMA/HMPC/96910/2010, Assessment report on Commiphora molmol Engler, gummi-resina, 15 September 2010, Committee on Herbal Medicinal Products (HMPC)
20. Myrrha, 2003; E/S/C/O/P Monographs: The Scientific Foundation for Herbal Medicinal Products. Supplement 2003, European Scientific Cooperative on Phytotherapy, Thieme. p. 340-344. ISBN: 1588902331
21. Verhelst, G., Groot handboek geneeskrachtige planten. 2004, Welvergem: BVBA Mannavita. ISBN: 9080778427
22. Marks, J.D., et al., Amphiphilic, tri-block copolymers provide potent membrane-targeted neuroprotection. The FASEB Journal, 2001. 15(6): p. 1107-1109.
23. Yasuda, S., et al., Dystrophic heart failure blocked by membrane sealant poloxamer. Nature, 2005. 436(7053): p. 1025-1029.
24. Merchant, F., et al., Poloxamer 188 enhances functional recovery of lethally heat-shocked fibroblasts. Journal of Surgical Research, 1998. 74(2): p. 131-140.
25. Collins, J.M., F. Despa, and R.C. Lee, Structural and functional recovery of electropermeabilized skeletal muscle in-vivo after treatment with surfactant poloxamer 188. Biochimica et Biophysica Acta (BBA) - Biomembranes, 2007. 1768(5): p. 1238-1246.
26. Plataki, M., et al., Poloxamer 188 facilitates the repair of alveolus resident cells in ventilator-injured lungs. American journal of respiratory and critical care medicine, 2011. 184(8): p. 939-947.
Реферат
Изобретение относится к фармацевтической промышленности и представляет собой композицию, состоящую из полигексаметиленбигуанида, очищенной воды и по меньшей мере одного полоксамера для применения в местном и/или оромукозном лечении ран. Изобретение обеспечивает предотвращение любых негативных последствий, которые могут повлиять на здоровье человека, содействие процессу заживления за счет обеспечения поверхностно-активными веществами, которые работают независимо от рН окружающей среды, лечение пациентов, страдающих от другого системного заболевания, с использованием полоксамеров без какого-либо токсического действия на организм, очистки поверхностей организма от вредных веществ в силу бактерицидного эффекта. 2 н. и 6 з.п. ф-лы, 5 табл., 8 пр.

Комментарии