Композиции, включающие электрогидродинамически полученные волокна, для нанесения заданных доз активного вещества на кожу или слизистую оболочку - RU2695217C2
Код документа: RU2695217C2
Чертежи














Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к полученным электрогидродинамически волокнам, содержащим лекарство, и к композициям, включающим указанные волокна, для нанесения на кожу, губы или слизистую оболочку для доставки заданного количества одного или более лекарственных веществ на кожу или слизистую оболочку. Действующее начало состава обеспечивает присутствие в волокнах биоадгезивного вещества в форме нерастворенного материала, что позволяет осуществлять биоадгезию in situ при контакте, например, со слюной в полости рта. Волокна находятся в форме слоя и могут быть снабжены одним или более дополнительными слоями, например, слоем подложки, который не растворим в воде или слюне, и/или слоем, который может влиять на высвобождение лекарственного вещества из конечной композиции.
Кроме того, композиции могут быть пригодны для местного нанесения на внутренние влажные поверхности, такие как голосовые связки или кишечник, например, для лечения воспалительных заболеваний кишечника. В частности настоящее изобретение относится к композициям, включающим полученные электрогидродинамически волокна, для нанесения на полость рта для доставки лекарственного вещества к слизистой оболочке полости рта.
УРОВЕНЬ ТЕХНИКИ
Одной из главных проблем, связанных с лечением заболеваний кожи или слизистой оболочки, является доставка корректного количества лекарственного вещества к пораженной коже или слизистой оболочке. Композиции для применения при лечении заболеваний кожи или слизистой оболочки очень часто находятся в виде крема, мази или геля, которые наносятся больным путем распределения варьирующего количества композиции на пораженную область варьирующего размера, и композиция распределяется в этой области с переменной толщиной.
Соответственно, обычно очень трудно получить достоверные результаты, касающиеся, например, связи между дозой и эффектом, различиями между индивидуумами и различиями результатов у одного и того же индивидуума и т.д.
Трансдермальные системы, такие как пластыри, обычно используются для лекарственных веществ, которые должны проникать в кожу, т.е. они не предназначены для использования при лечении заболеваний кожи или слизистой оболочки, когда лекарственные вещества должны действовать местно на поверхности или внутри кожи или слизистой оболочки. Патент США 4765983 относится к адгезивной медицинской ленте для использования при стоматите. Лента включает подложку, состоящую из полимера, растворимого в кишечнике, и, по меньшей мере, два слоя, содержащих лекарства, состоящих по существу из водорастворимого полимера, содержащего стероид.
Вариабельность дозировки существенно затрудняет контроль лечения поражений кожи или слизистой оболочки и принятие правильного решения о продолжении или прекращении лечения, так как, например, может быть затруднительной оценка профиля соотношения преимущества/риска при лечении. Если, например, наблюдаются системные побочные эффекты, то трудно узнать, обусловлены ли побочные эффекты чрезмерной дозой (больной наносит слишком большую дозу, например, путем распределения композиции на слишком большой площади, или больной распределяет композицию слишком толстым слоем), или побочные эффекты можно было бы избежать только путем прекращения лечения. Недостаточная дозировка также может быть проблемой при местном лечении, особенно когда используются кремы, мази, лосьоны или другие жидкие или полужидкие композиции. В целом, 30% больных, подвергающихся местному лечению, испытывают недостаточное дозирование.
Для того чтобы иметь фармацевтическую композицию, одобренную регулирующими органами здравоохранения, требуется весомая документация, относящаяся к терапевтическому эффекту, показаниям, побочным эффектам, токсическим эффектам, дозировкам и т.д. С этой целью было бы выгодно, если бы эффекты, связанные с вариабельностью дозировок, можно было бы избежать или существенно снизить, т.е. если бы было возможно гарантировать, что наносимая доза контролируется и не является предметом решения больного, наносящего композицию (например, относительно площади, толщины, частоты и т.д.). Таким образом может быть получен более надежный профиль преимущества/риска.
Кроме того, для того чтобы быть эффективными, композиции для применения при лечении заболеваний слизистой оболочки полости рта должны оставаться на месте поражения в течение определенного периода времени. Часто композиции, подобные, например, пленкам, не предназначены для использования при лечении патологических изменений в полости рта, но используются для получения относительно быстрого всасывания в системный кровоток. Пленки обычно распадаются относительно быстро, что либо делает их непригодными для использования, либо требует их применения много раз в день.
Еще одна проблема связана с введением в полость рта или в другие слизистые оболочки, локализующиеся во влажной среде, такие как влагалище, слизистая оболочка глаза и т.д. Многие патологические изменения находятся в полости рта и требуют местного лечения (например, плоский лишай полости рта). Такое лечение часто осуществляется с использованием растворов, кремов, паст или мазей, когда их вводят путем распределения композиции на пораженной площади с помощью пальца. Помимо перечисленных выше недостатков, слюна, продуцируемая слюнными железами, совместно с движениями языка стремится удалить композицию с места введения и будет уменьшать эффект лечения.
Таким образом, существует потребность в разработке композиций для лечения заболевания, локализованного на коже или слизистой оболочке, или как описано в Области техники, к которой относится изобретение, где композиции созданы таким образом, что конкретная доза легко может быть нанесена на пораженную область. Следует отметить, что композиция может оставаться на месте нанесения в течение длительного периода времени.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к электрогидродинамически полученным волокнам, включающим
i) образующий волокна гидрофильный полимер, который растворим в первом растворителе,
ii) биоадгезивное вещество, которое малорастворимо в указанном первом растворителе,
iii) лекарственное вещество.
В отдельном аспекте изобретение относится к электрогидродинамически полученным волокнам, включающим
i) образующий волокна гидрофильный полимер, который растворим в первом растворителе,
ii) биоадгезивное вещество, которое малорастворимо в указанном первом растворителе,
т.е. к волокнам, которые аналогичны волокнам, упомянутым выше, но без какого-либо содержания лекарственного вещества. Все подробности, упомянутые в настоящем документе в отношении волокнообразующего гидрофильного полимера, биоадгезивного вещества, их концентраций, отношений между биоадгезивным веществом и волокнообразующим гидрофильным полимером, и композиций, включающих такие волокна, применяются с учетом необходимых изменений к волокнам или композициям без какого-либо содержания лекарственного вещества. Авторы настоящего изобретения обнаружили, что такие волокна или композиции, включающие такие волокна, могут быть пригодны для использования в определенных случаях, таких как лечение неосложненных ран, например, в ротовой полости.
В данном контексте термин электрогидродинамически полученные волокна предназначен для обозначения того, что эти волокна получают способом, который включает электростатическое воздействие. В общем виде такие методы обозначаются как электрогидродинамические (EHD) методы и включают электропрядение, электрораспыление, коаксиальное электропрядение, коаксиальное электрораспыление, эмульсионное электропрядение и т.д. Такие методы рассматриваются как часть настоящего изобретения в отношении получения волокон в соответствии с настоящим изобретением. По практическим причинам используется термин «электроспряденные волокна», но он применяется без ограничения к волокнам, полученным с помощью электропрядения, но также к волокнам, полученным электрогидродинамическим способом, как описано выше.
Эти электроспряденные волокна предоставляются в тонком слое, который прилипает к коже, слизистой оболочке или влажной внутренней поверхности. Лекарственное вещество равномерно распределяется в электроспряденных волокнах, в результате чего концентрация лекарственного вещества на площадь поверхности слоя является постоянной, и доза лекарственного вещества может быть легко определена путем использования измерения площади слоя.
Важным признаком настоящего изобретения является использование сочетания волокнообразующего гидрофильного полимера и биоадгезивного вещества, где два вещества имеют различную растворимость в определенных растворителях. Таким образом, волокнообразующее гидрофильное вещество должно быть растворимым в растворителе, в то время как биоадгезивное вещество не должно растворяться или, по меньшей мере, должно растворяться только небольшое количество биоадгезивного вещества.
Растворитель может представлять собой C1-C3-алканол, такой как метанол, этанол, пропанол или изопропанол, или их смеси. Растворитель или смесь растворителей может также содержать максимально 20 об./об.% водной среды, такой как вода.
В некоторых случаях растворитель представляет собой этанол или смеси этанол-вода. Этанол может содержать до 20 об./об.% воды, обычно приблизительно 3-10 об./об.%.
При получении волокон использовался растворитель или смесь растворителей (в дальнейшем обычно обозначаемые как «растворитель»). Таким образом, для получения волокон ингредиенты содержатся в растворителе; гидрофильный полимер растворяют в растворителе, и биоадгезивное вещество находится в нерастворенной форме или, по меньшей мере, 90 масс./масс.% биоадгезивного вещества находится в нерастворенной форме. Ингредиенты растворяют/диспергируют в растворителе того же типа, но они могут применяться в процессе электропрядения в виде одной, двух или трех различных смесей.
Растворимость гидрофильного полимера и биоадгезивного вещества в используемом растворителе имеет большое значение для получения желаемых свойств волокон по изобретению. Таким образом, гидрофильный полимер должен иметь растворимость в первом растворителе 3 г/100 мл или более при 25°С или 10 г/100 мл или более при 25°С, и биоадгезивное вещество должно иметь растворимость в указанном первом растворителе 0,5 г/100 мл или менее при 25°С или 0,1 г/100 мл или менее при 25°С.
Из-за разницы в растворимости биоадгезивное вещество прикрепляется к волокнам в виде мелких частиц. Небольшое количество биоадгезивного вещества может быть растворено в растворителе, и, следовательно, может быть составной частью волокон, но для того, чтобы достичь максимального биоадгезивного эффекта, предполагается, что биоадгезивное вещество прикрепляется к волокнам и что волокнистая структура по существу обусловлена электропрядением волокнообразующего гидрофильного полимера.
В зависимости от свойств лекарственного вещества оно может быть составной частью волокон или может быть присоединено к волокнам или смешано с ними. Таким образом, если лекарственное вещество растворимо в используемом растворителе и способно образовывать волокна, то оно может быть составной частью волокон. Если таких условий нет, лекарственное вещество будет прикрепляться к присутствующим волокнам в смеси с волокнами.
В настоящем контексте термин «составная часть волокон» означает, что вещество совместно с волокнообразующим гидрофильным полимером образует волокнистую структуру волокон.
Гидрофильный полимер является основным ингредиентом в электроспряденных волокнах и является ингредиентом, который обладает способностью образовывать волокнистый материал. Для того чтобы избежать путаницы с другими ингредиентами, присутствующими либо в электроспряденных волокнах, либо в их композиции, термин «волокнообразующий гидрофильный полимер» используется в следующем смысле. Волокнообразующий гидрофильный полимер представляет собой соответственно полимер, который растворим в C1-C3 алканоле, таком как метанол, этанол, пропанол или изопропанол, в частности этанол, пропанол или изопропанол, или образует в них гель. Процесс прядения требует того, чтобы полимер, который является основным компонентом волокон, находился в растворенной форме, чтобы обеспечивать устойчивый поток растворенного полимера, вытекающего из иглы к заземленной собирающей пластине в виде струи в процессе прядения.
Подходящие волокнообразующие гидрофильные полимеры представляют собой поливинилпирролидон (PVP), акрилаты и акриловые сополимеры (например, эудрагит®) и их смеси. Другие полимеры, такие как, например, этилцеллюлоза (EC), гидроксипропилцеллюлоза (HPC) или их смеси, также могут быть использованы. Этилцеллюлоза (EC), гидроксипропилцеллюлоза (HPC) или их смеси могут использоваться особенно в сочетании с поливинилпирролидоном (PVP) и/или акрилатами, включая акриловые сополимеры (например, эудрагит®). В примерах использовали главным образом PVP и акриловые сополимеры.
Поливинилпирролидон может быть использован такого класса, который имеет приблизительную молекулярную массу от 2500 Да до 3000000 Да (например, повидон с величинами K от 12 до 120). PVP можно приобрести в виде коллидона®:
В диапазоне низких М.м. охватываемые подходящие классы имеют М.м. от приблизительно 25000 до приблизительно 120000 Да, в частности, от приблизительно 70000 до приблизительно 100000 Да. В приведенных в настоящем документе примерах использовался главным образом коллидон® 90F, и, соответственно, предпочтительный PVP имеет М.м. от приблизительно 900000 до приблизительно 3000000, в частности, от приблизительно 1000 до 1500000.
Этилцеллюлоза продается под торговой маркой ETHOCEL™ (Dow Chemical Company) и доступна в виде многих классов. Компания Dow Chemical производит этилцеллюлозу в двух этоксильных типах (обозначаемых стандартный и средний). В зависимости от содержания ее этоксильных групп этилцеллюлоза может иметь различные точки размягчения и точки температур плавления. Этилцеллюлоза также производится с рядом различных вязкостей. В таблице ниже приведен перечень доступных этилцеллюлоз.
Полимеры ETHOCEL
В пластифицированной форме она имеет отличную термопластичность и пригодна для композиций, полученных в результате формования, экструзии или ламинирования. Этилцеллюлоза является также прекрасным формирователем пленок и используется при покрытии, например, таблеток. Виды этилцеллюлозы вышеуказанного качества имеют содержание этоксила, по меньшей мере, 45,0% и, соответственно, они растворимы в этаноле и практически не растворимы в воде.
Акрилаты и производные акриловой кислоты включают полиметакрилаты, сополимеры метакрилатов, акриловые сополимеры и метакрилатные полимеры. Предпочтительными акрилатами являются акрилаты, которые продаются под торговой маркой ЭУДРАГИТ®, которые растворимы в этаноле, или сополимеры акрилатов/октаакриламида (продаваемые под названием ДЕРМАКРИЛ 79). Они включают ЭУДРАГИТ®E 12,5 (сополимер аминометакрилата), ЭУДРАГИТ® E100 (сополимер аминометакрилата; сополимер основного бутилированного метакрилата), ЭУДРАГИТ®E PO ((сополимер аминометакрилата), ЭУДРАГИТ®L 100-55, ЭУДРАГИТ®L 100 (сополимер метакриловой кислоты - метилметакрилата 1:1), ЭУДРАГИТ®S 100 (сополимер метакриловой кислоты - метилметакрилата 1:2), ЭУДРАГИТ®RL 100, ЭУДРАГИТ®RL 100 (сополимер аммония метакрилата типа А), ЭУДРАГИТ®RL PO, ЭУДРАГИТ®RS 100 (сополимер аммония метакрилата типа B), ЭУДРАГИТ®RS PO. ЭУДРАГИТ®E представляет собой катионный полимер на основе диметиламиноэтилметакрилата и других нейтральных эфиров метакриловой кислоты: ЭУДРАГИТ®L и S представляют собой сополимеры метакриловой кислоты и являются катионными продуктами сополимеризации метакриловой кислоты и метилметакрилата. Эудрагит® RL или RS представляют собой сополимеры аммония метакрилата, синтезированные из акриловой кислоты и метакриловой кислоты.
Эудрагит® E 100 растворим до рН 5,5, и Е 12,5 растворим при рН выше 5.
ЭУДРАГИТ® L30 D-55, L-100-55 (сополимер метакриловой кислоты - этилакрилата 1:1), L 100, L 12,5 обычно используются в составах для рассасывания в кишечнике, но могут быть использованы для того, чтобы отсрочить высвобождение лекарственного вещества из волокон по данному изобретению. ЭУДРАГИТ® L30 D-55 и L-100-55 растворяются при рН приблизительно 5,5, и классы L 100 и L 12,5 растворяются при рН 6 или выше.
Поскольку рН в слюне обычно составляет приблизительно 5-6, эти полимеры представляют интерес для волокон для перорального применения. Если желательно замедленное или пролонгированное высвобождение, более подходящими для использования могут быть полимеры, которые растворимы при более низких или более высоких значениях рН.
Продукты ЭУДРАГИТ® также доступны для составов с замедленным высвобождением, и такие классы могут представлять интерес для включения в волокна согласно изобретению либо отдельно, либо вместе с другим гидрофильным полимером. Соответствующие классы относятся к сериям RL, RS, NE и NM, таким как RL 100, RL PO, RL 30D и RL 12,5, RS 100, RS PO, RS 30D и RS 12,5, NE 30D и NE 40D и NM 30D.
Гидроксипропилцеллюлоза представляет собой неионный водорастворимый эфир целлюлозы. Она сочетает в себе растворимость в органическом растворителе, термопластичность и поверхностную активность и свойства утолщения и стабилизации. Волокна являются гибкими и не липкими при высокой влажности. Гидроксипропилцеллюлоза продается под названием KLUCEL™.
В контексте настоящего изобретения предпочтительные волокнообразующие гидрофильные полимеры выбраны из PVP, гидроксипропилцеллюлозы (HPC), акрилатов и производных акриловой кислоты и их смесей.
Концентрация волокнообразующего гидрофильного полимера(ов) в волокнах в соответствии с изобретением обычно составляет от приблизительно 40% до приблизительно 92 масс./масс.%, в частности, от приблизительно 50 до приблизительно 85 масс./масс.% или от приблизительно 60% до 75 масс./масс.%.
Волокна по данному изобретению также содержат биоадгезивное вещество. Для того чтобы обеспечить легкое получение волокон и получить желаемые биоадгезивные свойства in situ после нанесения на слизистую оболочку, важно, чтобы биоадгезивное вещество само по себе не вносило существенный вклад в вязкость раствора, содержащего волокнообразующий гидрофильный полимер.
В данном контексте термин «биоадгезивный» или «биоадгезивность» указывает на прикрепление к конкретному биологическому месту локализации, например, к поверхности кожи, губам или поверхности слизистой оболочки. Биоадгезивное вещество придает биоадгезивность содержащим лекарственное средство волокнам по изобретению или в некоторых случаях может быть включено в композицию по настоящему изобретению, например, в виде отдельного слоя, который после нанесения является внутренним слоем, обращенным к коже или слизистой оболочке, т.е. слоем, который находится в контакте с кожей или слизистой оболочкой.
Биоадгезивное вещество для использования в настоящем контексте может быть выбрано из декстрана, полиэтиленоксидов, альгината, трагаканта, каррагенана, пектина, желатина, гуаровой камеди, ксантана, геллана, метилцеллюлозы, гидроксипропилметилцеллюлозы (HPMC), карбоксиметилцеллюлозы и ее основных солей, полимеров акриловой кислоты (производных PAA), хитозана, лектинов, тиолированных полимеров, полиокс-WSRA, РАА-со-ПЭГ (ПЭГ представляет собой полиэтиленгликоль), а также их смесей.
В общем случае предполагается, что адгезивный эффект полимеров возрастает с увеличением молекулярной массы. Таким образом, в целом адгезивные полимеры, имеющие относительно высокую молекулярную массу, являются предпочтительными.
Полиэтиленоксид можно использовать в классе, имеющем примерную молекулярную массу от 100000 до 4000000. Предпочтительные классы имеют среднюю молекулярную массу от приблизительно 700000 до приблизительно 4000000. Полиэтиленоксид продается под названием POLYOX™ (Dow Chemical Company) с молекулярной массой в диапазоне от 100000 до 7000000 Да. Как видно из приведенных в настоящем документе примеров, пригодные полиэтиленоксиды имеют молекулярную массу 2000000 Да или более, например, от 2000000 до 7000000 Да.
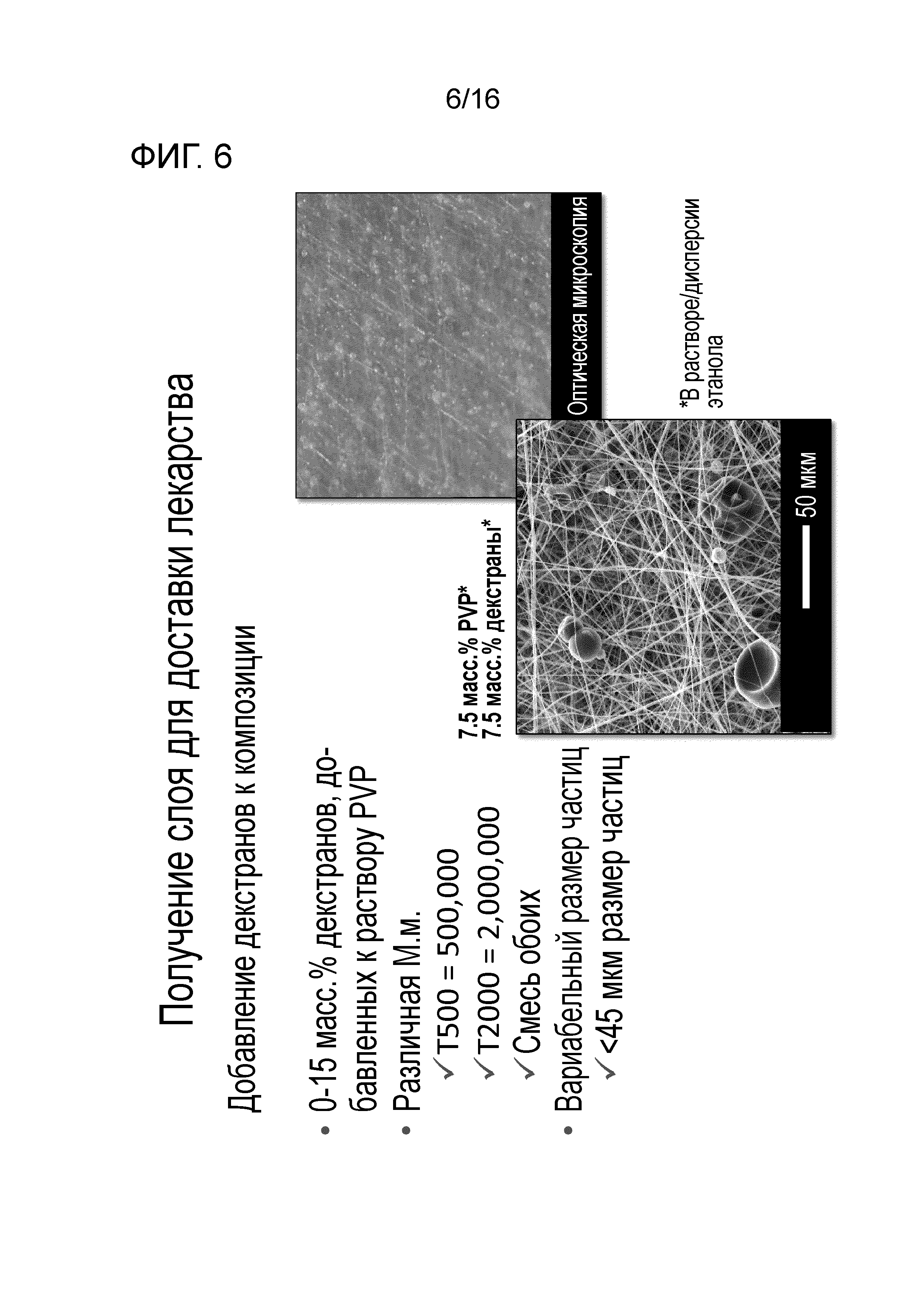
Декстран может быть использован в классе, имеющем примерную молекулярную массу от 400000 Да до 2000000 Да. Предпочтительные декстраны имеют молекулярную массу от приблизительно 500000 до приблизительно 2000000 Да, в частности, от приблизительно 700000 до приблизительно 800000 Да или приблизительно от 1000000 до приблизительно 2000000 Да.
Производные целлюлозы включают гидроксипропилметилцеллюлозу, метилцеллюлозу и карбоксиметилцеллюлозу.
Метилцеллюлоза продается под названием METHOCEL™ (Dow Chemical Company) и доступна в широком диапазоне уровней вязкости (от менее 3 до более 100000 мПа*сек).
НРМС продается различного качества в зависимости от вязкости. НРМС продается под названиями Metocel® и Klucel®. Подходящая НРМС имеет среднюю молекулярную массу от приблизительно 80000 до приблизительно 140000.
Карбоксиметилцеллюлоза доступна при широком выборе классов. Вязкость находится в диапазоне от 10 до 100000 мПа*сек. Она также доступна в виде ее натриевой соли с широким диапазоном уровней замещения. Dow Chemical Company продает натриевую соль карбоксиметилцеллюлозы под названием WALOCEL™.
Поливиниловый спирт может быть использован в классе, имеющем примерную молекулярную массу от 20000 Да до 200000 Да.
Предпочтительные биоадгезивные вещества представляют собой полиэтиленоксиды, декстраны или их сочетания.
Включение биоадгезивного вещества в волокна согласно изобретению дает возможность получить конечную композицию, которая является биоадгезивной и может оставаться на коже или на поверхности слизистой оболочки в течение длительного периода времени, не отваливаясь.
Количество биоадгезивного вещества в волокнах на площадь поверхности имеет большое значение для обеспечения надлежащей биоадгезии.
Концентрация биоадгезивного вещества в волокнах составляет от приблизительно 5% до приблизительно 60 масс./масс.%, в частности от приблизительно 8% до приблизительно 50% или от приблизительно 10% до приблизительно 40 масс./масс.%, основываясь на сумме общего сухого веса.
Авторы настоящего изобретения обнаружили, что весовое отношение биоадгезивного вещества и гидрофильного полимера в волокнах должно быть в диапазоне от 0,1 до 10, например, от 0,2 до 10. Оно может зависеть от заданного гидрофильного полимера и заданного используемого биоадгезивного вещества, но обычно применим указанный выше диапазон. Отношение будет в некоторой степени зависеть от выбранного биоадгезивного вещества, так что чем выше биоадгезивный потенциал, который имеет биоадгезивное вещество, тем ниже требуется отношение, и наоборот. Приведенные числа, однако, рассматриваются в качестве общего руководства. В примерах настоящего изобретения приведены дополнительные иллюстрации. В частности, подходящие результаты были получены, когда весовое отношение биоадгезивного вещества и гидрофильного полимера составляло от 0,1 до 4 или от 0,1 до 2.
Волокна согласно изобретению также содержат лекарственное вещество. Лекарственное вещество выбирают из лекарственных веществ, которые показаны для лечения заболевания кожи, губ или слизистой оболочки, или в случае, когда волокна включены в композиции для нанесения на внутреннюю поверхность, как описано в настоящем документе, лекарственное вещество может представлять собой любое лекарственное средство, которое показано для заданного лечения. В данном контексте лекарственное вещество может быть выбрано из лекарственных веществ, которые показаны для лечения заболевания в ротовой полости, таких как лекарственное вещество, которое показано для местного лечения заболевания в полости рта. В настоящем документе упомянуты лекарственные вещества, представляющие особый интерес. Лекарственное вещество может присутствовать в растворенной, нерастворенной или частично растворенной форме в зависимости от растворимости лекарства в гидрофильном полимере и используемого биоадгезивного вещества.
Волокна согласно изобретению могут также содержать один или более фармацевтически приемлемых наполнителей, включая наполнители, которые упомянуты в настоящем документе. Кроме наполнителей, упоминаемых в настоящем документе ниже, волокна могут содержать пластификатор. Пластификатор придает волокнам определенную пластичность, он может облегчить процесс получения и/или улучшить гибкость и способность к обработке гидрофильного полимера(ов). Примерами подходящих пластификаторов являются сложные эфиры лимонной кислоты, такие как ацетилтриэтилцитрат, трибутилцитрат или триэтилцитрат, касторовое масло, диацетилированные моноглицериды, дибутилсебакат, диэтилфталат, сорбит, глицерин или производные глицерина, такие как триацетин или трибутирин, производное целлюлозы, например, нитрат целлюлозы, гликоли, такие как полиэтиленгликоли, в частности, полиэтиленгликоли с молекулярной массой от приблизительно 100 до приблизительно 1500, монометиловый эфир полиэтиленгликоля, пропиленгликоль или их смеси.
Пластификатор может влиять на скорость высвобождения лекарственного вещества. Соответственно, пластификатор может также рассматриваться в качестве модификатора скорости высвобождения. Как правило, изменение концентрации пластификатора будет влиять на скорость высвобождения. Обычно и, если он присутствует, концентрация пластификатора в волокнах находится в диапазоне от 0 до приблизительно 10 масс./масс.%, например, от приблизительно 0,5 до приблизительно 5 масс./масс.%.
Электроспряденные волокна могут также содержать агент, улучшающий растворимость, для того чтобы подгонять или регулировать скорость высвобождения лекарственного вещества из электроспряденных волокон. Если он присутствует, лекарственное вещество растворяется в агенте, улучшающем растворимость, и, необязательно, в одном или более летучих растворителях, в частности в С1-C3-алканоле, перед подачей в аппарат, создающий электроспряденные волокна. Таким образом, создается уверенность в том, что лекарственное вещество, содержащее агент, улучшающий растворимость, находится в пределах электроспряденных волокон. Подходящие агенты, улучшающие растворимость, включают алкиловый эфир полиоксиэтилена и жирных кислот, изопропиловый эфир линейных или разветвленных C8-C14-жирных кислот, моно- или диэфир пропиленгликоля и C8-C14-алканола или алкенола, линейный или разветвленный C8-C24-алканол или алкенол, C6-C22-ацилглицерид, N-алкилпирролидон или N-алкилпиперидон и минеральное масло, такое как парафин.
Алкиловый эфир полиоксиэтилена и жирных кислот обычно выбран из группы, состоящей из полиоксиэтилен-15-стеарилового эфира, полиоксиэтилен-11-стеарилового эфира, полиоксиэтилен-14-бутилового эфира, полиоксиэтилен-10-цетилового эфира и полиоксиэтилен-3-миристилового эфира.
Изопропиловый эфир линейных или разветвленных C8-C14-жирных кислот представляет собой изопропилмиристат, изопропилпальмитат, изопропилизостеарат, изопропиллинолат или изопропилмоноолеат.
Моно- или диэфир пропиленгликоля и C8-C14-алканола или алкенола представляет собой пропиленгликоля монолаурат, пропиленгликоля монокаприлат или пропиленгликоля дипеларгонат.
Линейный или разветвленный C8-C24-алканол или алкенол может представлять собой каприловый, лауриловый, цетиловый, стеариловый, олеиловый, линоиловый или миристиловый спирт или 2-октилдодеканол.
C6-C22-ацилглицерид представляет собой растительное масло, например, кунжутное масло, подсолнечное масло, масло из пальмовых косточек, кукурузное масло, сафлоровое масло, оливковое масло, масло авокадо, масло жожоба, масло из виноградных косточек, масло канолы, масло зародышей пшеницы, миндальное масло, масло из семян хлопчатника, арахисовое масло, масло грецкого ореха или соевое масло, растительное масло высокой степени очистки, например, триглицериды со средней цепью (триглицериды каприловой/каприновой кислоты), длинноцепочечные триглицериды, касторовое масло, каприловой моноглицерид, моно- и диглицериды каприловой/каприновой кислоты или моно-, ди- или триглицериды каприловой/каприновой кислоты.
N-алкилпирролидон обычно представляет собой N-метилпирролидон, и N-алкилпиперидон обычно представляет собой N-метилпиперидон.
Агент, улучшающий растворимость, может также представлять собой жирную кислоту, такую как жирная кислота со средней, длинной или очень длинной цепью, включая олеиновую кислоту и линолевую кислоту.
Концентрация агента, улучшающего растворимость, в электроспряденных волокнах, если он присутствует, находится в диапазоне от 0 до приблизительно 10 масс./масс.%, например, от приблизительно 0,5 до приблизительно 5 масс./масс.%
Толщина волокон (их получают в виде слоя) может варьироваться в зависимости от предполагаемого использования. Для гарантии надлежащей прочности волокон толщина обычно находится в диапазоне от микрометра до приблизительно 5 мм. Толщина сходна с толщиной бумаги.
Толщина электроспряденных волокон (которые выглядят в виде листа) является одинаковой по всей длине и ширине листа. В данном контексте термин «одинаковый» означает, что разница в толщине при длине 1 м и ширине 1 м, составляет не более 10%.
Биоадгезивное вещество и лекарственное вещество гомогенно распределяют в материале волокна, что означает, что концентрация веществ, переносимых волокнами (биоадгезивного вещества, лекарственного вещества и, необязательно веществ/добавок, упомянутых в настоящем документе), является одинаковой на площади поверхности, где площадь поверхности измеряется как длина×ширина данной части листа волокон.
Каждое волокно содержит определенное количество биоадгезивного вещества и лекарственного вещества и, если применяются другие добавки или ингредиенты, такие вещества также будут являться частью волокон.
Высвобождение лекарственного вещества из волокон может представлять собой немедленное высвобождение или модифицированное высвобождение в зависимости от заданного лекарственного вещества и предполагаемого использования. Скорость высвобождения можно регулировать, например, для получения более медленного высвобождения путем
i) использования волокнообразующего гидрофильного полимера(ов) с повышенной средней молекулярной массой,
ii) использования волокнообразующего гидрофильного полимера(ов), обычно предназначенного для использования в композициях с поддерживаемым высвобождением или в композициях с покрытием для высвобождения в кишечнике,
iii) использования смеси волокнообразующих гидрофильных полимеров, в которой, по меньшей мере, один из полимеров не растворим в воде или слюне,
iv) повышения концентрации биоадгезивного вещества для получения более компактного волокна при применении, например, в полости рта, где биоадгезивное вещество может вызывать набухание,
v) повышения компактности структуры сети в волокнах (в качестве альтернативы поперечная сшивка из электроспряденных волокон),
iii) увеличения толщины,
iv) увеличения диаметра волокна,
v) изменения способа получения (например, от простого игольчатого сопла до коаксиальной инъекции),
vi) нанесения дополнительного слоя, например, гидрофобного материала, на слой волокон, где гидрофобный слой предназначен для нанесения наиболее близко к слизистой оболочке полости рта и, таким образом, замедляет высвобождение лекарственного вещества из волокон.
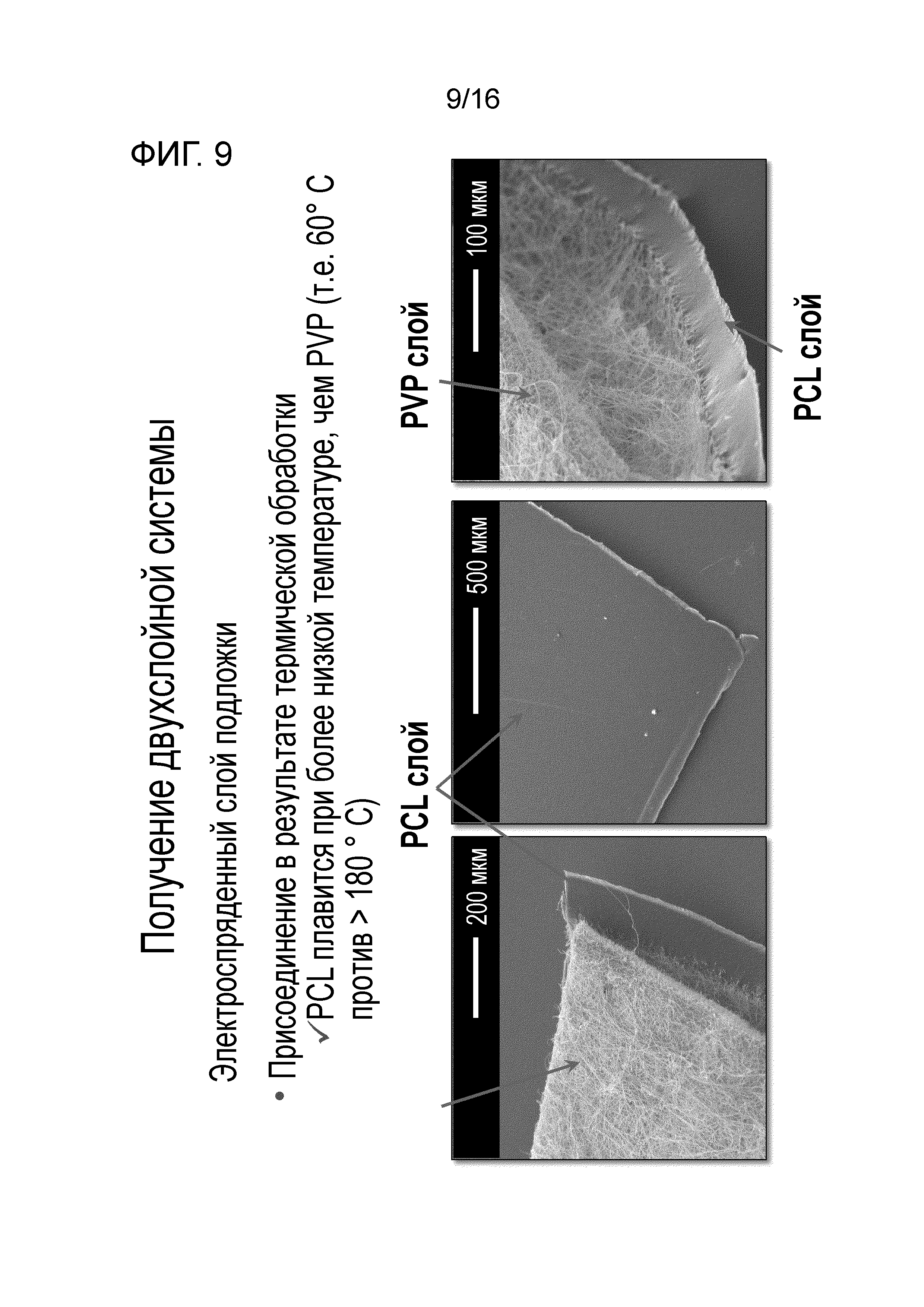
Подходящий гидрофобный материал, который может быть использован в качестве слоя подложки, представляет собой поли(капролактон).
Аналогично, скорость высвобождения можно регулировать, например, для получения более быстрого высвобождения путем
i) использования волокнообразующего гидрофильного полимера(ов) с пониженной средней молекулярной массой,
ii) уменьшения количества биоадгезивного вещества для снижения компактности волокон,
iii) увеличения концентрации вещества, улучшающего растворимость,
iv) увеличения пористости волокон,
v) уменьшения толщины слоя волокон,
vi) уменьшения компактности сетевой структуры в волокнах,
vii) увеличения концентрации вещества, улучшающего растворимость,
viii) уменьшения диаметра волокон,
ix) изменения способа получения (например, от коаксиальной инъекции до простого игольчатого сопла).
Волокна по данному изобретению могут быть использованы в медицине, в частности, для лечения заболевания, локализованного на коже или слизистой оболочке.
В конкретном аспекте волокна в соответствии с изобретением предназначены для использования при лечении заболеваний полости рта, в частности, для местного лечения слизистой оболочки полости рта.
Такие волокна пригодны для использования в фармацевтических композициях для нанесения на кожу или слизистую оболочку для лечения заболеваний, локализованных в этих областях. В контексте настоящего изобретения термин «слизистая оболочка» включает слизистую оболочку в полости рта, во влагалище, в прямой кишке, в глазе, в ухе, а также слизистую оболочку губ. Волокна также могут быть использованы в композициях для нанесения на внутренние поверхности, такие как, например, поверхности органов (например, печени, селезенки, сердца и т.д.), тканей, таких как голосовые связки, на слизистую оболочку, такую как слизистая оболочка желудочно-кишечного тракта и т.д. Благодаря природе электроспряденных волокон, композиции согласно изобретению могут предлагаться для немедленного высвобождения лекарственного вещества или для контролируемого высвобождения лекарственного вещества путем изменения ингредиентов, используемых в композиции или в электроспряденных волокнах. Электроспряденные волокна обычно становятся невидимыми после нанесения, что делает возможным нанесение композиций на любую часть кожи или слизистой оболочки, например, на лицо. На нанесенную композицию можно также наносить, например, косметику. Это вызывает большое одобрение больных, поскольку лечение не оставляет никаких видимых признаков.
Изобретение также относится к фармацевтическим композициям, включающим электроспряденные волокна, к способам получения электроспряденных волокон и к применению электроспряденных волокон и фармацевтической композиции в медицине.
Применение электроспряденных волокон в медицине дает один или более из следующих преимуществ:
i) Возникает возможность улучшить терапевтический эффект, например, создавая композиции в виде композиций с контролируемым высвобождением. Таким образом, лекарственное вещество высвобождается из композиции в течение продолжительного периода времени, и избегается возникновение пиковой концентрации лекарственного вещества в месте нанесения; такие пиковые концентрации очень часто ответственны за нежелательные эффекты, такие как раздражение.
ii) Электроспряденные волокна являются сухими, т.е. в композиции вода не присутствует или присутствует только очень небольшое количество воды. Кроме того, полутвердые композиции, которые обычно используются для лечения заболевания кожи или слизистой оболочки, могут содержать наполнители, такие как растительные масла, воски, поверхностно-активные вещества, которые могут быть подвержены деградации. Деградация обычно происходит быстрее, если композиция содержит жидкий растворитель; таким образом, с точки зрения стабильности выгодно разработать композиции без присутствия растворителя или только с незначительным количеством присутствующего растворителя. Соответственно, предусмотрены длительные сроки хранения электроспряденных волокон и композиций по настоящему изобретению.
iii) Способ, с помощью которого волокна становятся электроспряденными, позволяет получать волокна с содержанием более чем одного лекарственного вещества. Различные лекарственные вещества могут быть добавлены в процессе прядения путем впрыскивания одной композиции, содержащей все лекарственные вещества, растворенные или диспергированные в растворителе в желаемых концентрациях, через один клапан, или путем использования различных клапанов для различных лекарственных веществ (или путем сочетания этих двух иллюстративных примеров). Другая возможность состоит в том, чтобы обеспечить одним слоем волокон, содержащем одно лекарственное вещество, а затем поверх этого слоя нанести другой слой волокон, содержащих второе лекарственное вещество. Таким образом, можно легко получить сочетание продуктов с двумя или более лекарственными веществами.
iv) Лекарственное вещество должно гомогенно распределяться в электроспряденных волокнах; таким образом обеспечивается правильное дозирование, и оно может быть выражено, например, как количество лекарственного вещества на единицу площади поверхности.
v) Электроспряденные волокна и композиции высоко безвредны для кожи или слизистой оболочки; волокна становятся прозрачными при нанесении, и косметические средства могут наноситься поверх волокон/композиций.
vi) Электроспряденные волокна/композиции просты в применении. Как правило, композиция содержит три слоя: слой защитного покрытия, слой, содержащий электроспряденные волокна, и, необязательно, слой подложки. Слой защитного покрытия служит в качестве защитного слоя для слоя, содержащего лекарство, и должен быть удален перед нанесением. Слой подложки можно рассматривать как покрытие, которое защищает композицию от возможности удаления с места нанесения (например, в случае ротовой полости с помощью движений языка или в присутствии слюны) или как окклюзионный слой, который управляет высвобождением активного вещества в коже или слизистой оболочке.
vii) В отличие от композиций, обычно используемых для лечения заболеваний кожи или слизистой оболочки, электроспряденные волокна и композиции по настоящему изобретению не пахнут.
viii) Эти электроспряденные волокна и композиции по настоящему изобретению не содержат каких-либо спиртов или поверхностно-активных веществ или какого-либо существенного их количества. Присутствие таких веществ в композициях для местного нанесения или нанесения на слизистые оболочки часто приводит к раздражению кожи или слизистой оболочки.
ix) Электроспряденные волокна и композиции по настоящему изобретению не содержат каких-либо консервантов.
Однако предполагается, что другие способы, такие как другие способы, включающие электростатические силы, могут быть использованы для получения равнозначных результатов. Общим термином для таких способов является термин электрогидродинамические (EHD) способы, и он включает электропрядение, электрораспыление, коаксиальное электропрядение, коаксиальное электрораспыление, эмульсионное электропрядение и т.д. Такие способы рассматриваются как часть настоящего изобретения в отношении получения волокон в соответствии с настоящим изобретением.
Фармацевтические композиции
Как указано в настоящем документе, настоящее изобретение также относится к фармацевтическим композициям, включающим электроспряденные волокна, описанные в настоящем документе.
Фармацевтические композиции предназначены для использования на коже или на поверхности слизистой оболочки, в частности на поверхности слизистой оболочки полости рта. Композиция по настоящему изобретению, как правило, находится в форме листа, содержащего один из более слоев, где, по меньшей мере, один слой содержит электроспряденные волокна и где электроспряденные волокна содержат лекарственное вещество. Композиция может быть представлена в форме листа. Она может иметь круглую, вытянутую или многоугольную форму. Композиция по изобретению представляет собой лекарственную форму, которая может обозначаться как лист, слоистая композиция, мембрана или пластырь.
В простом виде композиция содержит только один слой, а именно слой электроспряденных волокон, содержащих лекарство. Такая композиция пригодна для использования на коже. После нанесения композиция остается на месте нанесения благодаря ее биоадгезивным свойствам и становится прозрачной.
Композиция может также содержать более одного слоя, например, два или три или более слоев. Если композиция содержит, например, два слоя, каждый слой может быть слоем электроспряденных волокон, содержащих лекарство, где лекарственное вещество в этих двух слоях может быть одинаковым или различаться. Два слоя могут также иметь различный состав в отношении природы и содержания волокнообразующих гидрофильных полимеров и/или биоадгезивных веществ для облегчения различного характера высвобождения лекарственного вещества из двух различных слоев. Другим примером является вариант, когда композиция содержит один или более слоя(ев) электроспряденных волокон, содержащих лекарство, и другой терапевтически инертный слой, который функционирует в качестве слоя подложки для защиты содержащего лекарство слоя(ев) от влаги или слюны или функционирует в качестве окклюзионного слоя, который может управлять проникновением лекарственного вещества в кожу или слизистую оболочку. В случае, когда такая композиция наносится на слизистую оболочку полости рта, слой подложки защищает слой с лекарственным средством от вымывания с места нанесения, что должно приводить к проглатыванию композиции, в результате чего желаемый местный терапевтический эффект уменьшается или исчезает.
Альтернативно, композиция может содержать слой, в котором конкретная область создана из одного типа электроспряденных волокон и другая конкретная область создана из другого типа электроспряденных волокон.
В некоторых случаях может быть желательно иметь один или более слоев электроспряденных волокон без какого-либо содержания лекарственного вещества между слоем(ями) электроспряденных волокон, содержащих лекарственное средство, без слоя подложки и/или с ним. Такие слои электроспряденных волокон могут иметь тот же состав, что и слой электроспряденных волокон, содержащих лекарственное средство, но без какого-либо содержания лекарственного вещества, или состав может быть отличным, например, содержащим волокнообразующий гидрофобный полимер или смесь гидрофобного и гидрофильного волокнообразующего полимера. Предусматривается, что такой слой может быть использован для регулирования высвобождения лекарственного вещества из композиции. Таким образом, такая композиция представляет особый интерес в том случае, когда желательна композиция с контролируемым высвобождением. Таким образом, предполагается, что может быть получено улучшенное отношение между побочными эффектами и клиническим эффектом, т.е. появится возможность уменьшить нежелательные эффекты и в то же время достигнуть терапевтически эффективного ответа.
Слой подложки обычно либо прядется совместно со слоем, содержащим лекарственное средство, либо он предлагается в качестве слоя покрытия поверх слоя, содержащего лекарство. Обычно слой подложки является водонепроницаемым для создания окклюзионного эффекта и/или защитного эффекта против, например, слюны. Подходящие материалы для слоя подложки включают полиэтилен-со-винилацетат, этилцеллюлозу, поли(капролактон), карботан или полисофтан. Кроме того, могут быть использованы или добавлены такие материалы, как сополимер ацетилатов/октилакриламида (продаваемый под названием дермпкрил® 79), сополимер аминометакрилата (ЭУДРАГИТ®), диметиламиноэтилметакрилат, метакрилат, метилметакрилат (например, ЭУДРАГИТ ®E 100) и другие акрилаты. Также могут быть добавлены пластификаторы, такие как упомянутые в настоящем изобретении выше (например, трибутилцитрат).
Слой подложки, если он присутствует, как правило, имеет толщину того же порядка, что и композиция. Слой подложки, если он присутствует, как правило, составляет приблизительно 30-60 масс./масс.% композиции.
Композиция может быть подвергнута термической обработке для того, чтобы расплавить вещество, содержащееся в слое подложки. Эффект этого состоит в получении более сжатой структуры слоя подложки для избегания проникновения воды (или слюны или другой соответствующей жидкости организма) в композицию, и, таким образом, избегания риска слишком быстрого высвобождения лекарственного вещества, или избегания риска нежелательного отделения слоя подложки от слоя, содержащего лекарство. Используемая температура должна балансировать между получением плавления вещества в слое подложки и избеганием нежелательной деградации лекарственного вещества. Поли(капролактон) плавится при температуре приблизительно 65°С.
Композиция по настоящему изобретению может быть снабжена слоем покрытия. Этот слой не является частью композиции и представляет собой инертный слой, который должен быть удален перед нанесением на кожу или слизистую оболочку. Слой защитного покрытия служит только практической цели, поскольку трудно обрабатывать и упаковать лист электроспряденных волокон без защиты композиции от окружающей среды. Таким образом, если композиция содержит только один слой, т.е. слой электроспряденных волокон, содержащих лекарственное средство, он может быть снабжен слоем защитного покрытия на обеих двух наружных поверхностях слоя.
Электроспряденные волокна и/или композиции, включающие волокна, могут также содержать один или более фармацевтически приемлемых наполнителей, некоторые из которых уже раскрыты в настоящем документе, и они могут также добавляться к композициям по изобретению, так чтобы они были частью композиции, но не содержались внутри электроспряденных волокон.
Такие наполнители (которые также могут быть использованы при получении электроспряденных волокон) включают агенты, маскирующие вкус, такие как ароматизаторы или подслащивающие агенты; регулирующие рН агенты, такие как забуферивающие вещества, такие как цитраты, ацетат или фосфат; модификаторы высвобождения; порообразователь, стабилизирующие агенты; антиокислители; пигменты; агенты кондиционирования кожи, включая мочевину, глицерин и т.д., агенты, снижающие раздражение, такие как глицерин, ментол, эвкалиптол или никотинамид; антинуклеирущие агенты, такие как глицерин; агенты, усиливающие проникновение, такие как азон, N-метилпирролидон, пропиленгликоль и т.д.
Высвобождение лекарственного вещества из композиции может быть немедленным или модифицированным в зависимости от используемого и предположительно используемого заданного лекарственного вещества. Скорость высвобождения можно регулировать, как описано в настоящем документе выше, под заголовком «Электроспряденные волокна», и/или она может быть отрегулирована путем использования заданных фармацевтически приемлемых наполнителей.
Более быстрое высвобождение может быть получено путем использования усилителя проникновения и/или путем включения пластификатора.
Композиция по настоящему изобретению, пригодная для использования на коже или слизистой оболочке, как правило, состоит из
i) приблизительно 75-100 масс./масс.% электроспряденных волокон, содержащих лекарственное средство,
ii) приблизительно 0-25 масс./масс.% одного или более фармацевтически приемлемых наполнителей (как описано в настоящем документе).
Композиция по настоящему изобретению, пригодная для использования на коже или слизистой оболочке, как правило, состоит из
i) приблизительно 50-70 масс./масс.% электроспряденных волокон, содержащих лекарственное средство
ii) приблизительно 0-10 масс./масс.% одного или более фармацевтически приемлемых наполнителей (как описано в настоящем документе), и
iii) от приблизительно 30 до 50 масс./масс.% защитного слоя.
Способ получения волокон в соответствии с изобретением
Настоящее изобретение также относится к способам получения электроспряденных волокон.
Первый способ включает
i) растворение гидрофильного полимера в первом растворителе,
ii) суспендирование биоадгезивного вещества в полученном растворе со стадии i)
iii) необязательное добавление лекарственного вещества к полученной дисперсии со стадии ii),
iv) электропрядение смеси, полученной на стадии ii) или iii),
где указанный гидрофильный полимер растворим в указанном первом растворителе, и указанное биоадгезивное вещество растворимо слегка или менее в указанном первом растворителе,
для получения электроспряденных волокон, где, по меньшей мере, 90 масс./масс.% биоадгезивного вещества присутствует в нерастворенной форме.
Альтернативный способ получения электроспряденных волокон в соответствии с настоящим изобретением включает стадии
i) растворения гидрофильного полимера в первом растворителе с получением первого раствора,
ii) необязательного растворения или суспендирования лекарственного вещества в указанном первом растворе с получением первой смеси,
iii) суспендирования биоадгезивного вещества в первом растворителе с получением второй дисперсии,
iv) двойного электропрядения первого раствора (или первой смеси, если включено лекарственное вещество) и второй дисперсии,
где указанный гидрофильный полимер растворим в указанном первом растворителе, и указанное биоадгезивное вещество малорастворимо в указанном первом растворителе,
для получения электроспряденных волокон, где, по меньшей мере, 90 масс./масс.% биоадгезивного вещества присутствует в нерастворенной форме.
Как было упомянуто выше, подходящий растворитель представляет собой один или более летучих растворителей, в частности C1-C3-алканол, такой как этанол или смеси этанол-вода. Вода может присутствовать в количестве до приблизительно 20 об./об.%, в частности, от приблизительно 3 до приблизительно 10 об./об.%. В тех случаях, когда волокнообразующий гидрофильный полимер и биоадгезивное вещество вращают с помощью двойного электропрядения, т.е. с помощью двух отдельных шприцев, воду можно использовать в концентрации вплоть до приблизительно 60 об./об.%, в частности, вплоть до приблизительно 50 об./об.% или вплоть до приблизительно 40 об./об.%. В таких случаях растворитель для волокнообразующего гидрофильного полимера и биоадгезивного вещества не является одинаковым, так как растворитель, используемый для биоадгезивного вещества, должен представлять собой растворитель, в котором биоадгезивное вещество растворимо лишь слабо или менее чем малорастворимо. Подходящий растворитель, в котором биоадгезивное вещество нерастворимо, представляет собой в частности этанол или смеси этанол-вода с содержанием воды приблизительно до 20 об./об.%, в частности от приблизительно 3 до приблизительно 10 об./об.%.
Концентрация волокнообразующего гидрофильного полимера в первом растворителе, как правило, находится в диапазоне от приблизительно 2 до приблизительно 40 масс./масс.%, в частности, от приблизительно 3 до приблизительно 30 масс./масс.%.
Концентрация биоадгезивного вещества в первом растворителе или во второй дисперсии, как правило, составляет от приблизительно 1 до приблизительно 20 масс./масс.%, в частности, от приблизительно 1 до приблизительно 15 масс./масс.%.
Способы, упомянутые выше, могут включать конечную стадию покрытия наружной поверхности волокон гидрофобным полимером.
Покрытие может быть в форме напыления, отливки пленки, электропрядения и т.д.
После покрытия покрытые волокна могут быть подвергнуты нагреванию для плавления или размягчения гидрофобного полимера с целью получения более компактной структуры гидрофобного полимера.
Настоящее изобретение также относится к набору, как описано в формуле изобретения. Использование в медицине. Электроспряденные волокна, содержащие лекарственное средство, и композиции, содержащие электроспряденные волокна, содержащие лекарственное средство, пригодны для использования в медицине.
Как было упомянуто выше, электроспряденные волокна и композиции, содержащие лекарственное средство, в первую очередь предназначены для местного нанесения на место поражения на коже или на слизистой оболочке. Тем не менее, предполагается, что специалист в данной области техники и на основании данного раскрытия должен иметь возможность использовать концепцию настоящего изобретения для получения композиций, которые создают возможность доставки в системный кровоток после нанесения на кожу или слизистую оболочку, или композиций, которые создают возможность доставки лекарственного вещества в полость тела, такую, как полость рта. Тем не менее, целью настоящего изобретения является предоставление электроспряденных волокон и композиций, которые остаются на пораженной ткани, для получения местного эффекта.
Лекарственные вещества, подходящие для использования в связи с настоящим изобретением, могут представлять собой лекарственные вещества, которые представляют собой небольшие молекулы, или они могут представлять собой пептиды, белки, биологические агенты, включая моно- или поликлональные антитела.
Кожные заболевания
Примерами кожных заболеваний являются актинический кератоз, типы рака кожи (базальноклеточная карцинома, болезнь Боуэна, плоскоклеточная карцинома и злокачественные меланомы), генитальные бородавки, угри, дерматит, псориаз, красные угри, ихтиоз, экзема, атопический дерматит, зуд, pustolis palmophantatis, боль, инфекции, вирусные заболевания, такие как герпес.
В настоящее время некоторые из этих кожных заболеваний (актинический кератоз, типы рака кожи (базальноклеточная карцинома, болезнь Боуэна, плоскоклеточный рак и злокачественные меланомы), генитальные бородавки) можно лечить с помощью имиквимода, который представляет собой прописываемое лекарство, действующее в качестве модификатора иммунного ответа. Как предполагается, его также можно использовать при лечении внутриэпителиальной карциномы вульвы, внутриэпителиальной неоплазии влагалища и обычных бородавок. Однако наблюдаются некоторые побочные эффекты лечения, такие как буллезное поражение, кровавый сухой струп, боль и общий дискомфорт. Кроме того, многие больные не могут переносить лечение.
Другим вариантом лечения актинического кератоза является ингенол.
Гель, содержащий ингенол мебутат, в настоящее время продается на рынке в двух различных концентрациях либо для лица и волосистой части головы (0,015%), либо для туловища и конечностей (0,05%), соответственно. Клинические исследования показали, что гель ингенола мебутата, наносимый местно в течение от 2 до 3 дней, является эффективным для лечения области актинического кератоза.
Ингенол мебутат продается под названием Picato®. Вещество представляет собой сложный эфир дитерпенингенола и ангеликовой кислоты. Ингенол мебутат практически не всасывается через кожу.
Однако применение геля очень часто приводит к раздражению в месте нанесения. Оно включает покраснение, шелушение, образование корки, боль и иногда инфекции. Другие побочные эффекты включают раздражение глаз, такое как периорбитальный отек, головную боль и воспаление носоглотки.
В связи с обычным побочным эффектом в виде раздражения в месте нанесения существует потребность в разработке композиции, содержащей ингенол мебутат или другое производное ингенола, которая при нанесении на кожу вызывает меньше раздражения, чем известный состав. Кроме того, композиция по настоящему изобретению, содержащая, например, ингенол мебутат или имиквимод, и находящаяся в форме листа с четко определенной площадью (т.е. она содержит желаемую дозу лекарственного вещества), может иметь улучшенные долгосрочные перспективы и уменьшенные рецидивы из-за корректного дозирования при каждом нанесении.
Композиция, пригодная для местного использования, обычно включает электроспряденные волокна, где волокна основываются на PVP и дополнительно содержат волокнообразующий агент, пластификатор, агент против раздражения и лекарственное вещество. Когда имиквимод является лекарственным веществом, он может присутствовать в волокнах в виде дисперсии или раствора, когда, например, в качестве растворителя используют олеиновую кислоту. Типичным примером гидрофильного волокнообразующего агента является акрилат (например, как описано в настоящем документе) или PVP. Пластификатор может представлять собой трибутилцитрат, и агент против раздражения может представлять собой глицерин.
Другие лекарственные вещества, используемые при лечении кожных заболеваний и пригодные для использования в соответствии с настоящим изобретением, представляют собой производные или аналоги витамина D, кортикостероиды, ингибиторы фосфодиэстеразы 4, производные ингенола, ретинол, такой как адаплен, ингибиторы JAK, антагонисты рецептора NK-1, ингибиторы кальциневрина, такие как такролимус или пикролимус, кератолитические агенты, такие как салициловая кислота или молочная кислота, антибиотики, такие как фузидовая кислота, бактобан или клиндамицин, нестероидные противовоспалительные агенты, такие как диклофенак, напроксен, ибупрофен, кетопрофен, противоопухолевые агенты, такие как 5-фторурацил, местные анестетики, такие как лидокаин, прилокаин и т.д.
Заболевания слизистой оболочки, в частности, губ и полости рта
Заболевания полости рта, которые можно лечить с помощью электроспряденных волокон или композиций согласно изобретению, включают:
Воспалительные заболевания, такие как плоский лишай полости рта и язвы полости рта. Такие заболевания, как правило, лечат кортикостероидами. Кортикостероид может быть выбран из группы, состоящей из амцинонида, бетаметазона, буденозида, клобетазола, клобетазона, кортизона, дезонида, дезоксикортизона, дезоксиметазона, дексаметазона, дифлукортолона, дифлоразона, флукортизона, флуметазона, флунизолида, флуцинонида, флуцинолона, флурометолона, флупреднизолона, флуандренолида, флутиказона, галцинонида, галобетазола, гидрокортизона, мепреднизона, метилпреднизона, мометазона, параметазона, предникарбата, преднизона, преднизолона и триамцинолона или их фармацевтически приемлемых эфиров или ацетонидов. Кортикостероид предпочтительно может быть выбран из бетаметазона, буденозида, клобетазола, клобетазона, дезоксиметазона, дифлукортолона, дифлоразона, флуоцинонида, флуцинолона, галцинонида, галобетазола, гидрокортизона, мометазона и триамцинолона или их фармацевтически приемлемых сложных эфиров. Сложный эфир кортикостероидов может представлять собой, например, бетаметазона ацетат, бетаметазона дипропионат, бетаметазона валерат, элобетазола пропионат, дексаметазона ацетат, флуметазона пивалат, флутиказона пропионат, гидрокортизона ацетат, гидрокортизона бутират или мометазона фуроат. Ацетонид может быть выбран из флуцинолона ацетонида или триамцинолона ацетонида. Кортикостероид предпочтительно представляет собой бетаметазона дипропионат или бетаметазона валерат.
Состояния боли (лечение с помощью анальгетиков, таких как НПВС - ибупрофен, кетопрофен, диклофенак и т.д.).
Грибковые заболевания (лечение с помощью метронидазола, кетоконазола и т.д.).
Вирусные заболевания, такие как простой герпес (лечение с помощью ацикловира).
Различные состояния дисплазии (лечение с помощью 5-фторурацила, диклофенака, ретиноидов, ингенола мебутата).
Ниже приведено более конкретное описание клинического применения для лечения заболеваний полости рта.
Использование в качестве простых перевязочных средств (с включением лекарств или без них)
(a) Язвы полости рта
Слизистая оболочка полости рта часто травмируется во время жевания и в результате термической, химической и физической травмы. Это обычно приводит к образованию изъязвления слизистой оболочки полости рта. Область изъязвления является болезненной, очень чувствительной к прикосновению, горячим блюдам и напиткам, алкоголю и сильным или пряным специям. Это может быть очень неудобно и затрудняет прием пищи, напитков и речь. Кроме того, приблизительно 25% населения испытывает возвращающиеся эпизоды изъязвления полости рта (известные как афтозное изъязвление) в определенные периоды своей жизни. Они страдают от одной или нескольких язв ротовой полости сразу, которые развиваются спонтанно, длятся от нескольких дней до нескольких недель, а затем заживают сами по себе. Эти множественные язвы часто возвращаются.
Как и в случае раны на коже, существует естественная потребность прикрыть такие раны в ротовой полости. К сожалению, для полости рта еще не существует эквивалента лейкопластыря. Тонкие и гибкие электроспряденные композиции, которые прилипают к слизистой оболочке полости рта и обеспечивают степень защиты раны от острой пищи, сильных ароматизаторов и т.д., поступающих через рот, а также обеспечивают степень защиты от бактериального загрязнения и физической травмы, должны ускорять заживление ран и обеспечивать облегчение от неудобств, связанных с язвами полости рта. В идеале эти композиции должны всасываться медленно в течение нескольких дней, так что их удаление не является необходимым. Заживление защищенных ран в полости рта, как правило, происходит очень быстро.
В некоторых случаях уместно использовать электроспряденные волокна без какого-либо содержания лекарственного вещества и, таким образом, настоящее изобретение также относится к таким электроспряденным волокнам (как подробно описано в настоящем документе, но без какого-либо содержания лекарственного вещества), к композициям, включающим электроспряденные волокна, и к применению этих волокон и композиций в медицине, т.е. не только к применению, упомянутому выше.
(b) Перевязка ран после операции
Хирургические процедуры в полости рта, особенно процедуры по удалению зубов являются наиболее обычной формой по сравнению с другими формами хирургического вмешательства. В настоящее время после простого удаления зуба открытый карман остается незащищенным от образования сгустка крови и заживает сам по себе. К счастью заживление в полости рта является очень эффективным, тем не менее, кровотечение после удаления зуба является обычным явлением - часто из-за отделения сгустка крови, инфицирования кармана зуба - что приводит к задержке заживления раны или к очень болезненному состоянию «сухой лунки», что также является обычным явлением. Больным также не нравится ощущение открытого кармана во рту и связанный с ним привкус крови. Покрытие кармана после удаления зуба композицией адгезивных электроспряденных волокон, например, в виде повязки, должно помочь сохранить формирующийся сгусток крови на месте и таким образом уменьшить кровотечение после удаления зуба и улучшить заживление раны. Это должно также снизить инфицирование и попадание остатков пищи в карман, снова облегчая заживление раны и снижая инфицирование раны. Кроме того, физическое покрытие открытого кармана обеспечивает комфорт и уверенность больного. Для таких композиций требуется хорошая адгезия, необходимость наличия высокой прочности, низкой проницаемости и в идеале сохранение на месте в течение первых 24 часов во время стабилизации образования сгустка крови.
Кроме удаления зубов многие другие хирургические процедуры выполняются в полости рта, включая биопсию, хирургию десен, хирургическое удаление зубов, имплантационную хирургию, ортодонтическую хирургию и т.д. Все они оставляют открытые раны или участки наложения швов, где подходящая перевязка ран будет способствовать снижению раневой инфекции и вторичного кровотечения, а также обеспечивать физическую защиту и комфорт для больного.
(c) Активное перевязывание ран
Хотя одна физическая защита будет создавать значительное преимущество, включение лекарственных средств и других активных агентов в некоторые раневые повязки должно иметь особую ценность в заданных ситуациях:
(i) Антисептик. Поскольку вторичная инфекция является общей проблемой для ран полости рта, включение и медленное высвобождение хорошо переносимого антисептического агента, такого как хлоргексидина глюконат или цетилпиридиния хлорид (используемых в антисептических ополаскивателях) может иметь значение в ситуации, когда вторичная инфекция является особой проблемой.
(ii) Анальгетик. Большинство язв полости рта связано с болью и воспалением, поэтому включение и медленное высвобождение признанного местного обезболивающего/противовоспалительного агента, такого как бензидамина гидрохлорид, может обеспечить облегчение боли и оказать успокаивающее действие, а также обеспечить физическое покрытие.
(iii) Гемостатик. Кровотечение после удаления зубов является общей проблемой, касающейся стоматологов и больных. Когда кровотечение трудно контролировать с помощью простых мер, таких как прямое давление. В таких ситуациях стоматологи и челюстно-лицевые хирурги часто используют транексамовую кислоту - которая ингибирует фибринолиз. Однако, так как она поставляется в форме таблеток, ее трудно наносить местно на карман зуба и поэтому ее основной эффект носит системный характер. Высвобождение транексамовой кислоты из композиции, покрывающей карман, например, в форме листа или пластыря должно физически предотвратить/уменьшить кровотечение, а также местно предотвратить фибринолиз в кармане, в то же время, сводя к минимуму вероятность любого системного эффекта. Композиция должна усиливать местный эффект транексамовой кислоты, предотвращая ее потери из кармана.
Актинический кератоз и лейкоплакия полости рта
Актинический кератоз (солнечный кератоз) представляет собой индуцированное УФ-излучением предраковое поражение губ, которое характеризуется значительным риском развития рака губы. Такие поражения часто удаляют хирургическим путем или лечат с помощью криотерапии, но в последнее время нанесение кремов имиквимода (Aldara), диклофенака (Solaraze) и фторурацила (Efudix), как показано, имеет преимущества при лечении некоторых случаев актинического кератоза. Однако необходимы методы удержания, локализации и медленного высвобождения активных агентов, которые являются более удачными, чем достигаемые с помощью кремов. Таким образом, представляет интерес включение этих лекарств в электроспряденные композиции, которые могут покрыть область актинического кератоза и медленно высвобождать активный агент для улучшения лечения.
Лейкоплакия ротовой полости является потенциально злокачественным поражением слизистой оболочки полости рта, которое характеризуется значительным риском превращения в рак полости рта. Лейкоплакии полости рта являются более распространенными, чем актинический кератоз, и встречаются чаще у курильщиков. Их потенциал злокачественного перерождения обычно оценивается путем взятия биопсии поражения. Гистопатолог затем дает бальную оценку степени дисплазии в поражении. Эти поражения, проявляющие умеренную или тяжелую дисплазию, рассматриваются как имеющие высокий риск прогрессии до рака. Современное лечение повреждений полости рта в виде дисплазии включает снижение риска, например, прекращение курения, и, если поражение характеризуется высоким риском, затем хирургическое иссечение. Так как лейкоплакии полости рта могут быть обширными и находиться в труднодоступных областях полости рта, хирургическое лечение может быть затруднено и может являться калечащим и неприятным для больного, часто оставляя остаточные осложнения. Кроме того, хирургическое удаление не может уменьшить риск развития рака полости рта. Были сделаны попытки использовать кремы имиквимода (Aldara), диклофенака (Solaraze) и фторурацила (Efudix) для лечения лейкоплакий полости рта. Тем не менее, наличие слюны делает нанесение и сохранение кремов затруднительным, и большой размер многих лейкоплакий полости рта и риск проглатывания лекарственного соединения создает трудности, а также значительно повышает риск развития системных побочных эффектов лекарств. Местная доставка с замедленным высвобождением с помощью биоадгезивной электроспряденной композиции по настоящему изобретению непосредственно на пораженное место должна решить многие из этих проблем, особенно, если композиция имеет непроницаемую подложку для обеспечения уверенности в однонаправленной доставке лекарства на место поражения, а не в ротовую полость, где оно может быть проглочено.
«Герпес»
От 40% до 70% населения (в зависимости от географического региона и социально-экономической группы) являются латентно инфицированными вирусом простого герпеса типа 1. Из них 20-40% испытывают периоды реактивации вируса, который наиболее часто обозначается как герпес. У многих индивидуумов герпес является обычной и возвращающейся проблемой. Чаще всего он присутствует в виде обилия везикул (маленьких волдырей) на стыке губ и окружающей кожи. Они затем разрываются с образованием мелких язв с экссудацией жидкости, и затем покрываются коркой до спонтанного заживления в течение от 7 до 10 дней. Они вызывают значительную боль, дискомфорт и смущение. Если лечить местными антивирусными агентами, такими как крем ацикловира (зовиракс) или пенцикловира (вектавир) на самых ранних стадиях развития поражения, продолжительность и тяжесть эпизодов может быть уменьшена. Однако крем необходимо наносить очень часто (5 раз в день и каждые 2 часа, соответственно), чтобы он был эффективным, и он ничем не может обеспечить покрытие для предотвращения вторичной инфекции или скрыть наличие повреждений. Небольшие электроспряденные адгезивные композиции для кожи, доставляющие ацикловир или сходный противовирусный агент с медленным высвобождением, должны быть более эффективными и должны также обеспечивать покрытие для скрывания повреждения и предотвращения вторичной инфекции.
Менее часто герпетические высыпания образуют небольшие, локализованные массы волдырей и язв на выстилке слизистой оболочки полости рта, чаще на верхней стенке рта. Опять же это очень болезненно, но гораздо более трудно для нанесения противовирусного крема. При наличии подходящего состава в соответствии с настоящим изобретением композиция по настоящему изобретению может использоваться для лечения герпеса на губах и также может использоваться для лечения поражений в полости рта.
Лечение иммунологически опосредованного заболевания слизистой оболочки полости рта
Существует несколько обычных иммунологически опосредованных заболеваний слизистой оболочки полости рта, которые приводят к обширным участкам эрозии (истончения) и изъязвления слизистой оболочки полости рта. Где бы ни было истончение или изъязвление слизистой оболочки полости рта, оно болезненно, очень чувствительно к прикосновению, горячей пище и напиткам, алкоголю и сильным или пряным специям. Это может быть очень неудобно и делает еду, питье и речь затруднительными. Как обсуждалось ранее, простое покрытие таких областей может обеспечить значительное облегчение. Однако эти состояния являются либо рецидивирующими - так что возникает рецидивирующий афтозный стоматит, либо хроническими. Таким образом, подавление лежащего в основе процесса заболевания имеет важное значение, если улучшение поражения должно происходить с длительным улучшением для больного.
Многие из этих состояний восприимчивы к иммуномодуляторным лекарствам, таким как стероиды, циклоспорин и микофенелата мофетил. Как правило, стероиды являются первой линией терапии, но они практически не составляются в виде лекарства с местной доставкой к поражениям полости рта, особенно в виде кремов и мазей, которые не будут прилипать к слизистой оболочке полости рта и поэтому легко проглатываются и практически не обладают необходимой продолжительностью действия. В результате таблетки стероидов (преднизолона и бетаметазона валерата) растворяют в воде с получением жидкости для полоскания рта или ингаляционные стероиды направляют на пораженные участки слизистой оболочки полости рта. Тем не менее, время контакта лекарственных веществ, доставляемых таким образом к пораженным участкам полости рта, является очень коротким, так что для компенсации этого эффекта требуются высокие дозы, высокоактивные стероиды и частое нанесение. В свою очередь это увеличивает риск побочных эффектов, как в полости рта, так и системных. Действительно для более тяжелых и трудно поддающихся лечению поражений часто необходимо прибегать к использованию системных стероидов для лечения местного заболевания. Даже в таком случае у многих больных участок устойчив к лечению, и часто необходимо обратиться к более сильнодействующим или стероидсберегающим альтернативным иммуномодулирующим лекарствам, таким как азатиоприн, циклоспорин и микофенилата мофетил. Опять же нет никаких местных препаратов для перорального приема этих лекарств, так что часто их необходимо использовать системно.
Поскольку поражения ротовой полости являются поверхностными и легкодоступными для современных биологических агентов, таких как антитела и ингибиторы киназ, которые часто необходимо давать парентерально (путем инъекции), можно наносить их непосредственно на место поражения и наблюдать эффект, если они доступны в подходящей системе доставки.
Таким образом, электроспряденные биоадгезивные композиции в соответствии с настоящим изобретением, обеспечивающие однонаправленную доставку лекарственного средства в место повреждения, должны обеспечивать столь необходимое и эффективное лечение широкого спектра заболеваний слизистой оболочки полости рта. С точки зрения наиболее широко применяемого лекарства для включения в лист стероидный препарат будет наилучшей отправной точкой. Гидрокортизон имеет преимущество из-за отсутствия значительного всасывания в кишечнике. В общем случае у него слишком низкая активность, чтобы быть эффективным для заболеваний слизистых оболочек полости рта, но с более длительным временем удерживания и медленным высвобождением он вполне может оказаться эффективным при доставке из однонаправленного пластыря. Однако широко используются более сильные стероидные препараты, включая триамцинолон ацетонид - который характеризуется доказанными успехами в качестве местно доставляемого стероида со средней активностью (обычно используемый как триамцинолон, продаваемый OROBASE® для местной доставки к поражениям полости рта - но он больше недоступен). В противном случае бетаметазон или флуоцинолон имеют повышенную активность и широко используются для лечения заболеваний слизистой оболочки полости рта в настоящее время. В то время как стероиды и другие иммуномодуляторные лекарства подавляют лежащий в основе процесс заболевания, они не эффективны при обеспечении немедленного симптоматического облегчения боли. Следовательно, мембрана для доставки, сочетающая в себе наличие стероида и местного анальгетического/противовоспалительного лекарства (бензидамина гидрохлорида), может иметь особое значение.
Конкретные заболевания слизистой оболочки полости рта, подходящие для лечения композицией в соответствии с настоящим изобретением, включают:
(i) Рецидивирующий афтозный стоматит - как описано ранее
(ii) Плоский лишай полости рта (OLP) - Это заболевание поражает 1,5-2% населения. В отличие от кожной формы плоского лишая, плоский лишай полости рта, однажды возникнув, существует в течение многих лет, вызывает гораздо более болезненные поражения, и гораздо более устойчив к лечению. У больных наблюдается широкое распространение эрозий и язв, которые в основном поражают слизистую оболочку щек (внутри щек), боковые стороны языка и десны, что часто болезненно и чрезвычайно чувствительно к пище и т.д.
(iii) Пемфигоид - это поражение в виде группы волдырей, которые могут поражать кожу и слизистые оболочки. Оно вызывается аутоантителами, повреждающими контакты между эпителием и подлежащей соединительной тканью, так что эпителий отщепляется от подлежащей ткани. Слизистая оболочка полости рта поражается постоянно с возникновением больших волдырей, которые прорываются с образованием обширных областей изъязвлений полости рта. Широко затрагиваются десны, но язвы могут также развиваться на крыше языка внутри щек. Он несколько менее обычен, чем OLP.
(iv) Пузырчатка - это другое поражение в виде волдырей, которое поражает кожу и слизистые оболочки. Оно немного отличается от пемфигоида тем, что аутоантитела повреждают контакты, которые связывают эпителиальные клетки друг с другом. Опять слизистая оболочка полости рта поражается постоянно. Несмотря на то, что оно немного реже, чем пемфигоид, оно, как правило, является более тяжелым и трудно поддается лечению, часто создает необходимость использования системных стероидов и иммуномодулирующих лекарств. Однако использование электроспряденных, адгезивных для слизистой оболочки мембран, которые однонаправленно доставляют активные стероиды с замедленным высвобождением, должно, очевидно, исключить необходимость доставки этих лекарств системно.
Доставка местных анестетиков
Местные анестетики широко применяются, например, в стоматологии. Для того чтобы доставить достаточное количество местного анестетика для удаления зуба, обычно необходимо дать его с помощью инъекции, вызывающей блокаду нервов, или местной инфильтрационной инъекции. Поскольку сама инъекция болезненна, нередко сначала на слизистую оболочку полости рта в предполагаемом месте инъекции наносят локально гель местного анестетика. Это часто делается для детей и обеспокоенных больных. К сожалению, гель часто создает плохой контакт со слизистой оболочкой, так что проникновение местного анестетика является плохим и большая часть геля рассасывается во рту. Это вызывает неприятное онемение вокруг рта, а также он имеет очень горький и неприятный вкус. В результате процедура часто имеет ограниченный эффект. Местная доставка локального анестетика с помощью однонаправленной, биоадгезивной композиции электроспряденных волокон (например, с помощью пластыря для доставки лекарственного средства) должна привести к лучшей локализации и проникновению местного анестетика, и, таким образом, к более высокой эффективности, а также к ограничению побочных эффектов в виде широкого распространения онемения и плохого вкуса. Композиция будет нуждаться только в коротком времени прикрепления или, если она стерильна, она может оставаться на месте, а инъекция может осуществляться через композицию.
Эффективная, биоадгезивная композиция местного анестетика, например, в виде пластыря для доставки лекарственного средства, потенциально может обеспечить достаточное обезболивание для многих видов общепринятой стоматологии верхних зубов - где обычно дается инфильтрационная местная анестезия или где процедуры являются относительно незначительными.
Местный анестетик также широко используется во рту для хирургии мягких тканей, включая хирургию десен, биопсии и т.д. Опять в таких ситуациях обычно дается инфильтрационная анестезия, и вполне вероятно, что в таких ситуациях может быть получена эффективная местная анестезия, так как не требуется проникновения местного анестезирующего агента в кость, просто путем использования однонаправленной, биоадгезивной электроспряденной композиции местного анестетика.
Наиболее очевидным местным анестетиком для использования в этой ситуации является лигнокаина (лидокаина) гидрохлорид, хотя артикаин должен быть возможной альтернативой. Включение адреналина, как это происходит во многих местных анестезирующих растворах для инъекций, может быть выгодным в плане индукции местной вазоконстрикции и тем самым повышения и продления действия местного анестетика.
Лечение воспаления слизистой оболочки полости рта
Лучевая терапия и химиотерапия рака связана с серьезными побочными эффектами. Одним из худших из них является возникающее воспаление слизистой оболочки полости рта. Это приводит к обширному отслоению и изъязвлению слизистой оболочки полости рта. Возникающие в результате боль и дискомфорт часто делают прием пищи и напитков невозможным и требуют применения наркотических анальгетиков. Часто от лечения рака приходится отказаться или его сократить из-за тяжести и страданий, причиняемых воспалением слизистой оболочки полости рта. В настоящее время не существует эффективных профилактических или лечебных мероприятий. Однако использование биоадгезивных раневых повязок в соответствии с настоящим изобретением, как было описано выше, должно быть полезным само по себе, но включение местного обезболивающего, например, бензидамина гидрохлорида, может быть еще более эффективным в плане облегчения боли. Ополаскиватели полости рта с бензидамином гидрохлоридом действительно обеспечивают симптоматическое облегчение, но их эффект продолжается очень недолго. Его можно было бы продлить и усилить с помощью композиции согласно изобретению, которая обеспечивает однонаправленную доставку к пораженной слизистой оболочке лекарства из композиции, например, в виде пластыря для доставки лекарственного средства.
Кроме того, недавние исследования показали, что применение ополаскивателя полости рта с адреналином до начала сеансов радио- или химиотерапевтического лечения может помочь предотвратить воспаление слизистой оболочки полости рта. Это, очевидно, возникает потому, что индуцируемая адреналином вазоконстрикция в субэпителиальных кровеносных сосудах уменьшает токсические побочные эффекты лечения на слизистую оболочку полости рта. К сожалению, короткое время контакта со слизистой оболочкой, которое возникает при доставке ополаскивателя полости рта, и неизбирательное применение ко всем местам слизистой оболочки означает, что доставка лекарственного средства является неэффективной, и системные побочные эффекты адреналина более вероятны. Более прямое, продолжительное и замедленное высвобождение адреналина в восприимчивые места слизистой оболочки полости рта с использованием композиции в соответствии с настоящим изобретением, например, с помощью однонаправленного, биоадгезивного пластыря с электроспряденными волокнами для доставки лекарственного средства или мембранной системы доставки будет гораздо более эффективным и действенным.
Доставка лекарств в полость рта
Вместо использования электроспряденных композиций (например, в виде мембран или пластырей) в качестве перевязочного материала для однонаправленной доставки лекарственных средств в слизистую оболочку полости рта, к которой они прикрепляются, можно также создать композицию, которая прилипает к слизистой оболочке полости рта, но доставляет лекарства в полость рта. Это может быть использовано для лечения более широко распространенных проблем полости рта, например, кандидоза полости рта, или для замедленной доставки лекарства к горлу, пищеводу и верхним отделам желудочно-кишечного тракта.
Основным преимуществом таких систем является способность композиции (например, в виде мембраны или пластыря) действовать в качестве резервуара с лекарственным средством и медленно, но непрерывно высвобождать лекарственное средство в ротовую полость.
(i) Кандидоз полости рта. Он представляет собой обычную грибковую инфекцию полости рта. Он особенно обычен у тех, кто носит зубные протезы, тех, кто курит или потребляет много сахара, тех, кто страдает диабетом или иммунодефицитом, и тех, кто принимает антибиотики или получает лечение иммунодепрессантами, включая стероиды. Есть несколько противогрибковых лекарств, которые должны быть эффективными и безопасными для лечения грибковых инфекций полости рта (хотя некоторые из них больше не доступны в качестве пероральных препаратов). Однако все они требуют частого нанесения, так как они быстро исчезают из ротовой полости из-за глотания. Главное преимущество композиции в соответствии с настоящим изобретением (например, в виде мембраны или системы доставки с помощь пластыря) должно заключаться в возможности обеспечения медленного и непрерывного высвобождения лекарственного средства в ротовую полость. Лекарственные средства, очевидно, могут быть наиболее эффективными и безопасными, будет ли это нистатин и амфотерицин. Хотя азольные противогрибковые препараты очень эффективны, риск системного всасывания и возможность взаимодействия с другими лекарственными средствами означает, что они, вероятно, имеют худший профиль безопасности.
(ii) Лекарственные средства могут также доставляться к горлу, например, антисептики, анальгетики и местные анестетики для лечения ангин, простудных заболеваний и т.д., или к пищеводу и желудку, например, антациды, ингибиторы протонной помпы и т.д., или даже системно через ЖК тракт. Основным преимуществом является возможность медленной и непрерывной доставки лекарственного средства.
Системная доставка лекарственных средств через слизистую оболочку полости рта
Хотя электроспряденные волокна и композиции в соответствии с изобретением в первую очередь предназначены для местного лечения кожи или слизистой оболочки, предполагается, что электроспряденные волокна или композиции, полученные в соответствии с настоящим изобретением, но включающие лекарственное вещество, которое предназначено для доставки в системную циркуляцию, могут быть пригодны не только для нанесения на слизистую оболочку полости рта, но и для системного введения через слизистую оболочку полости рта.
Слизистая оболочка полости рта легкодоступна, более проницаема, чем кожа, и лучше снабжается кровеносными сосудами. Она также обладает тем преимуществом, что лекарственные средства, доставляемые через слизистую оболочку полости рта и в кровоток, избегают проблемы метаболизма при первичном поступлении в печень. Это означает, что лекарства, которые нуждаются в быстром введении, включая некоторые лекарства экстренной терапии и некоторые лекарства, которые в противном случае необходимо доставлять путем инъекции или которые будут инактивироваться в печени, могут быть более эффективно введены через слизистую оболочку полости рта. Адгезивные композиции электроспряденных волокон для доставки лекарственных средств, которые однонаправленно доставляют такие лекарства через слизистую оболочку полости рта, могут быть очень эффективными. Они могут быть использованы для доставки лекарств экстренной терапии больным в бессознательном состоянии или когда инъекции невозможны, например, когда не доступен персонал, обученный соответствующим образом.
(i) Введение лекарственного средства экстренной терапии: Лекарственные средства, обычно доставляемые через слизистую оболочку полости рта, включают:
a. Нитроглицерин - Он обычно дается в форме сублингвального (подъязычного) спрея или быстро растворимой таблетки для лечения приступов стенокардии (боли в груди). Однако скорость его доставки такова, что он часто вызывает очень сильную головную боль из-за слишком быстрой дилатации мозговых кровеносных сосудов, а также кровеносных сосудов сердца и, может возникнуть необходимость повторного введения несколько раз. Трансмукозная доставка нитроглицерина более контролируемым образом из биоадгезивной композиции, например, в виде мембраны или пластыря, сможет создать более сглаживающую дозировку и с более длительным сроком действия и избежать таких проблем.
b. Аспирин - часто доставляется через слизистую оболочку полости рта при сердечном приступе и у больных, перенесших инсульт, особенно, когда они в бессознательном состоянии, для уменьшения тромбоза и снижения ухудшения состояния. Как правило, это достигается за счет размещения растворимой таблетки аспирина в щечной борозде (между деснами и с внутренней стороны щеки) и возможности ее растворения. Однако много лекарства теряется в ротовой полости, вместо того, чтобы точно доставляться через слизистую оболочку полости рта. Опять же более контролируемая, более направленная трансмукозная доставка и с большей продолжительностью может быть достигнута с использованием основы композиции в соответствии с настоящим изобретением, например, в виде биоадгезивного пластыря с электроспряденными волокнами для доставки лекарственного средства.
c. Мидазолам - является очень эффективным при купировании эпилептических припадков, особенно, когда они являются продолжительными или повторяющимися. Хотя обычно его дают в виде внутривенной инъекции, это может быть очень трудным при судорогах больного. Поэтому ближе к настоящему времени было рекомендовано давать раствор мидазолама, просто помещая его между щекой и деснами или под язык, так как он быстро пересекает слизистую оболочку полости рта для выхода в системную циркуляцию и купирования судорог. Доставка этим путем является неопределенной, и большая часть лекарства утрачивается или проглатывается. Опять же более контролируемая, более направленная трансмукозная доставка и с большей продолжительностью может быть достигнута с использованием композиции в соответствии с настоящим изобретением, например, в виде биоадгезивного пластыря с электроспряденными волокнами для доставки лекарственного средства.
(ii) Доставка наркотических анальгетиков. Наркотические (опиоидные) анальгетики широко используются для лечения тяжелой и неразрешимой боли, особенно боли, связанной с раком, и для лечения послеоперационной боли и боли, связанной с травмой (включая боевые травмы). Основная проблема заключается в том, что большинство опиоидных анальгетиков должно вводиться путем инъекции с частым повторением доз с помощью инъекций, поскольку они быстро метаболизируются в печени. Некоторые опиоидные анальгетики в настоящее время доступны в форме пластыря для трансдермальной доставки или в форме спреев для трансназальной доставки, но трансмукозная доставка с помощью электроспряденных биоадгезивных композиций для полости рта, например, пластырей, предоставляет значительные преимущества. Включая более медленную, более контролируемую и более поддерживаемую доставку лекарственных средств. Более эффективное проникновение лекарственного средства в кровоток по сравнению с накожными пластырями, а также предотвращение метаболизма при первичном проходе через печень. Лекарства, которые, вероятно, являются хорошими кандидатами для этого подхода, включают: морфин, петидин, бупренорфин и фентанил.
Подписи к фигурам
На фигуре 1 показаны снимки электроспряденных волокон в соответствии с изобретением, сделанные с помощью электронной микроскопии
На фигуре 2 показано испытательное устройство, пригодное для испытания на биоадгезию
На фигуре 3 показано устройство для тестирования проникновения через щеку
На фигуре 4 показаны различные варианты осуществления волокон или композиций по изобретению
На фигуре 5 показаны сделанные с помощью электронной микроскопии микрофотографии образца электроспряденного поливинилпирролидона (PVP). Раствор 10 масс.% PVP (коллидон 90F) получали путем растворения подходящего количества PVP в этаноле и перемешивания в течение минимального времени 3 часа. Объем раствора (2 мл) затем загружали в шприц и нажимали на шприцевой насос, толкая раствор через металлическую иглу (20 калибра), при этом применяя к игле электрический ток 14 кВ. Это приводило к образованию струи волокон, бегущих от кончика иглы к собирательной пластине, расположенной на расстоянии 17 см. Шприцевой насос был установлен на скорости потока 10 мл/час.
Изображения показывают, что материал состоял из сетки волокон, нанесенных случайным образом. Эти волокна обычно демонстрировали гладкую поверхность и не имели видимых дефектов, были цилиндрическими по форме и имели диаметр менее 2 мкм.
На фигуре 6 показана полученная методом сканирующей электронной микроскопии микрофотография образца электроспряденного PVP с частицами декстрана, расположенными на поверхности волокон.
Растворы для электропрядения готовили путем первого смешивания соответствующего количества порошков PVP и декстрана и последующего добавления этанола для восполнения желаемой массы. Образующуюся суспензию частиц декстрана в растворенном PVP получали после перемешивания в течение минимального времени 3 часа, ее затем использовали для электропрядения в условиях, описанных на фигуре 5. В растворах использовали две молекулярные массы (т.е. 500000 и 2000000), а также различные количества декстранов (т.е. до 15 масс.%).
Материал состоял из случайных волокон, демонстрирующих гладкую поверхность и без видимых дефектов. Частицы декстрана обычно существенно больше, чем волокна и, очевидно, прикрепляются к их поверхности, хотя возможно, что более мелкие частицы были также заключены в волокна PVP.
Кроме того, изображение образца электроспряденного PVP, содержащего декстраны, в оптическом микроскопе показывает, что частицы декстрана присутствовали на поверхности материала.
На фигуре 7 показано изображение образца электроспряденного PVP, содержащего краситель альциановый синий, в оптическом микроскопе.
10 масс.% раствор PVP получали растворением соответствующего количества PVP в 1 масс./об.% растворе альцианового синего 8GX в этаноле. Смесь перемешивали в течение как минимум 3 часов, и затем проводили электропрядение в условиях, описанных на фигуре 5.
Было обнаружено, что поверхность материала имеет однородную синюю окраску, демонстрируя способность электроспряденного PVP инкапсулировать вещества, растворимые в этаноле (например, красители, лекарства), внутри волокон и доставлять их после растворения PVP.
Фигура 8 (левое изображение) иллюстрирует быстрое растворение образца электроспряденного PVP в искусственной слюне. Измеренное время растворения составляло менее 1 секунды для образца размером 2 см×0,5 см, и, как обнаружено, было сходным в случае образцов, растворенных в других средах на водной основе. Это быстрое растворение позволяет быстро высвобождать любое лекарственное средство, инкапсулированное в пределах электроспряденных волокон.
После растворения электроспряденный PVP образует гель с биоадгезивными свойствами, как представлено на фигуре 8 (правое изображение). В этом случае несколько образцов двухслойной системы, полученной из электроспряденного PVP и электроспряденного поли(капролактона) (PCL), помещали на слизистую оболочку щеки свиньи, опрысканную искусственной слюной. Слой PVP быстро образовывал гель после контакта со слизистой оболочкой, в то время как слой PCL оставался неповрежденным, поскольку это вещество не растворимо в воде. Кроме того, слой PCL был в состоянии оставаться на месте в течение длительного времени из-за биоадгезивности геля PVP.
На фигуре 9 показаны микрофотографии двухслойной системы из электроспряденного PVP и электроспряденного PCL, полученные с помощью сканирующей электронной микроскопии. Эти образцы получали с помощью термической обработки, предназначенной для создания адгезии между двумя слоями.
Готовили 10 масс.% раствор PVP в этаноле и осуществляли электропрядение, как описано ранее. Кроме того, получали 10 масс.% раствор PCL (средняя М.м. 80000) в смеси дихлорметана и диметилформамида (т.е. ДХМ/ДМФ, 90%/10% об.%) и проводили электропрядение поверх слоя PVP. После этого образцы вырезали из матов, расположенных между предметными стеклами, и подвергали воздействию температуры 65°С в течение 15 минут в электрической печи. Затем всем образцам давали остыть до комнатной температуры.
Изображения показывают, что термическая обработка приводила к плавлению слоя электроспряденного PCL и к последующему образованию непористой и плотной пленки, прикрепленной к слою PVP. На слой PVP термическая обработка не оказывала влияния из-за того, что температура плавления PVP значительно выше, чем температура плавления PCL (PCL, 60°С; PVP, >180°С).
Фигура 10. На изображениях показаны фотографии образца электроспряденных волокон после электропрядения геля PVP с суспендированным имиквимодом.
На фигуре 11 представлены данные экспериментов по тестированию растяжения.
Пластыри зажимали в лапках электрической индукционной машины Bose 3100, и плечам давали расходиться на 0,02 мм/сек. Напряжение и деформацию измеряли в электронном виде по мере растягивания пластыря (смотри график). Исходя из графика, измеряли предел прочности при растяжении, относительное удлинение 5 и модуль Юнга (мера напряжения и деформации) пластыря.
Фигура 12. Слизистую оболочку щеки, выделенную из щеки свиньи, прочно приклеивали к чашке Петри с использованием цианоакрилатного клея. Пластыри для слизистой (PVP с увеличением % декстрана) равных размеров затем наносили в течение 5 секунд с приблизительно равной силой и затем погружали в PBS, а затем крутили при различных скоростях с помощью механической мешалки. Время, за которое пластырь отделялся от слизистой оболочки, измеряли в минутах.
Фигура 13. PCL/PVP (+ декстраны) наносили на поверхность слизистой оболочки свиньи с постоянной силой в течение 30 мин. Слизистую оболочку с пластырем затем быстро замораживали в жидком азоте и хранили при -80°С в оптимальном температурном режиме резки и монтирования. Затем резали 8 мкм срезы, используя криостат, и срезы окрашивали гематоксилином и эозином перед монтированием на стекла. На фигуре отчетливо видно, что пластырь плотно прикреплен к эпителию слизистой оболочки, но не проникает в него.
Фигура 14. На А и В показаны электроспряденные волокна, где эудрагит L100-55 представляет собой волокнообразующий гидрофильный полимер, и альгинат натрия представляет собой биоадгезивное вещество, которое присутствует в нерастворенной форме и прикрепляется к волокнам. В C и D натриевую соль карбоксиметилцеллюлозы использовали в качестве биоадгезивного материала.
Фигура 15. Волокна, образованные эудрагитом 100-55. В А и В хитозан представляет собой биоадгезивное вещество, и в C и D использовали поливиниловый спирт. Биоадгезивный материал присутствует в нерастворенной форме, прикрепленный к волокнам.
Фигура 16. Результаты испытаний на биоадгезивность, как описано в примере 23.
Материалы
Следующие материалы используются в экспериментах, представленных в приведенных ниже примерах.
Поливидон 90000 (коллидон 90K) получали от BASF, Germany
Клуцел LF получали от Hercules Incorporated, US
Эудрагит Е получали от Evonik Industires
Эудрагит RS, Evonik Industires
Дермакрил 79, получали от AkzoNobel
Трибутилцитрат, этанол, ацетат натрия, хлористоводородную кислоту и бетаметазона дипропионат и клобетазола пропионат получали от Sigma-Aldrich
Декстран, молекулярная масса 500000, 750000, 1000000, получали от Pharmacosmos Denmark
Полиэтиленоксид 400000, 2000000, 4000000 получали от The Dow Chemical Company
Глицериды со средней цепью, Henry Lamotte Oils GmbH
Имиквимод и клобетазола пропионат получали от APIChem Technology Co., Ltd.
Карботан получали от Lubrizol Corporation US
Методы
Анализ бетаметазона дипропионата или клобетазола с помощью ВЭЖХ:
Колонка: Sunfire С18; 3,5 мкм или 5 мкм; 150×4,6 мм ID или эквивалентная
Подвижная фаза: ацетонитрил/0,01 М (NН4)2HPO4 рН 6,4, 70:30 (об./об.).
Скорость потока: 0,8 мл/мин
Длина волны детектирования: 240 нм
Анализ имиквимода с помощью ВЭЖХ:
Колонка: колонка Phenomenex C18 или эквивалентная
Подвижная фаза: 40:60 ацетонитрил к воде, содержащей 1% трифторуксусную кислоту
Скорость потока: 1 мл/мин
Длина волны детектирования: 242 нм
ПРИМЕРЫ
Пример 1
Получение спиртового геля, готового к электропрядению, -декстран в качестве биоадгезивного вещества
1) Содержание различных декстранов колебалась между 2,5, 5,0 и 7,5% от массы геля или от 25 до 75% от массы волокнообразующего гидрофильного полимера в тех случаях, когда использовали PVP или дермакрил. Эксперименты показали, что можно использовать, по меньшей мере, до 20 масс./масс.% декстрана. Отношения масс между биоадгезивным веществом и гидрофильным полимером составляло от 0,1 до 1,5, а именно 0,1, 0,16, 0,25, 0,33, 0,5, 0,75, 1, 1,5.
Для приготовления гелей декстраны суспендировали в этаноле путем перемешивания и ультразвуковой обработки с последующим медленным добавлением волокнообразующего гидрофильного полимера при медленном перемешивании. Полученную суспензию перемешивали в течение ночи, чтобы завершить растворение волокнообразующего гидрофильного полимера.
Пример 2
Получение спиртового геля, готового к электропрядению, -полиэтиленоксид в качестве биоадгезивного вещества
Содержание различных декстранов колебалась между 2,5, 5,0 и 7,5% от массы геля или от 25 до 75% от массы волокнообразующего гидрофильного полимера в тех случаях, когда использовали PVP или дермакрил. Эксперименты показали, что можно использовать, по меньшей мере, до 20 масс./масс.% декстрана. Отношения масс между биоадгезивным веществом и гидрофильным полимером составляло от 0,1 до 1,5, а именно 0,1, 0,16, 0,25, 0,33, 0,5, 0,75, 1, 1,5.
Для приготовления гелей полиэтиленоксид суспендировали в этаноле путем перемешивания и ультразвуковой обработки с последующим медленным добавлением волокнообразующего гидрофильного полимера при медленном перемешивании. Полученную суспензию перемешивали в течение ночи, чтобы завершить растворение волокнообразующего гидрофильного полимера.
Пример 3
Получение спиртового геля, содержащего лекарственное вещество имиквимод и готового к электропрядению
Использовали два различных метода:
1,5 г имиквимода суспендировали путем перемешивания в 20 г этанола, к которому добавляли 80 г 10% PVP 90К в этаноле, и медленно перемешивали в течение 2 часов.
2,5 г имиквимода суспендировали путем перемешивания в 20 г 0,1 М ацетатного буфера рН 4,0 в течение 2 часов, в результате чего имиквимод частично растворялся. Затем добавляли 80 г 10% PVP 90000 в этаноле и медленно перемешивали в течение 2 часов.
После растворения волокнообразующего гидрофильного полимера добавляли имиквимод и биоадгезивное вещество для получения суспензии. Затем проводили электропрядение суспензии, как описано в настоящем документе.
Следующие биоадгезивные вещества использовали в обоих методах:
Декстран 500000 Да
Декстран 750000 Да
Декстран 2000000 Да
Полиэтиленоксид 400000 Да
Полиэтиленоксид 2000000 Да
Полиэтиленоксид 4000000 Да
Биоадгезивные вещества добавляли в пропорции к волокнообразующему гидрофильному полимеру таким образом, чтобы отношение масс между биоадгезивным веществом и волокнообразующим гидрофильным полимером было в диапазоне 0,1-5. Конкретные полученные отношения масс составляли: 0,2, 0,25, 0,3, 0,4, 0,6, 0,7, 0,75, 0,8, 1, 1,2, 1,25, 1,3, 1,5, 1,6, 1,7, 2, 2,4, 2,7, 3, и 4.
Пример 4
Получение волокон, содержащих лекарственное вещество имиквимод
Использовали два различных метода:
1,5 г имиквимода суспендировали путем перемешивания в 20 г этанола, к которому добавляли 80 г волокнообразующего гидрофильного полимера в этаноле, и медленно перемешивали в течение 2 часов.
2,5 г имиквимода суспендировали путем перемешивания в 20 г 0,1 М ацетатного буфера рН 4,0 в течение 2 часов, в результате чего имиквимод частично растворялся. Затем добавляли 80 г волокнообразующего гидрофильного полимера в этаноле и медленно перемешивали в течение 2 часов.
Следующие волокнообразующие гидрофильные полимеры использовали в обоих методах:
Эудрагит® E в виде 15% раствора в этаноле
Эудрагит® RS в виде 15% раствора в этаноле
Дермакрил 79 в виде 10% раствора в этаноле
Следующие биоадгезивные вещества использовали в обоих методах:
Декстран 500000 Да
Декстран 750000 Да
Декстран 2000000 Да
Полиэтиленоксид 400000 Да
Полиэтиленоксид 2000000 Да
Полиэтиленоксид 4000000 Да
Биоадгезивные вещества добавляли в пропорции к волокнообразующему гидрофильному полимеру таким образом, чтобы отношение масс между биоадгезивным веществом и волокнообразующим гидрофильным полимером было в диапазоне 0,1-2. Конкретные полученные отношения масс составляли: 0,2, 0,25, 0,3, 0,4, 0,6, 0,7, 0,75, 0,8, 1, 1,2, 1,25, 1,3, 1,5, 1,6, 1,7 и 2.
После растворения волокнообразующего гидрофильного полимера добавляли имиквимод и биоадгезивное вещество для получения суспензии. Затем проводили электропрядение суспензии, как описано в настоящем документе.
Пример 5
Получение двухслойной композиции, включающей волокна, содержащие слой имиквимода на гидрофобном слое подложки
Получали волокна, описанные в примерах 3 и 4, но спряденные на гидрофобном слое, содержащем поли(капролактон), для получения двухслойной композиции.
Пример 6
Получение спиртового геля, содержащего лекарственное вещество бетаметазона дипропионат или клобетазола пропионат и декстран в качестве биоадгезивного вещества и готового к электропрядению
BDP или клобетазола пропионат, трибутилцитрат и/или триглицерид со средней длиной цепи растворяли в этаноле. Затем добавляли декстран с молекулярной массой приблизительно 750000 при перемешивании и ультразвуковой обработке и затем добавляли поливидон 90000 при медленном перемешивании.
Полученную суспензию перемешивали в течение ночи для завершения растворения волокнообразующего гидрофильного полимера. Затем проводили электропрядение суспензии, как описано в настоящем документе.
Пример 7
Получение спиртового геля, содержащего лекарственное вещество бетаметазона дипропионат или клобетазола пропионат и полиэтиленоксид в качестве биоадгезивного вещества и готового к электропрядению
Для получения спиртового геля, готового для прядения, BDP или клобетазола пропионат, трибутилцитрат и/или глицерид со средней длиной цепи растворяли в этаноле. Затем добавляли полиэтиленоксид с молекулярной массой приблизительно 750000 путем перемешивания и обработки ультразвуком и затем добавляли эудрагит RS при медленном перемешивании.
Полученную суспензию геля перемешивали в течение ночи для завершения растворения волокнообразующего гидрофильного полимера. Затем проводили электропрядение суспензии, как описано в настоящем документе.
Пример 8
Получение спиртового геля, содержащего лекарственное вещество имиквимод и декстран в качестве биоадгезивного вещества и готового к электропрядению
Имиквимод суспендировали в ацетатном буфере для получения суспензии, в которой частично растворяется имиквимод. Трибутилцитрат и/или триглицерид со средней длиной цепи растворяли в этаноле. Добавляли полученную суспензию имиквимода. Затем добавляли декстран с молекулярной массой приблизительно 750000 с помощью перемешивания и ультразвуковой обработки и затем добавляли эудрагит RS при медленном перемешивании.
Полученную суспензию перемешивали в течение ночи для завершения растворения волокнообразующего гидрофильного полимера. Затем проводили электропрядение суспензии.
Гели, представленные в приведенном выше примере, получали в виде листов с использованием способа электропрядения со следующими параметрами:
Расстояние от кончика до коллектора: 25 см
Электрическое поле на кончике: -20 кВ
Электрическое поле на коллекторе: -+6 кВ
Геометрия кончика: 18 калибр
Скорость потока: 10 мл/час
Температура: комнатная температура
Влажность: 60%
Пример 9
Получение двухслойной композиции, содержащей слой лекарственного вещества и слой подложки
Получили четыре композиции, две из которых были без какого-либо покрытия, и покрытие II распыляли на электроспряденные волокна, в то время как покрытие III получали прядением поверх электроспряденных волокон.
Пример 10
Испытание адгезии композиций in vivo
Электроспряденные волокна, проиллюстрированные в примерах, которых приведены в настоящем документе, испытывали на биоадгезию путем размещения листа 1 см×1 см на середине языка. Индивидууму, на котором тестировались волокна, предлагали оценить биоадгезивность по шкале от 0 до 5, где 5 сильная биоадгезивность и 0 нет биоадгезивности.
Пример 11
Электронно-микроскопическое исследование
Электронно-микроскопические фотографии двух различных композиций, описанных в примере 3, показаны на фигуре 1. Из фигуры видно, что размер частиц лекарственного средства, намного меньше в волокнах, когда лекарственное вещество суспендируют в ацетатном буфере, т.е., подтверждается, что часть лекарственного вещества растворяется в ацетатном буфере перед прядением.
Пример 12
Испытание адгезии электроспряденных волокон in vitro
Биоадгезивные силы электроспряденных волокон определяли с помощью устройства измеряющего биоадгезию, показанного на фигуре 2. Слизистую оболочку щеки нарезали на полоски/кусочки и промывали казеозным раствором. Во время тестирования участок слизистой оболочки щеки (с) прикрепляли, размещая слизистой стороной наружу, на верхний стеклянный сосуд (B), используя резиновую ленту и алюминиевую крышку. Диаметр каждой экспонированной слизистой мембраны составлял 1 см. Сосуд со слизистой оболочкой щеки овцы (C) сохраняли при температуре 37°С в течение 10 мин. Затем один сосуд со срезом слизистой оболочки щеки (С) и другой сосуд фиксировали на регулируемой по высоте чашке (E). На нижний сосуд помещали электроспряденные волокна (D) с помощью двухслойной клейкой ленты, клейкой стороной, обращенной вниз. Высоту нижнего сосуда регулировали таким образом, чтобы электроспряденные волокна могли прилипать к слизистой оболочки щеки овцы на верхнем сосуде. Постоянную силу применяли к верхнему сосуду в течение 2 мин, после чего ее отменяли, и верхний сосуд затем соединяли с весами. Затем медленно добавляли вес на чашке с правой стороны с приращением 0,5 г до тех пор, пока два сосуда не начинали отделяться друг от друга. Общий вес (г), необходимый для отсоединения двух сосудов, использовали в качестве меры биоадгезивной силы. Из этой биоадгезивной силы рассчитывали силу адгезии.
Могут быть использованы также другие подходящие способы, например, методы in vitro и in vivo, описанные Kockish et al. в статье Journal of Controlled Release, 77 (2001) 1-6, которая включена в качестве ссылки в полном объеме.
Пример 13
Тестирование высвобождения композиций in vitro
Целью исследования является изучение влияния полимера и биоадгезивного полимера, пластификатора и жиросодержащего усиливающего высвобождение агента на высвобождение in vitro бетаметазона дипропионата, BDP или клобетазола пропионата из описанных в настоящем документе композиций.
Мембрана:
Мембраны из силиконового эластомера Dow Corning® 7-4107, 75 мкм.
Система диффузионных ячеек:
Модифицированные диализные ячейки.
Принимающий отсек: 3,75 мл. Фактический объем каждой ячейки регистрируется путем взвешивания собранной ячейки до и после заполнения принимающего отсека. Диаметр: 1,55 см, что соответствует доступной площади диффузии 1,89 см2.
Листы силиконовой мембраны разрезают по размеру (кружки, 0=22 мм). Мембрану помещают между двумя отделениями диализных ячеек глянцевой стороной наружу к донорскому отсеку.
Состав пластыря из электроспряденных волокон наносят непосредственно на мембрану, нажав на исполнительный механизм.
Принимающий отсек заполняют предварительно нагретой и дегазированной принимающей средой (фактический объем каждой ячейки регистрируется путем взвешивания), и возможные пузырьки воздуха удаляют. Плечо образца запаивают пластиковой пробкой и парафином для предотвращения испарения среды принимающего отсека. Равномерное перемешивание принимающей фазы получают с помощью магнитного стержня, помещенного в принимающий отсек. Ячейки для диффузии помещают в нагревательный шкаф при 37°С для поддержания температуры 32°С на поверхности мембраны. Устанавливается перемешивающийся слой.
Принимающая среда:
10 масс./масс.% метил-13-циклодекстрина в 0,05 М ацетатном буфере рН 4,0. Принимающую среду дегазировали в водяной бане ультразвуком в течение как минимум 20 минут до начала эксперимента и за 24 час и 48 час до отбора образцов. Гарантировалось, что условия достаточного разбавления присутствовали во все временные точки в течение периода исследования; т.е., что концентрация лекарственных соединений в принимающей фазе была ниже 10% от растворимости лекарственных веществ в среде.
Время экспозиции и отбора образцов:
Образцы 1500 мкл (фактический объем взвешивают и регистрируют) отбирают из каждой ячейки через регулярные промежутки времени. После каждого отбора проб принимающий отсек пополняют заново (точно на такой же объем, что и отобранный) предварительно нагретой свежей принимающей средой. Отобранные образцы хранят в коричневых герметичных флаконах для ВЭЖХ при температуре 2-8°С и защищают от света до количественной оценки с помощью анализа ВЭЖХ в конце эксперимента. Временные точки отбора образцов: 0, 1, 6, 24, 30, 48, 54, 72 час.
Дизайн исследования:
Каждый состав тестировали в 3 повторностях (n=3).
Пример 14
Исследования проникновения в кожу in vitro
Для исследования проницаемости и проникновения в кожу имиквимода из композиций в соответствии с примерами 3 и 6 проводили эксперимент с диффузией в кожу. В исследовании использовали полную толщину кожи ушей свиньи. Кожу очищали и хранили в замороженном состоянии при -18°C до использования. За день до начала эксперимента кожу помещали в холодильник (5±3°C) для медленного размораживания.
Использовали статические диффузионные ячейки типа Франца с доступной областью диффузии 3,14 см2 и принимающие объемы в диапазоне от 8,6 до 11,1 мл, по существу с помощью способа, описанного T.J. Franz, "The finite dose technique as a valid in vitro model for the study of percutaneous absorption in man", в Current Problems in Dermatology, 1978, J.W.H. Mall (Ed.), Karger, Basel, pp. 58-68. Конкретный объем измеряли и регистрировали для каждой ячейки. Магнитный стержень помещали в принимающий отсек каждой ячейки. После монтирования кожи каждую принимающую камеру заполняли физиологическим солевым раствором (35°С) для гидратации кожи. Ячейки помещали в водяную баню с контролируемой температурой, которую ставили на магнитную мешалку, установленную на 300 об/мин. Циркулирующую воду в водяных банях поддерживали при 35±1°С, что приводило к температуре приблизительно 32°С на поверхности кожи. Через 30 мин физиологический солевой раствор заменяли принимающей средой, состоящей из 1 части ацетатного буфера (100 мМ, рН 4,0) и 1 части физиологического солевого раствора.
Проникновение каждой исследуемой композиции, содержащей имиквимод, в кожу in vitro тестировали в 3-х повторностях (т.е. n=6). Каждую тестируемую композицию наносили на мембрану кожи в 0 часов, используя пипетку. Эксперименту по проникновению в кожу давали осуществляться в течение 24 часов. Затем образцы отбирали из принимающих отсеков в течение до 72 часов.
Концентрацию имиквимода в образцах определяли с помощью ВЭЖХ.
Пример 15
Проникновение в тканевую культуру щеки in vitro
Используемое устройство показано на фигуре 3.
Лист композиции спряденных волокон, содержащий бетаметазона дипропионат или клобетазола пропионат, наносили непосредственно на мембрану, нажав на исполнительный механизм. Ячейки поддерживали при 37°С в сушильном шкафу. Принимающий отсек заполняли предварительно нагретой принимающей средой. Фактический объем каждой ячейки регистрировали путем взвешивания. Принимающая среда состояла из 10 масс./масс. метил-13-циклодекстрина в 0,05 М ацетатном буфере рН 4,0. В разные промежутки времени в течение до 48 часов отбирали образцы получаемой жидкости и заменяли свежей нагретой принимающей средой. Отобранные образцы хранили в коричневых герметичных флаконах для ВЭЖХ в донорской среде при -2-8° и защищали от света до количественной оценки с помощью анализа ВЭЖХ в конце эксперимента. Каждый эксперимент проводился в трех повторностях.
Пример 16
Исследования раздражения кожи в культуре клеток человека in vitro
Исследования in vitro раздражения кожи в культуре клеток человека проводили в соответствии с руководством испытаний OECDʹs «OECD Guidelines for the testing of chemicals - In Vitro Skin Irritation: Reconstructed Human Epidermis Test Method. 439, утвержденным 26 июля 2013 г.
Пример 17
Определение растворимости биоадгезивных веществ
Растворимость биоадгезивных веществ определяли с использованием метода, рекомендованного Европейской фармакопеей 5.0 (раздел 5.11, стр. 565).
Европейская Фармакопея использует следующие термины для определения растворимости вещества в конкретном растворителе (раздел 1.4, стр. 7):
Экспериментальный метод, используемый для определения растворимости декстранов и полиэтиленоксида, описан далее:
Метод растворения: встряхнуть пробирку (1 мин) и поместить в устройство с постоянной температурой при температуре 25±0,5°С на 15 мин. Если вещество не полностью растворяется, повторить встряхивание (1 мин) и поместить пробирку в устройство с постоянной температурой на 15 мин.
Метод:
1) Взвесить 100 мг тонкоизмельченного вещества в закупоренной пробирке (внутренний диаметр 16 мм и длина 160 мм), добавить 0,1 мл растворителя и действовать, как описано в разделе метод растворения. Если вещество полностью растворяется, оно очень хорошо растворимо.
2) Если вещество не полностью растворяется, добавить 0,9 мл растворителя и действовать, как описано в разделе метод растворения. Если вещество полностью растворяется, оно легко растворимо.
3) Если вещество не полностью растворяется, добавить 2,0 мл растворителя и действовать, как описано в разделе метод растворения. Если вещество полностью растворяется, оно растворимо.
4) Если вещество не полностью растворяется, добавить 7,0 мл растворителя и действовать, как описано в разделе метод растворения. Если вещество полностью растворяется, оно умеренно растворимо.
5) Если вещество не полностью растворяется, взвесить 10 мг тонкоизмельченного вещества в закупоренной пробирке, добавить 10,0 мл растворителя и действовать, как описано в разделе метод растворения. Если вещество полностью растворяется, оно малорастворимо.
6) Если вещество не полностью растворяется, взвесить 1 мг тонкоизмельченного вещества в закупоренной пробирке, добавить 10,0 мл растворителя и действовать, как описано в разделе метод растворения. Если вещество полностью растворяется, оно очень малорастворимо.
Материалы
Вещества;
1) DEX20: Декстран с М.м. 2000000 (Pharmacosmos)
2) PEO20: Полиэтиленоксид с М.м. 2000000 (Sigma Aldrich)
Растворитель:
1) 3 об.% дистиллированной воды в этаноле
Результаты
Обсуждение и выводы
Оба биоадгезивных вещества (т.е. декстран и полиэтиленоксид) не полностью растворялись после последней стадии способа, рекомендованного Европейской фармакопеей, в котором 1 мг вещества добавляли к 10 мл растворителя.
Это означает, что более 10000 мл растворителя требуется для растворения 1 г обоих веществ.
Таким образом, используя терминологию, установленную Европейской фармакопеей, биоадгезивные вещества, используемые при получении композиции по изобретению (т.е. декстран и полиэтиленоксид), могут быть описаны как практически нерастворимые в 3 об.% дистиллированной воды в этаноле.
Пример 18
Определение максимального количества воды, добавляемого к этанолу, приводящего к успешному образованию волокон
Максимальное количество воды, которое может быть добавлено к системе растворителей, определяли путем получения серии растворов поливинилпирролидона (PVP) и/или эудрагита RS100 в смесях дистиллированной воды и этанола, которые затем подвергали электропрядению для подтверждения образования волокон.
Состав растворов
PVP=10 масс.%
Эудрагит RS100=0 масс.% и 5 масс.%
Растворитель=смесь дистиллированной воды и этанола в различных соотношениях
Условия электропрядения
Игла 15 калибра
Напряжение=16 кВ
Расстояние=19 см
Скорость потока=5 мл/час
Результаты
Растворы, полученные с водой до 50 об.%, легко обрабатывались, генерируя волокна и материалы хорошего качества.
Растворы, полученные с водой 60 об.%, могут генерировать волокна после изменения условий электропрядения. Полученные материалы были неудовлетворительного качества.
Растворы, полученные только из PVP с 75 об.% и 100 об.% дистиллированной воды, могут генерировать волокна после изменения условий электропрядения. Полученные материалы были неудовлетворительного качества.
Раствор, полученный из PVP и эудрагита RS100 с 75 об.% и 100 об.% дистиллированной воды, не может быть обработан, так как эудрагит RS100 не растворяется.
Результаты
Электроспряденные PVP и эудрагит RS100 также, очевидно, характеризуются повышенной растворимостью и сниженной целостностью материала при воздействии воды, когда содержание воды в системе растворителей увеличивается.
Выводы
До 50 об.% дистиллированной воды можно добавить к этанолу и получить хорошие электроспряденные волокна, полученные из PVP и/или эудрагита RS100.
На практике концентрация воды в используемой системе растворителей представляет собой баланс между i) обеспечением хорошей растворимости волокнообразующего гидрофильного полимера и плохой растворимости биоадгезивного вещества, и ii) свойствами биоадгезивного вещества при контакте с водой; биоадгезивное вещество должно только в незначительной степени влиять на вязкость системы растворителей, так как существенно высоковязкая система растворителей затрудняет электропрядение волокон.
Повышенное содержание воды (>20об.%) в системе растворителей влияет на поведение электроспряденных волокон из PVP+эудрагита RS100 при воздействии воды.
Пример 19
Демонстрация того, что электроспряденные волокна можно также получать с дополнительными полимерами
Различные гидрофильные полимеры могут быть пригодны для формирования волокон: поливинилпирролидон, поливиниловый спирт, этилцеллюлоза, карбоксиметилцеллюлоза, гидроксипропилцеллюлоза, акрилаты и акриловые сополимеры.
Проводили краткий обзор литературы в этой области с целью изучения возможных решений и условий обработки, которые могут облегчить получение электроспряденных волокон.
Затем, возможность электропрядения полимеров, отличных от PVP и эудрагита, исследовали с использованием растворов следующих полимеров в различных системах растворителей:
1) Поли(виниловый спирт), 99+% гидролизованный, М.м. 146000-186,000
2) Натриевая соль карбоксиметилцеллюлозы, М.м. ~250000
3) Гидроксипропилцеллюлоза, М.м. ~100000
4) Этилцеллюлоза, содержание этоксилов 48%, 10 мПа⋅сек
Первоначально выбранными растворителями были этанол и дистиллированная вода. По данным FAO (Продовольственной и сельскохозяйственной организации Объединенных Наций) растворимость этих полимеров в этаноле и воде является следующей:
Таким образом, основываясь на этой информации PVA и CMC свободно не растворимы в этаноле.
Поли(виниловый спирт) (PVA)
ПВА растворяли в дистиллированной воде при (70-90)°С при непрерывном перемешивании до образования прозрачного раствора.
Концентрация=6 масс.%
Электроспряденные волокна образовывались при использовании 20 кВ и 1,25 мл/час.
Нерегулярное образование волокон - В настоящее время не подходит для использования в качестве волокнообразующего гидрофильного полимера при получении композиции в соответствии с настоящим изобретением.
Этилцеллюлоза (EC)
EC хорошо растворяется в этаноле и тетрагидрофуране.
Концентрация=10-15 масс.%
Электропрядение невозможно в широком диапазоне условий получения, но правильная настройка параметров получения может позволить получение волокон
Однако можно получить электроспряденные волокна и целые маты путем смешивания с PVP (т.е. 10 масс.% PVP и 5 масс.% ЕС)
Полученный материал проявлял сниженную растворимость в воде, сходную с электроспряденными PVP и RS100.
Гидроксипропилцеллюлоза (HPC)
HPC хорошо растворяется в этаноле и тетрагидрофуране.
Концентрация=10-15 масс.%
Электропрядение невозможно в широком диапазоне условий получения, но правильная настройка параметров получения может позволить получение волокон
Однако можно получить электроспряденные волокна и целые маты путем смешивания с PVP (т.е. 10 масс.% PVP и 5 масс.% HPC)
Добавление HPC к PVP не снижало растворимости электроспряденных волокон.
Карбоксиметилцеллюлоза (CMC)
CMC хорошо растворяется в дистиллированной воде.
Концентрация=1-3 масс.%
Электропрядение невозможно в широком диапазоне условий получения.
Результаты частично улучшались после смешивания с полиэтиленоксидом (CMC:PEO 1:2)и добавления 25 об.% этанола в дистиллированной воде, хотя образование волокон не наблюдалось.
Выводы
PVA может быть электроспряденным, хотя текущие результаты не подходят для получения композиции в соответствии с настоящим изобретением.
EC и HPC могут быть электроспряденными, если смешаны с PVP.
CMC в настоящее время не может быть электроспряденной.
Результаты по ЕС, HPC и CMC отличаются от, описанных в литературе.
Вероятно, возможность появится при дальнейшей подгонке параметров получения.
Пример 20
Демонстрация возможности прядения различных композиций эудрагита
Различные композиции эудрагита были упомянуты в патенте, и это считается важным для выяснения того, какие композиции могут быть успешно использованы для получения электроспряденных волокон.
Следующие композиции были идентифицированы как интересные для исследования:
Эудрагит RS100
Сополимер аммония метакрилата, тип B.
Растворенный в 3 об.% дистиллированной воды в этаноле.
Подходит для электропрядения.
Образует хорошие волокна при смешивании с PVP.
Эудрагит L100-55
Сополимер метакриловой кислоты - этилакрилата (1:1), тип А.
Растворим в этаноле.
Подходит для электропрядения, образуя материалы хорошего качества.
Если для образования волокон используется смесь двух или более волокнообразующих гидрофильных полимеров, то эти используемые полимеры должны обладать способностью смешиваться в используемой системе растворителей, и они должны растворяться.
Пример 21
Молекулярная масса используемых биоадгезивных веществ
Целью данного примера является демонстрация того, что биоадгезивные вещества, предлагаемые для использования в композиции по настоящему изобретению, могут применяться в установленных диапазонах молекулярных масс.
Одно требование заключается в том, что биоадгезивное вещество не должно быть свободно растворимо в используемой системе растворителей, растворимость должна соответствовать критерию умеренной растворимости или менее. Это устанавливает ограничения относительно молекулярной массы, так как, например, декстран и PEO с низкой молекулярной массой не удовлетворяют критериям растворимости.
Экспериментальная работа заявителей продемонстрировала, что:
Биоадгезивная прочность полимера имеет тенденцию к увеличению по мере роста молекулярной массы.
Это связано с критической длиной молекулы, необходимой для получения взаимопроникающего слоя и сплетений с поверхностью мягких тканей.
В случае полиэтиленоксида, который имеет высоколинейную конфигурацию, адгезивные силы возрастают до молекулярной массы 4000000.
В случае декстранов, которые присутствуют в более свернутой конфигурации, как показано, они проявляют сходные биоадгезивные силы, как при низкой, так и при высокой молекулярной массе из-за «экранирования» функциональных групп декстрана.
Для полиэтиленоксида экспериментальное исследование биоадгезивных свойств композиции электроспряденных волокон проводили с использованием PEO с молекулярной массой 400000 и 2000000.
Несмотря на то, что не было существенных различий между двумя композициями, пластыри с полиэтиленоксидом 2000000 дали результаты с меньшей изменчивостью и более высоким среднем временем адгезии.
Для декстранов экспериментальное исследование было проведено на электроспряденных материалах, содержащих декстраны с молекулярной массой 500000 и 2000000.
Точно так же, хотя не было никаких существенных различий между обеими композициями, пластыри с декстраном 2000000 дали результаты с более высоким средним временем адгезии.
Заключается, что для исследования биоадгезии следует выбирать вещества с высокими молекулярными массами, так как они давали более четко определенные результаты, чем вещества с более низкой молекулярной массой.
Пример 22
Определение максимального количества биоадгезивного вещества, которое может быть добавлено к раствору для электропрядения
Максимальное количество биоадгезивных веществ, которое может быть добавлено к материалам для электропрядения, определяли путем получения серий разведений поливинилпирролидона (PVP) в этаноле с увеличивающимися количествами биоадгезивного вещества, которые затем подвергали электропрядению для подтверждения образования волокон.
Состав растворов
PVP=10 масс.%
Биоадгезивные вещества=полиэтиленоксид, М.м. 2000000 (PEO20) и декстраны М.м. 2000000 (DEX20)
Растворитель=этанол
Условия электропрядения
Игла 15 калибра
Напряжение=16 кВ
Расстояние=19 см
Скорость потока=5 мл/час
Результаты
Растворы DEX20 до 30 масс.% и PEO20 до 20 масс.% легко поддавались обработке, создавая волокна и материалы хорошего качества.
Растворы DEX20 40 масс.% и PEO20 30 масс.% могли поддаваться электропрядению, но полученные материалы были неудовлетворительного качества из-за высокой вязкости раствора.
Препараты DEX20 50 масс.% и PEO20 40 масс.% не могут быть обработаны. Их вязкость была слишком высокой для электропрядения, а их внешний вид был более похож на пасту, чем на раствор.
Пример 23
Демонстрация того, что электроспряденные волокна могут быть также получены с использованием дополнительных биоадгезивных веществ
Проводили эксперименты с диапазоном биоадгезивных веществ, отличных от декстрана и полиэтиленоксида.
Был сделан краткий обзор литературы в этой области с целью выявления потенциальных биоадгезивных веществ, которые могут быть добавлены к электроспряденным волокнам. Затем были предложены следующие гидрофильные вещества:
Используемые вещества представляли собой:
1) Натриевую соль альгиновой кислоты из бурых водорослей средней вязкости
2) Натриевую соль карбоксиметилцеллюлозы М.м.~250000
3) Хитозан со средней молекулярной массой
4) Поли(виниловый спирт), 99+%, гидролизованный, М.м. 146000-186000
Размер частиц поставляемых веществ был слишком большим, чтобы добавлять к электроспряденным волокнам. Поэтому все вещества размалывали и просеивали для получения порошков с размером частиц <150 мкм.
Затем готовили растворы для электропрядения и проводили обработку при следующих условиях:
Эудрагит L100-55 20 масс.% в этаноле+биоадгезивное вещество 10 масс.%
Игла 15 калибра
Напряжение=16 кВ
Расстояние=19 см
Скорость потока=2,5 мл/час
Результаты показали, что другие биоадгезивные вещества пригодны для использования в настоящем контексте.
Частицы поли(винилового спирта) и хитозана были видны после сушки образцов, в то время как другие вещества не были видимыми. Это предполагает, что поли(виниловый спирт) и хитозан могут быть веществами с наименьшим биоадгезивным потенциалом вследствие медленного растворения в воде при комнатной температуре.
Пример 24
Образование волокон PVP с использованием этанола в качестве растворителя
Эксперименты проводили с целью исследования вопроса, зависит ли образование волокон PVP от концентрации PVP в этаноле. Получены следующие результаты:
1) 2,5 масс.% PVP - отсутствие образования волокна. Вместо этого наблюдалось электрораспыление (т.е. образование частиц, а не волокон), даже после снижения скорости потока до 2,5 мл/час и 1 мл/час.
2) 5 масс.% PVP - наблюдалось образование волокон. Хорошее образование мембраны, полученной из отдельных волокон.
3) 7,5 масс.% PVP - наблюдалось образование волокон. Хорошее образование мембраны, полученной из отдельных волокон.
4) 10 масс.% PVP - наблюдалось образование волокон. Хорошее образование мембраны, полученной из отдельных волокон.
5) 12,5 масс.% PVP - наблюдалось образование волокон. Хорошее образование мембраны, полученной из отдельных волокон.
6) 15 масс.% PVP - наблюдалось образование волокон. Хорошее образование мембраны, полученной из отдельных волокон.
7) 20 масс.% PVP - наблюдалось образование волокон. Мембрана, полученная из отдельных волокон, может быть получена после снижения скорости потока до 2,5 мл/час и увеличения расстояния до коллектора до 23 см.
8) 25 масс.% PVP - наблюдалось образование волокон. Мембрана может быть получена после снижения скорости потока до 1 мл/час и увеличения расстояния до коллектора до 23 см. Однако полученная мембрана была менее хорошего качества, чем волокна, полученные в 1)-7).
Все растворы готовили в этаноле.
Условия электропрядения были следующими, если не указано иное:
- Напряжение=15 кВ
- Скорость потока=5 мл/час
- Расстояние до коллектора=19 см
Диаметр волокон, как выявлено, увеличивался по мере увеличения концентрации PVP. В случае PVP 20 масс.% и 25 масс.% это привело к более медленному испарению растворителя и слиянию волокон после осаждения с образованием пленки. В этих случаях расстояние до коллектора увеличивали до 23 см для того, чтобы получить мембраны, полученные из отдельных волокон. Кроме того, площадь осаждения волокон на коллекторе снижалась по мере увеличения концентрации.
Вязкость PVP 20 масс.% и 25 масс.% была значительно больше, чем в других растворах, вероятно, вызывая упомянутые выше проблемы образования волокон. В конкретном случае PVP 25 масс.% было трудно устранить пузырьки из раствора перед электропрядением из-за его вязкой природы. Волокна могли быть получены из 20 масс.% и 25 масс.%.
Эти результаты свидетельствуют о том, что оптимальный диапазон концентраций PVP для получения волокон согласно изобретению может составлять от 5 масс.% до 20 масс.%, причем концентрация приблизительно 10 масс.% дает очень хорошие результаты.
Реферат
Настоящее изобретение относится к композиции для применения в медицине, содержащей электроспряденные волокна, включающие i) гидрофильный полимер, растворимый в первом растворителе, и где гидрофильный полимер выбран из поливинилпирролидона, этилцеллюлозы, гидроксипропилцеллюлозы, акрилатов и акриловых сополимеров и их смесей, ii) биоадгезивное вещество, имеющее растворимость в указанном первом растворителе 0,5 г/100 мл или менее в указанном первом растворителе, и где биоадгезивное вещество выбрано из декстранов, полиэтиленоксидов, альгината, трагаканта, каррагенана, пектина, гуара, ксантана, геллана, метилцеллюлозы, гидроксипропилметилцеллюлозы, поливинилового спирта, полимеров акриловых кислот, хитозана, лектинов, тиолированных полимеров, полиоксо-WSRA, сополимеров полимеров акриловых кислот и полиэтиленгликоля, а также их смесей, iii) необязательно, лекарственное вещество, причем наружная поверхность композиции обеспечена водонепроницаемым покрытием. Также описан набор для применения в медицине, включающий i) указанную выше композицию и ii) аппликатор для нанесения композиции в полости рта. Также описан способ получения указанной выше композиции. Технический результат - композиция для применения в медицине, способная оставаться на месте нанесения в течение длительного периода времени, а также при наличии лекарственного вещества высвобождать его из композиции в течение продолжительного периода времени. 4 н. и 24 з.п. ф-лы, 16 ил., 24 пр.

Комментарии