Кортикостероидные композиции - RU2491074C2
Код документа: RU2491074C2
Описание
Перекрестная ссылка
По настоящей заявке испрашивается приоритет согласно предварительной заявке США № 60/987720, поданной 13 ноября, 2007; предварительной заявке США № 61/012012, поданной 6 декабря, 2007; предварительной заявке США № 61/015998, поданной 21 декабря, 2007; предварительной заявке США № 61/019818, поданной 8 января, 2008; предварительной заявке США № 61/034941, поданной 7 марта, 2008; предварительной заявке США № 61/035348, поданной 10 марта, 2008; предварительной заявке США № 61/054103, поданной 16 мая, 2008; предварительной заявке США № 61/054104, поданной 16 мая, 2008; предварительной заявке США № 61/054105, поданной 16 мая, 2008; предварительной заявке США № 61/054106, поданной 16 мая, 2008; предварительной заявке США № 61/054107, поданной 16 мая, 2008; и предварительной заявке США № 61/090658, поданной 20 августа, 2008, которые включены в описание посредством ссылки.
Предшествующий уровень техники
Воспалительные заболевания пищевода признаются, как требующие улучшения в постановке диагноза как у взрослых, так и у детей. Одним примером является эозинофильный эзофагит (ЕЕ или ЕоЕ), который является острым и быстро распространяющимся заболеванием, характеризующимся высокими уровнями эозинофилов в пищеводе, а также гиперплазией базального слоя. Полагают, что ЕЕ (или ЕоЕ) появляется, по меньшей мере, в подгруппе больных, в результате пищевых аллергий или действия ингаляционного алергена (1-5, 44). Диагноз ЕЕ (или ЕоЕ) часто связан с другими гиперчувствительными расстройствами, включающими астму, ринит и другие чувствительности к пище и аэроаллергенным вдыхаемым средствам (39-40). Диагноз часто ставят, например, у маленького ребенка, и он зависит от обнаружения от 15 до 20 или более, до 24 или более эозинофилов в поле зрения при большом увеличении (eos/hpf) в биоптатах слизистой пищевода (6-12).
В параллель с другими атопическими заболеваниями, число случаев ЕЕ (или ЕоЕ), по-видимому, увеличивается (15, 35). Нарушение может сопровождаться другими симптомами, похожими на рефлюкс, болью и дисплазией, клиническими симптомами, подобными картине гастроэзофагеальной рефлюксной болезни (“ГЭРБ”) (42). Симптомы ЕЕ (или ЕоЕ) включают, например, боль в области живота, боль в груди, удушье, трудность в глотании, остановку в весе, тошноту, рефлюкс, не облегченный применением стандартной антирефлюксной терапии, кожную сыпь или крапивницу, рвоту и потерю в весе. В одной группе, 15% больных с ЕЕ (или ЕоЕ) имели сопутствующую задержку в развитии (45).
Хотя ЕЕ (или ЕоЕ) становится более часто диагностируемым заболеванием в развитых странах (7, 8, 13-16), аспекты болезни остаются неясными, включая ее этиологию, течение болезни и оптимальную терапию. Симптомы ЕЕ (или ЕоЕ) часто напоминают симптомы ГЭРБ и включают рвоту, дисфагию, боль и задержку пищевых остатков (8, 14, 17-20). Однако лечение ЕЕ (или ЕоЕ) и ГЭРБ отличается, и важно различать между ними, особенно, как нелеченный ЕЕ (или ЕоЕ) может быть связан с сужением пищевода в 10-30% случаев (14, 18, 20, 21). Совпадение симптомов ЕЕ (или ЕоЕ) и ГЭРБ является обычным; отсутствие ответа на лечение ГЭРБ посредством PPI может быть одним диагностическим указанием на наличие ЕЕ (или ЕоЕ) (42). Общее явление постановки ошибочного диагноза ЕЕ (или ЕоЕ) для ГЭРБ часто приводит к запаздыванию в лечении больных с ЕЕ (или ЕоЕ) (42).
Продолжительная системная стероидная терапия может привести к значительным вторичным побочным воздействиям на рост и развитие кости. Хотя было показано, что лечение ЕЕ (или ЕоЕ) анти-IL-5 моноклональными антителами было успешным, в настоящее время указанная терапия не принята для использования у детей (36).
В настоящее время лечение включает элиминационные диеты (22, 23) и питание элементными смесями (2, 24). Идентификация истинных возбуждающих пищевых аллергенов может быть трудной, и элементные смеси часто бывают неприятными на вкус, что осложняет лечение диетой (1, 22). Процедуры самостоятельного впрыскивания и проглатывания могут быть трудными для больных, особенно для маленьких детей, и особенно детей с задержкой развития, чтобы выполнять их эффективно. Вследствие этого, менее эффективная доза местно действующего стероида может быть доставлена к пищеводу.
Сущность изобретения
Определенные варианты осуществления изобретения, представленные в описании, относятся к фармацевтической композиции, содержащей физически и химически стабильную композицию, включающую:
а. терапевтически эффективное количество кортикостероида,
b. эдетат,
с. цитрат,
d. полисорбат 80,
е. необязательный консервант,
f. необязательное ароматизирующее вещество,
g. необязательный подсластитель,
h. по меньшей мере, один дополнительный эксципиент, и
i. жидкий носитель.
В некоторых вариантах осуществления изобретения, представленная в описании фармацевтическая композиция является подходящей для однократного или многодозового введения. В некоторых вариантах осуществления изобретения, представленная в описании фармацевтическая композиция находится в упаковке для множества доз, содержащей множество единичных доз. В некоторых вариантах осуществления изобретения, представленная в описании композиция остается по существу однородной после хранения. В специфичных вариантах осуществления изобретения, представленная в описании фармацевтическая композиция остается по существу однородной после хранения в течение срока годности препарата. В некоторых вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция имеет консистенцию текучей среды, жидкости, раствора, суспензии, твердого материала, полутвердого материала, геля, крема, мази, мажущую, жидкотекучую или пастообразную консистенцию. В определенных вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция приобретает или восстанавливает значительную однородность при слабом или умеренном перемешивании, вихревом перемешивании, легком вихревом перемешивании или при встряхивании. В некоторых вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция приобретает или восстанавливает значительную однородность при слабом или умеренном перемешивании, вихревом перемешивании, легком вихревом перемешивании или при встряхивании. В определенных вариантах осуществления изобретения, после слабого или умеренного перемешивания, вихревого перемешивания, легкого вихревого перемешивания или после встряхивания, описанная в изобретении фармацевтическая композиция остается по существу однородной в течение подходящего периода времени, включающего, в качестве неограничивающего примера, по меньшей мере, 1, 2, 4, 6, 12, 18 или 24 часа, или 2, 3, 4, 5 или более дней.
В определенных вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция представляет собой композицию, состоящую из множества доз. В определенных вариантах осуществления изобретения, каждая доза (например, из упаковки для множества доз, содержащей множество доз фармацевтической композиции) композиции является по существу однородной относительно одной дозы к другой дозе. В некоторых вариантах осуществления изобретения, первая и последняя доза (например, из упаковки для множества доз, содержащей множество доз фармацевтической композиции) являются по существу однородными.
В некоторых вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция содержит кортикостероид, который легко диспергируется по всей композиции при перемешивании (например, слабом или умеренном перемешивании). В определенных вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция содержит кортикостероид, который легко диспергируется по всей композиции при слабом или умеренном перемешивании после хранения. В некоторых вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция содержит кортикостероид, который легко ресуспендируется в композиции при слабом или умеренном перемешивании. В определенных вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция содержит кортикостероид, который легко ресуспендируется в композиции при слабом или умеренном перемешивании после хранения. В некоторых вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция содержит кортикостероид, который легко диспергируется по всей композиции при слабом или умеренном перемешивании. В определенных вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция содержит кортикостероид, который легко диспергируется по всей композиции при слабом или умеренном перемешивании после хранения. В определенных вариантах осуществления изобретения, представленные в описании композиции проявляют способность легко ресуспендироваться и/или легко вновь диспергироваться после хранения в условиях окружающей среды. В других вариантах осуществления изобретения, хранение происходит в условиях инертной атмосферы, повышенной температуры и/или повышенной относительной влажности. В определенных вариантах осуществления изобретения, представленные в описании композиции проявляют способность легко ресуспендироваться и/или легко вновь диспергироваться после хранения в течение, в качестве неограничивающего примера, 1 дня, 2 дней, 3 дней, 1 недели, 2 недель, 3 недель, 1 месяца, 3 месяцев, 6 месяцев, 1 года, 2 лет или в течение срока годности препарата.
В определенных вариантах осуществления изобретения, представленная в описании фармацевтическая композиция не слеживается или не агрегирует в течение или после хранения (например, кортикостероид не осаждается и не образует твердый комок или не расплавляется).
В некоторых вариантах осуществления изобретения, представленной в описании фармацевтической композицией является дисперсия, суспензия или раствор. В определенных вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция представляет собой раствор, за исключением того, что по существу весь кортикостероид диспергируется или суспендируется в виде частиц в растворе (например, менее чем приблизительно 36 мкг будесонида находится в растворе). В некоторых вариантах осуществления изобретения, по меньшей мере, один эксципиент не увеличивает растворимость кортикостероида в жидком носителе.
В определенных вариантах осуществления изобретения, представленная в описании фармацевтическая композиция является неньютоновской текучей средой. В некоторых вариантах осуществления изобретения, неньютоновскую текучую среду выбирают, в качестве неограничивающего примера, из пластического материала, псевдопластического материала и дилатантной жидкости. В определенных вариантах осуществления изобретения, неньютоновской текучей средой является псевдопластический материал. В некоторых вариантах осуществления изобретения, неньютоновская текучая среда является тиксотропной.
В определенных вариантах осуществления изобретения, кортикостероид проявляет местную активность (например, местную активность на поверхности желудочно-кишечного тракта, такой как поверхность пищевода). В некоторых вариантах осуществления изобретения, кортикостероидом является будесонид. В других вариантах осуществления изобретения, кортикостероидом является флутиказона пропионат. В некоторых вариантах осуществления изобретения, кортикостероид представляет собой частицу (например, микрочастицу или наночастицу).
В определенных вариантах осуществления изобретения, дополнительный эксципиент выбирают, в качестве неограничивающего примера, из целлюлозы (включая ее производные), одного или более мальтодекстрина, декстрозы, гидроксиэтилцеллюлозы (НЕС), гидроксипропилметилцеллюлозы (НРМС), карбоксиметилцеллюлозы (СМС), микрокристаллической целлюлозы (МСС), карбомера и их комбинаций. В более специфичных вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает гидроксиэтилцеллюлозу (НЕС), гидроксипропилметилцеллюлозу (НРМС), карбоксиметилцеллюлозу (СМС), микрокристаллическую целлюлозу (МСС), карбомер и их комбинации, и, по меньшей мере, один дополнительный эксципиент присутствует в фармацевтической композиции в количестве приблизительно от 5 мг/мл до 100 мг/мл. В некоторых специфичных вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает, в качестве неограничивающего примера, мальтодекстрин, декстрозу и их комбинации, и, по меньшей мере, один дополнительный эксципиент присутствует в количестве приблизительно от 1 мг/мл до 1,5 г/мл.
В определенных вариантах осуществления изобретения, жидкий носитель включает водную среду.
В некоторых вариантах осуществления изобретения, представленная в описании фармацевтическая композиция содержит частицы кортикостероида, суспендированные в водной среде. В определенных вариантах осуществления изобретения, частицы кортикостероида представляют собой микрочастицы со средним диаметром, в качестве неограничивающего примера, приблизительно от 0,1 микрона до 50 микрон. В некоторых вариантах осуществления изобретения, по меньшей мере, 95%, по меньшей мере, 97%, по меньшей мере, 98% или, по меньшей мере, 99% частиц кортикостероида являются микрочастицами с диаметром менее чем приблизительно 10 микрон.
В определенных вариантах осуществления изобретения, изобретение предоставляет фармацевтическую композицию, где кортикостероид присутствует в количестве приблизительно от 0,01 мг/мл до 1 мг/мл. В определенных вариантах осуществления изобретения, фармацевтическая композиция имеет общий объем приблизительно от 1 мл до 20 мл, приблизительно от 1 мл до 10 мл, приблизительно от 1 мл до 15 мл или приблизительно от 3 мл до 7 мл, приблизительно 5 мл, приблизительно 10 мл, приблизительно 15 мл, или приблизительно 20 мл. В специфичных вариантах осуществления изобретения, представленная в описании фармацевтическая композиция включает приблизительно от 0,1 мг до 5 мг, приблизительно от 0,25 мг до 5 мг, приблизительно от 0,3 до 2 мг или приблизительно от 0,5 мг до 5 мг.
В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает СМС, и СМС содержится в фармацевтической композиции в количестве приблизительно от 5 мг/мл до 30 мг/мл. В определенных вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает карбомер, и карбомер содержится в фармацевтической композиции в количестве приблизительно от 5 мг/мл до 100 мг/мл. В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает НРМС, и НРМС содержится в фармацевтической композиции в количестве приблизительно от 5 мг/мл до 30 мг/мл. В определенных вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает МСС, и МСС содержится в фармацевтической композиции в количестве приблизительно от 5 мг/мл до 30 мг/мл. В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает комбинацию СМС и МСС, и комбинация СМС-МСС содержится в фармацевтической композиции в количестве приблизительно от 5 мг/мл до 40 мг/мл, и где массовое отношение смешанной комбинации СМС/МСС составляет приблизительно 11/89. В специфичных вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает декстрозу, и декстроза содержится в фармацевтической композиции в количестве приблизительно от 10 мг/мл до 1 г/мл. В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает мальтодекстрин, и мальтодекстрин содержится в фармацевтической композиции в количестве приблизительно от 10 мг/мл до 1 г/мл.
В определенных вариантах осуществления изобретения, эдетат содержится в фармацевтической композиции в количестве приблизительно от 0,05 мг/мл до 25 мг/мл. В некоторых вариантах осуществления изобретения, цитрат содержится в фармацевтической композиции в количестве приблизительно от 0,1 мг/мл до 30 мг/мл. В специфичных вариантах осуществления изобретения, полисорбат 80 содержится в фармацевтической композиции в количестве приблизительно от 0,05 мг/мл до 1 мг/мл.
В других или альтернативных вариантах осуществления изобретения, изобретение предоставляет фармацевтическую композицию, содержащую:
a. будесонид в количестве приблизительно от 0,02 мг/мл до 0,75 мг/мл,
b. эдетат в количестве приблизительно от 0,05 мг/мл до 25 мг/мл,
c. цитрат в количестве приблизительно от 0,1 мг/мл до 30 мг/мл,
d. полисорбат 80 в количестве приблизительно от 0,05 мг/мл до 1 мг/мл,
e. консервант,
f. ароматизирующее средство, подсластитель или их комбинацию,
g. по меньшей мере, один дополнительный эксципиент, и
h. водный жидкий носитель.
В других или альтернативных вариантах осуществления изобретения, изобретение предоставляет фармацевтическую композицию, содержащую:
a. будесонид в количестве приблизительно от 0,05 мг/мл до 0,75 мг/мл,
b. эдетат в количестве приблизительно от 0,05 мг/мл до 25 мг/мл,
c. цитрат в количестве приблизительно от 0,1 мг/мл до 30 мг/мл,
d. полисорбат 80 в количестве приблизительно от 0,05 мг/мл до 1 мг/мл,
e. консервант,
f. ароматизирующее средство, подсластитель или их комбинацию,
g. по меньшей мере, один дополнительный эксципиент, и
h. водный жидкий носитель.
В других или альтернативных вариантах осуществления изобретения, изобретение предоставляет фармацевтическую композицию, содержащую:
a. будесонид в количестве приблизительно от 0,1 мг/мл до 0,75 мг/мл,
b. эдетат в количестве приблизительно от 0,05 мг/мл до 25 мг/мл,
c. цитрат в количестве приблизительно от 0,1 мг/мл до 30 мг/мл,
d. полисорбат 80 в количестве приблизительно от 0,05 мг/мл до 1 мг/мл,
e. консервант,
f. ароматизирующее средство, подсластитель или их комбинацию,
g. по меньшей мере, один дополнительный эксципиент, и
h. водный жидкий носитель.
В специфичных вариантах осуществления изобретения, представленная в описании фармацевтическая композиция имеет общий объем приблизительно от 1 мл до 20 мл.
Определенные варианты осуществления изобретения, представленные в описании, предоставляют фармацевтическую композицию, которая включает физически и химически стабильную композицию, содержащую:
a. терапевтически эффективное количество кортикостероида,
b. консервант,
c. буфер,
d. поверхностно-активное вещество или сурфактант,
e. необязательный консервант,
f. необязательное ароматизирующее средство,
g. необязательный подсластитель,
h. по меньшей мере, один дополнительный эксципиент, и
i. жидкий носитель.
В некоторых вариантах осуществления изобретения, представленная в описании фармацевтическая композиция является подходящей для однократного или многодозового введения. В определенных вариантах осуществления изобретения, представленная в описании фармацевтическая композиция находится в упаковке для множества доз, содержащей множество единичных доз. В некоторых вариантах осуществления изобретения, представленная в описании композиция остается по существу однородной после хранения. В определенных вариантах осуществления изобретения, представленная в описании фармацевтическая композиция остается по существу однородной после хранения в течение срока годности препарата. В некоторых вариантах осуществления изобретения, представленная в описании фармацевтическая композиция имеет твердую, полутвердую, гелеподобную, кремоподобную, мазеподобную, мажущую, жидкотекучую или пастообразную консистенцию. В определенных вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция приобретает или восстанавливает значительную однородность при слабом или умеренном перемешивании, вихревом перемешивании, легком вихревом перемешивании или при встряхивании. В некоторых вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция приобретает или восстанавливает значительную однородность при слабом или умеренном перемешивании, вихревом перемешивании, легком вихревом перемешивании или при встряхивании. В определенных вариантах осуществления изобретения, после слабого или умеренного перемешивания, вихревого перемешивания, легкого вихревого перемешивания или после встряхивания, описанная в изобретении фармацевтическая композиция остается по существу однородной в течение подходящего периода времени, включающего, в качестве неограничивающего примера, по меньшей мере, 1, 2, 4, 6, 12, 18 или 24 часа, или 2, 3, 4, 5 или более дней.
В определенных вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция представляет собой препарат, содержащий множество доз. В определенных вариантах осуществления изобретения, каждая доза (например, из упаковки для множества доз, содержащей множество доз фармацевтической композиции) препарата является по существу однородной относительно одна другой дозе. В некоторых вариантах осуществления изобретения, первая и последняя доза (например, из упаковки для множества доз, содержащей множество доз фармацевтической композиции) являются по существу однородными.
В некоторых вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция содержит кортикостероид, который легко диспергируется по всей композиции при перемешивании (например, слабом или умеренном перемешивании). В определенных вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция содержит кортикостероид, который легко диспергируется по всей композиции при слабом или умеренном перемешивании после хранения. В некоторых вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция содержит кортикостероид, который легко ресуспендируется в композиции при слабом или умеренном перемешивании. В определенных вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция содержит кортикостероид, который легко ресуспендируется в композиции при слабом или умеренном перемешивании после хранения. В некоторых вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция содержит кортикостероид, который легко диспергируется по всей композиции при слабом или умеренном перемешивании. В определенных вариантах осуществления изобретения, описанная в изобретении фармацевтическая композиция содержит кортикостероид, который легко диспергируется по всей композиции при слабом или умеренном перемешивании после хранения. В определенных вариантах осуществления изобретения, представленные в описании композиции проявляют способность легко ресуспендироваться и/или легко вновь диспергироваться после хранения в условиях окружающей среды. В других вариантах осуществления изобретения, хранение происходит в условиях инертной атмосферы, повышенной температуры и/или повышенной относительной влажности. В определенных вариантах осуществления изобретения, представленные в описании композиции проявляют способность легко ресуспендироваться и/или легко вновь диспергироваться после хранения в течение, в качестве неограничивающего примера, 1 дня, 2 дней, 3 дней, 1 недели, 2 недель, 3 недель, 1 месяца, 3 месяцев, 6 месяцев, 1 года, 2 лет или в течение срока годности препарата.
В определенных вариантах осуществления изобретения, представленная в описании фармацевтическая композиция не слеживается или не агрегирует в течение или после хранения (например, кортикостероид не осаждается и не образует твердый комок или не расплавляется).
В некоторых вариантах осуществления изобретения, представленная в описании фармацевтическая композиция представляет собой дисперсию, суспензию или раствор. В определенных вариантах осуществления изобретения, представленной в описании фармацевтической композицией является раствор, за исключением того, что по существу весь кортикостероид диспергируется или суспендируется в виде частиц в растворе (например, менее чем приблизительно 36 мкг будесонида находится в растворе). В некоторых вариантах осуществления изобретения, по меньшей мере, один эксципиент не увеличивает растворимость кортикостероида в жидком носителе.
В определенных вариантах осуществления изобретения, представленная в описании фармацевтическая композиция является неньютоновской текучей средой. В некоторых вариантах осуществления изобретения, неньютоновскую текучую среду выбирают, в качестве неограничивающего примера, из пластического материала, псевдопластического материала и дилатантной жидкости. В специфичных вариантах осуществления изобретения, неньютоновской текучей средой является псевдопластический материал. В некоторых вариантах осуществления изобретения, неньютоновская текучая среда является тиксотропной.
В определенных вариантах осуществления изобретения, кортикостероид проявляет местную активность (например, местную активность на поверхности пищевода). В некоторых вариантах осуществления изобретения, кортикостероидом является будесонид. В других вариантах осуществления изобретения, кортикостероидом является флутиказона пропионат. В некоторых вариантах осуществления изобретения, кортикостероид представляет собой частицу (например, микрочастицу или наночастицу).
В определенных вариантах осуществления изобретения, дополнительный эксципиент выбирают, в качестве неограничивающего примера, из мальтодекстрина, декстрозы, гидроксиэтилцеллюлозы (НЕС), гидроксипропилметилцеллюлозы (НРМС), карбоксиметилцеллюлозы (СМС), микрокристаллической целлюлозы (МСС), карбомера и их комбинаций. В более специфичных вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает гидроксиэтилцеллюлозу (НЕС), гидроксипропилметилцеллюлозу (НРМС), карбоксиметилцеллюлозу (СМС), микрокристаллическую целлюлозу (МСС), карбомер и их комбинации, и, по меньшей мере, один дополнительный эксципиент присутствует в фармацевтической композиции в количестве приблизительно от 5 мг/мл до 100 мг/мл. В некоторых специфических вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает, в качестве неограничивающего примера, мальтодекстрин, декстрозу и их комбинации, и, по меньшей мере, один дополнительный эксципиент присутствует в количестве приблизительно от 1 мг/мл до 1,5 г/мл.
В определенных вариантах осуществления изобретения, жидкий носитель включает водную среду.
В некоторых вариантах осуществления изобретения, представленная в описании фармацевтическая композиция содержит частицы кортикостероида, суспендированные в водной среде. В специфичных вариантах осуществления изобретения, частицы кортикостероида представляют собой микрочастицы со средним диаметром, в качестве неограничивающего примера, приблизительно от 0,1 микрона до 50 микрон. В некоторых вариантах осуществления изобретения, по меньшей мере, 95%, по меньшей мере, 97%, по меньшей мере, 98% или, по меньшей мере, 99% частиц кортикостероида являются микрочастицами с диаметром менее чем приблизительно 10 микрон.
В определенных вариантах осуществления изобретения, изобретение предоставляет фармацевтическую композицию, где кортикостероид присутствует в количестве приблизительно от 0,01 мг/мл до 1 мг/мл. В определенных вариантах осуществления изобретения, фармацевтическая композиция имеет общий объем приблизительно от 1 мл до 20 мл, приблизительно от 1 мл до 10 мл, или приблизительно от 3 мл до 7 мл, приблизительно 5 мл, приблизительно 10 мл. В специфичных вариантах осуществления изобретения, представленная в описании фармацевтическая композиция включает приблизительно от 0,25 мг до 5 мг, приблизительно от 0,3 до 2 мг или приблизительно от 0,5 мг до 5 мг.
В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает СМС, и СМС содержится в фармацевтической композиции в количестве приблизительно от 5 мг/мл до 30 мг/мл. В определенных вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает карбомер, и карбомер содержится в фармацевтической композиции в количестве приблизительно от 5 мг/мл до 100 мг/мл. В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает НРМС, и НРМС содержится в фармацевтической композиции в количестве приблизительно от 5 мг/мл до 30 мг/мл. В определенных вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает МСС, и МСС содержится в фармацевтической композиции в количестве приблизительно от 5 мг/мл до 30 мг/мл. В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает комбинацию СМС и МСС, и комбинация СМС-МСС содержится в фармацевтической композиции в количестве приблизительно от 5 мг/мл до 40 мг/мл, и где массовое отношение смешанных компонентов СМС/МСС составляет приблизительно 11/89. В определенных вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает декстрозу, и декстроза содержится в фармацевтической композиции в количестве приблизительно от 10 мг/мл до 1 г/мл. В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает мальтодекстрин, и мальтодекстрин присутствует в фармацевтической композиции в количестве приблизительно от 10 мг/мл до 1 г/мл.
В определенных вариантах осуществления изобретения, представленная в описании фармацевтическая композиция имеет вязкость такую, что при пероральном введении индивидууму единичной дозы фармацевтической композиции, фармацевтическая композиция, по меньшей мере, частично обволакивает пищевод и местно доставляет терапевтически эффективное количество кортикостероида к пищеводу. В некоторых вариантах осуществления изобретения, представленная в описании любая фармацевтическая композиция проявляет мукоадгезивное свойство, которое проявляется в том, что при пероральном введении единичной дозы фармацевтической композиции индивидууму, фармацевтическая композиция “прилипает” к поверхности желудочно-кишечного тракта (например, к слизистой оболочке и/или эпителию желудочно-кишечного тракта или к отдельному отделу желудочно-кишечного тракта, такому как пищевод) индивидуума в течение времени, достаточного для местной доставки терапевтически эффективного количества кортикостероида к пищеводу.
В определенных вариантах осуществления изобретения, изобретение предоставляет способ лечения, предотвращения или ослабления воспаления или симптомов, связанных с воспалением желудочно-кишечного тракта, включающий пероральное введение индивидууму любой фармацевтической композиции, представленной в описании.
В определенных вариантах осуществления изобретения, предоставленный изобретением способ включает введение приблизительно от 0,1 мг до 20 мг, или приблизительно от 0,3 мг до 4 мг, или приблизительно от 0,25 мг до 5 мг кортикостероида в день.
В определенных вариантах осуществления изобретения, воспаление желудочно-кишечного тракта является воспалением пищевода. В определенных вариантах осуществления изобретения, введение представленной в описании фармацевтической композиции осуществляется индивидууму, у которого обнаружен эозинофильный эзофагит, воспалительное заболевание кишечника, вовлекающее пищевод, болезнь Крона, глютеиновая болезнь, патология проксимальных отделов желудочно-кишечного тракта (например, у индивидуумов, страдающих от гипофункции желчного пузыря), эозинофильное воспалительное заболевание желудочно-кишечного тракта, эозинофильный дуоденит, дуоденальная эозинофилия, функциональная диспепсия, промежуточный эзофагит, воспаление пищевода после введения внутрь разъедающего/раздражающего слизистые оболочки вещества, стойкие/рецидивирующие стриктуры пищевода по какой-либо причине и включающие действие веществ, разъедающих/раздражающих слизистые оболочки, вызванный таблетками эзофагит, системные заболевания, врожденные заболевания, послеоперационное воспаление, гиперплазия эпителия, базальноклеточная гиперплазия, удлиненные сосочки языка, расширенные сосуды в сосочках языка, грибковый эзофагит (например, кандида, turolopsis, гистоплазма Aspergillus, и т.д.), вирусный эзофагит (например, HSV, CMV, V2V), бактериальный эзофагит (например, туберкулез, актиномикоз, сифилис), коррозивный эзофагит, радиационный эзофагит, эзофагит вследствие введения химиотерапевтических средств, реакция “трансплантат против хозяина”, кожное заболевание с поражением пищевода (например, буллезный пемфигоид, обыкновенная пузырчатка, врожденный буллезный эпидермолиз, злокачественная экссудативная эритема), болезнь Бехчета, саркоидоз, идиопатический эзофагит, эозинофильный гастрит, гигантский гипертрофический гастрит, паразитический гастрит, лимфоцитарный эзофагит, эзофагит, ассоциированный с заболеванием кишечника или гастроэнтерит. В специфичных вариантах осуществления изобретения, индивидуум страдает от эозинофильного эзофагита. В некоторых специфичных вариантах осуществления изобретения, у индивидуума была обнаружена гастроэзофагеальная рефлюксная болезнь (GERD), неэрозивная рефлюксная болезнь (NERD) или эрозивный эзофагит. В некоторых вариантах осуществления изобретения, воспалением желудочно-кишечного тракта является воспаление желудка и/или тонких кишок, например, гастроэнтерит.
В определенных вариантах осуществления изобретения, индивидуумом, которому вводят фармацевтическую композицию с целью лечения, предотвращения или ослабления воспаления или симптомов, ассоциированных с воспалением желудочно-кишечного тракта, является ребенок или младенец. В различных вариантах осуществления изобретения, ребенку или младенцу менее чем 16 лет, менее чем 12 лет, менее чем 8 лет, менее чем 6 лет, менее чем 4 года или менее чем 2 года.
В некоторых вариантах осуществления изобретения, изобретение предоставляет набор, включающий упаковку для множества доз и множество единичных доз фармацевтической композиции (например, любой представленной в описании фармацевтической композиции). В определенных вариантах осуществления изобретения, каждая единичная доза фармацевтической композиции включает:
a. терапевтически эффективное количество кортикостероида,
b. эдетат,
c. цитрат,
d. полисорбат 80,
e. необязательный консервант,
f. необязательное ароматизирующее средство,
g. необязательный подсластитель,
h. по меньшей мере, один дополнительный эксципиент, и
i. жидкий носитель.
В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает мальтодекстрин, декстрозу, гидроксиэтилцеллюлозу (НЕС), гидроксипропилметилцеллюлозу (НРМС), карбоксиметилцеллюлозу (СМС), микрокристаллическую целлюлозу (МСС), карбомер и их комбинации.
В определенных вариантах осуществления изобретения, предоставленный изобретением набор включает стабильную фармацевтическую композицию, которая является физически и химически стабильной. В некоторых вариантах осуществления изобретения, предоставленный изобретением набор включает, в качестве неограничивающего примера, приблизительно от 10 до 60, приблизительно 14, или приблизительно 30 доз фармацевтической композиции. В определенных вариантах осуществления изобретения, представленный в описании набор включает, в качестве неограничивающего примера, приблизительно от 50 мл до 500 мл, приблизительно 150 мл, приблизительно 330 мл, или приблизительно 55 мл стабильной фармацевтической композиции. В некоторых вариантах осуществления изобретения, любой набор, представленный в описании, также содержит дозирующее устройство (например, ложку, чашку, насос или тому подобное) для введения композиции индивидууму. В различных вариантах осуществления изобретения, дозирующее устройство включено в упаковку для множества доз или находится отдельно от такой упаковки.
Включение в описание изобретения сведений путем ссылки
Все публикации и заявки на патенты, представленные в описании, включены в него посредством ссылки в такой степени, как если бы каждая индивидуальная публикация или заявка на патент отдельно и индивидуально была предназначена для включения посредством ссылки.
Краткое описание чертежей
Новые характеристики изобретения представлены подробно в прилагаемой формуле изобретения. Лучшее понимание характеристик и преимуществ настоящего изобретения будет достигнуто путем отсылки к следующему подробному описанию, которое отражает иллюстративные варианты осуществления изобретения, в которых принципы изобретения использованы, и к сопутствующим рисункам, где:
Фигура 1 иллюстрирует количество композиции в процентах, присутствующее в пищеводе, как функция времени после перорального введения (при измерении количества радиоактивной метки, присутствующей в пищеводе).
Подробное описание изобретения
В определенных вариантах осуществления изобретения, предоставлены композиции и способы лечения, предотвращения или ослабления воспаления или симптомов, связанных с воспалением желудочно-кишечного тракта, включая пищевод, желудок и/или пищеварительный тракт. Изобретением предоставлены способы лечения, предотвращения или ослабления, например, воспаления пищевода у индивидуума. В определенных вариантах осуществления изобретения, указанные способы включают пероральное введение указанному индивидууму кортикостероида в комбинации, по меньшей мере, с одним эксципиентом.
В некоторых вариантах осуществления изобретения, предоставлена композиция, содержащая кортикостероид, декстрозу, мальтодекстрин, эдетат, цитрат, полисорбат 80, необязательный консервант, необязательное ароматизирующее вещество, по меньшей мере, один дополнительный эксципиент и жидкий носитель. В специфичных вариантах осуществления изобретения, композиция содержит консервант. В других или альтернативных вариантах осуществления изобретения, композиция содержит ароматизирующее вещество. В других или альтернативных вариантах осуществления изобретения, жидким носителем является водный носитель (например, вода), или жидкий носитель включает водную среду. В других вариантах осуществления изобретения, изобретение предусматривает способ лечения, предотвращения или ослабление воспаления или симптомов, связанных с воспалением желудочно-кишечного тракта, композицией. В определенных вариантах осуществления изобретения, предусмотренные изобретением способы включают пероральное введение индивидууму, по необходимости, композиции, содержащей кортикостероид, декстрозу, мальтодекстрин, эдета, цитрат, полисорбат 80, необязательный консервант, необязательное ароматизирующее средство, по меньшей мере, один дополнительный эксципиент и жидкий носитель. В специфичных вариантах осуществления изобретения, композиция содержит консервант. В других или альтернативных вариантах осуществления изобретения, композиция содержит ароматизирующее средство. В других или альтернативных вариантах осуществления изобретения, жидким носителем является водная среда (например, вода). В специфичных вариантах осуществления изобретения, представленная в описании фармацевтическая композиция является стабильной. В специфичных вариантах осуществления изобретения, фармацевтическая композиция является химически и/или физически стабильной.
У индивидуума, подходящего для лечения композициями, представленными в описании, может быть, например, выявлено заболевание или состояние, включающее, но не ограниченное ими, эозинофильный эзофагит, воспалительное заболевание кишечника, вовлекающее пищевод, болезнь Крона, глютеиновую болезнь, патологию проксимальных отделов желудочно-кишечного тракта (например, у индивидуумов, страдающих от гипофункции желчного пузыря), эозинофильное воспалительное заболевание желудочно-кишечного тракта, эозинофильный дуоденит, дуоденальную эозинофилию, функциональную диспепсию, промежуточный эзофагит, гиперплазию эпителия, базальноклеточную гиперплазию, удлиненные сосочки языка, расширенные сосуды в сосочках языка, грибковый эзофагит (например, кандида, turolopsis, гистоплазма Aspergillus, и т.д.), вирусный эзофагит (например, HSV, CMV, V2V), бактериальный эзофагит (например, туберкулез, актиномикоз, сифилис), коррозивный эзофагит, радиационный эзофагит, эзофагит вследствие введения химиотерапевтических средств, реакцию “трансплантат против хозяина”, кожное заболевание с поражением пищевода (например, буллезный пемфигоид, обыкновенная пузырчатка, врожденный буллезный эпидермолиз, злокачественная экссудативная эритема), болезнь Бехчета, саркоидоз, идиопатический эзофагит, эозинофильный гастрит, гигантский гипертрофический гастрит, паразитический гастрит, лимфоцитарный эзофагит, эзофагит, ассоциированный с заболеванием кишечника, воспаление пищевода после введения внутрь разъедающего/раздражающего слизистые оболочки вещества, стойкие/рецидивирующие стриктуры пищевода по какой-либо причине и включающие действие веществ, разъедающих/раздражающих слизистые оболочки, вызванный таблетками эзофагит, системные заболевания, врожденные заболевания, послеоперационное воспаление или гастроэнтерит. Композиция также может быть использована в лечении индивидуумов с другими выявленными желудочно-кишечными расстройствами, включающими язвы желудка и двенадцатиперстной кишки, нарушения, ассоциированные с выбросом больших количеств соляной кислоты, такие как синдром Золлингера-Эллисона и ларингеальные расстройства. В некоторых вариантах осуществления изобретения, композиции или способы, представленные в описании, используют в способах лечения индивидуумов с другими выявленными желудочно-кишечными расстройствами, включающими, в качестве неограничивающего примера, пищевод Барретта, гастроэзофагеальную рефлюксную болезнь (GERD), неэрозивную рефлюксную болезнь (NERD) или эрозивный эзофагит. В некоторых вариантах осуществления изобретения, способы лечения, предотвращения или ослабления воспаления или симптомов воспаления включают способы лечения любого из желудочно-кишечных нарушений, предусмотренных в изобретении. В определенных вариантах осуществления изобретения, указанные способы включают пероральное введение индивидууму композиций, содержащих кортикостероид, представленных в описании.
В изобретении предусмотрены способы лечения, предотвращения и ослабления любого хронического воспалительного или злокачественного состояния, которое поражает желудочно-кишечный тракт, такой как пищевод, и реагирует на терапию стероидами. Способы и композиции согласно настоящему изобретению пригодны, например, для лечения, предотвращения и ослабления воспаления и/или симптомов воспаления, ассоциированных с эозинофильным эзофагитом, воспалительным заболеванием кишечника, поражающим пищевод, болезнью Крона, глютеиновой болезнью, патологией проксимальных отделов желудочно-кишечного тракта (например, у индивидуумов, страдающих от гипофункции желчного пузыря), эозинофильным воспалительным заболеванием желудочно-кишечного тракта, эозинофильным дуоденитом, дуоденальной эозинофилией, функциональной диспепсией, промежуточным эзофагиом, гиперплазией эпителия, базальноклеточной гиперплазией, удлиненными сосочамии языка, расширенными сосудами в сосочках языка, грибковым эзофагитом (например, кандида, turolopsis, гистоплазма Aspergillus, и т.д.), вирусным эзофагитом (например, HSV, CMV, V2V), бактериальным эзофагитом (например, туберкулез, актиномикоз, сифилис), коррозивным эзофагитом, радиационным эзофагитом, эзофагитом вследствие введения химиотерапевтических средств, обструкцией привратника желудка и родственным воспалением, реакцией “трансплантат против хозяина”, кожным заболеванием с поражением пищевода (например, буллезный пемфигоид, обыкновенная пузырчатка, врожденный буллезный эпидермолиз, злокачественная экссудативная эритема), болезнью Бехчета, саркоидозом, идиопатическим эзофагитом, эозинофильным гастритом, гигантским гипертрофическим гастритом, паразитическим гастритом, лимфоцитарным эзофагитом, эзофагитом, ассоциированным с заболеванием кишечника, воспалением пищевода после введения внутрь разъедающего/раздражающего слизистые оболочки вещества, стойкими/рецидивирующими стриктурами пищевода, возникающими по какой-либо причине и включающими действие веществ, разъедающих/раздражающих слизистые оболочки, вызванным таблетками эзофагитом, системными заболеваниями, врожденными заболеваниями, послеоперационным воспалением или гастроэнтеритом. Способы настоящего изобретения также пригодны для лечения, предотвращения или ослабления симптомов и/или воспаления, ассоциированного с другими заболеваниями или состояниями желудочно-кишечного тракта, например, верхних отделов желудочно-кишечного тракта, где благоприятным оказывается воздействие на отдельный участок мишени, а не системная терапия. Также в изобретении предусмотрена фармацевтическая композиция, пригодная в способах настоящей заявки. Как употребляют в описании, воспаление и/или симптомы, ассоциированные с нарушением или заболеванием, представленным в описании, включает воспаление и/или симптомы, ассоциированные с нарушением или заболеванием, вызванные и/или являющиеся результатом нарушения или заболевания. В некоторых вариантах осуществления изобретения, предусмотрен способ снижения высвобождения цитокинов и/или хемокинов в желудочно-кишечном тракте, таком как пищевод (например, в его слизистой оболочке или эпителии) путем введения композиции, представленной в описании, в желудочно-кишечный тракт (например, пищевод). В определенных вариантах осуществления изобретения, предусмотрен способ снижения миграции эозинофилов к желудочно-кишечному тракту (например, пищеводу) путем введения композиции, представленной в описании, в желудочно-кишечный тракт (например, пищевод).
В специфичных вариантах осуществления изобретения, предоставлена фармацевтическая композиция, включающая физически и химически стабильную композицию, содержащую: (а) терапевтически эффективное количество кортикостероида; (b) эдетат; (с) цитрат; (d) полисорбат 80; (е) консервант, ароматизирующее средство, подсластитель или их комбинацию; (f) по меньшей мере, один дополнительный эксципиент, и (g) жидкий носитель. В некоторых специфичных вариантах осуществления изобретения, фармацевтическая композиция, представленная в данном изобретении, пригодны для введения в виде одной или нескольких доз.В некоторых специфичных вариантах осуществления изобретения, предоставлена фармацевтическая композиция, включающая физически и химически стабильную композицию, содержащую: (а) терапевтически эффективное количество кортикостероида; (b) антиоксидант; (с) буфер; (d) поверхностно-активное вещество; (е) консервант, ароматизирующее средство, подсластитель или их комбинацию; (f) по меньшей мере, один дополнительный эксципиент, и (g) жидкий носитель. В специфичных вариантах осуществления изобретения, такие композиции являются подходящими для однократного или многодозового введения. В более специфичных вариантах осуществления изобретения, такие композиции включают ароматизирующее средство и/или подсластитель. В определенных специфичных вариантах осуществления изобретения, предоставлена фармацевтическая композиция, включающая физически и химически стабильную композицию, содержащую: (а) терапевтически эффективное количество кортикостероида; (b) необязательный антиоксидант; (с) необязательный буфер; (d) необязательное поверхностно-активное вещество; (е) необязательный консервант, (f) необязательное ароматизирующее средство; (g) необязательный подсластитель; (h) по меньшей мере, один дополнительный эксципиент, и (g) необязательный носитель (например, водный носитель). В специфичных вариантах осуществления изобретения, такие композиции являются подходящими для однократного или многодозового введения. В более специфичных вариантах осуществления изобретения, такие композиции включают ароматизирующее средство и/или подсластитель.
Как употребляют в описании, если не указано иное, использование единственного числа предполагает как единственное, так и множественное число. Как употребляют в описании, термин “индивидуум” включает любое животное. В некоторых вариантах осуществления изобретения, животным является млекопитающее. В специфичных вариантах осуществления изобретения, млекопитающим является человек. В специфичных вариантах осуществления изобретения, человеком является взрослый человек. В других вариантах осуществления изобретения, человеком является ребенок (например, ребенок менее 12 лет или ребенок менее 6 лет). В специфичных вариантах осуществления изобретения, человеком является младенец (новорожденный). Как употребляют в описании, фраза “способ лечения” или “способ, применяемый для лечения” может, в некоторых вариантах осуществления изобретения, охватывать способы предотвращения, уменьшения частоты заболеваний, предусматривающие профилактическую обработку, лечение и облегчение заболевания. Как употребляют в описании, фраза “эффективное количество” и “терапевтически эффективное количество” является количеством, достаточным для достижения изменения в симптомах воспаления или воспалении, ассоциированном с желудочно-кишечными нарушениями, включающими, но не ограничивающимися ими, воспаление пищевода, эозинофильный эзофагит, GERD, NERD или эрозивный эзофагит. Как употребляют в описании, термин “или” включает “и” и “или”.
Как употребляют в описании, фраза “лечение воспалительных заболеваний, поражающих пищевод” включает лечение симптомов таких заболеваний, и лечение воспаления, ассоциированного с заболеваниями.
Следует понимать, что любая композиция, представленная в описании, или способ, включающий введение композиции, представленной в описании, которая содержит соль или кислоту, включает раскрытие диссоциированной формы соли или кислоты. Например, если растворена, карбоксиметилцеллюлоза натрия может диссоциировать на ее натриевую катионную часть или части и соответствующую карбоксиметилцеллюлозную анионную часть.
Способы и композиции
В специфичных вариантах осуществления изобретения, кортикостероиды, используемые в настоящем изобретении, включают местные стероиды, включающие, например, будесонид или флутиказона пропионат. В некоторых вариантах осуществления изобретения, кортикостероиды выбирают, в качестве неограничивающего примера, из аклометазона, амциномида, беклометазона, бетаметазона, будесонида, циклезонида, клобетазола, клобетазона, клокортолона, клопреднолона, кортивазола, дефлазакорта, дезоксикортикостерона, дезонида, дезоксиметазона, дексаметазона, дифлоразона, дифлюкортолона, дифлюпредната, флуклоролона, флудрокортизона, флудроксикортида, флуметазона, флунизолида, флуоцинолона ацетонида, флуоцинонида, флуокортина, флуокортолона, флуорометолона, флуперолона, флутиказона, фупреднидена, формакортала, халцинонида, халометазона, гидрокортизона ацепоната, гидрокортизона бутепрата, гидрокортизона бутирата, лотепреднола, медризона, мепреднизона, метилпреднизолона, метилпреднизолона ацепоната, мометазона фуроата, параметазона, предникарбата, преднизона, преднизолона, преднилидена, ремексолона, тиксокортола, триамцинолона и улобетазола и их комбинаций, их фармацевтически приемлемых солей и сложных эфиров. В специфичном варианте осуществления изобретения, кортикостероидом является бутесонид. В другом варианте осуществления изобретения, кортикостероидом является сложный эфир флутиказона, например, пропионат флутиказона.
Предусмотренными в изобретении являются способы и фармацевтические композиции для лечения, предотвращения или ослабления симптомов воспаления и воспаления, ассоциированного с воспалительными заболеваниями желудочно-кишечного тракта, включающего, но не ограниченного ими, верхние отделы желудочно-кишечного тракта (например, пищевод).
В определенных вариантах осуществления изобретения, кортикостероид (например, бутесонид или флутиказона пропионат), который вводят перорально, доставляется к пищеводу в эффективной дозе для снижения воспаления пищевода.
В одном аспекте, примером кортикостероида является бутесонид, 16,17-(бутилиденбис(окси))-11,21-дигидрокси-, (1l-β,16-α)-прегна-l,4-диен-3,20-дион или флутиказона пропионат, S-(фторметил)6α,9-дифтор-11β-17-дигидрокси-16α-метил-3-оксоандроста-1,4-диен-17β-карботионат, 17 пропионат или (6α,11β,16α,17β)-6,9-дифтор-11-гидрокси-16-метил-3-оксо-17-(1-оксопропокси)андроста-1,4-диен-17-тиокарбоновой кислоты S-(фторметиловый) сложный эфир.
В определенных вариантах осуществления изобретения, кортикостероид(ы), используемый в изобретении, применяют в виде частиц (например, частиц кортикостероида, суспендированных или диспергированных в водной среде). В специфических вариантах осуществления изобретения, частицами являются микрочастицы. В некоторых вариантах осуществления изобретения, микрочастицы имеют средний диаметр приблизительно от 0,1 микрона до 50 микрон. В специфичных вариантах осуществления изобретения, микрочастицы имеют средний диаметр приблизительно от 1 микрона до 20 микрон. В определенных вариантах осуществления изобретения, по меньшей мере, 95%, по меньшей мере, 98% или, по меньшей мере, 99% микрочастиц имеют диаметр менее чем 10 микрон.
В некоторых вариантах осуществления изобретения, композиция или препарат, представленный в описании, содержит менее чем 50% масс./масс., менее чем 40% масс./масс., менее чем 30% масс./масс., менее чем 20% масс./масс., менее чем 10% масс./масс., менее чем 8% масс./масс., менее чем 6% масс./масс., менее чем 5% масс./масс., менее чем 4% масс./масс., менее чем 3% масс./масс., менее чем 2% масс./масс., или приблизительно 2% масс./масс., менее чем 1% масс./масс., менее чем 0,5% масс./масс., менее чем 0,3% масс./масс., менее чем 0,2% масс./масс., или приблизительно 0,2% масс./масс. нерастворенных частиц. В специфичных вариантах осуществления изобретения, композиция или препарат, представленный в описании, по существу свободен от частиц, отличных от кортикостероида.
В некоторых вариантах осуществления изобретения, активный кортикостероид, представленный в описании, заменен другим активным средством. В специфичных вариантах осуществления изобретения, активным средством является терапевтическое средство, которое нацелено на пищевод, например, для лечения воспаления пищевода, мукозита, рака пищевода, инфекций (например, бактериальных или грибковых инфекций) пищевода, ран и/или травм пищевода, или тому подобное. В некоторых вариантах осуществления изобретения, активным средством является терапевтическое средство, которое оказывает физиологическое действие путем всасывания через пищевод. В специфичных вариантах осуществления изобретения, терапевтическое средство, которое системно всасывается через пищевод, представляет собой средство, деградирующее или теряющее эффективность, отчасти в желудке, например, терапевтический пептид.
В определенных вариантах осуществления изобретения, фармацевтическая композиция, представленная в описании и используемая в изобретении, содержит один или более эксципиентов и/или одно или более дополнительные средства. Эксципиенты, применяемые в изобретении, включают, в качестве неограничивающего примера, мукоадгезивные средства, средства, увеличивающие вязкость, связывающие вещества, эксципиенты (например, кукурузный крахмал), лубриканты, растворители, суспендирующие средства, ароматизирующие средства, красители, подсластители, консерванты, антиоксиданты, буферные средства, смачивающие средства, хелатирующие средства, поверхностно-активные вещества и тому подобное. Как употребляют в описании, мукоадгезивным средством является средство, которое прилипает к желудочно-кишечной поверхности (например, либо по-отдельности, либо и к эпителию и слизистой оболочке желудочно-кишечного тракта).
Дополнительными эксципиентами являются эксципиенты, представленные в описании, и их используют в любых подходящих количествах, например, как предусмотрено в изобретении. Антиоксиданты, буферные средства и поверхностно-активные вещества используют в подходящих количествах. В специфичных вариантах осуществления изобретения, фармацевтическая композиция, предусмотренная в изобретении, является стабильной. В специфичных вариантах осуществления изобретения, фармацевтическая композиция является химически и/или физически стабильной.
Предусмотренными в определенных вариантах осуществления изобретения являются композиции или препараты, содержащие кортикостероид (например, бутесонид или флутиказона пропионат), один или более эксципиент, который повышает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, средство, которое увеличивает вязкость, мукоадгезивное свойство, адсорбцию к слою слизистой оболочки и/или поглощение активного ингредиента через поверхностный слой), необязательно одно или более связывающее средство, необязательно один или более эксципиент, необязательно один или более лубрикант, необязательно один или более растворитель, необязательно одно или более суспендирующее средство, необязательно одно или более ароматизирующее средство, необязательно один или более краситель, необязательно один или более подсластитель, необязательно один или более консервант, необязательно один или более антиоксидант, необязательно одно или более буферное вещество, необязательно одно или более смачивающее средство, необязательно одно или более хелатирующее средство и необязательно одно или более поверхностно-активное вещество. В отдельных случаях, поверхностью желудочно-кишечного тракта является слизистая оболочка и/или эпителий желудочно-кишечного тракта или конкретный отдел желудочно-кишечного тракта, такой как пищевод. В некоторых вариантах осуществления изобретения, композицией, представленной в описании, является фармацевтическая композиция, содержащая кортикостероид, антиоксидант, буферное средство, поверхностно-активное вещество, необязательный консервант, необязательное аромитизирующее средство, по меньшей мере, один дополнительный эксципиент и необязательно воду.
Консерванты включают, в качестве неограничивающего примера, хлорид безалкония, цетримид (цетилтриметиламмонийбромид), бензойную кислоту, бензиловый спирт, метил-, этил-, пропил- и бутил-сложные эфиры пара-гидроксибензойной кислоты, хлоргексидин, хлорбутанол, фенилртутьацетат, борат и нитрат, сорбат калия, бензоат натрия, сорбиновую кислоту, тиомерсал (ртути тиосалицилат), их комбинации или тому подобное. Композиции и препараты, представленные в описании, необязательно включают приблизительно от 0,1% масс./масс. до 5% масс./масс., приблизительно от 0,1% масс./масс. до 3% масс./масс., приблизительно от 0,1% масс./масс. до 1% масс./масс., приблизительно от 0,1% масс./масс. до 0,5% масс./масс., приблизительно 0,2% масс./масс. одного или более консерванта(ов).
Антиоксиданты включают, в качестве неограничивающего примера, аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, монотиоглицерин, аскорбат натрия, формальдегид-сульфоксилат натрия, метабисульфит натрия, BHT, BHA, бисульфит натрия, витамин E или его производное, пропилгаллат, эдетат (EDTA) (например, динатрия эдетат), диэтилентриаминпентауксусную кислоту (DTPA), тригликолламат (Triglycollamate) (NT), их комбинации или тому подобное. Композиции и препараты, представленные в описании, необязательно включают приблизительно от 0,01% масс./масс. до 1% масс./масс., приблизительно от 0,01% масс./масс. до 0,5% масс./масс., приблизительно от 0,01% масс./масс. до 0,3% масс./масс. или приблизительно от 0,01% масс./масс. до 0,1% масс./масс. одного или более антиоксиданта(ов).
Буферные средства включают, в качестве неограничивающего примера, цитратные буферы (т.е., лимонную кислоту м цитрат), карбонаты (например, карбонат кальция), гидроксиды (например, гидроксид магния), фосфатные буферы, ацетатные буферы, их комбинации или тому подобное.
Смачивающие средства включают, в качестве неограничивающего примера, глицерин, пропиленгликоль, этиленгликоль, глицерилтриацетат, многоатомные спирты (например, сорбит, ксилит, мальтит, полидекстроза) и тому подобное. Композиции и препараты, представленные в описании, необязательно включают приблизительно от 0,1% масс./масс. до 10% масс./масс., приблизительно от 1% масс./масс. до 10% масс./масс., приблизительно от 1% масс./масс. до 8% масс./масс. или приблизительно 5% масс./масс. смачивающего средства. В определенных вариантах осуществления изобретения, смачивающие средства тормозят или снижают осаждение и/или кристаллизацию одного или более компонента композиции или препарата, представленного в описании (например, подсластитель, мукоадгезивное средство или повышающее вязкость средство).
Хелатирующие средства включают, в качестве неограничивающего примера, эдетат (EDTA) (например, динатрия эдетат), диэтилентриаминпентауксусную кислоту (DTPA), тригликолламат (Triglycollamate) (NT), или тому подобное. Композиции и препараты, представленные в описании, необязательно включают приблизительно от 0,01% масс./масс. до 0,5% масс./масс., приблизительно от 0,01% масс./масс. до 0,3% масс./масс., приблизительно от 0,01% масс./масс. до 0,1% масс./масс. или приблизительно 0,05% масс./масс. одного или более хелатирующего средства. В некоторых вариантах осуществления изобретения, антиоксиданты или хелатирующие средства (например, EDTA) присутствуют в количестве приблизительно от 0,05 мг/мл до 25 мг/мл.
В определенных вариантах осуществления изобретения, подсластители включают, в качестве неограничивающего примера, сахар, глицерин, ацесульфам калия (AceK), моноаммония глицирризинат (например, магнасвит®), сахарозу, лактозу, глюкозу, фруктозу, арабинозу, ксилозу, рибозу, маннозу, галактозу, декстрозу, сорбозу, сорбит, маннит, мальтозу, целлобиозу, ксилит и тому подобное. В специфичных вариантах осуществления изобретения, подсластитель включает глицерин, ацесульфам калия и моноаммония глицирризинат. Подсластители необязательно включены в любом подходящем количестве, составляющем, в качестве неограничивающего примера, приблизительно от 0,01% масс./масс. до 30% масс./масс., приблизительно от 0,1% масс./масс. до 5% масс./масс., приблизительно от 5% масс./масс. до 20% масс./масс., приблизительно 0,5% масс./масс., приблизительно 0,8% масс./масс., приблизительно 1% масс./масс., приблизительно 6% масс./масс., приблизительно 7% масс./масс., приблизительно 8% масс./масс., приблизительно 9% масс./масс., приблизительно 10% масс./масс., приблизительно 11% масс./масс., приблизительно 12% масс./масс., приблизительно 13% масс./масс., приблизительно 14% масс./масс., приблизительно 15% масс./масс., приблизительно 16% масс./масс., приблизительно 17% масс./масс., приблизительно 18% масс./масс. или приблизительно 19% масс./масс. В некоторых вариантах осуществления изобретения, ароматизирующие средства включают, в качестве неограничивающего примера, мяту перечную, апельсин, жевательную резинку, винтергрен, виноград и вишню. Любое подходящее количество ароматизирующего средства, необязательно используемого, составляет, например, приблизительно 0,01% масс./масс., приблизительно 0,1% масс./масс., приблизительно 0,2% масс./масс., приблизительно 0,3% масс./масс., приблизительно 0,4% масс./масс., приблизительно 0,5% масс./масс., приблизительно 0,6% масс./масс., приблизительно 0,7% масс./масс., приблизительно 0,8% масс./масс., приблизительно 0,9% масс./масс., приблизительно 1% масс./масс., вплоть до 5% масс./масс., вплоть до 10% масс./масс. или вплоть до 50% масс./масс. В специфичных вариантах осуществления изобретения, представленная в описании композиция содержит уменьшенное количество сахарного подсластителя (например, менее чем 20% масс./масс., менее чем 15% масс./масс., менее чем 10% масс./масс., менее чем 9% масс./масс., менее чем 8% масс./масс., менее чем 7% масс./масс., менее чем 6% масс./масс., менее чем 5% масс./масс., менее чем 4% масс./масс., менее чем 3% масс./масс. или менее чем 2% масс./масс.) и/или консерванта для обеспечения стабильности композиции (например, для уменьшения роста микроорганизмов). В специфичных вариантах осуществления изобретения, глицирризинат, такой как моноаммония глицирризинат (например Магнасвит®), присутствует в количестве приблизительно от 0,01% масс./масс. до 2,95% масс./масс. В специфичных вариантах осуществления изобретения, красители включают желтые пигменты (например, FD&C 5 и/или 6), красные пигмента (например, FD&C красный 40, красный № 3), синий или тому подобное.
Поверхностно-активные вещества включают, например, анионные, катионные, неионные или цвиттерионные поверхностно-активные вещества, такие как, в качестве неограничивающего примера, полисорбат (например, полисорбат 20, полисорбат 60, полисорбат 40, полисорбат 80, полисорбат 81, полисорбат 85, полисорбат 120), желчные кислоты и их соли (например, таурохолаты натрия, дезокситаурохолаты натрия, хенодезоксихолевая кислота и урсодезоксихолевая кислота), ноноксинол или сложные полиэтиленгликолевые эфиры жирных кислот, плюроник или полоксамеры, такие как плюроник F68, плюроник L44, плюроник L101, их комбинации или тому подобное. В специфичных вариантах осуществления изобретения, поверхностно-активным веществом является полисорбат 80. Композиции и препараты, представленные в описании, необязательно включают любое подходящее количество поверхностно-активного вещества, например, приблизительно от 0,001% масс./масс. до 0,5% масс./масс., приблизительно от 0,001% масс./масс. до 0,3% масс./масс., приблизительно от 0,001% масс./масс. до 0,1% масс./масс. или приблизительно 0,01% масс./масс. одного или более поверхностно-активного вещества.
В определенных вариантах осуществления изобретения, композиция, представленная в описании, является фармацевтической композицией, содержащей кортикостероид, эдетат, цитрат, полисорбат 80, необязательный консервант, необязательное ароматизирующее средство, по меньшей мере, один дополнительный эксципиент и необязательно воду. В более специфических вариантах осуществления изобретения, композиция содержит воду. В других или альтернативных вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент выбирают из целлюлозы (включающей производные целлюлозы), декстрозы, одного или более мальтодекстрина, гидроксипропилметилцеллюлозы (НРМС), карбоксиметилцеллюлозы (СМС) (включающей, например, карбоксиметилцеллюлозу натрия (NaCMC)), микрокристаллической целлюлозы (МСС), карбомера, гидроксиэтилцеллюлозы (НЕС) и их комбинаций. В специфичном варианте осуществления изобретения, кортикостероид выбирают из будесонида, флутиказона пропионата и их комбинаций. В более специфичном варианте осуществления изобретения, кортикостероидом является будесонид. В другом специфичном варианте осуществления изобретения, кортикостероидом является флутиказона пропионат. В другом или дополнительном варианте осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает или представляет собой гидроксипропилметилцеллюлозу (НРМС). В определенном варианте осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает или представляет собой карбоксиметилцеллюлозу (СМС) (включающую, например, карбоксиметилцеллюлозу натрия (NaCMC)). В специфичном варианте осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает или представляет собой микрокристаллическую целлюлозу (МСС). В специфичном варианте осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает или представляет собой карбомер (т.е., высокомолекулярную поперечно-связанную полиакриловую кислоту). В специфичном варианте осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает или представляет собой комбинацию СМС и МСС.
В специфичных вариантах осуществления изобретения, эксципиент, который усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, слизистой оболочкой и/или эпителием желудочно-кишечного тракта или конкретным отделом желудочно-кишечного тракта, таким как пищевод), используемый в любой композиции или любом препарате, представленном в описании, включает, по меньшей мере, один мальтодекстрин. В определенных вариантах осуществления изобретения, эксципиент, который усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, мальтодекстрин), по существу или, по меньшей мере, частично растворен в жидком носителе. В некоторых вариантах осуществления изобретения, любая композиция или любой препарат, представленный в описании, содержит первый эксципиент, который усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, мальтодекстрин), который по существу или, по меньшей мере, частично растворен в жидком носителе (или по существу растворяется в слюне при пероральном введении), и второй эксципиент, усиливающий взаимодействие композиции с поверхностью желудочно-кишечного тракта, который по существу не растворен в жидком носителе (или в слюне при пероральном введении). В некоторых вариантах осуществления изобретения, пероральная фармацевтическая композиция, представленная в описании, содержит менее чем приблизительно 0,1 г или менее чем приблизительно 1 г мальтодекстрина на каждый мл жидкого носителя в пероральной фармацевтической композиции. В отдельных случаях, композиция или препарат, представленный в описании, содержит менее чем 2 г мальтодекстрина/мл композиции, менее чем 1,5 г мальтодекстрина/мл композиции, менее чем 1 г мальтодекстрина/мл композиции, менее чем 0,5 г мальтодекстрина/мл композиции, менее чем 0,25 г мальтодекстрина/мл композиции, приблизительно от 0,05 г мальтодекстрина/мл композиции до 0,5 г мальтодекстрина/мл композиции, приблизительно от 0,05 г мальтодекстрина/мл композиции до 0,4 г мальтодекстрина/мл композиции, приблизительно от 0,05 г мальтодекстрина/мл композиции до 0,3 г мальтодекстрина/мл композиции, приблизительно от 0,1 г мальтодекстрина/мл композиции до 0,5 г мальтодекстрина/мл композиции, приблизительно от 0,1 г мальтодекстрина/мл композиции до 0,4 г мальтодекстрина/мл композиции, приблизительно от 0,1 г мальтодекстрина/мл композиции до 0,3 г мальтодекстрина/мл композиции, приблизительно от 0,2 г мальтодекстрина/мл композиции до 0,5 г мальтодекстрина/мл композиции, приблизительно от 0,2 г мальтодекстрина/мл композиции до 0,4 г мальтодекстрина/мл композиции, приблизительно от 0,2 г мальтодекстрина/мл композиции до 0,3 г мальтодекстрина/мл композиции. В некоторых вариантах осуществления изобретения, любая композиция или любой препарат, представленный в описании, содержит более чем приблизительно 7% масс./масс., более чем приблизительно 8% масс./масс., более чем приблизительно 9% масс./масс., более чем приблизительно 10% масс./масс., более чем приблизительно 11% масс./масс., более чем приблизительно 12% масс./масс., более чем приблизительно 13% масс./масс., более чем приблизительно 14% масс./масс., более чем приблизительно 15% масс./масс., более чем приблизительно 16% масс./масс., более чем приблизительно 17% масс./масс., более чем приблизительно 18% масс./масс., более чем приблизительно 19% масс./масс., более чем приблизительно 20% масс./масс., более чем приблизительно 21% масс./масс., более чем приблизительно 22% масс./масс., более чем приблизительно 23% масс./масс., более чем приблизительно 24% масс./масс., более чем приблизительно 25% масс./масс., более чем приблизительно 26% масс./масс., более чем приблизительно 27% масс./масс., более чем приблизительно 28% масс./масс., более чем приблизительно 29% масс./масс. или более чем приблизительно 30% масс./масс. мальтодекстрина. В некоторых вариантах осуществления изобретения, мальтодекстрин по существу растворен в жидком носителе. В специфичных вариантах осуществления изобретения, мальтодекстрин характеризуется показателем декстрозный эквивалент (DE), составляющим более чем 4, более чем 5, более чем 10, более чем 11, более чем 12, более чем 13, более чем 14, более чем 15, приблизительно 15, приблизительно от 4 до 10, приблизительно от 4 до 9, приблизительно от 4 до 8, приблизительно от 4 до 7 (например, M150), приблизительно от 11 до 20, приблизительно от 12 до 19, приблизительно от 13 до 18, приблизительно от 13 до 17 (например, M440) или приблизительно от 14 до 16. В некоторых вариантах осуществления изобретения, композиция, представленная в описании, содержит первый мальтодекстрин и второй мальтодекстрин. В специфичных вариантах осуществления изобретения, первый мальтодекстрин имеет DE приблизительно от 4 до 10, приблизительно от 4 до 9 или приблизительно от 4 до 8, и второй мальтодекстрин имеет DE приблизительно от 10 до 20, приблизительно от 12 до 19 или приблизительно от 13 до 18. В некоторых вариантах осуществления изобретения, по меньшей мере, один мальтодекстрин, используемый в композиции, представленной в описании, имеет молекулярную массу достаточно высокую для того, чтобы повышать растворимость кортикостероида, или увеличивать способность частицы кортикостероида суспендироваться.
Как употребляют в описании, “эдетат” включает все соединения формулы I, где каждую группу R независимо выбирают из H и отрицательного заряда (например, в виде соли или в виде диссоциированной соли или кислоты). В определенных вариантах осуществления изобретения, эдетат выбирают, в качестве неограничивающего примера, из динатрия эдетата, кальция эдетата, этилендиаминтетрауксусной кислоты и тому подобное.
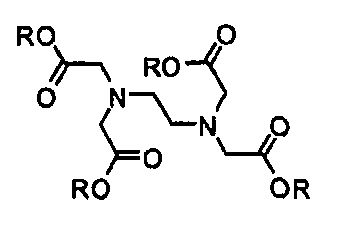
Формула I
Как употребляют в описании, “цитрат” включает все соединения формулы II, где каждую группу R независимо выбирают из H и отрицательного заряда (например, в виде соли или в виде диссоциированной соли или кислоты). В специфичных вариантах осуществления изобретения, цитрат выбирают, в качестве неограничивающего примера, из натрия цитрата, лимонной кислоты и тому подобное.

Формула II
В определенных вариантах осуществления изобретения, подсластители включают, в качестве н ограничивающего примера, сахарозу, лактозу, глюкозу, фруктозу, арабинозу, ксилозу, рибозу, маннозу, галактозу, декстрозу, сорбозу, сорбит, маннит, мальтозу, целлобиозу, ксилит и тому подобное. В некоторых вариантах осуществления изобретения, ароматизирующие средства включают, в качестве неограничивающего примера, мяту перечную, апельсин, жевательную резинку, винтергрен, виноград и вишню.
Консерванты включают, в качестве неограничивающего примера, бензалкония хлорид, метилпарабен (например, натрия метилпарабен), пропилпарабен, калия сорбат и натрия бензоат. В специфических вариантах осуществления изобретения, консервантом является калия сорбат.
В определенных вариантах осуществления изобретения, композиция, предусмотренная изобретением, содержит компоненты, или ее получают путем комбинирования компонентов, указанных в любой из таблиц 1-13. В различных вариантах осуществления изобретения, один или более мальтодекстрин, декстрозу, НЕС, СМС, МСС, карбомер и НРМС используют в изобретении. Композиции необязательно получают в любом объеме (например, любой объем, указанный в описании), содержащем компоненты в отношении, как описано в таблицах 1-13.
В некоторых вариантах осуществления изобретения, любая фармацевтическая композиция, представленная в описании, является стабильной. В специфичных вариантах осуществления изобретения, фармацевтическая композиция является химически и физически стабильной. В специфичных вариантах осуществления изобретения, доказательством химической стабильности фармацевтической композиции является то, что она содержит, по меньшей мере, 80%, 90%, 95%, 98% или 99% исходного количества или количества метки кортикостероида в течение, в качестве неограничивающего примера, 1 недели, 2 недель, 3 недель, 1 месяца, 3 месяцев, 6 месяцев, 1 года, 2 лет или в течение срока годности композиции. В некоторых вариантах осуществления изобретения, доказательством физической стабильности фармацевтической композиции является то, что она по существу достигает однородности при получении, остается по существу однородной (например, в течение, по меньшей мере, 1 дня, 3 дней, 1 недели, 2 недель, 3 недель, 1 месяца, 3 месяцев, 6 месяцев, 1 года, 2 лет и т.д.) или вновь становится по существу однородной (например, при легком или умеренном перемешивании после того, как она оставалась ненарушенной в течение 1 дня, 3 дней, 1 неделя, 2 недель, 3 недель, 1 месяца, 3 месяцев, 6 месяцев, 1 года, 2 лет и т.д.). В специфичных вариантах осуществления изобретения, доказательством физической стабильности композиции является то, что она содержит, по меньшей мере, 80%, 90%, 95%, 98% или 99% исходного количества или количества метки кортикостероида и/или необязательного дополнительного активного средства в течение, в качестве неограничивающего примера, 2 дней, 1 недели, 2 недель, 3 недель, 1 месяца, 3 месяцев, 6 месяцев, 1 года, 2 лет или в течение срока годности композиции. В специфичных вариантах осуществления изобретения, однородность, как представлено в описании, доказывается однородностью дисперсии частиц кортикостероида по всей фармацевтической композиции, однородностью распределенной массы кортикостероида по всей фармацевтической композиции, однородностью концентрации одного или более компонентов в композиции по всей фармацевтической композиции и тому подобное. В специфичных вариантах осуществления изобретения, слабое или умеренное перемешивание включает, в качестве неограничивающего примера, встряхивание, тщательное встряхивание, вихревое движение, слабое вихревое движение и тому подобное. В некоторых вариантах осуществления изобретения, слабое или умеренное перемешивание включает перемешивание без специального оборудования. В некоторых вариантах осуществления изобретения, однородность фармацевтической композиции относится к однородности дозы (например, каждая доза, доставленная или извлеченная из композиции, содержит по существу подобное количество кортикостероида), или концентрации кортикостероида, по меньшей мере, в некоторых или во всех дозах препаратов с множеством доз являются по существу сходными. В специфичных вариантах осуществления изобретения, по существу сходные включают, например, в пределах 20%, 15%, 10%, 7%, 5%, 3%, 2% или 1%.
В некоторых вариантах осуществления изобретения, фармацевтическая композиция, представленная в описании, содержит кортикостероид, который легко диспергируется по всей композиции при перемешивании (например, слабом или умеренном). В специфичных вариантах осуществления изобретения, фармацевтическая композиция, представленная в описании, содержит кортикостероид, который легко диспергируется по всей композиции при слабом или умеренном перемешивании после хранения. В некоторых вариантах осуществления изобретения, фармацевтическая композиция, представленная в описании, содержит кортикостероид, который легко ресуспендируется в композиции при слабом или умеренном перемешивании. В определенных вариантах осуществления изобретения, фармацевтическая композиция, представленная в описании, содержит кортикостероид, который легко ресуспендируется в композиции при слабом или умеренном перемешивании после хранения. В некоторых вариантах осуществления изобретения, фармацевтическая композиция, представленная в описании, содержит кортикостероид, который легко диспергируется по всей композиции при слабом или умеренном перемешивании. В специфичных вариантах осуществления изобретения, фармацевтическая композиция, представленная в описании, содержит кортикостероид, который легко диспергируется по всей композиции при слабом или умеренном перемешивании после хранения. В определенных вариантах осуществления изобретения, способность композиций, представленных в описании, заключается в способности легко ресуспендироваться и/или легко вновь диспергироваться после хранения в условиях окружающей среды. В других вариантах осуществления изобретения, хранение производится в условиях инертной атмосферы, повышенной температуры и/или повышенной относительной влажности. В определенных вариантах осуществления изобретения, способность композиций, представленных в описании, заключается в том, что они легко ресуспендируются и/или легко вновь диспергируются после хранения в течение, в качестве неограничивающего примера, 1 дня, 2 дней, 3 дней, 1 недели, 2 недель, 3 недель, 1 месяца, 3 месяцев, 6 месяцев, 1 года, 2 лет или в течение срока годности композиции.
В некоторых вариантах осуществления изобретения, любая фармацевтическая композиция, представленная в описании, необязательно содержит небольшое количество глицина, например, количество, которое не приводит к существенному изменению вязкости композиции.
В некоторых вариантах осуществления изобретения, композиция, представленная в описании, остается на поверхности пищевода, или ее некоторая часть, после перорального введения в течение, по меньшей мере, 6 секунд, по меньшей мере, 12 секунд, по меньшей мере, 15 секунд, по меньшей мере, 30 секунд, по меньшей мере, 60 секунд, по меньшей мере, 90 секунд, по меньшей мере, 120 секунд, по меньшей мере, 3 минут, по меньшей мере, 4 минут, по меньшей мере, 5 минут, по меньшей мере, 15 минут или, по меньшей мере, в течение 30 минут. В определенных вариантах осуществления изобретения, композиция остается на поверхности пищевода после перорального введения в течение приблизительно от 15 секунд до 120 секунд, или приблизительно от 30 до 90 секунд.
В определенных вариантах осуществления изобретения, описанная композиция имеет вязкость, достаточную для доставки эффективного количества композиции к месту воспаления в желудочно-кишечном тракте, например, к пищеводу. В некоторых вариантах осуществления изобретения, эффективное количество композиции, доставленной к пищеводу, составляет количество, достаточное для “обволакивания”, или частичного обволакивания, пищевода, и доставки композиции к местам воздействия, включающим, в качестве примера только, нижнюю часть пищевода, пищеводно-желудочное соединение, желудок и/или двенадцатиперстную кишку. В определенных вариантах осуществления изобретения, вязкость дозированной формы является таковой, что при пероральном введении она не будет настолько густой (вязкой), чтобы создавать трудности в глотании, вызывать рвотные движения или быть невкусной. В специфичных вариантах осуществления изобретения, вязкость дозированной формы является вязкостью, достаточной для осуществления воздействия кортикостероида на пищевод в течение достаточного периода времени, так что симптомы воспаления и/или воспаление, ассоциированное с воспалительными заболеваниями, поражающими желудочно-кишечный тракт, включающий пищевод, уменьшаются после введения пероральной дозированной формы, содержащей кортикостероид.
Вязкость может быть, например, определена при комнатной температуре, приблизительно при 20-25°С, или приблизительно при 37°С, чтобы имитировать температуру тела. В различных вариантах осуществления настоящего изобретения, вязкость композиции, представленной в описании, является любой вязкостью, подходящей для доставки кортикостероида к намеченной и/или воспаленной части желудочно-кишечного тракта. В некоторых вариантах осуществления изобретения, вязкость композиции составляет, по меньшей мере, 2 сантипуаза (сП), по меньшей мере приблизительно 3 сП, по меньшей мере приблизительно 5 сП, по меньшей мере приблизительно 10 сП, по меньшей мере приблизительно 15 сП, по меньшей мере приблизительно 20 сП, по меньшей мере приблизительно 25 сП, по меньшей мере приблизительно 30 сП, по меньшей мере приблизительно 35 сП, по меньшей мере приблизительно 40 сП, по меньшей мере приблизительно 50 сП, по меньшей мере приблизительно 200 сП или, по меньшей мере приблизительно 225 сП. В некоторых вариантах осуществления изобретения, вязкость композиции составляет, по меньшей мере, приблизительно 100 сП. В специфичных вариантах осуществления изобретения, вязкость композиции, измеренная при 25°С, составляет приблизительно от 50 сП до 250000 сП, приблизительно от 50 сП до 70000 сП, приблизительно от 50 сП до 25000 сП, приблизительно от 50 сП до 10000 сП, приблизительно от 50 сП до 3000 сП или приблизительно от 50 сП до 2000 сП. В одном аспекте, вязкость композиции, измеренная при 25°С, составляет приблизительно от 25 сантипуаз (сП) до 800 сП, приблизительно от 50 сП до 800 или приблизительно от 300 сП до 800 сП (например, измеренная вискозиметром Брукфильда). В другом аспекте, вязкость композиции может варьировать приблизительно от 100 сП до 200 сП, приблизительно от 200 сП до 300 сП, приблизительно от 250 сП до 600 сП или приблизительно от 400 сП до 600 сП. В особых вариантах осуществления изобретения, вязкость препарата составляет приблизительно 30 сП, приблизительно 100 сП, приблизительно 200 сП, приблизительно 300 сП, приблизительно 400 сП, приблизительно 500 сП или приблизительно 250000 сП (например, измеренная вискозиметром Брукфильда при 25°С, снабженного сверхнизким адаптером).
В некоторых вариантах осуществления изобретения, вязкость композиции измеряют при комнатной температуре (приблизительно 25°C) со скоростью сдвига приблизительно 13,2 сек-1. В специфичных вариантах осуществления изобретения, предусмотрена композиция, имеющая вязкость при таких условиях, которая составляет, по меньшей мере, приблизительно 2 сантипуаза (сП), по меньшей мере, приблизительно 3 сП, по меньшей мере, приблизительно 5 сП, по меньшей мере, приблизительно 10 сП, по меньшей мере, приблизительно 15 сП, по меньшей мере, приблизительно 20 сП, по меньшей мере, приблизительно 25 сП, по меньшей мере, приблизительно 30 сП, по меньшей мере, приблизительно 35 сП, по меньшей мере, приблизительно 40 сП, по меньшей мере, приблизительно 50 сП, по меньшей мере, приблизительно 200 сП, по меньшей мере, приблизительно 225 сП, по меньшей мере, приблизительно 250 сП, по меньшей мере, приблизительно 300 сП или, по меньшей мере, приблизительно 400 сП. В некоторых вариантах осуществления изобретения, вязкость композиции при таких условиях составляет приблизительно от 50 сП до 250000 сП, приблизительно от 50 сП до 70000 сП, приблизительно от 50 сП до 25000 сП, приблизительно от 50 сП до 10000 сП, приблизительно от 50 сП до 3000 сП, приблизительно от 50 сП до 2000 сП, приблизительно от 250 сП до 250000 сП, приблизительно от 250 сП до 70000 сП, приблизительно от 250 сП до 25000 сП, приблизительно от 250 сП до 10000 сП, приблизительно от 250 сП до 3000 сП или приблизительно от 250 сП до 2000 сП. В одном аспекте, вязкость композиции, измеренная при 25°С, составляет приблизительно от 25 сантипуаз (сП) до 800 сП, приблизительно от 50 сП до 800 или приблизительно от 300 сП до 800 сП (например, измеренная вискозиметром Брукфильда). В другом аспекте, вязкость композиции при таких условиях может колебаться приблизительно от 100 сП до 200 сП, приблизительно от 200 сП до 300 сП, приблизительно от 250 сП до 600 сП или приблизительно от 400 сП до 600 сП. В особых вариантах осуществления изобретения, вязкость препарата, измеренная при таких условиях, составляет приблизительно 30 сП, приблизительно 40 сП, приблизительно 100 сП, приблизительно 200 сП, приблизительно 300 сП, приблизительно 400 сП, приблизительно 500 сП или приблизительно 250000 сП.
В некоторых вариантах осуществления изобретения, вязкость композиции измеряют при комнатной температуре (около 25°C) со скоростью сдвига приблизительно 15 сек-1 (например, со щелью между шпинделем и стенкой камеры для образца, составляющей приблизительно 6 мм или больше). В специфичных вариантах осуществления изобретения, предусмотрена композиция, имеющая вязкость при таких условиях, которая составляет, по меньшей мере, приблизительно 2 сантипуаза (сП), по меньшей мере, приблизительно 3 сП, по меньшей мере, приблизительно 5 сП, по меньшей мере, приблизительно 10 сП, по меньшей мере, приблизительно 15 сП, по меньшей мере, приблизительно 20 сП, по меньшей мере, приблизительно 25 сП, по меньшей мере, приблизительно 30 сП, по меньшей мере, приблизительно 50 сП, по меньшей мере, приблизительно 100 сП, по меньшей мере, приблизительно 150 сантипуаз (сП), по меньшей мере, приблизительно 160 сП, по меньшей мере, приблизительно 170 сП, по меньшей мере, приблизительно 180 сП, по меньшей мере, приблизительно 190 сП или, по меньшей мере, приблизительно 200 сП. В некоторых вариантах осуществления изобретения, вязкость композиции при таких условиях составляет приблизительно от 150 сП до 250000 сП, от 160 сП до приблизительно 250000 сП, от 170 сП до приблизительно 250000 сП, от 180 сП до приблизительно 250000 сП или от 190 сП до приблизительно 250000 сП.
Вязкость также может быть определена любым методом, который позволяет измерить сопротивление к сдвигу, оказываемое веществом или препаратом. Многие вискозиметры приспособлены для таких целей в фармацевтической области и включают вискозиметры, созданные, например, Брукфильдом.
В некоторых вариантах осуществления изобретения, композиция или препарат, представленный в описании, содержит средство, повышающее вязкость, которое придает композиции вязкость, достаточную для увеличения времени удержания на поверхности пищевода, в то же время также допускающее движение активного средства(средств) (растворенное вещество или частицы) при пероральном введении композиции индивидууму. Другими словами, в некоторых вариантах осуществления изобретения, вязкость является достаточно высокой, чтобы увеличить время удержания композиции на поверхности желудочно-кишечного тракта (например, на слизистой оболочке или эпителии желудочно-кишечного тракта или на отдельном месте желудочно-кишечного тракта, таком как пищевод), но не настолько высокой, чтобы создавать препятствие для высвобождения активного средства(средств) из композиции, например, к поверхности желудочно-кишечного тракта.
Усиление взаимодействия композиции с поверхностью желудочно-кишечного тракта (например, пищевода) может быть определено путем измерения времени удержания материала на поверхности желудочно-кишечного тракта на всем его протяжении, где время удержания увеличивается в присутствии эксципиентов по сравнению с их отсутствием. Как употребляют в описании, В специфичных вариантах осуществления изобретения, поверхность желудочно-кишечного тракта включает слизистую оболочку желудочно-кишечного тракта и/или эпителий желудочно-кишечного тракта, причем все термины используют в описании взаимозаменяемо. В другом варианте осуществления изобретения, усиление взаимодействия можно измерить при уменьшении физиологических проявлений или симптомов заболевания или недомогания, которое подвергают лечению, включая уменьшение общего счета эозинофилов в заданном образце.
В некоторых вариантах осуществления изобретения, по меньшей мере, 50%, по меньшей мере, 30%, по меньшей мере, 25%, по меньшей мере, 20%, по меньшей мере, 15%, по меньшей мере, 10%, по меньшей мере, 9%, по меньшей мере, 8%, по меньшей мере, 7%, по меньшей мере, 6%, по меньшей мере, 5%, по меньшей мере, 4%, по меньшей мере, 3%, по меньшей мере, 2% или, по меньшей мере, 1% кортикостероида или композиции, представленной в описании, “прилипает” к поверхности или локализуется на поверхности желудочно-кишечного тракта (например, пищевода или его некоторой части, по меньшей мере, 5 секунд, по меньшей мере, 6 секунд, по меньшей мере, 10 секунд, по меньшей мере, 12 секунд, по меньшей мере, 15 секунд, по меньшей мере, 30 секунд, по меньшей мере, 60 секунд, по меньшей мере, 90 секунд, по меньшей мере, 120 секунд, по меньшей мере, 3 минуты, по меньшей мере, 4 минуты, по меньшей мере, 5 минут, по меньшей мере, 15 минут или, по меньшей мере, 30 минут после перорального введения (например, запивание или глотание). В специфичных вариантах осуществления изобретения, по меньшей мере, 50%, по меньшей мере, 30%, по меньшей мере, 25%, по меньшей мере, 20%, по меньшей мере, 15%, по меньшей мере, 10%, по меньшей мере, 9%, по меньшей мере, 8%, по меньшей мере, 7%, по меньшей мере, 6%, по меньшей мере, 5%, по меньшей мере, 4%, по меньшей мере, 3%, по меньшей мере, 2% или, по меньшей мере, 1% кортикостероида или композиции прилипает к, располагается на или удерживается на поверхности пищевода после перорального введения в течение приблизительно от 15 секунд до 120 секунд, или в течение приблизительно от 30 до 90 секунд. В некоторых вариантах осуществления изобретения, часть композиции включает приблизительно 90% или более, приблизительно 80% или более, приблизительно 70% или более, приблизительно 60% или более, приблизительно 50% или более, приблизительно 40% или более, приблизительно 30% или более, приблизительно 20% или более, приблизительно 10% или более или приблизительно 5% или более.
В определенных вариантах осуществления изобретения, прилипание и/или абсорбцию фармацевтической композиции или кортикостероида, представленных в описании, к слизистой оболочке желудочно-кишечного тракта (например, пищевода) можно определить любым подходящим способом, например, сцинтиграфическим исследованием или анализом. В некоторых вариантах осуществления изобретения, такие исследования осуществляют in vivo или in vitro. В определенных вариантах осуществления изобретения, in vivo сцинтиграфические исследования могут включать комбинирование фармацевтической композиции, представленной в описании, с определяемым радиоактивным изотопом, введение меченой композиции субъекту и определение и/или измерение степени прилипания или удержания фармацевтической композиции или кортикостероида на поверхности желудочно-кишечного тракта (например, пищевода) посредством устройства (например, камера), которое регистрирует и/или измеряет радиоактивность. В некоторых вариантах осуществления изобретения, in vivo сцинтиграфическое исследование может включать связывание кортикостероида, представленного в описании, с регистрируемым радиоактивным изотопом, включение меченого котикостероида в состав композиции, представленной в описании, введение композиции субъекту и регистрацию и/или измерение степени прилипания или удержания фармацевтической композиции или кортикостероида на поверхности желудочно-кишечного тракта (например, пищевода) посредством устройства (например, камера), которое регистрирует и/или измеряет радиоактивность. В определенных вариантах осуществления изобретения, in vitro анализ, оценивающий степень прилипания фармацевтической композиции или кортикостероида, представленного в описании, на поверхности слизистой оболочки отдела желудочно-кишечного тракта (например, пищевода), может включать применение композиции, представленной в описании, к дистальной части полоски слизистой оболочки желудочно-кишечного тракта (например, ткань пищевода свиньи) и подвергание композиции действию потока искусственной слюны в направлении, противоположном дистальной части полоски. Определение степени прилипания или удержания композиции и/или кортикостероида можно осуществить при заданном времени путем определения либо количества композиции и/или выделяемого кортикостероида, либо количества композиции и/или кортикостероида, остающегося на поверхности желудочно-кишечного тракта (например, пищевода).
В определенных вариантах осуществления изобретения, композиция, представленная в описании, имеет вязкость, достаточную для доставки эффективного количества композиции к месту поражения желудочно-кишечного тракта, например, к пищеводу. В некоторых вариантах осуществления изобретения, эффективное количество композиции, доставленное к пищеводу, составляет количество, достаточное для “обволакивания”, или частичного обволакивания, желудочно-кишечного тракта, и доставки композиции к местам воздействия, включающим, в качестве примера только, пищевод, нижнюю часть пищевода, пищеводно-желудочное соединение, желудок и/или двенадцатиперстную кишку. В специфичных вариантах осуществления изобретения, вязкость пероральной дозированной формы является таковой, что при пероральном введении она не будет настолько густой (вязкой), чтобы создавать трудности в глотании, вызывать рвотные движения или быть невкусной. В специфичных вариантах осуществления изобретения, вязкость пероральной дозированной формы является вязкостью, достаточной для осуществления воздействия терапевтического средства на пищевод в течение достаточного периода времени, так что расстройство или симптомы расстройства, поражающего желудочно-кишечный тракт, включающий пищевод, уменьшаются после введения фармацевтической композиции, представленной в описании, входящей в состав пероральной дозированной формы или в качестве пероральной дозированной формы. В некоторых примерах, где фармацевтическая композиция представлена в твердом или полутвердом виде, описанная композиция имеет вязкость, при смешивании со слюной или водой (например, в определенных случаях, где композиция приготовлена в виде шипучей таблетки, саше или домашнего пива), достаточную для доставки эффективного количества композиции, представленной в описании, к месту воспаления в желудочно-кишечном тракте, например, к пищеводу.
В определенных вариантах осуществления изобретения, фармацевтическая композиция, представленная в описании, является неньютоновской текучей средой или ньютоновской текучей средой. В некоторых вариантах осуществления изобретения, фармацевтическая композиция, представленная в описании, является неньютоновской текучей средой. В особых вариантах осуществления изобретения, неньютоновская текучая среда представляет собой пластический материал, псевдопластический материал или дилатантную жидкость. В некоторых особых вариантах осуществления изобретения, неньютоновская текучая среда является тиксотропной. В специфичных вариантах осуществления изобретения, неньютоновская жидкая текучая композиция становится менее плотной со сдвигом, и загустевает при отсутствии сдвига. Таким образом, в некоторых вариантах осуществления изобретения, предусмотрена жидкая текучая фармацевтическая композиция, которая является подходящей для удобного разливания после слабого или умеренного перемешивания. Кроме того, в некоторых вариантах осуществления изобретения, предусмотрена жидкая текучая фармацевтическая композиция, которая хотя и является подходящей для удобного разливания после слабого или умеренного перемешивания, становится достаточно вязкой при пероральном введении для того, чтобы фармацевтическая композиция могла, по меньшей мере, частично, “обволакивать” пищевод и местно доставлять терапевтически эффективное количество кортикостероида к пищеводу. В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент выбирают из средства, увеличивающего вязкость неньютоновской текучей среды (т.е., средство, которое придает композиции характер неньютоновской текучей среды). Средства, увеличивающего вязкость неньютоновской текучей среды, включают, в качестве неограничивающего примера, камедь (например, использована в количестве приблизительно 5-10% масс./масс. фармацевтической композиции, представленной в описании), альгиновую кислоту (например, приблизительно 0,5-20% масс./масс.), карбомер, CaCMC, NaCMC, каррагинан (например, приблизительно 0,3-12% масс./масс.), сератонию (например, приблизительно 0,1-1% масс./масс.), хитозин (например, приблизительно 0,5-2% масс./масс.), коллоидную двуокись кремния (например, приблизительно 2-10% масс./масс.), этилцеллюлозу (например, приблизительно 5-25% масс./масс.), желатин, гуаровую камедь (например, приблизительно 1-2,5% масс./масс.), HEC, гидроксиэтилметилцеллюлозу (например, приблизительно 1-5% масс./масс.), гидроксипропилцеллюлозу (например, приблизительно 1-10% масс./масс.), HPMC, магний-алюминий силикат (например, приблизительно 2-10% масс./масс.) или один или более мальтодекстрин, метилцеллюлозу (например, приблизительно 1-2% масс./масс.), полиэтиленгликоль (например, приблизительно 45-60% масс./масс.), повидон (например, приблизительно 10-15% масс./масс.), сапонит, натрия альгинат (например, приблизительно 1-5% масс./масс.), сахарозу (например, приблизительно 50-70% масс./масс.), трагакант (например, приблизительно 0,1-2% масс./масс.), ксантановую камедь (например, приблизительно 0,1-1% масс./масс.), их комбинации.
Ньютоновская текучая среда может быть описана как текучая среда, чья вязкость равна напряжению сдвига, создаваемому текучей средой, деленному на градиент скорости, перпендикулярный направлению сдвига. В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент выбирают из средства, увеличивающего вязкость ньютоновской текучей среды (т.е., средство, которое придает композиции характер ньютоновской текучей среды). Средства, увеличивающего вязкость ньютоновской текучей среды, включают, в качестве неограничивающего примера, глицерин (например, приблизительно 50-80% масс./масс.), полидекстрозу (например, приблизительно 50-70% масс./масс.) и их комбинации.
В специфичных вариантах осуществления изобретения, после введения композиции, представленной в описании, к поверхности желудочно-кишечного тракта (например, поверхности верхней части желудочно-кишечного тракта, или пищевода), по меньшей мере, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% масс. кортикостероида или введенной композиции прилипает и/или абсорбируется на поверхности желудочно-кишечного тракта (например, поверхности верхней части желудочно-кишечного тракта, или пищевода) после, по меньшей мере, 0,08, 0,17, 0,25, 0,5, 0,75, 1, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 или 60 минут после внесения композиции к поверхности желудочно-кишечного тракта (например, поверхности верхней части желудочно-кишечного тракта, или пищевода). В особых вариантах осуществления изобретения, поверхностью желудочно-кишечного тракта является место желудочно-кишечного воспаления. В специфичных вариантах осуществления изобретения, после перорального введения композиции, представленной в описании, к пищеводу (например, после первоначального проглатывания или выпивания композиции), по меньшей мере 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% масс. кортикостероида или введенной композиции присутствует в пищеводе (например, как измерено гамма-сцинтиграфическим исследованием) после, по меньшей мере, 5 секунд, 10 секунд, 15 секунд, 20 секунд, 25 секунд, 30 секунд, 40 секунд, 45 секунд, 50 секунд или 1, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 или 60 минут после внесения композиции к пищеводу. В определенных примерах, даже незначительные различия (например, увеличения) во времени прилипания (например, времени удержания) между препаратами может привести к терапевтически значимым или клинически значимым результатам или улучшениям.
В некоторых вариантах осуществления изобретения, фармацевтическая композиция, представленная в описании, является достаточно легко распределяющейся по поверхности и/или имеет соответствующую характеристику потока на поверхности желудочно-кишечного тракта (например, поверхности верхней части желудочно-кишечного тракта, такого как пищевод). В определенных вариантах осуществления изобретения, характеристика растекаемости и/или текучести композиции является подходящей для того, чтобы фармацевтическая композиция или унифицированная доза фармацевтической композиции, представленной в описании, могла распространиться и/или разлиться по поверхности желудочно-кишечного тракта, и, по меньшей мере, частично, “покрыть” поверхность желудочно-кишечного тракта. В некоторых вариантах осуществления изобретения, по меньшей мере, частичным покрытием поверхности желудочно-кишечного тракта, достигается местная доставка кортикостероида к участку желудочно-кишечного тракта.
В определенных х вариантах осуществления изобретения, фармацевтическую композицию, представленную в описании, используют для лечения, предотвращения или ослабления воспаления или симптомов, ассоциированных с воспалением, возникающим в желудочно-кишечном тракте, включая пищевод, желудок и/или пищеварительный тракт. В особых вариантах осуществления изобретения, фармацевтическая композиция представлена в жидкой форме. Жидкие формы включают, в качестве неограничивающего примера, растворы, суспензии, сиропы, взвеси, дисперсии, коллоиды и тому подобное. В специфичных вариантах осуществления изобретения, жидкостью является суспензия. В некоторых вариантах осуществления изобретения, фармацевтическая композиция, представленная в описании, находится в жидкой, полутвердой или твердой форме. В особых вариантах осуществления изобретения, фармацевтическая композиция, представленная в описании, находится в полутвердой форме, например, в виде геля, гелеобразного матрикса, крема, пасты или тому подобное. В некоторых вариантах осуществления изобретения, полутвердые формы содержат жидкий носитель.
Способы и композиции согласно настоящему изобретению используются индивидуумами любого возраста. Под “индивидуумом” подразумевают любое животное, например, млекопитающее или, например, человека, например, больных людей, испытывающих необходимость в лечении. В некоторых вариантах осуществления изобретения, индивидуумом является взрослый человек. В других вариантах осуществления изобретения, индивидуумом является ребенок или младенец. В специфичных вариантах осуществления изобретения, возраст ребенка или младенца составляет менее чем 16 лет, менее чем 12 лет, менее чем 8 лет, менее чем 6 лет, менее чем 4 года или менее чем 2 года.
Препараты
Хотя любые фармацевтические композиции, способы и наборы, представленные в описании, обычно используют в терапии больных людей, в некоторых вариантах осуществления изобретения, их используют в ветеринарии для лечения подобных или идентичных заболеваний. В некоторых вариантах осуществления изобретения, композиции используют, например, для лечения млекопитающих, включающих, но не ограниченных ими, приматов и домашних млекопитающих. В некоторых вариантах осуществления изобретения, композиции, способы и наборы используют, например, для лечения травоядных животных. Композиции согласно настоящему изобретению включают геометрические и оптические изомеры.
Фармацевтические композиции, подходящие для использования в настоящем изобретении, включают композиции, где активный ингредиент или ингредиенты содержатся в эффективном количестве, чтобы достичь заданного целевого назначения. В специфичных вариантах осуществления изобретения, фармацевтические композиции, представленные в описании, содержат кортикостероид в количестве, достаточном для лечения, предотвращения или ослабления воспаления или симптомов, ассоциированных с воспалением, поражающим желудочно-кишечный тракт, включая пищевод.
В определенных вариантах осуществления изобретения, точная дозировка кортикостероида зависит, в качестве неограничивающего примера, от формы, в которой композицию вводят, субъекта, подвергаемого лечению, возраста, массы тела и/или роста субъекта, подвергаемого лечению, и/или предпочтения и опыта лечащего врача. Таким образом, в некоторых вариантах осуществления изобретения, дозировку вводимого кортикостероида можно изменять исходя из дозировок, которые описаны в изобретении. В определенных вариантах осуществления изобретения, оптимальная концентрация кортикостероида в композиции зависит, в качестве неограничивающего примера, от отдельного используемого кортикостероида, характеристик больного и/или природы воспаления, для которого подбирают лечение. В различных вариантах осуществления изобретения, указанные факторы определяются специалистами в области медицины и фармацевтики с учетом данных настоящего изобретения.
Как правило, терапевтически эффективная доза является желательной. Терапевтически эффективная доза относится к количеству кортикостероида, которое приводит к степени уменьшения интенсивности симптомов и/или воспаления в сравнении со статусом таких симптомов и/или воспаления до лечения. Лекарственные формы и способы использования лекарственных форм, содержащих эффективные количества, предусмотрены объемом настоящего изобретения. В различных вариантах осуществления изобретения, количество кортикостероида (например, будесонида или флутиказона пропионата), используемое в способе или в композиции, представленной в описании, составляет приблизительно от 2,5 до 400 мкг/кг массы тела в день, или, например, в диапазоне от 5 до 300 мкг/кг в день, или, например, в диапазоне от 5 до 200 мкг/кг в день, или, например, в диапазоне 5 до 100 мкг/кг в день, или, например, в диапазоне от 10 до 100 мкг/кг в день, или, например, в диапазоне 10-50 мкг/кг в день, или, например, в диапазоне 10-100 мкг/кг в день, или, например, в диапазоне 5-50 мкг/кг/день, или в иллюстративном варианте, в диапазоне 10-60 мкг/кг/день.
В иллюстративном варианте осуществления изобретения, дозировка или количество (включающее разделенную общую дозу) кортикостероида предусмотрено в композиции достаточного объема, чтобы любые композиции, представленные в описании, могли достичь таргетированной и/или пораженной воспалением части желудочно-кишечного тракта, включающего пищевод, в эффективном количестве. В некоторых вариантах осуществления изобретения, эффективное количество композиции, доставленной к пищеводу, представляет собой количество, достаточное для “обволакивания” или, по меньшей мере, частичного обволакивания пищевода и доставки композиции к зонам воздействия, включающим, в качестве примера только, нижнюю часть пищевода, пищеводно-желудочное соединение, желудок и/или двенадцатиперстную кишку. В определеннывх вариантах осуществления изобретения, объем представленной в описании композиции составляет, например, приблизительно 1-20 мл, или, например, приблизительно 1-50 мл, или, например, приблизительно 1-40 мл, или, например, приблизительно 1-30 мл, или, например, приблизительно 1-25 мл, или, например, приблизительно 5-25 мл, или, например, приблизительно 10-20 мл, или, например, приблизительно 10 мл, или, например, приблизительно 15 мл, или, например, приблизительно 20 мл, или, например, приблизительно 1-15 мл, или, например, приблизительно 1-10 мл, или, например, приблизительно 2-8 мл, или, например, приблизительно 3-7 мл, или, например, приблизительно 4-6 мл, или, например, приблизительно 5 мл, или, например, приблизительно 6-14 мл, или, например, приблизительно 8-12 мл, или, например, приблизительно 9-11 мл, или, например, приблизительно 10 мл. В более специфичных вариантах осуществления изобретения, приблизительно от 0,05 мг до 20 мг, приблизительно от 0,05 мг до 10 мг, приблизительно от 0,1 мг до 10 мг, приблизительно от 0,25 мг до 6 мг, приблизительно 0,25 мг, приблизительно 0,375 мг, приблизительно 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 1,25 мг, приблизительно 1,5 мг или приблизительно 2 мг кортикостероида (например, будесонида) входит в состав однократной или унифицированной дозы фармацевтической композиции, представленной в описании, причем однократная или унифицированная доза имеет общий объем приблизительно 10-20 мл, или, например, приблизительно 10 мл, или, например, приблизительно 15 мл, или, например, приблизительно 20 мл, или, например, приблизительно 1-15 мл, или, например, приблизительно 1-10 мл, или, например, приблизительно 2-8 мл, или, например, приблизительно 3-7 мл, или, например, приблизительно 4-6 мл, или, например, приблизительно 5 мл, или, например, приблизительно 6-14 мл, или, например, приблизительно 8-12 мл, или, например, приблизительно 9-11 мл, или, например, приблизительно 10 мл. Как употребляют в описании, термин “жидкий” охватывает взвеси, растворы, суспензии, дисперсии или любую их комбинацию, в зависимости от растворимостей и количеств индивидуальных компонентов и используемых носителей и растворителей. В некоторых вариантах осуществления изобретения, соответствующая приятная на вкус дозировка находится в объеме, достаточном для “обволакивания” или, по меньшей мере, частичного обволакивания пищевода, и в иллюстративном варианте осуществления изобретения, объем является достаточным для того, чтобы “обволакивать” или, по меньшей мере, частично обволакивать пищевод и доставлять кортикостероид к зонам воздействия, включающим, в качестве примера только, нижнюю часть пищевода, пищеводно-желудочное соединение, желудок и/или двенадцатиперстную кишку. Композиция может быть доставлена, например, четыре раза в день, три раза в день, два раза в день, один раз в день, все последующие дни, три раза в неделю, два раза в неделю или один раз в неделю. Дозировка может быть, например, разделена на множество доз в течение дня, или может быть предоставлена, например, в виде четырех, трех, двух или одной дозы в день. В некоторых примерах, более частое введение (например, дважды в день против одного раза в день) способствует проведению более короткого курса общей терапии или скорому разрешению симптомов. В одном иллюстративном примере, доза предоставляется один раз в день.
В определенных вариантах осуществления изобретения, дозу или композицию, представленную в описании, вводят с пищей. В некоторых вариантах осуществления изобретения, дозу или композицию, представленную в описании, вводят без пищи. В специфичных вариантах осуществления изобретения, дозу или композицию, представленную в описании, вводят в состоянии сытости или натощак. В некоторых вариантах осуществления изобретения, дозу или композицию, представленную в описании, принимают утром, в полдень, вечером, ночью или комбинированно. В некоторых вариантах осуществления изобретения, дозу вводят в ночное время. В другом аспекте, дозу вводят приблизительно за 30 минут до укладывания в постель, без пищи и воды, данной после введения композиций, представленных в описании. В другом варианте осуществления настоящего изобретения, дозу вводят перед сном, когда, после введения композиции, больной или индивидуум находится, практически, в положении лежа на спине в течение, по меньшей мере, 30 минут, по меньшей мере, 1 часа, по меньшей мере, 2 часов, по меньшей мере, 4 часов или, по меньшей мере, 8 часов.
В некоторых вариантах осуществления изобретения, предоставлены способы лечения, предотвращения или ослабления воспаления или симптомов, связанных с воспалением желудочно-кишечного тракта, например, пищевода, включающие введение индивидууму по необходимости одной единичной дозы фармацевтической композиции, представленной в описании, из упаковки для множества доз. В особых вариантах осуществления изобретения, введение одной единичной дозы из упаковки для множества доз включает (1) встряхивание упаковки для множества доз, где упаковка для множества доз содержит, по меньшей мере, одну единичную дозу фармацевтической композиции, представленной в описании; (2) отливание (или иначе дозирование) одной единичной дозы из упаковки для множества доз в устройство для введения (например, устройство, подходящее для введения человеку, такое как ложка, чашка или шприц); и (3) введение одной единичной дозы индивидууму по необходимости. В особых вариантах осуществления изобретения, встряхивание упаковки для множества доз происходит до тех пор, пока содержащаяся в ней жидкость не достигнет вязкости, подходящей для отливания (например, удобного отливания). В некоторых особых вариантах осуществления изобретения, способ также включает ожидание после отливания одной единичной дозы и до введения одной единичной дозы индивидуумом по необходимости. В особых вариантах осуществления изобретения, время ожидания является временем, достаточным для того, чтобы вязкость композиции достигла желаемого уровня, например, вязкости, улучшающей способность композиции обволакивать поверхность. В некоторых вариантах осуществления изобретения, время ожидания составляет, например, приблизительно 3 секунды или более; приблизительно 5 секунд или более; приблизительно 10 секунд или более; приблизительно 15 секунд или более; приблизительно 20 секунд или более; приблизительно 25 секунд или более; приблизительно 30 секунд или более; приблизительно 40 секунд или более; приблизительно 45 секунд или более; приблизительно 50 секунд или более, или приблизительно 60 секунд или более. В других специфичных вариантах осуществления изобретения, композицию вводят немедленно после отливания композиции в устройство для введения. В некоторых вариантах осуществления изобретения, способ включает достаточное встряхивание упаковки для множества доз.
В некоторых вариантах осуществления изобретения, первоначальное лечение продолжается, например, в течение приблизительно от 3 дней до 2 недель для острого состояния или приблизительно от 4 недель до 16 недель для хронического состояния, или приблизительно от 8 недель до 12 недель для хронического состояния. В различных вариантах осуществления изобретения, требуется более продолжительная терапия, такая как, например, подобная терапии при хронической персистирующей астме. В некоторых аспектах настоящего изобретения, больные принимают лечение, например, вплоть до 6 месяцев или вплоть до одного года. В некоторых аспектах, поддерживающие терапии продолжаются вплоть до одного года или более одного года. В некоторых вариантах осуществления изобретения, больные лечатся на поддерживающей основе или в зависимости от потребности в процессе сложного приступа, в зависимости от тяжести состояния. В определенных вариантах осуществления изобретения, больные лечатся на основе периодически меняющейся терапии, когда лечение проводится в течение периода времени, и затем больной не принимает лекарственное средство в течение периода времени до возобновления лечения. При отмене лекарственного средства, больной может не получать лечение, получать лечение другим лекарственным средством, диетологическое лечение или лечение уменьшенной дозировкой. В определенных вариантах осуществления изобретения, больные получают лечение более высокой дозой композиции до тех пор, пока не будет достигнуто желаемое ослабление болезненного состояния, и затем лечение будет продолжено низкой дозой композиции. В определенных вариантах осуществления изобретения, больной получает комбинированное лечение композицией, представленной в описании, с лечением другим лекарственным средством и/или диетологическим лечением.
В некоторых вариантах осуществления изобретения, способы лечения, представленные в описании, включают прерывистые или постоянные курсы лечения. В специфичных вариантах осуществления изобретения, способ лечения воспаления желудочно-кишечного тракта, представленный в описании, включает профилактическое лечение воспаления желудочно-кишечного тракта (например, лечение, которое предотвращает появление симптомов и/или воспаления). В некоторых вариантах осуществления изобретения, способ лечения воспаления желудочно-кишечного тракта, представленный в описании, включает способ продолжения и/или поддержания состояния ремиссии желудочно-кишечного воспаления путем введения или продолжения введения фармацевтической композиции, как указано в описании, после того, как воспаление и/или симптомы воспаления находились в состоянии ремиссии. В специфичных вариантах осуществления изобретения, профилактические терапии и/или терапии, направленные на временное ослабление болезни или клинических симптомов, необязательно включают введение композиции, представленной в описании, содержащей сниженное количество кортикостероида по сравнению с количеством кортикостероида, которое использовалось тогда, когда воспаление и/или симптомы воспаления не находились на стадии ремиссии.
В некоторых вариантах осуществления изобретения, предусмотрен способ диагностики у индивидуума желудочно-кишечного воспаления (например, EoE) путем введения фармацевтической композиции, представленной в описании, и определения эффективности такого лечения. В некоторых примерах, индивидуумом является больной с желудочно-кишечным воспалением и/или симптомами воспаления, которые не поддаются лечению, по меньшей мере, одним ингибитором кислоты (например, PPI и/или H2A). В некоторых вариантах осуществления изобретения, эффективное лечение воспаления желудочно-кишечного тракта композицией, представленной в описании, является положительным указателем ЕоЕ. В некоторых вариантах осуществления изобретения, указанный выше способ диагностики используют вместо биопсии пищевода.
В некоторых вариантах осуществления изобретения, кортикостероид содержится в фармацевтической композиции, представленной в описании, в любом эффективном количестве. В некоторых вариантах осуществления изобретения, эффективным количеством является количество, достаточное для снижения воспаления или симптомов воспаления, связанных с воспалительным заболеванием или состоянием желудочно-кишечного тракта (например, пищевода), по сравнению с уровнем воспаления или симптомов воспаления, ассоциированных с воспалительным заболеванием до введения эффективного количества. В определенных вариантах осуществления изобретения, эффективным количеством является количество, достаточное для поддержания уменьшения воспаления или симптомов воспаления, достигаемого любым способом, включающим, но не ограниченным им, введение эффективного количества, достаточного для достижения такого уменьшения. В некоторых вариантах осуществления изобретения, эффективное количество составляет приблизительно от 50 мкг до 500 мг, приблизительно от 50 мкг до 200 мг, приблизительно от 50 мкг до 100 мг, приблизительно от 50 мкг до 50 мг, приблизительно от 250 мкг до 20 мг, приблизительно от 250 мкг до 15 мг, приблизительно от 250 мкг до 10 мг приблизительно от 0,05 мг до 20 мг, приблизительно от 0,1 мг до 20 мг, приблизительно от 0,05 мг до 15 мг, приблизительно от 0,05 мг до 10 мг, приблизительно от 0,05 мг до 7,5 мг, приблизительно от 0,05 мг до 5 мг, приблизительно от 0,3 мг до 4 мг, приблизительно от 0,3 мг до 2 мг, приблизительно от 0,25 мг до 3 мг, приблизительно от 0,25 мг до 2,5 мг, приблизительно от 0,5 мг до 3 мг, приблизительно от 0,5 мг до 2 мг, приблизительно от 0,5 мг до 0,1 мг, приблизительно от 0,5 мг до 5 мг, приблизительно от 0,5 мг до 4 мг, приблизительно от 1 мг до 4 мг, приблизительно от 1 мг до 3 мг, приблизительно от 2 мг до 3 мг или приблизительно от 2 мг до 4 мг. В специфичных вариантах осуществления изобретения, эффективное количество кортикостероида составляет приблизительно 0,05 мг, приблизительно 0,1 мг, приблизительно 0,15 мг, приблизительно 0,25 мг, приблизительно 0,3 мг, приблизительно 0,35 мг, приблизительно 0,4 мг, приблизительно 0,37 мг, приблизительно 0,375 мг, приблизительно 0,7 мг, приблизительно 0,8 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 1,2 мг, приблизительно 1,25 мг, приблизительно 1,3 мг, приблизительно 1,5 мг, приблизительно 2 мг, приблизительно 2,5 мг, приблизительно 3 мг, приблизительно 3,5 мг, приблизительно 4 мг, приблизительно 4,5 мг, приблизительно 5 мг, приблизительно 5,5 мг, приблизительно 6 мг, приблизительно 6,5 мг, приблизительно 7 мг или приблизительно 7,5 мг или более. В некоторых вариантах осуществления изобретения, кортикостероид содержится в фармацевтической композиции при концентрации приблизительно от 0,01 мг/мл до 2 мг/мл композиции. В специфичных вариантах осуществления изобретения, кортикостероид содержится в фармацевтической композиции при концентрации приблизительно от 0,01 мг/мл до 1,5 мг/мл, приблизительно от 0,02 мг/мл до 1,5 мг/мл, приблизительно от 0,04 мг/мл до 1,5 мг/мл, приблизительно от 0,03 мг/мл до 1,5 мг/мл, приблизительно от 0,05 мг/мл до 1,5 мг/мл, или приблизительно от 0,07 мг/мл до 1,5 мг/мл. В более специфичных вариантах осуществления изобретения, кортикостероид содержится в фармацевтической композиции при концентрации приблизительно от 0,07 мг/мл до 1 мг/мл.
В некоторых вариантах осуществления изобретения, композиция, представленная в описании, содержит кортикостероид (например, будесонид или флутиказона пропионат), один или более эксципиент, который усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, средство, повышающее вязкость, мукоадгезивное свойство, адсорбцию к поверхности желудочно-кишечного тракта и/или всасывание активного ингредиента через поверхность желудочно-кишечного тракта), необязательно один или более связывающий компонент, необязательно один или более эксципиент, необязательно один или более лубрикант, необязательно один или более растворитель (или носитель), необязательно одно или более суспендирующее средство, необязательно одно или более ароматизирующее средство, необязательно один или более краситель, необязательно один или более подсластитель, необязательно один или более консервант, необязательно один или более антиоксидант, необязательно одно или более буферное вещество, необязательно одно или более смачивающее средство, необязательно одно или более хелатирующее средство и необязательно одно или более поверхностно-активное вещество. В специфичных вариантах осуществления изобретения, композиция, представленная в описании, является композицией, содержащей кортикостероид, декстрозу, мальтодекстрин, эдетат, цитрат, полисорбат 80, необязательный консервант, необязательное ароматизирующее средство, необязательный подсластитель, по меньшей мере, один дополнительный эксципиент и жидкий носитель. В специфичных вариантах осуществления изобретения, композиция содержит консервант. В других или альтернативных вариантах осуществления изобретения, композиция содержит ароматизирующее средство. В других или альтернативных вариантах осуществления изобретения, жидким носителем является водная среда (например, вода). В специфичных вариантах осуществления изобретения, частицы кортикостероида (например, микрочастицы) суспендированы в водной среде.
В некоторых вариантах осуществления изобретения, кортикостероид выбирают, в качестве неограничивающего примера, из будесонида, флутиказона пропионата и их комбинаций. В специфичных вариантах осуществления изобретения, кортикостероид содержится в композиции в количестве, составляющем приблизительно от 0,01 мг/мл до 3 мг/мл, приблизительно от 0,01 мг/мл до 2 мг/мл, приблизительно от 0,01 мг/мл до 1,5 мг/мл, приблизительно от 0,07 мг/мл до 1,5 мг/мл, или приблизительно от 0,07 мг/мл до 1 мг/мл. В других специфичных вариантах осуществления изобретения, будесонид содержится в количестве, составляющем приблизительно от 0,01 мг/мл до 3 мг/мл, приблизительно от 0,01 мг/мл до 1,5 мг/мл, или приблизительно от 0,07 мг/мл до 1 мг/мл. В других отдельных вариантах осуществления изобретения, флутиказона пропионат содержится в количестве приблизительно от 0,005 мг/мл до 1,5 мг/мл, или приблизительно от 0,01 мг/мл до 1 мг/мл.
В некоторых вариантах осуществления изобретения, объем композиции или доза композиции, представленной в описании, является количеством, достаточным для значительного “обволакивания” (например, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99%) длины пищевода индивидуума, которому композиция вводится. В определенных вариантах осуществления изобретения, объем композиции или доза композиции, представленной в описании, составляет приблизительно от 0,05 мл/см длины пищевода до 1 мл/см длины пищевода, приблизительно от 0,1 мл/см длины пищевода до 0,8 мл/см длины пищевода, приблизительно от 0,2 мл/см длины пищевода до 0,6 мл/см длины пищевода, или приблизительно от 0,3 мл/см длины пищевода до 0,5 мл/см длины пищевода, где длина пищевода является длиной пищевода индивидуума, которому композиция вводится. В некоторых вариантах осуществления изобретения, объем композиции или доза композиции, представленной в описании, основана на длине пищевода индивидуума (например, мужчины, женщины или обоих), которая имеет значение 50-ой процентили роста для его возраста. Поэтому, в некоторых вариантах осуществления изобретения, объем композиции или доза композиции, представленной в описании, составляет приблизительно от 0,05 мл/см длины пищевода до 1 мл/см длины пищевода, приблизительно от 0,1 мл/см длины пищевода до 0,8 мл/см длины пищевода, приблизительно от 0,2 мл/см длины пищевода до 0,6 мл/см длины пищевода, приблизительно от 0,3 мл/см длины пищевода до 0,5 мл/см длины пищевода, приблизительно от 0,32 мл/см длины пищевода до 0,41 мл/см длины пищевода или приблизительно от 0,3 мл/см длины пищевода до 0,46 мл/см длины пищевода, где длиной пищевода является длина пищевода индивидуума, имеющего рост, соответствующий 50-ой процентили для данного возраста индивидуума, которому композиция вводится. В некоторых примерах, длина пищевода является фактической длиной пищевода или рассчитывается на основе уравнения: длина пищевода = 1,048(см)+(0,167∗рост(см)). В некоторых примерах, например, рост, соответствующий 50-ой процентили (CDC 2000), для мальчика в возрасте 2 лет составляет 87 см, в возрасте 3 лет составляет 95 см, в возрасте 4 лет составляет 102 см, в возрасте 5 лет составляет 109 см, в возрасте 6 лет составляет 115 см, в возрасте 7 лет составляет 122 см, в возрасте 8 лет составляет 128 см, в возрасте 9 лет составляет 134 см, в возрасте 10 лет составляет 139 см, в возрасте 11 лет составляет 144 см, в возрасте 12 лет составляет 149 см, в возрасте 13 лет составляет 156 см, в возрасте 14 лет составляет 164 см, в возрасте 15 лет составляет 170 см, в возрасте 16 лет составляет 174 см, в возрасте 17 лет составляет 175 см, и в возрасте 18 лет составляет 176 см.
Кроме того, в определенных вариантах осуществления изобретения, количество терапевтического средства (например, кортикостероида, такого как будесонид) в композиции или в дозе композиции, представленной в описании, составляет приблизительно от 0,005 мг/см длины пищевода до 0,3 мг/см длины пищевода, приблизительно от 0,008 мг/см длины пищевода до 0,2 мг/см длины пищевода, приблизительно от 0,01 мг/см длины пищевода до 0,15 мг/см длины пищевода, или приблизительно от 0,015 мг/см длины пищевода до 0,1 мг/см длины пищевода, где длина пищевода является длиной пищевода индивидуума, которому композиция вводится. В некоторых вариантах осуществления изобретения, объем композиции или дозы композиции, представленной в описании, основан на длине пищевода индивидуума (например, мужчина, женщина или оба), имеющего рост, соответствующий 50-ой процентили для данного возраста индивидуума. Поэтому, в некоторых вариантах осуществления изобретения, количество терапевтического средства (например, кортикостероида, такого как будесонид) в композиции или дозе композиции, представленной в описнии, составляет приблизительно от 0,005 мг/см длины пищевода до 0,3 мг/см длины пищевода, приблизительно от 0,008 мг/см длины пищевода до 0,2 мг/см длины пищевода, приблизительно от 0,01 мг/см длины пищевода до 0,15 мг/см длины пищевода или приблизительно от 0,015 мг/см длины пищевода до 0,1 мг/см длины пищевода, где длиной пищевода является длина пищевода индивидуума, имеющего рост в 50-ой процентили для возраста индивидуума, которому композиция вводится.
В некоторых вариантах осуществления изобретения, любая фармацевтическая композиция или доза фармацевтической композиции, представленной в описании, получается или вводится в объеме, достаточном для введения болюса при пероральном введении индивидууму. В определенных вариантах осуществления изобретения, композиция имеет объем, который не доставляет ко всему организму избыточные количества активного средства. В некоторых вариантах осуществления изобретения, фармацевтическая композиция или доза получается в объеме, достаточном для доставки болюса при введении индивидууму, где размер болюса у дистального конца пищевода (например, размер болюса до, например, непосредственно до, вхождения или прохождения нижнего сфинктера пищевода) составляет менее чем 90%, менее чем 85%, менее чем 80%, менее чем 75%, менее чем 70%, менее чем 65%, менее чем 60%, менее чем 55%, менее чем 50%, менее чем 45%, менее чем 40%, менее чем 35%, менее чем 30%, менее чем 25%, менее чем 20%, менее чем 15%, менее чем 10% или менее чем 5% размера болюса, который входит в пищевод (например, размер больса после, например, непосредственно после, прохождения верхнего сфинктера пищевода). В некоторых вариантах осуществления изобретения, размер болюса определяют как меру диаметра или объема. В определенных вариантах осуществления изобретения, диаметр сфинктера можно определять, используя гамма-сцинтиграфию. В специфичных вариантах осуществления изобретения, объем композиции или дозы доводят до заданной длины и/или диаметра пищевода индивидуума, которому композиция или доза вводится.
В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает или является HPMC. В специфичных вариантах осуществления изобретения, HPMC содержится в композиции в количестве приблизительно от 1 мг/мл до 100 мг/мл, приблизительно от 30 мг/мл до 70 мг/мл или приблизительно от 5 мг/мл до 50 мг/мл. В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает или является CMC. В специфичных вариантах осуществления изобретения, CMC содержится в композиции в количестве приблизительно от 1 мг/мл до 100 мг/мл, приблизительно от 30 мг/мл до 70 мг/мл или приблизительно от 5 мг/мл до 50 мг/мл. В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает или является MCC. В специфичных вариантах осуществления изобретения, MCC содержится в композиции в количестве приблизительно от 1 мг/мл до 100 мг/мл, приблизительно от 30 мг/мл до 70 мг/мл или приблизительно от 5 мг/мл до 50 мг/мл. В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает карбомер или является карбомером. В специфичных вариантах осуществления изобретения, карбомер содержится в композиции в количестве приблизительно от 2 мг/мл до 250 мг/мл, или приблизительно от 5 мг/мл до 100 мг/мл. В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает или является HEC. В специфичных вариантах осуществления изобретения, НЕС содержится в композиции в количестве приблизительно от 1 мг/мл до 100 мг/мл, приблизительно от 30 мг/мл до 70 мг/мл или приблизительно от 5 мг/мл до 50 мг/мл. В некоторых вариантах осуществления изобретения, по меньшей мере, один дополнительный эксципиент включает или является комбинацией CMC и MCC (например, Авицел® RC-591). В специфичных вариантах осуществления изобретения, комбинация CMC/MCC (например, Авицел® RC-591) содержится в композиции в количестве приблизительно от 1 мг/мл до 150 мг/мл, от 1 мг/мл до приблизительно 75 мг/мл, или приблизительно от 5 мг/мл до 40 мг/мл. В некоторых вариантах осуществления изобретения, массовое отношение смешанных компонентов CMC/MCC составляет приблизительно между 1/99 и 99/1, приблизительно между 20/80 и 5/95, или приблизительно между 15/85 и 10/90. В специфичных вариантах осуществления изобретения, CMC представляет собой NaCMC, и массовое отношение смешанных компонентов CMC/MCC составляет приблизительно 11/89.
В определенных вариантах осуществления изобретения, декстроза содержится в композиции в количестве приблизительно от 10 мг/мл до 1 г/мл. В некоторых вариантах осуществления изобретения, мальтодекстрин содержится в композиции в количестве приблизительно от 10 мг/мл до 1,5 г/мл. В определенных вариантах осуществления изобретения, эдетат содержится в композиции в количестве приблизительно от 0,02 мг/мл до 5 мг/мл, приблизительно от 0,02 мг/мл до 2 мг/мл, или приблизительно от 0,05 мг/мл до 2 мг/мл. В некоторых вариантах осуществления изобретения, цитрат содержится в композиции в количестве приблизительно от 0,1 мг/мл до 50 мг/мл, или приблизительно от 0,2 мг/мл до 30 мг/мл. В определенных вариантах осуществления изобретения, полисорбат 80 содержится в композиции в количестве приблизительно от 0,01 мг/мл до 10 мг/мл, приблизительно от 0,05 мг/мл до 1 мг/мл, или приблизительно от 0,05 до 0,5 мг/мл.
В определенных вариантах осуществления изобретения, количества компонента на мл относятся к количеству компонента по отношению к количеству общего (или достаточного количества) объема композиции в целом, вместо объема любого жидкого компонента, такого как вода, только. В специфичных вариантах осуществления изобретения, предоставлены композиции, содержащие ингредиенты приблизительно в количествах, как указано в любом одном из примеров 1-22, например, в примере 19, примере 20, примере 21 или примере 22.
В определенных вариантах осуществления изобретения, композиции, представленные в описании, также содержат эксципиенты и/или вспомогательные средства, которые способствуют получению композиций в виде таблеток, пилюль, драже, капсул, жидкостей, мягких жевачек, кремов, паст, жевательных таблеток, гелей или гелевых матриксов, сиропов, взвесей, суспензий, камедей, пастилок или тому подобное для перорального введения больным, подвергаемых лечению. В определенных примерах, препараты для перорального введения (например, суспензии, кремы или гелеобразные матриксы) получают так, что при пероральном введении образуется граничный слой между пероральным препаратом (например, суспензией, кремом или гелеобразными матриксами) и поверхностью желудочно-кишечного тракта (например, слизистой оболочкой или эпителием желудочно-кишечного тракта). В некоторых примерах, пероральный препарат (например, суспензия, крем или гелеобразный матрикс) в контакте с поверхностью желудочно-кишечного тракта доставляет кортикостероид к месту желудочно-кишечного тракта, где происходит контакт с препаратом через граничный слой, и поскольку пероральные препараты (например, суспензии, кремы или гелеобразные матриксы) близко от граничного слоя исчерпывают кортикостероид, образуется концентрационный градиент. В некоторых примерах, части пероральных препаратов (например, суспензии, кремы или гелеобразные матриксы) с высокими концентрациями кортикостероида относительно частей пероральных препаратов (например, суспензии, кремы или гелеобразные матриксы), приближенных к граничному слою, пополняют кортикостероидом часть пероральных препаратов (например, суспензии, кремы или гелеобразные матриксы), приближенных к граничному слою. В определенных примерах, при пероральном введении индивидууму пероральных препаратов, представленных в описании, граничный слой образуется между слизистой оболочкой и смесью перорального препарата (например, жевательная таблетка) и слюной индивидуума.
В определенных вариантах осуществления изобретения, фармацевтические композиции, представленные в описании, необязательно содержат воду. В определенных вариантах осуществления изобретения, фармацевтические композиции, представленные в описании, содержат воду в качестве носителя. В некоторых вариантах осуществления изобретения, носителем является комбинация воды и спирта. В других вариантах осуществления изобретения, носителем является неводный носитель.
В некоторых вариантах осуществления изобретения, фармацевтическая композиция или единичная дозированная форма, представленная в описании, представляет собой суспензию, содержащую кортикостероид (например, будесонид). В некоторых вариантах осуществления изобретения, композиции (например, суспензии) содержат определенную концентрацию кортикостероида (например, будесонида), который растворен в жидкой среде (например, растворителе или используемом жидком носителе, таком как вода, спирт, водный спирт или тому подобное). В определенных вариантах осуществления изобретения, количество кортикостероида (например, будесонида), растворенного в жидкой среде (например, в уравновешенном образце), составляет величину больше чем 4 мкг/мл, больше чем 5 мкг/мл, больше чем 10 мкг/мл, больше чем 15 мкг/мл, больше чем 20 мкг/мл, больше чем 21 мкг/мл, больше чем 22 мкг/мл, больше чем 23 мкг/мл, больше чем 24 мкг/мл, больше чем 25 мкг/мл, приблизительно 25 мкг/мл, больше чем 30 мкг/мл, приблизительно от 25 мкг/мл до 80 мкг/мл, приблизительно от 30 мкг/мл до 80 мкг/мл, приблизительно 30 мкг/мл, приблизительно 35 мкг/мл, приблизительно 40 мкг/мл, приблизительно 45 мкг/мл, приблизительно 50 мкг/мл, приблизительно 55 мкг/мл, приблизительно 60 мкг/мл, приблизительно 65 мкг/мл, или приблизительно 70 мкг/мл. В некоторых вариантах осуществления изобретения, кортикостероид (например, будесонид) присутствует в композиции в комбинации с мальтодекстрином. В специфичных вариантах осуществления изобретения, мальтодекстрин имеет DE приблизительно 4-7, или приблизительно 13-17. В некоторых вариантах осуществления изобретения, ациклический олигосахарид (например, мальтодекстрин), присутствующий в композиции, представленной в описании, используют в качестве средства, повышающего растворимость кортикостероида (например, будесонида). Как употребляют в описании, термин “ациклический олигосахарид” относится к олигосахариду или полисахариду, который не образует макроцикл (например, продукт превращения крахмала, такой как мальтодекстрин, или водорастворимая кукурузная патока, или гликан, такой как гиалуроновая кислота); индивидуальные сахаридные мономерные единицы олигосахарида могут быть циклическими. В некоторых вариантах осуществления изобретения, композиции, представленные в описании, содержат кортикостероид (например, будесонид), карбоксиметилцеллюлозу и/или микрокристаллическую целлюлозу (например, Авицел® RC-591) и жидкую среду (например, воду). В специфичных вариантах осуществления изобретения, композиции, представленные в описании, содержат кортикостероид (например, будесонид), карбоксиметилцеллюлозу и/или микрокристаллическую целлюлозу (например, Авицел® RC-591), мальтодекстрин и жидкую среду (например, воду). В других отдельных вариантах осуществления изобретения, композиция содержит больше чем 4 мкг/мл, больше чем 5 мкг/мл, больше чем 10 мкг/мл, больше чем 15 мкг/мл, больше чем 20 мкг/мл, или тому подобное, будесонида, растворенного в жидкой среде (например, воде).
В определенных вариантах осуществления изобретения, ингибитор растворяющей способности необязательно используют в препарате, чтобы ингибировать сольватацию или растворимость кортикостероида. В некоторых примерах, ингибирование сольватации или растворимости кортикостероида позволяет кортикостероиду сохранять химическую стабильность в композиции в течение продолжительного периода времени (в сравнении с подобной композицией, имеющей более высокую концентрацию растворенного кортикостероида). В некоторых вариантах осуществления изобретения, ингибиторы растворяющей способности включают, в качестве неограничивающего примера, дисахариды и моносахариды (например, декстрозу). В определенных вариантах осуществления изобретения, где эксципиент, который усиливает взаимодействие композиции или кортикостероида с поверхностью желудочно-кишечного тракта, также повышает растворимость кортикостероида в носителе композиции (например, водной среде), используют ингибитор растворяющей способности, чтобы уменьшить или ингибировать растворимость или сольватацию кортикостероида (например, такую сольватацию или растворимость, которая облегчается при использовании эксципиента, усиливающего взаимодействие композиции или кортикостероида с поверхностью желудочно-кишечного тракта).
В некоторых вариантах осуществления изобретения, композиции (например, суспензии) содержат определенную концентрацию будесонида, который растворен в жидкой среде (например, растворителе или используемом жидком носителе, таком как вода, спирт, водный спирт или тому подобное). В специфичных вариантах осуществления изобретения, количество R-эпимера растворенного будесонида (сравненное с общей массой будесонида) составляет больше чем 28% масс./масс., больше чем 30% масс./масс., больше чем 39% масс./масс., больше чем 40%, приблизительно 39-50%, приблизительно 40-50%, менее чем 38% масс./масс., приблизительно 29%-37% масс./масс., менее чем 27% масс./масс., или тому подобное. В некоторых примерах, эпимеры в процентах получают в композиции, содержащей общий R-эпимер в процентах (по ставнению с общим будесонидом) приблизительно 50-55% масс./масс. или приблизительно 53-54% масс./масс. В некоторых вариантах осуществления изобретения, мальтодекстрин (например, мальтодекстрин с показателем DE приблизительно 4-7 или приблизительно 13-17) применяют в изобретении в качестве повышающего растворимость средства. В других вариантах осуществления изобретения, мальтодекстрин является усилителем растворимости, который селективно повышает растворимость R-эпимера в сравнении с S-эпимером (например, повышает растворимость R-эпимера в большей степени, чем S-эпимера) будесонида. В других вариантах осуществления изобретения, мальтодекстрин является средством, повышающим растворимость, который селективно повышает растворимость S-эпимера в сравнении с R-эпимером (например, повышает растворимость S-эпимера в большей степени, чем R-эпимера) будесонида. В некоторых примерах, R-эпимер будесонида является менее стабильным, чем S-эпимер. В определенных вариантах осуществления изобретения, композиции, представленные в описании, получают таким образом, чтобы довести количество R- и/или S-эпимера будесонида, растворенного в водной среде, до такой степени, чтобы повысить или увеличить до максимума стабильность (например, химическую стабильность) композиции. В некоторых примерах, концентрация кортикостероида является измеренной концентрацией уравновешенного образца. В определенных примерах, уравновешивание образца завершается как только концентрация кортикостероида (например, будесонида), растворенного в жидкости, становится постоянной, например, после 2 дней, 3 дней, 4 дней, 5 дней, недели, месяца или тому подобное. В специфичных примерах, уравновешивание образца завершается после 2 дней.
В определенных вариантах осуществления изобретения, композиции, представленные в описании, получают при использовании любого подходящего источника активных средств. В некоторых вариантах осуществления изобретения, кортикостероид (например, будесонид), используемый в композициях, представленных в описании, является беспримесным кортикостероидом (например, будесонидом). В некоторых вариантах осуществления изобретения, беспримесный кортикостероид (например, будесонид) является беспримесным нерасфасованным кортикостероидом. В определенных вариантах осуществления изобретения, беспримесный кортикостероид (например, будесонид) является порошкообразным кортикостероидом (например, будесонидом). В специфичных вариантах осуществления изобретения, беспримесный кортикостероид (например, будесонид) является тонкоизмельченным кортикостероидом (например, будесонидом).
В некоторых вариантах осуществления изобретения, кортикостероид вводят в коммерчески доступном препарате. В других вариантах осуществления изобретения, кортикостероид вводят в композиции, содержащей коммерчески доступный препарат кортикостероида, и получают, как представлено в описании. Например, в некоторых вариантах осуществления изобретения, композиция, содержащая кортикостероид, представленная в описании, включает коммерчески доступный препарат и эксципиент, такой как разбавители, ароматизирующее средство, мукоадгезивное средство, средство, повышающее вязкость, связывающее вещество, эксципиент, лубрикант, растворитель, суспендирующее средство, краситель, подсластитель, консервант, антиокидант, буферное вещество, смачивающее средство, хелатирующее средство, поверхностно-активное вещество, их комбинации или тому подобное. В некоторых вариантах осуществления изобретения, где кортикостероидом является будесонид, коммерчески доступным препаратом является Pulmicort Respules® (распространяемый AstraZeneca, например, как указано в NDA 20-929, который включен в описание посредством ссылки во всей полноте). В других вариантах осуществления изобретения, где кортикостероидом является будесонид, коммерчески доступным препаратом является Rhinocort Aqua® (распространяемый AstraZeneca LP, Wilmington, DE 19850, например, как указано в NDA 20-746, который, включая все дополнения, включен в описание посредством ссылки во всей полноте). В других вариантах осуществления изобретения, где кортикостероидом является будесонид, коммерчески доступным препаратом является Symbicort® (производимый AstraZeneca Dunkerque Production, Dunkerque, France, например, как указано в NDA 21-929, который, включая все дополнения, включен в описание посредством ссылки во всей полноте). В некоторых вариантах осуществления изобретения, где кортикостероидом является флутиказон, коммерчески доступным препаратом является Flonase®. В некоторых вариантах осуществления изобретения, отношение коммерчески доступного препарата к необязательному разбавителю составляет приблизительно между 1:0,5 и 1:100. Разбавители включают любой фармацевтически приемлемый разбавитель для перорального введения, включающий, например, порошкообразные разбавители (такие как тальк) и жидкие разбавители (такие как вода, этанол и их комбинации). В некоторых вариантах осуществления изобретения, коммерчески доступным препаратом является Entocort® (производимый AstraZeneca AB, S-151 85 Sodertalje, Sweden, распространяемый Prometheus Laboratories Inc, San Diego, CA 92121, как указано в NDA 21-324, который, включая все дополнения, включен в описание посредством ссылки во всей полноте). В определенных вариантах осуществления изобретения, препараты Entocort® растворены и/или диспергированы в водном носителе. В специфичных вариантах осуществления изобретения, препарат Entocort® диспергирован в жидком носителе, который имеет рН, достаточный для удаления энтеросолюбильного покрытия с частиц будесонида. В других вариантах осуществления изобретения, препарат Entocort® представляет собой предварительно обработанный растворителем препарат, имеющим рН, достаточный для удаления энтеросолюбильного покрытия с частиц будесонида, и частицы впоследствии вводят в состав композиции, представленной в описании.
В определенных вариантах осуществления изобретения, кортикостероидная композиция, представленная в описании, содержит кортикостероид, коммерчески доступный препарат и, необязательно, один или более дополнительный эксципиент. В некоторых вариантах осуществления изобретения, кортикостероидная композиция, представленная в описании, содержит кортикостероид, полученный способом, подобным коммерческому препарату (например, отсутствие одного или более активных ингредиентов препарата), и, необязательно, один или более дополнительный эксципиент. Один или более дополнительных эксципиентов могут быть использованы для приготовления препарата, как представлено в описании. В специфичных вариантах осуществления изобретения, коммерчески доступным препаратом является Ultra XCID (производимый Matrixx Initiatives, Inc., Phoenix, AZ).
В некоторых вариантах осуществления изобретения, кортикостероидом является будесонид, и композиция содержит приблизительно от 0,01 мг до 1,0 мг будесонида/г композиции. В некоторых вариантах осуществления изобретения, композиция содержит приблизительно от 0,1 мг до 1,0 мг будесонида/г композиции. В определенных вариантах осуществления изобретения, композиция содержит приблизительно 0,3 мг до 0,6 мг будесонида/г композиции. В специфичных вариантах осуществления изобретения, композиция содержит приблизительно 0,4 мг или 0,44 мг будесонида/г композиции. В определенных вариантах осуществления изобретения, композиция содержит приблизительно 3,8 мг/8,6 г композиции. В некоторых вариантах осуществления изобретения, композиция содержит приблизительно от 0,01 мг до 1,0 мг будесонида/мл композиции (приблизительно от 0,001 до 0,1% масс./масс.). В некоторых вариантах осуществления изобретения, композиция содержит приблизительно от 0,1 мг до 1,0 мг будесонида/мл композиции (приблизительно от 0,01 до 0,1% масс./масс.). В определенных вариантах осуществления изобретения, композиция содержит приблизительно 0,3 мг до 0,8 мг будесонида/мл композиции (приблизительно от 0,03 до 0,08% масс./масс.). В специфичных вариантах осуществления изобретения, композиция содержит приблизительно от 0,6 до 0,7 мг будесонида/мл композиции (приблизительно от 0,06 до 0,07% масс./масс.). В других отдельных вариантах осуществления изобретения, композиция содержит приблизительно 0,63 мг будесонида/мл композиции (приблизительно 0,063% масс./масс.).
В одном варианте осуществления изобретения, композиция содержащая кортикостероид, включает будесонид, повышающее вязкость средство, консервант, антиоксидант (включающий, например, хелатирующее средство), изотоничное средство, поверхностно-активное вещество, водный носитель, необязательное регулирующее рН средство, и необязательный подсластитель. В определенных вариантах осуществления изобретения, композиция является жидкой. В специфичных вариантах осуществления изобретения, жидкой композицией является суспензия.
В определенных вариантах осуществления изобретения, повышающее вязкость средство содержится в количестве приблизительно от 0,005% до 3,0% масс./масс. композиции. В определенных вариантах осуществления изобретения, повышающее вязкость средство содержится в количестве приблизительно от 0,1% до 3,0% масс./масс. композиции. В специфичных вариантах осуществления изобретения, повышающее вязкость средство представляет собой комбинацию микрокристаллической целлюлозы и карбоксиметилцеллюлозы (например, карбоксиметилцеллюлозы натрия), такой как Авицел RC-591. В других отдельных вариантах осуществления изобретения, комбинация MCC и CMC содержится в количестве приблизительно от 0,05% до 2,5% масс./масс. (или приблизительно от 0,5% до 2,5% масс./масс.) композиции. В некоторых вариантах осуществления изобретения, повышающее вязкость средство выбирают, в качестве неограничивающего примера, из ксантановой камеди в количестве приблизительно от 0,03% до приблизительно 3% масс./масс. (или приблизительно от 0,3% до 3% масс./масс.), карбомера в количестве приблизительно от 0,01% до 2% масс./масс. (или приблизительно от 0,1% до 2% масс./масс.), гуаровой камеди в количестве приблизительно от 0,03% до 2% масс./масс. (или приблизительно от 0,3% до 2% масс./масс.), или HPMC в количестве приблизительно от 0,05% до 3,0% масс./масс. (или приблизительно от 0,5% до 3,0% масс./масс.) композиции. В некоторых вариантах осуществления изобретения, одно или более дополнительные повышающие вязкость средства добавляют для достижения вязкости, описанной в изобретении. Альтернативно, количество упомянутого выше повышающего вязкость средства, присутствующего в композиции, увеличивают для достижения вязкости, описанной в изобретении. В некоторых вариантах осуществления изобретения, комбинация CMC/MCC (например, Авицел® RC-591) содержится в композиции в количестве приблизительно от 1 мг/мл до 150 мг/мл, от 1 мг/мл до 75 мг/мл, или приблизительно от 5 мг/мл до 40 мг/мл. В определенных вариантах осуществления изобретения, массовое отношение смешанных компонентов CMC/MCC составляет приблизительно между 1/99 и 99/1, приблизительно между 20/80 и 5/95, или приблизительно между 15/85 и 10/90. В специфичном варианте осуществления изобретения, CMC является NaCMC, и массовое отношение смешанных компонентов CMC/MCC составляет приблизительно 11/89.
В некоторых вариантах осуществления изобретения, поверхностно-активные вещества включают, в качестве неограничивающего примера, полисорбаты (например, полисорбат 80), полоксамеры, полиоксиэтиленалкиловые эфиры, производные полиоксиэтиленкасторового масла и их комбинации. В определенных вариантах осуществления изобретения, поверхностно-активные вещества содержатся в количестве приблизительно от 0,0005% до 2% масс./масс. (или приблизительно от 0,005% до 2% масс./масс.) композиции. В специфичном варианте осуществления изобретения, поверхностно-активным веществом является полисорбат 80. В специфичных вариантах осуществления изобретения, полисорбаты содержатся в количестве приблизительно от 0,0005% до 2% масс./масс. (или приблизительно от 0,005% до 2% масс./масс.) композиции. В некоторых вариантах осуществления изобретения, полоксамеры содержатся в количестве приблизительно от 0,001% до 2% масс./масс. (или приблизительно от 0,01% до 2% масс./масс.) композиции, полиоксиэтиленалкиловые эфиры содержатся в количестве приблизительно от 0,001% до 1% масс./масс. (или приблизительно от 0,01% до 1% масс./масс.) композиции, и/или производные полиоксиэтиленкасторового масла содержатся в количестве приблизительно от 0,001% до 1% масс./масс. (или от 0,01% до приблизительно 1% масс./масс.) композиции.
В определенных вариантах осуществления изобретения, изотоничное средство включает, в качестве неограничивающего примера, декстрозу, глицерин, маннит, хлорид натрия, хлорид калия и их комбинации. В специфичных вариантах осуществления изобретения, изотоничным средством является декстроза (например, безводная декстроза). В определенных вариантах осуществления изобретения, изотоничное средство включено в любом подходящем количестве, таком как, в качестве неограничивающего примера, приблизительно между 0,5 мг и 0,5 г на грамм композиции. В специфичных вариантах осуществления изобретения, изотоничное средство включено в количестве приблизительно 10 мг и приблизительно 100 мг или приблизительно от 40 мг до 60 мг на грамм композиции.
В некоторых вариантах осуществления изобретения, антиоксиданты включают, в качестве неограничивающего примера, эдетат динатрия (EDTA). В определенных вариантах осуществления изобретения, антиоксидант содержится в количестве приблизительно от 0,0005% до 0,1% масс./масс. (или приблизительно от 0,005% до 0,1% масс./масс.) композиции.
Консерванты включают, в качестве неограничивающего примера, бензалкония хлорид, метилпарабен, пропилпарабен, сорбат калия и бензоат натрия. В специфичных вариантах осуществления изобретения, консервантом является сорбат калия. В некоторых вариантах осуществления изобретения, консервант содержится в количестве приблизительно от 0,0002% до 0,5% масс./масс. (или приблизительно от 0,002% до 0,5% масс./масс.) композиции. В специфичных вариантах осуществления изобретения, бензалкония хлорид содержится в количестве приблизительно от 0,0002% до 0,02% масс./масс. (или приблизительно от 0,002% до 0,02% масс./масс.) композиции, метилпарабен содержится в количестве приблизительно от 0,005% до 0,25% масс./масс. (или приблизительно от 0,05% до 0,25% масс./масс.) композиции, пропилпарабен содержится в количестве приблизительно от 0,001% до 0,2% масс./масс. (или приблизительно от 0,01% до 0,2% масс./масс.) композиции, сорбат калия содержится в количестве приблизительно от 0,005% до 2,0% масс./масс. (или приблизительно от 0,05% до 2,0% масс./масс.) композиции, и/или бензоат натрия содержится в количестве приблизительно от 0,01% до приблизительно 0,5% масс./масс. (или приблизительно 0,1% до 0,5% масс./масс.) композиции.
Подсластители включают, в качестве не органичивающего примера, сукралозу, сахарозу, лактозу, глюкозу, фруктозу, арабинозу, ксилозу, рибозу, маннозу, галактозу, декстрозу, сорбозу, сорбит, маннит, мальтозу, целлобиозу, ксилит, мед и тому подобное. Вообще, когда используют подсластитель, его берут в количестве, достаточном, чтобы, по меньшей мере, частично “скрыть” вкус композиции и/или кортикостероида (например, будесонида).
В некоторых вариантах осуществления изобретения, содержащая кортикостероид композиция включает тонкоизмельченный будесонид, микрокристаллическую целлюлозу, карбоксиметилцеллюлозу натрия, безводную декстрозу, полисорбат 80, эдетат динатния, сорбат калия, воду, необязательно хлористоводородную кислоту и необязательно один или более дополнительный эксципиент. В специфичных вариантах осуществления изобретения, композиция имеет pH приблизительно 4,5. В специфичном варианте осуществления изобретения, по меньшей мере, одним из необязательных эксципиентов является подсластитель, ароматизирующее средство или их комбинация.
В специфичных вариантах осуществления изобретения, вводимая композиция содержит тонкодисперсную суспензию будесонида в водной среде. В других отдельных вариантах осуществления изобретения, микрокристаллическая целлюлоза и карбоксиметилцеллюлоза натрия, безводная декстроза, полисорбат 80, эдетат динатрия, сорбат калия и очищенная вода содержатся в водной среде. В других отдельных вариантах осуществления изобретения, хлористоводородную кислоту добавляют, чтобы довести pH до заданной величины приблизительно 4,5. В определенных вариантах осуществления изобретения, композиции, представленные в описании, получают при использовании любого подходящего источника активных средств. В некоторых вариантах осуществления изобретения, кортикостероид (например, будесонид), используемый в композициях, представленных в описании, является беспримесным кортикостероидом (например, будесонидом). В некоторых вариантах осуществления изобретения, беспримесный кортикостероид (например, будесонид) является беспримесным, нерасфасованным кортикостероидом. В определенных вариантах осуществления изобретения, беспримесный кортикостероид (например, будесонид) является порошкообразным кортикостероидом (например, будесонидом). В специфичных вариантах осуществления изобретения, беспримесный кортикостероид (например, будесонид) является тонкоизмельченным кортикостероидом (например, будесонидом). В характерном варианте осуществления изобретения, композиция содержит Rhinocort Aqua® (производимый AstraZeneca; Rhinocort Aqua® Nasal Spray; 32 мкг будесонида на одно разбрызгивание и 120 измеренных порций после заполнения; листок-вкладыш в упаковке 30516-00, Rev. 01/05, включен в описание посредством ссылки во всей полноте), необязательный разбавитель и необязательный подсластитель. В некоторых вариантах осуществления изобретения, разбавителем является любой носитель, подходящий для перорального введения, включающий, в качестве неограничивающего примера, воду, этанол и их комбинации. В специфичных вариантах осуществления изобретения, разбавителем является вода. В некоторых вариантах осуществления изобретения, композиция содержит Rhinocort Aqua®, дополнительное повышающее вязкость средство (например, Спленда), необязательный разбавитель и необязательный подсластитель и/или ароматизирующее средство. В некоторых вариантах осуществления изобретения, используемая в изобретении композиция включает композицию, содержащую композицию, описанную в патентах США 6291445, 6686346 или 6986904, необязательное дополнительное повышающее вязкость средство или “загуститель”, необязательный разбавитель и необязательный подсластитель и/или ароматизирующее средство. В некоторых вариантах осуществления изобретения, композиция содержит Rhinocort Aqua® и разбавитель, где Rhinocort Aqua® и разбавитель присутствуют в отношении приблизительно 1:0,5 и 1:100. В специфичных вариантах осуществления изобретения, композиция с разбавленным Rhinocort Aqua® также содержит эксципиент, который усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, повышающее вязкость средство).
В некоторых вариантах осуществления изобретения, кортикостероид выбирают, в качестве неограничивающего примера, из флутиказона пропионата. В специфичных вариантах осуществления изобретения, кортикостероид содержится в композиции в количестве приблизительно от 0,01 мг/мл до 3 мг/мл, приблизительно от 0,01 мг/мл до 2 мг/мл, приблизительно от 0,01 мг/мл до 1,5 мг/мл, приблизительно от 0,07 мг/мл до 1,5 мг/мл, или приблизительно от 0,07 мг/мл до 1 мг/мл. В специфичных вариантах осуществления изобретения, флутиказона пропионат содержится в композиции в количестве приблизительно от 0,01 мг/мл до 3 мг/мл, приблизительно от 0,01 мг/мл до 1,5 мг/мл, или приблизительно от 0,07 мг/мл до 1 мг/мл. В других отдельных вариантах осуществления изобретения, флутиказона пропионат содержится в композиции в количестве приблизительно от 0,005 мг/мл до 1,5 мг/мл, или приблизительно от 0,01 мг/мл до 1 мг/мл. В некоторых вариантах осуществления изобретения, кортикостероидом является флукатизона пропионат, и композиция содержит приблизительно от 0,01 мг до 1,0 мг флукатизона пропионата/г композиции. В некоторых вариантах осуществления изобретения, композиция содержит приблизительно от 0,1 мг до 1,0 мг флукатизона пропионата/г композиции. В определенных вариантах осуществления изобретения, композиция содержит приблизительно от 0,3 мг до 0,6 мг флукатизона пропионата/г композиции. В специфичных вариантах осуществления изобретения, композиция содержит приблизительно 0,5 мг флукатизона пропионата/г композиции.
В определенных вариантах осуществления изобретения, настоящее изобретение предоставляет пероральный жидкий препарат, содержащий частицы кортикостероида. В определенных вариантах осуществления изобретения, частицами являются, например, микрочастицы или наночастицы. В некоторых вариантах осуществления изобретения, частицы выбирают с тем, чтобы повысить или увеличить до максимума площадь поверхности кортикостероида на единицу объема фармацевтического препарата по сравнению с другим идентичным фармацевтическим препаратом, содержащим частицы большего размера. В определенных вариантах осуществления изобретения, частицу выбирают с тем, чтобы увеличить площадь поверхности кортикостероида на единицу объема фармацевтического препарата, увеличить скорость растворения кортикостероида и повысить всасывание кортикостероида в ткани желудочно-кишечного тракта.
В одном варианте осуществления изобретения, содержащая кортикостероид композиция содержит флукатизона пропионат, консервант, изотоничное средство, поверхностно-активное вещество, водный носитель, эксципиент, необязательное, регулирующее рН средство (например, хлористоводородная кислота и/или гидроксид натрия) и необязательный подсластитель и/или ароматизирующее вещество. В определенных вариантах осуществления изобретения, эксципиентом является микрокристаллическая целлюлоза (MCC). В других вариантах осуществления изобретения, эксципиентом является карбоксиметилцеллюлоза (CMC). В некоторых вариантах осуществления изобретения, содержащая кортикостероид композиция содержит два или более эксципиента. Например, в некоторых вариантах осуществления изобретения, два или более эксципиента представляют собой комбинацию микрокристаллической целлюлозы (МСС) и карбоксиметилцеллюлозы (СМС). В некоторых вариантах осуществления изобретения, комбинация CMC/MCC (например, Авицел® RC-591) содержится в композиции в количестве приблизительно от 1 мг/мл до 150 мг/мл, от 1 мг/мл до 75 мг/мл, или приблизительно от 5 мг/мл до 40 мг/мл. В определенных вариантах осуществления изобретения, массовое отношение смешанных компонентов CMC/MCC составляет приблизительно между 1/99 и 99/1, приблизительно между 20/80 и 5/95 или приблизительно между 15/85 и 10/90. В специфичном варианте осуществления изобретения, CMC является NaCMC, и массовое отношение смешанных компонентов CMC/MCC составляет приблизительно 11/89. В некоторых вариантах осуществления изобретения, эксципиентом является эксципиент, который усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, слизистой оболочкой и/или эпителием желудочно-кишечного тракта или специфическим отделом желудочно-кишечного тракта, таким как пищевод) (например, повышающее вязкость средство). В определенных вариантах осуществления изобретения, композицией является жидкость. В специфичных вариантах осуществления изобретения, жидкая композиция представляет собой суспензию.
В определенных вариантах осуществления изобретения, эксципиентом, который усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, слизистой оболочкой и/или эпителием желудочно-кишечного тракта или специфического отдела желудочно-кишечного тракта, такого как пищевод), является повышающее вязкость средство. В некоторых вариантах осуществления изобретения, повышающее вязкость средство содержится в количестве приблизительно от 0,01% до 10% масс./масс. композиции. В определенных вариантах осуществления изобретения, повышающее вязкость средство содержится в количестве приблизительно от 0,01% до 5,0% масс./масс., приблизительно от 0,01% до 3,0% масс./масс. или приблизительно от 0,1% до 5,0% масс./масс., приблизительно от 0,1% до 3,0% масс./масс. композиции. В специфичных вариантах осуществления изобретения, повышающее вязкость средство представлено комбинацией микрокристаллической целлюлозы и карбоксиметилцеллюлозы (например, карбоксиметилцеллюлозы натрия). В другом отдельном варианте осуществления изобретения, повышающим вязкость средством является карбоксиметилцеллюлоза. В некоторых вариантах осуществления изобретения, один или более дополнительный эксципиент, который усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, одно или более повышающее вязкость средство), добавляют с тем, чтобы достичь вязкости, как представлено в описании. Альтернативно, количество эксципиента, которое усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, слизистой оболочкой и/или эпителием желудочно-кишечного тракта или специфического отдела желудочно-кишечного тракта, такого как пищевод), присутствующего в композиции, повышают с тем, чтобы достичь вязкости, как представлено в описании.
В некоторых вариантах осуществления изобретения, поверхностно-активные вещества включают, в качестве неограничивающего примера, полисорбаты (например, полисорбат 80), полоксамеры, полиоксиэтиленалкиловые эфиры, производные полиоксиэтиленкасторового масла и их комбинации. В определенных вариантах осуществления изобретения, поверхностно-активные вещества содержатся в количестве приблизительно от 0,0001% до 5% масс./масс., приблизительно от 0,0001% до 2% масс./масс. или приблизительно от 0,001% до 2% масс./масс. композиции. В специфичном варианте осуществления изобретения, поверхностно-активным веществом является полисорбат 80.
В определенных вариантах осуществления изобретения, изотоничное средство включает, в качестве неограничивающего примера, декстрозу, глицерин, маннит, хлорид натрия, хлорид калия и их комбинации. В специфичных вариантах осуществления изобретения, изотоничным средством является декстроза (например, безводная декстроза). В определенных вариантах осуществления изобретения, изотоничное средство включено в любом подходящем количестве, таком как, в качестве неограничивающего примера, приблизительно между 0,5 мг и 0,5 г на грамм композиции. В отдельных вариантах осуществления изобретения, изотоничное средство включено в количестве, приблизительно 10 мг и приблизительно 100 мг или приблизительно от 40 мг до 60 мг на грамм композиции.
Консерванты включают, в качестве неограничивающего примера, бензалкония хлорид, метилпарабен, пропилпарабен, сорбат калия, фенилэтиловый спирт и бензоат натрия. В специфичных вариантах осуществления изобретения, консервантом является сорбат калия. В некоторых вариантах осуществления изобретения, консервант содержится в количестве приблизительно от 0,0002% до 0,5% масс./масс. (или приблизительно от 0,002% до 0,5% масс./масс.) композиции. В специфичных вариантах осуществления изобретения, бензалкония хлорид содержится в количестве приблизительно от 0,0002% до 0,03% масс./масс., приблизительно от 0,002% до 0,03% масс./масс., или приблизительно 0,02% масс./масс. композиции. В некоторых вариантах осуществления изобретения, фенилэтиловый спирт содержится в количестве приблизительно от 0,005% до 0,4% масс./масс., приблизительно от 0,05 до 0,3% масс./масс., или приблизительно 0,25% масс./масс. композиции. В специфичных вариантах осуществления изобретения, как бензалкония хлорид, так и фенилэтиловый спирт присутствуют в композиции.
Подсластители включают, в качестве неограничивающего примера, сукралозу, сахарозу, лактозу, глюкозу, фруктозу, арабинозу, ксилозу, рибозу, маннозу, галактозу, декстрозу, сорбозу, сорбит, маннит, мальтозу, целлобиозу, ксилит, мед и тому подобное. Вообще, когда используют подсластитель, его берут в количестве, достаточном, чтобы, по меньшей мере, частично “скрыть” вкус композиции и/или кортикостероида (например, флутиказона пропионата).
Ароматизаторы включают, в качестве неограничивающего примера, фенилэтиловый спирт. Ароматизатор может содержаться в любом подходящем количестве, включающем, в качестве неограничивающего примера, приблизительно от 0,005% до 0,4% масс./масс., приблизительно от 0,05 до 0,3% масс./масс., или приблизительно 0,25% масс./масс. композиции.
В некоторых вариантах осуществления изобретения, содержащая кортикостероид композиция включает микрочастицы флутиказона пропионата, микрокристаллическую целлюлозу, карбоксиметилцеллюлозу натрия, безводную декстрозу, полисорбат 80, сорбат калия, воду, необязательно хлористоводородную кислоту и необязательно один или более дополнительный эксципиент. В специфичных вариантах осуществления изобретения, композиция имеет рН приблизительно от 5 до 7. В специфичном варианте осуществления изобретения, по меньшей мере, одним из необязательных эксципиентов является подсластитель, ароматизирующее средство или их комбинации.
В специфичных вариантах осуществления изобретения, вводимая композиция представляет собой суспензию микрочастиц флутиказона пропионата в водной среде. В более специфичных вариантах осуществления изобретения, микрокристаллическая целлюлоза и карбоксиметилцеллюлоза натрия, безводная декстроза, полисорбат 80, фенилэтиловый спирт, бензалкония хлорид и вода содержатся в водной среде. В других отдельных вариантах осуществления изобретения, pH композиции регулируют до заданного значения рН приблизительно от 5 до 7. В определенных вариантах осуществления изобретения, композиции, представленные в описании, получают при использовании любого подходящего источника активных средств. В некоторых вариантах осуществления изобретения, кортикостероид (например, флутиказона пропионат), используемый в композициях, представленных в описании, является беспримесным кортикостероидом (например, флутиказона пропионатом). В некоторых вариантах осуществления изобретения, беспримесный кортикостероид (например, флутиказона пропионат) является беспримесным, нерасфасованным кортикостероидом. В определенных вариантах осуществления изобретения, беспримесный кортикостероид (например, флутиказона пропионат) является порошкообразным кортикостероидом (например, флутиказона пропионатом). В специфичных вариантах осуществления изобретения, беспримесный кортикостероид (например, флутиказона пропионат) является тонкоизмельченным кортикостероидом (например, флутиказона пропионатом). В характерном варианте осуществления изобретения, композиция содержит Flonase® (производимый GlaxoSmithKline; Flonase® назальный спрей; 50 мкг флутиказона пропионата на одно распыление и 120 отмеренных распылений после первоначального заполнения; инструкция по применению препарата от августа 2007, © 2007, FLN:1PI, включена в описание посредством ссылки во всей полноте), необязательный разбавитель и необязательный подсластитель. В некоторых вариантах осуществления изобретения, разбавителем является любой носитель, подходящий для перорального введения, включающий, в качестве неограничивающего примера, воду, этанол и их комбинации. В специфичных вариантах осуществления изобретения, разбавителем является вода. В некоторых вариантах осуществления изобретения, композиция содержит Flonase®, вспомогательное повышающее вязкость средство (например, Спленда®), необязательный разбавитель и необязательный подсластитель и/или ароматизирующее средство. В некоторых вариантах осуществления изобретения композиция содержит Flonase® и разбавитель, где Flonase® и разбавитель присутствуют в отношении приблизительно между 1:0,5 и 1:100. В специфичных вариантах осуществления изобретения, композиция с разбавленным Flonase® также содержит эксципиент, который усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, повышающее вязкость средство).
В отдельных, не ограничивающих вариантах осуществления изобретения, предоставлена композиция или способ введения композиции, содержащей компоненты, указанные в любой из таблиц 14 или 15.
Заболевания
В некоторых вариантах осуществления изобретения, предоставлены способы лечения, предотвращения или ослабления воспаления или симптомов, связанных с воспалением желудочно-кишечного тракта, например, пищевода. В специфичных вариантах осуществления изобретения, способ, представленный в описании, является способом уменьшения или ослабления симптомов воспаления желудочно-кишечного тракта. В других отдельных вариантах осуществления изобретения, воспалением желудочно-кишечного тракта является эозинофильный эзофагит (ЕЕ или ЕоЕ). В некоторых вариантах осуществления изобретения, способ, предоставленный изобретением, является способом лечения дисфагии, ассоциированной с эозинофильным эзофагитом (ЕЕ или ЕоЕ). В некоторых вариантах осуществления изобретения, способ, предоставленный изобретением, является способом лечения воспаления и дисфагии, ассоциированной с эозинофильным эзофагитом (ЕЕ или ЕоЕ). В некоторых вариантах осуществления изобретения, способ, предоставленный изобретением, является способом лечения воспаления, ассоциированного с эозинофильным эзофагитом (ЕЕ или ЕоЕ). В определенных вариантах осуществления изобретения, предоставлены способы лечения заболеваний или состояний желудочно-кишечного тракта (например, заболевание или состояние верхнего отдела желудочно-кишечного тракта, включая заболевание или состояние пищевода) путем введения композиции, представленной в описании.
В некоторых вариантах осуществления изобретения, введение композиции, представленной в описании, способствует лечению, предотвращению или ослаблению воспаления или симптомов, ассоциированных с воспалительным заболеванием или состоянием. Заболевания или состояния желудочно-кишечного тракта включают, в качестве неограничивающего примера, любое хроническое воспалительное или злокачественное состояние, которое поражает желудочно-кишечный тракт (например, верхний отдел желудочно-кишечного тракта, пищевод, желудок и/или пищеварительный тракт) и отвечает на стероидную терапию. В определенных вариантах осуществления изобретения, заболевания или состояния, подвергаемые лечению композициями, представленными в описании, включают заболевания или состояния верхнего отдела желудочно-кишечного тракта (включая заболевания или нарушения отдела, идущего перед толстой кишкой), пищевода, желудка и/или пищеварительного тракта. Способы настоящего изобретения являются пригодными, например, для лечения, предотвращения и ослабления воспаления или симптомов воспаления, ассоциированных с эозинофильным эзофагитом, воспалительными кишечными заболеваниями, поражающими пищевод, болезнью Крона, глютеиновой болезнью, патологией проксимальных отделов желудочно-кишечного тракта (например, у индивидуумов, страдающих от гипофункции желчного пузыря), эозинофильным воспалительным заболеванием желудочно-кишечного тракта, эозинофильным дуоденитом, дуоденальной эозинофилией, функциональной диспепсией, промежуточным эзофагитом, гиперплазией эпителия, базальноклеточной гиперплазией, удлиненными сосочками языка, расширенными сосудами в сосочках языка, грибковым эзофагитом (например, кандида, turolopsis, гистоплазма Aspergillus, и т.д.), вирусным эзофагитом (например, HSV, CMV, V2V), бактериальным эзофагитом (например, туберкулез, актиномикоз, сифилис), коррозивным эзофагитом, радиационным эзофагитом, эзофагитом вследствие введения химиотерапевтических средств, реакцией “трансплантат против хозяина”, кожным заболеванием с поражением пищевода (например, буллезный пемфигоид, обыкновенная пузырчатка, врожденный буллезный эпидермолиз, злокачественная экссудативная эритема), болезнью Бехчета, саркоидозом, идиопатическим эзофагитом, эозинофильным гастритом, гигантским гипертрофическим гастритом, паразитическим гастритом, лимфоцитарным эзофагитом, воспалительным заболеванием кишечника, ассоциированным с эзофагитом, острым воспалением пищевода после введения внутрь разъедающего/раздражающего слизистые оболочки средства, стойкими/рецидивирующими стриктурами пищевода, возникающими после введения внутрь разъедающего/раздражающего слизистые оболочки средства, состояниями, обусловленными усвоением пищи, системными заболеваниями, врожденными заболеваниями, послеоперационным воспалением и гастроэнтеритом. Способы настоящего изобретения являются также пригодными, например, для лечения, предотвращения и ослабления воспаления или симптомов, ассоциированных с гастроэзофагеальной рефлюксной болезнью (GERD), неэрозивной рефлюксной болезнью (NERD), пищеводом Барретта и/или эрозивным эзофагитом.
Следует отметить, что ссылка на лечение распространяется на профилактику, а также лечение воспаления или других симптомов.
В определенных вариантах осуществления изобретения, предоставлен способ лечения, предотвращения или ослабления воспаления желудочно-кишечного тракта, включающего, в качестве неограничивающего примера, пищевод, желудок и/или пищеварительный тракт, у индивидуума, включающий введение перорально указанному выше индивидууму любой из композиций, представленных в описании. В определенных вариантах осуществления изобретения, пероральная дозированная форма содержит жидкий носитель и приготовляется в виде, например, взвеси, суспензии, сиропа, дисперсии, раствора и т.д.
В одном аспекте, больному вводят кортикостероид, такой как, например, будесонид или флутиказона пропионат.
В некоторых вариантах осуществления изобретения, воспаление, подвергаемое лечению способами и композициями, представленными в описании, связано с эозинофильным воспалением и/или нейтрофильным воспалением. В некоторых вариантах осуществления изобретения, индивидуумы (например, больные), подвергаемые лечению композициями, представленными в описании, включают тех, у кого выявлен эозинофильный эзофагит, воспалительное заболевание кишечника, поражающее пищевод, болезнь Крона, глютеиновая болезнь, патология проксимальных отделов желудочно-кишечного тракта (например, у индивидуумов, страдающих от гипофункции желчного пузыря), эозинофильное воспалительное заболевание желудочно-кишечного тракта, эозинофильный дуоденит, дуоденальная эозинофилия, функциональная диспепсия, промежуточный эзофагит, гиперплазия эпителия, базальноклеточная гиперплазия, удлиненные сосочки языка, расширенные сосуды в сосочках языка, грибковый эзофагит (например, кандида, turolopsis, гистоплазма Aspergillus, и т.д.), вирусный эзофагит (например, HSV, CMV, V2V), бактериальный эзофагит (например, туберкулез, актиномикоз, сифилис), коррозивный эзофагит, радиационный эзофагит, эзофагит вследствие введения химиотерапевтических средств, реакция “трансплантат против хозяина”, кожное заболевание с поражением пищевода (например, буллезный пемфигоид, обыкновенная пузырчатка, врожденный буллезный эпидермолиз, злокачественная экссудативная эритема), болезнь Бехчета, саркоидоз, идиопатический эзофагит, эозинофильный гастрит, гигантский гипертрофический гастрит, паразитический гастрит, лимфоцитарный эзофагит, воспалительное заболевание кишечника, ассоциированное с эзофагитом, воспаление пищевода после введения внутрь разъедающего/раздражающего слизистые оболочки средства, стойкие/рецидивирующие стриктуры пищевода, возникающие по какой-либо причине и включающие действие разъедающего/раздражающего слизистые оболочки средства, эзофагит, вызванный таблетками, системные заболевания, врожденные заболевания, послеоперационное воспаление или гастроэнтерит. В одном не ограничивающем примере, больной страдает эозинофильным эзофагитом. В некоторых вариантах осуществления изобретения, индивидуумы (например, больные), подвергаемые лечению композициями, представленными в описании, включают тех, у кого выявлена гастроэзофагеальная рефлюксная болезнь (GERD), неэрозивная рефлюксная болезнь (NERD), пищевод Барретта и/или эрозивный эзофагит. В некоторых вариантах осуществления изобретения, больным является взрослый человек. В других вариантах осуществления изобретения, больным является ребенок или младенец. В различных аспектах, больным является ребенок или младенец возраста менее чем 16 лет, менее чем 12 лет, менее чем 8 лет, менее чем 6 лет, менее чем 4 года или менее чем 2 года.
В некоторых вариантах осуществления изобретения, композиция представлена в единичной дозированной форме для перорального введения больному. В некоторых вариантах осуществления изобретения, единичная доза кортикостероида вводится из дозирующего устройства. В некоторых вариантах осуществления изобретения, дозирующее устройство доставляет единичную дозу композиции, представленной в описании, в рот или глотку индивидуума по необходимости. В определенных вариантах осуществления изобретения, дозирующее устройство представляет собой дозирующий ингалятор, который используют для введения дозированной единицы в рот или глотку индивидуума (глотательные движения индивидуумом, а не вдыхания дозированной единицы). В определенных вариантах осуществления изобретения, дозирующее устройство подает дозированную единицу композиции, представленной в описании, в емкость (например, чашку), которую затем используют, чтобы перорально ввести дозированную единицу в рот или глотку.
В некоторых вариантах осуществления изобретения, предоставлена упаковка лекарственного средства для множества доз, содержащая приблизительно от 2 до 180, приблизительно от 10 до 60, приблизительно 14, или приблизительно 30 единичных доз любой фармацевтической композиции, представленной в описании. В специфичных вариантах осуществления изобретения, каждая доза включает приблизительно от 1 мл до 25 мл, приблизительно от 1 мл до 20 мл, приблизительно от 7 мл до 25 мл, приблизительно от 10 до 20 мл, приблизительно 15 мл, приблизительно 20 мл, приблизительно от 3 до 7 мл, приблизительно 5 мл, приблизительно от 8 мл до 12 мл, или приблизительно 10 мл. В более специфичных вариантах осуществления изобретения, каждая доза содержит приблизительно от 0,1 до 20 мг, приблизительно от 0,1 до 10 мг, приблизительно от 0,1 до 7,5 мг, приблизительно от 0,1 до 5 мг, приблизительно от 0,3 до 4 мг, приблизительно от 0,25 до 2,5 мг, приблизительно от 0,3 мг до 2 мг, приблизительно от 0,5 мг до 1 мг, приблизительно от 0,7 мг до 1,5 мг, приблизительно 0,375 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 1,25 мг, приблизительно 1,5 мг или приблизительно 2 мг кортикостероида. В определенных вариантах осуществления изобретения, предоставлена упаковка для множества доз, содержащая приблизительно от 10 мл до 1500 мл, приблизительно от 50 мл до 600 мл, приблизительно 150 мл, приблизительно 300 мл, приблизительно 600 мл, или приблизительно 1200 мл любой фармацевтической композиции, представленной в описании. В специфичных вариантах осуществления изобретения, упаковка для множества доз содержит приблизительно 330 мл или приблизительно 55 мл композиции, представленной в описании. В некоторых вариантах осуществления изобретения, набор, представленный в описании, содержит любую упаковку для множества доз, как представлено в описании, фармацевтическую композицию, представленную в описании (например, в описанном объеме), и подающее или дозирующее устройство (например, шприц, чашка, ложка или тому подобное). В специфичных вариантах осуществления изобретения, подающее устройство включено в упаковку (например, ингалятор, аэрозольный баллон, насос или тому подобное). В определенных вариантах осуществления изобретения, фармацевтическая композиция, содержащаяся в любой из упаковок для множества доз, представленных в описании, является физически и химически стабильной.
В определенных аспектах, больному вводят приблизительно от 0,1 мг до 20 мг, приблизительно от 0,25 мг до 20 мг, приблизительно от 0,25 мг до 15 мг, приблизительно от 0,25 мг до 10 мг, или приблизительно от 0,25 мг до 5 мг (например, приблизительно от 0,1 до 5 мг, приблизительно от 0,3 мг до 4 мг, приблизительно от 0,25 до 2,5 мг, приблизительно от 0,3 мг до 2 мг, приблизительно от 0,5 мг до 1 мг, приблизительно от 0,7 мг до 1,5 мг, приблизительно 0,375 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 1,25 мг, приблизительно 1,5 мг или приблизительно 2 мг) кортикостероида в день. В некоторых вариантах осуществления изобретения, кортикостероид содержится в единичной дозе в количестве приблизительно между 0,25 мг и 5 мг. В некоторых вариантах осуществления изобретения, количество кортикостероида, вводимое ежедневно или в единичной дозе, составляет приблизительно между 0,1 мг и 20 мг. В некоторых вариантах осуществления изобретения, количество кортикостероида, вводимое ежедневно или в единичной дозе, составляет приблизительно между 0,3 мг и 4 мг. В определенных вариантах осуществления изобретения, количество кортикостероида, вводимое ежедневно или в единичной дозе, составляет приблизительно между 0,5 мг и 3 мг. В других вариантах осуществления изобретения, количество кортикостероида, содержащееся в единичной дозе или вводимое ежедневно, составляет приблизительно между 1 и 3 мг, или приблизительно между 1 и 2 мг, или приблизительно между 2 и 3 мг.
В некоторых вариантах осуществления изобретения, дозу или объем вводимой композиции регулируют на основании эффективности лечения. В определенных вариантах осуществления изобретения, диагноз эозинофильного эзофагита (EE или EoE) достигают путем введения композиции, представленной в описании, и определения эффективности лечения. В определенных вариантах осуществления изобретения, используется композиция, представленная в описании, и, как отдельно установлено, являющаяся эффективной в лечении эозинофильного эзофагита (EE или EoE). Эффективность лечения может быть определена любым подходящим способом, включающим, например, шкалу оценки симптомов, гастроинтестиноскопию (например, эзофагогастродуоденоскопию), биопсию желудочно-кишечного тракта (например, пищевода), гистологическим исследованием или их комбинации. Способы диагностики эозинофильного эзофагита (EE или EoE) и/или определения эффективности лечения включают любой подходящий способ, к числу которых относятся, в качестве неограничивающего примера, способы, описанные в публикациях Aceves et al, J Allergy Clin Immunol, Feb. 2008; abstract 270, или Aceves et al., Am J Gastroenterol., Oct. 2007, 102(10):2271-9, обе из которых включены в описание во всей полноте.
В некоторых вариантах осуществления изобретения, способ определения эффективности лечения (например, эозинофильного эзофагита), представленный в описании, представляет собой шкалу оценки клинических симптомов, включающий (i) введение композиции, представленной в описании, индивидууму с установленным или потенциальным диагнозом эозинофильным эзофагитом; и (ii) оценку одного или более симптома у индивидуума. В определенных вариантах осуществления изобретения, до введения композиции, способ влючает оценку одного или более симптома у индивидуума. Симптомы, которые необязательно подвергают оценке, включают, в качестве неограничивающего примера, тошноту, рвоту, боль и изжогу. Общую оценку или изменение в оценке необязательно используют для диагностики нарушения и/или определения эффективности лечения.
В определенных вариантах осуществления изобретения, способ определения эффективности лечения, представленный в описании, включает (i) введение композиции, представленной в описании, индивидууму с установленным диагнозом воспалением желудочно-кишечного тракта (например, эозинофильный эзофагит) или, по предположению, страдающим указанным заболеванием; (ii) эндоскопию поверхности желудочно-кишечного тракта индивидуума; (iii) биопсию ткани гастроинтестинальной поверхности; и (iv) оценку биопсийной ткани и необязательно оценку данных эндоскопии биопсийных тканей. В специфичных вариантах осуществления изобретения, способ также включает сравнение результатов биопсии ткани и/или данных эндоскопии, полученных до введения композиции, с биопсийной тканью и/или результатом эндоскопии после введения композиции.
В некоторых вариантах осуществления изобретения, предоставлен способ диагностики у индивидуума воспаления желудочно-кишечного тракта путем (i) определения и/или оценки симптомов у индивидуума до введения индивидууму композиции, представленной в описании; (ii) введение индивидууму любой композиции, представленной в описании; (iii) определения и/или оценки симптомов у индивидуума после введения индивидууму композиции; и (iv) сравнение симптомов, оцененных или обнаруженных до и после введения композиции, представленной в описании. Если симптомы, проявляемые индивидуумом, уменьшаются (например, с помощью статистически значимого или клинически соответствующего количества), то диагноз поставлен правильно. В специфичных вариантах осуществления изобретения, способ обнаружения у индивидуума желудочно-кишечного воспаления представляет собой диагностику у индивидуума эозинофильного эзофагита.
В некоторых вариантах осуществления изобретения, предоставлен способ лечения, предотвращения или ослабления воспаления желудочно-кишечного тракта, включающий введение перорально индивидууму по необходимости композиции, содержащей кортикостероид, консервант, антиоксидант, изотоничное средство, поверхностно-активное вещество и эксципиент, который усиливает взаимодействие композиции со слизистой оболочкой. В некоторых вариантах осуществления изобретения, кортикостероидом является, в качестве неограничивающего примера, будесонид. В специфичных вариантах осуществления изобретения, кортикостероид содержится в композиции в количестве приблизительно от 0,01 мг до 1,0 мг кортикостероида на грамм композиции. В некоторых вариантах осуществления изобретения, кортикостероид содержится в композиции в количестве приблизительно от 0,01 мг до 1,0 мг кортикостероида на мл композиции.
В некоторых вариантах осуществления изобретения, консервантом является, в качестве неограничивающего примера, сорбат калия. В специфичных вариантах осуществления изобретения, консервант содержится в композиции в количестве приблизительно от 0,0002% до 0,5% масс./масс. композиции. В некоторых вариантах осуществления изобретения, антиоксидантом является, в качестве неограничивающего примера, эдетат динатрия. В специфичных вариантах осуществления изобретения, антиоксидант содержится в композиции в количестве приблизительно от 0,0005% до 0,1% масс./масс. композиции. В определенных вариантах осуществления изобретения, изотоничным средством является, в качестве неограничивающего примера, декстроза. В некоторых вариантах осуществления изобретения, поверхностно-активным веществом является, в качестве неограничивающего примера, полисорбат 80. В специфичных вариантах осуществления изобретения, поверхностно-активное вещество содержится в композиции в количестве приблизительно от 0,0005% до 2% масс./масс. композиции. В определенных вариантах осуществления изобретения, эксципиентом, который усиливает взаимодействие композиции со слизистой оболочкой, является повышающее вязкость средство. В специфичных вариантах осуществления изобретения, повышающее вязкость средство выбирают, в качестве неограничивающего примера, из микрокристаллической целлюлозы, карбоксиметилцеллюлозы натрия и их комбинации. В других отдельных вариантах осуществления изобретения, повышающее вязкость средство представлено комбинацией микрокристаллической целлюлозы и карбоксиметилцеллюлозы натрия. В некоторых вариантах осуществления изобретения, повышающее вязкость средство содержится в композиции в количестве приблизительно от 0,01% до 3,0% масс./масс. композиции. В определенных вариантах осуществления изобретения, повышающим вязкость средством является Авицел® RC-591.
В некоторых вариантах осуществления изобретения, композиция содержит первый и второй эксципиент. В специфичных вариантах осуществления изобретения, второй эксципиент выбирают из эксципиента, который усиливает взаимодействие композиции со слизистой оболочкой, связывающего вещества, наполняющего материала, дезинтегрирующего средства, разбавителя, носителя, среды и их комбинаций. В других вариантах осуществления изобретения, второй эксципиент, который усиливает взаимодействие композиции со слизистой оболочкой, является вторым повышающим вязкость средством. В некоторых вариантах осуществления изобретения, вторым эксципиентом является носитель (включая разбавитель), и оно содержится в композиции в количестве приблизительно от 50% до 99,5% масс./масс. композиции. В специфичных вариантах осуществления изобретения, носитель выбирают, в качестве неограничивающего примера, из жидкого носителя, твердого носителя и их комбинаций. В некоторых вариантах осуществления изобретения, носителем является твердый носитель, и его выбирают, в качестве неограничивающего примера, из талька, бентонита, каолина, карбоната кальция и их комбинаций. В определенных вариантах осуществления изобретения, носителем является жидкий носитель, и его выбирают, в качестве неограничивающего примера, из воды, этанола, органического растворителя, масла (например, кукурузного масла) и их комбинаций. В специфичных вариантах осуществления изобретения, содержащую кортикостероид композицию получают в виде тонкодисперсной суспензии кортикостероида в водном носителе.
В некоторых вариантах осуществления изобретения, содержащая кортикостероид композиция имеет заданное значение pH приблизительно 4,5. В определенных вариантах осуществления изобретения, заданное значение pH композиции достигается путем добавления к композиции средства, регулирующего pH. В специфичных вариантах осуществления изобретения, регулирующим pH средством является, в качестве неограничивающего примера, хлористоводородная кислота или гидроксид натрия.
В определенных вариантах осуществления изобретения, содержащая кортикостероид композиция также содержит, в качестве неограничивающего примера, подсластитель, ароматизирующее средство или их комбинацию.
В специфичных вариантах осуществления настоящего изобретения, содержащая кортикостероид композиция включает будесонид в качестве кортикостероида, сорбат калия в качестве консерванта, эдетат динатрия в качестве антиоксиданта, декстрозу в качестве изотоничного средства, полисорбат 80 в качестве поверхностно-активного вещества, комбинацию микрокристаллической целлюлозы и карбоксиметилцеллюлозы натрия в качестве эксципиента, который усиливает взаимодействие композиции со слизистой оболочкой, и хлористоводородную кислоту в качестве регулирующего pH средства. В других отдельных вариантах осуществления изобретения, содержащая кортикостероид композиция содержит приблизительно от 0,01 мг до 1,0 мг будесонида на мл композиции, приблизительно от 0,0002% до 0,5% масс./масс. сорбата калия, приблизительно от 0,0005% до 0,1% масс./масс. эдетата динатрия, приблизительно от 0,0005% до 2% масс./масс. полисорбата 80 и приблизительно от 0,01% до 3,0% масс./масс. комбинации микрокристаллической целлюлозы и карбоксиметилцеллюлозы натрия. В других более специфичных вариантах осуществления изобретения, композиция также содержит водный носитель. В некоторых вариантах осуществления изобретения, содержащую кортикостероид композицию получают в виде тонкодисперсной суспензии будесонида в водном носителе. В других более специфичных вариантах осуществления изобретения, композиция имеет значение pH приблизительно 4,5. В некоторых вариантах осуществления изобретения, композиция содержит второй эксципиент, который усиливает взаимодействие композиции со слизистой оболочкой.
Определенные варианты осуществления настоящего изобретения предоставляют способ лечения, предотвращения или ослабления воспаления желудочно-кишечного тракта, включающий введение перорально индивидууму по необходимости композиции, содержащей кортикостероид, консервант, изотоничное средство, поверхностно-активное вещество и эксципиент.
В определенных вариантах осуществления изобретения, кортикостероидом является, в качестве неограничивающего примера, флутиказона пропионат. В некоторых вариантах осуществления изобретения, кортикостероид содержится в композиции в количестве приблизительно от 0,01 мг до 1,0 мг кортикостероида на грамм композиции.
В некоторых вариантах осуществления изобретения, консервантом является, в качестве неограничивающего примера, бензалкония хлорид. В определенных вариантах осуществления изобретения, консервант содержится в композиции в количестве приблизительно от 0,0002% до 0,03% масс./масс. композиции.
В некоторых вариантах осуществления изобретения, изотоничным средством является, в качестве неограничивающего примера, декстроза. В определенных вариантах осуществления изобретения, поверхностно-активным веществом является, в качестве неограничивающего примера, полисорбат 80. В некоторых вариантах осуществления изобретения, эксципиентом является эксципиент, который усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, слизистой оболочкой и/или эпителием желудочно-кишечного тракта или конкретным отделом желудочно-кишечного тракта, таким как пищевод). В определенных вариантах осуществления изобретения, эксципиентом, который усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, слизистой оболочкой и/или эпителием желудочно-кишечного тракта или конкретным отделом желудочно-кишечного тракта, таким как пищевод), является повышающее вязкость средство. В некоторых вариантах осуществления изобретения, повышающее вязкость средство выбирают, в качестве неограничивающего примера, из микрокристаллической целлюлозы, карбоксиметилцеллюлозы натрия и их комбинации. В определенных вариантах осуществления изобретения, повышающее вязкость средство представлено комбинацией микрокристаллической целлюлозы и карбоксиметилцеллюлозы натрия. В других специфичных вариантах осуществления изобретения, повышающим вязкость средством является карбоксиметилцеллюлоза натрия. В некоторых вариантах осуществления изобретения, содержащая кортикостероид композиция согласно настоящему изобретению содержит второй эксципиент. В определенных вариантах осуществления изобретения, второй эксципиент выбирают, в качестве неограничивающего примера, из эксципиента, который усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, слизистой оболочкой и/или эпителием желудочно-кишечного тракта или конкретным отделом желудочно-кишечного тракта, таким как пищевод), связывающего средства, наполняющего материала, дезинтегрирующего средства, разбавителя, носителя, среды и их комбинаций. В специфичных вариантах осуществления изобретения, вторым эксципиентом, который усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, слизистой оболочкой и/или эпителием желудочно-кишечного тракта или конкретным отделом желудочно-кишечного тракта, таким как пищевод), является второе повышающее вязкость средство.
В некоторых вариантах осуществления изобретения, композиция также содержит ароматизатор. В специфичных вариантах осуществления изобретения, ароматизатором является, в качестве неограничивающего примера, фенилэтиловый спирт. В некоторых вариантах осуществления изобретения, ароматизатор содержится в композиции в количестве приблизительно от 0,0005 до 0,4% масс./масс. композиции.
В определенных вариантах осуществления изобретения, носитель содержится в композиции в количестве приблизительно от 50% до 99,5% масс./масс. композиции. В некоторых вариантах осуществления изобретения, носитель выбирают из жидкого носителя, твердого носителя и их комбинаций. В определенных вариантах осуществления изобретения, твердый носитель выбирают, в качестве неограничивающего примера, из талька, бентонита, каолина, карбоната кальция и их комбинаций. В некоторых вариантах осуществления изобретения, жидкий носитель выбирают, в качестве неограничивающего примера, из воды, этанола, органического растворителя, масла и их комбинаций.
В некоторых вариантах осуществления изобретения, композицию получают в виде суспензии микрочастиц кортикостероида, суспендированных в водном носителе. В определенных вариантах осуществления изобретения, композиция имеет значение рН приблизительно от 5 до 7.
В некоторых вариантах осуществления изобретения, композиция также содержит подсластитель, ароматизирующее средство или их комбинацию.
В специфичных вариантах осуществления изобретения, кортикостероидом является сверхтонкий флутиказона пропионат, консервантом является бензалкония хлорид, изотоничным средством является декстроза, поверхностно-активное вещество представляет собой полисорбат 80, ароматизатором является фенилэтиловый спирт и эксципиентом, который усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, слизистой оболочкой и/или эпителием желудочно-кишечного тракта или конкретным отделом желудочно-кишечного тракта, таким как пищевод), является комбинация микрокристаллической целлюлозы и карбоксиметилцеллюлозы натрия. В некоторых вариантах осуществления изобретения, кортикостероидом является сверхтонкий флукатизона пропионат, консервант представляет собой комбинацию бензалкония хлорида и фенилэтилового спирта, изотоничным средством является декстроза, поверхностно-активным веществом является полисорбат 80 и эксципиентом, который усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, слизистой оболочкой и/или эпителием желудочно-кишечного тракта или конкретным отделом желудочно-кишечного тракта, таким как пищевод), является комбинация микрокристаллической целлюлозы и карбоксиметилцеллюлозы натрия. В более специфичных вариантах осуществления изобретения, композиция также содержит водный носитель. В еще более специфичных вариантах осуществления изобретения, композицию получают в виде суспензии микрочастиц кортикостероида, суспендированных в водном носителе. В некоторых вариантах осуществления изобретения, композиция имеет значение pH приблизительно от 5 до 7. В определенных вариантах осуществления изобретения, композиция также содержит второй эксципиент, который усиливает взаимодействие композиции с поверхностью желудочно-кишечного тракта (например, слизистой оболочкой и/или эпителием желудочно-кишечного тракта или конкретным отделом желудочно-кишечного тракта, таким как пищевод).
В некоторых вариантах осуществления изобретения, бензалкония хлорид содержится в композиции в количестве приблизительно от 0,0002% до 0,03% масс./масс. композиции, и фенилэтиловый спирт содержится в композиции в количестве приблизительно 0,0005 до 0,4% масс./масс. композиции.
Как уже указано, описанные композиции и препараты содержат, по меньшей мере, один кортикостероид (например, будесонид или флукатизона пропионат). В некоторых вариантах осуществления изобретения, описанная композиция или препарат также содержит, по меньшей мере, одно дополнительное активное средство. В специфичных вариантах осуществления изобретения, описанная композиция или препарат содержит терапевтически эффективное количество кортикостероида и терапевтически эффективное количество, по меньшей мере, одного дополнительного активного средства. В некоторых вариантах осуществления изобретения, по меньшей мере, одним дополнительным активным средством является средство, которое способствует лечению, предотвращению или ослаблению симптомов и/или воспаления, ассоциированного с воспалительными заболеваниями, поражающими желудочно-кишечный тракт (например, пищевод). Следует понимать, что в отдельных примерах, при комбинировании кортикостероида с дополнительным активным средством, терапевтически эффективное количество кортикостероида снижается по сравнению с тем, когда дополнительное активное средство отсутствует.
Кроме того, изобретением предоставлены способы предотвращения или ослабления воспаления желудочно-кишечного тракта (например, пищевода) у индивидуума, включающие введение перорально индивидууму кортикостероида в ассоциации или комбинации, по меньшей мере, с одним дополнительным активным средством. В определенных вариантах осуществления изобретения, кортикостероид и, по меньшей мере, одно дополнительное активное средство содержатся в одной дозированной форме. В других вариантах осуществления изобретения, кортикостероид и, по меньшей мере, одно дополнительное активное средство содержатся в разных дозированных формах и вводятся любым способом, включающим, в качестве неограничивающего примера, одновременное, последовательное и в разное время. Например, в определенных вариантах осуществления изобретения, несколько доз кортикостероидной композиции вводится в течение периода времени, после которого введение кортикостероидной композиции прерывается, и вводится, по меньшей мере, одно дополнительное активное средство, по меньшей мере, один раз.
В некоторых вариантах осуществления изобретения, по меньшей мере, одно дополнительное активное средство, используемое в композиции, препарате или способе, которые представлены в описании, является средством, которое способствует лечению, предотвращению или ослаблению симптомов и/или воспаления, ассоциированного с воспалительными заболеваниями, поражающими желудочно-кишечный тракт (например, пищевод). В более специфичных вариантах осуществления изобретения, по меньшей мере, одно дополнительное активное средство, не является вторым кортикостероидом. В специфичных вариантах осуществления изобретения, по меньшей мере, одно дополнительное активное средство, является ингибитором кислоты (например, антагонист H2 и/или PPI). В определенных вариантах осуществления изобретения, по меньшей мере, одно дополнительное активное средство, представляет собой, в качестве неограничивающего примера, ингибитор протонного насоса (PPI), лиганд гистаминового (например, H1, H2 и/или H3) рецептора (например, антагонист), средство, снижающее транзиторную релаксацию нижнего пищеводного сфинктера (TLESR), прокинетическое серотонинергическое средство, калий-конкурентный кислотный блокатор (P-CAB), средство, защищающее слизистую оболочку, антигастриновое средство, антагонист лейкотриена, ингибитор дегрануляции тучных клеток, стабилизатор мембран тучных клеток, иммуномодулятор, биопрепарат, противоастматическое средство, нестероидное противовоспалительное лекарственное средство (NSAID), химиотерапевтическое средство, антагонисты HiGIuR5, модулятор ацетилхолина, агонист 5HT4-рецептора, антагонист 5HT3-рецептора, антагонист 5НТ1-рецептора, антибиотики или их комбинации. В определенных вариантах осуществления изобретения, по меньшей мере, одним дополнительным активным средством является антацид (например, карбонат кальция и/или гидроксид магния).
PPI (ингибиторы протонного насоса), пригодные для изобретения, включают, в качестве неограничивающего примера, омепразол, гидроксиомепразол, эзомепразол, тенатопразол, лансопразол, пантопразол, рабепразол, донтопразол, габепразол, перпразол, рансопразол, парипразол, леминопразол, S-тенатопразол-Na и декслансопразол.
В некоторых вариантах осуществления изобретения, по меньшей мере, одним дополнительным активным средством является лиганд H2-рецептора (например, антагонист H2-рецептора). В определенных вариантах осуществления изобретения, антагонисты H2-рецептора, используемые в изобретении, включают, в качестве неограничивающего примера, циметидин, ранитидин, фамотидин и низатидин. В некоторых вариантах осуществления изобретения, терапевтическим средством является лиганд H3-рецептора (например, агонист или антагонист). В определенных вариантах осуществления изобретения, подходящие агонисты H3-рецептора включают, в качестве неограничивающего примера, (R)-α-метилгистамин. В некоторых вариантах осуществления изобретения, терапевтическим средством является лиганд H1-рецептора (например, антагонист).
В определенных вариантах осуществления изобретения, по меньшей мере, одним дополнительным активным средством является TLESR-снижающее средство. Подходящие TLESR-снижающие средства включают, в качестве неограничивающего примера, агонисты GABAB-рецепторов (например, баклофен), антагонисты холецистокинина (CCK-A или CCK-1), антихолинергические средства, ингибиторы NO-синтазы и их комбинации.
В некоторых вариантах осуществления изобретения, по меньшей мере, одним дополнительным активным средством является прокинетическое серотонинергическое средство. В определенных вариантах осуществления изобретения, подходящие прокинетические серотонинергические средства включают, в качестве неограничивающего примера, агонисты 5-HT4-рецептора (например, избирательные агонисты 5-HT4-рецептора). Агонисты 5-HT4-рецептора включают, в качестве неограничивающего примера, цисаприд, мосаприд, тегасерод и ATI-7505.
В некоторых вариантах осуществления изобретения, по меньшей мере, одним дополнительным активным средством является калий-конкурентный кислотный блокатор (P-CAB). В определенных вариантах осуществления изобретения, подходящий блокатор P-CAB включает, в качестве неограничивающего примера, сорапразан (BY359), ревапразан (YH1885), AZD0865, CS-526 и их комбинации.
В определенных вариантах осуществления изобретения, по меньшей мере, одним дополнительным активным средством является средство, защищающее слизистую оболочку. В некоторых вариантах осуществления изобретения, подходящие средства, защищающие слизистую оболочку, включают, в качестве неограничивающего примера, сукралфат. В некоторых вариантах осуществления изобретения, средства, защищающие слизистую оболочку, включают, один или более простагландин E2 (PGE2), эпидермальный фактор роста (EGF) и/или трансформирующий ростовой фактор-α (TGF-α) или их аналоги. В специфичных вариантах осуществления изобретения, средство, защищающее слизистую оболочку, включает аналог PGE2тримопростил.
В определенных вариантах осуществления изобретения, по меньшей мере, одним дополнительным активным средством является антигастриновое средство. В некоторых вариантах осуществления изобретения, подходящие антигастриновые средства включают, в качестве неограничивающего примера, антагонисты холецистокинина (CCK-B или CCK-2). Антагонисты холецистокинина (CCK-B или CCK-2) включают, в качестве неограничивающего примера, Z-360.
В некоторых вариантах осуществления изобретения, терапевтическим средством является ранозаживляющее средство, средство, способствующее выживанию клеток, средство, способствующее пролиферации клеток, противогрибковое средство, антибактериальное средство, антибиотик и их комбинация.
В других вариантах осуществления изобретения, по меньшей мере, одним дополнительным активным средством является прокинетик. В некоторых вариантах осуществления изобретения, прокинетики включают, в качестве не ограничивающих вариантов осуществления изобретения, метоклопрамид, цисаприд, бетанехол или тому подобное.
В некоторых вариантах осуществления изобретения, по меньшей мере, одним дополнительным активным средством является химиотерапевтическое средство. В некоторых вариантах осуществления изобретения, химиотерапевтические средства включают, в качестве неограничивающего примера, 5-фторурацил, цисплатин, доцетаксел, иринотекан, митомицин, паклитаксел, виндезин, винорелбин и тому подобное.
В определенных вариантах осуществления изобретения, по меньшей мере, одним дополнительным активным средством является ингибитор дегрануляции тучных клеток. В некоторых вариантах осуществления изобретения, подходящие ингибиторы дегрануляции тучных клеток включают, в качестве неограничивающего примера, кромолин, кромолин натрия, недокромил и тому подобное. В определенных вариантах осуществления изобретения, терапевтическим средством является антагонист лейкотриена. В некоторых вариантах осуществления изобретения, подходящие антагонисты лейкотриенов включают, в качестве неограничивающего примера, монтелукаст, зафирлукаст, зилеутон и тому подобное. В некоторых вариантах осуществления изобретения, ингибиторы дегрануляции тучных клеток, представленные в описании (например, монтелукаст), содержатся в композиции или дозе композиции, представленной в описании, в количестве, достаточном для введения индивидуумом приблизительно от 0,1 до 20 мг/день, приблизительно от 0,3 до 4 мг/день, приблизительно от 10 мг/день до 500 мг/день, приблизительно от 20 мг/день до 40 мг/день, приблизительно от 20 мг/день до 100 мг/день, или в любом другом терапевтически эффективном количестве.
В некоторых вариантах осуществления изобретения, по меньшей мере, одним дополнительным активным средством является нестероидное противовоспалительное лекарственное средство (NSAID). В специфичных вариантах осуществления изобретения, NSAID является кетопрофен. В различных других вариантах осуществления изобретения, терапевтическим средством является противовоспалительное средство, например, средство, предложенное в международной публикации WO 2008/070129, которая включена в описании посредством ссылки во всей полноте.
В некоторых вариантах осуществления изобретения, по меньшей мере, одним дополнительным активным средством является иммуномодулятор или иммунодепрессант. В специфичных вариантах осуществления изобретения, иммуномодулятором является 6-меркаптопурин (6MP), азатиоприн, суплатаста тозилат, микофенолата мофетил, лактобациллус, ингибиторы кальциневрина (например, такролимус, циклоспорин или тому подобное) или тому подобное.
В определенных вариантах осуществления изобретения, по меньшей мере, одним дополнительным активным средством является биопрепарат. В специфичных вариантах осуществления изобретения, биопрепаратом является анти-IL-5, анти-TNF (например, TNF-α), IFN (например, IFN-α), антитело против эотаксина-1, анти-IL-3, анти-IgE, омализумаб, резлизумаб, меполизумаб, даклизумаб, SCH55700 или тому подобное.
В некоторых вариантах осуществления изобретения, химиотерапевтические средства включают, в качестве неограничивающего примера, иматиниб, иматиниба мезилат, дазатиниб, AMN 107, кладрибин или тому подобное.
В некоторых вариантах осуществления изобретения, по меньшей мере, одним дополнительным активным средством является спазмолитик, средство для лечения боли в груди (например, нитраты, нитроглицерин или тому подобное), лекарственное средство, обычно вводимое сублингвально (например, витамины, минералы или тому подобное), меполиз, эзомепраз, STI571, иматиниб, анти-CD25 (например, даклизумаб), ингибиторы тирозинкиназы, соматостатин, аналоги соматостатина, анти-CCR-3, анти-TIM-3, кетотифен, ингибитор рецептора тромбоцитарного фактора роста (PDGFR) или тому подобное.
Полнота каждого патента, заявки на патент, публикации и документа, упомянутые в описании, включена в него посредством ссылки. Цитирование указанных выше патентов, заявок на патенты, публикаций и документов не должно быть истолковано как признание того, что любую из упомянутых выше ссылок можно рассматривать как предшествующий настоящему изобретению уровень техники, не является каким-либо подтверждением содержания или даты указанных публикаций или документов.
Если не указано иное, все технические и научные термины, используемые в описании, имеют одинаковые значения, как обычно подразумевается специалистом в данной области, к которой принадлежит данное изобретение. Хотя любые способы и системы, подобные или эквивалентные тем, которые представлены в описании, могут быть использованы на практике или при проверке настоящего изобретения, способы, устройства и материалы описаны в данной работе. Все публикации, упоминаемые в описании, включены посредством ссылки с целью описания и раскрытия способов, систем и методологий, приведенных в публикациях, которые могут быть использованы в связи с изобретением. Ничто не должно быть истолковано как признание того, что изобретение не имеет право противопоставлять такое раскрытие предшествующему изобретению.
Модификации предлагаемого изобретения могут быть сделаны, не отклоняясь от основных аспектов изобретения. Хотя изобретение описано подробно со ссылкой на один или более варианты осуществления изобретения, специалисты в данной области должны признать, что изменения могут быть сделаны к вариантам осуществления изобретения, точно раскрытым в данной заявке, и все же указанные модификации и улучшения входят в истинный объем данного изобретения. Иллюстративно описанное изобретение соответствующим образом может быть осуществлено на практике в отсутствие какого-либо элемента(ов), специально не раскрытого в изобретении. Таким образом, например, в каждом примере изобретения, любой из терминов “включающий”, “состоящий, в основном, из” и “состоящий из” может быть заменен любым из описанных других двух терминов. Таким образом, термины и выражения, которые были использованы в качестве способов выражения описания без ограничения, эквивалентов показанных и описанных признаков, или их частей, не исключены, и следует признать, что различные модификации возможны в объеме данного изобретения.
Хотя определенные варианты осуществления изобретения показаны и описаны, специалистам в данной области следует иметь в виду, что такие аспекты изобретения обеспечиваются только с помощью примера. Многочисленные вариации, изменения и замены будут иметь место для специалистов в данной области и рассматриваются, как входящие в объем данного изобретения. Следует понимать, что различные альтернативы вариантам осуществления изобретения, представленным в описании, могут быть использованы в практике изобретения. Следует иметь в виду, что прилагаемая формула изобретения определит объем изобретения, и что способы и структуры, входящие в объем указанной формулы изобретения, и ее эквиваленты, охвачены изобретением.
ПРИМЕРЫ
Пример 1
Препарат, содержащий будесонид
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 2
Препарат, содержащий будесонид
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 3
Препарат, содержащий будесонид
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 4
Препарат, содержащий будесонид
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 5
Препарат, содержащий будесонид
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 6
Препарат, содержащий будесонид
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 7
Препарат, содержащий будесонид
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 8
Препарат, содержащий будесонид
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 9
Препарат, содержащий будесонид
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 10
Препарат, содержащий флутиказона пропионат
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 11
Препарат, содержащий флутиказона пропионат
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 12
Препарат, содержащий флутиказона пропионат
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 13
Препарат, содержащий флутиказона пропионат
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 14
Препарат, содержащий флутиказона пропионат
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 15
Препарат, содержащий флутиказона пропионат
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 16
Препарат, содержащий флутиказона пропионат
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 17
Препарат, содержащий флутиказона пропионат
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 18
Препарат, содержащий флутиказона пропионат
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию делят на единичные дозы в количестве приблизительно от 1 мл до 10 мл (например, приблизительно 5 мл) и вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 19
Препарат, содержащий будесонид
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 20
Препарат, содержащий будесонид
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 21
Препарат, содержащий будесонид
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 22
Препарат, содержащий будесонид
Типичную композицию, предоставленную изобретением, получают путем комбинирования следующих компонентов:
Композицию вводят перорально индивидууму с целью лечения, предотвращения или ослабления воспаления или симптомов воспалениякишечного тракта (например, пищевода).
Пример 23
В некоторых примерах, препараты, описанные в указанных выше примерах, приведены в соответствие с количеством, достаточным для получения любого желаемого количества, например, приблизительно 150 мл или 300 мл общего объема композиции, либо приведены к объему композиции, описанной в примерах, приблизительно 150 мл, или объем приведенной композиции доведен до большего объема и разделен на меньшие части, например, части, составляющие приблизительно 150 мл. Части, например, такие, которые составляли приблизительно 150 мл или 300 мл, затем моглы быть помещены в упаковку для многократного введения. Затем, множество доз могло быть распределено и введено индивидууму для лечения, предотвращения или ослабления воспаления или симптомов воспаления желудочно-кишечного тракта (например, пищевода).
Пример 24
Растворимость будесонида отдельных препаратов описана. Для того чтобы определить растворимость будесонида в жидкой среде препарата, твердые частицы препарата фильтровали. Образцы центрифугировали при 12000 об./мин. и 20°С, используя центробежные фильтры Whatman, 0,45 мкм (Nylon). Время фильтрации изменялось в зависимости от образца, однако, главным образом, составляло интервал между 5 минутами и 1 часом. Перед центрифугированием, образцы уравновешивали, при необходимости, для достижения по существу уравновешенной концентрации будесонида. Концентрацию будесонида в жидкой среде и процент (масс./масс) растворенного будесонида, которым являлся R-эпимер, определяли. Препарат А получали путем комбинирования двух Pulmicort Respules® (0,5 мг будесонида в 2 мл каждый) с 10 г Спленда® (распространяемая McNeil Nutritionals, LLC Fort Washington, PA 19034- 2299; приблизительно 1 г на упаковку) и уравновешивания в течение приблизительно 48 часов. Препарат В получали путем комбинирования двух Pulmicort Respules® (0,5 мг будесонида в 2 мл каждый) с 9 г мальтодекстрина с DE приблизительно 17 и малым количеством сукралозы, и уравновешивания в течение приблизительно 48 часов. Для получения препаратов C-I, избыток частиц будесонида объединяли с водой и необязательно мальтодекстрином и уравновешивали в течение 5 дней. Препарат С представлял собой насыщенный будесонид в воде. Препарат D являлся водной композицией, содержащей 2,5% (масс./масс.) мальтодекстрина (M440, DE 4-7). Препарат E являлся водной композицией, содержащей 5% (масс./масс.) мальтодекстрина (M440, DE 4-7). Препарат F являлся водной композицией, содержащей 10% (масс./масс.) мальтодекстрина (M440, DE 4-7). Препарат G являлся водной композицией, содержащей 7,5% (масс./масс.) мальтодекстрина (M150, DE 13-17). Препарат Н являлся водной композицией, содержащей 15% (масс./масс.) мальтодекстрина (M150, DE 13-17). Препарат I являлся водной композицией, содержащей 30% (масс./масс.) мальтодекстрина (M 150, DE 13-17). Препарат J являлся водной композицией примера 22, содержащей 26% (масс./масс.) мальтодекстрина (M150, DE 13-17). Препарат K являлся водной композицией, содержащей 20% (масс./масс.) декстрозы, уравновешенной в течение 48 часов. Препарат L являлся водной композицией, содержащей 40% (масс./масс.) декстрозы, уравновешенной в течение 48 часов. Препарат M получали путем комбинирования избытка будесонида и GUM® Rincinol® P.R.N.ТМ и фильтрования. Результаты представлены в таблице 10.
Относительно препарата А, неуравновешенная концентрация будесонида составляла 28 мкг/мл, 38,7% масс./масс. растворенного будесонида составлял R-эпимер. Относительно препарата В, неуравновешенная концентрация будесонида составляла 48 мкг/мл, 45,3% масс./масс. растворенного будесонида составлял R-эпимер.
Пример 25
Данный пример иллюстрирует эффективность и безопасность использования один раз в день и дважды в день препаратов, содержащих будесонид, примеров 21 и 22 в 5 мл, 7 мл, 10 мл, 12 мл, 15 мл и 17,5 мл доз в индукции и поддержании ремиссии активности заболевания у детей с ЕЕ. Несколько детей (например, 20 на проверку частоты, количества и объема дозы будесонида) проверяли для определения наибольшего счета эозинофилов (eos/hpf) и среднего значения наибольшего счета эозинофилов на группу. Определение наибольшего счета эозинофилов (eos/hpf) и среднего значения наибольшего счета эозинофилов на группу проводили после терапии. Показатели по шкале симптомов и средние значения показателей по шкале симптомов также определяли до и после терапии.
В некоторых примерах, индивидуумы, получавшие предшествующую терапию ингибитором протонного насоса, элиминационную диету, основанную на проверке кожи и крови на аллергии, или элиминационную диету или отказывались от элиминационной диеты, но у которых число эозинофилов продолжало оставаться >=24 eos/hpf в биоптатах пищевода, были включены в исследование. Больных определяли как имеющих пищевую аалергию или аллергию от аэроаллергенов, если RAST и/или скарификационная проба были положительные. Никаких изменений не было сделано по отношению к продолжительной терапии, применяемой для лечения хронических состояний, таких как астма или экзема и ни один ребенок не получал сопутствующую иммуномодулирующую терапию.
Эндоскопию осуществляли при использовании эндоскопа Olympus P160 (RD), и для исследования брали пан-эзофагеальные, желудочные и дуоденальные биоптаты. Эозинофильный эзофагит (EE или EoE) диагностировали, когда обнаруживали >=24 eos/hpf, по меньшей мере, в одном из участков пишевода, взятых на биопсию. Два биоптата слизистой оболочки были взяты из проксимального отдела пищевода (3 см ниже перстнеглоточной мышцы), дистального отдела пищевода (3 см выше гастроэзофагеального соединения (GEJ) и середины пищевода (середины между перстнеглоточной мышцы и GEJ). Биоптаты обрабатывали обычным способом, и их оценивал педиатр-патолог (RN). Наибольшее число эозинофилов на поле зрения микроскопа при большом увеличении ×400 считали. Базально-клеточную гиперплазию (BZH) наблюдали, когда зона базальных клеток распространялась по отношению к люминальной поверхности эпителия (>25% толщины эпителия).
Следующая эндоскопия с биоптатами была сделана после 3-4 месяцев лечения. Подсчет наибольшего числа eos/hpf в биоптатах позволил определить ответную реакцию на терапию, и больных распределяли по категориям на больных, ответивших на лечение (0-7 eos/hpf), частично ответивших на лечение (8-23 eos/hpf) и не ответивших на лечение (>=24 eos/hpf).
Оценку эндоскопии EE (EoE) выводили, чтобы сравнить данные до и после лечения. Подсчеты производили на основании протоколов проделанной работы и фотографий. Четыре категории, (1) бледность и уменьшенные сосудистые тени; (2) образование борозд с “утолщенной” слизистой оболочкой; (3) белые бляшки слизистой оболочки; (4) концентрические кольца или структуры. Для каждой категории, один пункт выделяли, если 1 или 2 участка пищевода поражалось, и два пункта для пан-эзофагеального поражения. Максимальная оценка составляла 8.
Больные получали препарат, представленный в описании, в количестве между 0,25 и 2 мг ежедневно, и им рекомендовали не принимать твердую пищу или жидкости в течение 30 минут после введения препарата. Никаких изменений в питании не было сделано для больных, которые имели ограничения в пище.
Модифицированную шкалу симптомов, основанную на кислотно-пептическом заболевании у детей, использовали, как принято, в клинике для больных ЕЕ (ЕоЕ). Категории симптомов включали (1) изжогу или отрыжку; (2) абдоминальную боль или необъяснимую возбудимость у детей младшего возраста; (3) тошноту или рвоту; (4) анорексию или чувство быстрого насыщения; (5) дисфагию или одинофагию; (6) ночное пробуждение с симптомами; (7) желудочно-кишечное кровотечение (предшествующие 4 месяца). Каждая категория набирала 0-2 пункта с максимумом 14 пунктов. Нулевые пункты получали, если симптом отсутствовал; один пункт, если симптом был слабо выраженным, не мешал повседневным активностям; 2 пункта, если симптомы были достаточно выраженными, мешали повседневным активностям. Предшествующее кровотечение GI рассматривалось как слабое (1 пункт), если оно не ассоциировалось с нарушением гемодинамики или анемией, и как тяжелое (2 пункта), если кровотечения были множественные, вызванные анемией, или требующие переливания крови.
Весь статистический анализ выполняли, используя пакет статистических программ NCSS. Двухсторонний критерий р-величины рассчитывали, используя двухсторонний критерий Стьюдента, чтобы провести у больных сравнения средних величин eos/hpf, результатов эндоскопии EE (EoE) и счет симптомов до и после терапии будесонидом. Двухсторонний критерий Стьюдента использовали, чтобы сравнить переменные величины, объединенные в группы относительно больных, ответивших на лечение, против больных, не ответивших на лечение. Коэффициенты корреляции Спирмена вычисляли, используя программу GraphPad Prism. Результаты с величинами p<0,05 рассматривали, как статистически значимые. Средние значения и медианы получали, оба показателя являются эквивалентными, и средние значения представляли.
Субъекты. Анализ амбулаторных карт и историй болезни у ряда детей выполняли. Все дети имели >24 eos/hpf при повторной биопсии пищевода до начала терапии.
Лечение. Больные получали описанный препарат в течение означенного периода времени (например, 1 недели, 2 недель, 1 месяца, 2 месяцев, 3 месяцев, 4 месяцев, 6 месяцев или тому подобное) до повторной эндоскопии. Различные больные получали будесонид в количествах, колеблющихся от 0,25 до 2 мг/день.
Гистология. До лечения, определяли средний наибольший счет эозинофилов у всех больных, включая участки дистальных, срединных и проксимальных отделов пищевода. Все участки аналогично охарактеризовывали в течение означенного периода времени, и еще раз, если желательно.
Эндоскопия верхних отделов желудочно-кишечного тракта. До лечения, средний показатель эндоскопии EE (EoE) для всех больных определяли. После лечения, средний показатель эндоскопии EE (EoE) вновь определяли. Уменьшения показателей в эндоскопии (например, >95%, >90%, >85%, >75%, >50%, >25%, или тому подобное) у индивидуума указывает на успешное лечение.
Шкала симптомов. До лечения, средний показатель по шкале симптомов для всех больных определяли. Такую оценку вновь производили после лечения. Уменьшения показателей по шкале симптомов (например, >95%, >90%, >85%, >75%, >50%, >25% или тому подобное) у индивидуума указывает на успешное лечение (только или в комбинации с указанными выше уменьшениями в показателях эндоскопии).
Взрослые люди: определение указанных выше параметров у взрослых людей повторяли для оценки эффективности и безопасности лечения.
Пример 26
Данный пример иллюстрирует увеличение взаимодействия между описанной в изобретении композицией и поверхностью пищевода при сравнении с пероральной композицией, меченной радиоактивным изотопом, полученной путем комбинирования Pulmicort Respules® (4 мл) с99mTc-пертехнетатом и разбавления физиологическим раствором до приблизительно 7-8 мл (MO). MO-композиция имела вязкость приблизительно 1 сП при скорости сдвига 13,2 сек-1. Также, популяции здоровых индивидуумов вводили композицию с меченым радиоактивным изотопом будесонидом (Rhinocort Aqua®, M1), которая имела вязкость приблизительно 39 при 13,2 сек-1. Увеличение взаимодействия композиции, содержащей будесонид, определяли путем измерения количества радиоактивной метки, присутствующей в пищеводе после перорального введения будесонидной композиции М1. Фигура 1 иллюстрирует количество композиции в процентах, обнаруженное в пищеводе, как функция времени после перорального введения (путем измерения количества радиоактивной метки, присутствующей в пищеводе).
Площадь под кривой (AUCr) процента введенной дозы как функцию от времени (% дозы-время(мин)) определяли от времени 50% проглатывания (т.е., 50% введенной дозы прошло от ротовой полости), до того, как активность пищевода достигала пика и падала до 10% максимальной величины. Площадь под кривой от t=0 мин до t=1 мин (AUC0-1); и от t=0 мин до t=2 мин (AUC0-2) также определяли. Полученные результаты (включающие отношение невязкого образца к вязкому образцу) представлены ниже:
Пример 27
В данном примере подробно описаны результаты определения эффективности и безопасности использования один раз в сутки и два раза в сутки препарата или композиции, представленных изобретением, для индукции и поддержания состояния ремиссии заболевания у индивидуумов (дети и/или взрослые) с GERD. Дозы 0-1 мг, 1-2 мг, 2-3 мг, 3-4 мг, 4-5 мг и 5-6 мг на суточную дозу вводили один раз в день, два раза в день или три раза в день в объемах 3, 5, 7, 10, 12, 15 или 17,5 мл. На ряде индивидуумов (например, 20 на проверку частоты, количества и объема дозы будесонида) проводили исследования с целью оценки симптомов до терапии, в течение терапии и после терапии. Введение осуществляли в течение 7 дней, 14 дней и 28 дней. Измерения первичных результатов включали полное избавление от изжоги и отрыжки (например, не более чем один день с умеренной изжогой или отрыжкой в течение семи дней до оценки момента времени). Измерения вторичных результатов включали: число дней с изжогой (в дневное время и в ночное время); число дней с отрыжкой (в дневное время и в ночное время); число дней без изжоги и отрыжки (24 часа); суммарный балл частоты и тяжести изжоги и отрыжки; время до разрешения симптомов изжоги/отрыжки; тяжесть дополнительных симптомов GERD; качество жизни (оцененное с помощью шкалы PAGI-QOL или PGIC (общее впечатление больного об изменении)); полное избавление от изжоги; полное избавление от отрыжки; изжогу средней тяжести (в дневное время и в ночное время); отрыжку средней тяжести (в дневное время и в ночное время). Указанные симптомы оценивали по шкале (например, присваивание балла 3 наиболее тяжелым симптомам и 0 отсутствию симптомов), и результаты использовали для определения эффективности лечения.
Ссылки
1. Liacouras С A, Ruchelli E. Eos i пор hi lie esophagitis. Cuff. Opin. Pediatr. 2004; 16:560-6.
2. Kelly К J, Lazenby A J, Rowe P C, et al. Eosinophilic esophagitis attributed to gastroesophageal reflux: improvement with an amino acid-based formula. Gastroenterology 1995; 109: 1503-12.
3. Fogg M I, Ruchelli E, Spergel J M. Pollen and eosinophilic esophagitis. J. Allergy CHn. Immunol. 2003; 112:796-7.
4. Mishra A, Hogan S P, Brandt E B, Rothenberg M E. An etiological role for aeroallergens and eosinophiis in experimental esophagitis. J. Clin. Invest. 2001; 107:83-90.
5. Spergel J M, Beausoleil J L, Mascarenhas M, Liacouras С A. The use of skin prick tests and patch tests to identify causative foods in eosinophilic esophagitis. J. Allergy Clin. Immunol. 2002; 109:363-8.
6. Ruchelli E, Wenner W, Voytek T, et al. Severity of esophageal eosinophilia predicts response to conventional gastroesophageal reflux therapy. Pediatr. Dev. Patho]. 1999; 2:15-8.
7. Steiner S J, Gupta S K, Croffie J M, Fitzgerald J F. Correlation between number of eosinophiis and reflux index on same day esophageal biopsy and 24 hour esophageal pH monitoring. Am. J. Gastroenterol. 2004; 99:801-5.
8. Orenstein S R, Shalaby T M, Di Lorenzo C, et al. The spectrum of pediatric eosinophilic esophagitis beyond infancy: a clinical series of 30 children. Am. J. Gastroenterol. 2000; 95:1422-30.
9. Rothenberg M E, Mishra A, Collins M H, Putnam P E. Pathogenesis and clinical features of eosinophilic esophagitis. J. Allergy Clin. Immunol. 2001; 108:891-4.
10. Ravelli A M, Villanacci V, Ruzzenenti N, et al. Dilated Intercellular Spaces: A Major Morphological Feature of Esophagitis, J. Pediatr. Gastroenterol. Nutr. 2006; 42:510-515.
11. Steiner S J, Kemek К M, Fitzgerald J F. Severity of Basal Cell Hyperplasia Differs in Reflux Versus Eosinophilic Esophagitis. J. Pediatr. Gastroenterol. Nutr. 2006; 42:506-509.
12. Mueller S, Aigner T, Neureiter D, Stolte M. Eosinophil infiltration and degranulation in oesophageal mucosa from adult patients with eosinophilic oesophagitis: a retrospective comparative study on pathologic biopsy. J. Clin. Pathol. 2006; 59:1175-80.
13. Croese J, Fairley S K, Masson J W, et al. Clinical and endoscopic features of eosinophilic esophagitis in adults. Gastrointest. Endosc. 2003; 58:516-22.
14. Aceves S, Newbury, RO, Dohil R, Schwimmer J, Bastian J. Distinguishing Eosinophilic Esophagitis in pediatric patients: clinical, endoscopic, and histologic features of an emerging disorder. Journal of Clinical Gastroenterology 2006; 41(3):252-6.
15. Straumann A, Simon H U. Eosinophilic esophagitis: escalating epidemiology? J. Allergy Clin. Immunol. 2005; 115:418-9.
16. Cherian S, Smith N M, Forbes D A. Rapidly increasing prevalence of eosinophilic oesophagitis in Western Australia. Arch. Dis. Child 2006; 91:1000-4.
17. Sant'Anna A M, Rolland S, Fournet J C, et al. Eosinophilic Esophagitis in Children: Symptoms, Histology and pH Probe Results. J. Pediatr. Gastroenterol. Nutr. 2004; 39:373-377.
18. Potter J W, Saeian K, Staff D, et al. Eosinophilic esophagitis in adults: an emerging problem with unique esophageal features. Gastrointest. Endosc. 2004; 59:355-61.
19. Parfitt J R, Gregor J C, Suskin N G, et al. Eosinophilic esophagitis in adults: distinguishing features from gastroesophageal reflux disease: a study of 41 patients. Mod. Pathol. 2006; 19:90-6.
20. Desai T K, Stecevic V, Chang С Н, et al. Association of eosinophilic inflammation with esophageal food impaction in adults. Gastrointest Endosc. 2005; 61:795-801.
21. Straumann A, Spichtin H P> Grize L, et al. Natural history of primary eosinophilic esophagitis: a follow-up of 30 adult patients for up to 11.5 years. Gastroenterology 2003; 125:1660-9.
22. Spergel J M, Andrews T, Brown-Whitehom T F, et al. Treatment of eosinophilic esophagitis with specific food elimination diet directed by a combination of skin prick and patch tests. Алл. Allergy Asthma Immunol. 2005; 95:336-43.
23. Kagalwalla A F, Sentongo T A, Ritz S, et al. Effect of six-food elimination diet on clinical and histologic outcomes in eosinophilic esophagitis. Clin. Gastroenterol. Hepatol. 2006; 4:1097-102.
24. Markowitz J E, Spergel J M, Ruchelli E, Liacouras С A. Elemental diet is an effective treatment for eosinophilic esophagitis in children and adolescents. Am. J. Gastroenterol. 2003; 98:777-82.
25. Liacouras С A, Wenner W J, Brown K, Ruchelli E. Primary eosinophilic esophagitis in children: successful treatment with oral corticosteroids. J. Pediatr. Gastroenterol. Nutr. 1998; 26:380-5.
26. Teitelbaum J E, Fox V L, Twarog F J, et al. Eosinophilic esophagitis in children: immunopathological analysis and response to fluticasone propionate. Gastroenterology 2002; 122:1216-25.
27. Faubion W A, Jr., Perrault J, Burgart L J, et al. Treatment of eosinophilic esophagitis with inhaled corticosteroids. J. Pediatr. Gastroenterol, Nutr. 1998; 27:90-3.
28. Aceves S S, Dohil R, Newbury R O, Bastian J F. Topical viscous budesonide suspension for treatment of eosinophilic esophagitis. J. Allergy Clin. Immunol. 2005; 116:705-6.
29. Noel R J, Putnam P E, Collins M H, et al. Clinical and immunopathologic effects of swallowed fluticasone for eosinophilic esophagitis. Clin. Gastroenterol. Hepatol. 2004; 2:568-75.
30. Remedios M, Campbell C, Jones D M, Kerlin P. Eosinophilic esophagitis in adults: clinical, endoscopic, histologic findings, and response to treatment with fluticasone propionate. Gastrointest. Endosc. 2006; 63:3-12.
31. Dohil R, Newbury R O, Sellers 2 M, et al. The evaluation and treatment of gastrointestinal disease in children with cystinosis receiving cysteamine. J. Pediatr. 2003; 14:224-30.
32. Cheung К M, Oliver M R, Cameron D J, et al. Esophageal eosinophilia in children with dysphagia. J. Pediatr. Gastroenterol. Nutr. 2003;37:498-503.
33. Fox V L, Nurko S, Furuta G T. Eosinophilic esophagitis: it's not just kid's stuff. Gastrointest. Endosc. 2002; 56:260-70
34. Budin C, Villard-Truc F, Rivet C, et al. [Eosinophilic esophagitis: 3 case reports]. Gastroenterol. Clin. Biol. 2005; 29:73-5.
35. Noel R J, Putnam P E, Rothenberg M E. Eosinophilic esophagitis. N. Engl. J. Med. 2004; 351:940-1.
36. Guajardo J R, Plotnick L M, Fende J M, et al. Eosinophil-associated gastrointestinal disorders: a world-wide-web based registry. J. Pediatr. 2002; 141:576-81.
37. Liacouras С A, Spergel J M, Ruchelli E, et al. Eosinophilic esophagitis: a 10-year experience in 381 children. Clin. GastroenteroL Hepatol. 2005; 3:1198-206.
38. Liacouras С A. Eosinophilic esophagitis: treatment in 2005. Curr. Opin. Gastroenterol. 2006; 22:147-152.
39. Spergel JM. Eosinophilic esophagitis in adults and children: evidence for a food allergy component in many patients. Curr. Opin. Allergy Clin. Immunol. 2007; 7:274-8.
40. Plaza-Martin, AM, Jimenez-Feijoo R, Andaluz C, Giner-Munoz MT, Martin-Mateos MA, Piquer-Gibert M, Sierra-Martinez JI. Polysensitlzation to aeroallergens mid food in eosinophilic esophagitis in a pediatric population. Alergol. Immunopathol. 2007; 35:35-7.
41. Nicolazzo, JA, Reed, BL, Finnin, ВС. Buccal penetration enhancers - how do they really work J. Controlled Release 2005; 105:1-15.
42. Furuta, GT, Liacouras, CA, Collins, MH, Sandeep, KG, Justinich, C, Putnam, PE, Bonis, P, Hassall, E, Straumann, A, Rothenberg, ME. Eosiniophilic esophagitis in children and adults: A systematic review and consensus recommendations for diagnosis and treatment. Gastroenterology 2007; 133:1342-1363.
43. Aceves, SS, Bastian JF, Newbury, RO, Dohil, R. Oral viscous budesonide: A potential new therapy for eosinophilic esophagitis. Amer. Journal of Gastroenterology 2007; 102:1-9.
44. Rothenberg M E. Eosinophilic gastrointestinal disorders. J. Allergy Clin. Immunol. 2004; 113:11-28.
45. Garrett J K, Jameson S C, Thomson B, Collins M H, Wagoner L E, Freese, D K, et al. Anti-interleukin-5 (mepolizumab) therapy for hypereosinophilic syndromes. J. Allergy Clin. Immunol. 2004; 113:115-9.
Реферат
Настоящее изобретение относится к медицине и описывает стабильные пероральные жидкие фармацевтические композиции для лечения воспаления пищевода или ассоциированных с ним симптомов, содержащие: кортикостероид в количестве, терапевтически эффективном для лечения воспаления пищевода, антиоксидант, буфер, поверхностно-активное вещество, консервант, ароматизирующее средство, подсластитель или их комбинацию, по меньшей мере, один дополнительный эксципиент, который повышает взаимодействие композиции с поверхностью пищевода, декстрозу в количестве 0-500 мг на мл композиции и жидкий носитель, где композиции являются физически и химически стабильными, причем композиции остаются по существу однородными, по меньшей мере, в течение 1 дня, и где композиции являются подходящими для однократного или многодозового введения. Изобретение обеспечивает стабильность композиций. 4 н. и 34 з.п. ф-лы, 27 пр., 1 ил., 39 табл.
Формула
a. кортикостероид в количестве, терапевтически эффективном для лечения воспаления пищевода,
b. антиоксидант,
c. буфер,
d. поверхностно-активное вещество,
e. консервант, ароматизирующее средство, подсластитель или их комбинацию,
f. по меньшей мере, один дополнительный эксципиент, который повышает взаимодействие композиции с поверхностью пищевода,
g. декстрозу в количестве 0-500 мг на 1 мл композиции и
h. жидкий носитель,
где композиция является физически и химически стабильной, причем композиция остается, по существу, однородной, по меньшей мере, в течение 1 дня, и где композиция является подходящей для однократного или многодозового введения.
a. кортикостероид в количестве, терапевтически эффективном для лечения воспаления пищевода,
b. эдетат,
c. цитрат,
d. полисорбат 80 и
e. воду.
a. будесонид в количестве приблизительно от 0,02 до 0,75 мг на 1 мл композиции,
b. эдетат в количестве приблизительно от 0,05 до 25 мг на 1 мл композиции,
c. цитрат в количестве приблизительно от 0,1 до 30 мг на 1 мл композиции,
d. полисорбат 80 в количестве приблизительно от 0,05 до 1 мг на 1 мл композиции,
e. консервант, ароматизирующее средство, подсластитель или их комбинацию,
f. по меньшей мере, один дополнительный эксципиент и
g. водный жидкий носитель.
a. кортикостероид в количестве, терапевтически эффективном для лечения воспаления пищевода,
b. антиоксидант,
c. буфер,
d. поверхностно-активное вещество,
e. консервант, ароматизирующее средство, подсластитель или их комбинацию,
f. по меньшей мере, один дополнительный эксципиент, который повышает взаимодействие композиции с поверхностью пищевода,
g. декстрозу в количестве 0-500 мг на 1 мл композиции и
h. жидкий носитель,
где каждая доза композиции является физически и химически стабильной, причем каждая доза композиции остается, по существу, однородной, по меньшей мере, в течение 1 дня.
a. кортикостероид в количестве, терапевтически эффективном для лечения воспаления пищевода,
b. повышающее вязкость средство, которое повышает взаимодействие композиции с поверхностью пищевода,
c. декстрозу в количестве 0-500 мг на 1 мл композиции и
d. жидкий носитель,
где композиция является подходящей для однократного или многодозового введения, где композиция является физически и химически стабильной, причем композиция остается, по существу, однородной, по меньшей мере, в течение 1 дня, и где, по меньшей мере, 10% композиции находится в пищеводе, по меньшей мере, 15 с после перорального введения стабильной пероральной фармацевтической композиции.
a. кортикостероид в количестве, терапевтически эффективном для лечения воспаления пищевода, и
b. по меньшей мере, один дополнительный эксципиент, который повышает взаимодействие композиции с поверхностью пищевода,
где композиция представляет собой текучую среду и имеет объем 2-20 мл, где композиция является физически и химически стабильной, причем композиция остается, по существу, однородной, по меньшей мере, в течение 1 дня, и где композиция является подходящей для введения одной или множества доз.

Комментарии