Композиция для предотвращения головных болей - RU2698196C2
Код документа: RU2698196C2
Чертежи
Описание
Область техники
Настоящее изобретение относится к нетоксичной пероральной фармацевтической композиции для снижения частоты, или предотвращения, или, по крайней мере, облегчения сильных головных болей, в частности мигрени или кластерных головных болей. Кроме того, изобретение относится к способу снижения частоты случаев или предотвращения таких сильных головных болей.
Уровень техники
Кластерная головная боль является неврологическим заболеванием, которое включает в себя в качестве наиболее яркого признака мучительные односторонние головные боли крайней интенсивности. Термин "кластерный" относится к свойству этих головных болей возникать периодически, с активными периодами, перемежающимися спонтанными ремиссиями. Причина заболевания в настоящее время неизвестна. Данным заболеванием страдает примерно 0,1% населения.
В то время как мигрени диагностируются чаще у женщин, кластерные головные боли более распространены у мужчин. Соотношение случаев кластерной головной боли у мужчин и женщин составляет примерно 5:1. Такие боли в основном возникают в возрасте от 20 до 50 лет.
В одной лишь Финляндии более 15000 людей страдают от кластерных головных болей (примерно 0,3% населения). Число людей, страдающих от мигрени, еще больше (от 10 до 20% населения).
Продолжительность общего приступа варьируется в диапазоне от максимально короткого - 15 минут - до трех или более часов. При отсутствии лечения частота приступов составляет от 1 до 16 атак в течение 48 часов. Головная боль может сопровождаться одним или более из следующих вегетативных симптомов: птоз (опущение век), миоз (сужение зрачков), конъюнктивальная инъекция (покраснение конъюнктивы), слезоотделение (слезотечение), ринорея (насморк), и, менее часто, бледность лица, отек или потливость - все это появляется с той же стороны головы, что и боль.
Наступление приступа является быстрым и, чаще всего, без предварительных признаков, которые характерны для мигрени.
Кластерные головные боли иногда называют «будильниковыми» головными болями вследствие их способностей пробуждать человека ото сна и вследствие регулярности их появления: как отдельные приступы, так и сами кластерные головные боли могут иметь метрономную регулярность; типичными являются приступы, поражающие в определенное время суток каждое утро или ночь, даже точно в одно и то же время через неделю. Кластерные головные боли имеют тенденцию следовать за изменениями, вызванными переходом на летнее время, и случаются чаще всего в весеннее и осеннее равноденствие. Это побудило исследователей предположить вовлеченность мозговых «биологических часов» или суточного ритма.
При эпизодических кластерных головных болях приступы происходят ежедневно один раз или чаще, часто в одно и то же время каждый день, в течение нескольких недель или даже месяцев, следуя за периодом без головной боли, продолжающимся недели, месяцы или годы. Эти приступы часто возникают во время того же времени года, например, осенью или весной.
Однако примерно 10-15% страдающих от кластерной головной боли являются хроническими больными, и они могут испытывать множественные головные боли каждый день в течение многих лет. Примерно 10% эпизодических кластерных головных болей в определенный момент времени превращаются в хронический тип.
Кластерные головные боли иногда классифицируют как сосудистые головные боли. Было высказано предположение, что указанные интенсивные боли связаны с расширением кровеносных сосудов, что создает давление на тройничный нерв. Хотя этот процесс рассматривается как непосредственная причина боли, этиология до конца не изучена.
Приступы, как известно, вызываются такими факторами, как употребление алкоголя, изменения привычного характера сна, излишнее физическое напряжение, вспышки гнева и колебания давления (например, во время полетов или горных восхождений). Также предполагается связь между этими приступами и курением.
Последний из упомянутых недугов часто встречается у людей с тяжелой зависимостью от курения сигарет. Также известны случаи, когда пассивное курение было способно вызывать кластерные головные боли.
Также встречается чувствительность к алкоголю во время кластерного приступа. Пациенты, которые чувствительны к алкоголю, обратили внимание, что приступы происходят в пределах от 5 до 45 минут после приема умеренных количеств алкоголя, составляющих, как правило, менее одного коктейля или бокала вина. Алкоголь вызывает приступы в 70-80% случаев таких воздействий.
Как показали эксперименты, почти у всех пациентов приступы могут происходить во время приступа, вызванного приемом нитроглицерина или гистамина. Гистамин, по всей вероятности, действует, вызывая воспалительную реакцию.
Кроме того, было показано, что тучные клетки, основной репозиторий гистамина во многих тканях, находятся в большом количестве в коже болезненной височной области у больных с кластерной головной болью. Этот эффект также наблюдается у пациентов с мигренью.
Кластерные головные боли являются доброкачественными, но из-за связанной с ними чрезвычайной и изнурительной боли и потенциального риска самоубийства, тяжелый приступ все же лечат как неотложное состояние. В связи с относительной редкостью данного состояния и неоднозначностью симптомов, некоторые страдающие им люди могут не получить лечение в отделении неотложной помощи, и это состояние даже может быть ошибочно принято это за проявление наркотической ломки.
Есть и другие виды головной боли, которые иногда ошибочно принимают за кластерные головные боли, такие как хроническая пароксизмальная гемикрания (ХПГ) и иктальная головная боль.
Лекарственные средства для лечения кластерных головных болей классифицируются либо как абортивные (например, кортизон, мигреневые лекарственные средства, эрготамин тартрат, наратриптан, фроватриптан или местный анестетик затылочного нерва), либо профилактические средства (предотвращающие, например верапамил, литий, вальпроат натрия, топирамат, баклофен, мелатонин, метисергид, индометацин или капсаицин). Кроме того, могут быть применены краткосрочные лекарственные средства переходного периода (такие как стероиды), пока назначено и корректируется профилактическое лечение.
В Европейских руководствах предложено применение блокатора кальциевых каналов - верапамила. Также применяются стероиды, такие как преднизолон/преднизон. Как альтернативные методы лечения рекомендуются метисергид, литий и противосудорожный топирамат.
Безрецептурные обезболивающие лекарственные средства (такие как аспирин, парацетамол и ибупрофен), как правило, не оказывают какого-либо влияния на кластерные головные боли. Лечение, как правило, выбирают на основе индивидуального опыта после испробования различных лекарственных средств. Надежные результаты испытаний не были доступны.
Однако авторы настоящего изобретения неожиданно обнаружили, что фармацевтическая композиция, уменьшающая количество ацетальдегида, вносимого извне или образующегося в человеческом организме, будет облегчать и предотвращать эти сильные головные боли, в частности кластерные головные боли, что может показать связь между этими головными болями и указанным употреблением алкоголя, а также курением.
Первым метаболитом спирта является ацетальдегид. Алкоголь равномерно распределяется в жидкой фазе органов. Следовательно, после наслаждения алкоголем и до тех пор, пока алкоголь есть в органах, содержание алкоголя в крови, слюне, желудочном соке и содержимом кишечника является одним и тем же. Ацетальдегид образуется из спирта, в частности, под действием микроорганизмов. Микроорганизмы, в частности, в желудочно-кишечном тракте, способны окислять спирт до ацетальдегида. Например, даже после умеренной дозы этанола (0,5 г/кг), в слюне человека было обнаружено высокое содержание ацетальдегида микробного происхождения (18-143 мкМ). Другими словами, ацетальдегид накапливается в слюне в качестве промежуточного продукта микробного метаболизма (Homann et al, Carcinogenesis (1997) 18:1739-1743).
В организме ацетальдегид, таким образом, образуется из алкоголя, как следствие метаболизма в печени и, локально, в пищеварительном тракте через микробную алкогольдегидрогеназу (Salaspuro et al, (1996) Ann Med 28:195-200). Слюна распространяется из полости рта в другие области пищеварительного тракта, в результате чего области воздействия ацетальдегида, содержащегося в слюне, включают в себя рот, глотку, пищевод и желудок. Следовательно, воздействия ацетальдегида могут распространяться на всей площади верхней части пищеварительного тракта.
Кроме того, было показано, что ацетальдегид накапливается в толстой кишке, поскольку бактерии, которые представляют ее нормальную флору, способны превращать этанол в ацетальдегид (Jokelainen et al, (1996) Gut 39:100-104). В кишечнике также может быть найден эндогенный этанол, то есть этанол, который образуется в кишечнике в бескислородных условиях под действием микробов. Ацетальдегид образуется, например, когда этанол вступает в контакт с кислородом вблизи слизистой оболочки.
С другой стороны, канцерогенный ацетальдегид может также вырабатываться эндогенно посредством микробов полости рта из различных пищевых продуктов с высоким содержанием сахара или углеводов, которые будут вызывать повышенное содержание ацетальдегида также в желудке, в частности у субъектов, страдающих от ахлоргидрии желудка.
Наши недавние исследования показали, что все сахаросодержащие (сахароза, мальтоза, лактоза) пищевые продукты, включая напитки, могут содержать значительные количества ацетальдегида, от 5 до 2000 мкМ, и этанола, от 0,1 до 0,5 промилле, или ацетальдегид может быть образован в пищевом продукте. Некоторые кисломолочные продукты, йогурты и соки содержат ацетальдегид и этанол как таковой (PCT/FI 2006/000104, включенный в настоящую заявку в качестве ссылки).
Во время активного курения ацетальдегид в слюне также увеличивается до величины 261,4±45,5 мкМ от базового уровня (Salaspuro et al. (2004) Int J Cancer, 2004 Sep 10; 111(4):480-3).
В уровне техники описаны фармацевтические композиции, которые содержат соединения, связывающие ацетальдегид, и их действие основывается на реакции действующих веществ с ацетальдегидом внутри крови и/или клеток, например, см. патент США №5202354, патент США №4496548, патент США №4528295, патент США №5922346.
Когда такую композицию проглатывают, действующие вещества мгновенно доставляются в тонкую кишку, а оттуда в кровоток (Matsuoka, патент США №5202354, и Moldowan и др., патент США №4496548).
Предлагалось применять лекарственные средства, содержащие аминокислоты и витамины, которые всасываются или разжевываются во рту, чтобы уменьшить опосредованное воздействие на печень соединений вредных свободных радикалов, которые образуются при употреблении табачных изделий или их воздействии. Считается, что после поглощения аминокислоты оказывают воздействие на различные ткани (Hersch, патент США №5922346, Hersch, международная заявка на патент WO 99/00106). Однако во всех этих случаях воздействие является только системным.
В публикации WO 02/36098 (включенной в настоящую заявку в качестве ссылки) предложено применение соединения, содержащего свободную сульфгидрильную группу и/или аминогруппу, для местного и долгосрочного связывания ацетальдегида из слюны, желудка или толстой кишки. Соединение смешивали с веществом, которое позволило бы ему высвобождаться в течение по меньшей мере 30 минут в условиях полости рта, желудка или толстой кишки. В этом случае воздействие ограничивалось желудочно-кишечным трактом.
В публикации WO 2006/037848 (включенной в настоящую заявку в качестве ссылки) предложена композиция, содержащая соединение, содержащее одну или более свободную сульфгидрильную группу и/или аминогруппу для удаления или уменьшения содержания альдегида в слюне во время курения. Это воздействие также является только местным.
Однако ни в одном из источников из уровня техники не предложено применять цистеин, или цистин, или другие подобные соединения, чтобы облегчить или предотвратить любые типы головной боли. Кроме того, не были разработаны комбинированные лекарственные средства.
В соответствии с недавними исследованиями авторов настоящего изобретения ацетальдегид играет роль в возникновении сильных головных болей, в частности кластерных головных болей и мигрени. Поскольку эти обстоятельства еще пока не могут быть эффективно предотвращены, и все существующие профилактические лекарственные средства имеют серьезные побочные эффекты, существует, таким образом, необходимость поиска альтернативных и легких способов, чтобы по крайней мере облегчить симптомы или уменьшить число приступов у пациентов, страдающих от этих сильных головных болей.
Краткое описание изобретения
Задача настоящего изобретения заключается в создании новых композиций, которые можно применять для предотвращения или по крайней мере снижения частоты приступов сильных головных болей, таких как кластерные головные боли, мигрень, иктальная головная боль или хроническая пароксизмальная гемикрания.
Также задача настоящего изобретения заключается в создании новых способов и применений для лечения людей, для которых установлено, что они испытывают кластерные головные боли или мигрени.
В частности, задача настоящего изобретения заключается в создании композиций, которые можно применять для лечения или предотвращения сильных головных болей и которые маскируют вкус активных агентов.
Эти и другие задачи, вместе с их преимуществами по сравнению с известными способами и продуктами, достигаются с помощью настоящего изобретения, как описано и заявлено далее.
Композиции, содержащие один или более цистеинов в качестве активных агентов, как было показано, связывают ацетальдегид. Эти активные агенты, как было установлено, также способны разрушать биопленки, образуемые некоторыми микроорганизмами, в частности, в желудке. Кроме того, по меньшей мере частичное уничтожение микроорганизмов может быть осуществлено с применением композиции, содержащей цистеин, хотя это действие может быть следствием разрушения указанных биопленок, в результате чего желудочные кислоты способны агрессивно воздействовать на микроорганизмы.
Было показано, что все вышеперечисленные действия композиций, содержащих один или более цистеинов, дают нужный эффект также у субъектов с ахлоргидрией или с низким содержанием желудочной кислоты, часто связанной с инфекцией Н. pylori. Чтобы оценить масштабы проблем, вызываемых ацетальдегидом в желудочно-кишечном тракте (ЖКТ), рекомендуется начинать любое лечение с постановки диагноза как возможной инфекции Н. pylori.
Композиция согласно настоящему изобретению может быть применена для предотвращения кластерных головных болей (КГБ), регулярных мигреней, или и того, и другого, или даже иктальных головных болей, или хронической пароксизмальной гемикрании.
Таким образом, настоящее изобретение относится к нетоксичной твердой фармацевтической композиции для перорального введения, содержащей один или более агент из группы, состоящей из L-цистеина, D-цистеина и N-ацетилцистеина, в сочетании с одним или более агентом, выбранным из цистина, глутатиона и метионина.
Более конкретно, композиция согласно настоящему изобретению характеризуется признаками, приведенными в отличительной части п. 1 формулы изобретения.
Кроме того, активные агенты согласно изобретению для медицинского применения в соответствии с изобретением характеризуются тем, что указано в п. 22 формулы изобретения, и способ согласно настоящему изобретению характеризуется тем, что указано в п. 23 формулы изобретения.
При помощи изобретения достигаются значительные преимущества. Таким образом, настоящее изобретение относится к композиции и способу предотвращения или по крайней мере уменьшения частоты или количества приступов головной боли у субъектов, страдающих от сильных головных болей, таких как кластерные головные боли или мигрени.
Композиции являются эффективными для высвобождения активных агентов в пищевом продукте или напитке (включая воду или любые напитки), в частности в тех случаях, когда эти пищевые продукты или напитки содержат спирт, ацетальдегид, дрожжи или сахара. В этих случаях композицию преимущественно добавляют к пищевому продукту или напитку вместе с потреблением, то есть едой или питьем. На практике композицию добавляют к пищевому продукту или напитку непосредственно перед едой или питьем.
Композиции также действенны для высвобождения активных агентов в полости рта или в желудке и связывания ацетальдегида, в частности, когда они употребляются вместе с едой или питьем, то есть непосредственно перед, во время или сразу после еды или питья, или вместе с курением. На практике композиции обычно вводят в то время, когда субъект сидит за обеденным столом, или непосредственно перед закуриванием сигареты (или началом использования другого табачного изделия), или сразу же после тушения сигареты.
Однако несмотря на то, что здесь подразумевается местное воздействие, композиции также обладают системным воздействием за счет дополнительного активного агента, выбранного из цистина, глутатиона и метионина. Этот дополнительный активный агент превращается в организме в цистеин, но упомянутое превращение происходит, главным образом, после того, как агент прошел желудок, в результате чего он поступит через тонкую кишку в кровоток с обеспечением более широкой области действия (через системный путь) и более широкого диапазона воздействий.
Композиции могут быть также применены в непрерывном режиме, например, через каждые 8-10 часов. Композиция содержит один или более носителей, которые контролируют высвобождение активных агентов, тем самым обеспечивая непрерывное воздействие.
Далее изобретение будет описано более подробно со ссылкой на прилагаемые чертежи и подробное описание.
Краткое описание чертежей
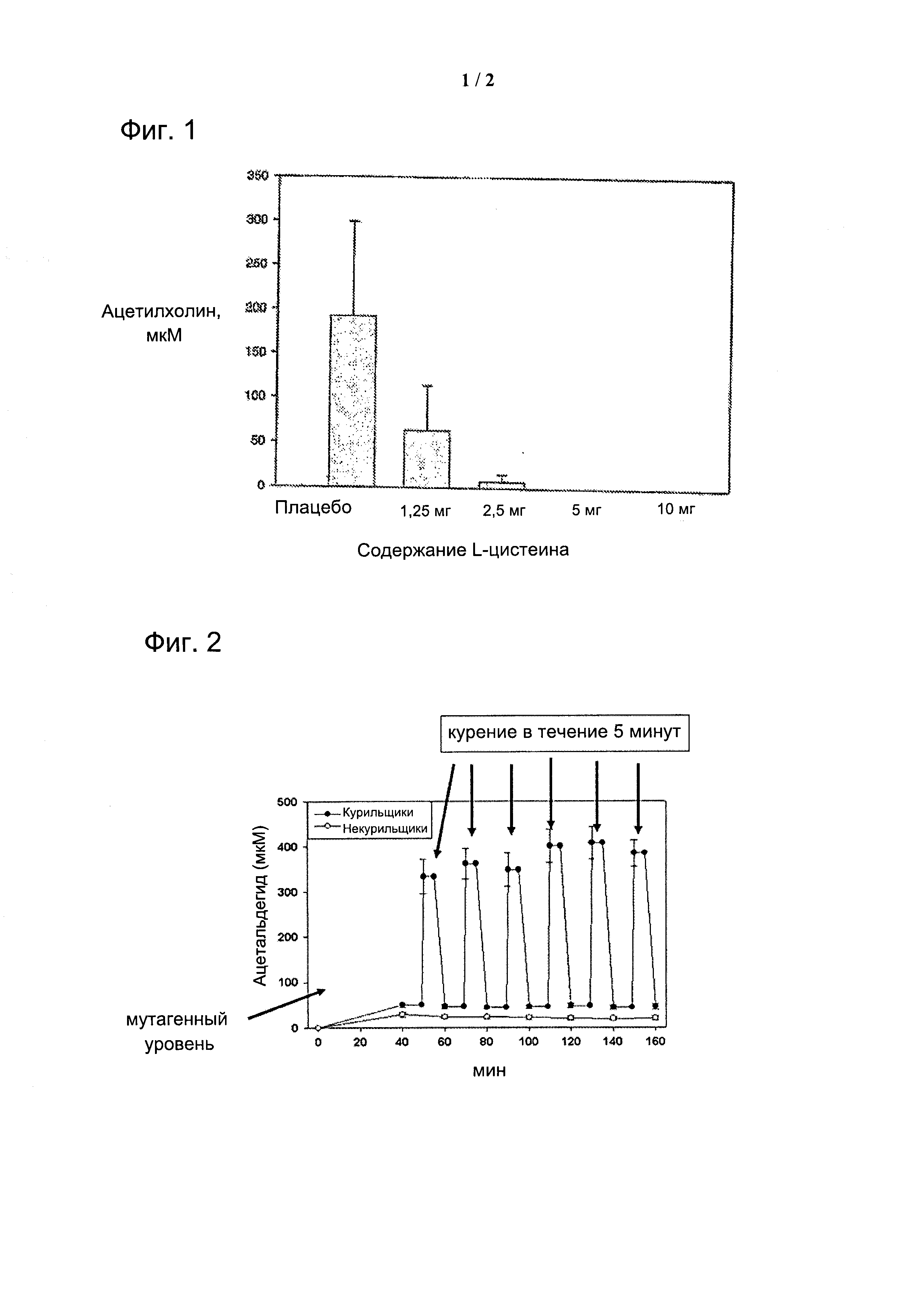
На фигуре 1 показано действие композиций, содержащих цистеин в различных количествах на уровнях ацетальдегида в слюне.
На фигуре 2 показаны изменения уровня ацетальдегида в слюне во время курения.
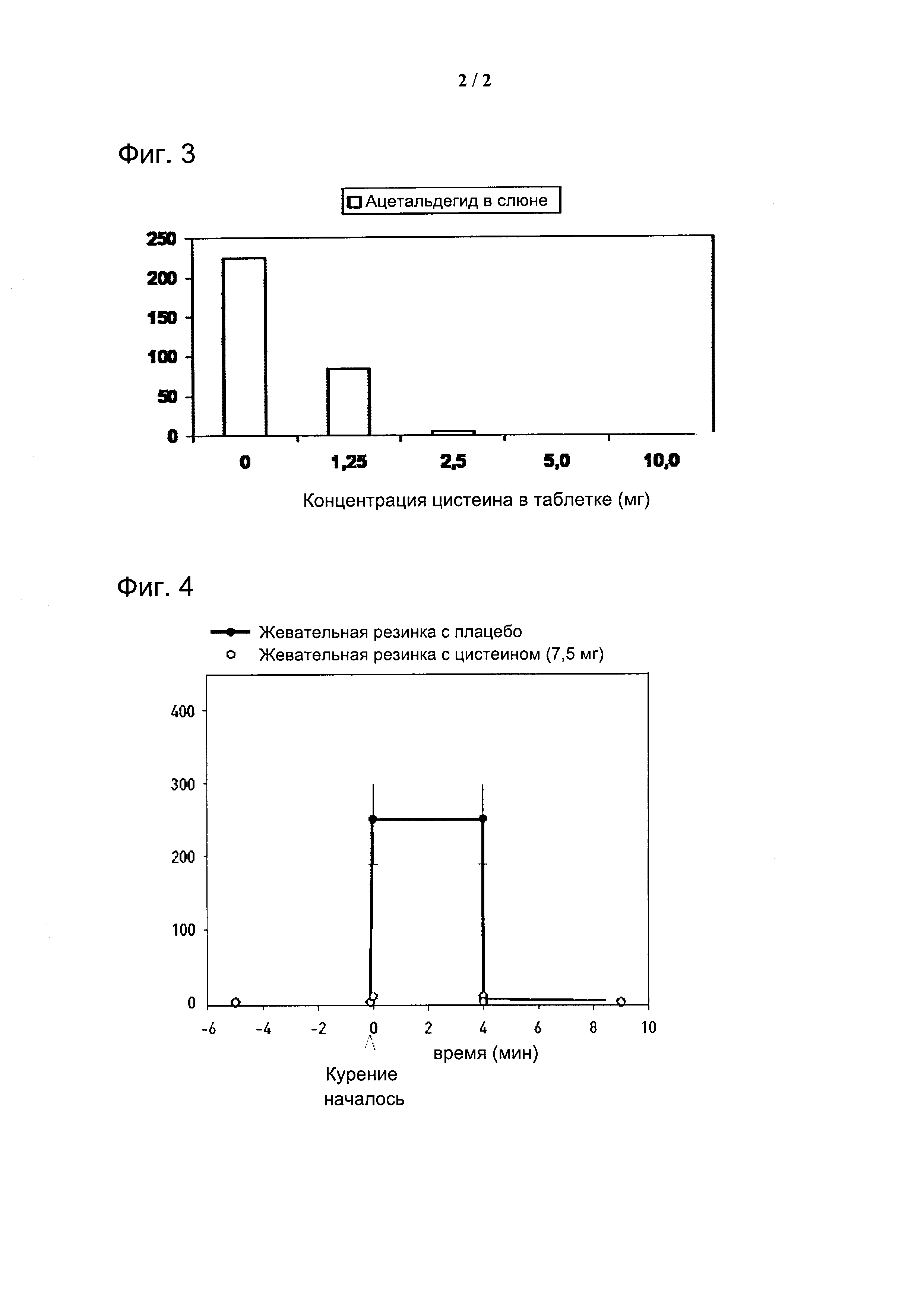
На фигуре 3 показано связывание ацетальдегида, образующегося при курении, с применением цистеина.
На фигуре 4 показано действие жевательной резинки, содержащей L-цистеин (7,5 мг) на уровнях ацетальдегида в слюне во время курения, по сравнению с применением плацебо жевательной резинки.
Подробное описание предпочтительных вариантов реализации изобретения
Настоящее изобретение относится к нетоксичный твердой фармацевтической композиции для перорального введения, содержащей одно или более цистеиновых соединений из группы L-цистеина, D-цистеина и N-ацетилцистеина в качестве активных агентов в сочетании с одним или более дополнительным активным агентом, по меньшей мере один из которых выбран из цистина, глутатиона и метионина, причем композиция предназначена для снижения частоты или даже предотвращения сильных головных болей.
Термин "цистеиновое соединение" предназначен для обозначения цистеина, такого как L- или D-цистеин, или его производного, или его соли, в частности N-ацетилцистеина. Действие этого основного активного агента основано на локальном воздействии, получаемом в результате реакции этого цистеинового соединения в желудочно-кишечном тракте.
Действие упомянутого дополнительного активного агента (-ов), выбранного из цистина, глутатиона и метионина, основано на способности этих агентов трансформироваться в цистеин или обеспечивать такое же воздействие, как у цистеина, пусть даже в организме в целом.
Частично местные и частично системные воздействия возможны вследствие различных реакционных способностей этих групп активных веществ в желудочно-кишечном тракте. Основное цистеиновое соединение будет вступать в реакцию, в частности с ацетальдегидом, в желудке, в то время как дополнительный активный агент, выбранный из цистина, глутатиона и метионина, будет перед реакцией передан в кровоток, главным образом, через тонкую кишку.
В соответствии с одним из вариантов реализации изобретения композиция дополнительно содержит диаминоксидазу (т.е. гистаминазу) в качестве активного агента для разложения избытка гистамина.
В соответствии с предпочтительным вариантом реализации активные агенты, однако, состоят из аминокислот, выбранных из L-цистеина, D-цистеина, N-ацетилцистеина, цистина, глутатиона и метионина.
В соответствии с другим вариантом реализации, витамин или аналогичная питательная добавка дополнительно включены в композицию. Это дополнительное вещество может представлять собой, например, тауриновое соединение или распространенный водорастворимый витамин, такой как витамин C, B2 или B5, вследствие содержания реакционноспособных функциональных групп этих соединений или их солей. Предпочтительно, чтобы дополнительный агент представляет собой витамин C или соль таурина, такую как магниевая или кальциевая соль, вследствие дополнительной нервно-мышечной активности таких солей. Более предпочтительно, чтобы дополнительный агент представляет собой тауринат магния, самое подходящее - N-ацетилтауринат магния. Здесь были найдены эти соединения, чтобы в дальнейшем снизить частоту или даже предотвратить сильные головные боли.
Композиция может быть приготовлена, например, в виде таблетки, капсулы, гранулы или порошка, или, необязательно, в виде таблетки или капсулы, заполненной вышеупомянутым порошком или гранулами. Таким образом, композиция может быть приготовлена в виде единого или состоящего из нескольких частей лекарственного средства. Композицию для высвобождения в пищевой продукт или напиток (включая воду и любые напитки) предпочтительно приготовляют и добавляют к вышеупомянутым пищевым продуктам или напиткам в виде порошка или гранул. Композицию для введения внутрь и высвобождения в полость рта или в желудок субъекта, в свою очередь, предпочтительно вводят в виде капсулы, таблетки или пастилки, наиболее предпочтительно в виде капсулы, заключающей в себе активные агенты и добавки в гранулированной форме.
Действие цистеина или N-ацетилцистеина основано на нейтрализации ацетальдегида, образованного во время курения или во время употребления алкоголя, или алкоголе- или ацетальдегидо-содержащих пищевых продуктов или напитков, в том числе продуктов питания и напитков, которые содержат вещества, способные образовывать спирт или ацетальдегид до или сразу же после потребления, такие как некоторые бактерии, дрожжи или углеводы.
Упомянутые выше необязательные витамины и добавки действуют путем усиления ацетальдегидо-связывающего эффекта цистеинового соединения.
Действия цистина, глутатиона или метионина, в свою очередь, основываются на их низкой реакционной способности в желудочно-кишечном тракте, в результате чего они проводятся непосредственно в тонкую кишку в своем первоначальном виде, где они будут, во-первых, преобразованы в цистеин и вступят в реакцию с любыми остатками ацетальдегида, высвобожденными за пределы желудка, а во-вторых, будут высвобождаться в кровоток и далее в органы, в частности, в печень, чтобы устранить любой ацетальдегид, образованный в этих органах.
Действие диаминоксидазы (т.е. гистаминазы) основано на ее ферментативной активности по разложению гистамина, в результате чего эта еще одна причина сильных головных болей уменьшается.
Определения
Композиция по настоящему изобретению содержит эффективное количество одного или более агента из группы L-цистеина, D-цистеина и N-ацетилцистеина, а также из одного или более агента, выбранного из цистина, глутатиона и метионина. Глутатион может присутствовать в композиции либо в окисленной, либо в восстановленной форме. Предпочтительно, чтобы применялась восстановленная форма, поскольку это будет обеспечивать возрастающее локальное воздействие, в то время как окисленная форма может быть направлена на системный путь действия. Также в композицию необязательно может быть включено эффективное количество диаминоксидазы, тауринового соединения или обычного водорастворимого витамина.
Термин "эффективное количество" означает количество, способное связывать или инактивировать количество ацетальдегида, присутствующее в пищевом продукте, алкоголе, другом напитке или табаке, или образованное в процессе потребления пищевых продуктов, алкоголя или другого напитка, или после еды или питья, или образованное во время или после курения, или, по крайней мере, сохраняющее содержание ацетальдегида существенно ниже, чем без применения композиции. В случае диаминоксидазы, эффективное количество означает количество, способное разлагать избыток гистамина, временно образовавшийся в организме субъекта.
Поддержание содержания ацетальдегида существенно ниже, чем без применения композиции, означает, что содержание ацетальдегида должно держаться на таком уровне, который по меньшей мере на 20%, предпочтительно более, чем на 40%, и наиболее предпочтительно более, чем на 60%, ниже, чем тогда, когда не применяли композицию в соответствии с описанием изобретения.
Упомянутый ацетальдегид в основном образуется в слюне субъекта. Из-за осаждения ацетальдегида внутри дыхательных путей и пищеварительного тракта, ацетальдегид также достигает пищевода и желудка через нормальное смывание слюны. Далее, алкоголь, попадающий дальше в кровоток, будет распространяться по всему телу и в органы, где он может причинить вред как таковой, или может быть преобразован в ацетальдегид. Таким образом, вред является, по крайней мере, в незначительной степени, системным. Однако только системное воздействие или только местное воздействие не снимает проблему.
Такое вредное содержание ацетальдегида, в основном во рту человека, пищеводе, желудке, или тонкой кишке, или толстой кишке, и в небольшой степени в других участках тела, может быть связано с употреблением алкогольных напитков, в частности крепких алкогольных напитков, или пищевых продуктов, содержащих алкоголь, или как следствие курения, или при употреблении продуктов, содержащих ацетальдегид, в частности, у людей, имеющих атрофический гастрит или ахлоргидрию желудка.
"Алкогольные напитки" это этанол-содержащие напитки, содержание этанола в которых варьируется пределах от 0,7% по объему до 84% по объему.
"Алкогольные продукты питания" относятся к пищевым продуктам, содержащим по меньшей мере 0,7% этанола. Такими пищевыми продуктами могут быть, например, ферментированные соки или консервы, или продукты питания, консервированные с небольшими количествами алкоголя, пирожные, желе и муссы, приправленные ликером или соответствующими продуктами, содержащими алкоголь.
"Ацетальдегидо-содержащие продукты" относятся к продуктам питания, содержащим ацетальдегид. Ацетальдегид содержится в продуктах питания, в которых этанол был образован вместе с брожением, таких как пиво, сидр, вино, домашнее пиво и другие алкогольные напитки, а также многие соки. В определенных пищевых продуктах, таких как некоторые молочные продукты, ацетальдегид применяется для целей консервации и для придания аромата, или ацетальдегид образуется в продукте как следствие активности микроорганизмов. Например, сладкие соки или сахаросодержащие пищевые продукты в целом обеспечивают питательный субстрат для таких микроорганизмов. Высокие концентрации ацетальдегида образуются, например, в ферментированных молочных продуктах, таких как йогурт. Микроорганизмы применяются для того, чтобы заставить йогурт производить ацетальдегид в йогурте. Что касается алкогольных напитков, херес и Кальвадос содержат особенно большое количество ацетальдегида.
Применение композиций в соответствии с изобретением может быть полезным даже вместе с употреблением легких алкогольных напитков или пищевых продуктов - таких напитков или пищевых продуктов, которые содержат только небольшие количества алкоголя.
Термин "вместе с употреблением алкогольных напитков" в настоящем описании относится к периоду времени, который начинается, когда субъект начинает употреблять алкогольные напитки, и заканчивается, когда больше нет алкоголя в крови субъекта. Однако этот термин, как таковой, не предназначен для ограничения изобретения реакцией алкоголя в крови.
Поскольку композиции согласно изобретению могут быть предпочтительны также "вместе с употреблением напитков", где напитки содержат вещества, способные образовывать спирт или ацетальдегид в организме субъекта, или содержащие только небольшое количество спирта (таким образом, не образуя измеримое содержание алкоголя в крови), указанный период времени, необязательно, может быть интерпретирован как период, начинающийся за 10-0 минут до момента употребления субъектом напитков и заканчивающийся примерно через 10 минут после употребления напитков.
Аналогичным образом, "вместе с едой" в данном описании относится к периоду времени, начинающемуся за 10 минут до того, как субъект начнет есть, и заканчивающемуся через 10 минут после еды.
Композиция может быть, например, смешана с пищевыми продуктами, или ее можно вводить до или после еды.
"Курение", как таковое, будет относиться к использованию табачного изделия путем ингаляции, такому, как курение сигареты, сигары или трубки. Однако табак может быть использован, например, при курении, жевании, смачивании или нюханий, и "табачное изделие" относится к любому табачному продукту, такому как сигареты, сигары, трубки, нюхательный табак или жевательный табак. Таким образом, "вместе с курением" в данном описании относится к любому использованию табачного изделия в течение периода времени, который начинается от начала использования табака и заканчивается, когда указанное использование прекращается.
Однако согласно исследованию, проведенному авторами настоящего изобретения, курение, в частности, по-видимому, является причиной образования ацетальдегида в полости рта.
Композиции согласно изобретению
Композиция по настоящему изобретению содержит в качестве активных агентов один или более агентов из группы L-цистеина, D-цистеина и N-ацетилцистеина в виде комбинации с одним или более агентом, выбранным из цистина, глутатиона и метионина в любой из описанных выше форм, при этом композиция необязательно содержит дополнительные активные агенты.
Согласно одному из вариантов реализации изобретения композиция дополнительно содержит диаминоксидазы (т.е. гистаминазы) в качестве активного агента для разложения избытка гистамина.
Согласно другому варианту реализации композиция содержит тауриновое соединение или распространенный водорастворимый витамин.
Композиция дополнительно содержит одну или более фармацевтическую добавку, предпочтительно с одним или более нетоксичными носителями, что обеспечивает регулируемое высвобождение указанных соединений в желаемом(ых) участке(ах) тела.
Регулируемое высвобождение здесь означает локальное высвобождение цистеинового соединения в течение по меньшей мере 5 минут в условиях полости рта, предпочтительно от 5 до 15 минут, или, по меньшей мере 30 минут в условиях желудка, предпочтительно от 0,5 до 8 часов, в то время как цистин или глутатион или метионин проводится непосредственно в тонкую кишку для высвобождения в кровоток.
В соответствии с изобретением, продукты, полученные от связывания ацетальдегида с активными агентами, являются безопасными и нетоксичными для организма.
В дополнение к цистеинам и их производным, а также цистину, глутатиону и метионину, в объем настоящего изобретения также включены соли этих соединений, а именно фармацевтически приемлемые соли, в частности соли, растворимые в воде.
Это является преимуществом для дальнейшего добавления к композициям по настоящему изобретению по меньшей мере одного из веществ, выбранных из группы, включающей в себя хром, витамин В12, А-, D-, Е, -C-витамины, ниацин, биотин, тиамин, B2-, В5-, В6-витамины и фолиевую кислоту, и микроэлементы, такие как хром, марганец, селен, цинк и железо, и противомикробные средства, которые уменьшают образование ацетальдегида, так как они дополнительно улучшают желаемое действие. Как указано выше, витамины C, B2 и B5 являются особенно полезными, в частности витамин C.
Другим полезным соединением для добавления к композиции по изобретению, которое может усиливать ацетальдегидо-связывающее действие композиции, является также лецитин.
Однако только те соединения (и в тех количествах), которые являются нетоксичными и пригодными для потребления человеком, применяются к композиции в соответствии с настоящим изобретением.
Единичная доза композиции в соответствии с изобретением может быть в форме, например, порошка, таблетки, капсулы, пастилки или жевательной резинки. Применяемая таблетка, по возможности, может быть представлена в виде единого или состоящего из нескольких частей лекарственного средства, в то время как применяемая капсула, по возможности, может содержать активные агенты и добавки в форме, например, порошка или гранул. Наиболее предпочтительно, чтобы композиции по изобретению изготавливали в виде капсул, содержащие активные агенты, а также одну или более подходящих добавок, наиболее предпочтительно в гранулированной форме.
Гранулы, таблетки и капсулы могут быть покрыты водорастворимой пленкой, которая эффективно скрывает или маскирует вкус активных агентов.
Композиции, предназначенные для высвобождения в пищевых продуктах или напитках, перед употреблением, могут быть приготовлены в виде, например, порошков, которые легко смешивается с пищевым продуктом или напитком.
В случае такого порошка содержание активных агентов в композиции может варьироваться между 0,2 и 2% по массе цистеина и между 0,2 и 2% по массе цистина, или глутатиона, или их комбинации. Добавки обычно содержат агенты, маскирующие вкус активных агентов, такие как подсластители или ароматизаторы.
Композиции, предназначенные для высвобождения в ротовой полости, могут быть приготовлены в виде, например, таблеток или других препаратов, которые могут быть размещены между щекой или губой и десной, или препаратов, которые рассасывают или жуют во рту.
В соответствии с простейшей альтернативой, единичная доза для высвобождения в ротовой полости может быть получена путем простого смешивания твердых веществ, необязательно увлажненных этанолом, и приготовления их в подходящей форме, например, прессованием в таблетки.
Композиции, предназначенные для высвобождения в желудке, могут быть приготовлены в виде, например, таблеток или капсул, которые могут быть проглочены.
В случае жевательной резинки содержание активных агентов в композиции может варьироваться между 0,2 и 2% по массе цистеина и между 0,2 и 2% по массе цистина, глутатиона, или метионина, или их комбинации.
В этом случае композиция также содержит жевательную основу, содержание которой составляет от 90 до 99% по массе от массы композиции, предпочтительно в количестве от 500 до 1500 мг на единичную дозу.
В случае пастилки или таблетки, которые будут держать во рту, содержание активных веществ в композиции может варьироваться между 0,3 и 20% по массе цистеина и между 0,3 и 20% по массе цистина, глутатиона или метионина, или их комбинации.
В этом случае композиция также содержит один или более разбавитель или наполнитель с содержанием от 85 до 98% по массе композиции, предпочтительно в количестве от 50 до 750 мг на единичную дозу.
В случае проглатываемой таблетки или капсулы содержание активных веществ в композиции может варьироваться между 0,5 и 20% по массе цистеина и от 0,5 до 20% по массе цистина, глутатиона или метионина, или их комбинации.
В этих случаях композиция также содержит один или более наполнителей с содержанием от 85 до 98% по массе композиции, предпочтительно в количестве от 50 до 750 мг на единичную дозу.
Все типы составов предпочтительно содержат количество цистеина, составляющее от 2 до 50 мг на единичную дозу, и количество цистина, глутатиона или метионина, или их комбинации, составляющее от 2 до 50 мг на единичную дозу.
В соответствии с предпочтительным вариантом реализации композиция содержит общее количество активных агентов, в частности, цистеинового соединения, и дополнительный активный агент, составляющее от 2 до 100 мг на единичную дозу, предпочтительно от 2 до 50 мг на единичную дозу, более предпочтительно от 4 до 20 мг на единичную дозу и наиболее предпочтительно от 5 до 10 мг на единичную дозу.
Требуются только небольшие количества/дозы из-за локальной области действия цистеина, вследствие чего цистеин не разбавляется в какой-либо значительной степени, и из-за синергического действия активных агентов, где как цистеин, так и цистин, или глутатион, или метионин облегчают головные боли у субъекта, и, таким образом, обеспечивают снижение частоты головных болей посредством, задействуя несколько путей одновременно. Это обеспечивает неожиданно сильный эффект.
Высвобождение активных соединений в условиях полости рта, как правило, имеет место в количествах от 15 до 25 мг в час. В желудке скорость высвобождения, как правило, от 40 до 80 мг в час.
1 или 2 препараты по изобретению можно вводить одновременно, и введение может быть повторено с 2-10-часовыми интервалами, наиболее предпочтительно с 4-8-часовыми интервалами. В случае жевательных резинок может быть применен больший интервал, от 6 до 10 часов, так как одна резинка после жевания может быть спрятана между щекой и деснами и пожевана еще раз позже, чтобы высвободить более активные агенты.
Композиция может быть приготовлена таким образом, чтобы ее активные агенты контролируемым образом высвобождались в полости рта или в желудке.
В соответствии с одним из предпочтительных вариантов реализации настоящего изобретения композиция высвобождает активные агенты в полости рта и содержит, в целях регулирования высвобождения, носитель, как правило, в форме полимера, который не растворяется, или только слабо растворяется в полости рта (здесь и далее называемый "носителем/полимером, который не растворяется в полости рта").
Полимером, не растворимым в ротовой полости, может быть любая фармацевтически приемлемая добавка, такая как полимер метакрилат, например, Эудрагит RS или S, или этилцеллюлоза (ЭЦ).
Носитель также может быть выбран из тех гелей, которые прилипают к слизистой оболочке полости рта. Такие носители обычно выбирают из фармацевтически приемлемых полимеров. Более конкретно, носитель может быть выбран из группы, включающей различные хитозаны, альгинаты, такие как альгинат натрия, гидроксид алюминия, гидрокарбонат натрия, натрий-карбоксиметилцеллюлоза и гидрокарбонат натрия.
В дополнение к активным агентам и необязательному носителю (-ям), композиция может содержать, например:
1. Фармацевтически приемлемые разбавители (наполнители, сухие разбавители),
2. Подсластители, такие как сахара и сахарные спирты,
3. Ароматизаторы, и
4. Добавки/смазывающие вещества, улучшающие проскальзывание.
Сахара могут содержать, например, сахарозу, фруктозу, глюкозу или их смеси. Сахарные спирты могут содержать маннит, сорбит, мальтит, лактит, изомальт, или ксилит или их смеси. Предпочтительно, чтобы ни одна из используемых добавок не вступала в реакцию с другими ингредиентами в композиции. Не будучи слишком сладким, предпочтительный подсластитель содержит маннит, и его количество в композиции может быть довольно большим; соответственно, он одновременно действует в качестве разбавителя.
Ароматизаторы могут содержать, например, мяту колосковую, мяту перечную, ментол, цитрусовые, эвкалипт или анис, или их смеси.
Композиция может также содержать другие ингредиенты, такие как вещества, которые предотвращают плохой запах изо рта, вещества, которые действуют как освежители дыхания и/или предотвращают зубной кариес, или препарат может содержать витамины. Композиция может также содержать вещества, усиливающие слюноотделение.
Кроме того, композиция может содержать в качестве дополнительной добавки наполнитель, предпочтительно инертный агент, в частности, в количестве 20-70% по массе, предпочтительно от 40 до 60% по массе, наиболее предпочтительно примерно 50% по массе.
Инертным наполнителем может быть, например, вторичный кислый фосфат водорода, микрокристаллическая целлюлоза (МКЦ) или другой соответствующий неразбухающий агент.
В соответствии с предпочтительным вариантом реализации настоящего изобретения типичный препарат/единичная доза (например, одна таблетка) для высвобождения в полости рта может содержать или состоять из следующего:
Таблетки могут быть приготовлены путем смешивания порошкообразной массы и ее прессования с получением таблеток для рассасывания с помощью любых известных способов.
Если количество цистеина, или цистина, или глутатиона, или метионина увеличивается, количество разбавителя (-ей)/подсластителя (-ей) и ароматизаторов также может быть увеличено, так как желательно, чтобы вкус цистеина был замаскирован.
Типичный препарат/единичная доза может быть приготовлен в виде жевательной резинки и, в основном, содержать или состоять из следующего:
Жевательная основа может быть образована из содержащей лекарственное средство жевательной резинки (Morjaria, Y. et al., Drug Delivery Systems & Sciences, vol. 4, No. 1, 2004) или природных или синтетических эластомеров, смягчителей, восков или липидов. Природные основы жевательной резинки, в том числе сырая резина и копченый натуральный каучук, разрешены FDA. Однако современные основы жевательной резинки, в основном, являются синтетическими и содержат стирол-бутадиеновый каучук, полиэтилен и поливинилацетат.
Жевательная основа, как правило, составляет от 15 до 40% по массе от массы жевательной резинки. Оставшаяся часть содержит, в основном, лекарственные агенты, сахара, подсластители, смягчители, ароматизаторы и красители.
Большинство систем доставки лекарственных средств на основе жевательной резинки получают с применением обычных способов. Однако непосредственно прессуемые порошкообразные резинки являются современными альтернативами содержащим лекарственное средство жевательным резинкам. Pharmagum является новой прессуемой системой резинок. Он представляет собой смесь полиола (-ов) и/или сахаров с жевательной основой. Приготовленная композиция, которая включает резинки Pharmagum, может быть спрессована в резиночные таблетки с использованием обычных таблеточных прессов. Способ изготовления является быстрым и недорогим. Количество жевательной основы в препарате, включая подсластители, может быть от 50 до 500 мг, предпочтительно от 500 до 1500 мг.
Pharmagum S содержит каучуковую основу и сорбит, Pharmagum М содержит каучуковую основу, маннит и изомальт.
Композиция может быть приготовлена путем смешивания порошкообразной массы и ее прессования с получением жевательных кусочков.
Препарат может представлять собой буккальную таблетку, содержащую:
Неионизированные макромолекулы включают, например, метилцеллюлозу (МЦ), гидроксипропилцеллюлозу (ГПЦ), и гидроксипропилметилцеллюлозу (ГПМЦ), и полиэтиленгликоль (ПЭГ). Полимеры, образующие ионы, включают в себя, например, натриевую соль карбоксиметилцеллюлозы (Na-КМЦ), альгиновую кислоту, альгинат натрия, хитозан, поликарбофил (Noveon™) и карбомер (Capropol™).
Неионизированные макромолекулы обычно составляют от 40 до 80% по массе буккальной таблетки, в то время как полимеры, образующие ионы, обычно составляют от 20 до 60% по массе такой таблетки.
Лекарственное средство также представлять собой подъязычную таблетку, по существу содержащую или состоящую из следующего:
Разбавители включают в себя, например, лактозу, фосфаты кальция, крахмал, карбоксиметилцеллюлозу, гидроксиметилцеллюлоза. Подсластителем может быть, например, маннит или ксилит.
Разбавители обычно составляют от 90 до 98% по массе подъязычной таблетки.
В соответствии с другим предпочтительным вариантом реализации настоящего изобретения композиция приготовлена таким образом, чтобы активные агенты высвобождались в желудке, и содержит, в целях регулирования высвобождения, носитель, такой как полимер, который не растворяется или только плохо растворяется в желудке (в настоящем описании он называется просто "носитель/полимер, который не растворяется в желудке"). Композицию для этой цели предпочтительно получают путем прессования ее в таблетку или путем заключения композиции в капсулы. В качестве альтернативы композиция может быть покрыта не растворимой в воде пленкой.
Носитель, не растворяемый в желудке, может быть полимером, таким как полимер метакрилат, например, Эудрагит RS или S, или этилцеллюлоза.
Такие полимеры предпочтительно присутствуют в количестве 10-50% по массе, более предпочтительно от 20 до 40% по массе, наиболее предпочтительно от 20 до 30% по массе всей композиции.
Носитель может также образовывать гель в желудке, который плавает в содержимом желудка, или композиция может быть приготовлена в виде жидкого препарата; принимаемого внутрь (смеси), физическая структура которого предпочтительно является гелем. В качестве альтернативы, носитель композиции можно прикрепить к слизистой оболочке желудка, что вынуждает весь препарат, в том числе активный агент, прикрепляться к слизистой оболочке.
Композиция может также содержать наполнитель, предпочтительно инертный агент, такой как вторичный кислый фосфат водорода, микрокристаллическая целлюлоза (МКЦ) или другой соответствующий неразбухающий агент, например, в количестве 20-70% по массе, предпочтительно от 40 до 60% по массе, наиболее предпочтительно примерно 50% по массе всей композиции.
В соответствии с одним из предпочтительных вариантов реализации настоящего изобретения композиция содержит матричные гранулы, не растворимые в желудке. Такая композиция может содержать, например:
Полимер, не растворимый в желудке, может в указанной выше композиции быть любой обычно используемой добавкой, такой как полимер метакрилат, например, Эудрагит RS или S, или этилцеллюлоза (ЭЦ). Инертный наполнитель может быть, например, вторичным кислым фосфатом водорода, микрокристаллической целлюлозой (МКЦ) или другим соответствующим неразбухающим агентом. Твердые вещества смешивают и смачивают этанолом. Влажную смесь превращают в гранулы с помощью хорошо известных в фармацевтической промышленности способов и устройств. Высушенные гранулы могут быть применены, как таковые, или распределены в дозы, например в капсулы.
В соответствии с другим предпочтительным вариантом реализации изобретения композиция содержит матричные таблетки, не растворимые в желудке. Такая композиция может содержать, например:
Полимер, не растворимый в желудке, может в указанной выше композиции быть любой обычно используемой в фармацевтической промышленности добавкой, такой как полимер метакрилат, например, Эудрагит RS или S, или этилцеллюлоза (ЭЦ). Инертный наполнитель может быть, например, фосфатом дикальция водорода, микрокристаллической целлюлозой (МКЦ) или другим соответствующим неразбухающим агентом. Твердые вещества смешивают, и смесь гранулируют, применяя, например, этанол или гидрофильный полимерный раствор. Гранулы прессуют в таблетки с помощью хорошо известных в фармацевтической промышленности способов и устройств. Высвобождение активного соединения (-й) будет здесь основываться на распространении водорастворимого эффективного соединения (-й) через поры, образованные в матрице таблетки.
В соответствии с другим предпочтительным вариантом реализации настоящего изобретения композиция содержит один или более пористый пленкообразующий агент для нанесения лекарственного средства, такой как этилцеллюлоза, или гидроксипропилметилцеллюлоза, или их комбинации. Наиболее предпочтительно, когда применяют комбинацию этилцеллюлозы и гидроксипропилметилцеллюлозы, такую, как комбинация, в которой соотношение количества ЭЦ к ГПМЦ составляет от 3/2 до 7/3.
Такая композиция, покрытая пористой пленкой, может содержать, например:
Водорастворимый наполнитель в такой композиции может быть, например, лактозой или каким-либо другим водорастворимым наполнителем, обычно применяемым в фармацевтической промышленности. Твердые вещества смешивают, и смесь прессуют в таблетки с помощью способов и устройств, хорошо известных в фармацевтической промышленности. Пористая пленка может быть получена из водорастворимого полимера, такого как гидроксипропилметилцеллюлоза (ГПМЦ), или не растворимого в воде полимера, такого как этилцеллюлоза (ЭЦ), предпочтительно из смеси таких полимеров. Предпочтительным является следующее соотношение количеств пленкообразующих веществ, например, ЭЦ и ГПМЦ - 2-5 частей нерастворимого в воде полимера и 1-2 части водорастворимого полимера. В условиях желудка водорастворимый полимер растворяется, и становится пористым, и образует в остатке нерастворимый в воде полимер. Высвобождение эффективного соединения (-й) будет здесь основано на распространении водорастворимого эффективного соединения (-й) из пор, образованных в пленке. Пленкообразующие вещества эффективно маскируют также вкус активного агента (-ов).
Лечение
Композицию, содержащую эффективные количества цистеина и цистина, или глутатиона, или метионина, вводят в пищевой продукт или напиток, который вскоре будет потребляться субъектом, или непосредственно субъекту, в соответствующем количестве, которое может содержать, например, от 0,2 до 20% по массе цистеина и от 0,02 до 20% по массе цистина, или глутатиона, или метионина, или их комбинации, наиболее предпочтительно непосредственно субъекту вместе с потребляемыми субъектом напитками или продуктами питания, содержащими алкоголь, или напитками или продуктами питания, содержащими ацетальдегид, или вместе с курением субъекта.
Кроме того, предпочтительно, чтобы препарат имел определенную форму, которая позволяет легко держать его во рту или проглатывать. Однако является преимуществом, если композиция для высвобождения активных агентов в желудке присутствует в виде препарата, имеющего диаметр по меньшей мере 7 мм, предпочтительно от 8 до 15 мм, более предпочтительно от 11 до 15 мм. Это помогает препарату оставаться в желудке достаточное времени для регулируемого высвобождения активных агентов.
Таким образом, настоящее изобретение относится к препаратам и способам, которые могут быть применены, чтобы снизить частоту сильных головных болей, в частности, кластерных головных болей и мигреней.
Например, частота сильных головных болей может быть уменьшена с помощью способа лечения, который включает в себя следующие этапы:
а) человека, по крайней мере, время от времени страдающего от сильных головных болей, обеспечивают композицией, содержащей цистеин и цистин, или глутатион, или метионин, которые будут применяться вместе с потреблением алкогольных напитков, или продуктов питания, или содержащих ацетальдегид напитков или продуктов питания, или вместе с курением,
b) субъект самостоятельно вводит композицию, и
c) субъекту разрешают есть, пить или курить,
причем цистеин и цистин, или глутатион, или метионин связывают ацетальдегид, произведенный или внесенный в организм вместе с потреблением напитка или пищевого продукта, и
d) необязательно, этапы а) - с) повторяют столько раз, сколько считают необходимым.
Другие заявки по изобретению
В соответствии с одним из вариантов реализации настоящего изобретения композицию по настоящему изобретению вводят людям, имеющим атрофический гастрит, в дополнение к страданиям от указанных выше сильных головных болей.
Атрофический гастрит, среди прочего, повышает риск нарушения всасывания витамина B12 и может привести к злокачественной анемии. Нарушение всасывания питательных микроэлементов может привести к серьезным вторичным заболеваниям центральной нервной системы и к остеопорозу. Половина людей с атрофическим гастритом тела желудка может иметь исключительно низкий уровень витамина В12, и по меньшей мере половина этих людей одновременно имеет повышенные сывороточные уровни гомоцистеина. Таким образом, композиция по настоящему изобретению с добавлением витамина В12 особенно подходит для применения такими людьми. Витамин В12 будет высвобождаться с другими активными агентами и переноситься, по меньшей мере, с частью цистина, или глутатиона, или их комбинации, в кровоток для системного воздействия.
Дефицит витамина B12 является сильным фактором риска для нейродегенеративных расстройств, таких как деменция, депрессия и полинейропатия. Дефицит витамина B12 является одной из распространенных причин гипергомоцистеинемии, независимым фактором риска развития атеросклероза, инсультов и инфарктов. Из-за атрофии тела и плохого питания целых 15% людей в возрасте старше 50 лет страдают от предотвратимых эпидемий дефицита витамина B12.
Ранним выявлением атрофии тела посредством регулярного скрининга соответствующих биомаркеров, например, скринингом GastroPanel® и последующим лечением, можно предотвратить возможные неврологические инвалидности (например, деменции, депрессии и полинейропатии) и сосудистые заболевания (например, инсульты и инфаркты). Старение населения увеличивает потребность в скрининге на указанных биомаркерах, например, исследовании и скрининге посредством GastroPanel®, и, другими словами, в диагностике атрофического гастрита и сопутствующих рисков и заболеваний.
В композиции по настоящему изобретению, в дополнение к витамину В12, могут быть добавлены и другие витамины, такие как витамины A, D, Е и С, ниацин, биотин, тиамин, В2, В5, В6 и фолиевая кислота, а также рассеянные элементы, такие как хром, марганец, селен, цинк и железо. Сплавы черных металлов имеют особое преимущество, так как атрофический гастрит часто связан с железодефицитной анемией.
В соответствии с одним из вариантов реализации настоящего изобретения описанному выше лечению предшествует установление такого диагноза, как возможная инфекция Н. pylori, предпочтительно с применением теста, который надежно устанавливает также такой диагноз, как атрофический гастрит. Таким образом, можно оценить масштабность проблем, вызванных ацетальдегидом в желудочно-кишечном тракте (ЖКТ).
Как известно из литературы, биомаркеры пепсиногены I и II (ПГ-I и ПГ-II), а также гастрин-17 (Г-17) определяют атрофический гастрит точно, возможно, в среднем, даже более точно, чем гастроскопия. Соотношение ПГ I/ПГ II также коррелирует с возникновением предраковых и раковых изменений в пищеводе. Эти биомаркеры выделяются в полость желудка и в небольших количествах передаются в кровообращение, где они отражают концентрации в желудке.
Уровень ПГI и соотношение ПГ I/ПГ II являются маркерами функции и структуры слизистой оболочки тела, а уровень Г-17, который, как правило, измеряют в образце крови, сданной натощак, является маркером функции и структуры слизистой оболочки антрального отдела. В том числе, например, антитела Н. pylori, такие как IgG и IgA Н. pylori, в качестве биомаркеры в тесте будут предоставлять информацию так же, как о возможной инфекции Н. pylori. Таким образом, указанные биомаркеры (ПГ-I, ПГ-II и их соотношение, в комбинации с Г-17 и IgG и IgA H. pylori) дополняют друг друга с получением диагностической панели.
Уровни этих биомаркеров предпочтительно измеряют с использованием анализа ELISA на крови, плазме или образце сыворотки пациента, в частности, на образце плазмы крови, сданной натощак. Если у пациента есть инфекция Н. pylori, и низкие уровни Г-17 не позволяют провести инвазивную гастроскопию, атрофический гастрит в антральном отделе может быть подтвержден или исключен путем анализа концентрации стимулированного белком Г-17 в плазме в дополнение к упомянутому исследованию из образца в плазме крови, сданной натощак. Процедурой исследования, особенно подходящей для указанной цели, является исследование GastroPanel®.
Роль ПГ-I в качестве маркера атрофического гастрита хорошо известна. В последнее время также было предоставлено свидетельство о его полезности в определении состояния, в частности, слизистой оболочки организма.
В последнее время было показано, что соотношение ПГI/ПГII линейно уменьшается с увеличением степени атрофического гастрита в теле. Соотношение составляет <3.0, когда атрофический гастрит в теле желудка является расширенным (умеренным или тяжелым). Было показано, что риск рака желудка увеличивается (в 5 раз), когда соотношение ПГI/ПГII является низким.
Роль измерения амидированного пептидного гормона гастрина-17 является менее изученной, чем пепсиногенов, но все же уже вызывает значительный клинический интерес. В желудке гастрин-17 имеет задачу стимуляции секреции соляной кислоты. Кроме того, существует отрицательный контроль с обратной связью, при котором соляная кислота ингибирует образование Г-17.
Сочетание определения Г-17 с определением ПГ I и II помогает различать случаи, когда атрофический гастрит (АГ) ограничивается областями дна желудка и тела (ПГ-I является низким, но Г-17 является высоким), от тех, где также поврежден антральный отдел (как ПГ-I, так и Г-17 являются низкими). Такое разграничение клинически важно, потому что последнее (панатрофия) несет высокий известный риск развития рака желудка.
Для дальнейшего усиления исследования результаты анализа Г-17 натощак можно сравнить с результатами определения Г-17 после стимуляции белковой пищей. Если низкий уровень Г-17 не становится явно повышенным после такой стимуляции, то это является хорошим доказательством атрофии в области антрального отдела. Однако если изначально низкий уровень Г-17 явно повышен такой стимуляцией, антральный отдел желудка, вероятно, будет физиологически функциональным, и низкий остаточный уровень Г-17 (например, ниже 2 пмоль/л) в таких случаях является сильной индикацией аномально высокой кислотности в желудке, и в этом случае повышается риск язвы Барретта пищевода. И наоборот, патологически высокий уровень Г-17 натощак сильно свидетельствует о гипо- или ахлоргидрии, которые могут быть вызваны АГ, ограниченным областью тела, или даже ИПП-лечением.
Следующие примеры включены только в целях иллюстрации и не предназначены для ограничения изобретения.
Примеры
Пример 1 - Приготовление таблеток для рассасывания
Были приготовлены сосательные таблетки, одна таблетка, содержащая:
Последующие композиции различались по содержанию цистеина, который составлял 1,25 мг, 2,5 мг, 5 мг и 10 мг цистеина.
Композиции приготовили путем смешивания порошкообразной массы и ее прессования с получением таблеток для рассасывания.
Пример 2 - Приготовление жевательных резинок
Была приготовлена жевательная резинка, содержащая:
Композицию приготовили путем смешивания порошкообразной массы и ее прессования с получением жевательных резинок.
Приготовили другую композицию, содержащую 500 мг Pharmagum S или М и 20 мг стеарата магния.
Пример 3 - Приготовление буккальных таблеток
Была приготовлена буккальная таблетка, содержащая:
Композицию приготовили путем смешивания порошкообразной массы и ее прессования с получением буккальных таблеток.
Пример 4 - Приготовление подъязычных таблеток
Была приготовлена подъязычная таблетка, содержащая:
Композицию готовили путем смешивания порошкообразной массы и ее прессования с получением подъязычных таблеток.
Пример 5 - Влияние композиции на уровни ацетальдегида
Пять курильщиков (в возрасте 29±2,8) приняли участие в исследовании, в котором были выкурены три сигареты (с очищающими периодами между ними). Во время курения каждой сигареты (в течение 5 минут), добровольцы с завязанными глазами рассасывали таблетки, содержащие плацебо, 1,25 мг, 2,5 мг, 5 мг, 10 мг или 20 мг L-цистеина. Ацетальдегид в образцах слюны анализировали с помощью газовой хроматографии через 0, 5, 10, 20 минут от начала курения.
Таблетки L-цистеина (5 мг, 10 и 20 мг) удалили из слюны весь ацетальдегид, происходящий из табака (см. Фиг. 1). Среднее содержание ацетальдегида в слюне сразу же после курения были 191,2±48,5 мкМ, 0 мкМ, 0 мкМ, 0 мкМ для плацебо и 5 мг, 10 мг и 20 мг таблеток L-цистеина, соответственно.
Исследование показало, что даже 5 мг L-цистеина, когда их давали с растворяющейся таблеткой, полностью инактивировали канцерогенный ацетальдегид в слюне во время курения. Таблетка L-цистеина в 1,25 мг уменьшила количество ацетальдегида примерно на две трети по сравнению с плацебо.
Пример 6 - Увеличение уровней ацетальдегида в слюне как следствие курения и употребления алкоголя
Табачный дым содержит ацетальдегид, который во время курения становится растворенным в слюне (см. Фиг. 2). В этом исследовании, как курильщики, так и некурящие, сначала выпили небольшую дозу алкоголя, а после этого курильщики курили 6 сигарет в течение примерно 5 минут каждый. Во время курения ацетальдегид в слюне существенно превышает уровень канцерогенности.
Посредством глотания ацетальдегид в слюне, полученный либо из алкоголя, либо от курения, распространяется из полости рта в глотку, пищевод и желудок. Таким образом, канцерогенный эффект не ограничивается полостью рта.
Убедительное доказательство местного канцерогенного действия ацетальдегида представлено в исследованиях с участием азиатов с ALDH2-дефицитом, которые образуют исключительную человеческую "нокаут-модель" для долгосрочного воздействия ацетальдегида.
У субъектов с ALDH2-дефицитом (Flushers) дополнительный ацетальдегид в слюне, по-видимому, был получен из слюнных желез.
В нескольких эпидемиологических исследованиях, проведенных в странах Азии, было одинаково показано, что ALDH2-дефицит связан с более чем 10-кратным риском рака верхних отделов пищеварительного тракта. Связь является сильнейшей среди сильно пьющих, но, кроме того, значительна и среди обычных потребителей алкоголя. При этом, очевидно, курильщики также в зоне высокого риска.
В заключение необходимо отметить, что ацетальдегид, полученный из табака, по-видимому, действует в верхней части пищеварительного тракта в качестве локального канцерогена дозозависимым и синергетическим способами.
Пример 7 - ацетальдегидо-устраняющее применение цистеина
Цистеин является серосодержащей аминокислотой. Его среднее потребление составляет около 1 г/день. Цистеин конденсируется с реакционно-способным и канцерогенным ацетальдегидом путем образования 2-метил-тиазолидин-4-карбоновой кислоты (МТКК) и тем самым, дезактивирует его.
Например, пастилка, содержащая всего лишь 5 мг L- или D-цистеина, полностью исключает ацетальдегид из слюны во время курения (Фиг. 3).
Вредное воздействие реакционноспособного ацетальдегида может быть предотвращено путем связывания его с цистеином. Эта частично незаменимая аминокислота инактивирует ацетальдегид путем неферментативного связывания, образуя более стабильное соединение, 2-метилтиазолидин-4-карбоновую кислоту. Например, были разработаны таблетка и жевательная резинка, содержащие L-цистеин, чтобы исключить воздействие ацетальдегида во время курения (Фиг. 4).
Реферат
Настоящее изобретение относится к фармакологии и раскрывает нетоксичную твердую фармацевтическую композицию для перорального введения, содержащую L-цистеин в сочетании с одним или более дополнительными активными агентами, по меньшей мере один из которых выбран из цистина, глутатиона и метионина, а также нетоксичный носитель. Композиция обеспечивает снижение частоты случаев сильных головных болей, в частности мигрени и/или кластерных головных болей. 17 з.п. ф-лы, 4 ил., 7 пр.

Комментарии