Офтальмологическая система доставки лекарственного препарата, содержащая фосфолипид и холестерин - RU2572213C2
Код документа: RU2572213C2
Чертежи
Описание
Перекрестная ссылка на родственные заявки
Данная заявка испрашивает приоритет заявки US №12/538,435, поданной 10 августа 2009. Содержание указанной заявки включено сюда посредством ссылки полностью.
Область техники, к которой относится изобретение
Изобретение касается системы доставки офтальмологического лекарственного препарата, которая содержит фосфолипид и холестерин для пролонгирования продолжительности действия лекарственного препарата в глазах.
Уровень техники изобретения
Так как глаза представляют собой закрытые органы с медленной циркуляцией крови, большинство терапевтических агентов не могут достигнуть их в эффективных количествах при систематичном введении.
Чтобы решить данную проблему, была выбрана интравитреальная инъекция для офтальмологической доставки терапевтических агентов, в частности, к задней стороне глаз (например, сетчатке и хориоиду). Так как терапевтический агент обычно остается в глазах в течение ограниченного периода, требуются повторные интравитреальные инъекции, чтобы достичь заданного терапевтического результата. Однако частое введение, использующее такой инвазивный способ, является весьма нежелательным.
Существует необходимость в системе доставки лекарственного препарата, которая пролонгирует продолжительность действия терапевтического агента в глазах, чтобы сократить периодичность интравитреальной инъекции, требуемой в лечении.
Раскрытие изобретения
Настоящее изобретение основано на неожиданном открытии того факта, что система доставки лекарственного препарата, содержащая фосфолипид и холестерин, значительно пролонгирует продолжительность действия авастина (антитела, специфичного к эндотелиальному сосудистому фактору роста) в глазах.
Соответственно один аспект настоящего изобретения относится к системе доставки лекарственного препарата, содержащей терапевтический агент (например, протеин, нуклеиновую кислоту или малую молекулу) и средство доставки, которое включает фосфолипид и холестерин. Мольный процент холестерина в средстве доставки (например, в лиофилизированной форме) может быть 5-40% (например, 10-33% или 20-25%). Средство доставки и терапевтический агент могут быть либо смешаны, либо разделены.
В системе доставки лекарственного препарата настоящего изобретения 50-90% терапевтического агента присутствует в неассоциированной форме и массовое соотношение фосфолипида и холестерина в комбинации к терапевтическому агенту составляет 5-80:1. В одном примере терапевтический агент представляет собой антитело против эндотелиального сосудистого фактора роста (VEGF) и 60-90% антитела присутствует в неассоциированной форме и массовое соотношение фосфолипида и холестерина в комбинации к антителу составляет 5-40:1. В другом примере терапевтический агент представляет собой противовоспалительную молекулу (например, кортикостероид).
Фосфолипид в средстве доставки, описанном здесь, может быть смесью двух фосфолипидов. Например, фосфолипид может быть одним из 2-диолеоил-sn-глицеро-3-фосфатидилхолина (DOPC), 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфатидилхолина (РОРС), соевого фосфатидилхолина (SPC) или яичного фосфатидилхолина (ЕРС), смешанного либо с полиэтиленгликолем дистеароилфосфатидилэтаноламином (PEG-DSPE) или диолеилфосфатидилглицерином (DOPG). Когда фосфолипид представляет собой смесь DOPC и DOPG, мольный процент первого может быть 29,5-90% (например, 50-80%) и мольный процент последнего может быть 3-37,5% (например, 3-18,75%). В одном примере средство доставки содержит DOPC, DOPG и холестерин при мольном процентном соотношении 56,25-72,5:7,5-18,75:20-25.
Другой аспект настоящего изобретения относится к способу доставки терапевтического агента в глаз пациента. Указанный способ включает (i) обеспечение системы доставки лекарственного препарата, описанной выше, которая может быть в форме водной суспензии, и (ii) введение системы в глаз пациента, нуждающегося в этом, например, посредством интравитреальной инъекции. Система доставки может быть приготовлена смешиванием фосфолипида, холестерина и одного или более терапевтического агента, чтобы образовать смесь; лиофилизированием смеси и перед введением суспендированием смеси в водном растворе, чтобы образовать водную суспензию. Альтернативно, систему приготавливают смешиванием фосфолипида и холестерина, чтобы образовать смесь; лиофилизированием смеси и перед введением суспендированием смеси вместе с одним или более терапевтическим агентом в водном растворе, чтобы образовать водную суспензию.
Также в объем охраны настоящего изобретения входит применение средства доставки, описанного выше для доставки терапевтического агента офтальмологически и в производстве медикамента для лечения глазного заболевания.
Детали одного или более вариантов осуществления изобретения изложены в описании ниже. Другие особенности или преимущества настоящего изобретения будут очевидны из следующих чертежей и подробного описания нескольких вариантов осуществления изобретения, а также из приложенной формулы изобретения.
Краткое описание чертежей
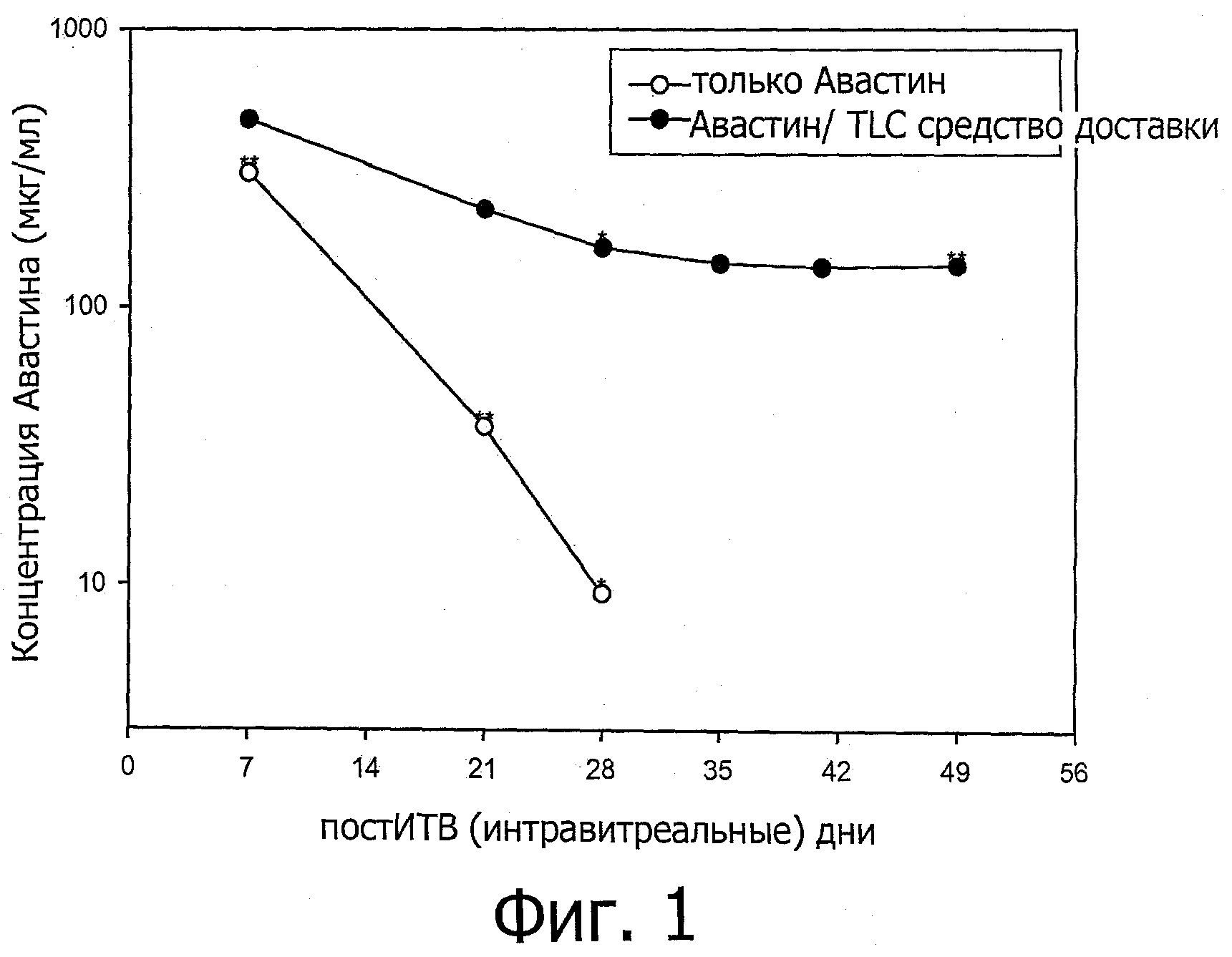
Фиг.1 представляет собой график, показывающий концентрацию авастина в стекловидном теле глаза на 7, 21, 28, 35, 41 и 49 дни после интравитреальной инъекции. TLC средство доставки относится к средству доставки, содержащему DOPC/Холестерин/DOPG при соотношении 67,5/25/7,5. «*» и «**» относится к моментам времени, при которых 1 и 2 глаза кролика были изучены соответственно. 4 глаза кролика были изучены при других моментах времени.
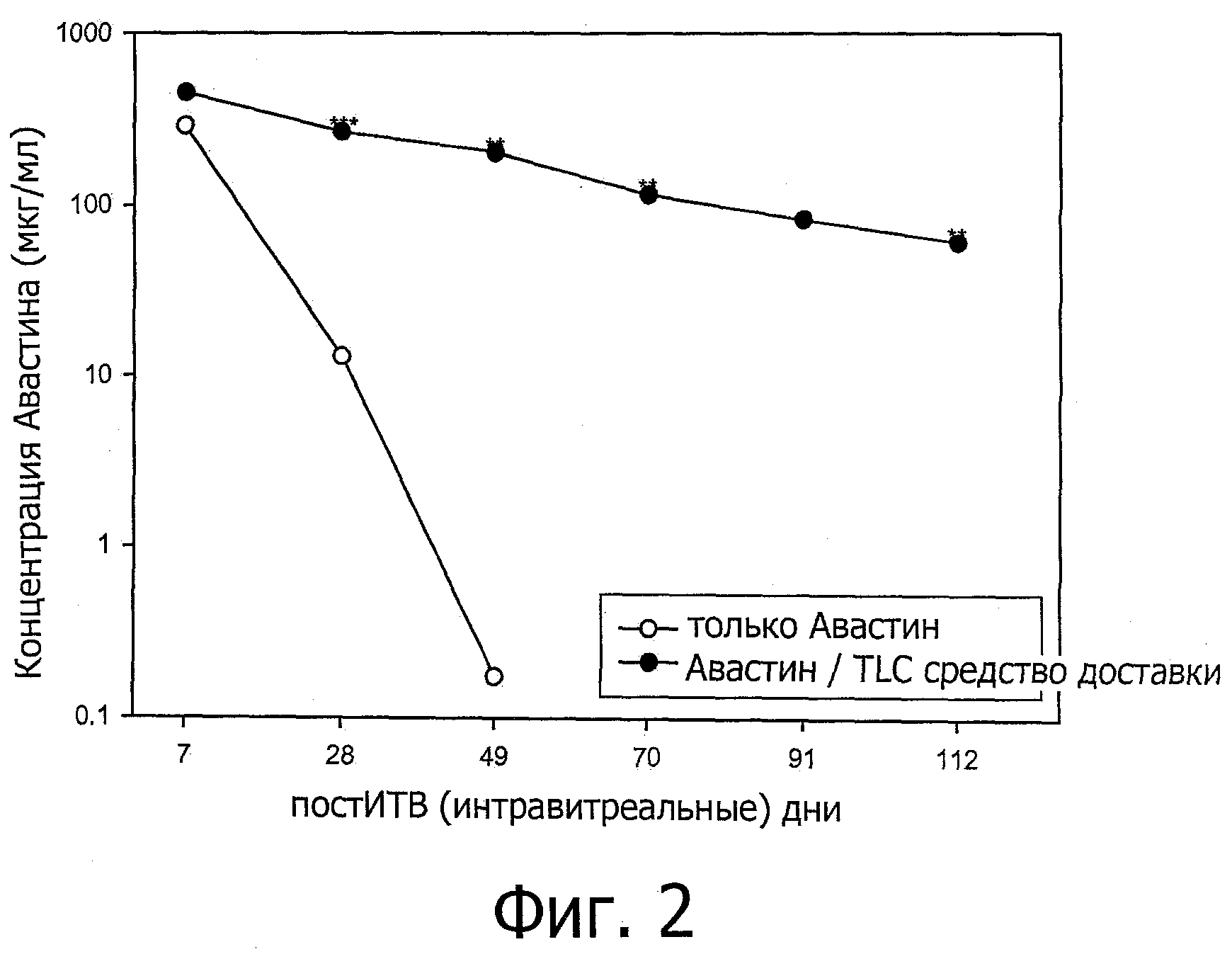
Фиг.2 представляет собой график, показывающий концентрацию авастина в стекловидном теле глаза на 7, 28, 49, 70 91 и 112 дни после интравитреальной инъекции. TLC средство доставки относится к средству доставки, содержащему DOPC/Холестерин/DOPG при соотношении 67,5/25/7,5. «**» и «***» относится к моментам времени, при которых 2 и 3 глаза кролика были изучены соответственно. 4 глаза кролика были изучены при других моментах времени.
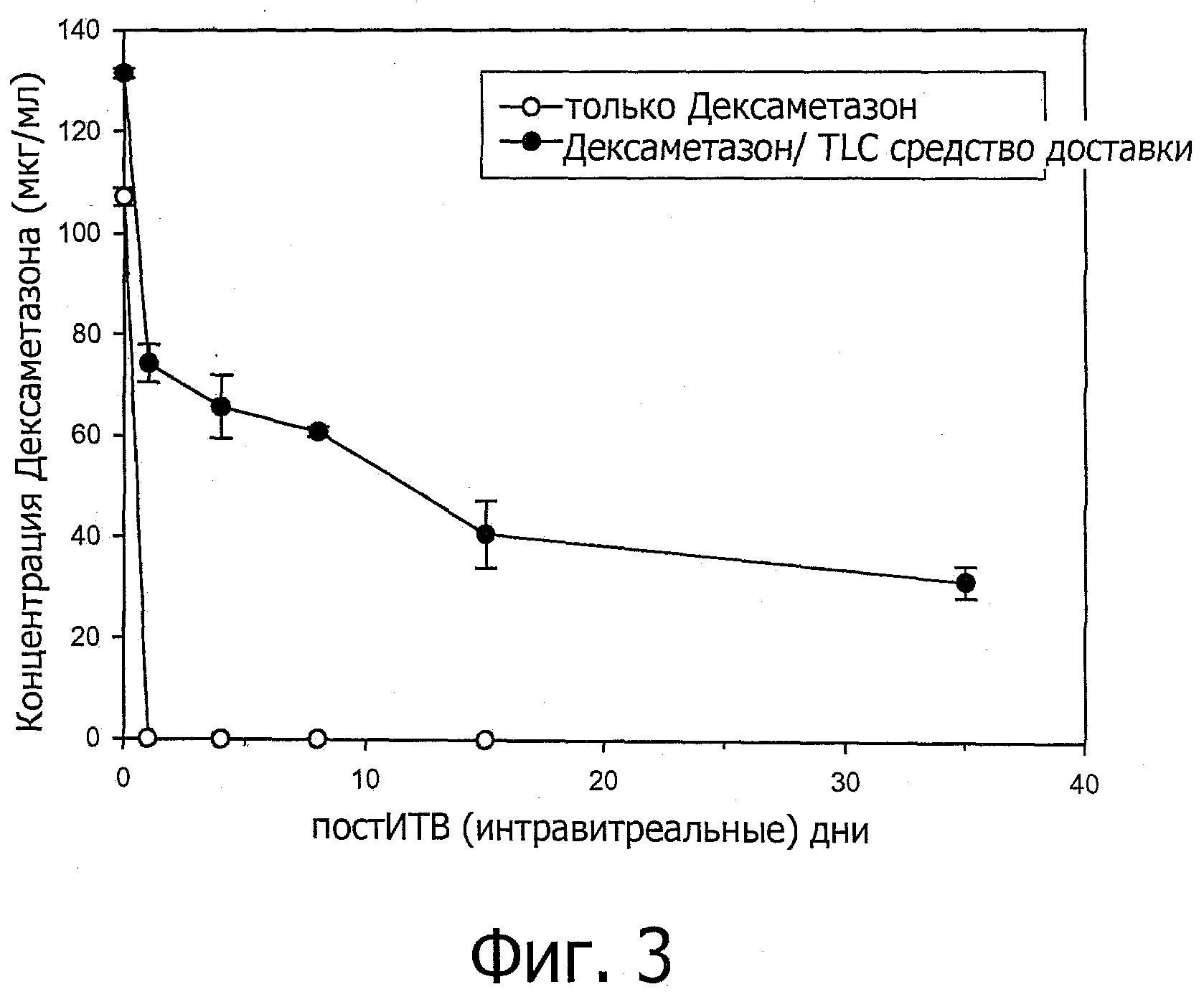
Фиг.3 представляет собой график, показывающий концентрацию дексаметазона натрия фосфат (DSP) при 2 ч, 1 д, 4 д, 8 д, 15 д и 35 д после интравитреальной инъекции. TLC средство доставки относится к средству доставки, содержащему DOPC/Холестерин/DOPG при соотношении 67,5/25/7,5.
Осуществление изобретения
Описанное в данном документе является полезной системой доставки лекарственного препарата для глазного введения, по крайней мере, одного терапевтического агента, который при доставке проявляет увеличенную продолжительность действия в глазах, в частности в стекловидном теле глаза.
Средство доставки
Указанная система доставки лекарственного препарата, описанная здесь, включает средство доставки, содержащее фосфолипид и холестерин. Фосфолипид может быть гомологичной популяцией фосфолипида, предпочтительно нейтральным фосфолипидом или смесью различных видов фосфолипидов. Примеры фосфолипида для производства средства доставки включают, но не ограничиваются, фосфатидилхолин (PC), фосфатидилглицерин (PG), фосфатидилэтаноламин (РЕ), фосфатидилсерин (PS), фосфатидную кислоту, фосфатидилинозит (PI), яичный фосфатидилхолин (ЕРС), яичный фосфатидилглицерин (EPG), яичный фосфатидилэтаноламин (ЕРЕ), яичный фосфатидилсерин (EPS), яичную фосфатидную кислоту (ЕРА), яичный фосфатидилинозит (EPI), соевый фосфатидилхолин (SPC), соевый фосфатидилглицерин (SPG), соевый фосфатидилэтаноламин (SPE), соевый фосфатидилсерин (SPS), соевую фосфатидную кислоту (SPA), соевый фосфатидилинозит (SPI), дипальмитоилфосфатидилхолин (DPPC), 1,2-диолеоил-sn-глицеро-3-фосфатидилхолин (DOPC), димиристоилфосфатидилхолин (DMPC), дипальмитоилфосфатидилглицерин (DPPG), диолеилфосфатидилглицерин (DOPG), димиристоилфосфатидилглицерин (DMPG), гексадецилфосфохолин (НЕРС), гидрогенизированный соевый фосфатидилхолин (HSPC), дистеароилфосфатидилхолин (DSPC), дистеароилфосфатидилглицерин (DSPG), диолеилфосфатидилэтаноламин (DOPE), пальмитоилстеароилфосфатидилхолин (PSPC), пальмитоилстеароилфосфатидилглицерин (PSPG), моноолеоилфосфатидилэтаноламин (МОРЕ), 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфатидилхолин (РОРС), полиэтиленгликоль дистеароилфосфатидилэтаноламин (PEG-DSPE), дипальмитоилфосфатидилсерин (DPPS), 1,2-диолеоил-sn-глицеро-3-фосфатидилсерин (DOPS), димиристоилфосфатидилсерин (DMPS), дистеароилфосфатидилсерин (DSPS), дипальмитоилфосфатидную кислоту (DPPA), 1,2-диолеоил-sn-глицеро-3-фосфатидную кислоту (DOPA), димиристоилфосфатидную кислоту (DMPA), дистеароилфосфатидную кислоту (DSPA), дипальмитоилфосфатидилинозит (DPPI), 1,2-диолеоил-sn-глицеро-3-фосфатидилинозит (DOPI), димиристоил-фосфатидилинозит (DMPI), дистеароилфосфатидилинозит (DSPI) или их смесь.
В одном примере средство доставки является свободным от жирной кислоты (а именно карбоновой кислоты с длинным неразветвленным алифатическим хвостом), катионоактивным липидом (а именно липидом, несущим свободный положительный заряд при физиологическом рН); и мукоадгезивным полимером (например, Carbopol 1934 Р, polyaxomer, карбомер и растительный лектин).
Средство доставки может быть приготовлено способами, известными в фармацевтической промышленности. Пример следует далее. Фосфолипид, холестерин и другие компоненты, если это имеет место, суспендируют в дистиллированной воде или водном растворе для образования суспензии. Затем суспензию подвергают гомогенизации традиционным методом, например обработке ультразвуком, взбалтыванию или экструзии. После стерилизации гомогенизированное суспензионное средство может быть помещено в контейнер в стерильных условиях и затем лиофилизировано для образования порошка.
Терапевтический агент
Любые терапевтические агенты (например, малая молекула, протеин, пептид или нуклеиновая кислота) для лечения глазного заболевания могут быть смешаны со средством доставки, описанным выше, и введены в глаз пациента. В одном примере терапевтический агент представляет противовоспалительный препарат, такой как соединение кортикостероида. Термин «соединение кортикостероида» относится к встречающимся в природе стероидным гормонам (включая глюкокортикоидные) и их производным, которые предпочтительно являются водорастворимыми. Примеры кортикостероида включают, но не ограничиваются, кортизон, гидрокортизон, гидрокортизона ацетат, тиксокортола пивалат, флюоцинолон, преднизолон, метилпреднизолон, преднизон, триамцинолона ацетонид, триамцинолон, мометазон, амцинонид, будесонид, дезонид, флюоцинонид, флуоцинолон ацетонид, галцинонид, бетаметазон, бетаметазон натрия фосфат, дексаметазон, дексаметазон натрия фосфат, флуокортолон, гидрокотизон-17-бутират, гидрокортизон-17-валерат, аклометазона дипропионат, бетаметазона валерат, бетаметазона дипропионат, предникарбат, клобетазон-17-бутират, клобетазол-17-пропионат, флуокортолона капроат, флуокортолона пивалат и флупреднедина ацетат. В другом примере агент представляет собой антагонист VEGF, который может быть антителом, специфичным к VEGF, растворимым VEGF рецептором, нуклеиновой кислотой, связывающейся с VEGF или малой молекулой, которая причиняет вред взаимодействию между VEGF и его родственному рецептору, и блокирует сигнальный путь VEGF. Термин «антитело», используемый здесь, относится к встречающемуся в природе иммуноглобулину, его функциональному фрагменту, такому как Fab, Fab', F(ab)2 или F(ab')2, или генетически модифицированному иммуноглобулину, такому как гуманизированное антитело, химерное антитело, диатело и одноцепочечное антитело.
Система доставки лекарственного препарата
Система доставки лекарственного средства настоящего изобретения включает средство доставки, описанное выше, и один или более терапевтических агентов, также описанных выше. Система может содержать смесь средство-лекарственный препарат в лиофилизированной форме. В одном примере смесь получают суспендированием всех компонентов средства в воде или водном растворе до образования суспензии, гомогенизацией суспензии, смешиванием гомогенизированной суспензии с одним или более терапевтических агентов до образования смеси, и наконец, лиофилизацией смеси. В другом примере смесь получают суспендированием всех компонентов средства и одного или более терапевтических агентов в воде или водном растворедо образования суспензии и затем лиофилизацией суспензии до образования лиофилизированной смеси. Криопротектор (например, маннит, сахароза, трегалоза и лактоза) может быть добавлен к суспензии средство-лекарственный препарат во время лиофилизации. Когда используется маннит, предпочтительный диапазон концентрации равен 0,5-5% (например, 0,5-2% или 1%). Перед введением лиофилизированную смесь средство-лекарственный препарат повторно суспендируют в водном растворе, который затем может быть направлен в глаз пациента.
В приведенной системе доставки лекарственного препарата 50-90% терапевтического агента присутствует в неассоциированной форме. Термин «терапевтический агент в неассоциированной форме» относится к терапевтическим молекулам, отделимым через гель-фильтрацию из фракции фосфолипид/холестерин системы доставки. Процентное содержание неассоциированного терапевтического агента определяется следующим способом, описанным ниже в примере 7.
При необходимости система доставки лекарственного препарата в настоящем изобретении может дополнительно включать фармацевтически приемлемый носитель, а именно носитель, совместимый с терапевтическим агентом в настоящей системе и предпочтительно обеспечивающий стабилизацию терапевтического агента и не губительный для пациента, которого лечат.
Вышеописанная система доставки лекарственного препарата может быть введена в глаз пациента с помощью, например, интравитреальной инъекции для лечения глазных заболеваний.
Без дополнительного изобретательства специалист в данной области техники может на основании вышеприведенного описания осуществить настоящее изобретение в полной степени. Следующие конкретные варианты осуществления изобретения поэтому должны быть истолкованы только как иллюстративные, но не ограничивающие объем притязаний. Все публикации, процитированные в данном описании, включены в полном объеме посредством ссылки.
Пример 1: Получение композиции, содержащей фосфолипид-холестерин для доставки лекарственного препарата в глаза
Фосфолипиды DOPC и DOPG смешивали с холестерином при различных молярных соотношения (а именно 67,5:7,5:25,72:8:20 и 56,25:18,75:25) до образования липидной смеси. Смеси суспендировали в хлороформе и сушили в вакууме в роторном испарителе. Каждую из высушенных смесей повторно суспендировали в деионизированной H2O, гомогенизировали посредством рупорообразной чаши ультразвукового измельчающего гомогенизатора (Misonix Sonicator 3000) и затем стерилизовали, используя стерильный фильтр. Стерилизованные липидные смеси заполняли в стерильных условиях в ампулы, смешивали с 1% маннита и затем лиофилизировали. Общую концентрацию фосфолипидов в каждой лиофилизированной смеси определяли биологическим анализом на фосфор. Перед доставкой в глаза подходящее количество липидной смеси, упомянутой выше, смешивали с подходящим количеством авастина и суспендировали в водном растворе до образования водной суспензии.
Пример 2: Применение средств доставки, содержащих DOPC/PEG-DSPE/холестерин для доставки авастина в глаза
Средства доставки, содержащие DOPC, PEG-DSPE и холестерин, при различных молярных соотношениях готовили способом, описанным выше в примере 1. Каждое из указанных средств доставки смешивали с подходящим количеством авастина до образования водных суспензий.
Эффект средств доставки, упомянутых выше, в пролонгировании продолжительности действия авастина на глаза проверяли способом, описанным в Bakri et al., Ophthalmology, 2007, 114:5, 855-859. Кратко: белым кроликам из Новой Зеландии были сделаны внутримышечные инъекции седативного средства из смеси, содержащей Zoltil (15 мг/мл) и Rompun (7 мг/мл). В оба глаза каждого кролика интравитреально инъецировали 50 мкл авастина (25 мг/мл) или одну из водных суспензий, указанных выше (при дозе авастина 1,25 мг на глаз), используя иглу 30-го калибра. Кроликов умертвляли через 7 дней или 21 день после инъекции и их глаза сразу энуклеировали. Стекловидное тело глаза выделяли из каждого глаза вместе с сетчаткой, а концентрацию авастина определяли посредством методом ELISA как показано далее.
Планшет F96 MaxiSorp™ NUNC-IMMUNO покрывали VEGF (10 мкг/мл в PBS, рН 7,4; 100 мкл/клетку) при 4°С на ночь. Планшет, покрытый VEGF, промывали PBS и затем блокировали буферным раствором для блокировки (5% обезжиренное молоко в PBS) при комнатной температуре в течение 1 ч. Образец стекловидное тело/сетчатка, указанный выше, разбавляли в том же блокирующем буферном растворе и полученные в результате разбавители добавляли к планшету, покрытому VEGF, при 100 мкл/лунку. После инкубирования при комнатной температуре в течение 1 ч планшет промывали 0,1% Tween-20 и 0,5% обезжиренным молоком в PBS в течение 5 раз и с PBS в течение других 5 раз. Затем в планшет добавляли HRP-меченное козье антитело против IgG человека (Jackson ImmunoResearch Lab.Inc.), разбавленное в блокирующем буфере. После инкубирования при комнатной температуре в течение 30 мин планшет экстенсивно промывали. Затем к планшету добавляли реагент, содержащий тетраметилбензидин, для окрашивания. После значительного периода реакцию прекращали путем добавления к каждой лунке 50 мкл 2N HCl. Абсорбцию при 450 нм (OD450) каждой лунки определяли ELISA ридером. Разные предварительно определенные концентрации авастина (3,125-25 нг/мл) использовали для построения стандартной кривой концентрация авастина/OD450. Концентрацию авастина в каждом образце определяли на основе его OD450 величины, принимая во внимание стандартную кривую.
Результаты, полученные из данного исследования, показаны в таблице 1 ниже:
Как показано в таблице 1, авастин оставался в глазах в течение длительного периода времени, когда совместно доставлялся со средствами, содержащими DOPC/PEG-DSPE/холестерин по сравнению с одним авастином. Результаты также показывают, что холестерин является необходимым для результата для увеличения продолжительности действия авастина на глаза, а молярный процент PEG-DSPE не влияет на этот результат.
Пример 3: Применение средств доставки, содержащих различные фосфолипиды для пролонгирования продолжительности действия авастина на глаза
Средства доставки, содержащие различные фосфолипиды и холестерин при различных молярных соотношениях готовили способом, описанным выше в примере 1. Средства смешивали с авастином и полученные смеси инъецировали интравитреально в глаза новозеландских кроликов. Через 7 или 21 дней после инъекции концентрацию авастина в глазах кроликов изучали способом, описанным в примере 2. Полученные таким образом результаты приведены в таблицах 2 и 3 ниже:
Пример 4: Применение средств доставки, содержащих анионные фосфолипиды для пролонгирования продолжительности действия авастина на глазах
Средства доставки, содержащие DOPG, анионный фосфолипид, PEG-DSPE или DOPC, с холестерином или без готовили способом, описанным в примере 1. Указанные средства смешивали с авастином и полученные смеси инъецировали интравитреально в глаза новозеландских кроликов. Через 7 или 21 дней после инъекции концентрации авастина в глазах кроликов изучали способом, описанным в примере 2.
Как показано ниже в таблице 4, средство доставки, содержащее анионный фосфолипид DOPG, привело к увеличенной концентрации авастина (7 дней после инъекции, по сравнению со средством доставки, которое не содержит DOPG).
Результаты, полученные из приведенного исследования, также указывают, что средства доставки, содержащие холестерин и DOPG, значительно увеличили концентрацию авастина в стекловидном теле глаза на 21 день после инъекции. Смотри таблицу 5 ниже.
Пример 5: Применение анионных средств доставки, содержащих холестерин при различных мольных процентах для пролонгирования продолжительности действия авастина в глазах
Средства доставки, содержащие холестерин при различных мольных процентах, DOPC и DOPG готовили способом, описанным в примере 1. Указанные средства смешивали с авастином и полученные смеси инъецировали интравитреально в глаза новозеландских кроликов. На 21 день после инъекции концентрацию авастина в глазах кроликов изучали способом, описанным в примере 2. Результаты, полученные в исследованиях, представлены ниже в таблице 6:
Пример 6: Фармакокинетические свойства авастина, доставленного в стекловидное тело глаза средствами доставки, содержащими фосфолипид и холестерин
Кроликам интравитреально инъецировали либо один авастин (кролики контрольной группы), либо авастин, смешанный со средством доставки, содержащим DОРС/холестерин/DOPG при соотношении 67,5/25/7,5 (кролики исследуемой группы). Концентрации авастина в стекловидном теле глаза кроликов контрольной группы проверяли посредством ELISA на 7, 21 и 28 дни после инъекции и указанные концентрации авастина кроликов исследуемой группы проверяли на 7, 21, 28, 35, 41 и 49 пост-инъекционные дни.
Концентрация авастина, инъецируемого без средства доставки в стекловидном теле глаза, уменьшилась со временем гораздо быстрее, чем концентрация авастина, инъецируемого со средством доставки. Смотри фиг.1. Приведенный результат демонстрирует, что средство доставки пролонгирует продолжительность действия авастина на глаза.
В похожем исследовании концентрации авастина в стекловидном теле глаза контролировали на 7, 28, 49, 70, 91 день после интравитреальной инъекции. Для кроликов контрольной группы концентрация авастина в стекловидном теле глаза была 13 мкг/мл через 28 дней после инъекции, в то время как для кроликов исследуемой группы концентрация авастина в стекловидном теле в той же самой временной точке была 265 мкг/мл, в 20 раз выше, чем концентрация для кроликов контрольной группы. Смотри фиг.2. Период полураспада интравитреального авастина в контрольной группе кроликов составляет 3,9 дней. Иначе, период полураспада интравитреального авастина в исследуемой группе кроликов проявляет 2-компартмент характерной особенности с начальным и конечным периодами полураспада, составляющими 5,5 (t1/2α) и 40,5 (t1/2β) дней соответственно. AUC (а именно площадь под кривой) авастина от 7 дня до бесконечности (AUC(7-∞)) в исследуемой группе кроликов составляет 6,8 раз выше, чем площадь под кривой контрольной группы кроликов, и (AUC(112-∞)) авастина в исследуемой группе кроликов составляет 1,1-раз выше, чем (AUC(7-∞)) авастина в контрольной группе кроликов. Смотри таблицу 7 ниже.
Итак, результаты, обсужденные выше, демонстрируют, что средство доставки значительно пролонгировало продолжительность действия авастина на глаза.
Пример 7: Приготовление композиций для доставки различных терапевтических агентов
DOPC, DOPG и холестерин при массовом соотношении 8,8/1/1,6 растворяли в хлороформе, который затем выпаривали в вакууме, используя роторный испаритель. Высушенную смесь фосфолипидов и холестерина, полученную таким образом, суспендировали в деионизированной воде, чтобы образовать водную суспензию. Суспензию затем гомогенизировали с помощью обработки ультразвуком, используя рупорообразную чашу ультразвукового гомогенизатора (Misonix Sonicator 3000), стерилизовали фильтрованием, в стерильных условиях заполнили в ампулу и лиофилизировали, чтобы образовать средство доставки, содержащее фосфолипид-холестерин. Концентрацию фосфолипида в средстве доствки определяли традиционным биологическим анализом на фосфор, чтобы гарантировать, что средство содержало соответствующее общее количество фосфолипидов.
Средство доставки затем смешивали с различными терапевтическими агентами, а именно триптофаном (10 мг/мл), тирозином (10,4 мг/мл), HFRRHLC пептидом (10 мг/мл), HWRGWVC пептидом (10 мг/мл), протеином W (13 мг/мл), альбумином бычьей сыворотки (50 мг/мл), авастином (25 мн/мл) и дексаметазоном натрия фосфатом (6,7 мг/мл), все растворяли в 50 мМ фосфатным буфером, рН 6,2. Полученные таким образом смеси растворяли 18-100-кратно в том же самом фосфатном буфере и аликвоту каждой смеси (50-200 мл) подвергали гель-фильтрации, чтобы определить процентное содержание терапевтического агента, которое находилось в неассоциированной форме. Кратко: аликвоту смеси загружали в колонку Sepharose 4B (диаметр 1,8; длина 315 мм). Компоненты смеси затем элюировали фосфатным буфером 50 нМ (рН 6,2). Фракции, содержащие терапевтический агент в разной форме, а именно неассоциированной форме или ассоциированной с фосфолипидами, собирали, их абсорбцию измеряли при 215 нм и 254 нм. Количество терапевтического агента в каждой фракции определяли исходя из величин OD215 и OD254. На основании приведенных величин определяли процентное содержание неассоциированных терапевтических агентов и массовые соотношения липидов к лекарственным препаратам - см. таблицу 8.
Пример 8: Фармакокинетические свойства дексаметазон фосфат натрия, доставленного в стекловидное тело глаза средством, содержащим фосфолипид и холестерин
Кроликам интравитреально инъецировали либо один дексаметазон фосфат натрия фосфат (DSP) (кролики контрольной группы), либо DSP, смешанный со средством доставки, содержащим DOPC/холестерин/DOPG при соотношении 67,5/25/7,5 (кролики тестовой группы). В оба глаза каждого кролика интравитреально инъецировали 50 мкл DSP или DSP-средство доставки смеси при дозе DSP 0,2 мг. Концентрация DSP в стекловидном теле глаза кроликов контрольной группы проверяли ультраэффективной жидкостной хроматографией (ACQUITY UPLC™) с матричным фотодиодным детектором (PDA) при 2 ч, 1 д, 4 д, 8 д и 15 д после инъекции и концентрацию в стекловидном теле глаза кроликов исследуемой группы определяли на 2 ч, 1 д, 4 д, 8 д, 15 д и 35 д после инъекции. Два глаза проверяли для каждого момента времени.
Как показано на фиг.3, концентрация DSP в стекловидном теле, инъецированного без средства доставки, уменьшалась очень быстро после инъекции; напротив, значительный уровень DSP, инъецированного вместе со средством доставки, наблюдали даже через 35 дней после инъекции. Этот результат показывает, что средство доставки пролонгирует продолжительность действия DSP в глазах.
Другие варианты осуществления изобретения
Все признаки, раскрытые в приведенном описании, могут быть скомбинированы в любом сочетании. Каждый признак, раскрытый в приведенном описании, может быть замещен любым альтернативным признаком, служащим той же эквивалентной или подобной цели. Таким образом, если прямо не указано иное, каждый признак раскрыт только в качестве примера общего ряда эквивалентных или похожих признаков.
Из приведенного выше описания специалист в данной области техники может легко определить существенные характерные особенности настоящего изобретения и без выхода за пределы существа и объема изобретения может произвести различные изменения и модификации изобретения для того, чтобы адаптировать его к различным применениям и условиям. Таким образом, другие варианты осуществления изобретения также в объеме формулы изобретения.
Реферат
Изобретение относится к медицине, а именно к офтальмологии, и касается системы доставки офтальмологического лекарственного препарата. Эта система включает средство доставки, содержащее фосфолипид или смесь фосфолипидов, холестерин, и терапевтический агент в определенных массовых соотношениях. Такая система обеспечивает эффективную доставку и пролонгирование действия терапевтического агента.15 з.п.ф-лы, 3 ил.,8 табл.,8 пр.
Формула
- средство доставки, содержащее фосфолипид или смесь фосфолипидов, выбранных из группы, состоящей из DOPC, POPC, SPS, ЕРС, PEG-DSPE и DOPG, и холестерин, который присутствует в количестве 10-33 мол.% относительно средства доставки, и
терапевтический агент для глаз;
при этом 50-90% терапевтического агента для глаз присутствует в неассоциированной форме и массовое соотношение фосфолипида и холестерина в комбинации с терапевтическим агентом для глаз составляет 5-80:1.

Комментарии