Применение сиролимуса для лечения экссудативной возрастной макулярной дегенерации с персистирующим отеком - RU2765728C2
Код документа: RU2765728C2
Чертежи





Описание
Область техники, к которой относится настоящее изобретение
Это изобретение относится к способу лечения персистирующего отека у пациентов с экссудативной возрастной макулярной дегенерацией. В частности, настоящее изобретение относится к лечению влажной возрастной макулярной дегенерации интравитреальным сиролимусом у субъектов с неадекватным ответом на предшествующее лечение интравитреальным агентом ингибитором фактора роста эндотелия сосудов.
Перекрестная ссылка на родственные заявки
Для настоящей заявки испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США № 62/341543, поданной 25 мая 2016 года, которая включена в настоящее описание посредством ссылки во всей своей полноте.
Предшествующий уровень техники настоящего изобретения
Возрастная макулярная дегенерация является основной причиной серьезной потери зрения у людей старше 65 лет в Соединенных Штатах (Rein et al., Arch Ophthalmology, 127:533-540, 2009). Большинство случаев серьезной потери зрения вследствие прогрессирующей AMD связано с наступлением хориоидальной неоваскуляризации (CNV). Неоваскулярная AMD (влажная AMD) характеризуется ростом хориоидальных сосудов в субретинальное пространство. Эти сосуды имеют тенденцию к пропотеванию текучей среды и крови, вызывая отек сетчатки и центральную потерю зрения.
Данные испытаний, сравнивающих виды лечения возрастной макулярной дегенерации: испытания (CATT) LUCENTIS (Торговая марка)-AVASTIN (Торговая марка) показали, что у пациентов с AMD трудно достичь анатомического уплощения желтого пятна (NCT00593450). Кратко, при CATT сравнили эффект лечения двумя ингибиторами фактора роста эндотелия сосудов (VEGF), ранибизумабом и бевацизумабом. После одного года ежемесячно требуемого лечения в обеих группах бевацизумаба и ранибизумаба у приблизительно 50% субъектов продолжалось наличие интраретинальной и/или субретинальной текучей среды при оптической когерентной томографии (CATT Research Group, New Engl J Med, 364:1897-1908, 2011). Когда текучая среда продолжает присутствовать в этих структурах, обычно требуется повторное лечение для стабилизации зрения. Более того, субъекты с персистирующей интраретинальной текучей средой, как правило, имеют более слабое улучшение зрения в результате лечения анти-VEGF (Jaffe et al., Ophthalmology, 120:1860-1870, 2013).
Таким образом, в данной области техники остается потребность в схемах лечения и лекарственных средствах для уменьшения интраретинального отека у субъектов с неоваскулярной AMD.
Список ссылок
Непатентная литература
[NPL 1] Rein et al., Arch Ophthalmology, 127:533-540, 2009
[NPL 2] CATT Research Group, New Engl J Med, 364:1897-1908, 2011
[NPL 3] Jaffe et al., Ophthalmology, 120:1860-1870, 2013
Краткое раскрытие настоящего изобретения
Это изобретение относится к способу лечения персистирующего отека у пациентов с экссудативной возрастной макулярной дегенерацией. В частности, настоящее изобретение относится к лечению влажной возрастной макулярной дегенерации интравитреальным сиролимусом у субъектов с неадекватным ответом на предшествующее лечение интравитреальным агентом ингибитором фактора роста эндотелия сосудов.
В настоящем изобретении предоставлены способы лечения экссудативной возрастной макулярной дегенерации (AMD) у субъекта-человека, при этом способ включает: введение субъекту-человеку эффективного количества жидкого состава посредством интравитреальной инъекции для лечения экссудативной AMD, причем жидкий состав содержит от приблизительно 1% (мас./мас.) до приблизительно 10% сиролимуса или его фармацевтически приемлемой соли; и у субъекта-человека имеется персистирующий интраретинальный или субретинальный отек вследствие экссудативной AMD несмотря на предшествующее лечение интравитреальным ингибитором фактора роста эндотелия сосудов (VEGF). В некоторых вариантах осуществления эффективное количество жидкого состава содержит от 200 до 900 мкг сиролимуса или от 400 до 480 мкг сиролимуса. В некоторых вариантах осуществления предшествующее лечение интравитреальным анти-VEGF включает по меньшей мере три предшествующих инъекции за последние три-семь месяцев или за последние пять месяцев. В некоторых вариантах осуществления лечение анти-VEGF включает лечение моноклональным анти-VEGF антителом или его VEGF-связывающим фрагментом. В некоторых из этих вариантов осуществления моноклональное анти-VEGF антитело представляет собой антитело человека или гуманизированное антитело. В некоторых вариантах осуществления лечение анти-VEGF включает одно или более из группы, состоящей из бевацизумаба, ранибизумаба, афлиберцепта, пегаптаниба и их комбинаций. В некоторых вариантах осуществления возраст субъекта 50 лет или больше. В некоторых из этих вариантов осуществления возраст субъекта от 50 до 64 лет, от 65 до 74 лет или 75 лет или старше. В некоторых вариантах осуществления при лечении экссудативной AMD добиваются уменьшения отека в обработанном глазу, составляющего по меньшей мере приблизительно -15 микрон по толщине центральной подобласти при измерении с помощью оптической когерентной томографии через приблизительно один месяц (± неделя) после введения жидкого состава. В некоторых предпочтительных вариантах осуществления введение проводят один раз каждые два месяца в течение по меньшей мере двух месяцев, и при лечении экссудативной AMD добиваются уменьшения отека в обработанном глазу, составляющего по меньшей мере приблизительно -30 микрон по толщине центральной подобласти при измерении с помощью оптической когерентной томографии через приблизительно один месяц (± неделя) после второго введения жидкого состава. В некоторых вариантах осуществления введение проводят один раз каждые два месяца в течение по меньшей мере четырех месяцев, и при лечении экссудативной AMD добиваются уменьшения отека в обработанном глазу, составляющего по меньшей мере приблизительно -40 микрон по толщине центральной подобласти при измерении с помощью оптической когерентной томографии через приблизительно один месяц (± неделя) после третьего введения жидкого состава. В некоторых вариантах осуществления острота зрения обработанного глаза после введения жидкого состава остается стабильной или улучшается приблизительно на один месяц (± неделя). В некоторых вариантах осуществления при лечении экссудативной AMD достигают уменьшения субретинального ретинального сверхотражающего вещества в обработанном глазу. В некоторых вариантах осуществления при лечении экссудативной AMD достигают уменьшения толщины отслоения серозного пигментного эпителия в обработанном глазу. В некоторых предпочтительных вариантах осуществления жидкий состав содержит приблизительно 2% (мас./мас.) сиролимуса или его фармацевтически приемлемой соли, приблизительно 94% (мас./мас.) полиэтиленгликоля 400 и приблизительно 4% (мас./мас.) этанола, а эффективное количество жидкого состава содержит приблизительно 440 мкг сиролимуса.
Кроме того, в настоящем изобретении предоставлены способы лечения экссудативной возрастной макулярной дегенерации (AMD) у субъекта-человека, при этом способ включает: введение субъекту-человеку эффективного количества жидкого состава посредством интравитреальной инъекции для лечения экссудативной AMD; и введение субъекту-человеку эффективного количества анти-VEGF агента посредством интравитреальной инъекции для лечения экссудативной AMD, причем жидкий состав содержит от приблизительно 1% (мас./мас.) до приблизительно 10% сиролимуса или его фармацевтически приемлемой соли, у субъекта-человека имеется персистирующий интраретинальный или субретинальный отек вследствие экссудативной AMD несмотря на предшествующее лечение интравитреальным ингибитором фактора роста эндотелия сосудов (VEGF), и анти-VEGF агент вводят от одной до пяти недель после введения жидкого состава. В некоторых вариантах осуществления эффективное количество жидкого состава содержит от 200 до 900 мкг сиролимуса или от 400 до 480 мкг сиролимуса. В некоторых вариантах осуществления предшествующее лечение интравитреальным анти-VEGF включает по меньшей мере три предшествующих инъекции за последние три-семь месяцев. В некоторых вариантах осуществления анти-VEGF агент содержит моноклональное анти-VEGF антитело или его VEGF-связывающий фрагмент. В некоторых вариантах осуществления моноклональное анти-VEGF антитело представляет собой антитело человека или гуманизированное антитело. В некоторых вариантах осуществления анти-VEGF агент содержит бевацизумаб, ранибизумаб, афлиберцепт, пегаптаниб или их комбинации. В некоторых вариантах осуществления возраст субъекта 50 лет или больше. В некоторых вариантах осуществления возраст субъекта от 50 до 64 лет, от 65 до 74 лет или 75 лет или старше. В некоторых вариантах осуществления при лечении экссудативной AMD добиваются уменьшения отека в обработанном глазу, составляющего по меньшей мере приблизительно -15 микрон по толщине центральной подобласти при измерении с помощью оптической когерентной томографии через приблизительно один месяц (± неделя) после введения жидкого состава. В некоторых вариантах осуществления при лечении экссудативной AMD добиваются уменьшения отека в обработанном глазу, составляющего по меньшей мере приблизительно -45 микрон по толщине центральной подобласти при измерении с помощью оптической когерентной томографии через приблизительно один месяц (± неделя) после введения анти-VEGF агента. В некоторых вариантах осуществления острота зрения обработанного глаза после введения жидкого состава остается стабильной или улучшается приблизительно на один месяц (± неделя). В некоторых вариантах осуществления острота зрения обработанного глаза после введения анти-VEGF агента остается стабильной или улучшается приблизительно на один месяц (± неделя). В некоторых вариантах осуществления при лечении экссудативной AMD достигают уменьшения субретинального ретинального сверхотражающего вещества в обработанном глазу. В некоторых вариантах осуществления при лечении экссудативной AMD достигают уменьшения толщины отслоения серозного пигментного эпителия в обработанном глазу. В некоторых предпочтительных вариантах осуществления жидкий состав содержит приблизительно 2% (мас./мас.) сиролимуса или его фармацевтически приемлемой соли, приблизительно 94% (мас./мас.) полиэтиленгликоля 400 и приблизительно 4% (мас./мас.) этанола, а эффективное количество жидкого состава содержит приблизительно 440 мкг сиролимуса. В некоторых предпочтительных вариантах осуществления и жидкий состав, и анти-VEGF агент вводят по меньшей мере дважды, причем анти-VEGF агент вводят каждые семь-девять недель, а жидкий состав вводят каждые три-пять недель после введения анти-VEGF агента. В некоторых вариантах осуществления и жидкий состав и анти-VEGF агент вводят по меньшей мере три раза.
Краткое описание чертежей
[Фиг. 1] На фиг. 1 представлено среднее изменение остроты зрения у субъектов групп лечения сиролимусом и анти-VEGF при определении путем измерения наибольшей остроты зрения с коррекцией (BCVA).
[Фиг. 2] На фиг. 2 представлено среднее изменение толщины центральной подобласти (CST) у субъектов групп лечения сиролимусом и анти-VEGF при определении с помощью оптической когерентной томографии (OCT).
[Фиг. 3] На фиг. 3 представлено среднее изменение остроты зрения у субъектов групп лечения сиролимусом и анти-VEGF при определении путем измерения наибольшей остроты зрения с коррекцией (BCVA) при завершении исследования примера 1.
[Фиг. 4] На фиг. 4 представлено среднее изменение толщины центральной подобласти (CST) у субъектов групп лечения сиролимусом и анти-VEGF при определении с помощью оптической когерентной томографии (OCT) при завершении исследования примера 1.
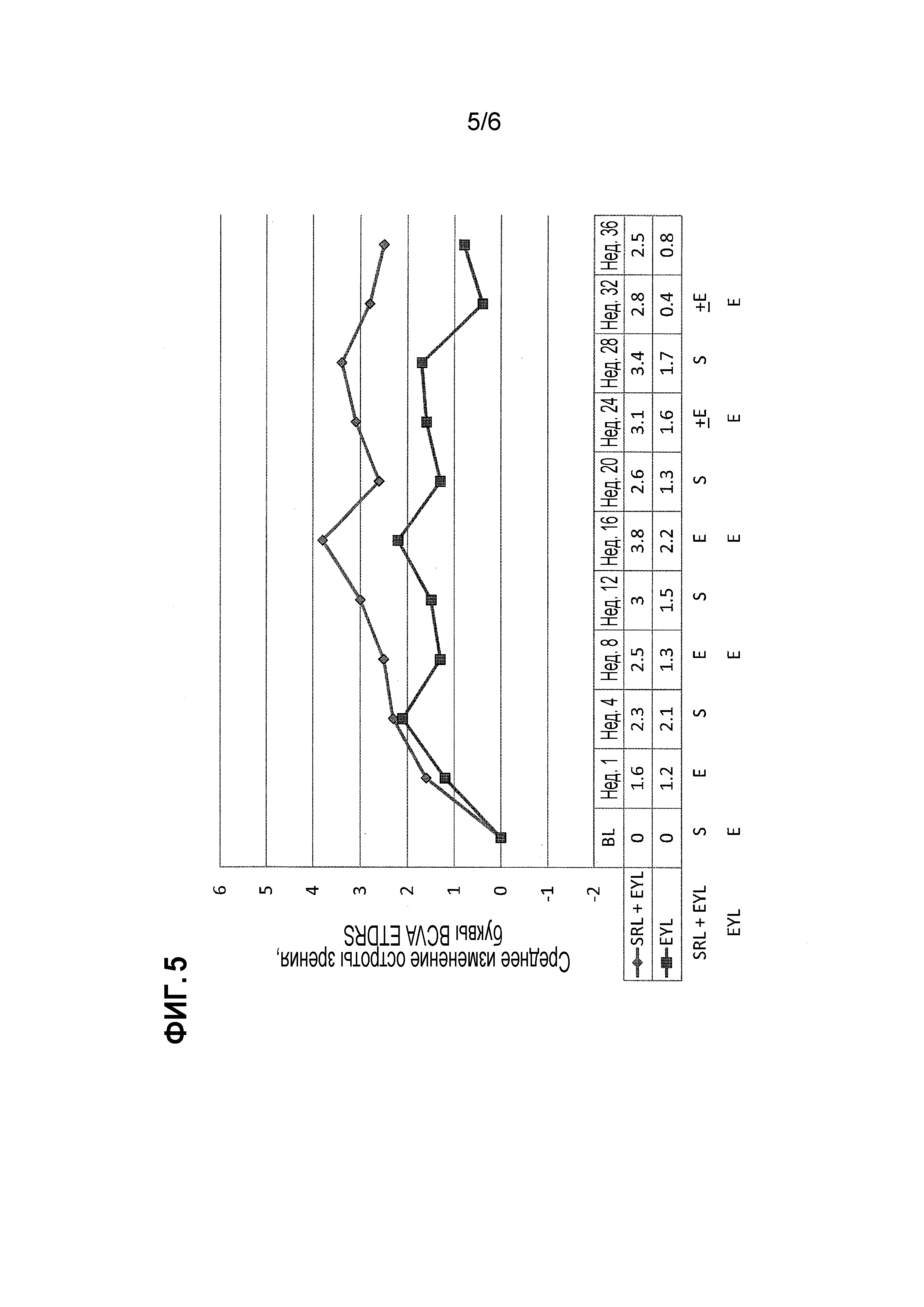
[Фиг. 5] На фиг. 5 представлено среднее изменение остроты зрения у субъектов групп лечения комбинацией (сиролимус+анти-VEGF) и монотерапией (только анти-VEGF) при определении путем измерения наибольшей остроты зрения с коррекцией (BCVA) в виде части исследования примера 2.
[Фиг. 6] На фиг. 6 представлено среднее изменение толщины центральной подобласти (CST) у субъектов групп лечения комбинацией (сиролимус+анти-VEGF) и монотерапией (только анти-VEGF) при определении с помощью оптической когерентной томографии (OCT) в виде части исследования примера 2.
Подробное раскрытие настоящего изобретения
Это изобретение относится к способу лечения персистирующего отека у пациентов с экссудативной возрастной макулярной дегенерацией. В частности, настоящее изобретение относится к лечению влажной возрастной макулярной дегенерации интравитреальным сиролимусом у субъектов с неадекватным ответом на предшествующее лечение интравитреальным агентом ингибитором фактора роста эндотелия сосудов. Как описано в примере 1, происходило измеряемое анатомическое улучшение, когда субъектов с персистирующим отеком, несмотря на предшествующее лечение анти-VEGF, лечили интравитреальным сиролимусом (рапамицином). Кроме того, как описано в примере 2, происходило улучшение остроты зрения, когда субъектов с персистирующим отеком, несмотря на предшествующее лечение анти-VEGF, лечили как интравитреальным сиролимусом (рапамицином), так и интравитреальным анти-VEGF агентом.
Конкретно, в настоящем раскрытии предоставлен способ лечения экссудативной возрастной макулярной дегенерации (AMD или ARMD) у субъекта-человека, включающий:
введение субъекту-человеку эффективного количества жидкого состава посредством интравитреальной инъекции для лечения экссудативной AMD, причем жидкий состав содержит от приблизительно 1% (мас./мас.) до приблизительно 10% сиролимуса или его фармацевтически приемлемой соли; и у субъекта-человека имеется персистирующий интраретинальный или субретинальный отек вследствие экссудативной AMD несмотря на предшествующее лечение интравитреальным ингибитором фактора роста эндотелия сосудов (VEGF). Экссудативная AMD, также известная как неоваскулярная AMD и влажная AMD, включает активную хороидальную неоваскуляризацию. CNV можно идентифицировать, когда при флюоресцентной ангиографии наблюдают пропотевание или повышенную «крапчатость» и когда при оптической когерентной томографии (OCT) выявляют текучую среду (отек). В некоторых вариантах осуществления способы дополнительно включают:
введение субъекту-человеку эффективного количества анти-VEGF агента посредством интравитреальной инъекции для лечения экссудативной AMD, причем анти-VEGF агент вводят от одной до пяти недель после введения жидкого состава.
В некоторых вариантах осуществления эффективное количество жидкого состава содержит дозу от приблизительно 200 мкг до приблизительно 900 мкг сиролимуса. То есть эффективное количество сиролимуса составляет: больше, чем приблизительно (нижний предел) 200, 300, 400, 500, 600, 700 или 800 мкг; и меньше, чем приблизительно (верхний предел) 900, 800, 700, 600, 500, 400, или 300 мкг; при условии, что нижний предел меньше, чем верхний предел.
Жидкий состав настоящего раскрытия содержит от приблизительно 1% (мас./мас.) до приблизительно 10% (мас./мас.) сиролимуса или его фармацевтически приемлемой соли. То есть, жидкий состав содержит: больше, чем приблизительно (нижний предел) 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5 или 9% сиролимуса; и меньше, чем приблизительно (верхний предел) 10, 9,5, 9,0, 8,5, 8,0, 7,5, 7,0, 6,5, 6,0, 5,5, 5,0, 4,5, 4,0, 3,5, 3,0, 2,5 или 2,0% сиролимуса; при условии, что нижний предел меньше, чем верхний предел.
В предпочтительных вариантах осуществления жидким составом является жидкий раствор, где сиролимус растворен в растворителе. Иллюстративным растворителем является полиэтиленгликоль (напр., PEG 400), который может дополнительно содержать этанол. В любом случае жидкий состав стерилен и предпочтительно предоставлен в контейнере для однократного применения (напр., в пузырьке или в шприце).
Способы настоящего раскрытия являются эффективными для достижения уменьшения отека от исходного уровня в обработанном глазу, которое подлежит измерению с помощью OCT. В некоторых вариантах осуществления уменьшение отека составляет от приблизительно -15 микрон до приблизительно -105 микрон. То есть уменьшение отека составляет: больше, чем приблизительно (нижний предел) -15, -30, -45, -60, -75, или -90 микрон; и меньше, чем приблизительно (верхний предел) -105, -90, -75, -60, -45, или -30 микрон; при условии, что нижний предел меньше, чем верхний предел. В некоторых вариантах осуществления уменьшение отека определяют от одной недели до пяти недель после введения эффективного количества жидкого состава, содержащего сиролимус. В некоторых вариантах осуществления более чем одну дозу (напр., n+1) жидкого состава вводят в течение некоторого периода времени. В таких вариантах осуществления уменьшение отека, при наличии такового, определяют от одной недели до пяти недель после введения первой дозы, второй дозы и/или дополнительной дозы. В некоторых предпочтительных вариантах осуществления уменьшение отека определяют от трех до пяти недель после введения по меньшей мере одной дозы жидкого состава.
<Определения>
В рамках настоящего изобретения и приложенной формулы изобретения, если не указано иное, единственные формы включают ссылки на множественные формы. Например, единственное вспомогательное вещество включает одно или более вспомогательных веществ.
Оборот «содержащий» в рамках настоящего изобретения является неограничивающим, указывая, что такие варианты осуществления могут содержать дополнительные элементы. В отличие от этого, оборот «состоящий из» является ограничивающим, указывая, что такие варианты осуществления не содержат дополнительных элементов (исключая следы примесей). Оборот «состоящий по существу из» является частично ограничивающим, указывая, что такие варианты осуществления могут дополнительно содержать элементы, которые существенно не изменяют основные характеристики таких вариантов осуществления. Должно быть понятно, что аспекты и варианты осуществления, описанные в данном документе, такие как «содержащий», включают варианты осуществления «состоящий из» и «состоящий по существу из».
Термин «приблизительно» в рамках настоящего изобретения со ссылкой на значение охватывает от 90% до 110% этого значения (напр., приблизительно 20 мкл жидкого состава относится к значению от 18 мкл до 22 мкл жидкого состава).
Термины «индивид» и «субъект» относятся к млекопитающим, предпочтительно к людям.
Термин «анти-VEGF агент» относится к соединению, способному блокировать биологическую активность VEGF. В некоторых вариантах осуществления анти-VEGF агентом является моноклональное анти-VEGF антитело, такое как бевацизумаб (маркированный как AVASTIN (Торговая марка) от Genentech, Inc., South San Francisco, CA) или ранибизумаб (поставляемый на рынок как LUCENTIS (Торговая марка) от Genentech, Inc., South San Francisco, CA). В некоторых вариантах осуществления анти-VEGF агентом является пегилированный анти-VEGF аптамер, такой как пегаптаниб (MACUGEN (Торговая марка), поставляемый на рынок Eyetech Inc., Palm Beach Gardens, FL). В некоторых вариантах осуществления анти-VEGF агентом является рекомбинантный VEGF рецептор, такой как афлиберцепт (поставляемый на рынок как EYLEA (Торговая марка) от Regeneron Pharmaceuticals, Inc., Tarrytown, NJ).
Термин «интравитреальное лечение VEGF» относится к введению VEGF ингибитора в стекловидное тело глаза субъекта в попытке ослабить признак или симптом глазного заболевания (напр., экссудативной возрастной макулярной дегенерации). Ингибиторы VEGF, которые можно вводить посредством интравитреальной инъекции, включают без ограничения ранибизумаб, бевацизумаб, афлиберцепт, пегаптаниб, бевазираниб, siRNA-027 и ALN-VPS02 (см., напр., Amadio et al., Pharm Res, 103:253,269, 2016).
«Эффективным количеством» агента (напр., сиролимуса), раскрытого в данном документе, является количество, достаточное для достижения конкретно указанной цели. «Эффективное количество» можно определить эмпирически в отношении указанной цели. «Эффективным количеством» или «достаточным количеством» агента является такое количество, которое является адекватным, чтобы вызвать требуемый биологический эффект, такой как положительный результат, включая положительный клинический результат. Термин «эффективное количество» со ссылкой на способ лечения относится к количеству агента, эффективному для «лечения» заболевания или расстройства у субъекта (напр., млекопитающего, такого как человек). «Эффективное количество» или «достаточное количество» агента можно вводить в виде одной или более доз.
Термины «обработка» или «лечение» заболевания относятся к выполнению протокола, который может включать введение индивиду (человеку или другому млекопитающему) одного или более лекарственных средств, стремясь ослабить признак или симптом заболевания. Таким образом, «обработка» или «лечение» не требует полного ослабления признаков или симптомов, не требует исцеления, а конкретно включает протоколы, которые оказывают только паллиативное влияние на индивида. В рамках настоящего изобретения, и как хорошо понятно в данной области, «лечением» является подход получения положительных или требуемых результатов, включая клинические результаты. Положительные или требуемые клинические результаты включают, без ограничения, ослабление или облегчение одного или более симптомов, уменьшение степени заболевания, стабилизированное (т.е., без ухудшения) состояние заболевания, предотвращение распространения заболевания, отсрочка или замедление прогрессирования заболевания, облегчение или смягчение состояния заболевания и ремиссия (частичная ли или полная), выявляемая ли или невыявляемая. «Облегчение» заболевания или расстройства означает, что уменьшаются степень и/или нежелательные клинические проявления заболевания или расстройства и/или замедляется временная динамика прогрессирования заболевания или расстройства по сравнению с ожидаемым результатом без лечения. Кроме того, ослабление и лечение не обязательно происходит за счет введения одной дозы, но часто происходит при введении ряда доз.
В рамках настоящего изобретения оборот «острота зрения обработанного глаза остается стабильной» относится к остроте зрения, которая остается ±2 буквы BCVA ETDRS от исходного значения (перед лечением) приблизительно на один месяц (± неделя) после введения жидкого состава. В рамках настоящего изобретения оборот «острота зрения обработанного глаза улучшается» относится к остроте зрения, которая увеличивается больше, чем на 2 буквы BCVA ETDRS от исходного значения (перед лечением) приблизительно на один месяц (± неделя) после введения жидкого состава.
<ПРИМЕРЫ>
Сокращения: AMD (возрастная макулярная дегенерация); BCVA (наибольшая острота зрения с коррекцией); BL (исходный уровень); CNV (хороидальная неоваскуляризация); CST (утолщение центральной подобласти); ETDRS (исследование раннего лечения диабетической ретинопатии); EYL (EYLEA (Торговая марка), афлиберцепт для интравитреальной инъекции, поставляемый на рынок Regeneron Pharmaceuticals, Inc., Tarrytown, NY); IOP (внутриглазное давление); IVT (интравитреальный); OCT (оптическая когерентная томография); SRL (сиролимус); Tx (лечение) и VEGF (фактор роста эндотелия сосудов).
Хотя вышеизложенное раскрытие было описано в некоторой степени путем пояснения и примера с целью ясности и понимания, специалистам в данной области будет понятно, что можно осуществить некоторые изменения и модификации. Вследствие этого описание и примеры не следует истолковывать как ограничение объема раскрытия.
<ПРИМЕР 1>
Сиролимус по сравнению с анти-VEGF для лечения экссудативной AMD
Это исследование провели для определения безопасности и эффективности интравитреальной инъекции сиролимуса (рапамицина) у субъектов с экссудативной AMD с постоянным интраретинальным или субретинальным отеком несмотря на предшествующее лечение интравитреальным анти-VEGF. Это исследование представляло собой одноцентровое, рандомизированное, простое слепое исследование в течение шести месяцев с восемью запланированными посещениями.
Выборка исследования. Тридцать человек пациентов в возрасте 50 лет или старше на момент включения в исследование набрали согласно следующим критериям включения и исключения. Если оба глаза соответствовали всем критериям включения/исключения, глаз с худшей BCVA на момент включения в исследование выбирали в качестве глаза исследования. Если оба глаза соответствовали всем критериям включения/исключения, и значения BCVA идентифицировали для обоих глаз, в качестве глаза исследования выбирали правый глаз.
Глазные критерии включения:
(i) BCVA 5-65 (20/800-20/50), включительно, в глазу исследования;
(ii) наличие хороидальной неоваскуляризации, обусловленной AMD;
(iii) персистирующий отек несмотря на по меньшей мере три предшествующих интравитреальных анти-VEGF инъекции за последние пять месяцев;
(iv) отсроченная инъекция анти-VEGF в течение по меньшей мере четырех недель, не противопоказанная; и
(v) прозрачные глазные среды и адекватное расширение зрачка, чтобы обеспечить фотографическое изображение хорошего качества.
Глазные критерии исключения:
(i) уменьшение по толщине центральной подобласти больше, чем 100 микрон при измерении с помощью OCT после интравитреальной анти-VEGF инъекции в глаз исследования;
(ii) афакия;
(iii) в анамнезе первичная витрэктомия в глазу исследования;
(iv) в анамнезе серьезная глазная хирургическая операция в глазу исследования за последние три месяца и любая глазная хирургическая операция в глазу исследования в течение последних 30 дней;
(v) в анамнезе значимое глазное заболевание или состояние, не являющееся экссудативной AMD, которое может исказить результаты;
(vi) неконтролируемая глаукома (внутриглазное давление >21 мм рт. ст. несмотря на лечение средствами, снижающими внутриглазное давление, на момент включения в исследование);
(vii) отсутствие активных глазных или окологлазных инфекций или опухоли; и
(viii) наличие значительной эпиретинальной мембраны.
Лечение. Системные анти-VEGF препараты были запрещены. Терапия неисследуемого глаза была разрешена в любое время.
Лечение Исследования (1 группа). Интравитреальную инъекцию, составляющую 440 мкг сиролимуса (Santen Inc., Emeryville, CA), делали на момент включения в исследование, 2 месяц и 4 месяц. Кратко, вводили 20 мкл жидкого раствора, содержащего 2% (мас./мас.) сиролимуса, 94% (мас./мас.) полиэтиленгликоля 400 и 4% (мас./мас.) этанола. Имитацию интравитреальной инъекции делали в 1 месяц, 3 месяц и 5 месяц.
Сравнительное Лечение (Группа 2). Интравитреальную инъекцию анти-VEGF на пациента/по выбору исследователя (пегаптаниб, афлиберцепт, бевацизумаб или ранибизумаб) делали на момент включения в исследование и после этого раз в месяц по клиническим критериям. Имитацию интравитреальных инъекций делали при несоответствии критерия повторного лечения в 1 месяц или при любом более позднем посещении.
Введение. Перед инъекцией разрешали глазные капли с антибиотиком. Рекомендовали нижневисочный участок интравитреальной инъекции, на усмотрение врача. Инъекционную иглу необходимо было вставлять на 3,5-4,0 мм позади лимба, направляя к центру глазного яблока, избегая горизонтального меридиана, чтобы избежать инъекции в зрительную ось. Для каждой последующей инъекции нужно было использовать другой участок склеры. При выполнении имитации инъекции кончик шприца (без иглы или лекарственного препарата) необходимо было осторожно прижать к конъюнктиве. После инъекции соответствующим образом контролировали и регулировали как внутриглазное давление, так и перфузию головки зрительного нерва. После инъекции разрешали глазные капли с антибиотиком.
В таблице 1-1 изложен график офтальмологических процедур. Субъектам давали окно ±1 неделя для ежемесячного посещения. Если не указано иное, процедуры проводили как на обработанном, так и на необработанном глазах.
[Таблица 1]
Таблица 1-1. График офтальмологических процедур
a 1 группа получала инъекцию сиролимуса в начале исследования, во 2 месяц и в 4 месяц
1 группа получала имитацию инъекции в 1 месяц, в 3 месяц и в 5 месяц
b Группа 2 получала анти-VEGF в начале исследования и раз в месяц при соответствии клиническим критериям повторного лечения
Группа 2 получала имитацию инъекции в любое ежемесячное посещение при несоответствии критериям повторного лечения
Критерии повторного лечения. Субъекты в обеих группах лечения получали повторное лечение раз в месяц при условии наличия продолжающегося субретинального отека, интраретинального отека или активной CNV.
Посещение в начале исследования. Выполняли следующие процедуры:
стандартное BCVA, используя способ ETDRS после рефракции глаза;
полное офтальмологическое обследование, включая биомикроскопию при помощи щелевой лампы, обратную офтальмоскопию и IOP;
гейдельбергскую OCT визуализацию;
цветную съемку глазного дна при расширенном зрачке;
Гейдельбергскую флюоресцентную визуализацию;
Гейдельбергскую флюоресцентную ангиографию; и
выполнение назначенной интравитреальной инъекции.
Посещение на 1 неделе включало вопросы о побочных эффектах, изменениях в терапии и медицинских процедурах. Выполняли следующие процедуры:
стандартное BCVA, используя способ ETDRS после рефракции глаза;
полное офтальмологическое обследование, включая биомикроскопию при помощи щелевой лампы, обратную офтальмоскопию и IOP;
гейдельбергскую OCT визуализацию;
Посещения 1, 2, 3, 4 и 5 месяцев включали вопросы о побочных эффектах, изменениях в терапии и медицинских процедурах. Выполняли следующие процедуры:
стандартное BCVA, используя способ ETDRS после рефракции глаза;
полное офтальмологическое обследование, включая биомикроскопию при помощи щелевой лампы, обратную офтальмоскопию и IOP;
гейдельбергскую OCT визуализацию; и
выполнение назначенной интравитреальной инъекции по протоколу (или имитации).
Посещение 6 месяца (выход) включало вопросы о побочных эффектах, изменениях в терапии и медицинских процедурах. Выполняли следующие процедуры:
стандартное BCVA, используя способ ETDRS после рефракции глаза;
полное офтальмологическое обследование, включая биомикроскопию при помощи щелевой лампы, обратную офтальмоскопию и IOP;
гейдельбергскую OCT визуализацию;
цветную съемку глазного дна при расширенном зрачке;
Гейдельбергскую флюоресцентную визуализацию; и
Гейдельбергскую флюоресцентную ангиографию.
Основной показатель эффективности включает изменение отека от исходного уровня до 6 месяца при измерении с помощью CST на Гейдельбергской OCT.
Дополнительные показатели эффективности включают:
изменение BCVA от исходного уровня до 6 месяца;
изменение интраретинального и субретинального отека от исходного уровня до 6 месяца;
изменение компонентов поражения CNV, включая субретинальное ретинальное сверхотражающее вещество (SRHM) и толщину отслоения серозного пигментного эпителия (PED);
количество субъектов, которым потребовалась неотложная помощь при стандарте лечения и ухода в 1 группе; и
количество инъекций, необходимых для регулирования кровоизлияния CNV на основании объема субретинальной текучей среды.
Анализ данных. Анализ данных исследования выполняют, когда все субъекты либо завершили посещение на 6 месяц, либо досрочно выбыли из исследования. Проводят как одномерный, так и многомерный анализ.
Непрерывные величины необходимо суммировать со средними и стандартными отклонениями, а медианы с минимальными и максимальными значениями и категориальными переменными с частотами и процентными значениями. Для оценки основных и дополнительных показателей необходимо выполнять стандартные параметры и статистические тесты. Конкретно, необходимо измерять среднее изменение CST, определение вручную наличия субретинальной текучей среды и интраретинальной текучей среды в каждой группе на шестой месяц (и в другие моменты времени), изменение BCVA между исходным уровнем и шестым месяцем и количество анти-VEGF инъекций, необходимых в каждой группе.
Результаты. Как показано на фиг. 2 и фиг. 4, исследование было успешным по достижению основного показателя уменьшения отека от исходного уровня до 6 месяца у субъектов 1 группы, которых лечили интравитреальным сиролимусом после предшествующего лечения интравитреальным анти-VEGF. В частности, у субъектов в 1 группе, завершивших исследование через 6 месяцев, было среднее уменьшение отека от исходного уровня до 3-6 месяцев (2 обработки сиролимусом) приблизительно от -30 до -40. В отличие от них, у субъектов во 2 группе, завершивших исследование через 6 месяцев, было среднее увеличение отека от исходного уровня до 3-6 месяцев (до 4, 5 или 6 обработок анти-VEGF) от приблизительно 0 до приблизительно +20. Кроме того, как показано на фиг. 1 и ФИГ. 3, среднее изменение остроты зрения у субъектов 1 группы было сравнимо с изменением 2 группы от исходного уровня до 3-6 месяцев. Таким образом, субъекты с экссудативной AMD с постоянным интраретинальным или субретинальным отеком вследствие неоваскулярной AMD, несмотря на предшествующее интравитреальное лечение анти-VEGF, получают явную пользу от лечения интравитреальным сиролимусом.
<ПРИМЕР 2>
Сиролимус плюс анти-VEGF по сравнению с одним анти-VEGF для лЛечения экссудативной AMD
Это исследование провели для определения безопасности и эффективности интравитреальной инъекции сиролимуса (рапамицина) с дополнением анти-VEGF у субъектов с персистирующим отеком вследствие неоваскулярной AMD по сравнению с лечением только анти-VEGF. Это исследование представляло собой одноцентровое, рандомизированное, простое слепое исследование в течение шести месяцев с одиннадцатью запланированными посещениями.
Выборка исследования. Двадцать пациентов-людей в возрасте 50 лет или старше на момент включения в исследование набрали согласно следующим критериям включения и исключения. Если оба глаза соответствовали всем критериям включения/исключения, в качестве глаза исследования выбирали глаз с наилучшим потенциалом для улучшения зрения (худшей BCVA) на момент включения в исследование. Если оба глаза соответствовали всем критериям включения/исключения и значения BCVA идентифицировали для обоих глаз, в качестве глаза исследования выбирали правый глаз.
Глазные критерии включения:
(i) BCVA 5-75 (20/800-20/30), включительно, в глазу исследования;
(ii) наличие хороидальной неоваскуляризации, обусловленной AMD;
(iii) по меньшей мере три предшествующих интравитреальных анти-VEGF инъекции за последние пять месяцев;
(iv) отсроченная инъекция анти-VEGF в течение по меньшей мере четырех недель, не противопоказанная; и
(v) прозрачные глазные среды и адекватное расширение зрачка, чтобы обеспечить фотографическое изображение хорошего качества.
Глазные критерии исключения:
(i) уменьшение по толщине центральной подобласти больше, чем 100 микрон при измерении с помощью OCT с момента последнего стандартного медицинского посещения;
(ii) афакия;
(iii) в анамнезе первичная витрэктомия в глазу исследования;
(iv) в анамнезе серьезная глазная хирургическая операция в глазу исследования за последние три месяца и любая глазная хирургическая операция в глазу исследования в течение последних 30 дней;
(v) в анамнезе значимое глазное заболевание или состояние, не являющееся экссудативной AMD, которое может исказить результаты;
(vi) неконтролируемая глаукома (внутриглазное давление >21 мм рт. ст. несмотря на лечение средствами, снижающими внутриглазное давление на момент включения в исследование);
(vii) отсутствие активных глазных или окологлазных инфекций или опухоли; и
(viii) наличие значительной эпиретинальной мембраны.
Лечение. Системные анти-VEGF препараты были запрещены. Терапия неисследуемого глаза была разрешена в любое время.
Лечение Исследования (1 группа). Интравитреальную инъекцию SRL (сиролимуса) делали на момент включения в исследование и на 4, 12, 30, 28 неделях. Интравитреальные инъекции EYL (афлиберцепта) делали на 1, 8, 16, 24 и 32 неделях. На 24 и 32 неделях инъекции EYL откладывали, если показатель остроты зрения не уменьшался более чем на пять букв, а OCT CST с последнего посещения не увеличивалась более чем на 50 микрон.
Сравнительное Лечение (Группа 2). Интравитреальную инъекцию EYL (афлиберцепта) делали на момент включения в исследование и на 8, 16, 24 и 32 неделях. Имитации интравитреальной инъекции делали на 1, 4, 12, 20 и 28 неделях, чтобы продолжать скрывать от пациента распределение в группу лечения.
Инъекция SRL: 20 мкл жидкого раствора, содержащего 2% (мас./мас.) сиролимуса, 94% (мас./мас.) полиэтиленгликоля 400 и 4% (мас./мас.) этанола. Каждая доза содержала 440 мкг сиролимуса. Раствор сиролимуса получали от Santen Inc. (Emeryville, CA).
Инъекция EYL: 50 мкл жидкого раствора, содержащего афлиберцепт (40 мг/мл), 10 мм фосфата натрия, 40 мм хлорида натрия, 0,03% полисорбата 20 и 5% сахарозы. Каждая доза содержала 2 мг афлиберцепта. Раствор афлиберцепта получали от Regeneron Pharmaceuticals, Inc. (Tarrytown, NY).
Введение. Перед инъекцией разрешали глазные капли с антибиотиком. Рекомендовали нижневисочный участок интравитреальной инъекции, на усмотрение врача. Инъекционную иглу вводили на 3,5-4,0 мм позади лимба, направляя к центру глазного яблока, избегая горизонтального меридиана, чтобы избежать инъекции в зрительную ось. Для каждой последующей инъекции использовали другой участок склеры. При выполнении имитации инъекции кончик шприца (без иглы или лекарственного препарата) осторожно прижимали к конъюнктиве. После инъекции соответствующим образом контролировали и регулировали как внутриглазное давление, так и перфузию головки зрительного нерва. После инъекции разрешали глазные капли с антибиотиком.
В Таблице 2-1 изложен график офтальмологических процедур. Субъектам давали окно ±1 неделя для каждого посещения. Сокращения: * (только глаз исследования); и sh (имитация инъекции).
[Таблица 2]
Таблица 2-1
Критерии Повторного лечения: Субъекты в обеих группах получали повторное лечение (или имитации) в каждое запланированное посещение при условии наличия продолжающегося субретинального отека, интраретинального отека или активной хороидальной неоваскуляризации.
Критерии неотложной помощи:
(i) субъекты в группе исследования с уменьшением на 10 букв за два последовательных посещения или с уменьшением на 15 букв в любое посещение с уходом от стандарта лечения;
(ii) увеличение центральной толщины сетчатки на 50 микрон или более, связанное с уменьшением на 5 букв с уходом от стандарта лечения; и
(iii) наличие нового кровоизлияния, ухудшения кровоизлияния, новой дополнительной фовеальной текучей среды или уход от стандарта лечения по усмотрению исследователя.
Посещение в начале исследования. Выполняли следующие процедуры:
стандартное BCVA, используя способ ETDRS после рефракции глаза;
полное офтальмологическое обследование, включая биомикроскопию при помощи щелевой лампы, обратную офтальмоскопию и IOP;
гейдельбергскую OCT визуализацию;
цветную съемку глазного дна при расширенном зрачке;
Гейдельбергскую флюоресцентную ангиографию; и
выполнение назначенной интравитреальной инъекции.
Посещение 1 недели включало вопросы о побочных эффектах, изменениях в терапии и медицинских процедурах. выполняли следующие процедуры:
стандартное BCVA, используя способ ETDRS после рефракции глаза;
полное офтальмологическое обследование, включая биомикроскопию при помощи щелевой лампы, обратную офтальмоскопию и IOP;
гейдельбергскую OCT визуализацию; и
выполнение назначенной интравитреальной инъекции или имитации.
Посещения 4, 8, 12, 16, 20, 24, 28 и 32 недели включали вопросы о побочных эффектах, изменениях в терапии и медицинских процедурах. Выполняли следующие процедуры:
стандартное BCVA, используя способ ETDRS после рефракции глаза;
полное офтальмологическое обследование, включая биомикроскопию при помощи щелевой лампы, обратную офтальмоскопию и IOP;
гейдельбергскую OCT визуализацию; и
выполнение назначенной интравитреальной инъекции по протоколу (или имитации).
Посещение 36 недели (выход) включало вопросы о побочных эффектах, изменениях в терапии и медицинских процедурах. выполняли следующие процедуры:
стандартное BCVA, используя способ ETDRS после рефракции глаза;
полное офтальмологическое обследование, включая биомикроскопию при помощи щелевой лампы, обратную офтальмоскопию и IOP;
гейдельбергскую OCT визуализацию;
цветную съемку глазного дна при расширенном зрачке; и
Гейдельбергскую флюоресцентную ангиографию.
Основной показатель эффективности включал:
изменение отека от исходного уровня к 36 неделе при измерении с помощью CST на Гейдельбергской OCT.
дополнительные показатели эффективности включали:
изменение BCVA от исходного уровня к 36 неделе; и
изменение интраретинального и субретинального отека от исходного уровня к 36 неделе;
изменение компонентов поражения CNV: субретинального ретинального сверхотражающего вещества, толщины отслоения пигментного эпителия; и
количество инъекций, необходимых для регулирования хороидальной неоваскуляризации на основании объема субретинальной текучей среды.
Анализ данных. Анализ данных исследования выполняют, когда все субъекты либо завершили посещение на 6 неделе, либо досрочно выбыли из исследования. Проводят как одномерный, так и многомерный анализ.
[Таблица 3]
Таблица 2-2. Демографические данные пациентов исследования
Результаты. Два из десяти пациентов в комбинированной группе получали имитации инъекций на 24 неделе, и четырех из десяти пациентов в комбинированной группе получали имитации инъекций на 32 неделе. Таким образом, введение SRL уменьшало потребность в лечении анти-VEGF для регулирования отека, связанного с экссудативной AMD у 40% субъектов в комбинированной группе. Кроме того, как показано на фиг. 5, острота зрения улучшалась в комбинированной группе (+2,5 буквы) в большей степени, чем в группе монотерапии (+0,8 букв). Более того, как показано на фиг. 6, значительно большее уменьшение отека наблюдалось в комбинированной группе на 4 и 12 неделях по сравнению с группой монотерапии. Однако уменьшение отека, наблюдаемое в комбинированной группе в более поздние моменты времени, существенно не отличалось от уменьшения, наблюдаемого в группе монотерапии. У одного из десяти пациентов в группе монотерапии было очень высокое исходное значение OCT CST (646 микрон), которое доходило до наилучшего потенциала для улучшения среди 20 субъектов исследования. Считается, что этот выброс в группе монотерапии и решение отложить инъекции EYL на 24 и 32 неделях в комбинированной группе способствует отсутствию преимущества комбинированной группы на протяжении всего исследования и особенно на поздних неделях.
Реферат
Изобретение относится к области медицины и фармацевтики, а именно к способу лечения персистирующего интраретинального или субретинального отека вследствие экссудативной AMD несмотря на предшествующее лечение интравитреальным анти-VEGF у субъекта-человека, при этом способ включает введение субъекту-человеку эффективного количества жидкого состава посредством интравитреальной инъекции для лечения персистирующего интраретинального или субретинального отека, где жидкий состав содержит от 1 до 10 мас./мас.% сиролимуса или его фармацевтически приемлемой соли. Изобретение обеспечивает способ лечения персистирующего отека у пациентов с экссудативной AMD. 13 з.п. ф-лы, 6 ил., 3 табл., 2 пр.

Комментарии