Фармацевтическая композиция, включающая полипептид - RU2726625C2
Код документа: RU2726625C2
Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к композиции, включающей лекарственное средство, полипептид, представленный Ac-(Arg-Ala-Asp-Ala)4-NH2, и особый органический растворитель, агент, придающий способность к пролонгированному высвобождению полипептида, содержащего лекарственное средство, и к способу придания способности к пролонгированному высвобождению лекарственного средства. По настоящей заявке испрашивается приоритет предшествующей заявки на патент Японии No. 2015-053757, поданной 17 марта 2015 г., полное содержание которой включено в настоящее описание в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ
С точки зрения нагрузок на пациентов в результате введения лекарственных средств, инвазивных вмешательств, таких как, например, введение в стекловидное тело, желательно наличие лекарственного средства, которое после введения лекарственного средства в организм постоянно высвобождается из места введения лекарственного средства и тем самым определяет эффективность действия лекарственного средства в течение долгого времени. Сообщалось о составах гидрогеля, в которых используют полипептиды со свойствами самосборки, как средств для достижения этого эффекта.
В патентной литературе 1 и непатентной литературе 1 раскрыты состав с пролонгированным высвобождением инсулина как водорастворимого лекарственного средства, состав, в котором используют полипептид, представленный Ac-(Arg-Ala-Asp-Ala)4-CONH2 (SEQ ID NO: 1), как полипептид со свойствами самосборки. Кроме того, в непатентной литературе 2 раскрыт состав с пролонгированным высвобождением, в котором используют полипептид, представленный Ac-(Arg-Ala-Asp-Ala)4-CONH2, и содержащий пиндолол, хинин и тимолол малеат в качестве лекарственных средств. В этой представленной выше литературе полипептид, представленный Ac-(Arg-Ala-Asp-Ala)4-CONH2, представляет собой PuraMatrix (зарегистрированный товарный знак), и PuraMatrix (зарегистрированный товарный знак) также представлен Ac-(Arg-Ala-Asp-Ala)4-NH2. По этой причине PuraMatrix (зарегистрированный товарный знак) в настоящем описании обозначается как Ac-(Arg-Ala-Asp-Ala)4-NH2 (SEQ ID NO: 1).
Однако в составах с пролонгированным высвобождением, описанных в этой литературе, в качестве растворителя используется только вода. Ни в одном из этих литературных источников не раскрыт органический растворитель, выбранный из группы, состоящей из полиэтиленгликоля, диметилсульфоксида, гликофурола и N-метилпирролидона, используемый в качестве растворителя фармацевтической композиции, включающей лекарственное средство и полипептид, представленный Ac-(Arg-Ala-Asp-Ala)4-NH2, или не отмечено, что эта фармацевтическая композиция пригодна в качестве состава с пролонгированным высвобождением лекарственного средства.
Перечень цитируемой литературы
Патентная литература
Патентная литература 1: описание публикации патентной заявки США No. 2012/0289462
Непатентная литература
Непатентная литература 1: Euro. J. Pharm. Sci., 45, 2012, 1-7
Непатентная литература 2: Int. J. Pharm., 474, 2014, 103-111
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является раскрытие фармацевтической композиции с пролонгированным высвобождением лекарственного средства в течение долгого времени после введения в организм.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
Авторы настоящего изобретения серьезно исследовали желатинизаторы для формирования гидрогеля, растворители для растворения лекарственного средства и тому подобное для достижения указанной выше цели и в результате нашли, что фармацевтическая композиция, в которой лекарственное средство и полипептид, представленный Ac-(Arg-Ala-Asp-Ala)4-NH2, смешиваются по меньшей мере с одним органическим растворителем, выбранным из группы, состоящей из полиэтиленгликоля, диметилсульфоксида, гликофурола и N-метилпирролидона, постоянно высвобождает лекарственное средство, тем самым завершая настоящее изобретение.
Более конкретно в настоящем изобретении относится к следующему.
[1] Фармацевтическая композиция, включающая лекарственное средство, полипептид, представленный Ac-(Arg-Ala-Asp-Ala)4-NH2, и органический растворитель, где органический растворитель представляет собой по меньшей мере один органический растворитель, выбранный из группы, состоящей из полиэтиленгликоля, диметилсульфоксида, гликофурола и N-метилпирролидона.
[2] Фармацевтическая композиция по п.[1] выше, дополнительно включающая воду.
[3] Фармацевтическая композиция по п.[2] выше, в которой объемное отношение органического растворителя к воде составляет от 99:1 до 60:40.
[4] Фармацевтическая композиция по любому из пп. [1] - [3] выше, в которой органический растворитель представляет собой полиэтиленгликоль, и полиэтиленгликоль имеет среднюю молекулярную массу в диапазоне от 90 до 2200.
[5] Фармацевтическая композиция по любому из пп. [1] - [3] выше, в которой органический растворитель представляет собой полиэтиленгликоль, и полиэтиленгликоль представляет собой ПЭГ 400.
[6] Фармацевтическая композиция по любому из пп. [1] - [5] выше, в которой содержание лекарственного средства составляет от 0,01 до 30% (масс./об.).
[7] Фармацевтическая композиция по любому из пп. [1] - [6] выше, в которой содержание полипептида, представленного Ac-(Arg-Ala-Asp-Ala)4-NH2, составляет от 0,001 до 5% (масс./об.).
[8] Фармацевтическая композиция по любому из пп. [1] - [7] выше, в которой содержание органического растворителя составляет от 70 до 99,99% (масс./масс.).
[9] Фармацевтическая композиция по любому из пп. [1] - [8] выше, где фармацевтическая композиция состоит по существу только из лекарственного средства, полипептида, представленного Ac-(Arg-Ala-Asp-Ala)4-NH2, полиэтиленгликоля и воды.
[10] Фармацевтическая композиция по п.[1] выше, где фармацевтическая композиция состоит по существу только из лекарственного средства, полипептида, представленного Ac-(Arg-Ala-Asp-Ala)4-NH2, и диметилсульфоксида.
[11] Фармацевтическая композиция по любому из пп. [1] [10] выше, в которой лекарственное средство представляет собой соединение или его соль, причем соединение представлено формулой (1):
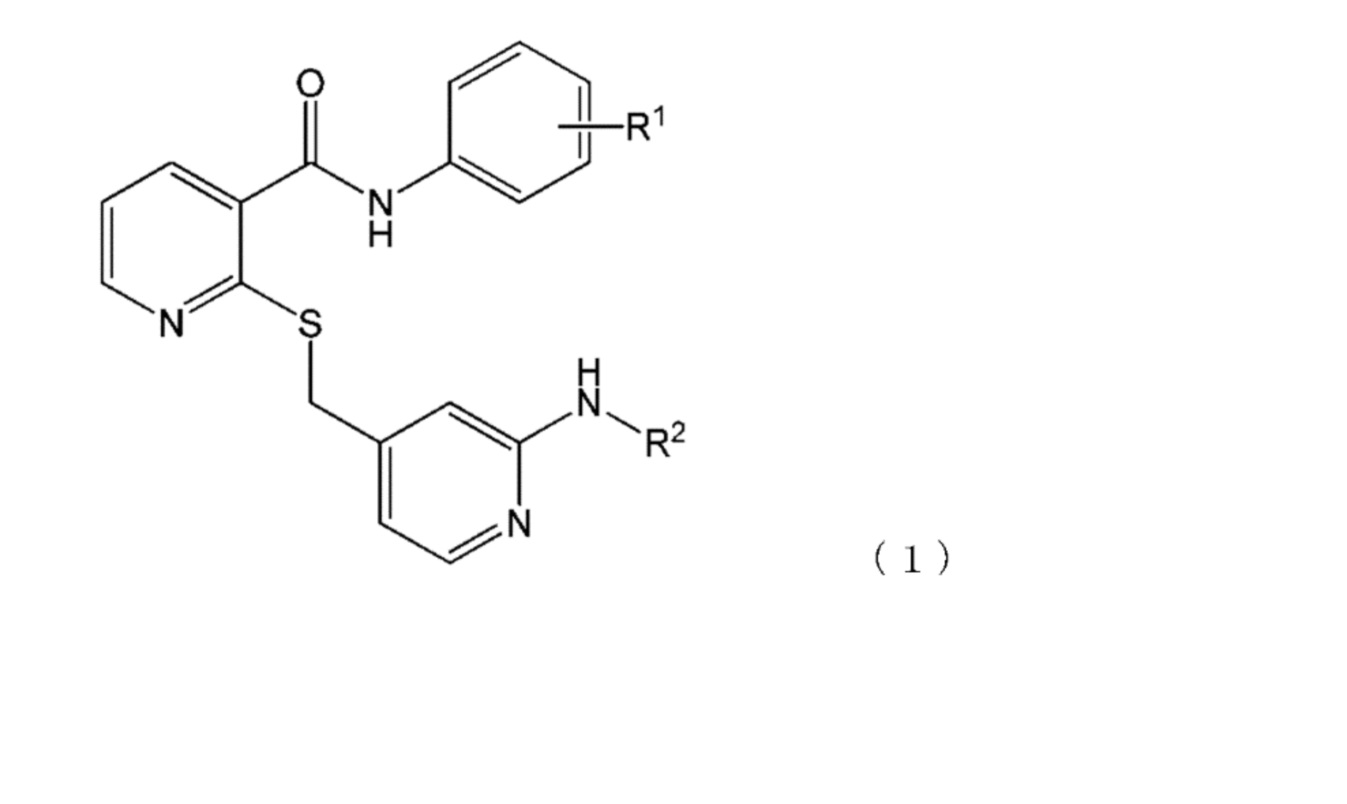
где
R1 представляет собой атом водорода, атом галогена, гидроксильную группу, C1-6-алкильную группу, C1-6-алкильную группу, замещенную одним или более атомами галогена, C1-6-алкоксигруппу, или C1-6-алкоксигруппу, замещенную одним или более атомами галогена; и
R2 представляет собой атом водорода, C1-6-алкильную группу, C1-6-алкилкарбонильную группу или C1-6-алкилкарбонильную группу, замещенную одной или более гидроксильными группами.
[12] Фармацевтическая композиция по любому из пп. [1] по [10] выше, в которой лекарственное средство представляет собой 2-[[[2-[(гидроксиацетил)амино]-4-пиридинил]метил]тио]-N-[4-(трифторметокси)фенил]-3-пириднкарбоксамид или его соль.
[13] Фармацевтическая композиция по любому из пп. [1] - [12] выше, где фармацевтическая композиция предназначена для профилактики или лечения глазного заболевания.
[14] Фармацевтическая композиция по п.[13] выше, где фармацевтическая композиция предназначена для введения в стекловидное тело или в камеру глаза.
[15] Фармацевтическая композиция по п.[13] или [14] выше, где фармацевтическая композиция предназначена для пролонгированного высвобождения лекарственного средства.
[16] Агент, придающий способность к пролонгированному высвобождению лекарственного средства, содержащий полипептид, представленный Ac-(Arg-Ala-Asp-Ala)4-NH2; и органический растворитель, где органический растворитель представляет собой по меньшей мере один органический растворитель, выбранный из группы, состоящей из полиэтиленгликоля, диметилсульфоксида, гликофурола и N-метилпирролидона.
[17] Способ придания способности к пролонгированному высвобождению лекарственного средства, включающий добавление полипептида, представленного Ac-(Arg-Ala-Asp-Ala)4-NH2; и органического растворителя к лекарственному средству, где органический растворитель представляет собой по меньшей мере один органический растворитель, выбранный из группы, состоящей из полиэтиленгликоля, диметилсульфоксида, гликофурола и N-метилпирролидона.
Следует отметить, что любые две или более структур [1] - [17] могут быть выбраны и скомбинированы, если это необходимо.
ПОЛЕЗНЫЕ РЕЗУЛЬТАТЫ ИЗОБРЕТЕНИЯ
Фармацевтическая композиция по настоящему изобретению представляет собой композицию, которая растворяет лекарственное средство и которая образует депо и постоянно высвобождает лекарственное средство после введения в организм. Более того, фармацевтическая композиция по настоящему изобретению является безопасной как фармацевтический продукт.
Агент, придающий способность к пролонгированному высвобождению лекарственного средства по настоящему изобретению, подходит для придания благоприятной способности к пролонгированному высвобождению лекарственного средства.
Способ придания способности к пролонгированному высвобождению лекарственного средства по настоящему изобретению способен придавать благоприятную способность к пролонгированному высвобождению лекарственного средства.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Далее изобретение будет описан подробно.
«Полипептид»
Полипептид в настоящем изобретении представляет собой полипептид, представленный Ac-(Arg-Ala-Asp-Ala)4-NH2(SEQ ID NO: 1) (обозначаемый в настоящем описании далее также как полипептид А), и продается как PuraMatrix (зарегистрированный товарный знак) 3-D Matrix, Ltd. С-концевая карбоксильная группа (COOH) амидирована (CONH2).
Содержание полипептида А особенно не ограничивается, но предпочтительно составляет от 0,001 до 5% (масс./об.), более предпочтительно от 0,005 до 3% (масс./об.), особенно предпочтительно от 0,05 до 1% (масс./об.) и наиболее предпочтительно от 0,1 до 0,5% (масс./об.). Следует отметить, что «% масс./об.» обозначает массу (г) соответствующего ингредиента (в настоящем описании полипептида А), содержащуюся в 100 мл фармацевтической композиции по настоящему изобретению. Если не указано иначе, то же самое применяется ниже.
«Лекарственное средство»
Лекарственное средство по настоящему изобретению особенно не ограничивается, но предпочтительно представляет собой гидрофобное лекарственное средство. Гидрофобное лекарственное средство представляет собой лекарственное средство, которое имеет тенденцию не растворяться в воде, и степень гидрофобности выражается таким показателем как коэффициент распределения CLogP. CLogP представляет собой расчетную величину логарифма коэффициента распределения 1-октанол/вода, и подробное объяснение этого представлено в публикации патентной заявки Японии No. 2009-298878 и тому подобном. Как лекарственное средство по настоящему изобретению гидрофобное лекарственное средство, описываемое как имеющее коэффициент распределения ClogP 0,5 или более является предпочтительным, лекарственное средство, имеющее коэффициент распределения ClogP от 1 до 20 включительно, является более предпочтительным, лекарственное средство, имеющее коэффициент распределения ClogP от 1,5 до 15 включительно, является даже более предпочтительным, лекарственное средство, имеющее коэффициент распределения ClogP от 2 до 12 включительно, является даже еще более предпочтительным, лекарственное средство, имеющее коэффициент распределения ClogP от 2,2 до 9 включительно, является особенно более предпочтительным и лекарственное средство, имеющее коэффициент распределения ClogP от 2,5 до 8 включительно, является наиболее предпочтительным. Конкретные примеры лекарственного средства по настоящему изобретению включают: ингибиторы тирозинкиназы, такие как тафетиниб, SIM-817378, ACTB-1003, хиаураниб, CT-53608, циннамон, chim4G8-SDIE, CEP-5214, IMC-1C11, CEP-7055, 3-[5-[2-[N-(2-метоксиэтил)-N-метиламино]этокси]-1H-индол-2-ил]хинолин-2(1H)-он, hF4-3C5, ZK-CDK, IMC-EB10, LS-104, CYC-116, OSI-930, PF-337210, JNJ-26483327, SSR-106462, R-1530, PRS-050, TG-02, SC-71710, SB-1578, AMG-191, AMG-820, сульфатиниб, луцитаниба гидрохлорид, JNJ-28312141, илорасертиб, PLX-5622, ARRY-382, TAS-115, танибирумаб, генатиниб, LY-2457546, PLX-7486, FPA-008, NVP-AEE-788, cgi-1842, RAF-265, MK-2461, SG-00529, ребастиниб, голватиниб, ронициклиб, BVT-II, X-82, XV-615, KD-020, лестауртиниб, делфинидин, семаксиниб, ваталаниб, OSI-632, телатиниб, алцизумаб пегол, ATN-224, тивозаниб, XL-999, икрукумаб, форетиниб, креноланиб безилат, R-406, бриваиб, пегдинетаниб, TG-100572, оларатумаб, динатриевая соль фостаматиниба, BMS-690514, AT-9283, MGCD-265, хизартиниб, ENMD-981693, фамитиниб, анлотиниб, товетумаб, PLX-3397, фрухинтиниб, (-)-эпигаллокатехин, мидостаурин, NSC-706456, орнатиниб, цедираниб, довитиниб, XL-647, мотесаниб, линифаниб, бриваниб, цедираниб, апатиниб, федратиниб, пакритиниб, рамукирумаб, интеданиб, маситиниб, элемен, дигидроартемизинин, WS-1442, итраназол, лефлуномид, дигидроартемизинин, имтиниб, сорафениб, сунитиниб, дазатиниб, пазопаниб, вандетаниб, акситиниб, регорафениб и кабозантиниб и понатиниб; стероиды, такие как гидрокортизон, триамцинолон, флуцинолон, дексаметазон и бетаметазон; производные простагландинов, такие как изопропилунопростон, латанопрост, биматопрост и травопрост; иммуносуппрессоры, такие как циклоспорин, сиролимус и FK506; противоаллергические агенты, такие как азеластин; нестероидные противовоспалительные лекарственного средства, такие как индометацин, бромфенак и диклофенак; ингибиторы ангиогенеза, такие как пазопаниб, SU5416, балатиниб, ранибизумаб и бевацизумаб; лекарственного средства, улучшающие циркуляцию, такие как никардипин и нитрендипин; антиоксиданты, такие как витамин E; ингибиторы карбоангидразы, такие как ацетазоламид и бринзроламид; блокаторы β-рецепторов, такие как тимолол и картеолол; модуляторы цикла превращения родопсина, такие как производные витамина А; трофические факторы, такие как трофический фактор цилиарного тела (CNTF) и происходящий из мозга нейротрофический фактор (BDNF); факторы роста, такие как фактор роста нервов (NGF) и фактор роста клеток печени (HGF); аптамеры, такие как пегаптаниб; различные антисмысловые нуклеиновые кислоты; лекарственные нуклеиновые кислоты, такие как миРНК; составы антитело/пептид, такие как луцентиз и IgG; ингибиторы VEGF, описанные в публикациях заявок на патенты Японии Nos. 2006-96739, 2011-37844, 2005-232149, 2006-273851, 2006-306861, 2008-266294 и тому подобном; соединения, обладающие связывающей активностью в отношении рецепторов глюкокортикоидов, описанные в публикациях заявок на патенты Японии Nos. 2007-230993, 2008-074829, 2008-143889, 2008-143890, 2008-143891, 2009-007344, 2009-084274 и тому подобном; селективные агонисты глюкокортикоидных рецепторов, такие как RU24858; противораковые лекарственного средства, такие как фторурацил; ингибиторы киназ Януса, такие как тофацитиниб; ингибиторы протеинкиназ, такие как рубоксистаурин мезилат; и другие.
В частности, предпочтительно использовать в качестве лекарственного средства по настоящему изобретению соединение или его соль, причем соединение представлено формулой (1):

где
R1 представляет собой атом водорода, атом галогена, гидроксильную группу, C1-6-алкильную группу, C1-6-алкильную группу, замещенную одним или более атомами галогена, C1-6-алкоксигруппу, или C1-6-алкоксигруппу, замещенную одним или более атомами галогена; и
R2 представляет собой атом водорода, C1-6-алкильную группу, C1-6-алкилкарбонильную группу или C1-6-алкилкарбонильную группу, замещенную одной или более гидроксильными группами. Более предпочтительное лекарственное средство представляет собой соединение указанной выше формулы (1) или его соль, где R1 представляет собой C1-6-алкоксигруппу, или C1-6-алкоксигруппу, замещенную одним или более атомами галогена, и R2 представляет собой C1-6-алкилкарбонильную группу или C1-6-алкилкарбонильную группу, замещенную одной или более гидроксильными группами. Еще более предпочтительное лекарственное средство представляет собой соединение указанной выше формулы (1) или его соль, где R1 представляет собой C1-6-алкоксигруппу, замещенную одним или более атомами галогена, и R2 представляет собой C1-6-алкилкарбонильную группу, замещенную одной или более гидроксильными группами.
В настоящем описании «атом галогена» представляет собой фтор, хлор, бром или йод.
«C1-6-алкильная группа» представляет собой линейную или разветвленную алкильную группу, имеющую от 1 до 6 атомов углерода, и предпочтительно представляет собой линейную или разветвленную алкильную группу, имеющую от 1 до 4 атомов углерода. Конкретные примеры таких групп включают метильную группу, этильную группу, н-пропильную группу, н-бутильную группу, н-пентильную группу, н-гексильную группу, изопропильную группу, изобутильную группу, сек-бутильную группу, трет-бутильную группу, изопентильную группу и тому подобное.
«C1-6-алкоксигруппа» представляет собой группу, в которой атом водорода в гидроксильной группе замещен C1-6-алкильной группой. Конкретные примеры таких групп включают метоксигруппу, этоксигруппу, н-пропоксигруппу, н-бутоксигруппу, н-пентоксигруппу, н-гексилоксигруппу, изопропоксигруппу, изобутоксигруппу, сек-бутоксигруппу, трет-бутоксигруппу, изопентилоксигруппу и тому подобное.
«C1-6-алкилкарбонильная группа» представляет собой группу, в которой атом водорода в формильной группе замещен C1-6-алкильной группой. Конкретные примеры таких групп включают метилкарбонильную группу (ацетильную группу), этилкарбонильную группу, н-пропилкарбонильную группу, н-бутилкарбонильную группу, н-пентилкарбонильную группу, н-гексилкарбонильную группу, изопропилкарбонильную группу, изобутилкарбонильную группу, сек-бутилкарбонильную группу, трет-бутилкарбонильную группу, изопентилкарбонильную группу и тому подобное.
Выражение «замещенная одним или более атомами галогена» указывает на C1-6-алкильную группу, в которой от одного до максимального количества замещаемых положений замещено атомом(амии) галогена. Атомы галогена могут быть одинаковыми или отличаться друг от друга. В отношении количества атомов галогена предпочтительными являются 2 или 3, особенно предпочтительны 3.
Выражение «замещенная одной или более гидроксильными группами» указывает на C1-6-алкильную группу, в которой от одного до максимального количества замещаемых положений замещено гидроксильной(ыми) группой(ами). В отношении количества гидроксильных групп предпочтительными являются 1 или 2, особенно предпочтительна 1.
Конкретным предпочтительным специфическим примером лекарственного средства по настоящему изобретению является 2-[[[2-[(гидроксиацетил)амино]-4-пиридинил]метил]тио]-N-[4-(трифторметокси)фенил]-3-пиридкарбоксамид, представленный формулой (2):

или его соль. В описании публикации заявки на патент США No. 2007/0149574 раскрыто соединение, представленное формулой (2) и тому подобные, которые демонстрировали ингибиторное действие в отношении пролиферации в тесте, использующем систему оценки пролиферации HUVEC, индуцированную VEGF, демонстрировали ингибиторное действие в отношении роста опухоли в тесте, использующем модели рака у мышей, демонстрировали ингибиторное действие в отношении отека лап в тесте, использующем адъювантные модели артрита у крыс, демонстрировали ингибиторное действие в отношении неоваскуляризации сосудистой оболочки глаза в тесте, использующем модели неоваскуляризации сосудистой оболочки глаза у крыс. Кроме того, установлено также, что соединение, представленное формулой (2), пригодно в качестве лекарственного средства благодаря этим фармакологическим эффектам, и прогнозируется его использование в качестве профилактического или терапевтического агента для таких заболеваний как в частности рак, ревматоидный артрит, связанная с возрастом дегенерация макулы, диабетическая ретинопатия и диабетический отек макулы.
Также в описании публикации заявки на патент США No. 2012/0116088 раскрыт бензолсульфонат соединения, представленного формулой (2), его кристаллы, его полиморфные кристаллы, и его способы получения, и установлено, что бензолсульфонат соединения, представленного формулой (2), является прекрасным соединением в отношении стабильности при хранении и не вызывает отложения минерального вещества в желудке даже после повторяемого перорального введения.
Соединение, представленное формулой (2), или его соль, содержащиеся в фармацевтической композиции по настоящему изобретению, может быть получено в соответствии с обычным методом в данной области техники, таким как метод, описанный в описании публикации заявки на патент США No. 2007/0149574.
Лекарственного средства по настоящему изобретению также включают производные, такие как сложные эфиры и амиды. Конкретным примером сложных эфиров является сложный эфир, в котором гидроксильная группа в лекарстве конденсирована с карбоновой кислотой, такой как уксусная кислота, пропионовая кислота, изопропионовая кислота, масляная кислота, изобутиловая кислота или пивалевая кислота. Конкретным примером амидов является амид, в котором аминогруппа в лекарстве конденсирована с карбоновой кислотой, такой как уксусная кислота, пропионовая кислота, изопропионовая кислота, масляная кислота, изобутиловая кислота или пивалевая кислота.
Кроме того, лекарственное средство по настоящему изобретению может представлять собой сольват.
В случае присутствия геометрических изомеров, таутомеров или оптических изомеров лекарств по настоящему изобретению эти изомеры также включаются в объем настоящего изобретения.
Кроме того, в случае присутствия полиморфных кристаллов лекарственного средства по настоящему изобретению полиморфные кристаллы также включаются в объем настоящего изобретения.
Лекарственное средство по настоящему изобретению может представлять собой соль и быть любой фармацевтически приемлемой солью без особого ограничения. В качестве соли используется соль неорганической кислоты, соль органической кислоты, четвертичная аммонийная соль, соль иона галогена, соль щелочного металла, соль щелочноземельного металла, соль металла, соль органического амина и тому подобное. В качестве соли неорганической кислоты используется соль хлористоводородной кислоты, бромистоводородной кислоты, йодистоводородной кислоты, азотной кислоты, серной кислоты, фосфорной кислоты или тому подобное. В качестве соли органической кислоты используется соль уксусной кислоты, щавелевой кислоты, фумаровой кислоты, малеиновой кислоты, янтарной кислоты, яблочной кислоты, лимонной кислоты, винной кислоты, адипиновой кислоты, глюконовой кислоты, глюкогептоновой кислоты, глюкуроновой кислоты, терефталевой кислоты, метансульфоновой кислоты, аланина, молочной кислоты, гиппуровой кислоты, 1,2-этандисульфоновой кислоты, этионовой кислоты, лактобионовой кислоты, олеиновой кислоты, галловой кислоты, памоевой кислоты, полигалактуроновой кислоты, стеаровой кислоты, дигалловой кислоты, трифторметансульфоновой кислоты, бензолсульфоновой кислоты, п-толуолсульфоновой кислоты, лаурилсульфата, метилсульфата, нафталинсульфоновой кислоты, сульфосалициловой кислоты или тому подобное. В качестве соли четвертичного аммония используется соль метилбромида, метилйодида или тому подобное. В качестве соли иона галогена используется соль иона хлорида, иона бромида, иона йодида или тому подобное. В качестве соли щелочного металла используется соль лития, натрия, калия или тому подобное. В качестве соли щелочноземельного металла используется соль кальция, магния или тому подобное. В качестве соли металла используется соль железа, цинка или тому подобное. В качестве соли органического амина используется соль триэтилендиамина, 2-аминоэтанола, 2,2-имино-бис(этанола), 1-дезокси-1-(метиламино)-2-d-сорбита, 2-амино-2-(гидроксиметил)-1,3-пропандиола, прокаина, n,n-бис(фенилметил)-1,2-этандиамина или тому подобное.
Содержание лекарственного средства по настоящему изобретению особенно не ограничено при условии, что лекарственное средство содержится в количестве, достаточном для получения желаемого эффекта лекарственного средства. Однако содержание лекарственного средства предпочтительно составляет от 0,01 до 30% (масс./об.), более предпочтительно от 0,1 до 25% (масс./об.), даже более предпочтительно от 0,5 до 20% (масс./об.), даже еще более предпочтительно от 1 до 15% (масс./об.), особенно предпочтительно от 1 до 12% (масс./об.), или наиболее предпочтительно 1% (масс./об.), 1,5% (масс./об.), 2% (масс./об.), 2,5% (масс./об.), 3% (масс./об.), 3,5% (масс./об.), 4% (масс./об.), 5% (масс./об.), 6% (масс./об.), 7% (масс./об.), 8% (масс./об.), 9% (масс./об.), 10% (масс./об.), 11% (масс./об.) или 12% (масс./об.).
«Органический растворитель»
Органический растворитель по настоящему изобретению выбран из группы, состоящей из полиэтиленгликоля (ПЭГ), диметилсульфоксида, гликофурола и N-метилпирролидона.
Полиэтиленгликоль как указанный выше органический растворитель представляет собой полиэфир, полученный путем полимеризации этиленгликоля, и представлен химической формулой HO(CH2CH2O)nH, где n представляет собой количество повторяющихся единиц.
Средняя молекулярная масса полиэтиленгликоля как указанного выше органического растворителя составляет предпочтительно от 90 до 2200, более предпочтительно от 100 до 2000, даже более предпочтительно от 100 до 1500, даже еще более предпочтительно от 100 до 1000, особенно предпочтительно от 200 до 800, дополнительно особенно предпочтительно от 300 до 660, еще дополнительно особенно предпочтительно от 400 до 600, даже еще дополнительно особенно предпочтительно от 400 до 600, или наиболее предпочтительно 400. Конкретные примеры полиэтиленгликоля включают ПЭГ 100, ПЭГ 200, ПЭГ 300, ПЭГ 400, ПЭГ 600, ПЭГ 800, ПЭГ 1000 и тому подобное.
Диметилсульфоксид (ДМСО) как указанный выше органический растворитель представляет собой соединение, представленное химической формулой CH3SOCH3.
Гликофурол как указанный выше органический растворитель представляет собой соединение, представленное следующей формулой (3):

где n представляет собой количество повторяющихся единиц и составляет предпочтительно от 1 до 20, более предпочтительно от 1 до 10, даже более предпочтительно от 1 до 6, особенно предпочтительно от 1 до 4 или наиболее предпочтительно от 1 до 2.
N-метилпирролидон как указанный выше органический растворитель представляет собой соединение, содержащее тетрагидрофуран и полиэтиленгликоль и представлено следующей формулой (4):
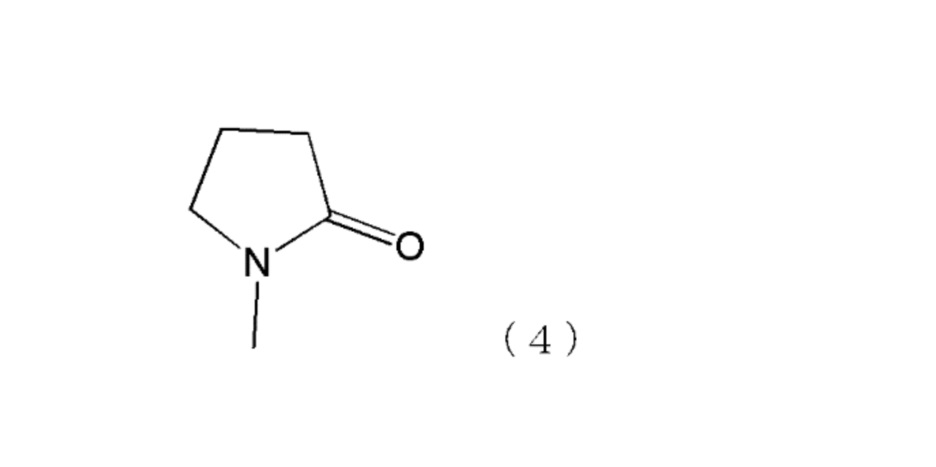
В дополнение к указанному выше органическому растворителю, выбранному из группы, состоящей из полиэтиленгликоля, диметилсульфоксида, гликофурола и N-метилпирролидона, фармацевтическая композиция по настоящему изобретению может дополнительно содержать растворитель, применяемый в качестве аддитивного фармацевтического продукта, такой как вода, этанол и N,N-диметилацетамид. С точки зрения растворения полипептида А особенно предпочтительно, чтобы композиция содержала воду.
Если фармацевтическая композиция по настоящему изобретению содержит воду, объемное отношение органического растворителя, выбранного из группы, состоящей из полиэтиленгликоля (ПЭГ), диметилсульфоксида, гликофурола и N-метилпирролидона (полиэтиленгликоль особенно предпочтителен), к воде особенно не ограничено, но составляет предпочтительно от 99:1 до 60:40, более предпочтительно от 97:3 до 70:30, даже более предпочтительно от 95:5 до 75:25 или наиболее предпочтительно от 90:10 до 80:20.
Суммарное содержание растворителя в фармацевтической композиции по настоящему изобретению особенно не ограничено, но величина % растворителя по массе относительно 100% массы фармацевтической композиции по настоящему изобретению составляет предпочтительно от 70 до 99,99% (масс./масс.), более предпочтительно от 80 до 99,95% (масс./масс.), даже более предпочтительно от 85 до 99,9% (масс./масс.), особенно предпочтительно от 90 до 99,5% (масс./масс.) или наиболее предпочтительно от 92 до 99% (масс./масс.).
«Аддитивные компоненты»
Если необходимо, в фармацевтической композиции по настоящему изобретению могут использоваться аддитивные компоненты и любое из поверхностно-активных веществ, забуферивающих агентов, агентов, поддерживающих тоничность, стабилизаторов, консервантов, антиоксидантов, полимеров высокой молекулярной массы и тому подобного может быть добавлено в качестве аддитивного компонента.
В качестве поверхностно-активного вещества, используемого как указанный выше аддитивный компонент, могут быть смешаны катионное поверхностно-активное вещество, анионное поверхностно-активное вещество или неионное поверхностно-активное вещество. Примеры анионного поверхностно-активного вещества включают фосфолипиды и тому подобное, и фосфолипиды включают лецитин и тому подобное. Примеры катионного поверхностно-активного вещества включают соль алкиламина, аддукт алкиламина-полиоксиэтилена, соль моноэфира жирной кислоты и триэтаноламина, соль ациламиноэтилдиэтиламина, конденсат жирной кислоты-полиамина, соль алкилтриметиламмония, соль диалкилдиметиламмония, соль алкилдиметилбензиламмония, соль алкилпиридиния, соль аммония ациламиноалкильного типа, соль диацилоксиэтиламмония, алкилимидазолин, 1-ациламиноэтил-2-алкилимидазолин, 1-гидроксилэтил-2-алкилимидазолин и тому подобное. В качестве алкилдиметилбензиламмонийной соли используется хлорид бензалкония, хлорид цетаркония и тому подобное. Примеры неионного поверхностно-активного вещества включают сложный эфир полиоксиэтилена и жирной кислоты, сложный эфир полиоксиэтиленсорбитана и жирной кислоты, полиоксиэтиленизированное, гидрогенизированное касторовое масло, полиоксиэтиленизированное касторовое масло, полиоксиэтилен-полиоксипропиленгликоль, сложный эфир сахарозы и жирных кислот, витамин Е (TPGS) (сукцинат токоферола полиэтиленгликоля 1000, CAS 9002-96-4) и тому подобное.
В качестве сложного эфира полиоксиэтилена и жирных кислот используется полиоксол-40-стеарат и тому подобное.
В качестве сложного эфира полиоксиэтиленсорбитана и жирных кислот используется полисорбат 80, полисорбат 65, полисорбат 60, полисорбат 40, полисорбат 20, полиоксиэтиленсорбитана монолаурат, полиоксиэтиленсорбитана триолеат и тому подобное.
В качестве полиоксиэтиленизированного, гидрогенизированного касторового масла можно использовать различные виды полиоксиэтиленизированных, гидрогенизированных касторовых масел, которые отличаются по количеству повторяющихся этиленоксидных единиц. Количество повторяющихся этиленоксидных единиц составляет предпочтительно от 10 до 100, более предпочтительно от 20 до 80, особенно предпочтительно от 40 до 70 или наиболее предпочтительно 60. Конкретные примеры полиоксиэтиленизированного, гидрогенизированного касторового масла включают полиоксиэтиленизированное, гидрогенизированное касторовое масло 10, полиоксиэтиленизированное, гидрогенизированное касторовое масло 40, полиоксиэтиленизированное, гидрогенизированное касторовое масло 50, полиоксиэтиленизированное, гидрогенизированное касторовое масло 60 и тому подобное.
В качестве полиоксиэтиленизированного касторового масла можно использовать различные виды полиоксиэтиленизированных касторовых масел, которые отличаются по количеству повторяющихся этиленоксидных единиц. Количество повторяющихся этиленоксидных единиц составляет предпочтительно от 5 до 100, более предпочтительно от 20 до 50, особенно предпочтительно от 30 до 40 или наиболее предпочтительно 35. Конкретные примеры полиоксиэтиленизированного касторового масла включают полиоксил 5 касторовое масло, полиоксил 9 касторовое масло, полиоксил 15 касторовое масло, полиоксил 35 касторовое масло, полиоксил 40 касторовое масло и тому подобное.
В качестве полиоксиэтилен-полиоксипропиленгликоля используются полиоксиэтилен (160) полиоксипропилен (30) гликоль, полиоксиэтилен (42) полиоксипропилен (67) гликоль, полиоксиэтилен (54) полиоксипропилен (39) гликоль, полиоксиэтилен (196) полиоксипропилен (67) гликоль, полиоксиэтилен (20) полиоксипропилен (20) гликоль и тому подобное.
В качестве сложного эфира сахарозы и жирных кислот используется стеарат сахарозы и тому подобное.
Если фармацевтическая композиция по настоящему изобретению смешивается с поверхностно-активным веществом, содержание поверхностно-активного вещества может быть подходящим образом доведено в зависимости от типа поверхностно-активного вещества и тому подобного, но составляет предпочтительно от 0,001 до 10% (масс./об.), более предпочтительно от 0,01 до 5% (масс./об.), даже более предпочтительно от 0,05 до 3% (масс./об.) или наиболее предпочтительно от 0,1 до 2% (масс./об.).
В качестве забуферивающего агента, применяемого как указанный выше аддитивный компонент, используется фосфорная кислота или фосфат, борная кислота или борат, лимонная кислота или цитрат, уксусная кислоты или ацетат, угольная кислота или карбонат, винная кислота или тартрат, ε-аминокапроновая кислота, трометамол и тому подобное. В качестве фосфата используется фосфат натрия, дигидрофосфат натрия, двунатриевая соль гидрофосфата, дигидрофосфат калия, двукалиевая соль гидрофосфата и тому подобное. В качестве бората используется пироборнокислый натрий, борат натрия, борат калия и тому подобное. В качестве цитрата используется цитрат натрия, двунатриевая соль цитрата и тому подобное. В качестве ацетата используется ацетат натрия, ацетат калия и тому подобное. В качестве карбоната используется карбонат натрия, гидрокарбонат натрия и тому подобное. В качестве тартрата используется тартрат натрия, тартрат калия и тому подобное.
Если фармацевтическая композиция по настоящему изобретению смешивается с забуферивающим агентом, содержание забуферивающего агента может быть подходящим образом доведено в зависимости от типа забуферивающего агента или тому подобного, но составляет предпочтительно от 0,001 до 10% (масс./об.), более предпочтительно от 0,01 до 5% (масс./об.), еще более предпочтительно от 0,05 до 3% (масс./об.) или наиболее предпочтительно от 0,1 до 2% (масс./об.).
В качестве агента, регулирующего тоничность, используемого как указанный выше аддитивный компонент, используется ионный агент, регулирующий тоничность, неионный агент, регулирующий тоничность, и тому подобное. В качестве ионного агента, регулирующего тоничность, используется хлорид натрия, хлорид калия, хлорид кальция, хлорид магния и тому подобное. В качестве неионного агента, регулирующего тоничность, используется глицерин, пропиленгликоль, сорбит, маннит, трегалоза, сахароза, глюкоза и тому подобное.
Если фармацевтическая композиция по настоящему изобретению смешивается с агентом, регулирующим тоничность, содержание агента, регулирующего тоничность, может быть подходящим образом доведено в зависимости от типа агента, регулирующего тоничность, или тому подобного, но составляет предпочтительно от 0,001 до 10% (масс./об.), более предпочтительно от 0,01 до 5% (масс./об.), еще более предпочтительно от 0,05 до 3% (масс./об.) или наиболее предпочтительно от 0,1 до 2% (масс./об.).
В качестве стабилизатора, используемого как указанный выше аддитивный компонент, используется этилендиаминтетрауксусная кислота, эдетат натрия, цитрат натрия и тому подобное.
Если фармацевтическую композицию по настоящему изобретению смешивают со стабилизатором, содержание стабилизатора может быть доведено в зависимости от типа стабилизатора или тому подобного, но составляет предпочтительно от 0,001 до 10% (масс./об.), более предпочтительно от 0,01 до 5% (масс./об.), еще более предпочтительно от 0,05 до 3% (масс./об.) или наиболее предпочтительно от 0,1 до 2% (масс./об.).
В качестве консерванта, используемого как указанный выше аддитивный компонент, используется хлорид бензалкония, бромид бензалкония, хлорид бензэтония, сорбиновая кислота, сорбат натрия, метилпарагидроксибензоат, пропилпарагидроксибензоат, хлорбутанол и тому подобное.
Если фармацевтическую композицию по настоящему изобретению смешивают с консервантом, содержание консерванта может быть доведено в зависимости от типа консерванта или тому подобного, но составляет предпочтительно от 0,0001 до 10% (масс./об.), более предпочтительно от 0,001 до 5% (масс./об.), еще более предпочтительно от 0,005 до 3% (масс./об.) или наиболее предпочтительно от 0,01 до 2% (масс./об.).
В качестве антиоксиданта, используемого как указанный выше аддитивный компонент, используется аскорбиновая кислота, производные аскорбиновой кислоты, такие как аскорбилпальмитат, токоферол, дибутилгидрокситолуол, бутилгидроксианизол, эриторбат натрия, пропилгаллат, сульфит натрия и тому подобное.
Если фармацевтическую композицию по настоящему изобретению смешивают с антиоксидантом, содержание антиоксиданта может быть доведено в зависимости от типа антиоксиданта или тому подобного, но составляет предпочтительно от 0,001 до 10% (масс./об.), более предпочтительно от 0,01 до 5% (масс./об.), еще более предпочтительно от 0,05 до 3% (масс./об.) или наиболее предпочтительно от 0,1 до 2% (масс./об.).
В качестве высокомолекулярного полимера, используемого как указанный выше аддитивный компонент, используется метилцеллюлоза, этилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксиэтилметилцеллюлоза, гироксипропилметилцеллюлоза, карбоксиметилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, ацетат-сукцинат гидроксипропилметилцеллюлозы, фталат гидроксипропилметилцеллюлозы, карбоксиметилэтилцеллюлоза, ацетат-фталат целлюлозы, поливинилпирролидон, поливиниловый спирт, карбоксивиниловый полимер и тому подобное.
Если фармацевтическую композицию по настоящему изобретению смешивают с высокомолекулярным полимером, содержание высокомолекулярного полимера может быть доведено в зависимости от типа высокомолекулярного полимера или тому подобного, но составляет предпочтительно от 0,001 до 10% (масс./об.), более предпочтительно от 0,01 до 5% (масс./об.), еще более предпочтительно от 0,05 до 3% (масс./об.) или наиболее предпочтительно от 0,1 до 2% (масс./об.).
Содержание каждого аддитивного компонента, используемого как указанный выше аддитивный компонент, может быть доведено в зависимости от типа аддитивного компонента или тому подобного, но суммарное его количество составляет предпочтительно от 0,0001 до 30% (масс./об.), более предпочтительно от 0,001 до 25% (масс./об.), еще более предпочтительно от 0,01 до 20% (масс./об.) особенно предпочтительно от 0,1 до 15% (масс./об.) и наиболее предпочтительно от 1 до 10% (масс./об.).
Конкретным предпочтительным вариантом осуществления фармацевтической композиции по настоящему изобретению является фармацевтическая композиция, состоящая по существу только из лекарственного средства, полипептида, представленного Ac-(Arg-Ala-Asp-Ala)4-NH2, полиэтиленгликоля и воды.
Конкретным предпочтительным вариантом осуществления фармацевтической композиции по настоящему изобретению является фармацевтическая композиция, состоящая по существу только из соединения, представленного формулой (1), или его соли, полипептида, представленного Ac-(Arg-Ala-Asp-Ala)4-NH2, полиэтиленгликоля и воды.
Конкретным предпочтительным вариантом осуществления фармацевтической композиции по настоящему изобретению является фармацевтическая композиция, состоящая по существу только из соединения, представленного формулой (2), или его соли, полипептида, представленного Ac-(Arg-Ala-Asp-Ala)4-NH2, полиэтиленгликоля и воды.
Конкретным предпочтительным вариантом осуществления фармацевтической композиции по настоящему изобретению является фармацевтическая композиция, состоящая по существу только из лекарственного средства, полипептида, представленного Ac-(Arg-Ala-Asp-Ala)4-NH2, и диметилсульфоксида.
Конкретным предпочтительным вариантом осуществления фармацевтической композиции по настоящему изобретению является фармацевтическая композиция, состоящая по существу только из соединения, представленного формулой (1), или его соли, полипептида, представленного Ac-(Arg-Ala-Asp-Ala)4-NH2, и диметилсульфоксида.
Конкретным предпочтительным вариантом осуществления фармацевтической композиции по настоящему изобретению является фармацевтическая композиция, состоящая по существу только из соединения, представленного формулой (2), или его соли, полипептида, представленного Ac-(Arg-Ala-Asp-Ala)4-NH2, и диметилсульфоксида.
Фармацевтическую композицию по настоящему изобретению можно вводить перорально или парентерально. Лекарственная форма фармацевтической композиции по настоящему изобретению особенно не ограничена при условии, что фармацевтическая композиция может использоваться в качестве фармацевтического продукта. Лекарственная форма, например, для перорального получения, представляет собой, например, жидкий препарат, тогда как примеры лекарственных форм для парентерального введения включают инъекцию, инфузию, капли в нос, капли в ухо, глазные капли и тому подобное. В настоящем описании офтальмологические инъекции и глазные капли являются предпочтительными, офтальмологические инъекции являются более предпочтительными, или инъекции для введения в стекловидное тело, введение в камеру глаза и введение под конъюнктиву являются наиболее предпочтительными. Эти препараты могут быть получены с использованием обычных методов, известных в данной области техники.
Фармацевтическая композиция по настоящему изобретению может быть введена подходящим образом в зависимости от ее лекарственной формы. Например, в случае офтальмологической инъекции фармацевтическая композиция может быть введена в стекловидное тело, вблизи задней склеры, вокруг орбиты или между склерой и конъюнктивой. В случае введения офтальмологической инъекции в стекловидное тело или в камеру глаза, лекарственная форма офтальмологической инъекции особенно не ограничена при условии, что доза является достаточной для индукции желаемой эффективности лекарственного средства, но доза на одно введение составляет предпочтительно от 1 до 100 мкл, более предпочтительно от 5 до 70 мкл, даже более предпочтительно от 10 до 60 мкл, особенно предпочтительно от 20 до 50 мкл или наиболее предпочтительно 10 мкл, 20 мкл, 25 мкл, 30 мкл, 35 мкл, 40 мкл, 45 мкл или 50 мкл. Доза составляет предпочтительно от 0,001 до 30 мг/глаз, более предпочтительно от 0,01 до 10 мг/глаз, даже более предпочтительно от 0,1 до 5 мг/глаз, особенно предпочтительно от 0,2 до 1,6 мг/глаз или наиболее предпочтительно 0,2 мг/глаз, 0,3 мг/глаз, 0,4 мг/глаз, 0,5 мг/глаз, 0,6 мг/глаз, 0,7 мг/глаз, 0,8 мг/глаз, 1 мг/глаз, 1,2 мг/глаз, 1,4 мг/глаз или 1,6 мг/глаз.
В случае последовательного введения фармацевтической композиции по настоящему изобретению в стекловидное тело или в переднюю камеру, интервал между ее введением особенно не ограничен при условии, что интервалы между введениями достаточны для индукции желаемой эффективности лекарственного средства. Однако предпочтительный интервал находится в диапазоне от одного раза в неделю до одного раза каждые три года. Более предпочтительный интервал составляет один раз в неделю, один раз каждые две недели, один раз в месяц, один раз каждые два месяца, один раз каждые три месяца, один раз каждые четыре месяца, один раз каждые пять месяцев, один раз каждые шесть месяцев, один раз в год, один раз каждые два года, один раз каждые три года, и наиболее предпочтительный интервал составляет один раз каждые два месяца, один раз каждые три месяца, один раз каждые четыре месяца, один раз каждые пять месяцев, один раз каждые шесть месяцев или один раз в год. Затем интервал между введениями может быть соответствующим образом изменен в зависимости от типа лекарственного средства, способности к пролонгированному высвобождению лекарственного средства, симптомов пациента и тому подобного.
Композиция по настоящему изобретению пригодна в качестве фармацевтического препарата и особенно пригодна для профилактики или лечения заболеваний глаз. Конкретные заболевания, которые можно предотвращать или лечить с помощью композиции по настоящему изобретению, включают связанную с возрастом дегенерацию макулы, диабетическую ретинопатию, ретинопатию недоношенных, окклюзию вен сетчатки, окклюзию артерий сетчатки, полипоидную хороидальную ангиопатию, ангиоматозную пролиферацию сетчатки, миопическую хороидальную неоваскуляризацию, диабетический макулярный отек, опухоль глаза, лучевую ретинопатию, рубеоз радужки, неоваскулярную глаукому, пролиферативную витреоретинопатию (PVR), первичную открытоугольную глаукому, вторичную открытоугольную глаукому, нормотензивную глаукому, первичную закрытоугольную глаукому, вторичную закрытоугольную глаукому, глаукому с плоской радужкой, смешанную глаукому, врожденную глаукому, индуцированную стероидами глаукому, эксфолиативную глаукому, амилоидную глаукому, неоваскулярную глаукому, злокачественную глаукому, капсулярную глаукому, глаукому плоской радужки, гипертензию глаза и тому подобное. Более предпочтительны профилактика и лечение таких заболеваний как связанная с возрастом дегенерация макулы, диабетическая ретинопатия, первичная открытоугольная глаукома, нормотензивная глаукома, первичная закрытоугольная глаукома и гипертензия глаза.
Фармацевтическая композиция по настоящему изобретению обладает способностью к пролонгированному высвобождению и способна постепенно высвобождать вводимое лекарственное средство по настоящему изобретению в организме, что обозначается как замедленное высвобождение лекарственного средства. Способность к пролонгированному высвобождению может быть оценена, например, путем измерения скорости высвобождения лекарственного средства с течением времени. Скорость высвобождения может быть получена в соответствии со следующей формулой.
Скорость высвобождения (%)=[Количество высвобождаемого лекарственного средства (масса)]/[Количество лекарственного средства (дозировка)(масса)×100
Что касается скорости высвобождения, например, скорость высвобождения через 1 день после введения составляет предпочтительно 60% или менее, более предпочтительно от 1 до 50% или даже более предпочтительно от 1 до 45%. Кроме того, скорость высвобождения через 6 дней составляет предпочтительно 97% или менее, более предпочтительно от 5 до 95% или даже более предпочтительно от 10 до 90%.
При введении в организм фармацевтическая композиция по настоящему изобретению и/или агент, придающий способность к пролонгированному высвобождению лекарственного средства, описываемого ниже, откладывается в виде массы, другими словами создается «депо», и это позволяет лекарственному средству, содержащемуся в фармацевтической композиции или тому подобном, медленно высвобождаться из депо, так чтобы могла быть достигнута указанная выше способность к пролонгированному высвобождению.
«Агент, придающий способность к пролонгированному высвобождению лекарственного средства»
Агент, придающий способность к пролонгированному высвобождению лекарственного средства по настоящему изобретению, способен придавать способность к пролонгированному высвобождению лекарственного средства и содержит полипептид, представленный Ac-(Arg-Ala-Asp-Ala)4-NH2, и органический растворитель. Органический растворитель представляет собой по меньшей мере органический растворитель, выбранный из группы, состоящей из полиэтиленгликоля, диметилсульфоксида, гликофурола и N-метилпирролидона. Что касается подробностей ингредиентов и дополнительных аддитивных компонентов, описанные выше для фармацевтической композиции могут применяться для агента, придающего способность к пролонгированному высвобождению лекарственного средства, без каких-либо изменений. Например, подробности относительно полипептида и растворителя являются теми же самыми, что и описанные выше, и агент, придающий способность к пролонгированному высвобождению, также является тем же самым, что и в описанной выше фармацевтической композиции, в которую могут быть добавлены указанные выше аддитивные компоненты. Что касается отношения агент, придающий способность к пролонгированному высвобождению: лекарственное средство по настоящему изобретению, например, подходящее соотношение масс составляет от 0,01:99,99 до 30:70, предпочтительно от 0,1:99,9 до 25:75, более предпочтительно от 0,5:99,5 до 20:80, даже более предпочтительно от 1:99 до 15:85 или особенно предпочтительно 1:99 до 12:88.
Далее в настоящем описании будут демонстрироваться примеры получения и результаты их тестирования, но они предназначены для облегчения лучшего понимания настоящего изобретения и не предназначены для ограничения объема настоящего изобретения.
ПРИМЕРЫ
Примеры получения
Далее в настоящем описании будут представлены типичные примеры получения по настоящему изобретению. В последующих примерах получения содержание каждого ингредиента находится в контексте ингредиента в 100 мл композиции.
Пример получения 1
Пример получения 2
Пример получения 3
Пример получения 4
Пример получения 5
Пример получения 6
Следует отметить, что желаемая композиция может быть получена путем доведения содержаний лекарственного средства, полипептида А и растворителя в любом из примеров получения от 1 до 6 до соответствующего уровня.
1. Тест на оценку осуществления растворения
Исследовали способность растворения лекарственного средства в различных растворах
1-1. Метод тестирования

Соединение представленное выше формулой (2), (2-[[[2-[(гидроксиацетил)амино]-4-пиридинил]метил]тио]-N-[4-(трифторметокси)фенил]-3-пиридинкарбоксамид, обозначаемое в настоящем описании также как лекарственное средство A; полученное в соответствии с методом, описанным в описании публикации заявки на патент США No. 2007/0149574), добавляли к каждому растворителю (суммарно 1 мл) из различных растворителей ДМСО (GAYLORD), ПЭГ 400 (Nacalai Tesque) и воды и перемешивали при комнатной температуре (25°C) в течение ночи (в течение 8 часов).
1-2. Результаты тестирования и обсуждение
В таблице 1 представлены результаты тестирования. Как видно из таблицы 1, раствор, содержащий ДМСО или ПЭГ 400, может растворить лекарственное средство, которое не может быть растворимо в воде.
[Таблица 1]
2. Тест (1) на оценку образования депо
Исследовали образование депо (депозитной массы) различных видов желатинизаторов.
2-1. Метод тестирования
Композиции с 1 по 6 получали путем смешивания каждого из различных видов желатинизаторов с растворителем ДМСО/вода (объемное отношение 9:1), так что желатинизатор содержался в концентрации 0,1% (масс./об.) (0,1% массы желатинизатора содержится на 100 мл раствора ДМСО/вода). Затем хлорид дигидрат кальция и хлорид гексагидрат магния растворяли в физиологическом растворе, забуференном фосфатом Дульбекко (-) (продукт No. D-5652, производимый Sigma-Aldrich) для получения физиологического раствора, забуференного фосфатом Дульбекко (+). 0,005 мл каждой композиции добавляли к 1 мл физиологического раствора, забуференного фосфатом Дульбекко (+), и образование депо отслеживали визуально. Образование депо оценивали таким образом, что депо считалось сформированным, если наблюдали образовавшуюся массу отложенной композиции.
2-2. Результаты тестирования и обсуждение
В таблице 2 представлены результаты тестирования. Как видно из таблицы 2, только полипептид А образовывал депо в растворе ДМСО/вода в объемном отношении (9:1) среди различных видов желатинизаторов. Это указывает на то, что агент, придающий способность к пролонгированному высвобождению по настоящему изобретению, способен к пролонгированному высвобождению лекарственного средства в результате образования депо при введении в организм совместно с лекарственное средством.
[Таблица 2]
ο: депо образуется.
×: депо не образуется.
3. Тест (2) оценки образования депо
Исследовали растворители полипептида А.
3-1. Метод тестирования
Композиции с 2 по 6 и из сравнительных примеров 6 и 7 получали путем добавления 0,01 мл 1% (масс./об.) водного раствора полипептида А (содержащего 1% массы полипептида А на 100 мл воды) к 0,09 мл каждого из различных растворителей с последующим перемешиванием. 0,005 мл каждой из композиций вносили в физиологический раствор, забуференный фосфатом Дульбекко (+), и образование депо прослеживали визуально.
3-2. Результаты тестирования и обсуждение
В таблице 3 представлены результаты тестирования. Как можно видеть из таблицы 3, полипептид А образует депо в любом из случаев, когда в качестве растворителей используются ДМСО, ПЭГ 200, ПЭГ 400, гликофурол (смесь, имеющая преимущественно от 1 до 4 повторяющихся единиц) и N-метилпирролидон. С другой стороны, в тех случаях, когда в качестве растворителей используются этанол и N,N-диметилацетамид, полипептид А не образует депо. Таким образом, демонстрируется, что агент, придающий способность к пролонгированному высвобождению по настоящему изобретению, способен постоянно высвобождать лекарственное средство путем образования депо при введении в организм совместно с лекарственное средством.
[Таблица 3]
ο: депо образуется.
×: депо не образуется.
4. Тест на оценку способности к пролонгированному высвобождению
Исследовали способность лекарственного средства к пролонгированному высвобождению из депо.
4-1. Получение тестируемой композиции
Композицию А получали путем добавления 0,25 г лекарственного средства А к 8 мл ПЭГ 400 (Nacalai Tesque) и растворения лекарственного средства А путем перемешивания.
Композицию B получали путем добавления 0,4 мл воды к 1,6 мл композиции А и растворения композиции А.
Композицию С получали путем помещения 1 мл водного раствора полипептида А в 1% (масс./об.) (содержащего 1% полипептида А по массе на 100 мл воды) в стандартную колбу, лиофилизации раствора при от -35 до 30°С и затем добавления к полученному веществу 1,6 мл композиции А и 0,4 мл воды с последующим смешиванием путем перемешивания.
Композицию D получали путем добавления 0,7 мл композиции B к 0,7 мл композиции С с последующим смешиванием путем перемешивания.
Композицию E получали путем добавления 0,8 мл композиции B к 0,2 мл композиции С с последующим смешиванием путем перемешивания.
Композицию F получали путем добавления 25 мг лекарственного средства А к 1 мл ПЭГ 400 (Nacalai Tesque) и растворения лекарственного средства А путем перемешивания.
4-2. Метод тестирования
Добавляли воду к 10 г полиоксол-40-стеарата (Nikko Chemicals) и 9,6 г физиологического раствора, забуференного фосфатом Дульбекко (Sigma Aldrich), для получения растворителя в суммарном объеме 1 л (растворитель для высвобождения).
20 мл растворителя для высвобождения, нагретого до 37°С, вносили в каждую стандартную колбу, и 0,01 мл тестируемого раствора каждой из композиций с С по F тестируемых растворов вносили в стандартную колбу с последующим перемешиванием при 37°С и 86 об/мин в течение 6 дней. Количество лекарственного средства А, высвобождаемого в растворитель для высвобождения, рассчитывали с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ), и рассчитывали скорость высвобождения (%). Скорость высвобождения рассчитывали на основе следующей формулы.
Скорость высвобождения (%)=[Количество высвобожденного лекарственного средства (масса)]/[Исходное количество лекарственного средства (дозировка) (масса)]×100
В случае расчета скорости высвобождения, например, через 1 день в соответствии с представленной выше формулой, день 0 обозначает тот день, когда тестируемый раствор каждой из композиций вносится в растворитель для высвобождения, и через 1 день обозначает после прохождения 1 дня (24 часов) после внесения, [исходное количество лекарственного средства (дозировка) (масса)] представляет собой количество лекарственного средства, внесенного во время внесения лекарственного средства (в день 0), и «количество высвобожденного лекарственного средства (масса)» представляет собой количество лекарственного средства, высвобожденного после прохождения 1 дня.
4-3. Результаты тестирования и обсуждение
В таблице 4 представлены результаты тестирования. Как видно из таблицы 4, после внесения в растворители для высвобождения композиции с С по E образовывали депо и постоянно высвобождали лекарственное средство А в течение от 1 до 6 дней.
[Таблица 4]
ο: депо образуется.
×: депо не образуется.
Как описано выше, предположено, что фармацевтическая композиция по настоящему изобретению растворит в себе лекарственное средство и будет постоянно высвобождать лекарственное средство в результате образования депо после введения в организм.
[Таблица SEQ ID в произвольном формате]
(SEQ ID NO: 1) продается как PuraMatrix (зарегистрированная товарный знак) 3-D Matrix, Ltd.
SEQUENCE LISTING
<110> SANTEN PHARMACEUTICAL CO., LTD.
<120> Фармацевтическая комозиция, включающая полипептиды
<130> OP16025
<150> JP 2015-53757
<151> 2015-03-17
<160> 1
<170> Патент версии 3.5
<210> 1
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид продается как PuraMatrix (зарегистрированная торговая марка)
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Ацетилирование
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Амидирование
<400> 1
Arg Ala Asp Ala Arg Ala Asp Ala Arg Ala Asp Ala Arg Ala Asp Ala
1 5 10 15
Реферат
Изобретение относится к фармацевтической композиции, включающей лекарственное средство и полипептид, представленный Ac-(Arg-Ala-Asp-Ala)-NH, и дополнительно содержащая органический растворитель, выбранный из группы, состоящей из полиэтиленгликоля, диметилсульфоксида, гликофурола и N-метилпирролидона. Фармацевтическая композиция пролонгированно высвобождает лекарственное средство в организме. 3 н. и 12 з.п. ф-лы, 4 табл., 4 пр.
Формула

Комментарии