Стент для расширения просвета, расположенного внутри тела канала - RU2180844C2
Код документа: RU2180844C2
Чертежи
































Описание
Изобретение относится к устройствам для реконструкции просвета расположенных внутри тела каналов, покрытым композициями, включающими факторы, подавляющие развитие кровеносных сосудов, и полимерные носители. Более конкретно - к стентам для расширения просвета расположенных внутри тела каналов, протоков и сосудов.
Предпосылки изобретения
Рак занимает второе место среди причин смертности в США и ответственен более
чем за одну пятую часть от общей смертности. Если коротко, то рак характеризуется бесконтрольным делением популяций клеток, которое, как правило, приводит к образованию одной или большего количества
опухолей. Хотя в настоящее время рак гораздо легче диагностируют, чем раньше, многие формы, даже при их раннем выявлении, все еще не поддаются лечению.
В настоящее время при лечении рака используется множество методов, в том числе, например, различные хирургические процедуры. Однако если проводить лечение лишь хирургическим способом, то у многих пациентов наблюдается рецидив рака. Помимо хирургического вмешательства многие виды рака лечат с применением комбинированной терапии, включающей использованием цитотоксических химиотерапевтических средств (в частности, винкристина, винбластина, цисплатина, метотрексата, 5-FU и т.д.) и/или радиационную терапию. Одна из сложностей указанного подхода заключается в том, что радиотерапевтические и химиотерапевтические средства являются токсичными по отношению к нормальным тканям и часто вызывают опасные для жизни побочные эффекты. Далее, при таком подходе весьма часто наблюдаются неблагоприятные исходы или временное исчезновение симптомов заболевания.
Помимо хирургии, химиотерапии и радиотерапии предпринимались попытки использовать для уничтожения раковых клеток собственную иммунную систему пациента. Например, было предложено применять бактериальные или вирусные компоненты в качестве адъювантов, с целью стимулировать иммунную систему для уничтожения опухолевых клеток, (см. "Principles of Cancer Biotherapy", Oldham (ed.), Raven Press, New York, 1987). Подобные агенты обычно применяют в качестве адъювантов и неспецифичных стимуляторов в опухолевых моделях животных, однако еще не показано, что они в целом эффективны для лечения людей.
При лечении рака также использовали лимфокины. Если коротко, то лимфокины секретируются разными клетками и обычно оказывают воздействие на специфические клетки, вызывая ответную иммунную реакцию. Примерами лимфокинов являются интерлейкины (IL)-l, -2, -3 и -4, а также колониестимулирующие факторы, такие как G-CSF, GM-CSF и M-CSF. Недавно одна из групп исследователей применила IL-2 для стимулирования клеток периферической кровяной системы, с целью их разрастания и выделения больших количеств клеток, которые являются цитотоксичными для опухолевых клеток (Rosenberg et al., N. Engl. J. Med., 313: 1485-1492, 1985).
Другими группами исследователей для лечения рака предложено использовать антитела. Если коротко, то могут быть получены антитела, распознающие определенные антигены на поверхности клеток, которые либо уникальны для раковых клеток, либо превалируют у раковых клеток, по сравнению с нормальными клетками. Указанные антитела, или "магические пули", могут использоваться сами по себе или в сочетании с токсином, с тем, чтобы они могли специфично нацелиться и поразить раковые клетки (Dilman, "Antibody Therapy", "Principles of Cancer Biotherapy", Oldham (ed.), Raven Press Ltd, New York, 1987). Трудность, однако, заключается в том, что большинство моноклональных антител имеют муриновое происхождение и, таким образом, гиперчуствительность по отношению к муриновому антителу может ограничивать их эффективность, особенно после повторного лечения. Обычные побочные эффекты включают жар, испарину и озноб, высыпания на коже, артрит и нервный паралич.
Дополнительная сложность существующих методов заключается в том, что локальный рецидив и локальный контроль остается важнейшей задачей при лечении злокачественных образований. В частности, в общей сложности 630000 пациентов (в США) ежегодно страдают от локальных заболеваний (не замечено распространение отдаленных метастаз); это составляет 64% от числа всех пациентов, у которых обнаружены злокачественные образования (в него не входит немеланомный рак кожи или карцинома in situ). Для подавляющего большинства этих пациентов хирургическое лечение болезни предоставляет наибольший шанс для выздоровления, и действительно 428000 из них вылечиваются после первичного лечения. К сожалению, у 202000 (или 32% пациентов с локальными заболеваниями) наблюдается рецидив после первичного лечения. Из пациентов, у которых наблюдается рецидив, число тех, у кого наблюдается рецидив локального заболевания, достигает 133000 ежегодно (или 21% от числа пациентов с локальными заболеваниями). Число тех, у кого рецидив связан с отдаленными метастазами, составляет 68000 пациентов ежегодно (11% из всех пациентов с локальными заболеваниями). Еще 102139 пациентов ежегодно умирают непосредственно в результате невозможности контролировать локальное распространение болезни.
Одним из методов, который опробован при лечении опухолей и имел ограниченный успех, является терапевтическая эмболизация. Если коротко, то кровеносные сосуды, которые питают опухоль, преднамеренно блокируют путем введения в сосуды эмболических веществ. С этой целью испытано большое количество материалов, в том числе аутогенных веществ, таких как жир, сгустки крови и измельченные фрагменты мышц, а также искусственные материалы, такие как шерсть, хлопок, стальные шарики, пластиковые или стеклянные шарики, порошок тантала, кремниевые соединения, радиоактивные частицы, стерильный поглощаемый губчатый желатин (Sterispon, Gelfoam), окисленная целлюлоза (Oxycel), стальная спираль, спирт, лиофилизованная твердая мозговая оболочка человека (Lyodura), микрофибриллярный коллаген (Avitene), фибриллы коллагена (Tachotop), губчатый поливиниловый спирт (PVA, Ivalon), импрегнированные барием кремниевые сферы (Biases) и съемные надувные шарики. При использовании указанных методов размер метастаз печени может быть временно уменьшен, однако опухоль отвечает тем, что стимулирует прорастание внутрь нее новых кровеносных сосудов.
Проблемой, связанной с образованием опухоли, является развитие вызванных раком блокад, которые препятствуют прохождению веществ по находящимся внутри организма каналам, таким как желчные протоки, трахея, пищевод, сосудистая система и мочеиспускательный канал. Чтобы держать открытыми проходы, блокированные опухолями или другими веществами, было разработано устройство для реконструкции органов - стент. Примерами обычных стентов являются стеночный стент, стент Штреккера, стент Жиантурко и стент Пальмаца. Основная проблема при использовании стентов заключается, однако в том, что они не препятствуют проникновению опухоли или воспалительного вещества через щели стента. Если указанные вещества проникают внутрь стента и возникает опасность закупорки отверстия стента, то это может привести к блокаде расположенного внутри тела прохода, в который стент установлен. Далее, присутствие стента внутри организма может привести к тому, что активные или воспалительные ткани (в частности, кровеносные сосуды, фибропласты, белые кровяные тельца) попадают в проход стента, что приводит к частичной или полной закупорке стента.
В настоящем изобретении заявляются стенты, покрытые композицией, пригодной для лечения рака и других заболеваний, связанных с развитием кровеносных сосудов.
Краткое описание изобретения
Если коротко, то в настоящем изобретении заявляются устройства, в которых используются
композиции, подавляющие развитие кровеносных сосудов, для лечения рака и других заболеваний, связанных с развитием кровеносных сосудов. Эти композиции (далее называемые "композициями, подавляющими
развитие кровеносных сосудов"), включают (а) фактор, препятствующий развитию кровеносных сосудов и (b) полимерный носитель. В рамках настоящего изобретения в качестве факторов, препятствующих развитию
кровеносных сосудов, может использоваться широкий круг молекул, в том числе, например, таксол, аналоги таксола и производные таксола. Аналогично, может использоваться широкий круг полимерных носителей,
выборочными примерами которых являются поли(этилен-винилацетат), сшитый 40% винилацетата, сополимер молочной и гликолевой кислот, поликапролактон полимолочной кислоты, сополимеры полиэтилена и
винилацетата, сшитые 40% винилацетата и молочной кислоты, сополимеры полимолочной кислоты и поликапролактона.
В соответствии с настоящим изобретением заявляются стенты, имеющие в общем случае трубчатую структуру, а их поверхность покрыта одной или несколькими композициями, подавляющими развитие кровеносных сосудов. В рамках различных вариантов осуществления настоящего изобретения заявляются стенты для устранения закупорки желчных протоков, мочеиспускательных каналов, пищевода, трахеи и бронхов. В каждом из этих вариантов осуществления настоящего изобретения стент имеет в общем случае трубчатую структуру, а его поверхность покрыта вышеуказанной композицией, содержащей таксол, которая подавляет развитие кровеносных сосудов.
Далее настоящее изобретение более подробно поясняется приведенным подробным описанием и прилагаемыми чертежами. Ниже указаны многочисленные ссылки, подробно описывающие некоторые методики и композиции, которые приводятся здесь для справок.
Краткое описание чертежей
На фиг. 1А представлена фотография, на которой изображена культура яйца без оболочки на 6-й день. На фиг. 1В приведен после цифровой
обработки на компьютере образ живых неокрашенных капилляров, полученный с помощью стереомикроскопа (1040х). На фиг. 1С показаны микрососуды хорионалантоисной мембраны, которые питаются нижележащими
более крупными сосудами (стрелки, 1300х). На фиг. 1D показан разрез хорионалантоисной мембраны толщиной 0,5 мм, наблюдаемый в оптический микроскоп, На этой фотографии приведена композиция
хорионалантоисной мембраны, включающая внешний двухслойный эктодерм (Ес), мезодерм (М), содержащий капилляры (стрелки) и разбросанные клетки адвентициальной оболочки, и однослойный эндодерм
(Еn)(400х). Фиг. 1Е представляет собой полученную с помощью электронного микроскопа (3500х) фотографию, на которой показана типичная капиллярная структура с тонкостеночными эндотелиальными клетками
(острие стрелок) и связанным с ними перицитом.
Фиг. 2А, 2В, 2С и 2D представляют собой серию цифровых образов четырех различных неокрашенных хорионалантоисных мембран, полученных после 48-часового воздействия таксола.
Фиг. 3А, 3В и 3С представляют собой серию фотографий разрезов толщиной 0,5 мм, полученных от обработанных хорионалантоисных мембран в трех различных местах в пределах содержащей сосуды зоны.
Фиг. 4А, 4В и 4С представляют собой серию полученных на электронном микроскопе микрофотографий мест, близких к тем, которые показаны выше на фиг. 3А, 3В и 3С (соответственно).
Фиг. 5 представляет собой гистограмму, на которой приведено числовое распределение размеров микросфер (5% ELVAX с 10 мг сурамина натрия в 5% поливиниловом спирте).
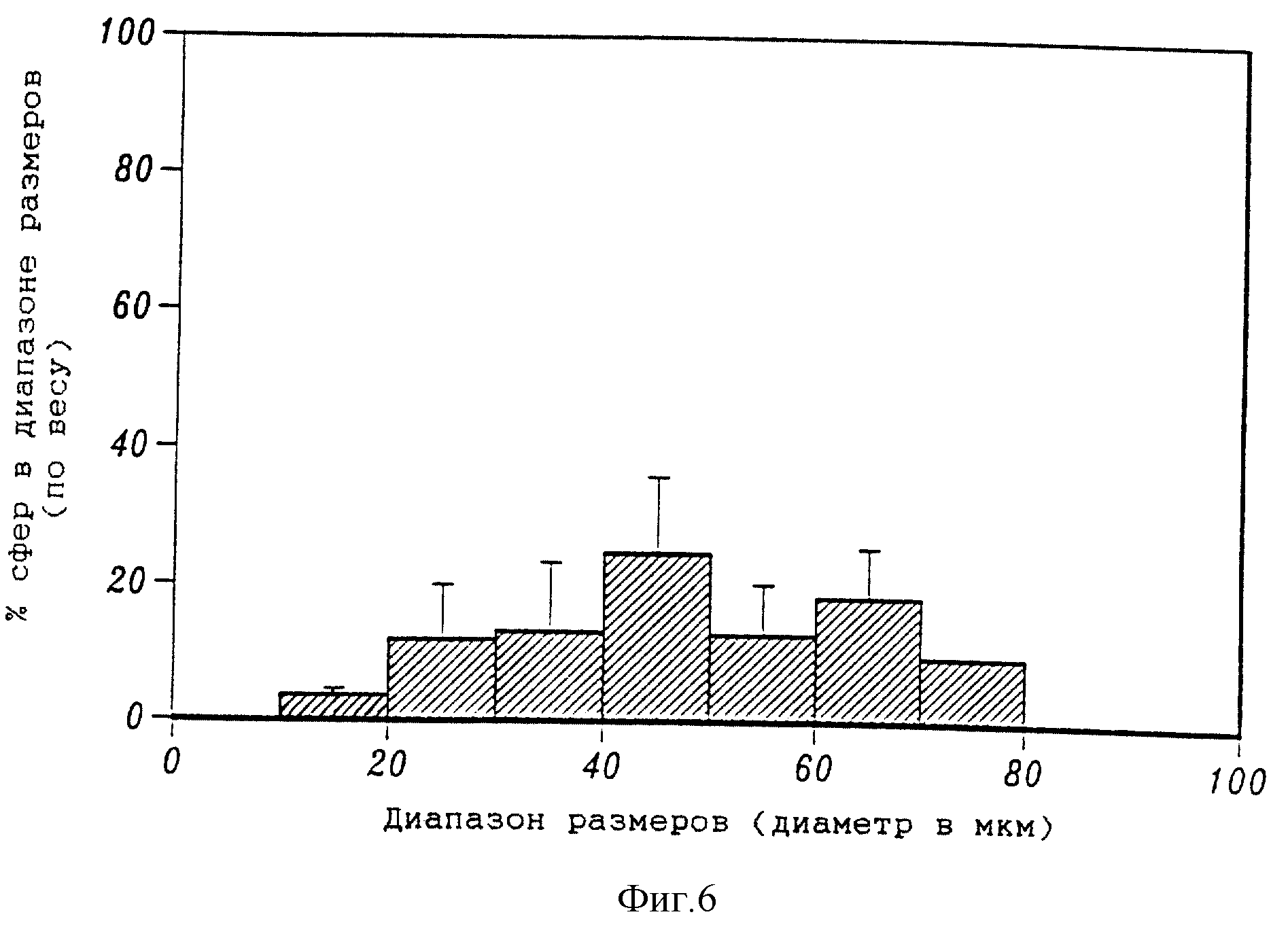
Фиг. 6 представляет собой гистограмму, на которой приведено весовое распределение размеров микросфер (5% ELVAX с 10 мг сурамина натрия в 5%-ном поливиниловом спирте).
На фиг. 7 приведен график, на котором показан вес инкапсулированного сурамина натрия в 1 мл 5%-ного ELVAX.
На фиг. 8 приведен график, на котором указан процент инкапсулированного сурамина натрия в ELVAX.
На фиг. 9 приведена гистограмма распределения размеров 5%-ных микросфер ELVAX, содержащих 10 мг сурамина натрия в 5%-ном поливиниловом спирте, включающем 10% NaCl.
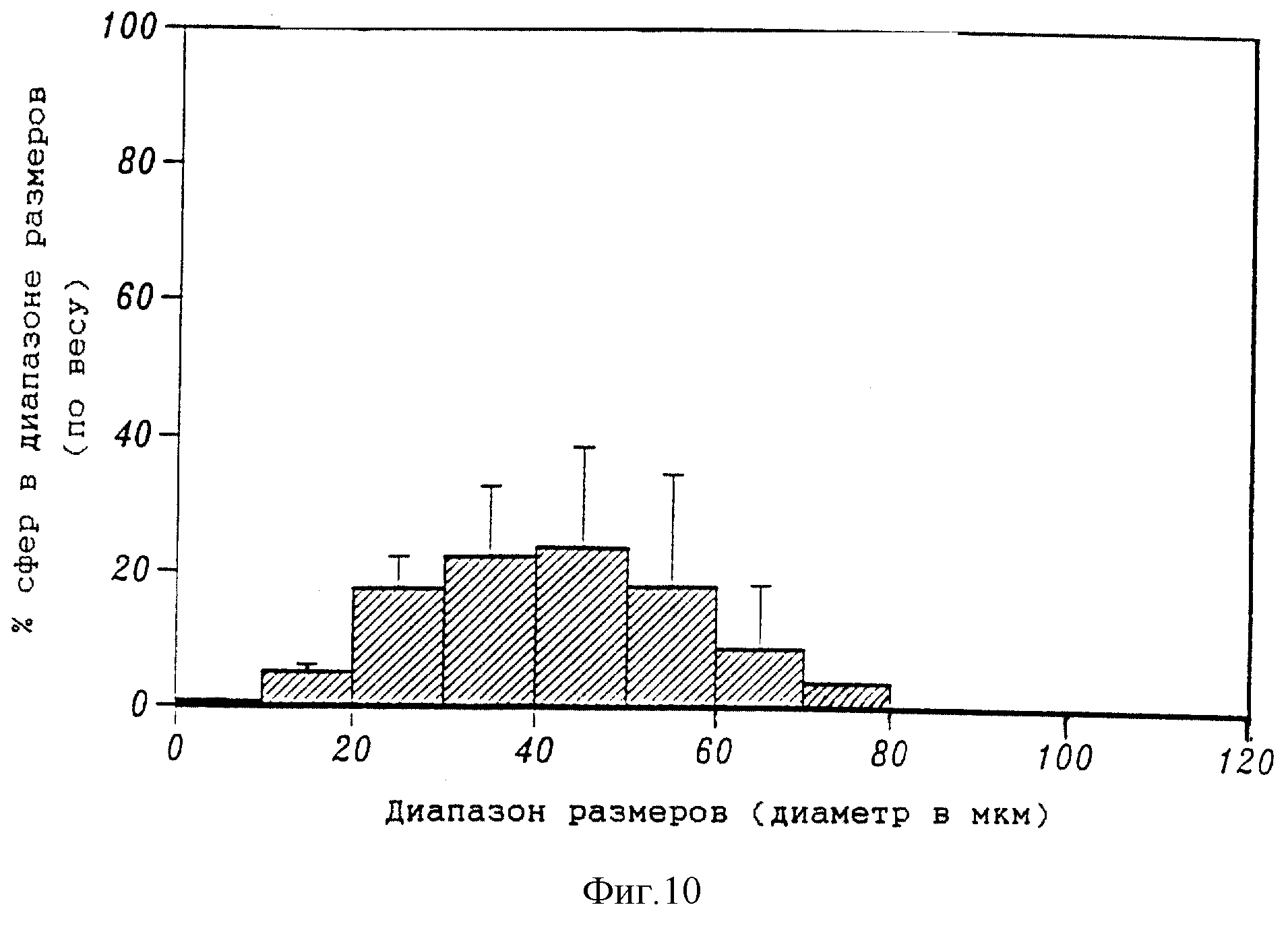
На фиг. 10 приведена гистограмма весового распределения размеров 5%-ных микросфер PLL, содержащих 10 мг сурамина натрия в 5%-ном поливиниловом спирте, включающем 10% NaCl.
На фиг. 11 приведена гистограмма числового распределения размеров 5%-ных микросфер PLL, содержащих 10 мг сурамина натрия в 5%-ном поливиниловом спирте, включающем 10% NaCl.
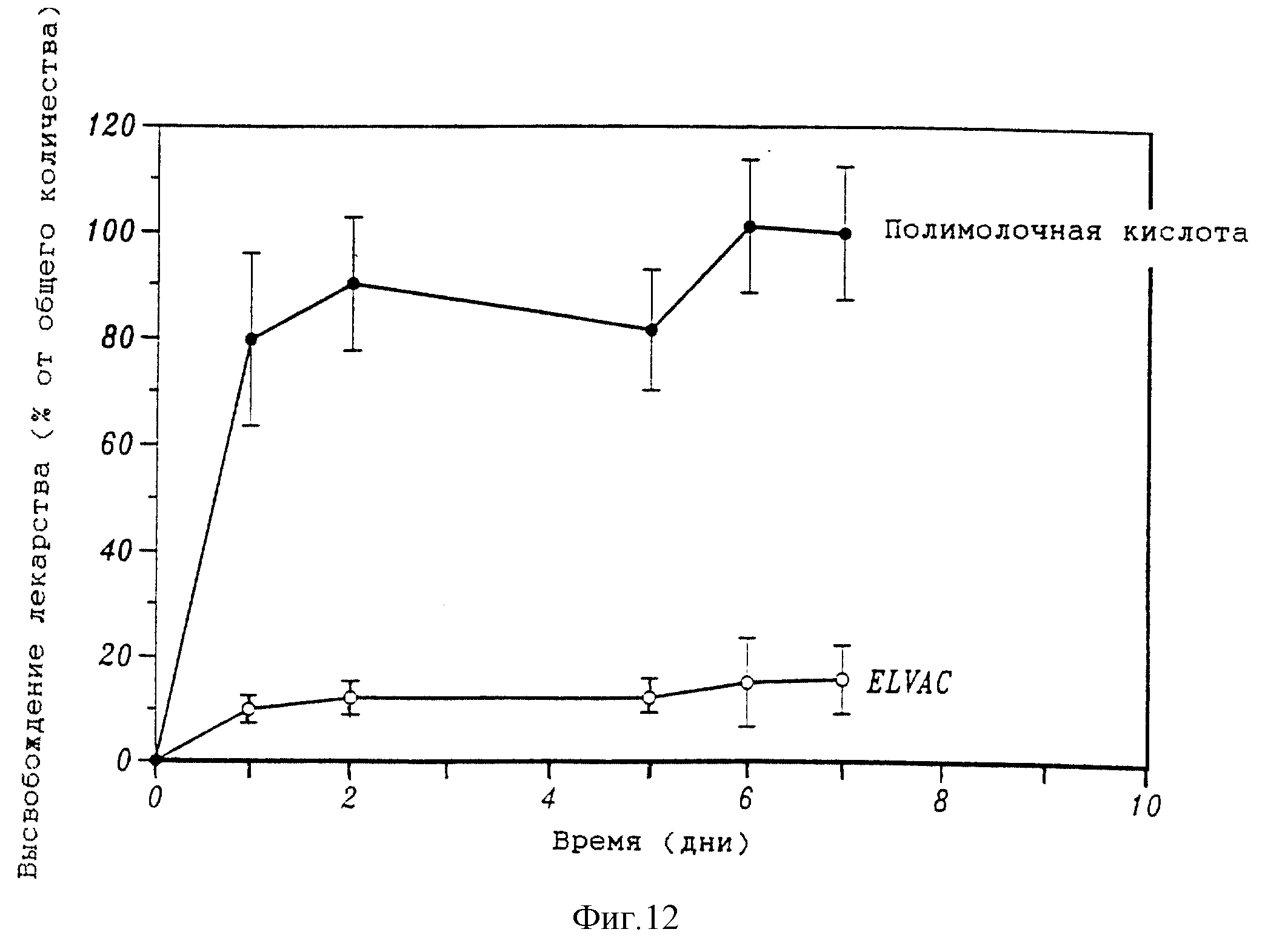
Фиг. 12 представляет собой график, который показывает количество высвобожденного сурамина натрия в зависимости от времени.
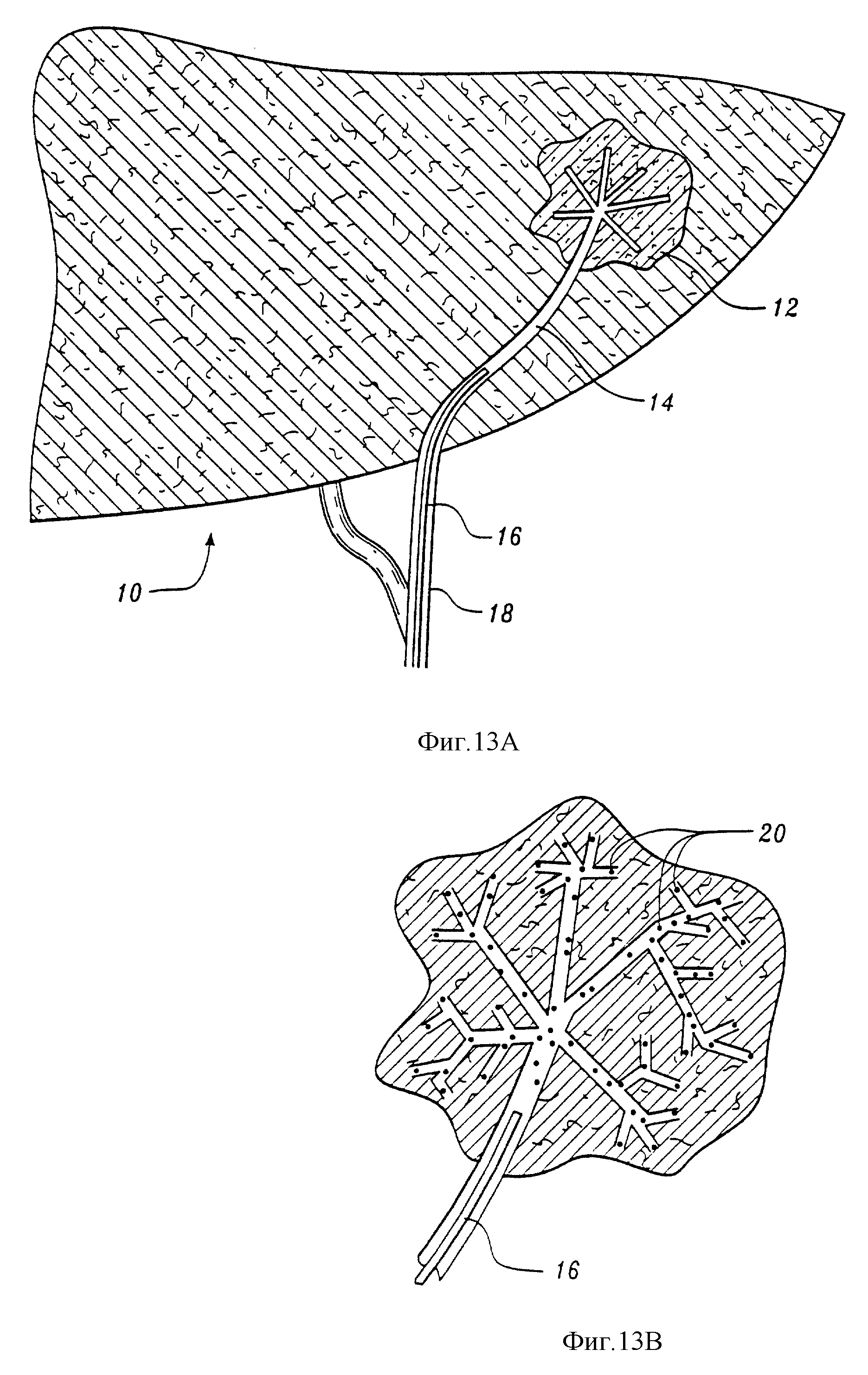
На фиг. 13 приведен пример эмболизации опухоли печени. Фиг. 14 показывает выборочный пример размещения стента, покрытого композицией, подавляющей развитие кровеносных сосудов, по настоящему изобретению.
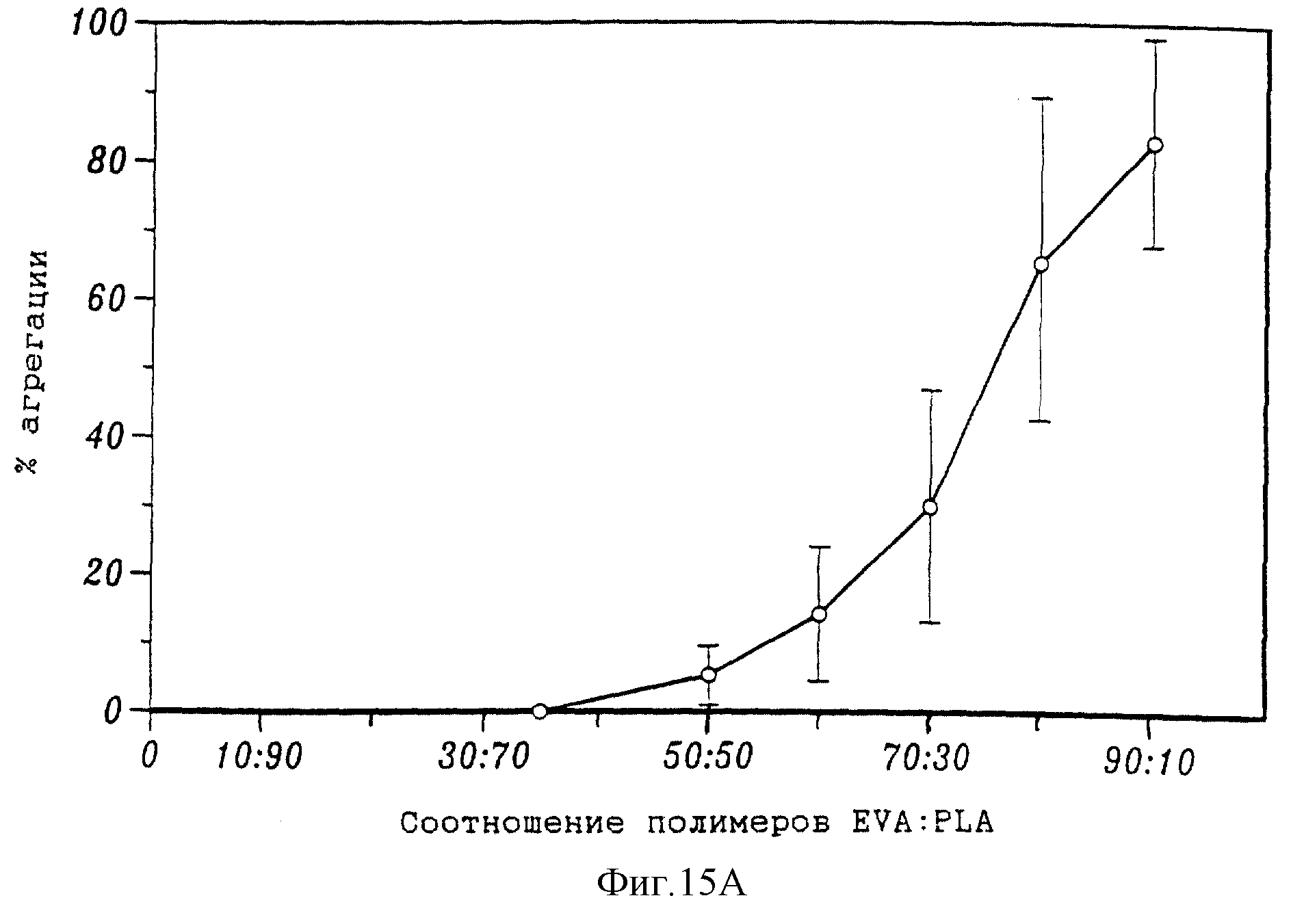
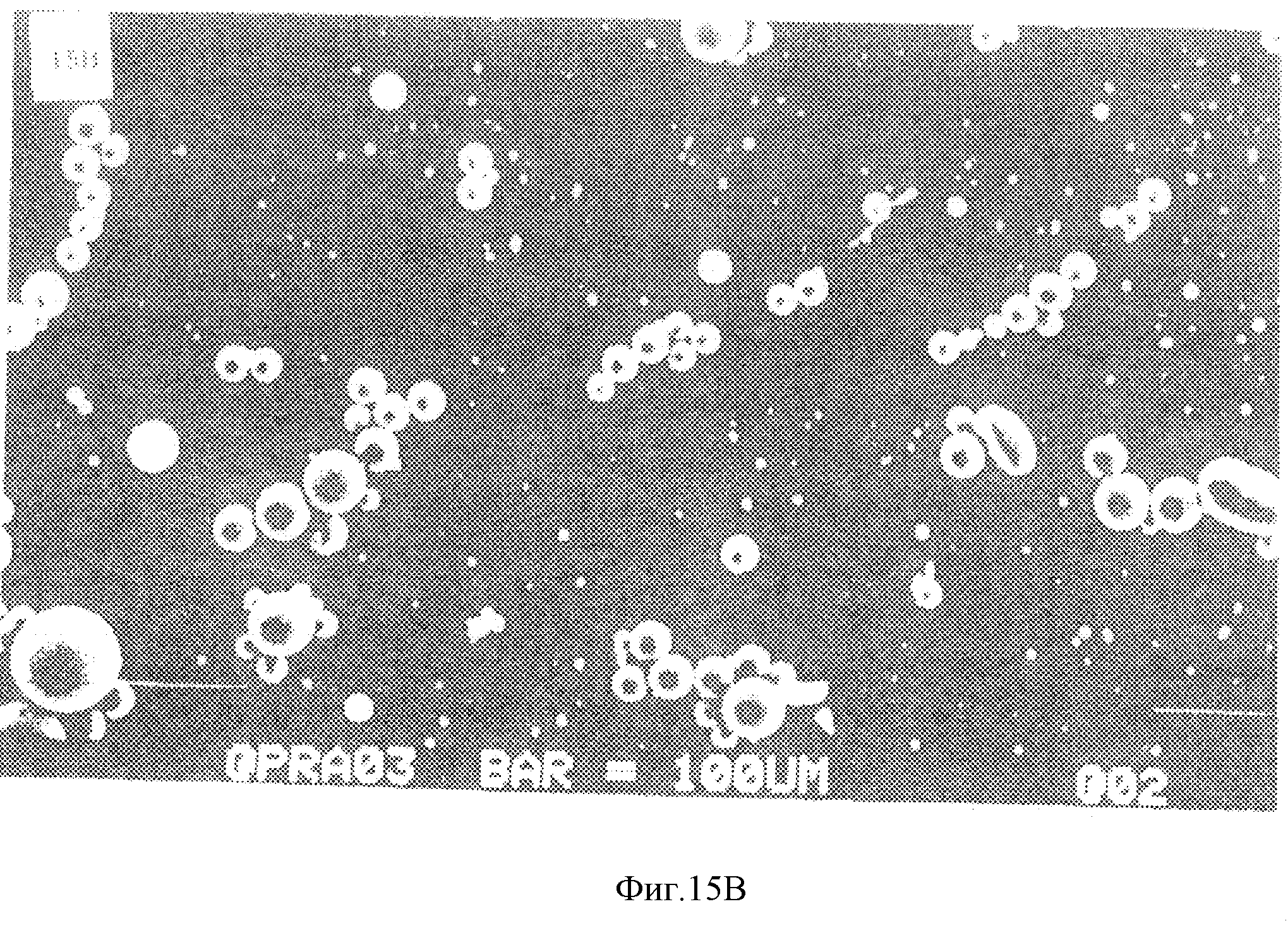
На фиг. 15А приведен график, показывающий влияние отношения сополимер этилена и винилацетата: поли-1-молочная кислота в смеси полимеров на агрегацию микросфер. На фиг. 15В приведена микрофотография, полученная с помощью сканирующего электронного микроскопа, которая показывает размер "маленьких" микросфер. На фиг. 15С приведена микрофотография, полученная с помощью сканирующего электронного микроскопа, которая показывает размер "больших" микросфер. На фиг. 15D приведен график, который показывает выделение таксола с течением времени из сфер, изготовленных из полимерной смеси 50:50 сополимер этилена и винилацетата: поли-1-молочная кислота и наполненных 0,6%-ным (вес/об) раствором таксола, в забуференный фосфатом солевой физиологический раствор (рН 7,4) при температуре 37oС. Незакрашенные кружки соответствуют микросферам "маленького" размера, а закрашенные кружки соответствуют микросферам "большого" размера. На фиг. 15Е приведена фотография хорионалантоисной мембраны, которая показывает результаты высвобождения таксола микросферами ("MS"). Фиг. 15F соответствует фиг. 15Е при большем увеличении.
На фиг. 16 приведен график, показывающий профили высвобождения таксола из поликапролактоновых (PCL) микросфер, содержащих 1%, 2%, 5% или 10% таксола, в забуференный фосфатом солевой физиологический раствор при температуре 37oС. На фиг. 16В представлена фотография, на которой показана хорионалантоисная мембрана, обработанная контрольными микросферами. На фиг. 16С представлена фотография, на которой показана хорионалантоисная мембрана, обработанная микросферами, наполненными 5%-ным таксолом.
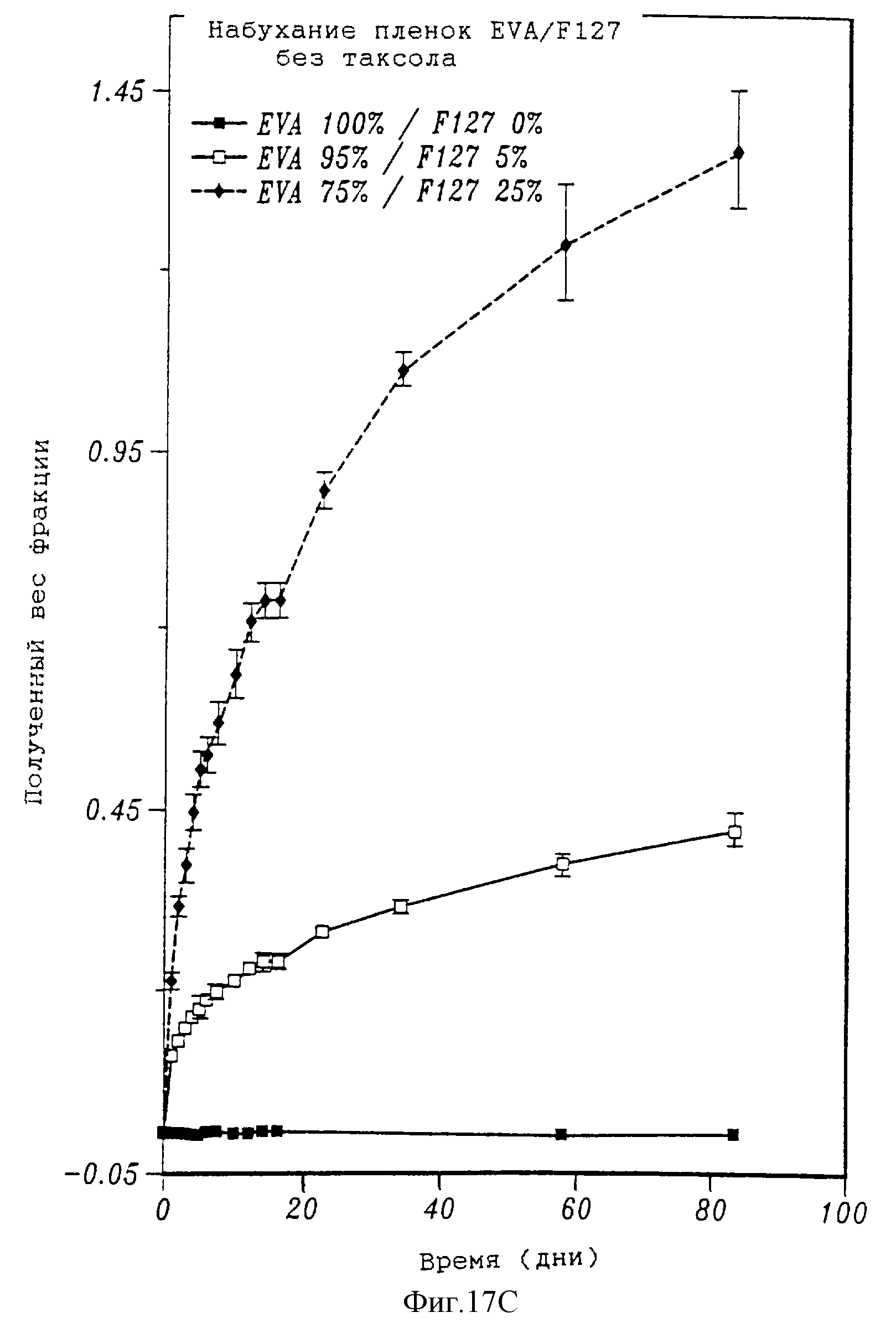
На фиг. 17А и 17В, соответственно, представлены два графика, на которых показано высвобождение таксола из пленок сополимера этилена и винилацетата (EVA) и процент таксола, остающегося в тех же пленках с течением времени. На фиг. 17С показано набухание пленок EVA/F127, не содержащих таксол, с течением времени, на фиг. 17D показано набухание пленок EVA /Span 80, не содержащих таксол, с течением времени. На фиг. 17Е приведена зависимость напряжения от деформации в различных смесях EVA/F127.
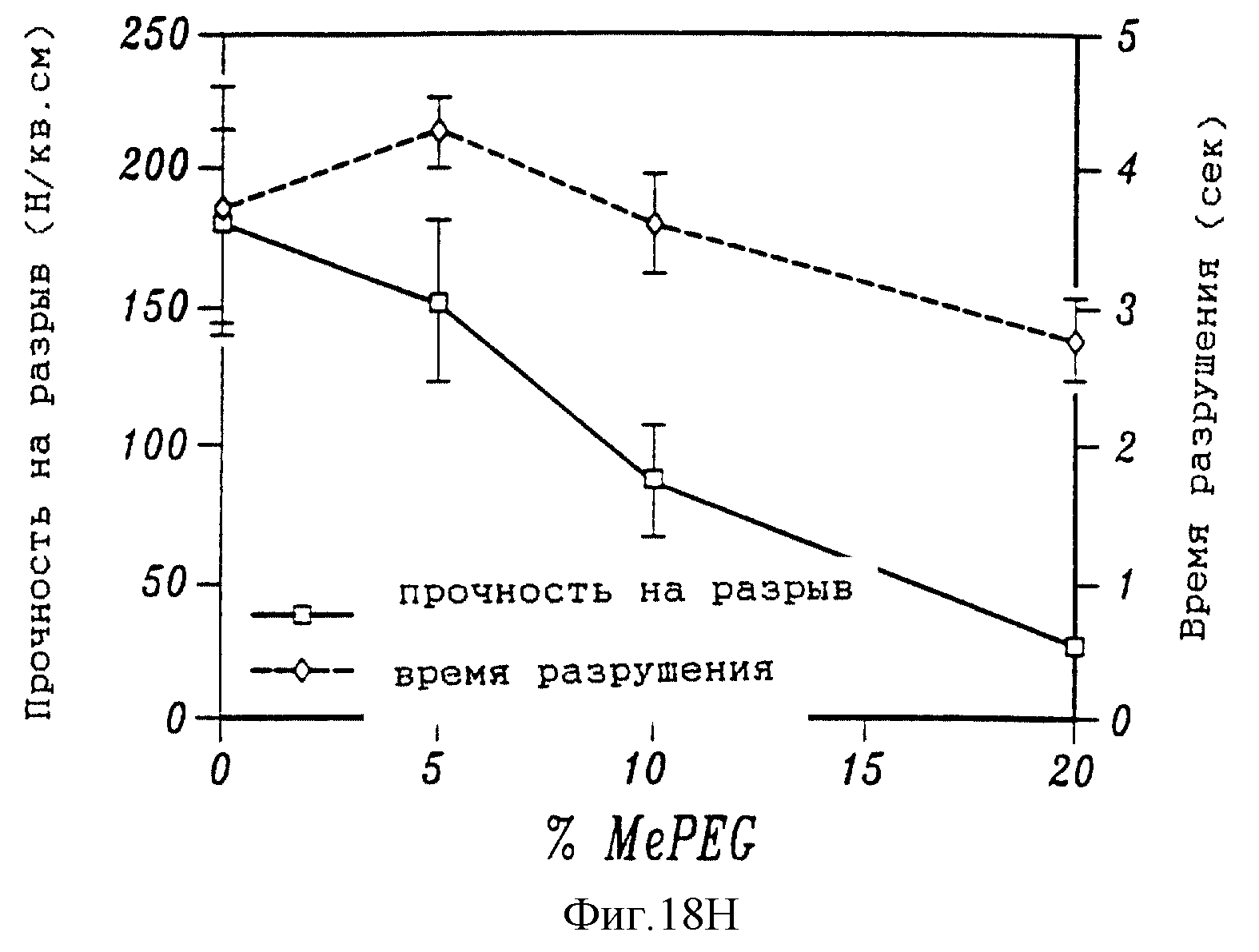
На фиг. 18А и 18В приведена зависимость точки плавления полимерных смесей PCL/MePEG в зависимости от процентного содержания (18А) и процент увеличения времени, необходимого, чтобы паста PCL начала затвердевать при температуре 60oС в зависимости от количества MePEG (18B). На фиг. 18С показана хрупкость различных полимерных смесей PCL/MePEG. На фиг. 18D приведен график, показывающий изменение веса, выраженное в процентах, с течением времени для полимерных смесей с различным содержанием MePEG. На фиг. 18Е представлен график, показывающий скорость высвобождения таксола с течением времени из различных полимерных смесей, нагруженных 1% таксола. Графики на фиг. 18F и 18G показывают влияние различного содержания таксола на общее количество таксола, высвобождаемого из смеси 20% MePEG/PCL. График, приведенный на фиг. 18Н, показывает влияние MePEG на прочность полимеров MePEG/PCL при пластической деформации.
На фиг. 19А приведена фотография контрольной термопасты (не нагруженной) на хорионалантоисной мембране. На фиг. 19В приведена фотография термопасты, содержащей 20% таксола, на хорионалантоисной мембране.
Фиг. 20А и 20В показывают две фотографии хорионалантоисной мембраны, содержащей опухоль, обработанную контрольной (ненагруженной) термопастой. Фиг. 20С и 20D показывают две фотографии хорионалантоисной мембраны, содержащей опухоль, обработанную нагруженной таксолом термопастой.
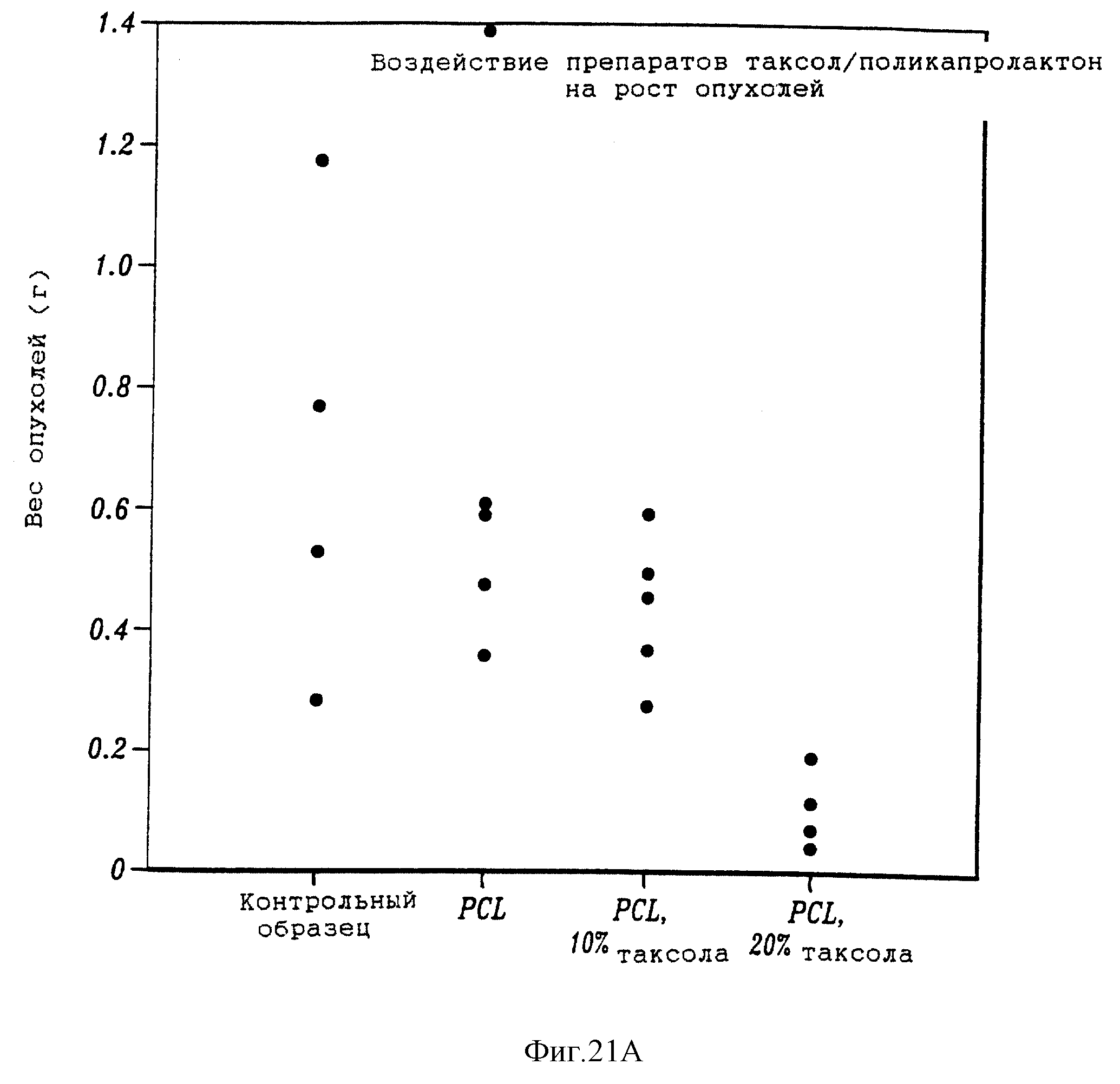
График на фиг. 21А показывает влияние таксола на поликапролактоне на рост опухоли. На фиг. 21В и 21С приведены две фотографии, показывающие влияние контрольной термопасты и термопасты, содержащей 10% и 20% таксола, на рост опухоли.
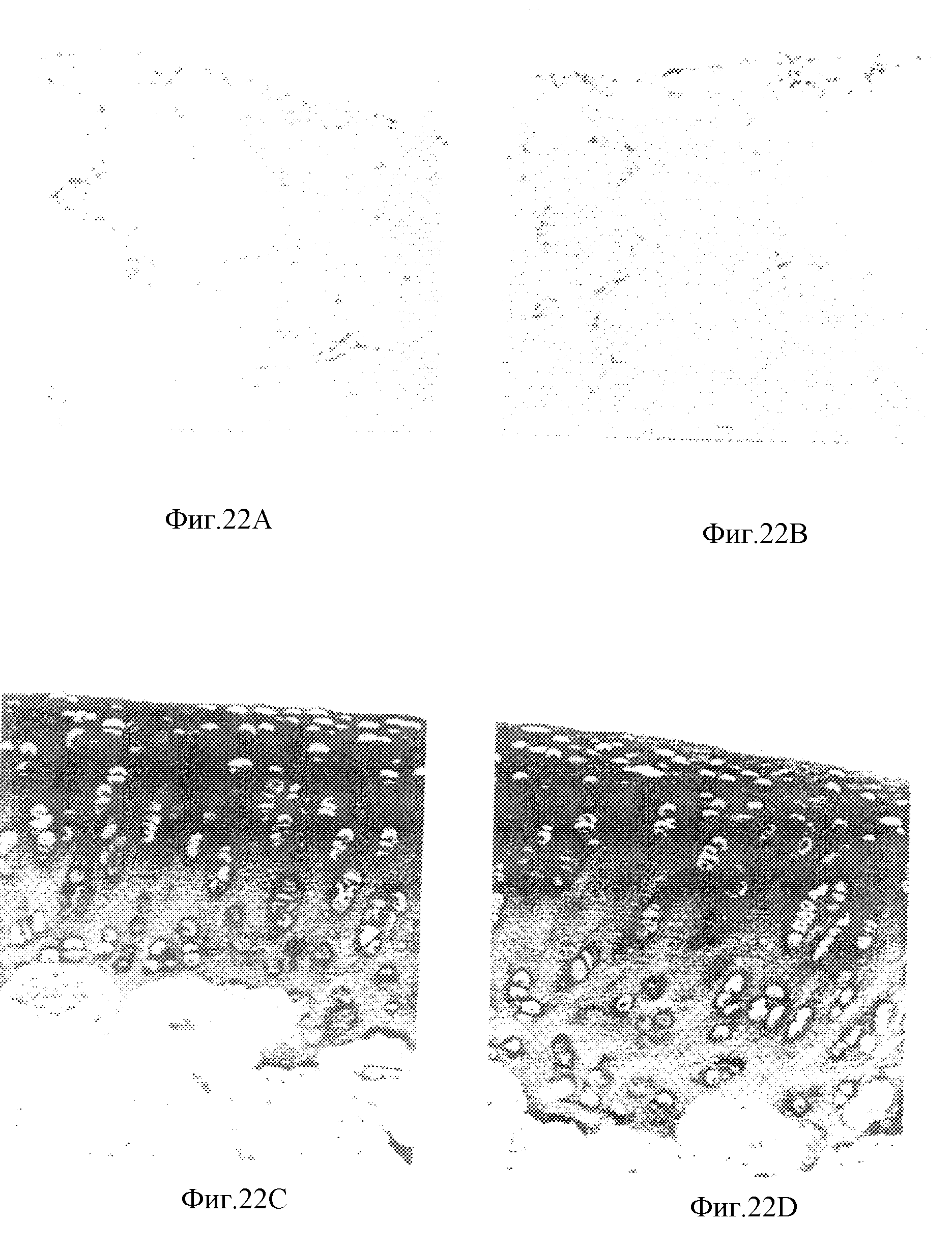
На фиг. 22А представлена фотография синовиальной мембраны из сустава после инъекции забуференного фосфатом солевого раствора. На фиг. 22В представлена фотография синовиальной мембраны из сустава после инъекции микросфер. На фиг. 22С представлена фотография хряща из сустава после инъекции забуференного фосфатом солевого раствора, а на фиг. 22D представлена фотография хряща из сустава после инъекции микросфер.
Подробное описание изобретения
Как
указано ранее, в настоящем изобретении заявляются стенты для расширения просвета расположенного внутри тела канала, покрытые композицией, в которой используются факторы, подавляющие развитие
кровеносных сосудов, в частности таксол или его аналоги, или его производные, т.е. действие которых приводит к ингибированию роста сосудов. Существует множество простых способов определения
подавляющей развитие кровеносных сосудов активности данного фактора, в том, числе, например, анализы с хорионалантоисной мембраной ("САМ") цыплят, как показано ниже, в Примерах 2А и 2С, удаляют
оболочку у свежеоплодотворенных куриных яиц и на мембрану помещают диск из метилцеллюлозы, содержащий образец фактора, подавляющего развитие кровеносных сосудов. Через несколько дней (в частности,
через 48 час) ингибирование роста сосудов под действием испытуемого образца может быть легко замечено путем визуального изучения хорионалантоисной мембраны в области, окружающей диск из
метилцеллюлозы. Ингибирование роста сосудов можно также оценить количественно, например, определяя количество и размер кровеносных сосудов, окружающих диск из метилцеллюлозы, по сравнению с
контрольным диском из метилцеллюлозы. Наиболее предпочтительные факторы, подавляющие развитие кровеносных сосудов, пригодные для использования по настоящему изобретению, полностью подавляют
образование новых кровеносных сосудов в указанном выше анализе.
Кроме того, может быть использовано множество способов определения в условиях in vivo эффективности факторов, подавляющих развитие кровеносных сосудов, в том числе, например, в мышиных моделях, которые были разработаны с этой целью (см. Robertson et al.. Cancer. Res. 51:1339-1344, 1991). Кроме того, множество примеров анализов в условиях in vivo, относящихся к описываемым различным аспектам настоящего изобретения, более подробно рассматривается далее в Примерах.
Как указано ранее, в настоящем изобретении заявляются стенты для расширения просвета расположенного внутри тела канала, покрытые композицией, содержащей фактор, подавляющий развитие кровеносных сосудов, и полимерный носитель. Если коротко, то в соответствии с настоящим изобретением может использоваться множество факторов, подавляющих развитие кровеносных сосудов. Отдельные примеры включают таксол, его аналоги или его производные.
Эти факторы, подавляющие развитие кровеносных сосудов, будут подробнее рассмотрены далее.
Таксол представляет собой содержащий большое количество заместителей дитерпеноид (Wani et al., J. Am. Chem. Soc., 93: 2325, 1971), который получают после сбора и высушивания коры Taxus brevifolia (тиса тихоокеанского) и из Taxomyces Andreanae и Endophytic Fungus. (Stierle et al., Science 60: 214-216, 1993). В общем случае действие таксола приводит к стабилизации микротрубчатой структуры сосудов за счет присоединения тубулина с образованием ненормальных митотических веретен. "Таксол" (в контексте настоящего изобретения следует понимать, что этот термин включает аналоги и производные таксола, такие как, например, баккатин и таксотер), может быть легко получен с использованием методов, известных специалистам в данной области техники (см. также международные заявки WO 94/07882, WO 94/07881, WO 94/07880, WO 94/07876, WO 93/23555, WO 93/10076, Патенты США с номерами 5294637, 5283253, 5279949, 5274137, 5202448, 5200534 и Европейскую патентную заявку 590267), или от различных промышленных источников, в том числе, например, компании "Sigma Chemical Со. " (Сент-Луис, штат Миссури) (Т7402 - из Taxus brevifolia).
Композиции, используемые в настоящем изобретении, подавляющие развитие кровеносных сосудов, помимо фактора, ингибирующего развитие кровеносных сосудов, и полимерного носителя, могут дополнительно включать широкий круг соединений. Например, композиции, подавляющие развитие кровеносных сосудов, по настоящему изобретению в некоторых вариантах его осуществления могут также содержать один или большее количество антибиотиков, противовоспалительных средств, антивирусных средств, противогрибковых средств и/или средств, убивающих простейших. Отдельными примерами антибиотиков, которые включаются в приведенные в настоящем описании композиции, являются: пенициллины; цефаллоспорины, такие как цефадроксил, цефазолин, цефаклор; аминогликозиды, такие как гентамицин и тобрамицин; сульфонамиды, такие как сульфаметоксазол; и метронидазол. Отдельными примерами противовоспалительных средств являются: стероиды, такие как преднизон, преднизолон, гидрокортизон, адрено-кортикотропный гормон и сульфазалазин; и нестероидные противовоспалительные средства, такие как аспирин, ибупрофен, напроксен, фенопрофен, индометацин и фенилбутазон. Отдельными примерами антивирусных средств являются ацикловир, ганцикловир, зидовудин. Отдельными примерами противогрибковых средств являются нистатин, кетоконазол, гризеофульвин, флуцитозин, миконазол, клотримазол. Отдельными примерами средств, убивающих простейших, являются изетионат пентамидина, хинин, хлорхинин и мефлохин.
Композиции, используемые в настоящем изобретении, подавляющие развитие кровеносных сосудов, могут также содержать один или несколько гормонов, таких как гормон щитовидной железы, эстроген, прогестерон, кортизон и/или ростовой гормон, другие биологически активные молекулы, такие как инсулин, а также такие как цитокины ТH1 (в частности, интерлейкины -2, -12 и -15, гамма-интерферон) или ТH2 (в частности, интерлейкины -4 и -10).
Композиции, используемые в настоящем изобретении, подавляющие развитие кровеносных сосудов, могут также включать дополнительные ингредиенты, такие как поверхностно-активные вещества (как гидрофильные, так и гидрофобные; см. Пример 13), противоопухолевые или химиотерапевтические средства (в частности, 5-фторурацил, винбластин, доксирубицин, адриамицин или рамоцифен), радиоактивные средства (в частности, Cu-64, Ga-67, Ga-68, Zr-89, Ru-97, Tc-99m, Rh-105, Pd-109, In-111,1-123, 1-125, 1-131, Re-186, Re-188, Au-198, Au-199, Pb-203, At-211, Pb-212 и Bi-212) или токсины (в частности, рицин, абрин, токсин дифтерии, холерный токсин, гедонин, антивирусный белок филолакки американской, тритин, токсин Shigella и экзотоксин A Pseudomonas).
Помимо факторов, подавляющих развитие кровеносных сосудов, и других соединений, рассмотренных выше, композиции, используемые в настоящем изобретении, подавляющие развитие кровеносных сосудов, могут включать самые разнообразные полимерные носители, в том числе, например, как биоразлагаемые, так и небиоразлагаемые соединения. Отдельными примерами биоразлагаемых композиций являются альбумин, желатин, крахмал, целлюлоза, декстраны, полисахариды, фибриноген, поли((1,1-лактид), пoли(d, l-лaктид-гликoлид), поли(гликолид), поли(гидроксибутират), поли(алкилкарбонат) и поли(ортоэфиры) (см. L. Illium, S.S. Davids (eds.) "Polymers in Controlled Drug Delivery", Wright, Bristol, 1987; J. Arshady, J. Controlled Release 17: 1-22, 1991; Pitt, Int. J. Phar. 59: 173-196, 1990; Holland et al., J. Controlled Release 4: 155-180, 1986). Отдельными примерами небиоразлагаемых полимеров являются сополимеры этилена и винилацетата, кремнийорганические каучуки и поли(метилметакрилат). Наиболее предпочтительными полимерными носителями являются сополимеры этилена и винилацетата (в частности, ELVAX 40, поли(этилен-винилацетат), сшитый 40%-ами винилацетата; "DuPont. "), поли(молочная кислота-гликолевая кислота), поликапролактон, полимолочная кислота, сополимеры этилена и винилацетата, сшитые 40% винилацетата и полимолочной кислоты, сополимеры полимолочной кислоты и поликапролактона.
Полимерным носителям можно придать разнообразную форму, в том числе, например, форму наносфер или микросфер, форму стержней, таблеток, полосок или капсул (см. , в частности, Goodell et al, Am. J. Hosp. Pharm. 43:1454-1461, 1986; Langer et. al, "Controlled Release of macromolecules from polymers", in: "Biomedical polymers, Polymeric materials and pharmaceuticals for biomedical use", E.P. Goldberg, A. Nakagim (eds.), Academic Press, pp. 113-137, 1980; Rhine et al, J. Pharm. Sci. 69: 265-270, 1980; Brown et al., J. Pharm. Sci. 72: 1181-1185, 1983; и Bawa et al., J. Controlled Release 1: 259-267, 1985).
Композиции, используемые в настоящем изобретении, подавляющие развитие кровеносных сосудов и содержащие один или несколько факторов, подавляющих развитие кровеносных сосудов, и полимерный носитель, преимущественно изготавливают в форме, удобной для конкретного использования. В соответствии с предпочтительными вариантами осуществления настоящего изобретения композиции, подавляющие развитие кровеносных сосудов, должны быть биоразлагаемыми и высвобождать один или несколько факторов, подавляющих развитие кровеносных сосудов, с течением времени от нескольких недель до нескольких месяцев. Далее, композиции, подавляющие развитие кровеносных сосудов, преимущественно должны быть устойчивы в течение нескольких месяцев и их можно было бы получать и хранить в стерильных условиях. В соответствии с некоторыми аспектами настоящего изобретения композиции, подавляющие развитие кровеносных сосудов, могут быть изготовлены в виде частиц любого размера, начиная от наносфер и кончая микросферами (в частности, от 0,1 мкм до 500 мкм), в зависимости от конкретного использования.
Композиции, подавляющие развитие кровеносных сосудов, могут быть также приготовлены, в соответствии с настоящим описанием, для различных применений. Наночастицы (которые называют также "наносферами") могут быть получены с широким диапазоном размеров, включая, например, наночастицы с размерами от 0,1 до 3 мкм, от 10 до 30 мкм и от 30 до 100 мкм (см. Пример 8).
Композиции, используемые в настоящем изобретении, подавляющие развитие кровеносных сосудов, могут быть также приготовлены в форме разнообразных "паст" или гелей. Например, композиции, используемые в данном изобретении, подавляющие развитие кровеносных сосудов, могут представлять собой жидкость при одной температуре (в частности, при температуре выше 37oС, такой как 40oС, 45oС, 50oС, 55oС или 60oС) и становиться твердыми или полутвердыми при другой температуре (в частности, при обычной температуре тела или при температуре менее 37oС). Подобные "термопасты" могут быть легко получены в соответствии с настоящим описанием (см., в частности, Примеры 10 и 14).
В соответствии с настоящим изобретением, композиции, используемые в настоящем изобретении, подавляющие развитие кровеносных сосудов, могут быть приготовлены в виде пленки, эти пленки обычно имеют толщину преимущественно менее 5, 4, 3, 2 или I мм, более предпочтительно толщину менее 500 мкм до 100 мкм. Указанные пленки являются преимущественно гибкими с хорошей прочностью на разрыв при пластической деформации (в частности, с величиной более 50, преимущественно более 100 и наиболее преимущественно более 150 или 200 Н/см2), хорошими адгезионными свойствами (т.е. обладают хорошей адгезией к влажным или сырым поверхностям) и обладают хорошей проникающей способностью, отдельные примеры подобных пленок приведены далее в Примерах (см., в частности, Пример 13).
Композиции, используемые в настоящем изобретении, подавляющие развитие кровеносных сосудов, являются нетоксичными, тромбогенными, должны быть непрозрачными для рентгеновских лучей, оказывать быстрое и длительное воздействие, быть стерильными и легко получаться в различной форме или различного размера в процессе использования. Далее, композиции преимущественно должны приводить к медленному (в идеале - в течение от нескольких недель до нескольких месяцев) высвобождению фактора, подавляющего развитие кровеносных сосудов.
Использование композиций, подавляющих развитие кровеносных сосудов, в качестве покрытий стентов
Как указано
ранее, в настоящем изобретении заявляются стенты, имеющие в общем случае трубчатую
структуру (которая охватывает, например, спиральную форму), поверхность которых покрыта описанной выше композицией.
Если коротко, то стент представляет собой распорку, обычно имеющую трубчатую форму, которую можно поместить в находящийся внутри тела проход (в частности, желчные протоки), суженный вследствие
протекания болезненного процесса (в частности, вследствие врастания опухоли), чтобы предотвратить закрытие или повторное закрытие прохода. Стент функционирует, физически удерживая открытыми стенки
прохода внутри тела, в который он помещен.
В соответствии с настоящим изобретением могут использоваться разнообразные стенты, включая, например, стенты пищевода, сосудистые стенты, стенты желчных протоков, стенты поджелудочной железы, стенты мочеточников и уретральные стенты, стенты слезных путей, стенты евстахиевой трубы, стенты фаллопиевой трубы и трахеально-бронхиальные стенты.
Стенты легко доступны из коммерческих источников или могут быть легко изготовлены по известным методикам. Отдельными примерами стентов являются стенты, описанные в патенте США 4776337, озаглавленном "Expandable Intraluminal Graft, and Method and Apparatus for Implanting and Expandable Intraluminal Graft", патенте США 5176626, озаглавленном "Indweling Stent", патенте США 5147370, озаглавленном "Nitinol Stent for Hollow Body Conduits", патенте США 5064435, озаглавленном "Self Expanding Prosthesis Having Stable Axial Length", патенте США 5052998, озаглавленном "Indwelling Stent and Method of Use", и патенте США 5041126, озаглавленном "Endovascular Stent and Delivery System", которые все приводятся здесь в качестве ссылок.
Стенты могут быть покрыты композициями, подавляющими развитие кровеносных сосудов, или факторами, подавляющими развитие кровеносных сосудов, с использованием различных способов, в том числе, например: (а) непосредственного нанесения на стент композиции, подавляющей развитие кровеносных сосудов (в частности, путем разбрызгивания на стент пленки полимер/лекарство или путем окунания стента в раствор полимер/лекарство), (b) покрытия стента веществом, таким как гидрогель, которое, в свою очередь, абсорбирует композицию, подавляющую развитие кровеносных сосудов (или вышеуказанного фактора, подавляющего развитие кровеносных сосудов), (с) вплетения нити (или самого полимера, сформированного в виде нити), покрытой композицией, подавляющей развитие кровеносных сосудов, в структуру стента, (d) размещения стента в муфте или петле, которая изготовлена или покрыта композицией, подавляющей развитие кровеносных сосудов, или (с) изготовления самого стента из композиции, подавляющей развитие кровеносных сосудов. В предпочтительных вариантах осуществления изобретения композиция должна надежно прикрепляться к стенту в процессе хранения и в процессе размещения стента и не должна отделяться от стента, когда диаметр стента изменяется при переходе от свернутого состояния в полностью развернутое состояние. Предпочтительные композиции, подавляющие развитие кровеносных сосудов, не должны деградировать в процессе хранения, перед размещением стента, или при нагревании до температуры тела после расширения внутри тела. Далее, она предпочтительно должна покрывать стент ровно и однородно, при этом ингибитор процесса развития кровеносных сосудов должен быть распределен равномерно, а стент не менял своих контуров. В соответствии с предпочтительными вариантами осуществления изобретения композиции, подавляющие развитие кровеносных сосудов, должны обеспечивать равномерное, поддающееся расчету и продолжительное высвобождение фактора, подавляющего развитие кровеносных сосудов, в окружающие стент ткани после его развертывания. Для сосудистых стентов, помимо вышеуказанных свойств, композиция не должна приводить к появлению у стента тромбогенных свойств (вызывать образование сгустков крови) или вызывать значительную турбулентность потока крови (большую, чем можно было бы ожидать при размещении непокрытого стента).
Заявляемые стенты используются для расширения просветов находящихся внутри тела каналов и протоков. Они предназначены для размещения в канале (протоке), при этом стент имеет в общем случае трубчатую структуру, поверхность которой покрыта композицией, подавляющей развитие кровеносных сосудов (или одним лишь фактором, подавляющим развитие кровеносных сосудов), так что канал расширяется. Ниже приведены различные варианты использования стентов согласно настоящему изобретению, в соответствии с которыми просвет находящегося внутри тела канала расширяют, чтобы устранить закупорку желчных протоков, пищевода, трахеально-бронхиальных каналов, мочеточников или сосудов, кроме того, отдельный пример более подробно рассматривается в Примере 7.
Обычно стенты размещаются аналогичным образом независимо от места и болезни, лечение которой проводится. Если коротко, то, с целью определить подходящее место размещения стента, вначале проводят обследование, обычно методами получения диагностического образа, эндоскопии или непосредственным визуальным наблюдением в процессе проведения операции. Направляющий шнур затем вставляют в разрез или в предполагаемое место размещения стента, а по нему перемещают специальный катетер, который позволяет вставлять стент в его сжатом виде. Обычно стенты можно сжать так, что их можно внести через мельчайшие полости с помощью маленьких катетеров, а после того, как они попадают в нужное место, они расширяются до большего диаметра. Расширившись, стент физически препятствует смыканию стенок прохода и заставляет его быть открытым. Таким образом, стенты можно вставлять через маленькие отверстия, но они способны держать открытыми полости или каналы большого диаметра. Стент может быть саморасширяющимся (в частности, стеночный стент или стент Жиантурко), расширяться при надувании (в частности, стент Пальмаца и стент Штреккера) или имплантироваться при изменении температуры (в частности, стент из нитинола).
Маневры по перемещению стента обычно проводят под радиологическим или визуальным контролем, принимая все меры предосторожности к тому, чтобы разместить стент точно поперек сужения в органе, лечение которого проводится. Направляющий катетер затем удаляют, оставляя стент в качестве подпорки. Для подтверждения правильности размещения обычно чаще используют рентгеноскопию.
Одним из вариантов воплощения изобретения является стент для предотвращения. При этом стент имеет в общем случае трубчатую структуру, поверхность которой покрыта вышеуказанной композицией, так что закупорка желчного протока устраняется. Если коротко, то разрастание опухоли обычного желчного протока приводит к прогрессирующей холестатической желтухе, которая несовместима с жизнью. Обычно желчная система, которая перемещает желчь из печени в двенадцатиперстную кишку наиболее часто закупоривается (1) опухолью, составленной клетками желчного прохода (холангиокарцинома), (2) опухолью, которая вторгается в желчный проток (в частности, при раке поджелудочной железы) или (3) опухолью, которая оказывает внешнее давление и сжимает желчный проток (в частности, увеличенные лимфатические узлы).
Как первичные опухоли печени, так и другие опухоли, вызывающие сжатие дерева желчных протоков, можно лечить с использованием стентов, приведенных в настоящем описании, одним из примеров первичных опухолей являются аденокарциномы (которые также называют опухолями Клатскина, если они обнаруживаются в разветвлении обычного протока печени). Указанные опухоли часто относят к раку печени, холедохолангиокарциномам или железистому раку желчной системы. Доброкачественные опухоли, которые оказывают воздействие на желчные протоки (в частности, аденома желчной системы) и в редких случаях плоскопленочный рак желчных протоков и аденокарциномы желчного пузыря также могут сжимать желчные протоки, а следовательно, привести к непроходимости желчи.
Сжатие дерева желчных протоков в первую очередь является следствием опухолей печени и поджелудочной железы, которые сжимают, а потому закупоривают протоки. Большинство опухолей поджелудочной железы возникает из клеток протоков поджелудочной железы. Эта форма рака характеризуется очень высокой смертностью (5% от всех смертей, вызванных раком; 26000 новых случаев в США ежегодно), при этом среднее время жизни больных составляет 6 месяцев, а до одного года доживает лишь 10% больных. Когда указанные опухоли располагаются в головке поджелудочной железы, они часто вызывают непроходимость желчи, что значительно ухудшает качество жизни пациентов. Хотя все типы опухолей поджелудочной железы обычно называют "раком поджелудочной железы", существуют ее гистологические подтипы, включающие: железистый рак, аденосквамозный рак, цистаденокарциному и рак гроздевидных клеток, опухоли печени, как указано ранее, также могут вызывать сжатие дерева желчных протоков и, следовательно, закупорку желчных протоков.
Стент желчного протока вначале помещают в желчный канал одним из следующих способов: с верхнего конца, вводя иглу через стенку брюшной полости и через печень (чрескожно-чреспеченочная холангиография); с нижнего конца путем каннелирования желчного протока с помощью эндоскопа, который вводят через рот, желудок или двенадцатиперстную кишку (эндоскопическая дегенеративная холангиография); или прямым рассечением при проведении хирургической операции. Обычно перед хирургической операцией проводят чрескожно-чреспеченочную холангиографию, эндоскопическую дегенеративную холангиографию или прямую визуализацию, с целью определения соответствующего участка для размещения стента. Затем через разрез вводят направляющий шнур, а через него пропускают катетер для доставки, который позволяет разместить стент в свернутой форме. Если при диагностике используют чрескожно-чреспеченочную холангиографию, то направляющий шнур и катетер помещают через стенку брюшной полости, а если первичные исследования проводят методом эндоскопической дегенеративной холангиографии, то стент вводят через рот. Затем стент размещают, проводя радиологический, эндоскопический или прямой визуальный контроль и принимая специальные меры для того, чтобы стент был размещен точно поперек сужения желчного протока. Катетер для доставки удаляют, и он оставляет стент в виде подпорки, которая удерживает проток открытым. С целью определить, что стент установлен правильно, проводят дальнейшую холангиографию.
В других вариантах осуществления настоящего изобретения предлагается стент для устранения непроходимости пищевода, который в общем случае имеет трубчатую структуру, а его поверхность покрыта вышеуказанной композицией, подавляющей развитие кровеносных сосудов, так что устраняется непроходимость пищевода. Если коротко, то пищевод представляет собой полую трубку, по которой транспортируется пища и жидкости изо рта в желудок. Рак пищевода или инвазия рака из соседних органов (в частности, рака желудка или рака легких) приводит к невозможности проглатывать пищу или слюну. В этом варианте осуществления изобретения перед введением стента необходимо провести предварительное исследование, обычно с помощью назначаемого внутрь соединения бария или методом эндоскопии, с целью определить нужное место размещения стента. Затем через рот вводят катетер или эндоскоп и через блокаду вводят направляющий шнур. Катетер для доставки стента перемещают по направляющему шнуру при радиологическом или эндоскопическом контроле, а стент размещают точно в месте сужения пищевода. Наблюдение после размещения стента, с целью подтверждения правильности установки, можно провести методом флюороскопии с использованием назначаемого внутрь соединения бария.
В других вариантах осуществления изобретения предлагаются стенты для устранения трахеально-бронхиальных закупорок, которые в общем случае имеют трубчатую структуру, а их поверхности покрыты вышеуказанной композицией, подавляющей развитие кровеносных сосудов, так что устраняется трахеалъно-бронхиальная закупорка. Если коротко, то трахея и бронхи представляют собой трубки, по которым воздух изо рта или носа подается в легкие. Блокирование трахеи раком, инвазией рака, возникающего в соседних органах (в частности, рака легких) или схлопывание трахеи или бронхов вследствие хондромаляции (размягчения хрящевой ткани) приводит к невозможности дышать. В этом варианте осуществления настоящего изобретения обычно проводят предварительное исследование методом эндоскопии, с целью определения подходящего места для размещения стента. Затем через рот вводят катетер или эндоскоп и через блокаду вводят направляющий шнур. Катетер для доставки стента перемещают по направляющему шнуру, чтобы ввести стент в сжатом состоянии. Стент размещают при радиологическом или эндоскопическом контроле, чтобы установить его точно поперек сужения, затем катетер для доставки извлекают и стент остается в виде подпорки. Наблюдение после размещения стента, с целью подтверждения правильности установки, можно провести методом бронхоскопии.
В другом варианте осуществления изобретения предлагаются стенты для устранения непроходимости мочеиспускательного канала, так называемые уретральные стенты, которые предназначены для размещения в мочеиспускательном канале, при этом стент в общем случае имеет трубчатую структуру, а его поверхность покрыта вышеуказанной композицией, подавляющей развитие кровеносных сосудов, так что устраняется закупорка мочеиспускательного канала. Если коротко, то мочеиспускательный канал представляет собой трубку, соединяющую мочевой пузырь с половым членом. Наружное сужение мочеиспускательного канала по пути его через предстательную железу, вызванное гипертрофией предстательной железы, наблюдается практически у всех мужчин в возрасте старше 60 лет и вызывает прогрессирующие затруднения в мочеиспускании. В этом варианте осуществления настоящего изобретения вначале обычно проводят предварительное исследование методом эндоскопии или уретрографии, с целью определения подходящего места для размещения стента, которое расположено выше внешнего сфинктера мочеиспускательного канала в нижнем конце и вблизи шейки мочевого пузыря в верхнем конце. Затем через отверстие полового члена вводят катетер или эндоскоп и продвигают направляющие в мочевой пузырь. Катетер для доставки стента перемещают по направляющим, чтобы установить стент, затем катетер для доставки извлекают и стент расширяется в месте его установки. Наблюдение после размещения стента, с целью подтверждения правильности его установки, можно провести методом эндоскопии или дегенеративной уретрографии.
В соответствии с другим вариантом осуществления настоящего изобретения заявляются стенты для устранения закупорки сосудов. Сосудистый стент предназначен для размещения в кровеносном сосуде, при этом стент в общем случае имеет трубчатую структуру, а его поверхность покрыта вышеуказанной композицией, подавляющей развитие кровеносных сосудов, так что устраняется закупорка сосуда. Если коротко, то стенты могут быть размещены в самых разнообразных кровяных сосудах, как артериях, так и венах, с целью предотвращения рецидивирующего стеноза в случае неудачных пластических операций на сосудах, при лечении сужений, которое вероятнее всего будет неудачным, если применить пластическую операцию, и при лечении послеоперационных сужений (в частности, диализного стеноза трансплантата). Отдельными примерами подходящих стентов являются подвздошный стент, почечный стент и стент коронарных артерий, стент верхней полой вены и диализный трансплантат. В одном из вариантов осуществления настоящего изобретения вначале проводят рентгеноангиографию, с целью локализации места установки стента. Практически это осуществляют путем инъекции непрозрачного для рентгеновских лучей контрастного материала, который вводят в артерию или вену с помощью катетера по мере проведения рентгеноскопии. Катетер можно ввести как чрескожно, так и хирургическим способом в бедренную артерию, плечевую артерию, бедренную вену или плечевую вену и продвинуть в соответствующий кровяной сосуд перемещением по сосудистой системе под контролем методом флюороскопии. Затем поперек сосудистого стеноза может быть размещен стент. Наблюдение после размещения стента, с целью подтверждения правильности его установки, можно провести методом ангиографии.
Следующие примеры приводятся для иллюстрации, а не для
ограничения настоящего изобретения.
ПРИМЕРЫ
Пример 1.
Анализ различных средств на ингибирующую активность по отношению к развитию кровеносных сосудов
А. Анализ хорионалантоисной мембраны цыплят
Оплодотворенные эмбрионы цыплят перед получением безоболочечной культуры выдерживают в инкубаторе в течение 3 дней. В соответствии с этой методикой
содержимое яиц высвобождают, удаляя оболочку, расположенную вокруг воздушного пространства. Мембрану внутренней оболочки отделяют и противоположный конец оболочки протыкают, чтобы содержимое яйца
могло осторожно вылиться из тупого конца. Содержимое яйца выливают в круглодонную стерильную стеклянную чашку и покрывают крышкой от чашки Петри. Помещают в инкубатор с относительной влажностью 90% и
с содержанием диоксида углерода 3% и выдерживают в течение 3 дней.
Таксол ("Sigma", Сент-Луис, штат Миссури) смешивают с концентрацией 1, 5, 10, 30 мг на 10 мл аликвоты 0,5%-ного водного раствора метилцеллюлозы. Поскольку таксол не растворяется в воде, для получения тонкодисперсных частиц используют стеклянные шарики. Аликвоты по 10 микролитров полученного раствора высушивают на пленке в течение 1 час с образованием дисков размером 2 мм в диаметре. Высушенные диски, содержащие таксол, осторожно помещают на растущий край каждого образца хорионалантоисной мембраны на 6-й день инкубации, контрольные образцы получают, помещая не содержащие таксол диски на хорионалантоисную мембрану на то же самое время. Через 2 дня экспонирования (8 дней инкубации) исследуют сосудистую систему с помощью стереомикроскопа. Липозин II в виде белого непрозрачного раствора вводят с помощью инъекции в хорионалантоисную мембрану, с целью визуализации деталей сосудов, сосудистая система неокрашенных живых эмбрионов визуализируют с помощью стереомикроскопа фирмы "Zeiss", который сопрягают с видеокамерой ("Dage-MTI Inc.", Мичиган-Сити, штат Иллинойс). Указанные сигналы передают на дисплей при увеличении в 160 раз и захватывают с помощью системы анализа образа ("Vidas, Rontron", Энкинг, Германия). Негативы образа затем получают с помощью графопостроителя (Модель 3000, "Matrix Instruments", Оранжбург, штат Нью-Йорк).
Мембраны восьмидневных безоболочечных эмбрионов питают 2%-ным глутаровым альдегидом в 0,1 М буферном растворе какодилата натрия; в хорионалантоисную мембрану вводят дополнительное количество комплементсвязывающего антитела. Через 10 минут in situ хорионалантоисную мембрану удаляют и на 2 час при комнатной температуре помещают в свежий раствор комплементсвязывающего антитела. Затем оставляют ткани промываться на ночь в какодилатном буфере, содержащем 6% сахарозы. Представляющие интерес области подвергают послефиксационной обработке в 1%-ном растворе тетроксида осмия в течение 1,5 час при температуре 4oС. Затем ткани обезвоживают последовательно этанолом, оксидом пропилена и внедряют в смолу Spurr. Полученные срезы разрезают алмазным лезвием, помещают на медную сетку, окрашивают и изучают с помощью электронного микроскопа 1200ЕХ фирмы "Jeol". Аналогично готовят срезы толщиной 0,5 мм и окрашивают их с помощью толуолового голубого для изучения методом оптической микроскопии.
На 11 день развития эмбрионы цыплят используют в методе коррозионного формообразования. Смолу Мегсох ("Ted Pella, Inc.", Реддинг, штат Калифорния) вводят в сосудистую систему хорионалантоисной мембраны с помощью гиподермической иглы номер 30. Материал для формообразования включает 2,5 г полимера Мегсох CL-2B и 0,05 г катализатора (55%-ная перекись бензоила), время полимеризации которого составляет 5 минут. После инъекции пластику позволяют дать усадку в течение 1 час при комнатной температуре, а затем в течение ночи при температуре 65oС. Хорионалантоисную мембрану помещают в 50%-ный водный раствор гидроксида натрия, чтобы переработать все органические компоненты. Пластиковые формы затем тщательно промывают дистиллированной водой, сушат на воздухе, покрывают золотом/палладием и исследуют с помощью электронного микроскопа 501В фирмы "Philips".
Результаты вышеописанных экспериментов приведены на фиг. 1-4. Если коротко, то основные характеристики нормальной культуры безоболочечного куриного яйца представлены на фиг. 1А. Через б дней выдерживания в инкубаторе эмбрионы располагается в центре по отношению к радиалъно распространяющейся сети кровеносных сосудов; хорионалантоисная мембрана развивается в непосредственной близости от эмбриона. Эти растущие сосуды находятся вблизи поверхности и легко различимы, что делает эту систему идеальной моделью для изучения процесса развития кровеносных сосудов. Живую неокрашенную сеть капилляров хорионалантоисной мембраны можно неинвазивно визуализировать с помощью стереомикроскопа. На фиг. 1В показана эта сосудистая область, в которой кровяные элементы клетки внутри капилляров регистрируют с использованием интерфейса монитор/компьютер. Трехмерная структура подобной капиллярной сети хорионалантоисной мембраны получена методом коррозионного формообразования и визуализована с помощью сканирующего электронного микроскопа (фиг. 1С). Это формование вскрывает нижележащие сосуды, которые простираются в сторону поверхности хорионалантоисной мембраны, где они образуют один слой анастомозных капилляров.
Поперечные сечения хорионалантоисной мембраны показывают внешний эктодерм, составленный двумя слоями клеток, более широкий слой мезодерма, содержащий капилляры, который примыкает к эктодерму, адвентициальную оболочку и внутренний одиночный слой, составленный клетками эндодерма (фиг. 1D). Электронная микроскопия позволяет увидеть типичные структурные детали капилляров хорионалантоисной мембраны. Обычно эти сосуды лежат в непосредственной близости от внутреннего слоя эктодерма (фиг. 1E).
Через 48 час воздействия концентрациями таксола, равными 1, 5, 10 или 30 мг, каждую хорионалантоисную мембрану исследуют в живых условиях с помощью стереомикроскопа, снабженного интерфейсом монитор/компьютер, с целью установить воздействие процесса развития кровеносных сосудов. Это приспособление для визуализации используют при увеличении в 160 раз, что позволяет непосредственно наблюдать клетки крови внутри капилляров; при этом можно легко обнаружить и зарегистрировать ток крови в представляющих интерес областях. В этом исследовании подавление развития кровеносных сосудов определяют как область хорионалантоисной мембраны, лишенную сети капилляров и составляющую 2-6 мм в диаметре. В ингибированных областях ток крови в сосудах отсутствует и они наблюдаются лишь в экспериментальных условиях с использованием метилцеллюлозы, содержащей таксол; в контрольных экспериментах с использованием дисков, не содержащие таксол, воздействие на развивающуюся капиллярную систему не наблюдается. Экспериментальные данные в зависимости от дозы таксола при различных концентрациях приведены в Таблице I. (см. в конце описания).
Типичные хорионалантоисные мембраны, обработанные таксолом (фиг. 2А и 2В), показаны вместе с прозрачным диском из метилцеллюлозы, расположенным в центре лишенной сосудов зоны с диаметром 6 мм. При несколько большем увеличении ясно видна периферия указанной лишенной сосудов области (фиг. 2С); окружающие функциональные сосуды часто меняют направление в сторону от источника таксола (фиг. 2С и 2D). Подобные углы направленного в новую сторону потока крови никогда не наблюдается в нормальных условиях. Другой особенностью воздействия таксола является образование островков крови в лишенной сосудов зоне, что указывает на агрегацию кровяных клеток.
Связанные с воздействием таксола морфологические изменения хорионалантоисной мембраны легко различимы как в оптическом, так и в электронном микроскопе. Для удобства рассмотрения приведены три отличительные фазы при общем переходе от нормального состояния до лишенного сосудов состояния. Вблизи периферии лишенной сосудов зоны в хорионалантоисной мембране отмечается избыток митотических клеток внутри всех трех слоев эмбриона (фиг. 3А и 4А). Это повышенное деление митотических клеток также устойчиво наблюдается для эндотелиальных клеток капилляров. Однако места соединения клеток эндотелия остаются незатронутыми и транссудация клеток крови не наблюдается. Последующая деградация хорионалантоисной мембраны характеризуется разрушением и растворением капилляров (фиг. 3В и 4В). Предположительно эндотелиальные клетки, обычно захваченные при митотическом делении, все еще сохраняют тесные пространственные связи с клетками крови и располагаются непосредственно рядом с эндодермом; однако эти клетки уже не соединяются между собой. Расположенная в самом центре часть лишенной кровеносных сосудов зоны характеризуется увеличенной толщиной эктодермального и эндодермального слоев (фиг. 3С и 4С). Хотя эти слои увеличили свою толщину, клеточные связи остались незатронутыми и слои сохраняют свою структурные особенности. Внутри мезодерма наблюдается множество разбросанных клеток, захваченных при митотическом делении; эти клетки не обладают поляризацией клеток эндотелия, которая наблюдалась в предыдущей фазе. По всей этой лишенной сосудов зоне располагаются деградирующие клетки, что отмечается наличием небольших полостей в тканях и клеточных остатков, непрозрачных при исследовании в электронном микроскопе (фиг. 4С).
Таким образом, это исследование показывает, что через 48 часов после нанесения таксола на хорионалантоисную мембрану развитие кровеносных сосудов подавляется. Ингибирование развития кровеносных сосудов приводит к формированию лишенной сосудов зоны, которая в зависимости от воздействия таксола характеризуется наличием трех зон. Центральная зона, где воздействие максимально, содержит разрушенные капилляры с вырожденными красными кровяными тельцами; это указывает на то, что межклеточные связи между клетками эндотелия отсутствуют. Клетки эндодерма и эктодерма сохраняют свои межклеточные связи, а потому эти слои эмбриона остаются незатронутыми; однако они слегка утолщены. При приближении к нормальной содержащей сосуды области кровеносные сосуды сохраняют свои связанные комплексы, а потому также остаются незатронутыми. На периферии обработанной таксолом зоны ингибируется рост новых кровеносных сосудов, что проявляется в изменении направления или эффекте "локтя" кровеносных сосудов (фиг. 2D).
В областях, обработанных таксолом, наблюдается также обилие клеток, захваченных митотическим делением во всех трех слоях хорионалантоисной мембраны; это явление уникально для таксола, поскольку в предыдущих исследованиях оно не отмечено. Захваченные митозом клетки эндотелия не могут выполнять свои метаболические функции, связанные с развитием новых кровеносных сосудов. Для сравнения, лишенная сосудов зона, образующаяся под действием сурамина и ацетата кортизона, не приводит к образованию в хорионалантоисной мембране захваченных при митотическом делении клеток; указанные препараты лишь препятствуют дальнейшему росту кровеносных сосудов в сторону подвергнутой обработке области. Таким образом, хотя указанные средства и являются ингибиторами процесса развития кровеносных сосудов, сохраняется большое количество точек, на которые может нацелиться процесс развития кровеносных сосудов.
Наблюдалось также воздействие таксола в течение 48 час и было обнаружено, что подавление ангиогенеза начинается уже через 9 час после нанесения. Гистологические срезы показывают одинаковую морфологию, которая наблюдается в первой переходной фазе лишенной сосудов зоны после 48 час, что показано на фиг. 3А и 4А. Также наблюдали развитие реваскуляризационного процесса в ранее наблюдаемой лишенной сосудов зоне. Было показано, что лишенная сосудов зона, образующаяся под действием гепарина и стероидов, подавляющих развитие кровеносных сосудов, реваскуляризуется через 60 час после применения указанных препаратов. В нашем исследовании лишенная сосудов зона, полученная обработкой таксолом, не реваскуляризуется в течение, по крайней мере, 7 дней после применения препарата, что свидетельствует о потенциально более длительном воздействии.
Пример 2. Инкапсулирование таксола
500 мкг таксола или
баккатина (аналог таксола, получают из компании "Inflazyrne Pharmaceuticals Inc. ", Ванкувер, Британская Колумбия, Канада) растворяют в 1 мл смеси 50:50 ELVAX:PLL. Затем получают 3 порции микросфер в
устройстве для приготовления растворов (шестишпиндельная исследовательская машина, "VanderKanp, Van Kell Industries Inc.", США) при перемешивании в течение 3 час со скоростью 200 об/мин при
температуре 42oС. Полученные таким образом микросферы дважды промывают водой и их размер оценивают с помощью микроскопа.
Определение инкапсулирования проводят с помощью УФ спектрометра λmax 237 нм, возбуждение флюоресценции при 237 нм, испускание при 325 нм); результаты исследований представлены в квадратных скобках [ ]). При использовании вышеописанной методики из общего количества 500 мкг исходного вещества может быть инкапсулировано 58 мкг (+/-12 мкг) [75 мкг (+/-25 мкг)] таксола. Это соответствует 12% (+/-2,4%) [15% (+/-5%)1 от первоначального веса или 1,2% (+/-0,25%) от веса полимера. Через 18 час после выдерживания в сушильном шкафу при температуре 37oС 10,3%(+/-10%) [6%(+/-5,6%)] общего количества таксола было высвобождено из микросфер.
Для баккатина, 100 +/-15 мкг [83 +/-23 мкг] баккатина может быть инкапсулировано из общего количества 500 мкг исходного вещества. Это соответствует 20% (+/-3%) [17%(+/-5%)] от первоначального веса баккатина и 2%(+/-0,3%) [1,7%(+/-0,5%)] от веса полимера. Через 18 часов после выдерживания в сушильном шкафу при температуре 37oС 55%(+/-13%) [60%(+/-23%)] баккатина высвобождается из микросфер.
Пример 3. Исследование хирургической пасты, содержащей композиции, подавляющие развитие кровеносных сосудов
Крыс Fisher
весом приблизительно 300 г анестезируют и делают им поперечный разрез длиной 1 см в верней части брюха. В две из пяти долей печени вводят 0,2 мл физиологического солевого раствора, содержащего один
миллион живых клеток гликосаркомы 9L (элюируют непосредственно перед использованием из тканевой культуры), протыкая оболочку печени на глубину 1 см с помощью иглы номер 27. Рану на брюхе зашивают,
используя рассасывающийся шовный материал номер 6,0 и кожные скобки и реакцию антиген-антитело прерывают.
Через две недели метастазы опухоли имеют размер приблизительно 1 см. К этому времени обе печеночные опухоли удаляют и на голые края печени тампоном наносят средство, подавляющее развитие кровеносных сосудов. Крыс делят на две группы: одной половине наносят лишь полимерный носитель, а второй половине наносят композицию, подавляющую развитие кровеносных сосудов.
Крыс умерщвляют на 2, 7, 14, 21 и 84 день после проведения операции на печени. В частности, крыс подвергают легкой смерти, вводя им эутанил в заднюю вену хвоста. Печень, селезенку и оба легких извлекают и для исследования опухолей на предмет наличия интибирующей активности по отношению к развитию кровеносных сосудов проводят гистологический анализ.
Пример 4. Трансплантация стентов желчных протоков у крыс
Крысам Fisher весом 300 г делают общий наркоз, делают
поперечный разрез длиной 1 см в верхней части брюха и находят печень. В ближайшую к поверхности долю печени вводят 0,2 мл физиологического солевого раствора, содержащего один миллион живых клеток
гликосаркомы 9L (элюируют непосредственно перед использованием из тканевой культуры), протыкая оболочку печени на глубину 1 см с помощью иглы номер 27. Чтобы остановить кровотечение, на место прокола
после удаления игла кладут тампон. По мере вытаскивания иглы в нее вводят солевой раствор, чтобы предотвратить попадание клеток в брюшинную полость или вдоль пути движения иглы. На место каждого
прокола для остановки кровотечения помещают тампон. Общую анестезию прерывают и крыс возвращают в питомник, где они получают обычную пищу.
Через две недели вновь осуществляют общий наркоз и в асептических условиях идентифицируют долю печени, содержащую опухоль, и проводят разрез по средней линии. Затем сквозь оболочку печени в опухоль вводят ангиографическую иглу номер 16, через иглу вводят 0,038 дюймовый (0,96 мм) направляющий шнур и иглу вынимают. Вдоль направляющего шнура в опухоль вводят французский расширитель номер 5, затем вдоль направляющего шнура вводят французский катетер для доставки номер 5 с находящимся в нем в сжатом состоянии стальным стеночным стентом (5 мм в диаметре и 1 см в длину). Стент размещают внутри опухоли и катетер для доставки извлекают. Одной трети крыс внутри опухоли размещают обычные стальные стенты, одной трети крыс внутри опухоли размещают стальные стенты, покрытые полимером, а одной трети крыс внутри опухоли размещают стальные стенты, покрытие композиций полимер-фактор, подавляющей развитие опухоли. Общий наркоз прерывают и крыс возвращают в питомник.
Через два дня проводят простое флюороскопическое обследование, с целью определения степени раскрытия стента, крыс умерщвляют на 2, 7, 14, 28 и 56 день после размещения стента, вводя эутанил, и их печень удаляют en bloc после наступления смерти. После фиксирования в формальдегиде в течение 48 час печень разрезают с интервалом 0,5 мм; одновременно проводят и поперечный разрез стента, используя каждый раз новое лезвие. Гистологические разрезы окрашивают с помощью гематоксилина и эозина и анализируют, с целью определить степень врастания опухоли в полость стента.
Пример 5. Изготовление микросфер
Оборудование,
которое является предпочтительным для изготовления микросфер, которые описываются ниже, включает: стакан (из кимакса или пирекса) емкостью 200 с водяной рубашкой, водяную баню с циркуляцией фирмы
"Haake", размещаемую сверху мешалку и контроллер диаметром 2 дюйма (50,8 мм) (4-х лопастная мешалка пропеллерного типа из нержавеющей стали фирмы "Fisher"), стеклянный стакан емкостью 500 мл,
магнитную мешалку с подогревом (от фирмы "Corning"), 4 X 50 мл полипропиленовые трубки для центрифуги (от фирмы " Nalgene"), стеклянные пробирки для сцинтилляции с пластиковыми крышечками, настольную
центрифугу (от фирмы "GPR Beckman"), высокоскоростную напольную центрифугу (модель JS 21 фирмы "Beckman"), аналитические весы фирмы "Mettler" (модель AJ 100, 0,1 мг), цифровые аналитические весы с
верхней загрузкой фирмы "Mettler" (модель АЕ 163, 0,01 мг), автоматическую пипетку (от фирмы "Gilson"). Используемые реагенты включают поликапролактон (PCL) с молекулярным весом от 10000 до 20000
("Polysciences", Уоррингтон, штат Пенсильвания, США), "промытый" этиленвинилацетат (EVA, промывают с целью удаления антиоксиданта ВНТ), поли(d1)молочную кислоту (PLA) с молекулярным весом от 15000 до
25000 ("Polysciences"), поливиниловый спирт (PVA) с молекулярным весом от 124000 до 186000; гидролизован на 99% ("Aldrich Chemical Co", Миллуоки, штат Висконсин, США), дихлорметан для жидкостной
хроматографии высокого разрешения ("Fisher Scientific Co") и дистиллированную воду.
А. Приготовление 5%-ных (вес/об) растворов полимеров
В зависимости от приготавливаемого
раствора полимера 1,00 г поликапролактона или поли(d1)молочной кислоты или по 0,50 г поли(d1)молочной кислоты и промытого этиленвинилацетата отвешивают непосредственно в стеклянные пробирки для
сцинтилляции емкостью 20 мл. Добавляют 20 мл дихлорметана и пробирки плотно закрывают. Пробирки оставляют при комнатной температуре (25oС) на один час (изредка можно встряхивать) или до тех
пор, пока полимер не растворится (раствор должен быть прозрачным). Раствор можно хранить при комнатной температуре, по крайней мере, две недели.
В. Получение 5%-ного (вес/об) маточного
раствора поливинилового спирта
Двадцать пять граммов поливинилового спирта непосредственно отвешивают в стеклянный стакан емкостью 600 мл. Добавляют 500 мл дистиллированной воды и покрытый
тефлоном якорь мешалки длиной 3 дюйма (76,2 мм). Стакан накрывают стеклом, чтобы уменьшить потери, вызванные испарением, и помещают в стеклянный стакан емкостью 2000 мл, содержащий 300 мл воды
(которая играет роль водяной бани). Поливиниловый спирт перемешивают со скоростью 300 об/мин при температуре 85oС (на мешалке с подогревом фирмы "Corning") в течение 2 час или до полного
растворения. Растворение поливинилового спирта можно определить визуально; раствор должен быть прозрачным. Раствор переносят в стеклянный контейнер с завинчивающейся крышкой и хранят при температуре
4oС не более двух месяцев, однако, перед использованием или разбавлением раствор необходимо нагреть до комнатной температуры.
С. Методика получения микросфер
В
зависимости от размеров изготавливаемых микросфер (см. Таблицу II), 100 мл раствора поливинилового спирта (концентрации указаны в таблице II) помещают в стакан с водяной рубашкой емкостью 200 мл.
Водяную баню фирмы "Haake" с циркулирующей водой подсоединяют к этому стакану и дают температуре, содержимого установиться на уровне 27oС (+/-1oС) в течение 10 минут. В
зависимости от размеров изготавливаемых микросфер (см. Таблицу II) устанавливают стартовую скорость верхней мешалки, а лопасти мешалки наполовину помещают в раствор поливинилового спирта. Мешалку
включают и в перемешиваемый раствор поливинилового спирта добавляют по каплям в течение 2 минут 10 мл раствора полимера (раствор полимера используют в зависимости от типа изготавливаемых микросфер) с
помощью автоматической пипетки емкостью 5 мл. Через 3 минуты устанавливают необходимую скорость перемешивания (Таблица II) и раствор перемешивают в течение 2,5 час, затем лопасти мешалки вынимают из
препарата микросфер и промывают их 10 мл дистиллированной воды, так что промывочный раствор стекает в препарат микросфер. Затем препарат микросфер выливают в стакан емкостью 500 мл и водяную рубашку
промывают 70 мл дистиллированной воды, которой также дают стечь, а препарат микросфер 180 мл препарата микросфер затем перемешивают стеклянной палочкой и равными частями выливают в четыре трубки для
центрифуги из полипропилена емкостью 50 мл. Затем трубки закрывают крышками и центрифугируют в течение 10 минут (величина ускорения указана в Таблице II). Для удаления 45 мл раствора поливинилового
спирта от каждой таблетки микросфер применяют автоматическую пипетку емкостью 5 мл или вакуумный отсос.
В каждую пробирку для центрифугирования затем добавляют по пять миллилитров дистиллированной воды и перемешивают, чтобы ресуспендировать микросферы. Затем четыре суспензии микросфер сливают в одну трубку для центрифугирования вместе с 20 мл дистиллированной воды и центрифугируют еще в течение 10 минут (ускорение указано в Таблице II). Эту процедуру повторяют еще дважды, т.е. всего три раза. Микросферы затем центрифугируют в последний раз и вновь подвергают дисперсии в 10 мл дистиллированной воды. После последней промывки препарат микросфер переносят в заранее взвешенную стеклянную пробирку для сцинтилляции. Пробирку закрывают крышкой и оставляют на ночь при комнатной температуре (25oС), давая возможность микросферам осесть под действием силы тяжести. Микросферы, размер которых попадает в диапазон от 0,1 мкм до 3 мкм, не оседают под действием силы тяжести, так что они остаются в 10 мл суспензии.
D. Сушка микросфер с диаметром 10-30 мкм или 30-100 мкм
После того, как микросферы осели при стоянии в течение
ночи при комнатной температуре для удаления жидкости над осадком от седиментированных микросфер используют автоматическую пипетку емкостью 5 мл или вакуумный отсос. Дают микросферам высохнуть в
незакрытой пробирке в течение одной недели до тех пор, пока они полностью не высохнут (до постоянного веса пробирки). Более быстрое высушивание может быть достигнуто, если оставить незакрытые пробирки
под вытяжным шкафом в токе азота (поток газа составляет приблизительно 10 мл/мин). После полного высушивания (до постоянного веса пробирки) пробирку взвешивают и закрывают крышкой. Снабженную меткой
закрытую крышкой пробирку хранят в шкафу при комнатной температуре. Микросферы обычно хранят не более 3 месяцев.
Е. Сушка микросфер с диаметром 0,1-3 мкм
Микросферы с
размерами в указанном интервале не оседают, так что их оставляют при 4oС не более чем на четыре недели. Чтобы определить концентрацию микросфер в 10 мл суспензии берут образец в 200 мкл с
помощью пипетки и помещают в трубку микроцентрифуги емкостью 1,5 мл. Затем трубку центрифугируют с ускорением 10000 g (настольная микроцентрифуга фирмы "Eppendorf"), жидкость над осадком удаляют и
трубке дают высохнуть в течение ночи при температуре 50oС. Затем трубку вновь взвешивают, чтобы определить вес высушенных микросфер внутри трубки.
F. Изготовление микросфер,
наполненных таксолом
Для приготовления микросфер, наполненных таксолом, соответствующее количество таксола (в зависимости от процентного содержания таксола, которое необходимо
инкапсулировать) помещают непосредственно в стеклянную пробирку для сцинтилляции емкостью 20 мл. Десять миллилитров соответствующего раствора полимера затем добавляют в пробирку, содержащую таксол и
перемешивают до тех пор, пока таксол не растворится.
Аналогично по описанным выше стадиям (С)-(Е) могут быть получены микросферы, содержащие таксол.
Пример 6.
Изготовление покрытия стента
Реагенты и оснастка, которые используются в описываемом эксперименте, включают медицинские стенты, приобретаемые у различных изготовителей (в частности, стенты
фирмы "Strecker"), и держатель для них, стеклянные пробирки для сцинтилляции с крышками (из пластмассы, которые вставляются внутрь), распылитель для тонкослойной хроматографии, баллон с газообразным
азотом, стеклянные пробирки (разного размера емкостью от 1 мл и более), стеклянные стаканы (разного размера), пипетку Пастора, пинцет, поликапролактон с молекулярным весом от 10000 до 20000
("Polysciences"), таксол ("Sigma Chemical Co", Сент-Луис, штат Миссури, чистота 95%), сополимер этилена и винилацетата (промытый, как указано ранее), поли(d1)молочную кислоту с молекулярным весом от
15000 до 25000 ("Polysciences"), дихлорметан для жидкостной хроматографии высокого разрешения ("Fisher Scientific Co.").
А. Нанесение покрытия на стенты распылением
Следующая
методика описывает стандартный метод с использованием гофрированного слоеного стента из металлической проволоки с диаметром 3 мм и длиной приблизительно 3 см. Для стентов большего диаметра используют
большие количества растворов полимер/лекарство.
Отвешивают необходимое количество полимера непосредственно в стеклянную пробирку для сцинтилляции емкостью 20 мл и добавляют достаточное количество дихлорметана, чтобы получить раствор с концентрацией 2% (вес/об). Пробирки закрывают крышками и перемешивают смесь для растворения полимера (встряхивают вручную). Собирают стент с вертикальной ориентацией. Это можно осуществить, используя кусочек нейлона и привязывая стент к штативу. Помещают это устройство для поддержания стента на высоте 6-12 дюймов (15-30 см) от пола вытяжного шкафа на подставку (в частности, перевернутый стакан емкостью 2000 мл), чтобы можно было осуществить горизонтальное нанесение распылением. С помощью автоматической пипетки переносят нужный объем (минимум 5 мл) 2%-ного раствора полимера в отдельную пробирку для сцинтилляции емкостью 20 мл. Добавляют к раствору соответствующее количество таксола и растворяют, встряхивая закрытую колпачком пробирку.
Перед подготовкой к распылению колпачок с пробирки снимают и погружают корпус распылителя для тонкослойной хроматографии в раствор полимера. Следует отметить, что резервуар распылителя использовать нельзя: роль резервуара играет стеклянная пробирка емкостью 20 мл. Соединяют баллон с азотом с отверстием для ввода газа распылителя. Постепенно увеличивают давление до тех пор, пока не начнется атомизация и распыление. Замечают это давление и используют его в течение всей процедуры. Для нанесения покрытия на стент распыляют жидкость в течение 5 секунд, совершая круговые движения, а затем сушат в течение 15 секунд между каждой порцией распыления. Проводят 5 циклов распыления, вращая стент на 90 градусов и нанося каждый раз покрытие на часть стента. Операцию повторяют, пока не будут покрыты все стороны стента. Во время сушки газовую линию зажимают пальцем, чтобы предотвратить потерю распыляемого продукта. Распыление продолжают до тех пор, пока на стент не будет нанесено требуемое количество полимера. Это количество может зависеть от конкретного использования стента in vivo. Для определения нанесенного количества полимера стент взвешивают по окончании распыления и сушки стента. Вычитают исходный вес стента из конечного веса, это и составляет количество полимера (плюс таксол), нанесенного на стент. Стенты с покрытием хранят в закрытом контейнере.
В. Нанесение покрытия на стент окунанием
Следующая методика описывает стандартный метод с использованием гофрированного слоеного стента из металлической проволоки с диаметром 3
мм и длиной приблизительно 3 см. Для стентов большего диаметра используют большие количества растворов полимер/лекарство в больших по размеру пробирках.
В стеклянную пробирку для сцинтилляции емкостью 20 мл отвешивают 2 г сополимера этилена и винилацетата и добавляют 20 мл дихлорметана. Накрывают пробирку колпачком и оставляют на 2 час для растворения (часто встряхивая для ускорения процесса растворения). Прямо в пробирку емкостью 1 мл отвешивают известное количество таксола и добавляют 0,5 мл раствора полимера. С помощью стеклянной пипетки Пастера растворяют таксол, осторожно прокачивая раствор полимера. Как только таксол растворится, наклоняют пробирку практически горизонтально (так чтобы вязкий раствор полимера начал растекаться). С помощью пинцета помещают стент в трубку и опускают на дно, дают раствору полимера практически достигнуть горловины пробирки, наклоняя ее ниже горизонтального уровня и возвращая пробирку в исходное состояние с углом чуть больше горизонтального. Медленно вращая стент в пробирке, медленно извлекают стент (приблизительно в течение 30 секунд).
Для просушки устанавливают стент в вертикальное положение. Некоторые из закупоренных перфораций могут трескаться, так что в непрерывной пленке полимера могут возникнуть отверстия. Их можно устранить, повторяя ранее описанную процедуру, однако повторение процедуры также может привести к дальнейшему растрескиванию и получению в целом неровно сформированного покрытия полимера. В общем случае лучше окунать стент всего один раз и отрезать часть стента, где нет растрескиваний на перфорации. Стент с нанесенным методом окунания покрытием хранят в закрытом контейнере.
Пример 7. Изготовление хирургической "пасты"
Как указано
ранее, в настоящем изобретении заявляется большое количество полимерсодержащих лекарственных композиций, которые могут быть использованы в различных клинических ситуациях. Например, композиции могут
готовиться: (1) в виде "термопасты", которая наносится на нужное место в виде жидкости и затвердевает в твердый продукт нужной формы при специфической температуре (в частности, при температуре тела);
(2) в виде аэрозоля (в частности, "наноаэрозоля"), который может наносится на нужное место как непосредственно, так и с помощью соответствующего устройства (в частности, эндоскопически), и который
затем превращается в твердое вещество, прилипающее к тканям, на которые оно нанесено; (3) в виде плотно прилегающей, гибкой, эластичной пленки полимер-ингибитор развития кровеносных сосудов, которую
наносят на нужное место как непосредственно, так и с помощью специального устройства и которая преимущественно прилегает к тому месту, на которое она нанесена; и (4) в виде жидкости, содержащей
суспензию микросфер в подходящей среде-носителе, которую наносят на нужное место как непосредственно, так и с помощью специального устройства и которая оставляет в месте ее нанесения слой,
составленный микросферами. Отдельные примеры каждого из этих вариантов осуществления изобретения более подробно представлены ниже.
А. Методика получения термопаст
Реагенты и
оборудование, которое используется для проведения указанных далее экспериментов, включает стерильный стеклянный шприц (емкостью 1 мл), мешалку с обогреваемым столиком фирмы "Corning"), стеклянную
трубку для сцинтилляции емкостью 20 мл, формы для отливки (в частности, кюветы, используемые в методе сканирующей дифференциальной калориметрии, емкостью 50 мкл или внутренняя часть колпачка трубки
для центрифуги емкостью 50 мл), скальпель и пинцет, поликапролактон с молекулярным весом от 10000 до 20000 ("Polysciences", Уоррингтон, штат Пенсильвания, США) и таксол ("Sigma", минимальное
содержание 95%).
Непосредственно в пробирку для сцинтилляции емкостью 20 мл отвешивают 5,00 г поликапролактона. Помещают пробирку в стакан емкостью 600 мл, содержащий 50 мл воды. Осторожно нагревают стакан до 65oС и поддерживают эту температуру в течение 20 минут, при этом полимер плавится. Тщательно смешивают известное количество таксола или другого ингибитора образования кровеносных сосудов с расплавленным полимером при 65oС. Выливают расплав полимера в предварительно подогретую (60oС) форму. Перемешивают с помощью шпателя, ускоряя процесс растворения. Дают форме остыть, при этом полимер затвердевает. Нарезают или разбивают полимер на мелкие кусочки (приблизительно размером 2Х2 мм). Эти кусочки должны входить в стеклянный шприц емкостью 1 мл. Извлекают поршень из шприца емкостью 1 мл (не удаляя колпачок с его конца) и кладут на весы. Показание весов обнуляют.
Отвешивают 0,5 г кусочков прямо в открытый конец, шприца. Устанавливают шприц вертикально (снизу находится колпачок) в стеклянном стакане емкостью 500 мл, содержащем дистиллированную воду с температурой 65oС (мешалка с обогреваемым столиком фирмы "Corning"), так чтобы вода не поступала в баллончик шприца. В этом устройстве полимер полностью расплавляется в течение 10 минут. После того, как кусочки полимера расплавились, баллончик извлекают из водяной бани, размещают его горизонтально и удаляют колпачок. Вставляют поршень в баллон шприца и сжимают расплав полимера в вязкую массу в тонком конце баллончика. Закрывают шприц колпачком и дают остыть до комнатной температуры.
Перед использованием шприц можно вновь нагреть до температуры 60oС и вводить содержимое в виде жидкости, которая затвердевает при температуре тела.
В. Методика получения наноаэрозоля
Наноаэрозоль представляет собой суспензию маленьких микросфер в солевом физиологическом растворе. Если
микросферы являются очень маленькими (т.е. менее 1 мкм в диаметре), они образуют коллоидный раствор, так что суспензия не седиментирует в поле силы тяжести. Как более подробно поясняется ниже,
суспензию микрочастиц с размерами от 0,1 до 1 мкм можно подготовить для нанесения на ткани с помощью ручного распылителя. Оборудование и материалы, которые могут быть использованы для получения
наноаэрозоля, включают стакан (из кимакса или пирекса) емкостью 200 мл с водяной рубашкой, водяную баню с циркуляцией фирмы "Haake", размещаемую сверху мешалку и контроллер диаметром 2 дюйма (50,8 мм)
(4-х лопастная мешалка пропеллерного типа из нержавеющей стали фирмы "Fisher"), стеклянный стакан емкостью 500 мл, магнитную мешалку с подогревом (от фирмы "Corning"), 4 X 50 мл полипропиленовые
трубки для центрифуги (от фирмы "Nalgene"), стеклянные пробирки для сцинтилляции с вставляемыми внутрь пластиковыми крышечками, настольную центрифугу (от фирмы "Beckman"), высокоскоростную напольную
центрифугу (модель JS 21 фирмы "Beckman"), аналитические весы фирмы "Mettler" (модель AJ 100, 0,1 мг), цифровые аналитические весы с верхней загрузкой фирмы "Mettler" (модель АЕ 163, 0,01 мг),
автоматическую пипетку (от фирмы "Gilson"), стерильные наконечники пипеток, приводящийся в действие насосом пульверизатор (от фирмы ("Pfeiffer Pharmaceuticals") емкостью 20 мл, вытяжной шкаф с
ламинарным потоком, поликапролактон (PCL) с молекулярным весом от 10000 до 20000 ("Polysciences", Уоррингтон, штат Пенсильвания, США), "промытый" (см, ранее) этиленвинилацетат (EVA), поли(d1)молочную
кислоту (PLA) с молекулярным весом от 15000 до 25000 ("Polysciences"), поливиниловый спирт (PVA) с молекулярным весом от 124000 до 186000; гидролизованный на 99% ("Aldrich Chemical Co", Миллуоки, штат
Висконсин, США), дихлорметан для жидкостной хроматографии высокого разрешения ("Fisher Scientific Co."), дистиллированную воду и стерильный солевой физиологический раствор (от компании "Becton and.
Dickenson" или эквивалентный).
1. Приготовление 5%-ных (вес/об) растворов полимеров
В зависимости от приготавливаемого раствора полимера 1,00 г поликапролактона или
пoли(dl)мoлoчнoй кислоты или по 0,50 пoли(dl)мoлoчнoй кислоты и промытого сополимера этилена и винилацетата отвешивают непосредственно в стеклянные пробирки для сцинтилляции емкостью 20 мл. С помощью
мерного цилиндра добавляют 20 мл дихлорметана и пробирки плотно закрывают. Пробирки оставляют при комнатной температуре (25oС) на один час или до тех пор, пока полимер не растворится
(изредка можно встряхивать вручную). За процессом растворения полимера можно следить визуально; раствор должен быть прозрачным. Раствор можно хранить при комнатной температуре и использовать в течение
двух недель.
2. Получение 3,5%-ного (вес/об) маточного раствора поливинилового спирта
Раствор можно получить по приведенной ниже методике или путем разбавления 5%-ного
(вес/об) маточного раствора поливинилового спирта, приготовленного для получения микросфер (см. Пример 8). Если коротко, то 17,5 г поливинилового спирта непосредственно отвешивают в стеклянный стакан
емкостью 600 мл. Добавляют 500 мл дистиллированной воды. Помещают в стакан, покрытый тефлоном, якорь мешалки длиной 3 дюйма (76,2 мм). Стакан накрывают покровным стеклом, чтобы уменьшить потери,
вызванные испарением. Стакан помещают в стеклянный стакан емкостью 2000 мл, содержащий 300 мл воды. Он играет роль водяной бани. Поливиниловый спирт перемешивают со скоростью 300 об/мин при
температуре 85oС (на мешалке с подогревом фирмы "Corning") в течение 2 час или до полного растворения. Растворение поливинилового спирта можно определить визуально; раствор должен быть
прозрачным. Раствор переносят в стеклянный контейнер с завинчивающейся крышкой и хранят при температуре 4oС не более двух месяцев. Однако перед использованием или разбавлением раствор
необходимо нагреть до комнатной температуры.
3. Методика получения наноаэрозоля
Размещают устройство для перемешивания в вытяжном шкафу. Помещают 100 мл 3,5%-ного раствора
поливинилового спирта в стакан с водяной рубашкой емкостью 200 мл. Водяную баню фирмы "Haake" с циркулирующей водой подсоединяют к этому стакану и дают температуре содержимого установиться на уровне
27oС (+/-1oС) в течение 10 минут. Устанавливают стартовую скорость верхней мешалки 3000 об/мин (+/- 200 об/мин). Лопасти мешалки наполовину помещают в раствор поливинилового
спирта и включают мешалку. В перемешиваемый раствор поливинилового спирта добавляют по каплям в течение 2 минут 10 мл раствора полимера (раствор полимера используют в зависимости от типа
изготавливаемого наноаэрозоля) с помощью автоматической пипетки емкостью 5 мл. Через 3 минуты устанавливают скорость перемешивания 2500 об/мин (+/- 200 об/мин) и перемешивают в течение 2,5 час. Через
2,5 час лопасти мешалки вынимают из препарата микросфер и промывают их 10 мл дистиллированной воды, так чтобы промывочный раствор стекал в препарат микросфер.
Затем препарат микросфер выливают в стакан емкостью 500 мл. Водяную рубашку промывают 70 мл дистиллированной воды, которой также дают стечь в препарат микросфер. 180 мл препарата микросфер затем перемешивают стеклянной палочкой и равными частями выливают в четыре трубки для центрифуги из полипропилена емкостью 50 мл. Трубки закрывают крышками. Центрифугируют в течение 10 минут с ускорением 10000 g (+/-1000 g). Для удаления 45 мл раствора поливинилового спирта от каждой таблетки микросфер применяют автоматическую пипетку емкостью 5 мл. В каждую пробирку для центрифугирования затем добавляют по пять миллилитров дистиллированной воды и перемешивают, чтобы ресуспендировать микросферы. Затем четыре суспензии микросфер сливают в одну трубку для центрифугирования вместе с 20 мл дистиллированной воды. Чтобы промыть микросферы, центрифугируют препарат наноаэрозоля в течение 10 минут с ускорением 10000 g (+/- 1000 g). Удаляют жидкость над таблеткой из микросфер. Добавляют 40 мл дистиллированной воды и перемешивают для ресуспендирования микросфер. Процедуру повторяют еще дважды, т.е. всего три раза. Проводят четвертую промывку, однако используют для ресуспендирования микросфер лишь 10 мл (не 40 мл) дистиллированной воды. После четвертой промывки препарат микросфер переносят в заранее взвешенную стеклянную пробирку для сцинтилляции.
Пробирку закрывают крышкой и оставляют на 1 час при комнатной температуре (25oС), давая возможность микросферам с диаметром 2 мкм и 3 мкм осесть под действием силы тяжести. Через 1 час верхние 9 мл суспензии удаляют, используя автоматическую пипетку емкостью 5 мл. Помещают эти 9 мл в стерильную трубку для центрифуги емкостью 50 мл, снабженную крышкой. Центрифугируют суспензию с ускорением 10000 g (+/-1000 g) в течение 10 минут. Жидкость над осадком сливают и вновь суспендируют таблетку в 20 мл стерильного солевого физиологического раствора. Центрифугируют суспензию с ускорением 10000 g (+/-1000 g) в течение 10 минут. Жидкость над осадком сливают и вновь суспендируют таблетку в стерильном солевом физиологическом растворе. Количество используемого физиологического раствора зависит от конечной требуемой концентрации (обычно 10% вес/об). Тщательно промывают устройство для получения аэрозоля стерильным солевым физиологическим раствором и добавляют суспензию наноаэрозоля в распылитель.
С.
Изготовление наноаэрозоля, содержащего таксол
Для приготовления наноаэрозоля. содержащего таксол, используют таксол фирмы "Sigma" (с чистотой 95%). Для получения маточного раствора
полимер/лекарство отвешивают соответствующее количество таксола прямо в стеклянную пробирку для сцинтилляции емкостью 20 мл. Это количество определяют в зависимости от процентного, содержания таксола
в наноаэрозоле. Например, если требуется получить наноаэрозоль, содержащий 5% таксола, то отвешивают 25 мг таксола, поскольку количество добавляемого полимера составляет 10 мл 5%-ного раствора в
дихлорметане (см. следующую стадию).
Добавляют 10 мл 5%-наго раствора подходящего полимера в пробирку, содержащую таксол. Пробирку закрывают и перемешивают механически или вручную, чтобы растворить таксол (проверяют полноту растворения таксола визуально). На пробирку наклеивают этикетку, на которой указывают дату изготовления. Препарат должен быть использован в тот же день.
Повторяют описанные выше процедуры, взяв вместо раствора полимера маточный раствор, полимер/лекарство (в частности, таксол).
D. Методика получения пленки
Термин
"пленка" относится к полимеру, полученному в одном из множества геометрических форм. Пленка может быть тонким эластичным листом полимера или изготовленным из полимера диском с диаметром 2 мм. Форму
пленки подбирают таким образом, чтобы ее можно было поместить на ткань, с тем чтобы инкапсулированное лекарство выделялось из полимера в окружающие ткани в течение длительного периода времени. Пленки
могут быть получены разными способами, в том числе, например, отливкой и пульверизацией.
В методе получения пленки отливкой полимер либо расплавляют и выливают в форму, либо
растворяют в дихлорметане и выливают в форму. Затем полимер, соответственно, либо затвердевает по мере охлаждения, либо
затвердевает по мере испарения растворителя. В методе получения пленки
пульверизацией полимер растворяют в растворителе и разбрызгивают на стекло и при испарении растворителя полимер затвердевает в виде пленки на стекле. Повторным разбрызгиванием можно получить слой
полимера на стекле, который можно снять со стекла.
Реагенты и оснастка, которая применяется в указанных экспериментах, включают маленькие стаканчики, мешалку с подогреваемым столиком фирмы "Corning", формы для отливки (в частности, колпачки трубок для центрифуги емкостью 50 мл) и устройство для закрепления форм, пробирку для сцинтилляции емкостью 20 мл с колпачком, который вставляется внутрь, распылитель для тонкослойной хроматографии, баллон с газообразным азотом, поликапролактон с молекулярным весом от 10000 до 20000 ("Polysciences"), таксол ("Sigma", содержание основного вещества 95%), этанол, "промытый" (см. ранее) этиленвинилацетат, поли(d1)молочную кислоту с молекулярным весом от 15000 до 25000 ("Polysciences"), дихлорметан для жидкостной хроматографии высокого разрешения ("Fisher Scientific Co.").
1. Методика получения пленок - формовка из расплава
Непосредственно в маленький стеклянный стакан отвешивают известное
количество поликапролактона. Помещают стакан в больший стакан, содержащий воду (играет роль водяной бани) и на 15 минут, или пока полимер не расплавится, помещают на горячую плитку с температурой
70oС. В расплавленный полимер добавляют известное количество лекарства и смесь тщательно перемешивают. Чтобы облегчить образование дисперсии лекарства в расплаве поликапролактона, лекарство
можно растворить/суспендировать в небольшом объеме (<10% от объема расплава поликапролактона) абсолютного этанола. Полученную суспензию в этаноле затем смешивают с расплавленным полимером.
Выливают расплав полимера в форму и дают остыть. После охлаждения пленку хранят в контейнере.
2. Методика получения пленок - формовка из раствора
Отвешивают известное
количество поликапролактона непосредственно в пробирку для сцинтилляции емкостью 20 мл и добавляют необходимое количество дихлорметана, так чтобы концентрация составила 10% (вес/об). Закрывают
пробирку пробочкой и перемешивают. Добавляют достаточное количество таксола, чтобы получить нужную конечную концентрацию таксола. Для растворения таксола пробирку встряхивают вручную или осуществляют
перемешивание механически. Дают раствору отстояться в течение одного часа (чтобы уменьшить количество пузырьков газа) и медленно выливают в форму. Используют форму в зависимости от необходимой
конфигурации изделия. Форму на ночь помещать в вытяжной шкаф, и дихлорметан испаряется. Пленку либо оставляют в форме, либо отслаивают и хранят в закрытом контейнере.
3. Методика
получения пленок - разбрызгивание
Отвешивают достаточное количество полимера непосредственно в пробирку для сцинтилляции емкостью 20 мл и добавляют необходимое количество дихлорметана, так
чтобы концентрация составила 2% (вес/об). Закрывают пробирку пробочкой и перемешивают, чтобы растворить полимер (встряхивают вручную). Собирают формы в вертикальном положении в подходящем держателе и
помещают под вытяжной шкаф, размещают устройство для закрепления форм на высоте 6-12 дюймов (15-30 см) над поверхностью вытяжного шкафа на подходящей подставке (в частности перевернутом стеклянном
стакане емкостью 2000 мл), чтобы облегчить горизонтальное разбрызгивание. С помощью автоматической пипетки переносят подходящий объем (минимум 5 мл) 2%-ного раствора полимера в отдельную пробирку для
сцинтилляции емкостью 20 мл. К раствору добавляют достаточное количество таксола и растворяют его, встряхивая закрытую колпачком пробирку вручную. Перед подготовкой к распылению колпачок с пробирки
снимают и погружают корпус распылителя для тонкослойной хроматографии в раствор полимера. Следует отметить, что резервуар самого распылителя использовать нельзя: роль резервуара играет стеклянная
пробирка емкостью 20 мл.
Соединяют баллон с азотом с отверстием для ввода газа-распылителя. Постепенно увеличивают давление до тех пор, пока не начнется атомизация и распыление. Замечают это давление и используют его в течение всей процедуры. Для разбрызгивания формы распыляют жидкость в течение 5 секунд, совершая круговые движения, а затем сушат в течение 15 секунд между каждой порцией распыления. Во время сушки газовую линию зажимают пальцем, чтобы предотвратить потерю распыляемого продукта. Распыление продолжают до тех пор, пока на форму не будет нанесено требуемое количество полимера.
Е. Методика получения нанопасты
Нанопаста представляет собой суспензию микросфер в гидрофильном геле. В соответствии с одним из аспектов настоящего
изобретения, гель или пасту можно намазать на ткани в качестве метода размещения наполненных лекарством микросфер вблизи ткани-мишени. Поскольку она имеет водную основу, паста вскоре разбавляется
циркулирующими внутри организма жидкостями, ухудшая прилипаемость пасты и способствуя осаждению микросфер на близлежащих тканях. Поэтому все количество инкапсулированного лекарства
стремятся нанести
как можно ближе к тканям-мишеням.
Реагенты и оснастка, которые используют в указанных экспериментах, включают стеклянные стаканы, карбопол 925 (для использования в фармацевтике, "Goodyear Chemical. Co."), дистиллированную воду, раствор гидроксида натрия (1 М) в воде, раствор гидроксида натрия (5 М) в воде, микросферы размером в интервале от 0,1 мкм до 3 мкм, суспендированные в воде с концентрацией 20% (см. ранее).
1. Приготовление 5%-ного геля карбопола
Достаточное количество карбопола добавляют в 1 М раствор гидроксида натрия, чтобы получился
5%-ный (вес/об) раствор. Чтобы растворить карбопол в 1 М растворе гидроксида натрия, оставляют смесь приблизительно на 1 час. В течение указанного времени смесь перемешивают стеклянной палочкой. Через
час измеряют рН смеси. Низкое значение рН свидетельствует о том, что карбопол растворился не полностью. Необходимо, чтобы величина рН составляла 7,4. Для того, чтобы подогнать значение рН, используют
5 М раствор гидроксида натрия. Эту процедуру осуществляют очень медленно, добавляя по каплям 5 М раствор гидроксида натрия в смесь, перемешивают и измеряют величину рН. Чтобы довести рН до величина 7,
4, обычно требуется около одного часа. Как только величина рН 7,4 достигнута, закрывают гель и оставляют его на 2-3 час. После этого проверяют, равно ли значение рН 7,4. Если оно изменилось, то вновь
доводят его до величины 7,4, добавляя 5 М раствор гидроксида натрия. Оставляют гель еще на несколько часов, чтобы убедиться, что рН стабилизирован на уровне 7.4. Повторяют процедуру до тех пор, пока
не будет достигнуто требуемое значение рН и величина его не будет стабильной. После этого гель следует использовать в течение одной следующей недели для приготовления нанопасты.
2.
Методика получения нанопасты
Добавляют достаточное количество микросфер с размерами в интервале 0,1-3 мкм в воду для получения 20%-ной суспензии микросфер. Помещают 8 мл 5%-ного геля
карбопола в стеклянный стакан. В стакан добавляют 2 мл 20%-ной суспензии микросфер. Используя стеклянную палочку или шпатель, смесь перемешивают, чтобы тщательно распределить микросферы внутри геля.
Обычно это занимает 30 минут. Как только микросферы распределились внутри геля, смесь помещают в сосуд на хранение. Хранят сосуд при температуре 4oС. Нанопасту следует использовать в
течение месяца.
Пример 8. Контролируемое выделение таксола из микросфер, изготовленных из смеси сополимера этилена и винилацетата и поли(d1)молочной кислоты. Испытания in vivo
микросфер в анализе с использованием хорионалантоисной мембраны цыпленка
В этом примере описывается получение наполненных таксолом микросфер, изготовленных из смеси биоразлагаемого полимера
поли(d1)молочной кислоты и небиоразлагаемого сополимера этилена и винилацетата. Кроме того, в условиях in vitro показана скорость выделения и ингибируюшая активность таксола. выделившегося из
микросфер, нанесенных на хорионалантоисную мембрану, по отношению к развитию кровеносных сосудов.
Реагентами, которые используют в этих экспериментах, являются таксол. который покупают у компании "Sigma Chemical Co." (Сент-Луис, штат Миссури), поли(d1)молочная кислота с молекулярным весом от 15000 до 25000 и полиэтиленвинилацетат (60% винилацетата) (которые покупают у компании "Polysciences", Уоррингтон, штат Пенсильвания), поливиниловый спирт с молекулярным весом от 124000 до 186000, гидролизованный на 99% (покупают у компании "Aldrich Chemical Co.", Миллуоки, штат Висконсин) и дихлорметан для жидкостной хроматографии высокого разрешения ("Fisher Scientific Co."). Всюду используют дистиллированную воду.
А. Приготовление микросфер
Микросферы в основном получают по методике, приведенной в Примере 8, используя способ с испарением растворителя. Если коротко, то получают 5%-ные (вес/об) растворы полимера в 20 мл дихлорметана из
смесей сополимер этилена и винилацетата: поли(d1) молочная кислота с соотношениями от 35:65 до 90:10. К 5 мл 2,5%-ного (вес/об) раствора поливинилового спирта в воде, помещенного в пробирку емкостью
20 мл, по каплям при перемешивании добавляют 1 мл раствора полимера. Шесть аналогичных пробирок устанавливают в аппарат для растворения фирмы "Vanderkamp" с расположенными вверху мешалками и
перемешивают со скоростью 200 об/мин. Температуру в пробирках в течение 15 минут повышают от комнатной до 40oС и выдерживают при указанной температуре в течение 2 час. Пробирки
центрифугируют с ускорением 500 g и микросферы трижды промывают водой. Для некоторых смесей сополимер этилена и винилацетата:поли(d1)молочная кислота образцы микросфер агрегируют при проведении стадии
промывки вследствие удаления диспергирующего или эмульгирующего агента - поливинилового спирта. Указанное влияние агрегации можно полуколичественно оценить, поскольку агрегированные микросферы
слипаются, и полученная полимерная масса плавает на поверхности промывных вод. Этот слой полимера на поверхности сливают при проведении промывок, а оставшиеся в виде таблетки микросферы взвешивают.
Процент агрегации определяют из соотношения:
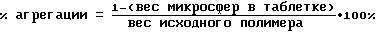
Наполненные таксолом микросферы (0,6 % вес/вес) получают, растворяя таксол в 5%-ном (вес/об) растворе полимера в дихлорметане. Используют полимерную смесь сополимер этилена и винилацетата:поли(d1)молочная кислота с соотношением 50: 50. Фракции микросфер с "большим" размером и фракции микросфер с "маленьким" размером готовят, добавляя по каплям раствор таксол/полимер в 2,5%-ный раствор поливинилового спирта и 5%-ный раствор поливинилового спирта, соответственно. Дисперсии перемешивают при температуре 40oС со скоростью 200 об/мин в течение 2 час, центрифугируют и промывают 3 раза водой, как указано ранее. Микросферы сушат на воздухе, и размер частиц образца оценивают с помощью оптического микроскопа, снабженного предметным столиком. Для каждого образца определяют 300 микросфер. Готовят контрольные микросферы (без таксола) и размер их определяют, как описано ранее.
В. Эффективность инкапсулирования
Известные количества содержащих таксол микросфер растворяют в 1 мл дихлорметана, добавляют 20 мл
40%-ного раствора ацетонитрила в воде с температурой 50oС и перемешивают до тех пор, пока дихлорметан не испарится. Концентрацию таксола в 40%-ном ацетонитриле определяют методом жидкостной
хроматографии высокого разрешения, используя в качестве подвижной фазы смесь вода: метанол: ацетонитрил (37:5:58) со скоростью подачи I мл/мин (применяют изократический насос фирмы "Beckman"), колонку
С8 с обращенной фазой (фирмы "Beckman") и контролируют с помощью УФ детектора на длине волны 232 нм. Чтобы определить эффективность высвобождения при использовании указанной методики экстракции,
известные количества таксола в интервале 100-1000 мкг растворяют в 1 мл дихлорметана и подвергают по три образца той же процедуре экстракции, как описано ранее. Высвобождение лекарства всегда
составляет более 85% и величины эффективности инкапсулирования соответствующим образом корректируются.
С. Изучение выделения лекарства
В снабженные закручивающейся крышкой
стеклянные трубки емкостью 15 мл помещают 10 мл 10 мМ забуференного фосфатом физиологического раствора с рН 7,4 и 35 мг содержащих таксол микросфер. Трубки встряхивают при температуре 37oС
и через определенные промежутки времени центрифугируют с ускорением 1500 g в течение 5 минут и жидкость над осадком сохраняют для анализа. Таблетки микросфер вновь суспендируют в свежем забуференном
фосфатом физиологическом растворе (10 мл) при температуре 37oС и вновь помещают в инкубатор. Концентрации таксола определяют путем экстракции в I мл дихлорметана с последующим упариванием
досуха в токе азота, растворением в 1 мл 40%-ного раствора ацетонитрила в воде и анализом с использованием жидкостной хроматографии высокого разрешения, как описано ранее.
D.
Сканирующая электронная микроскопия
Микросферы помещают на держатель образцов, напыляют на них золото и получают микрофотографии с помощью сканирующего электронного микроскопа Philips 501B с
рабочим напряжением 15 кВ.
Е. Изучение хорионалантоисной мембраны
До получения безоболочечной культуры оплодотворенные эмбрионы цыплят выдерживают в инкубаторе 4 дня.
Содержимое яиц выдерживают 2 дня в инкубаторе при относительной влажности 90% и концентрации углекислого газа 3%. На шестой день инкубации аликвоты по 1 мг микросфер, содержащих 0,6% таксола, и
контрольных микросфер (без таксола) помещают непосредственно на поверхность хорионалантоисной мембраны. По прошествии двух дней исследуют сосудистую систему с использованием стереомикроскопа,
сопряженного с видеокамерой; сигналы видеокамеры передают на компьютер и делают распечатку.
F. Результаты
Микросферы, полученные из 100%-ного сополимера этилена и
винилацетата легко суспендируются в растворе поливинилового спирта, однако энергично агрегируют и коалесцируют или слипаются при последующей промывке в воде для удаления поливинилового спирта.
Смешивание сополимера этилена и винилацетата с возрастающими пропорциями поли(d1)молочной кислоты приводит к получению микросфер, которые обладают меньшей тенденцией к агрегации и коалесценции при
промывке водой, что показано на фиг. 15А. Смесь 50:50 сополимер этилена и винилацетата:поли(d1)молочная кислота образует микросферы, обладающие хорошей физической стабильностью, т.е. микросферы
остаются дискретными и хорошо суспендируются, при этом агрегация и коалесценция минимальны.
В образцах микросфер с "маленькими" размерами фракций диапазон размеров >95% микросфер (по весу) составляет от 10 до 30 микрон, а в образцах микросфер с "большими" размерами фракций диапазон размеров >95% микросфер (по весу) составляет от 30 до 100 микрон. Отдельные примеры микрофотографий, полученных с помощью сканирующего электронного микроскопа, для наполненных таксолом микросфер 50:50 сополимера этилена и винилацетата:поли((d1)молочная кислота в "маленьком" и "большом" диапазоне размеров приведены на фиг. 15В и 15С, соответственно. Микросферы являются сферическими и имеют гладкую поверхность; на поверхности микросфер не видно присутствия лекарства. Эффективность наполнения микросфер 50:50 сополимера этилена и винилацетата: поли(d1)молочная кислота составляет 95-100% при изначальной концентрации таксола в интервале от 100 до 1000 мг таксола на 50 мг полимера. Заметной разницы (t-тест Стьюдента, p<0,05) между эффективностью инкапсулирования "маленьких" и "больших" микросфер не отмечается.
Время высвобождения таксола из 0, 6%-ных (вес/об) наполненных 50:50 сополимера этилена и винилацетата: поли(d1)молочной кислоты приведены на фиг. 15D для "маленьких" размеров (незакрашенные кружки) и "больших" размеров (закрашенные кружки) микросфер. Исследования скорости высвобождения проводят, трижды повторяя эксперименты для трех трубок. Профили высвобождения лекарства показывают две фазы: быструю первичную фазу высвобождения таксола или "взрывную" фазу, которая продолжается в течение первых четырех дней для микросфер обоих диапазонов размеров микросфер. За ней следует фаза значительно более медленного высвобождения. Не отмечается значительных различий в скоростях высвобождения между "маленькими" и "большими" микросферами. 10-13% от общего количества содержащегося в микросферах таксола высвобождается в течение 50 дней.
Микросферы, наполненные таксолом (0,6% вес/об), исследуют с помощью анализа с использованием хорионалантоисной мембраны, результаты которого представлены на фиг. 15Е. Микросферы, полненные таксолом. высвобождают достаточное количество лекарства, чтобы создать лишенную сосудов зону в окружающих тканях (фиг. 15F). Следует отметить, что к микросферам (" MS" на фиг. 15Е и 15F) непосредственно примыкает зона, в которой полностью отсутствуют кровеносные сосуды (зона 1); далее от микросфер располагается область с разрушенными нефункционирующими капиллярами (зона 2); и лишь на расстоянии приблизительно 6 мм от микросфер капилляры возвращаются к нормальному состоянию. В хорионалантоисных мембранах, обработанных контрольными микросферами (таксол отсутствует), сохраняется нормальная архитектура сети капилляров.
Обсуждение
Химиоэмболизация артерий является инвазивным хирургическим способом. Таким образом, в идеальном случае, химиоэмболитические
составы, содержащие лекарства, подавляющие развитие сосудов, или противораковые лекарства, такие как таксол, высвобождают лекарство рядом с опухолью с концентрациями, достаточными для активного
действия в течение длительного периода времени - порядка нескольких месяцев. Сополимер этилена и винилацетата представляет собой совместимый с тканями неразлагаемый полимер, который часто используют
для контролируемой доставки макромолекул в течение длительных периодов времени (> 100 дней).
Сополимер этилена и винилацетата первоначально выбирают в качестве полимерного биоматериала для приготовления микросфер с растворенным в полимерной матрице таксолом. Однако микросферы, полученные с использованием 100%-ного сополимера этилена и винилацетата практически полностью агрегируют и коалесцируют при промывке.
Полимеры и сополимеры на основе молочной кислоты и гликолевой кислоты являются физиологически инертными и биосовместимыми и при гидролизе разлагаются на токсикологически приемлемые продукты. Сополимеры молочной кислоты и гликолевой кислоты разлагаются гораздо быстрее, чем сополимер этилена и винилацетата, и наполненные лекарством микросферы, приготовленные с использованием указанных сополимеров, как правило, непригодны для продолжительного контролируемого высвобождения лекарства в течение нескольких месяцев. Dollinger и Sawan смешали поли(d1)молочную кислоту с сополимером этилена и винилацетата и показали, что время разложение поли(d1молочной кислоты возрастает по мере возрастания доли сополимера этилена и винилацетата в смеси.
На фиг. 15А показано, что увеличение доли поли(d1)молочной кислоты в смеси сополимер этилена и винилацетата: поли(d1)молочная кислота приводит к уменьшению степени агрегации суспензии микросфер. Смеси с содержанием поли(d1)молочной кислоты в матрице сополимер этилена и винилацетата:поли(d1)молочная кислота дают физически стабильные суспензии микросфер в воде или забуференном фосфатом солевом физиологическом растворе. Смесь 50:50 сополимер этилена и винилацетата:поли(d1)молочная кислота выбирают для проведения дальнейших исследований.
Фракции микросфер с разными диапазонами размеров могут быть получены путем изменения концентрации эмульгатора - поливинилового спирта - в водной фазе. "Маленькие" микросферы получаются при большей концентрации поливинилового спирта, равной 5% (вес/об), в то время как "большие" микросферы получаются при концентрации поливинилового спирта, равной 2,5% (вес/об). Все остальные переменные при синтезе остаются одними и теми же для фракций микросфер обоих размеров. Большие концентрации эмульгатора приводят к более вязкой водной дисперсионной среде и к образованию более мелких капелек полимер/таксол/дихлорметан, эмульгированных в водной фазе и, таким образом, к более мелким микросферам. Наполненные таксолом микросферы содержат от 95 до 100% исходного количества таксола, добавленного в органическую фазу, инкапсулированную в твердых микросферах. Низкая растворимость таксола в воде способствует его перераспределению в органическую фазу, содержащую полимер.
Скорости высвобождения таксола из микросфер 50:50 сополимера этилена и винилацетата: поли(d1)молочная кислота являются очень низкими, так что в течение 50 дней выделяется менее 15% содержащегося таксола. Первичная фаза взрывного высвобождения лекарства может быть вызвана диффузией лекарства из приповерхностной области микросфер (расположенных недалеко от поверхности микросфер).
Механизм высвобождения лекарства из неразлагаемых полимерных матриц, таких как сополимер этилена и винилацетата, как полагают, включает диффузию воды сквозь дисперсную фазу лекарства в полимере, растворение лекарства и диффузию растворенного вещества через ряд взаимопроникающих наполненных жидкостью пор. Смеси сополимера этилена и винилацетата и поли(d1)молочной кислоты, как было показано, являются несмешивающимися и образуют две фазы в широком диапазоне от 30 до 70% сополимера этилена и винилацетата в поли(d1)молочной кислоте. При изучении разложения забуференного фосфатом физиологического солевого раствора при 37oС вслед за индукционным или скрытым периодом поли(d1)молочная кислота гидролитически разлагается и подвергается эрозии из полимерной матрицы сополимера этилена и винилацетата:поли(d1)молочная кислота, оставляя неактивный скелет, похожий на губку. Хотя индукционный период и скорость разложения и эрозии поли((d1)молочной кислоты в полимерной матрице зависят от пропорции поли(d1)молочной кислоты в матрице и от процесса получения. Поли(d1)молочная кислота практически не теряется в течение 40-50 дней.
Хотя некоторая эрозия поли(d1)молочной кислоты из микросфер 50:50 сополимер этилена и винилацетата:поли(d1)молочная кислота могла произойти в течение 50 дней при исследовании скорости высвобождения лекарства в условиях in vitro (фиг. 15С), наиболее вероятно, что основным механизмом высвобождения лекарства из смеси полимеров является диффузия растворенного вещества сквозь сеть пор в полимерной матрице.
По завершении исследования скорости высвобождения лекарства микросферы анализируют на остаточное содержание лекарства. Процентное содержание оставшегося таксола, сохраняющееся в течение 50 дней инкубации образца микросфер составляет 94% (+/-9%) и 89% (+/-12%) для фракций микросфер с "большими" и "маленькими" размерами.
Микросферы, наполненные 0,6 мг на 1 г полимера (0,6%), обеспечивают активное подавление процесса развития кровеносных сосудов при размещении на хорионалантоисной мембране цыпленка (фиг. 15Е и 15F).
Пример 9.
Инкапсулирование таксола в микросферах поли(ε-капролактона). Подавление развития кровеносных сосудов наполненными таксолом микросферами в анализе с использованием хорионалантоисной мембраны
В этом примере оценивается профиль скорости выделения таксола из биоразлагаемых микросфер поли(ε-капролактона) в условиях in vitro и показана ингибируюшая активность таксола,
выделившегося из микросфер, при нанесении на хорионалантоисную мембрану, по отношению к развитию кровеносных сосудов.
Реагентами, которые используют в этих экспериментах, являются поли(ε-капролактон) с молекулярным весом 35000-45000, который покупают у компании "Polysciences" (Уоррингтон, штат Пенсильвания), дихлорметан ("Fisher Scientific Co.", Канада), поливиниловый спирт (PVP) с молекулярным весом 12000-18000, гидролизованный на 99% (покупают у компании "Aldrich Chemical Co. ". Миллуоки, штат Висконсин) и таксол от компании "Sigma Chemical Co. " (Сент-Луис, штат Миссури). Если специально не оговаривается, все реактивы используют без дальнейшей очистки, всюду применяют дистиллированную воду.
А. Приготовление микросфер
Микросферы в
основном получают по методике, приведенной в Примере 8, используя способ с испарением растворителя. Если коротко, то микросферы с 5%-ным (вес/вес) содержанием таксола получают, растворяя 10 мг таксола
и 190 мг поликапролактона в 2 мл дихлорметана, добавляя 100 мл 1%-ного раствора поливинилового спирта PVP и перемешивая со скоростью 1000 об/мин при температуре 25oС в течение 2 час.
Суспензию микросфер центрифугируют с ускорением 1000 g в течение 10 минут ("Beckman GPR"), жидкость над осадком сливают и микросферы трижды промывают водой, сушат на воздухе и хранят при комнатной
температуре. Контрольные, микросферы (без таксола) получают, как указано ранее, получают также микросферы, содержащие 1% и 2% таксола. Размер микросфер определяют с помощью оптического микроскопа,
снабженного предметным столиком.
В. Эффективность инкапсулирования
Известные количества содержащих таксол микросфер (приблизительно 5 мг) растворяют в 8 мл ацетонитрила и для
осаждения полимера добавляют 2 мл воды. Смесь центрифугируют с ускорением 1000 g в течение 10 минут и количество инкапсулированного таксола определяют по поглощению жидкости над осадком с помощью УФ
спектрометра (спектрофотометр с диодной матрицей Hewlett-Packard 845 2А) на длине волны 232 нм.
С. Изучение выделения лекарства
Приблизительно 10 мг содержащих таксол мембран
суспендируют в 20 мл 10 мМ забуференного фосфатом физиологического раствора с рН 7,4 в снабженных закручивающейся крышкой стеклянных пробирках. Пробирки встряхивают, переворачивая вверх-вниз при
температуре 37oС и через определенные промежутки времени удаляют 19,5 мл жидкости над осадком (предварительно дав микросферам осесть на дно), отфильтровывают через мембранный фильтр с
размерами пор 0,45 мм и сохраняют фильтрат для анализа на таксол. В каждую пробирку доливают равный объем забуференного фосфатом физиологического раствора, чтобы поддерживать одинаковые условия
осаждения в течение всего эксперимента. Фильтрат экстрагируют 3 Х 1 мл дихлорметаном, экстракты в дихлорметане упаривают досуха в токе азота, вновь растворяют в 1 мл ацетонитрила и анализируют методом
жидкостной хроматографии высокого разрешения, используя в качестве подвижной фазы смесь вода: метанол: ацетонитрил (37:5:58) со скоростью подачи 1 мл/мин (изократический насос фирмы "Beckman"),
колонку С8 с обращенной фазой ("Beckman") и УФ детектор (Shimadzu SPD А) на длине волны 232 нм.
D. Изучение хорионалантоисной мембраны
До получения безоболочечной культуры
оплодотворенные эмбрионы цыплят выдерживают в инкубаторе 4 дня. На шестой день инкубации аликвоты по 1 мг микросфер, содержащих 5% таксола, и контрольных микросфер (без таксола) помещают
непосредственно на поверхность хорионалантоисной мембраны. По прошествии двух дней исследуют сосудистую систему с использованием стереомикроскопа, сопряженного с видеокамерой; сигналы видеокамеры
передают на компьютер и делают распечатку.
Е. Сканирующая электронная микроскопия
Микросферы помещают на держатель образцов, напыляют на них золото и получают микрофотографии
с помощью сканирующего электронного микроскопа Philips 501B с рабочим напряжением 15 кВ.
F. Результаты
Диапазон размеров для образцов микросфер лежит в интервале 30-100 мкм,
хотя во всех наполненных таксолом и контрольных микросферах некоторые микросферы выпадают из этого диапазона. Эффективность наполнения поликапролактоновых микросфер таксолом всегда составляет более
95% для всех изученных лекарств, сканирующая электронная микроскопия показывает, что все микросферы имеют сферическую форму с шероховатой и покрытой ямками поверхностью. На поверхности микросфер не
наблюдается следов твердого лекарства.
Выделение таксола с течением времени из поликапролактоновых микросфер, наполненных 1%, 2% и 5% таксола, показано на фиг. 16А. Профили скорости высвобождения показывают две фазы. Для всех нагрузок лекарства существует первоначальная быстрая или "взрывная фаза" выделения таксола. Взрывная фаза продолжается в течение 1-2 дней для концентраций таксола I % и 2% и 3-4 дня для 5%-ных микросфер. За первой фазой быстрого выделения следует фаза относительно медленного высвобождения лекарства. Для микросфер, содержащих 1% или 2% таксола, выделения таксола через 21 день не наблюдается. При нагрузке таксола, равной 5%, микросферы через 21 день выделяют 20% от общего содержания лекарства.
На фиг. 16В показана хорионалантоисная мембрана, обработанная контрольными поликапролактоновыми микросферами и на фиг. 16С показана обработка 5%-ными микросферами, загруженными таксолом. Хорионалантоисная мембрана с контрольными микросферами показывает обычную архитектуру сети капилляров. Хорионалантоисная мембрана, обработанная поликапролактоновыми микросферами, наполненными таксолом, показывает явно выраженную регрессию сосудов в зонах, в которых сеть капилляров отсутствует.
G. Обсуждение
Метод получения наполненных таксолом микросфер испарением растворителя позволяет добиться очень высокой
эффективности инкапсулирования таксола, составляющей 95-100%. Это объясняется плохой растворимостью таксола в воде и его гидрофобностъю, которая способствует перераспределению таксола в фазу
органического растворителя, содержащего полимер.
Двухфазный профиль выделения таксола является типичным для высвобождения многих лекарств из биоразлагаемых полимерных матриц. Поли(ε-капролактон) представляет собой алифатический полиэфир, который может разлагаться при гидролизе в физиологических условиях, не токсичен и совместим с тканями. Разложение поликапролактона протекает заметно медленнее, чем разложение интенсивно изучаемых полимеров и сополимеров молочной и гликолевой кислот, а потому он удобен для разработки систем для продолжительной доставки лекарства. Первоначальная фаза или взрывная фаза высвобождения таксола, как полагают, вызвана диффузией лекарства из приповерхностной области микросфер (расположенных недалеко от поверхности микросфер). Высвобождение таксола во второй (медленной) стадии профиля высвобождения, вероятно, не связано с разложением или эрозией поликапролактона, поскольку исследования показывают, что в условиях in vitro в воде не наблюдается значительной потери веса или эрозии поверхности поликапролактона в течение 7,5 недель. Более медленная фаза выделения таксола, вероятно, связана с растворением лекарства внутри наполненных жидкостью пор в полимерной матрице и диффузией через поры. Большая скорость высвобождения при больших нагрузках таксола, вероятно, является результатом более интенсивной сети пор внутри полимерной матрицы.
Было показано, что микросферы, содержащие 5% лекарства, высвобождают достаточное его количество, чтобы вызвать активное подавление процесса развития кровеносных сосудов при размещении на хорионалантоисной мембране. Ингибирование роста кровеносных сосудов приводит к появлению лишенной сосудов зоны, как это показано на фиг. 16С).
Пример 10.
Наполненные таксолом полимерные пленки, составленные этиленвинилацетатом и поверхностно-активным соединением
В основном получают пленки двух типов, как указано в Примере 10: пленки из
этиленвинилацетата, наполненные таксолом, и смешанные пленки этиленвинилацетат/поверхносно-активное вещество (т.е. Pluronic F127, Span 80 и Pluronic L101), наполненные таксолом.
Исследованные поверхностно-активные вещества представляют собой гидрофобные поверхностно-активные вещества (Span 80 и Pluronic L 101) и одно гидрофильное поверхностно-активное вещество (Pluronic F127). Плюроновые поверхностно-активные вещества сами являются полимерами, что является привлекательным, поскольку их можно смешать с этиленвинилацетатом, чтобы оптимизировать различные свойства по доставке лекарств. Span 80 представляет собой маленькую молекулу, которая тем или иным способом диспергируется в полимерной матрице и не образует смеси.
Поверхностно-активные вещества полезны для модифицирования скорости высвобождения таксола из пленок и оптимизации определенных физических свойств пленок. Одним свойством смешанных пленок, содержащих поверхностно-активное вещество, которое указывает на то, что можно контролировать скорости высвобождения, является их способность изменять скорость и степень набухания соединения в воде. Диффузия воды в матрицу полимер-лекарство критична для высвобождения лекарства из носителя. Фиг.17С и 17D показывают степень набухания пленок, и как при этом изменяется содержание поверхностно-активного вещества в смеси. Пленки из чистого этиленвинилацетата не набухают в сколько-нибудь заметной степени в течение двух месяцев. Однако, увеличивая содержание добавляемого к этиленвинилацетату поверхностно-активного вещества, можно увеличить степень набухания соединения, кроме того, набухание можно увеличить, повышая гидрофильность.
Результаты экспериментов с указанными пленками представлены далее на фиг. 17А-Е. Если коротко, то фиг. 17А показывает высвобождение таксола (в мг) с течением времени из пленок, полученных из чистого этиленвинилацетата. На фиг. 17B указано процентное содержание таксола, остающегося в тех же пленках, как видно из этих двух чертежей, при увеличении нагрузки таксола (т.е. по мере увеличения весового процентного содержания таксола) скорость высвобождения лекарства возрастает, показывая ожидаемую концентрационную зависимость. По мере увеличения нагрузки таксола процент таксола, остающегося в пленке, возрастает, что указывает на то, что большая нагрузка является более предпочтительной для составов, предназначенных для длительного действия.
Физическая прочность и эластичность пленок исследуется на фиг. 17Е. Если коротко, то фиг. 17Е показывает кривые зависимости напряжения от деформации для пленок из чистого этиленвинилацетата и смесей этиленвинилацетат - поверхностно-активное вещество. Эти приближенные измерения напряжений показывают, что эластичность пленок возрастает по мере добавления Pluronic F127, а прочность на разрыв при пластической деформации увеличивается в зависимости от увеличения концентрации по мере добавления Pluronic F127. Эластичность и прочность являются важными параметрами при приготовлении пленки, которую можно использовать в конкретных медицинских целях так, чтобы не наблюдалась деформация материала.
Приведенные выше данные показывают способность определенных поверхностно-активных веществ контролировать скорости высвобождения лекарства и изменять физические свойства носителя.
Пример 11. Включение метоксиполиэтиленгликоля 350 (MePEG) в поли(ε-капролактон) при получения композиции для контролируемой доставки таксола из пасты
Реагенты и оснастка,
которую используют в этих экспериментах, включает метоксиполиэтиленгликоль 350 (MePEG), получаемый из компании "Union Carbide" (Дэнбери, штат Коннектикут). Метоксиполиэтиленгликоль 350 представляет
собой жидкость при комнатной температуре и затвердевает при температуре от 10oС до минус 5oС.
А. Получение таксолсодержащей пасты на основе MePEG/PCL
Пасту на основе MePEG /PCL получают, растворяя некоторое количество таксола в MePEG, а затем поликапролактон. Одно из преимуществ этого способа заключается в том, что не требуется применение
дихлорметана.
В. Изучение температуры плавления
Температура плавления полимерных смесей PCL/MePEG может быть определена методом дифференциальной сканирующей калориметрии в
интервале температур от 30oС до 70oС со скоростью нагревания 2,5oС в минуту. Результаты этого эксперимента представлены на фиг. 18А и 18В. Если коротко, то как
показано на фиг.18A, температура плавления полимерной смеси (по данным термического анализа) уменьшается по мере увеличения содержания MePEG. Зависимость температуры плавления полимерных смесей от
концентрации MePEG приведена на фиг. 18A. Эти низкие величины температуры плавления приводят в итоге к увеличению времени, необходимого для затвердевания расплавов полимерных смесей, как это показано
на фиг. 18В. Для затвердевания расплава смеси 30:70 MePEG /PCL требуется вдвое больше времени, чем для самого поликапролактона.
С. Измерение хрупкости
Введение MePEG в
поликапролактон, видимо, приводит к получению менее хрупкого твердого вещества, по сравнению с самим поликапролактоном. В качестве "грубого" метода оценки взвешенную иглу бросают с равной высоты в
смеси полимеров, содержащих от 0% до 30% MePEG в поликапролактоне, и измеряют расстояние, на которое игла проникает в твердое вещество. Полученный график приведен на фиг. 18С. Приведенные значения
являются средними из четырех измерений с точностью + /-1 S.D. Для сравнения испытывают также образец парафина, в который игла проникает на длину 7,25 мм +/-0,3 мм.
D. Изучение
высвобождения таксола
Таблетки полимера (поликапролактона, содержащего 0%, 5%, 10% или 20% MePEG) выдерживают в инкубаторе в забуференном фосфатом солевом физиологическом растворе (рН 7,4)
при температуре 37oС и с течением времени замеряют процент изменения веса полимера, Как видно из фиг. 18D, весовые потери возрастают с увеличением первоначального содержания MePEG в смеси
полимеров. Вероятно, отмечаемые весовые потери вызваны высвобождением MePEG из полимерной матрицы в жидкость при инкубации. Это означает, что таксол должен легко высвобождаться из смесей MePEG/PCL,
так как таксол до включения в поликапролактон вначале растворяют в MePEG.
Е. Влияние различных
количеств MePEG на высвобождение таксола
Готовят термопасту, включающую от 0,
8% до 20% MePEG в поликапролактоне. Ее наполняют 1% таксола. Высвобождение таксола с течением времени из таблеток весом 10 мг в забуференном фосфатом солевом физиологическом растворе при температуре
37oС изучают методом жидкостной хроматографии высокого разрешения. Как показано на фиг. 18Е, количество MePEG в композиции не оказывает влияния на количество высвобождаемого таксола.
F. Влияние различного содержания таксола на общее количество таксола, выделяемого из смеси 20% MePEG/PCL
Готовят термопасту, содержащую 20% MePEG в поликапролактоне, наполненную от
0,2% до J0% таксола. Высвобождение таксола с течением времени определяют, как указано ранее. Как показано на фиг. 18F, количество таксола, высвобождаемого с течением времени, возрастает по мере
нагрузки таксола. Если же построить график зависимости в процентах от общего количества высвободившегося таксола, то порядок становится обратным (фиг. 18G), Таким образом, можно получить информацию об
остаточном таксоле в пасте и, если можно допустить, что полученные результаты позволяют провести экстраполяцию, то можно оценить период времени, за который таксол высвободится из термопасты,
содержащей 20% MePEG.
G. Анализ различных смесей MePEG/PGL на прочность
Для определения прочности "таблеток" твердого полимера с диаметром 0,88 см и средней толщиной 0,560 см
используют машину для проведения нагрузочных испытаний СТ-40. Полимерные таблетки представляют собой смеси MePEG с концентрацией 0%, 5%, 10% или 20% в поликапролактоне.
Результаты этих испытаний приведены на фиг. 18Н, где приведена зависимость предела прочности при пластической деформации и время разрушения от процентного содержания MePEG в смеси. Единственная переменная ANOVA показывает, что толщины таблеток в каждой группе одинаковы, как видно из фиг. 18Н, добавление MePEG к поликапролактону уменьшает твердость полученного вещества.
Пример 12. Влияние
содержащей таксол термопасты на развитие кровеносных сосудов in vivo
Оплодотворенные эмбрионы цыплят перед получением безоболочечной культуры выдерживают в инкубаторе в течение 4 дней, как
описано в Примере 2. Содержимое яиц высвобождают из оболочки, выливают в круглодонную стерильную стеклянную чашку и покрывают крышкой от чашки Петри.
Таксол вводят в термопасту в количестве 5%, 10% и 20% (вес/об), как указано ранее (см. Пример 10) и используют в следующих экспериментах. Высушенную нарезанную термопасту затем нагревают до температуры 60oС и сдавливают между двумя листами парпленки, делая ее плоской, и дают остыть. 6 эмбрионов получают термопасту, содержащую 20% таксола, а 6 эмбрионов получают термопасту, полученную аналогично, но не содержащую таксол. По одному эмбриону умирает в каждой группе, т.е. в контрольной и подвергнутой обработке группе остается по пять эмбрионов.
Кроме того, на 6-й день выдерживания в инкубаторе ненагруженную термопасту и термопасту, содержащую 20% таксола, нагревают до 60oС и помещают непосредственно на растущий край хорионалантоисной мембраны; такой обработке подвергают два эмбриона.
Не наблюдается отличий, полученных в этих двух различных способах нанесения, что указывает на то, что температура пасты в момент ее использования не является определяющим фактором.
Термопастой, содержащей 10% таксола, обрабатывают 11 хорионалантоисных мембран, а еще 11 хорионалантоисных мембран обрабатывают ненагруженной термопастой, в то время как термопастой, содержащей 5% таксола, обрабатывают 10 хорионалантоисных мембран, а еще 10 контрольных хорионалантоисных мембран обрабатывают ненагруженной термопастой. Через два дня (на 8 день инкубации) изучают сосудистую систему с помощью стереомикроскопа. Для усиления контраста деталей сосудов водят липозин II в виде непрозрачного белого раствора.
В эмбрионах, обработанных 5%-ной наполненной таксолом пастой, лишь у двух животных наблюдается максимальное ингибирование процессе развития кровеносных сосудов, в то время как у оставшихся восьми животных отмечается лишь пограничное влияние. У животных, обработанных 10%-ной наполненной таксолом термопастой, лишь у двух животных наблюдается максимальное ингибирование процесса развития кровеносных сосудов, в то время как у оставшихся девяти отмечается лишь пограничное влияние.
20%-ная наполненная таксолом термопаста вызывает появление обширных лишенных капилляров областей (см. фиг. 19В) у всех пяти хорионалантоисных мембран, которые подвергают указанному воздействию. Наибольшая степень ингибирования определяется как лишенная капилляров область с размерами 6Х6 мм. Все хорионалантоисные мембраны, подвергнутые обработке 20%-ной наполненной таксолом термопастой, показывают именно эту степень ингибирования процесса развития кровеносных сосудов. Для сравнения, контрольная (не нагруженная) термопаста не подавляет процесс развития кровеносных сосудов на хорионалантоисной мембране (см. фиг. 19А); эта картина при большем увеличении (отметим, что край пасты виден вверху образца) показывает, что сосуды, примыкающие к пасте, не подвергаются воздействию термопасты. Это указывает на то, что наблюдаемый эффект вызван замедленным высвобождением таксола, а не благодаря выделенному количеству и самому полимеру или вторичному воздействию пасты на развивающуюся сосудистую систему.
Проведенные исследования показывают, что термопаста высвобождает достаточное количество вещества, подавляющего развитие кровеносных сосудов (в данном случае таксол), для ингибирования нормального развития кровеносной сосудистой системы хорионалантоисной мембраны.
Пример 13. Воздействие содержащей таксол термопасты на рост опухоли и на развитие опухоли in vivo.
Оплодотворенные эмбрионы цыплят перед получением безоболочечной культуры выдерживают в инкубаторе в течение 3 дней. Содержимое яиц высвобождают, удаляя оболочку, расположенную вокруг воздушного пространства, отделяя мембрану внутренней оболочки и протыкая противоположный конец оболочки, и позволяют содержимому яйца осторожно вылиться из тупого конца. Содержимое яйца выливают в круглодонную стерильную стеклянную чашку, покрывают крышкой от чашки Петри и помещают в инкубатор с относительной влажностью 90% и с содержанием диоксида углерода 3% (см. Пример 2).
Мышам вводят клетки MDAY-D2 (муриновая лимфоидная опухоль) и дают им вырасти в опухоли весом 0,5-1,0 г. Мышей умерщвляют, место расположения опухоли протирают спиртом, вырезают, помещают в стерильную среду для выращивания культуры и в ламинарном потоке нарезают кубиками размером 1 мм. Перед размещением отсеченных опухолей в девятидневные эмбрионы поверхность хорионалантоисной мембраны осторожно накалывают иглой номер 30 для облегчения имплантации опухоли. Через 8 дней инкубации (4 дня после удаления оболочки) на хорионалантоисные мембраны помещают опухоли и дают им вырасти на хорионалантоисных мембранах в течение четырех дней, чтобы установилось кровоснабжение. Указанным методом получают четыре эмбриона, при этом на каждом эмбрионе размещают 3 опухоли. Из этих эмбрионов одну опухоль обрабатывают термопастой, содержащей 20% таксола, вторую опухоль - ненаполненной термопастой, а третья опухоль не подвергается обработке. Обработку продолжают в течение двух дней и оценивают полученные результаты.
Эксплантаты опухолей MDAY-D2 секретируют факторы
стимулирующие развитие кровеносных сосудов, которые инициируют врастание капилляров (из хорионалантоисной мембраны) в тело опухоли, позволяя
ей расти дальше. Поскольку все сосуды опухоли образуются из хорионалантоисной мембраны, а все клетки опухоли образуются из эксплантата, то становится возможным исследовать эффект от терапевтических
воздействий на два указанных процесса независимо. Этот анализ используют для определения эффективности наполненной таксолом термопасты на (а) ингибирование развития сосудистой системы опухоли и (b)
ингибирование роста самих клеток опухоли. Прямая стереомикроскопическая оценка in vivo и гистологическое изучение фиксированных тканей в этом исследовании показывают следующее. В опухолях,
обработанных термопастой, содержащей 20% таксола, наблюдается уменьшение количества кровеносных сосудов, которые снабжают опухоль (см. фиг. 20С и 20D), уменьшение количества кровеносных сосудов внутри
опухоли и уменьшение количества кровеносных сосудов по периферии опухоли (области, которая, как правило, наиболее насыщена сосудами в твердых опухолях), по сравнению с контрольными опухолями. Размеры
и масса опухолей начинают уменьшаться в течение двух дней проведения исследований. Кроме того, видно, что множество клеток эндотелия захватываются при делении клеток, указывая на то, что влияние
оказывается и на разрастание клеток эндотеля. Часто отмечается захват клеток при митотическом делении. 4 эмбриона показывают устойчивою картину:термопаста, содержащая 20% таксола, подавляет сосудистою
систему опухоли, в то время как термопаста не оказывает никакого эффекта.
Для сравнения, в хорионалантоисных мембранах, обработанных термопастами, не содержащими таксол, опухоли имеют хорошо развитую сеть сосудов, при этом количество и плотность сосудов возрастает, по сравнению с обычными окружающими тканями, и наблюдается значительно больше кровеносных сосудов, чем в опухолях, обработанных пастой, наполненной таксолом. Вновь образовавшиеся сосуды проникают в опухоль со всех углов и напоминают спицы, присоединенные к середине колеса (см. фиг. 20А. и 20В). В процессе исследования размер и масса опухолей продолжали возрастать. При гистологическом изучении по периферии опухоли наблюдается множество расширенных тонкостенных капилляров и при клеточном делении наблюдается немного эндотелия. Ткани опухоли имеют хорошо развитую сосудистую сеть и распространяются повсюду.
В качестве примера в двух опухолях одинакового размера (первоначально на момент эксплантации), размещенных на одной и той же хорионалантоисной мембране, получают следующие результаты. Для опухоли, обработанной термопастой, наполненной 20% таксола, величина опухоли составляет 330 мм Х 597 мм; непосредственная периферия опухоли имеет 14 кровеносных сосудов, в то время как в теле опухоли имеется лишь 3-4 небольших капилляра. Для опухоли, обработанной ненаполненной термопастой, величина опухоли составляет 623 мм Х 678 мм; непосредственная периферия опухоли имеет 54 кровеносных сосуда, в то время как в теле опухоли имеется 12-14 небольших капилляров. Кроме того, сама окружающая хорионалантоисная мембрана содержит намного больше кровеносных сосудов, по сравнению с областью, окружающей опухоль, обработанную таксолом. Эти исследования показывают, что термопаста высвобождает достаточные количества ингибитора развития кровеносных сосудов (в данном случае - таксола), чтобы подавить патологическое развитие кровеносных сосудов, которое сопровождает рост и развитие опухоли. В этих условиях процесс развития кровеносных сосудов максимально стимулируется клетками опухоли, которые продуцируют факторы, способствующие развитию кровеносных сосудов, и которые способны индуцировать врастание капилляров из окружающих тканей в тело опухоли. Термопаста, содержащая 20% таксола, способна блокировать этот процесс и ограничить способность тканей опухоли поддерживать адекватное кровоснабжение. Это приводит к уменьшению массы опухоли как за счет цитотоксического воздействия лекарства на сами клетки опухоли, так и за счет уменьшения снабжения ткани питательными веществами, необходимыми для роста и распространения опухоли.
Пример 14. Влияние термопасты, наполненной ингибитором развития кровеносных сосудов, на in vivo рост опухоли
в муриновой опухолевой модели
Муриновая модель опухоли MDAY-D2 может быть использована для исследования влияния локального медленного высвобождения химиотерапевтических и подавляющих развитие
кровеносных сосудов соединений, таких как таксол, на рост опухоли, метастазы опухоли и степень выживания животных. Клеточная линия MDAY-D2 выращивается в суспензии клеток, содержащей 5% сыворотки
плода коровы в альфа-среде. Клетки выдерживают инкубаторе при температуре 37oС во влажной атмосфере, содержащей 5% диоксида углерода и разбавляют в 15 раз через каждые 3 дня до тех пор не
получится достаточное количество клеток. После периода инкубации жизнеспособные клетки изучают с помощью оптического микроскопа, а затем центрифугируют с ускорением 1500 об/мин в течение 5 минут.
Добавляют забуференный фосфатом солевой физиологический раствор, чтобы получить разбавление 1000000 клеток на миллилитр.
Женские особи мышей DBA/2] акклиматизируются после поступления в течение 3-4 дней. Каждой мыши вводят подкожно в заднебоковую часть в виде инъекции 100000 клеток MDAY-D2 в 100 мл забуференного фосфатом физиологического солевого раствора. Предыдущие исследования показывают, что указанная процедура приводит к развитию через 3-4 дня в месте инъекции наблюдаемой визуально опухоли, достигающей через 14 дней веса 1,0-1,7 г, которая дает наблюдаемые визуально метастазы в печени в течение 19-25 дней после инъекции. В зависимости от цели изучения, терапевтическое вмешательство можно осуществить на любой стадии развития болезни.
Используя указанную выше животную модель, 20 мышам подкожно вводят инъекции 140000 клеток MDAY-D2 и дают опухолям вырасти. На 5-й день мышей разделяют на группы по пять мышей в каждой. Место опухоли вскрывают хирургически под наркозом и локально обрабатывают термопастой, наполненной лекарством, или контрольной термопастой, не затрагивая окружающие опухоль ткани, и рану закрывают. Группы из пяти мышей либо не подвергают обработке (рану просто зарывают), вводят лишь полимер (поликапролактон), либо термопасту, содержащую 10% таксола, или термопасту, содержащую 20% таксола (инъекции вводят лишь 4 животным), имплантируют рядом с местом, где находится опухоль. На 16 день мышей умерщвляют, опухоли извлекают и исследуют (поверхностно и гистологически) на предмет роста опухоли, метастазов опухоли, местной и общей токсичности вследствие обработки, воздействия на заживление раны, воздействия на развитие кровеносных сосудов опухоли и состояния пасты, оставшейся в месте иссечения.
Вес опухолей для каждого животного приведен в таблице III (см. в конце описания).
Термопаста, наполненная 20% таксола, уменьшает рост опухоли более чем на 85% (средний вес 0,105), по сравнению с контрольными животными (средний вес 0,681). У животных, подвергавшихся обработке только термопастой или термопастой, содержащей 10% таксола, наблюдается лишь умеренное воздействие на рост опухоли; вес опухоли уменьшился лишь на 10% и 35%, соответственно (фиг. 21А). Таким образом, термопаста, содержащая 20% таксола, оказывается более эффективной для подавления роста опухоли, чем термопаста, содержащая 10% таксола (см. фиг. 21С; см. также фиг. 21В).
Термопасту обнаруживают у некоторых животных в месте ее нанесения. Полимер в количестве от 0,026 г до 0,078 г обнаруживают у 8 из 15 мышей. У каждого животного из группы, подвергавшейся обработке термопастой с 20% таксола, остается некоторое количество полимера, свидетельствуя о том, что он менее подвержен растворению. Гистологически у опухолей, обработанных термопастой, содержащей таксол, наблюдается меньший некроз клеток и тканей, чем у контрольных опухолей. Сосудистая система сокращается и часто наблюдаются клетки эндотелия, захваченные при клеточном делении. Наполненная таксолом термопаста не оказывает ощутимого воздействия на целостность или насыщенность клетками кожи или тканей, окружающих опухоль. На первый взгляд процесс заживление ран не нарушен.
Из вышесказанного очевидно, что специфические варианты осуществления настоящего изобретения приведены здесь для иллюстрации и могут быть предложены различные их модификации, не противоречащие сущности настоящего изобретения и не выходящие за границы притязаний по настоящему изобретению. Таким образом, изобретение ограничивается лишь приведенной далее формулой изобретения.
Реферат
Изобретение относится к медицине. В настоящем изобретении заявляется стент для расширения просвета, расположенного внутри тела канала, и устранения непроходимости желчных протоков, мочеиспускательного канала, пищевода и трахеально-бронхиальной непроходимости, представляющий собой в общем случае трубчатую структуру, покрытую композицией, содержащей фактор, подавляющий развитие кровеносных сосудов, и полимерный носитель. В частности примером факторов, подавляющих развитие кровеносных сосудов, является таксол, его аналоги или его производные. Предложенный стент препятствует проникновению опухолей при снижении опасности закупорки отверстия стента. 2 с. и 19 з.п. ф-лы, 3 табл., 22 ил.
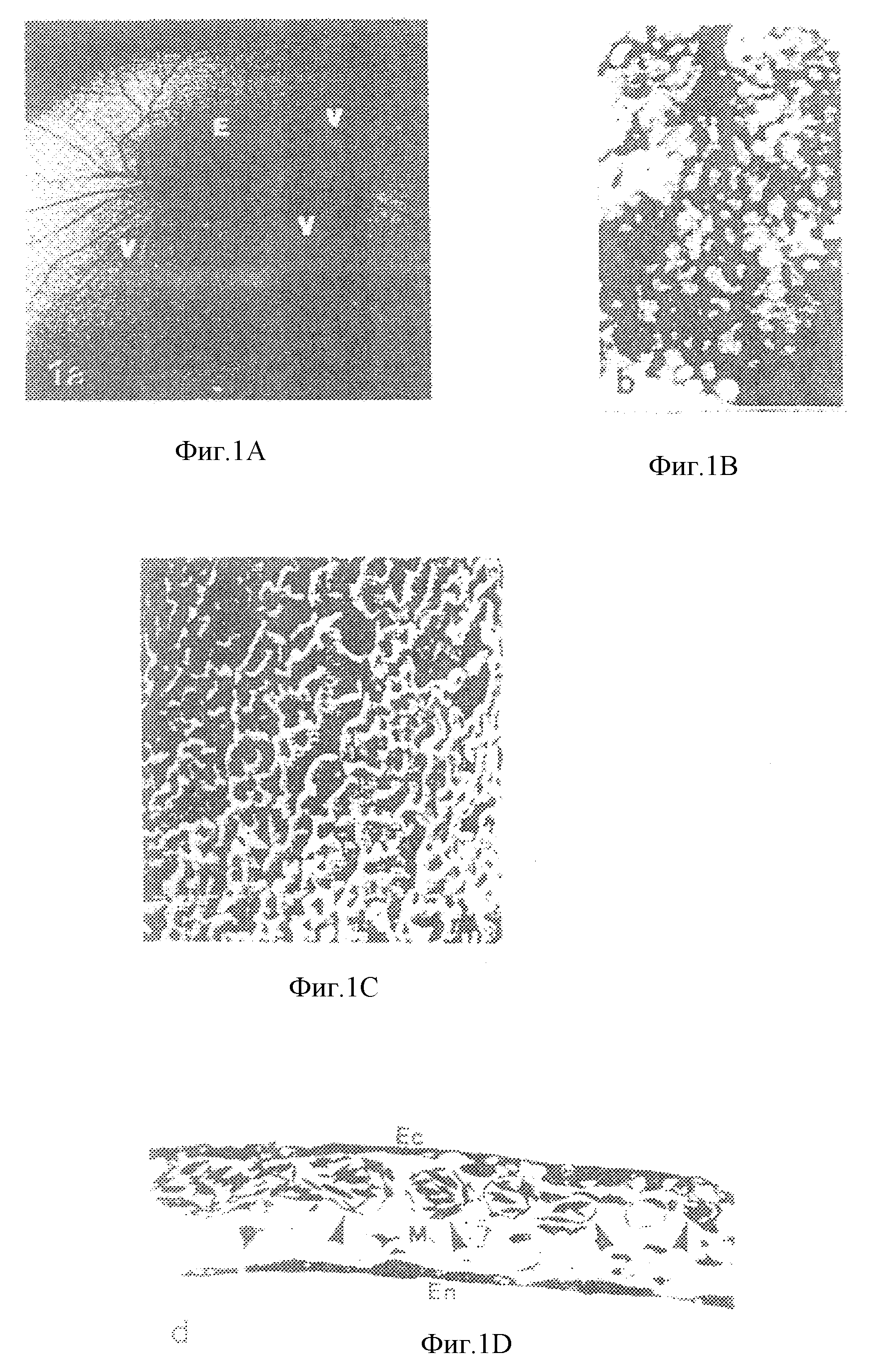

Комментарии