Составы на основе сунитиниба и способы их применения для лечения глазных заболеваний - RU2729731C2
Код документа: RU2729731C2
Чертежи








Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка претендует на приоритет и положительный эффект предварительной заявки США на патент №62/092,118 "Controlled Release Sunitinib Formulations", поданной 15 декабря 15, 2014 г, и предварительной заявки США на патент №62/139,306 "Method Of Prevention Of Corneal Neovascularization", поданной 27 марта 2015, содержание которых полностью включено в данную заявку посредством отсылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к составам на основе сунитиниба и его аналогов и фармацевтически приемлемых солей и к способам их применения, особенно применения для лечения глазных заболеваний и нарушений.
УРОВЕНЬ ТЕХНИКИ
Сунитиниб (продаваемый фирмой Pfizer в виде соли (-)яблочной кислоты как SUTENT® и известный ранее как SU 11248) представляет собой применяемый орально многоцелевой ингибитор рецепторов тирозинкиназ с малыми молекулами, который был одобрен FDA (Управлением по контролю за пищевыми продуктами и лекарственными средствами США) для лечения почечно-клеточной карциномы (RCC) и гастро-интестинальной стромальной опухоли, резистентной к иматинибу (GIST), 26 января 2006 г. Сунитиниб был первым противораковым лекарством, который был одобрен одновременно для двух разных назначений.
Сунитиниб ингибирует передачу сигналов в клетки путем направленного действия на многие рецепторы тирозинкиназ (RTKs). Эти рецепторы включают все рецепторы тромбоцитарного фактора роста (PDGF-Rs) и рецепторов 2 сосудистого эндотелиального фактора роста (VEGFRs), которые играют роль как в ангиогенезе опухолей, так и в пролиферации опухолевых клеток. Одновременное ингибирование этих мишеней приводит как к уменьшению васкуляризации, так и к гибели раковых клеток и, в конечном счете, к уменьшению массы опухоли.
Представляет интерес получение составов, которые могли бы доставлять сунитиниб или его аналог или фармацевтически приемлемую соль контролируемым образом в течение продолжительного периода времени. Однако это оказалось трудным из-за плохой растворимости лекарства в фармацевтических эксципиентах, что ограничивает содержание лекарственного вещества и приводит к получению нестабильных результатов.
Следовательно, цель данного изобретения заключается в обеспечении составов на основе сунитиниба или его аналога или фармацевтически приемлемой соли с увеличенной продолжительностью действия, стабильностью, безопасностью и эффективностью.
Другой целью настоящего изобретения является обеспечение способов инкапсулирования или введения в полимерные матрицы, включая нано- и микрочастицы, при повышенном содержании лекарства.
Еще одна цель данного изобретения состоит в обеспечении лекарственных форм, пролонгированной фармакокинетики и способов их применения.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Способы усовершенствования инкапсулирования или введения сунитиниба или его аналога или фармацевтически приемлемой соли в полимерные матрицы были уже разработаны. Получаемые составы обеспечивают более продолжительное контролируемое высвобождение сунитиниба или его аналога или соли при лечении рака, ингибировании ангиогенеза, лечении глазных заболеваний и при другом применении. Повышенное содержание лекарства достигается за счет применения системы щелочных растворителей, и/или повышения вязкости или концентрации полимерного раствора, как описано более подробно ниже.
Согласно одному из вариантов полимерный состав на основе сунитиниба получают путем: (i) растворения или диспергирования сунитиниба или его соли в органическом растворителе, необязательно в присутствии щелочного агента; (ii) смешения раствора/дисперсии, полученных на стадии (i), с раствором полимера, вязкость которого составляет по меньшей мере примерно 300 сП (или, возможно, по меньшей мере примерно 350, 400, 500, 600, 700 или 800 или более сП); (iii) смешения полимерного раствора/дисперсии лекарства со стадии (ii) с водным некислым или щелочным раствором (например, с величиной рН равной по меньшей мере примерно 7, 8 или 9 и обычно не более, чем примерно 10) необязательно в присутствии поверхностно-активного вещества или эмульгатора с образованием инкапсулированной микрочастицы сунитиниба, насыщенной растворителем, (iv) выделения микрочастиц. Было установлено, что, когда используется сутиниба малат или другая фармацевтически приемлемая соль, может быть полезно включать в органический растворитель щелочной агент. Однако, было обнаружено, что, когда применяют свободное основание сунитиниба, добавление кислоты к органическому растворителю может обеспечить повышение содержания лекарства в микрочастице. Примеры показывают, что сложные полиэфиры, такие как PLGA, PEG-PLGA(PLA) и смесь микрочастиц PEG-PLGA/PLGA характеризуются продолжительным высвобождением сунитиниба или его аналога или фармацевтически приемлемой соли. Микрочастицы полимеров, состоящие из PLGA и PEG, ковалентно конъюгированных с PLGA (Mw 45 кДа) (PLGA45k-PEG5k), содержащие сутиниба малат, были получены с использованием способа однократного выпаривания растворителя в эмульсии. Повышение содержания лекарственного вещества было достигнуто путем увеличения щелочности малата сунитиниба в растворе до 16.1% при помощи PEG-PLGA, которое может быть далее повышено за счет добавления DMF, по сравнению с величиной равной только 1% при отсутствии добавления щелочи. Содержание малата сунитиниба было далее увеличено путем повышения величины рН водного раствора, а также раствора полимера. Еще более высокое содержание малата сунитиниба в микрочастицах было достигнуто при увеличении концентрации или вязкости полимера.
Полимерная композиции лекарства, полученная согласно данному изобретению, может быть использована для получения имплантатов (например, стержней, дисков, капсул и т.д.), наночастиц или микрочастиц с улучшенными свойствами для контролируемой доставки лекарств. Фармацевтические композиции, включающие имплантаты (например, в виде стержней, дисков, капсул и т.д.), наночастицы, микрочастицы или их комбинации для контролируемого высвобождения сунитиниба или его аналога или фармацевтически приемлемой соли могут быть получены путем соединения лекарства в матрице с одним или более фармацевтически приемлемыми эксципиентами. Наночастицы, микрочастицы или их комбинации могут быть получены соединением одного или более лекарств или смесей лекарств с одним или более полимерами.
Фармацевтические композиции могут вводиться для лечения или профилактики заболевания в глазу или на поверхности глаза пациента, ассоциированного с неоваскуляризацией, такого как неоваскуляризация роговицы и влажная или сухая возрастная макулярная дегенерация (AMD).
Иллюстративные примеры с применением животных моделей подтверждают, что составы на основе сунитиниба или его фармацевтически приемлемой соли эффективны при лечении неоваскуляризации роговицы, хориоидальной васкуляризации AMD и при профилактике повреждения зрительных нервов из-за повышенного внутриглазного давления.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На Фигуре 1 представлен график зависимости эффективности инкапсулирования от величины концентрации полимера (мг/мл).
На Фигуре 2А представлен график зависимости кумулятивного высвобождения сунитиниба малата при температуре 37°С из различных полимерных микрочастиц в зависимости от времени (в днях).
На Фигуре 2В представлен график, показывающий, что увеличение концентрации полимера повышает эффективность инкапсулирования сунитиниба малата, показана зависимость эффективности инкапсулирования в зависимости от концентрации полимера (мг/мл).
Фигура 3 показывает график профиля in vitro высвобождения сунитиниба малата из MS (из микросфер).
На Фигуре 4 представлен график, отражающий кривую удерживания свободного сунитиниба малата и малата сунитиниба в MS.
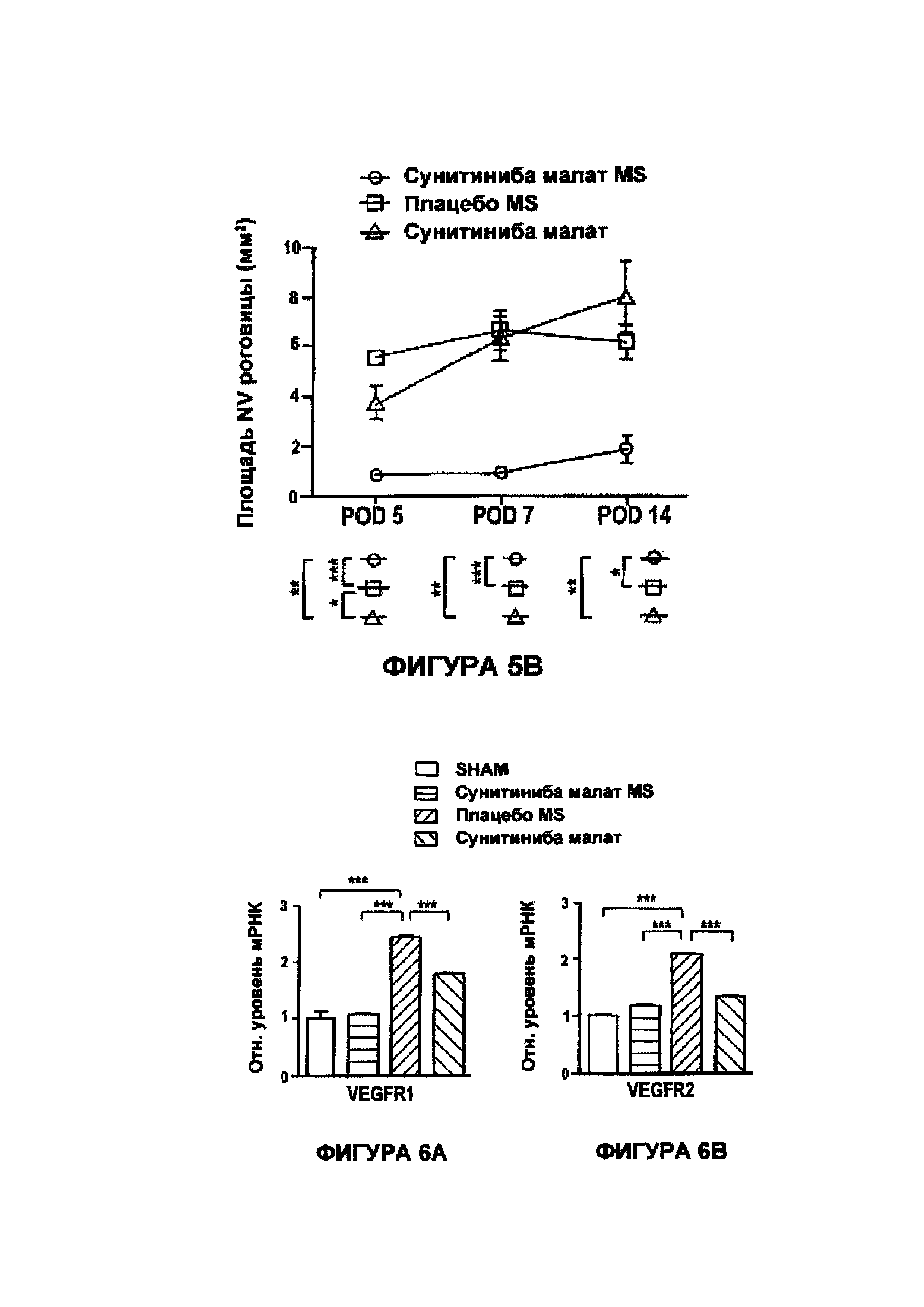
На Фигурах 5А и 5В приведены графики, показывающие результаты количественного анализа неоваскуляризации роговицы (длина сосуда, Фигура 5А, и поверхность NV, Фигура 5В) в POD 5, POD 7 и POD 14 в случаях лечения при SC инъекции сунитиниба малата в MS, свободного малата сунитиниба и плацебо - MS.
На Фигурах 6А-6М приведены столбчатые графики результатов анализа RT-PCR, показывающие сильное подавление уровней экспрессии целевых генов сунитиниба малатом в MS по сравнению со свободным сунитиниба малатом и плацебо - MS в POD 7.
На Фигурах 7A-7D представлены графики, показывающие, что микрочастицы сунитиниба малата подавляют NV в мышиной модели CNV в течение по меньшей мере 9 недель после инъекции в стекловидное тело нормальных мышей С57В1/6. Сразу же, через 2, 4 или 8 недель у мышей (n=5) разрушали лазером мембрану Бруха и через одну неделю количественно определяли размер повреждений, вызванных CNV. Фигура 7А, через одну неделю; Фигура 7В, через три недели; Фигура 7С, через пять недель; Фигура 7D, через девять недель. Р<0.05 для всех обработанных групп сравнивали с контрольными значениями
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
I. Определения
Термин "активный агент," используемый в данной заявке, относится к физиологически или фармакологически активному веществу, которое действует локально и/или системно в организме. Активный агент является веществом, которое вводится пациенту для лечения (например, терапевтическим агентом), профилактики (например, профилактическим агентом) или диагностики (например, диагностическим агентом) заболевания или нарушения. Термин "офтальмологическое лекарство" или "офтальмологический активный агент", используемый в данной заявке, относится к агенту, который вводится пациенту для облегчения, задержки начала или предотвращения одного или более симптомов заболевания или нарушения в глазу или к диагностическому агенту, пригодному для получения изображения или другой оценки состояния глаза.
Термин "эффективное количество" или "терапевтически эффективное количество," используемый в данной заявке, относится к количеству лекарства, эффективному для облегчения, задержки начала или предотвращения одного или более симптомов, в особенности рака или другого заболевания, или нарушения состояния глаза. В случае возрастной макулярной дегенерации эффективное количество лекарства замедляет, уменьшает или предотвращает потерю зрения у пациента.
Используемый в данной заявке термин "щелочное" относится к соединению, способному принимать кислый протон или иначе повышать величину рН композиции.
Термин "биосовместимые" и "биологически совместимые," используемый в данной заявке, обычно относится к материалам, которые вместе с любыми метаболитами или их продуктами разложения обычно являются нетоксичными для реципиента и не вызывают никаких вредных эффектов у реципиента. Говоря в общем, биосовместимые материалы являются материалами, которые не вызывают значительного воспалительного или иммунного ответа при введении пациенту.
Термин "биоразлагаемый полимер," используемый в данной заявке, обычно относится к полимеру, который будет разлагаться или разрушаться при ферментативном действии и/или гидролизе в физиологических условиях на меньшие части или химические фрагменты, которые способны подвергаться метаболизму, выводиться или выделяться субъектом. Время разложения является функцией состава полимерной композиции, морфологии, такой как пористость, размеры частиц, и окружающей среды.
Термин "гидрофильный," используемый в данной заявке, относится к свойству иметь сродство к воде. Например, гидрофильные полимеры (или гидрофильные полимеры -это повтор) представляют собой полимеры (или полимеры - повтор), которые прежде всего растворяются в водных растворах и/или имеют тенденцию к поглощению воды. В общем, чем более гидрофильным является полимер, тем больше этот полимер стремится растворяться, смешиваться с водой или смачиваться водой.
Термин "гидрофобный," используемый в данной заявке, относится к отсутствию сродства к воде или даже к отталкиванию воды. Например, чем более гидрофобным является полимер (или полимер - повтор), тем более этот полимер (или полимер - повтор) стремится не растворяться в воде, не смешиваться с водой или даже не смачиваться водой.
О гидрофильности или гидрофобности можно говорить относительно, например, но без ограничения, как о спектре гидрофильности/гидрофобности в группе полимеров или полимеров (повтор) В соответствии с некоторыми вариантами, когда речь идет о двух или более полимерах, термин "гидрофильный полимер" может быть определен на основании относительной гидрофобности полимера при сравнении с другим более гидрофильным полимером.
Термин "наночастица," используемый в данной заявке, обычно относится к частице, имеющей диаметр, например, средний диаметр, от примерно 10 нм до, но включая, примерно 1 микрона, например, от примерно 100 нм до примерно 1 микрона. Эти частицы могут иметь любую форму. Наночастицы, имеющие сферическую форму, обычно называются "наносферами".
Термин "микрочастица," используемый в данной заявке, обычно относится к частице, имеющей диаметр, например, средний диаметр, от примерно 1 микрона до примерно 100 микрон, например, от примерно 1 микрона до примерно 50 микрон, более предпочтительно, например, от примерно 1 до примерно 30 микрон. Микрочастицы могут иметь любую форму. Микрочастицы, имеющие сферическую форму, обычно называются "микросферами" ("MS").
Термин "молекулярная масса," используемый в данной заявке, обычно относится к относительной средней длине цепи блочного полимера, если не указано иное. На практике, молекулярная масса может быть определена или охарактеризована с применением различных методов, включая гель-проникающую хроматографию (GPC) или капиллярную вискозиметрию. Молекулярные массы, определенные методом GPC, указываются как средневесовые молекулярные массы (Mw) в противоположность среднечисловым молекулярным массам (Mn). Капиллярная вискозиметрия обеспечивает получение молекулярной массы как характеристической вязкости, определенной для разбавленного раствора полимера с применением конкретного набора величин концентрации, температуры и растворителей.
Термин "средний размер частиц," используемый в данной заявке, обычно относится к статистическому среднему размеру частиц (диаметру) в популяции частиц. Диаметр по существу сферической частицы может относиться к физическому или гидродинамическому диаметру. Диаметр несферической частицы может относиться предпочтительно к гидродинамическому диаметру. Используемый в данной заявке термин "диаметр несферической частицы" может относиться к самому большому линейному расстоянию между двумя точками на поверхности частицы. Средний размер частиц может быть измерен с применением методов, известных в уровне техники, например, метода динамического светорассеяния.
Термины "монодисперсное" и "гомогенное распределение частиц по размерам" используются в данной заявке как взаимозаменяемые и описывают популяцию наночастиц и микрочастиц, когда все частицы имеют один и тот же или почти одинаковый размер.
Используемый в данной заявке термин "монодисперсное распределение" относится к распределению частиц, когда 90% или более распределения находится среди 15% величин среднего размера частиц, более предпочтительно, среди, например, 10% величин среднего размера частиц, наиболее предпочтительно, например, среди 5% величин среднего размера частиц.
Термин "фармацевтически приемлемые", используемый в данной заявке, обычно относится к соединениям, носителям, эксципиентам, композициям и/или лекарственным формам, которые, с точки зрения здравого медицинского суждения, пригодны для использования в контакте с тканями людей и животных без наличия чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений с разумным отношением польза/риск.
Термин "имплантат," обычно используемый в данной заявке, относится к полимерному приспособлению или элементу, которые имеют структуру, размер и конфигурацию, подходящие для имплантации, например, путем инъекции или хирургической имплантации в конкретном участке тела таким образом, чтобы обеспечить терапевтическую пользу при высвобождении одного или более активных агентов в течение продолжительного периода времени в месте имплантации. Например, внутриглазные имплантаты являются полимерными устройствами или элементами, которые имеют структуру, размер и конфигурацию, подходящие для помещения в глаз, например, путем инъекции или хирургической имплантации, и для лечения одного или более заболеваний или нарушений в глазу при высвобождении одного или более лекарств в течение продолжительного периода времени. Внутриглазные имплантаты являются обычно биосовместимыми с физиологическими условиями в глазах и не вызывают неблагоприятных побочных эффектов. Внутриглазные имплантаты обычно могут быть помещены в глаз без ухудшения зрительного восприятия глаза.
II. Композиции
А. Сунитиниб
Сунитиниб является соединением формулы (1):
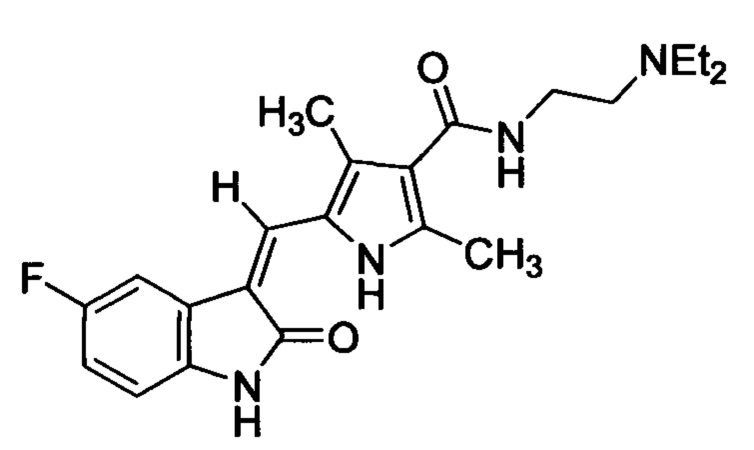
Сутиниба малат представляет собой соль сутиниба и (-)яблочной кислоты, которая продается как Sutent:

Как описано в данной заявке, аналоги сунитиниба имеют формулу:

где
R1 выбран из группы, состоящей из водорода, галогена, алкила, циклоалкила, арила, гетероарила, гетероалициклила, гидрокси, алкокси, -(CO)R15, -N-NR13R14, -(CH2)rR16 и -C(O)NR8R9;
R2 выбран из группы, состоящей из водорода, галогена, алкила, тригалогенметила, гидрокси, алкокси, циано, -NR13R14, -NR13C(O)R14, -C(O)R15, арила, гетероарила, -S(O)2NR13R14 и -SO2R20 (где R20 обозначает алкил, арил, аралкил, гетероарил и гетероалкил);
R3 выбран из группы, состоящей из водорода, галогена, алкила, тригалогенметила, гидрокси, алкокси, -(CO)R15, -NR13R14, арила, гетероарила, -NR13S(O)2R14, -S(O)2NR13R14, -NR13C(O)R14, -NR13C(O)OR14 и -SO2R20 (где R20 обозначает алкил, арил, аралкил, гетероарил и гетероалкил);
R4 выбран из группы, состоящей из водорода, галогена, алкила, гидрокси, алкокси и -NR13R14;
R5 выбран из группы, состоящей из водорода, алкила и -C(O)R10;
R6 выбран из группы, состоящей из водорода, алкила и -C(O)R10;
R7 выбран из группы, состоящей из водорода, алкила, арила, гетероарила, -C(O)R17 и -C(O)R10; или
R6 и R7 могут быть соединены с образованием группы, выбранной из группы, состоящей из -(CH2)4-, -(СН2)5- и -(CH2)6-; при условии, что по меньшей мере один из R5, R6 или R7 должен обозначать -C(O)R10;
R8 и R9 независимо выбраны из группы, состоящей из водорода, алкила и арила;
R10 выбран из группы, состоящей из гидрокси, алкокси, арилокси, -N(R11) (CH2)nR12, и -NR13R14;
R11 выбран из группы, состоящей из водорода и алкила;
R12 выбран из группы, состоящей из-NR13R14, гидрокси, -C(O)R15, арила, гетероарила, -N+(O-)R13R14, -N(OH)R13 и -NHC(O)Ra (где Ra обозначает незамещенный алкил, галогеналкил или аралкил);
R13 и R14 независимо выбраны из группы, состоящей из водорода, алкила, цианалкила, циклоалкила, арила и гетероарила; или
R13 и R14 могут быть соединены с образованием гетероциклической группы;
R15 выбран из группы, состоящей из водорода, гидрокси, алкокси и арилокси;
R16 выбран из группы, состоящей из гидрокси, -C(O)R15, -NR13R14 и -C(O)NR13R14;
R17 выбран из группы, состоящей из алкила, циклоалкила, арила и гетероарила;
R20 обозначает алкил, арил, аралкил или гетероарил; и
n и r независимо обозначают 1, 2, 3 или 4;
или они являются фармацевтически приемлемыми солями.
В данной заявке используются следующие определения:
Термин "алкил" относится к насыщенному алифатическому углеводородному радикалу, включая линейные цепи и разветвленные цепи из 1-20 атомов углерода (когда в данной заявке указывается численный интервал, например, "1-20", это означает, что указанная группа, в данном случае алкильная группа, может содержать 1 атом углерода, 2 атома углерода, 3 атома углерода и т.д. до, в том числе включая, 20 атомов углерода). Алкильные группы, содержащие от 1 до 4 атомов углерода, называются низшими алкильными группами. Когда низшие алкильные группы не содержат заместителей, они называются незамещенными низшими алкильными группами. Более предпочтительно, когда алкильная группа является алкилом среднего размера, содержащим 1-10 атомов углерода, например, метилом, этилом, пропилом, 2-пропилом, н-бутилом, изобутилом, трет-бутилом и пентилом. Наиболее предпочтительно, когда низший алкил содержит 1-4 атома углерода, например, это могут быть метил, этил, пропил, 2-пропил, н-бутил, изобутил или трет-бутил. Алкильная группа может быть замещенной или незамещенной. В случае замещенной группы замещающей группой(-ами) может(-ут) быть, например, один или более, более предпочтительно, например, один-три, даже более предпочтительно, например, один или два заместителя(-ей), независимо выбранных из группы, состоящей из галогена, гидрокси, незамещенной низшей алкоксигруппы, арила, необязательно замещенного одной или более группами, например, одной, двумя или тремя группами, которые независимо друг от друга обозначают галоген, гидрокси, незамещенный низший алкил или незамещенную низшую алкоксигруппу, арилокси, необязательно замещенный одной или более группами, например, одной, двумя или тремя группам, которые независимо друг от друга обозначают галоген, гидрокси, незамещенный низший алкил или незамещенную низшую алкоксигруппу, 6-членный гетероарил, содержащий от 1 до 3 атомов азота в кольце, при этом атомы углерода в кольце необязательно замещены одной или более группами, например, одной, двумя или тремя группам, которые независимо друг от друга обозначают галоген, гидрокси, незамещенный низший алкил или незамещенную низшую алкоксигруппу, 5-членный гетероарил, содержащий от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, при этом атомы углерода и атомы азота в группе необязательно замещены одной или более группами, например, одной, двумя или тремя группами, которые независимо друг от друга обозначают галоген, гидрокси, незамещенный низший алкил или незамещенную низшую алкоксигруппу, 5- или 6-членную гетероалициклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, при этом атомы углерода и атомы азота (если они содержатся) в группе необязательно замещены одной или более группами, например, одной, двумя или тремя группами, которые независимо друг от друга обозначают галоген, гидрокси, незамещенный низший алкил или незамещенную низшую алкоксигруппу, меркаптогруппу, (незамещенный низший алкил)тио, арилтио, необязательно замещенный одной или более группами, например, одной, двумя или тремя группами, которые независимо друг от друга обозначают галоген, гидрокси, незамещенный низший алкил или незамещенную низшую алкоксигруппу, циано, ацил, тиоацил, О-карбамил, N-карбамид, О-тиокарбамил, N-тиокарбамил, С-амидо, N-амидо, нитро, N-сульфонамидо, S-сульфонамидо, R18S(O)-, R18S(O)2-, -C(O)OR18, R18C(O)O- и -NR18R19, при этом R18 и R19 независимо выбраны из группы, состоящей из водорода, незамещенного низшего алкила, тригалогенметила, незамещенного (С3-С6)циклоалкила, незамещенного низшего алкенила, незамещенного низшего алкинила и арила, необязательно замещенного одной или более группами, например, одной, двумя или тремя группами, которые независимо друг от друга обозначают галоген, гидрокси, незамещенный низший алкил или незамещенную низшую алкоксигруппу.
Согласно одному из вариантов алкильная группа замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из гидрокси, 5- или 6-членной гетероалициклической группы, содержащей от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, при этом атомы углерода и атомы азота (если они содержатся) в группе необязательно замещены одной или более группами, например, одной, двумя или тремя группами, которые независимо друг от друга обозначают галоген, гидрокси, незамещенный низший алкил или незамещенную низшую алкоксигруппу, 5-членный гетероарил, содержащий от 1 до 3 гетероатома, выбранные из группы, состоящей из азота, кислорода и серы, при этом атомы углерода и атомы азота в группе необязательно замещены одной или более группами, например, одной, двумя или тремя группами, которые независимо друг от друга обозначают галоген, гидрокси, незамещенный низший алкил или незамещенную низшую алкоксигруппу, 6-членный гетероарил, содержащий от 1 до 3 атомов азота в кольце, при этом атомы углерода в кольце необязательно замещены одной или более группами, например, одной, двумя или тремя группами, которые независимо друг от друга обозначают галоген, гидрокси, незамещенный низший алкил или незамещенную низшую алкоксигруппу, или -NR18R19, где R18 и R19 независимо выбраны из группы, состоящей из водорода, незамещенного низшего алкила. Согласно некоторым вариантам, алкильная группа, например, является замещенной одним или двумя заместителями, которые независимо друг от друга обозначают гидрокси, диметиламино, этиламино, диэтиламино, дипропиламино, пирролидино, пиперидино, морфолино, пиперазино, 4-низший алкилпиперазино, фенил, имидазолил, пиридинил, пиридазинил, пиримидинил, оксазолил и триазинил.
Термин "циклоалкил" относится к 3-8-членному моноциклическому кольцу, целиком состоящему из атомов углерода, полностью углеродному 5-членному/6-членному или 6-членному/6-членному конденсированному бициклическому кольцу или к полициклическому конденсированному кольцу ("конденсированная" кольцевая система означает, что каждое кольцо в системе делит соседнюю пару атомов углерода с каждым другим кольцом в системе), причем одно или более колец могут содержать одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной π - электронной системы. Примерами циклоалкильных групп являются циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексадиенил, адамантил, циклогептанил и циклогептатриенил. Циклоалкильная группа может быть замещенной или незамещенной. В случае замещенных групп замещающие группы могут представлять собой, например, одну или более групп, например, один или более заместителей, независимо выбранных из группы, состоящей из незамещенного низшего алкила, тригалогеналкила, галогена, гидрокси, незамещенной низшей алкоксильной группы, арила, необязательно замещенного одним или более группами, например, одной или двумя группами, каждая из которых независимо обозначает галоген, гидрокси, незамещенный низший алкил или незамещенную низшую алкоксильную группу, арилоксигруппу, необязательно замещенную одной или более, например, одной или двумя группами, каждая из которых независимо обозначает галоген, гидрокси, незамещенный низший алкил или незамещенную низшую алкоксильную группу, 6-членный гетероарил, содержащий от 1 до 3 атомов азота в кольце, при этом атомы углерода в кольце являются необязательно замещенными одной или более, например, одной или двумя группами, каждая из которых независимо обозначает галоген, гидрокси, незамещенный низший алкил или незамещенную низшую алкоксильную группу, 5-членный гетероарил, содержащий от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, при этом атомы углерода и атомы азота этой группы являются необязательно замещенными одной или более, например, одной или двумя группами, каждая из которых независимо обозначает галоген, гидрокси, незамещенный низший алкил или незамещенную низшую алкоксильную группу, 5- или 6-членную гетероалициклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, при этом атомы углерода и атомы азота (если они есть) этой группы являются необязательно замещенными одной или более, например, одной или двумя группами, каждая из которых независимо обозначает галоген, гидрокси, незамещенный низший алкил или незамещенную низшую алкоксильную группу, меркаптогруппу (незамещенный низший алкил)тио, арилтио, необязательно замещенный одной или более, например, одной или двумя группами, каждая из которых независимо обозначает галоген, гидрокси, незамещенный низший алкил или незамещенную низшую алкоксильную группу, циано, ацил, тиоацил, О-карбамил, N-карбамил, О-тиокарбамил, N-тиокарбамил, С-амидо, N-амидо, нитро, N-сульфонамидо, S-сульфонамидо, R18S(O)-, R18S(O)2-, -C(O)OR18, R18C(O)O- и -NR18R19, определение которых дано выше.
Термин "алкенил" относится к низшей алкильной группе, определение которой дано в данной заявке, состоящей по меньшей мере из двух атомов углерода и по меньшей мере одной двойной углерод-углеродной связи. Репрезентативные примеры включают, но без ограничения, этенил, 1-пропенил, 2-пропенил и 1-, 2- или 3-бутенил.
Термин "алкинил" относится к низшей алкильной группе, определение которой дано в данной заявке, состоящей по меньшей мере из двух атомов углерода и по меньшей мере одной тройной углерод-углеродной связи. Репрезентативные примеры включают, но без ограничения, этинил, 1-пропинил, 2-пропинил и 1-, 2- или 3-бутинил.
Термин "арил" относится к полностью углеродным моноциклическим или конденсированным полициклическим (то есть, к кольцам, которые делят соседние пары атомов углерода) группам, содержащим 1-12 атомов углерода, имеющим полностью сопряженную π-электронную систему. Примерами арильных групп, но без ограничения, являются фенил, нафталинил и антраценил. Арильные группы могут быть замещенными и незамещенными. Если они являются замещенными, замещающие группа (группы) являются, например, одной или более группами, например, одной, двумя или тремя группами, независимо выбранными из группы, состоящей из незамещенного низшего алкила, тригалогеналкила, галогена, гидрокси, ненасыщенной низшей алкоксильной группы, меркаптогруппы, (незамещенного низшего алкил)тио, циано, ацила, тиоацила, О-карбамила, N-карбамила, О-тиокарбамила, N-тиокарбамила, С-амидо, N-амидо, нитро, N-сульфонамидо, S-сульфонамидо, R18S(O)-, R18S(O)2-, -C(O)OR18, R18C(O)O- и -NR18R19, при этом определение R18 и R19 дано выше. Например, арильная группа является необязательно замещенной одним или двумя заместителями, независимо выбранными из галогена, незамещенного низшего алкила, тригалогеналкила, гидрокси, меркаптогруппы, циано, N-амидо, моно- или диалкиламино, карбокси или N-сульфонамидо.
Термин "гетероарил" относится к моноциклическим или конденсированным кольцевым (то есть, к кольцам, которые делят соседние пары атомов углерода) группам, содержащим 5-12 атомов в кольце, содержащем один, два или три гетероатома, выбранных из N, О или S, причем остальные атомы в кольце являются атомами углерода, и, в дополнение имеющими полностью сопряженную π-электронную систему. Примерами незамещенных гетероарильных групп, без ограничения, являются пирролил, фуранил, тиофенил, имидазолил, оксазолил, тиазолил, пиразолил, пиридинил, пиримидинил, хинолинил, изохинолинил, пуринил и карбазолил. Гетероарильная группа может быть замещенной или незамещенной. Если она является замещенной, замещающие группа (группы) являются, например, одной или более группами, например, одной, двумя или тремя группами, независимо выбранными из группы, состоящей из незамещенного низшего алкила, тригалогеналкила, галогена, гидрокси, ненасыщенной низшей алкоксильной группы, меркаптогруппы, (незамещенного низшего алкил)тио, циано, ацила, тиоацила, О-карбамила, N-карбамила, О-тиокарбамила, N-тиокарбамила, С-амидо, N-амидо, нитро, N-сульфонамидо, S-сульфонамидо, R18S(O)-, R18S(O)2-, -C(O)OR18, R18C(O)O- и -NR18R19, при этом определение R18 и R19 дано выше. Например, гетероарильная группа является необязательно замещенной одним или двумя заместителями, независимо выбранными из галогена, незамещенного низшего алкила, тригалогеналкила, гидрокси, меркапто, циано, N-амидо, моно- или диалкиламино, карбокси или N-сульфонамидо.
Термин "гетероалициклическая" относится к моноциклической или конденсированной кольцевой группе, содержащей в кольце(-ах) 5-9 кольцевых атомов, в которой один или два кольцевых атома являются гетероатомами, выбранными из N, О или S(O)n (где n обозначает целое число от 0 до 2), а остальные атомы являются атомами С. Такие кольца могут содержать одну или более двойных связей. Однако эти кольца не имеют полностью сопряженной π-электронной системы. Примерами незамещенных гетероалициклических групп, без ограничения, являются пирролидино, пиперидино, пиперазино, морфолино, тиоморфолино и гомопиперазино. Гетероалициклическое кольцо может быть замещенным и незамещенным. Если оно является замещенным, замещающие группа (группы) являются, например, одной или более группами, например, одной, двумя или тремя группами, независимо выбранными из группы, состоящей из незамещенного низшего алкила, тригалогеналкила, галогена, гидрокси, ненасыщенной низшей алкоксильной группы, меркапто, (незамещенного низшего алкил)тио, циано, ацила, тиоацила, О-карбамила, N-карбамила, О-тиокарбамила, N-тиокарбамила, С-амидо, N-амидо, нитро, N-сульфонамидо, S-сульфонамидо, R18S(O)-, R18S(O)2-, -C(O)OR18, R18C(O)O- и -NR18R19, при этом определение R18 и R19 дано выше. Например, гетероалициклическая группа является необязательно замещенной одним или двумя заместителями, независимо выбранными из галогена, незамещенного низшего алкила, тригалогеналкила, гидрокси, меркапто, циано, N-амидо, моно- или диалкиламино, карбокси или N-сульфонамидо.
Термин "гетероцикл" означает насыщенный циклический радикал, содержащий 3-8 атомов в кольце, в котором один или два атома являются гетероатомами, выбранными из N, О или S(O)n (где n обозначает целое число от 0 до 2), а остальные атомы являются атомами С, при этом один или два атома С могут быть необязательно замещенными карбонильной группой. Гетероциклическое кольцо может быть необязательно замещенным одним, двумя или тремя независимыми заместителями, выбранными из необязательно замещенного низшего алкила (замещенного 1 или 2 заместителями, независимо выбранными из карбокси или сложноэфирной группы), галогеналкила, цианалкила, галогена, нитро, циано, гидрокси, алкокси, амино, моноалкиламино, диалкиламино, аралкила, гетероалкила, -COR (где R обозначает алкил) или -COOR (где R обозначает водород или алкил). Более конкретно, термин "гетероциклил" включает, но без ограничения, тетрагидропиранил, 2,2-диметил-1,3-диоксоланил, пиперидинил, N-метилпиперидин-3-ил, пиперазинил, N-метилпирролидин-3-ил, 3-пирролидинил, морфолинил, тиоморфолинил, тиоморфолин-1-оксид, тиоморфолин-1,1-диоксид, 4-этилоксикарбонилпиперазинил, 3-оксопиперазинил, 2-имидазолидонил, 2-пирролидинонил, 2-оксогомопиперазинил, тетрагидропиримидин-2-онил и их производные. Например, гетероциклическая группа является необязательно замещенной одним или двумя заместителями, независимо выбранными из галогена, незамещенного низшего алкила, низшего алкила, замещенного карбоксильной группой, сложноэфирной группы, гидрокси, моно- или диалкиламино.
Термин "гидрокси" относится к группе -ОН.
Термин "алкокси" относится как к -O-(незамещенному алкилу), так и к -О-(незамещенному циклоалкилу). Репрезентативные примеры включают, но без ограничения, например, метокси, этокси, пропокси, бутокси, циклопропокси, циклобутилокси, циклопентилокси и циклогексилокси.
Термин "арилокси" относится к -О-арилу и -О-гетероарилу, определение которых приведено в данной заявке. Репрезентативные примеры включают, но без ограничения, фенокси, пиридинилокси, фуранилокси, тиенилокси, пиримидинилокси, пиразинилокси и их производные.
Термин "меркаптогруппа" относится к группе -SH.
Термин "алкилтио" относится к -S-(незамещенному алкилу) и к -S-(незамещенному циклоалкилу). Репрезентативные примеры включают, но без ограничения, например, метилтио, этилтио, пропилтио, бутилтио, циклопропилтио, циклобутилтио, циклопентилтио и циклогексилтио.
Термин "арилтио" относится к -S-арилу и к -S-гетероарилу, определение которых приведено в данной заявке. Репрезентативные примеры включают, но без ограничения, например, фенилтио, пиридинилтио, фуранилтио, тиенилтио, пиримидинилтио и их производные.
Термин "ацил" относится к группе -С(О)-R", где R" выбран из группы, состоящей из водорода, незамещенного низшего алкила, тригалогенметила, незамещенного циклоалкила, арила, необязательно замещенного одним или более, например, одним, двумя или тремя заместителями, выбранными из группы, состоящей из незамещенного низшего алкила, тригалогенметила, незамещенной низшей алкоксильной группы, галогена и групп -NR18R19, гетероарила (присоединенного через атом углерода в кольце), необязательно замещенного одним или более, например, одним, двумя или тремя заместителями, выбранными из группы, состоящей из незамещенного низшего алкила, тригалогеналкила, незамещенной низшей алкоксильной группы, галогена, групп -NR18R19 и гетероалициклической группы (присоединенной через атом углерода в кольце), необязательно замещенной одним или более, например, одним, двумя или тремя заместителями, выбранными из группы, состоящей из незамещенного низшего алкила, тригалогеналкила, незамещенной низшей алкоксильной группы, галогена и групп -NR18R19. Репрезентативные ацильные группы включают, но без ограничения, ацетил, трифторацетил и бензоил.
Термин "альдегидная" относится к ацильной группе, в которой R'' обозначает водород.
Термин "тиоацильная" относится к группе -C(S)-R'', где значение R'' указано в данной заявке.
Термин "эфирная" относится к группе -С(O)O-R'', где значение R'' указано в данной заявке за исключением того, что R'' не может быть водородом.
Термин "ацетильная" относится к группе -С(O)СН3.
Термин "галоген" относится к фтору, хлору, брому или йоду, например, к фтору или хлору.
Термин "тригалогенметил" относится к группе -СХ3, где X обозначает атом галогена, определение которого дано в данной заявке.
Термин "тригалогенметансульфонил" относится к группам X3CS(=O)2-, где определение X приведено выше.
Термин "циано" относится к группе -C≡N.
Термин "метилендиокси" относится к группе -ОСН2О-, где атомы кислорода связаны с соседними атомами углерода.
Термин "этилендиокси" относится к группе -ОСН2СН2О-, где два атома кислорода соединены с соседними атомами углерода.
Термин "S-сульфонамидо" относится к группе -S(O)2NR18R19, где R18 и R19 указаны в данной заявке.
Термин "N-сульфонамидо" относится к группе -NR18S(O)2R19, где R18 и R19 указаны в данной заявке.
Термин "О-карбамил" относится к группе -OC(O)NR18R19, где R18 и R19 указаны в данной заявке.
Термин "N-карбамил" относится к группе R18OC(O)NR19-, где R18 и R19 указаны в данной заявке.
Термин "О-тиокарбамил" относится к группе -OC(S)NR18R19, где R18 и R19 указаны в данной заявке.
Термин "N-тиокарбамил" относится к группе R18OC(S)NR19-, где R18 и R19 указаны в данной заявке.
Термин "амино" относится к группе -NR18R19, где R18 и R19 оба обозначают водород.
Термин "С-амидо" относится к группе -C(O)NR18R19, где R18 и R19 указаны в данной заявке.
Термин "N-амидо" относится к группе R18C(O)NR19-, где R18 и R19 указаны в данной заявке.
Термин "нитро" относится к группе-NO2.
Термин "галогеналкил" означает незамещенный алкил, например, незамещенный алкил, определение которого дано выше, который замещен одним или более одинаковыми или разными атомами галогена, например, -CH2Cl, -CF3, -CH2CF3 и -CH2CCl3.
Термин "аралкил" означает незамещенный алкил, например, незамещенный алкил, определение которого дано выше, который замещен арильной группой, определение которой дано выше, например, -СН2фенил, -(СН2)2фенил, -(СН2)3фенил, СН3СН(СН3)СН2фенил, и его производные.
Термин "гетероаралкил" означает незамещенный алкил, например, незамещенный низший алкил, определение которого дано выше, который замещен гетероарильной группой, определение которой дано выше.
Термин "диалкиламино" означает радикал -NRR, где каждый R независимо обозначает незамещенный алкил или незамещенный циклоалкил, определение которых дано выше, например, диметиламино, диэтиламино, (1-метилэтил)этиламино, циклогексилметиламино и циклопентилметиламино.
Термин "цианалкил" означает незамещенный алкил, например, незамещенный низший алкил, определение которого дано выше, который замещен 1 или 2 циано-группами.
Термин "необязательный" или "необязательно" означает, что описанное далее событие или обстоятельство могут не возникать, и что описание включает случаи, когда событие или обстоятельство возникают, и случаи, когда они не возникают. Например, выражение "гетероциклическая группа, необязательно замещенная алкильной группой" означает, что алкильная группа может, но не должна содержаться, и что описание включает ситуации, когда гетероциклическая группа замещена алкильной группой, и ситуации, когда гетероциклическая группа не замещена алкильной группой.
В. Полимеры для инкапсулирования
Лекарственные формы с контролируемым высвобождением для доставки одного или более лекарств в полимерном носителе описаны далее в настоящей заявке. Полимерная матрица может быть образована небиоразлагаемым или биоразлагаемым полимерами; однако, предпочтительно, чтобы полимерная матрица была биоразлагаемой. Полимерная матрица может быть в виде имплантатов (например, стержней, дисков, капсул для имплантации и т.д.), микрочастиц, наночастиц и их комбинаций для доставки. После введения сунитиниб или его аналог, или фармацевтически приемлемая соль высвобождается в течение продолжительного периода времени, или после разложения полимерной матрицы, диффузии одного или более ингибиторов из полимерной матрицы, или их комбинации. Лекарство может быть диспергировано или инкапсулировано в полимере или ковалентно связано с полимером, использованным для получения матрицы. Профиль разложения одного или более полимеров может быть выбран для осуществления влияния на скорость высвобождения активного агента in vivo.
Полимеры могут быть гидрофобными, гидрофильными, конъюгатами гидрофильных и гидрофобных полимеров (то есть, амфифильными полимерами), блок-сополимерами или их смесями.
Примеры подходящих гидрофобных полимеров включают, но без ограничения, полигидроксиэфиры, такие как полимолочная кислота, полигликолевая кислота или их сополимеры, поликапролактон, полиангидриды, такие как полисебациновый ангидрид, полидиоксидон, смеси и сополимеры вышеуказанных соединений. Согласно одному из вариантов используется смесь PLGA и полимолочной кислоты (PLA). Полимеры с более высокой молекулярной массой, имеющие разное отношение молочной кислоты (LA), которая характеризуется большим временем разложения, составляющим до одного года или двух лет), к гликолевой кислоте (GA) (которая имеет короткое время разложения, составляющее несколько дней или до недели), используются для обеспечения высвобождения в течение более длительного времени. Гидрофильность PLGA можно контролировать путем выбора отношения мономеров LA и GA (более гидрофильной), вид концевой группы PLGA (сложноэфирной или кислотной) также влияет на разложение. Кислотная группа на конце PLGA также обеспечивает более быстрое разложение. Кислотные концевые группы PLGA способствуют увеличению содержания лекарства, но также меняют кислотное число. Однако при контроле кислотного числа, даже при низком содержании кислоты в полимере, можно достичь более высокого содержания лекарства. Можно получать более гидрофильный PLGA путем обработки полимера карбоксилсодержащим соединением.
Один или более гидрофильных полимеров могут быть любым гидрофильным, биосовместимым, нетоксичным полимером или сополимером. В соответствии с некоторыми вариантами один или более гидрофильных полимеров содержат полиалкиленгликоль, такой как полиэтиленгликоль (PEG). Согласно конкретным вариантам один или более гидрофильных полимеров являются линейными PEG.
Репрезентативные синтетические полимеры включают полиоксикислоты, такие как полимолочная кислота), полигликолевая кислота и сополимер полимолочной и полигликолевой кислот, полилактид, полигликолид, сополимер полилактида с полигликолидом, полиангидриды, полиортоэфиры, полиамиды, поликарбонаты, полиалкилены, такие как полиэтилен и полипропилен, полиалкиленгликоли, такие как полиэтиленгликоль, полиалкиленоксиды, такие как полиэтиленоксид, полиалкилентерефталаты, такие как полиэтилентерефталат, поливиниловые спирты, поливиниловые простые эфиры, поливиниловые сложные эфиры, поливинилгалогениды, такие как поливинилхлорид, поливинилпирролидон, полисилоксаны, поливиниловые спирты, поливинилацетат, полистирол, полиуретаны и их сополимеры, целлюлозы, такие как алкилцеллюлоза, гидроксиалкилцеллюлозы, простые эфиры целлюлозы, сложные эфиры целлюлозы, нитроцеллюлозы, метилцеллюлоза, этилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксибутилметилцеллюлоза, ацетат целлюлозы, пропионат целлюлозы, ацетатбутират целлюлозы, ацетатфталат целлюлозы, карбоксиэтилцеллюлоза, триацетат целлюлозы и натриевая соль сульфата целлюлозы (называемые вместе "целлюлозами"), полимеры акриловой кислоты, метакриловой кислоты или их сополимеры, включая сложные эфиры, полиметилметакрилат), полиэтилметакрилат, полибутилметакрилат, полиизобутилметакрилат, полигексилметакрилат), полиизодецилметакрилат, полилаурилметакрилат, полифенилметакрилат), полиметилакрилат, полиизопропилакрилат, полиизобутилакрилат и полиоктадецилакрилат (вместе называемые в данной заявке "полиакриловыми кислотами"), полимасляная кислота, полимер на основе валериановой кислоты и сополимер полилактида с капролактоном, их сополимеры и смеси. Используемый в данной заявке термин "производные" включает полимеры, имеющие заместители, дополнительные химические группы, например, алкильную, алкиленовую, гидроксилированные полимеры, окисленные полимеры и полимеры, содержащие другие модификации, осуществляемые согласно обычной практике специалистами в данной области.
Примеры типичных природных полимеров включают белки, такие как альбумин и проламины, например, зеин, и полисахариды, такие как альгинат, целлюлоза и полигидроксиалканоаты, например, полигидроксибутират.
Примеры типичных небиоразлагаемых полимеров включают сополимеры этилена с винилацетатом, полиметакриловую кислоту, полиамиды, их сополимеры и смеси.
С. Растворители и подщелачивающие агенты
Сунитиниб или его фармацевтически приемлемая соль (включая соль (-)яблочной кислоты), или аналог сунитиниба или его фармацевтически приемлемая соль могут быть использованы для получения частиц, как описано в данной заявке. Свободное основание является более гидрофобным, а солевая форма, такая как малат, является более гидрофильной. Содержание лекарства может быть увеличено путем изменения формы сунитиниба. Например, добавление щелочи (как в водную, так и в органическую фазу) повышает содержание сунитиниба малата. Свободное основание сунитиниба является очень гидрофобным и легко кристаллизуется. Можно избежать кристаллизации и получать частицы с лучшими свойствами при добавлении кислоты, или регулируя величину рН водной фазы.
Типичные растворители при получении частиц являются органическими растворителями, такими как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, этилацетат и циклогексан. Дополнительные растворители включают, но без ограничения, ацетон, спирт, ацетонитрил, DMSO и DMF. Растворители, растворимые в воде, и щелочные растворители способствуют увеличению содержания сунитиниба малата.
Было установлено, что содержание сунитиниба может быть увеличено путем повышения щелочности сунитиниба в растворе в процессе инкапсулирования. Этого можно достичь путем выбора растворителя, добавления подщелачивающих агентов к растворителю или включения щелочных лекарственных средств вместе с сунитинибом. Примеры соединений, которые могут быть добавлены для этой цели, включают растворители или добавки к растворителям, такие как диметилацетамид (DMA), DMTА, триэтиламин (TEA), анилин, аммиак и гидроксид натрия, лекарства, такие как витамин В4, кофеин, алкалоиды, никотин, обезболивающий морфин, антибактериальный берберин, противораковое соединение винкристин, противогипертоническое лекарство резерпин, холиномиметический галантамин, антихолинергический агент атропин, сосудорасширяющее средство винкамин, антиаритмическое соединение хинидин, противоастматическое терапевтическое средство эфедрин и противомалярийное средство хинин. Поверхностно-активные вещества включают анионные, катионные и неионные поверхностно-активные вещества, такие как, но без ограничения, поливиниловый спирт, F-127, лектин, жирные кислоты, фосфолипиды, производные полиокиэтиленсорбитана и жирных кислот и касторовое масло.
III. Способы получения микрочастиц, наночастиц и имплантатов
А. Получение микро- и наночастиц
Микрочастицы и наночастицы могут быть получены с применением любого подходящего метода получения полимерных микро- и наночастиц, известного из предшествующего уровня техники. Метод, используемый для получения частиц, будет зависеть от ряда факторов, включая характеристики полимеров, содержащихся в лекарстве или в полимерной матрице, а также желательный размер частиц и распределение частиц по размерам. Вид лекарства (лекарств), вводимого (вводимых) в частицы, также может быть таким фактором, так как некоторые лекарства нестабильны в присутствии некоторых растворителей, в некоторых интервалах температур и/или в некоторых интервалах величин рН.
В композициях, описанных в данной заявке, пригодными являются частицы, имеющие средний размер частиц между 10 нм и 1000 микронами. Согласно некоторым вариантам частицы имеют средний размер между 10 нм и 100 микронами, например, между примерно 100 нм и примерно 50 микронами, или между примерно 200 нм и примерно 50 микронами. Частицы могут иметь любую форму, но обычно эта форма является сферической.
Содержание лекарства в частице в значительной степени зависит от величины кислотного числа. Например, повышение величины рН путем добавления щелочи значительно повышает количество введенного сунитиниба малата. Содержание может быть также повышено путем изменения величины рН водной фазы, например, когда величина рН водной фазы (такой как PBS) повышена от 6.8 до 7.4. Содержание лекарства может быть также увеличено путем повышения концентрации полимера и лекарства, молекулярной массы полимера.
Предпочтительная величина рН водной фазы составляет более 6 и менее 10, более предпочтительно, она равна, например, величине между 6 и 8.
Например, один из Примеров в Таблице 2 показывает, что для некоторой композиции частиц наблюдается значительное повышение эффективности инкапсулирования от 36% до 84%, когда величина рН водной фазы повышается от примерно 6 до примерно 7.4. Другой Пример в таблице 2 показывает, что при рН 10 морфология многих частиц меняется от сферической до неправильной формы и некоторые частицы образовывали агрегаты, что говорит о том, что водный раствор с высоким значением рН также является неблагоприятным для получения частиц с высоким содержанием сунитиниба и с высоким качеством.
Концентрация и вязкость полимера также влияет на эффективность инкапсулирования. Например, в случае одного и того же состава (99% PLGA 75:25 4А и 1% PLGA-PEG (PEG MW 5 кДа, PLGA MW ~ 45 кДа) при разных концентрациях полимера в дихлорметане (DCM) эффективность инкапсулирования повышается до величины более 50% при концентрации полимера равной 100 мг/мл. Динамическая вязкость этого раствора полимера в DCM, до смешения с раствором сунитиниба малата в DMSO, по подсчетам составляет примерно 350 сП. Предпочтительная минимальная вязкость раствора полимера в DCM составляет около 350 сП. Согласно предпочтительному варианту концентрация полимера в DCM составляет 140 мг/мл, что по расчетам соответствует вязкости, составляющей примерно 720 сП. Частицы, полученные из 99% PLGA 7525 6Е и 1% PLGA-PEG (PEG MW 5 кДа, PLGA MW ~ 45 кДа), имеют концентрацию полимера в DCM равную 100 мг/мл. Поскольку PLGA 7525 6Е является полимером с более высокой молекулярной массой, чем PLGA 7525 4А, раствор этого полимера в DCM является более вязким с динамической вязкостью равной примерно 830 сП.
Содержание лекарства в значительной степени зависит также от способа получения и используемого растворителя. Например, метод однократного возбуждения S/O/W приведет к получению большего содержания лекарства даже без контролирования кислотного числа.
Высвобождение лекарства
На высвобождение лекарства влияет ряд факторов, включая молекулярную массу полимера, гидрофильность или гидрофобность полимера, количество лекарства, способ получения частиц. Как сунитиниб или его фармацевтически приемлемая соль, так и аналог сунитиниба или его фармацевтически приемлемая соль могут быть использованы для получения частиц. Свободное основание является более гидрофобным, и высвобождение свободного основания сунитиниба происходит гораздо медленнее, чем высвобождение сунитиниба малата. Среда, где происходит высвобождение, также влияет на высвобождение лекарства. Высвобождение будет увеличиваться с увеличением величины рН среды.
Способы получения
Распространенные способы изготовления микрочастиц и наночастиц включают, но без ограничения, выпаривание растворителя, удаление растворителя, сушку при распылении, инверсию фаз, коацервацию и отлив при низкой температуре. Подходящие способы получения частиц кратко описаны ниже. В процессе получения частиц в них могут быть введены фармацевтически приемлемые эксципиенты, включая агенты модификации рН, дезинтегранты, консерванты и антиоксиданты.
Согласно предпочтительному варианту составы получают в эмульсии.
1. Выпаривание растворителя
Согласно этому способу лекарство (или полимерная матрица и одно или более лекарств) растворяется в летучем органическом растворителе, таком как метиленхлорид. Органический раствор, содержащий лекарство, затем суспендируют в водном растворе, который содержит поверхностно-активное вещество, такое как поливиниловый спирт. Полученную эмульсию перемешивают до тех пор, пока не испарится большая часть растворителя, остаются твердые наночастицы. Полученные наночастицы промывают водой и сушат в течение ночи в лиофилизаторе. Этим способом могут быть получены наночастицы различного размера с различной морфологией.
Лекарства, которые содержат лабильные полимеры, такие как некоторые полиангидриды, во время получения частиц могут разлагаться вследствие присутствия воды. Для этих полимеров могут быть использованы следующие два способа, которые осуществляются в среде полностью безводных растворителей.
2. Удаление растворителя
Для получения частиц из лекарств, которые гидролитически нестабильны, может быть также использован способ удаления растворителя. Согласно этому способу лекарство (или полимерная матрица и одно или более лекарств) диспергируется или растворяется в летучем органическом растворителе, таком как метиленхлорид. Затем эту смесь суспендируют путем перемешивания в органическом масле (таком как силиконовое масло) с образованием эмульсии. Из эмульсии образуются твердые частицы, которые затем могут быть выделены из супернатанта. Внешняя морфология сфер, полученных этим способом, зависит в значительной степени от вида лекарства.
3. Сушка при распылении
Согласно этому способу лекарство (или полимерная матрица и одно или более лекарств) растворяется в органическом растворителе, таком как метиленхлорид. Раствор прокачивают через измельчающее сопло, работающее под током сжатого газа, и полученный аэрозоль суспендируют в нагретом циклоне воздухом, что приводит к выпариванию растворителя из микрокапель с образованием частиц. Этим способом могут быть получены частицы размером между 0.1 и 10 микронами.
4. Инверсия фаз
Частицы могут быть также получены с применением способа инверсии фаз. Согласно этому способу лекарство (или полимерная матрица и одно или более лекарств) растворяется в "хорошем" растворителе, и раствор выливается в сильный нерастворитель для лекарства для мгновенного получения, в благоприятных условиях, микрочастиц или наночастиц. Этот способ можно использовать для получения наночастиц с размерами в широком интервале, включая, например, частицы размером от примерно 100 нанометров до примерно 10 микрон, обычно имеющие узкое распределение частиц по размерам.
5. Коацервация
Способы получения частиц с применением коацервации известны из предшествующего уровня техники, например, из GB-B-929 406; GB-B-929 40 1; и патентов США №№3,266,987, 4,794,000 и 4,460,563. Коацервация предусматривает разделение раствора лекарства (или полимерной матрицы и одного или более лекарств) на две несмешивающиеся жидкие фазы. Одна фаза является плотной фазой коацервата, которая содержит высокую концентрацию лекарства, в то время как вторая фаза содержит низкую концентрацию лекарства. В плотной фазе коацервата лекарство образует капли наноразмера или микроразмера, которые затвердевают с образованием частиц. Коацервация может быть вызвана изменением температуры, добавлением нерастворителя или добавлением микросоли (простая коацервация), или добавлением другого полимера, образующего при этом интерполимерный комплекс (сложная коацервация).
6. Отлив при низкой температуре
Способы отлива микросфер с контролируемым высвобождением при очень низкой температуре описаны в патенте США №5,019,400 на имя Gombotz et al. Согласно этому способу лекарство (или полимерная матрица и сунитиниб) растворяется в растворителе. Затем смесь атомизируют в сосуде, содержащем жидкий нерастворитель при температуре ниже температуры замерзания раствора лекарства, что вызывает замораживание капель лекарства. По мере нагревания капель и нерастворителя для лекарства растворитель в каплях оттаивает и экстрагируется в нерастворитель, вызывая затвердевание микросфер.
D. Имплантаты
Могут быть получены имплантаты, которые инкапсулируют и/или содержат диспергированные в них лекарства. Согласно предпочтительным вариантам имплантаты представляют собой внутриглазные имплантаты. Подходящие имплантаты включают, но без ограничения, стержни, диски и капсулы. Матрица может быть образована любым из небиоразлагаемых или биоразлагаемых полимеров, описанных выше, хотя предпочтительными являются биоразлагаемые полимеры. Состав полимерной матрицы выбирается на основе времени, требуемого для достижения in vivo стабильности, то есть, времени, требуемого для распределения лекарства на участке доставки и времени, желательного для доставки.
Имплантаты могут быть любой геометрии, такой как волокна, листы, пленки, микросферы, сферы, круглые диски, стержни или пластинки. Размер имплантата определяется такими факторами, как переносимость имплантата, расположение имплантата, ограничение по размерам ввиду предложенного способа введения имплантата, легкости обращения с имплантатом и т.д.
В случае использования листов или пленок эти листы или пленки имеют размеры в пределах по меньшей мере примерно 0.5 мм × 0.5 мм, обычно примерно 3-10 мм × 5-10 мм с толщиной равной примерно от 0.1 до 1.0 мм для легкости обращения. В случае использования волокон диаметр волокна составляет обычно от примерно 0.05 до 3 мм и длина волокна обычно находится в пределах от примерно 0.5 до 10 мм. Размер и форма имплантата могут быть также использованы для контролирования скорости высвобождения, периода лечения и концентрации лекарства в месте имплантации.
Имплантаты большего размера будут доставлять пропорционально большую дозу лекарства, в зависимости от отношения поверхности к массе они могут иметь более медленное высвобождение. Конкретные размер и геометрия имплантата выбираются в соответствии с участком имплантации.
Внутриглазные имплантаты по форме могут быть сферическими или несферическими. В случае сферических имплантатов они могут иметь большие размеры (например, диаметр) между примерно 5 мкм и примерно 2 мм, или между примерно 10 мкм и примерно 1 мм для введения при помощи иглы, большей чем 1 мм, или большей чем 2 мм, такой как 3 мм или до 10 мм, для введения путем хирургической имплантации. В случае несферического имплантата имплантат может иметь большие размеры или самый маленький размер может составлять от примерно 5 мкм до примерно 2 мм, или от примерно 10 мкм до примерно 1 мм для введения при помощи иглы, большей чем 1 мм, или большей чем 2 мм, такой как 3 мм или до 10 мм, для введения путем хирургической имплантации.
Стекловидная камера у людей способна размещать относительно большие имплантаты различной формы, имеющие длину, например, от 1 до 10 мм. Имплантат может быть цилиндрической таблеткой (например, стержнем с размерами примерно 2 мм × 0.75 мм (диаметр). Имплантат может быть цилиндрической таблеткой длиной примерно от 7 мм до примерно 10 мм, и диаметром от примерно 0.75 мм до примерно 1.5 мм. Согласно некоторым вариантам имплантат имеет вид экструдированного волокна с диаметром от примерно 0.5 мм, длиной примерно 6 мм, и весом равным примерно 1 мг. Согласно некоторым вариантам имплантаты имеют размеры, похожие на размеры имплантатов, уже одобренных для внутриглазного введения при помощи иглы диаметром 460 мк и длиной 6 мм и диаметром 370 мк и длиной 3.5 мм.
Внутриглазные имплантаты могут быть получены таким образом, чтобы они были по меньшей мере отчасти гибкими, чтобы облегчить их введение в глаз, например, в стекловидное тело, и последующее размещение имплантата. Общий вес имплантата обычно составляет от примерно 250 до 5000 мкг, например, примерно 500-1000 мкг. Согласно некоторым вариантам внутриглазной имплантат имеет массу равную примерно 500 мкг, 750 мкг или 1000 мкг.
2. Способы изготовления
Имплантаты могут быть изготовлены с применением любого способа, известного из предшествующего уровня техники. Примеры подходящих способов изготовления имплантатов включают выпаривание растворителя, разделение фаз, межфазные способы, способы формования, способы инжекционного формования, способы экструзии, способы соэкструзии, способ прессования с применением ножа, способы вырезания штампом, способы прессования при нагреве и их комбинации. Подходящие способы изготовления имплантатов могут быть выбраны с учетом ряда факторов, включая свойства полимера/полимеров, содержащихся в имплантате, свойства одного или более лекарств, содержащихся в имплантате и желательную форму и размер имплантата. Подходящие способы изготовления имплантатов описаны, например, в патенте США №4,997,652 и в опубликованной заявке США на патент №2010/0124565.
В некоторых случаях для того, чтобы избежать необходимости использования растворителей при изготовлении имплантатов, могут быть использованы способы экструзии. При применении способов экструзии полимер/полимеры и лекарство выбираются таким образом, чтобы они были стабильными при температурах, требующихся для изготовления, обычно по меньшей мере при примерно 85°С. Однако в зависимости от природы полимерных компонентов и одного или более лекарств способы экструзии могут осуществляться при температурах равных от примерно 25°С до примерно 150°С, например, от примерно 65°С до примерно 130°С. Имплантаты могут получаться способом коэкструзии для того, чтобы обеспечить получение покрытия на всей поверхности или на части поверхности имплантата. Такие покрытия могут быть эродируемыми или неэродируемыми и могут быть непроницаемыми, полупроницаемыми или проницаемыми для лекарства, воды или их комбинации. Такие покрытия могут использоваться для дальнейшего регулирования высвобождения лекарства из имплантата.
Для изготовления имплантатов могут быть использованы способы прессования. Способы прессования часто приводят к получению имплантатов с большей скоростью высвобождения по сравнению со способами экструзии. Способы прессования осуществляются при давлении равном примерно 50-150 ф/дюйм2, например, примерно 70-80 ф/дюйм2, еще более предпочтительно, например, примерно 76 ф/дюйм2, и температурах, составляющих от примерно 0°С до примерно 115°С, например, примерно 25°С.
IV. Фармацевтические составы
А. Фармацевтические эксципиенты
Фармацевтические составы содержат сунитиниб в комбинации с одним или более фармацевтически приемлемыми эксципиентами. Репрезентативные эксципиенты включают растворители, разбавители, агенты модификации рН, консерванты, антиоксиданты, суспендирующие агенты, смачивающие агенты, модификаторы вязкости, регуляторы тоничности, стабилизирующие агенты и их комбинации. Подходящие фармацевтически приемлемые эксципиенты выбираются, например, из материалов, которые обычно признаны безопасными (GRAS) и могут вводиться субъекту без появления нежелательных биологических побочных эффектов или нежелательных взаимодействий.
Эксципиенты могут добавляться к составам для обеспечения стерильности, сохранения и для регулирования и/или сохранения величин рН или изотоничности. Микрочастицы можно суспендировать в стерильном физиологическом растворе, фосфатно-солевом буферном растворе (PBS), сбалансированном солевом растворе (BSS), в вязком геле или других фармацевтически приемлемых носителях для введения в глаз, таких как вязкоэластичные агенты, одобренные для введения в глаза.
Как отмечено выше, на высвобождение лекарства влияет среда, особенно величина рН растворов. Например, высвобождение свободного основания сунитиниба из частиц, происходит быстрее в PBS при рН 7, чем в солевом растворе, так как свободное основание образует соль, которая является более гидрофильной, чем свободное основание. Следовательно, величина рН на участке введения будет влиять на высвобождение лекарства.
В некоторых случаях фармацевтический состав содержит только один вид конъюгата или полимерных частиц для контролируемого высвобождения лекарств (например, состав, содержащий частицы лекарства, причем частицы лекарства, введенные в фармацевтическую композицию, имеют одинаковый состав). Согласно другим вариантам фармацевтический состав содержит два или более разных типов конъюгатов или полимерных частиц для контролируемого высвобождения лекарств (например, фармацевтический состав содержит две или более популяции частиц лекарства, причем популяции частиц лекарства имеют разный химический состав, разный средний размер частиц и/или разное распределение частиц по размерам).
Частицы, полученные из лекарств, будут, например, получены в виде раствора или суспензии для инъекции в глаз или в ткань, такую как опухоль.
Фармацевтические составы для офтальмологического применения находятся, например, в виде стерильного водного раствора или суспензии частиц на основе сунитиниба или его аналога или фармацевтически приемлемой соли. Приемлемые растворители включают, например, воду, раствор Рингера, фосфатно-солевой буферный раствор (PBS) и изотонический раствор хлорида натрия. Состав также может представлять собой стерильные раствор, суспензию или эмульсию в нетоксичном парентерально приемлемом разбавителе или растворителе, таком как 1,3-бутандиол.
В некоторых случаях состав помещают или упаковывают в жидкой форме. Альтернативно, составы для введения в глаза могут быть упакованы в виде твердых веществ, полученных, например, путем лиофилизации подходящего жидкого состава. Твердый состав может быть восстановлен перед применением с помощью соответствующих носителя или разбавителя.
Растворы, суспензии или эмульсии для введения в глаза могут буферировать с помощью эффективного количества буфера, необходимого для поддержания величины рН, подходящей для введения в глаза. Подходящие буферы хорошо известны специалистам в данной области, некоторыми примерами пригодных буферов являются ацетатный, боратный, карбонатный, цитратный и фосфатный буферы.
Растворы, суспензии или эмульсии для введения в глаза могут также содержать один или более агентов тоничности для регулирования изотоничности состава. Подходящие агенты тоничности хорошо известны специалистам в данной области, некоторые примеры включают глицерин, маннит, сорбит, хлорид натрия и другие электролиты.
Растворы, суспензии или эмульсии для введения в глаза могут также содержать один или более консервантов для предотвращения бактериального загрязнения офтальмологических препаратов. Подходящие консерванты известны из предшествующего уровня техники и включают полигексаметиленбигуанидин (РНМВ), бензалконийхлорид (BAK), стабилизированные оксихлоридные комплексы (иначе известные как Purite®), ацетат фенилртути, хлорбутанол, сорбиновую кислоту, хлоргексидин, бензиловый спирт, парабены, тимеросал и их смеси.
Растворы, суспензии или эмульсии для введения в глаза могут также содержать один или более известных из предшествующего уровня эксципиентов, таких как диспергирующие агенты, смачивающие агенты и суспендирующие агенты.
В. Дополнительные активные агенты
Кроме сунитиниба или его аналога или фармацевтически приемлемой соли, содержащихся в полимерных частицах, состав может содержать один или более дополнительных терапевтических, диагностических и/или профилактических агентов. Активные агенты могут быть активными агентами с малыми молекулами или биомолекулами, такими как фермент или белок, полипептид или нуклеиновая кислота. Подходящие активные агенты с малыми молекулами включают органические и металлорганические соединения. В некоторых случаях активный агент с малыми молекулами имеет молекулярную массу меньше примерно 2000 г/моль, например, меньше примерно 1500 г/мол, например, меньше примерно 1200 г/мол. Активный агент с малыми молекулами может быть гидрофильным, гидрофобным или амфифильным соединением.
В некоторых случаях один или более дополнительных активных агентов могут быть инкапсулированы, диспергированы или каким-либо другим образом ассоциированы с частицами. Согласно некоторым вариантам один или более дополнительных активных агентов могут быть также растворены или суспендированы в фармацевтически приемлемом носителе.
В случае фармацевтических композиций для лечения глазных заболеваний состав может содержать одно или более офтальмологических лекарств. Согласно конкретным вариантам офтальмологическое лекарство представляет собой лекарство, используемое для лечения, профилактики или диагностики заболевания или нарушения состояния заднего отрезка глаза. Неограничивающие примеры офтальмологических лекарств включают агенты для лечения глаукомы, агенты для лечения ангиогенеза, противоинфекционные агенты, противовоспалительные агенты, факторы роста, иммунодепрессанты, противоаллергические средства и их комбинации.
Репрезентативные агенты для лечения глаукомы включают аналоги простагландина (такие как травопрост, биматопрост и латанопрост), антагонисты бета-адренергических рецепторов (такие как тимолол, бетаксолол, левобетаксолол и картеолол), агонисты альфа-2 адренергических рецепторов (такие как бримонидин и апраклонидин), ингибиторы карбоангидразы (такие как бринзоламид, ацетазоламид и дорзоламид), миотики (то есть, парасимпатомиметики, такие как пилокарпин и экотиопат), серотонинергические средства, дофаминергические агонисты и адренергические агонисты (такие как апраклонидин и бримонидин).
Репрезентативные агенты для лечения ангиогенеза включают, но без ограничения, антитела к сосудистому эндотелиальному фактору роста (VEGF), такие как бевасизумаб (AVASTIN®) и rhuFAb V2 (ранибизумаб, LUCENTIS®), и другие анти-VEGF соединения, включая афлиберцепт (EYLEA®); MACUGEN® (пегаптаниба натрий, анти-VEGF аптамер или EYE001) (Eyetech Pharmaceuticals); фактор(-ы) пигментного эпителия (PEDF); ингибиторы СОХ-2, такие как целекоксиб (CELEBREX®) и рофекоксиб (VIOXX®); альфа-интерферон; интерлейкин-12 (IL-12); талидомид (THALOMID®) и его производные, такие как леналидомид (REVLIMID®); скваламин; эндостатин; ангиостатин; ингибиторы рибозима, такие как ANGIOZYME® (Sirna Therapeutics); многофункциональные агенты для лечения ангиогенеза, такие как NEOVASTAT® (АЕ-941) (Aeterna Laboratories, Quebec City, Canada); ингибиторы рецепторов тирозинкиназ (RTK), такие как сунитиниба малат (SUTENT®); ингибиторы тирозинкиназ, такие как сорафениб (Nexavar®) и эрлотиниб (Tarceva®); антитела к рецепторам эпидермального фактора роста, такие как панитумумаб (VECTIBIX®) и цетуксимаб (ERBITUX®), а также другие агенты для лечения ангиогенеза, известные из уровня техники.
Противоинфекционные агенты включают противовирусные агенты, антибактериальные агенты, антипаразитарные вещества и противогрибковые средства. Репрезентативные противовирусные агенты включают ганцикловир и ацикловир. Репрезентативные антибиотики включают аминогликозиды, такие как стрептомицин, амикацин, гентамицин и тобрамицин, ансамицины, такие как гелданамицин и гербимицин, карбацефемы, карбапенемы, цефалоспорины, гликопептиды, такие как ванкомицин, тейкопланин и телаванцин, линкозамиды, липопептиды, такие как даптомицин, макролиды, такие как азитромицин. кларитромицин, диритромицин и эритромицин, монобактамы, нитрофураны, пенициллины, полипептиды, такие как бацитрацин, колистин и полимиксин В, хинолоны, сульфонамиды и тетрациклины.
В некоторых случаях активный агент является противоаллергическим агентом, таким как олопатадин и эпинастин.
Противовоспалительные агенты включают и нестероидные, и стероидные противовоспалительные средства. Подходящие стероидные активные агенты включают глюкокортикоиды, прогестины, минералокортикоиды и кортикостероиды.
Офтальмологическое лекарство может быть в нейтральной форме или в виде фармацевтически приемлемой соли. В некоторых случаях может быть желательно получать состав, содержащий соль активного агента из-за предпочтительных одного или более свойств соли, таких как повышенная стабильность или желательные растворимость, или профиль растворения.
В общем, фармацевтически приемлемые соли могут быть получены по реакции свободной кислоты или свободного основания активного агента со стехиометрическим количеством соответствующего основания или кислоты в среде воды или органического растворителя или в их смеси; обычно предпочтительными являются неводные среды, такие как этилацетат, этанол, изопропанол или ацетонитрил. Фармацевтически приемлемые соли включают соли активного агента, полученные из неорганических кислот, органических кислот, соли щелочных металлов и соли щелочноземельных металлов, а также соли, полученные по реакции лекарства с подходящим органическим лигандом (например, соли четвертичного аммония). Перечень подходящих солей находится, например, в монографии Remington's Pharmaceutical Sciences, 20th ed., Lippincott Williams & Wilkins, Baltimore, MD, 2000, p. 704. Примеры офтальмологических лекарств, иногда вводимых в виде фармацевтически приемлемой соли, включают тимолола малеат, бримонидина тартрат и натриевую соль диклофенака. Неограничивающие примеры фармацевтически приемлемых солей кислот, которые могут быть использованы как противоион сунитиниба или аналога сунитиниба, включают, но без ограничения, соли, полученные из неорганических кислот, таких как соляная, бромистоводородная, серная, сульфаминовая, фосфорная и азотная; и соли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памовая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, мезиловая, эзиловая, безиловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфокислота, метансульфокислота, этандисульфокислота, щавелевая, изетионовая и НООС-(СН2)n-СООН, где n обозначает 0-4. В некоторых случаях активный агент является диагностическим агентом для получения изображения или для оценки состояния глаза. Примеры диагностических агентов включают парамагнитные молекулы, флуоресцентные соединения, магнитные молекулы и радионуклиды, агенты для формирования рентгеновских изображений и контрастные среды.
Согласно некоторым вариантам фармацевтическая композиция содержит один или более местных анестетиков. Репрезентативные местные анестетики включают тетракаин, лидокаин, аметокаин, пропаракаин, лигнокаин и бупивакаин. В некоторых случаях в состав также добавляют один или более дополнительных агентов, таких как фермент гиалуронидаза, для ускорения действия и улучшения диспергируемости местного анестетика.
V. Способы применения
Составы с контролируемым высвобождением для доставки сунитиниба или его аналога, или его фармацевтически приемлемой соли могут быть использованы для лечения заболевания или нарушения у пациента, ассоциированных с васкуляризацией, включая рак и ожирение. Согласно конкретному варианту фармацевтические композиции вводятся для лечения или профилактики заболевания или нарушения у пациента, ассоциированных с неоваскуляризацией. После введения одно или более лекарств высвобождаются в течение продолжительного периода времени с концентрациями, достаточно высокими для получения терапевтического эффекта, но достаточно низкими для исключения токсичности.
Для того, чтобы осуществлять лечение хронических заболеваний глаза, необходимы способы для доставки сунитиниба или его фармацевтически приемлемой соли в глаз в течение длительного времени. Составы, которые обеспечивают пролонгированную доставку сунитиниба или его соли, обеспечивают минимизацию возможности появления токсичности, связанной с введением сунитиниба. Составы, которые обеспечивают пролонгированную доставку сунитиниба или его соли, будут также поддерживать ослабление действия VEGF и других стимуляторов ангиогенеза, максимально повышать эффективность, ускорять регрессию неоваскуляризации и минимизировать возможность катастрофических осложнений, включая субретинальное кровоизлияние. Кроме того, уменьшение необходимости в частых инъекциях будет снижать риск появления эндофтальмита и необходимость частых визитов пациента, большой нагрузки для врачей, пациентов и их семей.
А. Глазные заболевания и нарушения
При введении в глаз частицы высвобождают низкую дозу одного или более активных агентов в течение продолжительного периода времени, например, в течение периода, составляющего более 3, 7, 10, 15, 21, 25, 30, 45 дней, или по меньшей мере периода до примерно 2 мес, 3 мес, 4 мес, 5 мес или 6 мес или более. Структуру лекарства или компонентный состав полимерной матрицы, морфологию частиц и дозировку частиц можно регулировать для введения терапевтически эффективного количества одного или более активных агентов в глаз в течение продолжительного периода времени при минимизации возникновения побочных эффектов, таких как уменьшение скотопических амплитуд ЭРГ-b-волн и/или дегенерация сетчатки.
Фармацевтические композиции, содержащие частицы с контролируемым высвобождением одного или более лекарств, могут вводиться в глаз пациента, нуждающегося в этом, для лечения или профилактики одного или более глазных заболеваний или нарушений. В некоторых случаях глазное заболевание или нарушение затрагивает задний сегмент глаза. Выражение "задний сегмент глаза", используемое в данной заявке, относится к задним двум третям глаза, включая переднюю гиалоидную мембрану и все из оптических структур за ней, такие как стекловидное тело, сетчатка, хороид и зрительный нерв.
Согласно предпочтительным вариантам фармацевтическая композиция, содержащая частицы, вводится для лечения или профилактики внутриглазного неоваскулярного заболевания. Глазные заболевания, особенно те, которые характеризуются неоваскуляризацией глаз, представляют собой угрозу здоровью общества. Внутриглазные неоваскулярные заболевания характеризуются неконтролируемым ростом сосудов на одном или более участков глаза. Будучи неконтролируемой, васкуляризация повреждает и/или затемняет одну или более структур в глазу, приводя к потере зрения. Внутриглазные неоваскулярные заболевания включают пролиферативные ретинопатии, хориоидальную неоваскуляризацию (CNV), возрастную макулярную дегенерацию (AMD), диабетическую и другие виды ретинопатий, связанные с ишемией, диабетический отек макулы, патологическую миопию, болезнь Гиппеля-Линдау, гистоплазмоз глаз, окклюзию центральной вены сетчатки (CRVO), неоваскуляризацию роговицы и неоваскуляризацию сетчатки (RNV). Внутриглазные неоваскулярные заболевания поражают миллионы людей во всем мире, приводя во многих случаях к тяжелой форме потери зрения и снижению качества жизни и производительности.
Возрастная макулярная дегенерация (AMD) является основной причиной значительной необратимой потери зрения у пожилых людей. См. Bressler, et al. JAMA, 291: 1900-1901 (2004). AMD характеризуется широким спектром клинических и патологических изменений, таких как бледно-желтые пятна, известные как друзы, разрушение ретинального пигментного эпителия (RPE), хориоидальная неоваскуляризация (CNV) и дисковидная дегенерация желтого пятна. AMD классифицируется на сухую (то есть, неэкссудативную) или влажную (то есть, экссудативную). Сухая AMD характеризуется наличием повреждений, называемых друзами. Влажная AMD характеризуется неоваскуляризацией в центре поля зрения.
Хотя и менее распространенная, влажная AMD является причиной 80%-90% случаев необратимой потери зрения, связанной с AMD (Ferris, et al. Arch. Ophthamol. 102: 1640-2 (1984)). Причина возникновения AMD является неизвестной. Однако ясно, что риск развития AMD увеличивается с возрастом. AMD также связана с факторами риска, включая случаи заболевания в семье, курение сигарет, окислительный стресс, диабет, потребление алкоголя и пребывание на солнце.
Влажная AMD обычно характеризуется CNV макулярного участка. Хориоидальные капилляры пролиферируют и проникают в мембрану Бруха, достигая ретинального пигментного эпителия (RPE). В некоторых случаях капилляры могут врастать в субретинальное пространство. Повышенная проницаемость вновь образовавшихся капилляров приводит к накоплению серозной жидкости или крови под RPE и/или под нейросенсорной сетчаткой или внутри нейросенсорной сетчатки. Ослабление зрения происходит, когда фовеолярная зона становится распухшей или отслоившейся. Могут проявиться волокнистая метаплазия и организация, что приводит к появлению увеличенной субретинальной массы, называемой дисковидным рубцом, который составляет последнюю стадию AMD и ассоциируется с тяжелой формой потери зрения (D'Amico D J. N. Engl. J. Med. 331: 95-106 (1994)).
Другие глазные заболевания и нарушения, такие как увеит, также с трудом поддаются лечению известными способами. Увеит является общим термином, относящимся к воспалению любого компонента увеального тракта, например, радужки, ресничного тела или хороида (сосудистой оболочки). Воспаление вышележащей сетчатки, называемое ретинитом, или воспаление зрительного нерва, называемое оптическим невритом, могут возникать вместе с сопутствующим увеитом или без него.
Офтальмологические осложнения от увеита могут вызывать глубокую и необратимую потерю зрения, особенно, когда они не были выявлены или лечились неправильно. Наиболее часто встречающиеся осложнения при увейте включают отслоение сетчатки, неоваскуляризацию сетчатки, зрительного нерва или радужки и цистоидный отек макулы. Отек макулы (ME) может произойти, если внутри макулы возникают разбухание, истечение и фоновая диабетическая ретинопатия (BDR), центральные 5% сетчатки являются наиболее критическими для зрения. ME является распространенной причиной развившегося ухудшения зрения.
Было сделано множество попыток лечить внутриглазные неоваскулярные болезни, а также болезни, связанные с хроническим воспалением глаз, при помощи фармацевтических средств. Попытки создать клинически полезные лекарства блокировались трудностями введения и поддержания терапевтически эффективного количества фармацевтического средства в глазной ткани в течение продолжительного времени. Кроме того, многие фармацевтические средства вызывают появление значительных побочных эффектов и/или токсичности при введении в глазную ткань.
Внутриглазные неоваскулярные заболевания представляют собой глазные заболевания или нарушения, которые характеризуются глазной неоваскуляризацией. Неоваскуляризация может происходить в одной или более областей глаза, включая роговицу, сетчатку, хороидный слой или радужку. В некоторых случаях глазное заболевание или нарушение характеризуется образованием новых кровеносных сосудов в хороидном слое глаза (то есть, хориоидальной неоваскуляризацией, CNV). В некоторых случаях глазное заболевание или нарушение характеризуется образованием кровеносных сосудов, происходящих из вен сетчатки и простирающихся вдоль внутренней (стекловидной) поверхности сетчатки (то есть, ретинальной неоваскуляризацией, RNV).
Примеры неоваскулярных глазных заболеваний включают возрастную макулярную дегенерацию, ассоциированную с хороидальной неоваскуляризацией, пролиферативной диабетической ретинопатией (диабетической ретинопатией, ассоциированной с ретинальной, преретинальной неоваскуляризацией или неоваскуляризацией радужки), пролиферативной витреоретинопатией, ретинопатией недоношенных, патологической миопией, болезнью Гиппеля-Линдау, синдромом предполагаемого гистоплазмоза глаз (POHS) и с состояниями, ассоциированными с ишемией, такой как окклюзия ветки вены сетчатки, окклюзия центральной вены сетчатки, окклюзия ветки артерии сетчатки и окклюзия центральной артерии сетчатки.
Неоваскуляризация может быть вызвана опухолью. Опухоль может быть доброкачественной или злокачественной. Примеры доброкачественных опухолей включают гамартомы и нейрофибромы. Примеры злокачественных опухолей включают хороидальную меланому, увеальную меланому радужки, увеальную меланому ресничного тела, ретинобластому или метастатическое заболевание (например, хороидальный метастаз).
Неоваскуляризация может быть связано с ранением глаза. Например, такая рана может быть результатом травматического повреждения глазного яблока, такого как разрыв роговицы. Альтернативно, рана может быть результатом хирургического вмешательства.
Лекарства могут вводиться для предотвращения или уменьшения риска возникновения пролиферативной витреоретинопатии после витреоретинальной хирургии, профилактики помутнения роговицы после корнеальной хирургии (такой как корнеальная трансплантация и эксимерлазерная хирургия), профилактики закрытия участка трабекулэктомии или для профилактики или значительного замедления возникновения птеригия.
Лекарства могут вводиться для предотвращения или лечения глазного заболевания, ассоциированного с воспалением. В таких случаях лекарство содержит, например, противовоспалительный агент. Примеры воспалительных глазных заболеваний включают, но без ограничения, увеит, эндофтальмит и офтальмологические травмы или хирургическое вмешательство.
Глазное заболевание может также быть инфекционным глазным заболеванием, таким как ретинопатия, вызванная ВИЧ, токсокароз, токсоплазмоз и эндофтальмит.
Фармацевтические композиции, содержащие частицы, полученные из одного или более лекарств, могут быть также использованы для лечения или профилактики одного или более заболеваний, которые влияют на другие части глаза, таких как сухость глаз, мейбомит, глаукома, конъюнктивит (например, аллергический конъюнктивит, весенний конъюнктивит, конъюнктивит с гиперплазией сосочков, атопический кератоконъюнктивит), неоваскулярная глаукома с неоваскуляризацией радужки и ирит.
1. Способы введения
Составы, описанные в данной заявке, могут вводиться локально в глаз путем инъекции в стекловидное тело (например, фронтальной инъекции, инъекции в среднюю или заднюю часть стекловидного тела), путем субконъюнктивальной инъекции, интракамеральной инъекции, инъекции в переднюю камеру через темпоральный лимб, интрастромальной инъекции, инъекции в субхороидальное пространство, внутрироговичной инъекции, субретинальной инъекции и внутриглазной инъекции. Согласно предпочтительному варианту фармацевтическая композиция вводится путем инъекции в стекловидное тело.
Имплантаты, описанные в данной заявке, могут вводиться в глаз с применением способов, известных из предшествующего уровня техники. Согласно некоторым вариантам имплантаты вводятся в стекловидное тело с помощью иглы, такой как игла 22 калибра (по шкале Гейдж). Размещение имплантата в стекловидном теле может меняться в зависимости от размера имплантата, формы имплантата и вида заболевания или нарушения, подвергающихся лечению.
Согласно некоторым вариантам фармацевтические композиции и/или имплантаты, описанные в данной заявке, вводятся совместно с одним или более дополнительными активными агентами. Термин "совместное введение", используемый в данной заявке, относится к введению состава с контролируемым высвобождением на основе одного или более лекарств вместе с одним или более дополнительными активными агентами в одной и той же лекарственной форме, а также к введению с применением разных лекарственных форм одновременно или по существу в одно и то же время. Термин "по существу в одно и то же время", используемый в данной заявке, обычно означает в течение десяти минут, например, в течение пяти минут, например, в течение двух минут, например, в течение одной минуты.
Согласно некоторым вариантам фармацевтические композиции и/или имплантаты, описанные в данной заявке, вводятся совместно с одним или более дополнительными препаратами для лечения неоваскулярных глазных заболевания или нарушения. Согласно некоторым вариантам фармацевтические композиции и/или имплантаты, описанные в данной заявке, вводятся совместно с одним или более агентами для лечения ангиогенеза, такими как бевацизумаб (AVASTIN®), ранибизумаб LUCENTIS® или афлиберцепт (EYLEA®).
b. Режим дозирования
Предпочтительно, чтобы частицы высвобождали эффективное количество сунитиниба или его аналога, или его фармацевтически приемлемой соли в течение продолжительного периода времени. Согласно предпочтительным вариантам частицы высвобождают эффективное количество сунитиниба в течение периода времени, составляющего по меньшей мере две недели, в течение периода времени, составляющего по меньшей мере четыре недели, в течение периода времени, составляющего по меньшей мере шесть недель, в течение периода времени, составляющего по меньшей мере восемь недель, в течение периода времени, составляющего три месяца, в течение периода времени, составляющего четыре месяца, в течение периода времени, составляющего пять месяцев или в течение периода времени, составляющего шесть месяцев. Согласно некоторым вариантам частицы высвобождают эффективное количество сунитиниба в течение периода времени, составляющего три месяца или более.
В некоторых случаях фармацевтический состав вводится пациенту, нуждающемуся в этом, в терапевтически эффективном количестве для уменьшения хориоидальной неоваскуляризации. Согласно другому варианту фармацевтический состав вводится в количестве и в течение периода времени для уменьшения неоваскуляризации роговицы. В некоторых случаях фармацевтический состав вводится пациенту, нуждающемуся в этом, в терапевтически эффективном количестве для уменьшения ретинальной неоваскуляризации, например, в случае острой макулярной дегенерации (AMD)
c. Терапевтическая эффективность
Примеры демонстрируют способы оценки терапевтической эффективности на различных животных моделях. В случае людей или животных, таких как собаки, специалистами в области офтальмологии хорошо разработаны такие методы, и они включают осмотр с помощью щелевой лампы, визуальный осмотр сетчатки, измерение поля зрения, остроты зрения и внутриглазного давления.
В случае возрастной макулярной дегенерации терапевтическую эффективность у пациента можно оценить одним или более следующими методами: оценки средней величины изменения остроты зрения с наилучшей коррекцией (BCVA) от исходного значения до желательного момента времени, определения количества пациентов, которые не видят менее 15 букв (три ряда) при определении остроты зрения в желательный момент времени по сравнению с исходным показателем, определения количества пациентов, которые видят более чем на 15 букв больше или на 15 букв больше по сравнению с исходным показателем при определении остроты зрения в желательный момент времени, определения количества пациентов с остротой зрения, определенной по шкале Снеллена и равной 20/2000 или меньше в желательный момент времени, оценки по опроснику Национального института глаза США (Eye Institute Visual Functioning Questionnaire) и оценки размеров CNV и степени пропотевания CNV в желательный момент времени с применением флуоресцентной ангиографии.
Согласно некоторым вариантам у по меньшей мере 25%, например, по меньшей мере, 30%, например, по меньшей мере 35%, например, по меньшей мере 40% пациентов с недавно возникшей CNV, которых лечили составами, описанными в данной заявке, наблюдалось улучшение остроты зрения на три или более ряда букв.
Далее настоящее изобретение будет описано в следующих неограничивающих примерах.
Пример 1. Влияние поверхностно-активных веществ, формы сунитиниба и общей щелочности на величину содержания лекарства и профили in vitro высвобождения из микрочастиц (MPs)
Материалы и методы
Материалы - две формы сунитиниба
Были использованы две формы сунитиниба, а именно, сунитиниба малат и свободное основание сунитиниба, которые обе были приобретены в LC Lab (Woburn, MA, USA).
Сополимер D,L-молочной кислоты и гликолевой кислоты (PLGA, 50:50), 2А был приобретен в компании Alkermes, Waltham, MA, US; сополимер D,L-молочной кислоты и гликолевой кислоты (PLGA, 50:50), 2А - в компании Lakeshore Biomaterials, Birmingham, Al, US; сополимер D,L-молочной кислоты и гликолевой кислоты (PLGA, 50:50), 4А - в Lakeshore, Biomaterials, Birmingham, Al, US; сополимер D,L-молочной кислоты и гликолевой кислоты (PLGA, 75:25), PURASORB PDLG 7502A - в компании PURAC, Netherlands; сополимер полиэтиленгликоль-сополимер D,L-молочной кислоты и гликолевой кислоты, PEG-PLGA (5K, 45K), PEG 10%, PLGA 50:50, был приобретен в Jinan Daigang Biomaterials Со, Ltd., Jinan, Shandong, China и очищен и растворен в хлороформе и осажден в среде простого эфира. PLA (поли-D,L-молочная кислота), поливиниловый спирт (PVA) были приобретены в Polyscience, Mw, 25000, степень гидролиза 88%. PEG-PLA (5K, 45K), 10% PEG, PEG, 5K, был синтезирован. N,N-диметилтолуидин, N,N-диметиланилин, яблочная кислота, лимонная кислота, триэтиламин и все другие реагенты были приобретены в компании Sigma (St. Louis, МО, USA)
Получение частый и регулирование кислотности/щелочности
Полимерные микрочастицы, содержащие две формы сунитиниба (или малат, или свободное основание) были получены с применением способа однократного эмульгирования с получением одинарной эмульсии масло/вода или твердое вещество/масло/вода, способа выпаривания растворителя. Вкратце, приготавливали раствор путем смешения PLGA, растворенного в метиленхлориде (известном также как дихлорметан, DCM), с лекарством, растворенным в DMSO, или лекарством, суспендированным в метиленхлориде (М/В). Эту смесь гомогенизировали (гомогенизатор Silverson Homogenizer, модель L4RT, Chesham Bucks, England) в течение 1 мин в водном растворе, содержащем 1% поливинилового спирта (PVA). Полученные частицы затем перемешивали в течение 2 ч для затвердевания, собирали путем центрифугирования, промывали дважды дистиллированной водой и замораживали-сушили.
При выборе поверхностно-активных веществ вначале пытались использовать и катионные, и ионные поверхностно-активные вещества, додецилсульфат натрия ("SDS") и гексадецилтриметиламмонийбромид ("HDTA"), их добавляли к растворителям при получении частиц. Альтернативно, вместо SDS или HDTA применяли неионное поверхностно-активное вещество поливиниловый спирт (PVA).
Частицы также получали в двойных эмульсиях в/м/в или т/в/м/в методом двойного эмульгирования. Вкратце, приготавливали раствор путем смешения лекарства в DMSO и воды или лекарства, суспендированного в воде, затем добавляли к PLGA в метиленхлориде, обрабатывали ультразвуком, гомогенизировали смесь (Silverson Homogenizer, модель L4RT, Chesham Bucks, England) в течение 1 мин в водном растворе, содержащем 1% поливинилового спирта (PVA). Затем частицы перемешивали в течение 2 для их затвердевания, собирали путем центрифугирования, промывали дважды дистиллированной водой и замораживали-сушили.
Затем регулировали кислотность органической фазы для увеличения содержания лекарства в полученных микрочастицах путем добавления щелочи в органическую фазу
Обозначение составов
Для облегчения идентификации различным составам частиц были даны обозначения (ID), например, МР-n (n обозначает номер от 1 до 20). Сунитиниба малат был использован в составах МР-1 - МР-10, МР-14, МР-15 и МР-18; в то время как свободное основание сунитиниба было использовано в составах МР-11 - МР-13, МР-16, МР-17, МР-19 и МР-20.
Метод получения одинарной эмульсии масло в воде (М/В)
МР-1: 100 мг PEG-PLGA (5K, 45K) растворяли в 1 мл метиленхлорида и 20 мг сунитиниба малата растворяли в 0.5 мл DMSO и триэтиламина. Затем эти растворы смешивали, гомогенизировали при 5000 об/мин в течение 1 мин в водном растворе, содержащем 1% поливинилового спирта (PVA), перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и сушили при замораживании.
МР-2: 200 мг PLGA (2A, Alkermers) растворяли в 3 мл метиленхлорида и 40 мг сунитиниба малата растворяли в 0.5 мл DMSO и триэтиламина. Затем эти растворы смешивали, гомогенизировали при 5000 об/мин в течение 1 мин в водном растворе, содержащем 1% поливинилового спирта (PVA), перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и сушили при замораживании.
МР-3: 180 мг PLGA (2А, Alkermers) и 20 мг PEG-PLGA (5K, 45K) растворяли в 3 мл метиленхлорида и 40 мг сунитиниба малата растворяли в 0.5 мл DMSO и триэтиламина. Затем эти растворы смешивали, гомогенизировали при 5000 об/мин в течение 1 мин в водном растворе, содержащем 1% поливинилового спирта (PVA), перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и сушили при замораживании.
МР-4: 140 мг PLGA (2А, Alkermers), 60 мг PEG-PLGA (5K, 45K) растворяли в 3 мл метиленхлорида и 40 мг сунитиниба малата растворяли в 0.5 мл DMSO и триэтиламина. Затем эти растворы смешивали, гомогенизировали при 5000 об/мин в течение 1 мин в водном растворе, содержащем 1% поливинилового спирта (PVA), перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и сушили при замораживании.
МР-5: 100 мг PLGA (2A, Alkermers) и 100 мг PEG-PLGA (5K, 45K) растворяли в 3 мл метиленхлорида и 40 мг сунитиниба малата растворяли в 0.5 мл DMSO и триэтиламина. Затем эти растворы смешивали, гомогенизировали при 5000 об/мин в течение 1 мин в водном растворе, содержащем 1% поливинилового спирта (PVA), перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и сушили при замораживании.
МР-6: 90 мг PLGA (2А, Alkermers) и 10 мг PEG-PLGA (5K, 45K) растворяли в 1 мл метиленхлорида и 20 мг сунитиниба малата растворяли в 0.25 мл DMSO и N, N-диметилтолуидина. Затем эти растворы смешивали, гомогенизировали при 5000 об/мин в течение 1 мин в водном растворе, содержащем 1% поливинилового спирта (PVA), перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и сушили при замораживании.
МР-7: 90 мг PLGA (2А, Alkermers) и 10 мг PEG-PLGA (5K, 45K) растворяли в 1 мл метиленхлорида и 20 мг сунитиниба малата растворяли в 0.25 мл DMSO и N, N-диметиланилина. Затем эти растворы смешивали, гомогенизировали при 5000 об/мин в течение 1 мин в водном растворе, содержащем 1% поливинилового спирта (PVA), перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и сушили при замораживании.
МР-8: 160 мг PLGA (2А, Alkermers) и 40 мг PEG-PLGA (5K, 45K) растворяли в 2 мл DMF, добавляли 20 мг сунитиниба малата и перемешивали, затем гомогенизировали при 5000 об/мин в течение 1 мин в водном растворе, содержащем 1% поливинилового спирта (PVA), перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и сушили при замораживании.
МР-9: 90 мг PLGA (4A, Lakeshore Biomaterials) и 10 мг PEG-PLGA (5K, 45K) растворяли в 1 мл метиленхлорида и 20 мг сунитиниба малата растворяли в 0.25 мл DMSO, добавляли 0.1М гидроксида калия в этаноле, затем гомогенизировали при 5200 об/мин в течение 1 мин в водном растворе, содержащем 1% поливинилового спирта (PVA), перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и сушили при замораживании.
МР-10: 160 мг PLGA (2А, Alkermers) и 40 mg PEG-PLGA (5K, 45K) растворяли в 2 мл метиленхлорида, 40 мг сунитиниба малата растворяли в 1 мл DMSO, добавляли триэтиламин, гомогенизировали при 5000 об/мин в течение 1 мин в водном растворе, содержащем 1% поливинилового спирта (PVA), перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и сушили при замораживании.
МР-11: 100 мг PLGA (4A, Lakeshore Biomaterials), растворяли в 1 мл метиленхлорида, 20 мг сунитиниба малата растворяли в 0.25 мл DMSO, добавляли небольшое количество 1% уксусной кислоты в этаноле, гомогенизировали при 5000 об/мин в течение 1 мин в водном растворе, содержащем 1% поливинилового спирта (PVA), перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и сушили при замораживании.
МР-12: 100 мг PLGA (7502А, PURAC, Netherlands) растворяли в 2 мл метиленхлорида, 20 мг сунитиниба малата растворяли в 0.25 мл DMSO, добавляли 0.1 М лимонную кислоту в этаноле, гомогенизировали при 3000 об/мин в течение 1 мин в водном растворе, содержащем 1% поливинилового спирта (PVA), перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и сушили при замораживании.
МР-13: 100 мг PLGA (4А, Lakeshore Biomaterials) растворяли в 2 мл метиленхлорида, 20 мг свободного основания сунитиниба растворяли в 0.25 мл DMSO, добавляли 0.1М яблочную кислоту в этаноле, гомогенизировали при 3000 об/мин в течение 1 мин в водном растворе, содержащем 1% поливинилового спирта (PVA), перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и сушили при замораживании.
Метод получения одинарной эмульсии Т/М/В (твердое вещество в масле в воде)
МР-14: 90 мг PLGA (4А, Lakeshore Biomaterials) и 10 мг PEG-PLGA (5K, 45K)) растворяли в 2 мл метиленхлорида, добавляли 20 мг сунитиниба малата и обрабатывали ультразвуком, затем выливали в 1% раствор PVA для гомогенизации в течение 1 мин при 4300 об/мин, перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и замораживали-сушили.
MP-15: (Регулирование величины рН водной фазы): 90 мг PLGA (4A, Lakeshore Biomaterials), 10 мг PEG-PLGA (5K, 45K)) растворяли в 1 мл метиленхлорида, к этому раствору добавляли 20 мг сунитиниба малата, обрабатывали ультразвуком, затем выливали в 1% раствор PVA с PBS (фосфатный буфер, рН=7.4), гомогенизировали в течение 1 мин при 4800 об/мин, перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и замораживали-сушили.
МР-16: 90 мг PLGA (4А, Lakeshore Biomaterials) и 10 мг PEG-PLGA (5K, 45K) растворяли в 1 мл метиленхлорида, к этому раствору добавляли 20 мг свободного основания сунитиниба, добавляли к этому раствору 0.1 М яблочную кислоту в этаноле, раствор обрабатывали ультразвуком, затем выливали в 1% раствор PVA для гомогенизации в течение 1 мин при 4800 об/мин, перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и замораживали-сушили.
MP-17: 90 мг PLGA (4A, Lakeshore Biomaterials) и 10 мг PEG-PLGA (5K, 45K)) растворяли в 1 мл метиленхлорида, к этому раствору добавляли 20 мг свободного основания сунитиниба, затем выливали в 1% раствор PVA в PBS и гомогенизировали в течение 1 мин при 4800 об/мин, перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и замораживали-сушили.
Способ получения двойной эмульсии (в/м/в)
МР-18: 90 мг PLGA (4А, Lakeshore Biomaterials) и 10 мг PEG-PLGA (5K, 45K)) растворяли в 1 мл метиленхлорида, добавляли 20 мг сунитиниба малата в 100 мкл DMSO и 200 мкл воды, обрабатывали ультразвуком, затем выливали в 1% раствор PVA в PBS и гомогенизировали в течение 1 мин при 3000 об/мин, перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и замораживали-сушили.
MP-19: 90 мг PLGA (4А, Lakeshore Biomaterials) и 10 мг PEG-PLGA (5K, 45K)) растворяли в 1 мл метиленхлорида, 20 мг свободного основания сунитиниба малата добавляли в 100 мкл DMSO и 200 мкл воды, обрабатывали ультразвуком, затем выливали в 1% раствор PVA в PBS и гомогенизировали в течение 1 мин при 4000 об/мин, перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и замораживали-сушили.
МР-20: 90 мг PLGA (4A, Lakeshore Biomaterials) и 10 мг PEG-PLGA (5K, 45К)) растворяли в 1 мл метиленхлорида, 20 мг свободного основания сунитиниба малата добавляли в 100 мкл DMSO и 200 мкл воды, обрабатывали ультразвуком, затем выливали в 1% раствор PVA в PBS и гомогенизировали в течение 1 мин при 4000 об/мин, перемешивали в течение 2 ч, собирали частицы, промывали дважды дистиллированной водой и замораживали-сушили.
Характеристика микрочастиц (MPs)
Размер MPs определяли при помощи прибора Coulter Multisizer VI (Beckman-Coulter Inc., Fullerton, CA). К 5-10 мг микрочастиц добавляли примерно 2 мл изотонического раствора Isoton II. Полученный раствор встряхивали для суспендирования микрочастиц в течение небольшого времени и затем добавляли по каплям 100 мл изотонического раствора Isoton II до тех пор, пока не достигалось совпадение частиц в пределах от 8% до 10%. В каждой партии микрочастиц отсортировывали более 100,000 частиц для определения среднего размера частиц. Для определения скорости in vitro высвобождения лекарства 5 мг частиц, содержащих лекарство, суспендировали в 1 мл физиологического раствора с фосфатно-солевым буферным раствором (рН 7.4) и выдерживали при 37°С во вращателе. В выбранные моменты времени микрочастицы осаждали путем центрифугирования, супернатант удаляли и заменяли среду свежим раствором фосфатно-солевого буфера.
Содержание лекарства определяли методом спектрофотометрии в УФ и видимой части спектра. Микрочастицы, содержащие сунитиниб (общий вес 10 мг), растворяли в безводном DMSO (1 мл) и затем разбавляли до тех пор, пока концентрация лекарства не стала находиться на линейном отрезке стандартной кривой УФ-абсорбции лекарства. Концентрацию лекарства определяли путем сравнения УФ-абсорбции со стандартной кривой. Содержание лекарства определяли как весовое отношение лекарства к микрочастицам.
In vitro высвобождение лекарства определяли путем суспендирования MPs, содержащих сунитиниб (общим весом 10 мг) в 4 мл PBS, содержащего 1% Tween 20, в стеклянном сосуде объемом 6 мл и последующей выдержки при 37°С при встряхивании со скоростью 150 об/мин. В заданные моменты времени удаляли 3 мл супернатанта после того, как частицы осаждались на дно сосуда и заменяли его 3 мл свежей среды для высвобождения. Содержание лекарства в супернатанте определяли методом спектрофотометрии в УФ и видимой части спектра или методом HPLC.
Результаты
Результаты определения высвобождения
Все количество сунитиниба (F127) в течение примерно 30 дней линейно высвобождалось в PBS (рН 7.4) из частиц с PLGA, полученных с F127.
Все количество сунитиниба (F127/PVA) в течение примерно 40 дней линейно высвобождалось в PBS (рН 7.4) из частиц с PLGA, полученных с PVA, и затем промытых при помощи F-127.
Все количество сунитиниба в течение примерно 60-70 дней линейно высвобождалось в PBS (рН 7.4) из частиц с PLGA, полученных с PVA.
Все количество сунитиниба линейно высвобождалось в PBS (рН 7.4) из частиц с PEG-PLGA в течение примерно 100-120 дней.
Все количество сунитиниба линейно высвобождалось в PBS (рН 7.4) из частиц с PEG-PLA в течение примерно 120 дней.
Результаты определения влияния поверхностно-активных веществ и величины рН на содержание лекарства
И катионные, и ионные поверхностно-активные вещества приводили к получению очень низкого содержания лекарства, например, 0.20% с SDS и 0.27% с HDTA-бромидом. Применение PVA привело к увеличению содержания до 1.1%. Свободное основание сунитиниба кристаллизовалось, и оно не могло быть использовано для получения большего содержания лекарства. Добавление DMSO к растворителю увеличило содержание лекарства до примерно 5%. Однако увеличенное содержание лекарства до 16.1% при применении PEG-PLGA было получено за счет увеличения щелочности раствора сунитиниба, которое может быть повышено далее путем добавления DMF по сравнению с содержанием лекарства равным только 1%, когда щелочь не добавляли.
В Таблице приведены размеры, содержание лекарства и величины высвобождения в первый день из составов MP, приготовленных с применением PVA, двух форм сунитиниба и разной степени щелочности всего раствора, как описано выше.

Пример 2: Получение и профили in vitro высвобождения наночастиц (NPs), инкапсулирующих сунитиниб
Материалы и методы
Обозначение составов (IDs)
Для облегчения идентификации различные составы с наночастицами, полученные в водной фазе, содержащей 1% PVA в PBS (рН 7.4), были обозначены, как, например, NP-n (n обозначает номер от 21 до 27).
NP-21: 100 мг PLGA (2А, Lakeshore Biomaterials) растворяли в 1 мл метиленхлорида. 20 мг сунитиниба малата добавляли в 250 мкл DMSO и затем выливали в 1% PVA. 5 мл этого раствора обрабатывали ультразвуком в течение 3 мин и выливали в 80 мл 0.1% PVA, перемешивали в течение 2 ч, собирали частицы, дважды промывали дистиллированной водой и сушили при замораживании.
NP-22: 100 мг PLGA (2A, Lakeshore Biomaterials) растворяли в 1 мл метиленхлорида. 20 мг сунитиниба малата добавляли в 250 мкл DMSO и затем выливали в 1% PVA в PBS (рН 7.4). 5 мл этого раствора обрабатывали ультразвуком в течение 3 мин и выливали в 80 мл 0.1% PVA, перемешивали в течение 2 ч, собирали частицы, дважды промывали дистиллированной водой и сушили при замораживании.
NP-23: 100 мг PLGA (1А, Lakeshore Biomaterials) растворяли в 1 мл метиленхлорида. 20 мг сунитиниба малата добавляли в 250 мкл DMSO и затем выливали в 1% PVA в PBS (рН 7.4). 5 мл этого раствора обрабатывали ультразвуком в течение 3 мин и выливали в 80 мл 0.1% PVA, перемешивали в течение 2 ч, собирали частицы, дважды промывали дистиллированной водой и сушили при замораживании.
NP-24: 100 мг PLGA (75:25, 4А, Lakeshore Biomaterials) растворяли в 1 мл метиленхлорида. 20 мг сунитиниба малата добавляли в 250 мкл DMSO и затем выливали в 1% PVA в PBS (рН 7.4). 5 мл этого раствора обрабатывали ультразвуком в течение 3 мин и выливали в 80 мл 0.1% PVA, перемешивали в течение 2 ч, собирали частицы, дважды промывали дистиллированной водой и сушили при замораживании.
NP-25: 100 мг PLGA (2A, Resomer Biomaterials) растворяли в 1 мл метиленхлорида. 20 мг сунитиниба малата добавляли в 250 мкл DMSO, добавляли TEA (20 мкл) и затем выливали в 1% PVA. 5 мл этого раствора обрабатывали ультразвуком в течение 3 мин и выливали в 80 мл 0.1% PVA, перемешивали в течение 2 ч, собирали частицы, дважды промывали дистиллированной водой и сушили при замораживании.
NP-26: 100 мг PLGA (2A, Resomer Biomaterials) растворяли в 1 мл метиленхлорида. 20 мг сунитиниба малата добавляли в 250 мкл DMSO и затем выливали в 1% PVA в PBS (рН 7.4). 5 мл этого раствора обрабатывали ультразвуком в течение 3 мин и выливали в 80 мл 0.1% PVA, перемешивали в течение 2 ч, собирали частицы, дважды промывали дистиллированной водой и сушили при замораживании.
NP-27: 100 мг PEG-PLGA (5K,45K Shangdong, 10% PEG) растворяли в 1 мл метиленхлорида. 20 мг сунитиниба малата добавляли в 250 мкл DMSO и затем выливали в 1% PVA, обрабатывали ультразвуком в течение 3 мин и выливали в 80 мл 0.1% PVA, перемешивали в течение 2 ч, собирали частицы, дважды промывали дистиллированной водой и сушили при замораживании.
Результаты

Пример 3. Влияние величины рН водной фазы на эффективность инкапсулирования сунитиниба
Материалы и методы
Полимерные микрочастицы PLGA и/или диблочного сополимера PLGA и PEG, ковалентно соединенного с PLGA (Mw 45 кДа) (PLGA45k-PEG5k), с сунитиниба малатом или без него получали, используя способ выпаривания растворителя из одинарной эмульсии. Вкратце, PLGA и/или PLGA-PEG сначала растворяли в дихлорметане (DCM) и сунитиниба малат растворяли в диметилсульфоксиде (DMSO) при заданных концентрациях. Раствор полимера и раствор лекарства смешивали с образованием гомогенного раствора (органической фазы). Органическую фазу добавляли к водному раствору 1% поливинилового спирта (PVA) (Polysciences, Mw 25 кДа, степень гидролиза 88%) и гомогенизировали при 5,000 об/мин в течение 1 мин, используя для получения эмульсии лабораторный смеситель L5M-A (Silverson Machines Inc., East Longmeadow, MA).
Микрочастицы, содержащие растворитель в эмульсии, затем затвердевали при перемешивании при комнатной температуре в течение > 2 ч для испарения DCM. Микрочастицы собирали при осаждении, промывали три раза в воде и сушили лиофилизацией.
Поскольку было показано, что растворимость сунитиниба в водном растворе зависит от величины рН, для определения влияния величины рН в водной фазе на эффективность инкапсулирования были приготовлены составы микрочастиц (MP), инкапсулирующих сунитиниб, в водных фазах при различных значениях рН (как показано в Таблице 3).

Определение содержания лекарства
Содержание лекарства определяли методом спектрофотометрии в УФ и видимой части спектра. Микрочастицы, содержащие сунитиниб (общий вес 10 мг) растворяли в безводном DMSO (1 мл) и затем разбавляли до тех пор, пока концентрация лекарства не стала находиться на линейном отрезке стандартной кривой УФ-абсорбции лекарства. Концентрацию лекарства определяли путем сравнения УФ-абсорбции со стандартной кривой. Содержание лекарства определяли как весовое отношение лекарства к микрочастицам.
Измерение среднего размера и распределения микрочастиц по размерам
Несколько миллиграммов микрочастиц вначале суспендировали в воде и диспергировали в разбавителе ISOTON®. Средний размер частиц и распределение частиц по размерам определяли на приборе COULTER MULTISIZER IV (Beckman Coulter, Inc., Brea, CA).
Результаты
Данные в Таблице 4 показывают содержание лекарства и эффективность инкпапсулирования MPs, содержащихся в составах, описанных в Таблице 3. Содержание лекарства и эффективность инкпапсулирования значительно увеличились, когда величина рН водной фазы возросла с 4 до 7.4, и по существу с 6 до 7.4. Однако, когда величину рН увеличили до 10 и водный раствор стал более основным, морфология многих частиц изменилась от сферической до неправильной формы и некоторые частицы образовали агрегаты, что означает, что водный раствор с высоким значением рН является неблагоприятным при получении частиц с высоким содержанием сунитиниба и высоким качеством. Следовательно, предпочтительные величины рН водного раствора находятся в интервале между 6 и 10, и более предпочтительно, между 6 и 8.

Пример 4. Влияние концентрации полимеров и вязкости полимеров на эффективность инкапсулирования сунитиниба при величине рН водного раствора 7.4
Материалы и методы
Составы микрочастиц (MP), инкапсулирующих сунитиниб, были приготовлены в среде фосфатно-солевого буферного раствора (PBS, рН 7.4), как показано в Таблице 5.

Результаты
Таблица 6 показывает содержание лекарства и эффективность инкапсулирования составов MPs, полученных, как показано в Таблице 5. Содержание лекарства и эффективность инкапсулирования увеличивались по мере того, как концентрация полимера PLGA 7525 4А возрастала от 50.5 мг/мл до 202 мг/мл (Фигура 1, Фигура 2В и Таблица 5). Это, по всей видимости, обусловлено тем фактом, что при более высоких концентрациях раствор полимера является более вязким и эффективно действует как барьер, предотвращающий диффузию молекул лекарства в водную фазу. Конкретно, эффективность инкпапсулирования увеличивается до величины более 50% при концентрации полимера 100 мг/мл. Было определено, что динамическая вязкость этого раствора полимера в DCM (метиленхлориде) до смешения с раствором сунитиниба малата в DMSO составляет примерно 350 сП. Полагают, что предпочтительная минимальная вязкость раствора полимера в DCM равна примерно 350 сП, и, предпочтительно, по расчетам эта вязкость составляет примерно 720 сП (что коррелирует с концентрацией полимера в среде DCM равной 140 мг/мл). Средний диаметр микрочастиц также увеличивался как функция концентрации полимера. При концентрации полимера 200 мг/мл и при величине рН водного раствора 7.4 эффективность инкапсулирования возрастала до 92%.
Содержание лекарства и эффективность инкапсулирования увеличивались также по мере того, как вязкость полимерных растворов возрастала при данной концентрации полимера и при данном значении величины рН водного раствора равном 7.4. При той же концентрации 100 мг/мл вязкость раствора PLGA 75:25, раствора PLGA 85:15 6Е и раствора PLGA 85:15 6А выше, чем вязкость раствора PLGA 75:25 4А, потому, что полимер PLGA 75:25 6Е, полимер PLGA 85:15 6Е и полимер PLGA 85:15 6Е каждый имеет более высокую молекулярную массу, чем полимер PLGA 75:25 4А. Конкретно, как было определено, вязкость раствора PLGA 75:25 6Е в DCM при концентрации 100 мг/мл составляет примерно 830 сП. В результате эффективность инкапсулирования составов на основе PLGA 75:25 6Е, PLGA 85:15 6Е или PLGA 85:15 6А была равна примерно 80%, что выше, чем эффективность инкапсулирования состава с той же концентрацией PLGA 7525 4А равная 53% (Таблица 6).

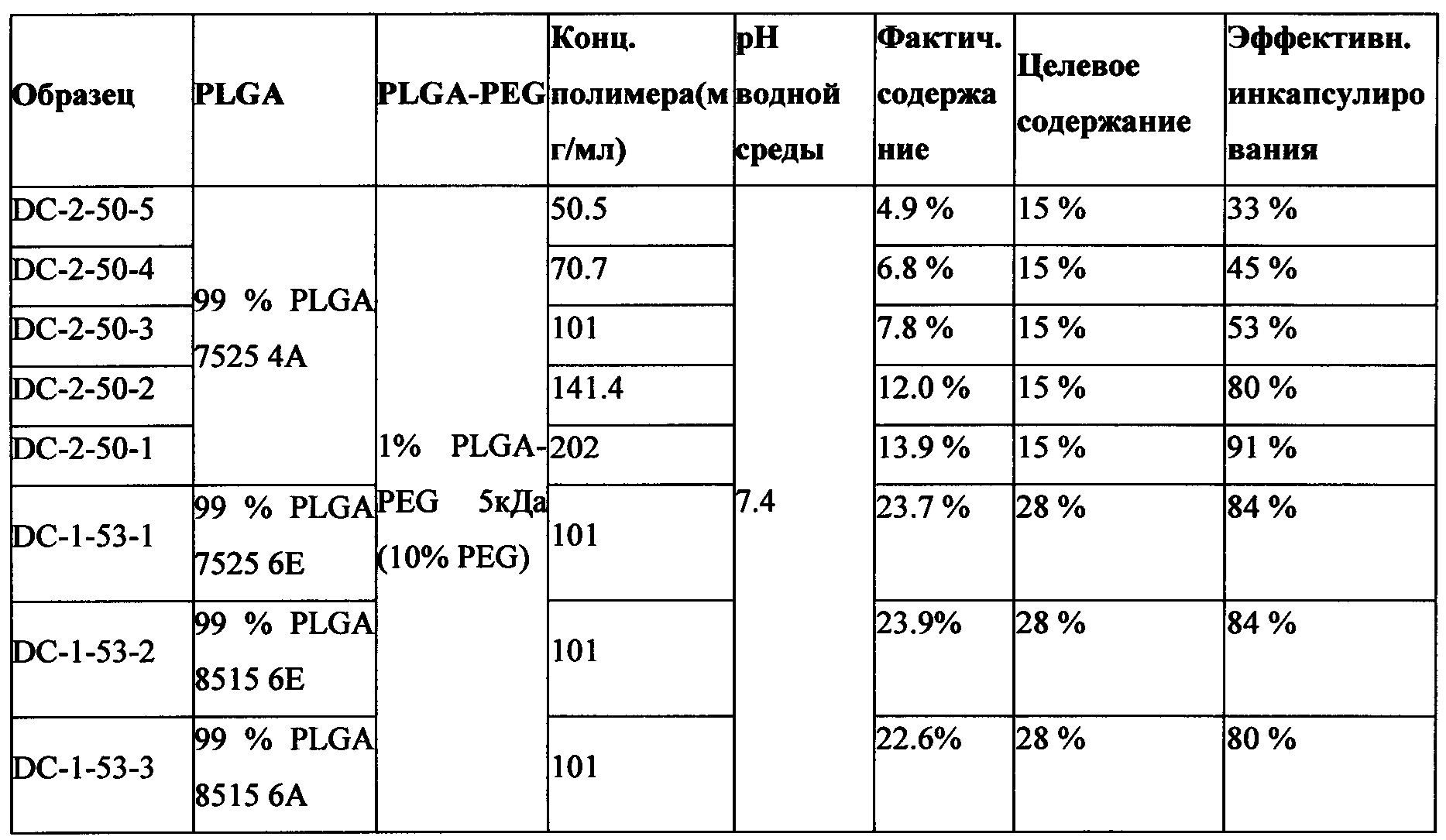
Результаты показывают, что содержание лекарства и эффективность инкапсулирования составов сунитиниба могут быть значительно повышены путем изменения концентрации/вязкости полимеров при оптимальном значении величины рН водной фазы. Считается, что можно применять раствор полимера, который является даже более вязким, чем растворы, описанные выше. Однако при некоторой точке такой раствор будет слишком вязким при тщательном его смешении с водной фазой для образования микрочастиц с относительно однородным распределением частиц по размерам.
Пример 5. Продолжительность высвобождения инкапсулированного сунитиниба из составов полимерных микрочастиц, полученных при рН водной фазы 7.4.
Материалы и методы
Составы
Были приготовлены следующие составы микрочастиц (MP): DC-1-53-1, DC-1-53-2, и DC-1-53-3 в соответствии с Таблицей 5; и составы в соответствии с Таблицей 7. Содержание лекарства и эффективность инкапсулирования составов по Таблице 7 были определены, как описано ранее в Примере 3.

In vitro высвобождение лекарства
MPs, содержащие сунитиниб (общий вес 10 мг), суспендировали в 4 мл PBS, содержащем 1% TWEEN® 20, в стеклянном сосуде объемом 6 мл и выдерживали при 37°С при встряхивании со скоростью 150 об/мин. В заданные моменты времени удаляли 3 мл супернатанта после того, как частицы оседали на дно сосуда и добавляли 3 мл свежей среды для высвобождения. Содержание лекарства в супернатанте определяли методом спектрофотометрии в УФ и видимой части спектра или методом HPLC.
Результаты
В Талице 8 показаны содержание лекарства и эффективность инкапсулирования составов MPs, приготовленных в соответствии с Таблицей 7.
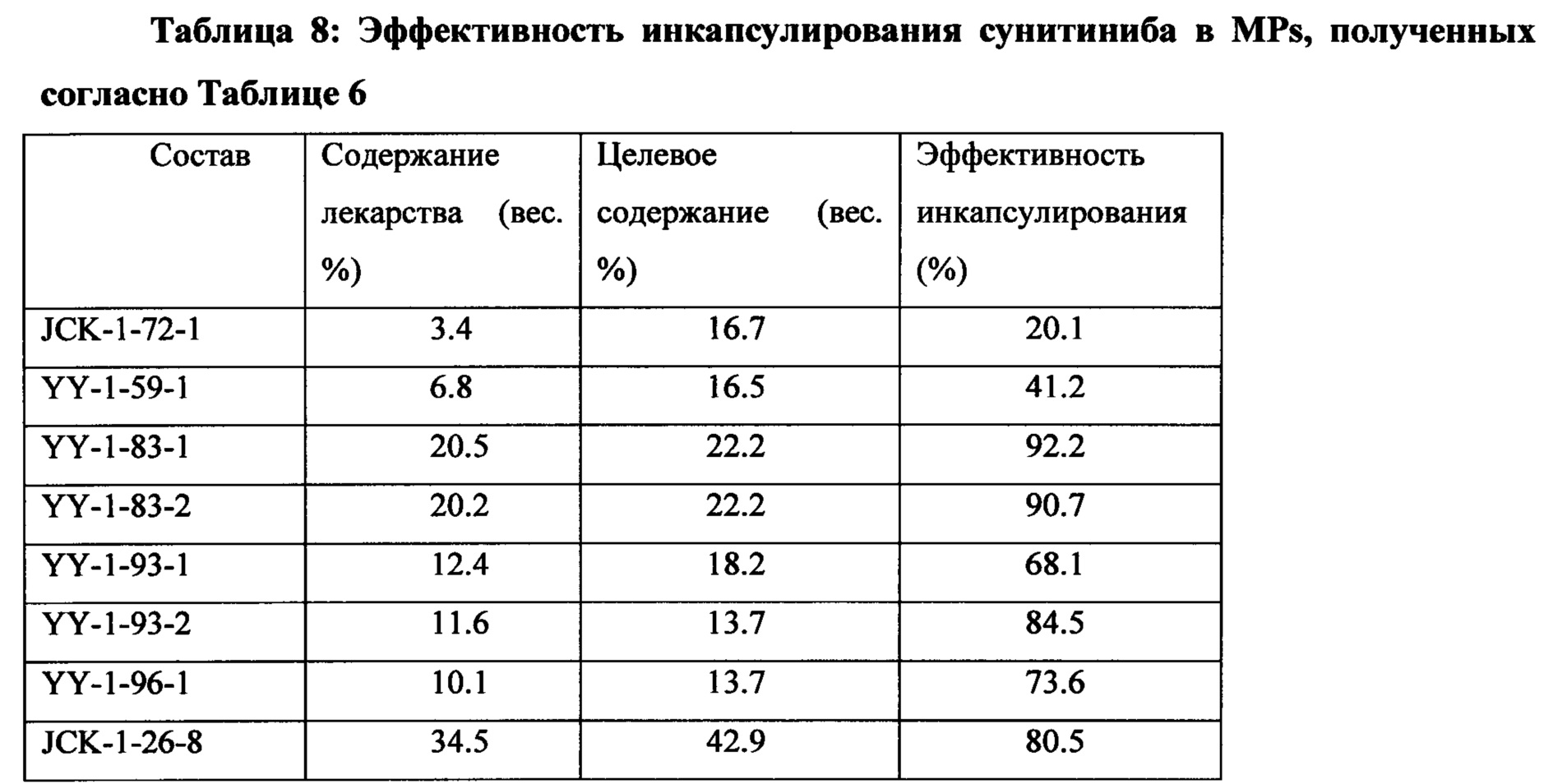
На Фигуре 2А показаны профили in vitro высвобождения за период, начиная от примерно 1 мес до примерно 6 мес из составов MP, перечисленных в Таблице 5 и в Таблице 7. Микрочастицы с PEG-PLGA(PLA) и PEG-PLGA/смесью характеризуются пролонгированным высвобождением сунитиниба. Пролонгированное высвобождение из частиц можно по необходимости регулировать для улучшения терапевтического профиля изменением отношения лактидтликолид в сополимере PLGA, концентрации полимера, отношения лекарство:полимер и размера частиц.
Пример 6: Биоразлагаемые микросферы, содержащие сунитиниб, ингибируют неоваскуляризацию роговицы
Введение
Роговица, характеризующаяся отсутствием кровеносных сосудов и прозрачностью, служит в качестве механического барьера и передней отражательной поверхности глаза. Неоваскуляризация роговицы (NV) возникает при различных патологических состояниях, включая инфекцию, химическое или травматическое повреждение, аутоиммунное заболевание и трансплантацию роговицы, она может привести к нарушенной остроте зрения, если ее не лечить. Следовательно, эффективное ингибирование NV роговицы является важным для сохранения зрения. Препараты для лечения NV роговицы включают топические кортикостероиды, нестероидные противовоспалительные средства, можно проводить фотокоагуляцию, однако, ни одна из этих возможностей не приводит к стойкому выздоровлению без некоторых нежелательных побочных эффектов.
Патологическая NV роговицы вызывается разрушением гомеостаза между ангиогенными и антиангиогенными факторами. Сосудистый эндотелиальный фактор роста (VEGF) и тромбоцитарный фактор роста (PDGF) являются ключевыми медиаторами в развитии NV роговицы. VEGF и его рецепторы (VEGFR) содержатся в неоваскуляризованной роговице в больших концентрациях по сравнению с нормальной роговицей. Действие VEGF через рецепторы тирозинкиназ (VEGFR 1, 2, 3) приводит к передаче сигналов для пролиферации клеток эндотелия сосудов, миграции и выживаемости. Блокада VEGF ингибирует NV роговицы. Разрастающиеся эндотелиальные клетки секретируют PDGF, и PDGF стимулирует транскрипцию VEGF через рецепторы PDGF тирозинкиназы. Перициты экспрессируют PDGFR-P, и эндотелиальные клетки подвергаются апоптозу, если нет подложки для перицитов и передачи сигналов VEGF. Ингибирование сигнального пути PDGF нарушает рекрутмент перицитов и в свою очередь ингибирует ангиогенез.
Анти-VEGF агенты, включающие моноклональные антитела, рибонуклеиновый аптамер и ловушку VEGF, применяли для профилактики и лечения NV роговицы у животных и при клинических испытаниях, которые показали ограниченное или частичное уменьшение патологической NV роговицы. Комбинация VEGFR и PDGFR может значительно повысить эффективность антиангиогенеза. Совместное ингибирование VEGFRs и PDGFRs при помощи сунитиниба было одобрено при лечении гастро-интестинальной стромальной опухоли, рака поджелудочной железы и почечно-клеточной карциномы. Ингибиторы рецепторов тирозинкиназы с малыми молекулами (TKI), такие как сунитиниб, пазопаниб и сорафиниб, нацеленные на рецепторы VEGF и PDGF демонстрируют высокую активность и эффективность при лечении NV роговицы.
Топическое применение TKI демонстрируют эффективность при лечении NV роговицы на животных моделях и в процессе клинических испытаний (Amparo, F., et al., Investigative Ophthalmology & Visual Science, 2013, 54(1): p. 537-544; Cakmak, H., et al., Cutan Ocul Toxicol, 2015: p. 1-7; Perez-Santonja, J.J., et al., Arch Soc Esp Oftalmol, 2013. 88(12): p. 473-81; Kо, B.Y., et al., Cornea, 2013. 32(5): p. 689-95). Однако топические глазные капли имеют ограниченную биодоступность из-за плохого проникновения лекарства, быстрого обновления слезной пленки и клиренса (Govindarajan, В. and I.K. Gipson, Exp Eye Res, 2010. 90(6): p. 655-63; Gaudana, R., et al., Pharm Res, 2009. 26(5): p. 1197-216.) Для достижения терапевтического эффекта глазные капли TKI должны применяться часто и при клиническом испытании применения TKI пазопаниба для лечения NV роговицы у пациентов глазные капли применяли четыре раза в день (Amparo 2013). Частое введение пациентам приводит к плохой совместимости.
Биоразлагаемые полимерные нано- и микрочастицы обладают преимуществами при офтальмологическом применении, например, контролируемой доставкой лекарства, повышенным проникновением в глазную полость, повышенной биодоступностью и уменьшением появления побочных эффектов при применении лекарства (Makadia, Н.K. and S.J. Siegel, Polymers (Basel), 2011. 3(3): p. 1377-1397; Shive, M.S. and J.M. Anderson, Adv Drug Deliv Rev, 1997. 28(1): p. 5-24)
Соответственно, была создана и испытана in vivo на крысиной модели биоразлагаемая полимерная система микросфер для SC введения, которая может обеспечить пролонгированное высвобождение сунитиниба малата для эффективного ингибирования NV роговицы.
Неоваскуляризация (NV) роговицы создает у пациентов предрасположенность к ухудшенной прозрачности роговицы и остроты зрения. Сунитиниба малат (Sunb-malate), нацеленный на множественные рецепторы тирозинкиназ, создает сильный антиангиогенез. Однако быстрый клиренс сунитиниба малата, введенного топически, ограничивает его терапевтическую активность и ставит под сомнение возможную совместимость лекарств и пациентов.
Как показано ниже, в случае микросфер из сополимера D,L-молочной кислоты и гликолевой кислоты, содержащих MS сунитиниба малата с размером частиц около 18 мкм, содержание лекарства составляло 6 вес. %. MS сунитиниба малат характеризовались пролонгированным высвобождением лекарства, составляющим до 25 дней в условиях достаточного in vitro разбавления. Подконъюнктивальная (SC) инъекция MS сунитиниба малата обеспечивала пролонгированное удерживание лекарства в глазу и не вызывала токсичности при дозе 150 мкг активного агента. MS сунитиниба малата после SC инъекции более эффективно ингибировали вызванную наложением шовного материала NV роговицы, чем свободный сунитиниба малат или плацебо-MS. Локальное пролонгированное высвобождение сунитиниба малата при SC инъекции MS сунитиниба малата снижало пролиферацию клеток сосудистого эндотелия и рекрутмент перицитов в роговицу. Более того, активация генами проангиогенных факторов, вызванная патологическим процессом, в значительной степени нейтрализовалась при SC инъекции MS сунитиниба малата.
Материалы и методы
Материалы
Сополимер D,L-молочной кислоты и гликолевой кислоты (LA:GA 50:50, MW ~5.6 кДа, с концевыми кислотными группами) (PLGA) приобретали в Lakeshore Biomaterials (Evonik, Birmingham, AL) и сунитиниба малат приобретали в лаборатории LC Laboratories (Woburn, MA). Раствор сунитиниба малата приготавливали путем растворения сунитиниба малата в фосфатно-солевом буферном растворе (PBS, рН 7.4) при концентрации 0.5%. Поливиниловый спирт (PVA) с MW ~25 кДа покупали в компании Polysciences, Inc. (Warrington, РА). Другие органические растворители приобретали в компании Sigma-Aldrich (St. Louis, МО).
Животные
Все экспериментальные протоколы были одобрены Johns Hopkins Animal Care and Use Committee (Комитетом по уходу за животными и их использованию Джона Хопкинса в США). Самцов крыс Sprague Dawley в возрасте 6-8 нед покупали в компании Harlan Company (Indianapolis, IN). Всех крыс использовали и лечили в соответствии с инструкциями, разработанными Association for Research in Vision and Ophthalmology (ARVO) (Ассоциацией по исследованиям зрения и офтальмологии), касающимися использования животных в офтальмологических исследованиях. Во время экспериментальных процедур животных анестезировали путем внутримышечной инъекции смеси кетамина (50 мг/кг) и ксилазина (5 мг/кг). Топическая инсталляция 0.5% пропаракаина и 0.5% тропикамида использовалась для топической анестезии и расширения зрачков, соответственно.
Получение PLGA микросфер, содержащих сунитиниба малат
Микросферы PLGA, содержащие MS сунитиниба малата (Sunb-malate MS) были получены с применением метода эмульгирования. Вкратце, 50 мг сунитиниба малата растворяли в 0.625 мл диметилсульфоксида (DMSO) перед смешением с 2.5 мл раствора, содержащего 250 мг PLGA в дихлорметане (DCM). Смесь выливали в 60 мл 1% раствора PVA при гомогенизации со скоростью 5000 об/мин, используя смеситель с высоким усилием сдвига L4RT High Shear mixer (Silverson, East Longmeadow, MA). Образовавшуюся эмульсию добавляли к дополнительному раствору 0.3% PVA (100 мл) при перемешивании магнитной мешалкой со скоростью 700 об/мин в течение 1 ч. Полученную суспензию помещали в вакуумную камеру на 3 ч при перемешивании для дальнейшего удаления DCM. MS сунитиниба малата отфильтровывали через сито 40 мкм, промывали дистиллированной водой и собирали центрифугированием при 500× g в течение 10 мин. Микросферы плацебо (плацебо-MS) получали тем же способом без добавления лекарства.
Содержание лекарства и in vitro его высвобождение
Определенное количество MS лиофилизированного сунитиниба малата растворяли в DMSO и полученный раствор подвергали анализу методом спектрофотометрии в УФ и видимой части спектра при длине волны 441 нм на автоматическом фотометре для микропланшетов BioTek Microplate Reader (Winooski, VT). Концентрацию сунитиниба малата рассчитывали с помощью стандартной кривой для сунитиниба малата. Содержание лекарства (DL) и эффективность инкапсулирования (ЕЕ) рассчитывали следующим образом:
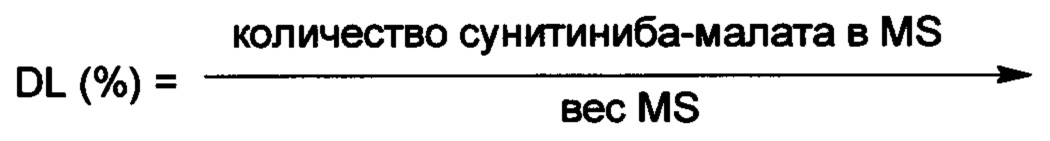

Для изучения профиля in vitro высвобождения лекарства из MS сунитиниба малата, 1 мл суспензии MS сунитиниба малата в PBS (РН 7.4) в силиконовой трубке Эпендорфа объемом 1.5 мл встряхивали со скоростью 120 об/мин при 37°С. В заданные моменты времени проводили центрифугирование суспензии при 2000× g в течение 5 мин, супернатант заменяли 1 мл свежей порции PBS. Концентрацию сунитиниба малата в собранном супернатанте измеряли в УФ и видимой части спектра.
In vivo удерживание лекарства в глазу
30 мкл раствора MS сунитиниба малата или свободного сунитиниба малата с концентрацией 5 мг сунитиниба малата/мл PBS вводили крысам путем SC инъекции с помощью иглы 27 gauge. После инъекции (PI) в дни 0, 1, 3, 7, 14 и 28 после умерщвления животных собирали целые глазные яблоки (n=4). Сунитиниба малат вызывает аутофлуоресценцию, следовательно, получали изображения энуклеированных глазных яблок при помощи оптической системы Xenogen IVIS Spectrum optical imaging system (Caliper Life Sciences Inc., Hopkinton, MA) при длинах волн возбуждения и эмиссии 420 нм и 510 нм, соответственно. Флуоресцентные изображения анализировали, используя компьютерную программу Living Image 3.0 software (Caliper Lifesciences, Inc.), удерживание сунитиниба определяли количественно путем сравнения с импульсами флуоресценции глаза сразу же после SC инъекции. Исходным уровнем служили глаза крыс без SC инъекции.
Изучение in vivo безопасности
Для того, чтобы определить офтальмологическую токсичность MS сунитиниба малата после SC инъекции 30 мкл MS сунитиниба малата с концентрацией 5 и 0.5 мг сунитиниба малата/мл вводили в оба глаза крысам линии Sprague Dawley. SC инъекция физиологического раствора и плацебо-MS (2.5 мг частиц на глаз) использовалась для контроля. В день 7 PI и в день 14 умерщвляли двух животных для сбора целых глазных яблок с конъюнктивой для гистологического исследования. Место инъекции отмечали нейлоновой нитью 6-0. Глазные яблоки фиксировали в формалине, помещали в парафин, делили на части вдоль переднезадней оси (от роговицы до зрительного нерва), разрезая через место SC инъекции и окрашивали гематоксилином и эозином (Н&Е). Слайды осматривал и сортировал патолог.
Лечение NV роговицы
NV роговицы индуцировали наложением швов в инстрастромальный туннель. Вкратце, два интрастромальных стежка нейлоновой нити 10-0 (Alcon Laboratories, Inc, Fort Worth, TX) помещали в верхний слой роговицы под микроскопом после анестезирования крыс и расширения зрачков. Расстояние между стежком и лимбом составляло примерно 2 мм, расстояние между двумя стежками было равно 1 м. После наложения шва животным сразу же делали одну SC инъекцию 30 мкл растворов (1) PBS, (2) плацебо-МР, (3) MS сунитиниба малата (5 мг сунитиниба малата/мл) и (4) свободного сунитиниба малата (5 мг сунитиниба малата/мл). Использовали эритромициновую мазь, чтобы предотвратить возникновение возможной инфекции и высыхание роговицы. За крысами наблюдали в течение 2 нед.
Количественное определение NV роговицы
Роговицу всех крыс исследовали с помощью биомикроскопа (щелевой лампы) (SL120; Carl Zeiss AG, Oberkochen, Germany), при помощи цифровой камеры получали фотографии роговицы. Поверхность и длина васкуляризованной роговицы определяли количественно с помощью программы Photoshop CS3.0. Дуга появлялась вдоль лимба, определяли количество элементов изображения (пикселей) васкуляризованной поверхности и рассчитывали поверхность NV роговицы по следующему уравнению:

Васкуляризованная поверхность была разделена на шесть одинаковых секций. Определяли расстояние между концами сосудов и лимбом в пяти точках пересечения дуги. Среднее значение пяти измеренных величин считалось длиной NV роговицы.
Полимеразная цепная реакция с обратной транскрипцией в режиме реального времени (RT-PCR)
В послеоперативный (РО) день 7 и день 14 умерщвляли крыс и собирали роговицы. При одинаковых условиях собирали три роговицы для выделения мРНК. Суммарная мРНК была выделена с помощью реагента TRIzol® (Invitrogen, USA) в соответствии с инструкциями производителя, затем осуществляли обратную транскрипцию, используя набор High Capacity cDNA Reverse Transcription Kit (Applied Biosystems, USA). Для количественного определения уровней экспрессии мРНК ангиогенных и антиангиогенных факторов, включающих VEGF, VEGFR1, VEGFR2, PDGFa, PDGFb, PDGFRα, PDGFRβ, VE-кадхерин (cadherin), Ang1, MMP2, MMP9, bFGF и PECAM1, проводили RT-PCR со смесью Fast SYBR® Green Master Mix с использованием системы ПЦР в реальном времени 7100 Real Time PCR System (Applied Biosystems, CA). Уровни экспрессии мРНК нормализовали до GAPDH для дальнейшего сравнения множественных групп.
Иммуноокрашивание и конфокальное получение изображений
Глазные яблоки энуклировали и фиксировали 4% параформальдегидом (PFA) в течение 1 ч при температуре 4°С. Затем роговицы рассекали, промывали PBS, криозащищали в 15% растворе сахарозы в PBS и заливали соединением для ОСТ (ОКТ). Собирали ряд криостатных срезов роговицы (толщиной 30 мкм), затем иммуноокрашивали их с помощью следующих антител: мышиного антитела к молекуле адгезии тромбоцитов/эндотелиальных клеток 1 (РЕСАМ-1, 1:500; Abсam), кроличьего антитела к нейрональному/глиальному антигену-2 (NG2, 1;500; Millipore), антитела осла к иммуноглобулина мыши Сy2 и антитела осла к иммуноглобулину кролика Сy3, разбавленное PBS, содержащем 10% ослиной сыворотки и 0.1% Triton Х-100. После инкубации в течение ночи при температуре 4°С срезы роговицы промывали три раза PBS и инкубировали со вторичным антителом при комнатной температуре в течение 2 ч. Получали изображения срезов роговицы, используя конфокальный микроскоп Zeiss LSM 710 (Carl Zeiss, Germany). Для обеспечения панорамных изображений роговицы мы выравнивали эти срезы вдоль переднезадней оси, используя Reconstruct 1.1.0 (J.C. Fiala, NIH) и получали проекцию с максимальной интенсивностью.
Статистический анализ
Количественные данные представлены как средние значения множественных повторов ± стандартная погрешность среднего (SEM). Все полученные данные сравнивали в группах, используя t-тест и тест множественных сравнений (однопроходный ANOVA-анализ, тест Бонферрони). Разницы считались статистически значимыми при Р<0.05. Значение для множественных сравнений: *Р<0.05; **Р<0.01; ***Р<0.001.
Результаты
Получение и характеристики сунитиниба малата MS
Методом растрово-электронной микрофотографии (SEM) было установлено, что MS сунитиниба малата были пористыми, размер частиц составлял 15±9 мкм и поверхностный заряд был равен - 0.7 мВ (Таблица 9). Содержание лекарства в MS сунитиниба малата было равно 6 вес. %, и сунитиниба малат устойчиво высвобождался в течение 25 дней в условиях достаточного разбавления при 37°С in vitro без наличия начальной фазы очевидного быстрого высвобождения (Фигура 3).
Таблица 9. Физикохимические характеристики микросфер PLGA

Удерживание лекарства в глазах
Свободный сунитиниба малат быстро вымывался в течение 1 дня после SC инъекции. Как показано на Фигуре 4, инкапсулирование сунитиниба малата в PLGA MS значительно пролонгировало удерживание лекарства в глазу, на 14 день PI удерживалось примерно 50% от первоначального содержания лекарства, и сунитиниба малат постепенно исчезал к 28 дню PI.
Безопасность MS сунитиниба малата для глаз
Для того, чтобы определить безопасность для глаз после SC инъекции плацебо-MS и сунитиниба малата MS, мы проводили гистологическое исследование глаз. SC инъекция плацебо-MS является безопасной, как и SC инъекция физиологического раствора. И низкая доза, и высокая доза сунитиниба малата MS (0.5 и 5 мг сунитиниба малата/мл) после SC инъекции не вызывает воспаления в ткани конъюнктивы в месте инъекции и в роговице.
Действие MS сунитиниба малата на NV роговицы
Всех животных исследовали под биомикроскопом (щелевой лампой) в постоперативные дни (POD) 5, 7 и 14 для оценки NV роговицы при лечении MS сунитиниба малата, свободного сунитиниба малата и плацебо-MS. Ориентированные радиально новые кровеносные сосуды распространялись в роговицу из лимба по направлению к шву к POD 5 и росли далее, достигая шва к POD 14 у крыс, получавших плацебо-MS. SC инъекция свободного сунитиниба малата оказала незначительное влияние на ингибирование NV роговицы, хотя наблюдалось слабое ингибирование NV поверхности роговицы по сравнению с плацебо-MS на POD 5, но оно не было статистически значимым. В противоположность этому, количественное определение длины NV роговицы (Фигура 5А) и поверхности (Фигура 5В) выявило, что MS сунитиниба малата значительно подавляли разрастание новых кровеносных сосудов в POD 5 и останавливали дальнейший их рост с течением времени. Гистопатологический анализ подтвердил, что врастание новых кровеносных сосудов, которые наблюдалось в случае роговицы, обработанной сунитиниба малатом и плацебо-MS, было сильно уменьшено при SC инъекции MS сунитиниба малата в POD 7 и 14. Воспаление роговицы и отек роговицы после SC инъекции 5 мг/мл MS сунитиниба малата не были обнаружены. Следовательно, MS сунитиниба малата обеспечивали безопасное и эффективное ингибирование ангиогенеза роговицы.
Уровни экспрессии мРНК антиангиогенных эффекторов, подавляемой MS сунитиниба малата
Экспрессия мРНК ангиогенных факторов, маркеров эндотелиальных клеток и матриксных металлопротеаз определялась методом RT-PCR в POD 7 и 14. Количественный анализ в POD 7 показал, что экспрессия VEGF, VEGFR 1, PDGFb, PDGFRs, VE-кадхерина, bFGF, MMPs и Ang1 на клетках роговицы значительно снижалась путем SC инъекции MS сунитиниба малата по сравнению с плацебо-MP и свободным сунитиниба малатом, хотя не было статистически значимой разницы в уровнях мРНК VEGFR2 и PDGFa между группами с применением MS сунитиниба малата и свободного сунитиниба малата (Фигуры 6А-6М). Похожий результат, полученный в POD 14, показал значительное подавление экспрессии генов, ассоциированной с ангиогенезом при SC инъекции МS.сунитиниба малата
MS Сунитиниба малата подавляли рекрутмент перицитов
Для изучения действия SC инъекции MS сунитиниба малата на разрастание клеток сосудистого эндотелия и последующий рекрутмент перицитов в стенках сосудов, включая перициты вокруг стенок капилляров и клетки гладких мышц вокруг сосудов большего размера, после SC инъекции сунитиниба малата собирали срезы роговицы для проведения иммуногистохимического анализа. Панорамные изображения роговицы показали, что рост сосудистой сети в роговице заметно подавлялся SC инъекцией MS сунитиниба малата по сравнению с SC инъекцией плацебо-MS. Рекрутмент NG2-положительных перицитов был снижен в большей степени, чем в случае РЕСАМ-положительных эндотелиальных клеток при SC инъекции MS сунитиниба малата.
Таким образом, сунитиниба малат, инкапсулированный в MS биоразлагаемого PLGA, обеспечивает эффективное ингибирование NV роговицы в модели NV роговицы, индуцированной наложением шва. Сунитиниба малат может быть растворен в PBS при концентрациях, составляющих по меньшей мере 25 мг/мл. В течение 24 ч почти не наблюдалось удерживание лекарства в глазу после SC инъекции крысам раствора свободного сунитиниба малата. Хотя в случае инкапсулирования водорастворимого сунитиниба малата в MS биоразлагаемого PLGA наблюдалось более длительное удерживание сунитиниба малата, до 28 дней при наличии 50% в PI день 14. Частицы могут постоянно удерживаться в месте инъекции после первоначальной инъекции и просачивания частиц. Улучшенное удерживание частиц после SC инъекции и пролонгированное высвобождение лекарства способствовали пролонгированному удерживанию лекарства в месте инъекции. Эффективность действия SC инъекции MS сунитиниба малата при ингибировании NV являются результатом наличия двух важных факторов: (1) эффективного инкапсулирования водорастворимого сунитиниба малата в биоразлагаемые полимерные MS и (2) эффективного проникновения водорастворимого сунитиниба малата, высвободившегося из MS сунитиниба малата после SC инъекции в глаза.
Полученные результаты показали, что повышающая регуляция маркеров эндотелиальных клеток (VE-кадхерина и РЕСАМ1), металлопротеиназ (ММР2 и ММР9), проангиогенных факторов и их рецепторов (VEGF, PDGFs, bFGF, Ang1, VEGFRs и PDGFRs) в значительной степени прекращаются при введении MS сунитиниба малата. MMPs участвуют в разложении внеклеточной матицы и ремоделировании сосудистой базальной мембраны, которые требуются для ангиогенеза. VEGF, PDGFs, bFGF и Ang1 участвуют в регулировании ангиогенеза путем связывания и активации соответствующих рецепторов тирозинкиназ на клеточной поверхности. В данном исследовании экспрессия генов многих проангиогенных факторов и ангиогенез-ассоциированной протеазы понижающе регулируется MS сунитиниба малата в животной модели, индуцированной наложением шва, демонстрируя свою антиангиогенную активность на молекулярном уровне.
Биосовместимые и биоразлагаемые микросферы PLGA обеспечивают пролонгированное высвобождение сунитиниба малата и пролонгированное удерживание лекарства на поверхности глаз. Безопасная доза MS сунитиниба малата была определена методом анализа градиента концентраций на животных моделях. SC инъекция MS сунитиниба малата ингибировала в значительной степени NV в модели, индуцированной наложением шва. Пролонгированное высвобождение сунитиниба малата после SC инъекции MS сунитиниба малата повышает эффективность, уменьшает токсичность и преодолевает несовместимость у пациентов. Исследование дает возможность выработать терапевтическую стратегию нацеливания лечения на NV роговицы.
Пример 7: Устойчивость и биосовместимость частиц сунитиниба
Материалы и методы
Группы мышей линии C57BL/6 (n=5) получали IVT инъекцию микрочастиц сунитиниба (общее содержание лекарства 10 мкг), затем через 0, 2, 4 или 8 нед после инъекции осуществляли индуцированный лазером разрыв мембраны Бруха. Поверхность CNV была измерена через одну неделю после обработки лазером (то есть, в недели 1, 3, 5 и 9). Сразу же или через 2, 4 или 8 нед у мышей (n=5) осуществляли индуцированный лазером разрыв мембраны Бруха и через одну неделю после этого количественно определяли размер повреждений CNV.
Было проведено также фармакокинетическое исследование с использованием нормальных мышей C57BL/6, методом HPLC-MS в различные моменты времени после IVT инъекции микрочастиц определяли уровень лекарства в различных глазных тканях. Через 1, 2 и 3 мес после одной инъекции микрочастиц, высвобождающих сунитиниба малат, получали изображения глазного дна.
Гистологические изображения сетчатки в глазах кролика через 3 мес после инъекции фосфатно-солевого буферного раствора или микрочастиц, высвобождающих сунитиниба малат, использовали для определения воспалительного ответа.
Результаты
Микрочастицы содержали лекарство в количестве 3.4% (по весу) и имели средний диаметр равный примерно 13 мкм. У всех животных, получивших микрочастицы сунитиниба, наблюдалось значительное уменьшение поверхности CNV по сравнению с контрольными животными. Важно отметить, что защитный эффект сохранялся в течение по меньшей мере 9 нед после IVT инъекции микрочастиц.
Микрочастицы, высвобождавшие сунитиниб, удерживались и обеспечивали пролонгированные уровни сунитиниба в глазу кролика in vivo в течение по меньшей мере 3 мес. Сунитиниб имеет характерную желтую окраску, которая видна в месте инъекции в течение по меньшей мере 3 мес.Средняя концентрация сунитиниба в стекловидном теле этих кроликов через 3 мес составляла 1.6 мкМ, что находится в желательном интервале для максимальной выживаемости RGC (ганглиозной клетки сетчатки) на основе in vitro культуры. Суммарная концентрация сунитиниба в микрочастицах отчетливо уменьшалась, поскольку лекарство высвобождалось в стекловидное тело с течением времени, о чем свидетельствовало уменьшение интенсивности желтого цвета. Было найдено, что средняя концентрация сунитиниба в стекловидном теле через 3 мес по данным HPLC-MS составляет 1.6 мкМ, что попадает в желательный интервал для максимальной выживаемости RGC на основе in vitro первичной культуры RGC.
Гистологические изображения глаз кроликов, полученные через 3 мес после инъекции микрочастиц, высвобождающих сунитиниб, анализировались Директором Отдела глазной патологии (Director of Ophthalmic Pathology) доктором Чарльзом Эберхардтом. В половине глаз воспалительный ответ не наблюдался, в половине глаз было отмечено умеренное воспаление вокруг агрегатов микрочастиц.
Увеличение содержания PEG в микрочастицах, высвобождающих сунитиниб, должно дальше уменьшить вероятность возможного воспалительного ответа при сохранении терапевтических уровней сунитиниба в глазу в течение по меньшей мере 6 мес после однократной инъекции.
Пример 8: Лечение возрастной макулярной дегенерации
Возрастная макулярная дегенерация (AMD) является основной причиной серьезной необратимой потери зрения у пожилых людей. См. Bressler, et al. JAMA, 291: 1900-1901 (2004). AMD характеризуется широким спектром клинических и патологических явлений, таких как бледные желтые пятна, известные как друзы, разрушение ретинального пигментного эпителия (RPE), хориоидальная неоваскуляризация (CNV) и дисковидная макулярная дегенерация. AMD классифицируется на сухую (то есть, неэкссудативную) или влажную (то есть, экссудативную) формы. Сухая AMD характеризуется наличием повреждений, называемых друзами. Влажная форма AMD характеризуется неоваскуляризацией в центре зрительного поля.
Хотя влажная AMD является менее распространенной, она отвечает за 80%-90% случаев тяжелой формы потери зрения, связанной с AMD (Ferris, et al. Arch. Ophthamol. 102: 1640-2 (1984)). Причина появления AMD неизвестна. Однако ясно, что риск развития AMD возрастает с возрастом. AMD также связана с факторами риска, включающими наследственность, курение сигарет, окислительный стресс, диабет, употребление алкоголя и пребывание на солнце.
Влажная AMD обычно характеризуется CNV макулярного участка. Хориоидальные капилляры пролиферируют и проникают в мембрану Бруха, достигая ретинального пигментного эпителия (RPE). В некоторых случаях капилляры могут распространяться в субретинальное пространство. Повышенная проницаемость вновь образовавшихся капилляров приводит к накоплению серозной жидкости или крови под RPE и/или в нейросенсорной сетчатке. Ухудшение зрения происходит, когда фовеолярная зона становится распухшей или отслоившейся. Затем могут последовать фиброзная метаплазия и организация, что приводит к появлению увеличенной субретинальной массы, называемой дисковидным рубцом, которое составляет последнюю стадию AMD и ассоциируется с тяжелой формой потери зрения (D'Amico D J. N. Engl. J. Med. 331: 95-106 (1994)).
Было показано пролонгированное подавление хориоидальной неоваскуляризации у мышей при инъекции полимерных частиц с инкапсулированным сунитинибом в стекловидное тело. Длительная эффективность сунитиниба, высвободившегося из биоразлагаемых полимерных частиц, после инъекции в стекловидное тело (IVT) на мышиной модели лазер-индуцированной хориоидальной неоваскуляризации была продемонстрирована следующим образом.
Материалы и методы
Были получены биоразлагаемые полимерные микрочастицы для пролонгированной доставки сунитиниба, как описано в приведенных выше примерах. Микрочастицы были охарактеризованы in vitro, включая их средний размер, распределение по размерам, содержание лекарства и профиль высвобождения лекарства.
Материалы и методы
Свободные от патогенов мыши линии C57BL/6 (Charles River, Wilmington, MA) получали лечение в соответствии с указаниями Ассоциации по исследованиям зрения и офтальмологии (Association for Research in Vision and Ophthalmology Statement) no использованию животных при проведении исследований в области офтальмологии и изучению зрения и руководством Комитета по уходу за животными и их использованию Университета Джона Хопкинса, США.
Хориоидальную NV индуцировали путем разрыва мембраны Бруха методом фотокоагуляции, как было описано (Tobe, Т. et al, Am. J. Pathol. 135(5): 1641-1646 (1998)). Вкратце, самок мышей линии C57BL/6 в возрасте 5-6 нед анестезировали с помощью кетамина гидрохлорида (100 мг/кг веса) и проводили расширение зрачков. Лазерную фотокоагуляцию (размер пятна 75 мкм, продолжительность 0.1 с, 120 мВ) осуществляли в точках заднего полюса глазного яблока каждого глаза, соответствующих положению стрелок на часах, показывающих 9, 12 и 3 ч, при помощи диодного лазера OcuLight GL (Iridex, Mountain View, CA) совместно с щелевой лампой и ручного покровного стекала в качестве контактной линзы для осмотра сетчатки. Образование пузырька во время действия лазера, который свидетельствует о разрыве мембраны Бруха, является важным фактором возникновения хориоидальной NV; следовательно, в исследовании учитывались только участки прижигания, на которых образовывался пузырек.
Сразу же после получения лазер-индуцированного разрыва мембраны Бруха мышей распределяли случайным образом по различным группам лечения для внутриглазных инъекций. Инъекции в стекловидное тело проводили под препаровальной лупой с системой микроинъекций Harvard Pump Microinjection System и вытянутыми стеклянными микропипетками.
Группы мышей линии C57BL/6 (n=5) получили интравитреальную (IVT) инъекцию микрочастиц сунитиниба (общее содержание лекарства 10 мкг), затем им проводили лазер-индуцированный разрыв мембраны Бруха через 0, 2, 4 или 8 нед после инъекции. Через одну неделю после обработки лазером (то есть, в недели 1, 3, 5 и 9) измеряли поверхность CNV.
Было также проведено фармакокинетическое исследование с использованием нормальных мышей линии C57BL/6, содержание лекарства в различных глазных тканях определяли методом HPLC-MS в разные моменты времени после IVT инъекции микрочастиц.
Результаты
Микрочастицы содержали лекарство в количестве 3.4% (по весу) и имели средний диаметр равный примерно 13 мкм
У всех животных, которые получали микрочастицы сунитиниба было отмечено значительное уменьшение поверхности CNV по сравнению с контрольными животными, как показано на Фигурах 7A-7D. Важно отметить, что защитный эффект сохранялся в течение по меньшей мере 9 нед после IVT инъекции микрочастиц.
Модификация и вариации составов сунитиниба и способов их применения являются очевидными для специалистов в данной области и входят в объем прилагаемой формулы изобретения.
Реферат
Группа изобретений относится к области фармацевтики и раскрывает составы, обеспечивающие пролонгированное высвобождение сунитиниба или фармацевтически приемлемой соли из полимерной матрицы, способы получения и применения таких составов, способы лечения внутриглазного неоваскулярного заболевания. После введения сунитиниб или его соли высвобождаются в течение продолжительного периода времени в концентрациях, которые являются достаточно высокими, чтобы получить терапевтическую пользу, но достаточно низкими, чтобы избежать неприемлемых уровней цитотоксичности. 8 н. и 25 н.п. ф-лы, 9 табл., 7 ил.

Комментарии