Ускоренное заживление повреждений глаз с помощью ангиотензиновых пептидов - RU2674148C2
Код документа: RU2674148C2
Чертежи































Описание
Перекрестная ссылка
Данная заявка испрашивает приоритет согласно предварительной заявке на патент США №61/817596, поданной 30 апреля 2013 г., и №61/938851, поданной 12 февраля 2014 г., содержание которых полностью включено в настоящую заявку посредством ссылки.
Уровень техники
Повреждение глаз может возникать в результате ряда факторов, включающих хирургическое вмешательство, воздействие химических веществ, травму, инфекции и при повреждении глаз инородным телом. Подобные повреждения требуют много времени для лечения, если они вообще излечимы, к тому же продолжительное повреждение приводит к попаданию инфекции и другой контаминации, которые могут привести к потере остроты зрения или слепоте.
Краткое описание изобретения
В первом аспекте настоящее изобретение обеспечивает способы лечения повреждений глаз, включающие введение субъекту с повреждением глаз эффективного количества ангиотензинового пептида для лечения повреждения глаз. В одном из вариантов реализации повреждение глаз вызвано травмой, воздействием света/излучения или химических веществ, заболеванием или хирургической операцией. В другом варианте реализации повреждение глаз включает повреждение, выбранное из группы, состоящей из послеоперационного воспаления, послеоперационного фиброза, послеоперационного повышения внутриглазного давления, повреждения роговицы, рассечения катаракты, повреждений вследствие лазерного кератомилеза in situ (LASIK), сухости глаз и повреждения вследствие проведения фоторефрактивной кератэктомии (PRK).
В другом варианте реализации повреждение глаз представляет собой повреждение роговицы, причем повреждение роговицы включает проникновение в эпителий роговицы, эндотелий роговицы, боуменову мембрану, десметову мембрану и/или переднюю часть стромы роговицы. В другом варианте реализации повреждение роговицы включает царапину на роговицы или разрывы роговицы. В другом варианте реализации лечение включает снижение развития и/или тяжести симптома, выбранного их группы, состоящей из фиброза, воспаления, отека, повышения внутриглазного давления, боли в глаза, усиленного слезотечения по сравнению с нормальным, затуманенного зрения, светочувствительности, изменения остроты зрения и чувства присутствия инородного тела в глазу.
В другом варианте реализации лечение включает сокращение времени заживления и/или формирования передней камеры глаза по сравнению с контролем.
В одном из вариантов реализации повреждение глаз включает сухость глаз. В другом варианте реализации лечение включает снижение развития и/или тяжести симптома, выбранного из группы, состоящей из раздражения глаз, острой боли, покраснения, ощущения присутствия песка в глазах, зуда в глазах, жжения, конъюнктивальных выделений, ощущения наличия инородного тела в глазах, избыточного увлажнения и затуманенного зрения.
В другом варианте реализации повреждение глаз вызвано офтальмологической операцией. В различных вариантах реализации офтальмологическая операция выбрана из группы, состоящей из кератомилеза, лазерного кератомилеза in situ (LASIK), автоматической ламеллярной кератопластики (ALK), лазерного суб-эпителиального кератомилеза (LASEK), фоторефрактивной кератэктомии (PRK), лазерной термокератопластики (LTK), кондуктивной кератопластики (CK), лимбальных послабляющих разрезов (LRI), астигматической кератотомии (AK), радиальной кератотомии (RK), мини-асимметричной радиальной кератотомии (M.A.R.K.), гексагональной кератотомии (HK), имплантатируемых контактных линз, исправления старческой дальнозоркости, передней цилиарной склеротомии (ACS), лазерной коррекции старческой дальнозоркости (LRP), склеральных расширяющих бандажей, интракорнеальных линз Kamra inlay, операции укрепления склеры, операции по трансплантации роговицы, проникающей кератопластики (PK), имплантации кератопротеза (KPro), хирургии катаракты, вставки внутриглазных линз, фитотерапевтической кератэктомии (PTK), удаления птеригиума, татуировки роговицы, витрэктомии, панретинальной фотокоагуляции (PRP), лечения отслоения сетчатки, лазерной фотокоагуляции, пневматической ретинопексии, криопексии сетчатки, лечения макулярного отверстия, частичной пластинчатой склероувектомии, частичной пластинчатой склероциклохориедэктомии, частичной пластинчатой склерохориедэктомии, задней склеротомии, радиальной оптической нейротомии, операции по транслокации макулы, операции на глазных мышцах, окулопластической операции и операции для лечения катаракты, глаукомы и диабетической ретинопатии.
В другом варианте реализации лечение включает снижение развития и/или тяжести симптома, выбранного из группы, состоящей из послеоперационного фиброза, послеоперационного воспаления, послеоперационного повышения внутриглазного давления, разрывов, конъюнктивальных выделений, проколов, боли в глазах, усиленного слезотечения по сравнению с нормальным состоянием, затуманенного зрения, светочувствительности, изменения остроты зрения и чувства присутствия инородного тела в глазу.
В одном из вариантов реализации ангиотензиновый пептид содержит или состоит из Nle3 А (1-7) (SEQ ID NO: 14). В другом варианте реализации ангиотензиновый пептид вводят в концентрации от примерно 0,01% до примерно 1% по отношению масса (мг)/объем (мл) или по отношению масса/масса (мг), или в концентрации от примерно 0,03% до примерно 0,3% по отношению масса (мг)/объем (мл) или по отношению масса/масса (мг). В другом варианте реализации ангиотензиновый пептид вводят в виде состава для местного применения. В различных вариантах реализации состав для местного применения выбирают их группы, состоящей из гидрогелей, кремов, вискоэластиков, мазей, паст, капель, наночастиц, полимерных составов и лосьонов. В другом варианте реализации, состав вводят через средство доставки, выбранное из группы, состоящей из бандажных контактных линз, контактных линз, имплантата на основе свода конъюнктивы, повязок на глаза, давящих повязок или глазного щитка. В другом варианте реализации состав для местного применения содержит от примерно 0,5% до примерно 4% (или от примерно 1% до примерно 3%) гидроксиэтиллцеллюлозы (НЕС) по отношению масса (мг)/объем (мл) или по отношению масса/масса (мг).
В другом варианте реализации способ включает введение субъекту эффективного количества активного агента для лечения повреждения глаз, выбранного из группы, состоящей их искусственных слез, антибиотиков, противовирусных препаратов, противогрибковых препаратов, анальгетиков и противовоспалительных лекарственных средств.
Во втором аспекте настоящее изобретение предлагает фармацевтическую композицию, содержащую:
(a) ангиотензиновый пептид;
(b) активный агент, выбранный из группы, состоящей их искусственных слез, антибиотиков, противовирусных препаратов, противогрибковых препаратов, анальгетиков и противовоспалительных лекарственных средств; и
(с) фармацевтически приемлемый носитель.
В одном варианте реализации активный агент содержит искусственные слезы. В другом варианте реализации ангиотензиновый пептид содержит или состоит из Nle3 А (1-7) (SEQ ID NO: 14). В другом варианте реализации ангиотензиновый пептид вводят в концентрации от примерно 0,01% до примерно 1% (или от примерно 0,03% до примерно 0,3%) по отношению масса (мг)/объем (мл) или по отношению масса/масса (мг).
В другом варианте реализации фармацевтическая композиция предложена в виде состава для местного применения. В одном варианте реализации состав для местного применения выбирают их группы, состоящей из гидрогелей, кремов, вискоэластиков, мазей, паст, капель, наночастиц, полимерных составов и лосьонов. В другом варианте реализации состав для местного применения вводят через средство доставки, выбранное из группы, состоящей из бандажных контактных линз, контактных линз, имплантата на основе свода конъюнктивы, повязок на глаза, давящих повязок или глазного щитка. В другом варианте реализации состав для местного применения содержит от примерно 0,5% до примерно 4% (или от примерно 1% до примерно 3%) гидроксиэтиллцеллюлозы (НЕС) по отношению масса (мг)/объем (мл), или по отношению масса/масса (мг).
Краткое описание фигур
Фигура 1. Окрашивание гематоксилином и эозином области пореза роговицы, на котором показано нормализованное строение с уменьшенным фиброзом после активного лечения с применением Nle3-A(1-7) (панель С) по сравнению с контрольным носителем (панель В). Контроль без пореза показан на панели А.
Фигура 2. Изображение, полученное с помощью конфокального микроскопа, на котором показана упорядоченная организация коллагеновых пластинок стромы вблизи повреждения роговицы в двух группах, получавших лечение Nle3-A(1-7), в сравнении с неровным и бессистемным расположением пластинок в группе, получавшей негативный контроль, после одного месяца ежедневного лечения.
Подробное описание изобретения
В настоящей заявке, слова, употребленные в единственном числе, подразумевают собой также множественное число, за исключением случаев, когда из контекста явно следует обратное. Союз «и» используется в настоящей заявке взаимозаменяемо с союзом «или», за исключением случаев, когда в тексте указано иное.
Все варианты реализации, относящиеся к одним или разным аспектам настоящего изобретения, могут быть совмещены, за исключением случаев, когда из контекста явно следует обратное.
В настоящей заявке термин «примерно» означает ±5% от соответствующего измерения или значения.
В первом аспекте настоящего изобретения предложены способы для лечения повреждений глаз, включающий введение субъекту с повреждением глаз эффективного количества ангиотензинового пептида для лечения повреждения глаз.
Изобретатели открыли, что ангиотензиновые пептиды (как описано ниже) могут быть использованы для лечения ряда повреждений глаз для заживления повреждений с ограниченным помутнением или без помутнения роговицы. На данный момент единственными разрабатываемыми методами для закрывания повреждений глаз являются швы, адгезивы или клеи. Данные средства не ускоряют заживление и не оказывают эффект после их удаления.
Без привязки к определенному механизму действия, изобретатели считают, что способы, описанные в настоящем изобретении, усиливают бессосудистое заживление повреждений глаз, что является неочевидным для специалистов в области техники, поскольку заживление повреждений тканей всегда ассоциировалось с сосудистыми процессами заживления (например, посредством красных и белых телец крови, а также посредством сосудистых или эндотелиальных каналов). Способы, описанные в настоящем изобретении, ускоряют заживление глаз, не вызывая неоваскуляризацию или расстройство зрения, и снижает воспаление и отек.
Субъектом может являться любой субъект, страдающий от повреждения глаз, включая без ограничений людей или других приматов, коз, собак, кошек, лошадей, крупный рогатый скот, овец, свиней и других млекопитающих.
В настоящей заявке термин «повреждение глаз» представляет собой любое повреждение глаза, приводящее к травме глаза, которая может привести к снижению остроты зрения или помутнению роговицы, воспалению и/или задержке заживления. Данные способы могут применяться к любым подобным повреждениям глаз, включая без ограничений разрывы ткани глаза, проникновения в ткань глаза, послеоперационное воспаление, послеоперационный фиброз, послеоперационное повышение внутриглазного давления, повреждение роговицы, рассечение катаракты, помутнение роговицы, повреждения вследствие лазерного кератомилеза in situ (LASIK), и повреждение вследствие фоторефрактивной кератэктомии (PRK), воздействие излучения или химических веществ, трансплантацию роговицы, сухость глаз или глазную инфекцию.
Повреждения глаз могут быть вызваны любыми способами, включая без ограничений хирургические операции, травмы (от пыли, стекла, дерева, песка, грязи, военных снарядов, металла, камней или других материалов; быстрых объектов, таких как бейсбольные мячи, теннисные мячи, кулаки, баскетбольные мячи, фейерверки и т.д.), воздействие излучения или химических веществ, инфекцию, язву, сухой кератоконъюнктивит (KCS), болезни, аутоиммунные заболевания, старение и/или воспаление.
В другом варианте реализации повреждение глаз включает повреждение роговицы. В настоящем изобретении термин «повреждение роговицы» означает любое повреждение роговицы. Роговица является прозрачной сканью, покрывающей переднюю часть глаза. Вместе с хрусталиком глаза она участвует в фокусировке изображения на сетчатке. Способы, описанные в настоящем изобретении, могут применяться для лечения любого повреждение роговицы, включая без ограничений повреждения роговицы, включающие проникновение в эпителий роговицы, боуменову мембрану, эндотелий роговицы, десметову мембрану и/или переднюю часть стромы роговицы. Заживление роговицы является важным не только для восстановления защитного эпителия, но также для восстановления прозрачности роговицы и четкого зрения. Ответ роговицы на лечение зависит от ряда факторов, включая тип, размер и степень повреждения; природу повреждающего агента; состояние глаз; и общее состояние субъекта. Наиболее распространенные повреждения роговицы включают поверхностное проникновение в эпителий, включая разрезы и удаления, а также царапины, в боуменову мембрану и переднюю часть стромы. Поверхностные дефекты роговицы могут быть связаны с травмой или заболеваниями, такими как дистрофия, нейротрофный, токсический или инфекционный кератит, включая бактериальный, грибковый или вирусный, а также могут быть последствием хирургических операций, таких как деэпителизация, фототерапевтическая кератэктомия, фоторефракционная кератэктомия, или лазерный кератомилез in situ. За счет расположения и тонкости роговицы, наиболее распространенными офтальмологическими жалобами являются повреждения поверхности роговицы и рецидивирующие эрозии роговицы, развивающиеся у части пациентов с поверхностными повреждениями, а также у индивидуумов, имеющих изменения в стволовых клетках, расположенных в лимбе роговицы.
В другом примерном варианте реализации повреждение роговицы включает царапину на роговице или разрыв роговицы. Царапина на роговице или разрыв может произойти в результате любой причины, включая без ограничений химическое раздражение, чрезмерное использование контактных линз или использование плохо сидящих контактных линз, царапины, инородное тело в глазу, инфекцию или царапины на роговице, вызванные светом (солнечным светом, светом ламп, снегом или отражением света в воде, электродуговой сваркой и т.д.).
Повреждение роговицы может происходить в результате хирургического вмешательства или в результате попадания инородного тела в глаз. Такие повреждения очень долго заживают, если заживают вообще, а продолжительное повреждение является путем попадания инфекции и другой контаминации, что может привести к снижению остроты зрения и/или слепоте.
В одном из вариантов реализации повреждение глаз вызывано офтальмологической операцией. Настоящий способ может применяться для лечения глазных повреждений, вызванных любым видом офтальмологических операций, включая без ограничений рефрактивные хирургические операции (включая без ограничений кератомилез, лазерный кератомилез in situ (LASIK), автоматическую ламеллярную кератопластику (ALK), лазерный субэпителиальный кератомилез (LASEK), фоторефрактивную кератэктомию (PRK), лазерную термокератопластику (LTK), кондуктивную кератопластику (CK), лимбальные послабляющие разрезы (LRI), астигматическую кератотомию (AK), радиальную кератотомию (RK), мини-асимметричную радиальную кератотомию (M.A.R.K.), гексагональную кератотомию (НK), имплантируемые контактные линзы, исправление старческой дальнозоркости, переднюю цилиарную склеротомию (ACS), лазерную коррекцию пресбиопии (LRP), склеральные расширяющие бандажи, интракорнеальные линзы Kamra inlay, операции укрепления склеры); хирургические операции на роговице (включая без ограничений рефрактивные хирургические операции, упомянутые выше, и операции трансплантации роговицы, проникающую кератопластику (PK), имплантацию кератопротеза (KPro), хирургию катаракты, вставку внутриглазных линз, фототерапевтическую кератотэктомию (PTK), удаление птеригиума, татуировку роговицы); витреоретинальные хирургические операции (включая без ограничений витрэктомию, панретинальную фотокоагуляцию (PRP), лечение отслоения сетчатки, лазерную фотокоагуляцию, пневматическую ретинопексию, криопексию сетчатки, лечение макулярного отверстия, частичную пластинчатую склероувектомию, частичную пластинчатую склероциклохориедэктомию, частичной пластинчатую склерохориедоэктомию, задную склеротомию, радиальную оптическую нейротомию и операцию по транслокации макулы); операции на глазных мышцах, окулопластические операции и операции для лечения катаракты, глаукомы и диабетической ретинопатии.
В другом варианте реализации повреждением глаз является сухость глаз. Люди с сухостью глаз могут испытывать симптомы раздражения, острой боли, покраснения, ощущения присутствия песка в глазах, зуда в глазах или жжения, ощущения присутствия инородного тела в глазах, избыточного увлажнения и затуманенного зрения. При отсутствии лечения данное состояние может привести к боли, язвам или рубцеванию роговицы. Сухие глаза могут быть более подвержены бактериальным инфекциям или воспалению. Сухость глаз в прогрессирующей стадии может привести к повреждению передней поверхности глаз и снизить зрение. В различных вариантах реализации сухость глаз может быть вызвана хирургической операцией, сухим кератоконъюнктивитом (KCS), аутоиммунным заболеванием, старением и/или воспалением, и/или неспособностью выделять слезы в достаточном количестве, или когда слезы имеют неправильную консистенцию и быстро испаряются.
В одном из вариантов реализации ангиотензиновые пептиды для применения в настоящем изобретении содержат или состоят из последовательности из по меньшей мере четырех смежных аминокислот из групп R1-R8 в последовательности общей формулы I
R1-R2-R3-R4-R5-R6-R7-R8 (SEQ ID NO: 1)
где R1 выбран из группы, состоящей из Н, Asp, Glu, Asn, Асрс (1-аминоциклопентановой карбоновой кислоты), Ala, Me2Gly, Pro, Bet, Glu(NH2), Gly, Asp(NH2) и Suc, или отсутствует,
R2 выбран из группы, состоящей из Arg, Lys, Ala, Cit, Orn, Ser(Ac), Sar, D-Arg и D-Lys,
R3 выбран из группы, состоящей из Val, Ala, Leu, norLeu, Ile, Gly, Lys, Pro, Aib, Acpc и Tyr;
R4 выбран из группы, состоящей из Tyr, Tyr(РО3):, Thr, Ser, homoSer, azaTyr и Ala;
R5 выбран из группы, состоящей из Ile, Ala, Leu, norLeu, Val и Gly;
R6 выбран из группы, состоящей из His, Arg или 6-NH2-Phe;
R7 выбран из группы, состоящей из Pro или Ala; и
R8 выбран из группы, состоящей из Phe, Phe(Br), Ile и Tyr, исключая последовательности, содержащие R4 в качестве терминальной группы Tyr.
Примерные агонисты АТ2, являющиеся полезными в ходе настоящего изобретения, включают аналоги AII, изложенные выше, при условии, что R6 представляет собой p-NH2-Phe.
В другом предпочтительном варианте реализации каждого из приведенных выше вариантов реализации (SEQ ID NO: 15),
R1 выбран из группы, состоящей из Asp и Glu, или отсутствует;
R2 выбран из группы, состоящей из Arg, Lys и Ala;
R3 выбран из группы, состоящей из Val, Ala, Leu, norLeu, Ile, Gly, Lys и Pro;
R4 выбран из группы, состоящей из Tyr и homoSer;
R5 выбран из группы, состоящей из Ile, Ala, Leu, norLeu, Val и Gly;
R6 выбран из группы, состоящей из His и Arg;
R7 выбран из группы, состоящей из Pro или Ala; и
R8 выбран из группы, состоящей из Phe, Ile, или отсутствует.
Другие агонисты АТ2 для применения в настоящем изобретении включают агонисты, раскрытые в Wallinder, С, 2008. Design, Synthesis, и Biological Evaluation of Selective Nonpeptide AT2 Receptor Agonists и Antagonists. Acta Universitatis Upsaliensis. Digital Comprehensive Summaries of Uppsala Dissertations from the Faculty of Pharmacy 78. 96 pp. UPPSALA. ISBN 978-91-554-7263-4.
В альтернативном варианте реализации ангиотензиновые пептиды содержат или состоят из по меньшей мере пяти, шести, семи или восьми смежных аминокислот групп R1-R8 в последовательности общей формулы I. В следующем альтернативном варианте реализации, ангиотензиновые пептиды преимущественно состоят из по меньшей мере четырех, пяти, шести, семи или восьми смежных аминокислот из групп R1-R8 в последовательности общей формулы I.
Особенно предпочтительными комбинациями для R1 и R2 являются Asp-Arg, Asp-Lys, Glu-Arg и Glu-Lys. Особенно предпочтительные варианты реализации данного класса включают следующее: AIII или AII(2-8), Arg-Val-Tyr-Ile-His-Pro-Phe [SEQ ID NO: 2]; AII(3-8), также известный как des1-AIII или AIV, Val-Tyr-Ile-His-Pro-Phe [SEQ ID NO: 3]; AII(1-7), Asp-Arg-Val-Tyr-Ile-His-Pro [SEQ ID NO: 4]; AII(2-7). Arg-Val-Tyr-Ile-His-Pro [SEQ ID NO: 5]; AII(3-7), Val-Tyr-Ile-His-Pro [SEQ ID NO: 6]; AII(5-8), Ile-His-Pro-Phe [SEQ ID NO: 7]; AII(1-6), Asp-Arg-Val-Tyr-Ile-His [SEQ ID NO: 8]; AII(1-5), Asp-Arg-Val-Tyr-Ile [SEQ ID NO: 9]; AII(1-4), Asp-Arg-Val-Tyr [SEQ ID NO: 10]; и AII(1-3), Asp-Arg-Val. Другие предпочтительные варианты реализации включают: Arg-norLeu-Tyr-Ile-His-Pro-Phe [SEQ ID NO: 11] и Arg-Val-Tyr-norLeu-His-Pro-Phe [SEQ ID NO: 12]. Также другим предпочтительным вариантом реализации, включенным в объем настоящего изобретения, является пептид, имеющий последовательность Asp-Arg-Pro-Tyr-Ile-His-Pro-Phe [SEQ ID NO: 13].
В другом варианте реализации ангиотензиновые пептиды для применения в настоящем изобретении содержат или состоят из по меньшей мере пяти смежных аминокислот Nle3-A(1-7).
Nle3-A(1-7) представляет собой пептид, состоящий из аминокислотной последовательности Asp-Arg-Nle-Tyr-Ile-His-Pro (SEQ ID NO: 14). В различных вариантах реализации пептидом, вводимым субъекту, может являться Asp-Arg-Nle-Tyr-Ile (SEQ ID NO: 16), Asp-Arg-Nle-Tyr-Ile-His (SEQ ID NO: 17) или Asp-Arg-Nle-Tyr-Ile-His-Pro (SEQ ID NO: 14).
Другие предпочтительные варианты реализации содержат или состоят из
Другим классом ангиотензиновых пептидов, представляющих особый интерес в соответствии с настоящим изобретением, являются пептиды, имеющие общую формулу II:
R2-R3-R4-R5-R6-R7-R8 (SEQ ID NO: 34)
где R2 выбран из группы, состоящей из Н, Arg, Lys, Ala, Orn, Citron, Ser(Ac), Sar, D-Arg и D-Lys;
R3-R8 являются такими, как описано выше, и
исключая последовательности, содержащие R4 в качестве терминальной группы Tyr.
Особенно предпочтительным подклассом соединений общей формулы II являются соединения, представленные формулой:
R2-R3-Tyr-R5-His-Pro-Phe [SEQ ID NO: 35]
где R2, R3 и R5 являются такими, как описано ранее. Особенно предпочтительным является ангиотензин III с формулой Arg-Val-Tyr-Ile-His-Pro-Phe [SEQ ID NO: 2]. Другие предпочтительные соединения включают пептиды, имеющие структуру Arg-Val-Tyr-Gly-His-Pro-Phe [SEQ ID NO: 36] и Arg-Val-Tyr-Ala-His-Pro-Phe [SEQ ID NO: 37].
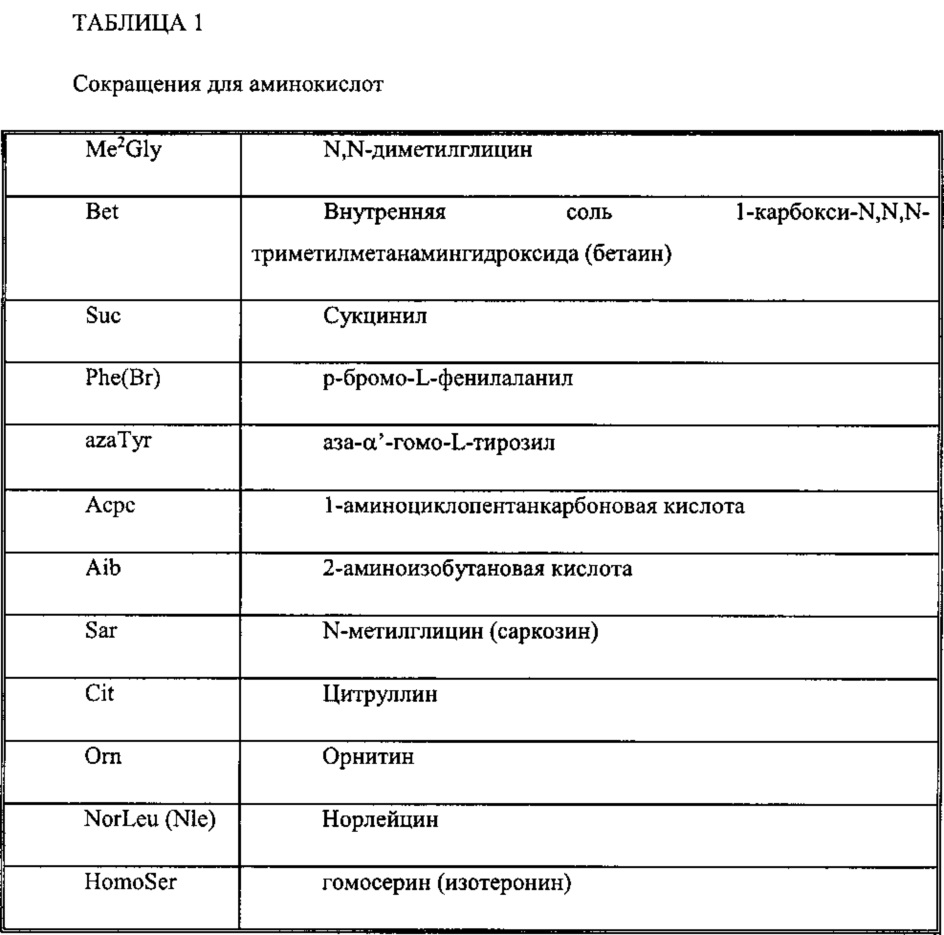
В приведенных выше формулах были использованы стандартные трехбуквенные сокращения для аминокислотных остатков. Сокращения для других остатков приведены ниже:
Аналоги, представляющие особый интерес, включают следующее:


Другие предпочтительные варианты реализации включают:

В другом варианте реализации ангиотензиновые пептиды могут быть любыми из раскрытых в US20100055146, содержание которой полностью включено в настоящую заявку посредством ссылки. В различных вариантах реализации полипептид является:
4,7-циклизованным аналогом Ангиотензина II (Ang(1-8) или любым его аналогом, описанным в настоящей заявке;
4,7-циклизованным аналогом Ангиотензина III (Ang(2-8) или любым его аналогом, описанным в настоящей заявке;
4,7-циклизованным аналогом Ангиотензина IV (Ang(3-8) или любым его аналогом, описанным в настоящей заявке;
4,7-циклизованным аналогом Ang(1-7) или любым его аналогом, описанным в настоящей заявке;
В другом варианте реализации способы включают введение агониста рецептора MAS. В настоящем изобретении допускается применение любого подходящего полипептидного или неполипептидного агониста рецептора MAS, включая без ограничений А(1-7) и его аналоги, А779 (D-Ala А(1-7); которые можно получить в Sigma Chemical Со.) и AVE0991 (см., например, Pinheiro et al., Hypertension. 2004 Oct; 44(4):490-6. Epub 2004 Aug 23).
Ангиотензиновые пептиды для применения в настоящем изобретении могут быть линейными или циклизованными любым подходящим образом, как пептиды, описанные в WO 2008/018792, включая без ограничений полипептиды, содержащие тиоэфирный мостик между положениями 4 и 7, или другими положениями.
Ангиотензиновые пептиды могут быть экспрессированы рекомбинантно или синтезированы химически посредством подходящих методик, которые хорошо известны специалисту в области техники.
В настоящей заявке термины «лечить» или «лечение» повреждения глаз означает достижение одного или более из следующего: (а) снижение тяжести повреждения глаз; (b) ограничение или предотвращение развития симптомов, характеризующих повреждение глаза, подлежащего лечению; (с) подавление ухудшения симптомов, характеризующих повреждение глаза, подлежащего лечению; (d) ограничение или предотвращение рецидива повреждения глаз у пациентов, ранее имевших нарушение(я); и (е) ограничение или предотвращения рецидива симптомов у пациентов, у которых ранее наблюдались симптомы повреждения глаз. Например, в зависимости от повреждения глаза, подлежащего лечению, симптомы могут включать послеоперационный фиброз, послеоперационное воспаление, послеоперационное повышение внутриглазного давления, разрывы, проколы, боль в глазах, усиленное слезотечение по сравнению с нормальным состоянием, затуманенное зрение, светочувствительность, изменение остроты зрения и/или чувство присутствия инородного тела в глазу.
Полипептиды могут быть введены в любой подходящей дозе, определенной согласно всем важным факторам. В одном варианте реализации всех аспектов настоящего изобретения полипептид или его соль вводят в фармацевтический состав в концентрации от примерно 0,001% до примерно 3% по отношению масса (мг)/объем (мл), или по отношению масса/масса (мг). В различных других вариантах реализации полипептид или его соль вводят в фармацевтический состав в концентрации от примерно 0,005% до примерно 3%; примерно 0,01% до примерно 3%; примерно 0,05% до примерно 3%; примерно 0,01% до примерно 3%; примерно 0,5% до примерно 3%; примерно 1% до примерно 3%; примерно 2% до примерно 3%; примерно 0,005% до примерно 2%; примерно 0,01% до примерно 2%; примерно 0,05% до примерно 2%; примерно 0,01% до примерно 2%; примерно 0,5% до примерно 2%; примерно 1% до примерно 2%; примерно 0,005% до примерно 1%; примерно 0,01% до примерно 1%; примерно 0,05% до примерно 1%; примерно 0,01% до примерно 1%; примерно 0,5% до примерно 1%; примерно 0,005% до примерно 0,75%; примерно 0,01% до примерно 0,75%; примерно 0,005% до примерно 0,75%; примерно 0,01% до примерно 0,75%; примерно 0,03% до примерно 1%; примерно 0,03% до примерно 0,75%; примерно 0,03% до примерно 0,3%; примерно 0,03% до примерно 0,5%; примерно 0,03% до примерно 0,25%; примерно 0,03% до примерно 0,1%; примерно 0,03% до примерно 0,075%; примерно 0,03% до примерно 0,05%; и примерно 0,03% до примерно 0,3%; или примерно 0,03% или примерно 0,3%
Во всех аспектах настоящего изобретения полипептид или его соль могут быть введены любым подходящим способом, таким как системное введение (включая пероральное введение), предпочтительно путем местного введения, включая без ограничения введение в виде капель (например, в виде суспензии, раствора или мази), вместе с бандажными контактными линзами, длительное введение через контактные линзы, через имплантат на основе свода конъюнктивы или через глазную повязку. В одном варианте реализации способы, описанные в настоящем изобретении, могут включать введение состава для местного применение так часто, как будет сочтено целесообразным, например, один раз в день, дважды в день, три раза в день, четыре раза в день и т.д. Способы могут далее дополнительно включать введение полипептида или его соли так долго, как сочтет целесообразным лечащий врач.
В одном варианте реализации всех аспектов изобретения, местное введение включает введение состава, выбранного из группы, состоящей из гидрогелей, кремов, вискоэластиков, мазей, паст, капель (в виде суспензий или растворов), наночастиц, полимерных составов и лосьонов. Составы могут быть применены любым подходящим способом, который может включать любое средство доставки (включая без ограничений бандажные контактные линзы, контактные линзы, имплантат на основе свода конъюнктивы, глазные повязки, давящуюие глазную повязку или глазной щиток), которое будет считаться целесообразным для человеческого пациента или лечащего врача.
В другом варианте реализации любого варианта реализации или комбинации вариантов реализации, представленных в настоящей заявке, ангиотензиновые пептиды могут быть включены в состав для медленного или продолжительного высвобождения любым подходящим способом, известным в области технике. В одном варианте реализации пептиды включены в состав геля, пилюли, наночастицы, полимерного переносчика, циклодекстрина или в любую форму для медленного или продолжительного высвобождения, и помещены на свод конъюнктивы для медленного или продолжительного высвобождения в организм субъекта.
В другом варианте реализации всех аспектов настоящего изобретения состав для местного применения содержит от примерно 0,5% до примерно 4% гидроксиэтилцеллюлозы (НЕС) по отношению масса (мг)/объем (мл) или по отношению масса/масса (мг). В различных других вариантах реализации состав для местного применения может включать от примерно 1% до примерно 3% НЕС, или примерно 2% НЕС по отношению масса (мг)/объем (мл) или по отношению масса/масса (мг).
Во всех аспектах настоящего изобретения полипептид или его соль могут быть введены совместно с одним или более (а) лиопротектором; (b) ПАВ; (с) объемообразующим агентом; (d) регулятором осмотических свойств; (е) стабилизатором; (f) консервантом и/или (g) буфером. В некоторых вариантах реализации буфер, использующийся в фармацевтической композиции представляет собой Трис-буфер, гистидиновый буфер, фосфатный буфер, цитратный буфер или ацетатный буфер. Пептиды могут быть введены совместно с лиопротектором, например, с сорбитолом или трегазолом. В некоторых вариантах реализации пептиды могут быть введены совместно с консервантом, например, хлоридом бензалкония, бензетонием, хлоргексидином, фенолом, м-крезолом, бензиновым спиртом, метилпарабеном, пролипарабеном, хлорбутанолом, о-крезолом, р-крезолом, хлоркрелозом, нитратом фенилртути, тимерозалом, бензойной кислотой и различных их смесей. В других вариантах реализации пептиды могут быть введены совместно с объемообразующим агентом, таким как глицин. В еще других вариантах реализации пептиды могут быть введены совместно с ПАВ, например, с полисорбатом-20, полисорбатом-40, полисорбатом-60, полисорбатом-65, полисорбатом-80, полисорбатом-85, полоксамером-188, сорбитан монолауратом, сорбитан монопальмитатом, сорбитан моностеаратом, сорбитан моноолеатом, сорбитан трилауратом, сорбитан тристеаратом, сорбитан триолеатом или с их комбинациями. Пептиды, описанные в настоящем изобретении, могут быть введены совместно с регулятором осмотических свойств, например, с соединением, которое делает состав преимущественно изотоническим или изоосмотическим относительно человеческой крови. Примеры регуляторов осмотических свойств включают сахарозу, сорбитол, глицин, метионин, маннитол, декстрозу, инозитол, хлорид натрия, аргинин и гидрохлорид аргинина. В других вариантах реализации пептиды могут быть введены совместно со стабилизатором, например, с молекулой, которая в сочетании с пептидом преимущественно предотвращает или снижает химическую и/или физическую нестабильность целевых пептидов в лиофилизорованной или жидкой формах. Примеры стабилизаторов включают сахарозу, сорбитол, глицин, инозитол, хлорид натрия, метионин, аргинин и гидрохлорид аргинина, парабен и комбинации метилпарабена и пропилпарабена.
Во всех аспектах и вариантах реализации настоящего изобретения подходящие кислоты, которые способны формировать соли с полипептидами, описанными в настоящем изобретении, включают без ограничений такие неорганические кислоты как хлороводородную, бромоводородную, хлорную, азотную, тиоциановую, серную, фосфорную кислоты и им подобные; и органические кислоты, такие как муравьиная, уксусная, пропионовая, гликолевая, молочная, пируватная, щавелевая, малоновая, янатарная, малеиновая, фумаровая, антраниловая, коричная, нафталинсульфокислота, сульфаниловая кислоты и им подобные. Подходящие для применения основания, способные образовывать соли с пептидами, описанными в настоящем изобретении, включают без ограничений такие неорганические основания как гидроксиды натрия, аммония и калия и им подобные; и органические основания, такие как первичные, вторичные и третичные алкилы и ариламины (например, триеэтиламин, диизопропиламин, метиламин, диметиламин и им подобные) и необязательно замещенные этаноламины (например, этаноламин, диэтаноламин и им подобные).
Полипептиды, описанные в настоящем изобретении, или их соли могут быть дополнительно изменены, с целью удлинения периода их полувыведения, например, соединением с полиэтиленгликолем. Пептиды, писанные в настоящем изобретении, или их соли могут содержать L-аминокислоты, D-аминокислоты (которые являются устойчивыми к протеазам, специфичным к L-амикислотам in vivo), комбинацию D- и L-аминокислот и различные «неестественные» аминокислоты (например, β-метиламинокислоты, Сα-метиламинокислоты, Nα-метиламинокислоты и т.д.) для обеспечения особых свойств.
Полипептиды, описанные в настоящем изобретении, могут быть единственными активными агентами в составе фармацевтической композиции или композиция может дополнительно содержать один или более активных агентов, подходящих для осуществления желаемого лечения. Подобные другие активные агенты могут включать без ограничений один или более вид искусственных слез (такие как Кармеллоза, Гидроксиэтилцеллюлоза, Гипромеллоза, поливиниловых спирт, цикл о декстрин), антибиотики (такие как Хлорамфениколь, Ципрофлоксацин, Гентамицин, Неомицин, Полимиксин Б), антивирусные препараты (такие как Ацикловир), противогрибковые препараты (такие как флюконазол), анальгетики и противовоспалительные лекарственные средства (такие как нестероидные противовоспалительные препараты, стероиды для местного применения, циклоспорин и противоаллергенные препараты).
Таким образом, в другом аспекте настоящее изобретение обеспечивает фармацевтическую композицию, содержащую:
(a) ангиотензиновый пептид;
(b) активный агент, выбранный из группы, состоящей из искусственных слез (таких как Кармеллоза, Гидроксиэтилцеллюлоза, Гипромеллоза, поливиниловых спирт, циклодекстрин), антибиотиков (таких как Хлорамфениколь, Ципрофлоксацин, Гентамицин, Неомицин, Полимиксин Б), антивирусных препаратов (таких как Ацикловир), противогрибковых препаратов (таких как флюконазол), анальгетиков и противовоспалительных лекарственных средств (таких как нестероидные противовоспалительные препараты, стероиды для местного применения, циклоспорин и противоаллергенные препараты); и
(c) фармацевтически приемлемый носитель.
Ангиотензиновый полипептид, описанный в настоящем изобретении, может быть представлен в фармацевтической композиции в любой подходящей дозе, определенной в свете всех влияющий факторов, включая факторы, раскрытые выше в способах настоящего изобретения. Фармацевтические композиции могут быть приготовлены для введения любым подходящим способом, таким как системное введение (включая пероральное введение), местное введение, включая без ограничения введение в виде капель (например, в виде суспензии, раствора или мази), вместе с бандажными контактными линзами, длительное введение через контактные линзы, через имплантат на основе свода конъюнктивы или через глазную повязку. Композиция для местного введения может включать, например, состав, выбранный из группы, состоящей из гидрогелей, кремов, вискоэластиков, мазей, паст, капель (в виде суспензий или растворов), наночастиц, полимерных составов и лосьонов. Фармацевтические композиции могут быть приготовлены для введения любым подходящим способом, который может включать любое средство доставки (включая без ограничений бандажные контактные линзы, контактные линзы, имплантат на основе свода конъюнктивы, глазные повязки, давящую глазную повязку и глазной щиток), которое будет считаться подходящим для человеческого пациента или лечащего врача. В одном из вариантов реализации фармацевтическая композиция содержит состав для местного применения, содержащий от примерно 0,5% до примерно 4% гидроксиэтилцеллюлозы (НЕС) по отношению масса (мг)/объем (мл) или по отношению масса/масса (мг). В различных дополнительных вариантах реализации состав для местного применения содержит от примерно 1% до примерно 3% НЕС, или примерно 2% НЕС по отношению масса (мг)/объем (мл) или по отношению масса/масса (мг).
Фармацевтическая композиция может содрежать один или более (а) лиопротектор; (b) ПАВ; (с) объемообразующий агент; (d) регулятор осмотических свойств; (е) стабилизатор; (f) консервант и/или (g) буфер, такие как описанные в данном изобретении для способов по настоящему изобретению.
Способы, описанные в настоящем изобретении, можно применять совместно с другими терапевтическими методами, подходящими для лечения соответствующего нарушения.
Способы и композиции, описанные в настоящем изобретении, могут включать любые другие варианты реализации, раскрытые в примерах ниже. Такие варианты реализации могут быть применены в любой комбинации со способами, описанными в настоящем изобретении, если из контекста явно не следует обратное.
Пример 1
Заживление роговицы является важным не только для восстановления защитного эпителия, но и для восстановления прозрачности роговицы и ясного зрения. Ответ роговицы на лечение зависит от ряда факторов, включая тип, размер и степень повреждения; природу повреждающего агента; состояние глаза; и общее состояние субъекта. Наиболее распространенные повреждения роговицы включают поверхностное проникновение в эпителий, боуменову мембрану и переднюю части стромы. Поверхностные дефекты роговицы могут быть связаны с травмой или заболеваниями, такими как дистрофия, нейротрофный, токсический или инфекционный кератит, а также могут быть последствием хирургических операций, таких как деэпитализация, фототерапевтическая кератэктомия, фоторефракционная кератэктомия или лазерный кератомилез in situ. Во всех этих случаях, вне зависимости от этиологии, основной целью лечения является ускорение восстановления структуры при минимальном рубцевании, что позволяет получить наилучшие возможные оптические свойства восстановленной ткани. Были предложены и описаны различные механизмы заживления роговицы, включая роль факторов роста, их регуляторов и рецепторов. Вне зависимости от глубины повреждения, отмечается, что кератоциты всегда вовлечены в процесс заживления и поэтому важной задачей остается ускорение заживления за счет регенерации, а не фиброза. За счет расположения и тонкости роговицы, наиболее распространенными офтальмологическими жалобами являются повреждения поверхности роговицы и рецидивирующие эрозии роговицы, развивающиеся у части пациентов с поверхностными повреждениями. Целью настоящего исследования является оценка эффектов нового лекарственного средства для местного применения на реэпитализацию роговицы и заживление травм стромы.
Подготовка животных и процедура:
Перед каждой процедурой кролики получали анестезию в виде подкожной инъекции гидрохлорида кетамина (50-80 мг/кг) и гидрохлорида ксилазина (5-9 мг/кг). Животное подготавливали для стерильной хирургической операции в асептических условиях. Периорбитальную область очистили с помощью 5% раствора повидон-йода, и каплю данного раствора закапали на свод конъюнктивы, а для удержания век открытыми использовали расширитель. С помощью ножа для роговицы (Keratome 3,2 мм) проделали сквозной туннель глаза схожим образом, как для проведения хирургической операции по человеческой факоэмульсификации. Для предотвращения коллапса глазного яблока после создания туннеля в роговице через прокол добавили небольшое количество вискоэлатика во внешнюю камеру. Ввели внутриконъюнктивно 25 мг гентамицина и 2 мг дексаметазона. Применили послеоперационную анестезию. Животных, отнесенных в группу, получающую лечение, лечили одной каплей (примерно 50 мкл) активного лекарственного средства (0,03% или 0,03% Nle3 А(1-7) в 2% гидроксиэтилцеллюлозе в 0,05 М фосфорном буфере, рН 6,5), закапываемого в конъюнктивальный мешок ежедневно (с помощью пипетки) в течение всего периода наблюдения. С другой стороны, животных, отнесенный к контрольной группе, лечили с помощью негативного контроля (2% гидроксиэтилцеллюлоза в 0,05 М фосфорном буфере, рН 6,5), закапываемого ежедневно в течение всего периода наблюдения.
Оценка в ходе наблюдения:
Данные оценки в ходе наблюдения провели в то время, когда животные находились под анестезией, как описано выше. Изображения внешнего сегмента включают изображения без красного цвета и флуоресцентное изображение внешнего сегмента, полученные с помощью аппарата Spectralis (Heildelberg Engineering, Germany), причем последовательные фотографии сделали после закапывания одной капли 10% флуоресцеина (Akorn, Abit Springs, LA) в конъюнктивальный мешок и после легкого надавливания на глазное яблоко. Данный метод более широко известен как тест Зейделя, в котором флуоресцеиновую полоску, содержащую 10% флуоресцеин, применяли по месту поврежденной области и оценивали с помощью голубого кобальтового фильтра. В данной области флуоресцеин демонстрирует зеленую окраску. Любые изменения окраски или поверхности флуоресцентной области означает наличие утечки в роговице. Данные полученные с помощью этих изображений использовали для оценки степени заживления ран роговицы, а так же масштабы протекания из раны. Измерение внутриглазного давления проводили с помощью Tonopen-AVIVA (TPA, Reichert Inc.).
Получение изображений и гистология:
Изображения травм также получили с использованием аппарата Heidelberg Retina Tomograph (HRT). Он представляет собой конфокальный сканирующий лазерный офтальмоскоп, который был преобразован в конфокальный роговичный микроскоп с использованием дополнительных микроскопных линз, прикрепленных к стандартным линзам. Данные дополнительные линзы позволили HRT получать изображения клеток и клеточных слоев внутри роговицы и позволили осуществить фазу прижизненной оценки заживления и структуры роговицы, что позволило получить детальное представление о структуре роговицы и патологии.
РЕЗУЛЬТАТЫ
В кроличьей модели сквозного повреждения глаза, ежедневное применение Nle3-А(1-7) снизило время заживления роговицы, определенное как отсутствие протекания согласно тесту Зейделя, с 7-ми дней у животных контрольной группы до 4-х дней у животных, получавших активное лекарственное средство (обе концентрации). Далее, наблюдалось снижение воспаление/отека глаза, измеренное в ходе клинического осмотра. Когда животные получали негативный контроль на 7-ой день уровень воспаление/отека оставался средним. При лечении с меньшей концентрацией Nle3 А(1-7) (0,03%) на седьмой день наблюдался небольшой отек. При лечении с большей концентрацией лекарственного средства (0,3%) отек наблюдался только первые 5 дней после операции. Данные результаты показывают уникальную способность активного соединения к снижению воспаления и к ускорению заживления роговицы. Данные эффекты сопровождались без изменения внутриглазного давления, а также нормальной оценкой глазного дна и флуоресцентной ангиографией.

Провели оценку области разреза с помощью HRT, а также гистологическую оценку (на 10 день). У животных, получавших негативный контроль, наблюдался фиброз и нарушение нормальной архитектуры роговицы в месте разреза. Показательный пример данного наблюдения можно увидеть на изображениях HRT ниже. В месте разреза у животных, получавших негативный контроль, наблюдается отложение большого количества фиброзного материала, который нарушает архитектуру роговицы. При лечении с применением Nle3-A(1-7) рана зажила, а ткань имеет нормальный внешний вид и архитектуру. Это было далее показано на вскрытии (21 день), когда произвели сбор тканей и подготовили их для микроскопической оценки. Окрашивания области разреза гематоксилином и эозином показало нормализованную архитектуру и сниженный уровень фиброза, достигнутые в результате активного лечения (Фигура 1).
Применение 0,3% и 0,03% Nle3-A(1-7) после проведения сквозного разреза роговицы глаза привело к более быстрому исчезновению отека и воспаления, снижению времени протекания раны роговицы и заживлению с получением нормальной архитектуры и отсутствием фиброза по сравнению с животными контрольной группы. Более высокая концентрация, 0,3% Nle3-A(1-7), привела к наиболее короткой длительности воспаления и отека, а остальные параметры между двумя группами Nle3-A(1-7) были равны.
Пример 2
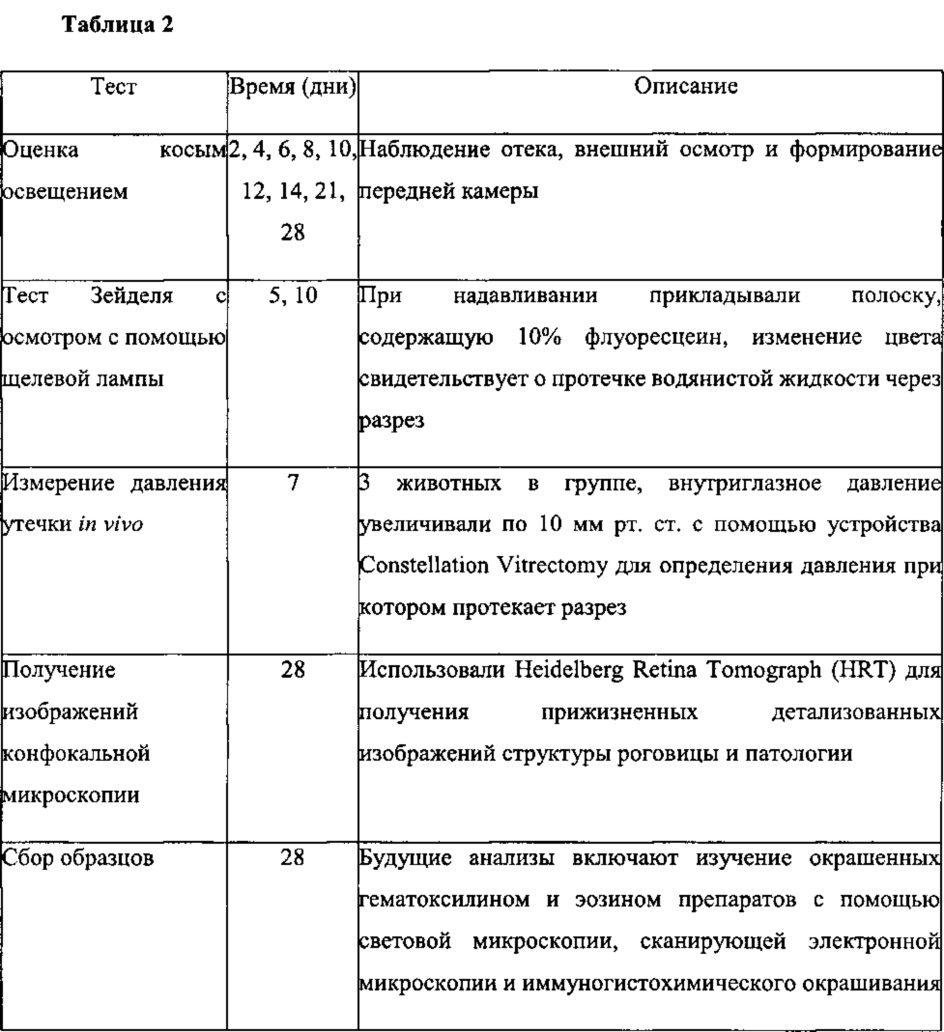
Задача теста: Определить влияние Nle3-A(1-7) в негативном контроле (2% гидроксиэтилцеллюлозе (НЕС) в 0,05 М фосфорном буфере, рН 6,5) на заживление роговицы, определенное с помощью оценки косым освещением, теста Зейделя, конфокальной микроскопии и давления утечки in vivo следующих после проведения сквозного разреза роговицы глаза кролика.
Животные: Мужские и женские особи, пигментированные кролики, только правый глаз, 5 на группу, имеющие массу 2,26-2,72 кг (5-6 фунтов). Кролики получали анестезию в виде подкожной инъекции гидрохлорида кетамина (50-80 мг/кг) и гидрохлорида ксилазина (5-9 мг/кг). Животных подготавливали для стерильной хирургической операции в асептических условиях. Периорбитальную область очистили с помощью 5% раствора повидон-йода, и каплю данного раствора закапали на свод конъюнктивы. Для удержания век открытыми использовали расширитель. С помощью ножа для роговицы (Keratome 3,2 мм) проделали чистый сквозной разрез глаза. Применили послеоперационную анестезию с последующим тестом. Примерно через 30-60 минут ввели антибиотическую мазь.
Тестовые и контрольные вещества и режим лечения:

Оценки:
Результаты:
Оценка косым освещением. Все животные имели конъюнктивальные выделения или сильно заполненные глаза по состоянию на 2 день. На 4 день выделения наблюдались у одного животного, получавшего 0,3% Nle3-A(1-7), у одного животного, получавшего 0,03% Nle3-A(1-7), и у двух, получавших негативный контроль. Формирование передней камеры (ПК) было впервые отмечено на 4 день у группы, получавшей 0,3%, у всех животных, получавших 5 больших доз ПК полностью сформировалась на день 6. В группе, получавшей 0,03%, 4 из 5 животных имели полностью сформировавшуюся ПК на день 6, а у оставшегося животного ПК полностью сформировалась на 8 день. Первый случай 100% формирования ПК у животных из контрольной группы отметили на 12 день, на 14 день (2 недели) все животные имели полностью сформированную ПК.
Тест Зейделя: По состоянию на 5 день все животные показали положительный результат теста Зейделя, за исключением трех животных - двух из группы, получавшей 0,3% Nle3-A(1-7), и одного из группы, получавшей 0,03% Nle3-A(1-7). По состоянию на 10 день все животные, получавшие лечение Nle3-A(1-7) имели отрицательный результат теста Зейделя, в то время как все животные из контрольной группы продолжали демонстрировать протечку под действием давления. Далее, на 6 день оценка косым освещением не показала наличие протечки ни у одного животного из группы, получавшей 0,3% NorLeu3-A(1-7) и ни у одного из трех животных из группы, получавшей 0,03% Nle3-A(1-7).
Оценка давления утечки in vivo: Трое животных из каждой группы использовали для оценки давления утечки in vivo. Среднее давление у животных, получавших 0,3% или 0,03% Nle3-A(1-7), составило 79,3±6 мм рт.ст. и 77,3±3,2 мм рт.ст. соответственно. Среднее давление у животных, получавших негативный контроль, составило 38,7±3,2 мм рт.ст. Лечение с помощью Nle3-A(1-7) увеличило прочность заживления таким образом, что потребовалось почти в два раза большее давление, чтобы вызвать протечку ран, которые лечили Nle3-A(1-7) по сравнению с контрольной группой.
Конфокальная микроскопия (Фигура 2): Показана упорядоченная организация коллагеновых пластинок стромы вблизи повреждения роговицы в двух группах, получавших лечение Nle3-A(1-7), в сравнении с неровным и бессистемным расположением пластинок в группе, получавшей негативный контроль, после одного месяца ежедневного лечения.
Обсуждение и выводы:
Применение 0,3% и 0,03% Nle3-A(1-7) после сквозного разреза глаза привело к более быстрому формированию передней камеры глаза по сравнению с животными контрольной группы на 6 день, 8 день и 14 день соответственно. Заживление роговицы, измеренное по наличию протекания жидкости согласно тесту Зейделя, произошло на 10 день у всех животных, получавших лечение Nle3-A(1-7), в то время как животные контрольной группы имели отрицательный результат теста Зейделя.
Прочность заживления увеличилась после лечения 0,3% и 0,03% Nle3-A(1-7) по сравнению с животными контрольной группы. Упорядоченное распределение кератоцитов и пластинок свидетельствует о заживлении роговицы у животных, получавших Nle3-A(1-7).
Реферат
Группа изобретений относится к области медицины, а именно к офтальмологии, и предназначена для лечения повреждения глаз. Для лечения повреждения глаз, которое выбирают из группы, состоящей из послеоперационного воспаления, послеоперационного фиброза, повреждения роговицы, рассечения катаракты, повреждений вследствие лазерного кератомилеза in situ (LASIK) и повреждения вследствие проведения фоторефрактивной кератэктомии (PRK), осуществляют введение субъекту эффективного количества ангиотензинового пептида, содержащего Nle3-A(1-7) (SEQ ID NO: 14). Также обеспечена фармацевтическая композиция для топического лечения повреждения глаза, содержащая (a) ангиотензиновый пептид, содержащий Nle3-A(1-7) (SEQ ID NO: 14), (b) активный агент, выбранный из группы, состоящей их искусственных слез, и (c) фармацевтически приемлемый носитель. Использование группы изобретений позволяет уменьшить длительность отека и воспаления, а также увеличить прочность заживления и восстановить прозрачность роговицы глаза. 2 н. и 24 з.п. ф-лы, 2 ил., 2 табл., 2 пр.

Комментарии