Антитела против нtrа1 и способы их применения - RU2750285C2
Код документа: RU2750285C2
Чертежи














































Описание
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Данная заявка содержит перечень последовательностей, который был подан в электронном виде в формате ASCII и тем самым полностью включен в данную заявку путем ссылки. Указанная копия ASCII, созданная 25 октября 2016 г., названа 50474-117WO4_Sequence_Listing_10_25_16_ST25, а ее размер составляет 114779 байтов.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение в целом относится к антителам против HtrA1 и способам их применения.
УРОВЕНЬ ТЕХНИКИ
Сериновая протеаза, HtrA-сериновая пептидаза 1 (HtrA1) (PRSS11; Clan PA, семейство 51) относится к эволюционно консервативному семейству белков HtrA. У человека HtrA1, HtrA3 и HtrA4 имеют одинаковую доменную архитектуру: N-концевой IGFBP-подобный модуль и Kazal-подобный модуль, протеазный домен с трипсиноподобным типом сворачивания и С-концевой домен PDZ. Физиологическую релевантность HtrA1 надежно установили путем выявления у людей мутаций, обуславливающих потерю функции, вызывающих наследственное ишемическое заболевание мелких церебральных сосудов. В этом молекулярном механизме задействовано недостаточное ингибирование TGFβ (трансформирующий ростовой фактор бета) при участии HtrA1, приводящий к увеличенной сигнализации TGFβ. Нарушение регулирования сигнализации TGFβ под влиянием аномальной экспрессии HtrA1 также может способствовать возникновению артрита, вероятно в связи с опосредованной HtrA1 деградацией различных компонентов внеклеточного матрикса или опосредованно через стимулирование металлопротеаз матрикса. В дополнение к этому, при генетических исследованиях человека выявлена сильная корреляция между прогрессированием возрастной макулярной дегенерации (ВМД) и SNP (однонуклеотидным полиморфизмом) в промоторном участке HtrA1, приводящем к повышенным уровням транскрипта HtrA1 (см., например, Dewan et al., Science 314:989-992, 2006 and Yang et al., Science 314:992-993, 2006).
ВМД представляет собой прогрессирующее хроническое заболевание центральной сетчатки с существенными последствиями для остроты зрения. Поздние формы заболевания являются главной причиной потери зрения в развитых странах. Для европеоидной популяции возрастом ≥40 лет частота распространения ранней ВМД по оценке составляет около 6,8%, а запущенной - около 1,5%. Частота распространения поздней ВМД с возрастом существенно увеличивается, возрастая до около 11,8% после 80 лет. Существует два типа ВМД, неэкссудативная (сухая) и экссудативная (влажная) ВМД. При более распространенной сухой ВМД происходят атрофические и гипертрофические изменения в ретинальном пигментном эпителии (RPE), лежащем под центральной сетчаткой (макулой), а также образуются отложения (друзы) на самом RPE. Прогрессирование сухой ВМД может приводить к значительному повреждению сетчатки, включая географическую атрофию (GA) с необратимой потерей зрения. Более того, у пациентов сухая ВМД может прогрессировать во влажную форму, при которой под сетчаткой образуются анормальные кровеносные сосуды, названные хориоидальными неоваскулярными мембранами (CNVM), происходит подтекание жидкости и крови и, в конечном итоге, это приводит к образованию ослепляющего рубца в виде диска в сетчатке или под ней.
Существует потребность в антителах против HtrA1 с улучшенными свойствами, такими как аффинность связывания, стабильность и ингибирующая активность (блокирование), а также их терапевтическом и диагностическом применении.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам против HtrA1 и способам применения их в терапевтических и диагностических целях. Антитела против HtrA1 по данному изобретению являются высокоактивными и обладают высокой аффинностью связывания в отношении HtrA1. Улучшенные свойства антител по данному изобретению делают их пригодными для применения при лечении.
В одном аспекте, изобретение охватывает выделенное антитело, которое специфически связывается с эпитопом HtrA1, причем эпитоп HtrA1 содержит по меньшей мере одну аминокислоту белка HtrA1, выбранную из группы, состоящей из Arg190, Leu192, Pro193, Phe194 и Arg197, где нумерация аминокислот соответствует нумерации белка-предшественника HtrA1 человека.
В одном варианте реализации изобретения эпитоп HtrA1 содержит по меньшей мере одну аминокислоту белка HtrA1, выбранную из группы, состоящей из Leu 192, Pro193 и Arg197.
В другом варианте реализации изобретения эпитоп HtrA1 содержит по меньшей мере две аминокислоты белка HtrA1, выбранные из группы, состоящей из Leu192, Pro193 и Arg197.
В конкретном варианте реализации изобретения эпитоп HtrA1 содержит аминокислоты HtrA1 Leu192, Pro193 и Arg197.
В другом варианте реализации изобретения эпитоп HtrA1 содержит аминокислоты HtrA1 Arg190, Leu192, Pro193 и Arg197.
В дополнительном варианте реализации изобретения эпитоп HtrA1 содержит аминокислоты HtrA1 Arg190, Leu192, Pro193, Phe194 и Arg197.
В одном аспекте изобретение относится к выделенному антителу, которое специфически связывает человеческую HtrA-сериновую пептидазу 1 (HtrA1) с KD около 550 пМ или меньше. В некоторых вариантах реализации изобретения антитело специфически связывает HtrA1 человека с KD от около 40 пМ до около 550 пМ. В некоторых вариантах реализации изобретения антитело специфически связывает HtrA1 человека с KD от около 40 пМ до около 250 пМ. В некоторых вариантах реализации изобретения антитело специфически связывает HtrA1 человека с KD от около 50 пМ до около 125 пМ. В некоторых вариантах реализации изобретения антитело специфически связывает HtrA1 человека с KD около 110 пМ. В некоторых вариантах реализации изобретения антитело специфически связывает HtrA1 человека с KD около 60 пМ. В некоторых вариантах реализации изобретения значение KD измеряют методом поверхностного плазмонного резонанса (ППР) (например, ППР BIACORE®). В некоторых вариантах реализации изобретения ППР выполняют, как описано в данном документе (например, в разделе «Примеры»).
В некоторых вариантах реализации изобретения любое из предыдущих антител способно ингибировать активность HtrA1. В некоторых вариантах реализации изобретения антитело ингибирует активность протеазного домена человеческой HtrA1 (huHtrA1-PD) с 50% ингибирующей концентрацией (IC50) равной 1,5 нМ или меньше. В некоторых вариантах реализации изобретения антитело ингибирует активность huHtrA1-PD с IC50 равной от 0,25 нМ до около 0,5 нМ. В некоторых вариантах реализации изобретения антитело ингибирует активность huHtrA1-PD с IC50 равной около 0,3 нМ. В некоторых вариантах реализации изобретения ингибирующую активность измеряют in vitro в анализе блокирования на основе FRET (резонансный перенос энергии флуоресценции). В некоторых вариантах реализации изобретения анализ блокирования in vitro на основе FRET включает использование зонда H2-Opt (например, SEQ ID NO: 152). В некоторых вариантах реализации изобретения выполняют анализ блокирования in vitro на основе FRET, как описано в данном документе (например, в примерах).
В некоторых вариантах реализации вышеприведенного аспекта антитело содержит связывающий домен, содержащий: (a) HVR-H1, содержащий аминокислотную последовательность DSEX1H (SEQ ID NO: 1), где X1 представляет собой Met или Leu; (b) HVR-H2, содержащий аминокислотную последовательность GVDPETX2GAAYNQKFKG (SEQ ID NO: 2), где Х2 представляет собой Glu или Asp; и (с) HVR-H3, содержащий аминокислотную последовательность GYDYDYALDY (SEQ ID NO: 3). В некоторых вариантах реализации изобретения антитело содержит связывающий домен, содержащий: (a) HVR-H1, содержащий аминокислотную последовательность DSEMH (SEQ ID NO: 7); (b) HVR-H2, содержащий аминокислотную последовательность GVDPETEGAAYNQKFKG (SEQ ID NO: 8); и (с) HVR-H3, содержащий аминокислотную последовательность GYDYDYALDY (SEQ ID NO: 3). В некоторых вариантах реализации изобретения антитело дополнительно содержит: (a) FR-H1, содержащий аминокислотную последовательность EVQLVQSGAEVKKPGASVKVSCKASGYX1FX2 (SEQ ID NO: 12), где X1 представляет собой Lys или Thr, а Х2 представляет собой Thr, Lys или Arg; (b) FR-H2, содержащий аминокислотную последовательность WVRQAPGQGLEWIG (SEQ ID NO: 13); (с) FR-H3, содержащий аминокислотную последовательность RATITRDTSTSTAYLELSSLRSEDTAVYYCTR (SEQ ID NO: 14); и (d) FR-H4, содержащий аминокислотную последовательность WGQGTLVTVSS (SEQ ID NO: 15). В некоторых вариантах реализации изобретения антитело дополнительно содержит: (a) FR-H1, содержащий аминокислотную последовательность EVQLVQSGAEVKKPGASVKVSCKASGYKFT (SEQ ID NO: 16); (b) FR-H2, содержащий аминокислотную последовательность WVRQAPGQGLEWIG (SEQ ID NO: 13); (с) FR-H3, содержащий аминокислотную последовательность RATITRDTSTSTAYLELSSLRSEDTAVYYCTR (SEQ ID NO: 14); и (d) FR-H4, содержащий аминокислотную последовательность WGQGTLVTVSS (SEQ ID NO: 15).
В некоторых вариантах реализации вышеприведенного аспекта связывающий домен дополнительно содержит: (a) HVR-L1, содержащий аминокислотную последовательность RASSSVX3FIH (SEQ ID NO: 4), где Х3 представляет собой Glu или Asn; (b) HVR-L2, содержащий аминокислотную последовательность ATSX4LAS (SEQ ID NO: 5), где Х4 представляет собой Asn, His или Glu; и (с) HVR-L3, содержащий аминокислотную последовательность QQWX5SX6PWT (SEQ ID NO: 6), где Х5 представляет собой Ser или Tyr, а Х6 представляет собой Ala или Asn. В некоторых вариантах реализации изобретения связывающий домен дополнительно содержит: (a) HVR-L1, содержащий аминокислотную последовательность RASSSVEFIH (SEQ ID NO: 9); (b) HVR-L2, содержащий аминокислотную последовательность ATSNLAS (SEQ ID NO: 10); и (с) HVR-L3, содержащий аминокислотную последовательность QQWSSAPWT (SEQ ID NO: 11). В некоторых вариантах реализации изобретения антитело дополнительно содержит: (a) FR-L1, содержащий аминокислотную последовательность DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17); (b) FR-L2, содержащий аминокислотную последовательность WYQQKPGKAPKPLIS (SEQ ID NO: 18); (с) FR-L3, содержащий аминокислотную последовательность GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 19); и (d) FR-L4, содержащий аминокислотную последовательность FGQGTKVEIK (SEQ ID NO: 20).
В другом аспекте изобретение относится к выделенному антителу, которое специфически связывает HtrA1, причем антитело содержит связывающий домен, содержащий (а) вариабельный домен (VH) тяжелой цепи, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 21; (b) вариабельный домен (VL) легкой цепи, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 22; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). В некоторых вариантах реализации изобретения домен VH дополнительно содержит: (a) FR-H1, содержащий аминокислотную последовательность EVQLVQSGAEVKKPGASVKVSCKASGYKFT (SEQ ID NO: 16); (b) FR-H2, содержащий аминокислотную последовательность WVRQAPGQGLEWIG (SEQ ID NO: 13); (c) FR-H3, содержащий аминокислотную последовательность RATITRDTSTSTAYLELSSLRSEDTAVYYCTR (SEQ ID NO: 14); и (d) FR-H4, содержащий аминокислотную последовательность WGQGTLVTVSS (SEQ ID NO: 15). В некоторых вариантах реализации изобретения домен VH содержит аминокислотную последовательность SEQ ID NO: 21. В некоторых вариантах реализации изобретения домен VL дополнительно содержит: (a) FR-L1, содержащий аминокислотную последовательность DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17); (b) FR-L2, содержащий аминокислотную последовательность WYQQKPGKAPKPLIS (SEQ ID NO: 18); (с) FR-L3, содержащий аминокислотную последовательность GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 19); и (d) FR-L4, содержащий аминокислотную последовательность FGQGTKVEIK (SEQ ID NO: 20). В некоторых вариантах реализации изобретения домен VL содержит аминокислотную последовательность SEQ ID NO: 22.
В другом аспекте изобретение относится к выделенному антителу, которое специфически связывает HtrA1, причем антитело содержит связывающий домен, содержащий следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность DSEX1H (SEQ ID NO: 1), где X1 представляет собой Met или Leu; (b) HVR-H2, содержащий аминокислотную последовательность GVDPETX2GAAYNQKFKG (SEQ ID NO: 2), где X2 представляет собой Glu или Asn; (c) HVR-H3, содержащий аминокислотную последовательность GYDYDYALDY (SEQ ID NO: 3); (d) HVR-L1, содержащий аминокислотную последовательность RASSSVX3FIH (SEQ ID NO: 4), где Х3 представляет собой Glu или Asn; (е) HVR-L2, содержащий аминокислотную последовательность ATSX4LAS (SEQ ID NO: 5), где Х4 представляет собой Asn, His или Glu; и (f) HVR-L3, содержащий аминокислотную последовательность QQWX5SX6PWT (SEQ ID NO: 6), где Х5 представляет собой Ser или Tyr, а Х6 представляет собой Ala или Asn. В некоторых вариантах реализации изобретения связывающий домен содержит следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность DSEMH (SEQ ID NO: 7); (b) HVR-H2, содержащий аминокислотную последовательность GVDPETEGAAYNQKFKG (SEQ ID NO: 8); и (с) HVR-H3, содержащий аминокислотную последовательность GYDYDYALDY (SEQ ID NO: 3); (d) HVR-L1, содержащий аминокислотную последовательность RASSSVEFIH (SEQ ID NO: 9); (e) HVR-L2, содержащий аминокислотную последовательность ATSNLAS (SEQ ID NO: 10); и (f) HVR-L3, содержащий аминокислотную последовательность QQWSSAPWT (SEQ ID NO: 11).
В другом аспекте изобретение относится к выделенному антителу, которое специфически связывает HtrA1, причем антитело содержит связывающий домен, содержащий (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 21; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 22; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). В некоторых вариантах реализации изобретения домен VH дополнительно содержит: (a) FR-H1, содержащий аминокислотную последовательность EVQLVQSGAEVKKPGASVKVSCKASGYKFT (SEQ ID NO: 16); (b) FR-H2, содержащий аминокислотную последовательность WVRQAPGQGLEWIG (SEQ ID NO: 13); (с) FR-H3, содержащий аминокислотную последовательность RATITRDTSTSTAYLELSSLRSEDTAVYYCTR (SEQ ID NO: 14); и (d) FR-H4, содержащий аминокислотную последовательность WGQGTLVTVSS (SEQ ID NO: 15). В некоторых вариантах реализации изобретения домен VH содержит аминокислотную последовательность SEQ ID NO: 21. В некоторых вариантах реализации изобретения домен VL дополнительно содержит: (a) FR-L1, содержащий аминокислотную последовательность DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17); (b) FR-L2, содержащий аминокислотную последовательность WYQQKPGKAPKPLIS (SEQ ID NO: 18); (с) FR-L3, содержащий аминокислотную последовательность GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 19); и (d) FR-L4, содержащий аминокислотную последовательность FGQGTKVEIK (SEQ ID NO: 20). В некоторых вариантах реализации изобретения домен VL содержит аминокислотную последовательность SEQ ID NO: 22.
В другом аспекте изобретение относится к выделенному антителу, которое специфически связывает HtrA1, причем антитело содержит связывающий домен, содержащий (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере 99% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 21; и (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере 99% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 22.
В другом аспекте изобретение относится к выделенному антителу, которое специфически связывает HtrA1, причем антитело содержит связывающий домен, содержащий (а) вариабельный домен (VH) тяжелой цепи, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 23; (b) вариабельный домен (VL) легкой цепи, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 24; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). В некоторых вариантах реализации изобретения домен VH дополнительно содержит: (a) FR-H1, содержащий аминокислотную последовательность QVQLQQSGAELVRPGASVTLSCKASGYTFT (SEQ ID NO: 24); (b) FR-H2, содержащий аминокислотную последовательность WVKQTPVHGLEWIG (SEQ ID NO: 25); (с) FR-H3, содержащий аминокислотную последовательность KATLTADKSSSTAYMELRSLTSEDSAVYYCTR (SEQ ID NO: 26); и (d) FR-H4, содержащий аминокислотную последовательность WGQGTSVTVSS (SEQ ID NO: 27). В некоторых вариантах реализации изобретения домен VH содержит аминокислотную последовательность SEQ ID NO: 23. В некоторых вариантах реализации изобретения домен VL дополнительно содержит: (a) FR-L1, содержащий аминокислотную последовательность NIVVTQSPASLAVSLGQRATISC (SEQ ID NO: 29); (b) FR-L2, содержащий аминокислотную последовательность WYQQKPGQPPKLLIY (SEQ ID NO: 30); (с) FR-L3, содержащий аминокислотную последовательность GVPARFSGSGSRTDFTLTIDPVEADDAATYYC (SEQ ID NO: 31); и (d) FR-L4, содержащий аминокислотную последовательность FGGGTKLEIK (SEQ ID NO: 32). В некоторых вариантах реализации изобретения домен VL содержит аминокислотную последовательность SEQ ID NO: 24.
В другом аспекте изобретение относится к выделенному антителу, которое специфически связывает HtrA1, причем антитело содержит связывающий домен, содержащий (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере 99% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 23; и (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере 99% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 24.
В другом аспекте изобретение относится к выделенному антителу, которое специфически связывает HtrA1, причем антитело содержит связывающий домен, содержащий следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность SYIMS (SEQ ID NO: 39); (b) HVR-H2, содержащий аминокислотную последовательность YISNGGGTTYYSDTIKG (SEQ ID NO: 40); и (с) HVR-H3, содержащий аминокислотную последовательность QNFRSDGSSMDY (SEQ ID NO: 41); (d) HVR-L1, содержащий аминокислотную последовательность RASESVDSYGKSFMH (SEQ ID NO: 42); (е) HVR-L2, содержащий аминокислотную последовательность LASKLES (SEQ ID NO: 43); и (f) HVR-L3, содержащий аминокислотную последовательность QQNNEDPYT (SEQ ID NO: 44).
В другом аспекте изобретение относится к выделенному антителу, которое специфически связывает HtrA1, причем антитело содержит связывающий домен, содержащий (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 45; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 46; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). В некоторых вариантах реализации изобретения домен VH дополнительно содержит: (a) FR-H1, содержащий аминокислотную последовательность EVQLVESGGGLVQPGGSLRLSCAASGFTFS (SEQ ID NO: 47); (b) FR-H2, содержащий аминокислотную последовательность WVRQAPGKGLEWVA (SEQ ID NO: 48); (с) FR-H3, содержащий аминокислотную последовательность RFTISRDNSKNTLYLQMNSLRAEDTAVYYCAR (SEQ ID NO: 49); и (d) FR-H4, содержащий аминокислотную последовательность WGQGTLVTVSS (SEQ ID NO: 50). В некоторых вариантах реализации изобретения домен VH содержит аминокислотную последовательность SEQ ID NO: 45. В некоторых вариантах реализации изобретения домен VL дополнительно содержит: (a) FR-L1, содержащий аминокислотную последовательность DIVMTQSPDSLAVSLGERATINC (SEQ ID NO: 51); (b) FR-L2, содержащий аминокислотную последовательность WYQQKPGQPPKLLIY (SEQ ID NO: 52); (с) FR-L3, содержащий аминокислотную последовательность GVPDRFSGSGSGTDFTLTISSLQAEDVAVYYC (SEQ ID NO: 53); и (d) FR-L4, содержащий аминокислотную последовательность FGQGTKVEIK (SEQ ID NO: 54). В некоторых вариантах реализации изобретения домен VL содержит аминокислотную последовательность SEQ ID NO: 46.
В другом аспекте изобретение относится к выделенному антителу, которое специфически связывает HtrA1, причем антитело содержит связывающий домен, содержащий (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере 99% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 45; и (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере 99% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 46.
В другом аспекте изобретение относится к выделенному антителу, которое специфически связывает HtrA1, причем антитело содержит связывающий домен, содержащий (а) вариабельный домен (VH) тяжелой цепи, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 55; (b) вариабельный домен (VL) легкой цепи, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 56; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). В некоторых вариантах реализации изобретения домен VH дополнительно содержит: (a) FR-H1, содержащий аминокислотную последовательность EVKLVESGGGLVEPGGSLKLACVASGFTFS (SEQ ID NO: 57); (b) FR-H2, содержащий аминокислотную последовательность WVRQTPEKRLEWVA (SEQ ID NO: 58); (с) FR-H3, содержащий аминокислотную последовательность RFTISRDNAKNTLYLQMSTLKSEDTAIYFCAR (SEQ ID NO: 59); и (d) FR-H4, содержащий аминокислотную последовательность WGQGTAVTVSS (SEQ ID NO: 60). В некоторых вариантах реализации изобретения домен VH содержит аминокислотную последовательность SEQ ID NO: 55. В некоторых вариантах реализации изобретения домен VL дополнительно содержит: (a) FR-L1, содержащий аминокислотную последовательность NIVVTQSPASLAVSLGQRATISC (SEQ ID NO: 61); (b) FR-L2, содержащий аминокислотную последовательность WYQQKPGQPPKLLIY (SEQ ID NO: 62); (c) FR-L3, содержащий аминокислотную последовательность GVPARFSGSGSRTDFTLTIDPVEADDAATYYC (SEQ ID NO: 63); и (d) FR-L4, содержащий аминокислотную последовательность FGGGTKLEIK (SEQ ID NO: 64). В некоторых вариантах реализации изобретения домен VL содержит аминокислотную последовательность SEQ ID NO: 56.
В другом аспекте изобретение относится к выделенному антителу, которое специфически связывает HtrA1, причем антитело содержит связывающий домен, содержащий (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере 99% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 55; и (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере 99% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 56.
В другом аспекте изобретение относится к выделенному антителу, которое специфически связывает HtrA1, причем антитело содержит связывающий домен, содержащий (а) вариабельный домен (VH) тяжелой цепи, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 65; (b) вариабельный домен (VL) легкой цепи, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 66; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b).
В другом аспекте изобретение относится к выделенному антителу, которое специфически связывает HtrA1, причем антитело содержит связывающий домен, содержащий (а) вариабельный домен (VH) тяжелой цепи, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 67; (b) вариабельный домен (VL) легкой цепи, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 68; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b).
В другом аспекте изобретение относится к выделенному антителу, которое специфически связывает HtrA1, причем антитело содержит связывающий домен, содержащий (а) вариабельный домен (VH) тяжелой цепи, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 69; (b) вариабельный домен (VL) легкой цепи, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 70; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b).
В некоторых вариантах реализации любого из предыдущих аспектов антитело является моноклональным, человеческим, гуманизированным или химерным. В конкретных вариантах реализации изобретения антитело является моноклональным, гуманизированным или химерным.
В некоторых вариантах реализации любого из предыдущих аспектов антитело представляет собой фрагмент антитела, который связывается с HtrA1. В некоторых вариантах реализации изобретения фрагмент антитела выбран из группы, состоящей из фрагментов Fab, Fab'-SH, Fv, scFV и (Fab')2. В некоторых вариантах реализации изобретения фрагмент антитела представляет собой Fab. В некоторых вариантах реализации изобретения Fab содержит усечение в шарнирном участке константного участка тяжелой цепи. В некоторых вариантах реализации изобретения Fab содержит усечение в верхнем шарнире константного участка тяжелой цепи. В некоторых вариантах реализации изобретения константный участок тяжелой цепи завершается положением 221 (нумерация EU). В некоторых вариантах реализации изобретения аминокислотный остаток положения 221 представляет собой аспарагиновую кислоту. В некоторых вариантах реализации изобретения константный участок тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 156. В некоторых вариантах реализации изобретения антитело содержит аминокислотную последовательность тяжелой цепи SEQ ID NO: 160. В некоторых вариантах реализации изобретения антитело содержит аминокислотную последовательность легкой цепи SEQ ID NO: 159. В некоторых вариантах реализации изобретения антитело содержит аминокислотную последовательность тяжелой цепи SEQ ID NO: 160 и аминокислотную последовательность легкой цепи SEQ ID NO: 159.
В некоторых вариантах реализации изобретения Fab представляет собой Fab IgG1.
В некоторых вариантах реализации любого из предыдущих аспектов антитело представляет собой полноразмерное антитело. В некоторых вариантах реализации изобретения антитело представляет собой антитело IgG. В некоторых вариантах реализации изобретения антитело представляет собой моноспецифическое антитело.
В некоторых вариантах реализации любого из предыдущих аспектов антитело представляет собой биспецифическое антитело. В некоторых вариантах реализации изобретения биспецифическое антитело содержит второй связывающий домен, который связывается с фактором D. В некоторых вариантах реализации изобретения второй связывающий домен содержит следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащий аминокислотную последовательность WINTYTGETTYAX1DFKG (SEQ ID NO: 110), где X1 представляет собой Asp или Glu; (с) HVR-H3, содержащий аминокислотную последовательность EGGVX1N (SEQ ID NO: 111), где X1 представляет собой Asp или Ser; (d) HVR-L1, содержащий аминокислотную последовательность ITSTX1IX2X3DMN (SEQ ID NO: 112), где X1 представляет собой Asp или Ser, Х2 представляет собой Asp или Glu, а Х3 представляет собой Asp или Ser; (е) HVR-L2, содержащий аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащий аминокислотную последовательность LQSX1SLPYT (SEQ ID NO: 114), где X1 представляет собой Asp или Glu. В некоторых вариантах реализации изобретения второй связывающий домен содержит следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащий аминокислотную последовательность WINTYTGETTYADDFKG (SEQ ID NO: 115); и (с) HVR-H3, содержащий аминокислотную последовательность EGGVNN (SEQ ID NO: 116); (d) HVR-L1, содержащий аминокислотную последовательность ITSTDIDDDMN (SEQ ID NO: 117); (e) HVR-L2, содержащий аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащий аминокислотную последовательность LQSDSLPYT (SEQ ID NO: 118). В некоторых вариантах реализации изобретения второй связывающий домен содержит (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 119; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотною последовательностью SEQ ID NO: 120; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному (b). В некоторых вариантах реализации изобретения домен VH содержит аминокислотную последовательность SEQ ID NO: 119. В некоторых вариантах реализации изобретения домен VL содержит аминокислотную последовательность SEQ ID NO: 120.
В другом аспекте изобретение относится к выделенному антителу, которое специфически связывает как HtrA1, так и фактор D, причем антитело содержит первый связывающий домен, который специфически связывает HtrA1, включающий следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность DSEMH (SEQ ID NO: 7); (b) HVR-H2, содержащий аминокислотную последовательность GVDPETEGAAYNQKFKG (SEQ ID NO: 8); (с) HVR-H3, содержащий аминокислотную последовательность GYDYDYALDY (SEQ ID NO: 3), (d) HVR-L1, содержащий аминокислотную последовательность RASSSVEFIH (SEQ ID NO: 9); (e) HVR-L2, содержащий аминокислотную последовательность ATSNLAS (SEQ ID NO: 10); и (f) HVR-L3, содержащий аминокислотную последовательность QQWSSAPWT (SEQ ID NO: 11); и второй связывающий домен, который специфически связывает фактор D, включающий следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащий аминокислотную последовательность WINTYTGETTYADDFKG (SEQ ID NO: 115); (с) HVR-H3, содержащий аминокислотную последовательность EGGVNN (SEQ ID NO: 116); (d) HVR-L1, содержащий аминокислотную последовательность ITSTDIDDDMN (SEQ ID NO: 117); (е) HVR-L2, содержащий аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащий аминокислотную последовательность LQSDSLPYT (SEQ ID NO: 118).
В другом аспекте изобретение относится к выделенному антителу, которое специфически связывает как HtrA1, так и фактор D, причем антитело содержит первый связывающий домен, который специфически связывает HtrA1, содержащий (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере 99% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 21; и (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере 99% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 22, и второй связывающий домен, который специфически связывает фактор D, содержащий (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере 99% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 119; и (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере 99% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 120.
В некоторых вариантах реализации вышеприведенных аспектов изобретение охватывает выделенное антитело, которое специфически связывается с эпитопом HtrA1, причем эпитоп HtrA1 содержит по меньшей мере одну аминокислоту белка HtrA1, выбранную из группы, состоящей из Arg190, Leu192, Pro193, Phe194 и Arg197, где нумерация аминокислот соответствует нумерации белка-предшественника HtrA1 человека.
В одном варианте реализации изобретения эпитоп HtrA1 содержит по меньшей мере одну аминокислоту белка HtrA1, выбранную из группы, состоящей из Leu192, Pro193 и Arg197.
В конкретном варианте реализации изобретения эпитоп HtrA1 содержит аминокислоты HtrA1 Leu192, Pro193 и Arg197.
В другом варианте реализации изобретения эпитоп HtrA1 содержит аминокислоты HtrA1 Arg190, Leu192, Pro193 и Arg197.
В дополнительном варианте реализации изобретения эпитоп HtrA1 содержит аминокислоты HtrA1 Arg190, Leu192, Pro193, Phe194 и Arg197.
В другом аспекте изобретение относится к выделенной нуклеиновой кислоте, кодирующей любое из антител, описанных в данном документе. В другом аспекте изобретение относится к вектору (например, экспрессионному вектору), содержащему выделенную нуклеиновую кислоту для экспрессии антитела. В другом аспекте изобретение относится к клеткам-хозяевам, содержащим предыдущие нуклеиновые кислоты и/или векторы. В некоторых вариантах реализации изобретения клетка-хозяин представляет собой клетку млекопитающего. В некоторых вариантах реализации изобретения клетка млекопитающего представляет собой клетку яичника китайского хомячка (СНО) или клетку 293. В некоторых вариантах реализации изобретения клетка-хозяин представляет собой прокариотическую клетку. В некоторых вариантах реализации изобретения прокариотическая клетка представляет собой Е. coli.
В другом аспекте изобретение относится к способу получения любого из антител, описанных в данном документе, причем способ включает культивирование клетки-хозяина, содержащей любой из предыдущих векторов (например, экспрессионных векторов), в культуральной среде. В некоторых вариантах реализации изобретения способ дополнительно включает выделение антитела из клетки-хозяина или культуральной среды.
В другом аспекте изобретение относится к композиции, содержащей любое из предыдущих антител. В некоторых вариантах реализации изобретения композиция дополнительно содержит фармацевтически приемлемый носитель, наполнитель или разбавитель. В некоторых вариантах реализации изобретения композиция представляет собой фармацевтическую композицию. В некоторых вариантах реализации изобретения фармацевтическая композиция является лиофилизированной. В некоторых вариантах реализации изобретения композиция дополнительно содержит антагонист связывания фактора D. В некоторых вариантах реализации изобретения антагонист связывания фактора D представляет собой антитело против фактора D или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения антигенсвязывающий фрагмент представляет собой Fab или (Fab')2. В некоторых вариантах реализации изобретения антитело против фактора D или его антигенсвязывающий фрагмент содержит следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащий аминокислотную последовательность WINTYTGETTYAX1DFKG (SEQ ID NO: 110), где X1 представляет собой Asp или Glu; (с) HVR-H3, содержащий аминокислотную последовательность EGGVX1N (SEQ ID NO: 111), где X1 представляет собой Asp или Ser; (d) HVR-L1, содержащий аминокислотную последовательность ITSTX1IX2X3DMN (SEQ ID NO: 112), где X1 представляет собой Asp или Ser, X2 представляет собой Asp или Glu, а Х3 представляет собой Asp или Ser; (е) HVR-L2, содержащий аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащий аминокислотную последовательность LQSX1SLPYT (SEQ ID NO: 114), где X1 представляет собой Asp или Glu. В некоторых вариантах реализации изобретения антитело против фактора D или его антигенсвязывающий фрагмент содержит следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащий аминокислотную последовательность WINTYTGETTYADDFKG (SEQ ID NO: 115); и (с) HVR-H3, содержащий аминокислотную последовательность EGGVNN (SEQ ID NO: 116); (d) HVR-L1, содержащий аминокислотную последовательность ITSTDIDDDMN (SEQ ID NO: 117); (e) HVR-L2, содержащий аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащий аминокислотную последовательность LQSDSLPYT (SEQ ID NO: 118). В некоторых вариантах реализации изобретения антитело против фактора D или его антигенсвязывающий фрагмент содержит (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 119; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотною последовательностью SEQ ID NO: 120; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). В некоторых вариантах реализации изобретения домен VH содержит аминокислотную последовательность SEQ ID NO: 119. В некоторых вариантах реализации изобретения домен VL содержит аминокислотную последовательность SEQ ID NO: 120. В некоторых вариантах реализации изобретения антигенсвязывающий фрагмент антитела против фактора D представляет собой лампализумаб.
В другом аспекте изобретение охватывает комбинированную терапию, включающую любое из предыдущих антител против HtrA1 и антагонист фактора D. В конкретном варианте реализации изобретения антагонист фактора D представляет собой антитело против фактора D. В конкретном варианте реализации изобретения антагонист фактора D представляет собой лампализумаб. В конкретном варианте реализации изобретения антагонист против фактора D вводят последовательно.
В некоторых аспектах изобретения любое из предыдущих антител можно применять в качестве лекарственного средства.
В некоторых аспектах изобретения любое из предыдущих антител можно применять для лечения связанного с HtrA1 нарушения или глазного нарушения. В некоторых вариантах реализации изобретения связанное с HtrA1 нарушение или глазное нарушение представляет собой возрастную макулярную дегенерацию (ВМД), диабетическую ретинопатию, ретинопатию недоношенных или полипообразную хориоидальную васкулопатию. В некоторых вариантах реализации изобретения связанное с HtrA1 нарушение или глазное нарушение представляет собой ВМД. В некоторых вариантах реализации изобретения ВМД представляет собой раннюю сухую ВМД, промежуточную сухую ВМД или запущенную сухую ВМД. В некоторых вариантах реализации изобретения запущенная сухая ВМД представляет собой географическую атрофию.
В некоторых аспектах изобретения любое из предыдущих антител можно применять для производства лекарственного средства для лечения связанного с HtrA1 нарушения или глазного нарушения. В некоторых вариантах реализации изобретения связанное с HtrA1 нарушение или глазное нарушение представляет собой ВМД, диабетическую ретинопатию, ретинопатию недоношенных или полипообразную хориоидальную васкулопатию. В некоторых вариантах реализации изобретения связанное с HtrA1 нарушение или глазное нарушение представляет собой ВМД. В некоторых вариантах реализации изобретения ВМД представляет собой раннюю сухую ВМД, промежуточную сухую ВМД или запущенную сухую ВМД. В некоторых вариантах реализации изобретения запущенная сухая ВМД представляет собой географическую атрофию. В некоторых вариантах реализации изобретения лекарственное средство составлено с целью применения в комбинации с антагонистом связывания фактора D. В некоторых вариантах реализации изобретения антагонист связывания фактора D представляет собой антитело против фактора D или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения антигенсвязывающий фрагмент представляет собой Fab или (Fab')2. В некоторых вариантах реализации изобретения антитело против фактора D или его антигенсвязывающий фрагмент содержит следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащий аминокислотную последовательность WINTYTGETTYAX1DFKG (SEQ ID NO: 110), где X1 представляет собой Asp или Glu; (с) HVR-H3, содержащий аминокислотную последовательность EGGVX1N (SEQ ID NO: 111), где X1 представляет собой Asp или Ser; (d) HVR-L1, содержащий аминокислотную последовательность ITSTX1IX2X3DMN (SEQ ID NO: 112), где X1 представляет собой Asp или Ser, X2 представляет собой Asp или Glu, а Х3 представляет собой Asp или Ser; (е) HVR-L2, содержащий аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащий аминокислотную последовательность LQSX1SLPYT (SEQ ID NO: 114), где X1 представляет собой Asp или Glu. В некоторых вариантах реализации изобретения антитело против фактора D или его антигенсвязывающий фрагмент содержит следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащий аминокислотную последовательность WINTYTGETTYADDFKG (SEQ ID NO: 115); и (с) HVR-H3, содержащий аминокислотную последовательность EGGVNN (SEQ ID NO: 116); (d) HVR-L1, содержащий аминокислотную последовательность ITSTDIDDDMN (SEQ ID NO: 117); (e) HVR-L2, содержащий аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащий аминокислотную последовательность LQSDSLPYT (SEQ ID NO: 118). В некоторых вариантах реализации изобретения антитело против фактора D или его антигенсвязывающий фрагмент содержит (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 119; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотною последовательностью SEQ ID NO: 120; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). В некоторых вариантах реализации изобретения домен VH содержит аминокислотную последовательность SEQ ID NO: 119. В некоторых вариантах реализации изобретения домен VL содержит аминокислотную последовательность SEQ ID NO: 120. В некоторых вариантах реализации изобретения антигенсвязывающий фрагмент против фактора D представляет собой лампализумаб.
В другом аспекте изобретение относится к способу лечения связанного с HtrA1 нарушения или глазного нарушения у имеющего для этого показания субъекта, причем способ включает введение терапевтически эффективного количества антитела любого из предыдущих антител. В некоторых вариантах реализации изобретения связанное с HtrA1 нарушение или глазное нарушение представляет собой ВМД, диабетическую ретинопатию, ретинопатию недоношенных или полипообразную хориоидальную васкулопатию. В некоторых вариантах реализации изобретения связанное с HtrA1 нарушение или глазное нарушение представляет собой ВМД. В некоторых вариантах реализации изобретения ВМД представляет собой раннюю сухую ВМД, промежуточную сухую ВМД или запущенную сухую ВМД. В некоторых вариантах реализации изобретения запущенная сухая ВМД представляет собой географическую атрофию. В некоторых вариантах реализации изобретения способ дополнительно включает введение антагониста связывания фактора D.
В другом аспекте изобретение относится к способу ингибирования ретинальной или фоторецепторной клеточной дегенерации у субъекта, причем способ включает введение субъекту эффективного количества любого из предыдущих антител, тем самым ингибируя ретинальную или фоторецепторную клеточную дегенерацию.
В другом аспекте изобретение относится к способу ингибирования активности сериновой протеазы HtrA1 в глазе субъекта, причем способ включает введение субъекту эффективного количества любого из предыдущих антител, тем самым ингибируя активность сериновой протеазы HtrA1 в глазе. В некоторых вариантах реализации изобретения способ дополнительно включает введение антагониста связывания фактора D.
В другом аспекте изобретение относится к способу лечения связанного с HtrA1 нарушения или связанного с комплементом нарушения у имеющего для этого показания субъекта, причем способ включает введение субъекту терапевтически эффективного количества антагониста связывания HtrA1 и антагониста связывания фактора D. В некоторых вариантах реализации изобретения связанное с HtrA1 нарушение или связанное с комплементом нарушение представляет собой глазное нарушение. В некоторых вариантах реализации изобретения глазное нарушение выбрано из группы, состоящей из ВМД, диабетической ретинопатии, хориоидной неоваскуляризации (CNV), увеита, диабетического макулярного отека, патологической миопии, болезни Гиппеля-Линдау, гистоплазмоза глаза, окклюзии центральной вены сетчатки, корнеальной васкуляризации и ретинальной неоваскуляризации. В некоторых вариантах реализации изобретения глазное нарушение представляет собой ВМД. В некоторых вариантах реализации изобретения ВМД представляет собой раннюю сухую ВМД, промежуточную сухую ВМД или запущенную сухую ВМД. В некоторых вариантах реализации изобретения запущенная сухая ВМД представляет собой географическую атрофию. В некоторых вариантах реализации изобретения антагонист связывания HtrA1 представляет собой антитело против HtrA1 или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения антигенсвязывающий фрагмент выбран из группы, состоящей из фрагментов Fab, Fab'-SH, Fv, scFV и (Fab')2. В некоторых вариантах реализации изобретения антигенсвязывающий фрагмент представляет собой Fab. В некоторых вариантах реализации изобретения Fab содержит усечение в верхнем шарнире константного участка тяжелой цепи. В некоторых вариантах реализации изобретения константный участок тяжелой цепи завершается положением 221 (нумерация EU). В некоторых вариантах реализации изобретения аминокислотный остаток положения 221 представляет собой аспарагиновую кислоту. В некоторых вариантах реализации изобретения константный участок тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 156. В некоторых вариантах реализации изобретения антитело содержит аминокислотную последовательность тяжелой цепи SEQ ID NO: 160. В некоторых вариантах реализации изобретения антитело содержит аминокислотную последовательность легкой цепи SEQ ID NO: 159. В некоторых вариантах реализации изобретения антитело содержит аминокислотную последовательность тяжелой цепи SEQ ID NO: 160 и аминокислотную последовательность легкой цепи SEQ ID NO: 159. В некоторых вариантах реализации изобретения Fab представляет собой Fab IgG1.
В другом аспекте изобретение относится к способу лечения связанного с HtrA1 нарушения или связанного с комплементом нарушения у имеющего для этого показания субъекта, причем способ включает введение субъекту терапевтически эффективного количества любого из предыдущих антител и терапевтически эффективного количества антагониста связывания фактора D.
В некоторых вариантах реализации любого из предыдущих аспектов антагонист связывания фактора D представляет собой антитело против фактора D или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения антигенсвязывающий фрагмент представляет собой Fab или (Fab')2. В некоторых вариантах реализации изобретения антитело против фактора D или его антигенсвязывающий фрагмент содержит следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащий аминокислотную последовательность WINTYTGETTYAX1DFKG (SEQ ID NO: 110), где X1 представляет собой Asp или Glu; (с) HVR-H3, содержащий аминокислотную последовательность EGGVX1N (SEQ ID NO: 111), где X1 представляет собой Asp или Ser; (d) HVR-L1, содержащий аминокислотную последовательность ITSTX1IX2X3DMN (SEQ ID NO: 112), где X1 представляет собой Asp или Ser, Х2 представляет собой Asp или Glu, а Х3 представляет собой Asp или Ser; (е) HVR-L2, содержащий аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащий аминокислотную последовательность LQSX1SLPYT (SEQ ID NO: 114), где X1 представляет собой Asp или Glu. В некоторых вариантах реализации изобретения антитело против фактора D или его антигенсвязывающий фрагмент содержит следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащий аминокислотную последовательность WINTYTGETTYADDFKG (SEQ ID NO: 115); и (с) HVR-H3, содержащий аминокислотную последовательность EGGVNN (SEQ ID NO: 116); (d) HVR-L1, содержащий аминокислотную последовательность ITSTDIDDDMN (SEQ ID NO: 117); (e) HVR-L2, содержащий аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащий аминокислотную последовательность LQSDSLPYT (SEQ ID NO: 118). В некоторых вариантах реализации изобретения антитело против фактора D или его антигенсвязывающий фрагмент содержит (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 119; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотною последовательностью SEQ ID NO: 120; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). В некоторых вариантах реализации изобретения домен VH содержит аминокислотную последовательность SEQ ID NO: 119. В некоторых вариантах реализации изобретения домен VL содержит аминокислотную последовательность SEQ ID NO: 120. В некоторых вариантах реализации изобретения антигенсвязывающий фрагмент против фактора D представляет собой лампализумаб.
В некоторых вариантах реализации любого из предыдущих аспектов связанное с HtrA1 нарушение или связанное с комплементом нарушение представляет собой глазное нарушение. В некоторых вариантах реализации изобретения глазное нарушение выбрано из группы, состоящей из ВМД, диабетической ретинопатии, хориоидной неоваскуляризации (CNV), увеита, диабетического макулярного отека, патологической миопии, болезни Гиппеля-Линдау, гистоплазмоза глаза, окклюзии центральной вены сетчатки, корнеальной васкуляризации и ретинальной неоваскуляризации. В некоторых вариантах реализации изобретения глазное нарушение представляет собой ВМД. В некоторых вариантах реализации изобретения ВМД представляет собой раннюю сухую ВМД, промежуточную сухую ВМД или запущенную сухую ВМД. В некоторых вариантах реализации изобретения запущенная сухая ВМД представляет собой географическую атрофию.
В некоторых вариантах реализации любого из предыдущих аспектов антитело вводят в стекловидное тело, окулярно, внутрь глаза, около склеры, в субтеноновое пространство, в супрахориоидальное пространство, местно, внутривенно, внутримышечно, внутрикожно, чрезкожно, внутриартериально, внутрибрюшинно, внутриочагово, интракраниально, внутрисуставно, внутрь простаты, внутриплеврально, интратрахеально, интратекально, назально, вагинально, ректально, местно, внутрибрюшинно, в брюшину, интравентрикулярно, подкожно, субконъюнктивально, внутрь мочевого пузыря, через слизистую оболочку, интраперикардиально, внутрь пуповины, интраорбитально, перорально, трансдермально, путем ингаляции, путем инъекции, с глазными каплями, путем имплантации, путем инфузии, путем непрерывной инфузии, путем непосредственного омывания клеток-мишеней при локализованной перфузии, с помощью катетера, путем промывания, в кремах или в липидных композициях. В некоторых вариантах реализации изобретения антитело вводят в стекловидное тело, окулярно, внутрь глаза, около склеры, в субтеноновое пространство, в супрахориоидальное пространство или местно. В некоторых вариантах реализации изобретения антитело вводят в стекловидное тело путем инъекции. В некоторых вариантах реализации изобретения антитело вводят местно с помощью глазных капель или мази. В некоторых вариантах реализации изобретения антитело вводят с помощью системы доставки длительного действия. В конкретных вариантах реализации изобретения система доставки длительного действия представляет собой твердый имплантат на основе PLGA или систему доставки с имплантируемым портом.
В некоторых вариантах реализации любого из предыдущих аспектов субъект является человеком.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На ФИГ. 1А-1В изображены графики, показывающие, что большинство из позитивных по твердофазному иммуноферментному анализу (ELISA) клонов гибридом демонстрировали сходные профили реактивности как к человеческому (hu), так и мышиному (mu) протеазному домену HtrA1 (PD). На графиках показаны значения оптической плотности при 650 нм (ОП650нм) для каждого из указанных 75 клонов. Фоновый сигнал в данном анализе составлял <0,05 ОП650нм. Протеазные домены человеческой и мышиной HtrA1 обладают 91% гомологией.
На ФИГ. 2А представлена схематическая диаграмма анализа блокирования, использованного для определения способности указанных супернатантов клонов гибридом против HtrA1 ингибировать опосредованное HtrA1-PD расщепление BODIPY® FL-меченого флуоресцентного субстрата.
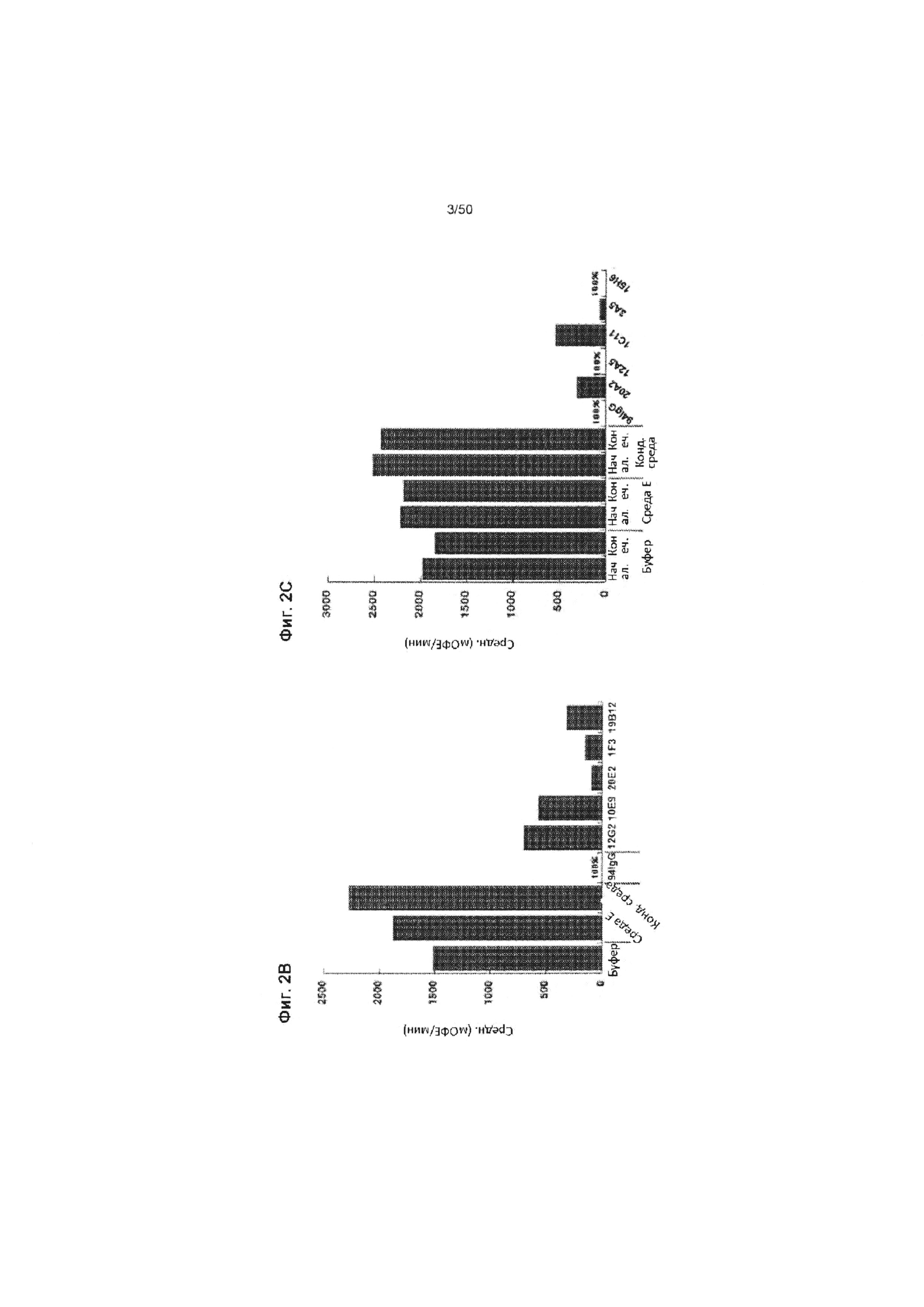
На ФИГ. 2В-2С представлены графики, показывающие, что 10 супернатантов клонов гибридом против HtrA1 существенно ингибировали опосредованное HtrA1-PD человека расщепление субстрата с использованием анализа блокирования, описанного на Фиг. 2А и в примере 1. Графики показывают средний флуоресцентный сигнал (тысячные относительные флуоресцентные единицы (мОФЕ)/мин) супернатантов гибридом из указанных клонов. Антитело YW505.94 (также называемое «94 IgG», см. международную публикацию заявки на патент № WO 2013/055998, которая в полном объеме включена в данный документ путем ссылки) при содержании 10 мкг/мл в кондиционированной среде (КС или конд. среда) служило в качестве положительного контроля для демонстрации отсутствия изменений в анализе вследствие влияния среды и стабильности в течение проведения анализа. Буферный раствор или среда служили в качестве отрицательного контроля. На Фиг. 2С изображены исходные и конечные результаты анализа для буферного раствора, среды Е (богатой питательными веществами среды из CLONACELL™) и кондиционированной среды. 100% указывает на полное ингибирование.
На ФИГ. 3А-3В представлены графики, изображающие способность супернатантов указанных гибридом ингибировать расщепление флуоресцентного субстрата muHtrA1-PD (Фиг. 3А) или huHtrA1-PD (Фиг. 3В). На Фиг. 3А применяли 40 нМ muHtrA1-PD в соотношении 40 мкл muHtrA1-PD на 60 мкл супернатантов гибридом. На Фиг. 3В применяли 20 нМ huHtrA1-PD в соотношении 40 мкл huHtrA1-PD на 60 мкл супернатанта гибридом. Антитело YW505.94 (94 IgG) служило в качестве положительного контроля. Буферный раствор или КС служили в качестве отрицательного контроля.
На ФИГ. 4А представлена схематическая диаграмма анализа блокирования на основе FRET, использованного для определения способности очищенных клонов антитела против HtrA1 ингибировать опосредованное HtrA1-PD расщепление субстрата на основе FRET, H2-Opt.
На ФИГ. 4В-4С представлены графики, показывающие, что очищенные клоны антител 15Н6, 19В12, 3А5, 12А5 и 20Е2 сохраняют способность ингибировать опосредованное мышиным (Фиг. 4В) и человеческим (Фиг. 4С) HtrA1-PD расщепление субстрата. Отсутствие добавления антитела (без ab) служило в качестве отрицательного контроля, тогда как антитело YW505.94 (94 IgG) служило в качестве положительного контроля. Очищенные антитела добавляли в концентрациях 5 нМ, 50 нМ или 500 нМ. В анализе, представленном на Фиг. 4В, использовали 15 нМ muHtrA1-PD-Fc, тогда как в анализе, представленном на Фиг. 4С, использовали 3 нМ huHtrA1-PD-Fc.
На ФИГ. 5А-5В представлены графики, показывающие, что указанные очищенные клоны антител mIgG ингибируют опосредованное полноразмерным человеческим HtrA1 (huHtrA1-FL) расщепление пептидного субстрата FRET. На графике изображена активность (мОФЕ/мин) в виде зависимости от концентрации IgG. Добавляли huHtrA1-FL в концентрации 5 нМ. YW505.94 в форме IgG (IgG94) и его химерный вариант (IgG94-ch), как описано в Cifferi et al. (2015) Biochem. J. 472(2): 169-81, служили в качестве положительных контролей. Изображена полумаксимальная ингибирующая концентрация (IC50) для каждого клона антитела.
На ФИГ. 5C-5D представлены графики, показывающие, что указанные очищенные клоны антител mIgG ингибируют опосредованное muHtrA1-FL расщепление пептидного субстрата FRET. На графике изображена активность (мОФЕ/мин) в виде зависимости от концентрации IgG. Добавляли muHtrA1-FL в концентрации 5 нМ. IgG94 и IgG94-ch служили в качестве положительного контроля как описано в описании фигур для Фиг. 5А и 5В. Изображена полумаксимальная ингибирующая концентрация (IC50).
На ФИГ. 6А изображено выравнивание последовательностей аминокислотных последовательностей вариабельного участка тяжелой цепи (VH) клонов антител 19В12, 20Е2, 3А5, 12А5 и 15Н6.
На ФИГ. 6В изображено выравнивание последовательностей аминокислотных последовательностей вариабельного участка легкой цепи (VL) клонов антител 19В12, 20Е2, 3А5, 12А5 и 15Н6.
На ФИГ. 7А-7В представлены графики, изображающие результаты анализа блокирования на основе FRET с использованием клона 15Н6 антитела mlgG (Фиг. 7А) или клона 19В12 (Фиг. 7В), очищенного из супернатанта гибридом (гиб) или рекомбинантного экспрессированного в клетках 293 (293). Графики изображают Vmax (мОФЕ/мин) в виде зависимости от концентрации антител (нМ). В каждом анализе использовали 3 нМ huHtrA1-FL. Изображены также значения IC50 для указанных клонов антител.
На ФИГ. 8А-8В изображены выравнивания последовательностей аминокислотных последовательностей VL (Фиг. 8А) и VH (Фиг. 8В) из клонов антител против HtrA1 m15H6, H15H6.v1, H15H6.v2 и h15H6.v2.APEG (также называемых в данном документе как h15H6.v3) по сравнению с консенсусной последовательностью к1 человека (Фиг. 8А) или последовательностью VH1 (Фиг. 8В). Последовательности разграничены для каждого из клонов антител обозначающими прямоугольниками. Подчеркнуты последовательности HVR в соответствии с определением Кабата. Остатки, изображенные текстом белого цвета в закрашенных прямоугольниках, указывают на остатки, которые различаются у консенсусной последовательности VH1 человека и у клонов антител против HtrA1.
На ФИГ. 9A-9D представлены графики, изображающие результаты анализа связывания m15H6 или h15H6.v1 с захваченным стрептавидином биотинилированным человеческим или мышиным HtrA1 методом поверхностного плазмонного резонанса (ППР) BIACORE™. Применяли кинетический анализ одного цикла. На графиках изображены единицы ответа (RU) в виде зависимости от времени (с). На Фиг. 9А изображены результаты связывания Fab m15H6 с huHtrA1. На Фиг. 9В изображены результаты связывания Fab m15H6 с muHtrA1. На Фиг. 9С изображены результаты связывания h15H6.v1 с huHtrA1. На Фиг. 9D изображены результаты связывания h15H6.v1 с huHtrA1. Определенные для каждого анализа Ka, Kд и KD изображены в виде текста внутри каждого графика.
На ФИГ. 10А-10В представлены графики, изображающие результаты экспериментов ELISA по фаговой конкуренции за связывание указанных вариантов Fab h15H6.v1 с мышиным (Фиг. 10А) или человеческим (Фиг. 10В) HtrA1. На графике изображено связывание фага (ОП450нм) в виде зависимости от концентрации HtrA1 (нМ).
На ФИГ. 11А-11В представлены графики, изображающие результаты анализа ППР BIACORE™ сравнения связывания клона антитела h15H6.v2 и вариантов HVR-L3 LC-W91L и LC-W91Y с мышиным (Фиг. 11А) или человеческим (Фиг. 11В) HtrA1. Использованные антитела были в форме Fab. Определенные для каждого анализа Ka, Kд и KD изображены в виде текста внутри каждого графика.
На ФИГ. 12А представлен график, изображающий результаты анализа ППР BIACORE™ сравнения связывания клона антитела h15H6.v2 (исходный) и указанных вариантов в положении VL 94 (т.е. LC-N94A LC-P95 (АР), LC-N94E LC-Р95 (ЕР), LC-N94Q LC-P95 (QP) и LC-N94S LC-P95 (SP)) с huHtrA1.
Использованные антитела были в форме Fab. На графике изображены единицы ответа (RU) в виде зависимости от времени (с).
На ФИГ. 12В представлена таблица, на которой обобщены результаты анализа ППР BIACORE™, изображенного на Фиг. 12А.
На ФИГ. 13А представлен график, изображающий результаты анализа ППР BIACORE™ сравнения связывания клона антитела h15H6.v2 (исходный) и указанных вариантов в положении VH 55 и/или 56 (т.е. HC-D55A HC-G56 (AG), HC-D55E HC-G56 (EG), HC-D55S HC-G56 (SG) и HC-D55 HC-G56A (DA)) с huHtrA1. Использованные антитела были в форме Fab. На графике изображены единицы ответа (RU) в виде зависимости от времени (с).
На ФИГ. 13В представлена таблица, на которой обобщены результаты анализа ППР BIACORE™, изображенного на Фиг. 13А.
На ФИГ. 14А представлен график, изображающий результаты анализа ППР BIACORE™ сравнения связывания клона антитела h15H6.v2 (исходный) и указанных комбинированных вариантов в положении VL 94 и положении VH 55 и/или 56 с huHtrA1 AP_EG: LC-N94A LC-P95 HC-D55E HC-G56 (также называемое h15H6.v2.APEG и h15H6.v3). EP_EG: LC-N94E LC-P95 HC-D55E HC-G56. QP_EG: LC-N94Q LC-P95 HC-D55E HC-G56. SP_EG: LC-N94S LC-P95 HC-D55E HC-G56.
На ФИГ. 14В представлена таблица, на которой обобщены результаты анализа ППР BIACORE™, изображенного на Фиг. 14А.
На ФИГ. 14С представлен график, изображающий результаты анализа блокирования на основе FRET исследования способности IgG h15H6.v2, Fab h15H6.v2 и указанных комбинированных вариантов в положении VL 94 и положении VH 55 и/или 56 ингибировать активность HtrA1. Графики изображают процент максимальной активности в виде зависимости от log-концентрации антител (М).
На ФИГ. 14D представлена таблица, показывающая значения IC50 для каждого из клонов антител, исследованных на Фиг. 14С.
На ФИГ. 15А-15В изображены выравнивания последовательностей аминокислотных последовательностей VL (Фиг. 15А) и VH (Фиг. 15В) клонов антител против HtrA1 m19B12 и h19B12.v1 по сравнению с консенсусной последовательностью κ4 человека (Фиг. 15А) или последовательностью VH3 (Фиг. 15В). Последовательности разграничены для каждого из клонов антител обозначающими прямоугольниками. Подчеркнуты последовательности HVR в соответствии с определением Кабата. Остатки, изображенные текстом белого цвета в закрашенных прямоугольниках, указывают на остатки, которые различаются у консенсусной последовательности VH1 человека и у клонов антител против HtrA1.
На ФИГ. 16A-16D представлены графики, изображающие результаты анализа связывания клона антител m19B12 или h19B12.v1 с человеческим или мышиным HtrA1 методом ППР BIACORE™. Применяли кинетический анализ одного цикла. На графиках изображены единицы ответа (RU) в виде зависимости от времени (с). На Фиг. 16А изображены результаты связывания Fab m19B12 с huHtrA1. На Фиг. 16В изображены результаты связывания Fab m19B12 с muHtrA1. На Фиг. 16С изображены результаты связывания Fab h19B12.v1 с huHtrA1. На Фиг. 16D изображены результаты связывания Fab h19B12.v1 с huHtrA1. Ka, Kд и KD для каждого анализа изображены в виде текста внутри каждого графика.
На ФИГ. 17 представлена схематическая диаграмма отмечающая стратегию фагового пэннинга, примененную для глубокого сканирующего NNK-мутагенеза НС и LC HVR из h15H6.v2 в отношении созревания аффинности.
На ФИГ. 18А-18В представлены карты интенсивности в log2 коэффициентов обогащения для мутаций в указанных положениях HVR VH (Фиг. 18А) или VL (Фиг. 18В), рассчитанных путем деления частоты встречаемости заданной мутации в заданном положении в отсортированном образце с частотой встречаемости точно такой же мутации в неотсортированном образце. Соотношения обогащения типичных мутаций указаны в виде карт интенсивностей.
На ФИГ. 19 представлена таблица, показывающая мутации, идентифицированные как обогащенные в отсортированном образце по сравнению с неотсортированным образцом из библиотек NNK и/или библиотек «мягкой» рандомизации VH и VL h15v6.v2.
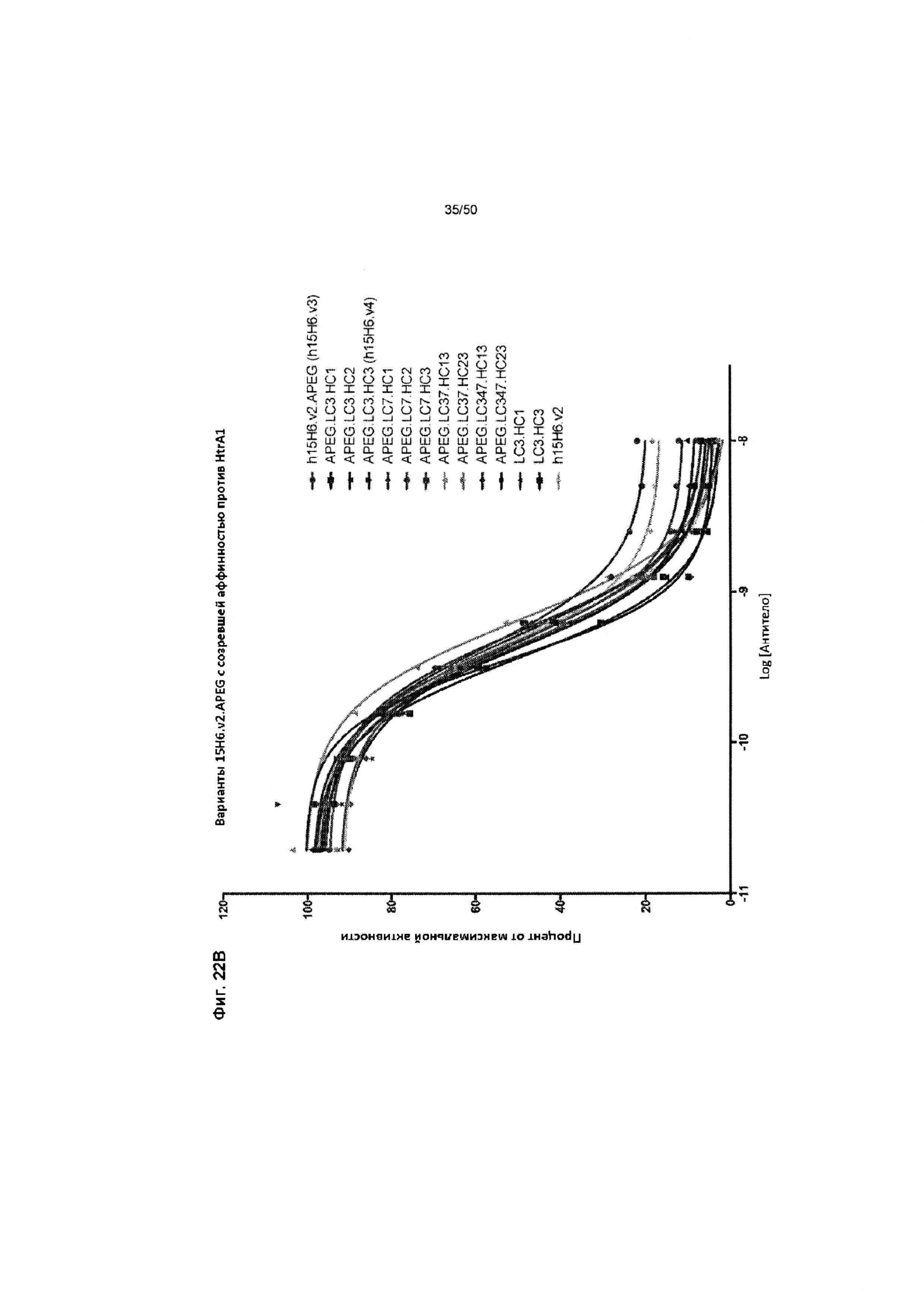
На ФИГ. 20 представлена таблица, показывающая результаты анализа связывания ППР BIACORE™ указанных клонов вариантов Fab антител с созревшей аффинностью. Показаны Ka, Kд и KD для каждого клона варианта антитела с созревшей аффинностью, полученные в данном анализе по сравнению с h15H6.v2 и h15H6.v2.APEG (также называемым h15H6.v3).
На ФИГ. 21А-21В изображены выравнивания последовательностей аминокислотных последовательностей VL (Фиг. 21А) и VH (Фиг. 21В) клонов вариантов антител против HtrA1 с созревшей аффинностью.
На ФИГ. 22А представлена таблица, в которой обобщены результаты для указанных клонов вариантов Fab антител против HtrA1 с созревшей аффинностью в отношении ингибирования активности HtrA1 по оценке анализов активности с H2-Opt на основе FRET. В таблице показаны результаты 3 независимых экспериментов, а также среднее и стандартное отклонение (Ст. откл.). В этих экспериментах использован анализ скорости (ОФЕ/с).
На ФИГ. 22В представлен график, изображающий типичный график результатов анализа активности с H2-Opt с использованием рекомбинантного HtrA1, описанного на Фиг. 22А. Условия анализа включают 400 пМ HtrA1 и 2,5 мкМ субстрата. Буферный раствор состоял из 50 мМ Трис, 200 мМ NaCl, 0,25% CHAPS, рН 8,3. Эти данные получены из второго повторения трех независимых экспериментов из Фиг. 22А.
На ФИГ. 23A-23D представлены графики, изображающие результаты анализов активности с H2-Opt для указанных форм вариантов антитела h15H6, проанализированные с использованием подхода с определением скорости ОФЕ/с. На графиках показано процентное значение контроля (ОФЕ/S) в виде зависимости концентрации (нМ) антитела для моноклонального антитела (mAb) IgG h15H6.v4 (Фиг. 23А), положительного контроля антитела против HtrA1 (IgG YW505.94A, см., например, WO 2013/055998) (Фиг. 23В), Fab h15H6.v4 (Фиг. 23С) и Fab 15H6.v2 (Фиг. 23D). На таблице возле каждого графика для каждого анализа показаны IC50, диапазон Y, коэффициент наклона и фоновое значение.
На ФИГ. 23Е-23Н представлены графики, изображающие результаты анализов активности с H2-Opt для указанных форм вариантов антитела h15H6, проанализированные с использованием подхода с определением конечной точки (ОФЕ). На графиках показано процентное значение контроля (ОФЕ/S) в виде зависимости концентрации (нМ) антитела для Mab IgG h15H6.v4 (Фиг. 23Е), положительного контроля антитела против HtrA1 (IgG YW505.94A) (Фиг. 23F), Fab h15H6.v4 (Фиг. 23G) и Fab 15H6.v2 (Фиг. 23Н). На таблице возле каждого графика для каждого анализа показаны IC50, диапазон Y, коэффициент наклона и фоновое значение.
На ФИГ. 24А-24В представлены таблицы, на которых показаны результаты IC50 (Фиг. 24А) и IC90 (Фиг. 24В) для указанных форм вариантов антитела h15H6 из первой выборки трех независимых экспериментов. Значения IC50 определяли с использованием 4-х параметрических функций подбора. Значения IC90 определяли по значениям IC50 и коэффициентам наклона функций подбора. Эксперимент I соответствует данным, показанным на Фиг. 23A-23F. KB %, коэффициент вариации. Данные анализировали с использованием подхода с определением скорости (ОФЕ/с).
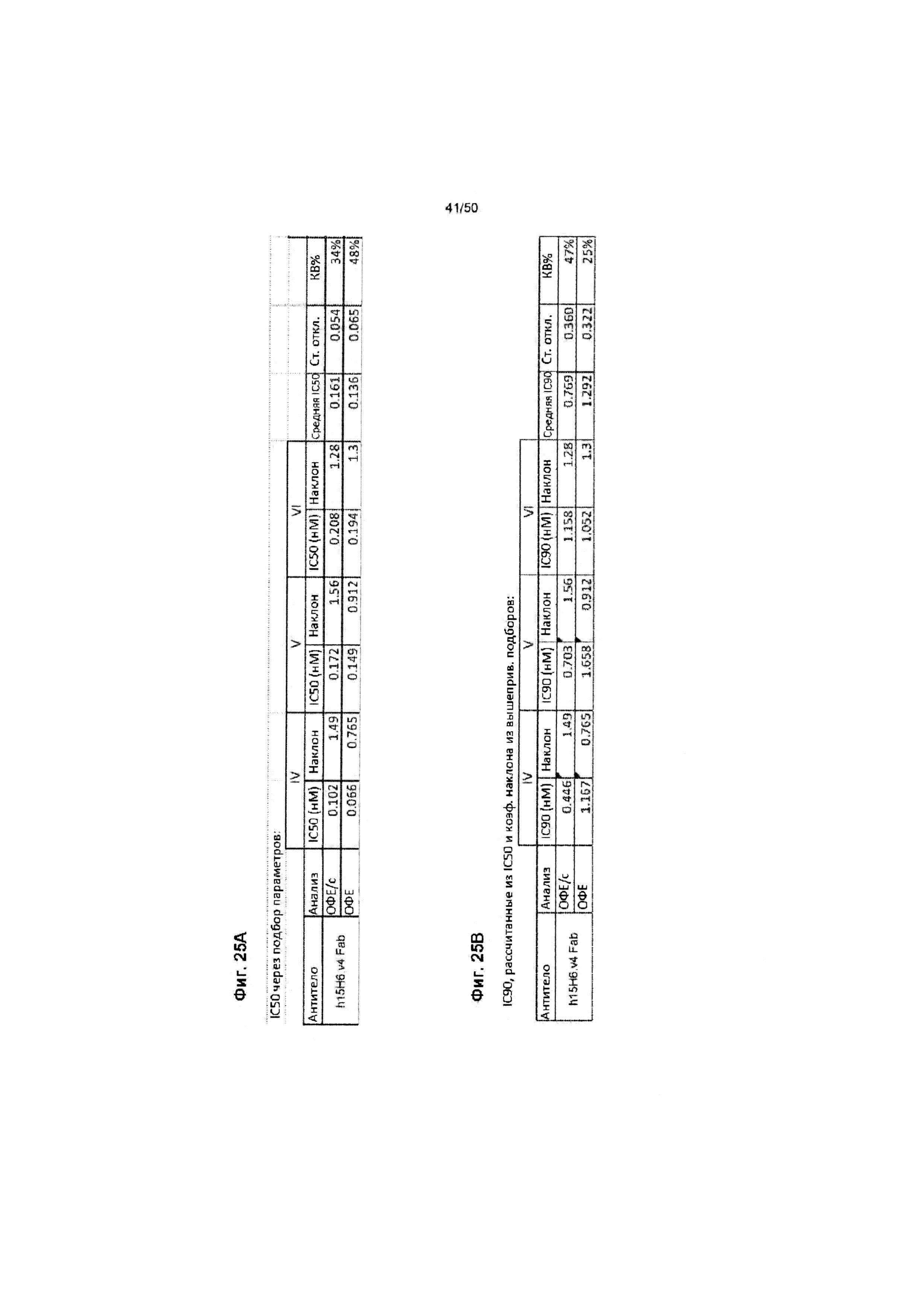
На ФИГ. 25А-25В представлены таблицы, на которых показаны результаты IC50 (Фиг. 25А) и IC90 (Фиг. 25В) для указанных форм вариантов антитела h15H6 из второй выборки трех независимых экспериментов. Значения IC50 определяли с использованием 4-х параметрических функций подбора. Значения IC90 определяли по значениям IC50 и коэффициентам наклона функций подбора. Данные анализировали с использованием либо подхода с определением скорости (ОФЕ/с), либо подхода с определением конечной точки (ОФЕ).
На ФИГ. 26А представлен график, изображающий кривую титрования интактного α-казеина. Экспериментальная концентрация изображена в виде зависимости от теоретической концентрации при использовании метода добавок. Коэффициент корреляции (R2) составил 0,999.
На ФИГ. 26В представлен график, изображающий результаты анализа активности HtrA1 на основе масс-спектрометрии. Способность APEG.LC3.HC3 (h15H6.v4) ингибировать активность Htra1-PD оценивали как описано в примере 3, раздел G. Низкомолекулярный ингибитор ucf-101 служил в качестве положительного контроля.
На ФИГ. 27А-27В представлены графики, изображающие результаты двух независимых анализов активности эндогенного HtrA1, эксперимент I (Фиг. 27А) и эксперимент II (Фиг. 27В). Для каждого Fab антитела №1 и №2 указаны отдельные серии разведения одного и того же антитела с отдельно приготовленными начальными разведениями. Серии двух разведений анализировали на одном и том же планшете с другими реактивами, приготовленными для одного и того же препарата.
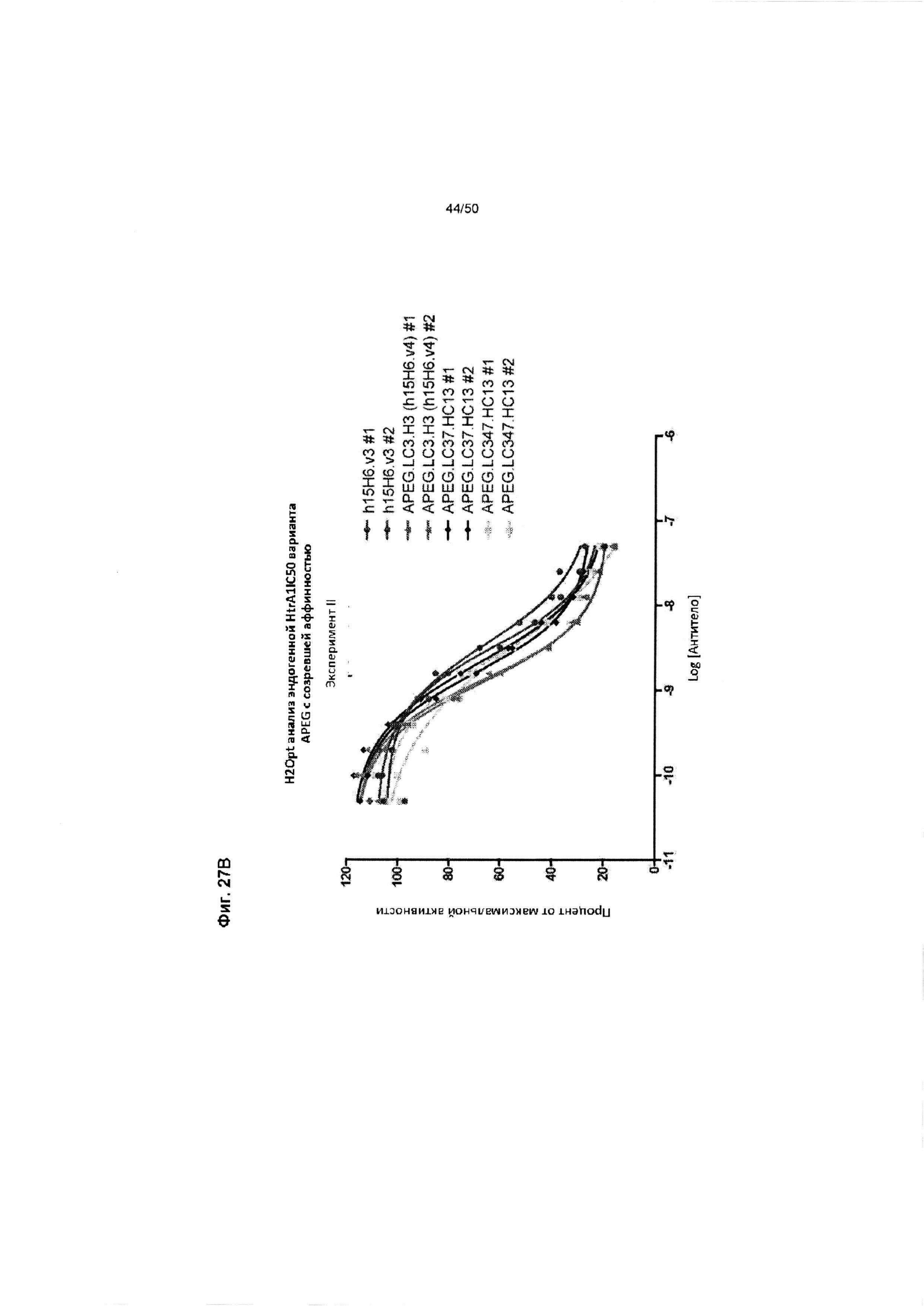
На ФИГ. 27С представлена таблица, в которой обобщены результаты анализов активности эндогенного HtrA1, изображенные на Фиг. 27А и 27В.
На ФИГ. 28 представлена таблица, в которой обобщены кинетические свойства связывания и ингибирующая активность указанных вариантов Fab h15H6.v2 и производных. YW505.94a.28 (см., например, WO 2013/055998) служило в качестве положительного контроля. Все варианты и производные Fab h15H6 показали улучшение аффинности и улучшение активности по сравнению с Fab YW505.94a.28, Fab h15H6.v4, демонстрируя приблизительно 30-кратное улучшение аффинности по сравнению с данным антителом.
На ФИГ. 29А изображена аминокислотная последовательность человеческого HtrA1. Зрелая последовательность изображена заглавными буквами, протеазный домен подчеркнут, а остатки N224 и K248 затенены.
На ФИГ. 29В изображена аминокислотная последовательность мышиного HtrA1. Зрелая последовательность изображена заглавными буквами, а протеазный домен подчеркнут.
На ФИГ. 30 изображено выравнивание вариабельных доменов легкой и тяжелой цепи эталонного антитела против фактора D (ДТ, дикого типа) и его выбранные варианты. HVR внутри вариабельных доменов подчеркнуты. Замены остатков в вариантах изображены жирным шрифтом.
На ФИГ. 31А-31В изображено связывание Fab YW505.94 (как описано в WO 2013/055998) с HtrA1. Когда аминокислоты, обозначенные на Фиг. 31А, заменяют аланином, то аффинность связывания Fab YW505.94 для мутировавшего белка снижается. Структура, изображенная на Фиг. 31В, создана с использованием электронной микроскопии, как описано в Ciferri et al. (2015) Biochem. J. 472(2):169-81. Кругом изображен эпитоп Fab YW505.94 на белке HtrA1. Fab YW505.94 связывается с петлями В и С белка HtrA1.
На ФИГ. 32А-32В изображено связывание Fab 15H6.v4 с HtrA1 и показано, что эпитоп HtrA1, связанный Fab 15H6.v4, отличается от эпитопа, связанного Fab YW505.94. На Фиг. 32А изображено взаимодействие между Fab 15H6.v4 и его эпитопом на белке HtrA1, как определено рентгеновской кристаллографией. Fab 15H6.v4 связывается с LA-петлей белка HtrA1 (см., например, Glaza Р et al. (2015) PLoS One 10(6):е0131142). Структура, изображенная на Фиг. 32В, создана с использованием электронной микроскопии. Кругом изображен эпитоп Fab 15H6V.4 на белке HtrA1.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. ОПРЕДЕЛЕНИЯ
В контексте данного документа термин «около» относится к обычному диапазону ошибки для соответствующего значения, легко понятному специалисту в данной технической сфере. В данном документе ссылка на «около» в отношении значения или параметра включает (и описывает) варианты реализации, которые касаются данного значения или параметра, как таковых.
«Акцепторный человеческий каркасный участок» для целей данного изобретения представляет собой каркасный участок, содержащий аминокислотную последовательность каркаса вариабельного домена легкой цепи (VL) или каркаса вариабельного домена тяжелой цепи (VH), происходящий от каркаса иммуноглобулина человека или консенсусной последовательности каркаса человека, как указано ниже. Акцепторный человеческий каркасный участок «происходящий от» каркаса иммуноглобулина человека или консенсусной последовательности каркаса человека может иметь такую же аминокислотную последовательность, как у них, или может содержать изменения в аминокислотной последовательности. В некоторых вариантах реализации изобретения количество аминокислотных изменений составляет 10 или меньше, 9 или меньше, 8 или меньше, 7 или меньше, 6 или меньше, 5 или меньше, 4 или меньше, 3 или меньше, или 2 или меньше. В некоторых вариантах реализации изобретения последовательность акцепторного каркасного участка VL человека идентична последовательности каркасного участка VL иммуноглобулина человека или консенсусной последовательности каркаса человека.
«Активный» или «активность», или «биологическая активность» в контексте антитела по данному изобретению представляет собой способность действовать антагонистически (частично или полностью ингибировать) по отношению к биологической активности своих мишеней, например, in vitro и/или in vivo. Одним примером биологической активности антитела является способность достигать измеряемого улучшения состояния, например патологии, нарушения, связанного с мишенью антитела. Например, для антитела против HtrA1 нарушение может представлять собой связанное с HtrA1 нарушение, такое как, например, ВМД (например, географическая атрофия). Активность антитела против HtrA1 можно определять в исследованиях in vitro или in vivo, включая анализы связывания, анализы активности (например, анализы активности на основе FRET (например, с использованием субстрата H2-Opt) или анализы активности на основе масс-спектрометрии), используя релевантную модель на животных или клинические исследования на людях. В другом примере для антитела против фактора D (например, антитела против HtrA1/фактора D) нарушение может быть связанным с комплементом нарушением, таким как, например, связанное с комплементом глазное нарушение. Активность антитела против фактора D можно определять в исследованиях in vitro или in vivo, включая анализы связывания, анализы с альтернативным путем гемолиза (например, анализы измерения ингибирования или активации альтернативного пути активности комплемента), используя релевантную модель на животных или клинические исследования на людях.
«Аффинность» относится к силе суммарных общих нековалентных взаимодействий между одиночным сайтом связывания молекулы (например, антитела) и его партнером по связыванию (например, антигеном). В контексте данного документа, если не указано иное, «аффинность связывания» относится к присущей молекуле аффинности связывания, отражающей взаимодействие между участниками пары связывания (например, антителом и антигеном) при их соотношении 1:1. Аффинность молекулы X к ее партнеру Y, в целом, можно выразить константой диссоциации (KD). Аффинность можно измерять общепринятыми методами, известными в данной области техники, в том числе описанными в данном документе. Конкретные иллюстративные и типичные варианты реализации изобретения, связанные с измерением аффинности связывания, описаны в данном документе далее.
«Аффинность созревшего» антитела относится к антителу с одной или более модификациями в одном или более гипервариабельных участков (HVR) и/или каркасных участков (FR) по сравнению с исходным антителом, которое не содержит таких модификаций, причем такие модификации приводят к улучшению аффинности антитела к антигену.
Термины «антитело против HtrA1» или «антитело, специфически связывающееся с HtrA1» относится к антителу, способному связывать HtrA1 с достаточной аффинностью, такой что указанное антитело можно использовать в качестве диагностического и/или терапевтического средства при целевом воздействии на HtrA1. В одном варианте реализации изобретения степень связывания антитела против HtrA1 с нерелевантным белком, не являющимся HtrA1, составляет менее около 10% связывания антитела с HtrA1 при измерении, например, методом радиоиммуноанализа (РИА). В некоторых вариантах реализации изобретения антитело, которое связывается с HtrA1, имеет константу диссоциации (KD)







Термины «антитело против фактора D» или «антитело, специфически связывающееся с D» относится к антителу, способному связывать фактор D с достаточной аффинностью, такой что указанное антитело можно использовать в качестве диагностического и/или терапевтического средства при целевом воздействии на фактор D, например, таким образом чтобы ингибировать или в основном снижать активацию комплемента. В одном варианте реализации изобретения степень связывания антитела против фактора D с нерелевантным белком, не являющимся фактором D, составляет менее около 10% связывания антитела с фактором D при измерении, например, методом РИА. В некоторых вариантах реализации изобретения антитело, которое связывается с фактором D, имеет константу диссоциации (KD)







Термин «антитело» в данном документе используется в самом широком смысле и охватывает различные структуры антител, включая, но не ограничиваясь ими, моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они проявляют требуемую антигенсвязывающую активность.
«Фрагмент антитела» относится к молекуле, не являющейся интактным антителом, но содержащей часть интактного антитела и связывающей антиген, с которым связывается интактное антитело. Примеры фрагментов антител включают, но не ограничиваются ими, Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; молекулы одноцепочечных антител (например, scFv) и мультиспецифические антитела, образованные из фрагментов антител.
При расщеплении антител папаином образуются два идентичные антигенсвязывающие фрагмента, называемые фрагментами Fab, и остающийся фрагмент Fc, название которого отражает его способность легко кристаллизоваться. Фрагмент Fab состоит из целой легкой (L) цепи вместе с доменом вариабельного участка тяжелой (Н) цепи (VH) и первым константным доменом из одной тяжелой цепи (СН1). Обработка антитела пепсином дает единственный большой фрагмент F(ab')2, который условно соответствует двум связанным дисульфидами фрагментам Fab, имеющий дивалентную антигенсвязывающую активность и еще способный к перекрестному связыванию антигена. Фрагменты Fab' отличаются от фрагментов Fab тем, что имеют несколько дополнительных остатков на карбоксильном конце домена СН1, включая один или более цистеинов из шарнирного участка антитела. В данном документе Fab'-SH представляет собой обозначение Fab', в котором цистеиновый (-е) остаток (-и) константных доменов несет (несут) свободную тиольную группу. Фрагменты F(ab')2 антител первоначально получали в виде пар фрагментов Fab', между которыми находились шарнирные остатки цистеина. Известны также другие варианты химического связывания фрагментов антител.
Термин «Fc-участок» в данном документе используется для обозначения С-концевого участка тяжелой цепи иммуноглобулина, который содержит по меньшей мере часть константного участка. Этот термин включает нативную последовательность Fc-участков и варианты Fc-участков. В одном варианте реализации изобретения Fc-участок тяжелой цепи IgG человека проходит от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако Fc-участок может содержать С-концевой лизин (Lys447) или не содержать его. Если в данном документе не указано иное, нумерация аминокислотных остатков в Fc-участке или константном участке соответствует системе EU-нумерации, также называемой EU-индексом, описанной в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991).
«Fv» состоит из димера одного домена вариабельного участка тяжелой цепи и одного вариабельного участка домена легкой цепи, соединенных жесткой нековалентной связью. В результате фолдинга этих двух доменов выделяется шесть гипервариабельных петель (по 3 петли из каждой цепи Н и L), которые предоставляют аминокислотные остатки для связывания антигенов и придают антителу антигенсвязывающую специфичность. Тем не менее даже один вариабельный домен (или половина Fv, содержащая только три HVR, специфические по отношению к антигену) обладает способностью распознавать и связывать антиген, хотя часто и с более низкой аффинностью, чем полный участок связывания.
«Одноцепочечные Fv», также имеющие аббревиатуру sFv или scFv, представляют собой фрагменты антител, которые содержат домены антител VH и VL, связанные в одну полипептидную цепь. Предпочтительно, полипептид scFv дополнительно содержит полипептидный линкер между доменами VH и VL, которые дают возможность scFv образовывать требуемую структуру для связывания антигенов. В качестве обзора scFv см. Pluckthun в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315(1994).
Термин «диатела» относится к малым фрагментам антител, полученным конструированием фрагментов sFv (см. предыдущий параграф) с такими короткими линкерами (около 5-10 остатков) между доменами VH и VL, чтобы достигалось спаривание V-доменов между цепями, но не внутри цепей, приводящее к получению бивалентного фрагмента, т.е. фрагмента, имеющего два антигенсвязывающих сайта. Биспецифические антитела представляют собой гетеродимеры двух «перекрестных» фрагментов sFv, в которых домены VH и VL двух антител представлены на разных полипептидных цепях. Диатела подробнее описаны, например, в ЕР 404097; WO 93/11161 и Hollinger era/., Proc. Natl. Acad. Sci. USA, 90: 6444-6448, 1993).
«Блокирующим» антителом или антителом-«антагонистом» является такое антитело, которое ингибирует или уменьшает биологическую активность связываемого им антигена. Некоторые блокирующие антитела или антитела-антагонисты практически или полностью ингибируют биологическую активность антигена.
«Антитело, которое связывается с тем же эпитопом» в качестве эталонного антитела, относится к антителу, которое контактирует с перекрывающимся набором аминокислотных остатков антигена при сравнении с эталонным антителом или блокирует связывание эталонного антитела с его антигеном в конкурентном анализе на 50% или более. Можно определять аминокислотные остатки антитела, которые контактируют с антигеном, например, путем определения кристаллической структуры антитела в комплексе с антигеном или путем выполнения анализа обмена атомов водорода/дейтерия. В некоторых вариантах реализации изобретения остатки антитела, которое находится в пределах 5
Термин «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи походит от конкретного источника или вида животного, в то время как остальная часть тяжелой и/или легкой цепи походит от другого источника или вида животного.
«Класс» антитела относится к типу константного домена или константного участка его тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них дополнительно делятся на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, соответствующие различным классам иммуноглобулинов, называются, соответственно, α, δ, ε, γ, и μ.
Термин «эффекторные функции» относится к тем видам биологической активности, присущей Fc-участку антитела, которые изменяются в зависимости от изотипа антитела. Примеры эффекторных функций антител включают в себя: связывание C1q и комплемент-зависимую цитотоксичность (КЗЦ); связывание рецептора Fc; антителозависимую клеточно-опосредованную цитотоксичность (АЗКЦ); фагоцитоз; понижающую регуляцию рецепторов поверхности клетки (например, рецептора В-клеток) и активацию В-клеток.
Термин «каркас» или «каркасный участок» или «FR» относится к остаткам вариабельного домена, за исключением остатков гипервариабельного участка (HVR). FR вариабельного домена обычно состоит из четырех доменов FR: FR1, FR2, FR3 и FR4.
Термины «полноразмерное антитело», «интактное антитело» и «целое антитело» в данном документе являются взаимозаменяемыми и относятся к антителу, структура которого практически аналогична структуре нативного антитела, или которое содержит тяжелые цепи, содержащие Fc-участок, описанный в данном документе.
Термин «шарнирный участок» в целом определяется как протяженность, занимающая остатки 216-238 (нумерация EU) или 226-251 (нумерация Кабата) IgG1 человека. Шарнир можно дополнительно разделять на три различных участка, верхний, средний (например, основной) и нижний шарнир. В некоторых вариантах реализации изобретения шарнирный участок антитела IgG1 человека в целом представлен следующим образом.
Верхний шарнир содержит аминокислоты в последовательности EPKSCDKTHT (SEQ ID NO: 157). В некоторых вариантах реализации изобретения верхний шарнир содержит аминокислоты в положениях 216-225 (нумерация EU) или 226-238 (нумерация Кабата).
Средний (например, основной) шарнир содержит аминокислоты в последовательности СРРС (SEQ ID NO: 122). В некоторых вариантах реализации изобретения основной шарнир содержит аминокислоты в положениях 226-229 (нумерация EU) или 239-242 (нумерация Кабата).
Нижний шарнир содержит аминокислоты в последовательности PAPELLGGP (SEQ ID NO: 158). В некоторых вариантах реализации изобретения нижний шарнир содержит аминокислоты в положениях 230-238 (нумерация EU) или 243-251 (нумерация Кабата).
«Антитело человека» представляет собой антитело с аминокислотной последовательностью, соответствующей последовательности антитела, продуцированного в организме человека или клетке человека или происходящее из источника, не являющегося человеком, использующего репертуары антител человека или другие последовательности, кодирующие антитела человека. Это определение антитела человека, в частности, не включает гуманизированное антитело, содержащее антигенсвязывающие остатки нечеловеческого происхождения.
«Консенсусный каркас человека» является каркасом, представляющим наиболее распространенные аминокислотные остатки в выборке каркасных последовательностей VL или VH иммуноглобулина человека. Обычно выбор последовательностей VL или VH человеческого иммуноглобулина осуществляют из подгруппы последовательностей вариабельного домена. Обычно подгруппа последовательностей представляет собой подгруппу по Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. В одном варианте реализации изобретения для VL подгруппа представляет собой подгруппу каппа I, согласно Kabat et al., выше. В одном варианте реализации изобретения для VH подгруппа представляет собой подгруппу III, согласно Kabat et al., выше.
«Гуманизированные» формы нечеловеческих (например, грызуна) антител представляют собой химерные антитела, которые содержат минимальную последовательность, происходящую из нечеловеческого антитела. В большинстве случаев гуманизированные антитела представляют собой иммуноглобулины человека (антитело-реципиент), в которых остатки гипервариабельного участка реципиента замещены остатками гипервариабельного участка видов, отличных от человека (антитело-донор), таких как мышь, крыса, кролик или нечеловеческий примат, обладающими желаемой специфичностью, аффинностью и эффективностью. В некоторых случаях остатки FR иммуноглобулина человека заменяют соответствующими остатками нечеловеческого происхождения. Кроме того, гуманизированные антитела могут содержать остатки, отсутствующие в антителе-реципиенте или в антителе-доноре. Эти модификации можно выполнять для дальнейшего улучшения эффективности антитела. В общем, гуманизированное антитело будет содержать практически все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или практически все гипервариабельные петли соответствуют таким участкам иммуноглобулина нечеловеческого происхождения, а все или практически все FR соответствуют таким участкам последовательности иммуноглобулина человека. Гуманизированное антитело также не обязательно будет содержать по меньшей мере часть константного участка иммуноглобулина (Fc), обычно происходящего из иммуноглобулина человека. Более подробно, см. Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988) и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
Термин «вариабельный» относится к тому факту, что среди антител некоторые сегменты вариабельных доменов сильно различаются по последовательностям. Вариабельный или V-домен опосредует антигенное связывание и определяет специфичность конкретного антитела к своему конкретному антигену. В то же время изменчивость не является равномерно распределенной по длине вариабельных доменов. Вместо этого, V-участки состоят из относительно инвариантных промежутков, называемых каркасные участки (FR), из 15-30 аминокислот, разделенных более короткими участками с чрезвычайной вариабельностью, называемыми «гипервариабельные участки», которые составляют в длину 9-12 аминокислот каждый. Термин «гипервариабельный участок» или HVR, когда используется в данном документе, относится к аминокислотным остаткам антитела, которые отвечают за связывания антигена. Гипервариабельный участок обычно содержит аминокислотные остатки из, например, примерно около 24-34 (L1), 50-56 (L2) и 89-97 (L3) остатков в VL и примерно около 26-35 (Н1), 49-65 (Н2) и 95-102 (Н3) остатков в VH (в одном варианте реализации изобретения, Н1 состоит из примерно около 31-35 остатков); Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или этих остатков из «гипервариабельной петли» (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в VL, и 26-32 (Н1), 53-55 (Н2) и 96-101 (Н3) - в VH; Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987). Каждый из вариабельных доменов нативных тяжелых и легких цепей содержит четыре FR, преимущественно принимающих конфигурацию бета-листа, соединенных тремя гипервариабельными участками, которые образуют петли, соединяющие структуру бета-листа, а в некоторых случаях - образующие ее часть. Гипервариабельные участки каждой цепи удерживаются вместе в непосредственной близости с помощью FR и, с гипервариабельными участками из другой цепи, участвуют в образовании антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Соответственно, последовательности HVR и FR в составе VH (или VL) обычно располагаются в следующей последовательности: FR1-H1 (L1)-FR2-H2(L2)-FR3-H3(L3)-FR4. Константные домены не принимают непосредственного участия в связывании антитела с антигеном, однако проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной токсичности (АЗКЦ).
Термин «нумерация остатков вариабельных доменов по Кабату», «аминокислотные остатки по Кабату» или «нумерация положений аминокислот по Кабату» и их вариации, относятся к системе нумерации, используемой для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи, компиляции антител в Kabat et al., выше. Используя эту систему нумерации, фактическая линейная аминокислотная последовательность может содержать меньше аминокислот или дополнительные аминокислоты, соответствующие укорочению FR или CDR вариабельного домена или вставке в них. Например, вариабельный домен тяжелой цепи может содержать одну аминокислотную вставку (остаток 52а по Кабату) после остатка 52 Н2 и вставленные остатки (например, остатки 82а, 82b и 82с и т.д. по Кабату) после остатка 82 FR тяжелой цепи. Для данного антитела нумерацию остатков по Кабату можно определять путем выравнивания участков гомологии последовательности антитела со «стандартной» последовательностью, пронумерованной по Кабату.
Система нумерации Кабата обычно используется для обозначения остатка в вариабельном участке (приблизительно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (например, Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). В целом, «система нумерации EU» или «индекс EU» используется, когда речь идет об остатке в константном участке тяжелой цепи иммуноглобулина (например, индекс EU, описанный в Kabat et al., выше). «Индекс EU по Кабату» относится к нумерации остатков антитела EU IgG1 человека. Если в данном документе не указано иное, ссылки на номера остатков в вариабельном домене антител обозначают нумерацию остатков по системе нумерации Кабата. Если в данном документе не указано иное, ссылки на номера остатков в константном домене антител обозначают нумерацию остатков по системе нумерации EU (например, см. предварительную заявку США №60/640,323, фигуры с нумерацией EU).
Если не указано иное, остатки HVR и другие остатки в вариабельном домене (например, остатки FR) в данном документе нумеруют по Kabat et al., выше.
«Иммуноконъюгат» представляет собой антитело, конъюгированное с одной или более гетерологичными молекулами, включая, но не ограничиваясь цитотоксическим средством.
Термин «выделенное антитело», когда используется для описания различных антител, описанных в данном документе, обозначает антитело, которое идентифицировано и отделено и/или выделено из клетки или культуры клеток, в которой оно экспрессировано. Контаминирующие компоненты природного окружения представляют собой вещества, которые, как правило, могут мешать диагностическому или терапевтическому применению полипептида, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В некоторых вариантах реализации антитело является очищенным до более чем 95% или 99% чистоты, определяемой, например, посредством методов электрофореза (например, электрофореза в ДСН-ПААГ, изоэлектрического фокусирования (ИЭФ), капиллярного электрофореза) или хроматографии (например, ионообменной или обращенно-фазной ВЭЖХ). Обзор методов оценки чистоты антител см., например, в Flatman et al., J. Chromatogr. В 848:79-87 (2007). В предпочтительных вариантах реализации изобретения антитело будет очищено (1) до степени, достаточной для получения по меньшей мере 15 остатков на N-концевой или внутренней аминокислотной последовательности путем использования секвенатора с вращающейся чашкой или (2) до гомогенности, полученной методом ДСН-ПААГ электрофореза в невосстанавливающих или восстанавливающих условиях, используя окрашивание Кумасси синим или, предпочтительно, серебром. Выделенное антитело включает антитела, полученные in situ внутри рекомбинантных клеток, поскольку по меньшей мере один компонент из полипептидного природного окружения будет отсутствовать. В то же время, выделенный полипептид обычно будет получен с использованием по меньшей мере одной стадии очистки.
Термин «моноклональное антитело» в данном документе относится к антителу, полученному из популяции практически гомогенных антител, т.е. составляющие популяцию отдельные антитела являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантных антител, например, содержащих мутации природного происхождения или мутации, возникающие во время продукции при получении моноклонального антитела, причем такие варианты обычно присутствуют в незначительных количествах. В отличие от препаратов поликлональных антител, которые обычно содержат различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело препарата моноклонального антитела направлено против одной детерминанты на антигене. Таким образом, модификатор «моноклональное» указывает на то, что антитело получено из практически гомогенной популяции антител; и его не следует интерпретировать как требование к продукции антитела посредством какого-либо конкретного способа. Например, моноклональные антитела для использования согласно данному изобретению можно получать с помощью различных способов, включая, но не ограничиваясь ими, гибридомную методику, методики рекомбинантных ДНК, методики фагового дисплея и методики с использованием трансгенных животных, полностью или частично содержащих локусы человеческих иммуноглобулинов, причем такие способы и другие типичные способы получения моноклональных антител описаны в данном документе.
Термин «мультиспецифическое антитело» используется в самом широком смысле и конкретно охватывает антитело, содержащее вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), причем единица VH-VL обладает полиэпитопной специфичностью (т.е. способна связываться с двумя разными эпитопами на одной биологической молекуле или каждым эпитопом на разных биологических молекулах). Такие мультиспецифические антитела включают, но не ограничиваются ими, полноразмерные антитела, антитела, имеющие два или более доменов VL и VH, фрагменты антител, такие как Fab, Fv, dsFv, scFv, диатела, биспецифические антитела и триатела, фрагменты антител, которые связаны ковалентно или нековалентно. «Полиэпитопная специфичность» предполагает способность специфически связываться с двумя или более разными эпитопами на одной и той же или отличающейся (-ихся) мишени (-ях). «Двойная специфичность» или «биспецифичность» относится к способности специфически связываться с двумя разными эпитопами на одной и той же или отличающейся (-ихся) мишени (ях). Однако в отличие от биспецифических антител, антитела с двойной специфичностью содержат два антигенсвязывающих плеча, идентичные по аминокислотной последовательности, и каждое Fab-плечо способно к распознаванию двух антигенов. Двойная специфичность дает возможность антителам взаимодействовать с высокой аффинностью с двумя разными антигенами как одна молекула Fab или IgG. В соответствии с одним вариантом реализации изобретения мультиспецифическое антитело в форме IgG1 связывается с каждым эпитопом с аффинностью от 5 мкМ до 0,001 пМ, от 3 мкМ до 0,001 пМ, от 1 мкМ до 0,001 пМ, от 0,5 мкМ до 0,001 пМ или от 0,1 мкМ до 0,001 пМ. Термин «моноспецифический» относится к способности связывать только один эпитоп.
Термин «нативные антитела» относится к молекулам иммуноглобулинов природного происхождения, имеющим различающиеся структуры. Например, нативные антитела IgG представляют собой гетеротетрамерные гликопротеины с молекулярной массой около 150000 Дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, соединенных дисульфидными связями. В направлении от N- к С-концу каждая тяжелая цепь содержит вариабельный участок (VH), также называемый вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, сопровождающийся тремя константными доменами (СН1, СН2 и СН3). Аналогичным образом, в направлении от N- к С-концу каждая легкая цепь содержит вариабельный участок (VL), также называемый вариабельным легким доменом или вариабельным доменом легкой цепи, сопровождающимся константным легким (CL) доменом. В зависимости от аминокислотной последовательности своего константного домена легкую цепь антитела можно отнести к одному из двух типов, называемых каппа (к) и лямбда (λ).
Применительно к связыванию антитела с молекулой-мишенью, термин «специфическое связывание» или «специфически связываться с» или является «специфическим к» конкретному полипептиду или эпитопу на конкретной полипептидной мишени означает связывание, которое измеряемо отличается от неспецифического взаимодействия. Специфическое связывание может быть измерено, например, определением связывания молекулы по сравнению со связыванием контрольной молекулы. Например, специфическое связывание может определяться конкуренцией с контрольной молекулой, которая имеет сходство с мишенью, например, при избытке немеченой мишени. В этом случае специфическое связывание показывает может ли связывание меченой мишени с зондом полностью ингибироваться избытком немеченой мишени. Термин «специфическое связывание» или «специфически связывается с» или является «специфическим к» конкретному полипептиду или эпитопу на конкретной полипептидной мишени, как используется в данном документе, может быть проиллюстрирован, например, молекулой, обладающей KD для мишени 10-4 M или ниже, альтернативно 10-5М или ниже, альтернативно 10-6 М или ниже, альтернативно 10-7 М или ниже, альтернативно 10-8 М или ниже, альтернативно 10-9 М или ниже, альтернативно 10-10 М или ниже, альтернативно 10-11 М или ниже, альтернативно 10-12 М или ниже, или KD в диапазоне от 10-4 М до 10-6 М, или от 10-6 М до 10-10 М, или от 10-7 М до 10-9 М. Как будет ясно специалисту в данной области техники, значения аффинности и KD связаны обратной зависимостью. Высокая аффинность для антигена измеряется низким значением KD. В одном варианте реализации изобретения термин «специфическое связывание» относится к связыванию, при котором молекула связывается с конкретным полипептидом или эпитопом на конкретном полипептиде без существенного связывания с любым другим полипептидом или полипептидным эпитопом.
«Выделенная нуклеиновая кислота, кодирующая антитело» относится к одной или более молекулам нуклеиновой кислоты, кодирующим тяжелые и легкие цепи антитела (или их фрагменты), включая такую(-ие) молекулу(-ы) нуклеиновой кислоты в составе одного вектора или отдельных векторов и такую(-ие) молекулу(-ы) нуклеиновой кислоты, присутствующую(-ие) в одном или нескольких местах в клетке-хозяине. В некоторых вариантах реализации нуклеиновая кислота кодирует антитело против HtrA1. В других вариантах реализации изобретения нуклеиновая кислота может кодировать антитело против фактора D (например, антитело против HtrA1/фактора D).
Как используется в данном документе термин «вектор» относится к молекуле нуклеиновой кислоты, способной обеспечивать репродукцию другой, связанной с ней нуклеиновой кислоты. Термин включает вектор, находящийся в виде самореплицирующейся структуры нуклеиновой кислоты, а также вектор, внедренный в геном клетки-хозяина, в которую он введен. Некоторые векторы способны управлять экспрессией нуклеиновых кислот, с которыми они функционально связаны. Такие векторы в данном документе называются «экспрессионными векторами».
Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» в данном документе используются взаимозаменяемо и относятся к клеткам, в которые введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают «трансформанты» и «трансформированные клетки», которые включают первично трансформированные клетки и полученное из них потомство, независимо от количества пассажей. Потомство может быть не полностью идентичным исходной клетке по содержанию нуклеиновых кислот и может содержать мутации. В объем настоящего описания входит мутантное потомство, полученное путем скрининга или отбора, которое обладает такой же функцией или биологической активностью, как и исходно трансформированная клетка.
«Процент (%) идентичности аминокислотной последовательности» в отношении эталонной полипептидной последовательности определяют как процентное содержание аминокислотных остатков последовательности-кандидата, идентичных аминокислотным остаткам эталонной полипептидной последовательности после выравнивания последовательностей и введения гэпов, если это необходимо для достижения максимального процента идентичности последовательностей, причем при определении идентичности последовательностей консервативные замены не учитываются. Выравнивание аминокислотных последовательностей с целью определения процента их идентичности можно осуществлять разными способами, известными специалистам в данной области техники, к примеру, с использованием общедоступного компьютерного программного обеспечения, такого как программы BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определять параметры, подходящие для выравнивания последовательностей, в том числе любые алгоритмы, необходимые для достижения максимального выравнивания сравниваемых последовательностей по всей длине. Однако для целей данного изобретения значения % идентичности аминокислотных последовательностей генерируются с использованием компьютерной программы сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 разработана Genentech, Inc., а ее исходный код подан с информацией для пользователя в Бюро по охране авторских прав США, г. Вашингтон, округ Колумбия, 20559, где зарегистрирован под № TXU510087 регистрации авторского права в США. Программа ALIGN-2 общедоступна в Genentech, Inc., г. Саут-Сан-Франциско, штат Калифорния, США, или может быть скомпилирована из исходного кода. Для применения в операционной системе UNIX, включающей цифровую версию UNIX v4.0D, программу ALIGN-2 нужно компилировать. Все параметры сравнения последовательностей заданы программой ALIGN-2 и не изменяются.
В случаях, когда для сравнения аминокислотных последовательностей используют ALIGN-2, % идентичности данной аминокислотной последовательности А по отношению к, по сравнению с или относительно данной аминокислотной последовательности В (что альтернативно можно сформулировать как данная аминокислотная последовательность А обладает или характеризуется определенным % идентичности последовательностей по отношению к, по сравнению с или относительно данной аминокислотной последовательности В) рассчитывают следующим образом: 100 умножено на дробь X/Y, где X представляет собой количество подсчитанных идентичных совпадений аминокислотных остатков, определенных при программном выравнивании последовательностей А и В программой для выравнивания последовательностей ALIGN-2, и где Y представляет собой общее количество аминокислотных остатков в последовательности В. Следует понимать, что, если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, то % идентичности аминокислотной последовательности А аминокислотной последовательности В не будет равен % идентичности аминокислотной последовательности В аминокислотной последовательности А. Если конкретно не указано иное, все значения % идентичностей аминокислотных последовательностей, использованные в данном документе, получены как описано в непосредственно предыдущем параграфе с применением компьютерной программы ALIGN-2.
Белок, включая антитело, указан как «стабильный», если он по существу сохраняет интактную конформационную структуру и биологическую активность. Различные аналитические методики для измерения стабильности белка доступны в данной области техники и рассматриваются, например, в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991) и Jones (1993) Adv. Drug Delivery Rev. 10: 29-90. Вариант антитела с «улучшенной стабильностью» относится к варианту антитела, который является более стабильным по сравнению с исходным эталонным антителом. Предпочтительно, варианты антитела с улучшенной стабильностью представляют собой варианты эталонных (дикого типа) антител, в которых специфические аминокислотные остатки изменены с целью улучшения физической стабильности и/или химической стабильности, и/или биологической активности и/или получения сниженной иммуногенности нативных антител.
Термин «изомеризация» в целом относится к химическому процессу, с помощью которого химическое соединение превращают в любую из его изомерных форм, т.е. формы с одинаковым химическим составом, но с различной структурой или конфигурацией и, следовательно, в целом, с различными физическими и химическими свойствами. В данном документе конкретно использована изомеризация аспартата, процесс при котором один или более остатков аспарагиновой кислоты (D или Asp) полипептида трансформирован в остаток (-ки) изоаспарагиновой кислоты. См., например, Geigeret al., J. Biol. Chem. 262:785-94, 1987.
Термин «дезамидирование» относится в целом к химической реакции, в ходе которой из органического соединения удаляется амидная функциональная группа. В данном документе конкретно использовано дезамидирование аспарагина, процесс, при котором один или более остатков аспарагина (N или Asn) полипептида (например, антитела) были превращены в аспарагиновую кислоту (D или Asp), т.е. нейтральный амид боковой цепи превращен в остаток с общим кислотным характером. См., например, Xie et al., J. Pharm. Sci. 88:8-13, 1999.
«Окисленный» вариант полипептидной молекулы (например, антитела) представляет собой полипептид, у которого один или более остатков метионина (М или Met) или триптофана (W или Trp) исходного полипептида были превращены в сульфон или сульфоксид при участии серы метионина. Окисление можно предотвращать превращением метионина (М или Met) в лейцин (L или Leu) или изолейцин (I или IIe). См., например, Amphlettet al., Pharm. Biotechnol., 9:1-140, 1996.
Аминокислотные остатки, «склонные» к определенным установленным физическим или химическим процессам (например, изомеризации, дезамидированию или окислению), относятся к тем остаткам в конкретной белковой молекуле, которые идентифицированы, как обладающие свойством подвергаться установленным процессам, таким как изомеризация, дезамидирование или окисление. Эти свойства часто определяют по относительным положениям остатков в первичной и/или конформационной структуре белка. Например, было показано, что первый Asp в мотиве Asp-XXX (где XXX может быть Asp, Gly, His, Ser или Thr) склонен к изомеризации Asp из-за участия соседнего к нему участка, тогда как некоторые другие Asp в том же белке могут не обладать таким свойством. Анализы для идентификации остатков, склонных к определенным процессам в конкретной белковой молекуле хорошо известны в данной области техники. См., например, Cacia et al., Biochem. 35:1897-1903, 1996.
Термин «сериновая пептидаза 1 HtrA (HtrA1)» или HtrA1, как взаимозаменяемо используется в данном документе, относится к любой нативной HtrA1 из любого источника позвоночного животного, включая млекопитающих, таких как приматы (например, люди) и грызуны (например, мыши и крысы), если не указано иное. Термин охватывает «полноразмерную» непроцессированную HtrA1, а также любую форму HtrA1, которая является результатом процессинга в клетке. Данный термин также охватывает варианты HtrA1 природного происхождения, например, сплайс-варианты или аллельные варианты. Аминокислотная последовательность типичной HtrA1 человека изображена на SEQ ID NO: 121 (см. Фиг. 29A). Номер доступа для HtrA1 человека в базе UniProt-Q92743. Аминокислотная последовательность типичной HtrA1 мыши изображена на SEQ ID NO: 155 (см. Фиг. 29В). Номер доступа для HtrA1 мыши в базе UniProt-Q9R118. Как описано в данном документе, аминокислотные остатки huHtrA1 и muHtrA1 расположены согласно SEQ ID NO: 121 и SEQ ID NO: 155, соответственно. Аминокислотные положения отмечены с помощью однобуквенного кода обозначения аминокислот, с последующим их положением в SEQ ID NO: 121 или SEQ ID NO: 155 (см. Фиг. 29В). Как изображено на Фиг. 29А, зрелая последовательность HtrA1 человека содержит последовательность, начиная с глутамина в положении 23 SEQ ID NO: 121 и заканчивая пролином в положении 480 SEQ ID NO: 121, например, Q23-P480. Типичный фрагмент HtrA1 человека включает фрагмент, содержащий, состоящий по существу из или состоящий из аминокислот D161-K379. HtrA1 также известна в данной области техники как протеаза, сериновая, 11 (связывающая IGF) (PRSS11), ARMD7, HtrA и IGFBP5-протеаза.
Термин «HtrA1» также охватывает «вариант HtrA1», который означает активный полипептид HtrA1, обладающий по меньшей мере около 80% идентичностью аминокислотной последовательности с нативной последовательностью полипептида HtrA1, такой как SEQ ID NO: 121 или SEQ ID NO: 155. Как правило, вариант HtrA1 будет обладать по меньшей мере около 80% идентичностью аминокислотной последовательности или по меньшей мере около 85% идентичностью аминокислотной последовательности, или по меньшей мере около 90% идентичностью аминокислотной последовательности, или по меньшей мере около 95% идентичностью аминокислотной последовательности, или по меньшей мере около 98% идентичностью аминокислотной последовательности, или по меньшей мере около 99% идентичностью аминокислотной последовательности с нативной последовательностью HtrA1, например, SEQ ID NO: 121 или SEQ ID NO: 155.
Термин «антагонист связывания HtrA1» используется в самом широком смысле и включает любую молекулу, которая способна нейтрализовать, блокировать, частично или полностью ингибировать, подавлять, снижать или негативно влиять на биологическую активность HtrA1. Антагонисты связывания HtrA1 включают, без ограничений, антитела против HtrA1 и варианты таких антител, их антигенсвязывающие фрагменты, другие связывающие полипептиды, пептиды и непептидные малые молекулы, которые связываются с HtrA1, и они способны нейтрализовать, блокировать, частично или полностью ингибировать, подавлять, снижать или негативно влиять на активности HtrA1, такие как способность HtrA1 к расщеплению субстрата in vitro (например, субстрата H2-Opt или казеина) или in vivo (например, способность HtrA1 участвовать в патологическом процессе глазного нарушения (например, ВМД (например, географической атрофии)).
Термин «фактор D», как используется в данном документе, относится к полипептидам с нативной последовательностью и вариантам фактора D. Фактор D в данной области техники также известен как фактор D системы комплемента (CFD), проактиватор конвертазы С3, фактор D эстеразы пропердина и адипсин.
«Нативная последовательность фактора D» представляет собой полипептид с такой же аминокислотной последовательностью, что и у полипептида фактора D, полученного из природных источников, несмотря на его способ получения. Таким образом, нативную последовательность фактора D можно выделять из природных источников, или продуцировать с помощью рекомбинантных и/или синтетических способов. В дополнение к зрелому белку фактора D, такому как зрелый белок фактора D человека (см., например, эталонную последовательность NCBI NM_001928, SEQ ID NO: 126), термин «нативная последовательность фактора D» конкретно охватывает формы предшественника фактора D природного происхождения (например, неактивный препробелок, который протеолитически расщепляется с получением активной формы), формы вариантов природного происхождения (например, в альтернативном варианте сплайсированные формы) и аллельные варианты фактора D природного происхождения, а также структурные конформационные варианты молекул фактора D, обладающие той же аминокислотной последовательностью, что и полипептид фактора D, полученный из природных источников. Номер доступа для фактора D человека в базе UniProt-Р00746. Полипептиды фактора D не являющихся человеком животных, включающих высшие приматы и не являющихся человеком млекопитающих, специально включены в рамки данного определения.
Термин «вариант фактора D» означает активный полипептид фактора D, обладающий по меньшей мере около 80% идентичностью аминокислотной последовательности с нативной последовательностью полипептида фактора D (например, NM_001928, SEQ ID NO: 126). Как правило, вариант фактора D будет обладать по меньшей мере около 80% идентичностью аминокислотной последовательности или по меньшей мере около 85% идентичностью аминокислотной последовательности, или по меньшей мере около 90% идентичностью аминокислотной последовательности, или по меньшей мере около 95% идентичностью аминокислотной последовательности, или по меньшей мере около 98% идентичностью аминокислотной последовательности, или по меньшей мере около 99% идентичностью аминокислотной последовательности со зрелой аминокислотной последовательностью человека (например, NM_001928, SEQ ID NO: 126).
Термин «антагонист связывания фактора D» используется в самом широком смысле и включает любую молекулу, которая способна нейтрализовать, блокировать, частично или полностью ингибировать, подавлять, снижать или негативно влиять на биологическую активность фактора D. Антагонисты связывания фактора D включают, без ограничений, антитела против фактора D и варианты таких антител, их антигенсвязывающие фрагменты, другие связывающие полипептиды, пептиды и непептидные малые молекулы, которые связываются с фактором D, и они способны нейтрализовать, блокировать, частично или полностью ингибировать, подавлять, снижать или негативно влиять на активности фактора D, такие как способность фактора D участвовать в патологическом процессе глазного нарушения, связанного с системой комплемента.
Термин «антагонист VEGF (фактор эндотелия сосудов)», как используется в данном документе, относится к молекуле, способной к связыванию с VEGF, снижению уровней экспрессии VEGF или нейтрализации, блокированию, ингибированию, подавлению, снижению или негативному влиянию на биологические активности VEGF, включающие, но не ограничивающиеся ими, связывание VEGF с одним или более рецепторов VEGF, сигналинга VEGF и опосредованного VEGF ангиогенеза и выживаемости или пролиферации эндотелиальных клеток. Например, способная к нейтрализации, блокированию, ингибированию, подавлению, снижению или негативному влиянию на биологические активности VEGF молекула может проявлять свои эффекты путем связывания с одним или более рецепторами VEGF (VEGFR) (например, VEGFR1, VEGFR2, VEGFR3, мембраносвязанный рецептор VEGF (mbVEGFR), или растворимым рецептором VEGF (sVEGFR)). Включены, как антагонисты VEGF и используемые в способах по данному изобретению, полипептиды, которые специфически связываются с VEGF, антитела против VEGF и их антигенсвязывающие фрагменты, рецепторные молекулы и производные, которые специфически связываются с VEGF, тем самым блокируя его связывание с одним или более рецепторов, гибридные белки (например, VEGF-Trap (Regeneron)) и VEGF121-гелонин (Peregrine). Антагонисты VEGF также включают варианты антагонистов полипептидов VEGF, антисмысловые нуклеотидные олигомеры, комплементарные по меньшей мере фрагменту молекулы нуклеиновой кислоты, кодирующей полипептид VEGF; малые РНК, комплементарные по меньшей мере фрагменту молекулы нуклеиновой кислоты, кодирующей полипептид VEGF; рибозимы, для которых мишенью является VEGF; пептитела к VEGF и аптамеры VEGF. Антагонисты VEGF также включают полипептиды, которые связываются с VEGF, антитела против VEGFR и их антигенсвязывающие фрагменты и производные, которые связываются с VEGFR, тем самым блокируя, ингибируя, подавляя, снижая или негативно влияя на биологические активности VEGF (например, сигналинг VEGF), или гибридные белки. Антагонисты VEGF также включают непептидные малые молекулы, которые связываются с VEGF или VEGFR, и способны блокировать, ингибировать, подавлять, снижать или негативно влиять на биологические активности VEGF. Таким образом, термин «активности VEGF» конкретно включает опосредованные VEGF биологические активности VEGF. В определенных вариантах реализации изобретения антагонист VEGF снижает или ингибирует по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или более уровень экспрессии или биологической активности VEGF. В некоторых вариантах реализации изобретения VEGF ингибируется VEGF-специфическим антагонистом, являющимся VEGF (8-109), VEGF (1-109) или VEGF165.
Как используется в данном документе, антагонисты VEGF могут включать, но не ограничиваться ими, антитела против VEGFR2 и родственные молекулы (например, рамуцирумаб, тинибирумаб, афлиберцепт), антитела против VEGFR1 и родственные молекулы (например, икрукумаб, афлиберцепт (VEGF Trap-Eye; EYLEA®) и зив-афлиберцепт (VEGF Trap; ZALTRAP®)), биспецифические антитела к VEGF (например, МР-0250, вануцизумаб (VEGF-ANG2) и биспецифические антитела, описанные в US 2001/0236388), биспецифические антитела, включая комбинации двух антител против VEGF, с плечами против VEGFR1 и против VEGFR2, антител против VEGF (например, бевацизумаб, севацизумаб и ранибизумаб), и непептидные малые молекулы-антагонисты VEGF (например, пазопаниб, акситиниб, вандетаниб, стивагра, кабозантиниб, ленватиниб, нинтеданиб, орантиниб, телатиниб, довитиниг, цедираниб, мотесаниб, сульфатиниб, апатиниб, форетиниб, фамитиниб и тивозаниб).
Термины «антитело против VEGF», «антитело, которое связывается с VEGF» и «антитело, которое специфически связывает VEGF» относится к антителу, способному связывать VEGF с достаточной аффинностью, такой что указанное антитело можно использовать в качестве диагностического и/или терапевтического средства при целевом воздействии на VEGF. В одном варианте реализации изобретения степень связывания антитела против VEGF с нерелевантным белком, не являющимся VEGF, составляет менее около 10% связывания антитела к VEGF при измерении, например, методом радиоиммуноанализа (РИА). В некоторых вариантах реализации изобретения антитело, связывающееся с VEGF, имеет значение константы диссоциации (Kd)







В некоторых вариантах реализации изобретения антитело против VEGF можно применять в качестве терапевтического средства для целенаправленного воздействия и вмешательства в ход заболеваний или патологических состояний, в которые вовлечена активность VEGF. Кроме того, антитело можно подвергать другим анализам биологической активности, например, с целью оценки его эффективности как терапевтического средства. Такие анализы известны в данной области техники и зависят от антигена-мишени и планируемого применения антитела. Примеры включают анализ ингибирования HUVEC; анализы ингибирования роста опухолевых клеток (например, описанные в WO 89/06692); анализы антитело-зависимой клеточной цитотоксичности (АЗКЦ) и комплемент-опосредованной цитотоксичности (КЗЦ) (патент США №5500362); и анализы агонистической активности или кроветворения (см. WO 95/27062). Антитело против VEGF обычно не связывается с другими гомологами VEGF, например, VEGF-B или VEGF-C, и другими факторами роста, например, PIGF, PDGF или bFGF. В одном варианте реализации изобретения антитело против VEGF представляет собой моноклональное антитело, которое связывается с тем же эпитопом, что и моноклональное антитело против А4.6.1, продуцируемое гибридомой АТСС НВ 10709. В другом варианте реализации изобретения антитело против VEGF представляет собой рекомбинантное гуманизированное моноклональное антитело против VEGF, созданное в соответствии с Presta et al. (1997) Cancer Res. 57:4593-4599, включая, но ограничиваясь антителом, известным как бевацизумаб (BV; AVASTIN®).
Антитело против VEGF «ранибизумаб», также известное как «LUCENTIS®» или «rhuFab V2», представляет собой гуманизированный аффинно зрелый фрагмент Fab против VEGF человека. Ранибизумаб получают стандартными способами рекомбинантных технологий в экспрессионном векторе Escherichia coli и ферментацией бактерий. Ранибизумаб не является гликозилированным и имеет молекулярную массу ~ 48000 Дальтон. См. WO 98/45331 и US 2003/0190317. Дополнительные предпочтительные антитела включают антитела серии G6 или В20 (например, G6-31, В20-4.1), как описано в публикациях заявки РСТ № WO 2005/012359 и WO 2005/044853, каждая из которых полностью включена в данный документ путем ссылки. В отношении дополнительных предпочтительных антител см. патенты США №7060269, 6582959, 6703020; 6054297; W098/45332; WO 96/30046; WO94/10202; ЕР 0666868 В1; публикации патентных заявок США №2006009360, 20050186208, 20030206899, 20030190317, 20030203409 и 20050112126; и Popkov et al., Journal of Immunological Methods 288:149-164 (2004). Другие предпочтительные антитела включают антитела, связывающиеся с функциональным эпитопом на VEGF человека, содержащим остатки F17, М18, D19, Y21, Y25, Q89, I91, K101, Е103 и С104 или, в альтернативном варианте, содержащим остатки F17, Y21, Q22, Y25, D63, I83 и Q89. Дополнительные антитела против VEGF включают антитела против VEGF, описанные в публикации заявки по протоколу РСТ № WO 2009/155724.
Термин «антагонисты связывания IL-6» относится к молекуле, которая снижает, блокирует, ингибирует, подавляет или нарушает сигнальную трансдукцию, возникающую из-за взаимодействия IL-6 с одним или более его партнерами по связыванию, такими как рецептор интерлейкина-6 (IL-6R) (также называемый CD126) и/или gp130 (также называемый CD130). Типичные антагонисты связывания IL-6 включают, например, антагонисты против IL-6 (включая антитела против IL-6, например, EBI-031 (Eleven Biotherapeutics)) и антагонисты против IL-6R (включая антитела против IL-6R, например, тоцилизумаб (ACTEMRA®). «Малая молекула» определена в данном документе как имеющая молекулярную массу меньше около 600, предпочтительно меньше около 1000 Дальтон.
«Нарушение» представляет собой любое патологическое состояние, которое будет улучшено при лечении с помощью данного антитела. Этот термин охватывает хронические и острые нарушения или заболевания, включая те патологические состояния, которые увеличивают предрасположенность млекопитающего к рассматриваемому нарушению. Неограничивающие примеры нарушений, требующих лечения, в данном документе включают связанные с HtrA1 нарушения, глазные нарушения и/или нарушения, связанные с системой комплемента.
Термин «связанное с HtrA1 нарушение», как используется в данном документе, относится в самом широком смысле к любому нарушению или патологическому состоянию, связанному с анормальной экспрессией или активностями HtrA1. В некоторых вариантах реализации изобретения связанные с HtrA1 нарушения с избыточными уровнями HtrA1, при которых могут проявляться атипичные симптомы из-за уровней или активности HtrA1 локально (например, в глазе) и/или системно в организме. Типичные связанные с HtrA1 нарушения, включают связанные с HtrA1 нарушения, которые включают, например, возрастную макулярную дегенерацию (ВМД), включающую влажную (экссудативную) ВМД (включая раннюю, промежуточную и запущенную влажную ВМД) и сухую (неэкссудативную) ВМД (включая раннюю, промежуточную и запущенную сухую ВМД (например, географическую атрофию (ГА)), но не ограничиваются ими.
Как используется в данном документе, термин «глазное нарушение» включает, но не ограничивается ими, нарушения глаза, включающие макулярные дегенеративные заболевания, такие как возрастная макулярная дегенерация (ВМД), включающую влажную (экссудативную) ВМД (включая раннюю, промежуточную и запущенную влажную ВМД) и сухую (неэкссудативную) ВМД (включая раннюю, промежуточную и запущенную сухую ВМД (например, географическую атрофию (ГА)); диабетическую ретинопатию (DR) и другие связанные с ишемией ретинопатии; эндофтальмит; увеит; хориоидальную неоваскуляризацию (CNV); ретинопатию недоношенных (ROP); полипообразную хориоидальную васкулопатию (PCV); диабетический макулярный отек; патологическую миопию, болезнь Гиппеля-Линдау; гистоплазмоз глаза; окклюзию центральной вены сетчатки (CRVO); корнеальную васкуляризацию и ретинальную неоваскуляризацию. В некоторых вариантах реализации изобретения глазное нарушение представляет собой ВМД (например, ГА).
Термин «связанное с комплементом нарушение» используется в самом широком смысле и включает нарушения, связанные с избыточной или неконтролированной активацией комплемента. Они включают активацию комплемента во время операций сердечно-легочного шунтирования; активацию комплемента вследствие ишемии-реперфузии с последующим острым инфаркта миокарда, аневризмы, инсульта, геморрагического шока, повреждения при аварии, полиорганной недостаточности, гипоболемического шока, кишечной ишемии или других событий, вызывающих ишемию. Показано, что активация комплемента может быть связана с воспалительными патологическими состояниями, такими как тяжелые ожоги, эндотоксемия, септический шок, синдром острой дыхательной недостаточности у взрослых, гемодиализ; анафилактический шок, тяжелая астма, ангиоэдема, болезнь Крона, серповидноклеточная анемия, постстрептококковый гломерулонефрит и панкреатит. Нарушение может быть результатом неблагоприятной побочной реакции на лекарственное средство, аллергией на лекарственное средство, индуцированным IL-2 синдромом пропотевание жидкости через сосуды или аллергией на контрастную среду для рентгенографии. Оно также включает аутоиммунное заболевание, такое как системная красная волчанка, тяжелая миастения, ревматоидный артрит, болезнь Альцгеймера и множественный склероз. Активация комплемента также связана с реакцией отторжения трансплантата. Активация комплемента также связана с глазными нарушениями, такими как связанные с комплементом глазные нарушения.
Термин «связанное с комплементом глазное нарушение» используется в самом широком смысле и включает все состояния глаз, при патологии которых вовлекается комплемент, включая классический и альтернативный пути, и в частности альтернативный путь активации комплемента. Связанные с комплементом глазные нарушения включают, без ограничений, макулярные дегенеративные заболевания, такие как все стадии возрастной макулярной дегенерации (ВМД), хориоидальную неоваскуляризацию (CNV), увеит, диабетическую и другие связанные с ишемией ретинопатии, эндофтальмит, увеит и другие внутриглазные неоваскулярные заболевания, такие как диабетический макулярный отек; патологическую миопию, болезнь Гиппеля-Линдау; гистоплазмоз глаза; окклюзию центральной вены сетчатки (CRVO); корнеальную васкуляризацию и ретинальную неоваскуляризацию. В одном примере ВМД включает влажную ВМД (включая раннюю, промежуточную и запущенную влажную ВМД) и сухую ВМД (включая раннюю, промежуточную и запущенную сухую ВМД (например, географическую атрофию (ГА)). В дополнительном примере сухая (неэкссудативная) ВМД может включать присутствие твердых друз, мягких друз, географической атрофии и/или перераспределения пигмента. Легкая ВМД может включать, например, множество от малых до одной или более необширных друз среднего размера. Промежуточная ВМД может включать, например, от обширной друзы среднего размера до одной или более крупных друз. См., например, Ferris et al., AREDS Report No. 18; Sallo et al., Eye Res, 34(3):238-40,2009; Jageret al., New Engl. J. Med., 359(1):1735, 2008. В дополнительном примере промежуточная сухая ВМД может включать большие сливающиеся друзы. В дополнительном примере географическая атрофия может включать потерю фоторецептрного и/или пигментированного эпителия сетчатки (RPE). В дополнительном примере область географической атрофии может быть малой или большой и/или может находится в области желтого пятна или в периферической сетчатке. В одном примере связанное с комплементом глазное нарушение представляет собой промежуточную сухую ВМД. В одном примере связанное с комплементом глазное нарушение представляет собой географическую атрофию. В одном примере связанное с комплементом глазное нарушение представляет собой влажную ВМД (например, хориоидную неоваскуляризацию (CNV)).
Вышеприведенные перечни не является всеобъемлющими и должно быть понятно, что заболевание или нарушение может попадать в различные категории. Например, в некоторых случаях ВМД может оказываться в категории связанного с HtrA1 нарушения, глазного нарушения и связанного с комплементом нарушения.
Как используется в данном документе, термин «введение» означает способ предоставления субъекту дозировки соединения (например, антитела против HtrA1 по данному изобретению, нуклеиновой кислоты, кодирующей антитело против HtrA1 по данному изобретению) или композиции (например, фармацевтической композиции, например, фармацевтической композиции, содержащей антитело против HtrA1 по данному изобретению). Композиции, используемые в способах, описанных в данном документе, можно вводить, например, в стекловидное тело (например, интравитреальной инъекцией), окулярно (например, глазной инъекцией), внутрь глаза (например, внутриглазной инъекцией), около склеры (например, околосклеральной инъекцией), в субтеноновое пространство (например, субтеноновой инъекцией), в супрахориоидальное пространство (например, супрахориоидальной инъекцией), местно (например, с глазными каплями), внутримышечно, внутривенно, внутрикожно, чрезкожно, внутриартериально, внутрибрюшинно, внутриочагово, интракраниально, внутрисуставно, внутрь простаты, внутриплеврально, интратрахеально, интратекально, назально, вагинально, ректально, внутрь опухоли, в брюшину, подкожно, субконъюнктивально, внутрь мочевого пузыря, через слизистую оболочку, интраперикардиально, внутрь пуповины, интраорбитально, перорально, трансдермально, путем ингаляции, путем инъекции, путем имплантации, путем инфузии, путем непрерывной инфузии, путем непосредственного омывания клеток-мишеней при локализованной перфузии, с помощью катетера, путем промывания, в кремах или в липидных композициях. Композиции, используемые в способах, описанных в настоящем документе, можно также вводить системно или локально. Способ введения может изменяться в зависимости от различных факторов (например, соединения или композиции для введения, степени тяжести подлежащего лечению патологического состояния, заболевания или нарушения). В конкретных вариантах реализации изобретения антитела, описанные в данном документе (например, антитела против HtrA1, антитела против фактора D и антитела против HtrA1/фактора D) вводят интравитреальной инъекцией.
Введение «в комбинации с» одним или более дополнительными терапевтическими средствами включает одновременное (совместное) и последовательное введение в любом порядке.
Термин «доставка с длительным действием», «замедленное высвобождение» и «контролируемое высвобождение» обычно используют для описания механизма доставки с использованием состава, лекарственной формы, устройства или других типов технологий для достижения пролонгированного или продленного высвобождения или биодоступности терапевтического средства (например, антитела по данному изобретению).
Он может относиться к технологиям, предоставляющим пролонгированное или продленное высвобождение или биодоступность лекарственного средства для общего системного кровотока или субъекта, или локальных мест воздействия в организме субъекта, включающих, но ограничивающихся ими, клетки, ткани, органы, суставы, области и т.п. Кроме того, эти термины могут относиться к технологии, используемой для пролонгирования или продления высвобождения лекарственного средства из состава или лекарственной формы, или они могут относиться к технологии, используемой для продления или пролонгирования биодоступности или фармакокинетических параметров, или длительности воздействия лекарственного средства на организм субъекта, или они могут относится к технологии, которая относится к продлению или пролонгированию фармакодинамического действия, вызванного составом.
«Состав длительного действия», «состав с замедленным высвобождением» или «состав с контролируемым высвобождением» представляет собой фармацевтический состав, лекарственную форму или другую технологию, используемую для обеспечения доставки длительного действия. В одном аспекте изобретения контролируемое высвобождение используют для улучшения местной биодоступности терапевтического средства, особенно времени удержания внутри глаза в контексте окулярной доставки. «Увеличенное время удержания внутри глаза» относится к периоду после доставки, в продолжение которого доставленное в глаз лекарственное средство остается эффективным как в понятиях качества (например, активность), так и в понятиях количества (например, эффективное количество). В дополнение к этому или вместо введения высокой дозы или контролируемого высвобождения для достижения увеличения периода полувыведения in vivo лекарственное средство можно модифицировать после трансляции, например, посредством ПЭГилирования.
«Эффективное количество» средства, например фармацевтического состава, относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения требуемого терапевтического или профилактического результата.
«Индивид» или «субъект» представляет собой млекопитающее. Млекопитающие включают, но не ограничиваются ими, одомашненных животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и приматов, не являющихся людьми, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). В некоторых вариантах реализации изобретения индивид или субъект является человеком. «Субъект» может быть «пациентом».
Термин «вкладыш в упаковку» используется по отношению к инструкциям, которые обычно вкладывают в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, комбинированной терапии, противопоказаниях и/или предупреждениях, касающихся применения таких терапевтических продуктов.
Термин «фармацевтически приемлемый носитель» относится к ингредиенту фармацевтического состава, отличающемуся от активного ингредиента, который является нетоксичным для субъекта. Фармацевтически приемлемый носитель включает буфер, наполнитель, стабилизатор или консервант, но не ограничивается ими.
Термин «фармацевтический состав» относится к препарату, который находится в такой форме, чтобы обеспечивать эффективную биологическую активность активного ингредиента, содержащегося в нем, и не содержит дополнительных компонентов, являющихся неприемлемо токсичными для субъекта, которому композиция должна быть введена.
Как используется в данном документе, термин «лечение» (и его грамматические варианты, например, «лечить») относится к клиническому вмешательству с попыткой изменить естественный ход заболевания, подвергаемого лечению, и может осуществляться либо для профилактики, либо в ходе клинической патологии. Желательные эффекты лечения включают предупреждение частоты или повторного проявления болезни или нарушения, облегчение симптомов, уменьшение любых прямых или опосредованных патологических последствий заболевания или нарушения, уменьшение скорости прогрессирования болезни, улучшение или временное облегчение состояния заболевания или нарушения и ремиссию или улучшение прогноза, но не ограничиваются ими. В некоторых вариантах реализации антитела по данному изобретению используют для задержки развития заболевания или нарушения, или для замедления прогрессирования заболевания или нарушения. В некоторых примерах нарушение представляет собой связанное с HtrA1 нарушение, глазное нарушение и/или связанное с комплементом нарушение, например ВМД (например, ГА).
«Выделенная» молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, которая идентифицирована и отделена от по меньшей мере одной молекулы загрязняющей нуклеиновой кислоты, с которой она обычно связана в природном источнике данной нуклеиновой кислоты. Выделенная молекула нуклеиновой кислоты отличается по форме или структуре, в которой она обнаружена в природе. Поэтому выделенные молекулы нуклеиновых кислот отличаются от молекулы нуклеиновой кислоты, существующей в природных клетках. Тем не менее выделенная молекула нуклеиновой кислоты включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно экспрессируют антитело, в которых, например, молекула нуклеиновой кислоты находится в участке хромосомы, отличающемся от такого положения в природных клетках.
Термин «регуляторные последовательности» относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине. Последовательности контроля, пригодные для прокариот, например, содержат промотор, необязательно операторную последовательность и участок связывания рибосом. Известно, что в эукариотических клетках применяются промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота является «функционально связанной», если она вступает в функциональное взаимоотношение с другой последовательностью нуклеиновой кислоты. Например, ДНК предпоследовательности или секреторного лидера является функционально связанной с ДНК полипептида, если она экспрессируется как пребелок, принимающий участие в секреции этого полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию этой последовательности, или участок связывания рибосом функционально связан с кодирующей последовательностью, если он расположен так, чтобы способствовать процессу трансляции. В целом, «функционально связанный» означает, что последовательности ДНК, будучи связанными, являются непрерывными и, в случае наличия секреторного лидера, непрерывными и находятся в фазе считывания. Тем не менее, энхансеры не обязательно должны быть непрерывными. Связывание сопровождается лигированием по подходящим участкам рестрикции. Если таких участков нет, то в соответствии с традиционной практикой применяются синтетические олигонуклеотидные адапторы или линкеры.
Как используются в данном документе, выражения «клетка», «линия клеток» и «культура клеток» применяются взаимозаменяемо, и все такие обозначения включают потомство. Таким образом, слова «трансформанты» и «трансформированные клетки» включают первичную клетку субъекта и полученные из нее культуры, независимо от количества пассажей. Также понятно, что все потомство не может быть точно идентичным по содержанию ДНК из-за преднамеренных или непреднамеренных мутаций. В объем описания включено мутантное потомство, обладающее такой же функцией или биологической активностью по результатам скрининга, что и исходно трансформированная клетка. Если предполагаются отличающиеся обозначения, то это будет ясно из контекста.
Как используется в данном документе, термин «библиотека» относится к множеству последовательностей антител или фрагментов антител (например, антител против HtrA1 по данному изобретению) или нуклеиновым кислотам, которые кодируют эти последовательности, причем последовательности отличаются по комбинации вариантов аминокислот, которые введены в данные последовательности, например, как описано в данном документе.
«Мутация» представляет собой делецию, вставку или замену нуклеотида(-ов) относительно эталонной нуклеотидной последовательности, такой как последовательность дикого типа.
Как используется в данном документе, «кодонный набор» относится к набору разных последовательностей нуклеотидных триплетов, используемых для кодирования требуемых вариантов аминокислот. Набор олигонуклеотидов можно синтезировать, например, методом твердофазного синтеза, включая последовательности, которые представляют все возможные комбинации нуклеотидных триплетов, обеспечиваемых кодонным набором, и которые будут кодировать требуемую группу аминокислот. Стандартная форма обозначения кодонов соответствует коду, установленному МБС (Международным биохимическим союзом), который известен в данной области техники. Как правило, кодонный набор представлен 3 заглавными буквами курсивом, например, NNK, NNS, XYZ, DVK и т.п. Синтез олигонуклеотидов с выбранной нуклеотидной «вырожденностью» в определенных положениях хорошо известен в данной области техники, например, при использовании подхода TRIM (Knappek et al., J. Mol. Biol. 296:57-86,1999; Garrard et al., Gene 128:103, 1993). Такие наборы олигонуклеотидов, имеющие определенные кодонные наборы, можно синтезировать с использованием коммерческих синтезаторов нуклеиновых кислот (доступных, например, в компании Applied Biosystems, г. Фостер Сити, штат Калифорния, США) или их можно получать коммерческим заказом (например, из компании Life Technologies, г. Роквилл, штат Мэриленд, США). Поэтому, набор олигонуклеотидов, синтезированный с конкретным кодонным набором, как правило, будет содержать множество олигонуклеотидов с разными последовательностями, причем отличия определяются кодонным набором в пределах всей последовательности. Олигонуклеотиды, используемые в соответствии сданным изобретением, имеют последовательности, которые допускают гибридизацию с нуклеотидной матрицей вариабельного домена и также могут, но не обязательно, содержать сайты для ферментов рестрикции, например в целях проведения клонирования.
«Фаговый дисплей» представляет собой методику, с помощью которой полипептиды отображаются в виде гибридных белков с по меньшей мере частью белка оболочки на поверхности фаговых, например нитчатого фага, частиц. Полезность фагового дисплея заключается в том факте, что большие библиотеки рандомизированных белковых вариантов можно быстро и эффективно сортировать на наличие последовательностей, связывающихся с антигеном-мишенью с высокой аффинностью. Отображение пептидных и белковых библиотек на фаге используют для скрининга миллионов полипептидов на наличие тех, которые обладают свойствами специфического связывания. Методы с поливалентными фаговыми дисплеями используют для отображения малых случайных пептидов и малых белков посредством слияний либо с геном III, либо с геном VIII нитчатого фага. См., например, Wells et al., Curr. Opin. Struct. Biol., 3:355-362, 1992, и цитируемые в данном документе ссылки. В моновалентом фаговом дисплее белковую или пептидную библиотеку гибридизируют с геном III или его частью и экспрессируют его на низких уровнях в присутствии белка гена III дикого типа, так что фаговые частицы отображают одну копию или ни одного из гибридных белков. Влияния авидности снижаются относительно поливалентного фага, так что сортировка происходит на основе внутренней аффинности лигандов, и используются фагмидные векторы, которые упрощают манипуляции с ДНК. См., например, Lowman et al., Methods: A companion to Methods in Enzymology, 3:205-216, 1991.
«Вариант» или «мутант» исходного или эталонного полипептида (например, эталонного антитела или его вариабельного (-ых) домена (-ов)/HVR), представляет собой полипептид, который (1) имеет аминокислотную последовательность, отличающуюся от последовательности исходного или эталонного полипептида и (2) получен из исходного или эталонного полипептида посредством либо природного или искусственного (выполненного человеком) мутагенеза. Такие варианты включают, например, делеции и/или вставки и/или замены остатков в аминокислотной последовательности интересующего полипептида, называемые в данном документе «изменениями аминокислотных остатков». Таким образом, вариант HVR относится к HVR, содержащему вариант последовательности относительно исходной или эталонной полипептидной последовательности (такой как последовательность исходного антитела или антигенсвязывающего фрагмента). В данном контексте, изменение аминокислотного остатка относится к аминокислоте, отличающейся от аминокислоты в соответствующем положении в исходной или эталонной полипептидной последовательности (такой как последовательность эталонного антитела или его антигенсвязывающего фрагмента). Для получения варианта или мутанта конструкции можно внести любую комбинацию делеций, вставок и замен при условии, что конечная конструкция обладает требуемыми функциональными характеристиками. Аминокислотные изменения также могут изменять посттрансляционные процессы в отношении полипептида, такие как изменение количества или положения сайтов гликозилирования.
Последовательность «дикого типа (ДТ)» или «эталонная» последовательность, или последовательность белка/полипептида «дикого типа» или «эталонная» последовательность белка/полипептида, такая как HVR или вариабельный домен эталонного антитела, может быть эталонной последовательностью, из которой получают варианты полипептидов посредством введения мутаций. В общем, последовательность «дикого типа» для данного белка представляет собой последовательность, которая наиболее распространена в природе. Сходным образом, последовательность гена «дикого типа» представляет собой последовательность для такого гена, который чаще всего обнаруживается в природе. Мутации можно вводить в ген «дикого типа» (и таким образом в кодированный им белок) либо посредством природных процессов, либо посредством созданных человеком средств. Продуктами таких процессов являются «вариантные» или «мутантные» формы исходного белка или гена «дикого типа».
Как используется в данном документе, «эталонное антитело» относится к антителу или его фрагменту, антигенсвязывающая последовательность которого служит в качестве матричной последовательности, на которой выполняется диверсификация в соответствии с критериями, описанными в данном документе. Антигенсвязывающая последовательность, в целом, включает вариабельный участок антитела, предпочтительно по меньшей мере одного HVR, предпочтительно включая каркасную область.
Термин «обогащенный», как используется в данном документе, означает, что объект (например, изменение аминокислотного остатка) присутствует в отсортированной библиотеке с большей частотой, по сравнению с соответствующей эталонной библиотекой (например, неотсортированной библиотекой или библиотекой, которая отсортирована по другому или нерелевантному антигену). И наоборот, термин «истощенный» означает, что объект (например, изменение аминокислотного остатка) присутствует в отсортированной библиотеке с меньшей частотой, по сравнению с соответствующей эталонной библиотекой (например, неотсортированной библиотекой или библиотекой, которая отсортирована по другому или нерелевантному антигену). Термин «нейтральный», при применении по отношению к методам идентификации вариантов аминокислотных остатков, означает, что объект не является ни обогащенным, ни истощенным, другими словами, он присутствует в отсортированной библиотеке приблизительно с той же частотой, по сравнению с соответствующей эталонной библиотекой (например, неотсортированной библиотекой или библиотекой, которая отсортирована по другому или нерелевантному антигену).
Термином «изоэлектрическая точка (pI)» обозначают значение рН, при котором молекула (например, такой белок, как антитело) не несет чистого электрического заряда, оно также называется в данной области техники как рН(I) или IEP.
II. КОМПОЗИЦИИ И СПОСОБЫ
В изобретении предложены новые антитела, которые связываются с HtrA1, и способы создания и использования таких антител, например, для терапевтического и диагностического применения. Антитела по данному изобретению применимы, например, для диагностики или лечения различных нарушений, включая связанные с HtrA1 нарушения, глазные нарушения и/или связанные с комплементом нарушения, включая возрастную макулярную дегенерацию (например, географическую атрофию).
А. Типичные антитела против HtrA1
В одном аспекте изобретение частично основано на антителах, специфически связывающихся с HtrA1. Антитела по данному изобретению применимы, например, для лечения или диагностики нарушений, включая связанные с HtrA1 нарушения, глазные нарушения и/или связанные с комплементом нарушения, включая возрастную макулярную дегенерацию (например, географическую атрофию).
В изобретении предложены выделенные антитела, способные специфически связываться с HtrA1. В некоторых случаях HtrA1 является человеческим HtrA1 (huHtrA1). В других случаях HtrA1 является мышиным HtrA1 (muHtrA1). В определенных случаях антитело против HtrA1 по данному изобретению специфически связывает huHtrA1 с KD равной 100 нМ или ниже (например, 100 нМ или ниже, 10 нМ или ниже, 5 нМ или ниже, 2,5 нМ или ниже, 1 нМ или ниже, 100 пМ или ниже, 10 пМ или ниже, 1 пМ или ниже или 0,1 пМ или ниже). Например, в определенных случаях антитело против HtrA1 по данному изобретению специфически связывает huHtrA1 с KD равной 1 нМ или ниже (например, 1 нМ или ниже, 900 пМ или ниже, 800 пМ или ниже, 700 пМ или ниже, 600 пМ или ниже, 550 пМ или ниже, 500 пМ или ниже, 400 пМ или ниже, 300 пМ или ниже, 200 пМ или ниже, 150 пМ или ниже, 125 пМ или ниже, 100 пМ или ниже, 75 пМ или ниже, 50 пМ или ниже, 25 пМ или ниже или 1 пМ или ниже). В некоторых случаях антитело против HtrA1 связывает huHtrA1 с KD между около 40 пМ и около 700 пМ (например, между около 40 пМ и около 700 пМ, между около 40 пМ и около 600 пМ, между около 40 пМ и около 550 пМ, между около 40 пМ и около 500 пМ, между около 40 пМ и около 400 пМ, между около 40 пМ и около 300 пМ, между около 40 пМ и около 250 пМ, между около 50 пМ и около 200 пМ, между около 50 пМ и около 175 пМ, между около 50 пМ и около 150 пМ, между около 50 пМ и около 125 пМ, между около 70 пМ и около 125 пМ или между около 50 пМ и около 125 пМ). В некоторых случаях антитело против HtrA1 связывает huHtrA1 с KD около 110 пМ. В некоторых случаях антитело против HtrA1 связывает huHtrA1 с KD около 60 пМ. Любое из предыдущих значений KD может представлять аффинность связывания антитела против HtrA1 по данному изобретению (например, Fab антитела против HtrA1 по данному изобретению) с протеазным доменом (PD) huHtrA1 (huHtrA1-PD), например, как измерено с использованием поверхностного плазмонного резонанса BIACORE®, например, как описано в данном документе.
В некоторых случаях антитело против HtrA1 по данному изобретению способно ингибировать активность HtrA1. В некоторых случаях антитело ингибирует активность протеазного домена huHtrA1-PD с 50% ингибирующей концентрацией (IC50) равной 10 нМ или ниже (например, 10 нМ или ниже, 5 нМ или ниже, 2 нМ или ниже, 1,5 нМ или ниже, 1 нМ или ниже, 900 пМ или ниже, 800 пМ или ниже, 700 пМ или ниже, 600 пМ или ниже, 500 пМ или ниже, 400 пМ или ниже, 300 пМ или ниже, 200 пМ или ниже, 100 пМ или ниже, 50 пМ или ниже или 1 пМ или ниже). В некоторых случаях антитело против HtrA1 ингибирует активность huHtrA1-PD с IC50 между около 0,25 нМ и около 1 нМ (например, между около 0,25 нМ и около 1 нМ, между около 0,25 нМ и около 0,9 нМ, между около 0,25 нМ и около 0,8 нМ, между около 0,25 нМ и около 0,7 нМ, между около 0,25 нМ и около 0,6 нМ, между около 0,25 нМ и около 0,5 нМ или между около 0,25 нМ и около 0,4 нМ). В некоторых случаях антитело против HtrA1 ингибирует активность huHtrA1-PD с IC50 равной около 0,3 нМ. В любом из предыдущих случаев ингибирующую активность можно измерять в анализе блокирования in vitro на основе FRET. В некоторых случаях анализ блокирования in vitro на основе FRET включает расщепление зонда H2-Opt (например, (Mca)IRRVSYSF(Dnp)KK (SEQ ID NO: 152). В любом из предыдущих случаях значение IC50 может основываться на способности антитела против HtrA1 в бивалентной форме (например, форме IgG) ингибировать активность huHtrA1-PD.
Изобретение также охватывает выделенное антитело, которое специфически связывается с эпитопом HtrA1, причем эпитоп HtrA1 содержит по меньшей мере одну аминокислоту белка HtrA1, выбранную из группы, состоящей из Arg190, Leu192, Pro193, Phe194 и Arg197, где нумерация аминокислот соответствует нумерации белка-предшественника HtrA1 человека. В одном варианте реализации изобретения белок-предшественник HtrA1 человека имеет последовательность SEQ ID NO: 121. В одном варианте реализации изобретения эпитоп HtrA1 содержит по меньшей мере одну аминокислоту белка HtrA1, выбранную из группы, состоящей из Leu192, Pro193 и Arg197. В одном варианте реализации изобретения эпитоп HtrA1 содержит по меньшей мере две аминокислоты белка HtrA1, выбранные из группы, состоящей из Leu192, Pro193 и Arg197. В конкретном варианте реализации изобретения эпитоп HtrA1 содержит аминокислоты HtrA1 Leu192, Pro193 и Arg197. В другом варианте реализации изобретения эпитоп HtrA1 содержит аминокислоты HtrA1 Arg190, Leu192, Pro193 и Arg197. В дополнительном варианте реализации изобретения эпитоп HtrA1 содержит аминокислоты HtrA1 Arg190, Leu192, Pro193, Phe194 и Arg197.
В некоторых вариантах реализации изобретения антитело против HtrA1 при связывании с HtrA1 расположено на расстоянии 4 ангстрема или меньше от одной или более аминокислот Arg190, Leu192, Pro193, Phe194 и Arg197. В некоторых вариантах реализации изобретения расстояние между антителом и одной или более аминокислот определяют методом кристаллографии, например, с использованием методов кристаллографии, описанных в примерах.
В некоторых случаях антитело против HtrA1 может содержать по меньшей мере один, два, три, четыре, пять или шесть гипервариабельных участков (HVR), выбранных из: (a) HVR-H1, содержащего аминокислотную последовательность DSEX1H (SEQ ID NO: 1), где X1 представляет собой Met или Leu; (b) HVR-H2, содержащего аминокислотную последовательность GVDPETX2GAAYNQKFKG (SEQ ID NO: 2), где Х2 представляет собой Glu или Asn; (с) HVR-H3, содержащего аминокислотную последовательность GYDYDYALDY (SEQ ID NO: 3); (d) HVR-L1, содержащего аминокислотную последовательность RASSSVX3FIH (SEQ ID NO: 4), где Х3 представляет собой Glu или Asn; (е) HVR-L2, содержащего аминокислотную последовательность ATSX4LAS (SEQ ID NO: 5), где Х4 представляет собой Asn, His или Glu; и (f) HVR-L3, содержащего аминокислотную последовательность QQWX5SX6PWT (SEQ ID NO: 6), где X5 представляет собой Ser или Tyr, а Х6 представляет собой Ala или Asn, или комбинацию из одного или более вышеприведенных HVR и одного или более их вариантов, обладающих по меньшей мере 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью) с любой из SEQ ID NO: 1-6.
Например, антитело против HtrA1 может содержать по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из: (a) HVR-H1, содержащего аминокислотную последовательность DSEMH (SEQ ID NO: 7); (b) HVR-H2, содержащего аминокислотную последовательность GVDPETEGAAYNQKFKG (SEQ ID NO: 8); (с) HVR-H3, содержащего аминокислотную последовательность GYDYDYALDY (SEQ ID NO: 3); (d) HVR-L1, содержащего аминокислотную последовательность RASSSVEFIH (SEQ ID NO: 9); (e) HVR-L2, содержащего аминокислотную последовательность ATSNLAS (SEQ ID NO: 10); и (f) HVR-L3, содержащего аминокислотную последовательность QQWSSAPWT (SEQ ID NO: 11), или комбинацию из одного или более вышеприведенных HVR и одного или более их вариантов, обладающих по меньшей мере 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью) с любой из SEQ ID NO: 3 или 7-11.
В некоторых случаях любое из предыдущих антител против HtrA1 может содержать один, два, три или четыре следующих каркасных участка (FR) вариабельных доменов тяжелой цепи (VH): (a) FR-H1, содержащий аминокислотную последовательность EVQLVQSGAEVKKPGASVKVSCKASGYX1FX2 (SEQ ID NO: 12), где X1 представляет собой Lys или Thr, а Х2 представляет собой Thr, Lys или Arg; (b) FR-H2, содержащий аминокислотную последовательность WVRQAPGQGLEWIG (SEQ ID NO: 13); (с) FR-H3, содержащий аминокислотную последовательность RATITRDTSTSTAYLELSSLRSEDTAVYYCTR (SEQ ID NO: 14); и (d) FR-H4, содержащий аминокислотную последовательность WGQGTLVTVSS (SEQ ID NO: 15).
В некоторых случаях любое из предыдущих антител против HtrA1 может содержать один, два, три или четыре следующих FR вариабельных доменов легкой цепи (VL): (a) FR-L1, содержащий аминокислотную последовательность DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17); (b) FR-L2, содержащий аминокислотную последовательность WYQQKPGKAPKPLIS (SEQ ID NO: 18); (c) FR-L3, содержащий аминокислотную последовательность GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 19); и (d) FR-L4, содержащий аминокислотную последовательность FGQGTKVEIK (SEQ ID NO: 20).
Например, в некоторых случаях антитело против HtrA1 содержит следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность DSEMH (SEQ ID NO: 7); (b) HVR-H2, содержащий аминокислотную последовательность GVDPETEGAAYNQKFKG (SEQ ID NO: 8); и (с) HVR-H3, содержащий аминокислотную последовательность GYDYDYALDY (SEQ ID NO: 3); (d) HVR-L1, содержащий аминокислотную последовательность RASSSVEFIH (SEQ ID NO: 9); (e) HVR-L2, содержащий аминокислотную последовательность ATSNLAS (SEQ ID NO: 10); и (f) HVR-L3, содержащий аминокислотную последовательность QQWSSAPWT (SEQ ID NO: 11). В некоторых случаях антитело против HtrA1 содержит следующие четыре FR вариабельных доменов тяжелой цепи: (a) FR-H1, содержащий аминокислотную последовательность EVQLVQSGAEVKKPGASVKVSCKASGYKFT (SEQ ID NO: 16); (b) FR-H2, содержащий аминокислотную последовательность WVRQAPGQGLEWIG (SEQ ID NO: 13); (с) FR-H3, содержащий аминокислотную последовательность RATITRDTSTSTAYLELSSLRSEDTAVYYCTR (SEQ ID NO: 14); и (d) FR-H4, содержащий аминокислотную последовательность WGQGTLVTVSS (SEQ ID NO: 15). В дополнительных случаях антитело против HtrA1 содержит следующие четыре FR вариабельных доменов легкой цепи: (a) FR-L1, содержащий аминокислотную последовательность DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17); (b) FR-L2, содержащий аминокислотную последовательность WYQQKPGKAPKPLIS (SEQ ID NO: 18); (c) FR-L3, содержащий аминокислотную последовательность GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 19); и (d) FR-L4, содержащий аминокислотную последовательность FGQGTKVEIK (SEQ ID NO: 20). В некоторых случаях антитело против HtrA1 содержит (а) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 21, и (b) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 22. В некоторых случаях антитело против HtrA1 представляет собой APEG.LC3.HC3.
В другом примере, в некоторых случаях, антитело против HtrA1 содержит следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность DSEMH (SEQ ID NO: 7); (b) HVR-H2, содержащий аминокислотную последовательность GVDPETDGAAYNQKFKG (SEQ ID NO: 123); и (с) HVR-H3, содержащий аминокислотную последовательность GYDYDYALDY (SEQ ID NO: 3); (d) HVR-L1, содержащий аминокислотную последовательность RASSSVNFIH (SEQ ID NO: 124); (e) HVR-L2, содержащий аминокислотную последовательность ATSNLAS (SEQ ID NO: 10); и (f) HVR-L3, содержащий аминокислотную последовательность QQWSSAPWT (SEQ ID NO: 125). В некоторых случаях антитело против HtrA1 содержит следующие четыре FR вариабельных доменов тяжелой цепи: (a) FR-H1, содержащий аминокислотную последовательность QVQLQQSGAELVRPGASVTLSCKASGYTFT (SEQ ID NO: 25); (b) FR-H2, содержащий аминокислотную последовательность WVKQTPVHGLEWIG (SEQ ID NO: 26); (с) FR-H3, содержащий аминокислотную последовательность KATLTADKSSSTAYMELRSLTSEDSAVYYCTR (SEQ ID NO: 27); и (d) FR-H4, содержащий аминокислотную последовательность WGQGTSVTVSS (SEQ ID NO: 28). В дополнительных случаях антитело против HtrA1 содержит следующие четыре FR вариабельных доменов легкой цепи: (a) FR-L1, содержащий аминокислотную последовательность NIVVTQSPASLAVSLGQRATISC (SEQ ID NO: 29); (b) FR-L2, содержащий аминокислотную последовательность WYQQKPGQPPKLLIY (SEQ ID NO: 30); (с) FR-L3, содержащий аминокислотную последовательность GVPARFSGSGSRTDFTLTIDPVEADDAATYYC (SEQ ID NO: 31); и (d) FR-L4, содержащий аминокислотную последовательность FGGGTKLEIK (SEQ ID NO: 32). В некоторых случаях антитело против HtrA1 содержит (а) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 23, и (b) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 24. В некоторых случаях антитело против HtrA1 представляет собой 15Н6 (также называемое m15Н6).
В другом примере антитело против HtrA1 может содержать по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из: (a) HVR-H1, содержащего аминокислотную последовательность SYIMS (SEQ ID NO: 39); (b) HVR-H2, содержащего аминокислотную последовательность YISNGGGTTYYSDTIKG (SEQ ID NO: 40); (с) HVR-H3, содержащего аминокислотную последовательность QNFRSDGSSMDY (SEQ ID NO: 41); (d) HVR-L1, содержащего аминокислотную последовательность RASESVDSYGKSFMH (SEQ ID NO: 42); (e) HVR-L2, содержащего аминокислотную последовательность LASKLES (SEQ ID NO: 43); и (f) HVR-L3, содержащего аминокислотную последовательность QQNNEDPYT (SEQ ID NO: 44), или комбинацию из одного или более вышеприведенных HVR и одного или более их вариантов, обладающих по меньшей мере 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью) с любой из SEQ ID NO: 39-44.
В некоторых случаях любое из предыдущих антител против HtrA1 может содержать один, два, три или четыре следующих FR вариабельных доменов тяжелой цепи: (a) FR-H1, содержащий аминокислотную последовательность EVQLVESGGGLVQPGGSLRLSCAASGFTFS (SEQ ID NO: 47) или EVKLVESGGGLVEPGGSLKLACVASGFTFS (SEQ ID NO: 57); (b) FR-H2, содержащий аминокислотную последовательность WVRQAPGKGLEWVA (SEQ ID NO: 48) или WVRQTPEKRLEWVA (SEQ ID NO: 58); (c) FR-H3, содержащий аминокислотную последовательность RFTISRDNSKNTLYLQMNSLRAEDTAVYYCAR (SEQ ID NO: 49) или RFTISRDNAKNTLYLQMSTLKSEDTAIYFCAR (SEQ ID NO: 59); и (d) FR-H4, содержащий аминокислотную последовательность WGQGTLVTVSS (SEQ ID NO: 50) или WGQGTAVTVSS (SEQ ID NO: 60).
В некоторых случаях любое из предыдущих антител против HtrA1 может содержать один, два, три или четыре следующих FR вариабельных доменов легкой цепи: (a) FR-L1, содержащий аминокислотную последовательность DIVMTQSPDSLAVSLGERATINC (SEQ ID NO: 51) или NIVVTQSPASLAVSLGQRATISC (SEQ ID NO: 61); (b) FR-L2, содержащий аминокислотную последовательность WYQQKPGQPPKLLIY (SEQ ID NO: 52) или WYQQKPGQPPKLLIY (SEQ ID NO: 62); (c) FR-L3, содержащий аминокислотную последовательность GVPDRFSGSGSGTDFTLTISSLQAEDVAVYYC (SEQ ID NO: 53) или GVPARFSGSGSRTDFTLTIDPVEADDAATYYC (SEQ ID NO: 63); и (d) FR-L4, содержащий аминокислотную последовательность FGQGTKVEIK (SEQ ID NO: 54) или FGGGTKLEIK (SEQ ID NO: 64).
Например, в некоторых случаях антитело против HtrA1 содержит следующие шесть HVR: SYIMS (SEQ ID NO: 39); (b) HVR-H2, содержащий аминокислотную последовательность YISNGGGTTYYSDTIKG (SEQ ID NO: 40); и (с) HVR-H3, содержащий аминокислотную последовательность QNFRSDGSSMDY (SEQ ID NO: 41); (d) HVR-L1, содержащий аминокислотную последовательность RASESVDSYGKSFMH (SEQ ID NO: 42); (е) HVR-L2, содержащий аминокислотную последовательность LASKLES (SEQ ID NO: 43); и (f) HVR-L3, содержащий аминокислотную последовательность QQNNEDPYT (SEQ ID NO: 44). В некоторых случаях антитело против HtrA1 содержит следующие четыре FR вариабельных доменов тяжелой цепи: (a) FR-H1, содержащий аминокислотную последовательность EVQLVESGGGLVQPGGSLRLSCAASGFTFS (SEQ ID NO: 47); (b) FR-H2, содержащий аминокислотную последовательность WVRQAPGKGLEWVA (SEQ ID NO: 48); (с) FR-H3, содержащий аминокислотную последовательность RFTISRDNSKNTLYLQMNSLRAEDTAVYYCAR (SEQ ID NO: 49); и (d) FR-H4, содержащий аминокислотную последовательность WGQGTLVTVSS (SEQ ID NO: 50). В дополнительных случаях антитело против HtrA1 содержит следующие четыре FR вариабельных доменов легкой цепи: (а) FR-L1, содержащий аминокислотную последовательность DIVMTQSPDSLAVSLGERATINC (SEQ ID NO: 51); (b) FR-L2, содержащий аминокислотную последовательность WYQQKPGQPPKLLIY (SEQ ID NO: 52); (с) FR-L3, содержащий аминокислотную последовательность GVPDRFSGSGSGTDFTLTISSLQAEDVAVYYC (SEQ ID NO: 53); и (d) FR-L4, содержащий аминокислотную последовательность FGQGTKVEIK (SEQ ID NO: 54). В некоторых случаях антитело против HtrA1 содержит (а) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 45, и (b) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 46. В некоторых случаях антитело против HtrA1 представляет собой h19B12.v1.
Например, в некоторых случаях антитело против HtrA1 содержит следующие шесть HVR: SYIMS (SEQ ID NO: 39); (b) HVR-H2, содержащий аминокислотную последовательность YISNGGGTTYYSDTIKG (SEQ ID NO: 40); и (c) HVR-H3, содержащий аминокислотную последовательность QNFRSDGSSMDY (SEQ ID NO: 41); (d) HVR-L1, содержащий аминокислотную последовательность RASESVDSYGKSFMH (SEQ ID NO: 42); (e) HVR-L2, содержащий аминокислотную последовательность LASKLES (SEQ ID NO: 43); и (f) HVR-L3, содержащий аминокислотную последовательность QQNNEDPYT (SEQ ID NO: 44). В некоторых случаях антитело против HtrA1 содержит следующие четыре FR вариабельных доменов тяжелой цепи: (a) FR-H1, содержащий аминокислотную последовательность EVKLVESGGGLVEPGGSLKLACVASGFTFS (SEQ ID NO: 57); (b) FR-H2, содержащий аминокислотную последовательность WVRQTPEKRLEWVA (SEQ ID NO: 58); (с) FR-H3, содержащий аминокислотную последовательность RFTISRDNAKNTLYLQMSTLKSEDTAIYFCAR (SEQ ID NO: 59); и (d) FR-H4, содержащий аминокислотную последовательность WGQGTAVTVSS (SEQ ID NO: 60). В дополнительных случаях антитело против HtrA1 содержит следующие четыре FR вариабельных доменов легкой цепи: (a) FR-L1, содержащий аминокислотную последовательность NIVVTQSPASLAVSLGQRATISC (SEQ ID NO: 61); (b) FR-L2, содержащий аминокислотную последовательность WYQQKPGQPPKLLIY (SEQ ID NO: 62); (с) FR-L3, содержащий аминокислотную последовательность GVPARFSGSGSRTDFTLTIDPVEADDAATYYC (SEQ ID NO: 63); и (d) FR-L4, содержащий аминокислотную последовательность FGGGTKLEIK (SEQ ID NO: 64). В некоторых случаях антитело против HtrA1 содержит (а) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 55, и (b) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 56. В некоторых случаях антитело против HtrA1 представляет собой 19В12 (также называемое m19В12).
В другом примере антитело против HtrA1 по данному изобретению содержит один, два, три, четыре, пять или шесть HVR вариабельных доменов легкой и тяжелой цепи антитела 20Е2 (SEQ ID NO: 66 и 65, соответственно), и причем (i) последовательность HVR-L1 содержит аминокислотные остатки 24-34 по Кабату, последовательность HVR-L2 содержит аминокислотные остатки 50-56 по Кабату, а последовательность HVR-L3 содержит аминокислотные остатки 89-97 по Кабату SEQ ID NO: 66, и (ii) последовательность HVR-H1 содержит аминокислотные остатки 31-35 по Кабату, последовательность HVR-H2 содержит аминокислотные остатки 50-65 по Кабату, а последовательность HVR-H3 содержит аминокислотные остатки 95-102 по Кабату SEQ ID NO: 65, или комбинацию одного или более из вышеприведенных HVR и один или более их вариантов, обладающих по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью) с любым одним из вышеприведенных HVR антитела 20Е2. В некоторых случаях антитело против HtrA1 содержит (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере около 90% идентичностью последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 65; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере около 90% идентичностью последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 66; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 65, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 66.
В другом примере антитело против HtrA1 по данному изобретению содержит один, два, три, четыре, пять или шесть HVR вариабельных доменов легкой и тяжелой цепи антитела 3А5 (SEQ ID NO: 68 и 67, соответственно), и причем (i) последовательность HVR-L1 содержит аминокислотные остатки 24-34 по Кабату, последовательность HVR-L2 содержит аминокислотные остатки 50-56 по Кабату, а последовательность HVR-L3 содержит аминокислотные остатки 89-97 по Кабату SEQ ID NO: 68, и (ii) последовательность HVR-H1 содержит аминокислотные остатки 31-35 по Кабату, последовательность HVR-H2 содержит аминокислотные остатки 50-65 по Кабату, а последовательность HVR-H3 содержит аминокислотные остатки 95-102 по Кабату SEQ ID NO: 67, или комбинацию одного или более из вышеприведенных HVR и один или более их вариантов, обладающих по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью) с любым одним из вышеприведенных HVR антитела 3А5. В некоторых случаях антитело против HtrA1 содержит (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере около 90% идентичностью последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 67; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере около 90% идентичностью последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 68; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 67, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 68.
В другом примере антитело против HtrA1 по данному изобретению содержит один, два, три, четыре, пять или шесть HVR вариабельных доменов легкой и тяжелой цепи антитела 12А5 (SEQ ID NO: 70 и 69, соответственно), и причем (i) последовательность HVR-L1 содержит аминокислотные остатки 24-34 по Кабату, последовательность HVR-L2 содержит аминокислотные остатки 50-56 по Кабату, а последовательность HVR-L3 содержит аминокислотные остатки 89-97 по Кабату SEQ ID NO: 70, и (ii) последовательность HVR-H1 содержит аминокислотные остатки 31-35 по Кабату, последовательность HVR-H2 содержит аминокислотные остатки 50-65 по Кабату, а последовательность HVR-H3 содержит аминокислотные остатки 95-102 по Кабату SEQ ID NO: 69, или комбинацию одного или более из вышеприведенных HVR и один или более их вариантов, обладающих по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью) с любым одним из вышеприведенных HVR антитела 12А5. В некоторых случаях антитело против HtrA1 содержит (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере около 90% идентичностью последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 69; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере около 90% идентичностью последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 70; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 69, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 70.
В некоторых случаях антитело против HtrA1 содержит (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере около 90% идентичностью последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 21, 23, 76, 77, 78, 93-101, 106 или 107; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере около 90% идентичностью последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности) с любой из последовательностей SEQ ID NO: 22, 24, 72-74, 81-92, 105 или 108; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). Например, в некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 21, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 22. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 23, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 24. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 76, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 72. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 77, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 73. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 78, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 74. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 77, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 87. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 95, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 73. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 94, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 73. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 93, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 73. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 77, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 83. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 97, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 73. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 77, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 85. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 77, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 84. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 100, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 73. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 99, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 73. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 101, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 73. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 77, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 86. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 96, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 73. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 77, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 82. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 77, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 88. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 77, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 81. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 77, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 89. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 98, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 73. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 77, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 90. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 95, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 83. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 93, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 83. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 94, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 87. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 97, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 83. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 94, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 83. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 95, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 87. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 94, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 85. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 97, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 87. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 93, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 87. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 93, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 84. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 97, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 85. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 95, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 85. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 93, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 85. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 97, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 84. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 95, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 84. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 94, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 84. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 104, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 22. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 106, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 105. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 107, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 105. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 106, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 108. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 107, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 108.
В некоторых случаях любое из предыдущих антител против HtrA1 может содержать один, два, три или четыре следующих каркасных участка (FR) вариабельных доменов тяжелой цепи: (a) FR-H1, содержащий аминокислотную последовательность EVQLVQSGAEVKKPGASVKVSCKASGYX1FX2 (SEQ ID NO: 12), где X1 представляет собой Lys или Thr, а Х2 представляет собой Thr, Lys или Arg; (b) FR-H2, содержащий аминокислотную последовательность WVRQAPGQGLEWIG (SEQ ID NO: 13); (с) FR-H3, содержащий аминокислотную последовательность RATITRDTSTSTAYLELSSLRSEDTAVYYCTR (SEQ ID NO: 14); и (d) FR-H4, содержащий аминокислотную последовательность WGQGTLVTVSS (SEQ ID NO: 15). В некоторых случаях любое из предыдущих антител HtrA1 может содержать один, два, три или четыре следующих FR вариабельных доменов тяжелой цепи: (a) FR-H1, содержащий аминокислотную последовательность QVQLQQSGAELVRPGASVTLSCKASGYTFT (SEQ ID NO: 25); (b) FR-H2, содержащий аминокислотную последовательность WVKQTPVHGLEWIG (SEQ ID NO: 26); (c) FR-H3, содержащий аминокислотную последовательность KATLTADKSSSTAYMELRSLTSEDSAVYYCTR (SEQ ID NO: 27); и (d) FR-H4, содержащий аминокислотную последовательность WGQGTSVTVSS (SEQ ID NO: 28).
В некоторых случаях любое из предыдущих антител против HtrA1 может содержать один, два, три или четыре следующих FR вариабельных доменов легкой цепи: (a) FR-L1, содержащий аминокислотную последовательность DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 17); (b) FR-L2, содержащий аминокислотную последовательность WYQQKPGKAPKPLIS (SEQ ID NO: 18); (c) FR-L3, содержащий аминокислотную последовательность GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 19); и (d) FR-L4, содержащий аминокислотную последовательность FGQGTKVEIK (SEQ ID NO: 20). В других случаях любое из предыдущих антител против HtrA1 может содержать один, два, три или четыре следующих FR вариабельных доменов легкой цепи: (а) FR-L1, содержащий аминокислотную последовательность NIVVTQSPASLAVSLGQRATISC (SEQ ID NO: 29); (b) FR-L2, содержащий аминокислотную последовательность WYQQKPGQPPKLLIY (SEQ ID NO: 30); (с) FR-L3, содержащий аминокислотную последовательность GVPARFSGSGSRTDFTLTIDPVEADDAATYYC (SEQ ID NO: 31); и (d) FR-L4, содержащий аминокислотную последовательность FGGGTKLEIK (SEQ ID NO: 32).
В некоторых случаях антитело против HtrA1 содержит (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере около 90% идентичностью последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 45, 55, 65, 67 или 69; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере около 90% идентичностью последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности) с любой из последовательностей SEQ ID NO: 46, 56, 66, 68 или 70; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). Например, в некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 45, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 46. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 55, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 56. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 65, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 66. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 67, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 68. В некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 69, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 70.
В некоторых случаях в изобретении предложено выделенное антитело, которое специфически связывает HtrA1, содержащее (а) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 21, и (b) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 22, такое как антитело, называемое в данном документе APEG.LC3.HC3.
В некоторых случаях в изобретении предложено выделенное антитело, которое специфически связывает HtrA1, содержащее (а) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 45, и (b) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 46, такое как антитело, называемое в данном документе h19B6.v1.
В некоторых случаях в изобретении предложено антитело против HtrA1, которое связывается с тем же самым эпитопом, что и любое из предыдущих антител. В некоторых случаях в изобретении предложено антитело против HtrA1, которое конкурирует за связывание HtrA1 с любым из предыдущих антител.
В некоторых вариантах реализации изобретения любое из предыдущих антител против HtrA1 может обладать одним или более следующими свойствами: (i) связываться с HtrA1 в соотношении 1 вариабельный домен к одной субъединице тримера HtrA1 (например, Fab связывается с тримером HtrA1 в соотношении 3 Fab к 1 тримеру HtrA1, a IgG связывается с тримером HtrA1 в соотношении 3 IgG к 2 тримерам HtrA1), (ii) для антител, содержащих два вариабельных домена, связываться с HtrA1 способом, приводящим к образованию «клетки», подобной изображенной на ФИГ. 9 публикации заявки на патент США US 2013/0129743, (iii) не предотвращать образование тримера HtrA1, (iv) перекрестно реагировать с мышиным HtrA1; (v) не реагировать перекрестно с HtrA2, HtrA3 и/или HtrA4; (vi) полностью связываются с HtrA1 в отношении антитела против HtrA1 YW505.94.28a (см., например, WO 2013/055998), (vii) ингибировать образование комплекса между HtrA1 и альфа-антитрипсином (AIAT). В некоторых вариантах реализации изобретения предложено антитело, которое связывается с тем же самым эпитопом, что и любое из предыдущих антител.
В дополнительном аспекте изобретения антитело против HtrA1 в соответствии с любым из вышеприведенных вариантов реализации изобретения может включать признаки, по отдельности или в комбинации, описанные ниже в разделах 1-8.
В. Типичные антитела против фактора D
В изобретении предложены антитела против фактора D, которые можно применять с антителами против HtrA1 по данному изобретению, например, в способах лечения нарушения, включая связанное с HtrA1 нарушение, глазное нарушение и/или связанное с комплементом нарушение (например, ВМД (например, географическая атрофия)). В изобретении также предложены мультиспецифические (например, биспецифические) антитела, способные специфически связываться с HtrA1 и фактором D (например, антитела против HtrA1/фактора D). В композициях и способах по данному изобретению можно использовать любое подходящее антитело против фактора D. В качестве неограничивающего примера, в композициях и способах по данному изобретению можно использовать любое антитело против фактора D, описанное в данном документе и/или в патенте США №8067002; 8268310; 8273352 и/или в заявке на патент США №14/700853.
Например, в некоторых случаях антитело против фактора D может содержать аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью моноклонального антитела 166-32, полученного из гибридомы, депонированной в Американской коллекции типовых культур (АТСС) и обозначенной НВ12476. Например, в некоторых случаях антитело против фактора D содержит (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 136; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 137; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). Например, в некоторых случаях антитело против фактора D содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 136, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 137, такое как моноклональное антитело против фактора D 166-32. В некоторых случаях антитело против фактора D представляет собой гуманизированное производное моноклонального антитела 166-32. В некоторых вариантах реализации изобретения антитело против фактора D связывается с тем же эпитопом, что и моноклональное антитело 166-32. В некоторых случаях антитело против фактора D представляет собой фрагмент антитела, полученный из моноклонального антитела 166-32. В некоторых случаях фрагмент антитела, полученный из моноклонального антитела 166-32 представляет собой фрагмент Fab, Fab'-SH, Fv, scFv или (Fab')2. В некоторых вариантах реализации изобретения фрагмент антитела, полученный из моноклонального антитела 166-32 представляет собой Fab.
В некоторых случаях гуманизированное производное моноклонального антитела 166-32 можно применять в композициях и способах по данному изобретению. Например, в композициях и способах по данному изобретению можно применять любое гуманизированное производное моноклонального антитела 166-32, описанное, например, в патенте США №8067002. Типовые гуманизированные производные моноклонального антитела 166-32, описаны в патенте США №8067002, включают, например, клоны №111, №56, №250 и №416 гуманизированных антител против фактора D. Аминокислотные последовательности доменов VH и VL клонов №111, №56, №250 и №416 гуманизированных антител против фактора D показаны, например, на Фиг. 5 патента США №8067002. В некоторых случаях антитело против фактора D содержит аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью клона №111, №56, №250 или №416 антитела против фактора D.
В некоторых случаях в композициях и способах по данному изобретению можно применять модифицированные антитела или варианты гуманизированных антител против фактора D и их фрагменты. Например, в композициях и способах по данному изобретению можно применять любое модифицированное или версию варианта клона №111 гуманизированного антитела против фактора D, описанную, например, в патенте США №8273352, например, клон 238 или 238-1 антитела. В некоторых случаях антитело против фактора D содержит аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью клона 238 или 238-1 антитела против фактора D.
В некоторых случаях антитело против фактора D или его антигенсвязывающий фрагмент может содержать по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из: (a) HVR-H1, содержащего аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащего аминокислотную последовательность WINTYTGETTYAX1DFKG (SEQ ID NO: 110), где X1 представляет собой Asp или Glu; (с) HVR-H3, содержащего аминокислотную последовательность EGGVX1N (SEQ ID NO: 111), где X1 представляет собой Asn или Ser; (d) HVR-L1, содержащего аминокислотную последовательность ITSTX1IX2X3DMN (SEQ ID NO: 112), где X1 представляет собой Asp или Ser, X2 представляет собой Asp или Glu, а Х3 представляет собой Asp или Ser; (е) HVR-L2, содержащего аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащего аминокислотную последовательность LQSX1SLPYT (SEQ ID NO: 114), где X1 представляет собой Asp или Glu, или комбинацию из одного или более вышеприведенных HVR и одного или более их вариантов, обладающих по меньшей мере 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью) с любой из SEQ ID NO: 109-114. Например, в некоторых случаях антитело против фактора D или его антигенсвязывающий фрагмент содержит следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащий аминокислотную последовательность WINTYTGETTYAX1DFKG (SEQ ID NO: 110), где X1 представляет собой Asp или Glu; (с) HVR-H3, содержащий аминокислотную последовательность EGGVX1N (SEQ ID NO: 111), где X1 представляет собой Asp или Ser; (d) HVR-L1, содержащий аминокислотную последовательность ITSTX1IX2X3DMN (SEQ ID NO: 112), где X1 представляет собой Asp или Ser, X2 представляет собой Asp или Glu, а Х3 представляет собой Asp или Ser; (е) HVR-L2, содержащий аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащий аминокислотную последовательность LQSX1SLPYT (SEQ ID NO: 114), где X1 представляет собой Asp или Glu.
Например, в некоторых случаях антитело против фактора D или его антигенсвязывающий фрагмент может содержать по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из: (a) HVR-H1, содержащего аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащего аминокислотную последовательность WINTYTGETTYADDFKG (SEQ ID NO: 115); (c) HVR-H3, содержащего аминокислотную последовательность EGGVNN (SEQ ID NO: 116); (d) HVR-L1, содержащего аминокислотную последовательность ITSTDIDDDMN (SEQ ID NO: 117); (e) HVR-L2, содержащего аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащего аминокислотную последовательность LQSDSLPYT (SEQ ID NO: 118), или комбинацию из одного или более вышеприведенных HVR и одного или более их вариантов, обладающих по меньшей мере 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью) с любой из SEQ ID NO: 109, 113 или 115-118. Например, в некоторых случаях антитело против фактора D или его антигенсвязывающий фрагмент содержит следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-Н2, содержащий аминокислотную последовательность WINTYTGETTYADDFKG (SEQ ID NO: 115); и (с) HVR-H3, содержащий аминокислотную последовательность EGGVNN (SEQ ID NO: 116); (d) HVR-L1, содержащий аминокислотную последовательность ITSTDIDDDMN (SEQ ID NO: 117); (е) HVR-L2, содержащий аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащий аминокислотную последовательность LQSDSLPYT (SEQ ID NO: 118).
В некоторых случаях антитело против фактора D содержит (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере около 90% идентичностью последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичность последовательности) с любой из последовательностей SEQ ID NO: 119, 131 или 132; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере около 90% идентичностью последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичность последовательности) с любой из последовательностей SEQ ID NO: 120, 133, 134 или 135; или (с) VH, аналогичный описанному в (а), и VL, аналогичный описанному в (b). Например, в некоторых случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 119, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 120. В других случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 131, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 133. В других случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 131, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 134. В других случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 131, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 135. В других случаях антитело содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 132, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 135. В композициях и способах по данному изобретению можно использовать любое из антител против фактора D, изображенных на Фиг. 30, или их варианты, или их фрагменты. В некоторых вариантах реализации изобретения антитело против фактора D или его антигенсвязывающий фрагмент содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 119, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 120. В некоторых случаях антигенсвязывающий фрагмент антитела против фактора D представляет собой лампализумаб, имеющий регистрационный номер CAS 1278466-20-8.
В другом примере, в некоторых случаях антитело против фактора D представляет собой или получено из антитела 20D12, например, как описано в патенте США №8268310. В одном примере антитело против фактора D содержит один, два, три, четыре, пять или шесть HVR вариабельных доменов легкой и тяжелой цепи антитела 20D12 (SEQ ID NO: 128 и 127, соответственно), и причем (i) последовательность HVR-L1 содержит аминокислотные остатки 24-34 по Кабату, последовательность HVR-L2 содержит аминокислотные остатки 50-56 по Кабату, а последовательность HVR-L3 содержит аминокислотные остатки 89-97 по Кабату SEQ ID NO: 128, и (ii) последовательность HVR-H1 содержит аминокислотные остатки 31-35 по Кабату, последовательность HVR-H2 содержит аминокислотные остатки 50-65 по Кабату, а последовательность HVR-H3 содержит аминокислотные остатки 95-102 по Кабату SEQ ID NO: 127, или комбинацию одного или более из вышеприведенных HVR и один или более их вариантов, имеющих по меньшей мере около 80% идентичность последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность) с любым одним из вышеприведенных HVR антитела 20D12.
В некоторых случаях антитело против фактора D содержит (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 127; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 128; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). Например, в некоторых случаях антитело против фактора D содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 127, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 128, такое как антитело против фактора D 20D12. В некоторых случаях антитело против фактора D содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 129 и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 130. В некоторых случаях антитело против фактора D представляет собой гуманизированное производное моноклонального антитела 20D12. В некоторых вариантах реализации изобретения антитело против фактора D связывается с тем же эпитопом, что и моноклональное антитело 20D12 или его гуманизированное производное. В некоторых случаях антитело против фактора D представляет собой фрагмент антитела, полученный из моноклонального антитела 20D12 или его гуманизированное производное. В некоторых случаях фрагмент антитела, полученный из моноклонального антитела 20D12 или его гуманизированного производного представляет собой фрагмент Fab, Fab'-SH, Fv, scFv или (Fab')2. В некоторых случаях фрагмент антитела, полученный из моноклонального антитела 20D12 или его гуманизированного производного представляет собой Fab.
В некоторых случаях в композициях и способах по данному изобретению можно использовать фрагменты любого из предыдущих антител против фактора D (например, антигенсвязывающие фрагменты). Фрагменты антител по данному изобретению могут представлять собой, например, Fab, Fab', F(ab')2, scFv, (scFv)2, dAb, фрагменты гипервариабельных участков (HVR), линейные антитела, молекулы одноцепочечных антител, минитела, диатела или мультиспецифические антитела, образованные из фрагментов антител. В дополнительном варианте реализации изобретения в композициях и способах по данному изобретению можно использовать фрагмент антитела против фактора D (например, антигенсвязывающий фрагмент), способный проникать практически во всю сетчатку. В еще одном дополнительном варианте реализации изобретения в композициях и способах по данному изобретению можно использовать фрагмент антитела против фактора D (например, антигенсвязывающий фрагмент), способный проникать через всю толщину сетчатки.
В некоторых случаях изобретение может охватывать применение гуманизированных антител против фактора D, причем фрагмент Fab таких антител имеет период полувыведения по меньшей мере 3, 5, 7, 10 или 12 дней после введения в глаз млекопитающего (например, человека) посредством однократной инъекции внутрь стекловидного тела. В другом варианте реализации изобретение может охватывать применение гуманизированных антител против фактора D, причем фрагмент Fab таких антител ингибирует альтернативный путь (АР) активации комплемента в течение по меньшей мере 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110 или 115 дней после введения в глаз млекопитающего (например, человека) посредством однократной инъекции внутрь стекловидного тела. В другом варианте реализации изобретение может охватывать применение гуманизированных антител против фактора D, причем концентрация фрагмента Fab таких антител, которая ингибирует альтернативный путь (АР) активации комплемента, поддерживается в ткани сетчатки в течение по меньшей мере 40, 45, 50, 55, 60, 65, 70, 75, 80 или 85 дней после введения в глаз млекопитающего (например, человека) посредством однократной инъекции внутрь стекловидного тела. В другом варианте реализации изобретение может охватывать применение гуманизированных антител против фактора D, причем концентрация фрагмента Fab таких антител, которая ингибирует альтернативный путь (АР) активации комплемента, поддерживается в стекловидном теле в течение по меньшей мере 80, 85, 90, 95, 100, 105, 110 или 115 дней после введения в глаз млекопитающего (например, человека) посредством однократной инъекции внутрь стекловидного тела. В одном примере изобретение охватывает применение фрагмента указанных антител против фактора D (например, антигенсвязывающих фрагментов).
В некоторых случаях любое из предыдущих антител против фактора D в своей моновалентной форме связывает фактор D с KD равной около 20 нМ или ниже (например, KD антитела в виде фрагмента Fab к фактору D). В некоторых случаях предложенное в данном документе антитело в своей моновалентной форме связывает фактор D с KD равной около 10 нМ или ниже. В некоторых случаях предложенное в данном документе антитело в своей моновалентной форме связывает фактор D с KD равной около 5 нМ или ниже. В некоторых случаях предложенное в данном документе антитело в своей моновалентной форме связывает фактор D с KD равной около 2 нМ или ниже. Например, в некоторых случаях антитело в своей моновалентной форме связывает фактор D с KD между около 0,5 пМ и около 2 нМ (например, около 0,5 пМ, около 1 пМ, около 2 пМ, около 3 пМ, около 4 пМ, около 5 пМ, около 6 пМ, около 7 пМ, около 8 пМ, около 9 пМ, около 10 пМ, около 15 пМ, около 20 пМ, около 25 пМ, около 50 пМ, около 75 пМ, около 100 пМ, около 125 пМ, около 150 пМ, около 175 пМ, около 200 пМ, около 225 пМ, около 250 пМ, около 275 пМ, около 300 пМ, около 325 пМ, около 350 пМ, около 375 пМ, около 400 пМ, около 425 пМ, около 450 пМ, около 475 пМ, около 500 пМ, около 525 пМ, около 550 пМ, около 575 пМ, около 600 пМ, около 625 пМ, около 650 пМ, около 675 пМ, около 700 пМ, около 725 пМ, около 750 пМ, около 775 пМ, около 800 пМ, около 825 пМ, около 850 пМ, около 875 пМ, около 900 пМ, около 925 пМ, около 950 пМ, около 975 пМ, около 1 нМ, около 1,1 нМ, около 1,2 нМ, около 1,3 нМ, около 1,4 нМ, около 1,5 нМ, около 1,6 нМ, около 1,7 нМ, около 1,8 нМ, около 1,9 нМ или около 2 нМ). В некоторых случаях антитело в своей моновалентной форме связывает фактор D с KD от около 0,5 пМ до около 100 пМ. В некоторых случаях антитело в своей моновалентной форме связывает фактор D с KD равной около 0,5 пМ. В некоторых случаях антитело в своей моновалентной форме связывает фактор D с KD ниже около 10 пМ.
В некоторых случаях любое из предыдущих антител против фактора D в своей бивалентной форме связывает фактор D с KD равной около 10 нМ или ниже (например, KD антитела в виде IgG к фактору D). В некоторых случаях предложенное в данном документе антитело в своей бивалентной форме связывает фактор D с KD равной около 5 нМ или ниже. В некоторых случаях предложенное в данном документе антитело в своей бивалентной форме связывает фактор D с KD равной около 2 нМ или ниже. Например, в некоторых случаях антитело в своей бивалентной форме связывает фактор D с KD между около 0,5 пМ и около 2 нМ (например, около 0,5 пМ, около 1 пМ, около 2 пМ, около 3 пМ, около 4 пМ, около 5 пМ, около 6 пМ, около 7 пМ, около 8 пМ, около 9 пМ, около 10 пМ, около 15 пМ, около 20 пМ, около 25 пМ, около 50 пМ, около 75 пМ, около 100 пМ, около 125 пМ, около 150 пМ, около 175 пМ, около 200 пМ, около 225 пМ, около 250 пМ, около 275 пМ, около 300 пМ, около 325 пМ, около 350 пМ, около 375 пМ, около 400 пМ, около 425 пМ, около 450 пМ, около 475 пМ, около 500 пМ, около 525 пМ, около 550 пМ, около 575 пМ, около 600 пМ, около 625 пМ, около 650 пМ, около 675 пМ, около 700 пМ, около 725 пМ, около 750 пМ, около 775 пМ, около 800 пМ, около 825 пМ, около 850 пМ, около 875 пМ, около 900 пМ, около 925 пМ, около 950 пМ, около 975 пМ, около 1 нМ, около 1,1 нМ, около 1,2 нМ, около 1,3 нМ, около 1,4 нМ, около 1,5 нМ, около 1,6 нМ, около 1,7 нМ, около 1,8 нМ, около 1,9 нМ или около 2 нМ). В некоторых случаях антитело в своей бивалентной форме связывает фактор D с KD от около 0,5 пМ до около 100 пМ. В некоторых случаях антитело в своей бивалентной форме связывает фактор D с KD равной около 0,5 пМ. В некоторых случаях антитело в своей бивалентной форме связывает фактор D с KD ниже около 10 пМ.
В дополнительном аспекте изобретения антитело против фактора D в соответствии с любым из вышеприведенных вариантов реализации изобретения может включать признаки, по отдельности или в комбинации, описанные ниже в разделах 1-8 раздела С «Свойства и признаки антител».
С. Свойства и признаки антител
Описанные в данном документе антитела (например, антитела против HtrA1 и антитела против фактора D, описанные выше, а также антитела против HtrA1/фактора D, описанные ниже), а также любое из антител для применения в описанных в данном документе способах, может обладать любым из признаков, по отдельности или в комбинации, описанных ниже в разделах 1-8.
1. Аффинность антител
В некоторых вариантах реализации изобретения предложенное в данном документе антитело (например, антитело против HtrA1, антитело против фактора D или биспецифическое антитело против HtrA1 и против фактора D) имеет значения константы диссоциации (KD)






В одном варианте реализации изобретения KD измеряют анализом связывания антигена, меченного радиоактивным изотопом (РИА). В одном варианте реализации РИА выполняют с использованием версии Fab представляющего интерес антитела и его антигена. Например, аффинность связывания Fab с антигеном в растворе измеряют путем уравновешивания Fab с минимальной концентрацией (125I)-меченого антигена в присутствии серии титрования немеченого антигена с последующим захватом связанного антигена с помощью планшета, покрытого антителом против Fab (см., например, Chen et al., J. Mol. Biol. 293:865-881(1999)). Для определения условий анализа многолуночные планшеты MICROTITER® (Thermo Scientific) покрывают в течение ночи 5 мкг/мл антитела для захвата Fab (Cappel Labs) в 50 мМ растворе карбоната натрия (рН 9,6), а затем блокируют 2% (масс./об.) раствором бычьего сывороточного альбумина в ФБС в течение от двух до пяти часов при комнатной температуре (приблизительно 23°С). В планшете, не содержащем адсорбента (Nunc №269620), смешивают 100 пМ или 26 пМ [125I]-антигена с серийными разведениями интересующего Fab (например, в соответствии с оценкой антителом против VEGF, Fab-12 согласно Presta et al., Cancer Res. 57:4593-4599 (1997)). Затем интересующий Fab инкубируют в течение ночи; однако инкубацию можно продолжать в течение более длительного периода (например, около 65 часов) для обеспечения достижения равновесия. После этого смеси переносят в планшет для захвата и инкубируют при комнатной температуре (например, в течение одного часа). Затем раствор удаляют и планшет промывают восемь раз 0,1% полисорбатом 20 (TWEEN-20®) в ФСБ. После высушивания планшетов добавляют 150 мкл сцинтиллятора (MICROSCINT-20 ТМ; Packard) на лунку и производят подсчет планшетов на гамма-счетчике TOPCOUNT™ (Packard) в течение десяти минут. Для применения в анализах конкурентного связывания выбирают концентрации каждого Fab, обеспечивающие связывание меньшее или равное 20% от максимального.
В соответствии с другим вариантом реализации изобретения KD измеряют с использованием анализа поверхностного плазмонного резонанса (ППР) BIACORE®. Например, анализ с использованием прибора BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., г. Пискатауэй, штат Нью-Джерси, США) выполняют при 25°С на чипах СМ5 с иммобилизованным антигеном при ~10 единицах ответа (RU). В одном варианте реализации изобретения чипы биосенсора с карбоксиметилированным декстраном (СМ5, BIACORE, Inc.) активировали N-этил-N'-(3-диметиламинопропил)-карбодиимидгидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Антиген разбавляют 10 мМ раствором ацетата натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ) и затем вводят его при скорости потока 5 мкл/минуту до достижения приблизительно 10 единиц ответа (RU) связанного белка. После введения антигена вводят 1 М этаноламина для блокирования непрореагировавших групп. Для измерений кинетических параметров двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) вводят в ФСБ с 0,05% полисорбатом-20 (Tween®-20) (PBST) при 25°С при скорости потока приблизительно 25 мкл/мин. Скорости ассоциации (ka) и диссоциации (kд) рассчитывают с помощью простой модели связывания Ленгмюра при соотношении один к одному (программное обеспечение BIACORE® Evaluation Software версии 3.2) путем одновременной аппроксимации сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (KD) рассчитывают как соотношение kд/ka. См., например, Chen et al., J. Mol. Biol. 293:865-881 (1999). Если скорость ассоциации согласно вышеописанному анализу поверхностного плазмонного резонанса превышает 106 М-1 с-1, то ее можно определять с помощью методики гашения флуоресценции, измеряющей увеличение или снижение интенсивности испускания флуоресценции (возбуждение = 295 нм; испускание = 340 нм, полоса пропускания 16 нм) при 25°С для 20 нМ раствора антител против антигена (в форме Fab) в ФСБ, рН 7,2, в присутствии возрастающих концентраций антигена при измерении на спектрометре, таком как оборудованный для исследования методом остановленного потока (Aviv Instruments) или спектрофотометре SLM-AMINCO™ серия 8000 (ThermoSpectronic) с перемешиваемой кюветой. Значение KD также можно измерять с использованием анализа ППР BIACORE®, как описано в ниже в примерах.
2. Стабильность антител
В изобретении предложены антитела с повышенной стабильностью, например, по сравнению с эталонным антителом против HtrA1. Стабильность антитела можно определять, применяя любой способ, известный в данной области техники, например, спектроскопию (например, масс-спектроскопию), дифференциальную сканирующую флуориметрию (ДСФ), круговой дихроизм (КД), собственную флуоресценцию белков, дифференциальную сканирующую калориметрию (ДСК), рассеяние света (например, динамическое рассеяние света (ДРС) и статическое рассеяние света (СРС), хроматографию на основе самовзаимодействия (SIC). Антитело против HtrA1 может обладать, например, повышенной температурой плавления (Tm), температурой агрегации (Tagg) или другими параметрами стабильности по сравнению с эталонным антителом против HtrA1.
В изобретении предложены антитела с пониженным дезамидированием по сравнению с эталонным антителом против HtrA1. Дезамидирование можно снижать или предотвращать его, как описано в данном документе и/или используя известные в данной области техники способы. В изобретении также предложены антитела с пониженной способностью к окислению (например, окислению триптофана, к примеру в положении LC-W91), например по сравнению с эталонным антителом против HtrA1. Окисление (например, окисление триптофана) можно снижать или предотвращать его, как описано в данном документе и/или используя известные в данной области техники способы. В изобретении также предложены антитела с пониженной способностью к изомеризации, например, по сравнению с эталонным антителом против HtrA1. Изомеризацию можно снижать или предотвращать ее, как описано в данном документе и/или используя известные в данной области техники способы.
3. Фрагменты антител
В некоторых вариантах реализации изобретения предложенное в данном документе антитело представляет собой фрагмент антитела. Фрагменты антител включают, но не ограничиваются ими, фрагменты Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv, а также другие фрагменты, описанные ниже. Обзор некоторых фрагментов антител см. в Hudson et al., Nat. Med. 9:129-134 (2003). Обзор фрагментов scFv см., например, в

Диатела представляют собой фрагменты антител, содержащие два антигенсвязывающих сайта, и могут быть двухвалентными или биспецифическими. См., например, ЕР 404097; WO 1993/01161; Hudson et al., Nat. Med. 9:129-134 (2003) и Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). Триатела и тетратела также описаны в публикации Hudson et al., Nat. Med. 9:129-134(2003).
Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи антитела или его часть, или весь вариабельный домен легкой цепи антитела или его часть. В некоторых вариантах реализации однодоменное антитело представляет собой однодоменное антитело человека (Domantis, Inc, г. Уолтем, штат Массачусетс, США; см., например, патент США №6248516 В1).
Фрагменты антител можно получать различными методиками, включая протеолитический гидролиз интактного антитела, а также продукцию рекомбинантными клетками-хозяевами (например, Е. coli или фагом), но не ограничиваясь ими, как описано в настоящем документе.
В некоторых вариантах реализации изобретения предложенное в данном документе антитело (например, антитело против HtrA1) представляет собой фрагмент антитела. В некоторых вариантах реализации изобретения Fab содержит усечение в шарнирном участке (например, верхнем шарнире) константного участка тяжелой цепи. В некоторых вариантах реализации изобретения константный участок Fab тяжелой цепи завершается положением 221 (нумерация EU). В некоторых вариантах реализации изобретения аминокислотный остаток положения 221 представляет собой аспарагиновую кислоту (D221). В некоторых вариантах реализации изобретения константный участок тяжелой цепи Fab содержит аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 156. В некоторых вариантах реализации изобретения антитело содержит аминокислотную последовательность тяжелой цепи SEQ ID NO: 160. В некоторых вариантах реализации изобретения антитело содержит аминокислотную последовательность легкой цепи SEQ ID NO: 159. В некоторых вариантах реализации изобретения антитело содержит аминокислотную последовательность тяжелой цепи SEQ ID NO: 160 и аминокислотную последовательность легкой цепи SEQ ID NO: 159. В некоторых вариантах реализации изобретения Fab представляет собой Fab lgG1.
В некоторых случаях Fab связывает HtrA1 и может содержать по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из: (a) HVR-H1, содержащего аминокислотную последовательность DSEMH (SEQ ID NO: 7); (b) HVR-H2, содержащего аминокислотную последовательность GVDPETEGAAYNQKFKG (SEQ ID NO: 8); (с) HVR-H3, содержащего аминокислотную последовательность GYDYDYALDY (SEQ ID NO: 3); (d) HVR-L1, содержащего аминокислотную последовательность RASSSVEFIH (SEQ ID NO: 9); (e) HVR-L2, содержащего аминокислотную последовательность ATSNLAS (SEQ ID NO: 10); и (f) HVR-L3, содержащего аминокислотную последовательность QQWSSAPWT (SEQ ID NO: 11), или комбинацию из одного или более вышеприведенных HVR и одного или более их вариантов, обладающих по меньшей мере 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью) с любой из SEQ ID NO: 3 или 7-11. В некоторых случаях такой Fab может содержать усечение в шарнирном участке (например, верхнем шарнире) константного участка тяжелой цепи. В некоторых вариантах реализации изобретения константный участок Fab тяжелой цепи завершается положением 221 (нумерация EU). В некоторых вариантах реализации изобретения аминокислотный остаток положения 221 представляет собой Asp (D221). В некоторых вариантах реализации изобретения константный участок тяжелой цепи Fab содержит аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 156. В некоторых случаях Fab содержит следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность DSEMH (SEQ ID NO: 7); (b) HVR-H2, содержащий аминокислотную последовательность GVDPETEGAAYNQKFKG (SEQ ID NO: 8); и (с) HVR-H3, содержащий аминокислотную последовательность GYDYDYALDY (SEQ ID NO: 3); (d) HVR-L1, содержащий аминокислотную последовательность RASSSVEFIH (SEQ ID NO: 9); (е) HVR-L2, содержащий аминокислотную последовательность ATSNLAS (SEQ ID NO: 10); и (f) HVR-L3, содержащий аминокислотную последовательность QQWSSAPWT (SEQ ID NO: 11), и дополнительно содержит константный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 156.
В некоторых случаях Fab связывает HtrA1 и содержит (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью или аминокислотной последовательностью SEQ ID NO: 21; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью или аминокислотной последовательностью SEQ ID NO: 22; и (с) усечение в шарнирном участке (например, верхнем шарнире) константного участка тяжелой цепи. В некоторых вариантах реализации изобретения константный участок Fab тяжелой цепи завершается положением 221 (нумерация EU). В некоторых вариантах реализации изобретения аминокислотный остаток положения 221 представляет собой Asp (D221). В некоторых вариантах реализации изобретения константный участок тяжелой цепи Fab содержит аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 156. В некоторых вариантах реализации изобретения антитело содержит аминокислотную последовательность тяжелой цепи SEQ ID NO: 160. В некоторых вариантах реализации изобретения антитело содержит аминокислотную последовательность легкой цепи SEQ ID NO: 159. В некоторых вариантах реализации изобретения антитело содержит аминокислотную последовательность тяжелой цепи SEQ ID NO: 160 и аминокислотную последовательность легкой цепи SEQ ID NO: 159.
В некоторых случаях Fab связывает HtrA1 и содержит (а) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 21, (b) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 22, и (с) константный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 156.
4. Химерные и гуманизированные антитела
В некоторых вариантах реализации изобретения предложенное в настоящем документе антитело представляет собой химерное антитело. Некоторые химерные антитела описаны, например, в патенте США №4816567 и Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984). В одном примере химерное антитело содержит вариабельный участок нечеловеческого происхождения (например, вариабельный участок, происходящий от антитела мыши, крысы, хомяка, кролика или животного примата, например, обезьяны) и человеческий константный домен. В дополнительном примере химерное антитело представляет собой антитело «с переключенным классом», в котором класс или подкласс изменен по сравнению с исходным антителом. Термин «химерные антитела» включает антигенсвязывающие фрагменты таких антител.
В некоторых вариантах реализации изобретения химерное антитело представляет собой гуманизированное антитело. Как правило, нечеловеческое антитело гуманизируют для снижения иммуногенности для людей и сохранения при этом специфичности и аффинности исходного нечеловеческого антитела. Как правило, гуманизированное антитело содержит один или более вариабельных доменов, в которых HVR, например, CDR (или их фрагменты) происходят от антитела нечеловеческого происхождения, a FR (или их фрагменты) происходят от последовательностей антитела человека. Гуманизированное антитело необязательно также содержит по меньшей мере часть человеческого константного участка. В некоторых вариантах реализации изобретения некоторые остатки FR в гуманизированном антителе заменяют соответствующими остатками антитела нечеловеческого происхождения (например, антитела, из которого получены остатки HVR), например, с целью восстановления или улучшения специфичности или аффинности антитела.
Гуманизированные антитела и способы их создания рассмотрены, например, в Almagro and Fransson, Front. Biosci. Biosci. 13:1619-1633 (2008), и дополнительно описаны, например, в Riechmann et al., Nature 332:323-329 (1988); Queen et al., Proc. Nat'l Acad. Sci. USA 86:10029-10033 (1989); патентах США №5821337, 7527791, 6982321 и 7087409; Kashmiriet al., Methods 36:25-34 (2005) (где описана пересадка определяющего специфичность участка (SDR)); Padlan, Mol. Immunol. Immunol. 28:489-498 (1991) (где описано «изменение поверхности»);

Каркасные участки человека, которые можно применять для гуманизации, содержат, но не ограничиваются ими: каркасные участки, выбранные с использованием способа «наилучшего соответствия» (см., например, Sims et al., J. Immunol. 151:2296 (1993)); каркасные участки, полученные из консенсусной последовательности человеческих антител, содержащей конкретную подгруппу вариабельных участков легкой или тяжелой цепи (см., например, Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992) и Presta et al., J. Immunol., 151:2623 (1993)); зрелые (соматически мутировавшие) каркасные участки человека или эмбриональные каркасные участки человека (см., например, Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008)); и каркасные области, полученные при скрининге библиотек FR (см., например, Baca et al., J. Biol. Chem. 272:10678-10684 (1997) и Rosok et al., J. Biol. Chem. 271:22611-22618 (1996)).
5. Антитела человека
В некоторых вариантах реализации изобретения предложенное в данном документе антитело представляет собой антитело человека. Антитела человека могут быть получены с помощью различных методик, известных в данной области техники. Антитела человека в целом описаны в van Dijk and van de Winkel, Curr. OpIn. Pharmacol. 5: 368-74 (2001) и Lonberg, Curr. Opin. Immunol. 20:450-459 (2008).
Антитела человека можно получать путем введения иммуногена трансгенному животному, модифицированному с целью придания ему способности продуцировать интактные антитела человека или интактные антитела, содержащие вариабельные участки человека, в ответ на введение антигена. Такие животные обычно содержат все или часть локусов иммуноглобулинов человека, которые заменяют эндогенные локусы иммуноглобулинов, или которые присутствуют вне хромосом, или интегрируются случайным образом в хромосомы животного. У таких трансгенных мышей эндогенные локусы иммуноглобулинов обычно инактивированы. Обзор способов получения антител человека с использованием трансгенных животных см. Lonberg, Nat. Biotech. 23:1117-1125 (2005). Кроме того, см., например, патенты США №6075181 и 6150584, в которых описана технология XENOMOUSE™; патент США №5770429, в котором описана технология HUMAB®; патент США №7041870, в котором описана технология K-М MOUSE®, и публикацию патентной заявки США №US 2007/0061900, в которой описана технология VELOCIMOUSE®). Вариабельные области человека из интактных антител, генерируемых такими животными, можно дополнительно модифицировать, например, путем объединения с другой константной областью человека.
Антитела человека также можно получать с помощью гибридомных способов. Описаны человеческие миеломные и мышино-человеческие гетеромиеломные линии клеток, применяемые для получения моноклональных антител человека. (См., например, Kozbor J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and AppIications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)) и Boerneret al., J. Immunol., 147: 86 (1991).) Антитела человека, полученные посредством технологии на основе В-клеточных гибридом человека, также описаны в Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006). Дополнительные способы включают способы, описанные, например, в патенте США №7189826 (где описана продукция моноклональных lgM-антител человека гибридомными линиями клеток) и в Ni, Xiandai Mianyixue, 26(4):265-268 (2006) (где описаны гибридомы человека-человека). Технология на основе гибридом человека (технология триом) также описана в Vollmers and Brandlein, Histology and Histopathology, 20(3):927-937 (2005) и Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3): 185-91 (2005).
Антитела человека также можно получать путем выделения Fv-клона последовательностей вариабельного домена, отобранных из библиотек фагового дисплея человеческого происхождения. Такие последовательности вариабельного домена можно затем объединять с требуемым константным доменом человека. Методики отбора антител человека из библиотек антител описаны ниже.
6. Антитела, полученные из библиотек
Антитела по данному изобретению можно выделять путем скрининга комбинаторных библиотек на антитела, обладающие требуемой активностью или активностями. Например, в данной области техники известны различные способы создания библиотек фагового дисплея и скрининга таких библиотек на антитела, обладающие требуемыми характеристиками связывания. По таким способам составлен обзор, например в Hoogenboom et al. в Methods in Molecular Biology 178:1-37 (

В некоторых способах использования фаговых дисплеев репертуары генов VH и VL отдельно клонируют с помощью полимеразной цепной реакции (ПЦР) и случайным образом рекомбинируют в фаговых библиотеках, которые затем можно подвергать скринингу на антигенсвязывающие фаги, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Как правило, фаг отображает фрагменты антител либо в виде одноцепочечных фрагментов Fv (scFv), либо в виде фрагментов Fab. Библиотеки, полученные из иммунизированных источников, содержат антитела, обладающие высокой аффинностью к иммуногену, следовательно, необходимость конструирования гибридом отпадает. В альтернативном варианте можно клонировать наивный репертуар (например, человека) для обеспечения единого источника антител к широкому спектру чужеродных антигенов, а также аутоантигенов, без какой-либо иммунизации, как описано Griffiths et al., EMBO J, 12: 725-734 (1993). Наконец, наивные библиотеки можно также получать путем синтеза, клонируя сегменты V-генов стволовых клеток, не подвергавшихся реаранжировке, используя ПЦР-праймеры, содержащие случайную последовательность для кодирования гипервариабельных участков CDR3 и осуществления реаранжировки in vitro, как описано Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992). Патентные публикации, в которых описаны фаговые библиотеки антител человека включают, например: патент США №5750373 и патентные публикации США №2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек антител человека, в данном документе считаются антителами человека или фрагментами антител человека.
7. Мультиспецифические антитела
В некоторых вариантах реализации изобретения антитело, предложенное в настоящем документе, представляет собой мультиспецифическое антитело, например, биспецифическое антитело. Мультиспецифические антитела представляют собой моноклональные антитела, которые содержат по меньшей мере два разных участка специфического связывания. В некоторых вариантах реализации изобретения биспецифические антитела могут связываться с двумя различными эпитопами HtrA1. В некоторых вариантах реализации настоящего изобретения один из участков специфического связывания предназначен для HtrA1, а другой - для любого другого антигена (например, второй биологической молекулы, например, фактора D). Соответственно, биспецифическое антитело может обладать специфичностью связывания к HtrA1 и фактору D. Биспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител Любое из антител против HtrA1, описанных в данном документе, можно применять для конструирования мультиспецифического антитела (например, биспецифического антитела), например биспецифического антитела против HtrA1/фактора D. Любое из антител против фактора D, описанных в данном документе и/или известных в данной области техники, можно применять для конструирования такого биспецифического антитела против HtrA1/фактора D.
Например, в некоторых случаях биспецифическое антитело против HtrA1, содержащее по меньшей мере первый связывающий домен, который специфически связывает HtrA1, содержит по меньшей мере один, два, три, четыре, пять или шесть гипервариабельных участков (HVR), выбранных из: (а) HVR-H1, содержащего аминокислотную последовательность DSEX1H (SEQ ID NO: 1), где X1 представляет собой Met или Leu; (b) HVR-H2, содержащего аминокислотную последовательность GVDPETX1GAAYNQKFKG (SEQ ID NO: 2), где X1 представляет собой Glu или Asn; (с) HVR-H3, содержащего аминокислотную последовательность GYDYDYALDY (SEQ ID NO: 3); (d) HVR-L1, содержащего аминокислотную последовательность RASSSVX3FIH (SEQ ID NO: 4), где Х3 представляет собой Glu или Asn; (е) HVR-L2, содержащего аминокислотную последовательность ATSX4LAS (SEQ ID NO: 5), где Х4 представляет собой Asn, His или Glu; и (f) HVR-L3, содержащего аминокислотную последовательность QQWX5SX6PWT (SEQ ID NO: 6), где X5 представляет собой Ser или Tyr, а Х6 представляет собой Ala или Asn, или комбинацию из одного или более вышеприведенных HVR и одного или более их вариантов, обладающих по меньшей мере 80% идентичностью последовательности (например, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью) с любой из SEQ ID NO: 1-6, может содержать второй связывающий домен, который связывает фактор D. Второй связывающий домен, который специфически связывает фактор D может, например, содержать по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из: (a) HVR-H1, содержащего аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащего аминокислотную последовательность WINTYTGETTYAX1DFKG (SEQ ID NO: 110), где X1 представляет собой Asp или Glu; (с) HVR-H3, содержащего аминокислотную последовательность EGGVX1N (SEQ ID NO: 111), где X1 представляет собой Asn или Ser; (d) HVR-L1, содержащего аминокислотную последовательность ITSTX1IX2X3DMN (SEQ ID NO: 112), где X1 представляет собой Asp или Ser, Х2 представляет собой Asp или Glu, а Х3 представляет собой Asp или Ser; (е) HVR-L2, содержащего аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащего аминокислотную последовательность LQSX1SLPYT (SEQ ID NO: 114), где X1 представляет собой Asp или Glu, или комбинацию из одного или более вышеприведенных HVR и одного или более их вариантов, обладающих по меньшей мере 80% идентичностью последовательности (например, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью) с любой из SEQ ID NO: 109-114.
Например, в некоторых случаях биспецифическое антитело против HtrA1, содержащее первый связывающий домен, который специфически связывает HtrA1, содержит по меньшей мере один, два, три, четыре, пять или шесть гипервариабельных участков (HVR), выбранных из: (a) HVR-H1, содержащего аминокислотную последовательность DSEMH (SEQ ID NO: 7); (b) HVR-H2, содержащего аминокислотную последовательность GVDPETEGAAYNQKFKG (SEQ ID NO: 8); (с) HVR-H3, содержащего аминокислотную последовательность GYDYDYALDY (SEQ ID NO: 3); (d) HVR-L1, содержащего аминокислотную последовательность RASSSVEFIH (SEQ ID NO: 9); (е) HVR-L2, содержащего аминокислотную последовательность ATSNLAS (SEQ ID NO: 10); и (f) HVR-L3, содержащего аминокислотную последовательность QQWSSAPWT (SEQ ID NO: 11), или комбинацию из одного или более вышеприведенных HVR и одного или более их вариантов, обладающих по меньшей мере 80% идентичностью последовательности (например, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью) с любой из SEQ ID NO: 3 или 7-11, может содержать второй связывающий домен, который связывает фактор D. Второй связывающий домен, который специфически связывает фактор D, например, содержит по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из: (a) HVR-H1, содержащего аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащего аминокислотную последовательность WINTYTGETTYADDFKG (SEQ ID NO: 115); (c) HVR-H3, содержащего аминокислотную последовательность EGGVNN (SEQ ID NO: 116); (d) HVR-L1, содержащего аминокислотную последовательность ITSTDIDDDMN (SEQ ID NO: 117); (e) HVR-L2, содержащего аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащего аминокислотную последовательность LQSDSLPYT (SEQ ID NO: 118), или комбинацию из одного или более вышеприведенных HVR и одного или более их вариантов, обладающих по меньшей мере 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью) с любой из SEQ ID NO: 109, 113 или 115-118.
В конкретных вариантах реализации изобретения в изобретении предложено биспецифическое антитело против HtrA1, которое специфически связывает как HtrA1, так и фактор D, причем антитело содержит первый связывающий домен, который специфически связывает HtrA1, включающий следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность DSEMH (SEQ ID NO: 7); (b) HVR-H2, содержащий аминокислотную последовательность GVDPETEGAAYNQKFKG (SEQ ID NO: 8); (с) HVR-H3, содержащий аминокислотную последовательность GYDYDYALDY (SEQ ID NO: 3), (d) HVR-L1, содержащий аминокислотную последовательность RASSSVEFIH (SEQ ID NO: 9); (е) HVR-L2, содержащий аминокислотную последовательность ATSNLAS (SEQ ID NO: 10); и (f) HVR-L3, содержащий аминокислотную последовательность QQWSSAPWT (SEQ ID NO: 11); и второй связывающий домен, который специфически связывает фактор D, включающий следующие шесть HVR: (a) HVR-H1, содержащий аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащий аминокислотную последовательность WINTYTGETTYADDFKG (SEQ ID NO: 115); (с) HVR-H3, содержащий аминокислотную последовательность EGGVNN (SEQ ID NO: 116); (d) HVR-L1, содержащий аминокислотную последовательность ITSTDIDDDMN (SEQ ID NO: 117); (e) HVR-L2, содержащий аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащий аминокислотную последовательность LQSDSLPYT (SEQ ID NO: 118). В некоторых случаях второй связывающий домен содержит один, два, три, четыре, пять или шесть HVR из антигенсвязывающего фрагмента антитела против фактора D лампализумаба.
В некоторых случаях биспецифическое антитело против HtrA1 содержит первый связывающий домен, который специфически связывает HtrA1, содержащий (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 21; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 22; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b), такой как APEG.LC3.HC3, может содержать второй связывающий домен, который специфически связывается с фактором D. Второй связывающий домен, который специфически связывается с фактором D, может, например, содержать (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 119; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью SEQ ID NO: 120; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). В некоторых случаях второй связывающий домен, который специфически связывается с фактором D, может содержать (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью антигенсвязывающего фрагмента антитела против фактора D лампализумаба; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере около 80% идентичностью последовательности (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности) с последовательностью антигенсвязывающего фрагмента антитела против фактора D лампализумаба; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b).
Методики получения мультиспецифических антител включают, но не ограничиваются ими, рекомбинантную коэкспрессию двух пар тяжелой цепи-легкой цепи иммуноглобулинов, имеющих разную специфичность (см. Milstein and Cuello, Nature 305: 537 (1983)), WO 93/08829, and Traunecker et al., EMBO J. 10: 3655 (1991)) и рекомбинантную технологию «выступ-во-впадину» (см., например, патент США №5731168). Мультиспецифические антитела также можно получать за счет конструирования электростатических направляющих эффектов для создания Fc-гетеродимерных молекул антител (WO 2009/089004 А1); перекрестного сшивания двух или более антител или фрагментов (см., например, патент США 4676980 и Brennan et al., Science, 229: 81 (1985)); применения лейциновых молний для получения биспецифических антител (см., например, Kostelny et al., J. Immunol., 148(5):1547-1553 (1992)); применения технологии «диател» для создания биспецифических фрагментов антител (см., например, Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)); и применения одноцепочечных димеров Fv (sFv) (см., например, Gruber et al., J. Immunol., 152:5368 (1994)); и получения триспецифических антител, как описано, например, в Tutt et al. J. Immunol. 147:60 (1991).
В данный документа входит также конструирование антител с тремя или более функциональными антигенсвязывающими сайтами, в том числе «антител-осьминогов» (см., например, US 2006/0025576 А1).
В данном документе антитело или фрагмент также включает «FAb двойного действия» или «DAF», содержащее антигенсвязывающий сайт, связывающийся с HtrA1, а также с еще одним, отличающимся от него, антигеном (см., например, US 2008/0069820).
8. Варианты антител
В некоторых вариантах реализации изобретения предполагаются варианты аминокислотных последовательностей антител (например, варианты антител, содержащие одну или более замен аминокислотных остатков), предложенных в данном документе. Например, может требоваться улучшение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотных последовательностей антитела можно получать путем внесения соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или путем пептидного синтеза. Такие модификации включают, например, делеции и/или вставки и/или замены остатков в аминокислотных последовательностях антитела. Для получения конечной конструкции можно внести любую комбинацию делеций, вставок и замен при условии, что конечная конструкция обладает требуемыми характеристиками, например, связыванием с антигеном.
а) Варианты, полученные в результате замен, вставок и делеций
В некоторых вариантах реализации изобретения предложены варианты антител, содержащие одну или более аминокислотных замен. Сайты, представляющие интерес для заместительного мутагенеза, включают HVR и FR. Консервативные замены показаны ниже в таблице 1 под заголовком «предпочтительные замены». Более существенные изменения приведены в таблице 1 под заголовком «типичные замены» и подробнее описаны ниже по отношению к классам боковой цепи аминокислот. В интересующее антитело можно вносить аминокислотные замены и исследовать продукты посредством скрининга на предмет требуемой активности, например, сохранения/улучшения связывания антигена, снижения иммуногенности или улучшения АЗКЦ или КЗЦ.


Аминокислоты можно группировать по общим свойствам боковой цепи:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, влияющие на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены приводят к замене представителя одного из этих классов на представителя другого класса.
Один тип вариантов, полученных путем замены, включает замену одного или более остатков гипервариабельного участка и/или остатков FR исходного антитела (например, гуманизированного антитела или антитела человека). Как правило, полученный(-е) вариант(-ы), отобранный(-ые) для дальнейшего исследования, характеризуется(-ются) модификациями (например, улучшениями) определенных биологических свойств (например, повышенной аффинностью, увеличенной стабильностью, увеличенной экспрессией, измененной pI и/или сниженной иммуногенностью) по сравнению с исходным антителом и/или в значительной степени сохраняют определенные биологические свойства исходного антитела. Типичный вариант, получаемый путем замены, представляет собой антитело с созревшей аффинностью, которое можно легко получать, например, с использованием методик созревания аффинности на основе фагового дисплея, например, описанных в данном документе. Вкратце, подвергают мутации один или более остатков HVR и отображают вариантные антитела на фаге и подвергают скринингу на предмет конкретной биологической активности (например, аффинности связывания).
Можно вносить изменения (например, замены) в HVR, например, для улучшения аффинности антитела. Такие изменения можно вносить в «горячие точки» HVR, т.е. остатки, кодируемые кодонами, с высокой частотой подвергающимися мутациям во время процесса соматического созревания (см., например, Chowdhury, Methods Mol. Biol. 207:179-196 (2008)), и/или остатки, которые контактируют с антигеном, с тестированием полученного варианта VH или VL на аффинность связывания. Созревание аффинности путем конструирования и повторного отбора из вторичных библиотек описано, например, в Hoogenboom et al. в Methods in Molecular Biology 178:1-37 (

В некоторых вариантах реализации изобретения замены, вставки или делеций могут возникать в одном или более HVR при условии, что такие изменения по существу не снижают способность антитела к связыванию антигена. Например, в HVR можно вводить консервативные изменения (например, консервативные замены, как предложено в настоящем документе), которые по существу не снижают аффинность связывания. Такие изменения могут, например, находиться в HVR вне остатков, контактирующих с антигеном. В некоторых вариантах реализации изобретения из последовательностей вариантов VH и VL, предложенных выше, каждый HVR либо не изменен, либо содержит не более одной, двух или трех аминокислотных замен.
В некоторых вариантах реализации изобретения замены, вставки или делеций могут возникать в одном или более FR при условии, что такие изменения по существу не снижают способность антитела к связыванию антигена. Такие изменения могут, например, улучшать аффинность антитела и/или стабильность (например, по оценке с помощью повышенной температуры плавления).
Примеры остатков каркасного участка или остатки участка HVR в отношении модификации включают возможные сайты дезамидирования (т.е. аспарагин (N или Asn)), сайты окисления (т.е. метионин (М или Met) или триптофан (W или Trp)) или сайты превращения в пироглутамат (т.е. глутамин (Q или Gln)), причем модификация в таких сайтах, соответственно, предотвращает или снижает дезамидирование и/или окисление и/или превращение в пироглутамат.
Для предотвращения или снижения образования дезамидированных вариантов, аспарагин (N или Asn) можно подвергать мутации в аланин (А или Ala), глутамин (Q или Gln) или серин (S или Ser). Для предотвращения или снижения образования окисленных вариантов, метионин (Met) или триптофан (W или Trp) можно подвергать мутации в лейцин (L) или изолейцин (I). Для предотвращения или снижения образования вариантов с пироглутаматом, глутамин (Q или Gln) можно подвергать мутации в глутамат (Е или Glu). См., например, Amphlett al., Pharm. Biotechnol., 9:1-140, 1996. В альтернативном варианте или дополнительно, одно или более изменений (например, замен) остатков каркасного участка может происходить в участке Fc в исходном антителе.
Подходящий способ определения остатков или участков антитела, которые могут являться мишенями для мутагенеза, называется «мутагенезом с аланиновым сканированием», как описано в Cunningham and Wells (1989) Science, 244:1081-1085. В данном способе выявляют остаток или группу остатков-мишеней (например, заряженных остатков, таких как Arg, Asp, His, Lys и Glu) и замещают их нейтральными или отрицательно заряженными аминокислотами (например, аланином или полиаланином) для определения влияет ли это на взаимодействие антитела с антигеном. В аминокислотные положения, характеризующиеся функциональной чувствительностью к исходным заменам, можно вводить дополнительные замены. В альтернативном варианте или дополнительно, точки контакта антитела с антигеном идентифицируют с использованием кристаллической структуры комплекса антиген-антитело. Такие контактные остатки или соседние с ними остатки можно применять в качестве мишеней для замены, или они могут не рассматриваться как кандидаты для замены. Варианты можно подвергать скринингу для определения обладания ими требуемых свойств.
Вставки в аминокислотную последовательность включают амино- и/или карбоксил-концевые гибриды с вариацией длины от одного остатка до полипептидов, содержащих сотню или более остатков, а также вставки одного или множества аминокислотных остатков внутрь последовательности. Примеры концевых вставок включают антитело с N-концевым метионильным остатком. Другие инсерционные варианты молекулы антитела включают соединение N- или С-конца антитела с ферментом (например, для ADEPT) или полипептидом, который увеличивает период полувыведения антитела из сыворотки.
b) Варианты гликозилирования
В некоторых вариантах реализации изобретения антитело, предложенное в настоящем документе, изменяют для увеличения или уменьшения степени гликозилирования антитела. Добавление участков гликозилирования в антитело или удаление из него можно с легкостью осуществлять путем изменения аминокислотной последовательности, в результате чего создается или удаляется один или более сайтов гликозилирования.
Если антитело содержит участок Fc, то можно изменять присоединенный к нему углевод. Нативные антитела, продуцируемые клетками млекопитающих, как правило, содержат разветвленный двухантенарный олигосахарид, обычно присоединенный с помощью N-связи к Asn297 в домене СН2 участка Fc. См., например, Wright et al. TIBTECH 15:26-32 (1997). Данный олигосахарид может содержать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенные к GlcNAc в «стебле» двухантенарной олигосахаридной структуры. В некоторых вариантах реализации изобретения можно выполнять модификации олигосахарида в антителе по данному изобретению с целью создания вариантов антитела с определенными улучшенными свойствами.
В одном варианте реализации изобретения предложены варианты антител, содержащие углеводную структуру без фукозы, присоединенной (непосредственно или косвенно) к Fc-участку. Например, количество фукозы в таком антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Количество фукозы определяют путем расчета среднего количества фукозы в углеводной цепи при Asn297 по отношению к сумме всех углеводных структур, присоединенных к Asn 297 (например, сложных гибридных структур с высоким содержанием маннозы), измеренной с помощью ВП-МАЛДИ масс-спектрометрии, как описано, например, в WO 2008/077546. Asn297 относится к остатку аспарагина, расположенному приблизительно в положении 297 на Fc-участке (ЕС-нумерация остатков Fc-участка); однако Asn297 также может располагаться на расстоянии около ±3 аминокислоты выше или ниже положения 297, т.е. между положениями 294 и 300, из-за незначительных вариаций последовательностей у антител. Такие варианты фукозилирования могут обладать улучшенной функцией АЗКЦ. См., например, публикации патентов США № US 2003/0157108; US 2004/0093621. Примеры публикаций, касающихся «дефукозилированных» или «фукозодефицитных» вариантов антитела, включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki et al., J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al., Biotech. Bioeng. 87: 614 (2004). Примеры линий клеток, способных продуцировать дефукозилированные антитела, включают клетки Lec13 СНО, дефектные по фукозилированию белка (Ripka et al. Arch. Biochem. Biophys. 249:533-545 (1986); заявка на патент США № US 2003/0157108 А1, Presta, L; и WO 2004/056312 A1, Adams et al., особенно пример 11), и линии клеток с нокаутом, например, клетки СНО с нокаутом гена альфа-1,6-фукозилтрансферазы, FUT8 (см., например, Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004); Kanda et al., Biotechnol. Bioeng., 94(4):680-688 (2006); и WO 2003/085107).
Дополнительно, предложены варианты антител с олигосахаридами, разделенными пополам, например, в которых двухантенарный олигосахарид, присоединенный к Fc-участку антитела, разделен по GlcNAc. Такие варианты антител могут характеризоваться сниженным фукозилированием и/или улучшенной функцией АЗКЦ. Примеры таких вариантов антител описаны, например, в WO 2003/011878, патентах США №6602684 и US 2005/0123546 (Umana et al.). Кроме того, предложены варианты антител, содержащие по меньшей мере один остаток галактозы в составе олигосахарида, присоединенного к Fc-участку. Такие варианты антител могут обладать улучшенной функцией КЗЦ. Такие варианты антител описаны, например, в WO 1997/30087, WO 1998/58964 и WO 1999/22764.
с) Варианты Fc-участка
В некоторых вариантах реализации в Fc-участок антитела, предложенного в настоящем документе, можно вводить одну или более аминокислотных модификаций, тем самым получая вариант Fc-участка. Вариант Fc-участка может содержать последовательность Fc-участка человека (например, Fc-участок lgG1, lgG2, lgG3 или lgG4 человека), содержащую изменение аминокислотного остатка (например, замену) в одном или более аминокислотных положениях. В некоторых вариантах реализации в изобретении рассматривается вариант антитела, обладающий некоторыми, но не всеми эффекторными функциями, что делает его желательным кандидатом для вариантов применения, в которых важен период полувыведения антитела in vivo, а некоторые эффекторные функции (например, для комплемента и АЗКЦ) не нужны или вредны. Для подтверждения снижения/ослабления активности КЗЦ и/или АЗКЦ можно выполнять анализы цитотоксичности in vitro и/или in vivo. Например, для подтверждения отсутствия связывания антитела с FcγR (следовательно, по всей вероятности, отсутствия активности АЗКЦ), но сохранения способности связывания FcRn, можно проводить анализы связывания рецептора Fc (FcR). Основные клетки, опосредующие АЗКЦ, NK-клетки, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Сводная информация об экспрессии FcR на кроветворных клетках приведена в таблице 3 на с. 464 Ravetch and Kinet, Annu. Rev. Immunol. 9:457-492 (1991).
He ограничивающие примеры анализов in vitro для оценки активности АЗКЦ представляющей интерес молекулы, описаны в патенте США 5500362 (см., например, Hellstrom et al., Proc. Nat'l Acad. Sci. USA 83:7059-7063 (1986) и Hellstrom et al., Proc. Nat'l Acad. Sci. USA 82:1499-1502 (1985); патент США №5821337 и Bruggemann et al., J. Exp. Med. 166:1351-1361 (1987)). В альтернативном варианте можно использовать методы анализов без радиоактивных меток (см., например, анализ цитотоксичности ACTI™ для проточной цитометрии без радиоактивных меток (CellTechnology, Inc., г. Маунтин-Вью, штат Калифорния, США; и анализ цитотоксичности CYTOTOX 96® без радиоактивных меток (Promega, г. Мэдисон, штат Висконсин, США). В качестве эффекторных клеток в таких анализах можно применять мононуклеарные клетки периферической крови (МКПК) и клетки-естественные киллеры (NK). В альтернативном варианте, или дополнительно, активность АЗКЦ представляющей интерес молекулы можно оценивать in vivo, например, на животной модели, такой как описано в Clynes et al. Nat'l Acad. Sci. USA 95:652-656 (1998). Для подтверждения неспособности антитела связывать C1q и, следовательно, отсутствия активности КЗЦ, также можно проводить анализы связывания C1q. См., например, анализ ELISA по связыванию C1q и С3с в WO 2006/029879 и WO 2005/100402. Для оценки активации комплемента можно выполнять анализ КЗЦ (см., например, Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996); Cragg et al., Blood 101:1045-1052 (2003) и Cragg et al., Blood 103:2738-2743 (2004)). Определения связывания FcRn и выведения/периодов полувыведения также можно выполнять с использованием методов, известных в данной области техники (см., например, Petkova et al., Int'l. Immunol. 18(12): 1759-1769 (2006)).
Антитела с пониженной эффекторной функцией включают антитела с заменой одного или более из остатков 238, 265, 269, 270, 297, 327 и 329 Fc-участка (патент США №6737056). Такие Fc-мутанты включают Fc-мутантов с заменами в двух или более аминокислотных положениях 265, 269, 270, 297 и 327, включая так называемые Fc-мутанты «DANA» с заменой остатков 265 и 297 на аланин (патент США №7332581).
Описаны некоторые варианты антител с улучшенным или уменьшенным связыванием с FcR. (См., например, патент США №6737056; WO 2004/056312 и Shields et al., J. Biol. Chem. 9(2): 6591-6604 (2001)).
В некоторых вариантах реализации изобретения вариант антитела содержит Fc-участок с одной или более аминокислотными заменами, которые улучшают АЗКЦ, например, замены в положениях 298, 333 и/или 334 Fc-участка (EU-нумерация остатков).
В некоторых вариантах реализации изобретения вносят изменения в Fc-участок, что приводит к изменению (т.е. улучшению или снижению) связывания C1q и/или комплемент-зависимой цитотоксичности (КЗЦ), например, как описано в патенте США №6194551, WO 99/51642 и Idusogie et al., J. Immunol. 164: 4178-4184 (2000).
Антитела с повышенными периодами полувыведения и улучшенным связыванием с неонатальным рецептором Fc (FcRn), который отвечает за перенос материнских IgG плоду (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)), описаны в US 2005/0014934 A1 (Hinton et al.). Данные антитела содержат Fc-участок с одной или более заменами в них, которые улучшают связывание Fc-участка с FcRn. Такие варианты Fc включают те, которые содержат замены в одном или более остатков Fc-участка: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замена остатка 434 Fc-участка (патент США №7371826). См. также Duncan & Winter, Nature 322:738-40 (1988); патент США №5648260; патент США №5624821 и WO 94/29351, относительно других примеров вариантов Fc-участка.
d) Варианты антител, сконструированные с использованием остатков цистеина
В некоторых вариантах реализации может требоваться создавать антитела, сконструированные с использованием остатков цистеина, например, «тиоМАb», в которых один или более остатков антитела заменены остатками цистеина. В конкретных вариантах реализации изобретения замененные остатки находятся в доступных сайтах антитела. Путем замены данных остатков цистеином в доступных сайтах антитела таким образом располагаются реакционноспособные тиольные группы, которые можно использовать для конъюгирования антитела с другими фрагментами, такими как фрагменты лекарственных средств или фрагменты линкер-лекарственное средство, для создания иммуноконъюгата, как дополнительно описано в данном документе. В некоторых вариантах реализации изобретения цистеином можно заменять один или более из следующих остатков: V205 (нумерация Кабата) легкой цепи; А118 (EU-нумерация) тяжелой цепи и S400 (EU-нумерация) Fc-участка тяжелой цепи. Антитела, сконструированные с использованием остатков цистеина, можно получать, как описано, например, в патенте США №7521541.
е) Производные антител В некоторых вариантах реализации изобретения антитело, предложенное в данном документе, можно дополнительно модифицировать, чтобы оно содержало дополнительные небелковые фрагменты, известные в данной области и легко доступные. Фрагменты, подходящие для получения производных антитела, включают водорастворимые полимеры, но не ограничиваются ими. Неограничивающие примеры водорастворимых полимеров включают полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля и пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (гомополимеры или случайные сополимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры пропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси, но не ограничиваются ими. При производстве пропионовый альдегид полиэтиленгликоля может обладать преимуществами из-за его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединенных к антителу, может изменяться и, в случае присоединения более одного полимера, они могут представлять собой одинаковые или разные молекулы. В целом, число и/или тип полимеров, используемых для получения производных, можно определять, исходя из соображений, включающих конкретные свойства или функции антител, подлежащие улучшению, возможность применения производных антитела в терапии при определенных условиях и т.д., но не ограничивающихся ими.
Конъюгаты антитела-полимера можно получать, используя подходящую методику для дериватизации антитела с полимерами. Таким образом, следует понимать, что изобретение не ограничивается конъюгатами, в которых применяется любой конкретный тип связи или связь между антителом или фрагментом антитела и полимером.
В одном аспекте конъюгат по данному изобретению включает виды, в которых полимер ковалентно присоединен к специфическому сайту или специфическим сайтам на исходном антителе, т.е. присоединение полимера нацелено на конкретный участок или конкретный аминокислотный остаток или остатки в исходном антителе или фрагменте антитела. Сайт-специфической конъюгации полимеров чаще всего достигают присоединением к остаткам цистеина в исходном антителе или фрагменте антитела. В таких вариантах реализации изобретения при химическом связывании может, например, использоваться свободная сульфгидрильная группа цистеинового остатка, не находящаяся в исходном антителе в дисульфидном мостике. Полимер можно активировать по любой функциональной группе, способной специфически реагировать со свободной(-ыми) сульфгидрильной(-ыми) или тиольной(-ыми) группой(-ами), такими как функциональные группы малеимида, сульфгидрила, тиола, трифлата, тезилата, азиридина, экзирана и 5-пиридила. Полимер можно соединять с исходным антителом, используя любой протокол, пригодный для химической реакции выбранной системы связывания, такой как протоколы и системы, описанные в патентах США №4179337 и 7122636 и Jevsevar et al., Biotech. J. 5:113-128, 2010.
В одном варианте реализации изобретения один или более цистеиновых остатков, естественным образом присутствующих в исходном антителе, используют в качестве сайта(-ов) присоединения для конъюгации полимера. В другом варианте реализации изобретения с целью обеспечения специфического сайта или сайтов для присоединения полимера в исходном антителе в выбранном сайте или сайтах конструируют один или более остатков цистеина.
В одном аспекте изобретение охватывает конъюгаты фрагмента антитела-полимера, причем фрагмент антитела представляет собой Fab, а полимер присоединен к одному или более цистеиновым остаткам в легкой или тяжелой цепи фрагмента Fab, что, как правило, может формировать дисульфидную связь между цепями, связывающую легкую и тяжелую цепи.
В одном аспекте изобретение охватывает конъюгаты фрагмента антитела-полимера, причем фрагмент антитела представляет собой Fab, а присоединение полимера нацелено на шарнирный участок фрагмента Fab'. В одном варианте реализации изобретения один или более цистеиновых остатков, естественным образом присутствующие в шарнирном участке фрагмента антитела, используют для присоединения полимера. В другом варианте реализации изобретения с целью обеспечения специфического сайта или сайтов для присоединения полимера в шарнирном участке фрагмента Fab' конструируют один или более остатков цистеина. В одном варианте реализации изобретения с целью обеспечения одного сайта присоединения для конъюгации полимера фрагмент Fab по данному изобретению (например, фрагмент Fab против HtrA1, фрагмент Fab против фактора D или фрагмент Fab против HtrA1/фактора D) модифицируют добавлением одного цистеина в С'-концевой участок. В другом варианте реализации изобретения с целью обеспечения двух сайтов присоединения для конъюгации полимера фрагмент Fab по данному изобретению модифицируют добавлением четырех дополнительных остатков, Cys-Pro-Pro-Cys (SEQ ID NO: 122) в С'-концевом участке.
Одним обычно используемым способом конъюгации антител является ПЭГилирование, при котором один или более полимеров полиэтиленгликоля (ПЭГ) ковалентно присоединяют к константному участку антитела. См. патенты США №4179337 и 7122636. В данной области известны и широко применяют полимеры ПЭГ различных размеров (например, от около 500 Да до около 300000 Да). Полимеры, пригодные для данного изобретения, можно приобретать на рынке (например, в компаниях Nippon Oil and Fats; Nektar Therapeutics; Creative PEGWorks) или получать из доступных в продаже исходных веществ, используя традиционные химические процедуры. ПЭГилирование изменяет физические и химические свойства лекарственного средства на основе антитела и может приводить к улучшенным фармакокинетическим параметрам, таким как улучшенная стабильность, уменьшенная иммуногенность, увеличенный период циркуляции, а также увеличенное время удержания. В другом варианте реализации изобретения любое антитело, описанное в данном документе (например, антитело против HtrA1 по данному изобретению) можно конъюгировать с гиалуроновой кислотой (НА).
В другом варианте реализации настоящего изобретения предложены конъюгаты антитела с небелковым фрагментом, который можно избирательно нагревать посредством воздействия облучения. В одном варианте реализации изобретения небелковый фрагмент представляет собой углеродную нанотрубку (Kam et al., Proc. Natl. Acad. Sci. USA 102:11600-11605 (2005)). Длина волны излучения может быть любой и включает длины волн, но не ограничивается, не повреждающие обычные клетки длины волн, но нагревающие небелковый фрагмент до температуры, вызывающей гибель клеток, расположенных поблизости от антитела с небелковым фрагментом.
f) Варианты по изоэлектрической точке
В изобретении предложены варианты антител с измененными изоэлектрическими точками. Например, в изобретении предложены варианты антител с пониженным значением изоэлектрической точки (pI), например, по сравнению с эталонным антителом против HtrA1. В некоторых случаях заряд поверхности снижен до физиологического рН. В некоторых случаях антитело против HtrA1 имеет значение pI ниже или равное около 8 (например, около 8, около 7, около 6, около 5 или около 4). В некоторых случаях антитело имеет pI от около 4 до около 8 (например, около 4, около 5, около 6, около 7 или около 8). В некоторых случаях антитело против HtrA1 имеет pI от около 5 до около 7 (например, около 5, около 6 или около 7). В некоторых случаях антитело против HtrA1 имеет pI от около 5 до около 6 (например, около 5,1, около 5,2, около 5,3, около 5,4, около 5,5, около 5,6, около 5,7, около 5,8, около 5,9 или около 6).
Антитела по данному изобретению можно конструировать для получения пониженного pI, например, заменой аминокислотных остатков дикого типа в заданном положении на аминокислоту, имеющую более низкое значение pI. Значение pI аминокислоты можно определять на основании значений pKa амина (-NH2), карбоновой кислоты (-СООН) и аминокислоты боковой цепи, которые известные в данной области техники. В некоторых вариантах реализации изобретения для снижения pI антитела можно заменять расположенные на поверхности аминокислотные остатки. В одном варианте реализации изобретения можно заменять расположенные на поверхности аминокислотные остатки на глутамат (Е). В одном варианте реализации изобретения можно заменять расположенные на поверхности аминокислотные остатки на аспартат (D).
D. Рекомбинантные способы и композиции
Любое из антител (например, антител против HtrA1), описанных в данном документе, можно получать с использованием рекомбинантных способов и композиций, например, как описано в патенте США №4816567. В одном варианте реализации изобретения предложена выделенная нуклеиновая кислота, кодирующая антитело против HtrA1, описанное в данном документе. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепи антитела). В дополнительном варианте реализации изобретения предложен один или более векторов (например, экспресснойных векторов), содержащих такую нуклеиновую кислоту. В дополнительном варианте реализации изобретения предложена клетка-хозяин, содержащая такую нуклеиновую кислоту. В одном таком варианте реализации изобретения клетка-хозяин содержит (например, была трансформирована с использованием): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. В одном варианте реализации изобретения клетка-хозяин является эукариотической, например, клеткой яичника китайского хомяка (СНО) или лимфоидной клеткой (например, клеткой Y0, NS0, Sp20). В одном варианте реализации изобретения предложен способ получения антитела против HtrA1, включающий культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, как предложено выше, в условиях, подходящих для экспрессии антитела, и, при необходимости, выделение антитела из клетки-хозяина (или культуральной среды клетки-хозяина).
Для рекомбинантной продукции антитела против HtrA1 нуклеиновая кислота, кодирующая антитело, например, как описано выше, выделена и вставлена в один или более векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такую нуклеиновую кислоту можно легко выделять и секвенировать с использованием общепринятых процедур (например, с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела).
Клетки-хозяева, подходящие для клонирования или экспрессии векторов, кодирующих антитело, включают прокариотические или эукариотические клетки, описанные в данном документе. Например, антитела можно получать в бактериях, в особенности, если гликозилирование и эффекторная функция Fc не являются необходимыми. Экспрессию фрагментов антитела и полипептидов в бактериях см., например, в патентах США №5648237, 5789199 и 5840523. См. также Charlton, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ, 2003), pp. 245-254, где описана экспрессия фрагментов антитела в Е. coli. После экспрессии антитело можно выдеять из бактериальной биомассы в растворимую фракцию и подвергать дальнейшей очистке.
Помимо прокариотов в качестве хозяев, подходящих для клонирования или экспрессии векторов, кодирующих антитело, можно использовать эукариотические микроорганизмы, такие как мицелиальные грибы или дрожжи, включающие штаммы грибов и дрожжей с «гуманизированными» путями гликозилирования, которые позволяют получать антитело с частично или полностью человеческим профилем гликозилирования. См. Gerngross, Nat. Biotech. 22:1409-1414 (2004) и Li et al., Nat. Biotech. 24:210-215 (2006).
Клетки-хозяева, подходящие для экспрессии гликозилированного антитела, также можно получать из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Идентифицированы многочисленные бакуловирусные штаммы, которые можно использовать в сочетании с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
В качестве хозяев также можно использовать культуры растительных клеток. См., например, патенты США №5959177, 6040498, 6420548, 7125978 и 6417429 (где описана технология PLANTIBODIES™ для продукции антител в трансгенных растениях).
В качестве хозяев также можно использовать клетки позвоночных. Например, можно использовать линии клеток млекопитающих, адаптированные для роста в суспензии. К другим примерам используемых линий клеток млекопитающих в качестве клеток-хозяев относятся линия клеток CV1 почки обезьяны, трансформированная SV40 (COS-7); линия человеческих эмбриональных клеток почки (293 или клетки 293, которые описаны, например, в Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки новорожденного хомяка (ВНК); клетки Сертоли мыши (клетки ТМ4, как описано, например, в Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK; клетки печени крысы линии buffalo (BRL 3А); клетки легкого человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TRI, как описано, например, в статье Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982); клетки MRC 5 и клетки FS4. Другие подходящие линии клеток-хозяев млекопитающих включают клетки яичника китайского хомяка (СНО), в том числе DHFR-клетки СНО (Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); и миеломные линии клеток, такие как Y0, NS0 и Sp2/0. Обзор некоторых линий клеток-хозяев млекопитающих, пригодных для продукции антител, см., например, в Yazaki and Wu, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ), pp. 255-268 (2003).
E. Анализы
Антитела против HtrA1 (например, антитела против HtrA1 и антитела против HtrA1 /фактора D), предложенные в данном документе, можно идентифицировать, подвергнуть скринингу или характеризовать по их физическим/химическим свойствам и/или видам биологической активности с помощью разных анализов, известных в данной области техники.
1. Анализы связывания и другие анализы
В одном аспекте антитело по данному изобретению исследуют на его антигенсвязывающую активность, например, с помощью известных методов, таких как анализы ELISA, вестерн-блоттинга, поверхностного плазмонного резонанса (например, BIACORE®) и т.п.
В одном аспекте активность связывания антигена (например, как указано значением KD) измеряют с использованием анализа поверхностного плазмонного резонанса (ППР) BIACORE®. Например, анализ с использованием прибора BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., г. Пискатауэй, штат Нью-Джерси, США) выполняют при 25°С на чипах СМ5 с иммобилизованным антигеном при ~10 единицах ответа (RU). В одном варианте реализации изобретения чипы биосенсора с карбоксиметилированным декстраном (СМ5, BIACORE, Inc.) активировали N-этил-N'-(3-диметиламинопропил)-карбодиимидгидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Антиген разбавляют 10 мМ раствором ацетата натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ) и затем вводят его при скорости потока 5 мкл/минуту до достижения приблизительно 10 единиц ответа (RU) связанного белка. После введения антигена вводят 1 М этаноламина для блокирования непрореагировавших групп. Для измерений кинетических параметров двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) вводят в ФСБ с 0,05% полисорбатом-20 (Tween®-20) (PBST) при 25°С при скорости потока приблизительно 25 мкл/мин. Скорости ассоциации (ka) и диссоциации (kд) рассчитывают с помощью простой модели связывания Ленгмюра при соотношении один к одному (программное обеспечение BIACORE® Evaluation Software версии 3.2) путем одновременной аппроксимации сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (KD) рассчитывают как соотношение kд/ka. См., например, Chen et al., J. Mol. Biol. 293:865-881 (1999). Если скорость ассоциации согласно вышеописанному анализу поверхностного плазмонного резонанса превышает 106 М-1 с-1, то ее можно определять с помощью методики гашения флуоресценции, измеряющей увеличение или снижение интенсивности испускания флуоресценции (возбуждение = 295 нм; испускание = 340 нм, полоса пропускания 16 нм) при 25°С для 20 нМ раствора антител против антигена (в форме Fab) в ФСБ, рН 7,2, в присутствии возрастающих концентраций антигена при измерении на спектрометре, таком как оборудованный для исследования методом остановленного потока (Aviv Instruments) или спектрофотометре SLM-AMINCO™ серия 8000 (ThermoSpectronic) с перемешиваемой кюветой. Значение KD также можно измерять с использованием анализа ППР BIACORE®, как описано в ниже в примерах.
В другом аспекте для выявления антитела, конкурирующего с антителом, как описано в данном документе, за связывание с HtrA1, можно использовать конкурентные анализы. В некоторых вариантах реализации такое конкурирующее антитело связывается с тем же эпитопом (например, линейным или конформационным эпитопом), что и антитело, описанное в данном документе. Подробные примеры способов картирования эпитопа, с которым связывается антитело, представлены в Morris (1996) "Epitope Mapping Protocols," в Methods in Molecular Biology vol. 66 (Humana Press, Totowa, NJ).
В типичном конкурентном анализе иммобилизованный HtrA1 инкубируют в растворе, содержащем первое меченое антитело, которое связывается с HtrA1, и второе немеченое антитело, подлежащее исследованию на способность конкурировать с первым антителом за связывание с HtrA1. Второе антитело может присутствовать в супернатанте гибридом. В качестве контроля иммобилизованный HtrA1 инкубируют в растворе, содержащем первое меченое антитело, но не содержащем второе немеченое антитело. После инкубирования в условиях, благоприятных для связывания первого антитела с HtrA1, удаляют избыток несвязанного антитела и измеряют количество метки, связанной с иммобилизованным HtrA1. Если количество метки, связанной с иммобилизованным HtrA1, существенно снижается в исследуемом образце по сравнению с контрольным образцом, то это указывает на то, что второе антитело конкурирует с первым антителом за связывание с HtrA1. См. Harlow and Lane (1988) Antibodies: A Laboratory Manual ch. 14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY).
2. Анализы активности
В одном аспекте изобретения предложены анализы для выявления антител против HtrA1, обладающих биологической активностью. Биологическая активность может заключаться, например, в ингибировании, блокировании, антагонистическом воздействии, подавлении, интерференции, модуляции и/или снижении одной или более биологических активностей HtrA1. Предложены также антитела, обладающие такой биологической активностью in vivo и/или in vitro.
В некоторых вариантах реализации изобретения антитело по данному изобретению исследуют на такую биологическую активность. В некоторых вариантах реализации изобретения антитело против HtrA1 связывается с HtrA1 и снижает или ингибирует ее активность сериновой протеазы по отношению к одному или более субстратов HtrA1, включая, например, субстрат H2-Opt, α-казеин, β-казеин или BODIPY® FL-казеиновые субстраты, как описано ниже в примерах, или любому другому подходящему субстрату HtrA1. В некоторых вариантах реализации изобретения антитело против HtrA1 ингибирует активность сериновой протеазы HtrA1 с IC50 менее 50 нМ, 30 нМ, 25 нМ, 20 нМ, 15 нМ, 10 нМ, 5 нМ, 3 нМ, 2,5 нМ, 2 нМ, 1 нМ, 800 пМ, 600 пМ, 500 пМ, 400 пМ, 300 пМ, 200 пМ, 100 пМ, 50 пМ или меньше по отношению к одному или более субстратам HtrA1. В некоторых вариантах реализации изобретения антитело против HtrA1 защищает фоторецепторные клетки от разрушения, защищая толщину внешнего ядерного слоя, или защищает функциональную активность электроретинограммы в модели глазного заболевания, такой как мышиная модель с постоянным воздействием света, описанной в примере 10 U.S. 2013/0129743.
Для определения способности антитела или его варианта или фрагмента против фактора D (например, антигенсвязывающего фрагмента) связываться с фактором D и проявлять биологическое действие, например, ингибирование альтернативного пути гемолиза, можно использовать анализы гемолитического ингибирования, используя эритроциты кролика (RBC), включая анализы описанные в примере 2 патента США №8273352, который включен в данный документ в полном объеме путем ссылки. Такое гемолитическое ингибирование можно определять с использованием стандартных анализов (Kostavasili et al., J. Immunology 158:1763-72,1997; Wiesmann et al., Nature 444:159-60, 2006). В таких анализах активацию комплемента можно инициировать с помощью сыворотки или плазмы. Соответствующие концентрации фактора D в сыворотке и плазме (Pascual et al., Kidney International 34:529-536, 1998; Complement Facts Book, Bernard J. Morley and Mark J. Walport, editors, Academic Press (2000); Barnum et al., J. Immunol. Methods, 67: 303-309, 1984) можно обычным образом определять в соответствии с методами, известными в данной области техники, включая описанные в таких ссылках как Pascual et al., выше и Barnum et al., выше, и в примере 4 патента США №8273352. Антитела против фактора D, описанные в данном документе, в целом способны ингибировать биологические активности, связанные с фактором D. Например, при концентрации 18 мкг/мл (эквивалентной около 1,5-кратной молярной концентрации фактора D человека в крови; молярное соотношение антитела против фактора D составляет около 1,5:1), может наблюдаться значительное ингибирование альтернативной комплементарной активности антителом (см., например, патент США №6956107).
3. Анализы стабильности
В одном аспекте изобретения предложены анализы для определения стабильности (например, термостабильности) антитела против HtrA1. Например, стабильность антитела можно определять, применяя любой способ, известный в данной области техники, например, дифференциальную сканирующую флуориметрию (ДСФ), круговой дихроизм (КД), собственную флуоресценцию белков, дифференциальную сканирующую калориметрию (ДСК), спектроскопию, рассеяние света (например, динамическое рассеяние света (ДРС) и статическое рассеяние света (СРС), хроматографию на основе самовзаимодействия (SIC). Стабильность количественным анализом можно определять, как описано в данном документе, например, используя масс-спектрометрию, описанную, например, в примере 4, например, в контексте стресс-исследования ААРН и/или стресс-исследования при повышенных температурах.
F. Способы и композиции для диагностики и обнаружения
В некоторых вариантах реализации любое из антител против HtrA1, предложенных в данном документе, можно применять для обнаружения наличия HtrA1 в биологическом образце. В контексте данного документа термин «обнаружение» охватывает количественное или качественное обнаружение. В некоторых вариантах реализации изобретения биологический образец содержит клетку или ткань, такой как образец, содержащий фоторецепторные клетки, клетки пигментного эпителия сетчатки, клетки внешнего ядерного слоя, внутреннего ядерного слоя, клетки Мюллера, ресничный эпителий или ткань сетчатки. В некоторых вариантах реализации изобретения биологический образец содержит биологическую жидкость организма, например, стекловидное тело или кровь.
В одном варианте реализации изобретения предложено антитело против HtrA1 для применения в способе диагностики или обнаружения. В дополнительном аспекте предложен способ обнаружения наличия HtrA1 в биологическом образце. В некоторых вариантах реализации изобретения способ включает приведение в контакт биологического образца с антителом против HtrA1, описанным в данном документе, в условиях, допускающих связывание антитела против HtrA1 с HtrA1, и определение образования комплекса между антителом против HtrA1 и HtrA1. Такой способ можно осуществлять in vitro или in vivo. В одном варианте реализации изобретения антитело против HtrA1 применяют для отбора субъектов, подходящих для лечения с помощью антитела против HtrA1, например, если HtrA1 является биомаркером для отбора пациентов.
В некоторых вариантах реализации изобретения пациента, которому подходит лечение с помощью антитела против HtrA1, можно идентифицировать выявлением одного или более полиморфизмов в гене HtrA1 или регуляторной последовательности HtrA1, такого как полиморфизм промотора HtrA1 rs11200638(G/A) (см., например, DeWan et al., Science 314: 989-992, 2006, которая включена в данный документ в полном объеме путем ссылки).
Типовые нарушения, которые можно диагностировать с использованием антитела по данному изобретению включают рак, но не ограничиваются ими, связанные с HtrA нарушения, глазные нарушения, связанные с комплементом нарушения и преэклампсия. В некоторых примерах глазное нарушение включает, но не ограничивается ими, ВМД, включая влажную ВМД (включая раннюю, промежуточную и запущенную влажную ВМД) и сухую ВМД (включая раннюю, промежуточную и запущенную сухую ВМД (например, географическую атрофию (ГА)), диабетическую ретинопатию (ДР), ретинопатию недоношенных (ROP) или полипообразную хориоидальную васкулопатию (PCV).
В некоторых вариантах реализации изобретения использованием антитела по данному изобретению можно диагностировать преэклампсию. В некоторых вариантах реализации изобретения увеличенный уровень HtrA1 в образце, полученном у субъекта, относительно эталонного уровня HtrA1 может быть показателем наличия у субъекта преэклампсии или его восприимчивости к ней. См., например, Teoh et al. Placenta 36(9):990-995, 2015. В некоторых вариантах реализации изобретения использованием антитела по данному изобретению можно выявлять в сыворотке уровни HtrA1. В других вариантах реализации изобретения использованием антитела по данному изобретению можно выявлять плацентарные уровни HtrA1.
В некоторых вариантах реализации изобретения предложены меченые антитела против HtrA1. Метки включают метки или фрагменты, обнаруживаемые непосредственно (например, флуоресцентные, хромофорные, электронно-плотные, хемилюминесцентные и радиоактивные метки), а также такие фрагменты, как ферменты или лиганды, обнаруживаемые косвенно, например, с помощью ферментативной реакции или молекулярных взаимодействий, но не ограничиваются ими. Типичные метки включают радиоизотопы32Р,14С,125I,3Н и131I, флуорофоры, например, хелаты редкоземельных элементов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люциферазу светляка и бактериальную люциферазу (патент США №4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, оксидазы углеводов, например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу, оксидазы гетероциклических соединений, например, уриказу и ксантиноксидазу, в сочетании с ферментом, который использует пероксид водорода для окисления предшественника красителя, например, HRP, лактопероксидазой или микропероксидазой, биотин/авидин, спиновые метки, метки-бактериофаги, стабильные свободные радикалы и т.п., но не ограничиваются ими.
В другом варианте реализации изобретения антитело не требует введения метки, а его присутствие можно выявлять, используя меченое антитело, которое связывается с данным антителом.
Антитела данного изобретение можно применять в любом известном методе анализа, таком как анализы конкурентного связывания, прямые и непрямые сэндвич-анализы и анализы иммунопреципитации. Zola, Monoclonal Antibodies: A Manual of Techniques, pp. 147-158 (CRC Press, Inc. 1987).
Анализы конкурентного связывания зависят от способности меченного стандарта конкурировать с аналитом испытуемого образца за связывание с ограниченным количеством антитела. Количество антигена в испытуемом образце обратно пропорционально количеству стандарта, который осуществляет связывание с этими антителами. Для облегчения определения количества стандарта, который осуществляет связывание, антитела обычно переводят в нерастворимую форму до или после конкурентного связывания так, чтобы стандарт и аналит, которые связаны с антителами, можно было удобно отделять от молекул стандарта и аналита, которые остались несвязанными.
В сэндвич-анализах задействуют два антитела, каждое из которых способно связываться с различной иммуногенной частью или эпитопом выявляемого белка. В сэндвич-анализе аналит испытуемого образца связан первым антителом, которое иммобилизировано на твердой подложке и, после этого, второе антитело связывается с аналитом, благодаря этому образуется нерастворимый комплекс из трех частей. См., например, патент США №4376110. Второе антитело можно само метить детектируемым фрагментом (прямой сэндвич-анализ) или можно проводить измерения с использованием антитела против иммуноглобулина, которое мечено выявляемым фрагментом (непрямой сэндвич-анализ). К примеру, один тип сэндвич-анализа представляет собой твердофазный иммуноферментный анализ (ELISA), в случае которого выявляемым фрагментом является фермент.
Для иммуногистохимического исследования образец может быть свежим или замороженным, или он может быть залит парафином и фиксирован таким консервантом, как, например, формалин.
G. Диагностические наборы
В целях удобства антитело по данному изобретению (например, антитело против HtrA1 или антитело против HtrA1/фактора D) можно предоставлять в наборе, т.е. расфасованной комбинации реактивов в предварительно определенных количествах с инструкциями для выполнения диагностического анализа. Если антитело метят ферментом, набор будет содержать субстраты и кофакторы, необходимые для фермента (например, предшественник субстрата, который обеспечивает выявляемый хромофор или флуорофор). В дополнение к этому, в состав набора можно включать другие добавки, такие как стабилизаторы, буферы (например, блокирующий буфер или лизирующий буфер) и т.п. Для обеспечения концентраций реактивов в растворах, которые практически оптимизируют чувствительность анализа, можно в широких пределах варьировать относительные количества различных реактивов. В частности, реактивы могут предоставляться в виде сухих порошков, обычно лиофилизированных, включающих наполнители, чтобы при растворении получать раствор реактива в соответствующей концентрации.
H. Фармацевтические составы
Терапевтические составы антитела или варианта такого антитела (например, антитела против HtrA1 или антитела против HtrA1/фактора D по данному изобретению) можно готовить для хранения в виде лиофилизированных составов или водных растворов путем смешивания полипептида, имеющего требуемую степень чистоты с оптимальными «фармацевтически приемлемыми» носителями, наполнителями или стабилизаторами, обычно применяемыми в данной области техники (все из которых называют «наполнителями»). Например, буферизирующие агенты, стабилизирующие агенты, консерванты, изотонирующие добавки, неионные поверхностно-активные вещества, антиоксиданты и другие разнообразные добавки. См., например, Remington's Pharmaceutical Sciences, 16th edition, A. Osol, Ed. (1980). Такие добавки должны быть нетоксичными для реципиентов в применяемых дозировках и концентрациях.
Буферизирующие агенты помогают поддерживать рН в диапазоне, приближенном к физиологическим условиям. Предпочтительно они присутствуют в концентрациях от около 2 мМ до около 50 мМ. Приемлемые буферизирующие агенты для применения в данном изобретении включают как органические и неорганические кислоты и их соли, такие как цитратные буферы (например, смесь цитрата мононатрия-цитрата динатрия, смесь лимонной кислоты-цитрата тринатрия, смесь лимонной кислоты-цитрата мононатрия и т.д.), сукцинатные буферы (например, смесь янтарной кислоты-сукцината мононатрия, смесь янтарной кислоты-гидроксида натрия, смесь янтарной кислоты-сукцината динатрия и т.д.), тартратные буферы (например, смесь винной кислоты-тартрата натрия, смесь винной кислоты-тартрата калия, смесь винной кислоты-гидроксида натрия и т.д.), фумаратные буферы (например, смесь фумаровой кислоты-фумарата мононатрия, смесь фумаровой кислоты-фумарата динатрия, смесь фумарата мононатрия-фумарата динатрия и т.д.), глюконатные буферы (например, смесь глюконовой кислоты-глюконата натрия, смесь глюконовой кислоты-гидроксида натрия, смесь глюконовой кислоты-глюконата калия и т.д.), оксалатный буфер (например, смесь щавелевой кислоты-оксалата натрия, смесь щавелевой кислоты-гидроксида натрия, смесь щавелевой кислоты-оксалата калия и т.д.), лактатные буферы (например, смесь молочной кислоты-лактата натрия, смесь молочной кислоты-гидроксида натрия, смесь молочной кислоты-лактата калия и т.д.) и ацетатные буферы (например, смесь уксусной кислоты-ацетата натрия, смесь уксусной кислоты-гидроксида натрия и т.д.). Дополнительно можно упомянуть фосфатные буферы, гистидиновые буферы и такие соли триметиламина, как Трис.
Можно добавлять консерванты для сдерживания микробного роста и их можно добавлять в количествах в диапазоне от 0,2% до 1% (масс./об.). Приемлемые консерванты для применения по данному изобретению включают фенол, бензиновый спирт, мета-крезол, метилпарабен, пропилпарабен, хлорид октадецилдиметилбензиламмония, галогениды бензалкония (например, хлорид, бромид, йодид), хлорид гексаметония, алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол и 3-пентанол. Для обеспечения изотоничности жидких композиций данного изобретения
изотонирующие агенты, иногда известные как «стабилизаторы», можно добавлять многоатомные сахарные спирты, предпочтительно тригидратные или высшие сахарные спирты, такие как глицерин, эритрит, арабит, ксилит, сорбит и маннит.
Стабилизаторы относятся к широкой категории наполнителей, которые могут охватывать диапазон функций от объемообразующего агента до добавки, которая солюбилизирует терапевтическое средство или помогает предотвращать денатурацию или прилипание к стенке контейнера. Типичные стабилизаторы могут представлять собой многоатомные сахарные спирты (перечисленные выше); аминокислоты, такие как аргинин, лизин, глицин, глутамин, аспарагин, гистидин, аланин, орнитин, L-лейцин, 2-фенилаланин, глутаминовая кислота, треонин и т.д.; органические сахара или сахарные спирты, такие как лактоза, трегалоза, стахиоза, маннит, сорбит, ксилит, рибит, миоинизит, галактит, глицерин и т.д., включая такие циклиты, как инозит, полиэтиленгликоль; полимеры аминокислот; серосодержащие восстановители, такие как мочевина, глутатион, тиоктовая кислота, тиогликолят натрия, тиоглицерин, α-монотиоглицерин и тиосульфат натрия; полипептиды с низкой молекулярной массой (т.е. <10 остатков), такие белки, как человеческий сывороточный альбумин, бычий сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; моносахариды, такие как ксилоза, манноза, фруктоза и глюкоза, дисахариды, такие как лактоза, мальтоза и сахароза); трисахариды, такие как раффиноза, и полисахариды, такие как декстран. Стабилизаторы могут присутствовать в диапазоне от 0,1 до 10000 массовых частей на часть массы активного белка.
Можно добавлять неионные поверхностно-активные вещества или детергенты (также известные как «смачивающие агенты») для облегчения солюбилизации терапевтического белка (например, антитела), а также для защиты терапевтического белка от агрегации, вызванной перемешиванием, что также позволяет составу подвергаться напряжению на поверхности сдвига без инициирования денатурации белка. Приемлемые неионные поверхностно активные вещества включают полисорбаты (20, 80 и т.п.), полиоксамеры (184, 188 и т.п.), полиолы PLURONIC®, простые моноэфиры полиоксиэтиленсорбитана (TWEEN®-20, TWEEN®-80 и т.п.). Неионные поверхностно-активные вещества могут содержатся в диапазоне от около 0,05 мг/мл до около 1,0 мг/мл, предпочтительно от около 0,07 мг/мл до около 0,2 мг/мл.
Дополнительные различные наполнители включают объемообразующие агенты (например, крахмал), хелатирующие агенты (например, ЭДТК (этилендиаминтетрауксусная кислота), антиоксиданты (например, аскорбиновая кислота, метионин и витамин Е) и сорастворители. Состав, описанный в данном документе, также может содержать более одного активного соединения, если это необходимо для лечения по конкретным показаниям, предпочтительно, соединения с взаимодополняющими активностями, не оказывающими нежелательного действия друг на друга. Например, может требоваться включение в состав антагониста связывания HtrA1 (например, антитела против HtrA1) и антагониста связывания фактора D (например, антитела против фактора D). В другом примере для лечения глазного нарушения, связанного с нежелательной неоваскуляризацией, такой как ВМД, может требоваться дополнительно предоставлять антиангиогенную терапию, такую как терапию антагонистом VEGF, например LUCENTIS® (ранибизумаб). Соответственно, такие активные ингредиенты присутствуют в комбинации в количествах, эффективных для предполагаемой цели.
Активные ингредиенты также можно заключать в микрокапсулы, полученные, например, методиками коацервации или межфазной полимеризации, например, микрокапсулы из гидроксиметилцеллюлозы или желатина и полиметилметакрилатные микрокапсулы, соответственно, в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики описаны в Remington's Pharmaceutical Sciences, 16th edition, A. Osal, Ed. (1980).
Можно готовить препараты замедленного высвобождения. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащих антитело, вариант антитела или его фрагмент (например, антигенсвязывающий фрагмент), матрицы которых приготовлены в форме профилированных изделий, например, пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают
сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт),
полилактиды (патент США №3773919), сополимеры L-глутаминовой кислоты и этил-L-глутамат,
неразрушаемый этилвинилацетат, разрушаемые сополимеры молочной кислоты-гликолевой кислоты, такие как
LUPRON DEPOT™ (инъекционные микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты
и лейпролида ацетата) и поли-D-(-)-3-гидроксимасляную кислоту. В то время как такие полимеры, как этиленвинилацетат и молочная кислота-гликолевая кислота способны высвобождать молекулы в течение более 100 суток, некоторые гидрогели высвобождают белки за более короткие периоды времени.
Если инкапсулированные антитела остаются в организме в течение длительного времени, то они могут денатурировать или агрегировать в результате воздействия влаги при 37°С, что приводит к потере биологической активности и возможным изменениям иммуногенности.
Для стабилизации можно разрабатывать рациональные стратегии, зависящие от участвующего механизма.
К примеру, если обнаружено, что механизм агрегации вызывает образование межмолекулярной связи S--S посредством тиодисульфидного обмена, то можно достигать стабилизации модификацией сульфгидрильных остатков, лиофилизацией из кислых растворов, регулированием содержания влаги, использованием подходящих добавок и разработкой специальных композиций с полимерными матрицами.
I. Терапевтические способы и композиции
В терапевтических способах можно применять любое из антител против HtrA1, предложенных в данном документе (например, антитела против HtrA1 и антитела против HtrA1/фактора D).
В одном аспекте изобретения предложено антитело против HtrA1 для применения в качестве лекарственного средства. В дополнительном аспекте в изобретении предложено антитело против HtrA1 для применения при лечении связанного с HtrA1 нарушения. В некоторых вариантах реализации изобретения связанное с HtrA1 нарушение представляет собой ВМД, включающую влажную ВМД (включая раннюю, промежуточную и запущенную влажную ВМД) и сухую ВМД (включая раннюю, промежуточную и запущенную сухую ВМД (например, географическую атрофию (ГА)). В некоторых случаях ВМД представляет собой запущенную сухую ВМД (например, ГА).
В другом варианте реализации в изобретении предложено антитело против HtrA1 для применения при лечении глазного нарушения. В некоторых случаях глазное нарушение представляет собой ВМД, включающую влажную (экссудативную) ВМД (включая раннюю, промежуточную и запущенную влажную ВМД) и сухую (неэкссудативную) ВМД (включая раннюю, промежуточную и запущенную сухую ВМД (например, ГА); диабетическую ретинопатию (DR) и другие связанные с ишемией ретинопатии; эндофтальмит; увеит; хориоидальную неоваскуляризацию (CNV); ретинопатию недоношенных (ROP); полипообразную хориоидальную васкулопатию (PCV); диабетический макулярный отек; патологическую миопию, болезнь Гиппеля-Линдау; гистоплазмоз глаза; окклюзию центральной вены сетчатки (CRVO); корнеальную васкуляризацию и ретинальную неоваскуляризацию. В некоторых вариантах реализации изобретения глазное нарушение представляет собой ВМД (например, запущенную сухую ВМД (например, ГА)).
В другом аспекте предложено антитело против HtrA1 для применения в способе лечения. В некоторых случаях в изобретении предложено антитело против HtrA1 для применения в способе лечения субъекта, имеющего связанное с HtrA1 нарушение, включающем введение индивиду эффективного количества антитела против HtrA1. В некоторых вариантах реализации изобретения связанное с HtrA1 нарушение представляет собой ВМД, включающее влажную ВМД (включая раннюю, промежуточную и запущенную влажную ВМД) и сухую ВМД (включая раннюю, промежуточную и запущенную сухую ВМД (например, ГА)). В некоторых случаях ВМД представляет собой запущенную сухую ВМД (например, ГА).
В другом случае в изобретении предложено антитело против HtrA1 для применения в способе лечения субъекта, имеющего глазное нарушение, включающем введение индивиду эффективного количества антитела против HtrA1. В некоторых случаях глазное нарушение представляет собой ВМД, включающую влажную (экссудативную) ВМД (включая раннюю, промежуточную и запущенную влажную ВМД) и сухую (неэкссудативную) ВМД (включая раннюю, промежуточную и запущенную сухую ВМД (например, ГА); DR и другие связанные с ишемией ретинопатии; эндофтальмит; увеит; CNV; ROP; PCV; диабетический макулярный отек; патологическую миопию, болезнь Гиппеля-Линдау; гистоплазмоз глаза; CRVO; корнеальную васкуляризацию и ретинальную неоваскуляризацию. В некоторых вариантах реализации изобретения глазное нарушение представляет собой ВМД (например, запущенную сухую ВМД (например, ГА)).
В некоторых случаях в изобретении предложено антитело против HtrA1 для применения в ингибировании у субъекта дегенерации сетчатки или рецепторных клеток. В иных случаях в изобретении предложено антитело против HtrA1 для применения в ингибировании у субъекта активности сериновой протеазы HtrA1. «Субъект» согласно любому из вышеописанных применений может являться человеком.
В изобретении предложено применение антитела против HtrA1 для производства или приготовления лекарственного средства. Например, в одном случае лекарственное средство предназначено для лечения связанного с HtrA1 нарушения. В дополнительном случае лекарственное средство предназначено для применения в способе лечения связанного с HtrA1 нарушения, включающего введение субъекту, имеющему связанное с HtrA1 нарушение, эффективного количества данного лекарственного средства. В любом из предыдущих применений лекарственных средств способ может включать введение индивиду эффективного количества по меньшей мере одного дополнительного терапевтического средства, например, как описано ниже. В некоторых вариантах реализации изобретения связанное с HtrA1 нарушение представляет собой ВМД, включающее влажную ВМД (включая раннюю, промежуточную и запущенную влажную ВМД) и сухую ВМД (включая раннюю, промежуточную и запущенную сухую ВМД (например, ГА)). В некоторых случаях ВМД представляет собой запущенную сухую ВМД (например, ГА).
В другом случае лекарственное средство предназначено для применения в способе лечения глазного нарушения, включающего введение субъекту, имеющему глазное нарушение, эффективного количества данного лекарственного средства. В некоторых случаях глазное нарушение представляет собой ВМД, включающую влажную (экссудативную) ВМД (включая раннюю, промежуточную и запущенную влажную ВМД) и сухую (неэкссудативную) ВМД (включая раннюю, промежуточную и запущенную сухую ВМД (например, ГА); DR и другие связанные с ишемией ретинопатии; эндофтальмит; увеит; CNV; ROP; PCV; диабетический макулярный отек; патологическую миопию, болезнь Гиппеля-Линдау; гистоплазмоз глаза; CRVO; корнеальную васкуляризацию и ретинальную неоваскуляризацию. В некоторых вариантах реализации изобретения глазное нарушение представляет собой ВМД (например, запущенную сухую ВМД (например, ГА)).
В изобретении предложен способ лечения связанного с HtrA1 нарушения. В одном варианте реализации изобретения способ включает введение субъекту, имеющему связанное с HtrA1 нарушение, эффективного количества антитела против HtrA1. В некоторых вариантах реализации изобретения связанное с HtrA1 нарушение представляет собой ВМД, включающее влажную ВМД (включая раннюю, промежуточную и запущенную влажную ВМД) и сухую ВМД (включая раннюю, промежуточную и запущенную сухую ВМД (например, ГА)). В некоторых случаях ВМД представляет собой запущенную сухую ВМД (например, ГА). В дополнительных случаях способ дополнительно включает введение индивиду эффективного количества по меньшей мере одного дополнительного терапевтического средства, как описано ниже. «Субъект» согласно любому из вышеописанных методов может являться человеком.
В изобретении предложен способ лечения глазного нарушения. В одном варианте реализации изобретения способ включает введение субъекту, имеющему глазное нарушение, эффективного количества антитела против HtrA1. В некоторых случаях глазное нарушение представляет собой ВМД, включающую влажную (экссудативную) ВМД (включая раннюю, промежуточную и запущенную влажную ВМД) и сухую (неэкссудативную) ВМД (включая раннюю, промежуточную и запущенную сухую ВМД (например, ГА); DR и другие связанные с ишемией ретинопатии; эндофтальмит; увеит; CNV; ROP; PCV; диабетический макулярный отек; патологическую миопию, болезнь Гиппеля-Линдау; гистоплазмоз глаза; CRVO; корнеальную васкуляризацию и ретинальную неоваскуляризацию. В некоторых вариантах реализации изобретения глазное нарушение представляет собой ВМД (например, запущенную сухую ВМД (например, ГА)).
В изобретении предложен способ лечения связанного с HtrA1 нарушения, глазного нарушения и/или связанного с комплементом нарушения у имеющего для этого показания субъекта, причем способ включает введение субъекту терапевтически эффективного количества антагониста связывания HtrA1 и/или антагониста связывания фактора D. В некоторых вариантах реализации изобретения связанное с HtrA1 нарушение или связанное с комплементом нарушение представляет собой глазное нарушение. В некоторых вариантах реализации изобретения глазное нарушение выбрано из группы, состоящей из ВМД, диабетической ретинопатии, хориоидной неоваскуляризации (CNV), увеита, диабетического макулярного отека, патологической миопии, болезни Гиппеля-Линдау, гистоплазмоза глаза, окклюзии центральной вены сетчатки, корнеальной васкуляризации и ретинальной неоваскуляризации. В некоторых случаях глазное нарушение представляет собой ВМД, включающую влажную ВМД (включая раннюю, промежуточную и запущенную влажную ВМД) и сухую ВМД (включая раннюю, промежуточную и запущенную сухую ВМД (например, ГА)). В некоторых случаях ВМД представляет собой запущенную сухую ВМД (например, ГА). В любом из предыдущих вариантов реализации изобретения антагонист связывания HtrA1 может представлять собой антитело против HtrA1 или его антигенсвязывающий фрагмент, например любое антитело против HtrA1 или его антигенсвязывающий фрагмент, описанные в данном документе. В некоторых вариантах реализации изобретения антигенсвязывающий фрагмент антитела выбран из группы, состоящей из фрагментов Fab, Fab'-SH, Fv, scFV и (Fab')2. В некоторых вариантах реализации изобретения антигенсвязывающий фрагмент антитела представляет собой Fab. В некоторых вариантах реализации изобретения Fab содержит усечение в шарнирном участке (например, верхнем шарнире) константного участка тяжелой цепи. В некоторых вариантах реализации изобретения константный участок Fab тяжелой цепи завершается положением 221 (нумерация EU). В некоторых вариантах реализации изобретения аминокислотный остаток положения 221 представляет собой аспарагиновую кислоту. В некоторых вариантах реализации изобретения константный участок тяжелой цепи Fab содержит аминокислотную последовательность SEQ ID NO: 156. В некоторых вариантах реализации изобретения Fab представляет собой Fab lgG1. В некоторых случаях антагонист связывания фактора D представляет собой антитело против фактора D или его антигенсвязывающий фрагмент, например любое из антител против фактора D, описанных в данном документе.
В другом аспекте в изобретении предложено применение биспецифического антитела, которое специфически связывает как HtrA1, так и фактор D, или антигенсвязывающего фрагмента такого антитела в производстве лекарственного средства для лечения связанного с HtrA1 нарушения, глазного нарушения и/или связанного с комплементом нарушения. В некоторых вариантах реализации изобретения связанное с HtrA1 нарушение и/или связанное с комплементом нарушение представляет собой глазное нарушение. В некоторых случаях глазное нарушение представляет собой ВМД, включающую влажную ВМД (включая раннюю, промежуточную и запущенную влажную ВМД) и сухую ВМД (включая раннюю, промежуточную и запущенную сухую ВМД (например, ГА)). В некоторых вариантах реализации изобретения ВМД представляет собой запущенную сухую ВМД (например, ГА). Биспецифическое антитело может содержать связывающий домен, который специфически связывает HtrA1, происходящий из любого из антител против HtrA1, описанных в данном документе. Биспецифическое антитело может содержать связывающий домен, который специфически связывает фактор D, происходящий из любого из антител против фактора D, описанных в данном документе. В некоторых вариантах реализации изобретения антигенсвязывающий фрагмент антитела представляет собой фрагмент Fab или фрагмент (Fab')2.
Любое из антител против фактора D или их антигенсвязывающих фрагментов, описанных в данном документе и/или известных в данной области техники, можно применять в любом из предшествующих способов или применений. Например, в некоторых случаях антитело против фактора D или его антигенсвязывающий фрагмент может содержать следующие шесть HVR: (а) HVR-H1, содержащий аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащий аминокислотную последовательность WINTYTGETTYAX1DFKG (SEQ ID NO: 110), где X1 представляет собой Asp или Glu; (с) HVR-H3, содержащий аминокислотную последовательность EGGVX1N (SEQ ID NO: 111), где X1 представляет собой Asp или Ser; (d) HVR-L1, содержащий аминокислотную последовательность ITSTX1IX2X3DMN (SEQ ID NO: 112), где X1 представляет собой Asp или Ser, Х2 представляет собой Asp или Glu, а Х3 представляет собой Asp или Ser; (е) HVR-L2, содержащий аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащий аминокислотную последовательность LQSX1SLPYT (SEQ ID NO: 114), где X1 представляет собой Asp или Glu. В некоторых случаях антитело против фактора D или его антигенсвязывающий фрагмент содержит следующие шесть HVR: (а) HVR-H1, содержащий аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 109); (b) HVR-H2, содержащий аминокислотную последовательность WINTYTGETTYADDFKG (SEQ ID NO: 115); и (с) HVR-H3, содержащий аминокислотную последовательность EGGVNN (SEQ ID NO: 116); (d) HVR-L1, содержащий аминокислотную последовательность ITSTDIDDDMN (SEQ ID NO: 117); (e) HVR-L2, содержащий аминокислотную последовательность GGNTLRP (SEQ ID NO: 113); и (f) HVR-L3, содержащий аминокислотную последовательность LQSDSLPYT (SEQ ID NO: 118). В некоторых вариантах реализации изобретения антитело против фактора D или его антигенсвязывающий фрагмент содержит (а) домен VH, содержащий аминокислотную последовательность, обладающую по меньшей мере 90% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 119; (b) домен VL, содержащий аминокислотную последовательность, обладающую по меньшей мере 90% идентичностью последовательности с аминокислотною последовательностью SEQ ID NO: 120; или (с) домен VH, аналогичный описанному в (а), и домен VL, аналогичный описанному в (b). В некоторых случаях домен VH содержит аминокислотную последовательность SEQ ID NO: 119. В некоторых случаях домен VL содержит аминокислотную последовательность SEQ ID NO: 120. В некоторых случаях антигенсвязывающий фрагмент антитела против фактора D представляет собой лампализумаб, имеющий регистрационный номер CAS 1278466-20-8.
Предполагается, что антитело по данному изобретению можно применять для лечения млекопитающего. В одном варианте реализации изобретения антитело вводят млекопитающему, не относящемуся к человеку, с целью получения, например, доклинических данных. Примеры млекопитающих, не относящихся к человеку и подлежащих лечению, включают приматов, не относящихся к человеку, собак, кошек, грызунов (например, мышей и крыс) и других млекопитающих, на которых выполняют доклинические исследования. С помощью таких млекопитающих можно создавать животные модели заболевания, подлежащего лечению данным антителом, или их можно применять для изучения токсичности интересующего антитела. В каждом из таких вариантов реализации изобретения на млекопитающем можно проводить исследования с повышением дозы.
В дополнительном аспекте в изобретении предложены фармацевтические составы, содержащие любое из антител против HtrA1, предложенных в данном документе, например, для применения в любом из вышеперечисленных терапевтических способов. В одном варианте реализации фармацевтический состав содержит любое из антител против HtrA1, предложенных в данном документе, и фармацевтически приемлемый носитель. В другом варианте реализации фармацевтический состав содержит любое из антител против HtrA1, предложенных в данном документе, и по меньшей мере одно дополнительное терапевтическое средство, например, как описано ниже.
В любом из терапевтических применений и способов, описанных в данном документе, антитело против HtrA1 может представлять собой Fab. В некоторых вариантах реализации изобретения Fab содержит усечение в шарнирном участке (например, верхнем шарнирном участке) константного участка тяжелой цепи. В некоторых вариантах реализации изобретения константный участок Fab тяжелой цепи завершается положением 221 (нумерация EU). В некоторых вариантах реализации изобретения аминокислотный остаток положения 221 представляет собой аспарагиновую кислоту. В некоторых вариантах реализации изобретения константный участок тяжелой цепи Fab содержит аминокислотную последовательность SEQ ID NO: 156. В некоторых вариантах реализации изобретения Fab представляет собой Fab lgG1.
Антитело по данному изобретению (и любое дополнительное терапевтическое средство) для предотвращения или лечения глазного заболевания или патологического состояния можно вводить любыми приемлемыми способами, включающими, но не ограничивающимися ими, например, окулярной, внутриглазной и/или интравитреальной инъекцией, и/или околосклеральной инъекцией, и/или инъекцией в субтеноновое пространство, и/или супрахориоидальной инъекцией, и/или местным нанесением в форме глазных капель и/или мази. Такие антитела по данному изобретению можно доставлять разнообразными способами, например, интравитреально в виде устройства и/или депо, которое обеспечивает медленное высвобождение соединения в стекловидное тело, включая описанные в таких ссылках, как Intraocular Drug Delivery, Jaffe, Jaffe, Ashton, and Pearson, editors, Taylor & Francis (March 2006). В одном примере устройство может иметь форму мининасоса и/или матрицы и/или системы пассивной диффузии и/или инкапсулированных клеток, которые высвобождают соединение в течение продолжительного периода времени (Intraocular Drug Delivery, Jaffe, Jaffe, Ashton, and Pearson, editors, Taylor & Francis (March 2006). Можно также применять другие способы введения, которые включают местное, парентеральное, подкожное, внутрибрюшинное, внутрилегочное, интраназальное и внутриочаговое введение, но не ограничиваются ими. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение.
Составы для окулярного, внутриглазного или интравитреального введения можно готовить способами и с использованием наполнителей, известных в данной области техники. Важным признаком эффективного лечения является надлежащее проникновение внутрь глаза. В отличие от заболеваний на передней поверхности глаза, когда лекарственные средства наносят местно, как правило, для заболеваний сетчатки положительный результат получают при более локализированном подходе. Глазные капли и мази едва проникают к глазному дну, а гематоофтальмический барьер препятствует проникновению введенных системный кровоток лекарственных средств в глазные ткани. Соответственно, предпочтительным способом доставки лекарственных средств для лечения заболевания сетчатки, такого как ВМД и CNV, как правило, является прямая интравитреальная инъекция. Интравитреальные инъекции обычно повторяют с интервалами, которые зависят от состояния пациента, свойств и периода полувыведения доставляемого лекарственного средства. Для проникновения внутрь глаза (например, в стекловидное тело) обычно предпочтительными являются молекулы меньшего размера.
У глаз имеется множество биофизических и анатомических элементов, которые создают сложности для окулярной доставки лекарственных средств. Например, гематоофтальмические барьеры и защитные механизмы защищают глаз от инфекции, но в то же время затрудняют проникновение лекарственного средства, особенно для заболеваний в задних сегментах глаза. Следовательно, для достижения и поддержания биодоступности лекарственного средства на месте (например, время удержания в глазе) часто требуется введение высокой дозы для улучшения эффективности. Между тем, ограниченное пространство задней части глаза сокращает объем лекарственного средства, подлежащий доставке, что в свою очередь может давать преимущество лекарственным средствам, которые можно доставлять в виде состава с высокой концентрацией.
Пациенты с глазными нарушениями (например, ВМД (например, географическая атрофия)) также могут получать положительный результат от доставки терапевтических средств длительного действия/замедленного высвобождения. Менее частое введение доз может создавать повышенное удобство для пациента, дает потенциальные преимущества по снижению частоты возникновения инфекций и увеличению клинической эффективности. Контролируемое высвобождение лекарственное средств в высоких дозах также может сводить к минимуму побочные эффекты лекарственных средств. Две многообещающие системы для доставки с длительным действием представлены твердыми имплантами на основе PLGA и имплантируемая порт-система доставки (PDS). Обе системы потенциально способны обеспечивать кинетику высвобождения практически нулевого порядка в течение продолжительного периода времени. Для PLGA-имплантов инкапсулируют белковое лекарственное средство в гидрофобную полимерную матрицы и осуществляется высвобождение лекарственного средства посредством медленного гидролиза полимера. Скорость высвобождения можно контролировать изменением нагрузки лекарственным средством, гидрофобности полимера или молекулярной массы полимера. PDS представляет собой надежное устройство, в котором высвобождение в стекловидное тело контролируется пористой металлической мембраной, содержащей титановую керамику. Поскольку резервуар имеет малый объем, для эффективной доставки с помощью PDS требуется высокая концентрация белка.
В дополнение к этому или вместо высокой концентрации и доставки с длительным действием, можно достигать увеличенной биодоступности (например, время удержания в глазе) лекарственного средства или облегчать ее с помощью посттрансляционных модификаций, при которых белковое лекарственное средство ковалентно конъюгировано с природными или синтетическими полимерами, такими способами как полисиалирование, НЕSиалирование (конъюгация с гидроксиэтилкрахмалом) и ПЭГилирование. См., например, Chen et al., Expert. Opin. Drug Deliv. 8:1221-36, 2011; Kontermann, BioDrugs 23:93-109, 2011. ПЭГилирование, ковалентное присоединение полимера полиэтиленгликоля (ПЭГ) к белку, представляет собой хорошо отработанную технологию, особенно пригодную для продления периода полувыведения терапевтических средств на основе фрагментов антител. Jevsevaret al., Biotech. J. 5:113-128, 2010.
Условия, которым подвергается лекарственное средство, изменяются в зависимости от используемой системы доставки. Для включения в состав твердых PLGA-имплантов используют лиофилизированное или высушенное распылением лекарственное средство. Импланты производят с использованием процессе экструзии горячего расплава таким образом, что лекарственное средство кратковременно подвергается воздействию температур, приближающихся к 90°С. Хотя лекарственное средство остается в твердом состоянии во время высвобождения, разрушение PLGA может подвергать лекарственное средство действию окружения с низким значением рН. В противоположность этому, лекарственное средство, доставляемое с помощью PDS, поддерживается в жидком состоянии с высокой концентрацией и находится в среде стекловидного тела, для которой характерно восстановительное окружение с физиологическими значениями ионной силы и рН.
Количество антитела или варианта такого антитела, которое будет эффективным при лечении конкретного глазного нарушения или патологического состояния, будет зависеть от природы нарушения или патологического состояния, и может быть определено стандартными клиническими методиками. Если возможно, перед исследованиями на людях желательно сначала определять кривую «доза-ответ» для фармацевтических композиций по данному изобретению in vitro, а затем на применимых системах животных моделей.
Дополнительные приемлемые средства введения включают парентеральное, внутрилегочное и интраназальное введение и, если это необходимо для местного лечения, внутриочаговое введение. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Введение дозы можно осуществлять любым приемлемым способом, например, с помощью инъекций, таких как внутривенные или подкожные инъекции, что в частности зависит от того, является ли введение кратковременным или длительным. В данном документе рассмотрены различные схемы введения доз, включая одно или множество введений в различные моменты времени, болюсное введение и импульсное вливание, но не ограничиваясь ими. В некоторых случаях антитело против HtrA1 можно вводить с внутривенно, внутримышечно, внутрикожно, чрезкожно, внутриартериально, внутрибрюшинно, внутриочагово, интракраниально, внутрисуставно, внутрь простаты, внутриплеврально, интратрахеально, интратекально, назально, вагинально, ректально, местно, внутрь опухоли, внутрибрюшинно, в брюшину, интравентрикулярно, подкожно, субконъюнктивально, внутрь мочевого пузыря, через слизистую оболочку, интраперикардиально, внутрь пуповины, интраорбитально, перорально, местно, трансдермально, путем ингаляции, путем инъекции, путем имплантации, путем инфузии, путем непрерывной инфузии, путем непосредственного омывания клеток-мишеней при локализованной перфузии, с помощью катетера, путем промывания, в кремах или в липидных композициях.
Эффективность лечения глазных нарушений (например, связанных с комплементом глазных нарушений), таких как ВМД или CNV, можно измерять различными конечными критериями, обычно используемыми при оценке внутриглазных заболеваний. Например, можно оценивать потерю зрения. Потерю зрения можно оценивать любым способом, известным в данной области техники и/или описанным в данном документе, включая, но ограничиваясь ими, например, измерения по средней величине изменения лучшей коррекции остроты зрения (BCVA) от исходного уровня в требуемый момент времени (например, когда BCVA основана на таблице остроты зрения и оценке при тестируемом расстоянии 4 метра в исследовании диабетической ретинопатии при своевременном лечении (ETDRS)), измерения пропорции субъектов, которые теряют остроту зрения менее 15 букв в требуемый момент времени, по сравнению с исходным уровнем, измерения пропорции субъектов, которые обретают остроту зрения равную или превышающую 15 букв в требуемый момент времени, по сравнению с исходным уровнем, измерения пропорции субъектов с эквивалентом остроты зрения по таблице Снеллена 20/2000 или хуже в требуемый момент времени, измерения функционирования зрения по опроснику NEI, измерения размера CNV и величины подтекания при CNV в требуемые момент времени, например, флуоресцентной ангиографией и т.п. Оценивания характеристик глаз можно выполнять способами, например, включающими выполнение осмотра глаз, измерение внутриглазного давления, оценку остроты зрения, измерение давления в свете щелевой лампы, оценку внутриглазного воспаления и т.п., но не ограничивающимися ими.
Для предотвращения или лечения заболевания соответствующая дозировка антитела по данному изобретению (используемого самостоятельно или в комбинации с одним или более другими дополнительными терапевтическими средствами) будет зависеть от типа заболевания, подлежащего лечению, типа антитела, тяжести и течения заболевания, того, вводится ли антитело с предупреждающей или терапевтической целью, предыдущей терапии, истории болезни пациента и реакции на антитело, и предписания лечащего врача. Антитело подходит для введения пациенту однократно или за несколько приемов. В зависимости от типа и тяжести заболевания, антитело можно применять для введения пациенту в первоначальной предполагаемой дозировке от около 1 мкг/кг до 15 мг/кг (например, 0,1 мг/кг, 0,2 мг/кг, 0,4 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1 мг/кг, 2 мг/кг, 3 мг/кг, 4 мг/кг, 5 мг/кг, 6 мг/кг, 7 мг/кг, 8 мг/кг, 9 мг/кг или 10 мг/кг) либо, например, посредством одного или более раздельных введений или путем непрерывной инфузии. В некоторых вариантах реализации изобретения антитело применяют в дозе от около 0,01 мг/кг до около 45 мг/кг, от около 0,01 мг/кг до около 40 мг/кг, от около 0,01 мг/кг до около 35 мг/кг, от около 0,01 мг/кг до около 30 мг/кг, от около 0,01 мг/кг до около 25 мг/кг, от около 0,01 мг/кг до около 20 мг/кг, от около 0,01 мг/кг до около 15 мг/кг, от около 0,01 мг/кг до около 10 мг/кг, около 0,01 мг/кг до около 5 мг/кг или около 0,01 мг/кг до около 1 мг/кг. Одна типичная суточная доза может находиться в диапазоне от около 1 мкг/кг до 100 мг/кг или более в зависимости от вышеупомянутых факторов. При повторных введениях в течение нескольких дней или дольше, в зависимости от состояния, лечение обычно следует продолжать до желаемого подавления симптомов заболевания.
В некоторых случаях вводят фиксированную дозу антитела против HtrA1 по данному изобретению, например, в глаз. В некоторых случаях в глаз вводят от около 0,1 мг до около 10 мг или около 5-15 мг антитела против HtrA1 по данному изобретению, например, от около 0,1 мг/глаз до около 0,5 мг/глаз, от около 0,5 мг/глаз до около 1 мг/глаз, от около 1 мг/глаз до около 1,5 мг/глаз, от около 1,5 мг/глаз до около 2 мг/глаз, от около 2 мг/глаз до около 2,5 мг/глаз, от около 2,5 мг/глаз до около 3 мг/глаз, от около 3 мг/глаз до около 3,5 мг/глаз, от около 3,5 мг/глаз до около 4 мг/глаз, от около 4 мг/глаз до около 4,5 мг/глаз, от около 4,5 мг/глаз до около 5 мг/глаз, от около 5 мг/глаз до около 5,5 мг/глаз, от около 5,5 мг/глаз до около 6 мг/глаз, от около 6 мг/глаз до около 6,5 мг/глаз, от около 6,5 мг/глаз до около 7 мг/глаз, от около 7 мг/глаз до около 7,5 мг/глаз, от около 7,5 мг/глаз до около 8 мг/глаз, от около 8 мг/глаз до около 8,5 мг/глаз, от около 8,5 мг/глаз до около 9 мг/глаз, от около 9 мг/глаз до около 9,5 мг/глаз или от около 9,5 мг/глаз до около 10 мг/глаз. В некоторых случаях антитело применяют в дозе от около 0,1 мг/глаз до около 2 мг/глаз, от около 0,1 мг/глаз до около 3 мг/глаз, от около 0,1 мг/глаз до около 5 мг/глаз, от около 0,1 мг/глаз до около 6 мг/глаз, от около 0,1 мг/глаз до около 7 мг/глаз, от около 0,1 мг/глаз до около 8 мг/глаз, от около 0,1 мг/глаз до около 9 мг/глаз, от около 0,1 мг/глаз до около 10 мг/глаз, от около 0,5 мг/глаз до около 2 мг/глаз, от около 0,5 мг/глаз до около 3 мг/глаз, от около 1 мг/глаз до около 3 мг/глаз или от около 2 мг/глаз до около 5 мг/глаз. В некоторых случаях применяют фиксированную дозу антитела против HtrA1 составляет около 0,5 мг/глаз, около 1 мг/глаз, около 1,5 мг/глаз, около 2 мг/глаз, около 2,5 мг/глаз, около 3 мг/глаз, около 3,5 мг/глаз, около 4 мг/глаз, около 4,5 мг/глаз, около 5 мг/глаз, около 5,5 мг/глаз, около 6 мг/глаз, около 6,5 мг/глаз, около 7 мг/глаз, около 7,5 мг/глаз, около 8 мг/глаз, около 8,5 мг/глаз, около 9 мг/глаз, около 9,5 мг/глаз, около 10 мг/глаз или более. В конкретном случае, например, вводят фиксированную дозу антитела против HtrA1 около 2 мг/глаз.
В некоторых вариантах реализации изобретения дозу можно вводить один раз в неделю, один раз каждые две недели, один раз каждые три недели, один раз каждые четыре недели, один раз каждые пять недель, один раз каждые шесть недель, один раз каждые семь недель, один раз каждые восемь недель, один раз каждые девять недель, один раз каждые десять недель, один раз каждые одиннадцать недель или один раз каждые двенадцать недель.
Антагонист связывания HtrA1 (например, антитело против HtrA1 по данному изобретению) можно вводить самостоятельно или в комбинации с по меньшей мере вторым терапевтическим соединением. Введение антагониста связывания HtrA1 (например, антитела против HtrA1 по данному изобретению) и любого второго терапевтического соединения можно выполнять одновременно, например, в виде единой композиции или в виде двух или более отличающихся композиций, используя одинаковый или разные пути введения. В альтернативном варианте или дополнительно введение можно выполнять последовательно в любом порядке. В некоторых вариантах реализации изобретения между введениями двух или более композиций могут быть интервалы от минут до суток, от недель до месяцев. Например, антагонист связывания HtrA1 (например, антитело против HtrA1 по данному изобретению) можно вводить первым, с последующим введением второго терапевтического соединения. Тем не менее, также подразумевают одновременное введение или введение второго терапевтического соединения перед антагонистом связывания HtrA1 (например, антителом против HtrA1 по данному изобретению). В одном примере антагонист связывания HtrA1 представляет собой антитело против HtrA1, например, любое антитело против HtrA1, описанное в данном документе или известное в данной области техники. В одном примере второе терапевтическое соединение представляет собой антагонист связывания фактора D. В дополнительном примере антагонист связывания фактора D представляет собой антитело против фактора D, например, любое антитело против фактора D, описанное в данном документе или известное в данной области техники. В конкретных вариантах реализации изобретения антитело против фактора D представляет собой лампализумаб. В дополнительных вариантах реализации изобретения антитело против фактора D вводят в дозе 1-15 мг, например, в дозе 10 мг. В конкретных вариантах реализации изобретения лампализумаб вводят один раз каждые две недели, один раз каждые три недели или один раз каждые четыре недели. В некоторых вариантах реализации изобретения дополнительное терапевтическое средство пригодно для лечения глазного нарушения, связанного с нежелательной неоваскуляризацией глаза, такой, например, как влажная ВМД. Приемлемые терапевтические средства включают, например, антиангиогенные терапевтические средства, такие как антагонисты VEGF (например, антитела против VEGF и фрагменты антител, включая LUCENTIS® (ранибизумаб), и антител против VEGFR1 и родственные молекулы (например, афлиберцепт (VEGF Trap-Eye; EYLEA®)); ингибиторы системы комплемента, такие как антагонисты фактора С2 комплемента (включая, например, антитела против CFC2); и противовоспалительные средства, такие как антагонисты связывания IL-6 (например, тоцилизумаб (ACTEMRA®) и EBI-031 (Eleven Biotherapeutics)). В других вариантах реализации изобретения для лечения заболевания или нарушения, связанного с нежелательной неоваскуляризацией глаза, можно задействовать комбинацию антитела против HtrA1 и фотодинамическую терапию (например, с помощью MACUGEN™ или VISUDYNE™).
Такие варианты комбинированной терапии, отмеченные выше, включают совместное введение (где два или более терапевтических средств содержатся в одном и том же или отдельных составах), а также раздельное введение, и в этом случае введение антитела по данному изобретению может происходить до, одновременно и/или после введения дополнительного терапевтического средства или средств. В одном варианте реализации изобретения введение антагониста связывания HtrA1 (например, антитела против HtrA1) и введение дополнительного терапевтического средства осуществляется с интервалом около одного месяца или около одной, двух или трех недель, или около одних, двух, трех, четырех, пяти или шести суток между введениями.
Следует понимать, что любой из указанных выше составов или терапевтических способов можно осуществлять с использованием иммуноконъюгата по данному изобретению вместо антитела против HtrA1 или в дополнение к нему.
J. Изделия
В другом аспекте изобретения предложено изделие, содержащие материалы, используемые для лечения, предупреждения и/или диагностики описанных выше нарушений. Изделие содержит контейнер и связанную с контейнером или находящуюся на нем этикетку или вкладыш в упаковку. Подходящие контейнеры включают, например, бутыли, флаконы, шприцы, пакеты с растворами для в/в введения и т.д. Контейнеры можно изготавливать из различных материалов, таких как стекло или пластик. В контейнере содержится композиция, которая сама по себе или в сочетании с другой композицией является эффективной для лечения, предупреждения и/или диагностики патологического состояния, и может иметь стерильное отверстие доступа (например, контейнер может представлять собой пакет или флакон с раствором для внутривенного введения, имеющий пробку, выполненную с возможностью прокалывания иглой для подкожных инъекций). По меньшей мере один активный агент в композиции представляет собой антитело по данному изобретению. На этикетке или на листке-вкладыше в упаковку указано, что композицию применяют для лечения предпочтительного патологического состояния. Кроме того, изделие может содержать (а) первый контейнер с содержащейся в нем композицией, причем композиция содержит антитело по настоящему изобретению; и (b) второй контейнер с содержащейся в нем композицией, причем композиция включает дополнительное цитотоксическое или иное терапевтическое средство. Изделие в данном варианте реализации изобретения может дополнительно содержать вкладыш в упаковку, в котором указано, что композиции можно применять для лечения конкретного патологического состояния. В альтернативном варианте или дополнительно изделие может дополнительно содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буферный раствор, раствор Рингера и раствор декстрозы. Изделие может включать в себя другие материалы, требуемые с коммерческой и потребительской точки зрения, в том числе другие буферы, разбавители, фильтры, иглы и шприцы.
III. ПРИМЕРЫ
Ниже приведены примеры способов и композиций по данному изобретению. Следует понимать, что учитывая представленное выше общее описание, можно осуществлять различные другие варианты реализации данного изобретения.
Разработка стабильных антител с высокой активностью и высокой аффинностью, которые связывают HtrA1
Целью следующих экспериментов было обнаружение новых антител против HtrA1, обладающих более высокой активностью и более высокой аффинностью в отношении HtrA1.
Сначала получали мышей с нокаутом по mHtrA1. Была необходимость использования нокаутных мышей, поскольку не были успешными первоначальные усилия по созданию гибридом из мышей, экспрессирующих HtrA1, вероятно из-за того, что мышиные и человеческие белки HtrA1 обладают 98% идентичностью последовательностей.
Далее нокаутных по HtrA1 мышей иммунизировали протеазным доменом mHtrA1. Получаемые гибридомы подвергали скринингу методом ELISA и идентифицировали 75 позитивных по ELISA клонов. На способность ингибировать расщепление субстрата протеазы HtrA1 исследовали 75 клонов. Показано, что 10 из 75 клонов ингибируют протеазную активность HtrA1.
Для дальнейшего анализа отбирали семь из этих клонов по их способности ингибировать протеазную активность, по связыванию человеческого и мышиного HtrA1 и по селективному связыванию muHtrA1 по сравнению с muHtrA3 и muHtrA4. Данные семь клонов подвергали дополнительному скринингу и обнаружено четыре из них, имеющих улучшенную активность по отношению к HtrA1 по сравнению с контрольным антителом YW505.94. На основе их предпочтительного молекулярного профиля, включающего активность и селективность, для дальнейшей разработки отбирали двое из этих антител, 15Н6 и 9В12.
Гипервариабельные остатки отобранных антител прививали на каркасный участок человека, как отмечено ниже. Важность остатков зоны Vernier легкой цепи мыши исследовали для 15Н6 отдельными перестановками этих остатков и исследованием связывания с HtrA1 человека и мыши. Одна замена нарушала связывание, две - снижали связывание, две - влияли только на связывание с мышиным HtrA1, а три - не оказывали значимого воздействия на связывание. Эти три замены вводили в антитело 15H6.V1 для получения антитела 15H6.V2.
Затем 15H6.V2 конструировали таким образом, чтобы улучшить его стабильность. Определяли потенциально нестабильные остатки, которые могли приводить к окислению (W91 в HVR-L3), усечению (N94 Р95 в HVR-LC) и дезамидированию (055 G56 в HVR-H2). Замены W91 существенно влияли на связывание. Исследовали четыре замены в положении N94. Две из этих замен влияли на связывание, а две отобрали для дополнительного анализа. Исследовали четыре замены в положении D55. Только одна из этих замен показала сравнимое связывание с исходной молекулой.
Следующим этапом было улучшение аффинности связывания h15H6.v2 с HtrA1. На первом этапе для изучения взаимосвязи структура/функции в отношении h15H6.v2 применяли глубокое секвенирование. Из множества отдельных исследованных в данном эксперименте мутаций, найдено приблизительно 19 отдельных мутаций, улучшающих аффинность в отношении HtrA1. Разрабатывали и исследовали антитела, содержащие комбинации мутаций LC и НС с самой медленной скоростью диссоциации, что привело к определению вариантов антител, обладающих улучшенной активностью и аффинностью в отношении HtrA1. Для введения стабилизирующих замен, описанных выше, конструировали также варианты, обладающие наилучшей аффинностью и активностью. Из полученных вариантов обнаружено, что h15H6.v4 имеет самую высокую активность против HtrA1.
Рентгеновской кристаллографией и электронной микроскопией определяли структуру h15H6.v4 в форме Fab, связанного с HtrA1. Данный структурный анализ выявил, что Fab h15H6.v4 связывается вблизи «LA-петли» белка HtrA1. Связанный h15H6.v4 эпитоп отличается от связанного контрольным антителом YW505.94. Хотя не предполагается, что данное изобретение привязано к какому-либо конкретному механизму, возможно, что близкое взаимодействие между h15H6.v4 и LA-петлей HtrA1 объясняет значительное улучшение аффинности и активности данного антитела по сравнению с YW505.94.
Описанные выше эксперименты более подробно обсуждаются ниже.
Пример 1. Создание антител против HtrA1 с использованием подходов с получением гибридом
A. Среды и антитела
Среда В CLONACELL™-HY(№03802 по кат.), среда С (№03803 по кат.), среда D (№03804 по кат.) и среда Е (№03805 по кат.) получены от компании StemCell Technologies. Применяемая для электрофокусирования среда С CYTOFUSION® (№ LCM-C по кат.) получена от Cyto Pulse Sciences. Меченый аллофикоцианином (АРС) F(ab')2 козла против Ig мыши получали от SouthernBiotech (№1012-11 по кат.), конъюгированное с пероксидазой хрена (HRP) антитело козла против Fc IgG мыши - от Sigma. Однокомпронентный субстрат HRP ТМВ (3,3',5,5'-тетраметилбензидин) (№ TMBW-1000-01 по кат.) и стоп-реактив ТМВ (№ BSTP-1000-01 по кат.) получали от BioFx Laboratories.
B. Иммунизация мышей in vivo
Пять HtrA1-нокаутных мышей (HtrA1.noneo.BALB.ko.C1-3) иммунизировали очищенным протеазным доменом His-меченой рекомбинантной мышиной HtrA1 (называемым в данном документе muHtrA1-PD-His, SEQ ID NO: 153; см. пример 2 WO 2013/055998), суспендированной в адъюванте монофосфориллипида А/дикориномиколата трегалозы путем инъекции в подушечку стопы (2 мкг/инъекцию для одной мыши) с интервалами от 3 до 4 суток из всего 12 стимулирующих инъекций, после 2 предварительных совместных стимуляций антигеном в фосфатно-солевом буфере (ФСБ). Через три дня после последней стимуляции собирали и выделяли лимфоциты из селезенок и лимфоузлов иммунизированных мышей. Для инъекции готовили очисткой muHtrA1-PD-His, как описано в примере 2 WO 2013/055998.
C. Слияние клеток, скрининг гибридом и субклонирование
Выделенные клетки селезенки мыши из двух мышей (под номерами 748 и 749) сливали с миеломными клетками SP2/0 (Американская коллекция типовых культур), используя прибор Cyto Pulse CEEF-50 (Cyto Pulse Sciences). Вкратце, после двухкратного промывания средой CYTOFUSION® смешивали выделенные клетки селезенки и клетки SP2/0 в соотношении 1:1, а затем ресуспендировали в среде С CYTOFUSION® в концентрации 10 миллионов клеток/мл. Выполняли электрослияние в соответствии с руководством производителя. Слитые клетки культивировали в среде С CLONACELL™-HY в течение ночи при 37°С в инкубаторе с 7% СО2. На следующий день центрифугировали слитые клетки, а затем ресуспендировали их в 10 мл среды С CLONACELL™-HY и потом осторожно смешивали с 90 мл среды D CLONACELL™-HY на основе метил целлюлозы, содержащей селективные реактивы гипоксантин, аминоптерин и тимидин (ГАТ). Высаживали клетки на чашки Петри 40×100 мм (№351029 по кат., Becton Dickinson) и давали возможности расти при 37°С в инкубаторе с 7% СО2. Через 10 суток инкубации собирали 1429 отдельных клонов гибридом, используя систему CLONEPIX™ (Genetix, Великобритания) и переносили в 15 х 96-луночных культуральных планшетов (№353075, Becton Dickinson) с 200 мкл/лунку среды Е CLONACELL™-HY. Заменяли культуральную среду гибридом и через 3 суток супернатанты гибридом подвергали скринингу твердофазным иммуноферментным анализом (ELISA) для определения связывания с muHtrAI-PD-His.
Выполняли ELISA в соответствии со стандартным протоколом. Вкратце, покрывали 96-луночные планшеты для микротитрования ELISA (Greiner, Германия) 100 мкл/лунку muHtrA1-PD-His или huHtrA1-PD-His (SEQ ID NO: 154) в 2 мкг/мл в 0,05 М карбонатном буфере (рН 9,6) при 4°С в течение ночи. После трехкратного промывания промывочным буфером (0,05% TWEEN® 20 в ФСБ, Sigma) планшеты блокировали 100 мкл разбавителя для анализа ELISA с БСА (бычьим сывороточным альбумином). Добавляли 100 мкл культивированных супернатантов или разбавленных очищенных моноклональных антител (mAb) и инкубировали в течение 1 ч при комнатной температуре. Промывали планшеты три раза и инкубировали с конъюгированным с HRP Fc козла против IgG мыши в течение 1 ч. После трехкратного промывания выявляли связанный фермент добавлением 100 мкл/лунку субстрата ТМВ (BioFX Laboratories) с выдерживанием 5 мин. Реакции останавливали добавлением 100 мкл/лунку стоп-реактива (BioFX Laboratories) с последующим выявлением окрашивания при поглощении 650 нм (А650 нм). Выявляли 105 исходных ELISA-позитивных супернатантов. После размножения и культивирования в течение 3 суток, данные клоны повторно подвергали скринингу в последующем ELISA, который подтвердил, что 75 из 105 клонов все еще были ELISA-позитивными по связыванию с muHtrA1-PD-His (Фиг. 1А и 1В). Большинство из этих 75 клонов также связывались с протеазным доменом HtrA1 человека (Фиг. 1А и 1В).
Далее эти 75 ИФА-позитивных клонов исследовали с использованием анализа in vitro для оценки способности супернатанта гибридомы ингибировать расщепление субстрата протеазным доменом HtrA1 человека (huHtrA1-PD-His; SEQ ID NO: 154). Применяли протеазный анализ ENZCHEK® с зеленой флуоресценцией (ThermoFisher Scientific). В данном анализе в качестве субстрата используется производное казеина, которое интенсивно мечено нечувствительным к рН зеленым флуоресцентным красителем BODIPY® FL. Флуоресценция красителя BODIPY® FL внутримолекулярно гасится полноразмерным меченым субстратом. Расщепление субстрата под действием huHtrA1-PD высвобождает флуоресцентные меченые BODIPY® FL пептиды, приводя к увеличению флуоресцентного сигнала (Фиг. 2А). Вкратце, инкубировали супернатант гибридомы и HtrA1-PD (20 нМ hHtrA1-PD; 40 мкл hHtrA1-PD с 60 мкл супернатанта) в буфере (50 мМ Трис, 200 мМ NaCl, 0,25% CHAPS, рН 8,0) в конечном объеме 200 мкл в течение 20 мин при 37°С. Добавляли 5 мкг/мл меченого BODIPY® FL субстрата и в течение 20 мин считывали флуоресценцию (относительные тысячные единицы флуоресценции мОФЕ/мин). Используя данный анализ блокирования обнаружено, что 10 из 75 клонов ингибируют опосредованное HtrA1-PD расщепление субстрата (Фиг. 2В и 2С). На Фиг. 3А и 3В показано сравнение способности субпопуляции клонов ингибировать активность muHtrA1-PD по сравнению с huHtrA1-PD.
Через по меньшей мере 2 раунда субклонирования отдельных клеток методом предельного разведения масштабировали 7 клонов с различными характеристиками (20Е2, 19В12, 12А5, 3А5, 15Н6, 15Е3 и 19G10) и собирали супернатанты для очистки антитела и дополнительной очистки. Отбирали эти клоны, в частности, на основе способности ингибировать активность HtrA1 in vitro и связывания с muHtrA3 (19В12). Эти 7 клонов также исследовали на способность выявлять muHtrA1 в иммуногистохимическом анализе, а также способность связывать мышиный HtrA3-PD и мышиный HtrA4-PD (по оценке ELISA). В таблице 2 показана краткая информация о количественных свойствах данных 7 клонов.

Следующим этапом было определение способности семи отобранных выше антител ингибировать опосредованное HtrA1 расщепление при измерении в анализе FRET.
Очищали супернатанты гибридом методом аффинной хроматографии на белке А, с последующей стерильной фильтрацией (размер пор 0,2 мкм, Nalge Nunc International, штат Нью-Йорк, США) и хранили их при 4°С в ФСБ. Очищенные моноклональные антитела подтверждали методами ELISA и FACS перед дополнительным исследованием в функциональных анализах. Определяли изотипы очищенных mAb набором для изотипирования моноклональных антител мыши ISOSTRIP™ (Roche Diagnostics Corporation).
Исследовали очищенные антитела на способность ингибировать активность HtrA1 в анализе блокирования на основе FRET (например, анализ H2-Opt). В данном анализе определяли способность антитела ингибировать расщепление субстрата методом резонансного переноса энергии флуоресценции (FRET, также называемый ферстеровским резонансным переносом энергии). FRET-пептидный субстрат H2-Opt, имеющий молекулярную массу 1600 Да, содержит донор Мса (7-метоксикумарин-4-ил-ацетил) и акцептор (гаситель) Dnp (N-2,4-динитрофенил). Полноразмерная последовательность FRET-пептидного субстрата представляет собой (Mca)IRRVSYSF(Dnp)KK (SEQ ID NO: 152). У интактного пептидного субстрата фрагмент гашения Dnp гасит флуоресценцию донора Мса. Протеолитическое расщепление FRET-пептидного субстрата разделяет флуорофор и гаситель, тем самым освобождая флуоресценцию Мса от гашения и приводя к увеличению флуоресцентного сигнала (Фиг. 4А). Данный анализ выполняли, используя условия анализа H2-Opt, описанные ниже в примере 3, разделе F. Зависимое от времени увеличение интенсивности флуоресценции связано со степенью гидролиза субстрата. Исследовали антитела в концентрациях 5 нМ, 50 нМ или 500 нМ. Пятеро из очищенных антител против HtrA1 (15Н6, 19В12, 3А5, 12А5 и 20Е2) сохраняют способность блокировать опосредованное мышиным и человеческим HtrA1-PD расщепление субстрата (Фиг. 4В и 4С).
Далее исследовали способность очищенных антител ингибировать опосредованное полноразмерной HtrA1 расщепление субстрата. Применяли анализ блокирования на основе FRET, описанный в предыдущем параграфе, используя полноразмерную (FL) muHtrA1 или huHtrA1 Очищали muHtrA1-FL и huHtrA1-FL как описано в примере 2 WO 2013/055998. Очищенные антитела, включая 15Н6 и 19В12, ингибировали активность huHtrA1-FL (Фиг. 5А-5В) и muHtrA1-FL (Фиг. 5C-5D). В данном анализе клон 15Н6 ингибировал huHtrA1-FL со значением IC50 равным 0,7 нМ, которое приблизительно в два раза лучше по сравнению со значением IC50 антитела положительного контроля YW505.94. 15Н6, ингибировавшего muHtrA1-FL с IC50 равным 1,1 нМ, которое почти в 5 раз лучше по сравнению с антителом YW505.94 положительного контроля. Клон 19В12 ингибировал huHtrA1-FL с IC50 равным 1,4 нМ и ингибировал muHtrA1-FL с IC50 равным 1,0 нМ. Отобранные антитела подвергали секвенированию, как описано ниже в разделе D. Последовательности данных пяти антител изображены на Фиг. 6А и Фиг. 6В. На основе их предпочтительного молекулярного профиля, включающего активность и селективность, для дальнейшей разработки отбирали двое антител, 15Н6 и 19В12. Переформатирование этих антител описано ниже в разделе Е.
D. Секвенирование антител из клонов гибридом
i. Клонирование последовательностей генов вариабельных участков из клеток гибридом с использованием 5'-быстрой амплификации концов кДНК (5'-RACE) в 96-луночном формате
Для каждого клона гибридомы из планшетов для культивирования ткани переносили около 25 мкл растущих в лог-фазе клеток (0,5-1,0×106 клеток/мл) в лунки 96-луночного планшета с U-образным дном. Затем перед центрифугированием при 1000 об/мин в течение 5 минут добавляли 150 мкл холодного 1х ФСБ для промывания клеток. Удаляли супернатант и осадок клеток ресуспендировали в 25 мкл холодного 1х ФСБ.
ii. Полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР)
В пробирке Eppendorf готовили смесь мастер-микс из следующих ингредиентов (на 50 лунок): 2,5 мкл RNASEOUT™ (Invitrogen №10777019), 12,5 мкл 10х буфера для синтеза (5х буфер SUPERSCRIPT®), 12,5 мкл дитиотреитола (ДТТ) (0,1 М Invitrogen № P/NY00147), 6,25 мкл дНТФ (10 мМ Invitrogen №18427-013), 12,5 мкл 2,5% нонилфеноксиполиэтоксиэтанола (NP-40), 6,25 мкл бычьего сывороточного альбумина (БСА) с концентрацией 2 мг/мл (BioLabs №9001S), 25 мкл праймера RACE4muHC (1:100 в воде для ПЦР) (для секвенирования легкой цепи (LC) заменяли на праймер Race 3 каппа), 37,5 мкл воды для ПЦР и 10 мкл фермента SUPERSCRIPT® 3 (Invitrogen №18080-093). Нуклеотидная последовательность вырожденного праймера Race4muHC представляет собой ТТТ YTT GTC САС CKT GGT GCT GC (SEQ ID NO: 139), где Y кодирует С или Т, а K кодирует G или Т. Нуклеотидная последовательность Race 3 каппа представляет собой GTA GAA GTT GTT САА GAA G (SEQ ID NO: 140).
Затем в 96-луночный реакционный планшет для ПЦР переносили 2,5 мкл/лунку мастер-микса. В планшет добавляли 1 мкл клеток/лунку и его кратковременно центрифугировали в течение 30 секунд, а затем планшет встряхивали. Планшет помещали в амплификатор для ПЦР и задавали программу на 30 мин при 45°С с последующей выдержкой в течение 30 минут при 50°С. Данный планшет обозначали как планшет А.
iii. Реакция достраивания
Готовили 10х маточный буфер для достраивания со следующими ингредиентами (на 50 лунок): 5 мкл 1 М MgCl2, 5 мкл 0,1 М ДТТ, 5 мкл 1 М Трис рН 7,5, 10 мкл из 100 мМ дГТФ и 25 мкл воды для ПЦР.
Готовили рабочий раствор со следующими ингредиентами (на 50 лунок): 50 мкл 10х маточного буфера для достраивания, 312,5 мкл воды для ПЦР и 12,5 мкл концевой дезоксинуклеотидилтрансферазы (TdT) с активностью 300 единиц (Promega №М828А/С).
Затем к реакционному ПЦР планшету А добавляли рабочий раствор в количестве 7,5 мкл/лунку. Потом планшет помещали в амплификатор для ПЦР на 1 ч при 37°С с последующей выдержкой в течение 5 минут при 65°С. Данный планшет обозначали как планшет А/В для различения проведения достраивания в данном планшете.
iv. Первая реакция ПЦР
Получали мастер-микс, состоящий из следующих ингредиентов (для 50 лунок) в пробирке Falcon на 15 мл: 1050 мкл воды для ПЦР, 500 мкл 5х реакционного буфера для ПЦР GC кДНК, 500 мкл реактива для плавления GC (Clontech №S1091), 50 мкл прямого праймера DC5dn, 50 мкл Race7muHC (для LC - праймер Race 2 каппа), 50 мкл дНТФ (10 мМ) и 50 мкл полимеразы GC ADVANTAGE® (Clontech №S1088). Нуклеотидная последовательность вырожденного праймера Race7muHC представляет собой CAR GTC AMD GTC ACT GRC TCA G (SEQ ID NO: 141), где R кодирует или А или G, M кодирует или A или С, a D кодирует или G или А или Т. Нуклеотидная последовательность праймера Race 2 каппа представляет собой GAG GCA ССТ CCA GAT GTT ААС (SEQ ID NO: 142).
Затем в лунки нового реакционного планшета для ПЦР переносили 45 мкл данного мастер-микса и потом добавляли 1 мкл матрицы из планшета А/В. Затем данный планшет помещали в амплификатор для ПЦР и выполняли анализ по методу ПЦР Touchdown с уменьшением температур отжига, как указано ниже. Данный планшет обозначали как планшет С.
Метод ПЦР Touchdown:
96°С в течение 4 мин
3 цикла из [96°С в течение 45 с, 64°С в течение 30 с, 68°С в течение 90 с], 3 цикла из [96°С в течение 45 с, 61°С в течение 30 с, 68°С в течение 90 с], 3 цикла из [96°С в течение 45 с, 58°С в течение 30 с, 68°С в течение 90 с], 3 цикла из [96°С в течение 45 с, 57°С в течение 30 с, 68°С в течение 90 с], 3 цикла из [96°С в течение 45 с, 55°С в течение 30 с, 68°С в течение 90 с]
25 циклов из [96°С в течение 45 с, 52°С в течение 30 с, 68°С в течение 90 с]
68°С в течение 5 мин, с последующей конечной выдержкой при 4°С.
После этого 3 мкл продукта ПЦР анализировали на геле E-GEL® с 2% бромидом этидия (EtBr) и отмечали полосы. По 10 мкл/лунку добавляли щелочную фосфатазу Exol/креветки и помещали в амплификатор для ПЦР на 45 мин при 37°С с последующей выдержкой 15 мин при 85°С. Готовили мастер-микс Exol/SAP для 50 лунок: 2,5 мкл экзонуклеазы I с активностью 20 единиц/мкл (Fermentas № EN0582), 25 мкл SAP (USB №70092Y), 472,5 мкл воды для ПЦР. Готовили разведение продукта ПЦР в воде 1:4. Для секвенирования тяжелой цепи (НС) применяли праймер Race7muHC, а для секвенирования LC применяли праймер Race7.1muLC. Нуклеотидная последовательность праймера Race7.1muLC представляет собой ACT GCT САС TGG ATG GTG GGA AG (SEQ ID NO: 143).
v. Определение характеристик гель-фильтрацией и масс-спектрометрией
Для проведения анализа гель-фильтрацией в колонку TSK-GEL® Super SW3000 (внутренний диаметр 4,6 мм × 30 см, TOSOH Bioscience) инжектировали 10 мл очищенного образца при 0,35 мл/мин, используя в качестве подвижной фазы 200 мМ K2PO4, 250 мМ KCl, рН 7,0. При 37°С в течение 20 мин с помощью 50 мМ дитиотреитола восстанавливали приблизительно 2 мг очищенного IgG и после разделения на обращенной фазе в режиме реального времени с использованием колонки PLRP-S (Agilent) и градиента ацетонитрила анализировали времяпролетной (ВП) масс-спектрометрией (Agilent ЖХ/МС 6224). Определяли значения интактных масс по максимальной энтропийной деконволюции собранных спектров m/z, используя программное обеспечение MassHunter Qualitative Analysis (Agilent).
vi. Результаты
На Фиг. 6А для 19В12, 20Е2, 3А5, 12А5 и 15Н6 изображены последовательности вариабельного участка тяжелой цепи (VH). На Фиг. 6В для 19В12, 20Е2, 3А5, 12А5 и 15Н6 изображены последовательности вариабельного участка легкой цепи (VL). Данные клоны обладают уникальными тяжелой и легкой цепями. Данные масс-спектрометрии согласовывались с данными для последовательностей (см. таблицы 3 и 4) (см., например, Bos et al. Biotechnol. Bioeng. 112(9): 1832-1842, 2015).


Е. Переформатирование антител 15Н6 и 19В12
i. Клонирование ТОРО® антител 15Н6 и 19В12
Клонирование ТОРО® выполняли для подтверждения последовательностей вариабельных участков клонов антител 15Н6 и 19В12, полученных в результате прямого секвенирования продуктов ПЦР 5'-RACE (описанных выше). Выполняли реакцию клонирования ТОРО® ТА как описано в инструкции набора для клонирования pCR™4-TOPO® ТА для проведения секвенирования (Invitrogen K4575-02). Вкратце, в пробирке объединяли 2 мкл продукта ПЦР, 2 мкл воды, 1 мкл вектора pCR™4-TOPO® и 1 мкл приложенного солевого раствора, смешивали и инкубировали в течение 5 мин при комнатной температуре. Затем реакцию помещали на лед и добавляли 2 мкл данной реакционной смеси для клонирования ТОРО® в оттаявший флакон химически компетентных ONE-SHOT® клеток Escherichia coli ТОР10 (Invitrogen K4575-02) и смешивали без пипетирования. Реакционную смесь инкубировали на льду в течение 5-30 мин. Затем клетки подвергали тепловому шоку в течение 30 с при 42°С без встряхивания. Пробирки незамедлительно переносили на лед. Добавляли 250 мкл среды SOC с комнатной температурой. Пробирку закрывали и встряхивали горизонтально при 200 об/мин при 37°С в течение 1 ч. Далее из каждой трансформации распределяли 50 мкл по поверхности чашки с подогретым агаром ЛБ, содержащий 50 мкг/мл карбенициллина. Чашки инкубировали в течение ночи при 37°С, на следующий день собирали колонии и проводили очистку плазмид. Проверяли последовательности и отбирали конкретные лунки, содержащие последовательности VH и VL 15Н6, и VH и VL 19В12, каждая в векторе ТОРО®, для применения в качестве векторов для клонирования без использования рестрикции.
ii. Клонирование в mlgG2a без использования рестрикции
Амплифицировали вариабельные участки тяжелой и легкой цепи в векторах ТОРО® посредством приготовления смеси для ПЦР для LC следующим образом: 0,5 мкл матрицы ДНК (исходный вектор из мининабора), 4 мкл прямого праймера для VL 15Н6, 4 мкл обратного праймера для VL 15Н6, 2 мкл из 10 мМ дНТФ, 20 мкл 5х буфера HF, 1 мкл полимеразы PHUSION® (F-549L, Thermo Scientific, 2 Ед/мкл) и 68,5 мкл воды. Реакционную смесь для клонирования НС готовили таким же образом, за исключением применения прямого и обратного праймера для VH 15Н6. Смеси для ПЦР 19В12 готовили таким же образом, как смеси для 15Н6, за исключением применения праймеров 19В12. Последовательности праймеров были следующими:
Нуклеотидная последовательность прямого праймера VL 15Н6: GCA ACT GCA ACT GGA GTA CAT TCA CAA ATT GTT CTC TCC CAG TCT CC (SEQ ID NO: 144).
Нуклеотидная последовательность обратного праймера VL 15Н6: GGA TAC AGT TGG TGC AGC АТС AGC CCG TTT GAT TTC CAG CTT GG (SEQ ID NO: 145).
Нуклеотидная последовательность прямого праймера VH 15Н6: GCA ACT GCA ACT GGA GCG TAC GCC CAG GTC CAG CTG CAG CAG TCT GG (SEQ ID NO: 146).
Нуклеотидная последовательность обратного праймера VH 15Н6: GGG CCC TTG GTG GAG GCT GAG GAG ACG GTG ACT GAG GTT CCT TGA CCC (SEQ ID NO: 147).
Нуклеотидная последовательность прямого праймера VL 19В12: GCA ACT GCA ACT GGA GTA CAT TCA AAC ATT GTG GTG ACC CAA TCT CC (SEQ ID NO: 148).
Нуклеотидная последовательность обратного праймера VL 19В12: GGA TAC AGT TGG TGC AGC АТС AGC CCG CTT TAT TTC CAG CTT GG (SEQ ID NO: 149).
Нуклеотидная последовательность прямого праймера VH 19В12: GCA ACT GCA ACT GGA GCG TAC GCC GAG GTG AAG CTG GTG GAA TCT GGG GGA GG (SEQ ID NO: 150).
Нуклеотидная последовательность обратного праймера VH 19В12: GGG ССС TTG GTG GAG GCT GAG GAG ACG GTG ACT GCG GTT CCT TGA CCC (SEQ ID NO: 151).
Условия проведения циклов ПЦР были следующими:
98°С в течение 30 секунд
35 циклов из [98°С в течение 15 секунд, 68°С в течение 30 секунд, 72°С в течение 35 секунд]
72°С в течение 10 минут
В качестве праймеров для амплификации матрицы ДНК использовали амплифицированные VH и VL посредством приготовления смеси для ПЦР следующим образом для LC 15Н6: 1,25 мкл матрицы PRK-векторной ДНК mlgG2a (разведение из мининабора 1:10), 0,5 мкл продукта ПЦР VL 15Н6 (100-200 нг/мкл), 1 мкл 10 мМ дНТФ, 10 мкл буфера HF (5х), 1 мкл полимеразы PHUSION® и 35,75 мкл воды. Смесь для ПЦР НС 15Н6 готовили таким же образом, за исключением применения продукта ПЦР VH 15Н6. Смеси для ПЦР 19В12 готовили таким же образом, за исключением применения продукта ПЦР 19В12.
Условия проведения циклов ПЦР были следующими:
98°С в течение 30 секунд
25 циклов из [98°С в течение 15 секунд, 68°С в течение 30 секунд, 72°С в течение 4 минут]
72°С в течение 10 минут
Затем в новую пробирку переносили 18 мкл реакционной смеси для ПЦР и проводили расщепление 2 мкл Dpnl (№ R0176L, NEB 20000 Ед/мл) в течение 2 ч при 37°С, периодически осуществляя центрифугирование пробирки. Трансформировали 30 мкл компетентных клеток NOVABLUE SINGLES™ (Novagen, 70181) 1 мкл расщепленного Dpnl препарата в соответствии с инструкцией производителя. Вкратце, оттаивали клетки и добавляли ДНК, клетки инкубировали на льду в течение 5 мин перед тепловым шоком в течение 30 с, помещали обратно на лед в течение 2 мин, с последующим добавлением среды SOC. Высаживали 25 мкл или 50 мкл на планшеты, содержащие 50 мкг/мл карбенициллина и оставляли при 37°С в течение ночи. На следующий день собирали колонии, проводили очистку плазмид посредством мининабора и плазмиды секвенировали.
iii. Очистка антител
Проводили автоматизированную очистку супернатантов клеток 293 на системе для работы с жидкостями Tecan Freedom EVO® 200 с насадкой МСА96 на 500 мл. Вкратце, захватывали IgG, используя колонки-наконечники, специально наполненные 20 мл смолы MABSELECT SURE™ (Glygen Corp., Columbia, Maryland & GE Healthcare, г. Питсбург, штат Пенсильвания, США). После промывания 1х ФСБ с рН 7,4 элюировали IgG в 160 мл 50 мМ фосфорной кислоты, рН 3, и нейтрализовали с помощью 12 мл 20х ФСБ с рН 11. Колонки-наконечники MABSELECT SURE™ очищали в 0,1 М NaOH и регенерировали с помощью 1х ФСБ с рН 7,4 для последующего применения до 15 раз. Аналогичным образом захватывали Fab, используя колонки-наконечники с 20 мл смолы GAMMABIND™ Plus (Glygen Corp & GE Healthcare), и впоследствии их промывали 1х ФСБ рН 7,4. Fab элюировали в 190 мл 10 мМ цитрата, рН 2,9, и нейтрализовали с помощью 19 мл 0,4 М Трис с рН 8,7. Колонки-наконечники GAMMABIND™ Plus очищали в 6 М гуанидине и регенерировали с помощью 1х ФСБ с рН 7,4 для последующего применения до 15 раз.
iv. Рекомбинантные антитела 15Н6 и 19В12 сохраняют начальную блокирующую активность
Оценивали способность рекомбинантных антител 15Н6 и 19В12 ингибировать активность huHtrA1-FL, используя анализ блокирования FRET, описанный выше в разделе С. Оба рекомбинантных антитела сохраняли свою начальную блокирующую активность, как определено по антителам, полученным из гибридом (Фиг. 7А и 7В). Для рекомбинантного антитела 15Н6 значение IC50 приблизительно составило 0,7 нМ, тогда как для рекомбинантного антитела 19В12 значение IC50 приблизительно составило 1,2 нМ, что отражает активность полученных из гибридом антител (Фиг. 7А и 7В).
Пример 2. Гуманизация гибридомных антител против HtrA1 15Н6 и 19В12
А. Гуманизация антитела против HtrA1 15Н6
Выравнивали последовательности вариабельного участка легкой цепи (VL) и вариабельного участка тяжелой цепи (VH) мышиного антитела 15Н6 (также называемого m15H6) с консенсусными последовательностями антитела человека, и установили, что консенсусная легкая цепь каппа I человека (huk1) и консенсусная тяжелая цепь подгруппы I человека (huVH1) являются наиболее близкими к каркасным участкам человека Фиг. 8А и 8В).
Прививали гипервариабельные участки (HVR) легкой цепи и тяжелой цепи m15Н6 на консенсусные акцепторные каркасные участки huκI и huVH1, соответственно, методом мутагенеза по Кюнкелу (см., например, Kunkel et al., Methods Enzymol. 154: 367-382, 1987), используя для получения клона антитела h15H6.v1 отдельные олигонуклеотиды для каждого гипервариабельного участка (Фиг. 8А и 8В). В этом процессе прививали положения 24-34 в HVR-L1, 50-56 в HVR-L2 и 89-97 в HVR-L3 для VL m15H6 на консенсусный акцептор huκI, а положения 26-35 в HVR-H1, 49-65 в HVR-H2 и 95-102 в HVR-H3 для VH m15Н6 прививали на консенсусный акцептор huGI. В процесс гуманизации также включали положения 46, 47 и 49 в каркасном участке 2 легкой цепи (FR-L2), и положения 67, 69, 71 и 93 в каркасном участке 3 тяжелой цепи (FR-L3), поскольку Foote и Winter проанализировали кристаллические структуры комплекса антитела и антигена и обнаружили, что эти положения, являясь частью остатков каркаса, действуют как зона Vernier, что может корректировать структуру HVR и точно подстраивать подгонку к антигену (Foote et al., J. Mol. Biol. 224:487-499, 1992) (Figs. 8A-8B). Измеряли аффинность связывания m15H6 и h15H6.v1 в форме Fab для человеческого и мышиного HrtA1 анализом связывания поверхностным плазмонным резонансом (ППР) BIACORE™, как описано ниже в подразделе ii раздела С (Фиг. 9A-9D). Результаты этого анализа обобщены в таблице 5.


Для дополнительной оценки важности мышиных остатков зоны Vernier в h15H6.v1, данное антитело отображали на фаге, а отдельные мышиные остатки Vernier (LC: Р46, W47, S49; НС: А67, L69, А71 и Т93) для создания вариантов с точечными мутациями заменяли человеческими остатками (LC: L46, L47, Y49; НС: V67, I69, R71 и А93). Все 7 вариантов подвергали ELISA с фаговой конкуренцией против человеческой или мышиной HtrA1 для определения аффинностей связывания (выраженных в IC50 фага, см. ниже подраздел i раздела С). Результаты показывают, что вариант LC-P46L полностью нарушает связывание h15H6.v1 как с человеческой, так и мышиной HtrA1. Вариант LC-S49Y снижал связывание с человеческой и мышиной HtrA1 почти в 10 раз (Фиг. 10А и 10В). Оба НС-варианта HC-A67V и НС-Т93А нарушали лишь связывание с мышиной HtrA1, но не с человеческой HtrA1 (Фиг. 10А и 10В). Другие варианты, LC-W47L, HC-L69I и НС-A71R, не показывали какого-либо значимого падения связывания с человеческой и мышиной HtrA1 (Фиг. 10А и 10В). Поэтому, дополнительно конструировали клон антитела h15H6.v1 добавлением следующих мутаций: LC-W47L, HC-L69I и HC-A71R для получения клона антитела h15H6.v2 (см. Фиг. 8А и 8В).
При анализе химической стабильности клона антитела h15H6.v2 в HVR выявили несколько потенциально нестабильных остатков или пар остатков: W91 в HVR-L3 (окисление), N94 Р95 в HVR-L3 (усечение) и D55 G56 в HVR-H2 (изомеризация). См., например, пример 4 ниже. Для преодоления окисления W91 в HVR-L3, создавали 2 варианта (LC-W91Y и LC-W91L) и получали их в виде Fab для проведения анализа связывания ППР BIACORE™. Результаты, обобщенные ниже в таблице 6, показали, что положение LC-W91 является важным для аффинности связывания, а также замены, влияющие на связывание с человеческой и мышиной HtrA1 в кратности около 20-50 раз (Фиг. 11А и 11В).

Касательно усечения в положениях LC-N94 LC-P95 в HVR-L3, создавали четыре варианта j15H6.v2 (LC-N94A LC-P95 (также названы АР), LC-N94E LC-P95 (также названы ЕР), LC-N94Q LC-P95 (также названы QP) и LC-N94S LC-P95 (также названы SP)) и получали их в виде Fab для проведения анализа связывания BIACORE™. Результаты показали, что варианты АР и ЕР проявили сходную аффинность связывания с HtrA1 человека, а варианты QP и SP дали приблизительно 2-кратное снижение по аффинности связывания с HtrA1 человека (Фиг. 12А-12В). Таблица с обобщенными результатами данного анализа показана на Фиг. 12В.
Касательно изомеризации по остаткам HC-D55 HC-G56 в HVR-H2, создавали четыре варианта (HC-D55A HC-G56 (также названы AG), HC-D55E НС-G56 (также названы EG), HC-D55S HC-G56 (также названы SG) и HC-D55 НС-G56A (также названы DA)) и получали их в виде Fab для проведения анализа связывания BIACORE™. Результаты показали, что только вариант EG проявил сравнимую аффинность связывания по отношению HtrA1 человека, а остальные варианты в положениях 55 и/или 56 тяжелой цепи дали от 2- до 3-х кратное снижение аффинности связывания с HtrA1 человека (Фиг. 13А и 13В). Таблица с обобщенными результатами данного анализа показана на Фиг. 13В.
На основании этих результатов ввели оба варианта АР (HVR-L3) и EG (HVR-H2) в последовательность клона антитела h15H6.v2 для создания клона антитела h15H6.v2.APEG (также назван h15H6.v3 или AP_EG) (см. Фиг. 8А и 8В). Данный клон также сравнивали с несколькими другими вариантами h15H6.v2, включая LC-N94E LC-P95 HC-D55E HC-G56 (также назван EP_EG); LC-N94Q LC-Р95 HC-D55E HC-G56 (также назван QP_EG) и LC-N94S LC-P95 HC-D55E HC-G56 (также назван SP_EG). Анализ ППР BIACORE™ показал, что h15H6.v2.APEG сохраняет сравнимую аффинность связывания с h15H6.v2 (Фиг. 14А и 14В). Таблица с обобщенными результатами данного анализа показана на Фиг. 14 В. Способность данных вариантов блокировать активность HtrA1 определяли с использованием анализа блокирования на основе FRET, описанного в примере 1 (Фиг. 14С и 14D). Значения pI этих вариантов в форме Fab также определяли с использованием программного обеспечения SMACK (см., например, Sharma et al. Proc. Natl. Acad. Sci. USA 111: 18601, 2014) и они показаны в таблице 7 по сравнению с Fab против VEGF ранибизумабом (LUCENTIS®).

В. Гуманизация гибридомного антитела 19В12 против HrtA1
Выравнивали аминокислотные последовательности VL и VH мышиного антитела 19В12 (также названого m19B12) с консенсусными последовательностями человека и установили, что консенсусная легкая цепь каппа IV человека (huκ4) и консенсусная тяжелая цепь подгруппы III человека (huVH3) являются наиболее близкими к каркасным участкам человека Фиг. 15А-15В).
Прививали гипервариабельные участки легкой цепи и тяжелой цепи m19B12, соответственно, на консенсусные акцепторные каркасные участки huк4 и huVH3 методом мутагенеза по Кюнкелу с использованием отдельных олигонуклеотидов для каждого гипервариабельного участка для получения прямого HVR-привитого варианта, называемого в данном документе клоном антитела h19B12.v1. В этом процессе прививали положения 24-34 в HVR-L1, 50-56 в HVR-L2 и 89-97 в HVR-L3 для VL 19В12 на консенсусный акцептор huк4, а положения 26-35 в HVR-H1, 50-65 в HVR-H2 и 95-102 в HVR-H3 для VH 19В12 прививали на консенсусный акцептор huGIII (Фиг. 15А-15В).
Аффинность связывания m19B12 и h19B12.v1 (в форме Fab) определяли с использованием ППР BIACORE™ (Фиг. 16A-16D), применяя описанный ниже в подразделе ii раздела С подход. Результаты данного анализа обобщены ниже в таблице 8. Равновесная константа связывания (KD) h19B12.v1 с HtrA1 человека улучшилась приблизительно в 2 раза после гуманизации (таблица 8), по сравнению с m19B12.

С.Материалы и методы
i. ELISA с фаговой конкуренцией для определения IC50 фага
Покрывали планшеты для микротитрования MAXISORP™ HtrA1-PD-His человека при концентрации 2 мкг/мл в ФСБ в течение 2 ч, а затем блокировали буфером PBST (0,5% БСА и 0,05% TWEEN®20 в ФСБ) в течение 1 ч при комнатной температуре. Очищенный из культуральных супернатантов фаг инкубировали в течение 1 ч с последовательно разведенной в буфере PBST человеческой или мышиной HtrA1 в планшете для микротитрования тканей-культур, после чего переносили 80 мкл смеси в лунки, покрытые HtrA1 человека в течение 15 мин для захвата несвязанного фага. Промывали планшет буфером РВТ (0,05% TWEEN®20 в ФСБ) и добавляли конъюгированное с HRP антитело против М13 (Amersham Pharmacia Biotech) (1:5000 в буфере PBST) в течение 40 минут. Промывали планшет буфером РВТ и проявляли добавлением субстрата тетраметилбензидина (Kirkegaard and Perry Laboratories, г. Гейтерсберг, штат Мэриленд, США). Для определения IC50 фага на графике отмечали поглощение при 450 нм в виде зависимости от концентрации мишени в растворе. Данное значение использовали как оценку аффинности для клона Fab, отображаемого на поверхности фага.
ii. Определение аффинности антител методом BIACORE™ Для определения аффинности связывания Fab против HtrA1 по кинетическим параметрам одного цикла выполняли измерение (ППР) с помощью прибора Т100 BIACORE™. Вкратце, активировали сенсорный чип СМ5 серии S реактивами гидрохлоридом 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкцией поставщика, и связывали стрептавидин (Pierce) до получения приблизительно 2500 единиц ответа (RU) с последующим блокированием непрореагировавших групп 1 М этаноламином.
Для измерения кинетических параметров сначала вводили биотинилированную HtrA1-PD-His человека или мыши при скорости потока 10 мкл/мин для захвата приблизительно 150 RU в 3 различных проточных ячейках (FC), за исключением FC1 (которая служила в качестве эталона), а затем вводили (скорость потока: 30 мкл/мин) 5-кратные последовательные разведения от низкого (0,48 нМ) до высокого (300 нМ) Fab против HtrA1 в буфере HBS-P (0,01 М ГЭПЭС рН 7,4, 0,15 М NaCl, 0,005% сурфактант Р20) одно за другим в том же цикле без регенерации между введениями. Записывали сенсорграмму и выполняли вычитание показателей эталона и буфера перед оцениванием программным обеспечением BIACORE™ Т100 Evaluation (версия 2.0). Скорости ассоциации (ka) и скорости диссоциации (kд) вычисляли с использованием простой односвязной модели связывания Лэнгмюра. Равновесную константу диссоциации (KD) рассчитывали как соотношение kд/ka.
Пример 3. Созревание аффинности антитела против HtrA1 клона h15H6.v2
А. Конструирование библиотеки NNK созревания аффинности h15H6.v2 и пэннинг
Для дополнительного улучшения аффинности клона антитела h15H6.v2 против HtrA1 из варианта h15H6.v2 в форме Fab-амбер конструировали фаговые библиотеки для фагового дисплея моновалентного Fab либо с остатками HVR легкой цепи (т.е. HVR-L1, HVR-L2 и HVR-L3), либо с остатками HVR тяжелой цепи (т.е. HVR-H1, HVR-H2 и HVR-H3), остатки рандомизировали используя вырожденный кодон NNK, кодирующий все 20 аминокислот с 32 кодонами (см., например, Brenner et al., Proc. Natl. Acad. Sci. USA 89(12): 5381-5383,1992). Конструировали библиотеки для обеспечения одной мутации NNK в каждом из трех HVR легкой цепи или тяжелой цепи. Полученную библиотеку ДНК вводили электропорацией в клетки XL1 Е. coli, обеспечивая приблизительно 109 трансформантов. В некоторых случаях применяли библиотеки для мягкой рандомизации и NNK-эпистаза, как описано в PCT/US 2015/055672. Фаговые библиотеки инкубировали с 750 мМ NaCl в буфере ФСБ SUPERBLOCK™ (Pierce) и 0,05% TWEEN® 20 в течение 30 мин, а затем применяли на захваченном нейтравидином биотинилированном HtrA1 с маркером His в первом раунде пэннинга для снижения неспецифического электростатического взаимодействия между HtrA1 и фагом. В последующих двух раундах с использованием снижающейся концентрации биотинилированного антигена huHtrA1-PD-His с присутствием в растворе 1000х небиотинилированной HtrA1 в качестве конкурента для увеличения жесткости отбора. См. Фиг. 17 со схематической диаграммой стратегии пэннинга.
B. Гпубокое секвенирование библиотек созревания аффинности h15H6.v2
Для глубокого секвенирования из исходной фаговой библиотеки и из третьего раунда отбора выделяли фагмиду с двухспиральной ДНК из клеток XL-1 Е. coli, несущих фагмидные векторы. В качестве матрицы применяли очищенную ДНК для амплификации участков VL и VH на основе ПЦР с ограничением циклов, используя ДНК-полимеразу PHUSION® (New England Biolabs). Продукты ПЦР очищали экстракцией в агарозном геле и сорбировали (набор для экстракции из геля Qiagen). Элюированные ДНК-ампликоны применяли в качестве основы препарата для глубокого секвенирования библиотек с помощью стандартных способов получения библиотек IIIumina, используя набор для препаратов образцов ДНК TRUSEQ™ (IIIumina). Лигированные с адаптером библиотеки подвергали одному циклу ПЦР и секвенировали на IIIumina MISEQ®, используя секвенирование со спаренными концами с размером вставки 200 п.н. или 300 п.н., необходимыми для покрывания всей длины ампликона.
C. Анализ глубокого секвенирования библиотек созревания аффинности h15H6.v2
Анализировали данные секвенирования, используя язык программирования R для статистических данных (см., например, R Core Team, R: A language and environment for statistical computing, 2013) и пакет ShortRead (см. Morgan et al., Bioinformatics 25(19): 2607-2608, 2009). На установленных последовательностях выполняли контроль качества (QC), при котором каждую последовательность HVR проверяли на наличие правильной длины, и обеспечивали введение только до одной мутации NNK и отсутствие мутации, не являющейся NNK. Создавали матрицы веса положения расчетом частоты встречаемости всех мутаций по каждому рандомизированому положению. Рассчитывали коэффициенты обогащения для каждой мутации путем деления частоты встречаемости заданной мутации в заданном положении в отсортированном образце с частотой встречаемости точно такой же мутации в неотсортированном образце, как описано раннее (Fowler et al., Nature Methods 7(9): 741-746, 2010). На Фиг. 18A и 18В показаны карты интенсивности, изображающие коэффициенты обогащения, соответственно, для каждой мутации в положениях HVR легкой цепи и положениях HVR тяжелой цепи.
Для синтеза отбирали одиночные мутации из библиотек легкой цепи или тяжелой цепи с высоким коэффициентом обогащения для клонирования в экспрессионной конструкции Fab млекопитающего, содержащей маркер Flag для создания гибридных белков Fab-маркер Flag. Трансфицировали плазмиды, кодирующие тяжелую или легкую цепь, в клетки 293Т для экспрессии в объеме 30 мл, a Fab очищали с помощью колонки с антителом против Flag.
Использовали очищенные Fab, содержащие одиночные мутации, для определения аффинности связывания с использованием анализа ППР BIACORE™ (см. раздел D ниже). Данные по аффинности для одиночных мутаций обобщены в таблице 9. Значения скорости диссоциации находились в пределах от около 0,0013 до около 0,004, по сравнению со значением около 0,0016 для h15H6.v2. У варианта LC3 (LC-N31E) от 2-до 3-х раз улучшилась скорость диссоциации по сравнению с 15H6.v2.


D. Комбинация отобранных вариантов для дальнейшего улучшения аффинности
Большинство одиночных мутаций из библиотеки NNK тяжелой цепи или легкой цепи не улучшали аффинность связывания с HtrA1 по сравнению с исходным клоном h15H6.v2 (таблица 9). Для создания комбинационных мутантов отбирали варианты с наименьшей скоростью диссоциации как для легкой цепи (LC3, LC4 и LC7), так и тяжелой цепи (НС1, НС2, НС3 и НС5). Эти комбинационные мутанты включали как вариант легкой цепи, так и вариант тяжелой цепи. С использование комбинационных мутантов выполняли кинетический анализ BIACORE™ (как описано ниже в разделе С). Комбинационные мутанты LC3.HC3, LC3.HC1 и LC7.HC2 обладали 2-3 кратным улучшением аффинности по сравнению с исходным Fab (h15H6.v2) (таблица 10).

Далее дополнительно комбинировали мутанты LC (LC37=LC3_LC7, LC347=LC3_LC4_LC7) и мутанты НС (НС13=НС1_НС3, НС23=НС2_НС3). Эти мутанты дополнительно модифицировали введением вариантов N94A HVR-L3 и D55E HVR-H2 (т.е. AP_EG, см. пример 2), чтобы избежать саморасщепления и дезамидирования, для анализа кинетики аффинного взаимодействия.
Лучшими клонами были APEG.LC3.HC1, APEG.LC3.HC3 (h15H6.v4), APEG.LC37.HC13, APEG.LC37.HC23, APEG.LC347.HC13 и APEG.LC347.HC23 с от 3-до 5-х кратными улучшениями, в среднем, по сравнению с h15H6.v2 (Фиг. 20). Аминокислотные последовательности VL и VH этих вариантов показаны на Фиг. 21А и 21В, соответственно. Анализировали последовательности этих клонов по потенциальному риску окисления на W91 HVR-L3, используя виртуальный анализ (Sharma et al. Proc. Natl. Acad. Sci. USA 111:18601, 2014). Для APEG.LC3.HC3 (h15H6.v4), APEG.LC37.HC13 и APEG.LC347.HC13 получили уровень риска, эквивалентный h15H6.v3. Для других риск был выше, чем для h15H6.v2.
E. Определение аффинности Fab методом ППР BIACORE™
Для определения аффинности связывания отобранных вариантов Fab по отношению к HtrA1, выполняли измерение с помощью прибора Т200 BIACORE™. Вкратце, активировали сенсорный чип СМ5 серии S реактивами 1-EDC и NHS в соответствии с инструкцией поставщика, и связывали антитело против His до получения приблизительно 200-300 единиц ответа (RU) с последующим блокированием непрореагировавших групп 1 М этаноламином. Для измерения кинетических параметров сначала вводили приблизительно 5 нМ huHtrA1-PD-His при скорости потока 10 мкл/мин для захвата приблизительно 100 RU в 2 различных проточных ячейках (FC), за исключением FC1 (которая служила в качестве эталона). Далее вводили (скорость потока: 30 мкл/мин) 5-кратные последовательные разведения от низкого (0,8 нМ) до высокого (50 нМ) Fab в буфере HBS-P (0,01 М ГЭПЭС рН 7,4, 0,15 М NaCl, 0,005% сурфактант Р20). Корректировали ответы связывания на HtrA1 вычитанием значения RU, полученного для пустой проточной ячейки. Записывали сенсорграмму и выполняли вычитание показателей эталона и буфера перед оцениванием программным обеспечением BIACORE®T200 Evaluation (версия 2.0). Скорости ассоциации (ka) и скорости диссоциации (kд) вычисляли с использованием простой односвязной модели связывания Лэнгмюра. Равновесную константу диссоциации (KD) рассчитывали как соотношение kд/ka.
F. Ингибирующая активность вариантов h15H6.v2 в анализе блокирования HtrA1 на основе FRET (H2-Opt анализ блокирования)
Исследовали отобранные варианты h15H6.v2 с созревшей аффинностью на способность ингибировать активность HtrA1. Выполняли анализы блокирования in vitro на основе FRET с использованием субстрата H2-Opt ((Mca)IRRVSYSF(Dnp)KK). H2-Opt анализы блокирования выполняли как описано в примере 3 публикации заявки на патент №2013/0129743А1, которая в полном объеме включена в данный документ путем ссылки. Вкратце, пептид H2-Opt (Мса-IRRVSYSF(Dnp)KK) (SEQ ID NO: 152), первоначально описанный как субстрат для HtrA2 (см., например, Martins et al., J. Biol. Chem. 278:49417-27, 2003), синтезировали на смоле Fmoc-Lys(Boc)-wang, используя стандартные процедуры связывания с HBTU. В положении Р5' включен Fmoc-Lys(DNP)-OH (Anaspec). Синтезировали пептид до Р5 (Мса, 7-метоксикумарин, Aldrich), а затем отщепляли от твердой подложки, используя трифторуксусную кислоту, триизопропилсилан и воду в течение 2 часов при комнатной температуре. Пептид осаждали из этилового эфира, экстрагировали уксусной кислотой, ацетонитрилом, водой и лиофилизировали. Растворяли неочищенный меченый пептид и очищали на препаративной обращенно-фазной колонке С18, используя ацетонитрил/воду. Очищенные фракции объединяли, лиофилизировали и анализировали жидкостной хроматографией/масс-спектрометрией (PE/Sciex), выявлено, что массы согласовывались с расчетными.
Инкубировали HtrA1 в 96-луночных планшетах с черным оптически прозрачным дном (Nalge Nunc Int., г. Рочестер, штат Нью-Йорк, США) с антителами против HtrA1, последовательно разведенными в аналитическом буфере (50 мМ Трис-HCl, рН 8,0, 200 мМ NaCl, 0,25% CHAPS), в течение 20 мин при 37°С. Разбавляли водой 10 мМ маточный раствор пептидного субстрата Мса-IRRVSYSF(Dnp)KK (SEQ ID NO: 152) (H2-Opt) в ДМСО до 12,5 мкМ, подогревали до 37°С, а затем добавляли в реакционную смесь. Измеряли увеличение сигнала флуоресценции (возбуждение 328 нм, испускание 393 нм) на считывающем устройстве микропланшетов SPECTRAMAX® М5 (Molecular Devices, г. Саннивейл, штат Калифорния, США) и определяли линейные скорости расщепления H2-Opt (мОФЕ/мин).
На Фиг. 22А показано резюме результатов экспериментов трех независимых анализов с H2-Opt, по существу выполненных как описано выше. Большинство клонов имело значения IC50 в диапазоне от около 0,4 нм до около 0,5 нМ, по сравнению с около 0,39 нМ для h15H6.v2. Антитело против HtrA1 APEG.LC3.HC3 (также названое h15H6.v4) показало наилучшее значение IC50 в данном анализе при 0,386 нМ (Фиг. 22А). На Фиг. 22В изображен репрезентативный график для данного анализа. В целом, варианты h15H6.v2 с созревшей аффинностью показали лучшее максимальное ингибирование HtrA1 по сравнению с h15H6.v2 (Фиг. 22А), со значениями максимального ингибирования в диапазоне от около 78% до около 96%.
Для оценки способности различных форм антител вариантов h15H6.v2, включая h15H6.v4, ингибировать активность HtrA1 применяли H2-Opt анализ блокирования на основе FRET. Выполняли анализ H2-Opt по существу как описано выше, за исключением того, что условия анализа были такими: 1 нМ фермента huHtrA1-PD, 1,25 мкМ субстрата H2-Opt, 50 мМ Трис с рН 8, 200 мМ NaCl, 0,25% CHAPS. Анализировали результаты на основании скорости изменения в относительных флуоресцентных единицах ОФЕ/с (50-1000 с) или по значениям ОФЕ в конечной точке на 2000 с. На Фиг. 23А-23Н показаны результаты примерного независимого эксперимента сравнения способности h15H6.v2 в форме Fab и h15H6.v4 в форме IgG или Fab ингибировать активность huHtrA1-PD. Антитело YW505.94a против HtrA1 (см. WO 2013/055988) служило в качестве положительного контроля. На Фиг. 24А и 24 В показаны обобщенные результаты определения IC50 и IC90, соответственно, из первой серии трех независимых экспериментов, проанализированных с использованием подхода ОФЕ/с.На Фиг. 25А и 25В показаны обобщенные результаты определения IC50 и IC90, соответственно, из второй серии трех независимых экспериментов, проанализированных для Fab h15H6.v4 с использованием ОФЕ/с или подхода с измерением ОФЕ конечной точки.
G. Способность APEG.LC3.HC3 (h15H6.v4) к блокированию в анализе активности на основе масс-спектрометрии
Оценивали способность APEG.LC3.HC3 (h15H6.v4) ингибировать опосредованное huHtrA1-PD расщепление интактного полноразмерного субстрата (α-казеина) с использованием анализа активности на основе масс-спектрометрии (МС). В данном примере сравнивали антитело h15H6.v4 против HtrA1 с низкомолекулярным ингибитором протеаз HtrA, ucf-101, описанным как антагонист к HtrA2 (также известный как Omi) (Cilenti et al., J. Biol. Chem. 278(13): 11489-11494, 2003). Для количественного определения на основе МС расщепления α-казеина с помощью HtrA1 в присутствии h15H6.v4 или ucf-101 применяли метки тандемных маркеров масс (ТМТ), маркирующие изобарные массы. У α-казеина имеется три остатка Р1', которые могут расщепляться HtrA1: Ser72, Thr95 и Ser157.
Для различения меченых стандартов α-казеина и анализируемых образцов для количественного определения интактного α-казеина применяли реактивы для маркирования изобарных масс TMTDUPLEX™. Реактивы TMTDUPLEX™ представляют собой наборы изобарных соединений (т.е. с одинаковой массой и структурой, так называемые изотопомеры), которые NHS-активированы для ковалентного необратимого маркирования групп первичных аминов (-NH2). Каждый изобарный реактив содержит различное количество тяжелых изотопов во фрагменте масс-репортерного маркера, что приводит к получению уникальной репортерной массы во время тандемной МС/МС для идентификации и относительного количественного определения образца.
Инкубировали 100 мМ бикарбоната триэтиламмония, 100 нМ huHtrA1, 100 мкг/мл α-казеина и ингибитор (т.е. ucf-101 или h15H6.v4) (конечный объем 20 мкл) при 37°С в течение 18 часов (расщепленный раствор). Отдельно получали аналогичный раствор без добавления ингибитора и инкубировали его в идентичных условиях (контрольный раствор). Исследовали Fab h15H6.v4 в диапазоне концентраций от 3,12 нМ до 100 нМ, тогда как низкомолекулярный ингибитор ucf-101 положительного контроля исследовали в диапазоне концентраций от 2 нМ до 250 нМ.
Готовили маточные растворы маркеров тандемных масс (TMTDUPLEX™) согласно рекомендациям производителя (Thermo Fisher Scientific). К расщепленному раствору добавляли 5 мкл ТМТ-126, а к контрольному раствору добавляли 5 мкл ТМТ-127. Через 1 ч инкубации при комнатной температуре вышеуказанные растворы объединяли в равных по объему количествах. Анализировали образцы на ЖХ-МС и количественно определяли по фрагментации наиболее интенсивных пиков ионов с использованием высокоэнергетической диссоциации в С-ловушке (HCD); соотношение интенсивности репортерных ионов 126/127 после фрагментации использовали для определения концентрации в расщепленном растворе.
Кривая титрования показала, что в данном анализе точно количественно определяли интактный α-казеин (Фиг. 26В). В данном анализе Fab h15H6.v4 ингибировал опосредованное huHtrA1-PD расщепление интактного α-казеина с IC50 около 45 нМ (IC90 = около 71 нМ). Данное значение было значительно улучшено по сравнению с низкомолекулярным ингибитором ucf-101, у которого IC50 составляло 77 мкМ.
Н. Блокирующая способность вариантов h15H6.v2 с созревшей аффинностью в анализе активности эндогенной HtrA1
Оценивали способность вариантов h15H6.v2 с созревшей аффинностью ингибировать эндогенную активность HtrA1 в модели с использованием глаз у кроликов. Для анализа активности эндогенной HtrA1 в качестве источника HtrA1 использовали среду клеток, секретирующих HtrA1 (клетки меланомы С32 человека). См., например, Ciferri et al. Biochem J. September 18, 2015, DOI: 10.1042/BJ20150601. Следует отметить, что при анализе эндогенного белка, существует приблизительно в 10 раз выше концентрация HtrA1 по сравнению с анализом H2-Opt рекомбинантного HtrA1 (см., например, Фиг. 28), что, как считается, объясняет разные значения IC50, наблюдаемые в анализах H2-Opt с использованием эндогенного HtrA1 и рекомбинантного HtrA1. На Фиг. 27А-27С показаны результаты анализа эндогенного HtrA1. В частности, клон APEG.LC3.HC3 (h15H6.v4) имел значение IC50 около 1,125 нМ (Фиг. 27С) с максимальным ингибированием около 80,1%.
l. Резюме свойств выбранных вариантов h15H6.v2
Сравнивали кинетику связывания и ингибирующую активность выбранных производных клона h15H6.v2 антитела против HtrA1, используя анализ ППР и анализ H2-Opt активности на основе FRET. Для определения максимального ингибирования использовали положительные и отрицательные контроли для определения 0% ингибирования (только фермент, без ингибитора) и 100% ингибирование (без фермента). Результаты данного сравнения показаны на Фиг. 28.
Пример 4. Анализ молекулярного оценивания антител против HtrA1
Исследовали клоны h15H6.v2, h15H6.v2.APEG (также называется h15H6.v3) и APEG.LC3.HC3 (также называется h15H6.v4) антител против HtrA1 в анализах молекулярного оценивания (МА) на свойства стабильности. Исследовали также клон h19B12.v1 антитела против HtrA1. Вкратце, исследовали антитела против HtrA1 (1 мг/мл) в стрессовых условиях химического окружения с ААРН (дигидрохлорид 2,2-азобис(2-амидопропан), малая молекула, которая как известно генерирует свободные радикалы (см., например, Ji et al., J. Pharm. Sci. 98(12):4485-4500, 2009), а также в условиях нагрева при различных рН (стресс-исследование с двухнедельной выдержкой при 40°С, рН 5,5) (см., например, Zhang et al., J. Chromatography A 1272:56-64, 2013).
В таблице 11 показано сравнение между h15H6.v2 и h15H6.v3 по результатам анализов МА. Примечательно, что LC-W91 в HVR-L3 обладал увеличенной способностью к окислению после стрессового воздействия ААРН как для h15H6.v2, так и h15H6.v3 (соответственно, около 84,5% и около 86,4%). В таблице 12 показаны результаты анализа МА для h15H6.v4. Неожиданно обнаружено, что окисление LC-W91 в HVR-L3 h15H6.v4 снижено по сравнению с h15H6.v2 и M5H6.v3, было увеличение окисления только на 26,5% после стрессового воздействия ААРН по сравнению с приблизительно 84,5-86,4% увеличением окисления h15H6.v2 и h15H6.v3. Данное улучшение было неожиданным, поскольку APEG.LC3.HC3 имеет только две замены по сравнению с h15H6.v3, т.е. НС-Т28K в участке FR-H1 и LC-N31E в HVR-L1, обе из которых введены для улучшения аффинности и ни одна из них предположительно не влияла на окисление LC-W91. Готовили используемое в данном анализе МА антитело h15H6.v4, применяя процедуру одноколоночной очистки. Когда повторяли анализ МА для h15H6.v4, применяя антитело, полученное с использованием процедуры двухколоночной очистки, показано, что LC-W91 нестабильно в условиях стресса под воздействием ААРН. Предполагается, что результаты по стрессовой оценке с ААРН, выполненные с веществом, очищенным с использованием двухколоночной очистки, отличались от результатов, полученных с использованием вещества, очищенного процедурой одноколоночной очистки, потому что очищенное одноколоночной процедурой вещество содержало примесь, которая препятствовала оценке стресса с ААРН.



В таблице 13 показаны результаты анализа МА для клона h19B12.v1 антитела против HtrA1. При определении HC-N52a HC-G53 в HVR-H2 оказались нестабильными с увеличением дезамидирования на 49%. Соответственно, замены в этих положениях HVR-H2 h19B12.v1 (например, HC-N52aE, HC-N52aS, HC-N52aS и HC-N52a HC-G53A) предположительно улучшают стабильность.


Пример 5. Структура Fab h15H6.v4, связанного с HtrA1
Рентгеновской кристаллографией и электронной микроскопией определяли структуру Fab h15H6.v4, связанного с HtrA1. Результаты продемонстрировали, что HtrA1-эпитоп Fab h15H6.v4 главным образом формируется аминокислотами, содержащими начало LA-петли HtrA1.
Синтез пептидов:
Создавали пептиды, соответствующие участкам белка HtrA1, используя способы, хорошо известные в данной области техники. См., например, Atherton, Е., et al. (1978). J. Chem Soc. Chem. Commun. 13:537-539.
Кристаллизация:
Инкубировали Fab h15H6.v4 (1 мл) при концентрации 10 мг/мл в 0,15 М NaCl, 20 мМ Трис рН 7,5 в течение ночи при 4°С с 1 мг пептида (3-кратный молярный избыток пептида/белка), содержащим аминокислоты в LA-петле HtrA1. Комплекс Fab-пептид кристаллизовали с использованием 2 М сульфата аммония, 0,2 М ацетата калия.
Уточнение с помощью рентгеноструктурного анализа:
Выращивали пептидные кристаллы Fab h15H6.v4/пептида HtrA1 и сохраняли для дифракционного анализа погружением в криопротекторный раствор, приготовленный добавлением 30% глицерина в маточный раствор, с последующим быстрым погружением в жидкий азот. Собирали данные в пучке излучения SSRL 12-2 и обрабатывали их, используя XDS (Kabasch W (2010) Acta Crystallogr D Biol Crystallogr. 266:125-32). Достигали молекулярного замещения комплекса Fab-пептида, используя в качестве искомого зонда в ССР4 структуру Fab (Winn MD et al. (2011) Acta CrystallogrD Biol Crystallogr. 67:235-42). После уточнения по модели абсолютно твердого тела могли наблюдать плотность Fo-Fc пептида. Затем подбирали по существу плотность в части остатков протеазного домена HtrA1 из петли A (RKLPFSKREVPV) (PDB 3TJO), как описано в Emsley et al. (2010) Acta Crystallogr D Biol Crystallogr. 66:125-32.
Применяли несколько раундов уточнения в Phenix (Adams PD et al. (2010) Acta Crystallogr D Biol Crystallogr. 66:213-21). В конечном раунде уточнения в Buster (Bricogne G et al. (2011) получены значения R для разрешения 2,1

Структура Fab15H6.v4, связанного с HtrA1, по данным электронной микроскопии (ЭМ)
Для визуализации ЭМ инкубировали 4 мкл комплекса HtrA1-hFab15H6.v4 в течение 30 с на свежепрокаленной с полным удалением углерода медной сетке с числом ячеек 400 меш (Electron Microscopy Sciences). После инкубации образец негативно окрашивали, используя раствор 2% (масс/об.) формиата уранила (SPI SuppIies). Избыток раствора красителя убирали ватманской бумагой и высушивали сетку на воздухе. Анализировали образец HtrA1-Fab15H6.v4 на Tecnai-12 BioTween (FEI), оборудованном катодом LaB6 и работавшем при 120 кэВ в условиях низкой дозы. Получали изображения, используя ПЗС-камеру 4 к × 4 к (Gatan Inc.) при номинальном увеличении × 62000 (2,22


Проверка структуры Fab Fab15H6.v4, связанного с HtrA1 с использованием замен аланином
Описанные выше структурные исследования продемонстрировали, что Fab Fab15H6.v4 плотно взаимодействует с петлей «А» белка HtrA1. Для подтверждения этого, синтезировали пептид, соответствующий остаткам 190-201 последовательности HtrA1 человека (в которой нумерация соответствует нумерации белка-предшественника), и исследовали его на связывание с Fab h15H6.v4, используя поверхностный плазмонный резонанс (ППР), как описано выше. Пептид (LA-pep1) показал сильное взаимодействие связывания с Fab 15H6.v4 со значением KD равным 0,4 нМ. См. таблицу 14.
Замены аланином в данной пептидной последовательности снижают (LA-рер2, LA-pep5) или полностью нарушают (LA-рер3, LA-pep4, LA-pep5) связывание с Fab 15H6.v4. Данные биофизические результаты согласуются со структурными исследованиями, описанными выше на Фиг. 32А и 32В, и демонстрируют, что связывающий эпитоп 15H6.V4 главным образом формируется аминокислотами, содержащими начало LA-петли HtrA1.
В противоположность этому, Fab YW505.94 не связывается ни с LA-рер1, ни с любой из мутантных форм (таблица 14).
Это является показателем того, что несмотря на факт конкуренции Fab YW505.94 и h15H6.v4 друг с другом за связывание с HtrA1, эпитопы этих двух Fab отличаются. Эпитоп Fab YW505.94 находится по центру возле петель В и С, тогда как эпитоп Fab 15H6.V4 в основном содержит верхнюю часть LA-петли.
Хотя не предполагается, что данное изобретение привязано к какому-либо конкретному механизму, возможно, что близкое взаимодействие между h15H6.v4 и LA-петлей HtrA1 отвечает за значительное улучшение аффинности и активности данного антитела по сравнению с YW505.94.

*ОС - при 1 мкМ выявлено отсутствие связывания, ** потеря аффинности = KD мутанта/KD дикого типа.
Хотя для ясности понимания некоторые детали предшествующего изобретения описаны посредством иллюстраций и примеров, не следует считать, что данные описания и примеры ограничивают объем данного изобретения. Описания всех патентов и научной литературы, процитированные в данном документе, явным образом полностью включены в данный документ путем ссылки.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Genentech, Inc.
F. Hoffmann-La Roche AG
KELLEY, Robert F.
KIRCHHOFER, Daniel K.
LAI, Joyce
LEE, Chingwei V.
LIANG, Wei-Ching
LIPARI, Michael T.
LOYET, Kelly M.
SAI, Tao
VAN LOOKEREN CAMPAGNE, Menno
WU, Yan
FUH, Germaine
<120> АНТИТЕЛА ПРОТИВ HtrA1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
<130> 50474-117WO4
<150> US 62/411113
<151> 2016-10-21
<150> US 62/345669
<151> 2016-06-03
<150> US 62/248871
<151> 2015-10-30
<160> 160
<170> PatentIn, версия 3.5
<210> 1
<211> 5
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Xaa представляет собой Met или Leu
<400> 1
Asp Ser Glu Xaa His
1 5
<210> 2
<211> 17
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> Xaa представляет собой Glu или Asp
<400> 2
Gly Val Asp Pro Glu Thr Xaa Gly Ala Ala Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 3
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 3
Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr
1 5 10
<210> 4
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> Xaa представляет собой Glu или Asn
<400> 4
Arg Ala Ser Ser Ser Val Xaa Phe Ile His
1 5 10
<210> 5
<211> 7
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Xaa представляет собой Asn, His или Glu
<400> 5
Ala Thr Ser Xaa Leu Ala Ser
1 5
<210> 6
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Xaa представляет собой Ser или Tyr
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> Xaa представляет собой Ala или Asn
<400> 6
Gln Gln Trp Xaa Ser Xaa Pro Trp Thr
1 5
<210> 7
<211> 5
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 7
Asp Ser Glu Met His
1 5
<210> 8
<211> 17
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 8
Gly Val Asp Pro Glu Thr Glu Gly Ala Ala Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 9
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 9
Arg Ala Ser Ser Ser Val Glu Phe Ile His
1 5 10
<210> 10
<211> 7
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 10
Ala Thr Ser Asn Leu Ala Ser
1 5
<210> 11
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 11
Gln Gln Trp Ser Ser Ala Pro Trp Thr
1 5
<210> 12
<211> 30
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> MISC_FEATURE
<222> (28)..(28)
<223> Xaa представляет собой Lys или Thr
<220>
<221> MISC_FEATURE
<222> (30)..(30)
<223> Xaa представляет собой Thr, Lys, или Arg
<400> 12
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Xaa Phe Xaa
20 25 30
<210> 13
<211> 14
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 13
Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile Gly
1 5 10
<210> 14
<211> 32
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 14
Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr Leu Glu
1 5 10 15
Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Thr Arg
20 25 30
<210> 15
<211> 11
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 15
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 16
<211> 30
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 16
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Lys Phe Thr
20 25 30
<210> 17
<211> 23
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 17
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys
20
<210> 18
<211> 15
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 18
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
1 5 10 15
<210> 19
<211> 32
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 19
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
20 25 30
<210> 20
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 20
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 21
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 21
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Lys Phe Thr Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Glu Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 22
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 22
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Glu Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Ala Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 23
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 23
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Thr Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Glu Met His Trp Val Lys Gln Thr Pro Val His Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Asp Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 24
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 24
Gln Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Asn Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Ser
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Pro Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 25
<211> 30
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 25
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Thr Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr
20 25 30
<210> 26
<211> 14
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 26
Trp Val Lys Gln Thr Pro Val His Gly Leu Glu Trp Ile Gly
1 5 10
<210> 27
<211> 32
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 27
Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr Met Glu
1 5 10 15
Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Thr Arg
20 25 30
<210> 28
<211> 11
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 28
Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
1 5 10
<210> 29
<211> 23
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 29
Asn Ile Val Val Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys
20
<210> 30
<211> 15
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 30
Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 31
<211> 32
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 31
Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Asp Pro Val Glu Ala Asp Asp Ala Ala Thr Tyr Tyr Cys
20 25 30
<210> 32
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 32
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
1 5 10
<210> 33
<400> 33
000
<210> 34
<400> 34
000
<210> 35
<400> 35
000
<210> 36
<400> 36
000
<210> 37
<400> 37
000
<210> 38
<400> 38
000
<210> 39
<211> 5
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 39
Ser Tyr Ile Met Ser
1 5
<210> 40
<211> 17
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 40
Tyr Ile Ser Asn Gly Gly Gly Thr Thr Tyr Tyr Ser Asp Thr Ile Lys
1 5 10 15
Gly
<210> 41
<211> 12
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 41
Gln Asn Phe Arg Ser Asp Gly Ser Ser Met Asp Tyr
1 5 10
<210> 42
<211> 15
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 42
Arg Ala Ser Glu Ser Val Asp Ser Tyr Gly Lys Ser Phe Met His
1 5 10 15
<210> 43
<211> 7
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 43
Leu Ala Ser Lys Leu Glu Ser
1 5
<210> 44
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 44
Gln Gln Asn Asn Glu Asp Pro Tyr Thr
1 5
<210> 45
<211> 121
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 45
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ile Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Asn Gly Gly Gly Thr Thr Tyr Tyr Ser Asp Thr Ile
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gln Asn Phe Arg Ser Asp Gly Ser Ser Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 46
<211> 111
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 46
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Glu Ser Val Asp Ser Tyr
20 25 30
Gly Lys Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Lys Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 47
<211> 30
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 47
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
20 25 30
<210> 48
<211> 14
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 48
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala
1 5 10
<210> 49
<211> 32
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 49
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
20 25 30
<210> 50
<211> 11
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 50
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 51
<211> 23
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 51
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys
20
<210> 52
<211> 15
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 52
Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 53
<211> 32
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 53
Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys
20 25 30
<210> 54
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 54
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 55
<211> 121
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 55
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Glu Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ala Cys Val Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ile Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Asn Gly Gly Gly Thr Thr Tyr Tyr Ser Asp Thr Ile
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Thr Leu Lys Ser Glu Asp Thr Ala Ile Tyr Phe Cys
85 90 95
Ala Arg Gln Asn Phe Arg Ser Asp Gly Ser Ser Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ala Val Thr Val Ser Ser
115 120
<210> 56
<211> 111
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 56
Asn Ile Val Val Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ser Tyr
20 25 30
Gly Lys Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Lys Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Ala Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 57
<211> 30
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 57
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Glu Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ala Cys Val Ala Ser Gly Phe Thr Phe Ser
20 25 30
<210> 58
<211> 14
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 58
Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val Ala
1 5 10
<210> 59
<211> 32
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 59
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
1 5 10 15
Met Ser Thr Leu Lys Ser Glu Asp Thr Ala Ile Tyr Phe Cys Ala Arg
20 25 30
<210> 60
<211> 11
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 60
Trp Gly Gln Gly Thr Ala Val Thr Val Ser Ser
1 5 10
<210> 61
<211> 23
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 61
Asn Ile Val Val Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys
20
<210> 62
<211> 15
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 62
Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 63
<211> 32
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 63
Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Asp Pro Val Glu Ala Asp Asp Ala Ala Thr Tyr Tyr Cys
20 25 30
<210> 64
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 64
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
1 5 10
<210> 65
<211> 121
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 65
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ile Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Asn Gly Gly Gly Thr Thr Tyr Tyr Pro Asp Thr Ile
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Thr Leu Lys Ser Glu Asp Thr Ala Ile Tyr Phe Cys
85 90 95
Ala Arg Gln Asn Phe Arg Ser Asp Gly Ser Ser Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 66
<211> 111
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 66
Asn Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Ser
20 25 30
Gly Arg Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Arg Leu Leu Ile Tyr Leu Ala Ser Lys Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Ala Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gly Gly Thr Asn Leu Glu Ile Lys
100 105 110
<210> 67
<211> 117
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 67
Asp Val His Leu Val Glu Ser Gly Gly Gly Leu Val Arg Pro Gly Gly
1 5 10 15
Ser Arg Lys Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Thr Ser Asp Ser Ser Thr Ile Tyr Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Pro Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Thr Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Thr Arg Ser Gly Asp Asp Tyr Leu Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 68
<211> 111
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 68
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Gln Ser Val Ser Thr Ser
20 25 30
Ser Ser Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Val Phe Ile Lys Tyr Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Ser Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Thr Ala Thr Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Ile Pro Phe Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 69
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 69
Glu Val Met Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Val Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Ala Ile Ser Gly Gly Gly Asp Tyr Thr Tyr Tyr Pro Asp Ser Leu
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Asp Tyr Asp Glu Tyr Ser Phe Glu Tyr Trp Gly Gln Gly
100 105 110
Thr Ala Leu Thr Val Ser Ser
115
<210> 70
<211> 111
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 70
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Ile Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Gln Gly Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Ser Leu Asn Ile His
65 70 75 80
Pro Met Glu Glu Asp Asp Thr Ala Met Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 71
<211> 107
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 71
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 72
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 72
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Asn Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Trp Ile Ser
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 73
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 73
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Asn Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 74
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 74
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Asn Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Ala Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 75
<211> 112
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 75
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Asn Pro Gly Ser Gly Asn Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 76
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 76
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Asp Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 77
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 77
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Asp Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 78
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 78
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Glu Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 79
<211> 113
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 79
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Thr Pro Phe Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 80
<211> 112
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 80
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Ala Ile Ser Ser Ser Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 81
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 81
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Arg Val Asn Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 82
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 82
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val His Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 83
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 83
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Glu Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 84
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 84
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Asn Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser His Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 85
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 85
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Asn Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser Glu Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 86
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 86
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Asn Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys His Gln Trp Ser Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 87
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 87
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Asn Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Tyr Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 88
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 88
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Asn Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Lys Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 89
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 89
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Asn Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ile Asn Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 90
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 90
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Asn Val Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Lys Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 91
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 91
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Glu Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Tyr Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 92
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 92
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Glu Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser His Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Tyr Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 93
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 93
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Lys Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Asp Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 94
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 94
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Arg Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Asp Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 95
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 95
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Lys Phe Thr Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Asp Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 96
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 96
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Arg Phe Thr Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Asp Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 97
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 97
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Glu Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Asp Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 98
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 98
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Ala Thr Asp Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 99
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 99
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Asp Gly Ala Phe Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 100
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 100
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Asp Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Ile Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 101
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 101
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Asp Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Pro Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 102
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 102
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Lys Phe Lys Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Asp Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 103
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 103
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Lys Phe Arg Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Asp Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 104
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 104
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Lys Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Glu Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 105
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 105
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Glu Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Tyr Ser Ala Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 106
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 106
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Lys Phe Lys Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Glu Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 107
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 107
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Lys Phe Arg Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Glu Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 108
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 108
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Glu Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser His Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Tyr Ser Ala Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 109
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 109
Gly Tyr Thr Phe Thr Asn Tyr Gly Met Asn
1 5 10
<210> 110
<211> 17
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> MISC_FEATURE
<222> (13)..(13)
<223> Xaa представляет собой Asp или Glu
<400> 110
Trp Ile Asn Thr Tyr Thr Gly Glu Thr Thr Tyr Ala Xaa Asp Phe Lys
1 5 10 15
Gly
<210> 111
<211> 6
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Xaa представляет собой Asn или Ser
<400> 111
Glu Gly Gly Val Xaa Asn
1 5
<210> 112
<211> 11
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Xaa представляет собой Asp или Ser
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> Xaa представляет собой Asp или Glu
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> Xaa представляет собой Asp или Ser
<400> 112
Ile Thr Ser Thr Xaa Ile Xaa Xaa Asp Met Asn
1 5 10
<210> 113
<211> 7
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 113
Gly Gly Asn Thr Leu Arg Pro
1 5
<210> 114
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Xaa представляет собой Asp или Glu
<400> 114
Leu Gln Ser Xaa Ser Leu Pro Tyr Thr
1 5
<210> 115
<211> 17
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 115
Trp Ile Asn Thr Tyr Thr Gly Glu Thr Thr Tyr Ala Asp Asp Phe Lys
1 5 10 15
Gly
<210> 116
<211> 6
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 116
Glu Gly Gly Val Asn Asn
1 5
<210> 117
<211> 11
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 117
Ile Thr Ser Thr Asp Ile Asp Asp Asp Met Asn
1 5 10
<210> 118
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 118
Leu Gln Ser Asp Ser Leu Pro Tyr Thr
1 5
<210> 119
<211> 115
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 119
Glu Val Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Thr Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Glu Arg Glu Gly Gly Val Asn Asn Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 120
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 120
Asp Ile Gln Val Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Lys Val Pro Lys Leu Leu Ile
35 40 45
Ser Gly Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Leu Gln Ser Asp Ser Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Thr Lys Val Glu Ile Lys
100 105
<210> 121
<211> 480
<212> ПРТ
<213> Homo sapiens
<400> 121
Met Gln Ile Pro Arg Ala Ala Leu Leu Pro Leu Leu Leu Leu Leu Leu
1 5 10 15
Ala Ala Pro Ala Ser Ala Gln Leu Ser Arg Ala Gly Arg Ser Ala Pro
20 25 30
Leu Ala Ala Gly Cys Pro Asp Arg Cys Glu Pro Ala Arg Cys Pro Pro
35 40 45
Gln Pro Glu His Cys Glu Gly Gly Arg Ala Arg Asp Ala Cys Gly Cys
50 55 60
Cys Glu Val Cys Gly Ala Pro Glu Gly Ala Ala Cys Gly Leu Gln Glu
65 70 75 80
Gly Pro Cys Gly Glu Gly Leu Gln Cys Val Val Pro Phe Gly Val Pro
85 90 95
Ala Ser Ala Thr Val Arg Arg Arg Ala Gln Ala Gly Leu Cys Val Cys
100 105 110
Ala Ser Ser Glu Pro Val Cys Gly Ser Asp Ala Asn Thr Tyr Ala Asn
115 120 125
Leu Cys Gln Leu Arg Ala Ala Ser Arg Arg Ser Glu Arg Leu His Arg
130 135 140
Pro Pro Val Ile Val Leu Gln Arg Gly Ala Cys Gly Gln Gly Gln Glu
145 150 155 160
Asp Pro Asn Ser Leu Arg His Lys Tyr Asn Phe Ile Ala Asp Val Val
165 170 175
Glu Lys Ile Ala Pro Ala Val Val His Ile Glu Leu Phe Arg Lys Leu
180 185 190
Pro Phe Ser Lys Arg Glu Val Pro Val Ala Ser Gly Ser Gly Phe Ile
195 200 205
Val Ser Glu Asp Gly Leu Ile Val Thr Asn Ala His Val Val Thr Asn
210 215 220
Lys His Arg Val Lys Val Glu Leu Lys Asn Gly Ala Thr Tyr Glu Ala
225 230 235 240
Lys Ile Lys Asp Val Asp Glu Lys Ala Asp Ile Ala Leu Ile Lys Ile
245 250 255
Asp His Gln Gly Lys Leu Pro Val Leu Leu Leu Gly Arg Ser Ser Glu
260 265 270
Leu Arg Pro Gly Glu Phe Val Val Ala Ile Gly Ser Pro Phe Ser Leu
275 280 285
Gln Asn Thr Val Thr Thr Gly Ile Val Ser Thr Thr Gln Arg Gly Gly
290 295 300
Lys Glu Leu Gly Leu Arg Asn Ser Asp Met Asp Tyr Ile Gln Thr Asp
305 310 315 320
Ala Ile Ile Asn Tyr Gly Asn Ser Gly Gly Pro Leu Val Asn Leu Asp
325 330 335
Gly Glu Val Ile Gly Ile Asn Thr Leu Lys Val Thr Ala Gly Ile Ser
340 345 350
Phe Ala Ile Pro Ser Asp Lys Ile Lys Lys Phe Leu Thr Glu Ser His
355 360 365
Asp Arg Gln Ala Lys Gly Lys Ala Ile Thr Lys Lys Lys Tyr Ile Gly
370 375 380
Ile Arg Met Met Ser Leu Thr Ser Ser Lys Ala Lys Glu Leu Lys Asp
385 390 395 400
Arg His Arg Asp Phe Pro Asp Val Ile Ser Gly Ala Tyr Ile Ile Glu
405 410 415
Val Ile Pro Asp Thr Pro Ala Glu Ala Gly Gly Leu Lys Glu Asn Asp
420 425 430
Val Ile Ile Ser Ile Asn Gly Gln Ser Val Val Ser Ala Asn Asp Val
435 440 445
Ser Asp Val Ile Lys Arg Glu Ser Thr Leu Asn Met Val Val Arg Arg
450 455 460
Gly Asn Glu Asp Ile Met Ile Thr Val Ile Pro Glu Glu Ile Asp Pro
465 470 475 480
<210> 122
<211> 4
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 122
Cys Pro Pro Cys
1
<210> 123
<211> 17
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 123
Gly Val Asp Pro Glu Thr Asp Gly Ala Ala Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 124
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 124
Arg Ala Ser Ser Ser Val Asn Phe Ile His
1 5 10
<210> 125
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 125
Gln Gln Trp Ser Ser Asn Pro Trp Thr
1 5
<210> 126
<211> 253
<212> ПРТ
<213> Homo sapiens
<400> 126
Met His Ser Trp Glu Arg Leu Ala Val Leu Val Leu Leu Gly Ala Ala
1 5 10 15
Ala Cys Ala Ala Pro Pro Arg Gly Arg Ile Leu Gly Gly Arg Glu Ala
20 25 30
Glu Ala His Ala Arg Pro Tyr Met Ala Ser Val Gln Leu Asn Gly Ala
35 40 45
His Leu Cys Gly Gly Val Leu Val Ala Glu Gln Trp Val Leu Ser Ala
50 55 60
Ala His Cys Leu Glu Asp Ala Ala Asp Gly Lys Val Gln Val Leu Leu
65 70 75 80
Gly Ala His Ser Leu Ser Gln Pro Glu Pro Ser Lys Arg Leu Tyr Asp
85 90 95
Val Leu Arg Ala Val Pro His Pro Asp Ser Gln Pro Asp Thr Ile Asp
100 105 110
His Asp Leu Leu Leu Leu Gln Leu Ser Glu Lys Ala Thr Leu Gly Pro
115 120 125
Ala Val Arg Pro Leu Pro Trp Gln Arg Val Asp Arg Asp Val Ala Pro
130 135 140
Gly Thr Leu Cys Asp Val Ala Gly Trp Gly Ile Val Asn His Ala Gly
145 150 155 160
Arg Arg Pro Asp Ser Leu Gln His Val Leu Leu Pro Val Leu Asp Arg
165 170 175
Ala Thr Cys Asn Arg Arg Thr His His Asp Gly Ala Ile Thr Glu Arg
180 185 190
Leu Met Cys Ala Glu Ser Asn Arg Arg Asp Ser Cys Lys Gly Asp Ser
195 200 205
Gly Gly Pro Leu Val Cys Gly Gly Val Leu Glu Gly Val Val Thr Ser
210 215 220
Gly Ser Arg Val Cys Gly Asn Arg Lys Lys Pro Gly Ile Tyr Thr Arg
225 230 235 240
Val Ala Ser Tyr Ala Ala Trp Ile Asp Ser Val Leu Ala
245 250
<210> 127
<211> 115
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 127
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met Tyr Trp Val Lys Glu Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn Pro Thr Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ala
115
<210> 128
<211> 107
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 128
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Asp Thr Asp
20 25 30
Val Ala Trp Phe Gln Gln Lys Pro Gly Gln Ser Pro Arg Gly Leu Ile
35 40 45
Tyr Ser Ala Ser Ser Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Ser Gly Thr Lys Val Glu Ile Lys
100 105
<210> 129
<211> 464
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 129
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Ala Tyr Ala Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Ser Tyr Tyr Met Tyr Trp Val Lys Glu Arg Pro Gly Gln Gly Leu
50 55 60
Glu Trp Ile Gly Glu Ile Asn Pro Thr Asn Gly Gly Thr Asn Phe Asn
65 70 75 80
Glu Lys Phe Lys Ser Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Asn
85 90 95
Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Glu Gly Gly Phe Ala Tyr Trp Gly Gln Gly Thr
115 120 125
Leu Val Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
130 135 140
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
145 150 155 160
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
165 170 175
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
180 185 190
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
195 200 205
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
210 215 220
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
225 230 235 240
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
245 250 255
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
260 265 270
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
275 280 285
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
290 295 300
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
305 310 315 320
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
325 330 335
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
340 345 350
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
355 360 365
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
370 375 380
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
385 390 395 400
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
405 410 415
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
420 425 430
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
435 440 445
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455 460
<210> 130
<211> 233
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 130
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr
20 25 30
Ser Val Gly Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val
35 40 45
Asp Thr Asp Val Ala Trp Phe Gln Gln Lys Pro Gly Gln Ser Pro Arg
50 55 60
Gly Leu Ile Tyr Ser Ala Ser Ser Arg Tyr Ser Gly Val Pro Asp Arg
65 70 75 80
Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn
85 90 95
Val Gln Ser Glu Asp Leu Ala Glu Tyr Phe Cys Gln Gln Tyr Asn Asn
100 105 110
Tyr Pro Leu Thr Phe Gly Ser Gly Thr Lys Val Glu Ile Lys Arg Thr
115 120 125
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
130 135 140
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
145 150 155 160
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
165 170 175
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
180 185 190
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
195 200 205
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
210 215 220
Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 131
<211> 115
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 131
Glu Val Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Thr Thr Tyr Ala Glu Asp Phe
50 55 60
Lys Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Glu Arg Glu Gly Gly Val Asn Asn Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 132
<211> 115
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 132
Glu Val Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Thr Thr Tyr Ala Glu Asp Phe
50 55 60
Lys Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Glu Arg Glu Gly Gly Val Ser Asn Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 133
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 133
Asp Ile Gln Val Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ile Thr Ser Thr Asp Ile Glu Ser Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Lys Val Pro Lys Leu Leu Ile
35 40 45
Ser Gly Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Leu Gln Ser Asp Ser Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Thr Lys Val Glu Ile Lys
100 105
<210> 134
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 134
Asp Ile Gln Val Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ile Thr Ser Thr Asp Ile Glu Ser Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Lys Val Pro Lys Leu Leu Ile
35 40 45
Ser Gly Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Leu Gln Ser Glu Ser Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Thr Lys Val Glu Ile Lys
100 105
<210> 135
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 135
Asp Ile Gln Val Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ile Thr Ser Thr Ser Ile Glu Ser Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Lys Val Pro Lys Leu Leu Ile
35 40 45
Ser Gly Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Leu Gln Ser Asp Ser Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Thr Lys Val Glu Ile Lys
100 105
<210> 136
<211> 115
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 136
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Thr Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Val Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Glu Ile Asn Asn Leu Lys Asn Glu Asp Met Ala Thr Tyr Phe Cys
85 90 95
Glu Arg Glu Gly Gly Val Asp Asn Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser
115
<210> 137
<211> 107
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 137
Glu Thr Thr Val Thr Gln Ser Pro Ala Ser Leu Ser Met Ala Ile Gly
1 5 10 15
Glu Lys Val Thr Ile Arg Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Pro Pro Lys Leu Leu Ile
35 40 45
Ser Gly Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Tyr Gly Ala Asp Phe Val Phe Thr Ile Asp Asn Met Leu Ser
65 70 75 80
Glu Asp Val Ala Asp Tyr Tyr Cys Leu Gln Ser Asp Asn Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 138
<400> 138
000
<210> 139
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 139
tttyttgtcc accktggtgc tgc 23
<210> 140
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 140
gtagaagttg ttcaagaag 19
<210> 141
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 141
cargtcamdg tcactgrctc ag 22
<210> 142
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 142
gaggcacctc cagatgttaa c 21
<210> 143
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 143
actgctcact ggatggtggg aag 23
<210> 144
<211> 47
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 144
gcaactgcaa ctggagtaca ttcacaaatt gttctctccc agtctcc 47
<210> 145
<211> 44
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 145
ggatacagtt ggtgcagcat cagcccgttt gatttccagc ttgg 44
<210> 146
<211> 47
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 146
gcaactgcaa ctggagcgta cgcccaggtc cagctgcagc agtctgg 47
<210> 147
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 147
gggcccttgg tggaggctga ggagacggtg actgaggttc cttgaccc 48
<210> 148
<211> 47
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 148
gcaactgcaa ctggagtaca ttcaaacatt gtggtgaccc aatctcc 47
<210> 149
<211> 44
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 149
ggatacagtt ggtgcagcat cagcccgctt tatttccagc ttgg 44
<210> 150
<211> 53
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 150
gcaactgcaa ctggagcgta cgccgaggtg aagctggtgg aatctggggg agg 53
<210> 151
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 151
gggcccttgg tggaggctga ggagacggtg actgcggttc cttgaccc 48
<210> 152
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> MISC_FEATURE
<223> N-конц. Mca
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Lys(DNP)
<400> 152
Ile Arg Arg Val Ser Tyr Ser Phe Lys Lys
1 5 10
<210> 153
<211> 234
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 153
Met Lys His Gln His Gln His Gln His Gln His Gln His Gln Met His
1 5 10 15
Gln Ser Thr Ala Ala Ala Gly Gln Gly Gln Glu Asp Pro Asn Ser Leu
20 25 30
Arg His Lys Tyr Asn Phe Ile Ala Asp Val Val Glu Lys Ile Ala Pro
35 40 45
Ala Val Val His Ile Glu Leu Tyr Arg Lys Leu Pro Phe Ser Lys Arg
50 55 60
Glu Val Pro Val Ala Ser Gly Ser Gly Phe Ile Val Ser Glu Asp Gly
65 70 75 80
Leu Ile Val Thr Asn Ala His Val Val Thr Asn Lys Asn Arg Val Lys
85 90 95
Val Glu Leu Lys Asn Gly Ala Thr Tyr Glu Ala Lys Ile Lys Asp Val
100 105 110
Asp Glu Lys Ala Asp Ile Ala Leu Ile Lys Ile Asp His Gln Gly Lys
115 120 125
Leu Pro Val Leu Leu Leu Gly Arg Ser Ser Glu Leu Arg Pro Gly Glu
130 135 140
Phe Val Val Ala Ile Gly Ser Pro Phe Ser Leu Gln Asn Thr Val Thr
145 150 155 160
Thr Gly Ile Val Ser Thr Thr Gln Arg Gly Gly Lys Glu Leu Gly Leu
165 170 175
Arg Asn Ser Asp Met Asp Tyr Ile Gln Thr Asp Ala Ile Ile Asn Tyr
180 185 190
Gly Asn Ser Gly Gly Pro Leu Val Asn Leu Asp Gly Glu Val Ile Gly
195 200 205
Ile Asn Thr Leu Lys Val Thr Ala Gly Ile Ser Phe Ala Ile Pro Ser
210 215 220
Asp Lys Ile Lys Lys Phe Leu Thr Glu Ser
225 230
<210> 154
<211> 228
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 154
Met Gly Ser Ser His His His His His His Ser Ser Gly Leu Val Pro
1 5 10 15
Arg Gly Ser His Met Asp Pro Asn Ser Leu Arg His Lys Tyr Asn Phe
20 25 30
Ile Ala Asp Val Val Glu Lys Ile Ala Pro Ala Val Val His Ile Glu
35 40 45
Leu Phe Arg Lys Leu Pro Phe Ser Lys Arg Glu Val Pro Val Ala Ser
50 55 60
Gly Ser Gly Phe Ile Val Ser Glu Asp Gly Leu Ile Val Thr Asn Ala
65 70 75 80
His Val Val Thr Asn Lys His Arg Val Lys Val Glu Leu Lys Asn Gly
85 90 95
Ala Thr Tyr Glu Ala Lys Ile Lys Asp Val Asp Glu Lys Ala Asp Ile
100 105 110
Ala Leu Ile Lys Ile Asp His Gln Gly Lys Leu Pro Val Leu Leu Leu
115 120 125
Gly Arg Ser Ser Glu Leu Arg Pro Gly Glu Phe Val Val Ala Ile Gly
130 135 140
Ser Pro Phe Ser Leu Gln Asn Thr Val Thr Thr Gly Ile Val Ser Thr
145 150 155 160
Thr Gln Arg Gly Gly Lys Glu Leu Gly Leu Arg Asn Ser Asp Met Asp
165 170 175
Tyr Ile Gln Thr Asp Ala Ile Ile Asn Tyr Gly Asn Ser Gly Gly Pro
180 185 190
Leu Val Asn Leu Asp Gly Glu Val Ile Gly Ile Asn Thr Leu Lys Val
195 200 205
Thr Ala Gly Ile Ser Phe Ala Ile Pro Ser Asp Lys Ile Lys Lys Phe
210 215 220
Leu Thr Glu Ser
225
<210> 155
<211> 480
<212> ПРТ
<213> Mus musculus
<400> 155
Met Gln Ser Leu Arg Thr Thr Leu Leu Ser Leu Leu Leu Leu Leu Leu
1 5 10 15
Ala Ala Pro Ser Leu Ala Leu Pro Ser Gly Thr Gly Arg Ser Ala Pro
20 25 30
Ala Ala Thr Val Cys Pro Glu His Cys Asp Pro Thr Arg Cys Ala Pro
35 40 45
Pro Pro Thr Asp Cys Glu Gly Gly Arg Val Arg Asp Ala Cys Gly Cys
50 55 60
Cys Glu Val Cys Gly Ala Leu Glu Gly Ala Ala Cys Gly Leu Gln Glu
65 70 75 80
Gly Pro Cys Gly Glu Gly Leu Gln Cys Val Val Pro Phe Gly Val Pro
85 90 95
Ala Ser Ala Thr Val Arg Arg Arg Ala Gln Ala Gly Leu Cys Val Cys
100 105 110
Ala Ser Ser Glu Pro Val Cys Gly Ser Asp Ala Lys Thr Tyr Thr Asn
115 120 125
Leu Cys Gln Leu Arg Ala Ala Ser Arg Arg Ser Glu Lys Leu Arg Gln
130 135 140
Pro Pro Val Ile Val Leu Gln Arg Gly Ala Cys Gly Gln Gly Gln Glu
145 150 155 160
Asp Pro Asn Ser Leu Arg His Lys Tyr Asn Phe Ile Ala Asp Val Val
165 170 175
Glu Lys Ile Ala Pro Ala Val Val His Ile Glu Leu Tyr Arg Lys Leu
180 185 190
Pro Phe Ser Lys Arg Glu Val Pro Val Ala Ser Gly Ser Gly Phe Ile
195 200 205
Val Ser Glu Asp Gly Leu Ile Val Thr Asn Ala His Val Val Thr Asn
210 215 220
Lys Asn Arg Val Lys Val Glu Leu Lys Asn Gly Ala Thr Tyr Glu Ala
225 230 235 240
Lys Ile Lys Asp Val Asp Glu Lys Ala Asp Ile Ala Leu Ile Lys Ile
245 250 255
Asp His Gln Gly Lys Leu Pro Val Leu Leu Leu Gly Arg Ser Ser Glu
260 265 270
Leu Arg Pro Gly Glu Phe Val Val Ala Ile Gly Ser Pro Phe Ser Leu
275 280 285
Gln Asn Thr Val Thr Thr Gly Ile Val Ser Thr Thr Gln Arg Gly Gly
290 295 300
Lys Glu Leu Gly Leu Arg Asn Ser Asp Met Asp Tyr Ile Gln Thr Asp
305 310 315 320
Ala Ile Ile Asn Tyr Gly Asn Ser Gly Gly Pro Leu Val Asn Leu Asp
325 330 335
Gly Glu Val Ile Gly Ile Asn Thr Leu Lys Val Thr Ala Gly Ile Ser
340 345 350
Phe Ala Ile Pro Ser Asp Lys Ile Lys Lys Phe Leu Thr Glu Ser His
355 360 365
Asp Arg Gln Ala Lys Gly Lys Ala Val Thr Lys Lys Lys Tyr Ile Gly
370 375 380
Ile Arg Met Met Ser Leu Thr Ser Ser Lys Ala Lys Glu Leu Lys Asp
385 390 395 400
Arg His Arg Asp Phe Pro Asp Val Leu Ser Gly Ala Tyr Ile Ile Glu
405 410 415
Val Ile Pro Asp Thr Pro Ala Glu Ala Gly Gly Leu Lys Glu Asn Asp
420 425 430
Val Ile Ile Ser Ile Asn Gly Gln Ser Val Val Thr Ala Asn Asp Val
435 440 445
Ser Asp Val Ile Lys Lys Glu Asn Thr Leu Asn Met Val Val Arg Arg
450 455 460
Gly Asn Glu Asp Ile Val Ile Thr Val Ile Pro Glu Glu Ile Asp Pro
465 470 475 480
<210> 156
<211> 104
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 156
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp
100
<210> 157
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 157
Glu Pro Lys Ser Cys Asp Lys Thr His Thr
1 5 10
<210> 158
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 158
Pro Ala Pro Glu Leu Leu Gly Gly Pro
1 5
<210> 159
<211> 213
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 159
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Glu Phe Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Ser
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Ala Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 160
<211> 223
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 160
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Lys Phe Thr Asp Ser
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asp Pro Glu Thr Glu Gly Ala Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Asp Tyr Asp Tyr Ala Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
<---
Реферат
Изобретение относится к области биохимии, в частности к антителу или его антигенсвязывающему фрагменту, которое специфически связывает HtrA1. Раскрыты нуклеиновая кислота, кодирующая указанное антитело, фармацевтическая композиция, содержащая указанное антитело. Также раскрыты способ получения указанного антитела, комбинированная терапия с применением указанного антитела, применение указанного антитела в производстве лекарственного средства. Изобретение позволяет эффективно лечить заболевания, ассоциированные с HtrA1. 9 н. и 34 з.п. ф-лы, 32 ил., 14 табл., 5 пр.
Формула
Документы, цитированные в отчёте о поиске
Применение веществ для лечения потери зрения у людей с глаукомой и другими дегенеративными глазными заболеваниями

Комментарии