Дибензоазепиновые соединения и их применение для лечения ушных заболеваний и нарушений - RU2707284C1
Код документа: RU2707284C1
Чертежи
Описание
УРОВЕНЬ ТЕХНИКИ
Область техники, к которой относится изобретение
[0001] Настоящее раскрытие касается применения определенных замещенных дибензоазепиновых производных и их фармацевтических композиций для лечения заболеваний и нарушений внутреннего уха. Настоящее раскрытие также касается фармацевтических композиций и способов лечения ушных заболеваний и нарушений.
Описание
[0002] От потери слуха страдают более десяти процентов населения Соединенных Штатов. За большинство таких нарушений слуха отвечает поражение периферийной слуховой системы. В частности, основными причинами нарушений слуха считаются разрушение волосковых клеток и разрушение первичных афферентных нейронов в спиральных ганглиях, которые трансдуцируют слуховые сигналы от волосковых клеток в головной мозг.
[0003] Агенты, вызывающие нарушение слуха, включают громкий шум, старение, инфекции и ототоксичные химические вещества. Среди последних находятся некоторые терапевтические лекарства, примеси в пищевых продуктах и медицинских препаратах и окружающие и промышленные загрязнения. Терапевтические агенты, которые, как обнаружено, оказывают вредное воздействие на слух, включают аминогликозидные антибиотики (такие как стрептомицин, неомицин, гентамицин, канамицин, тобрамицин и амикацин), платиносодержащие противоопухолевые агенты, такие как цисплатин и карбоплатин, некоторые макролидные антибиотики, такие как эритромицин, гликопептидные антибиотики, такие как ванкомицин, гуинин и его аналоги, салицилат и его аналоги и петлевые диуретики, такие как фуросемид и этакриновая кислота. Ототоксины, такие как цисплатин и аминогликозидные антибиотики, аккумулируются в кохлеарных волосковых клетках, и клеточное поражение этих клеток в результате накопления считается основной причиной химически вызванной потери слуха. Вестибулярный аппарат и слуховая система участвуют во многих характеристиках, включая периферийные нейронные иннервации волосковых клеток и центральных отростков ядер стволовой части головного мозга. Вестибулярные функции также чувствительны к ототоксинам, которые описаны выше.
[0004] Токсические эффекты этих лекарств на слуховые клетки и нейроны спиральных ганглиев часто являются ограничительным фактором их терапевтической пригодности. Например, аминогликозидные антибиотики представляют широкий спектр антимикробных препаратов эффективных против грамположительных, грамотрицательных и кислотостойких бактерий. Их применяют главным образом для лечения инфекций, вызванных грамотрицательными бактериями, часто в комбинации с бета-лактамами, что обеспечивает синергические эффекты. Преимущества использования аминогликозидных антибиотиков включают низкий процент случаев Clostridium difficile-ассоциированной диареи относительно других антибиотиков и низкий риск аллергических реакций. Однако известно, что аминогликозиды демонстрируют тяжелую ототоксичность, особенно при высоких дозах. Например, 25% пациентов, принимавших один грамм стрептомицина ежедневно в течение от 60 до 120 дней, демонстрировали некоторое вестибулярное нарушение, а при двух граммах в день, частота случаев возрастала до 75%, и некоторые пациенты страдали от постоянного нарушения (смотри патент США №5059591).
[0005] Салицилаты, такие как аспирин, уже давно применяются, благодаря их противовоспалительным, анальгезирующим, жаропонижающим и антитромботическим эффектам. К сожалению, салицилаты оказывают ототоксичное побочное действие, часто приводя к шуму в ушах («звон в ушах») и временной потере слуха, и при приеме больших доз в течение длительного времени нарушение слуха может стать постоянным и необратимым (J. A. Brien, 1993, Drug Safety 9:143-148).
[0006] Известно, что петлевые диуретики (такие как этакриновая кислота, фуросемид и буметанид) вызывают ототоксичность. Также экспериментально показано, что некоторые реже используемые петлевые диуретики вызывают ототоксичность; эта группа включает торсемид, азосемид, озолинон, индакринон и пиретанид. Потеря слуха, связанная с петлевыми диуретиками, часто, но не всегда, является обратимой.
[0007] Ототоксичность представляет собой серьезный дозоограничительный побочный эффект для цисплатина, широко используемого противоопухолевого агента, который, как доказано, эффективен при различных раковых заболеваниях человека, включая тестикулярный, овариальный рак, рак мочевого пузыря и рак головы и шеи. Токсические побочные эффекты цисплатина (периферийные нейропатии, миелосупрессия, желудочно-кишечная токсичность, нефротоксичность и ототоксичность) хорошо известны. Стандартное введение маннита, гипертонического физиологического раствора и интенсивное введение жидкости в значительной степени уменьшало вызванную цисплатином нефротоксичность, оставляя на сегодня в качестве основного дозоограничительного фактора ототоксичность. Таким образом, хотя выживает все большее количество раковых пациентов, применяющих современные схемы химиотерапии, они часто страдают от нарушения слуха, вызванного цисплатином.
[0008] Цисплатин поражает обе системы, слуховую и вестибулярную. Первичные ототоксичные эффекты цисплатина, по-видимому, возникают в улитке. Анатомические изменения происходят и в сосудистой полоске, и в кортиевом органе. Первичные гистологические обнаружения включают зависящую от дозы дегенерацию волосковых клеток и поражение поддерживающих клеток, и при высоких дозах может произойти полный коллапс мембранного лабиринта. В кортиевом органе происходит утрата внешних и внутренних волосковых клеток при склонности к утрате внешних волосковых клеток в базальном завитке и изменения в поддерживающих клетках и Рейснеровой перепонке. Сообщается также о размягчении кутикулярной пластинки и увеличении количества лизосомальных телец в апикальной части внешних волосковых клеток.
[0009] Индуцированная шумом потеря слуха (NIHL) описывает хронический процесс нарушения слуха, который протекает постепенно на протяжении многих лет воздействия менее интенсивных уровней шума, при котором поражается внутреннее ухо, в частности, улитка. Этот тип потери слуха обычно вызван хроническим воздействием постоянного шума высокой интенсивности с наложением эпизодического ударного или импульсного шума. Оба звука, интенсивный звук, воздействующий на ухо в течение короткого периода времени, и менее интенсивный звук, который присутствует в течение более длительного периода времени, будут производить одинаковое поражение внутреннего уха. Большинство случаев хронической NIHL обусловлены воздействием профессиональных или промышленных шумов. Однако непрофессиональная форма NIHL, называемая социальной, может возникать в результате стрельбы, громкой музыки (концерты или наушники), использования открытых транспортных средств, таких как мотоциклы, снегоходы или трактора, и электроинструмента, если назвать только несколько причин. Хотя поражение слуха часто является симметричным, т.е. поражаются оба уха, имеются случаи потери слуха вследствие частой стрельбы по мишени, результатом чего является асимметричная потеря слуха.
[0010] При воздействии импульсного шума, такого как взрывная волна, пациент может страдать от значительного поражения барабанной перепонки и среднего уха. При хроническом воздействии, которое обычно происходит с меньшими уровнями интенсивности, поражение среднего уха и барабанной перепонки маловероятны. При воздействии шума первичное и начальное поражение обычно является кохлеарным при вторичной нейронной дегенерации слуховой системы, происходящей со временем. Индуцированная шумом потеря слуха рассматривается в работе K. Campbell «Essential Audiology for Physicians» (1998), San Diego: Singular Publishing Group, Inc.
[0011] Возрастная потеря слуха или пресбиакузис представляет собой общее нейродегенеративное нарушение у пожилых людей. Около одной трети людей в США от 65 до 74 лет теряют слух, и около половины людей старше 75 лет имеют трудности со слухом (данные National Institution on Deafness and other Communication Disorders). Процесс старения взаимодействует со многими другими факторами, такими как шумовое воздействие и разнообразные ототоксичные поражения, которые опасны для рецепторных волосковых клеток (HC) и нейронов спиральных ганглиев (SGN) в улитке. Во многих случаях трудно различить эффекты старения как таковые и эффекты других вредных факторов на гибель клеток в улитке. Перманентная потеря слуха в результате утраты HC и SGN необратима, так как клетки окончательно отработаны и не могут быть заменены посредством митоза.
[0012] Отит среднего уха представляет собой воспаление среднего уха, наиболее часто связанное с вирусной или бактериальной инфекцией. Болезнь затрагивает относительно высокий процент населения, особенно детей. У детей заболевание наиболее часто связано с болезнями верхних дыхательных путей, которые вызывают реакцию транссудативной секреции в евстахиевой трубе и среднем ухе. Бактерии и вирусы мигрируют из носоглотки в обычно заполненное воздухом среднее ухо через евстахиеву трубу, и могут блокировать евстахиеву трубу, препятствуя вентиляции и дренированию среднего уха. Затем жидкость аккумулируется за барабанной перепонкой, вызывая боль и воспаление.
[0013] Отит среднего уха является наиболее общей причиной потери слуха у детей. Хотя отит среднего уха легко лечится антибиотиками и обычно не является тяжелым, частый и/или нелеченый отит среднего уха может перманентно нарушать слух детей. Жидкость, оставшаяся в среднем ухе, может вызывать повторные приступы острого отита среднего уха, и если состояние становится хроническим, это может привести к частым рецидивам острых инфекций. При более тяжелых формах отита среднего уха, гнойный экссудат, токсины и эндогенные антимикробные ферменты аккумулируются в среднем ухе, что может вызвать непоправимое поражение сенсорно-нейронных и звукопроводящих структур. Поражение барабанной перепонки, костей уха или слуховых нервов, вызванное такими инфекциями, потенциально может приводить к постоянной потере слуха. Потеря слуха также может быть результатом нарушения, поражения или разрушения кохлеарных волосковых клеток внутреннего уха, поскольку поражающие вещества в области среднего уха получают доступ к внутреннему уху посредством диффузии через мембрану окна улитки.
[0014] В работе Izumikawa, M. и др. «Auditory Hair Cell Replacement and Hearing Improvement by Atoh1 Gene Therapy in Deaf Mammals», Nat. Med. 11(3), 271-276 (2005), раскрыто, что введение гена Atoh1 с помощью аденовектора в улитку улучшает слуховой порог у морских свинок. Понятно, что ингибиторы сигнального пути Notch и в частности селективные ингибиторы гамма-секретазы стимулируют дифференциацию волосковых клеток через их положительный эффект на экспрессию Atoh1 (Zheng и др., «Hes1 is a Negative Regulator of Inner Ear Hair Cell Differentiation», Development, 2000, 127(21):4551-60; Zine и др. «Hes1 and Hes5 Activities Are Required for the Normal Development of the Hair Cells in the Mammalian Inner Ear», J Neurosci., 2001, 21(13):4712-20; Yamamoto и др. «Inhibition of Notch/RBP-J Signaling Induces Hair Cell Formation in Neonate Mouse Cochleas», J Mol Med, 2006, 84(1):37-45).
[0015] В работе Mizutari, K. и др. «Notch Inhibition Induces Cochlear Hair Cell Regeneration and Recovery of Hearing after Acoustic Trauma», Neuron 77, 58-69 (2013), описано исследование LY411575 на молодых мышах с потерей слуха, индуцированной шумом.
[0016] Заявители идентифицировали выбранные замещенные дибензоазепиновые производные, которые особенно подходят для задачи лечения (в том числе предупреждения, снижения частоты инцидентов и/или тяжести, замедления или прекращения прогрессирования и обратного движения) заболеваний и нарушений внутреннего уха.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0017] Настоящее раскрытие касается кристаллических форм соединения, выбранного из соединения I, имеющего формулу:
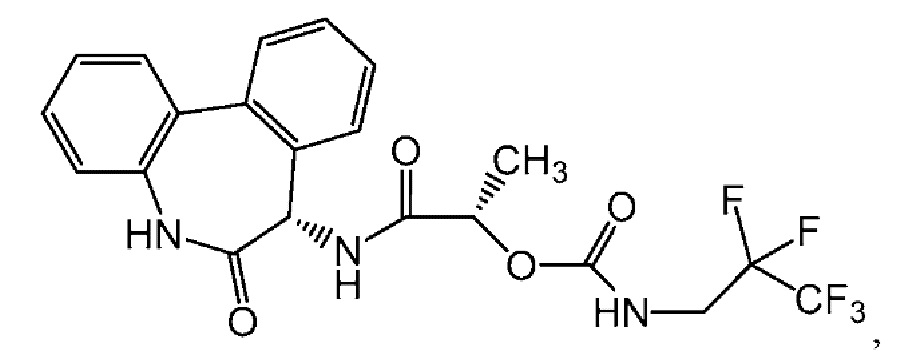
Соединение I
и соединения II, имеющего формулу:
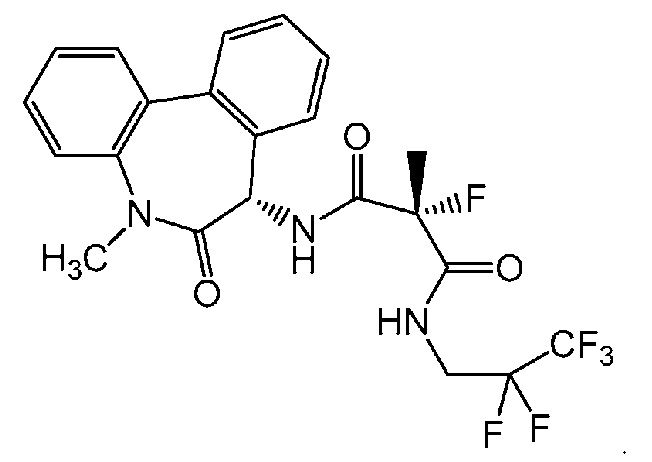
Соединение II
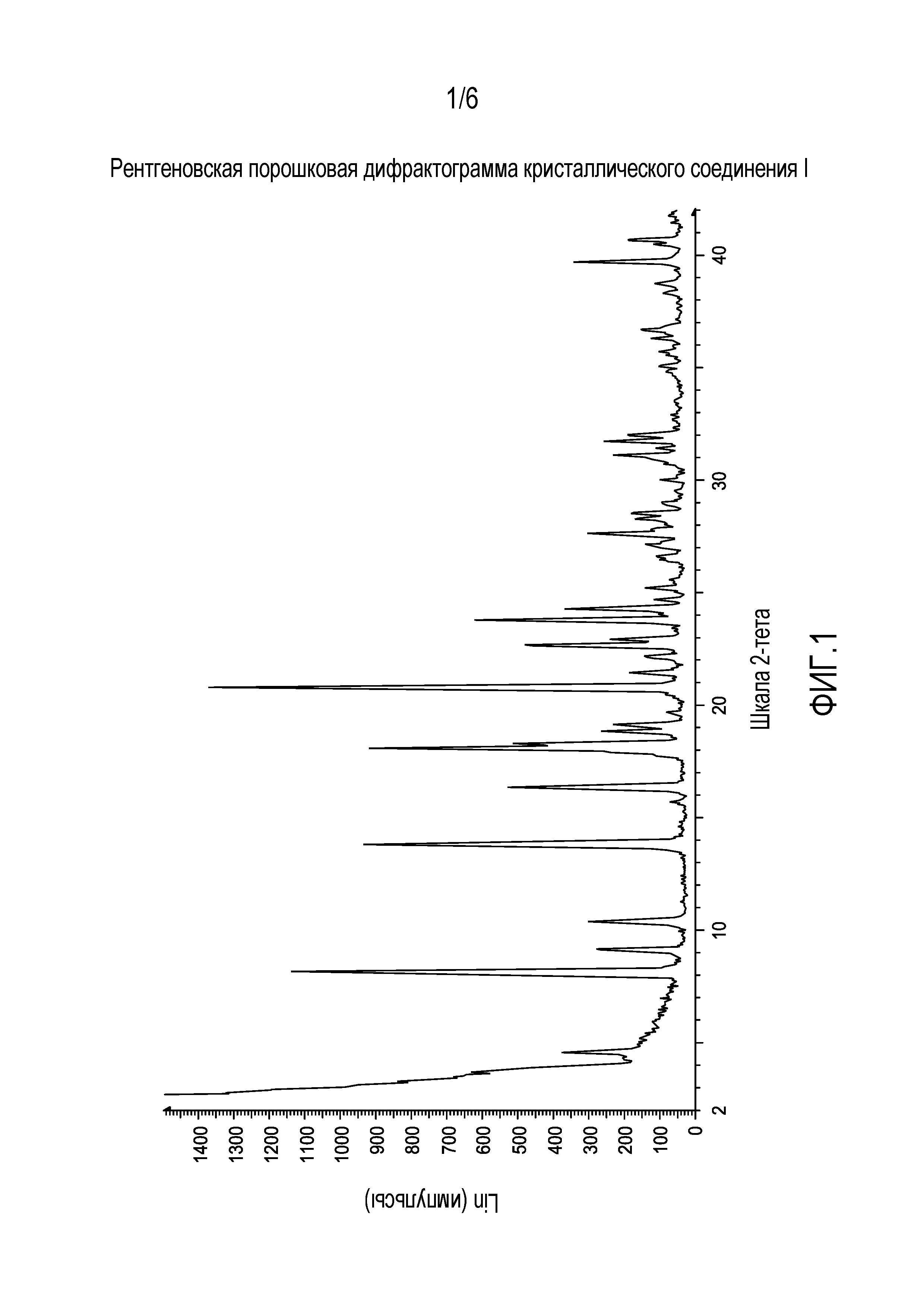
[0018] В некоторых вариантах осуществления настоящее кристаллическое соединение I характеризуется рентгеновской порошковой дифрактограммой с пиками при 8,2, 13,8, 14,0, 18,4, и 20,9±0,15 градуса два-тета.
[0019] В некоторых вариантах осуществления настоящее кристаллическое соединение I характеризуется рентгеновской порошковой дифрактограммой с пиками при 4,6, 8,2, 9,2, 13,8, 14,0, 18,2, 18,4, 20,9, 23,8, и 27,7±0,15 градуса два-тета.
[0020] В некоторых вариантах осуществления настоящее кристаллическое соединение I характеризуется рентгеновской порошковой дифрактограммой с пиками при 3,0, 4,6, 8,2, 9,2, 10,4, 13,8, 14,0, 16,4, 18,2, 18,4, 18,8, 19,1, 20,9, 21,5, 22,2, 22,7, 23,0, 23,8, 24,3, 24,7, 25,2, 26,5, 26,6, 27,1, 27,7, 28,1, 28,3, 28,6, 29,0, 30,0, 31,2, 31,5, 31,8, 32,1, 32,4, 35,1, 35,6, 35,8, 36,4, 36,7, 38,4, 38,8, 39,8, 40,5 и 40,8±0,15 градуса два-тета.
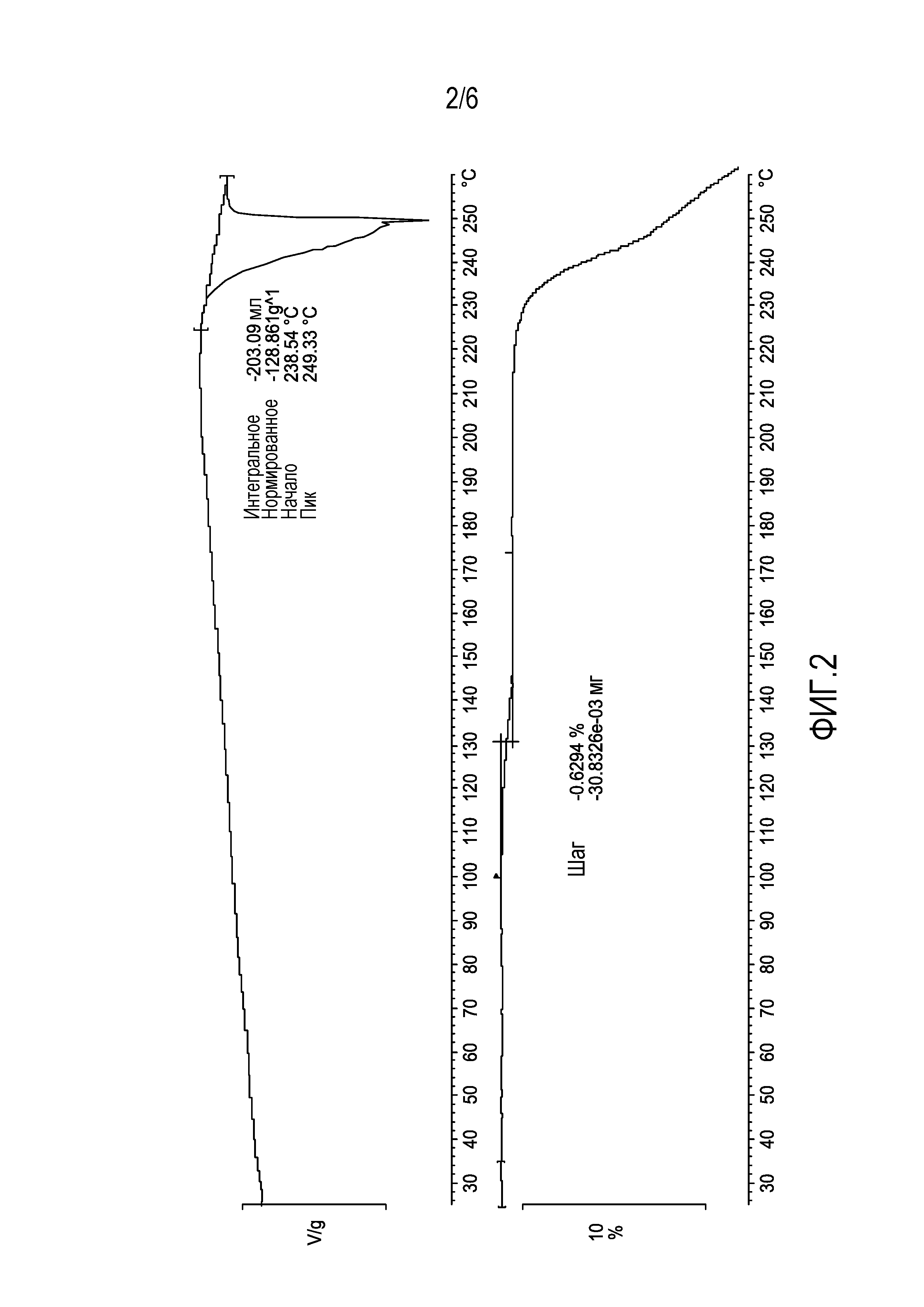
[0021] В некоторых вариантах осуществления настоящее кристаллическое соединение I дополнительно характеризуют как имеющее начало эндотермы на термограмме дифференциальной сканирующей калориметрии около 238,5°C.
В некоторых вариантах осуществления настоящее кристаллическое соединение I дополнительно характеризуют как имеющее эндотермический пик дифференциальной сканирующей калориметрии примерно при 249,3°C.
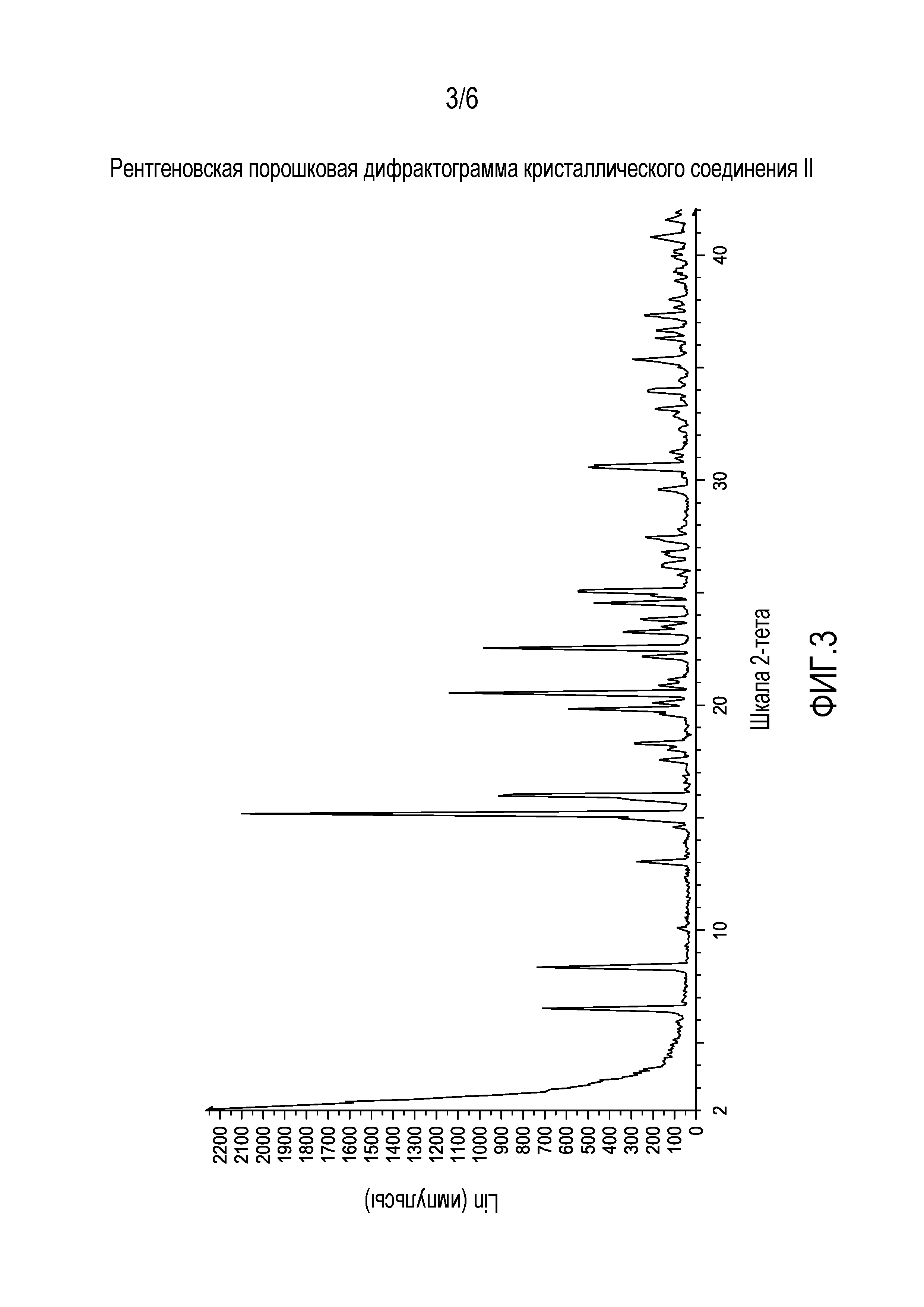
[0022] В некоторых вариантах осуществления настоящее кристаллическое соединение II характеризуется рентгеновской порошковой дифрактограммой с пиками при 8,4, 15,2, 16,0, 20,6 и 22,6±0,15 градуса два-тета.
[0023] В некоторых вариантах осуществления настоящее кристаллическое соединение II характеризуется рентгеновской порошковой дифрактограммой с пиками при 6,5, 8,4, 15,2, 16,0, 19,9, 20,6, 22,6, 24,5, 25,1 и 30,6±0,15 градуса два-тета.
[0024] В некоторых вариантах осуществления настоящее кристаллическое соединение II характеризуется рентгеновской порошковой дифрактограммой с пиками при 6,5, 8,4, 10,1, 13,1, 14,6, 15,0, 15,2, 16,0, 17,6, 18,0, 18,4, 19,6, 19,9, 20,1, 20,6, 20,9, 21,2, 22,2, 22,6, 23,3, 23,5, 23,8, 24,5, 24,9, 25,1, 25,8, 26,1, 26,7, 26,8, 27,5, 27,8, 29,6, 30,6, 31,2, 32,3, 32,9, 33,2, 33,9, 34,4, 35,4, 36,3, 36,7, 37,3, 37,7, 38,0, 38,9, 40,0, 40,2, 40,8 и 41,6±0,15 градуса два-тета.
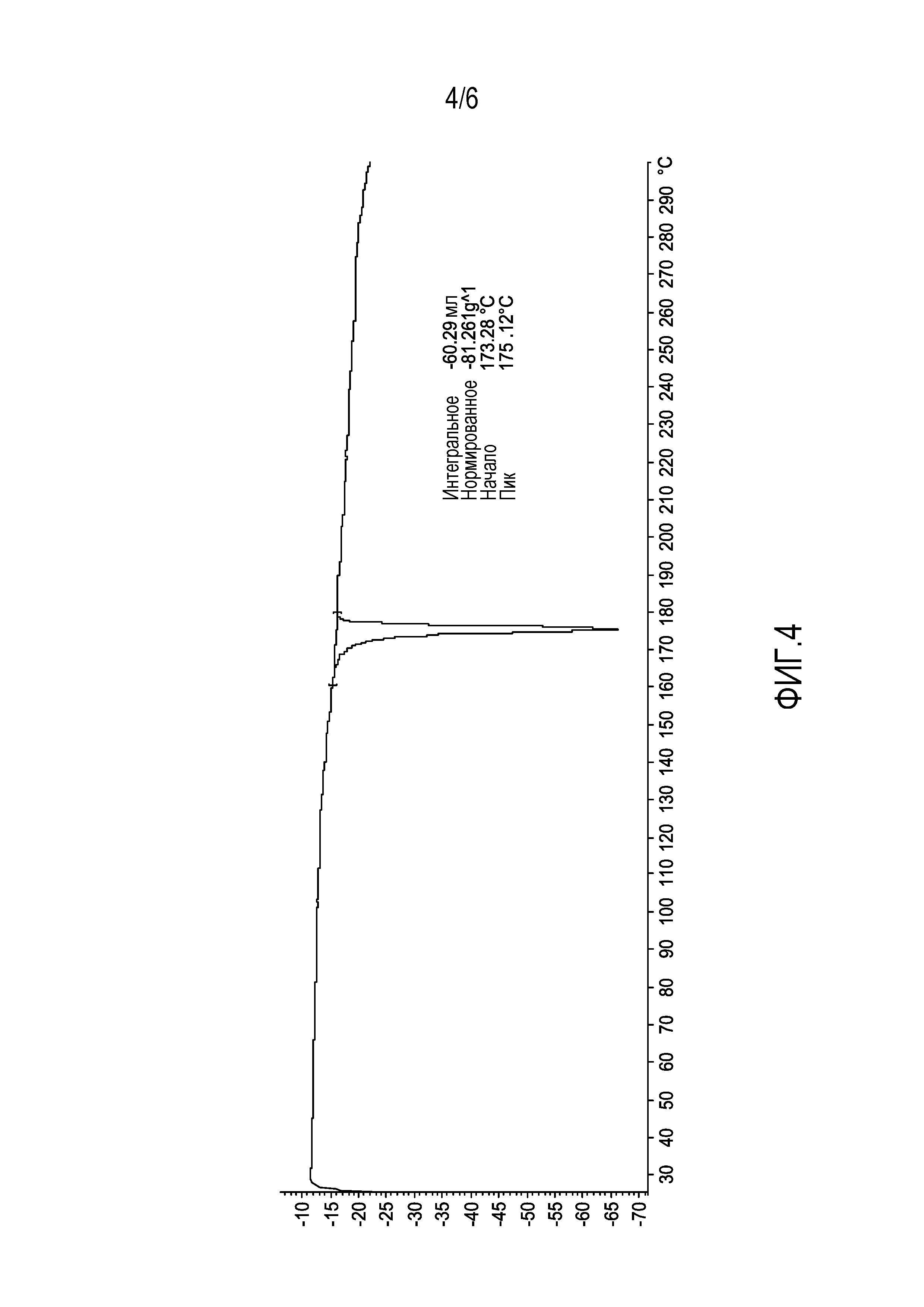
[0025] В некоторых вариантах осуществления кристаллическую форму соединения II дополнительно характеризуют как имеющую начало эндотермы на термограмме дифференциальной сканирующей калориметрии около 173°C.
[0026] В некоторых вариантах осуществления кристаллическую форму соединения II дополнительно характеризуют как имеющую эндотермический пик на термограмме дифференциальной сканирующей калориметрии примерно при 175°C.
[0027] В некоторых вариантах осуществления настоящее раскрытие касается водной фармацевтической композиции для интратимпанального введения, содержащей:
(1) активный агент, выбранный из кристаллического соединения I и кристаллического соединения II по приведенным выше вариантам осуществления, и
(2) фармацевтически приемлемый водный раствор, содержащий:
(A) примерно от 15% до 25% масс./масс. полоксамера 407; или
(B) (i) примерно от 15% до 25% масс./масс. полоксамера 407 и
(ii) примерно от 0,5% до 4% масс./масс. гидроксипропилметилцеллюлозы, имеющей номинальную вязкость 40-60 сП, или сорта 80-120 cP; или
(C) (i) примерно 10%-20% масс./масс. полоксамера 407 и
(ii) примерно 0,1%-0,3% масс./масс. Carbopol® 974P; или
(D) (i) примерно от 0,5% до 8% масс./масс. гиалуроновой кислоты; или
(E) (i) примерно от 0,5% до 4% масс./масс. гиалуроновой кислоты и
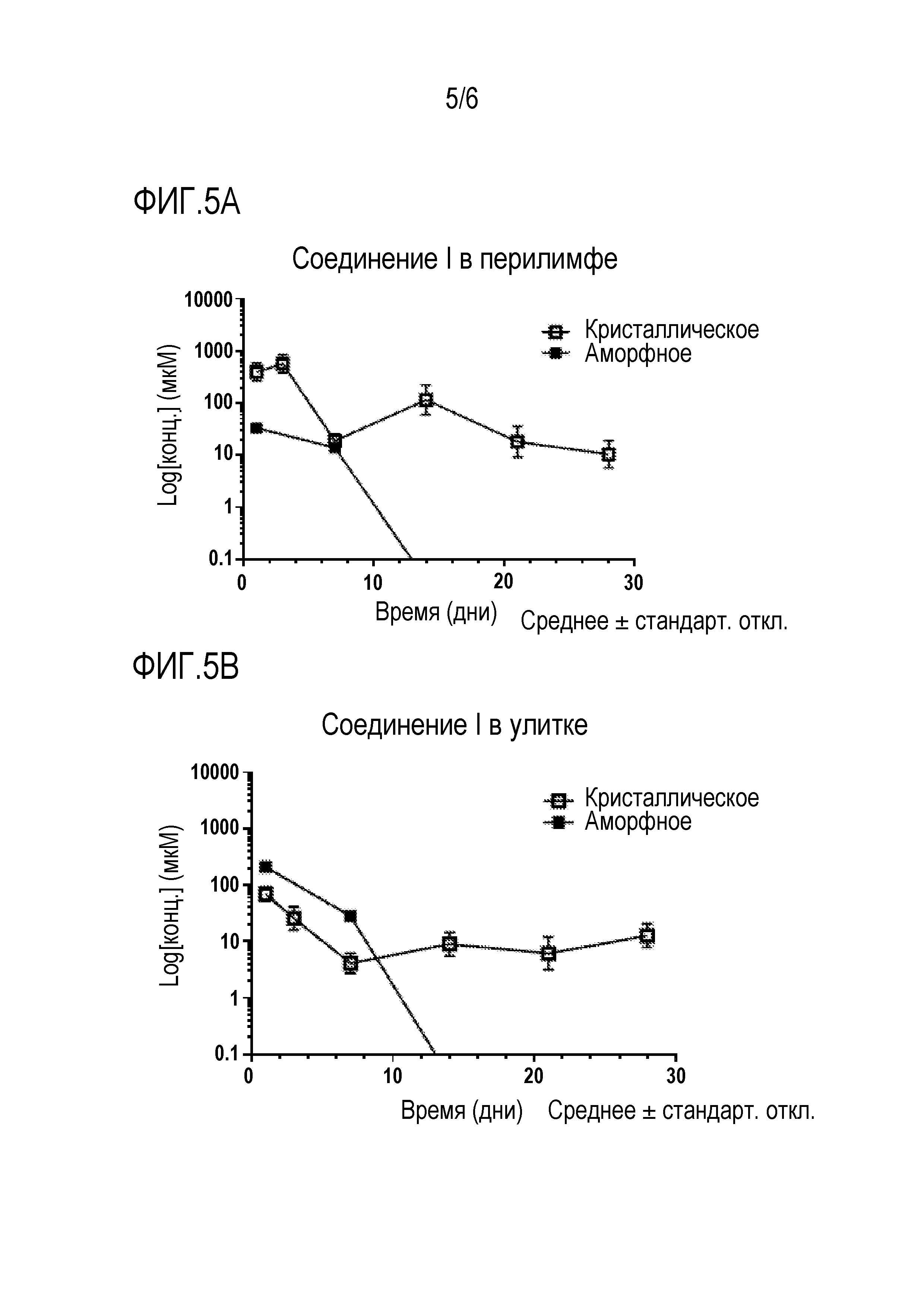
(ii) примерно от 5% до 20% об. полиэтиленгликоля 400;
где указанный активный агент присутствует в количестве примерно от 0,01% до примерно 20% масс./об. указанного водного раствора.
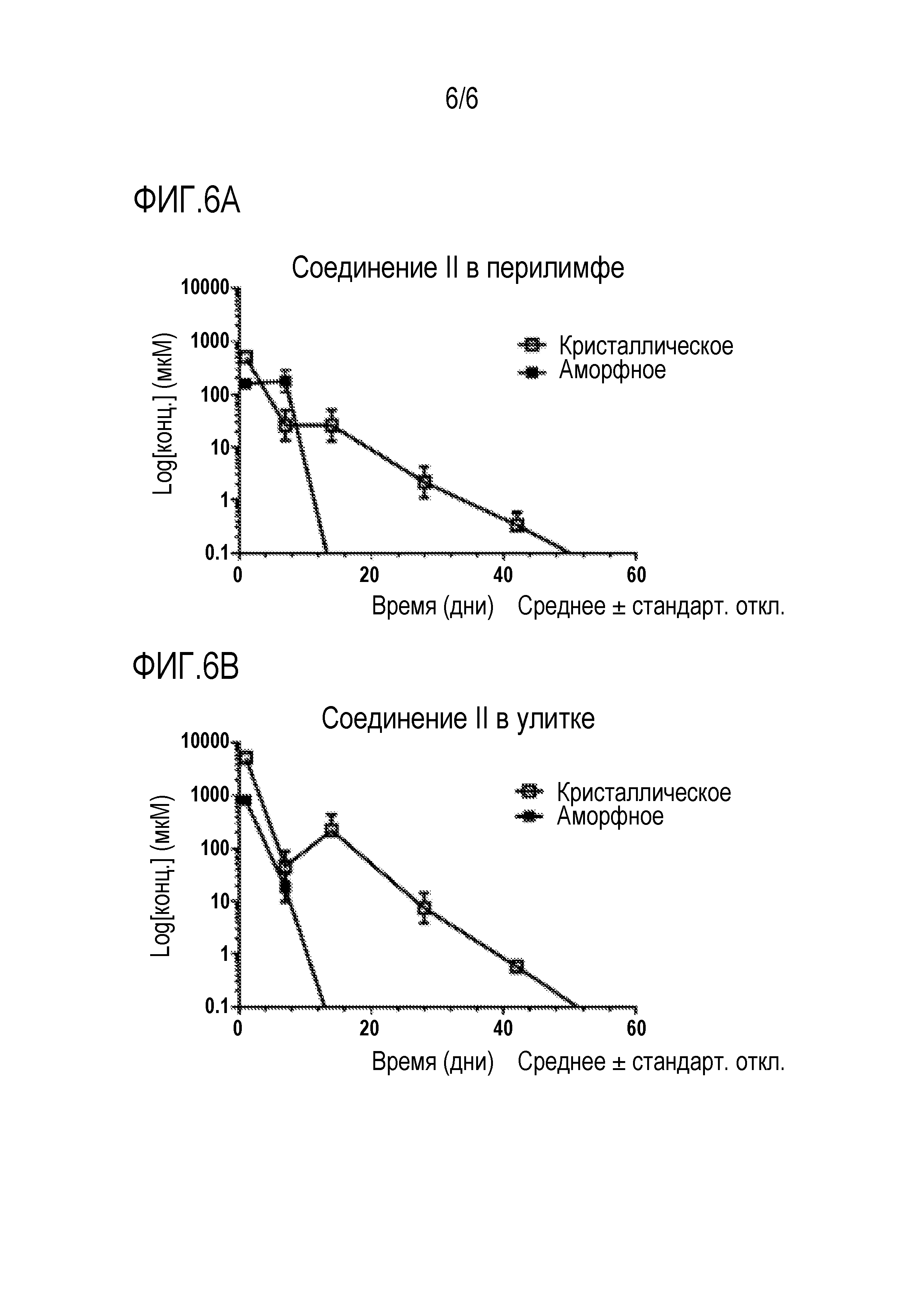
[0028] В некоторых вариантах осуществления водной фармацевтической композиции водный раствор содержит:
(A) примерно от 15% до 25% масс./масс. полоксамера 407; или
(B) (i) примерно от 15% до 25% масс./масс. полоксамера 407 и
(ii) примерно от 0,5% до 4% масс./масс. гидроксипропилметилцеллюлозы, имеющей номинальную вязкость 40-60 сП, или сорта 80-120 cP; или
(C) (i) примерно 10%-20% масс./масс. полоксамера 407 и
(ii) примерно 0,1%-0,3% масс./масс. Carbopol® 974P.
[0029] В некоторых вариантах осуществления водной фармацевтической композиции указанный водный раствор содержит примерно от 15% до 25% масс./масс. полоксамера 407.
[0030] В некоторых вариантах осуществления водной фармацевтической композиции pH указанного водного раствора составляет примерно от 7,0 до 8,0.
[0031] В некоторых вариантах осуществления водной фармацевтической композиции указанный водный раствор дополнительно содержит буферный агент.
[0032] В некоторых вариантах осуществления водной фармацевтической композиции указанный водный раствор дополнительно содержит буферный агент, выбранный из (i) одноосновного фосфата натрия, двухосновного фосфата натрия или их комбинации; и (ii) трис(гидроксиметил)аминометана.
[0033] В некоторых вариантах осуществления водной фармацевтической композиции указанный активный агент присутствует в количестве примерно от 0,1% до 5% масс./об.
[0034] В некоторых вариантах осуществления водной фармацевтической композиции указанный водный раствор содержит примерно от 15% до 18% масс./масс. полоксамера 407.
[0035] В некоторых вариантах осуществления водная фармацевтическая композиция содержит: (1) описанное выше кристаллическое соединение I и (2) фармацевтически приемлемый водный раствор, содержащий примерно от 15% до 25% масс./масс. полоксамера 407, где pH равен примерно от 7,0 до 8,0; и где указанное кристаллическое соединение I присутствует в количестве примерно от 0,01% до 20% масс./об. указанного водного раствора. В некоторых вариантах осуществления указанный водный раствор содержит примерно от 15% до 18% масс. полоксамера 407. В некоторых вариантах осуществления кристаллическое соединение I присутствует в количестве примерно от 0,1% до 5% масс./об. В некоторых вариантах осуществления указанный водный раствор содержит примерно от 15% до 18% масс. полоксамера 407, и кристаллическое соединение I присутствует в количестве примерно от 0,1% до 5% масс./об.
[0036] В некоторых вариантах осуществления водная фармацевтическая композиция содержит: (1) описанное выше кристаллическое соединение II и (2) фармацевтически приемлемый водный раствор, содержащий примерно от 15% до 25% масс./масс. полоксамера 407, где pH равен примерно от 7,0 до 8,0; и где указанное кристаллическое соединение II присутствует в количестве примерно от 0,01% до 20% масс./об. указанного водного раствора. В некоторых вариантах осуществления указанный водный раствор содержит примерно от 15% до 18% масс. полоксамера 407. В некоторых вариантах осуществления кристаллическое соединение II присутствует в количестве примерно от 0,1% до 5% масс./об. В некоторых вариантах осуществления указанный водный раствор содержит примерно от 15% до 18% масс. полоксамера 407, и кристаллическое соединение II присутствует в количестве примерно от 0,1% до 5% масс./об.
[0037] В некоторых вариантах осуществления настоящее раскрытие касается способа лечения слуховых нарушений, который включает интратимпанальное введение терапевтически эффективного количества активного агента, выбранного из раскрытого здесь кристаллического соединения, нуждающемуся в этом пациенту в область на или около мембраны окна улитки в ухе указанного пациента.
[0038] В некоторых вариантах осуществления способа лечения слуховых нарушений слуховым нарушением может являться потеря слуха.
[0039] В некоторых вариантах осуществления представлен способ лечения слухового нарушения, включающий интратимпанальное введение описанной здесь водной фармацевтической композиции нуждающемуся в таком лечении пациенту в область на или около мембраны окна улитки в ухе указанного пациента. В некоторых вариантах осуществления слуховым нарушением может являться потеря слуха. В некоторых вариантах осуществления водную фармацевтическую композицию можно вводить с частотой от одного раза в неделю до одного раза в каждые 3 месяца.
[0040] В некоторых вариантах осуществления представлен способ лечения потери слуха, включающий интратимпанальное введение нуждающемуся в таком лечении пациенту в область на или около мембраны окна улитки в ухе указанного пациента водной фармацевтической композиции, содержащей (1) активный агент, выбранный из описанного здесь кристаллического соединения, и (2) водный раствор, содержащий примерно от 15% до 18% масс./масс. полоксамера 407, где pH равен примерно от 7,0 до 8,0; и где указанный активный агент присутствует в количестве примерно от 0,1% до 5% масс./об. В некоторых вариантах осуществления активный агент представляет собой кристаллическое соединение I, которое здесь описано. В некоторых вариантах осуществления активный агент представляет собой кристаллическое соединение II, которое здесь описано.
[0041] Некоторые варианты осуществления по настоящему раскрытию касаются применения активного агента, выбранного из раскрытого здесь кристаллического соединения или композиции, содержащей такое соединение, при получении лекарственного средства для лечения слуховых нарушений. В некоторых вариантах осуществления готовят лекарственное средство для интратимпанального введения в область на или около мембраны окна улитки в ухе пациента. В некоторых вариантах осуществления слуховым нарушением может являться потеря слуха.
[0042] Некоторые варианты осуществления по настоящему раскрытию касаются применения активного агента, выбранного из раскрытого здесь кристаллического соединения или содержащей его композиции, при получении описанной здесь водной фармацевтической композиции для применения с целью лечения слухового нарушения. В некоторых вариантах осуществления готовят водную фармацевтическую композицию для интратимпанального введения в область на или около мембраны окна улитки в ухе пациента. В некоторых вариантах осуществления слуховым нарушением может являться потеря слуха.
[0043] Некоторые варианты осуществления по настоящему раскрытию касаются применения активного агента, выбранного из раскрытого здесь кристаллического соединения или содержащей его композиции, при получении водной фармацевтической композиции, содержащей (1) активный агент, выбранный из описанного здесь кристаллического соединения; и (2) водный раствор, содержащий примерно от 15% до 18% масс./масс. полоксамера 407, где pH равен примерно от 7,0 до 8,0; и где указанный активный агент присутствует в количестве примерно от 0,1% до 5% масс./об., для лечения потери слуха. В некоторых вариантах осуществления готовят водную фармацевтическую композицию для интратимпанального введения в область на или около мембраны окна улитки в ухе пациента. В некоторых вариантах осуществления активный агент представляет собой кристаллическое соединение I, которое здесь описано. В некоторых вариантах осуществления активный агент представляет собой кристаллическое соединение II, которое здесь описано.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0044] На фиг. 1 изображена рентгеновская порошковая дифрактограмма кристаллического соединения I.
[0045] На фиг. 2 изображена кривая дифференциальной сканирующей калориметрии (ДСК) для кристаллического соединения I.
[0046] На фиг. 3 изображена рентгеновская порошковая дифрактограмма кристаллического соединения II.
[0047] На фиг. 4 изображена кривая дифференциальной сканирующей калориметрии (ДСК) для кристаллического соединения II.
[0048] На фиг. 5A изображена PK в перилимфе морских свинок для водной фармацевтической композиции, содержащей соединение I в аморфном виде и в кристаллическом виде.
[0049] На фиг. 5B изображена PK в улитке морских свинок для водной фармацевтической композиции, содержащей соединение I в аморфном виде и в кристаллическом виде.
[0050] На фиг. 6A изображена PK в перилимфе морских свинок для водной фармацевтической композиции, содержащей соединение II в аморфном виде и в кристаллическом виде.
[0051] На фиг. 6B изображена PK в улитке морских свинок для водной фармацевтической композиции, содержащей соединение II в аморфном виде и в кристаллическом виде.
ВКЛЮЧЕНИЕ в ВИДЕ ССЫЛКИ
[0052] Все упоминаемые в данной спецификации публикации и патентные заявки включены здесь в виде ссылок в том объеме, как если бы каждая отдельная публикация или патентная заявка была специально и индивидуально указана для включения в качестве ссылки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0053] Термин «соединение I» относится к (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этиловому эфиру (2,2,3,3,3-пентафторпропил)карбаминовой кислоты, имеющему структурную формулу:
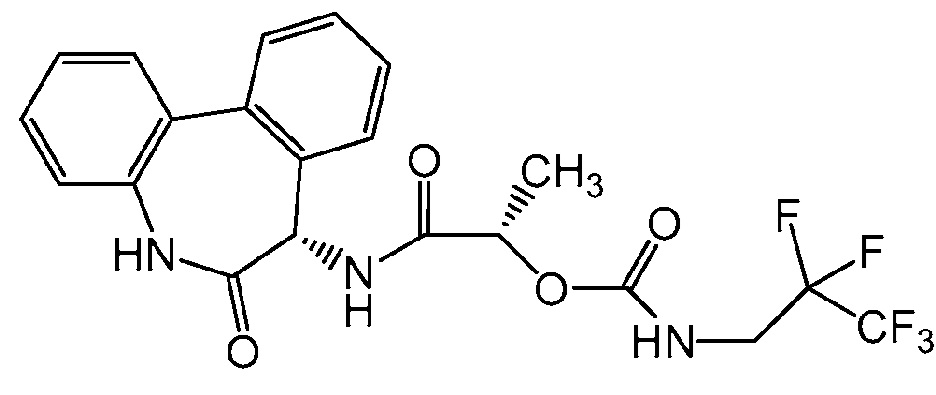
Соединение I
[0054] Термин «соединение II» относится к (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамиду, имеющему структурную формулу:
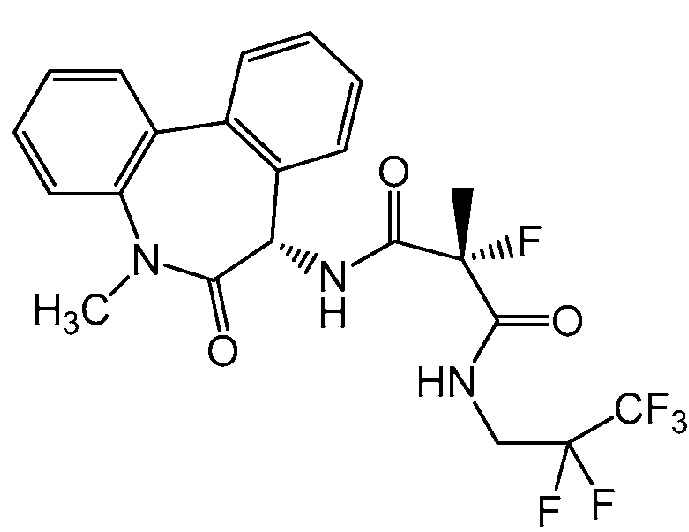
Соединение II
[0055] Кристаллические формы соединения I и соединения II можно получить, растворяя соответствующий аморфный материал в спирте, например, метаноле или этаноле и затем собирая образовавшиеся твердые вещества. Кристаллические соединения I и II характеризуют методом рентгеновской порошковой дифракции, применяя дифрактометр Bruker (Billerica, Massachusetts) AXS C2 GADDS или Bruker AXS D8 Advance, где используется CuKα-излучение (40 кВ, 40 мА). Данные ДСК собирают на Mettler (Columbus, Ohio) DSK 823E, оснащенном 34-позиционным автоматическим пробоотборником. Прибор калибруют по энергии и температуре, используя сертифицированный индий. Обычно 0,5-3 мг каждого образца на алюминиевом лотке с отверстиями нагревают от 25°C до 300°C с шагом 10°C/мин. Над образцом постоянно продувают азот при 50 мл/мин.
[0056] Кристаллическое соединение I можно охарактеризовать CuKα-рентгеновской порошковой дифрактограммой (XRPD), которая по существу показана на фиг. 3. По-другому, кристаллическое соединение I можно охарактеризовать рентгеновской порошковой дифрактограммой с пиками примерено при 8,2, 13,8, 14,0, 18,4, 20,9±0,15 градуса два-тета; или рентгеновской порошковой дифрактограммой с пиками примерено при 4,6, 8,2, 9,2, 13,8, 14,0, 18,2, 18,4, 20,9, 23,8, 27,7±0,15 градуса два-тета; или рентгеновской порошковой дифрактограммой с пиками примерено при 3,0, 4,6, 8,2, 9,2, 10,4, 13,8, 14,0, 16,4, 18,2, 18,4, 18,8, 19,1, 20,9, 21,5, 22,2, 22,7, 23,0, 23,8, 24,3, 24,7, 25,2, 26,5, 26,6, 27,1, 27,7, 28,1, 28,3, 28,6, 29,0, 30,0, 31,2, 31,5, 31,8, 32,1, 32,4, 35,1, 35,6, 35,8, 36,4, 36,7, 38,4, 38,8, 39,8, 40,5, 40,8±0,15 градуса два-тета. По-другому, кристаллическое соединение I можно охарактеризовать, как описано в параграфе «Примеры», см. ниже.
[0057] Кристаллическое соединение II можно охарактеризовать CuKα-рентгеновской порошковой дифрактограммой (XRPD), которая по существу показана на фиг. 4. По-другому, кристаллическое соединение II можно охарактеризовать рентгеновской порошковой дифрактограммой с пиками примерено при 8,4, 15,2, 16,0, 20,6, 22,6±0,15 градуса два-тета; или рентгеновской порошковой дифрактограммой с пиками примерено при 6,5, 8,4, 15,2, 16,0, 19,9, 20,6, 22,6, 24,5, 25,1, 30,6±0,15 градуса два-тета; или рентгеновской порошковой дифрактограммой с пиками примерено при 6,5, 8,4, 10,1, 13,1, 14,6, 15,0, 15,2, 16,0, 17,6, 18,0, 18,4, 19,6, 19,9, 20,1, 20,6, 20,9, 21,2, 22,2, 22,6, 23,3, 23,5, 23,8, 24,5, 24,9, 25,1, 25,8, 26,1, 26,7, 26,8, 27,5, 27,8, 29,6, 30,6, 31,2, 32,3, 32,9, 33,2, 33,9, 34,4, 35,4, 36,3, 36,7, 37,3, 37,7, 38,0, 38,9, 40,0, 40,2, 40,8, 41,6±0,2. По-другому, кристаллическое соединение II можно охарактеризовать, как описано в параграфе «Примеры», см. ниже.
[0058] Кристаллические соединения I и II пригодны для получения водных фармацевтических композиций для интратимпанального введения, которые здесь описаны. Кристаллические соединения I и II и содержащие их водные фармацевтические композиции подходят для лечения ушных заболеваний и нарушений.
Фармацевтическая композиция
[0059] В одном аспекте настоящее раскрытие касается водных фармацевтических композиций для интратимпанального введения, содержащих активный агент, выбранный из кристаллического соединения I и кристаллического соединения II, и фармацевтически приемлемый водный раствор. Активные агенты представляют собой ингибиторы сигнального пути Notch и, в частности, представляют собой селективные ингибиторы гамма-секретазы.
[0060] В некоторых вариантах осуществления активный агент выбран из кристаллического соединения I, которое описано и охарактеризовано здесь. В некоторых вариантах осуществления активный агент представляет собой кристаллическое соединение II, которое описано и охарактеризовано здесь.
[0061] В некоторых вариантах осуществления кристаллический активный агент дополнительно обрабатывают для получения более однородного размера частиц, или для регулирования размера частиц, или для уменьшения размера частиц. Например, исходный кристаллический материал можно подвергать механическому воздействию, такому как дробление, измельчение, помол (например, на шаровой мельнице и струйной мельнице) и подобное, получая частицы с желательным распределением по размерам.
[0062] В некоторых вариантах осуществления водные фармацевтические композиции для интратимпанального введения обеспечивают длительное высвобождение активного агента в среднем ухе. Препараты с длительным высвобождением обычно включают полимер; подходящие для настоящего раскрытия полимеры, которые можно указать, включают, но не ограничены этим, желатин, гиалуроновую кислоту/гиалуронаты, хитозан и полиоксиэтилен-полиоксипропиленовые триблоксополимеры [см., например, работы Liu и др., Acta Pharmaceutica Sinica B, 2013, 13(2): 86-96, и Swan и др., Adv. Drug Deliv. Rev., 2008, 60(15):1583-1599].
[0063] В некоторых вариантах осуществления настоящие водные фармацевтические композиции можно доставлять в среднее ухо в виде жидкости с низкой вязкостью при температуре окружающей среды, которая образует на месте гель с более высокой вязкостью. Преимущества такой композиции включают (1) удобство обращения с жидкостью во время введения и (2) увеличенное время высвобождения лекарства на месте внесения после гелеобразования на месте.
В результате увеличения времени высвобождения продлевается время терапевтической эффективности и потенциально снижается доза лекарства. Такие композиции преимущественно содержат термообратимый гель, который обладает свойством быть жидким при температуре окружающей среды и гелеобразным при температуре, близкой к температуре тела млекопитающего.
[0064] Термообратимые гели, которые подходят для фармацевтического применения, можно получить, используя полимеры, включающие поли(молочная кислота)-поли(этиленгликоль) (PLA-PEG) или триблоксополимеры PEG-PLGA-PEG. Раствор хитозан-глицеринфосфата способен образовывать обратимый термоотверждающийся гель. Добавление фосфатов сахаров трансформирует хитозан в термообратимую гелевую систему доставки лекарств. Общую группу термообратимых гелей составляют полимеры на базе полиоксиалкиленов, такие как полиоксиэтилен-полиоксипропиленовые триблоксополимеры, вообще известные как полоксамеры. Полоксамеры в водных растворах демонстрируют термообратимые свойства, которые являются преимуществом для настоящего раскрытия. Таким образом, водные растворы полоксамера могут переходить из жидкого состояния в гелеобразное состояние при повышении температуры. Температуру перехода жидкость-гель можно регулировать, изменяя концентрацию полоксамера, а также добавляя другие наполнители, такие как агенты модификации вязкости; таким образом, можно получить растворы полоксамера, которые находятся в жидком состоянии при комнатной температуре или более низкой и переходят в гелеобразное состояние при температуре тела. В одном варианте осуществления настоящей композиции термообратимый гель представляет собой полоксамер 407 (например, Pluronic® F127 продаваемый BASF, Florham Park, NJ).
[0065] В некоторых вариантах осуществления настоящая водная фармацевтическая композиция для интратимпанального введения содержит активный агент, выбранный из кристаллического соединения I и кристаллического соединения II, и фармацевтически приемлемый водный раствор, содержащий полоксамер 407. Полоксамер может присутствовать с концентрацией от примерно 15 до примерно 25% масс. В некоторых вариантах осуществления концентрация полоксамера 407 составляет от примерно 15 до примерно 18% масс. В некотором варианте осуществления концентрация полоксамера 407 составляет от примерно 16 до примерно 17% масс. В некоторых вариантах осуществления полоксамер присутствует в количестве примерно 15, или 16, или 17, или 18% масс. В некоторых вариантах осуществления фармацевтические композиции по настоящему раскрытию, содержащие полоксамер 407, могут необязательно включать гидроксипропилметилцеллюлозу (HPMC), имеющую номинальную вязкость от 40 до 120 сП, и в количестве примерно от 0,5% до 4% масс.
[0066] В некоторых вариантах осуществления композиция по настоящему раскрытию представляет собой водную фармацевтическую композицию для интратимпанального введения, содержащую активный агент, выбранный из кристаллического соединения I и кристаллического соединения II, и фармацевтически приемлемый носитель, содержащий (a) примерно от 0,5% до 8% масс. гиалуроновой кислоты или (b) (i) примерно от 0,5% до 4% масс. гиалуроновой кислоты и (ii) примерно от 5% до 20% об. полиэтиленгликоля 400 (PEG400).
[0067] В водных фармацевтических композициях для интратимпанального введения концентрация активного агента, выбранного из кристаллического соединения I и кристаллического соединения II, обычно составляет примерно от 0,01% масс./об. до 20% масс./об. Этот диапазон включает поддиапазон от примерно 0,05 масс./об. до примерно 15 масс./об., от примерно 0,1 масс./об. до примерно 10 масс./об., от примерно 0,1% масс./об. до примерно 5% масс./об. В некоторых вариантах осуществления концентрация активного агента составляет от примерно 0,5% масс./об. до примерно 5% масс./об. В некоторых вариантах осуществления концентрация активного агента составляет от примерно 0,5 до примерно 4% масс./об. В некоторых вариантах осуществления концентрация активного агента составляет от примерно 1 до примерно 5% масс./об. В некоторых вариантах осуществления концентрация активного агента составляет от примерно 1 до примерно 4%. В некоторых вариантах осуществления концентрация активного агента составляет примерно 0,5, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5 или 5% масс./об. В некоторых вариантах осуществления концентрация активного агента составляет примерно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1% масс./об.
[0068] Раскрытая здесь композиция может содержать любые общепринятые нетоксичные фармацевтически приемлемые наполнители. В некоторых вариантах осуществления pH композиции составляет от примерно 6 до 8, или примерно от 6 до 7, или примерно от 7 до 8. В некоторых вариантах осуществления композиция может включать буфер, такой как мононатрийфосфат или динатрийфосфат, или их комбиниции и может представлять собой физиологический раствор с фосфатным буфером (PBS) или буфер, например, трис(гидроксиметил)аминометан (TRIS). Количество буфера может составлять от примерно 0,1 до примерно 0,5% масс.
[0069] В некоторых вариантах осуществления водная фармацевтическая композиция по настоящему раскрытию может включать модификатор вязкости, такой как Carbopol® 974P (Lubrizol Advanced Materials, Cleveland, OH). В некоторых вариантах осуществления водная фармацевтическая композиция для интратимпанального введения содержит активный агент, выбранный из кристаллического соединения I и кристаллического соединения II и фармацевтически приемлемый носитель, содержащий полоксамер 407 и модификатор вязкости, такой как Carbopol® 974P. В некоторых вариантах осуществления полоксамер 407 присутствует в количестве примерно от 10% до 20% масс., и Carbopol® 974P присутствует в количестве примерно от 0,1% до примерно 0,3% масс. В некоторых вариантах осуществления активный агент представляет собой кристаллическое соединение I или кристаллическое соединение II. Другие обычные наполнители могут включать консерванты, такие как метилпарабен, а также хлорид натрия для обеспечения изотоничности. Композиции готовят так, чтобы они обеспечивали длительное высвобождение активного агента в течение периода, достаточного для выполнения ингибирования гамма-секретазы. Длительное ингибирование гамма-секретазы минимизирует частоту введения до одного раза в неделю, в две недели, в месяц, в два месяца, в квартал, в полгода, в год и т.д. В некоторых вариантах осуществления частота дозирования составляет один раз каждые две недели (или дважды в месяц), или ежемесячно (или один раз в месяц), или ежеквартально.
[0070] Раскрытую здесь водную фармацевтическую композицию, содержащую активный агент, выбранный из кристаллического соединения I и кристаллического соединения II, и носитель, можно получить, применяя общепринятые способы, такие как описаны в примерах, и можно упаковать для использования в виде разовой дозы, например, в шприц или в виде многократной дозы, например, в ампулу. По-другому, компонент активного агента и компонент водного раствора можно упаковать отдельно в отдельные ячейки или отдельные контейнеры и смешивать перед введением.
[0071] Иллюстративные примеры композиций, подходящих для локального введения соединений по настоящему раскрытию во внутреннее ухо, приведены в параграфе «Примеры», см. ниже.
Способ лечения
[0072] В одном аспекте настоящее раскрытие касается способов лечения слуховых нарушений, включающих интратимпанальное введение терапевтически эффективного количества активного агента, выбранного из кристаллического соединения I и кристаллического соединения II, нуждающемуся в этом пациенту в область на или около мембраны окна улитки в ухе указанного пациента. Термин «слуховые нарушения» обычно касается состояний, являющихся результатом утраты кохлеарных волосковых клеток, включающих, но не ограниченных этим, потерю слуха и глухоту, а также состояний, связанных с вестибулярной дисфункцией, которые можно обнаружить посредством симптомов, таких как головокружение, нарушение равновесия, вертиго, тошнота и нечеткое зрение. Потеря слуха или глухота может быть вызвана ототоксичными химическими веществами, чрезмерным шумом и старением.
[0073] Используемый здесь термин «лечение», или «терапия», или «обработка» и подобные включает регулирование, облегчение, обращение или замедление прогрессирования состояния, подлежащего лечению; например, уменьшение или остановка дальнейшей потери слуха вследствие указанных выше или других факторов; и восстановление слуха после частичной или абсолютной потери слуха вследствие указанных выше или других факторов. Лечение также включает предотвращение (например, замедление начала или снижение риска развития) потери слуха, а также профилактическое применение, например, до, во время или после получения ототоксичных химических веществ, таких как аминогликозидный антибиотик, например, гентамицин или платиновый химиотерапевтический агент, такой как цисплатин.
[0074] Используемое здесь выражение «терапевтически эффективное количество» относится к количеству активного агента, достаточному для вызова желательного или благотворного эффекта при заболевании или нарушении, подлежащем лечению; в случае профилактики это относится к количеству активного агента, достаточному для предотвращения начала или уменьшения эффекта заболевания или нарушения. Количество, которое будет использоваться, зависит от выбранного агента, тяжести заболевания или нарушения, подлежащего лечению, способа введения и характеристик пациента, например, возраста.
[0075] В настоящем раскрытии активный агент вводят в ухо посредством интратимпанальной инъекции в среднее ухо, внутреннее ухо, улитку или их комбинации. Интратимпанальное введение также называют транстимпанальным, и оба термина используются здесь взаимозаменяемо. Интратимпанальная инъекция является методикой введения терапевтического агента через барабанную перепонку в среднее ухо, где терапевтический агент может диффундировать через мембрану окна улитки, достигая внутреннего уха. Она применяется в клинической практике в течение многих лет и представляет собой относительно легкое вмешательство, которое может быть выполнено в кабинете врача. Для повторных инъекций можно вставить в барабанную перепонку трубку для вентиляции среднего уха, через которую можно вводить лекарственный препарат в пространство среднего уха за барабанной перепонкой в среднее и/или внутреннее ухо. В одном варианте осуществления активный агент вводят интратимпанально в область вблизи или на мембране окна улитки.
[0076] В некоторых вариантах осуществления настоящего способа активный агент вводят в виде водной фармацевтической композиции, содержащей a термообратимый гель; такие композиции являются жидкими при комнатной температуре (для простоты введения) и превращаются в гель при температуре тела, так что фармацевтическая композиция не вытекает быстро через Евстахиеву трубу. В некоторых вариантах осуществления применяют в настоящем способе фармацевтические композиции, описанные здесь ниже.
[0077] Дозы для локального внутреннего введения кристаллического соединения I или кристаллического соединения II включают от примерно 0,06 мг до примерно 100 мг. Этот диапазон включает поддиапазоны от примерно 0,1 мг до примерно 90 мг, от 0,25 мг до примерно 80 мг, от 0,4 мг до 70 мг, от 0,6 мг до 60 мг, от 0,80 мг до 50 мг, от 1,0 мг до 40 мг, от 2 мг до 30 мг, от 3 мг до 20 мг. Дозы можно вводить в виде водной фармацевтической композиции, содержащей водный раствор, где объем вводимого водного раствора составляет примерно до 100 мкл до примерно 500 мкл. Этот диапазон объемов включает поддиапазоны от примерно 100 мкл до 150 мкл, от 100 мкл до 200 мкл, от 100 мкл до 250 мкл, от 100 мкл до 300 мкл, от 100 мкл до 350 мкл, от 100 мкл до 400 мкл, от 100 мкл до 450 мкл и от 100 мкл до 500 мкл. Этот диапазон объемов также включает поддиапазоны от примерно 200 мкл до 250 мкл, от 200 мкл до 300 мкл, от 200 мкл до 350 мкл, от 200 мкл до 400 мкл, от 200 мкл до 450 мкл и от 200 мкл до 500 мкл. Этот диапазон объемов также включает поддиапазоны от примерно 300 мкл до 350 мкл, от 300 мкл до 400 мкл, от 300 мкл до 450 мкл и от 300 мкл до 500 мкл. Этот диапазон объемов также включает поддиапазоны от примерно 400 мкл до 450 мкл и от 400 мкл до 500 мкл. Из-за технических ограничений предполагается, что доля активного агента в водной фармацевтической композиции составляет 20% масс. или менее.
[0078] В одном аспекте раскрытые здесь соединения можно вводить совместно с одним или несколькими дополнительными агентами, такими как стероид; например, дексаметазон. В некоторых вариантах осуществления дополнительные агенты можно вводить отдельно от кристаллического соединения I или кристаллического соединения II (например, последовательно, например, по разным перекрывающимся схемам). В других вариантах осуществления эти агенты могут представлять часть единой дозированной формы, смешанную с соединением I или соединением II в единой композиции. Еще в одном варианте осуществления эти агенты можно принимать как отдельную дозу, которую вводят примерно в одно время с кристаллическим соединением I или кристаллическим соединением II. Если раскрытые здесь композиции включают комбинацию кристаллического соединения I или кристаллического соединения II и одного или нескольких дополнительных терапевтических или профилактических агентов, то оба компонента, соединение и дополнительный агент, могут присутствовать при уровнях доз от примерно 1 до 100% и более предпочтительно от примерно 5 до 95% дозы, вводимой в режиме монотерапии.
БИОЛОГИЧЕСКАЯ ФУНКЦИЯ
[0079] Полезность настоящего раскрытия можно продемонстрировать одним или несколькими из следующих способов или другими способами, известными в данной области.
A. Исследование дифференцировки отосфер.
[0080] Для определения активности соединения по индуцированию дифференцировки волосковых клеток мышей, генерировали отосферы из кортиева органа мыши, как описано в работе Oshima и др., Auditory and Vestibular Res Methods, 2009. Вкратце, выделяли сенсорный эпителий из неонатального кортиева органа, обрабатывали трипсином и осторожно диссоциировали. Затем диссоциированные клетки переносили в низкоадгезионную ячейку в среду DMEM/F12, содержавшую 1×B27 и N2 добавки (Invitrogen Life Sciences, Carlsbad, CA), EGF, IGF-1 и bFGF для образования сфер. Через 3 дня после образования сфер сферы выделяли центрифугированием, переносили на планшеты, покрытые фибронектином, и позволяли происходить адгезии в течение ночи в среде в отсутствие факторов роста. Затем прикрепленные сферы обрабатывали тестируемым соединением при концентрациях от 10-5 до 10-10M в течение 4 дней. Затем собирали РНК с помощью набора RNeasy (Qiagen®, Hilden, Germany) и анализировали, используя количественную ПЦР, проводимую с использованием ген-специфических праймеров относительно Atoh1 и Myo7a, используя Rpl19 в качестве гена «домашнего хозяйства». Полученные значения впоследствии анализировали, применяя метод ΔΔCt. Рядовым специалистам понятно, что метод ΔΔCt является общеприменимым в области ПЦР.
B. Исследование эксплантата кортиева органа мыши.
[0081] (a) Ингибирование Notch. Использовали неонатальные мышиные эксплантаты для определения ингибирования пути Notch и тестирования способности соединения генерировать волосковые клетки в ex vivo системе. Вкратце, кортиев орган иссекали из мышей на 3 день после рождения и помещали в 4-ячеечные камеры, покрытые поли-L-лизином и фибронектином. Эксплантаты помещали непосредственно в среду DMEM, содержащую 10% фетальную телячью сыворотку, B27, дополненную тестируемым соединением, и без тестируемого соединения. Для определения ингибирования Notch экстрагировали РНК через 24 час. после добавления соединения, используя набор RNeasy, и проводили количественную ПЦР с использованием генных праймеров, специфических относительно Hes5. Rpl19 использовали как ген «домашнего хозяйства» и анализировали полученные значения, применяя метод ΔΔCt.
[0082] (b) Индукция волосковых клеток. Для изучения индукции волосковых клеток генерировали эксплантаты и обрабатывали соединением, как описано выше; однако эксплантаты обрабатывали в течение 3-5 дней при ежедневном пополнении среды в присутствии или в отсутствие соединения. Затем эксплантаты фиксировали параформальдегидом и осуществляли иммунное окрашивание антителами против MYO7A, SOX2 и контрастное окрашивание Alexa647-фаллоидином и Hoechst. Изображения получали на конфокальной системе Nikon N2 с использованием программ NIS-Elements (Nikon, Melville, NY, USA). Затем подсчитывали MYO7A/фаллоидин позитивные волосковые клетки и сравнивали с группами, обработанными носителем.
C. Анализ нервных стволовых клеток человека
[0083] Нейронные стволовые клетки (НСК) получали из эмбриональных стволовых клеток с использованием опубликованного протокола Yuan и др., March 2, 2011, PLoS ONE, 6(3):e17540). Клетки сортировали, характеризовали на пассаже 3 и выращивали. Затем клетки замораживали на пассаже 5. Клетки содержали в среде NSC (DMEM/F12, N2 (1×), B27(1×) (Invitrogen) и Pen/Strep (1×) (Life Technologies) с 20 нг/мл bFGF (BD Bioscience/Corning)). В день 1 клетки помещали на 96-луночные планшеты, которые предварительно покрывали поли-орнитином и ламинином, 60000 клеток/лунку в 100 мкл среды. В день 2, использованную среду удаляли и добавляли к клеткам 180 мкл свежей среды. Позже в этот же день (день 2) клетки обрабатывали 20 мкл среды NSC, содержащей тестируемые соединения (7-точечный CRC). В день 3 использованную среду удаляли и добавляли к клеткам 140 мкл RLT/bME. РНК экстрагировали с использованием QiaCube (Qiagen®, Germantown, MD, USA), применяя полную экстракцию РНК + ДНКаза протокол. Затем РНК обратно транскрибировали в кДНК с использованием iScript (Bio-Rad, Hercules, CA, USA). Затем кДНК использовали для анализа ПЦР в режиме реального времени с использованием iTaq Sybergreen (BioRad). Оценивали экспрессию генов Atoh1, Hes5, Hes1, Myosin7a, используя CFX96 или CFX384 (Bio-Rad). HPRT1 использовали в качестве референсного гена. Анализ выполняли, применяя программы Microsoft® Excel® и CBIS (ChemInnovation Software, Inc., San Diego, CA, USA).
[0084] Описанную выше методику применяли для определения EC50 каждого соединения.
D. Дифференцировка человеческих эмбриональных стволовых клеток в клетки, подобные волосковым клеткам
[0085] Этот протокол предназначен для дифференцировки человеческих эмбриональных стволовых клеток (hESC) в ушные клетки-предшественники и дальнейшей дифференцировки клеток-предшественников в клетки, подобные волосковым клеткам. hESC сохраняли на обработанных митомицином C мышиных эмбриональных фибробластах (MEF) в нокаутной DMEM/F12 среде, дополненной 20% нокаутной сывороткой, 1× заменимыми аминокислотами, 1× l-глутамином, 1× β-меркаптоэтанолом (bME) и 8-10 нг/мл человеческих bFGF. hESC пассировали с использованием коллагеназы на новых MEF до тех пор, пока они были готовы начать дифференцировку, в этом случае их пассировали на планшеты, покрытые матригелем, в MEF-кондиционированную среду, дополненную 8 нг/мл bFGF, в течение 3-5 дней.
[0086] Человеческие ES клетки дифферинцировали, применяя опубликованный протокол (Ronaghi M и др., Stem Cells Dev. 2014, 1275-84). За исключением того, что использовали AggreWells планшеты (от Stem Cell Technology, Vancouver, CA) для генерирования эмбриоидных телец (EB) в течение первых 6 дней протокола. В день 34-39 проводили обработку клеток потенциальными индукторами Atoh1 или волосковых клеток. В день 39 клетки лизировали, получая белок, фиксировали для получения изображения или экстрагировали для получения РНК, как описано ниже.
[0087] (a) Western blot анализ Myosin7a: белок экстрагировали одновременно из двух экспериментально аналогичных лунок, используя RIPA буфер. Определяли концентрацию белка, применяя установленный протокол, и выполняли western blot на образцах дифференцированного белка, образце hESC такого же пассажа, маркере и положительном контрольном клеточном образце, который экспрессирует Myosin7a (Y79 клетки). Мембрану инкубировали с Myosin7a-антителом, а также (α-актин)-антителом в качестве контроля нагрузки. Когда блот отображался, использовали систему Licor, чтобы количественно определить полосы Myosin7a и α-актина для сравнительного анализа.
[0088] (b) Иммуноцитохимия: лунки быстро ополаскивали DPBS и затем фиксировали в течение 10 мин. 4% параформальдегидом с последующей 10-минутной инкубацией с 100 мМ глицином в DPBS. Лунки промывали 3 раза DPBS, пермеабилизировали в течение 10 мин. посредством 0,2% TritonX-100 и затем блокировали в течение одного часа буфером, содержащим 0,1% BSA и 0,2% TritonX-100. Добавляли первичные антитела к Myosin7a и Sox2 и хранили в течение ночи при 4°C. На следующий день лунки промывали 3 раза DPBS, добавляли вторичные антитела и инкубировали в темноте при комнатной температуре в течение 2 час. Лунки промывали 2 раза и клетки окрашивали 488-фаллоидином в течение 10 мин. в темноте при комнатной температуре. Лунки промывали 2 раза DPBS, добавляли в лунки краситель Hoechst и инкубировали в течение 10 мин. в темноте при комнатной температуре. Лунки промывали последние 3 раза и получали изображения, используя автоматизированную систему формирования и анализа изображений GE Healthcare Life Sciences (Pittsburgh, PA, USA) InCell 2200.
[0089] (c) ПЦР: РНК экстрагировали и выделяли, используя набор для выделения РНК от Qiagen® (включающий обработку ДНКазой). Концентрацию РНК определяли с помощью Nano-Drop. кДНК получали, используя iScript (Bio-Rad) на CFX96 (BioRad). Количество целевых генов, например, Myosin7a, Atoh1, Hes5, Axin2 и GAPDH, определяли, используя набор iTaq PCR (Bio-Rad) на CFX-96 или CFX-384, проводя ПЦР в режиме реального времени (BioRad). Все праймеры были получены от OriGene (Rockville, MD) или Integrated DNA Technologies (IDT, Coralville, IA).
E. PK на морских свинках
[0090] Самцов морских свинок Hartley (300-350 г) анестезировали кетамином и ксилазином. Тридцать мкл водной фармацевтической композиции по настоящим вариантам осуществления доставляли транстимпанально для внесения лекарства в мембрану окна улитки. Доставка была односторонней. Животных помещали в теплую камеру в лежачем положении на боку, сохраняя положение вверх ухом, в которое вводили дозу, до восстановления животных после анестезии.
[0091] В различные моменты времени после введения животных подвергали эвтаназии посредством ингаляции CO2. Собирали кровь и CSF и хранили при -80°C. Животных декапитировали, удаляли височные кости и вскрывали буллу, открывая слуховую капсулу. Собирали ипсилатеральную и контралатеральную перилимфу с вершины, используя микрокапиллярную трубку. Ипсилатеральную улитку удаляли из слуховой капсулы и хранили при -80°C. Все собранные ткани анализировали, применяя метод ЖХ/МС-МС для указанных концентраций тестируемого соединения. Аналитические стандарты готовили, вводя известные концентрации маточных растворов тестируемого соединения в матрикс, например, плазму или искусственную CSF. Фиксированные количества собранных тканей и введенных стандартов осаждали с помощью ацетонитрила, содержащего буспирон в качестве внутреннего стандарта. Осажденные образцы центрифугировали при 4000g в течение 10 мин. при 4°C. Супернатанты анализировали, применяя метод ЖХ-MS/MS. Систему ЖХ-MS/MS готовили с использованием AB Sciex 4000 Qtrap (AB Sciex, Framingham, MA), оснащенного ВЭЖХ Agilent 1200 и автоматическим пробоотборником CTC PAL (Agilent Technologies, Santa Clara, CA).
F. Функциональная фармакодинамика
[0092] (a) Хирургическая доставка тестируемого соединения в мембрану окна улитки. Хирургическую операцию выполняли на неподготовленных мышах или мышах с шумом в ушах или с фармакологически пораженными ушами. Животных анестезировали изофлураном и производили 8 мм ретроаурикулярный разрез до нижнего каудального края ушной раковины. Кожу отводили и производили тупое отсечение жировой ткани от места, где сходятся лицевой нерв и мышцы. Отводили мышцу, чтобы открыть область в барабанной булле, где кость является тонкой. Использовали иглу 30g, чтобы просверлить отверстие в открытой тонкой части ушной буллы. Вставляли в отверстие ушной буллы шприц Hamilton, снабженный тупой иглой 32g. Лекарственный препарат доставляли посредством инъекции и иглу удаляли. Рану закрывали клеем для ткани.
[0093] (b) Функциональная PD. В разные моменты времени после доставки лекарств, обычно через 24 час., мышей подвергали эвтаназии посредством воздействия CO2 и удаляли височную кость в охлаждаемый льдом RNAlater® (Thermo Fisher Scientific, Waltham, MA, USA). Осторожно иссекали слуховую капсулу из височной кости, помещали в чистую пробирку, содержащую тризол (Zymo Research, Irvine, CA, USA), сразу быстро замораживали в жидком азоте и хранили при -80°C до выделения РНК. РНК выделяли, используя набор Qiagen® RNA MiniElute в соответствии с инструкциями производителей. Генерировали кДНК и проводили ПЦР на специфических праймерах, используя BioRad iTaq.
G. Индукция волосковых клеток
[0094] Мышам доставляли настоящий лекарственный препарат хирургически в окно улитки, как описано выше в параграфе F. Морским свинкам доставляли настоящий лекарственный препарат посредством транстимпанальной инъекции в нишу окна улитки, как описано выше в параграфе E. Через 7-14 дней после доставки лекарств животных подвергали эвтаназии кетамином и ксилазином, их тела целиком перфузировали 10% формалином с нейтральным буфером, удаляли височные кости и хранили в формалине. На морских свинках, если следовало приготовить полное монтирование улитки, выполняли внутрискалярную перфузию, полностью погружая улитку в формалин. Готовили среднеосевые срезы или полное монтирование улитки и окрашивали для идентификации волосковых клеток.
H. Слуховая реакция Брейнстема (ABR)
[0095] Неподготовленных мышей или мышей в разные моменты времени после шумовой или фармакологической потери слуха анестезировали кетамином/ксилазином/ацепромазином и определяли слуховую реакцию Брейнстема на обоих ушах, используя аппарат Tucker Davis (Alachua, FL) RZ6. На мышей воздействовали звуком щелчка или чистыми тонами 4, 8, 16, 24 и 32 кГц при 90-10 дБ и шаге убывания 10 дБ и определяли слуховой порог.
[0096] Результаты описанного выше эксперимента, проводимого с использованием препаратов из примеров 3(c) и 3(d), приведены ниже в таблице:
[0097] Морских свинок, неподготовленных или после факмакологической потери слуха, анестезировали кетамином/ксилазином. Определяли слуховую реакцию Брейнстема (ABR) с двух сторон, используя аппарат Tucker Davis RZ6. На морских свинок воздействовали звуком щелчка или чистыми тонами 4, 8, 16 или 24 кГц при 90-10 дБ и шаге убывания 10 дБ и определяли слуховой порог.
ПРИМЕРЫ
Пример 1. Получение кристаллического соединения I
[0098] Соединение I раскрыто в работе Flohr и др., патент США №7166587, от 23 января 2007, следуя раскрытой там методике синтеза, получают соединение I в виде аморфного материала. Аморфное соединение I (2 г) суспендировали в MeOH (60 мл) и суспензию нагревали до 65°C, получая прозрачный раствор. Раствору давали охладиться и оставляли при температуре окружающей среды на 18 час. В течение этого времени происходила кристаллизация. Реакционную смесь фильтровали, собирали твердое вещество и сушили в вакууме, получая белое твердое вещество (1 г), которое было определено как кристаллическое, и охарактеризовано пиками рентгеновской порошковой дифракции, представленными в таблице 1 и на дифрактограмме, показанной на фиг. 1. Эндотерма ДСК начинается при 238,5°C, как показано на фиг. 2.
ТАБЛИЦА 1 - положения XRPD-пиков для кристаллического соединения I
Пример 2. Получение кристаллического соединения II
[0099] Соединение II раскрыто в работе Flohr и др., патент США №7160875, от 9 января 2007, следуя раскрытой там методике синтеза, получают соединение II в виде аморфного материала. Аморфное соединение II (432 мг) отвешивали в 20 мл пузырек и растворяли в EtOH (2,15 мл, 5 объемов). Результирующий прозрачный раствор проверяли через 30 мин. и наблюдали образование белого порошка. Эту суспензию перемешивали в течение примерно 16 час. при комнатной температуре, выделяли твердое вещество фильтрованием и сушили в течение 16 час. при 40°C/3 мбар, получая порошкообразное белое твердое вещество (315 мг, выход 73%), которое было определено как кристаллическое и охарактеризовано XRPD-пиками, представленными в таблице 2 и на дифрактограмме, показанной на фиг. 3. ДСК-эндотерма начинается при 173°C (плавление), как показано на фиг. 4.
ТАБЛИЦА 2 - положения пиков XRPD для кристаллического соединения II.
Примеры 3(a) и 3(b). Получение препарата A-1
[0100] Пример 3(a). К 128 мл стерильной фильтрованной воды добавляли 0,9 г хлорида натрия, 0,59 г двухосновного фосфата натрия и 0,17 г одноосновного фосфата натрия. Раствор перемешивали при температуре окружающей среды, добавляли 27,2 г полоксамера 407 и перемешивали в течение ночи, получая прозрачный раствор. 2 мл описанного выше раствора добавляли к 40 мг кристаллического соединения I и суспензию перемешивали на бане со льдом в течение 20 мин., получая гомогенную суспензию.
[0101] Пример 3(b). Готовили гомогенную суспензию, содержащую 2% масс./об. кристаллического соединения II, способом, аналогичным описанному выше.
Примеры 3(c) и (d) препарата A-2
[0102] Пример 3(c). К 129 мл стерильной воды добавляли 0,96 г хлорида натрия, 0,59 г двухосновного фосфата натрия и 0,14 г одноосновного фосфата натрия. Раствор перемешивали при температуре окружающей среды, добавляли 25,6 г полоксамера 407 и перемешивали в течение ночи, получая прозрачный раствор. Раствор стерильно фильтровали, добавляли 1 мл описанного выше раствора к 20 мг кристаллического соединения I и суспензию встряхивали в течение 60 мин, получая гомогенную суспензию.
[0103] Пример 3(d). Гомогенную суспензию, содержащую 2% масс./об. кристаллического соединения II, получали способом, аналогичным описанному выше.
Пример 4. Получение препарата B
[0104] К 3 мл стерильно фильтрованного 0,1M pH7 TRIS буфера добавляли 0,6 г полоксамера 407 и смесь перемешивали в течение ночи при 4°C, получая прозрачный, гомогенный раствор. Затем к этому раствору добавляли 60 мг кристаллического соединения I и 3 мг метилпарабена. Результирующую суспензию перемешивали при 4°C в течение 16 час. и хранили при 4°C до дозирования.
Примеры 5(a), 5(b), 5(c) и 5(d). Получение препарата C
[0105] Пример 5(a). К 10 мл стерильно фильтрованного 0,1M pH 7 TRIS буфера добавляли 1,8 г полоксамера 407 и перемешивали эту смесь в течение ночи при 4°C, получая прозрачный, гомогенный раствор. Затем к 3 мл этого раствора добавляли 60 мг кристаллического соединения I и суспензию перемешивали в течение ночи при 4°C, получая гомогенно распределенную суспензию. В заключение добавляли 90 мг гидроксипропилметилцеллюлозы (HPMC) (40-60 сП) (Sigma-Aldrich, St. Louis, MO) и 3 мг метилпарабена, суспензию перемешивали при 4°C в течение 16 час. и хранили при 4°C до дозирования.
[0106] Пример 5(b). Получали гомогенную суспензию, содержащую 2% аморфного соединения I, следуя описанной выше методике.
[0107] Пример 5(c). Получали гомогенную суспензию, содержащую 2% кристаллического соединения II, следуя описанной выше методике.
[0108] Пример 5(d). Получали гомогенную суспензию, содержащую 2% аморфного соединения II, следуя описанной выше методике.
Пример 6. Получение препарата D
[0109] К 3 мл стерильно фильтрованного 0,1M pH 7 TRIS буфера добавляли 0,54 г полоксамера 407 и эту смесь перемешивали в течение ночи при 4°C, получая прозрачный, гомогенный раствор. Затем к этому раствору добавляли 60 мг кристаллического соединения I и суспензию перемешивали в течение ночи при 4°C, получая гомогенно распределенную суспензию. В заключение добавляли 90 мг HPMC (40-60 сП), 3 мг метилпарабена и 6 мг Carbopol® 974P (Lubrizol Advanced Materials, Cleveland, OH), суспензию перемешивали при 4°C в течение 16 час. и хранили при 4°C до дозирования.
Пример 7. Получение препарата E
[0110] К 3 мл стерильного фильтрованного 0,1M pH 7 TRIS буфера добавляли 0,54 г полоксамера 407 и эту смесь перемешивали в течение ночи при 4°C, получая прозрачный, гомогенный раствор. Затем к этому раствору добавляли 60 мг кристаллического соединения I, суспензию перемешивали в течение ночи при 4°C, получая гомогенно распределенную суспензию, и хранили при 4°C до дозирования.
Пример 8. Получение препарата F
[0111] К 10 мл стерильно фильтрованного физиологического раствора с фосфатным буфером добавляли 100 мг гиалуроновой кислоты и эту смесь перемешивали при температуре окружающей среды в течение ночи, получая прозрачный, гомогенный раствор. К 60 мг кристаллического соединения I добавляли 0,6 мл PEG400 (Sigma-Aldrich, St. Louis, MO). Суспензию перемешивали при температуре окружающей среды. Добавляли 3 мл описанного выше раствора гиалуроновой кислоты к суспензии соединения I и PEG400. Суспензию перемешивали при температуре окружающей среды, получая гомогенно распределенную суспензию.
Пример 9. Получение препарата G
[0112] К 10 мл стерильно фильтрованного физиологического раствора с фосфатным буфером добавляли 200 мг гиалуроновой кислоты и эту смесь перемешивали при температуре окружающей среды в течение ночи, получая прозрачный, гомогенный раствор. К 60 мг кристаллического соединения I добавляли 0,15 мл PEG400. Суспензию перемешивали при температуре окружающей среды. Добавляли 3 мл описанного выше раствора гиалуроновой кислоты к суспензии соединения I и PEG400. Суспензию перемешивали при температуре окружающей среды, получая гомогенно распределенную суспензию.
Примеры 10(a) и 10(b). Получение препарата H
[0113] Пример 10(a). К 10 мл стерильно фильтрованного физиологического раствора с фосфатным буфером добавляли 150 мг гиалуроновой кислоты и эту смесь перемешивали при температуре окружающей среды в течение ночи, получая прозрачный, гомогенный раствор. К 60 мг кристаллического соединения I добавляли 0,3 мл PEG400. Суспензию перемешивали при температуре окружающей среды. Добавляли 3 мл описанного выше раствора гиалуроновой кислоты к суспензии соединения I и PEG400. Суспензию перемешивали при температуре окружающей среды, получая гомогенно распределенную суспензию.
[0114] Пример 10(b). Получали гомогенную суспензию, содержащую 2% кристаллического соединения II, следуя описанной выше методике.
Пример 11. Получение препарата I
[0115] К 5 мл стерильно фильтрованного физиологического раствора с фосфатным буфером добавляли 50 мг олигопептида (Corning® PuraMatrixTM Peptide Hydrogel, Corning, NY) и эту смесь перемешивали при температуре окружающей среды в течение 2 час., получая прозрачный, гомогенный раствор. К 60 мг кристаллического соединения I добавляли 0,3 мл PEG400. Суспензию перемешивали при температуре окружающей среды. Добавляли 3 мл описанного выше раствора олигопептида к суспензии соединения I и PEG400. Суспензию перемешивали при температуре окружающей среды, получая гомогенно распределенную суспензию.
Пример 12. Получение препарата J
[0116] К 5 мл стерильно фильтрованного физиологического раствора с фосфатным буфером добавляли 500 мг HPMC (40-60 сП) и эту смесь перемешивали при температуре окружающей среды в течение ночи, получая прозрачный, гомогенный раствор. К 60 мг кристаллического соединения I добавляли 0,3 мл PEG400. Суспензию перемешивали при температуре окружающей среды. Добавляли 3 мл описанного выше раствора HPMC к суспензии соединения I и PEG400. Суспензию перемешивали при температуре окружающей среды, получая гомогенно распределенную суспензию.
Пример 13. PK на морских свинках
[0117] Описанные здесь жидкие композиции оценивали, применяя способ, описанный выше в части E параграфа «Биологическая функция». Каждую из полученных жидких композиций, описанных в примерах 5(a)- 5(d), переносили в шприц на 1 мл. Используя заполненный шприц на 1 мл, заполняли жидкой композицией при 5°C шприц Hamilton на 100 мкл с прилаженной иглой размера 28g. Затем шприцу Hamilton позволяли нагреться до комнатной температуры.
[0118] Самцов морских свинок Hartley (300-350 г) анестезировали кетамином и ксилазином. Тридцать мкл описанной выше жидкой композиции доставляли транстимпанально для внесения лекарства в мембрану окна улитки. Доставка была односторонней. Животных помещали в теплую камеру в лежачем положении на боку сохраняя положение вверх ухом, в которое вводили дозу, до их восстановления от анестезии.
[0119] В различные моменты времени после введения животных подвергали эвтаназии посредством ингаляции CO2. Собирали кровь и цереброспинальную жидкость и хранили при -80°C. Животных декапитировали, удаляли височные кости и вскрывали буллу, открывая слуховую капсулу. Собирали ипсилатеральную и контралатеральную перилимфу с вершины, используя микрокапиллярную трубку. Ипсилатеральную улитку удаляли из слуховой капсулы и хранили при -80°C. Все собранные ткани анализировали, применяя метод ЖХ/МС-МС, как описано выше в части E параграфа «Биологическая функция».
[0120] Концентрации соединения I и соединения II определяли, применяя метод ЖХ/МС-МС в жидкости перилимфы и ткани улитки после транстимпанальной инъекции настоящего препарата в кристаллическом или аморфном виде в разные моменты времени. При дозировке аморфной формы концентрация соединения I в перилимфе и улитке была выше значения NSC EC50 человека для Atoh1 с 1 по 7 день. Концентрация соединения 1 при дозировке кристаллической формы была выше значения NSC EC50 с 1 по 28 день. При дозировке аморфной формы концентрация соединения II в перилимфе и улитке была выше значения NSC EC50 человека для Atoh1 с 1 по 7 день. Концентрация соединения II при дозировке кристаллической формы была выше значения NSC EC50 человека Atoh1 с 1 по 42 день. Концентрация настоящего соединения в перилимфе и/или ткани улитки была выше значения NSC EC50 человека для Atoh1, указывая, что рассматриваемые соединения могут быть эффективны для регенерации волосковых клеток и восстановления слуха у человека. Неожиданно результаты по PK показали, что препараты, содержащие кристаллическое соединение I и кристаллическое соединение II, обеспечивают боле длительное действие соединения I и соединения II на внутреннее ухо, чем препараты, содержащие соответствующие аморфные формы. Ниже в таблице 3 перечислены результаты исследований с использованием водных препаратов кристаллического соединения I, а в таблице 4 перечислены результаты для водных препаратов кристаллического соединения II. Результаты для водных препаратов кристаллического соединения I также показаны графически на фиг. 5A и фиг. 5B, а результаты для водных препаратов кристаллического соединения II показаны графически на фиг. 6A и фиг. 6B.
ТАБЛИЦА 3
ТАБЛИЦА 4
[0121] Хотя вышеизложенное было описано с некоторыми деталями с помощью иллюстраций и примеров для ясности и понимания, специалистам в данной области техники будет понятно, что могут быть сделаны многочисленные и различные модификации, не отступая от духа настоящего раскрытия. Поэтому должно быть понятно, что раскрытые здесь формы являются только иллюстративными и не предназначены для ограничения области настоящего раскрытия, а скорее также охватывают все модификации и альтернативы, соответствующие точной области и духу изобретения.
Реферат
Изобретение относится к соединениям формулы I и II в кристаллической форме, охарактеризованным рентгеновской порошковой дифрактограммой с пиками при 8,2, 13,8, 14,0, 18,4 и 20,9±0,15 градуса два-тета (соединение I) и рентгеновской порошковой дифрактограммой с пиками при 8,4, 15,2, 16,0, 20,6 и 22,6±0,15 градуса два-тета (соединение II). Также изобретение относится к водной фармацевтической композиции для лечения слухового нарушения для интратимпанального введения, содержащей (1) активный агент, выбранный из кристаллического соединения формулы I или II, и (2) фармацевтически приемлемый водный раствор, содержащий (A) от 15% до 25% масс./масс. полоксамера 407; или (B) (i) от 15% до 25% масс./масс. полоксамера 407 и (ii) от 0,5% до 4% масс./масс. гидроксипропилметилцеллюлозы, имеющей номинальную вязкость 40-60 сП, или сорта 80-120 сП; или (C) (i) 10%-20% масс./масс. полоксамера 407 и (ii) 0,1%-0,3% масс./масс. Carbopol974P; или (D) (i) от 0,5% до 8% масс./масс. гиалуроновой кислоты; или (E) (i) от 0,5% до 4% масс./масс. гиалуроновой кислоты и (ii) от 5% до 20% об. полиэтиленгликоля 400; где указанный активный агент присутствует в количестве от 0,01% до 20% масс./об. указанного водного раствора. Кристаллические соединения формулы I и II предназначены для получения лекарственного средства для лечения слухового нарушения. 6 н. и 24 з.п. ф-лы, 4 табл., 6 ил., 13 пр.
Формула
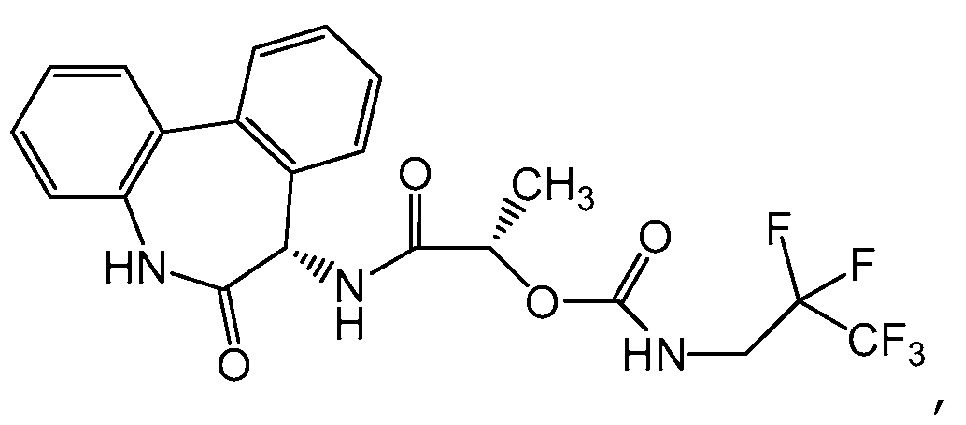
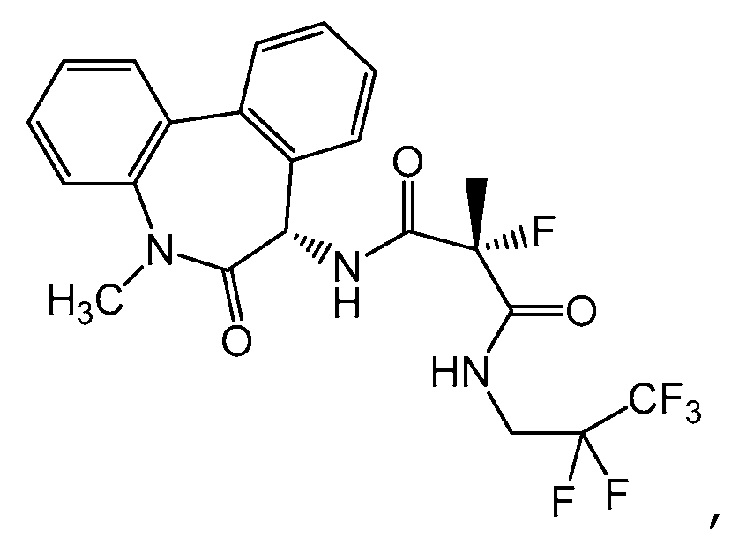

Комментарии