Назальные фармацевтические композиции и способы их применения - RU2380090C2
Код документа: RU2380090C2
Чертежи

Описание
I. Область, к которой относится изобретение
Настоящее изобретение направлено на назальные фармацевтические композиции, содержащие лекарственное вещество, имеющее специфический профиль распределения размеров частиц. Такой профиль обеспечивает повышенную биодоступность, улучшенную эффективность или продолжительный терапевтический эффект лекарственного вещества при интраназальном введении. В альтернативном воплощении композиции в соответствии с настоящим изобретением включают флутиказон или его фармацевтически приемлемую производную, которые имеют специфический профиль распределения размеров частиц. Композиции могут обеспечиваться в виде водной суспензии, приемлемой для интраназального введения субъекту, который нуждается в этом.
II. Предпосылки создания изобретения
Известно, что размер частиц лекарственного вещества влияет на биодоступность лекарственного средства и его эффективность. Были изучены способы получения тонко измельченных лекарственных веществ, а также были предприняты усилия в отношении контроля размера частиц и интервала размера частиц лекарственного вещества в фармацевтических композициях. Однако уровень техники не описывает лекарственных веществ, обладающих специфическими профилями распределения размеров частиц, которые обеспечивают повышенную биодоступность, улучшенную эффективность или длительный терапевтический эффект лекарственного средства при его введении интраназально.
Известно, что кортикостероиды, вводимые путем ингаляции, представляют собой наиболее эффективную систему медикации, используемую для лечения респираторных расстройств или заболеваний, характеризующихся воспалением. Один из таких кортикостероидов, пропионат флутиказона (FP), является особенно полезным при лечении или профилактике сезонного или длящегося круглый год ринита, а также назначается для ослабления одного или более симптомов, ассоциированных с сезонным или длящимся круглый год ринитом, а также назначаются для ослабления одного или более симптомов, ассоциированных с сезонным или длящимся круглый год аллергическим и неаллергическим (вазомоторным) ринитом. Ринит представляет собой реакцию, которая возникает в глазах, носу и горле, когда раздражаются дыхательные пути, например запускается высвобождение гистамина. Гистамин вызывает воспаление и выработку жидкости в хрупкой выстилке носовых ходов, синусах и веках. Применение кортикостероидов, таких как флутиказон, может вызвать частичное или полное избавление от симптомов, связанных с ринитом, таких как чихание, закладывание носа, выделения из носа, зуд в носу, горле глазах и ушах. Применение флутиказона может также отсрочить повторное появление полипов в носу у индивидуумов, которые подверглись удалению носовых полипов. У тех индивидуумов, у которых полипы возникают повторно, флутиказон может подавлять рост полипов и увеличение их размера.
Подобно большинству кортикостероидов и других лекарственных веществ, FP является очень слабо растворимым в воде. Когда такие лекарственные средства вводятся интраназально, их обычно суспендируют в водном растворе. Однако, когда эти вещества вводятся интраназально с помощью традиционного назального аэрозоля, то количества лекарственных веществ, меньшие, чем оптимальные, поглощаются слизистой оболочкой носа (ткань, которая представляет интерес), остальное количество заглатывается или выводится из носовой полости. В некоторых случаях частички, которые являются недостаточно мелкими, удаляются из желудочно-кишечного тракта до их попадания в область, которая преставляет интерес. Невозможность введения оптимальных количеств лекарственного вещества приводит к сниженной биодоступности и эффективности этого лекарственного средства.
III. Краткое изложение изобретения
Настоящее изобретение направлено на назальную фармацевтическую композицию, содержащую лекарственное вещество, имеющее специфический профиль распределения размеров частиц, который обеспечивает повышенную биодоступность, улучшенную эффективность или длительный терапевтический эффект лекарственного вещества, когда оно вводится интраназально. В частности, в одном альтернативном воплощении композиция в соответствии с настоящим изобретением включает лекарственное вещество (например, активный ингредиент), имеющий следующий профиль распределения размеров частиц: приблизительно 10% частиц лекарственного вещества имеют размер частиц приблизительно 0,90 микрона; приблизительно 25% частиц лекарственного вещества имеют размер частиц, меньший, чем 1,6 микрона; приблизительно 50% частиц лекарственного вещества имеют размер частиц, меньший, чем 3,2 микрона; приблизительно 75% частиц лекарственного вещества имеют размер частиц, меньший, чем 6,10 микрона; приблизительно 90% частиц лекарственного вещества имеют размер частиц, меньший, чем 10 микрон. В одном альтернативном воплощении лекарственное вещество представляет собой кортикостероид, предпочтительно флутиказон или его фармацевтически приемлемую производную.
IV. Фигуры
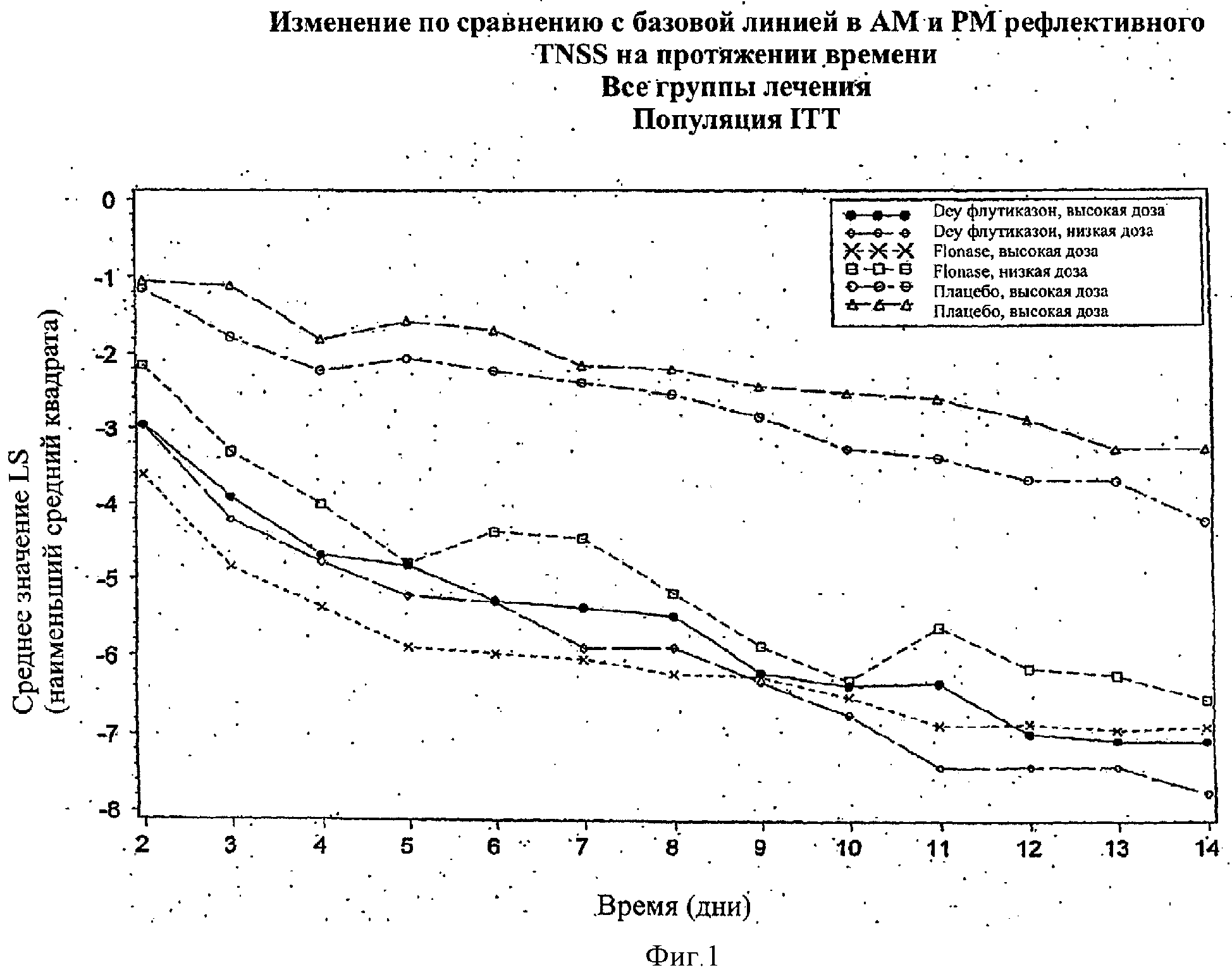
Фигура 1 показывает изменение по сравнению с базовой линией в AM и РМ рефлективном TNSS в течение периода времени в популяции ITT на протяжении периода изучения 14 дней.
Фигура 2 показывает изменение по сравнению с базовой линией в AM и РМ рефлективном TNSS в течение периода времени в популяции РР на протяжении периода изучения 14 дней.
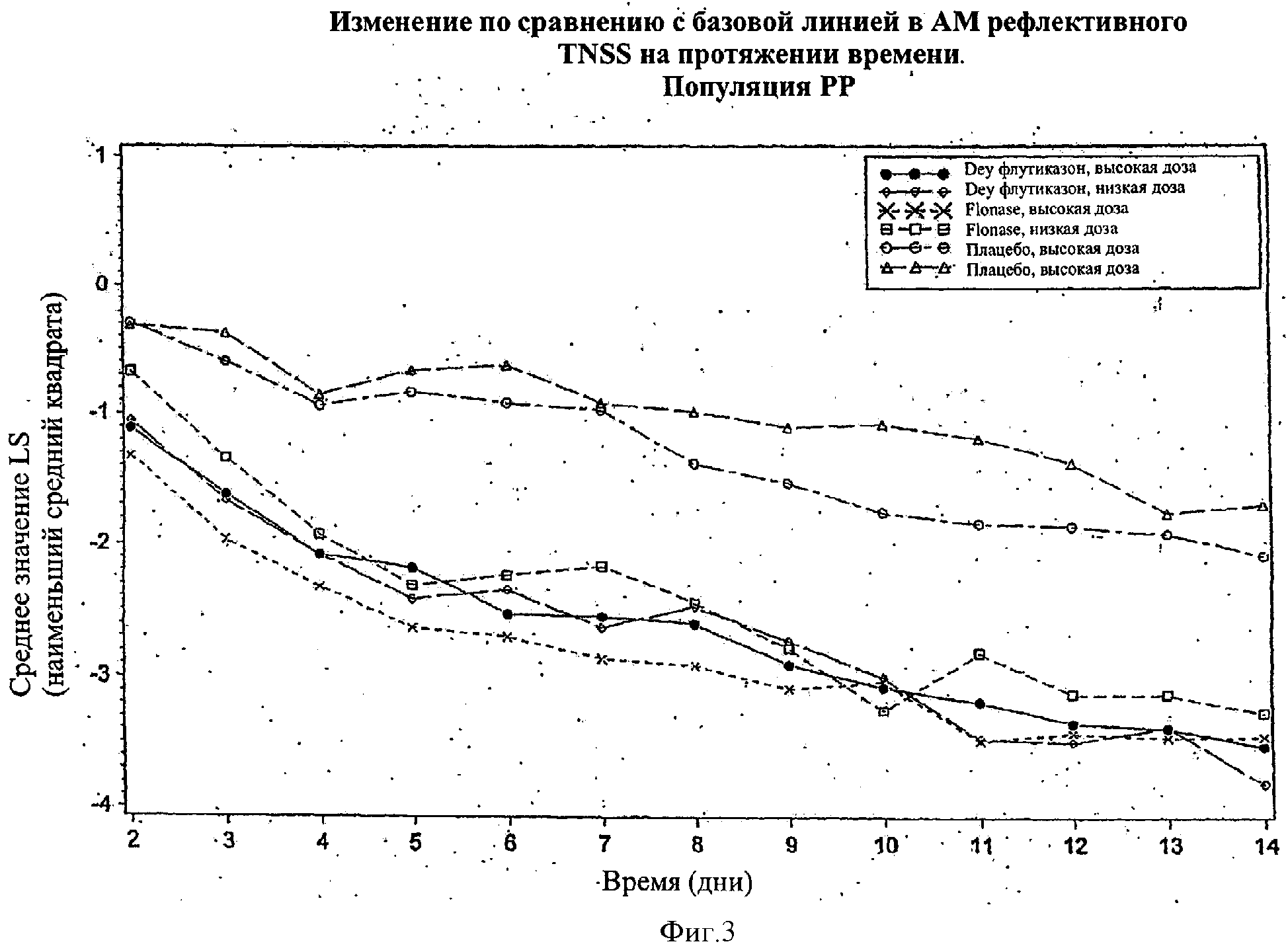
Фигура 3 показывает изменение по сравнению с базовой линией в AM рефлективном TNSS в течение периода времени в популяции РР на протяжении периода изучения 14 дней.
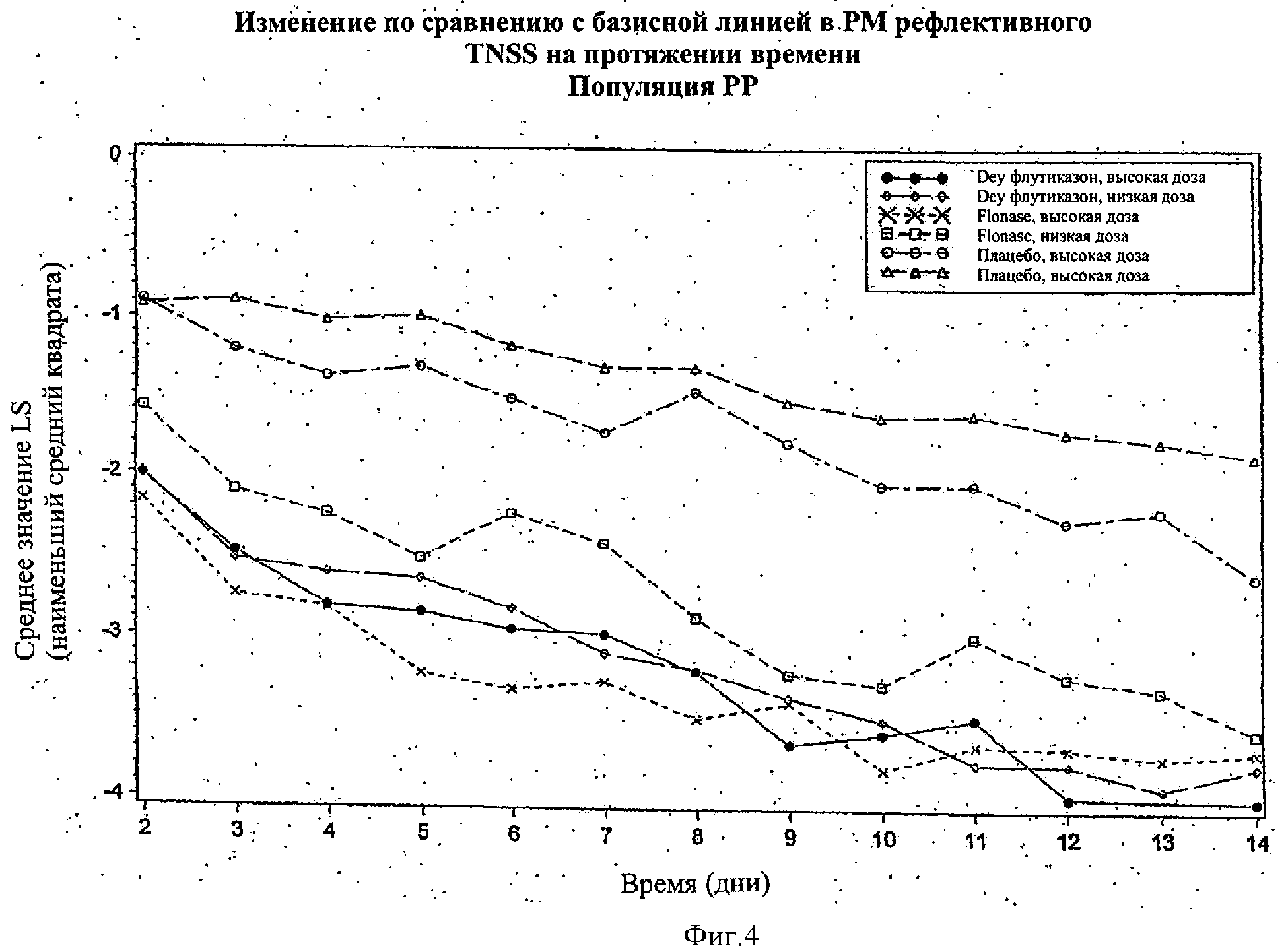
Фигура 4 показывает изменение по сравнению с базовой линией в РМ рефлективной TNSS в течение периода времени в популяции РР на протяжении периода изучения 14 дней.
V. Подробное описание изобретения
Композиции, которые предлагаются в настоящем изобретении, применяются для лечения, предотвращения и/или облегчения одного или более симптомов медицинского состояния, расстройства или заболевания. Как используется в данной заявке, лечение означает любой способ, с помощью которого один или более симптомов состояния, расстройства или заболевания облегчаются или претерпевают иное благотворное изменение. Лечение также охватывает любое фармацевтическое или медицинское применение композиций в соответствии с настоящим изобретением. Как используется в данной заявке, облегчение симптомов частного расстройства путем введения частной композиции относится к любому облегчению, либо постоянному, либо временному, длительному либо краткосрочному, которое может быть приписано или ассоциировано с введением композиции. Как таковой, который используется в данной заявке, термин «терапевтически эффективное количество» означает количество лекарственного вещества, достаточное для лечения, предотвращения и/или облегчения одного или более симптомов медицинского состояния, расстройства или заболевания. Оно также может включать безопасное и переносимое количество лекарственного вещества на основе промышленных и/или регуляторных стандартов.
В одном альтернативном воплощении композиции, которые обеспечиваются в данной заявке, используются для лечения, предотвращения и/или облегчения одного или более симптомов респираторного расстройства у индивидуума. В другом альтернативном воплощении настоящее изобретение обеспечивает композицию для лечения, профилактики и/или облегчения одного или более симптомов ринита или других родственных расстройств, при этом композиция включает один или более кортикостероидов, которые имеют специфический профиль распределения размеров частиц. В альтернативном воплощении лекарственное вещество представляет собой флутиказон или его фармацевтически приемлемую производную. Препочтительно, когда лекарственное вещество представляет собой пропионат флутиказона. Неожиданно было обнаружено, что лекарственное вещество, имеющее профили распределения размеров частиц в соответствии с изобретением, при введении интраназально субъекту, который в этом нуждается, обеспечивает повышенную биодоступность лекарственного вещества, а также повышенную и длительную эффективность по сравнению с традиционными композициями, содержащими то же лекарственное средство. Лекарственные вещества для применения в данной заявке включают любое фармацевтическое вещество, имеющее настоящий профиль распределения размеров частиц и пригодное для лечения, предотвращения и/или облегчения одного или более симптомов медицинского состояния, расстройства или заболевания, когда такое вещество вводится интраназально субъекту, который в этом нуждается.
Способ введения
Настоящие композиции могут быть упакованы для введения любым традиционным способом, предпочтительно в назальном аппликаторе, и предпочтительно таким образом, чтобы обеспечить доставку фиксированной дозы лекарственного вещества (например, активного ингредиента). Однако композиции в соответствии с настоящим изобретением могут вводиться с помощью назального применения таким образом, чтобы обеспечить доставку нефиксированной дозы лекарственного вещества. Контейнеры для введения в виде аэрозолей для различных типов назальных композиций были известны ранее и существенно все являются в равной степени приемлемыми для композиций в соответствии с настоящим изобретением, принимая во внимание то, что материалы, из которых изготовлен контейнер, являются совместимыми с композициями. Среда, содержащая лекарственное вещество и другие приемлемые ингредиенты, может содержаться в маленькой бутылочке или подобном контейнере, из которого она может быть распылена в виде тумана, направленного в каждую ноздрю. Используя окружающий воздух в качестве газа-вытеснителя, можно получить бутылочку, изготовленную из гибкого пластика так, что простое сжимание бутылочки по бокам приводило бы к распылению через форсунку в полость каждой ноздри. Воздух может также служит агентом-вытеснителем для насосного распылителя, в котором пользователь манипулирует с небольшой кнопкой насоса, накачивающего воздух в контейнер и вызывающего образование распыленной жидкости, которая испускается при обратном ударе. Альтернативно, бутылочка может быть герметизирована с газом, который является инертным для пользователя и для ингредиентов раствора. Газ может быть растворен под давлением в контейнере или может быть получен при растворении или реакции твердого материала, который образует газ в качестве продукта растворения или продукта реакции. Типичные газы, которые могут использоваться, включают азот, аргон и двуокись углерода. Кроме того, когда композиции вводятся в виде спрея или аэрозоля, композиция может находится в герметизированном контейнере, содержащем жидкий газ-вытеснитель, включая без ограничения дихлордифторметан или хлортрифторэтилен среди прочих газов-вытеснителей.
В другом альтернативном воплощении для введения в виде аэрозоля композиция в соответствии с настоящим изобретением может быть помещена в приемлемое устройство для распыления, например в насосное распылительное устройство или подобные ему. Распылительное устройство может быть обеспечено с приемлемыми средствами для доставки водного аэрозоля в ноздрю. Предпочтительно, когда оно обеспечивается со средствами, служащими для доставки существенно фиксированного объема композиции/впрыска (то есть на каждую аэрозольную единицу). В одном воплощении устройство вводит отмеренную дозу. Аэрозольная композиция может быть суспендирована или растворена в жидком газе-вытеснителе. Могут присутствовать стабилизирующие и/или суспендирующие агенты и/или сорастворители. В других воплощениях настоящего изобретения композиция в соответствии с изобретением является приемлемой для интраназального введения с помощью насоса для аэрозоля, испускающего отмеренную дозу для индивидуума, который в этом нуждается. В этой связи композиция в соответствии с настоящим изобретением может быть предварительно упакована в бутылочку с насосом для накачивания отмеренной дозы или с дозирующим распылительным насосом.
В другом альтернативном воплощении композиции в соответствии с настоящим изобретением могут вводиться в ноздрю в форме капель или любым другим способом, который приводит к местному применению для слизистой оболочки носа. Форма дозы для интраназального введения может включать растворы, суспензии или эмульсии активного соединения в жидком носителе в форме носовых капель. Приемлемые жидкие носители включают воду, пропиленгликоль и другие фармацевтически приемлемые спирты. Для введения в виде капель композиции могут быть приемлемым образом помещены в контейнер, обеспеченный, например, традиционной пипеткой/устройством для перекрывания, например, включающим пипетку или тому подобное и предпочтительно доставляющим фиксированный объем композиции/капель. Дозированные формы могут быть стерилизованными, если это требуется. Дозированные формы могут также включать вспомогательные вещества, такие как консерванты, стабилизаторы, эмульгаторы или суспендирующие агенты, смачивающие агенты, соли для варьирования осмотического давления или буферы, если это требуется.
В другом альтернативном воплощении композиции в соответствии с настоящим изобретением могут вводиться в форме порошка. Например, порошковая назальная композиция может непосредственно использоваться в виде порошка для единичной дозированной формы. Если это является желательным, то порошок может помещаться в капсулы, такие как твердые желатиновые капсулы. Содержание капсулы или устройства для единичной дозы может вводиться при использовании, например, инсуффлятора. Предпочтительно, когда это обеспечивается при использовании средств, осуществляющих дозирование существенно фиксированного количества композиции/впрыска.
Лекарственное вещество
Настоящее изобретение направлено на композиции для лечения, профилактики или облегчения одного или более симптомов состояния, расстройства или заболевания. В альтернативном воплощении настоящее изобретение направлено на композиции для лечения, профилактики или облегчения одного или более симптомов ринита или любого другого респираторного расстройства. Например, композиции, раскрытые в данной заявке, являются полезными для лечения сезонного аллергического ринита (например, сенной лихорадки) или ринита, длящегося круглый год, и неаллергического (вазомоторного) ринита.
Лекарственные вещества, приемлемые для применения в композициях в соответствии с настоящим изобретением, включают любое фармацевтически приемлемое соединение или любую его производную, включая, но не ограничиваясь, любые соли, сложные эфиры, энол, сложные эфиры энола, кислоты, основания, сольваты или их гидраты. Такие производные могут быть получены специалистом в данной области при использовании известных способов для такой дериватизации. Кроме того, лекарственные вещества для применения в композициях и способах, предлагаемых в данной заявке, включают такие соединения, которые содержат хиральные центры либо (R), либо (S) конфигураций, или их смеси (например, рацемат). Таким образом, лекарственные вещества для применения в композициях, предложенных в данной заявке, включают энантиомерно чистые соединения, их стереоизомерные или диастереоизомерные смеси. При этом понятно, что хиральные центры лекарственных веществ, предлагаемых в данной заявке, могут подвергаться эпимеризации in vivo. Таким образом, специалист в данной области признает, что введение лекарственного вещества в его (R) форме является эквивалентным для соединений, которые подверглись эпимеризации in vivo, введению соединения в его (S) форме.
Лекарственные вещества, приемлемые для применения в композициях в соответствии с настоящим изобретением, включают без ограничения кортикостероиды, такие как флутиказон и любые его фармацевтически приемлемые производные. Как используется в данной заявке, фармацевтически приемлемые производные флутиказона включают любые соли, сложные эфиры, простые эфиры энола, сложные эфиры энола, кислоты, основания, их сольваты или гидраты. Такие производные могут быть получены специалистом в данной области при использовании известных способов для такой дериватизации.
Предпочтительно, когда композиции включают пропионат флутиказона. Пропионат флутиказона представляет собой синтетический кортикостероид, который имеет эмпирическую формулу С25Н31F3O5S. Он имеет химическое наименование S-(фторметил)-6α,9-дифтор-11β-17-дигидрокси-16α-метил-3-оксоандроста-1,4-диен-17β-карботиоат, 17-пропионат и следующую структурную формулу:

Пропионат флутиказона представляет собой белый порошок с молекулярным весом 500,6 и является практически нерастворимым в воде, хорошо растворим в диметилсульфоксиде и диметилформамиде, слабо растворимым в метаноле и 95%-ном этаноле.
Профиль распределения размеров частиц
Композиции в соответствии с настоящим изобретением могут включать кортикостероид (например, пропионат флутиказона), имеющий следующий профиль распределения размеров частиц: приблизительно 10% частиц лекарственного вещества или меньше имеют размер частиц, меньший, чем 0,90 микрона; приблизительно 25% частиц лекарственного вещества или меньше имеют размер частиц, меньший, чем 1,6 микрона; приблизительно 50% частиц лекарственного вещества или меньше имеют размер частиц, меньший, чем 3,2 микрона; приблизительно 75% частиц лекарственного вещества или меньше имеют размер частиц, меньший, чем 6,10 микрона; приблизительно 90% частиц лекарственного вещества или меньше имеют размер частиц, меньший, чем 10 микрон. Неожиданно было обнаружено, что композиции, содержащие кортикостероид (например, пропионат флутиказона) и имеющие профиль распределения размеров частиц, попадающий в пределы приведенных выше интервалов, обеспечивают повышенную биодоступность по сравнению с традиционными композициями, когда вводятся интраназальным путем субъекту, который имеет такую потребность, а также имеют повышенную и длительную эффективность лекарственного средства.
Как используется в данной заявке, размер частиц относится к среднему размеру частиц, который измеряется с помощью традиционных методик измерения размеров частиц, хорошо известных специалисту в данной области, таких как седиментационный анализ фракционирования потока, фотонкорреляционная спектроскопия или дисковое центрифугирование среди прочих методик.
В альтернативном воплощении композиция в соответствии с настоящим изобретением включает лекарственное вещество, которое имеет следующий профиль распределения размеров частиц: приблизительно 10% частиц лекарственного вещества имеют размер частиц, меньший, чем 0,70 микрона; приблизительно 25% частиц лекарственного вещества имеют размер частиц, меньший, чем 1,30 микрона; приблизительно 50% частиц лекарственного вещества имеют размер частиц, меньший, чем 2,5 микрона; приблизительно 75% частиц лекарственного вещества имеют размер частиц, меньший, чем 4,0 микрона; приблизительно 90% частиц лекарственного вещества имеют размер частиц, меньший, чем 6 микрон; и больше, чем 90%, или приблизительно 100% частиц лекарственного вещества имеют размер частиц, меньший, чем 10 микрон. Предпочтительно, когда лекарственное вещество представляет собой пропионат флутиказона.
Композиции в соответствии с настоящим изобретением могут также включать лекарственное вещество, которое имеет следующий профиль распределения размеров частиц: приблизительно 10% частиц лекарственного вещества имеют размер частиц, меньший, чем 0,90, 0,75, 0,70, 0,60, 0,55, 0,50, 0,40, 0,35, 0,30, 0,25, 0,20, 0,15, 0,10 или 0,05 микрона; приблизительно 25% частиц лекарственного вещества имеют размер частиц, меньший, чем 1,6, 1,5, 1,45, 1,40, 1,35, 1,30, 1,25, 1,20, 1,15, 1,10, 1,05, 1,0, 0,95, 0,90, 0,85, 0,80, 0,75, 0,70, 0,65, 0,60, 0,55, 0,50, 0,45, 0,40, 0,35, 0,30, 0,25, 0,20, 0,15 или 0,10 микрона; приблизительно 50% частиц лекарственного вещества имеют размер частиц, меньший, чем 3,2, 3,0, 2,5, 2,4, 2,3, 2,2, 2,1, 2,0, 1,9, 1,8, 1,7, 1,6, 1,5, 1,4, 1,3, 1,2, 1,1, 0,9, 0,8, 0,7 или 0,6 микрона. Приблизительно 75% частиц лекарственного вещества имеют размер частиц, меньший, чем 6,0, 5,5, 5,0, 4,5, 4,0, 3,5, 3,4, 3,3, 3,2, 3,1, 3,0, 2.9, 2,8, 2,7, 2,6, 2,5, 2,4, 2,3, 2,2, 2,1, 2.0, 1,9, 1,8, 1,7, 1,6, 1,5 или 1,4 микрона; приблизительно 90% частиц лекарственного вещества имеют размер частиц, меньший, чем 10, 9, 8, 7, 6,9, 6,8, 6,7, 6,6, 6,5, 6,4, 6,3, 6,2, 6,1, 6,0, 5,9, 5,8, 5,7, 5,6, 5,5, 5,4, 5,3, 5,2, 5,1, 5,0, 4,9, 4,8, 4,7, 4,6, 4,5, 4,4, 4,3, 4,2, 4,1, 4,0, 3,9, 3,8, 3,7, 3,6, 3,5, 3,4, 3,3, 3,2, 3,1, 3,0, 2,9, 2,8, 2,7, 2,6, 2,5, 2,4, 2,3, 2,2 или 2,1 микрона; и больше, чем 90%, или приблизительно 100% частиц лекарственного вещества имеют размер частиц, меньший, чем 10, 9,5, 9,0, 8,5, 8,0, 7,5, 7,0, 6,5, 6,0, 5,5, 5,0, 4,5 или 4,0 микрона.
В одном предпочтительном воплощении композиция в соответствии с настоящим изобретением включает лекарственное вещество, имеющее следующий профиль распределения размеров частиц: приблизительно 10% частиц лекарственного вещества имеют размер частиц, меньший, чем 0,50 микрона; приблизительно 25% частиц лекарственного вещества имеют размер частиц, меньший, чем 0,90 микрона; приблизительно 50% частиц лекарственного вещества имеют размер частиц, меньший, чем 1,7 микрона; приблизительно 75% частиц лекарственного вещества имеют размер частиц, меньший, чем 3,5 микрона; приблизительно 90% частиц лекарственного вещества имеют размер частиц, меньший, чем 5,5 микрона.
В другом альтернативном воплощении композиция в соответствии с настоящим изобретением включает лекарственное вещество, имеющее следующий профиль распределения размеров частиц: приблизительно 10% частиц лекарственного вещества имеют размер частиц, меньший, чем 0,40 микрона; приблизительно 25% частиц лекарственного вещества имеют размер частиц, меньший, чем 0,80 микрона; приблизительно 50% частиц лекарственного вещества имеют размер частиц, меньший, чем 1,60 микрона; приблизительно 75% частиц лекарственного вещества имеют размер частиц, меньший, чем 3,0 микрона; приблизительно 90% частиц лекарственного вещества имеют размер частиц, меньший, чем 5,3 микрона.
В другом альтернативном воплощении больше, чем 90%, или приблизительно 100% частиц имеют размер частиц, меньший, чем 15 микрон, предпочтительно меньший, чем 10 микрон, более предпочтительно меньший, чем 8 микрон, наиболее предпочтительно меньший, чем 7 микрон.
В одном альтернативном воплощении такие водные суспензионные композиции являются приемлемыми для непосредственного введения субъекту интраназальным путем и представляют собой улучшенный способ по сравнению с традиционными методиками для введения лекарственных веществ интраназально, в частности флутиказона. Так, благодаря специфическому профилю распределения размеров частиц лекарственного вещества композиции в соответствии с изобретением обеспечивают повышенную биодоступность лекарственного вещества, а также улучшенную эффективность и/или длительный терапевтический эффект лекарственного вещества.
Композиция в соответствии с настоящим изобретением может обеспечиваться в виде водной суспензии. Как используется в данной заявке, суспензия включает без ограничения смеси мелких частиц твердого вещества, не образующих осадка, в жидкой фазе. В одном воплощении композиция в соответствии с настоящим изобретением представляет собой водную суспензию, содержащую от приблизительно 0,005 мас.% до 10 мас.% лекарственного вещества. В альтернативном воплощении лекарственное вещество представляет собой флутиказон.
В другом альтернативном воплощении композиция в соответствии с настоящим изобретением представляет собой водную суспензию, содержащую от приблизительно 0,005 мас.% до приблизительно 5 мас.%, или от приблизительно 0,01 мас.% до приблизительно 2,5 мас.%, или от приблизительно 0,01 мас.% до приблизительно 0,2 мас.%, или от приблизительно 0,01 мас.% до приблизительно 0,1 мас.%, или от приблизительно 0,1 мас.% до приблизительно 0,75 мас.% лекарственного вещества. В предпочтительном воплощении композиция представляет собой водную суспензию, содержащую от приблизительно 0,025 мас.% до приблизительно 1,0 мас.% лекарственного вещества, при этом лекарственное вещество предпочтительно представляет собой флутиказон. Еще более предпочтительно, когда композиция представляет собой водную суспензию, содержащую от приблизительно 0,04 мас.% до приблизительно 0,06 мас.% лекарственного вещества, при этом лекарственное вещество представляет собой пропионат флутиказона. В предпочтительном воплощении композиция в соответствии с настоящим изобретением представляет собой водную суспензию, включающую приблизительно 0,045 мас.% пропионата флутиказона, где пропионат флутиказона имеет профиль распределения размеров частиц, как раскрыто в данной заявке.
В одном альтернативном воплощении назальная композиция в соответствии с настоящим изобретением может включать консервант, суспендирующий агент, смачивающий агент, агент для регулирования осмотического давления и/или разбавитель. В одном воплощении композиции, предлагаемые в данной заявке, могут включать от приблизительно 0,01 мас.% до приблизительно 90 мас.%, или от приблизительно 0,01 мас.% до приблизительно 50 мас.%, или от приблизительно 0,01 мас.% до приблизительно 25 мас.%, или от приблизительно 0,01 мас.% до приблизительно 10 мас.%, или от приблизительно 0,01 мас.% до приблизительно 5 мас.% одного или более фармакологически приемлемых суспендирующих жидкостей, которые являются физиологически приемлемыми при введении интраназально. Фармакологически приемлемые жидкости для применения в данной заявке включают без ограничения полярные растворители, включая без ограничения соединения, которые содержат гидроксильные группы или другие полярные группы. Растворители включают без ограничения воду или спирты, такие как этанол, изопропанол, а также гликоли, включая пропиленгликоль, полиэтиленгликоль, полипропиленгликоль, гликолевый простой эфир, глицерин и спирты полиоксиэтилена. Полярные растворители также включают протонные растворители, включая без ограничения воду, водные солевые растворы с одной или более фармацевтически приемлемыми солями, спирты, гликоли или их смеси. В одном альтернативном воплощении вода для применения в настоящих композициях будет соответствовать или превышать приемлемые регуляторные требования для применения в лекарственных средствах, которые вводятся путем ингаляции.
В некоторых воплощениях данной заявки композиции в соответствии с настоящим изобретением имеют значение рН от приблизительно 2,0 до приблизительно 9,0, предпочтительно от приблизительно 4,0 до приблизительно 7,0, более предпочтительно от приблизительно 4,0 до приблизительно 5,0. Композиции в соответствии с настоящим изобретением могут необязательно содержать буфер рН. Такой буфер может содержать любые известные фармацевтически приемлемые буферы, которые являются физиологически приемлемыми для интраназального введения.
Стерильность или адекватная защита от микроорганизмов может обеспечиваться как часть настоящих композиций. Поскольку определенные композиции в соответствии с настоящим изобретением предназначены для введения интраназально, то является предпочтительным, чтобы они были свободными от патогенных организмов. Преимущество стерильных жидких суспензий заключается в том, что они снижают возможность попадания загрязняющих веществ к индивидууму, когда суспензионная композиция вводится интраназально, снижая, таким образом, вероятность оппортунистической инфекции. Процессы, которые можно рассматривать как приемлемые для достижения стерильности, могут включать любые стерилизационные этапы, известные в области техники. В одном воплощении лекарственное вещество (например, флутиказон) получают в стерильных условиях, микронизацию осуществляют в стерильной окружающей среде, смешивание и упаковку проводят в стерильных условиях. В альтернативном воплощении композиции в соответствии с настоящим изобретением могут стерильно фильтроваться и вноситься во флаконы, включая флаконы для единичной дозы, обеспечивающие стерильные единичные дозы композиции, которые используются, например, в устройстве для назальных аэрозолей. Каждый флакон с единичной дозой может быть стерильным и приемлемым образом вводиться, не затрагивая других флаконов или следующей дозы. В одном альтернативном воплощении один или более ингредиентов композиции в соответствии с настоящим изобретением могут быть стерилизованы паром, с помощью гамма-облучения или могут быть приготовлены при использовании или при смешивании стерильного порошка стероидов и других стерильных ингредиентов, в случае, если это является приемлемым. Композиции также могут быть получены и подвергнуты обработке в стерильных условиях или могут быть простерилизованы перед их упаковкой или после упаковки.
В дополнение к или вместо стерилизации композиции в соответствии с настоящим изобретением могут содержать фармацевтически приемлемый консервант для минимизации возможности микробного загрязнения. Кроме того, фармацевтически приемлемый консервант может использоваться в настоящих композициях для увеличения стабильности композиций. Следует отметить, однако, что для безопасности ингаляции должен быть выбран любой консервант, поскольку обрабатываемые ткани могут быть чувствительными к раздражителям. Консерванты, приемлемые для применения в данной заявке, включают без ограничения те, которые защищают раствор от контаминации патогенными частицами, включая фенилэтиловый спирт, хлорид бензалкония, бензойную кислоту или бензоаты, такие как бензоат натрия, и фенилэтиловый спирт. Предпочтительно, когда консерванты для применения в настоящих композициях представляют собой хлорид бензалкония. В некоторых воплощениях композиции в соответствии с данным изобретением включают от приблизительно 0,01 мас.% до приблизительно 10,0 мас.% хлорида бензалкония или от приблизительно 0,01 об./мас.% фенилэтилового спирта. Консервирующие агенты могут также присутствовать в количестве от приблизительно 0,001 мас.% до приблизительно 1 мас.%, предпочтительно от приблизительно 0,002 мас.% до приблизительно 0,02 мас.%, более предпочтительно в количестве 0,02 мас.%.
Композиции, предлагаемые в данной заявке, могут также содержать от приблизительно 0,001 мас.% до приблизительно 90 мас.%, или от приблизительно 0,001 мас.% до приблизительно 50 мас.%, или от приблизительно 0,001 мас.% до приблизительно 25 мас.%, или от приблизительно 0,001 мас.% до приблизительно 10 мас.%, или от приблизительно 0,001 мас.% до приблизительно 1 мас.% одного или более эмульгирующего агента, смачивающего или суспендирующего агента. Такие агенты для применения в данной заявке включают без ограничения жирные эфиры полиоксиэтиленсорбита или полисорбаты, включая без ограничения полиэтиленсорбитмоноолеат (Полисорбат 80), полисорбат 20 (полиоксиэтилен (20) сорбитмонолаурат), полисорбат 65 (полиоксиэтилен (20) сорбиттристеарат), полиоксиэтилен (20) сорбитмоноолеат, полиоксиэтилен (20) сорбитмонопальмитат, полиоксиэтилен (20) сорбитмоностеарат; лецитины, альгиновую кислоту; альгинат натрия; альгинат калия; альгинат аммония, альгинат кальция; пропан-1,2-диолальгинат; агар; ирландский мох; камедь плодов рожкового дерева; гуаровую камедь; трагакант; гуммиарабик, ксантановую камедь; караевую камедь; пектин; амидированный пектин; фосфатиды аммония; микрокристаллическую целлюлозу; метилцеллюлозу; гидроксипропилцеллюлозу; гидроксипропилметилцеллюлозу; этилметилцеллюлозу; карбоксиметилцеллюлозу; соли натрия, калия и кальция жирных кислот; моно- и диглицериды жирных кислот; сложные эфиры уксусной кислоты и моно- и диглицеридов жирных кислот; сложные эфиры молочной кислоты и моно- и диглицеридов жирных кислот; сложные эфиры лимонной кислоты и моно- и диглицеридов жирных кислот; сложные эфиры винной кислоты и моно- и диглицеридов жирных кислот; сложные эфиры моно- и диацетилвинной кислоты и моно- и диглицеридов жирных кислот; сложные эфиры смешанных уксусной и винной кислоты и моно- и диглицеридов жирных кислот; сложные эфиры сахарозы и жирных кислот; сахароглицериды; полиглицериновые сложные эфиры жирных кислот; сложные полиглицериновые эфиры поликонденсированных жирных кислот касторового масла; пропан-1,2-диоловые сложные эфиры жирных кислот; стеароил-2-лактилат натрия; стеароил-2-лактилат кальция; стеароилтартрат; сорбитмоностеарат; сорбиттристеарат; сорбитмонолаурат; сорбитмоноолеат; сорбитмонопальмитат; экстракт килайи; сложные эфиры полиглицерина и димеризованных жирных кислот масла соевых бобов; окислительно полимеризованное масло соевых бобов и пектиновый экстракт. В некоторых воплощениях данной заявки предлагаемые композиции включают полисорбат 80, микрокристаллическую целлюлозу, карбоксиметилцеллюлозу натрия и/или декстрозу.
Композиции в соответствии с настоящим изобретением включают от приблизительно 0,001% до приблизительно 90%, или от приблизительно 0,001% до приблизительно 50%, или от приблизительно 0,001% до приблизительно 25%, или от приблизительно 0,001% до приблизительно 10%, или от приблизительно 0,001 до приблизительно 1% одного или более наполнителей и добавок, которые являются фармакологически приемлемыми. Наполнители и добавки обычно не имеют фармакологической активности или, по крайней мере, не имеют нежелательной фармакологической активности. Их концентрация может варьировать в зависимости от выбранного агента, несмотря на то что присутствие или отсутствие этих агентов или их концентрация не является существенной чертой изобретения. Наполнители и добавки могут включать без ограничения сурфактанты, смачивающие агенты, стабилизаторы, комплексирующие агенты, антиоксиданты или другие известные в области техники добавки. Комлексирующие агенты включают без ограничения этилендиаминтетрауксусную кислоту (ЭДТА) или ее соль, такую как соль динатрия, лимонную кислоту, нитрилтриуксусную кислоту и их соли. В другом воплощении, в частности в суспензионных композициях, предлагаемых в данной заявке, комплексирующий агент представляет собой эдетат натрия. В одном воплощении композиции содержат эдетат натрия в концентрации от приблизительно 0,05 мг/мл до приблизительно 0,5 мг/мл, или от приблизительно 0,1 мг/мл до приблизительно 0,2 мг/мл. Композиции в соответствии с настоящим изобретением могут также, например, включать от приблизительно 0,001 мас.% до приблизительно 5 мас.% увлажнителя для ингибирования высушивания слизистой оболочки и предотвращения раздражения. Может использоваться любой из разнообразия фармацевтически приемлемых увлажнителей, включая, например, сорбит, пропиленгликоль, полиэтиленглиоль, глицерин или их смеси.
Композиции, предлагаемые в данной заявке, могут также содержать от приблизительно 0,001% до приблизительно 90%, или от приблизительно 0,001% до приблизительно 50%, или от приблизительно 0,001% до приблизительно 25%, или от приблизительно 0,01% до приблизительно 10% одного или более растворителей или сорастворителей для увеличения растворимости любого из компонентов настоящей композиции. Растворители или сорастворители для применения в данной заявке включают без ограничения гидроксилированные растворители или другие фармацевтические приемлемые полярные растворители, такие как спирты, включая изопропиловый спирт, гликоли, такие как пропиленгликоль, полиэтиленгликоль, полипропиленгликоль, гликолевый эфир, глицерин и спирты полиоксиэтилена. В другом воплощении композиции в соответствии с настоящим изобретением могут включать один или более традиционных разбавителей, известных в области техники. Предпочтительный растворитель представляет собой очищенную воду.
Агенты для регулирования тоничности могут включать без ограничения хлорид натрия, хлорид калия, хлорид цинка, хлорид кальция и их смеси. Другие агенты, регулирующие осмотическое давление, могут также включать без ограничения маннит, глицерин, декстрозу и их смеси. В альтернативном воплощении композиция в соответствии с изобретением может содержать от приблизительно 0,01 мас.% до приблизительно 8 мас.% или от приблизительно 1 мас.% до приблизительно 6 мас.%, предпочтительно приблизительно 5,0 мас.% агента для регуляции осмотического давления. Предпочтительный агент для регуляции осмотического давления представляет собой безводную декстрозу.
В одном альтернативном воплощении композиции в соответствии с настоящим изобретением являются стабильными. Как используется в данной заявке, стабильность композиций, предлагаемых в данной заявке, относится к продолжительности времени при данной температуре, когда в композиции присутствует больше, чем 80%, 85%, 90% или 95% от исходного количества лекарственного вещества, например беклометазона. Например, композиции, предлагаемые в данной заявке, могут храниться при температуре от приблизительно 15°С до приблизительно 30°С и оставаться стабильными, по крайней мере, 1, 2, 12, 18, 24 или 36 месяцев. Кроме того, композиции могут быть приемлемыми для введения субъекту, который в этом нуждается, после их хранения в течение более чем 1, 2, 12, 18, 24 или 36 месяцев при температуре 25°С. Кроме того, в другом альтернативном воплощении при использовании кинетики Аррениуса установлено, что более чем 80%, или более чем 85%, или более чем 90%, или более чем 95% исходного количества лекарственного вещества (например, беклометазона) сохраняется после хранения композиций более чем 1, 2, 12, 18, 24 или 36 месяцев при температуре от приблизительно 15°С до приблизительно 30°С.
Композиции в соответствии с настоящим изобретением могут быть получены с помощью любого традиционного способа путем тщательного перемешивания ингредиентов, описанных в данной заявке, при комнатной температуре или температуре выше комнатной, для того чтобы достичь растворения ингредиентов, если это является приемлемым.
Препарат лекарственного вещества, которое имеет профиль распределения размеров частиц в соответствии с настоящим изобретением, может быть получен с помощью традиционных способов, известных в уровне техники, или с помощью незначительной модификации таких способов. Например, суспензии лекарственных частиц могут подвергаться быстрому уменьшению размеров частиц при использовании методики струйной мельницы (модель жидкостного дробления при высоком давлении). Другие известные способы для уменьшения размеров частиц в микрометрическом интервале включают механическое дробление, применение энергии ультразвука и другие методики.
В одном альтернативном воплощении настоящее изобретение обеспечивает способ лечения ринита, который предусматривает этап введения субъекту, который в этом нуждается, терапевтически эффективного количества композиций, описанных в данной заявке. В одном воплощении способ по настоящему изобретению включает введение субъекту, который в этом нуждается, терапевтически эффективного количества лекарственного вещества, при этом лекарственное вещество представляет собой флутиказон, при этом лекарственное вещество имеет профиль распределения размеров частиц, описанный в данной заявке. Предпочтительно, когда лекарственное вещество представляет собой пропионат флутиказона. В некоторых воплощениях субъект представляет собой млекопитающее. В других воплощениях субъект представляет собой человека.
В одном воплощении настоящее изобретение обеспечивает способ лечения ринита, включающий этап введения субъекту, который в этом нуждается, терапевтически эффективного количества предлагаемой композиции, где композиция содержит водную суспензию, включающую от приблизительно 0,005 мас.% до приблизительно 5 мас.% флутиказона, и которая имеет профиль распределения размеров частиц, описанный в данной заявке. В некоторых воплощениях композиция является стерильной, содержит консервант и/или является стабильной.
В других воплощениях настоящее изобретение обеспечивает способ лечения ринита, предусматривающий этап введения композиций, описанных в данной заявке, интраназально субъекту, который в этом нуждается. Предпочтительно композицию вводят субъекту с помощью назального аэрозоля, предпочтительно с помощью насоса для распыления отмеренной дозы. Каждое срабатывание насоса доставляет единичную дозу лекарственного вещества субъекту.
В другом альтернативном воплощении назальный аэрозоль включает отмеренную, распыленную с помощью аэрозольного насоса единицу, содержащую микрокристаллическую суспензию пропионата флутиказона. В другом альтернативном воплощении указанная суспензия включает микрокристаллическую целлюлозу, карбоксиметилцеллюлозу натрия, декстрозу, хлорид бензалкония, полисорбат 80 и приблизительно 0,25 об./мас.% фенилэтилового спирта и имеет значение рН от приблизительно 5 до 7. После исходного прокачивания (3-6 срабатываний), каждое приведение в действие ручного насоса может доставлять приблизительно от 10 мг до приблизительно 1000 мг, от приблизительно 100 мг до приблизительно 500 мг, от приблизительно 100 мг до приблизительно 200 мкг, предпочтительно приблизительно 50 мкг пропионата флутиказона через назальный адаптер. Каждая бутылочка, содержащая композиции в соответствии с настоящим изобретением для назального аэрозоля, может обеспечивать приблизительно 20-600 отмеренных впрысков, предпочтительно от 100 до приблизительно 300 впрысков, более предпочтительно, по крайней мере, 100 отмеренных впрысков.
В альтернативном воплощении введение композиций в соответствии с настоящим изобретением может включать 1, 2, 3, 4, 5, 6, 7 или 8 ингаляций настоящей композиции в каждую ноздрю один, два, три, четыре или пять раз в сутки. Каждая ингаляция может содержать от приблизительно 1 мкг до приблизительно 100 мкг или от приблизительно 1 мкг до приблизительно 100 мкг, предпочтительно от приблизительно 30 мкг до приблизительно 100 мкг, более предпочтительно от приблизительно 30 мкг до приблизительно 80 мкг, или приблизительно 50 мкг. Общая доза в сутки лекарственного вещества может включать от приблизительно 10 мкг до приблизительно 1000 мкг, от приблизительно 10 мкг до приблизительно 500 мкг, от приблизительно 10 мкг до приблизительно 400 мкг, или от приблизительно 10 мкг до приблизительно 300 мкг, предпочтительно от приблизительно 100 мкг до приблизительно 200 мкг, более предпочтительно приблизительно 200 мкг.
В другом альтернативном воплощении введение настоящей композиции может включать одну и только одну ингаляцию в каждую ноздрю в сутки. В одном альтернативном воплощении исходная доза настоящей композиции может содержать одну и только одну ингаляцию в каждую ноздрю один раз в сутки. В другом альтернативном воплощении такая исходная доза является приемлемой для взрослых. Каждая ингаляция может включать от приблизительно 10 мкг до приблизительно 200 мкг, предпочтительно приблизительно 100 мкг, более предпочтительно приблизительно 50 мкг флутиказона.
Введение одной и только одной ингаляции в каждую ноздрю является более благоприятным и предпочтительным по сравнению с традиционными режимами в соответствии с уровнем техники, которые требует больше ингаляций в каждую ноздрю в сутки. Например, другие известные назальные аэрозоли, например продукты на основе флутиказона, требуют 1 или 2 ингаляций (от 42 до 84 мкг) в каждую ноздрю два раза в сутки (общая доза 168-336 мкг/сутки). В противовес этому, композиции в соответствии с настоящим изобретением могут требовать одной или только одной ингаляции в каждую ноздрю в сутки. Путем снижения дозы или количества ингаляций в сутки индивидууму, вероятно, было бы возможно соблюдать режим или расписание введения регулярных доз для достижения адекватного ослабления и, таким образом, улучшения качества жизни пациента по сравнению с другими традиционными режимами лечения. Кроме того, введение меньшего количества ингаляций обеспечивает индивидууму больше возможности для осуществления других медикаций во время лечения, таких как, например, применение других стероидов, которые вводятся перорально или в форме ингаляции, снижая, таким образом, вероятность передозировки или перекрестной реакции между лекарственными средствами. Кроме того, обеспечение меньшего количества ингаляций будет снижать вероятность привыкания к лекарственному средству в назальной композиции. Более того, осуществление меньшего количества ингаляций может снизить токсичность и неблагоприятные события, которые ассоциируются с двумя или более ингаляциями конкретного лекарственного вещества в каждую ноздрю в сутки. Индивидуумы, обладающие гиперчувствительностью к двум или более дозам конкретного лекарственного вещества, также получат выгоду от приема одной и только одной дозы в сутки.
Настоящие композиции могут быть упакованы как наборы или системы, которые необязательно содержат другие компоненты, включая инструкции по применению композиций. Изделия, являющиеся полезными для лечения, предотвращения или облегчения одного или более симптомов медицинского состояния, расстройства или заболевания (например, ринита), содержат упаковочный материал и композицию в нем, а также этикетку, указывающую на то, что композиция используется для лечения, предотвращения или облегчения одного или более симптомов заболеваний или расстройств, ассоциированных с нежелательным и/или неконтролируемым ринитом.
VI. Пример
Следующий пример включен только с иллюстративной целью и не предназначен для ограничения объема изобретения.
Слепое, рандомизированное, плацебо-контролируемое, мультицентровое исследование осуществляли для оценки безопасности и эффективности назального спрея Dey пропионата флутиказона 50 мкг у подростков и взрослых пациентов с сезонным аллергическим ринитом. Первичной задачей этого исследования было определить безопасность и эффективность назального спрея Dey пропионата флутиказона 50 мкг (Dey-FP) по сравнению с плацебо на протяжении 2 недель лечения у взрослых и подростков с сезонным аллергическим ринитом (SAR); вызванным пыльцой горного кедра. Вторичная задача заключалась в установлении сравнимости Dey-FP с назальным аэрозолем FLONASE® 50 мкг в течение 2 недель лечения у взрослых пациентов и подростков с SAR, вызванным пыльцой горного кедра.
Исследование было рандомизированным, мультицентровым (7 сайтов), предполагало 3 вида лечения (Dey-FP, FLONASE® и плацебо), 2 уровня (высокая и низкая доза), плацебо-контролируемые повторные исследования, которые осуществляли в США во время сезона появления аллергической пыльцы горного кедра в 2001/2002 годах. Продолжительность исследования составляла 3 недели и изучение состояло из 2 фаз: базовый период скрининга продолжительностью 1 неделя для получения ежедневных данных, после чего осуществляли 2-недельную рандомизированную пациент-слепую фазу лечения. Пациентов наблюдали на амбулаторной основе на День - 7, День 1, День 7 и День 14. Начальный период базисного скрининга для получения ежедневных данных начинался с первой недели (День - 7±2 дня) перед рандомизацией для осуществления лечения. Пациенты, которые соответствовали критериям пригодности (критерии включения/исключения и завершение процедур исследования базовой линии (в пределах 30 дней от Дня - 7), получали номер, а также стандартный пероральный антигистаминовый препарат в качестве экстренной спасательной медикации, а также дневник для оценки значения общей назальной симптоматики пациента (TNSS). Пациенты ежедневно регистрировали TNSS (сумма признаков и симптомов для выделений из носа, закладывания носа, чихания и зуда в носу) в своих дневниках, оценивая каждый из показателей в интервале от 0 до 3, при этом 0 означал отсутствие симптомов, 3 означало наличие тяжелых симптомов. Также регистрировали количество принятого антигистаминового препарата.
Через неделю при наличии вывода относительно базового периода скрининга пациенты возвращались в место исследования и подвергались повторной оценке на пригодность. Пациенты, которые не заполняли дневники или более не соответствовали критериям, приостанавливали исследование. Пациентов, которые соответствовали всем критериям, потом подвергали рандомизации в группы лечения 1-6: Dey-FP, высокая доза, Dey-FP, низкая доза, FLONASE, высокая доза, FLONASE, низкая доза, Плацебо, высокая доза, или Плацебо, низкая доза. Пациент-слепая фаза лечения (День 1 - День 14) состояла из однократного самостоятельного лечения (1-2 впрыска в каждую ноздрю на введение). На День 7 и День 14 (или в более ранний период окончания) пациенты возвращались в место исследования и подвергались оценке. Оценки эффективности включали ежедневную суточную рефлективную и немедленную информацию относительно TNSS, общие оценки пациента и лечащего врача и применение экстренной спасательной медикации. Оценки безопасности представляли собой частоту возникновения неблагоприятных событий, клинические лабораторные анализы, обследование лечащего врача, измерение витальных признаков, результаты ЭКГ (смотри график обследования). Подсчет пыльцы, температуру наружного воздуха, выпадение осадков и влажность также подвергали мониторингу и регистрировали в каждом месте исследования.
- история от умеренного до тяжелого SAR, вызываемого пыльцой горного кедра в течение, по крайней мере, 2 лет, для индивидуумов в возрасте 12 лет и больше;
- подтвержденная IgE-опосредованная гиперчувствительность к пыльце горного кедра в пределах последних 12 месяцев (необходим позитивный результат);
- минимальное значение TNSS 8 при максимальном 12 (либо AM, либо РМ при 12-часовой оценке) в течение, по крайней мере, 3 дней во время базового периода, одно из которых должно быть в пределах 3 дней от Дня 1;
- если использовали иммунотерапию, то поддерживали стабильный режим в течение 30 дней перед вступлением в исследование;
- хорошее общее состояние здоровья, отсутствие заболеваний или сопутствующего лечения, которое может препятствовать интерпретации результатов исследования;
- письменное согласие/разрешение педиатра;
- готовность выполнять процедуры исследования.
Пациенты, которые соответствовали всем критериям, были потом подвергнуты рандомизации на группы лечения 1-6: (1) Dey-FP 50 мкг, низкая доза (100 мкг) - 1 впрыск в каждую ноздрю ежедневно; (2) Dey-FP 50 мкг, высокая доза (100 мкг) - 1 впрыск в каждую ноздрю два раза в день ежедневно; (3) назальный аэрозоль FLONASE®, низкая доза (100 мкг) - 1 впрыск в каждую ноздрю ежедневно; (4) FLONASE®, высокая доза (200 мкг) - 1 впрыск в каждую ноздрю ежедневно два раза в день; (5) Плацебо - 1 впрыск в каждую ноздрю один раз в день; и (6) Плацебо - 1 впрыск в каждую ноздрю два раза в день.
Первичная конечная точка для этого лечения представляла собой изменение по сравнению с базовой линией объединенного (AM и РМ) 12-часового отражающего TNSS в течение периода лечения 2 недели. Первичный анализ конечной точки представлял собой сравнение Dey-FP, низкая доза, против Плацебо, высокая и низкая дозы, суммарно (Дни 2-14) и в Дни 7 и 14. TNSS объединенного AM плюс РМ 12-часовой оценки значений выделений из носа, закладывания носа, чихания, зуда в носу регистрировалась ежедневно два раза в день в карточке дневника TNSS. Базовую линию определяли как среднее значение вводного периода объединенного (AM плюс РМ) 12-часового рефлективного TNSS из 7 календарных дней ±2 дня, предшествующих Дню 1.
Вторичные конечные точки для этого исследования включали:
- изменение по сравнению с базовой линией объединенных AM плюс РМ 12-часового рефлективного общего TNSS (Дни 2-14) пациентов;
- изменение по сравнению с базовой линией объединенных AM плюс РМ 12-часового рефлективного TNSS в Дни 7 и 14 пациентов;
- изменение по сравнению с базовой линией AM 12-часового рефлективного TNSS пациентов;
- изменение по сравнению с базовой линией РМ 12-часового рефлективного TNSS пациентов;
- процентное изменение по сравнению с базовой линией объединенного (AM плюс РМ) 12-часового рефлективного TNSS пациентов;
- процентное изменение по сравнению с базовой линией AM 12-часового рефлективного TNSS пациентов;
- процентное изменение по сравнению с базовой линией РМ 12-часового рефлективного TNSS пациентов;
- процентное изменение по сравнению с базовой линией 1- и 2-недельной постбазовой линии по площади под кривой концентрации (AUC) объединенного (AM плюс РМ) 12-часового рефлективного TNSS пациентов;
- изменение по сравнению с базовой линией 1- и 2-недельной постбазовой линии для AUC AM 12-часового рефлективного TNSS пациентов;
- изменение по сравнению с базовой линией 1- и 2-недельной постбазовой линии для AUC РМ 12-часового рефлективного TNSS пациентов;
- изменение по сравнению с базовой линией объединенного (AM плюс РМ) немедленного TNSS пациентов;
- изменение по сравнению с базовой линией AM немедленного TNSS у пациентов;
- изменение по сравнению с базовой линией РМ немедленного TNSS у пациентов;
- общая оценка пациентом изменения в признаках SAR и симптомах;
- общая оценка лечащим врачом изменения в признаках SAR и симптомах;
- применение экстренной спасательной медикации.
Вторичные конечные точки эффективности сравнивали между группами лечения.
Как рефлективное, так немедленное изменение по сравнению с базовой линией 12-часового (объединенные и индивидуальные AM и РМ) TNSS для первичных и вторичных переменных сравнивали между группами при использовании анализа смешанного эффекта вариантной (ANOVA) модели с лечением (Дни 2-14) и взаимодействия лечения по дням как фиксированных эффектов и пациентов как случайного эффекта. Площадь под кривой (AUC) 12-часового (AM плюс РМ, объединенных и индивидуальных) рефлективного TNSS подсчитывали для периода базовой линии. Недели 1 и Недели 2 постбазовой линии при использовании трапезоидального способа. Изменение по сравнению с базовой линией сравнивали по группам при использовании подобной модели ANOVA, как описано для переменной первичной эффективности. Общую оценку пациентом и лечащим врачом изменения по сравнению с базовой линией в SAR симптомах сравнивали между группами при использовании однонаправленной модели ANOVA. Частота применения экстренной спасательной медикации, а также процент пациентов, для которых была необходима экстренная спасательная медикация, сравнивали при использовании анализа хи-квадрата Пирсона. Среднее число таблеток экстренной спасательной медикации сравнивали при использовании модели ANOVA. Все статистические анализы осуществляли как для популяции, имеющей намерение лечиться (ITT), так и для популяции в соответствии с прописью (РР). Отсутствующие наблюдения TNSS в популяции ITT оценивали при использовании метода последнего наблюдения, перенесенного на другой счет (LOCF). Все выведенные статистические сведения получали против двусторонней альтернативной гипотезы при уровне значимости 0,05.
В общей сложности было зарегистрировано и подвергнуто рандомизации 774 пациента для 1-6 групп лечения в 7 исследовательских центрах, расположенных в США, во время сезона аллергии на пыльцу горного кедра 2001/2002 года, включая 1 пациента, который был зарегистрирован в двух отдельных местах (Пациент 02-044 и 05-056 был одним и тем же пациентом). Данные относительно пациента 02-044 исключали из анализа всей популяции за исключением рандомизированной популяции пациентов, поскольку этот пациент получал исследуемое лекарственное средство. Данные пациента 05-056 включались в анализ популяции, поскольку регистрация в сайте 5 предшествовала регистрации во втором сайте, сайте 2. Популяция пациентов, которые имели намерение лечиться (ITT), таким образом, состояла из 773 пациентов (774 рандомизированных пациента минус пациент 02-044). Распределение было следующим: 129 пациентов в группе Dey-FP, высокая доза, 129 пациентов в группе Dey-FP, низкая доза, 127 пациентов в группе FLONASE, высокая доза, 129 пациентов в группе FLONASE, низкая доза, 131 пациент в группе Плацебо, высокая доза и 128 пациентов в группе Плацебо, низкая доза. В общей сложности 752 (97,3%) пациентов из исходных 774 заканчивали исследование, а 22 пациента (2,8%) приостанавливали его раньше времени, 8 из них по причине АЕ. Пациенты были преимущественно белокожими (>90%) и особями женского пола (>59%). Среднее значение возраста колебалось от 37,55 до 42,01 года (интервал максимального-минимального возраста = от 12,1 до 78,9 лет) в группах лечения. Пациенты имели среднее значение кожной реакции при контрольном введении антигена в пределах от 7,5 до 8,5 мм. Свыше половины всех пациентов (> 58%) не имело предшествующей истории применения флутиказона.
Все группы активного лечения (Dey-FP и FLONASE) продемонстрировали снижение TNSS в течение 2-недельного периода лечения. Несмотря на то что проверяли эффективность конечной точки (то есть 12-часовое рефлективное TNSS, немедленное TNSS, изменения в AUC), эффект лечения был высокозначимым, как и дневной, (длительность лечения) эффект (р=0,0000), что свидетельствовало об улучшении в TNSS. Как группы Dey-FP, так и группы FLONASE, низкая доза, были такими, которые статистически превосходили плацебо для двух анализов конечных точек как первичной, так и вторичной эффективности, которые представляли собой группы лечения Dey-FP, высокая доза, и FLONASE, высокая доза. Эффекты суточного лечения (в среднем Дни 2-14) и недельного лечения не были статистически значимыми, что свидетельствовало о том, что группы лечения вели себя подобно на протяжении всего периода лечения, за исключением амплитуды улучшения TNSS. Не было статистической значимой разницы между группами Dey-FP и FLONASE, высокая и низкая дозы для любого из анализов эффективности конечных точек (ослабление признаков и симптомов SAR). Кроме того, все группы активного лечения были последовательно статистически превосходящими группы Плацебо, высокая и низкая дозы. Результаты анализов популяции в соответствии с прописью были параллельными таковым для популяции ITT для всех переменных эффективности.
На Фигурах 1-4 эффективность назальных композиций выражали как изменение по сравнению с базовой линией (предварительная обработка) в составном значении назальных симптомов (например, выделения из носа, чихание, зуд в носу и закладывание носа), которые указаны как общие значения назальных симптомов (TNSS). Изменение по сравнению с базовой линией в значениях TNSS выражали в абсолютных единицах (либо как процент отличия от базовой линии). Используя анализ вариантной модели (ANOVA), получали значение наименьшего среднего квадрата (значение LS) для базовой линии (позитивное значение) и изменение по сравнению с базовой линией (негативное значение, если симптом улучшен). Более высокое негативное значение наблюдали в значении LS, наиболее высоким было изменение (улучшение) TNSS.
Таблица 1 показывает распределение размеров частиц флутиказона в Dey-FP, размер частиц при этом выражен в микронах. Таблица 2 также показывает распределение размеров частиц флутиказона в другой партии Dey-FP, размер частиц при этом выражен в микронах. Таблица 3 показывает состав композиции Dey-FP.
Фигуры и приложения в данной заявке проставлены только для иллюстративных целей. Они не предназначены для ограничения объема изобретения. Кроме того, при этом понятно, что различные изменения и модификации к представленному воплощению, описанному в данной заявке, будут очевидны для специалиста в данной области. Такие изменения и модификации могут быть осуществлены без отступления от духа и буквы настоящего изобретения и без снижения присущих ему преимуществ. Таким образом, предполагается, что такие изменения и модификации охватываются прилагаемыми пунктами формулы изобретения. Изобретение может приемлемым образом включать, состоять или существенно состоять из элементов или этапов, описанных в данной заявке. Кроме того, изобретение, описанное тут, приемлемым образом может включать или может осуществляться при отсутствии любого элемента или этапа, который специфически не раскрыт в данной заявке. Более того, один или более этапов, описанных в данной заявке, могут осуществляться одновременно с другим этапом.
Реферат
Настоящее изобретение относится к области лекарственных средств, в частности к назальной фармацевтической композиции для лечения или ослабления симптомов ринита, включающей водную суспензию твердых частиц флутиказона, имеющих следующий профиль распределения размеров частиц: приблизительно 10% частиц имеют размер, меньший, чем 0,90 микрона; приблизительно 25% частиц имеют размер, меньший, чем 1,6 микрона; приблизительно 50% частиц имеют размер, меньший, чем 3,2 микрона; приблизительно 75% частиц имеют размер, меньший, чем 6,2 микрона; приблизительно 90% частиц имеют размер, меньший, чем 10,0 микрон; где композиция является приемлемой для интраназального введения в слизистую оболочку носа индивидуума. Кроме того, изобретение относится с способам лечения указанных заболеваний. Указанная композиция обеспечивает улучшение терапевтической эффективности при малой дозе флутиказона. 8 н. и 50 з.п. ф-лы, 4 ил., 3 табл.
Формула
приблизительно 10% частиц имеют размер, меньший, чем 0,90 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 1,6 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 3,2 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 6,2 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 10,0 мкм;
где композиция является приемлемой для интраназального введения в слизистую оболочку носа индивидуума.
приблизительно 10% частиц имеют размер, меньший, чем 0,70 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 1,30 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 2,5 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 4,0 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 6,0 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,50 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 0,90 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 1,70 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 3,5 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 5,5 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,40 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 0,80 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 1,60 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 3,0 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 5,30 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,90 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 1,6 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 3,2 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 6,2 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 10,0 мкм;
где композиция является приемлемой для введения в слизистую оболочку носа индивидуума.
приблизительно 10% частиц имеют размер, меньший, чем 0,90 мкм;
приблизительно 25% имеет размер частиц, меньший, чем 1,6 мкм;
приблизительно 50% имеют размер частиц, меньший, чем 3,2 мкм;
приблизительно 75% имеют размер частиц, меньший, чем 6,2 мкм и приблизительно 90% имеют размер частиц, меньший, чем 10,0 микрон, при этом композиция является приемлемой для введения в слизистую оболочку носа индивидуума.
приблизительно 10% частиц имеют размер, меньший, чем 0,70 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 1,30 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 2,5 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 4,0 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 6,0 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,50 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 0,90 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 1,70 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 3,5 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 5,5 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,40 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 0,80 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 1,60 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 3,0 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 5,30 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,90 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 1,6 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 3,2 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 6,2 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 10,0 мкм;
где композиция, включающая по меньшей мере один комплексообразующий агент, выбранный из группы, состоящей из ЭДТА, лимонной кислоты, нитрилтриуксусной кислоты, их солей и эдетата натрия, является приемлемой для интраназального введения в слизистую оболочку носа индивидуума.
приблизительно 10% частиц имеют размер, меньший, чем 0,70 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 1,30 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 2,5 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 4,0 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 6,0 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,50 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 0,90 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 1,70 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 3,5 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 5,5 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,40 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 0,80 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 1,60 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 3,0 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 5,30 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,90 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 1,6 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 3,2 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 6,2 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 10,0 мкм;
где композиция дополнительно включает комплексообразующий агент и указанная композиция является приемлемой для интраназального введения индивидууму.
приблизительно 10% частиц имеют размер, меньший, чем 0,70 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 1,30 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 2,5 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 4,0 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 6,0 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,50 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 0,90 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 1,70 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 3,5 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 5,5 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,40 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 0,80 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 1,60 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 3,0 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 5,30 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,50 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 0,90 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 1,70 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 3,5 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 5,5 мкм.
(a) микрокристаллическая целлюлоза;
(b) карбоксиметилцеллюлоза натрия;
(c) декстроза;
(d) хлорид бензалкония;
(e) полисорбат 80;
(g) фенилэтиловый спирт.
приблизительно 10% частиц имеют размер, меньший, чем 0,90 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 1,6 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 3,2 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 6,2 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 10,0 мкм;
где композиция является приемлемой для введения индивидууму интраназально.
приблизительно 10% частиц имеют размер, меньший, чем 0,70 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 1,30 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 2,5 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 4,0 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 6,0 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,50 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 0,90 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 1,70 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 3,5 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 5,5 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,40 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 0,80 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 1,60 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 3,0 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 5,30 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,90 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 1,6 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 3,2 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 6,2 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 10,0 мкм;
где указанная композиция является приемлемой для введения индивидууму интраназально и содержит от приблизительно 5 мкг до 100 мкг флутиказона.
приблизительно 10% частиц имеют размер, меньший, чем 0,70 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 1,30 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 2,5 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 4,0 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 6,0 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,50 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 0,90 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 1,70 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 3,5 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 5,5 мкм.
приблизительно 10% частиц имеют размер, меньший, чем 0,40 мкм;
приблизительно 25% частиц имеют размер, меньший, чем 0,80 мкм;
приблизительно 50% частиц имеют размер, меньший, чем 1,60 мкм;
приблизительно 75% частиц имеют размер, меньший, чем 3,0 мкм;
приблизительно 90% частиц имеют размер, меньший, чем 5,30 мкм.

Комментарии