Фармацевтическая композиция для интраназального введения (варианты), распылительное устройство и фармацевтическая упаковка - RU2097064C1
Код документа: RU2097064C1
Чертежи
Описание
Данное изобретение относится к фармацевтическим композициям, в состав которых входит кальцитонин, и к распылительному устройству для введения указанных композиций в нос.
Более узко данное изобретение относится к фармацевтическим композициям, активным компонентом которых является кальцитонин, причем указанные композиции не содержат консервантов и поверхностно-активных добавок.
Еще более узко данное изобретение относится к фармацевтическим композициям, предназначенным для введения в нос, в состав которых входит кальцитонин предпочтительно кальцитонин лососевых рыб в виде раствора в физиологическом солевом растворе, pH которого доведено до величины 3,5-4,5 с помощью хлористоводородной кислоты.
Известно, что кальцитонины представляют собой особое значение для лечения остеопороза, болезни Педжета, гиперкальцемии и аналогичных патологических состояний. Известно, что, вследствие полипептидной природы, кальцитонины легко расщепляются: поэтому их нельзя вводить перорально. С другой стороны, парентеральное введение кальцитонина путем инъекций связано со значительными неблагоприятными эффектами, в частности, вызывает болезненную реакцию у пациента.
Введение в нос лекарств на основе полипептидов также широко описано в литературе, смотри, например, Felber et al. Experientia, 1969, c. 1195; Gennser et al. Lancet, 1974, c. 865; Greenberg et al. Antimicrobial Agents and Chemotherapy, 1978, c. 596; Berggnist et al. Lancet, 1979, c. 215; Pontiroli et al. British Medical Journal, 1982, c. 203, кроме того, ряд патентов или заявок на патент, рассматривающих введение в нос инсубина (ЕР N 94157), вазопрессина (заявки патентов Японии N 55066517, N 55055120), полипептидов различной природы (патенты Германии N 2256445 и N 2758483, Европатент N 252, патент Бельгии N 860717, патент Южно-Африканской Республики N 68/4241).
Введение кальцитонина в нос также раскрывается в ряде патентов. Так, в патенте Италии N 1172324 описаны медицинские композиции, в состав которых входит кальцитонин, отличающиеся тем, что, помимо активного компонента, они содержат бензалконийхлорид или поверхностно-активное вещество, в частности, неионный поверхностно-активный агент, или обе вышеупомянутые добавки. В качестве поверхностно-активных добавок заявлены, в частности, высшие предельные спирты или эфиры стерина с полиоксиалкиленами.
Указывается, что и поверхностно-активные вещества, и бензалконийхлорид являются необходимыми ингредиентами, обеспечивающими хорошую биологическую доступность кальцитонина, то есть эффективную его адсорбцию слизистой оболочкой носа; бензалконийхлорид служит также как консервант против воздействия патогенных или нежелательных микроорганизмов.
Аналогичные композиции, также содержащие четвертичную соль аммония (бензалконийхлорид, цетилтриметиламмонийбромид), заявлены в ЕР-А-193372.
Заявка патента Японии N 61126034 раскрывает препараты для введения в нос на основе кальцитонина, в состав которых входят способствующие всасыванию агенты, такие как глюкоза и/или глюкозамин; необходимость введения агента, способствующего улучшению абсорбции, подчеркивается также в заявке патента Японии N 61118325, где предлагается использовать для этой цели аминокислоты, и в ЕР-А-183527, где, напротив, предлагается вводить в качестве усилителя абсорбции бензиловый спирт, этанол, салициловую кислоту, капроновую кислоту, полиэтиленгликоль и др. Далее, в ЕР-А-111841, ЕР 115627 и ЕР 156772 заявлены композиции, предназначенные для введения в нос, в состав которых входит кальцитонин в сочетании с поверхностно-активными добавками, в качестве которых предлагается использовать желчные кислоты и бензалконийхлорид. В частности, в ЕР 156772 описана композиция для введения в нос, содержащая кальцитонин, хлорид натрия, бензалконийхлорид, воду и имеющая pH 3,7.
Однако, присутствие четвертичных солей аммония нежелательно, вследствие возможных неблагоприятных эффектов (Am. S. Ophthalmol 1988, 105 (6), c. 670-3; Contact Dermatitis 1987, 17 (1), c. 41-2; Cutis 1987, 39 (5), p. 381-3). Следовательно, представляется более желательным обеспечить композиции для введения в нос на основе кальцитонина, не содержащие указанных солей.
Все приведенные выше публикации однозначно указывают на необходимость повышения указанной биологической доступности с помощью поверхностно-активных веществ различной природы, которые активизируют всасывание кальцитонина через слизистую носа.
Таким образом, представляется действительно удивительным открытие того факта, что практически не различаются биологическая доступность и характеристики хранения у композиций для введения в нос на основе кальцитонина, содержащих поверхностно-активные добавки различного типа или любые агенты, способствующие всасыванию через слизистую носа, и композиций, содержащих только кальцитонин в водном растворе хлорида натрия концентрации, близкой к физиологическому раствору.
Таким образом, цель данного изобретения
достигается посредством фармацевтической композиции для
интраназального введения, содержащей компоненты в следующих количествах:
Кальцитонин, МЕ 100-500
Хлористый натрий, мг 9
Соляная кислота до pH 3,5-4,5
Очищенная вода
остальное до объема 1 мл.
Вариантом композиции по данному изобретению является композиция, содержащая:
Салькатонин,
МЕ 500
Хлористый натрий, мг 9
Соляную
кислоту до pH 4
Очищенную воду остальное до объема 1 мл.
Другим вариантом композиции является композиция,
содержащая:
Салькотонин, МЕ 1000
Хлористый натрий,
мг 9
Соляную кислоту до pH 4
Очищенную воду до объем 1 мл.
Как ясно видно, преимущества композиций по данному изобретению по сравнению с известными заключаются не только в возможности избежать введения четвертичных аммониевых солей, но также и в исключении активаторов всасывания кальцитонина, введение которых до сих пор предполагалось необходимым.
Указанные активаторы, по существу, приводят к удорожанию исходных материалов и повышению стоимости обработки.
Согласно предпочтительному варианту исполнения, данное изобретение включает распылительное устройство, предназначенное для впрыскивания в нос указанных препаратов, которое состоит из сосуда (1), в который помещается композиция, и дозирующего устройства, присоединенного к горлу сосуда, причем это распылительное устройство отличается дополнительно тем, что пространство в верхней части указанного сосуда заполнено азотом под давлением.
Сосуды для распылителей описанного типа известны, например, описаны в заявке Франции N 2313945, но отличаются рядом недостатков; в частности, представляется затруднительным обеспечение герметичности заключенной внутри сосуда жидкости, особенно любого добавляемого в нее жира.
Сосуд для распылителя по данному изобретению позволяет снять вышеупомянутые проблемы благодаря особой конструкции дозирующего безклапанного устройства всасывания-выталкивания (как правило, обычно это клапан шарикового типа), которая препятствует выбросу содержимого сосуда через насос и в рабочем, и в нерабочем состоянии.
Дозирующее устройство, кроме того, снабжено уплотнительным кольцом, плотно насаженным на горло сосуда и обеспечивающим герметичность, что препятствует газообмену с внешней атмосферой в обоих направлениях и изнутри наружу, и наоборот.
Пространство в верхней части сосуда заполняется азотом, что обеспечивает избыточное давление 0,2-0,3 бар. Это избыточное давление предназначено для компенсации потери жидкости при впрыскивании, что позволяет использовать полностью все содержимое сосуда и препятствует встречному потоку воздуха снаружи. Это представляется особенно благоприятным, если подумать, что контакт жидкой фармацевтической композиции, которая находится в сосуде, с воздухом может привести к распаду активного начала композиции, а также к бактериальному загрязнению последней и нанести, таким образом, вред человеку, который применяет указанную композицию.
Сосуд снабжен "отстойником"; емкость сосуда около 7 мл; дозирующее устройство первичного сжатия выбрасывает за одну операцию около 100 мкл, что соответствует терапевтически эффективной дозе активного начала.
Конструкция дозирующего устройства включает пустотелый кожух, представляющий собой ряд камер различного поперечного сечения, который расположен в шейке сосуда посередине указанного уплотнительного кольца и который прикрепляется к сосуду с помощью капсулы, часть которой, прилегающая к дну, вращается относительно круглого внешнего бортика шейки сосуда.
В пустотелый кожух дозирующего устройства входит пустотелый поршень, который прижимается пружиной к седлу клапана, образующемуся в стержне поршня, выступающем над верхним краем сосуда.
Нажатие стержня поршня вызывает выбрасывание жидкости, заключенной в торообразной камере, которая расположена между внешней поверхностью поршня и внутренней поверхностью наибольшей секции кожуха насоса.
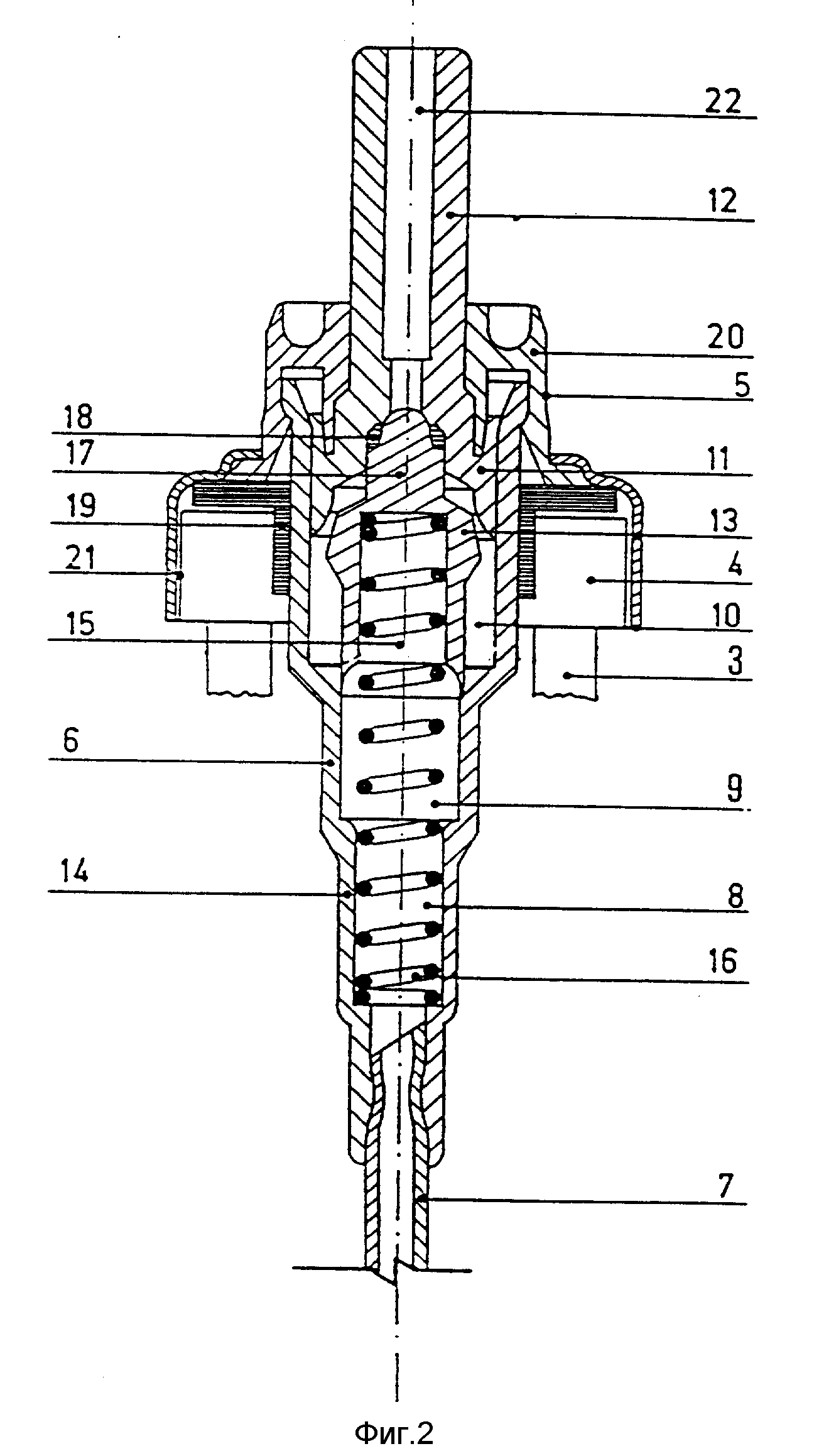
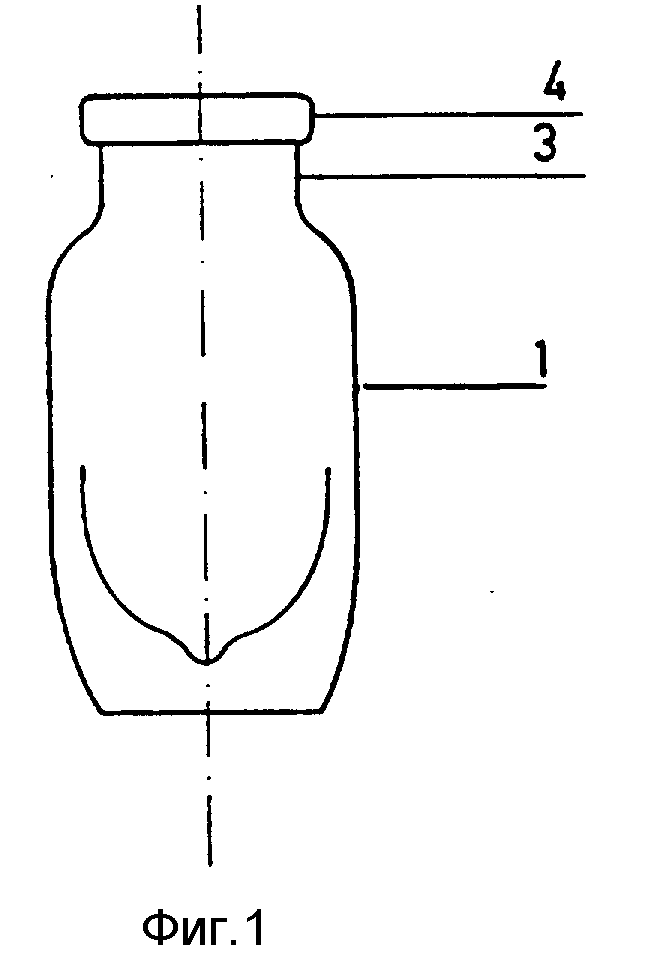
Более подробно конструкция распылительного устройства для впрыскивания композиции поясняется чертежами, где на фиг. 1 изображен увеличенный вид сбоку сосуда, воплощающего данное изобретение; на фиг. 2 разрез, показывающий в увеличенном масштабе дозирующее устройство, присоединяемое к шейке сосуда, изображенного на рис. 1.
На фиг. номером 1 обозначен стеклянный сосуд, снабженный на дне отстойником 2, емкостью предпочтительно около 7 мл.
Сосуд 1 имеет шейку 3 и приподнятый верхний круглый ободок 4.
К сосуду 1 смонтировано и прикреплено дозирующее устройство 5 (фиг. 2), которое сконструировано таким образом, чтобы за одну операцию выбрасывать примерно 100 мкл жидкости.
Дозирующее устройство 5 включает пустотелый кожух 6, расположенный в сосуде 1, к нижней части которого прикрепляется плунжер.
Пустотелый кожух 6 включает, если смотреть снизу вверх, три камеры 8, 9 и 10 последовательно увеличивающегося сечения, верхнее из которых расположено таким образом, чтобы принимать основание 11 пустотелого стержня поршня 12, имеющего достаточную длину и выступающего над верхней кромкой сосуда 1.
В кожухе насоса 6 располагается поршень 13, который плотно скользит внутри камеры 9 и который в нормальном состоянии выталкивается пружиной 14 клапана, часть которой, один конец, располагается в выемке 15 поршня 13, а другой конец упирается в круглый выступ 16, который расположен на днище самой нижней камеры 8 кожуха 6.
Головка 17 поршня 13 функционирует как клапанное устройство и в нормальном состоянии прижимается пружиной 14 к седлу клапана 18, которое образуется в основании 11 стержня поршня 12.
Уплотняющее кольцо из силиконовой резины располагается между кожухом насоса 6 и горловиной сосуда 1 и служит в качестве герметичного уплотнения, которое препятствует не только вытеканию жидкости из сосуда, но и газообмену с внешней средой в любом направлении.
Над отверстием сосуда 1 закрепляется капсула 20 из пластичного материала, в центре которой имеется отверстие для прохождения стержня поршня 12 и которая прикрепляется к сосуду с помощью алюминиевого днища 21, вращающегося относительно приподнятого круглого ободка 4 сосуда 1.
Пространство в верхней части сосуда 1 заполняется азотом до избыточного давления 0,2-0,3 бар.
Избыточное давление создается с целью подавления вытекания жидкости в процессе применения, что обеспечивает должное использование всего содержимого сосуда распылительного устройства без подсоса воздуха снаружи и обеспечивает также поддержание атмосферы азота в течение всего рабочего периода без ограничения времени.
Атмосферу азота внутри сосуда создают, промывая пустой сосуд азотом, вводя в него раствор, откачивая газ из сосуда с помощью разрежения и замещая его азотом, собирая и присоединяя насос и создавая с помощью насоса избыточное давление. Все эти операции проводятся в атмосфере азота.
В результате из пространства в верхней части сосуда почти полностью удаляется воздух так, что указанное пространство заполнено практически исключительно азотом, что сохраняется в течение всего рабочего периода распылительного устройства.
Для того, чтобы использовать распылительное устройство для впрыскивания в соответствии с данным изобретением, нужно нажать на стержень пустотелого поршня 12, что заставляет поршень 13 перемещаться вниз против действия силы пружины 14.
Движение поршня 13 вниз приводит к уменьшению объема торообразной камеры 10, так что имеющаяся в ней жидкость будет перетекать в головку 17 поршня 13, а седло клапана 18 выйдет из прохода 22 в стержень пустотелого поршня 12.
Высвобождение стержня поршня 12 заставит поршень 13 и, следовательно, стержень поршня 12 выталкиваться пружиной 14 вверх в положение, показанное на фиг. 2, что приведет к дальнейшему поступлению жидкости в торообразную камеру 10.
Количество жидкости, выталкиваемое при каждом нажатии, примерно соответствует объему камеры 10, то есть составляет около 100 мкл.
Из вышеизложенного должно быть ясно, что особая конструкция дозирующего устройства, не имеющего клапана всасывания-выталкивания (обычно шарикового типа), препятствует выбрасыванию содержимого сосуда через насос и в рабочем, и в нерабочем положении.
Композиции согласно данному изобретению сравнивали с композициями известного уровня техники; в
частности сопоставлялись фармако-кинетические характеристики после введения в нос 12 объектам одинаковых
доз (100 I.U.) кальцитонина лососевых (салькатонина) в составе препаратов А и В:
А)
Салькатонин, I.U. 100
Хлорид натрия, мг 0,9
1N хлористоводородная кислота до pH 4,0
Очищающая вода до объема 0,1 мл
В) Салькатонин, I.U. 100
Бензалконийхлорид, мг 0,0091
1N хлористоводородная кислота, мг 0,77
Очищающая вода до pH 4,0
Обработка, мл 0,1
В следующей таблице приводятся концентрации
салькатонина в плазме (усредненное по 12 объектам значение +/- стандартная ошибка) спустя различное время после введения
препаратов.
Площадь под кривой равнялась в случае А 1663 и в случае В 2108. Величина Т/2 β составила, соответственно 12,2 мин и 11,7 мин.
Различие между кривыми обоих типов незначительно.
Совершенно аналогичные результаты получены при сравнении композиций по данному изобретению и композиций, в состав которых входят, вместо бензалконийхлорида, эфир холестерина и полиоксиэтилена или, соответственно, салициловая кислота, таурохолат натрия и этанол.
Изобретение более детально иллюстрируется следующими примерами, которые, однако, не ограничивают его.
Пример 1. Кальцитонин лососевых (500000 I.U.) растворяют в 850 мл очищенной воды, в которой содержится 9 г хлорида натрия ч.д.а. pH раствора доводится до 4,0 с помощью аналитически чистой 1N HCl, после чего раствор разбавляют до 1000 мл, для чего добавляют очищенную воду. Раствор фильтруют через фильтр плотностью 0,2 mm и распределяют в контейнеры емкостью 5 мл, как раскрывается в прилагаемых рисунках, которые снабжены дозатором, высвобождающим каждый раз дозу 0,1 мл, что соответствует 50 I.U. кальцитонина.
Пример 2. Следовали процедуре, описанной в примере 1, но использовали двойное количество кальцитонина лососевых (1000000 I.U.). Раствор распределили по подходящим контейнерам емкостью 2,5 мл, соответствующим тем, которые описаны в прилагаемых рисунках, и высвобождающим каждый раз порцию 0, 1 мл, что соответствует 100 I.U. кальцитонина.
Реферат
Использование: в медицине для лечения остеопороза, болезни Педжета, гиперкальцемии и аналогичных патологий. Сущность изобретения: состав фармкомпозиции: кальцитонин - 100-5000 ME, NaCl - 9 мг, HCl - до pH 3,5-4,5, очищенная вода - до объема 1 мл. I вариант состава: салькатонин - 500 ME, NaCl - 9 мг, HCl - до pH 4, очищенная вода - до 1 мл. II вариант состава: салькатонин - 1000 ME, NaCl - 9 мг, HCl - до pH 4, очищенная вода - до 1 мл. Распылительное устройство содержит сосуд (1) для заполнения композицией и дозирующее устройство (5) с подпружиненным клапаном, установленным с возможностью взаимодействия с нажимным стержнем (12). Дозирующее устройство (5) содержит кожух (6), в полости которого выполнено несколько сообщающихся камер и расположен поршень (13), установленный с возможностью взаимодействия с пружиной (14) клапана, головка которого (17) выполнена в верхней части поршня (13). Седловая поверхность (18) клапана образована в теле стержня (12), выполненного с проходным каналом (22) и выступающего над горловиной сосуда. При этом верхняя камера (10) образована между поршнем (13) и внутренней стенкой кожуха (6), имеет тороидальную форму и выполнена с возможностью создания в ней давления при перемещении стержня (12), обеспечивающего отведение головки (17) клапана от его седловой поверхности (18). Сосуд выполнен с возможностью заполнения его верхнего пространства азотом под давлением. Предпочтительно возможность заполнения его верхнего пространства азотом под избыточном давлении 0,2-0,3 бар. Между кожухом (6) дозирующего устройства (5) и горловиной сосуда может быть установлено уплотнительное кольцо. Предпочтительный объем сосуда (1) 7 мл, а дозирующее устройство (5) выполнено с возможностью выдачи около 100 мкл за каждую операцию, что соответствует примерному объему тороидальной камеры (10). Фармацевтическая упаковка содержит распылительное устройство с сосудом, в котором содержится фармкомпозиция (фиг. 1,2). 5 с. и 7 з.п. ф-лы, 2 ил.
Формула
Кальцитонин, МЕ 100 5000
Хлористый натрий, мг 9
Соляная кислота, pH 3,5 4,5
Очищенная вода Остальное до 1 мл
2. Композиция по п.1, отличающаяся тем, что в качестве кальцитонина она содержит салькатонин в количестве 250 2000 МЕ.
Салькатонин, МЕ 500
Хлористый натрий, мг 9
Соляная кислота, pH 4
Очищенная вода Остальное до 1 мл
4. Фармацевтическая композиция для интраназального введения, включающая салькатонин, хлористый натрий, соляную кислоту и очищенную воду, отличающаяся тем, что она содержит указанные компоненты в следующих количествах:
Салькатонин, МЕ 1000
Хлористый натрий, мг 9
Соляная кислота, pH 4
Очищенная вода До 1 мл
5. Распылительное устройство для интраназального введения препарата, содержащее сосуд, выполненный с возможностью заполнения жидкой фармацевтической композицией, и дозирующее устройство с подпружиненным клапаном, установленным с возможностью взаимодействия с нажимным стержнем, отличающееся тем, что дозирующее устройство содержит кожух, в полости которого выполнено несколько сообщающихся камер и расположен поршень, установленный с возможностью взаимодействия с пружиной клапана, головка которого выполнена в верхней части поршня, седловая поверхностью клапана образована в теле стержня, выполненного с проходным каналом и выступающего над горловиной ссуда, при этом верхняя камера образована между поршнем и внутренней стенкой кожуха, имеет тороидальную форму и выполнена с возможностью создания в ней давления при перемещении стержня, обеспечивающего отведение головки клапана от его седловой поверхности, а сосуд выполнен с возможностью заполнения его верхнего пространства азотом под давлением.
Кальцитонин, МЕ 100 5000
Хлористый натрий, мг 9
Соляная кислота, pH 3,5 4,5,
Очищенная вода Остальное до 1 мл
10. Упаковка по п.9, отличающаяся тем, что фармацевтическая композиция в качестве кальцитонина содержит салькатонин в количестве 250 2000 МЕ.
Салькатонин, МЕ 500
Хлористый натрий, мг 9
Соляная кислота, pH До 4
Очищенная вода Остальное до 1 мл
12. Упаковка по пп.9 и 10, отличающаяся тем, что фармацевтическая композиция содержит компоненты при следующем соотношении:
Салькатонин, МЕ 1000
Хлористый натрий, мг 9
Соляная кислота, pH До 4
Очищенная вода Остальное до 1 мл
Приоритет по пунктам:
11.10. 88 по пп.1 4;
08.11.88 по пп.5 12.

Комментарии