Способы и композиции для улучшенной доставки макромолекул - RU2522245C2
Код документа: RU2522245C2
Чертежи






































Описание
Родственные заявки
По данной заявке испрашивается приоритет предварительной заявки США № 61/079586, поданной 10 июля 2008 года, содержание которой включено в данное описание посредством ссылки.
Область техники, к которой относится изобретение
Настоящее раскрытие относится к композициям и способам, которые облегчают доставку молекул через биологические мембраны, в частности доставку антигенсвязывающих полипептидов через гематоэнцефалический барьер в центральную нервную систему (ЦНС).
Уровень техники изобретения
Согласно докладу 2006 года Всемирной Организации Здравоохранения свыше 1 миллиарда людей во всем мире страдают от неврологических нарушений, и такие нарушения ежегодно приводят приблизительно к 6,8 миллионам смертей. Лечебные антигенсвязывающие пептиды, такие как антитела, могли бы применяться для лечения множества, если не большинства, таких неврологических нарушений. Однако лечению неврологических нарушений, применяющему такие терапевтические антигенсвязывающие пептиды, часто препятствуют трудности, связанные с доставкой лекарственных средств через гематоэнцефалический барьер (ГЭБ).
Несмотря на то что были обнаружены соединения, улучшающие доставку молекул через слои эпителиальных клеток, в целом было показано, что они эффективны для облегчения доставки только небольших молекул. Например, было показано, что пептид 4-фенилазобензилоксикарбонил-Pro-Leu-Gly-Pro улучшает перенос небольших молекул через слои эпителиальных клеток, тогда как для макромолекул 10 кДа и более улучшенный эффект проникновения не был продемонстрирован (см. патент США 5534496; Yen et al. 1995, J Control Release, 36:25-37). Несмотря на интенсивные исследования на сегодня нет пригодного и эффективного способа доставки терапевтических антигенсвязывающих полипептидов в ЦНС.
По этой причине существует сохраняющаяся необходимость в данной области в композициях и способах, которые улучшают специфическую доставку терапевтических антигенсвязывающих полипептидов через эпителиальные слои, в частности в ЦНС, для лечения нарушений, связанных с ЦНС.
Сущность изобретения
Настоящее изобретение основывается, по меньшей мере частично, на неожиданном открытии, что вещества, способствующие проникновению (например, Pz-пептид или FMOC-пептид), способны улучшать специфическую доставку больших макромолекул (т.е. более чем 10 кДа), таких как антигенсвязывающие полипептиды (например, scFv) в ЦНС, в частности при нанесении на слизистую носа. Соответственно, изобретение предоставляет композиции и способы, которые облегчают доставку больших макромолекул (т.е. более чем 10 кДа), таких как антигенсвязывающие полипептиды (например, scFv), через слои эпителия. Такие способы и композиции особенно преимущественны в том, что они дают возможность удобной, эффективной и избирательной доставки антигенсвязывающих полипептидов (например, scFv) в ЦНС посредством интраназального введения для лечения неврологических нарушений.
В одном аспекте изобретение предоставляет композиции, содержащие один или более антигенсвязывающих полипептидов, таких как иммуносвязывающее вещество (например, scFv), и одно или более веществ, способствующих проникновению (например, Pz-пептида или FMOC-пептида). В отдельном варианте осуществления антигенсвязывающий полипептид ковалентно связан с веществом, способствующим проникновению.
В некоторых вариантах осуществления антигенсвязывающий полипептид специфически связывается с антигеном-мишенью, выбранным из группы, состоящей из TNF-альфа, амилоида бета, растворимого рецептора лиганда - производного амилоида бета, моноаминооксидазы-B, L-3,4-дигидроксифенилаланиндекарбоксилазы, ацетил-коА-карбоксилазы, рецептора N-метил-D-аспартата (также известного как GRINl), GRINA, GRIN2A, GRIN2B, GRIN2C, GRIN2D, GRIN3A, GRJN3B, гистаминового рецептора H1, мускаринового рецептора (также известного как CHRM1), CHRM2, CHRM3, CHRM4, гипокретинового рецептора 1, гипокретинового рецептора 2, 5-гидрокситриптамина (также известного как HTR1A), допаминового рецептора (также известного как DRD1), DRD2, DRD3, DRD4, DRD5, адренергического бета-1 рецептора, переносчика норэпинефрина (NET) и допаминового D2-рецептора, в частности TNF-альфа.
В других вариантах осуществления антигенсвязывающий полипептид представляет собой scFv, включающий последовательность аминокислот по меньшей мере с 80%, предпочтительно 85%, 90%, 95% или 99% идентичностью или сходством с одним или более из наборов последовательностей аминокислот, приведенных в таблицах 5, 6 и 7 в данном описании.
В других вариантах осуществления вещество, способствующее проникновению, обеспечивает избирательную интраназальную доставку антигенсвязывающего полипептида в центральную нервную систему.
Композиции по изобретению особенно полезны в качестве лекарственных средств (или для производства лекарственных средств), в частности, для лечения, предупреждения или торможения прогрессирования неврологических нарушений, включая, но без ограничения, мигрень, депрессию, болезнь Альцгеймера, болезнь Паркинсона, шизофрению, эпилепсию, инсульт, менингит, боковой амиотрофический склероз, бессонницу, нарушение памяти, рассеянный склероз, нарколепсию, удар, травматическое повреждение мозга и стресс.
В еще одном аспекте изобретение предоставляет набор, содержащий один или более антигенсвязывающих полипептидов (например, scFv), одно или более веществ, способствующих проникновению (например, Pz-пептид или FMOC-пептид), и инструкции по применению.
Описание чертежей
Признаки и преимущества данного раскрытия будут более понятны при прочтении следующего подробного описания, взятого вместе со следующими чертежами, на которых:
Фиг.1 отображает эксперименты по определению зависимости от времени, которые отслеживают концентрации ESBA 105 в (A) обонятельной луковице, (B) головном мозге, (C) мозжечке и (D) стволе мозга после интраназального введения 400 мкг scFv.
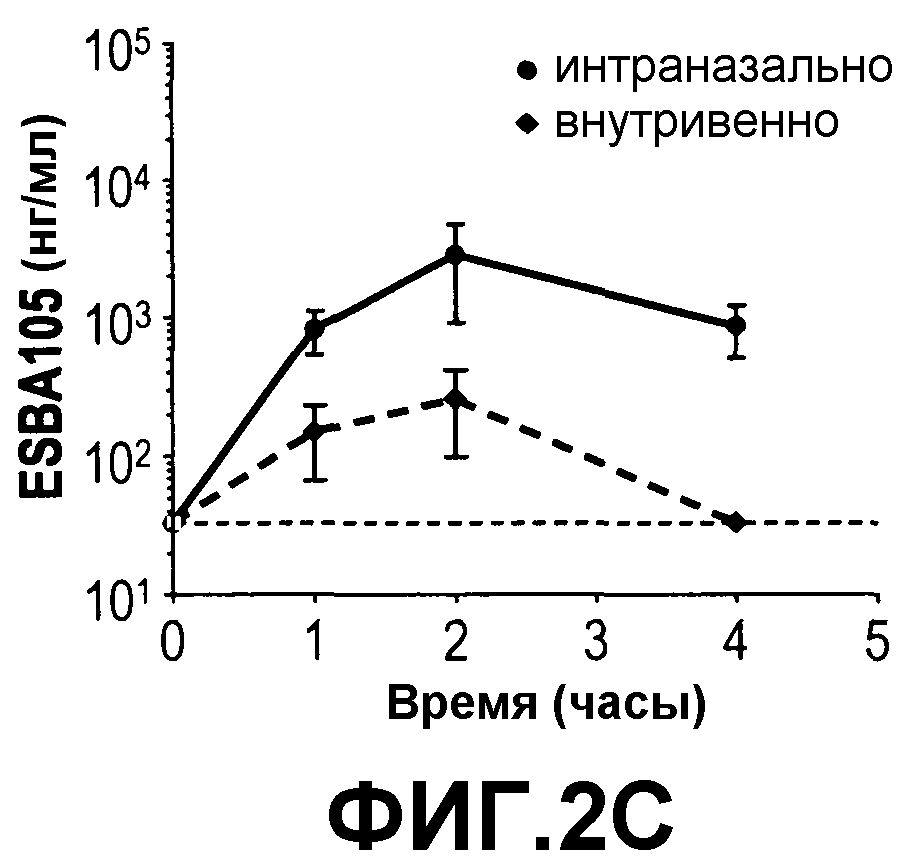
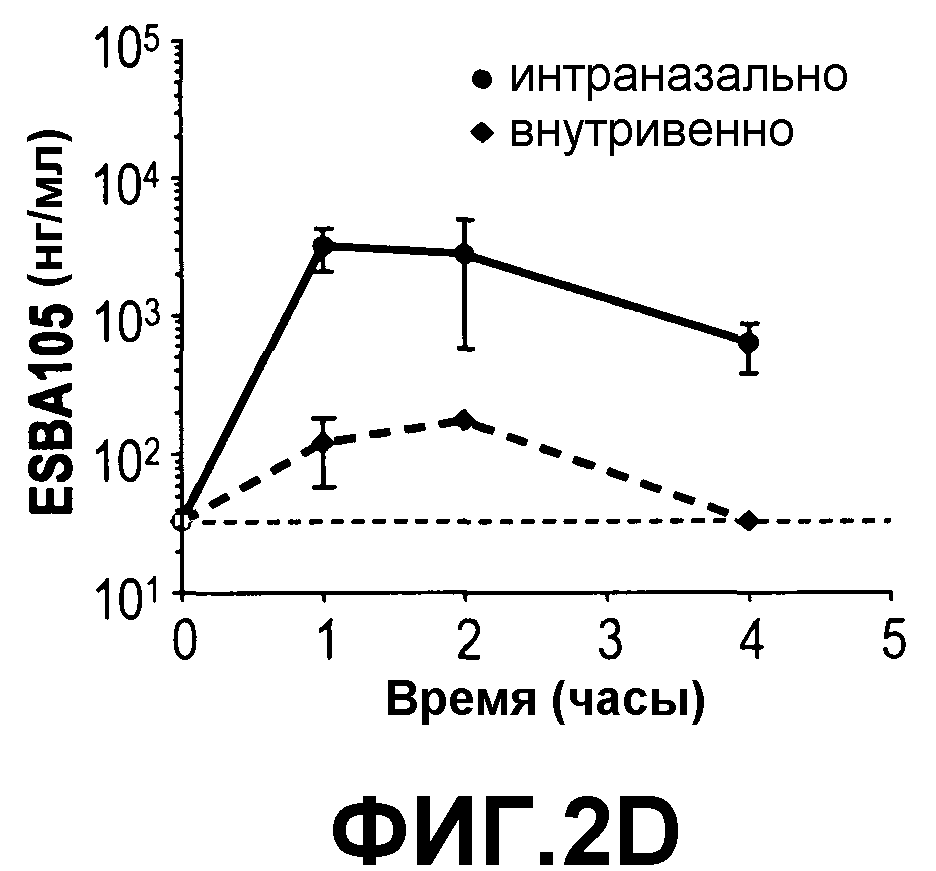
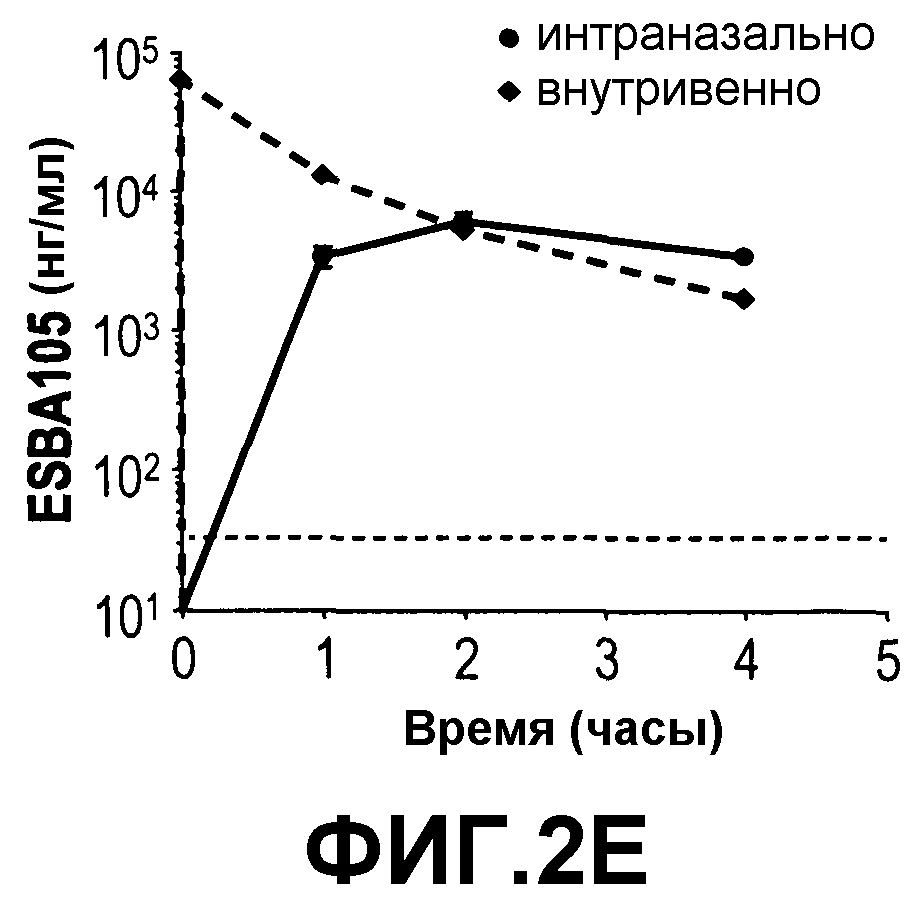
На фиг.2 приведено сравнение концентрации ESBA 105 в (A) обонятельной луковице, (B) головном мозге, (C) мозжечке, (D) стволе мозга и (E) сыворотке после либо интраназального (400 мкг/мл), либо внутривенного (40 мкг/мл) введения ESBA 105, а также в (F) сыворотке после либо интраназального, либо внутривенного введения ESBA 105 в равных концентрациях, составляющих 400 мкг/мл.
На фиг.3 показаны (A) Cmax (средние значения ± СО, n=4) и (B) воздействие (AUC) соотношения концентраций ESBA l05 ткани мозга-кровь в различных областях мозга после интраназального введения с Pz-пептидом или без него.
Фиг.4 отображает пути перемещения ESBA 105 из носовой полости в ЦНС после интраназальной доставки. Из носовой полости введенное соединение может перемещаться в кровь и проходить гематоэнцефалический барьер, чтобы, в конечном счете, проникать в ткань мозга (нижний путь). Альтернативно, соединение может перемещаться по аксонам N. olfactorius (т.е. внутриклеточно) или периневрально (т.е. внеклеточно) в обонятельную луковицу и впоследствии в головной мозг. Соединение может также перемещаться через N. trigeminus периневрально (т.е. внеклеточно) в ствол мозга и затем в мозжечок.
Подробное описание изобретения
Определения
Термин "вещество, способствующее проникновению" охватывает любую композицию, которая улучшает переход лекарственного средства через физический барьер, такой как тканевый барьер (например, эпителий). Подходящие вещества, способствующие проникновению, включают, но без ограничения, пептиды Pro-Leu-Gly-Pro-Arg [SEQ ID NO:28], Pro-Leu-Gly-Pro-Lys [SEQ ID NO:29], Pro-Leu-Gly-Pro-Glu [SEQ ID NO:30], Pro-Leu-Gly-Pro-Asp [SEQ ID NO:31], Pro-Leu-Gly-Pro [SEQ ID NO:32], Pro-Leu-Gly и Pro-Leu, связанные N-концом с защитной группой, как например 4-фенилазобензилоксикарбонил (Pz), N-метил трет-бутилоксикарбонил (t-Boc), флуоренилметилоксикарбонил (FMOC) и карбобензокси (CBZ) (см. например, патент США 534496, который включен в данное описание посредством ссылки).
Термин "Pz-пептид" относится к Pro-Leu-Gly-Pro-Arg [SEQ ID NO:28], связанному N-концом с Pz-группой (см. например, патент США 5534496, который включен в данное описание посредством ссылки).
Термин "FMOC-пептид" относится к Pro-Leu-Gly-Pro-Arg [SEQ ID NO:28], связанному N-концом с FMOC-группой (см. например, патент США 5534496, который включен в данное описание посредством ссылки).
Термин "избирательная интраназальная доставка" относится к интраназальному введению молекул (например, антигенсвязывающего полипептида) пациенту в условиях, приводящих к более высоким концентрациям молекул в ЦНС, чем в сыворотке пациента.
Термин "антигенсвязывающий полипептид" относится к полипептидам, размеры которых составляют по меньшей мере 10 кДа, и включает иммуносвязывающие вещества, моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), химерные антитела, антитела с пересаженными CDR, гуманизированные антитела, человеческие антитела, одноцепочечные антитела (scFv) и фрагменты антител, а также антигенсвязывающие полипептиды, основанные на альтернативных клеточных каркасах, известных в данной области, такие как, но не ограничиваясь ими, CTLA-4, тендамистат, фибронектин (FN3), неокрациностатин, CBM4-2, липокалины, T-клеточный рецептор, домен белка A (белок Z), Im9, сконструированные белки с анкириновым повтором (DARPins), сконструированные TPR-белки, цинковые пальцы, pVIII, птичий панкреатический полипептид, GCN4, WW-домен, гомологичный Src домен 3 (SH3), гомологичный Src домен 2 (SH2), PDZ-домены, TEM-I β-лактамаза, GFP, тиоредоксин, стафилококковая нуклеаза, PHD-пальцы, CI-2, BPT1 APPI, HPSTI, экотин, LACI-D1, LDTI, MTI-II, токсины скорпиона, пептид дефенсин A насекомых, EETI-II, Min-23, CBD, PBP, цитохром b562, домен A LdI рецептора, γ-кристаллин, убиквитин, трансферрин и лектиноподобный домен C-типа (см. например, Binz 2005, Curr Opin Biotechnol. Vol. 16 p. 459-69).
Термин "иммуносвязывающее вещество" относится к молекуле, которая содержит всю или часть антигенсвязывающего сайта антитела, например, весь домен или его часть с вариабельной тяжелой и/или легкой цепями, так что иммуносвязывающее вещество специфически распознает антиген-мишень. Неограничивающие примеры иммуносвязывающих веществ включают полноразмерные молекулы иммуноглобулинов и scFv, а также фрагменты антител, включая, но без ограничения, (i) Fab-фрагмент, моновалентный фрагмент, состоящий из VL, VH, CL и CH1 доменов; (ii) F(ab')2-фрагмент, бивалентный фрагмент, включающий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fab'-фрагмент, который является по существу Fab с частью шарнирной области (см. Fundamental Immunology (Paul ed., 3.sup.rd ed. 1993); (iv) Fd-фрагмент, состоящий из VH и CHI доменов; (v) Fv-фрагмент, состоящий из VL и VH доменов из одного плеча антитела, (vi) антитело с единичным доменном, такое как Dab-фрагмент (Ward et al., (1989) Nature 341:544-546)), который состоит из VH или VL домена, Камелид (см. например, Hamers-Casterman, et al, Nature 363:446-448 (1993) и Dumoulin, et al., Protein Science 11:500-515 (2002)) или антитело акулы (например, shark Ig-NAR Nanobodies®); и (vii) нанотело, вариабельная область тяжелой цепи, содержащая единичный вариабельный домен и два константных домена.
Термин "антитело", как используется в данном описании, является синонимом для "иммуноглобулина". Антитела согласно настоящему изобретению могут представлять собой целые иммуноглобулины или их фрагменты, содержащие по меньшей мере один вариабельный домен иммуноглобулина, такой как единичные вариабельные домены, Fv (Skerra A. и Pluckthun, A. (1988) Science 240:1038-41), scFv (Bird, R.E. et al. (1988) Science 242:423-26; Huston, J.S. et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-83), Fab, (Fab')2, и другие фрагменты, хорошо известные специалистам в данной области.
Термин "одноцепочечное антитело" или "scFv" относится к молекуле, включающей вариабельную область тяжелой цепи антитела (VH) и вариабельную область легкой цепи антитела (VL), соединенные линкером. Такие scFv молекулы могут иметь общие структуры: NH2-VL-линкер-VH-COOH или NH2-VH-линкер-VL-COOH.
Термин "каркасная область антитела", как используется в данном описании, относится к части вариабельного домена, либо VL, либо VH, который служит в качестве клеточного каркаса для антигенсвязывающих петель данного вариабельного домена (Kabat, E.A. et al., (1991) Sequences of proteins of immunological interest. NIH Publication 91-3242). Примеры подходящих каркасных областей раскрыты в PCT/CH 2009/000219 и PCT/CH 2009/000222, которые включены в данное описание посредством ссылки.
Термин "линкер" относится к линейной последовательности аминокислот, связывающих два домена. Линкеры по изобретению могут быть генетически и/или химически встроены в домен. В некоторых вариантах осуществления линкеры содержат петлю, образованную посредством дисульфидного мостика, сформированного между двумя цистеинами, присутствующими в линкере. Общая структура такого линкера приведена в SEQ ID NO:18 и 19; SEQ ID NO:16 и 17 являются иллюстративными вариантами осуществления указанных линкеров. Дополнительное подходящее состояние в линкерной области состоит из повторяющихся последовательностей аминокислот GGGGS или их вариантов. В предпочтительном варианте осуществления настоящего изобретения используется линкер (GGGGS)4 (SEQ ID NO:36) или его производное (например, используется SEQ ID NO:37), но варианты повторений 1-3 также являются возможными (Holliger et al. (1993), Proc. Natl. Acad. Sci. USA 90:6444-6448). Другие линкеры, которые могут быть использованы для настоящего изобретения, описаны Alfthan et al. (1995), в Protein Eng. 8:725-731, Choi et al. (2001), Eur. J. Immunol. 31:94-106, Hu et al. (1996), Cancer Res. 56:3055-3061, Kipriyanov et al (1999), J. Mol. Biol. 293:41-56, и Roovers et al. (2001), Cancer Immunol. Immunother. 50:51-59.
Термин "модифицированный" или "модифицирование" применительно к аминокислотной последовательности полипептида относится как к присоединению аминокислот в полипептидную последовательность, так и к замещению имеющихся аминокислот в полипептидной последовательности. Аминокислоты, подходящие для модифицирования полипептида, включают все известные природные аминокислоты, неприродные аминокислоты и их функционализированные производные (см. например, патенты США 7045337 и 7083970, которые включены в данное описание посредством ссылки во всей своей полноте). В определенных вариантах осуществления термин относится к делеции аминокислот из полипептидной последовательности.
"Антиген-мишень" представляет собой молекулу (например, растворимый белок или мембраносвязанный белок, имеющий один или более соединенных с мембранами доменов, полипептид, пептид или углевод), содержащую антигенную детерминанту, с которой антитело специфически связывается.
Термин "неврологическое нарушение" включает заболевания и нарушения, которые могут поражать центральную нервную систему (т.е. головной мозг и спинной мозг).
Термин нарушение со стороны ЦНС относится к нарушению, которое манифестируется в ЦНС. В качестве примера, это может быть опухоль мозга или неврологическое нарушение.
Термин "эффективное количество" определяется как количество лекарственного средства (например, антигенсвязывающего полипептида), достаточного для частичного или полного предупреждения или остановки заболевания или нарушения (например, неврологического нарушения) у пациента. Эффективное количество будет зависеть от тяжести заболевания или нарушения и многообразия фармакокинетических факторов, включая активность конкретной используемой композиции настоящего изобретения, способ введения, время введения, скорость выведения конкретного используемого соединения, продолжительность лечения, другие лекарственные средства, соединения и/или вещества, применяемые в комбинации с конкретными используемыми композициями, возраст, пол, массу, состояние, общее состояние здоровья и предшествующую историю болезни пациента, подвергаемого лечению, и подобные факторы, хорошо известные в медицинских областях.
Термин "пациент" включает человека и других млекопитающих субъектов, которые получают либо профилактическое, либо терапевтическое лечение.
Термины "специфическое связывание", "избирательное связывание", "избирательно связывается" и "специфически связывается" относятся к антителу, связывающемуся с эпитопом на предварительно заданном антигене. Обычно антитело связывается с аффинностью (Kj) приблизительно менее чем около 10-7M, например, приблизительно менее чем около 10-8M, 10-9M или 10-10M.
Как используется в данном описании, "идентичность" относится к последовательности, совпадающей у двух полипептидов, молекул или у двух нуклеиновых кислот. Когда положение в обеих из двух сравниваемых последовательностей занимает одно и то же основание или мономерная аминокислотная субъединица (например, если положение в каждой из двух молекул ДНК занимает аденин, или положение в каждой из двух полипептидов занимает лизин), то соответствующие молекулы в том положении являются идентичными. "Процент идентичности" между двумя последовательностями представляет собой функцию количества совпадающих положений, общих для двух последовательностей, разделенного на количество сравниваемых положений, ×100. Например, если 6 из 10 положений в двух последовательностях совпадают, то две последовательности обладают 60%-ной идентичностью. В качестве примера последовательности ДНК CTGACT и CAGGTT имеют 50%-ную идентичность (3 из 6 общих положений совпадают). В большинстве случаев сравнение производят, когда две последовательности выровнены для предоставления максимальной идентичности. Такое выравнивание может быть обеспечено при применении, например, способа Needleman et al. (1970) J MoI. Biol.48: 443-453, легко осуществляемого с помощью компьютерных программ, таких как Align программа (DNAstar, Inc.). Процент идентичности между двумя аминокислотными последовательностями может также быть определен с применением алгоритма E. Meyers и W. Miller (Comput. Appl. Biosci., 4:11-17 (1988)), который был включен в программу ALIGN (version 2.0), с использованием таблицы остаточных масс PAM 120, штрафа за длину делеции, равного 12, и штрафа за делецию, равного 4. В дополнение, процент идентичности между двумя аминокислотными последовательностями может быть определен с применением алгоритма Needleman и Wunsch (J. MoI. Biol. 48:444-453 (1970)), который был включен в программу GAP в пакете программного обеспечения GCG (доступен на www.gcg.com), с использованием либо матрицы Blossum 62, либо матрицы PAM250, и массой делеции, равной 16, 14, 12, 10, 8, 6 или 4, и весой длины, равной 1, 2, 3, 4, 5 или 6.
"Аналогичными" последовательностями являются последовательности, которые при выравнивании имеют идентичные и одинаковые аминокислотные остатки, где аналогичные остатки представляют собой консервативные заместители для соответствующих аминокислотных остатков в выравненной ссылочной последовательности. В этом отношении "консервативное замещение" остатка в ссылочной последовательности представляет собой замещение остатком, который физически или функционально является аналогичным соответствующему ссылочному остатку, например который имеет аналогичные размер, форму, электрический заряд, химические свойства, включая способность образовывать ковалентные или водородные связи и т.п. Таким образом, "консервативной замещающей модифицированной" последовательностью является последовательность, которая отличается от ссылочной последовательности или последовательности дикого типа в том, что присутствуют один или более консервативных заместителей. "Процентное сходство" между двумя последовательностями является функцией количества положений, которые содержат совпадающие остатки или консервативные заместители, являющиеся общими для двух последовательностей, разделенных на число сравниваемых положений, ×100. Например, если от 6 до 10 положений в двух последовательностях совпадают и от 2 до 10 положений содержат консервативные заместители, тогда две последовательности обладают 80% положительным сходством.
Как используется в данном описании, термин "консервативные модификации последовательностей" предназначен для обозначения аминокислотных модификаций, которые не влияют негативно и не изменяют связывающие характеристики антитела, имеющего в своем составе последовательность аминокислот. Подобные консервативные модификации последовательностей включают заместители нуклеотидов и аминокислот, добавления и делеции. Например, модификации можно вводить посредством стандартных методик, известных в данной области, таких как сайт-направленный мутагенез и ПЦР опосредованный мутагенез. Консервативные заместители аминокислот включают заместители, в которых аминокислотный остаток заменен аминокислотным остатком, имеющим аналогичную боковую цепь. Семейства аминокислотных остатков, имеющих аналогичные боковые цепи, были определены в данной области. Данные семейства включают аминокислоты с щелочными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глютаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глютамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, прогнозированный второстепенный аминокислотный остаток человеческого анти-VEGF антитела предпочтительно заменяют другим аминокислотным остатком из семейства с такими же боковыми цепями. Способы идентификации консервативных заместителей нуклеотидов и аминокислот, которые не устраняют связывание антигена, хорошо известны в данной области (см. например, Brummell et al, Biochem. 32:1 180-1187 (1993); Kobayashi et al. Protein Eng. 12(10):879-884 (1999); и Burks et al. Proc. Natl. Acad. Sci. USA 94:412-417 (1997))
Если не указано иное, все технические и научные термины, используемые в данном описании, имеют такое значение, которое наиболее понятно специалистам в области, к которой относится данное изобретение. Несмотря на то что при практическом применении или тестировании настоящего изобретения могут быть использованы способы и вещества, аналогичные или эквивалентные способам и веществам, описываемым в данном описании, ниже описаны подходящие способы и вещества. В случае противоречия будет доминировать данное описание, включая определения. В дополнение, вещества, способы и примеры являются только иллюстративными и не предназначены для ограничения. В следующих разделах более подробно описаны различные аспекты данного изобретения. Следует понимать, что в будущем различные варианты осуществления могут быть объединены.
Усовершенствованные антигенсвязывающие полипептидные композиции
В одном аспекте изобретение относится к композициям для обеспечения доставки терапевтических полипептидов, таких как антигенсвязывающие полипептиды (например, scFv), через тканевые барьеры, более конкретно, через слизистую оболочку носа, в ЦНС. Такие композиции, как правило, содержат антигенсвязывающий полипептид и вещество, способствующее проникновению. Данные композиции являются особенно предпочтительными за счет того, что они имеют возможность избирательной интраназальной доставки антигенсвязывающего полипептида в центральную нервную систему. На сегодняшний день биологические препараты обычно вводят систематически, требуя, таким образом, более высокую дозу лекарственного средства и/или подвергая организм, нуждающийся в этом, действию лекарственного средства; альтернативно, биологический препарат можно вводить через краниальный катетер. По этой причине настоящее изобретение значительно повышает качество жизни больного, нуждающегося в антигенсвязывающем полипептиде.
Любой антигенсвязывающий полипептид подходит для применения в способах по изобретению. В некоторых вариантах осуществления антигенсвязывающий полипептид представляет собой иммуносвязывающее вещество, такое как scFv. Такие scFv предпочтительно включают в себя высокостабильные и растворимые каркасные области, такие как области, перечисленные в WO 09/000098, содержание которой включено в данное описание посредством ссылки. В особенно предпочтительном варианте осуществления scFv включает последовательность аминокислот по меньшей мере с 80% сходством (например, 85%, 90%, 95% или 99%) с одной или более последовательностями аминокислот, перечисленными в таблицах 5, 6 и 7. Наиболее предпочтительно scFv включает последовательность аминокислот по меньшей мере с 80% идентичностью, предпочтительно 85%, 90%, 95% или 99% идентичностью с одной или более последовательностями аминокислот, перечисленных в таблицах 5, 6 и 7.
В предпочтительном варианте осуществления указанный scFv включает каркасную последовательность, обладающую по меньшей мере 80% сходством (например, 85%, 90%, 95% или 99%), более предпочтительно по меньшей мере 80% идентичностью, даже более предпочтительно 85%, 90%, 95% или 99% идентичностью, с SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26 или SEQ ID NO:27.
В еще одном варианте осуществления указанный scFv включает VH домен, содержащий последовательность аминокислот по меньшей мере с 80% сходством (например, 85%, 90%, 95% или 99%), более предпочтительно по меньшей мере 80% идентичностью, даже более предпочтительно 85%, 90%, 95% или 99% идентичностью, с SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10 или SEQ ID No:35. Дополнительно или альтернативно указанный scFv включает в себя VL домен, содержащий последовательность аминокислот по меньшей мере с 80% сходством (например, 85%, 90%, 95% или 99%), более предпочтительно по меньшей мере 80% идентичностью, даже более предпочтительно 85%, 90%, 95% или 99% идентичностью, с SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15 или SEQ ID No:34. В одном варианте осуществления указанные VH и/или VL связывают линкером для получения молекулы, имеющей общую структуру NH2-VH-линкер-VL-COOH или NH2-VL-линкер-VH-COOH. Указанная молекула-линкер может, например, быть выбрана из группы, состоящей из SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:36 и SEQ ID NO:37, или представляет собой последовательность, имеющую по меньшей мере 80% сходство с ней.
В предпочтительном варианте осуществления scFv включает в себя последовательность аминокислот по меньшей мере с 80% сходством (например, 85%, 90%, 95% или 99%), более предпочтительно по меньшей мере 80% идентичностью, даже более предпочтительно 85%, 90%, 95% или 99% идентичностью, с SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5 или SEQ ID No:33.
В композиции по изобретению может быть использовано любое вещество, способствующее проникновению. В некоторых вариантах осуществления, вещество, способствующее проникновению, представляет собой пептид или пептидомиметик, связанный с защитной группой. Пептиды, подходящие для применения в изобретении, могут содержать любые известные аминокислоты, включая природные аминокислоты, не являющиеся природными аминокислоты, D-аминокислоты и производные аминокислот. В отдельном варианте осуществления вещество, способствующее проникновению, представляет собой пептид, выбранный из группы, состоящей из Pro-Leu-Gly-Pro-Arg [SEQ ID NO:28], Pro-Leu-Gly-Pro-Lys [SEQ ID NO:29], Pro-Leu-Gly-Pro-Glu [SEQ ID NO:30], Pro-Leu-Gly-Pro-Asp [SEQ ID NO:31], Pro-Leu-Gly-Pro [SEQ ID NO:32], Pro-Leu-Gly и Pro-Leu, связанных N-концом с защитной группой, такой как 4-фенилазобензилоксикарбонил (Pz), N-метил трет-бутилоксикарбонил (t-Boc), флуоренилметилоксикарбонил (FMOC) и карбобензокси (CBZ) (см. например, патент США 5534496, который включен в данное описание посредством ссылки). В предпочтительном варианте осуществления вещество, способствующее проникновению, представляет собой Pro-Leu-Gly-Pro-Arg [SEQ ID NO:28], связанное N-концом с Pz или FMOC группами (см. например, патент США 5534496, который включен в данное описание посредством ссылки).
В пределах объема настоящего изобретения предусматривается, что вещества, способствующие проникновению, и антигенсвязывающие белки могут совместно доставляться в ткань-мишень в виде единой фармацевтической композиции, или их доставку можно разделить во времени посредством введения в виде различных композиций.
Кроме того, в пределах объема настоящего изобретения предусматривается, что вещество, способствующее проникновению, может быть конъюгировано с антигенсвязывающим белком. Предусматриваются все варианты физической или химической конъюгации, известные в данной области. Для конъюгирования могут быть использована химическая группа с аминокислотой, производным аминокислоты или миметиком аминокислоты любого подходящего химического состава, известного в данной области. Конъюгирование может быть с любым аминокислотным остатком антигенсвязывающего белка, включая остатки лизина, цистеина и гистидина.
В некоторых вариантах осуществления композиции по изобретению могут содержать дополнительные соединения, подходящие для совместной доставки с указанными выше антигенсвязывающими белками. Подобные лекарственные средства включают, но без ограничения, небольшие молекулы, ноотропики, полипептиды и олигонуклеотиды.
Композиции по изобретению могут быть использованы для доставки антигенсвязывающих белков через межклеточные контакты любой биологической мембраны, включая, но без ограничения, слизистый эпителий (например, назальный эпителий) и корнеальную ткань. Особо предпочтительной мембраной-мишенью является назальный эпителий, потому что введение композиции по изобретению в назальный эпителий приводит к прямой и конкретной доставке антигенсвязывающего белка в ЦНС, предпочтительно без первоначального попадания в кровоток.
Лечение нарушений ЦНС
Композиции по изобретению особенно подходят для лечения, предупреждения и/или торможения прогрессирования нарушений ЦНС, поскольку такие композиции дают возможность прямой и избирательной доставки антигенсвязывающих полипептидов в ЦНС через слизистую оболочку носа. Нарушения, подходящие для лечения с применением композиций по изобретению включают, но без ограничения, поведенческие/когнитивные синдромы, нарушения по типу головной боли (например, мигрень, кластерную головную боль и головную боль напряжения), эпилепсию, травматическое повреждение мозга, нейродегенеративные нарушения (например, адренолейкодистрофию, алкоголизм, болезнь Александера, болезнь Альпера, болезнь Альцгеймера, боковой амиотрофический склероз (также известный как болезнь Лу Герига), атаксию-телеангиэктазию, болезнь Баттена (также известную как болезнь Шпильмейера-Фогта-Шегрена-Баттена), губчатую энцефалопатию крупного рогатого скота, болезнь Канавана, корковый паралич, синдром Коккейна, корково-базальную дегенерацию, болезнь Крейтцфельда-Якоба, фатальнуюсемейную инсомнию, лобно-височно-долевую дегенерацию, болезнь Гентингтона, ВИЧ-ассоциированную деменцию, болезнь Кеннеди, болезнь Краббе, болезнь диффузных телец Леви, нейроборрелиоз, болезнь Мачадо-Джозефа (спиномозжечковую атаксию тип 3), множественную системную атрофию, рассеянный склероз, нарколепсию, болезнь Нимана-Пика, болезнь Паркинсона, болезнь Пелицеуса-Мерцбахера, болезнь Пика, первичный латеральный склероз, прионовые заболевания, прогрессирующий надъядерный паралич, болезнь Рефсума, болезнь Сандхоффа, болезнь Шильдера, подострую сочетанную дегенерацию спинного мозга на фоне пернициозной анемии, спиномозжечковую атаксию, спинальную мышечную атрофию, болезнь Стила-Ричардсона-Ольшевского, спинную сухотку и токсическую энцефалопатию, цереброваскулярное заболевание (например, транзиторную ишемическую атаку и инсульт), нарушения сна, церебральный паралич, инфекции (например, энцефалит, менингит и миелит), новообразования (например, опухоли головного мозга и спинного мозга), расстройства движения (например, гемибализм, тиковое расстройство и синдром Жилль де ла Туретта), демиелинизирующие заболевания ЦНС (например, рассеянный склероз, синдром Гиллана-Барре и хроническую воспалительную демиелинизирующую полинейропатию), нарушения со стороны периферических нервов (например, миопатию и нервномышечные соединения), измененное психическое состояние (например, энцефалопатию, ступор и кому), речевые и языковые расстройства, перенеопластические неврологические синдромы и синдромы, включающие функциональные неврологические симптомы с невыявленной физиологической причиной.
Соответственно, в еще одном аспекте изобретение относится к способу лечения или предупреждения заболевания или расстройства центральной нервной системы, включающему введение через слизистую оболочку носа субъекта, нуждающегося в таком лечении, эффективного количества композиции, содержащей антигенсвязывающий полипептид (например, scFv) и вещество, способствующее проникновению (например, Pz-пептид), для лечения и предупреждения заболевания или расстройства.
В еще одном аспекте изобретение относится к способу избирательной доставки антигенсвязывающего полипептида в центральную нервную систему пациента, включающему осуществление контакта композиции, содержащей антигенсвязывающий полипептид (например, scFv) и вещество, способствующее проникновению (например, Pz-пептид), со слизистой оболочкой носа пациента, посредством чего антигенсвязывающий полипептид напрямую и избирательно доставляется в центральную нервную систему.
Антигены-мишени
Антигенсвязывающие полипептиды, применяемые в способах по изобретению, могут связываться с одним или более отдельными антигенами-мишенями. Подходящие антигены-мишени включают, но без ограничения, TNF-альфа (например, Genbank с номером доступа: NP_000585.2), амилоид бета (например, Genbank с номером доступа: NP 000475.1), растворимый рецептор лиганда-производного амилоида бета (см. например, WO/2004/031400), моноаминооксидазу-B (например, Genbank с номером доступа: NP_000889.3), L-3,4-дигидроксифенилаланиндекарбоксилазу (например, Genbank с номером доступа: NP_000781.1), ацетил-коА карбоксилазу (например, Genbank с номером доступа: NP_942131.1), Рецептор N-метил-D-аспартата (также известный как GRIN1)(например, Genbank с номером доступа: NP_000823.4)), GRINA (например, Genbank с номером доступа: NP_000828.1), GRIN2D (например, Genbank с номером доступа: NP_000827.2), GRJN2C (например, Genbank с номером доступа: NP_000826.2), GRIN3B (например, Genbank с номером доступа: NP_619635.1), GRIN2A (например, Genbank с номером доступа: NP_000824.1), GRIN2B (например, Genbank с номером доступа: NP_000825.2), GRIN3A (например, Genbank с номером доступа: NP_597702.2), гистаминовый H1-рецептор (например, Genbank с номером доступа: NP_000852.1), мускариновый рецептор (также известный как CHRM1) (например, Genbank с номером доступа: NP_000729.2), CHRM2 (NP_000730.1), CHRM3 (NP 000731.1), CHRM4 (NP 000732.2), гипокретиновоговый рецептор 1 (например, Genbank с номером доступа: NP_001516.2), гипокретиновый рецептор 2 (например, Genbank с номером доступа: NP_001517.2), 5-гидрокситриптамин (также известный как HTR1 A) (например, Genbank с номером доступа: NP_000515.2), допаминовый рецептор (также известный как DRD1) (например, Genbank с номером доступа: NP_000785.1), DRD2 (например, Genbank с номером доступа: NP_000786.1), DRD3 (например, Genbank с номером доступа: NP_000787.2), DRD4 (например, Genbank с номером доступа: NP_000788.2), DRD5 (например, Genbank с номером доступа: NP_000789.1), норэпинефриновый переносчик (NET) (например, Genbank с номером доступа: NP_001034.1), адренергический бета-1 рецептор (например, Genbank с номером доступа: NP_000675.1) и допаминовый D2-рецептор (например, Genbank с номером доступа: NP_000786.1).
Готовые формы
Другой аспект изобретения относится к фармацевтическим готовым формам композиций по изобретению антигенсвязывающего полипептида/вещества, способствующего проникновению. Такие готовые формы обычно содержат один или более антигенсвязывающих полипептидов, одно или более веществ, способствующих проникновению, и фармацевтически приемлемый носитель. Как используется в данном описании, "фармацевтически приемлемый носитель" включает любые растворители, дисперсионную среду, покрывающие вещества, антибактериальные и противогрибковые агенты, изотонические и замедляющие всасывание агенты, и т.п., которые являются физиологически совместимыми. Предпочтительно носитель должен подходить, например, для внутривенного, внутримышечного, подкожного, местного (например, в глаза, на кожу или эпителиальный слой), ингаляционного, парентерального, спинального или эпидермального введения (например, посредством инъекции или инфузии). В зависимости от способа введения композиция антигенсвязывающего полипептида/вещества, способствующего проникновению, может быть покрыта веществом для защиты соединении от действия кислот и других естественных условий, которые могут инактивировать соединение.
Фармацевтическая композиция по изобретению может включать одну или более фармацевтически приемлемых солей. "Фармацевтически приемлемой солью" называют соль, которая сохраняет требуемую биологическую активность исходного соединения и не дает каких-либо нежелательных токсических эффектов (см. например, Berge, S.M., et al. (1977) J. Pharm. Sci. 66:1-19). Примеры таких солей включают кислотно-аддитивные соли и аддитивные соли основания. Кислотно-аддитивные соли включают соли, производные нетоксичных неорганических кислот, таких как хлористоводородная, азотная, фосфорная, серная, бромистоводородная, йодистоводородная, фосфористая и т.п., а также нетоксичных органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты и т.п. Аддитивные соли основания включают соли, производные щелочноземельных металлов, таких как натрий, калий, магний, кальций и т.п., а также нетоксичных органических аминов, таких как N,N'-дибензилэтилендиамин, N-метилглютамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, прокаин и т.п.
Фармацевтическая композиция по изобретению также может содержать фармацевтически приемлемый антиоксидант. Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, дисульфат натрия, метабисульфит натрия, сульфит натрия и т.п.; (2) жирорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный оксианизол (BHA), бутилированный гидрокситолуол (BHT), лецитин, пропилгаллат, альфа-токоферол и т.п.; и (3) металлохелатные агенты, такие как лимонная кислота, этилендиаминтетрауксусная кислота (EDTA), сорбит, виннокаменная кислота, фосфорная кислота и т.п.
Примеры пригодных водных и неводных носителей, которые могут быть использованы в фармацевтической композиции по изобретению, включают воду, этанол, полиолы (такие как глицерин, проипленгликоль, полиэтиленгликоль и т.п.) и их подходящие смеси, растительные масла, такие как оливковое масло, и инъекционные органические сложные эфиры, такие как этилолеат. Присущая текучесть может быть сохранена, например, путем использования покрывающих веществ, таких как лецитин, путем сохранения требуемого размера частиц в случае диспергирования и путем использования поверхностно-активных веществ.
Данные композиции могут также содержать адъюванты, такие как консерванты, увлажняющие агенты, эмульгирующие агенты и диспергирующие агенты. Предупреждение присутствия микроорганизмов может быть обеспечено как путем процедур стерилизации, supra, так и посредством включения различных антибактериальных и противогрибковых агентов, например парабена, хлоробутанола, фенолсорбиновой кислоты и других. Также может быть необходимо включение в композиции изотонических агентов, таких как сахара, хлорид натрия и других. В дополнение, пролонгированная абсорбция инъекционной фармацевтической формы может быть обусловлена путем включения агентов, которые замедляют абсорбцию, таких как моностеарат алюминия и желатин.
Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии и стерильные порошки для экстемпорального приготовления стерильных инъекционных растворов или дисперсии. Использование таких сред и агентов для фармацевтически активных веществ известно в данной области. За исключением случаев, когда любая традиционная среда или агент является несовместимым с активным соединением, предусматривается его использование в фармацевтических композициях по изобретению. Дополнительные активные соединения могут также быть включены в композиции.
Фармацевтические композиции обычно должны быть стерильными и стабильными в условиях производства и хранения. Композиция может быть приготовлена в виде раствора, микроэмульсии, липосом или другой упорядоченной стрктуры, пригодной для создания высокой концентрации лекарственного средства. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, проипленгликоль, жидкий полиэтиленгликоль и т.п.) и подходящие их смеси. Свойственная текучесть может быть сохранена, например, путем использования покрывающих веществ, таких как лецитин, путем сохранения требуемого размера частиц в случае диспергирования и путем использования поверхностно-активных веществ. Во многих случаях будет предпочтительным включение в композицию изотонических агентов, например сахаров, многоатомных спиртов, таких как маннит, сорбит или хлорид натрия. Пролонгированная абсорбция инъекционных композиций может быть обусловлена путем включения агентов, которые замедляют абсорбцию, таких как моностерарат алюминия и желатин.
Стерильные инъекционные растворы могут быть приготовлены посредством включения активного соединения в требуемом количестве в подходящий растворитель с одним или комбинацией ингредиентов, перечисленных выше, при необходимости, с последующей стерилизацией микрофильтрацией. Как правило, дисперсии готовят посредством включения активного соединения в стерильное средство доставки, которое содержит основную дисперсионную среду и т.п., необходимые ингредиенты из тех, что перечислены выше. В случае стерильных порошков для приготовления стерильных инъекционных растворов предпочтительными способами приготовления являются вакуумная сушка и сушка замораживанием (лиофилизация), которые производят порошок активного ингредиента плюс любого дополнительного требуемого ингредиента из предварительно стерильно-профильтрованного его раствора.
Количество активного ингредиента, который можно комбинировать с веществом носителя для получения единичной дозированной формы, будет варьировать в зависимости от пациента, подвергаемого лечению, и конкретного способа введения. Количество активного ингредиента, который можно комбинировать с веществом-носителем для производства единичной дозированной формы, будет в целом таким количеством композиции, которое оказывает терапевтический эффект. Как правило, из ста процентов данное количество будет варьировать приблизительно от 0,01 процента до приблизительно девяносто девяти процентов активного ингредиента, предпочтительно приблизительно от 0,1 процента до приблизительно 70 процентов, наиболее предпочтительно приблизительно от 1 процента до приблизительно 30 процентов активного ингредиента в комбинации с фармацевтически приемлемым носителем.
Схемы приема регулируют для обеспечения оптимального требуемого ответа (например, терапевтического ответа). Например, можно вводить разовый болюс, можно вводить несколько раздельных доз в течение некоторого времени или дозу можно пропорционально уменьшать или увеличивать, как указывает тяжесть терапевтической ситуации. Особенно выгодно изготавливать парентеральные композиции в единичной дозированной форме для облегчения введения и единообразия дозировки. Единичная дозированная форма, как используется в данном описании, относится к физически дискретным единицам, пригодным в качестве единичных дозировок для пациента, подвергаемого лечению; каждая единица содержит предварительно заданное количество активного соединения, вычисленного для оказания требуемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Спецификация для единичных дозированных форм по изобретению обусловлена и непосредственно зависит от (a) уникальных характеристик активного соединения и конкретного терапевтического эффекта, которого требуется достичь, и (b) ограничений, присущих данной области приготовления лекарственного средства, такого как активное соединение для лечения чувствительности у индивидов.
Другой аспект изобретения представляет собой способ введения фармацевтических композиций по изобретению. В рамках изобретения предполагается, что конкретные режимы доставки могут включать оральный, парентеральный (включая подкожный, внутримышечный и внутривенный), ректальный, трансбуккальный, сублингвальный, через легкие, трансдермальный, интраназальный и пероральный. Предпочтительным режимом доставки является интраназальный.
Для назального введения может применяться либо твердый, либо жидкий носитель. Твердый носитель включает крупный порошок, имеющий размер частиц в диапазоне, например, приблизительно от 20 до приблизительно 500 микрон, причем такая готовая форма вводится посредством быстрой ингаляции через носовые проходы. Когда применяется жидкий носитель, готовая форма может вводиться в виде назального спрея или капель и может содержать масляные или водные растворы активных ингредиентов.
Готовые формы, подходящие для назального введения, представлены таким образом, что частицы, содержащие активное соединение и обладающие требуемым диаметром в диапазоне от 0,5 до 7 микрон, доставляются в бронхиальное дерево получающего лечение. В качестве одной из возможностей такие готовые формы представлены в форме тонко измельченных порошков, которые могут удобно присутствовать либо в прокалываемой капсуле, соответственно, например, из желатина, для применения в ингаляционном устройстве, или альтернативно, в виде самораспространяющейся готовой формы, включающей активное соединение, подходящий жидкий или газообразный пропеллент и необязательно другие ингредиенты, такие как поверхностно-активное вещество и/или твердый разбавитель. Подходящие жидкие пропелленты включают пропан и хлорфтороуглеводороды, и подходящие газообразные пропелленты включают диоксид углерода. Самораспространяющиеся готовые формы также могут быть использованы, при этом активное соединение распределено в форме мелких капель раствора или суспензии. Подобные самораспространяющиеся готовые формы являются аналогами готовых форм, известных в данной области, и могут быть получены посредством общепринятых методик. Соответствующим образом они присутствуют в контейнере, снабженном либо мануально или автоматически функционирующим клапаном, имеющим требуемые характеристики распыляемого раствора; преимущественно это клапан дозирующего типа, доставляющий фиксированный объем, например, от 25 до 100 мкл при каждом приведении его в действие. В качестве дополнительной возможности активное соединение может быть в форме раствора или суспензии для применения в пульверизаторе или небулайзере, посредством чего для получения тумана из мелких капель для ингаляции задействуют ускоренную струю воздуха или ультразвуковое взбалтывание. При распылении такие готовые формы должны желательно иметь диаметр частиц в диапазоне от 10 до 200 микрон, чтобы обеспечить задерживание в носовой полости; при необходимости это может быть достигнуто посредством использования порошка с подходящим размером частиц или выбора соответствующего клапана. Другие подходящие готовые формы включают грубые порошки, имеющие диаметр частиц в диапазоне от 20 до 500 микрон, для введения посредством быстрой ингаляции через носовые проходы из контейнера, удерживаемого на близком расстоянии к носу, и капли в нос, включающие от 0,2 до 5% м/о активного соединения в водном или масляном растворе или суспензии.
Применение композиций
Композиции по настоящему изобретению могут применяться в качестве лекарственного средства, например для лечения, предупреждения и/или торможения прогрессирования неврологических нарушений. Соответственно, композиция, раскрытая в данном описании, может использоваться для получения лекарственного средства, применяемого для лечения или предупреждения неврологических нарушений.
В предпочтительном варианте осуществления такие нарушения выбраны из группы, состоящей из мигрени, депрессии, болезни Альцгеймера, болезни Паркинсона, шизофрении, эпилепсии, инсульта, менингита, бокового амиотрофического склероза, бессоницы, менингита, нарушения памяти, рассеянного склероза, нарколепсии, инсульта, травматического повреждения мозга и стресса.
Предпочтительно композиция изготовлена для интраназальной доставки.
ПРИМЕРЫ
Данное раскрытие дополнительно проиллюстрировано следующими примерами, которые не должны истолковываться как дополнительные ограничения.
В основном, при применении на практике настоящего изобретения используют, если не указано иное, традиционные технологии химии, молекулярной биологии, метод рекомбинантных ДНК и иммунологии (в особенности, например, иммуноглобулиновую методику). См. например, Sambrook, Fritsch и Maniatis, Molecular Cloning: Cold Spring Harbor Laboratory Press (1989); Antibody Engineering Protocols (Methods in Molecular biology), 510, Paul, S., Humana Pr (1996); Antibody Engineering: A Practical Approach (Practical Approach Series, 169), McCafferty, Ed., IrI Pr (1996); Antibody: A Laboratory Manual, Harlow et al., C.S.H.L. Press, Pub. (1999); Current Protocols in Molecular Biology, eds. Ausubel et al., John Wiley & Sons (1992). См. также, например, Polymeries US 6803438; EP 1701741 A2; EP 1648518A2; WO 05065712A2; WO 05007197A2; EP 1496941A1; EP 1222217B1; EP 1210093A4; EP 1461369A2; WO 03089010A1; WO 03059973A2 и EP 1210093A1); Genentech US 20070092940A1 и EP 1240337B1; и ESBATech U.S.S.N. 60/899907, PCT/CH 2009/000225, PCT/CH2009/000222, PCT/CH2009/000222, WO 06/131013 и WO 03097697A2.
Очистка ESBA 105
ESBA 105, фрагмент одноцепочечного антитела анти-TNF-альфа с молекулярной массой 26,3 кДа, очищали от клеток хозяина Escherichia coli, как описано ранее (Furrer et al. (2009) Invest Opthalmol Vis Sci 50, 771-778; Ottiger et al. (2009) Invest Opthalmol Vis Sci 50, 779-786). Кратко, ESBA 105 получали посредством рекомбинатной экспрессии в E. coli BL21 (DE3) с повторной укладкой цепи из вирусных включений и последующей эксклюзионной хроматографии. Для исследований на животных ESBA 105 готовили в 10 мг/мл (для интраназального введения) или 0,5 мг/мл (для внутривенной инъекции) в 50 мМ фосфата натрия, 150 мМ NaCl, pH 6,5. Содержание эндотоксина при определении в анализе коагулирующей активности ЛАЛ составляло ниже 0,1 Ед во всех составах, используемых для экспериментов in vivo.
Интраназальное введение синего Эванса
Оптимальные условия для выделенных белков в ЦНС сначала определяли путем введения 0,3% синего Эванса в 0,9% NaCl интраназальным путем мышам Balb/c. Затем животных умерщвляли посредством ингаляции CO2 в заранее определенные моменты времени и их легкие и желудки отбирали и визуально изучали для выявления присутствия синего Эванса. Оптимальных условий достигали посредством содержания животных под изофлурановой (Provet, Lyssach, Switzerland) анестезией в положении лежа на спине и обработки каждой ноздри 2 мкл синего Эванса с пятиминутными интервалами до тех пор, пока не достигали всего 40 мкл (45 мин) (таблица 1). Впоследствии данный протокол применяли для интраназального введения ESBA 105 во всех вариантах осуществления, описанных в данном описании.
Интраназальное и внутривенное введение ESBA 105
У всех животных брали анализы десять дней перед интраназальным или внутривенным дозированием ESBA 105. Интраназальное введение ESBA 105 выполняли под изофлурановой (Provet, Lyssach, Switzerland) анестезией. Мышей размещали в положении лежа на спине и всего 40 мкл (400 мкг) ESBA 105 вводили с помощью пипетки в 2 мкл каплях, обрабатывая каждую ноздрю каждые пять минут на протяжении в общем 45 минут. Для интраназального PK исследования по четыре животных умерщвляли через 1, 2, 4, 6, 8, 10, 12 и 24 часа после первой интраназальной инстилляции. В некоторых экспериментах 3 мМ Pz-пептида (4-фенилазобензилоксикарбонил-Pro-Leu-Gly-Pro-D-Arg; Bachem, Bubendorf, Switzerland) вещество, способствующее проникновению, которое облегчает перенос параклеточных маркеров посредством запуска открывания межклеточных контактов кратковременным двусторонним образом (Yen и Lee (1994) Journal of Controlled Release 28, 97-109), добавляли в препарат ESBA 105. По четыре животных умерщвляли через 1, 2 и 4 часа после первого введения. Для внутривенной инъекции мышей помещали в фиксатор, и 40 мкг (80 мкл) ESBA 105 инъецировали в хвостовую вену. Внутривенную дозу выбирали для наилучшего соответствия системной экспозиции согласно площади под кривой концентрация в крови - время (AUC), наблюдаемой на протяжении 4-часового периода с интраназальным введением, составляющим 400 мкг ESBA 105. По два животных умерщвляли в каждый момент времени (1, 2 и 4 часа). Во время умервщления мыши пребывали в глубокой анестезии смесью кетамина (Ketasol 100, 65 мг/кг; Pharmacy, Schlieren, Switzerland), ксилазина (Rompun, 13 мг/кг; Provet, Lyssach, Switzerland) и ацепромазина (Prequillan, 2 мг/кг; Arovet, Zollikon, Switzerland). Образцы крови собирали путем пункции сердца перед перфузией мышам 20 мл PBS. Мозг осторожно брали и разделяли на обонятельную луковицу, головной мозг, включая таламус и гипоталамус, мозжечок и ствол мозга. Ткани взвешивали, замораживали в сухом льду и хранили при -80°C до анализа.
Препарирование ткани
Ткани препарировали для анализа следующим образом. 100 мкл лизис-буфера (10 мМ Tris, pH 7,4, 0,1% SDS с коктейлем ингибиторов протеиназ (Roche Diagnostics, Rotkreuz, Switzerland)) добавляли к 15 мг ткани мозга. Ткани разрушали ультразвуком в течение 5 секунд (8 циклов, 100% интенсивность) (Sonoplus, Bandelin, Berlin, Germany), центрифугировали и супернатанты подвергали определению концентрации ESBA 105, основанном на ELISA.
Количественное определение ESBA 105 в сыворотке и ткани мозга
Концентрации ESBA 105 определяли посредством трехкратных анализов каждого образца прямым ELISA. 96-луночные планшеты (NUNC MaxiSorp; Omnilab, Mettmenstetten, Switzerland) покрывали 0,5 мкг/мл человеческим TNF-альфа (Peprotech, London, UK) в PBS на всю ночь при 4°C. Между каждой из следующих стадий планшеты трижды отмывали TBS-T (0,005% Tween20; Axon Lab, Baden-Dattwyl, Switzerland), используя микроустройство для отмывки иммунологических планшетов (ASYS Atlantis, Salzburg, Austria). Участки неспецифического связывания насыщали посредством 1,5-часового инкубирования в PBS/1% BSA/0,2% Tween20. Предварительное разведение каждого образца получали в буфере для разведения (PBS, 0,1% BSA, 0,2% Tween20), содержащем 10% соответствующего матрикса (обонятельная луковица, головной мозг, мозжечок, ствол мозга или сыворотка). Стандартные эталонные ряды разведений (50-0,5 нг/мл) ESBA 105 готовили в буфере для разведения/10% соответствующего матрикса. Предварительно разведенные образцы и стандартные эталонные разведенные растворы затем добавляли в лунки и планшеты инкубировали в течение 1,5 часов при комнатной температуре. Связанный ESBA 105 определяли с помощью биотинилированных аффинных очищенных поликлональных кроличьих анти-ESBA 105 антителами (AK3A, ESBATech, Schlieren, Switzerland), которые разводили 1:20000 в буфере для разведения (1,5 ч, комнатная температура). AK3A, в свою очередь, определяли с помощью полипероксидаз хрена-стрептавидина (Stereoспецифической Detection Technologies, Baesweiler, Germany) при концентрации 0,2 нг/мл в буфере для разведения. POD (Roche Diagnostics, Rotkreuz, Switzerland) использовали в качестве подложки пероксидаз и цветную реакцию останавливали спустя 2-20 минут (в зависимости от интенсивности цвета) путем добавления 1M HCl. Спектральную поглощательную способность измеряли при 450 нм на планшет-ридере (Sunrise; Tecan, Maennedorf, Switzerland) и концентрации ESBA 105 в образцах вычисляли с помощью параболической регрессии от калибровочной кривой (GraphPad Prism 4,03; GraphPad Software, Inc., San Diego, CA). Минимальная поддающаяся количественному определению концентрация (LOQ) ESBA 105 составила 5 нг/мл в сыворотке и 33 нг/мл в ткани мозга соответственно. Неразведенные образцы, которые имели результат в виде сигналов ниже нижней границы количественного анализа, помещали в LOQ для математического определения и графического изображения.
Пример 1
Методика интраназального введения
Данный пример демонстрирует, что результатом низкого объема при назальном введении является специфическая доставка в ЦНС. Для эффективной и специфической доставки лекарственного средства в ЦНС используемое вещество должно оставаться в носовой полости; однако некоторые исследования показали, что интраназально используемое вещество может мигрировать в дыхательную систему и желудочно-кишечный тракт в результате дыхания и глотания (Eyles et al. (1999) Int J Pharm 189, 75-79; Klavinskis et al. (1999) J Immunol 162, 254-262; Lundholm et al (1999) Vaccine 17, 2036-2042; Trolle et al. (2000) Vaccine 18, 2991-2998). Специалистам в данной области будет понятно, что ряд аспектов (например, анестезия, положение животного и объем и частота введения) может оказывать влияние на время задержания вводимого соединения в носовой полости. Используя описанный выше протокол интраназального введения, применяли синий Эванса в качестве индикатора для оценки распределения после введения красителя после интраназального введения. 40-50 мкл синего Эванса вводили интраназально с помощью нескольких различных способов. Во-первых, единичную дозу вводили либо анестезированным, либо бодрствующим мышам, удерживаемым в положении лежа на спине, результатом чего являлась миграция красителя как в легкие, так и в желудок в обоих случаях. Во-вторых, единичную дозу вводили анестезированным животным в течение 30-50 минут в положении лежа на спине вместо только 3 минут. В-третьих, объем красителя вводили в двух отдельных 10 мкл дозах, которые вводили с 5-минутными интервалами. Ни один из данных способов не уменьшил миграцию синего Эванса в легкие и желудок. В заключение, объемы до 2 мкл использовали для анестезированных животных в положении лежа на спине, что привело только к минимальным следам синего Эванса в легких, и голубое окрашивание желудка полностью отсутствовало (таблица 1).
Пример 2
Доставка ESBA 105 В ЦНС
Данный пример демонстрирует, что интраназальное введение scFv приводит к доставке scFv в ЦНС. ESBA 105 (SEQ ID NO:1) представляет собой одноцепочечные антитело, которое специфически связывает и ингибирует TNF-альфа (см. например, WO 06/131013, которая включена в данное описание посредством ссылки). При последующем интраназальном введении посредством описанного выше протокола ESBA 105 достигал значительных концентраций во всех областях мозга, подвергаемого анализу, и демонстрировал двухвершинное распределение с течением времени. Максимальные концентрации ESBA 105 (Cmax) в мозжечке и стволе мозга достигались через один час после первой инстилляции с пиковыми концентрациями в обонятельной луковице и головном мозге спустя один час. Затем уровни ESBA 105 уменьшались во всех областях мозга, но вновь повышались спустя 6-12 часов с получением отчетливой второй, на более низком уровне, пиковой концентрации в обонятельной луковице, мозжечке и стволе мозга (фиг.1), что указывает на вероятное существование двух различных путей миграции. Наиболее высокие концентрации были измерены в обонятельной луковице и стволе мозга. В обонятельной луковице, которая связана с носовой полостью посредством обонятельной системы (N. olfactorius), концентрации достигали 9455 нг/мл. В стволе мозга, который связан с носовыми проходами посредством периферической тройничной системы (N. trigeminus), концентрации были даже еще более высокими (11067 нг/мл) (таблица 2). Cmax в головном мозге (975 нг/мл) достигалась несколько позже (2 часа) и приблизительно в семь-десять раз ниже, чем в мозжечке или обонятельной луковице соответственно. Данные результаты демонстрируют, что ESBA 105 сначала достигал обонятельной луковицы и ствола мозга, и из них распределялся в головной мозг и мозжечок. Аналогично стволу мозга и мозжечку, Cmax в сыворотке достигалась через один час после первого введения ESBA 105 и достигала пика второй раз между пятью и 10 часами. Интересно то, что уровни ESBA 105 оставались почти постоянными на протяжении последних 12 часов (фиг. 1).
Пример 3
Доставка ESBA 105 в ЦНС является непосредственной
Данный пример демонстрирует, что интраназальное введение ESBA 105 приводит к непосредственной доставке в ЦНС, а не через кровоток. Для определения, мигрирует ли ESBA 105 непосредственно через ГЭБ в ЦНС из носовой полости или опосредованно через системное всасывание и последующую доставку в мозг через ГЭБ, интраназальное введение сравнивали наряду с внутривенной инъекцией, как описано выше. При последующей внутривенной инъекции значительные концентрации ESBA 105 были достигнуты во всех анализируемых областях, кроме головного мозга, где концентрации были ниже нижней границы количественного анализа. Однако значительно более высокие концентрации лекарственного средства были получены во всех областях мозга после интраназального введения (Фиг. 2). Максимальные уровни ESBA 105 в мозжечке и стволе мозга при интраназальной дозировке были приблизительно в 10-18 раз более высокими, чем таковые после внутривенной инъекции. Более того, Cmax в обонятельной луковице была более чем 60 раз выше при интраназальном против внутривенного введения (таблица 3). Неожиданно несмотря на то что дозировку устанавливали для получения одинаковых системных экспозиций для обоих путей, концентрации в сыворотке были явно ниже после интраназального введения (Фиг. 2), достигая 6006 нг/мл, тогда как Cmax после внутривенной инъекции была более чем в 10 раз более высокой (63709 нг/мл) (таблица 3). После внутривенной инъекции максимальные концентрации (Cmax) и экспозиции (AUC) в обонятельной луковице, мозжечке и стволе мозга достигали таких же значений 202, 257 и 174 нг/мл для Cmax и 448, 567, и 416 нг-ч/мл для AUC соответственно. Cmax в тканях мозга после внутривенной инъекции определяли через 2 часа, а через 4 часа ESBA 105 определить не смогли. В противоположность, после интраназального введения во всех областях мозга были получены явно более высокие концентрации. Наиболее высокие значения были получены для обонятельной луковицы (Cmax: 12586 нг/мл; AUC: 23130 нг-ч/мл) с последующим стволом мозга (Cmax: 3169 нг/мл; AUC: 7942 нг-ч/мл), мозжечом (Cmax: 2819 нг/мл; AUC: 5908 нг-ч/мл) и головным мозгом (Cmax: 1831 нг/мл; AUC: 2951 нг-ч/мл). Более того, в противоположность внутривенной инъекции через четыре часа после интраназального введения в областях мозга все концентрации ESBA 105 еще определялись. Данные результаты демонстрируют, что ESBA 105 способен проникать из крови через ГЭБ в ЦНС и что наиболее эффективным путем доставки является интраназальное введение (таблица 3).
Пример 4
PZ-пептид улучшает доставку ESBA 105 через ГЭБ
Данный пример демонстрирует, что Pz-пептид значительно улучшает интраназальную доставку scFv в ЦНС. Специфически, способность Pz-пептида функционировать в качестве вещества, способствующего проникновению, для транспорта лекарственных средств через ГЭБ была исследована посредством добавления 3 мМ Pz-пептида к ESBA 105 и оценки переноса в мозг. В присутствии Pz-пептида Cmax в обонятельной луковице, головном мозге и мозжечке достигалась раньше, чем в случае одного ESBA 105 (один вместо двух часов после первого дозирования) (таблица 4). Более того, добавление Pz-пептида привело к 2-3-кратному увеличению Cmax в обонятельной луковице и головном мозге (от 7309 до 15786 нг/мл и от 1133 до 3417 нг/мл соответственно), тогда как Cmax в стволе мозга оставалась неизменной. Соотношения для Cmax ткань-кровь были явно более высокими в обонятельной луковице и головном мозге при совместном введении ESBA 105 и Pz-пептида, чем только при ESBA 105 (фиг. 3A). Влияние на доставку в мозжечок, ствол мозга и сыворотку было, однако, менее выражено. Резюмируя, Pz-пептид может улучшать доставку белков с большой молекулярной массой в обонятельную луковицу и головной мозг без повышенного системного воздействия (фиг.3). По этой причине с целью терапевтического применения Pz-пептид может улучшать доставку лекарственного средства без повышенного риска системных побочных эффектов (таблица 4).
Эквиваленты
Специалистам в данной области будет очевидно, или в процессе рутинной экспериментальной работы они смогут обнаружить множество эквивалентов конкретных вариантов осуществления изобретения, раскрытых в данном описании. Предусматривается, что такие эквиваленты охватываются следующей формулой изобретения.
Реферат
Группа изобретений относится к биофармакологии и предоставляет композицию, способ и набор, которые включают одноцепочечное антитело scFv и вещество, способствующее проникновению, выбранное из аминокислотных последовательностей, при этом пептид связан N-концом с защитной группой, при этом вещество, способствующее проникновению, облегчает доставку больших макромолекул (т.е. более чем 10 кДа) через межклеточные контакты. Группа изобретений обеспечивает доставку терапевтических антигенсвязывающих полипептидов в ЦНС посредством интраназального введения, для лечения неврологических нарушений. 3 н. и 5 з.п. ф-лы, 14 ил., 8 табл., 4 пр.





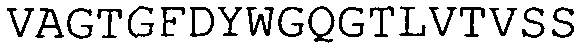




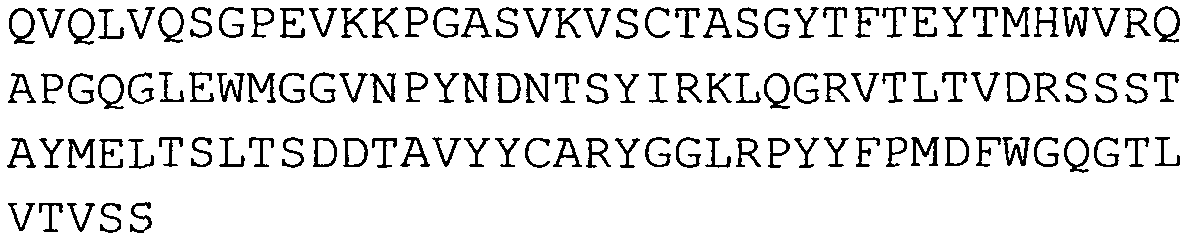











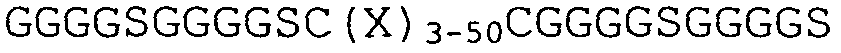











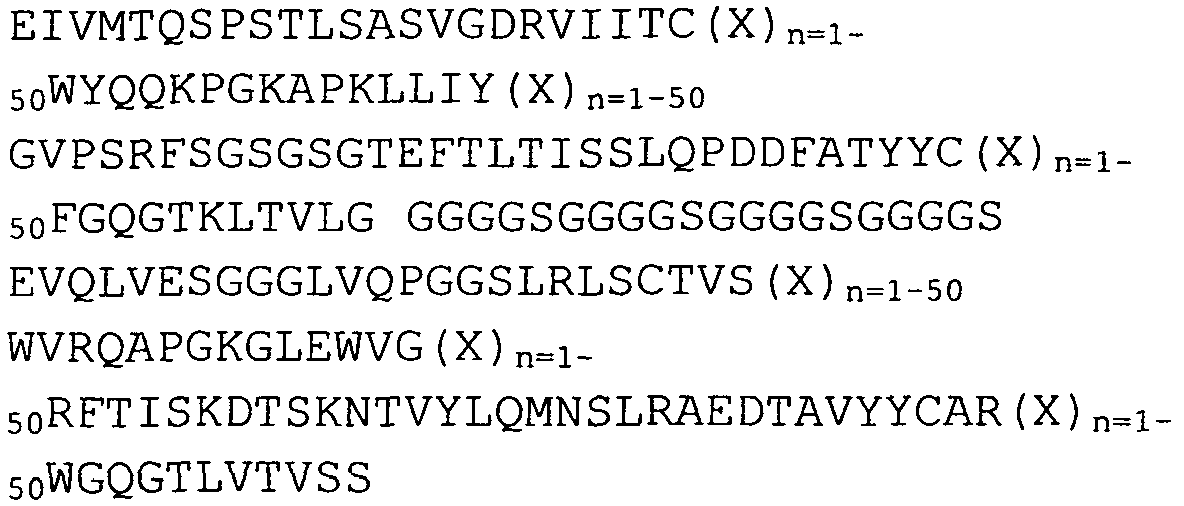

Комментарии