Фармацевтическая композиция, содержащая микрочастицы с поверхностным покрытием - RU2508093C2
Код документа: RU2508093C2
Чертежи









Описание
Область техники
Настоящее изобретение относится к фармацевтической композиции для чресслизистого введения и способу ее получения. Конкретнее, настоящее изобретение относится к новой фармацевтической композиции для чресслизистого введения, включающей комплекс, состоящий из лекарственного средства, малой частицы и полимера поверхностного покрытия, где поверхность малой частицы покрыта полимером поверхностного покрытия, лекарственное вещество закреплено на поверхности малой частицы посредством полимера поверхностного покрытия, и данный комплекс образован в результате нековалентного взаимодействия между малой частицей и полимером поверхностного покрытия, и конкурирующего электростатического взаимодействия между полимером поверхностного покрытия и лекарственным веществом; и способу ее получения.
Предпосылки создания изобретения
Достижения в области биотехнологии сделали возможным обнаружение большого числа терапевтических соединений, таких как пептиды, белки, полисахариды, полинуклеиновые кислоты, siRNA (малые интерферирующие РНК), РНК, антитела, антигены, низкомолекулярные лекарственные вещества и тому подобное. Однако многие из этих соединений из-за их физико-химических свойств сложно вводить в организм посредством способов, отличных от инъекций (например, большой молекулярный вес, гидрофильность, нестабильность и тому подобное). Для некоторых из этих соединений требуется многократное ежедневное дозированное введение посредством инъекции. Особой проблемой, однако, является то, что пациенты молодого возраста не всегда соблюдают этот режим дозированного введения данных соединений (непатентные документы 1 и 2).
Когда введение происходит перорально или посредством других чресслизистых путей введения через слизистую оболочку, например, легких, ротовой полости, влагалища, носа и тому подобного, всасывание этих лекарственных веществ затруднено из-за их физического размера и гидрофильности. Более того, эти лекарственные вещества имеют склонность к разрушению под действием ферментов, таких как пептидазы и протеазы, что представляет собой проблему особенно в желудочно-кишечном тракте. Для того чтобы усовершенствовать транспорт этих лекарственных веществ через слизистые поверхности, лекарственные формы, содержащие усилители всасывания, применяли с некоторым успехом, особенно при доставке через трансназальный путь или пульмональный путь введения. Тем не менее, существует потребность в разработке эффективных способов и композиций для осуществления транспорта соединений, имеющих более высокий молекулярный вес, через поверхности слизистых оболочек.
Системы, использующие малые частицы, такие как наночастицы, были широко изучены в качестве средства транспорта полимерных лекарственных веществ, таких как пептиды и белки, через поверхности слизистых оболочек (непатентные документы 3-5)). В случае использования пептидных или белковых лекарственных средств было предположено, что их стабильность является низкой, если данное лекарственное средство не инкапсулировано в матриксе наночастицы. Однако инкапсулирование этих соединений внутрь наночастиц представляет собой сложность из-за большого размера этих соединений и обычно гидрофобной среды в матриксе наночастицы, и это в результате приводит к очень низкой нагрузочной способности и, следовательно, необходимости введения больших количеств наночастиц на поверхность слизистой оболочки. Более того, в публикации было разъяснено, что транспорт наночастиц через слизистую оболочку не является легко достижимым (непатентный документ 6).
Ссылки на уже известный уровень техники
Непатентные документы
Непатентный документ 1: Drug Discovery Today, Vol.7, pp.1184-1189 (2002)
Непатентный документ 2: J. Control. Rel., Vol.87, pp.187-198 (2003)
Непатентный документ 3: J. Pharm. Sci., Vol.96, pp.473-483 (2007)
Непатентный документ 4: Biomaterials, Vol.23, pp.3193-3201 (2002)
Непатентный документ 5: Int. J. Pharm., Vol.342, pp.240-249 (2007)
Непатентный документ 6: J. Pharm. Sci., Vol.96, pp.473-483 (2007)
Краткое описание изобретения
Проблемы, которые будут решены посредством данного изобретения
Задача настоящего изобретения состоит в обеспечении фармацевтической композиции, которую можно использовать для эффективного применения низкомолекулярных лекарственных соединений и полимерных соединений, таких как пептиды и белки, способами, отличными от инъекции. Конкретнее, задачей настоящего изобретения является обеспечение фармацевтической композиции, включающей малые частицы для эффективного применения низкомолекулярных лекарственных соединений и полимерных лекарственных соединений, таких как пептиды и белки, посредством доставки через слизистую оболочку, такую как слизистая оболочка носа и тому подобное, где данная композиция имеет превосходную степень нагрузки лекарственным веществом и нагрузочную способность, по сравнению с общепринятыми композициями малых частиц для чресслизистого введения, и имеет повышенную стабильность лекарственного вещества. Также задачей настоящего изобретения является обеспечение способа получения данной фармацевтической композиции.
Способы решения проблем
Авторы настоящего изобретения сосредоточили свое внимание на чресслизистом введении с использованием системы малых частиц, таких как наночастицы, в качестве метода эффективного применения лекарственных соединений (например, пептида, белка, ДНК, РНК, siRNA, полисахарида, анититела, антигена, низкомолекулярного соединения и тому подобного) способами, отличными от инъекции, и провели тщательные исследования. В итоге, авторы настоящего изобретения обнаружили, что стабильность лекарственного вещества была заметно улучшена по сравнению с растворами композиций того же самого лекарственного вещества, в результате получения композиции, включающей комплекс, где комплекс лекарственное вещество-полимер поверхностного покрытия, который был сформирован в результате электростатического взаимодействия между лекарственным веществом и полимером поверхностного покрытия (а именно, полимера, который присоединен к поверхности малых частиц), был зафиксирован на поверхности малой частицы в результате нековалентного взаимодействия между данной малой частицей и данным полимером поверхностного покрытия. Более того, авторы настоящего изобретения обнаружили, что данная композиция имела превосходную нагрузочную способность лекарственным веществом по сравнению с композициями малых частиц типа, где лекарственное вещество инкапсулировано. На основании этих полученных данных авторы настоящего изобретения пришли к заключению, что система доставки лекарственного вещества, превосходящая общепринятые методы, может быть обеспечена с использованием данной композиции, что привело в результате к доработке настоящего изобретения.
Соответственно, настоящее изобретение представляет собой следующее.
[1] Фармацевтическая композиция для чресслизистого введения, включающая (a) лекарственное вещество, имеющее положительный или отрицательный заряд при предопределенном значении рН, (b) фармацевтически приемлемая малая частица и (c) фармацевтически приемлемый полимер поверхностного покрытия, допускающий наличие электрического заряда при данном значении рН, где поверхность данной малой частицы покрыта полимером поверхностного покрытия, данное лекарственное вещество зафиксировано на поверхности данной малой частицы посредством данного полимера поверхностного покрытия, и комплекс сформирован в результате нековалентного взаимодействия между данной малой частицей и полимером поверхностного покрытия, и конкурирующего электростатического взаимодействия между данным полимером поверхностного покрытия и данным лекарственным веществом.
[2] Композиция по вышеприведенному пункту [1], где данное нековалентное взаимодействие между данной малой частицей и полимером поверхностного покрытия представляет собой электростатическое взаимодействие.
[3] Композиция по вышеприведенным пунктам [1] или [2], где данное предопределенное значение рН представляет собой физиологическое значение рН в области введения.
[4] Композиция по любому из вышеприведенных пунктов [1]-[3], где данное лекарственное вещество выбрано из группы, состоящей из пептида, белка, ДНК, РНК, siRNA, полисахарида, антигена и низкомолекулярного лекарственного вещества.
[5] Композиция по любому из вышеприведенных пунктов [1]-[4], где данное лекарственное вещество представляет собой лекарственное вещество, способное обеспечить лечебный или вакцинный эффект.
[6] Композиция по вышеприведенному пункту [4], где данным лекарственным веществом является инсулин.
[7] Композиция по вышеприведенному пункту [4], где данное лекарственное вещество представляет собой по меньшей мере одно лекарственное вещество, выбранное из группы, состоящей из бромгексина, золмитриптана и их солей.
[8] Композиция по любому из вышеприведенных пунктов [1]-[7], где данный полимер поверхностного покрытия является сам по себе слабо растворимым в воде при предопределенном значении рН.
[9] Композиция по любому из вышеприведенных пунктов [1]-[8], где данный полимер поверхностного покрытия представляет собой по меньшей мере один полимер, выбранный из группы, состоящей из хитозана, полиаргинина, полиакриловой кислоты, поли-гамма-глутаминовой кислоты и их солей.
[10] Композиция по любому из вышеприведенных пунктов [1]-[9], где данный полимер поверхностного покрытия является мукоадгезивным и/или действует как стимулятор чресслизистого всасывания.
[11] Композиция по любому из вышеприведенных пунктов [1]-[10], где данная малая частица содержит полимер, имеющий карбоксильную группу или аминогруппу.
[12] Композиция по любому из вышеприведенных пунктов [1]-[11], где данная малая частица состоит из сополимера поли(молочная кислота - гликолевая кислота).
[13] Композиция по любому из вышеприведенных пунктов [1]-[12], где средний размер частиц комлекса при предопределенном значении рН составляет не менее 10 нм и не более 50 мкм.
[14] Способ получения композиции по вышеприведенному пункту [8], включающий
(a) смешивание лекарственного вещества, малой частицы и полимера поверхностного покрытия при значении рН, при котором полимер поверхностного покрытия легко растворим в воде, и
(b) доведение значения рН данной смеси до предопределенного значения рН.
[15] Способ получения композиции по любому из вышеприведенных пунктов [1]-[13], включающий
(a) смешивание лекарственного вещества, полимера поверхностного покрытия и малой частицы в условиях рН, при которых данное лекарственное вещество и данный полимер поверхностного покрытия имеют один и тот же знак заряда, и затем
(b) доведение значения рН данной смеси до значения рН, при котором знак заряда лекарственного вещества меняется на противоположный знак, и где данное лекарственное вещество представляет собой амфотерное лекарственное вещество.
[16] Способ получения по вышеприведенному пункту [15], где данная малая частица имеет заряд, противоположный знаком заряду данного лекарственного вещества и заряду полимера поверхностного покрытия в условиях рН на этапе (a).
[17] Способ получения композиции по любому из вышеприведенных пунктов [1]-[13], включающий
(a) добавление по капле раствора органического растворителя вещества данной малой частицы в водный раствор данного полимера поверхностного покрытия,
(b) испарение данного органического растворителя,
(c) добавление лекарственного вещества и перемешивание данной смеси и
(d) доведение значения рН данной смеси до предопределенного значения рН.
Эффективность данного изобретения
Применение композиции по настоящему изобретению делает возможным эффективное чресслизистое введение низкомолекулярных лекарственных веществ и полимерных лекарственных соединений, таких как пептиды и белки, которые до настоящего времени было сложно применять способом, отличным от инъекции. Данное лекарственное вещество, содержащееся в композиции по настоящему изобретению, формирует комплекс с полимером поверхностного покрытия с противоположным зарядом, и малой частицей, и таким образом имеет более высокую стабильность (например, стабильность в отношении ферментов, сохраняющая стабильность), чем когда содержится в композиции раствора, а также более высокую нагрузочную способность лекарственным веществом по сравнению с малой частицей, в которой лекарственное вещество инкапсулировано в матриксе данной малой частицы. Более того, возможно обеспечить замедленное высвобождение или быстрое высвобождение лекарственного вещества и контроль чресслизистого всасывания данного лекарственного вещества в зависимости от типа полимера поверхностного покрытия, который формирует комплекс с данным лекарственным веществом на поверхности данной малой частицы.
Краткое описание чертежей
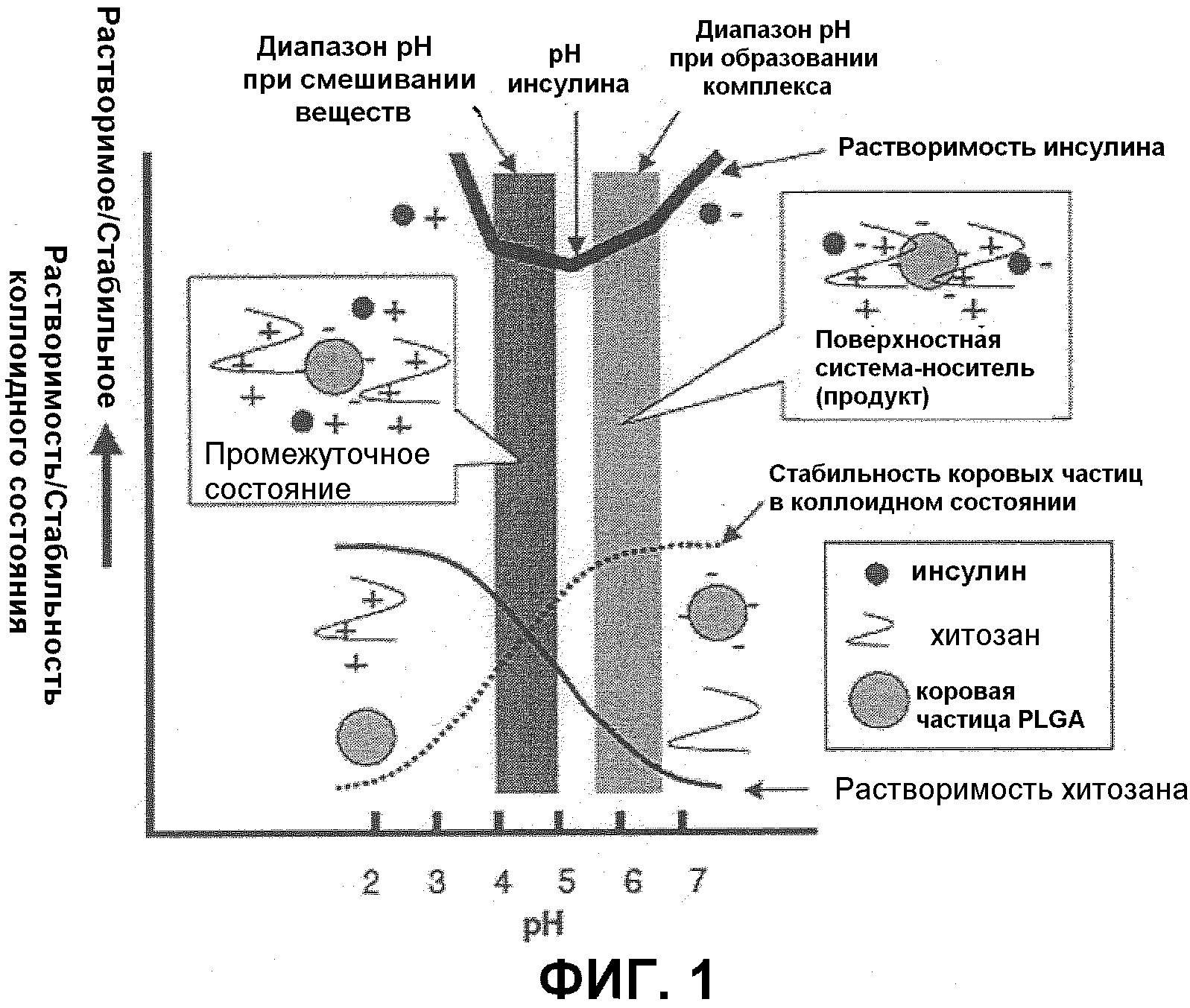
На Фиг.1 показан механизм получения малых частиц с поверхностным покрытием (поверхностная система-носитель), включающая коровые частицы PLGA с поверхностным покрытием из комплекса инсулин-хитозан.
На Фиг.2 представлены результаты образования комплекса инсулин-хитозан на поверхности малых частиц PLGA, где на левой гистограмме изображено высвобождение инсулина в буфере, имеющем рН 6,0, на правой гистограмме представлено высвобождение инсулина в буфере, имеющем рН 4,5, и вертикальная ось изображает количество (мкг) высвобожденного инсулина.
На Фиг.3 представлены результаты анализа время-пролетной масс-спектрометрии вторичных ионов (ToF-SIMS) коровых частиц PLGA с поверхностным покрытием комплексом инсулин-хитозан, где на верхней панели представлены результаты обнаружения пика m/z=33 в каждом образце (PLGA, хитозан (Хитозан), инсулин (Инсулин) и малые частицы с поверхностным покрытием (система-носитель)) (горизонтальная ось: m/z; вертикальная ось: интенсивность детекции), и на нижней панели представлено изображение распределения (слева) пика m/z=33 малых частиц с поверхностным покрытием и изображение общего распределения ионов (справа) в поле наблюдения.
На Фиг.4 представлено соотношение (%) нераспавшегося инсулина, оставшегося в растворе химотрипсина после культивирования, где верхний прямоугольник изображает раствор свободного инсулина и нижний прямоугольник соответствует малым частицам с поверхностным покрытием PLGA/хитозан/инсулин.
На Фиг.5 представлена принципиальная схема, объясняющая метод, используемый для исследования переноса инсулина через мембрану слизистой оболочки носа свиньи.
На Фиг.6 представлены результаты исследования переноса инсулина через мембрану слизистой оболочки носа свиньи, где горизонтальная ось изображает время (мин) после начала исследования переноса, а вертикальная ось отображает количество инсулина (нг/см2), которое было перенесено через дыхательную мембрану слизистой оболочки носа свиньи в данное время.
На Фиг.7 представлены результаты измерения размера частиц малых частиц с поверхностным покрытием или смеси хитозан/инсулин, где (а) изображает распределение по размерам малых частиц с поверхностным покрытием (имеющих коровые частицы; PLGA100/хитозан/инсулин=1250/900/200 мкг/мл), (b) изображает распределение частиц по размерам в смеси хитозан/инсулин (без коровых частиц; хитозан/инсулин=900/200 мкг/мл), горизонтальная ось отображает радиус частиц (нм) и вертикальная ось отображает интенсивность.
На Фиг.8 представлены результаты измерения размера малых частиц с поверхностным покрытием (PLGA100/хитозан/инсулин=250/180/40 мкг/мл) до лиофилизации и после лиофилизации и ресуспендирования, где (a) изображает распределение по размерам малых частиц с поверхностным покрытием до лиофилизации, и (b) изображает распределение по размерам малых частиц после лиофилизации и ресуспендирования, горизонтальная ось отображает радиус частиц (нм), а вертикальная ось отображает интенсивность.
На Фиг.9 представлен уровень глюкозы крови после назального введения крысам образца из Примера 7, или контрольного образца, где данные результаты демонстрируют относительное снижение уровня глюкозы (%) по сравнению с таковым до введения образца как 100%, среднее значение ± среднеквадратическая ошибка.
На Фиг.10 представлены результаты теста высвобождения in vitro с использованием образца из Примера 8 (N=3) (5 мМ изотонический буфер MES (pH 6), 37°C).
Описание вариантов осуществления
Настоящее изобретение обеспечивает фармацевтическую композицию для чресслизистого введения, содержащую (a) лекарственное вещество, имеющее положительный или отрицательный заряд при предопределенном значении рН, (b) фармацевтически приемлемую малую частицу и (c) фармацевтически приемлемый полимер поверхностного покрытия, способный иметь электрический заряд при данном значении рН. В данной композиции данная малая частица покрыта данным полимером поверхностного покрытия, данное лекарственное вещество зафиксировано на поверхности данной малой частицы посредством данного полимера поверхностного покрытия, и комплекс (в дальнейшем также упоминаемый как «малая частица с поверхностным покрытием») сформирован в результате нековалентного взаимодействия между данной малой частицей и полимером поверхностного покрытия, и конкурирующего электростатического взаимодействия между данным полимером поверхностного покрытия и данным лекарственным веществом.
«Фармацевтическая композиция для чресслизистого введения» означает фармацевтическую композицию, которая наносится на слизистую оболочку субъекта, нуждающегося в такой обработке и/или лечении, используя подходящий способ, такой как нанесение покрытия, разбрызгивание, распыление, наложение и тому подобное, когда данное лекарственное вещество может быть доставлено в ткань слизистой оболочки, или в кровеносную систему, или иммунную систему, через ткань слизистой оболочки для выработки лечебного или вакцинного эффекта. Данная фармацевтическая композиция может быть, например, абсорбирована через слизистую оболочку для системной доставки. В качестве примеров слизистых оболочек можно упомянуть такие слизистые оболочки, как слизистые легких, ротовой полости, глаза, влагалища, желудочно-кишечного тракта, носа и тому подобное. С точки зрения удобства применения предпочтительной является слизистая оболочка носа.
Фармацевтически приемлемый полимер поверхностного покрытия, упомянутый в пункте (с), из которого состоит поверхностный слой малой частицы, покрывает поверхность малых частиц, как указано выше. «Покрытие» здесь просто обозначает, что полимер поверхностного покрытия закреплен на поверхности, а не внутри малой частицы в результате нековалентного взаимодействия между данной малой частицей и данным полимером поверхностного покрытия, и необязательно означает, что вся поверхность данной малой частицы покрыта данным полимером поверхностного покрытия.
Полимер поверхностного покрытия предпочтительно является биологически совместимым. Используемый здесь термин «биологическая совместимость» означает, что вещество и продукты его разложения не имеют токсического или опасного эффекта на ткани тела или системы организма (например, систему кровообращения, нервную систему, иммунную систему и тому подобное). Данный биосовместимый полимер является подходящим для введения в организм человека или других животных. Дополнительно, полимер поверхностного покрытия более предпочтительно является биоразлагаемым. Используемый здесь термин «биоразлагаемость» означает, что вещество разлагается внутри живого организма в результате ферментативного, химического или физического процесса или тому подобного в течение приемлемого промежутка времени для формирования более малых химических соединений. Способы оценки биосовместимости и биоразлагаемости хорошо известны в области данного изобретения.
Данный полимер поверхностного покрытия может представлять собой природный полимер или синтетический полимер. Поскольку данный полимер поверхностного покрытия образует ионную связь с лекарственным веществом на поверхности малой частицы при предопределенном значении рН, необходимо, чтобы данный полимер имел заряд со знаком, противоположным заряду лекарственного вещества при предопределенном значении рН. При необходимости, более одного полимера поверхностного покрытия можно использовать в комбинации для данного полимера поверхностного покрытия, при условии, что они способны иметь заряды с тем же знаком при предопределенном значении рН.
Фармацевтическую композицию по настоящему изобретению можно получить, например, посредством нижеупомянутого способа получения; когда композиция получена данным способом получения, даже если полимер поверхностного покрытия сам по себе слабо растворим в воде при предопределенном значении рН, данная композиция может быть получена посредством смешивания данного полимера поверхностного покрытия с данным лекарственным веществом и данными малыми частицами при значении рН, при котором данный полимер поверхностного покрытия с легкостью растворяется в воде, а затем доводя значение рН данной смеси до предопределенного значения рН. Следовательно, для данного полимера поверхностного покрытия можно использовать не только полимеры, которые легко растворимы в воде при предопределенном значении рН, но также полимеры, которые слабо растворимы в воде при предопределенном значении рН.
Полимеры, которые можно использовать в качестве полимера поверхностного покрытия, могут быть выбраны, но неограничены ими, из полианионных или поликатионных полисахаридов, полиаминокислот или других заряженных полимеров. Данный полимер выбран соответствующим образом, исходя из типа используемого лекарственного вещества, заряда данного полимера поверхностного покрытия и данного лекарственного вещества, и тому подобного.
Полианионные полисахариды, которые можно использовать в настоящем изобретении, означают полисахарид, который имеет одну или несколько кислотных полярных групп, таких как карбоксильная группа, сернокислая группа или фосфорнокислая группа, в составном звене. Примеры таких полианионных полисахаридов включают, но не ограничиваются ими, хондроитинсульфат, сернокислый декстран, карбоксиметилцеллюлозу, альгиновую кислоту, пектин, гиалуроновую кислоту, их производные и соли, и тому подобное.
Поликатионные полисахариды, которые можно использовать в настоящем изобретении, означают полисахариды, которые имеют одну или несколько основных полярных групп, таких как аминогруппа, в составном звене. Примеры таких поликатионных полисахаридов включают, но не ограничивают ими, хитин, хитозан, их производные и соли, и тому подобное. Хитозан и производные хитозана могут быть выбраны из тех, которые имеют различные молекулярные массы, степени деацетилирования и, для производных хитозана, степени замещения.
Полианионные полиаминокислоты, которые можно использовать в настоящем изобретении, означают полиаминокислоту, чья изоэлектрическая точка находится в кислотной части физиологического рН; примеры их включают, но не ограничиваются ими, полиглутаминовую кислоту, полиаспарагиновую кислоту, их производные и соли, и тому подобное.
Поликатионные полиаминокислоты, которые можно использовать в настоящем изобретении, означают полиаминокислоту, чья изоэлектрическая точка находится в основной части физиологического рН; примеры их включают, но не ограничиваются ими, полилизин, полиаргинин, их производные и соли, и тому подобное.
Примеры полимеров, которые можно использовать в качестве полимера поверхностного покрытия, отличающиеся от вышеупомянутых полисахаридов и полиаминокислот, включают полиэтиленимин, полиакриловую кислоту, их производные и соли, и тому подобное.
Полимер поверхностного покрытия может быть полиэтиленгликолированным (ПЭГилированный) и/или гликозилированным.
Полимер поверхностного покрытия дополнительно может быть мукоадгезивным и/или действовать в качестве стимулятора чресслизистого всасывания. Примеры мукоадгезивных полимеров включают хитозан, полиакриловую кислоту, альгинат натрия, карбоксиметилцеллюлозу и тому подобное, а также их ПЭГилированные полимеры, и тому подобное. Примеры полимеров, которые действуют в качестве стимуляторов чресслизистого всасывания, включают хитозан, полиакриловую кислоту, полиаргинин, их соли и производные, и тому подобное.
Специалист, обладающий обычными навыками в данной области техники, может определить молекулярную массу полимера поверхностного покрытия, принимая во внимание такие факторы, как скорость деградации, механическая прочность, растворимость, лекарственное вещество какого типа будет образовывать комплекс с данным полимером поверхностного покрытия, и тому подобное. Обычно, средневесовая молекулярная масса данного полимера поверхностного покрытия должна быть, предпочтительно, не менее 1000 Да, и более предпочтительно, не менее 2000 Да; предпочтительно, не более 1000000 Да, и более предпочтительно, не более 500000 Да, как определено с помощью гель-проникающей хромотографии. Соответственно, обычно, средневесовая молекулярная масса данного полимера поверхностного покрытия составляет, предпочтительно, между 1000-100000 Да, и более предпочтительно, между 2000-500000 Да. Например, средневесовая молекулярная масса хитина или хитозана может составлять между 1000-1000000 Да, и степень деацетилирования хитина или хитозана может составлять между 20-100%.
Композиция по настоящему изобретению обеспечивает возможность контроля скорости высвобождения лекарственного вещества как композиция с замедленным высвобождением или с быстрым высвобождением, и регуляции чресслизистого всасывания лекарственного вещества, на основании выбора данного полимера поверхностного покрытия. Специалист, обладающий обычными навыками в данной области техники, может должным образом выбрать полимер поверхностного покрытия таким образом, чтобы обеспечить необходимое фармакокинетическое свойство данной композиции.
Лекарственное вещество, используемое в данной композиции по настоящему изобретению, выбрано в соответствии с предполагаемым применением. В данной композиции по настоящему изобретению, поскольку лекарственное вещество связывается ионной связью с соответствующим полимером поверхностного покрытия на поверхности данной малой частицы, лекарственное вещество, которое можно использовать в этой композиции, должно иметь положительный или отрицательный заряд (а именно, иметь заряд противоположного знака с полимером поверхностного покрытия) при предопределенном значении рН. До тех пор пока выполняется это условие, любое лекарственное вещество можно использовать в композиции по настоящему изобретению. При необходимости можно использовать более одного лекарственного вещества в комбинации, при условии, что они способны иметь заряды одинакового знака при предопределенном значении рН.
Данным лекарственным веществом может быть, без ограничений, пептид, белок, ДНК, РНК, siRNA, полисахарид, антитело, антиген, низкомолекулярное соединение и тому подобное. Данная фармацевтическая композиция по настоящему изобретению может быть получена, например, посредством нижеупомянутого способа получения. В случае когда данная композиция получена нижеупомянутым способом получения, лекарственное вещество, допускающее изменение заряда (знака и интенсивности), исходя из изменения рН во время процесса изготовления, может быть чрезвычайно предпочтительно, поскольку возможно достаточное смешивание данного лекарственного вещества и полимера поверхностного покрытия в условиях степени заряженности, свободных от электростатического взаимодействия между данным лекарственным веществом и данным полимером поверхностного покрытия, а затем формирование ионной связи между ними посредством изменения рН. Примеры таких лекарственных веществ включают амфотерические лекарственные вещества, такие как пептиды и белки, которые могут быть положительно или отрицательно заряжены в зависимости от рН, лекарственные вещества, имеющие такую константу кислотной диссоциации (рКа) или константу диссоциации оснований (pKb), которая заметно меняет интенсивность заряда между процессом производства и в данной композиции, и низкомолекулярные лекарственные вещества в форме солей, таких как гидрохлорид, сульфат, ацетат и тому подобное, которые способны растворяться в воде и имеют заряд, который в меньшей степени зависим от значения рН.
Примеры лекарственных средств включают, но не ограничены ими, антигипертензивное средство, антигипотензивное средство, болеутоляющее средство, нейролептическое средство, антидепрессант, противоманиакальное средство, анксиолитическое средство, седативное средство, снотворное средство, противоэпилептическое средство, опиоидные агонисты, терапевтическое средство для лечения астмы, анестетическое средство, противоаритмическое средство, терапевтическое средство для лечения артрита, противосудорожное средство, ингибитор АПФ, противозастойное средство, антибиотик, антиангиальное средство, мочегонное средство, противопаркинсонное средство, бронхорасширяющее средство, средство, стимулирующее родовую деятельность, антидиуретическое средство, антилипемическое средство, иммунодепрессивное средство, регулятор иммунитета, противорвотное средство, противоинфекционное средство, противоопухолевое средство, противогрибковое средство, противовирусное средство, противодиабетическое средство, противоаллергическое средство, жаропонижающее средство, противоопухолевое средство, средство против подагры, антигистаминное средство, противозудное средство, регулятор остеогенеза, сердечно-сосудистое средство, гипохолестеринемическое средство, противомалярийное средство, фармацевтическое средство для прекращения курения, противокашлевое средство, отхаркивающее средство, муколитическое средство, средство против заложенности носа, агонист допамина, фармацевтическое средство для желудочно-кишечного тракта, миорелаксант, блокатор нервно-мышечного проведения, парасимпатолитическое средство, простагландин, стимулирующее лекарственное средство, анорексигенное средство, тиреоидное средство или антитиреоидное средство, гормон, средство против мигрени, средство против ожирения, противовоспалительное средство и тому подобное. Данное лекарственное средство может быть выбрано из различных пептидов, белков, полисахаридов, антигенов, антител, ДНК, РНК, siRNA, низкомолекулярных лекарственных соединений и тому подобного, которые предназначены для профилактической вакцинации, иммунотерапии, терапии антителами, генотерапии, супрессии экспрессии генов и тому подобного.
Конкретные примеры лекарственного средства включают, но не ограничиваются ими, инсулин, глюкагон, лейпролид, гормоны роста, паратиреоидный гормон, кальцитонин, фактор роста эндотелия сосудов, эритропоэтин, гепарин, циклоспорин, окситоцин, тирозин, энкефалин, тиреотропин-высвобождающий гормон, фолликулостимулирующий гормон, лютеинизирующий гормон, вазопрессин, аналоги вазопрессина, каталазу, супероксиддисмутазу, интерлейкин II, интерфероны, колониестимулирующий фактор, фактор некроза опухоли, меланоцитстимулирующий гормон, глюкагоноподобный пептид-1, глюкагоноподобный пептид-2, катакальцин, холецистокенин-12, холецистокенин-8, эксендин, гонадолиберин-ассоциированный пептид, инсулиноподобный белок, лейцин-энкефалин, метионин-энкефалин, леуморфин, нейрофизин, копептин, нейропептид Y, нейропептид AF, PACAP-ассоциированный пептид, гормон поджелудочной железы, пептид YY, уротензин, интестинальный пептид, адренокортикотропный пептид, эпидермальный фактор роста, пролактин, гормон, высвобождающий лютеинизирующий гормон (LHRH), агонист LHRH, фактор, высвобождающий гормон роста, соматостатин, гастрин, тетрагастрин, пентагастрин, эндорфины, ангиотензины, тиреотропин-релизинг гормон, гранулоцитарный колониестимулирующий фактор, гранулоцитарно-моноцитарный колониестимулирующий фактор, гепариназу, антигены на вакцину гриппа, столбнячные токсины, пептиды для противораковой вакцины, β-амилоид, иммуноглобулины, siRNA для лечения цирроза, siRNA для лечения рака, низкомолекулярные лекарственные средства, такие как бромгексин, гранисетрон, золмитриптан, суматриптан и тому подобное, и их фармацевтически приемлемые соли и тому подобное.
Как указано выше, данное лекарственное соединение и данный полимер поверхностного покрытия связываются друг с другом в результате электростатического взаимодействия на поверхности данной малой частицы, для образования комплекса лекарственное средство - полимер поверхностного покрытия. Относительно комбинации данного лекарственного средства и данного полимера поверхностного покрытия, формирующих комплекс, это может быть комбинация, в которой данное лекарственное средство положительно заряжено и данный полимер поверхностного покрытия отрицательно заряжен при предопределенном значении рН, или комбинация, в которой данное лекарственное средство отрицательно заряжено и данный полимер поверхностного покрытия положительно заряжен при предопределенном значении рН.
Вышеупомянутая фармацевтически приемлемая малая частица (несмотря на то, что термин «малая частица» в настоящем описании означает вышеупомянутую малую частицу (b), данная малая частица, иногда, может быть названа «малая коровая частица», с тем чтобы провести четкое различие между этим термином и «малой частицей с поверхностным покрытием») предпочтительно состоит из биосовместимого полимера(ов). Данный полимер может быть биоразлагаемым или бионеразлагаемым; с точки зрения безопасности для живого организма, биоразлагаемый полимер является предпочтительным. Данный полимер может представлять собой природный полимер или синтетический полимер.
Примеры биосовместимых и биоразлагаемых полимеров, которые можно использовать для малой частицы, включают, но не ограничиваются ими, полиэтиленгликоль (PEG), полимолочную кислоту (PLA), поли(гликолевую кислоту) (PGA), сополимер поли(молочная кислота - гликолевая кислота) (PLGA), блок-сополимеры PEG и PLGA (PEG-PLGA), полиангидриды, поли(ε-капролактон), полигидроксибутират, полиаминокислоты, полиортоэфиры, полифосфоэфиры, полидиаксанон, полиамидоэфиры, полифосфаген, полицианоакрилат, хитозан, производные хитозана, крахмал, производные крахмала, альбумин, фибрин, фибриноген, целлюлозу, коллаген, гиалуроновую кислоту, смеси и сополимеры этих веществ, и тому подобное.
Примеры биосовместимых и бионеразлагаемых полимеров, которые можно использовать для малой частицы, включают, но не ограничиваются ими, полиакрилат, полиакриловые эфиры, полоксамер, тетроновые кислоты, полиэтилен, полиметилметакрилат, эфиры полиметилметакрилата, полистирол, этиленвинилацетат, ацилированная ацетат-целлюлоза, полиуретан, поливинилхлорид, смеси и сополимеры этих веществ, и тому подобное.
Данная малая частица может быть гидрофильной или гидрофобной. Поскольку форму и размер данной малой частицы можно с легкостью поддерживать в процессе подготовки данной малой частицы и процессе подготовки малой частицы с поверхностным покрытием в водной системе, предпочтительной является гидрофобная малая частица. В качестве предпочтительных образцов, для малой частицы можно использовать гидрофобные полимеры, имеющие карбоксильную группу, или первичную, вторичную или третичную аминогруппу.
Специалист, обладающий обычными навыками в данной области техники, может определить молекулярную массу полимера для малой частицы, принимая во внимание такие факторы, как скорость деградации, механическая прочность и растворимость. Обычно средневесовая молекулярная масса данного полимера, как определено посредством гель-проникающей хроматографии, предпочтительно составляет не менее 1000 Да (Дальтон), и более предпочтительно, не менее 2000 Да; предпочтительно, не более 1000000 Да, и более предпочтительно, не более 500000 Да. Соответственно, средневесовая молекулярная масса данного полимера обычно составляет между 1000-1000000 Да, и более предпочтительно, между 2000-500000 Да.
Относительно размера данной малой коровой частицы, можно упомянуть частицу, имеющую среднюю крупность частицы не менее 1 нм, предпочтительно, не менее 5 нм, и более предпочтительно, не менее 10 нм, и частицу, имеющую среднюю крупность частицы не более 50 мкм, предпочтительно, не более 20 мкм, и наиболее предпочтительно, не более 10 мкм.
Размер частицы здесь относится к значению, полученному в результате измерения малых частиц, диспергированных в водном растворе при вышеупомянутом «предопределенном значении рН». Размер частиц представляет собой диаметр, определенный с помощью измерительного прибора для определения размера частиц и рассчитанный при допущении, что данные частицы имеют сферическую форму. Данный измерительный прибор для определения размера частиц и способ расчета средней крупности частиц являются соответствующим образом изменяемыми в зависимости от размера частиц. Конкретнее, в случае размера частиц, определяемого посредством аппарата для измерения динамического рассеяния света (обычно не более 7 мкм), размер определяют с помощью прибора для измерения динамического рассеяния света, и средний гидродинамический диаметр, определенный по интенсивности распределения рассеяния, используют в качестве средней крупности частиц. В случае большого размера частиц, неопределяемого посредством прибора для измерения динамического рассеяния света (обычно более 7 мкм), размер определяют с помощью прибора для определения методом лазерной дифракции распределения частиц по размерам, и средний диаметр, полученный в результате вычисления среднеарифметической плотности распределения, используют в качестве среднего размера частиц.
Здесь, средний размер малых коровых частиц, например, менее 10 нм, означает, что не менее чем 10%, предпочтительно не менее 20%, более предпочтительно, не менее 30%, еще более предпочтительно, не менее 40%, в особенности предпочтительно, не менее 50% среднего размера частиц максимального размера частиц, составляет не менее 10 нм в соотношении каждого максимального значения размера частицы в вышеупомянутом распределении интенсивности рассеяния, определенном с помощью прибора для измерения динамического рассеяния света (количественное отношение совокупной интенсивности рассеяния для каждого максимального значения размера частиц к совокупной интенсивности рассеяния для всех максимальных значений), или количественное отношение каждого максимального значения размера частицы в вышеупомянутой плотности распределения, определенной посредством прибора для определения методом лазерной дифракции распределения частиц по размерам (количественное отношение совокупной частоты для каждого максимального размера частиц к совокупной частоте для всех максимальных значений).
Когда композиция по настоящему изобретению применяется на слизистой оболочке, данная малая частица с поверхностным покрытием достигает слизистой оболочки, или может быть абсорбирована внутрь ткани слизистой оболочки и там высвободить лекарственные вещества. Затем данное лекарственное вещество попадает в систему кровотока. В случае, когда данная малая частица достаточно мала (например, размер данной малой частицы составляет не более 20 нм), она может пройти сквозь межклеточное пространство, чтобы достичь кровотока. Альтернативно, малая частица может быть захвачена М-клеткой или М-подобной клеткой в некоторых слизистых оболочках, например, слизистой оболочке носа или кишечника, и транспортирована в иммунную систему или лимфатическую систему.
Вышеупомянутая малая частица может быть получена различными способами, описанными в литературе. Примеры источников литературы включают Champion JA. et al., Proc. Natl. Acad. Sci. USA, Vol.104, pp.11901-4 (2007); Chattopadhyay P. et al., Adv. Drug Deliv. Rev., Vol.59, pp.443-53 (2007); Zhou WY et al., J. Mater. Sci. Mater. Med., Vol.19, pp.103-110 (2008); Schaffazick SR et al., Pharmazie, Vol.62, pp.354-60 (2007); Almeida AJ et al., Adv. Drug Deliv. Rev., Vol.59, pp.478-90 (2007); Muller, R.H., «Colloidal Carriers for Controlled Drug Delivery and Targeting: Modification, Characterization and In vivo Distribution», CRC Press (1991); Jorg Kreuter (ed.), Colloidal Drug Delivery Systems, Marcel Dekker (1994), и тому подобное. Примеры способов, которые можно использовать для получения малых частиц, включают нанопреципитацию, разделение фаз, эмульсию, самосборку, гомогенизацию под высоким давлением, комплексообразование, ионическую желатинизацию и тому подобное.
Как упомянуто выше, малая частица должна нековалентно взаимодействовать с полимером поверхностного покрытия для образования малой частицы с поверхностным покрытием. Здесь, нековалентное взаимодействие означает взаимодействия, не основанные на ковалентной связи, такие как электростатическое взаимодействие, гидрофобное взаимодействие, ван-дер-ваальсово взаимодействие, образование водородной связи и тому подобное. Среди них, например, в случае, когда используется электростатическое взаимодействие, данная малая частица должна представлять собой полимер, имеющий заряд со знаком, противоположным заряду полимера поверхностного покрытия при предопределенном значении рН, для того, чтобы обеспечить возможность электростатического взаимодействия. Соответственно, комбинация данного лекарственного вещества, данного полимера поверхностного покрытия и данного полимера для малой частицы, которые можно использовать для данной композиции, представляет собой комбинацию положительно заряженного лекарственного вещества, отрицательно заряженного полимера поверхностного покрытия и положительно заряженного полимера для малых частиц, все при предопределенном значении рН, или комбинацию отрицательно заряженного лекарственного вещества, положительно заряженного полимера поверхностного покрытия и отрицательно заряженного полимера для малых частиц, все при предопределенном значении рН. Требования по изоэлектрической точке (pI), константе кислотной диссоциации (рКа) и константе диссоциации оснований (pKb), которым должны соответствовать лекарственное средство, полимер поверхностного покрытия и полимер для малых частиц, чтобы получить такую комбинацию, следующие: значение pI или pKa или (14-pKb) данного лекарственного вещества и данного полимера для малых частиц выше, чем значение рН данной композиции после получения, и значение pI или pKa или (14-pKb) полимера поверхностного покрытия ниже, чем значение рН данной композиции после получения; или значение pI или pKa или (14-pKb) данного лекарственного вещества и данного полимера для малых частиц ниже, чем значение pH данной композиции после получения, и значение pI или pKa или (14-pKb) данного полимера поверхностного покрытия выше, чем значение рН данной композиции после получения. Определение изоэлектрической точки и/или константы кислотной диссоциации для каждого соединения находится в технической области деятельности специалиста с обычными навыками в данной области техники. Альтернативно, в случае низкомолекулярных лекарственных веществ в форме солей, таких как гидрохлорид, сульфат, ацетат и тому подобное, которые способны растворяться в воде и иметь заряд, данную композицию можно получить посредством объединения заряженного лекарственного вещества с полимером поверхностного покрытия, имеющего заряд со знаком, противополножным заряду лекарственного вещества в воде, и малой частицей, имеющей заряд с таким же знаком, как и лекарственное вещество в воде.
Предопределенное значение рН, а именно, рН композиции после получения, желательно определено как физиологическое значение рН в области введения для того, чтобы избежать локального раздражения. Как отмечалось выше, композицию по настоящему изобретению можно применять на слизистой оболочке, такой как слизистая оболочка легких, ротовой полости, слизистая глаза, влагалища, кишечника, носовой полости, и тому подобное, где физиологическое значение рН изменяется в этих различных слизистых оболочках. Например, физиологическое значение рН желудочно-кишечного тракта повышается по его длине приблизительно от рН 1 в желудке до рН 8 в толстой кишке; значение рН ротовой полости составляет приблизительно 6,8; значение рН жидкости из носовой полости находится в пределах от приблизительно 5,5 до 6,5; рН влагалища составляет приблизительно 4,5. Например, в случае, когда композицию по настоящему изобретению применяют на слизистой оболочке носа, предпочтительное значение рН данной композиции равно, например, по меньшей мере 6,0.
Как отмечалось выше, инсулин можно использовать в качестве лекарственного вещества в композиции по настоящему изобретению. Когда значение рН данной композиции равно 6,0, инсулин в данной композиции имеет отрицательный заряд, поскольку изоэлектрическая точка инсулина приблизительно рН 5,3. Следовательно, полимером поверхностного покрытия должен полимер, имеющий положительный заряд при значении рН 6,0. В случае когда электростатическое взаимодействие используется в качестве нековалентного взаимодействия для обеспечения взаимодействия между полимером поверхностного покрытия и малой частицей, в качестве предпочтительной малой частицы можно использовать малую частицу, состоящую из полимера, имеющего отрицательный заряд при рН 6,0. Таким полимером поверхностного покрытия может быть хитозан, и полимером для малой частицы может быть сополимер поли(молочная кислота - гликолевая кислота) (PLGA).
Как отмечалось выше, бромгексин, золмитриптан и их соли можно использовать в качестве лекарственного вещества в композиции по настоящему изобретению. В случае когда значение рН данной композиции равно от 6,0 до 7,0, полимером поверхностного покрытия должен быть полимер, имеющий отрицательный заряд при указанном значении рН, поскольку лекарственное вещество имеет положительный заряд в воде. В случае когда электростатическое взаимодействие используется в качестве нековалентного взаимодействия для обеспечения взаимодействия между полимером поверхностного покрытия и малой частицей, в качестве предпочтительной малой частицы можно использовать малую частицу, состоящую из полимера, имеющего положительный заряд при указанном значении рН. Примеры таких полимеров поверхностного покрытия включают полиакриловую кислоту, поли-гамма-глутаминовую кислоту и их соли, примеры малой частицы включают хитозановую малую частицу и аминомодифицированную полистирольную частицу.
В отношении размера малых частиц с поверхностным покрытием, можно отметить частицу, имеющую среднюю крупность не менее 10 нм, предпочтительно, не менее 20 нм, более предпочтительно, не менее 40 нм, и имеющую среднюю крупность не более 50 мкм, предпочтительно, не более 20 мкм и, более предпочтительно, не более 10 мкм.
Размер частицы здесь относится к значению, полученному в результате измерения малых частиц с поверхностным покрытием, диспергированных в водном растворе при вышеуказанном «предопределенном значении рН». Конкретнее, в случае, когда малые частицы с поверхностным покрытием представлены в форме суспензии, размер определяют после разведения данной суспензии до концентрации, подходящей для измерения, водным раствором, имеющим такое же значение рН (вышеупомянутое предопределенное значение рН), как и значение рН суспензии. В случае когда малые частицы с поверхностным покрытием находятся в лекарственной форме, отличной от суспензии, например сухой порошок, пластинка и тому подобное, что препятствует прямому измерению размера частиц, добавляют воду или подходящий буфер для получения суспензии, имеющей вышеуказанное «предопределенное значение рН», и затем размер частиц может быть определен. Размер частиц представляет собой диаметр, определенный с помощью измерительного прибора для определения размера частиц и рассчитанный при допущении, что данные частицы имеют сферическую форму. Данный измерительный прибор для определения размера частиц и способ расчета средней крупности частиц являются соответствующим образом изменяемыми в зависимости от размера частиц. Конкретнее, в случае размера частиц, определяемого посредством аппарата для измерения динамического рассеяния света (обычно не более 7 мкм), размер определяют с помощью прибора для измерения динамического рассеяния света, и средний гидродинамический диаметр, определенный по интенсивности распределения рассеяния, используют в качестве средней крупности частиц. В случае большого размера частиц, неопределяемого посредством прибора для измерения динамического рассеяния света (обычно более 7 мкм), размер определяют с помощью прибора для определения методом лазерной дифракции распределения частиц по размерам, и средний диаметр, полученный в результате вычисления среднеарифметической плотности распределения, используют в качестве среднего размера частиц.
Здесь, средний размер малых частиц с поверхностным покрытием, например, менее 10 нм, означает, что не менее чем 10%, предпочтительно не менее 20%, более предпочтительно, не менее 30%, еще более предпочтительно, не менее 40%, в особенности предпочтительно, не менее 50% среднего размера частиц максимального размера частиц составляет не менее 10 нм в соотношении каждого максимального значения размера частицы в вышеупомянутом распределении интенсивности рассеяния, определенном с помощью прибора для измерения динамического рассеяния света (количественное отношение совокупной интенсивности рассеяния для каждого максимального значения размера частиц к совокупной интенсивности рассеяния для всех максимальных значений), или количественное отношение каждого максимального значения размера частицы в вышеупомянутой плотности распределения, определенной посредством прибора для определения методом лазерной дифракции распределения частиц по размерам (количественное отношение совокупной частоты для каждого максимального размера частиц к совокупной частоте для всех максимальных значений).
Благодаря наличию малых частиц в качестве сердцевины, данная малая частица с поверхностным покрытием в композиции по настоящему изобретению имеет монодисперсный диаметр частиц по сравнению с комплексом, сформированным в результате простого смешивания полимера поверхностного покрытия и лекарственного вещества. Соответственно, структура данной малой частицы с поверхностным покрытием делает легким получение композиции с однородным качеством. Эта характеристика также является преимуществом настоящего изобретения.
Данная композиция по настоящему изобретению должна быть доставлена в виде препарата, обеспечивающего прямую доставку малой частицы с поверхностным покрытием в целевой участок слизистой оболочки. Их примеры включают легочное средство, пероральное средство, средство для буккального применения, внутриглазное средство, вагинальное средство, интраназальное средство, суппозитории и тому подобное.
В качестве легочного средства предпочтительным является летучий препарат, который доставляется в альвеолы с помощью приспособления для легочных ингаляций.
В качестве орального средства можно отметить обычные лекарственные формы для перорального введения, например, таблетки, гранулы, мелкоизмельченные гранулы, капсулы и тому подобное. Предпочтительными являются лекарственные формы, разработанные для высвобождения лекарственного вещества в тонком кишечнике, например, таблетка с кишечнорастворимым покрытием, гранула с кишечнорастворимым покрытием, капсула с кишечнорастворимым покрытием и тонкоизмельченные гранулы с кишечнорастворимым покрытием.
В качестве буккального средства, внутриглазного средства и интраназального средства можно отметить таблетку для медленного растворения в защечном кармане, буккальный спрей, глазные капли, капли в нос, аэрозоль, мазь, гель, крем, жидкость, суспензию, лосьон, сухой порошок, пластинку, пластырь и тому подобное.
В качестве вагинального средства можно отметить суппозиторий, мазь, гель, крем, жидкость, суспензию, лосьон, сухой порошок, пластинку, капсулу и тому подобное.
В качестве способов получения вышеупомянутых лекарственных форм можно использовать известные способы получения, обычно используемые в данной области. При необходимости, при изготовлении вышеупомянутых лекарственных форм носители, такие как инертный наполнитель, связующее вещество, дезинтегрирующий агент и увлажнитель, и различные дополнительные компоненты, такие как подслащивающие вещества, поверхностно-активные вещества, суспендирующие вещества, эмульгирующие вещества, красители, консерванты и стабилизирующие вещества, которые обычно используются для изготовления определенной лекарственной формы, могут быть соответствующим образом добавлены в подходящем количестве для приготовления данных лекарственных форм. Также, композиция по настоящему изобретению может быть сохранена в форме сухого порошка, полученного в результате лиофилизации суспензии, и тому подобного, и ресуспендирована посредством добавления воды к данному сухому порошку в процессе применения. Используя этот способ, можно избежать гидролиза лекарственного вещества, полимера для малой частицы и/или полимера поверхностного покрытия, для того чтобы увеличить стабильность сохранности данной композиции.
Предпочтительные относительные пропорции полимера для малой частицы, полимера поверхностного покрытия и лекарственного вещества в данной композиции по настоящему изобретению, изменяются в зависимости от используемой малой частицы, полимера поверхностного покрытия и лекарственного вещества и, следовательно, в целом не могут быть установлены универсально. Например, в случае, когда в качестве полимера для малой частицы используют сополимер поли(молочная кислота - гликолевая кислота) (PLGA), в качестве полимера поверхностного покрытия используют хитозан и в качестве лекарственного вещества используют инсулин, их весовое соотношение в данной композиции может быть PLGA:хитозан:инсулин=1:0,1-100:0,01-100.
Фармацевтическая композиция по настоящему изобретению является стабильной и низкотоксичной и может использоваться без риска. Частота приема и однократная доза изменяются в зависимости от используемого лекарственного вещества, состояния и массы тела пациента, пути введения, терапевтического алгоритма и тому подобного, и следовательно в целом не могут быть установлены универсально. Например, в случае когда композиция по настоящему изобретению, в которой в качестве лекарственного вещества используется инсулин, вводится трансназально пациенту с диабетом и тому подобным, в качестве одной из терапевтических стратегий, приблизительно от 2 мг приблизительно до 6 мг активного ингредиента (инсулин) может быть введено взрослому человеку (с массой тела приблизительно 60 кг) перед каждым приемом пищи.
Настоящее изобретение также обеспечивает способ получения вышеуказанной фармацевтической композиции. Данный способ по настоящему изобретению включает смешивание лекарственного вещества, полимера поверхностного покрытия и малых частиц в растворе с соответствующим значением рН, при желании изменяя значение рН для индукции электростатического взаимодействия между лекарственным веществом и полимером поверхностного покрытия, и нековалентного взаимодействия между полимером поверхностного покрытия и малой частицей. Данный способ не требует проведения термической обработки и тому подобного и поэтому удобен.
В данном способе комбинация лекарственного вещества, полимера поверхностного покрытия и малых частиц, и значение рН композиции по настоящему изобретению (предопределенное значение рН) определены предварительно. Эти факторы могут быть определены, как упомянуто выше в разъяснении композиции по настоящему изобретению. Малые частицы обычно подготовливают вышеуказанным способом перед смешиванием лекарственного вещества, полимера поверхностного покрытия и малых частиц. Затем лекарственное вещество, полимер поверхностного покрытия и малые частицы смешивают, при желании адаптируют значение рН, в результате чего получают малую частицу с поверхностным покрытием по настоящему изобретению. Данное смешивание и опционное регулирование значения рН включают любой из этапов, выбранных из группы, состоящей из следующего от a) до c):
a) смешивание лекарственного вещества и полимера поверхностного покрытия в растворе с рН, при котором не происходит образования их комплекса, добавление малой частицы в данный раствор, и изменения рН раствора для стимуляции образования комплекса лекарственного вещества с полимером поверхностного покрытия, и иммобилизации данного комплекса лекарственное вещество - полимер поверхностного покрытия на поверхности данной малой частицы;
b) смешивание лекарственного вещества и полимера поверхностного покрытия в растворе с рН, при котором происходит их комплексообразование, добавление малой частицы в данный раствор для получения комплекса лекарственное вещество - полимер поверхностного покрытия, зафиксированного на поверхности данных малых частиц;
c) смешивание малой частицы и полимера поверхностного покрытия в растворе для обеспечения фиксации данного полимера поверхностного покрытия на поверхности данной малой частицы, добавление лекарственного вещества в данный раствор и изменение значения рН для обеспечения формирования комплекса лекарственного вещества с полимером поверхностного покрытия, иммобилизованного на поверхности данной малой частицы.
В частности, в случае когда полимер поверхностного покрытия сам по себе слабо растворим в воде при предопределенном значении рН, желательно сначала (а) смешать лекарственное вещество, малую частицу и полимер поверхностного покрытия при значении рН, при котором данный полимер поверхностного покрытия без труда растворяется в воде, а затем (b) довести значение рН данной смеси до предопределенного значения рН.
Когда лекарственное вещество, которое изменяет знак заряда в зависимости от значения рН, а именно амфотерное лекарственное вещество, используют в качестве лекарственного вещества в фармацевтической композиции по настоящему изобретению, следующий метод можно использовать в способе получения фармацевтической композиции по настоящему изобретению. А именно, в качестве первого этапа, данное лекарственное вещество, данный полимер поверхностного покрытия и данную малую частицу смешивают при значении рН, при котором заряд данного лекарственного вещества и заряд данного полимера поверхностного покрытия имеют одинаковый знак, тем самым позволяя и лекарственному веществу и полимеру поверхностного покрытия быть притянутыми к поверхности малой частицы в результате нековалентного взаимодействия, такого как электростатическое взаимодействие. Дополнительно, в качестве второго этапа, значение рН данной смеси изменяют до рН, при котором лекарственное вещество меняет свой заряд на противоположный знак, таким образом эффективно формируя связь между данным лекарственным веществом и полимером поверхностного покрытия, объединенными на поверхности данной малой частицы в результате электростатического взаимодействия, в результате чего фармацевтическая композиция по настоящему изобретению может быть эффективно произведена. Этот способ получения является полезным, поскольку можно исключить образование свободного комплекса полимер поверхностного покрытия - лекарственное вещество (не зафиксированного на поверхности малой частицы) в качестве побочного продукта.
При иллюстрации этого способа на примере инсулина (лекарственное вещество; изоэлектрическая точка: приблизительно 5,3), хитозан (полимер поверхностного покрытия) и малая частица PLGA (малая частица), например, инсулин, зитозан и малая частица PLGA смешаны при «значении рН меньше изоэлектрической точки», когда инсулин имеет положительный заряд (например, pH 4,5 и тому подобное), затем значение рН изменяют до «рН выше изоэлектрической точки», при котором инсулин имеет отрицательный заряд (рН 6,0 и тому подобное). В то время как хитозан имеет положительный заряд и частица PLGA имеет отрицательный заряд при обоих значениях рН 4,5 и рН 6,0, инсулин имеет положительный заряд при рН 4,5 и отрицательный заряд при рН 6,0. Следовательно, может быть получена одна из композиций по настоящему изобретению, в которой взаимно ионосвязанные хитозан и инсулин зафиксированы на поверхности малой частицы PLGA при значении рН 6,0. На фиг.1 представлено разъяснение этого варианта осуществления.
Соответственно, настоящее изобретение обеспечивает способ получения композиции по настоящему изобретению, включающий
(a) смешивание данного лекарственного вещества, данного полимера поверхностного покрытия и данной малой частицы при значении рН, при котором данное лекарственное вещество и данный полимер поверхностного покрытия имеют заряд с одинаковым знаком, и затем
(b) доведение значение рН данной смеси до рН, при котором данное лекарственное вещество меняет знак своего заряда на противоположный,
где данное лекарственное вещество представляет собой амфотерное лекарственное вещество.
Альтернативно, в качестве еще одного способа получения, в особенности пригодного для сведения к минимуму размера малой частицы для поверхностного покрытия в качестве продукта, посредством уменьшения размера данной коровой частицы, можно использовать следующий способ. В этом способе подготовка данной малой частицы и электростатическое взаимодействие между данной малой частицей и полимером поверхностного покрытия начаты одновременно, а не готовится заранее малая частица. В частности, в этом способе подходящий органический растворитель (например, раствор ацетона и тому подобное), содержащий вещество данной малой частицы, как упомянуто выше, добавляют по капле в водный раствор данного полимера поверхностного покрытия, и данный органический растворитель выпаривают из данного раствора посредством перемешивания и тому подобного, в результате чего начинается формирование малой частицы в качестве коровой частицы и покрытие данной малой частицы полимером поверхностного покрытия; после чего добавляют лекарственное вещество и смешивают, значение рН, при желании, изменяют для обеспечения электростатического взаимодействия между лекарственным веществом и полимером поверхностного покрытия, и между полимером поверхностного покрытия и малой частицей, в результате чего получают малую частицу с поверхностным покрытием.
Соответственно, настоящее изобретение обеспечивает способ получения композиции по настоящему изобретению, включающий
(a) добавление по капле раствора вещества малой частицы в органическом растворителе в водный раствор полимера поверхностного покрытия,
(b) выпаривание органического растворителя,
(c) добавление лекарственного вещества и перемешивание данной смеси, и
(d) доведение рН данной смеси до предопределенного значения рН.
Несмотря на то, что настоящее изобретение здесь далее подробно объясняется со ссылкой на Примеры и Экспериментальные Примеры, настоящее изобретение не ограничено следующими Примерами и тому подобным.
ПРИМЕРЫ
Подготовительный Пример 1: Подготовка сополимера поли(молочная кислота-гликолевая кислота) (PLGA) малых частиц с различными размерами частиц
Малые частицы PLGA были получены, используя PLGA с соотношением лактид:гликолид 50:50 (RESOMER RG 502H, Bohringer Ingelheim). PLGA разводили в ацетоне степени очистки ВЭЖХ при необходимой концентрации. Раствор PLGA/ацетон добавляли по капле в очищенную воду в соотношении 1:3 при постоянном перемешивании. Данную смесь перемешивали до тех пор, пока ацетон полностью не испарился (приблизительно 4 часа).
Распределение полученных малых частиц по размерам оценивали с помощью прибора для измерения динамического рассеяния света (DLS 802, Viscotek). В таблице 1 представлена взаимозависимость между концентрацией PLGA и диаметром полученной частицы. Совершенно ясно, что посредством уменьшения концентрации полимера в исходном растворе органического растворителя, более малые частицы могут быть с легкостью и воспроизводимо получены.
Пример 1: Получение системы малых частиц с поверхностным покрытием из комплекса лекарственное вещество - полимер поверхностного покрытия в двух различным буферных системах
Инсулин (pI около 5,3) использовали в качестве белкового лекарственного средства и хитозан использовали в качестве положительно заряженного полимера поверхностного покрытия.
1,5 мл бычьего инсулина (Sigma, 160 мкг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) добавляли к 1,5 мл хитозана (Bioneer 143 кДа, 0,72 мг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) и данную смесь оставляли при комнатной температуре по меньшей мере на 30 мин. Три мл суспензии малых частиц PLGA (диаметр приблизительно 100 нм; в дальнейшем также называемая «PLGA 100») в 0,5 мМ растворе лимонной кислоты (pH 4,5; концентрация малых частиц PLGA: 500 мкг/мл), приготовленной как описано в Подготовительном Примере 1, добавляли к раствору хитозан/инсулин и данную смесь оставляли при комнатной температуре по меньшей мере на 1 час. Значение pH повышали до 6,0 с помощью NaOH (0,1-2,5N), и добавляли в него соли и дополнительные ингредиенты для обеспечения таких же составов растворителей данной суспензии, как у буферов, описанных в Таблице 2 или Таблице 3.
Размер и дзэта-потенциал малых частиц с поверхностным покрытием измеряли с помощью DLS 802 (Viscotek) и Zeta sizer 2000 (Malvern), соответственно (Таблица 4).
Как можно видеть в Таблице 4, схожие и предпочтительные размеры частиц и дзэта-потенциалы были получены для двух различных буферных систем. Каждый из двух типов малых частиц с поверхностным покрытием имел средний размер приблизительно двухкратный от размера малых частиц без покрытия, и высоко положительный дзета-потенциал. Обнаружено, что оба типа малых частиц с поверхностным покрытием стабильны в виде коллоидных суспензий.
Пример 2: Получение системы малых частиц с поверхностным покрытием из комплекса лекарственное вещество-полимер поверхностнго покрытия в 20 мМ буферной системе MES с двумя различными концентрациями инсулина
Инсулин (pI около 5,3) использовали в качестве белкового лекарственного средства и хитозан использовали в качестве положительно заряженного полимера поверхностного покрытия.
Два мл бычьего инсулина (Sigma, 160 мкг/мл или 800 мкг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) добавляли к 2 мл хитозана (Bioneer 143 кДа, 0,72 мг/мл или 3,6 мг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) и данную смесь оставляли при комнатной температуре по меньшей мере на 30 мин. Четыре мл суспензии малых частиц PLGA (диаметр приблизительно 100 нм) в 0,5 мМ растворе лимонной кислоты (pH 4,5; концентрация малых частиц PLGA: 0,5 мг/мл или 2,5 мг/мл), приготовленной как описано в Подготовительном Примере 1, добавляли к раствору хитозан/инсулин и данную смесь оставляли при комнатной температуре по меньшей мере на 1 час. Значение pH повышали до 6,0 с помощью NaOH (0,1-2,5N) и добавляли соли и дополнительные ингредиенты для обеспечения такого же состава данной суспензии, как у буфера, описанного в Таблице 5.
Размер и дзэта-потенциал малых частиц с поверхностным покрытием измеряли с помощью DLS 802 (Viscotek) и Zeta sizer 2000 (Malvern), соответственно. Оба образца малых частиц с поверхностным покрытием продемонстрировали предпочтительный размер частиц и дзета-потенциал (Таблица 6); размер частиц был приблизительно двукратным по сравнению с частицами без покрытия (Таблица 4) и дзета-потенциал был в высокой степени положительным потенциалом. Обнаружено, что оба типа малых частиц с поверхностным покрытием стабильны в виде коллоидных суспензий.
Пример 3: Получение системы малых частиц PLGA с поверхностным покрытием с использованием поли-L-аргинина в качестве полимера поверхностного покрытия
Инсулин (pI около 5,3) использовали в качестве белкового лекарственного средства и поли-L-аргинин использовали в качестве положительно заряженного полимера поверхностного покрытия.
3 мл бычьего инсулина (Sigma, 40 мкг/мл) в 0,5 мМ растворе лимонной кислоты (pH 6,0) добавляли к 3 мл поли-L-аргинина (ММ 125 кДа, Sigma, 2,88 мг/мл) в 0,5 мМ растворе лимонной кислоты (pH 6,0) и данную смесь оставляли при комнатной температуре по меньшей мере на 30 мин. 6 мл суспензии малых частиц PLGA (диаметр приблизительно 100 нм) в 0,5 мМ растворе лимонной кислоты (pH 6,0; концентрация малых частиц PLGA: 250 мкг/мл), приготовленной как описано в Подготовительном Примере 1, добавляли к раствору поли-L-аргинин/инсулин и данную смесь оставляли при комнатной температуре по меньшей мере на 1 час. Добавляли в полученную смесь соли и дополнительные ингредиенты для обеспечения такого же состава данной суспензии, как у буфера, описанного в Таблице 5. Размер и дзета-потенциал малых частиц с поверхностным покрытием измеряли с помощью DLS 802 (Viscotek) и Zeta sizer 2000 (Malvern), соответственно. Средний диаметр данных частиц составлял 285,9±90,6 нм, и дзета-потенциал составлял +48,3±0,9 мВ.
Пример 4: Получение системы малых частиц PLGA с поверхностным покрытием с использованием хитозана и поли-L-аргинина в качестве полимеров поверхностного покрытия
Инсулин (pI около 5,3) использовали в качестве белкового лекарственного средства и хитозан и поли-L-аргинин использовали в качестве положительно заряженных полимеров поверхностного покрытия.
2 мл бычьего инсулина (Sigma, 800 мкг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) добавляли к 2 мл смеси хитозана (ММ 143 кДа, 0,36 мг/мл) и поли-L-аргинина (ММ 125 кДа, Sigma; 1,8 мг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) и данную смесь оставляли при комнатной температуре по меньшей мере на 30 мин. 4 мл суспензии малых частиц PLGA (диаметр приблизительно 100 нм) в 0,5 мМ растворе лимонной кислоты (pH 4,5; концентрация малых частиц PLGA: 2,5 мг/мл), приготовленной как описано в Подготовительном Примере 1, добавляли к раствору хитозан/поли-L-аргинин/инсулин и данную смесь оставляли при комнатной температуре по меньшей мере на 1 час. Добавляли в полученную смесь соли и дополнительные ингредиенты для обеспечения такого же состава данной суспензии, как у буфера, описанного в Таблице 7. Размер и дзета-потенциал малых частиц с поверхностным покрытием измеряли с помощью DLS 802 (Viscotek) и Zeta sizer 2000 (Malvern), соответственно. Средний диаметр данных частиц составлял 336,1±20,8 нм, и дзета-потенциал составлял +40,3±3,4 мВ.
Пример 5: Получение системы малых частиц PLGA с поверхностным покрытием инсулин/хитозан с использованием другого способа получения
3 мл 0,1% вес/объем полистирольных малых частиц (MolecularProbe, карбоксилатные FluoSpheres) в 0,5 мМ растворе лимонной кислоты (pH 4,5) добавляли к 3 мл хитозана (Bioneer 143 кДа, 180 мкг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) и данную смесь оставляли при комнатной температуре по меньшей мере на 1 час. 6 мл бычьего инсулина (Sigma, 20 мкг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) добавляли к вышеуказанной смеси полистирола и хитозана, и полученную смесь оставляли при комнатной температуре по меньшей мере на 1 час. Значение рН повышали до 6,0 посредством добавления NaOH (0,1-2,5N) и соли и дополнительные ингредиенты добавляли в данный раствор для обеспечения такого же состава данной суспензии, как у буфера, описанного в Таблице 5.
Размер и дзета-потенциал малых частиц с поверхностным покрытием измеряли с помощью DLS 802 (Viscotek) и Zeta sizer 2000 (Malvern), соответственно. Средний диаметр данных частиц составлял 302,0±68,6 нм, и дзета-потенциал составлял +27,9±1,7 мВ. Диаметр полистирольных коровых частиц составлял 196,7±27,5 нм, что показывает наличие слоя с толщиной приблизительно 50 нм вокруг перефирии данных полистирольных коровых частиц.
Пример 6: Получение системы малых частиц PLGA с поверхностным покрытием инсулин/хитозан с использованием другого способа получения
1,8 мл PLGA с соотношением лактид:гликолид 50:50 (RESOMER RG 502H, Bohringer Ingelheim) в растворе ацетона (PLGA 0,01% (вес/объем): концентрация, при которой частицы PLGA около 20 нм можно получить) добавляли к 6 мл хитозана (Bioneer 73 кДа, 0,25 мг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) и полученную смесь оставляли при комнатной температуре до тех пор, пока ацетон полностью не испарится. Три мл бычьего инсулина (Sigma, 160 мкг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) добавляли к 3 мл суспензии PLGA/хитозан и данную смесь оставляли при комнатной температуре по меньшей мере на 1 час. Значение pH повышали до 6,0 с помощью NaOH (0,1-2,5N) и добавляли соли и дополнительные ингредиенты для обеспечения такого же растворенного состава данной суспензии, как у буфера, описанного в Таблице 2. Размер малых частиц с поверхностным покрытием измеряли с помощью DLS 802 (Viscotek). Средний диаметр данных частиц составлял 146,1±35,8 нм. Данные частицы были стабильны в виде коллоидной суспензии.
Пример 7: Получение системы малых частиц PLGA с поверхностным покрытием инсулин/хитозан для проведения испытания на животных
Инсулин (pI приблизительно 5,3) использовали в качестве белкового лекарственного средства и хитозан использовали в качестве положительно заряженного полимера поверхностного покрытия. Образец был приготовлен в высокой концентрации (концентрация инсулина 6 мг/мл) для испытания на животных.
Водный раствор бычьего инсулина (15 мл, Sigma, 320 мкг/мл, pH 4,5) и 0,02 мл 50 мМ водного раствора лимонной кислоты добавляли к 15 мл водного раствора хитозана (изготовленный Koyo Chemical, Koyo Chitosan FL-80, 1,44 мг/мл, pH 4,5), значение pH доводили до 4,5±0,1 и данную смесь оставляли отстаиваться в течение приблизительно 1 часа. Затем добавляли 30 мл суспензии малых частиц PLGA (размер частиц приблизительно 100 нм, концентрация малых частиц PLGA 1 мг/мл, pH 4,5) и 0,02 мл 50 мМ водного раствора лимонной кислоты и значение pH доводили до 4,5. Полученный раствор оставляли отстаиваться в течение 1 часа, значение pH доводили до 6,0, в данном растворе разводили мальтозу (0,421 г) и подтверждали значение pH 6. Приготовленный таким образом раствор замораживали в жидком азоте, а затем лиофилизировали. Данный лиофилизированный продукт диспергировали снова в дистиллированной воде в объеме, эквивалентном 1/15 объема раствора до лиофилизации. Данную ресуспензию подвергали центрифугированию (19400×G, 3 часа, 4°C) и удаляли 4/5 объема супернатанта, в результате чего фракция частиц была концентрирована для получения образца для исследований на животных (концентрация инсулина 6 мг/мл).
Размер и дзета-потенциал малых частиц с поверхностным покрытием измеряли с помощью Zeta sizer Nano (Malvern). Средний диаметр данных частиц составлял 252 нм, и дзета-потенциал составлял +10,6 мВ. Данные частицы были стабильны в виде коллоидных суспензий. Дополнительно, соотношение инсулина, связанного с частицами с поверхностным покрытием в этом Примере, было определено с использованием способа, описанного ниже, для обнаружения степени загрузки 93%.
Пример 8: Получение системы малых частиц PLGA с поверхностным покрытием хитозан/инсулин для испытания при выпуске продукции
Инсулин (pI приблизительно 5,3) использовали в качестве белкового лекарственного средства и хитозан использовали в качестве положительно заряженного полимера поверхностного покрытия.
Водный раствор бычьего инсулина (15 мл, Sigma, 320 мкг/мл, pH 4,5) и 0,02 мл 50 мМ водного раствора лимонной кислоты добавляли к 15 мл водного раствора хитозана (изготовленный Koyo Chemical, Koyo Chitosan FL-80, 1,44 мг/мл, pH 4,5), значение pH доводили до 4,5±0,1 и данную смесь оставляли отстаиваться в течение приблизительно 1 часа. Затем добавляли 30 мл суспензии малых частиц PLGA (размер частиц приблизительно 100 нм, концентрация малых частиц PLGA 1 мг/мл, pH 4,5) и 0,02 мл 50 мМ водного раствора лимонной кислоты и значение pH доводили до 4,5. Полученный раствор оставляли отстаиваться в течение 1 часа, значение pH доводили до 6,0, в данном растворе разводили мальтозу (0,421 г) и подтверждали значение pH 6.
Пример 9: Получение системы малых частиц PLGA с поверхностным покрытием (рН 8) с использованием катионного производного хитозана в качестве полимера поверхностного покрытия
Инсулин (pI приблизительно 5,3) использовали в качестве белкового лекарственного средства, и катионное производное хитозана использовали в качестве положительно заряженного полимера поверхностного покрытия.
Два мл бычьего инсулина (Sigma, 0,32 мг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) добавляли к 2 мл катионного производного хитозана (производство компании Dainichiseika, раствор катионного производного хитозана, 1,44 мг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) и данную смесь оставляли отстаиваться при комнатной температуре по меньшей мере в течение 30 минут. Четыре мл суспензии малых частиц PLGA (диаметр приблизительно 100 нм), которые были получены способом, описанным в Подготовительном Примере 1, в 0,5 мМ лимонной кислоте (pH 4,5; концентрация малых частиц PLGA: 1,0 мг/мл) добавляли в раствор катионное производное хитозана/инсулин, и данную смесь оставляли отстаиваться при комнатной температуре по меньшей мере в течение 1 часа. В данный раствор добавляли мальтозу до 10% вес/объем и значение рН доводили до 8 с помощью NaOH.
Размер малых частиц с поверхностным покрытием определяли с помощью Zeta sizer Nano (Malvern). Средний диаметр частиц составлял 230 нм. Обнаружено, что данные частицы были стабильны в виде коллоидных суспензий. Дополнительно, соотношение инсулина, связанного с частицами с поверхностным покрытием в этом Примере, было определено с использованием способа, описанного ниже, для обнаружения степени загрузки 74% вес/вес.
Пример 10: Получение системы малых частиц PLGA с поверхностным покрытием (рН 7) с использованием катионного производного хитозана в качестве полимера поверхностного покрытия
Инсулин (pI приблизительно 5,3) использовали в качестве белкового лекарственного средства и катионное производное хитозана использовали в качестве положительно заряженного полимера поверхностного покрытия.
Два мл бычьего инсулина (Sigma, 0,32 мг/мл) в 0,5 мМ растворе лимонной кислоты (pH 7,0) добавляли к 2 мл катионного производного хитозана (производство компании Dainichiseika, раствор катионного производного хитозана, 1,44 мг/мл) в 0,5 мМ растворе лимонной кислоты (pH 7,0) и данную смесь оставляли отстаиваться при комнатной температуре по меньшей мере в течение 30 минут. Четыре мл суспензии малых частиц PLGA (диаметр приблизительно 100 нм), которые были получены способом, описанным в Подготовительном Примере 1, в 0,5 мМ лимонной кислоте (pH 7,0; концентрация малых частиц PLGA: 1,0 мг/мл) добавляли в раствор катионное производное хитозана/инсулин и данную смесь оставляли отстаиваться при комнатной температуре по меньшей мере в течение 1 часа. В данный раствор добавляли мальтозу до 10% вес/объем, и подтверждали значение рН 7.
Размер и дзета-потенциал малых частиц с поверхностным покрытием определяли с помощью Zeta sizer Nano (Malvern). Средний диаметр частиц составлял 234 нм, и дзета-потенциал был равен +11,3 мВ. Обнаружено, что данные частицы были стабильны в виде коллоидных суспензий. Дополнительно, количество инсулина, связанного с частицами с поверхностным покрытием в этом Примере, было определено с использованием описанного ниже способа для обнаружения степени загрузки, было равно 65% вес/вес.
Пример 11: Получение системы малых частиц с поверхностным покрытием с использованием положительно заряженного лекарственного вещества и отрицательно заряженного полимера поверхностного покрытия
Золмитриптан (pKa=9,5) использовали в качестве положительно заряженного низкомолекулярного лекарственного средства и полиакриловую кислоту использовали в качестве отрицательно заряженного полимера поверхностного покрытия.
Четыре мл водного раствора модифицированных триметиламином полистирольных частиц (1 мг/мл, микромер NR3+ 100 нм, Corefront Corporation) добавляли к 2 мл водного раствора полиакриловой кислоты (производство компании Wako Pure Chemical Industries, средняя молекулярная масса 250000, 1,44 мг/мл) и данную смесь осторожно перемешивали. Приблизительно через 1 час 2 мл водного раствора золмитриптана (640 мкг/мл) добавляли в данную смесь и доводили значение рН до 6,0.
Размер и дзета-потенциал малых частиц с поверхностным покрытием определяли с помощью Zeta sizer Nano (Malvern). Средний диаметр частиц составлял 330 нм, и дзета-потенциал составлял -75 мВ. Обнаружено, что данные частицы были стабильными в виде коллоидных суспензий. Дополнительно, количество лекарственного средства, связанного с частицами с поверхностным покрытием в этом Примере, было определено с использованием описанного ниже способа для обнаружения степени загрузки (при различных ВЭЖХ условиях), было равно 14% вес/вес.
Пример 12: Получение системы малых частиц с поверхностным покрытием с использованием положительно заряженного лекарственного вещества и отрицательно заряженного полимера поверхностного покрытия
Бромгексина гидрохлорид использовали в качестве положительно заряженного низкомолекулярного лекарственного средства и полиакрилат натрия использовали в качестве отрицательно заряженного полимера поверхностного покрытия.
Один мл водного раствора бромгексина гидрохлорида (640 мкг/мл) и 1 мл дистиллированной воды добавляли к 2 мл водного раствора полиакрилата натрия (степень полимеризации 2700-7500, производство компании Wako Pure Chemical Industries, 1,44 мг/мл) и данную смесь осторожно перемешивали. Приблизительно через один час 4 мл водной суспензии модифицированных триметиламином полистирольных частиц (1 мг/мл, микромер NR3+ 100 нм, Corefront Corporation) добавляли в данную смесь, осторожно перемешивали и доводили значение рН до 6.
Размер и дзета-потенциал малых частиц с поверхностным покрытием определяли с помощью Zeta sizer Nano (Malvern). Средний диаметр частиц составлял 160 нм, и дзета-потенциал составлял -57 мВ. Обнаружено, что данные частицы были стабильными в виде коллоидных суспензий. Дополнительно, количество лекарственного средства, связанного с частицами с поверхностным покрытием в этом Примере, было определено с использованием описанного ниже способа для обнаружения степени загрузки (при различных ВЭЖХ условиях), было равно 88% вес/вес.
Пример 13: Получение системы малых частиц с поверхностным покрытием с использованием положительно заряженного лекарственного средства и отрицательно заряженного полимера поверхностного покрытия
Бромгексина гидрохлорид использовали в качестве положительно заряженного низкомолекулярного лекарственного средства, и поли-гамма-глутамат натрия использовали в качестве отрицательно заряженного полимера поверхностного покрытия.
Один мл водного раствора бромгексина гидрохлорида (640 мкг/мл) и 1 мл дистиллированной воды добавляли к 2 мл водного раствора поли-гамма-глутамата натрия (средняя молекулярная масса 200000-500000, производство компании Wako Pure Chemical Industries, 1,44 мг/мл) и данную смесь осторожно перемешивали. Приблизительно через один час 4 мл водной суспензии модифицированных триметиламином полистирольных частиц (1 мг/мл, микромер NR3+ 100 нм, Corefront Corporation) добавляли в данную смесь, осторожно перемешивали и доводили значение рН до 6.
Размер и дзета-потенциал малых частиц с поверхностным покрытием определяли с помощью Zeta sizer Nano (Malvern). Средний диаметр частиц составлял 203 нм, и дзета-потенциал составлял -63 мВ. Обнаружено, что данные частицы были стабильными в виде коллоидных суспензий. Дополнительно, количество лекарственного средства, связанного с частицами с поверхностным покрытием в этом Примере, было определено с использованием описанного ниже способа для обнаружения степени загрузки (при различных ВЭЖХ условиях), было равно 32% вес/вес.
Экспериментальный Пример 1: Оценка взаимодействия лекарственного вещества и полимера поверхностного покрытия на поверхности малых частиц
Один мл суспензии малых частиц PLGA с поверхностным покрытием инсулин/хитозан (PLGA 100/хитозан/инсулин=500/360/80 мкг/мл) в буфере, описанном в Таблице 5, помещали в микропробирку и центрифугировали при 18000 об./мин (23900×g) в течение 60 мин. Осадок ополаскивали с помощью буфера, описанного в Таблице 5. После добавления к осадку буферов для высвобождения со значением рН 4,5 или 6,0 каждую пробирку встряхивали при комнатной тепературе в течение 2 часов. Суспензию центрифугировали еще раз при тех же условиях в течение 15 мин и собирали супернатант. Затем концентрация инсулина в каждом супернатантном буфере была количественно определена посредством ELISA (ИФА).
Показано, что при значении рН буфера 4,5, при котором оба, и хитозан, и инсулин, имеют положительный заряд, и вследствие этого их взаимное притяжение, обусловленное электростатическими силами, было низким, количество инсулина было заметно более высоким, чем при рН 6,0, при котором хитозан и инсулин имеют противоположные заряды, и, следовательно, электростатические силы притяжения становятся более сильными (фиг.2). Следует отметить, что свободные инсулин и хитозан были удалены в результате вышеупомянутой промывки перед испытанием при выпуске продукции. Эти результаты демонстрируют присутствие комплекса хитозан/инсулин на поверхности малых частиц.
Один мл суспензии малых частиц PLGA с поверхностным покрытием инсулин/хитозан (PLGA 100/хитозан/инсулин=250/180/40 мкг/мл) в буфере, описанном в Таблице 2, полученной методом, описанным в Примере 1, помещали в микропробирку и центрифугировали при 18000 об./мин (23900×g) в течение 60 мин. Осадок промывали с помощью буфера, описанного в Таблице 2. После промывки данный осадок ресуспендировали в буфере, наносили на стеклянную пластину и высушивали естественным образом в течение 48 часов для получения образца для TOF-SIMS. В качестве контроля для сравнения также были подготовлены стеклянные пластины с нанесенными на них образцами инсулина, хитозана или PLGA 100, полученных методом, описанным в Подготовительном Примере 1.
Каждый из этих образцов был оценен с помощью прибора TOF-SIMS IV (ION-TOF GmbH) на наличие или отсутствие пика (m/z=33), соответствующего SH-группе остатка цистеина в инсулине. В результате, значительный уровень пика m/z=33 не был обнаружен в PLGA и хитозане. Однако, интенсивный пик был обнаружен в вышеуказанном образце малых частиц с поверхностным покрытием после отмывки и в образце инсулина. Результаты измерений для каждого образца представлены в верхней панели на фиг.3.
Кроме того, распределение m/z=33 (нижняя левая панель на фиг.3) и общее ионное распределение (нижняя правая панель на фиг.3) в поле наблюдения также были подтверждены для вышеупомянутых малых частиц с поверхностным покрытием после промывки, и также было подтверждено, что модели распределения обоих совпадают, то есть определение m/z=33 от частиц.
Вышеуказанные результаты измерений, относящиеся к специфичности, и результаты изображений распределения частиц свидетельствуют о наличии инсулина на поверхности малых частиц с поверхностным покрытием после промывки.
Экспериментальный Пример 2: Оценка степени нагрузки лекарственным веществом и нагрузочной способности
Образцы, используемые в данных экспериментах, были получены следующим образом.
[PLGA/хитозан/инсулин (1000/720/160 мкг/мл) малая частица с поверхностным покрытием (в буфере, описанном в Таблице 8)]
Инсулин (pI приблизительно 5,3) использовали в качестве белкового лекарственного средства и хитозан использовали в качестве положительно заряженного полимера поверхностного покрытия.
4,5 мл бычьего инсулина (Sigma, 0,64 мг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) добавляли к 4,5 мл хитозана (Bioneer 143 кДа, 2,88 мг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) и данную смесь оставляли при комнатной температуре по меньшей мере приблизительно на 30 мин. Девять мл суспензии малых частиц PLGA (диаметр приблизительно 100 нм) в 0,5 мМ растворе лимонной кислоты (pH 4,5; концентрация малых частиц PLGA: 2,0 мг/мл), приготовленной как описано в Подготовительном Примере 1, добавляли к раствору инсулин/хитозан и данную смесь оставляли при комнатной температуре по меньшей мере на 1 час. Значение рН повышали до 6,0 с помощью NaOH (0,1-2,5N) и добавляли глюкозу для обеспечения такого же состава данной суспензии, как у буфера, описанного в Таблице 8.
Размер и дзета-потенциал малых частиц с поверхностным покрытием определяли с помощью DLS 802 (Viscotek) и Zeta sizer 2000 (Malvern), соответственно. Средний диаметр частиц составлял 248,8±94,2 нм, и дзета-потенциал составлял +8,7±0,5 мВ.
[PLGA/хитозан/инсулин (250/90/40 мкг/мл) малая частица с поверхностным покрытием (в буфере, описанном в Таблице 8)]
Инсулин (pI приблизительно 5,3) использовали в качестве белкового лекарственного средства и хитозан использовали в качестве положительно заряженного полимера поверхностного покрытия.
Три мл бычьего инсулина (Sigma, 160 мкг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) добавляли к 3 мл хитозана (Bioneer 143 кДа, 0,36 мг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) и данную смесь оставляли при комнатной температуре по меньшей мере приблизительно на 30 мин. Шесть мл суспензии малых частиц PLGA (диаметр приблизительно 100 нм) в 0,5 мМ растворе лимонной кислоты (pH 4,5; концентрация малых частиц PLGA: 500 мкг/мл), приготовленной как описано в Подготовительном Примере 1, добавляли к раствору инсулин/хитозан и данную смесь оставляли при комнатной температуре по меньшей мере на 1 час. Значение рН повышали до 6,0 с помощью NaOH (0,1-2,5N) и добавляли глюкозу для обеспечения такого же состава данной суспензии, как у буфера, описанного в Таблице 8.
Размер и дзета-потенциал малых частиц с поверхностным покрытием определяли с помощью DLS 802 (Viscotek) и Zeta sizer 2000 (Malvern), соответственно. Средний диаметр частиц составлял 253,7±31,3 нм, и дзета-потенциал составлял +6,4±1,8 мВ.
[PLGA/поли-L-аргинин/инсулин (125/720/40 мкг/мл) малая частица с поверхностным покрытием (в буфере, описанном в Таблице 5)]
Инсулин (pI приблизительно 5,3) использовали в качестве белкового лекарственного средства и поли-L-аргинин использовали в качестве положительно заряженного полимера поверхностного покрытия.
Три мл бычьего инсулина (Sigma, 160 мкг/мл) в 0,5 мМ растворе лимонной кислоты (pH 6,0) добавляли к 3 мл поли-L-аргинина (ММ 125 кДа, Sigma, 2,88 мг/мл) в 0,5 мМ растворе лимонной кислоты (pH 6,0) и данную смесь оставляли при комнатной температуре по меньшей мере приблизительно на 30 мин. Шесть мл суспензии малых частиц PLGA (диаметр приблизительно 100 нм) в 0,5 мМ растворе лимонной кислоты (pH 6,0; концентрация малых частц PLGA: 250 мкг/мл), приготовленной как описано в Подготовительном Примере 1, добавляли к раствору поли-L-аргинин/инсулин и данную смесь оставляли при комнатной температуре по меньшей мере на 1 час. Были добавлены соли и дополнительные ингредиенты для обеспечения такого же состава данной суспензии, как у буфера, описанного в Таблице 5. Размер и дзета-потенциал малых частиц с поверхностным покрытием определяли с помощью DLS 802 (Viscotek) и Zeta sizer 2000 (Malvern), соответственно. Средний диаметр частиц составлял 497,4±141,9 нм, и дзета-потенциал составлял +44,3±2,1 мВ.
Степень нагрузки и нагрузочная способность были определены способом, описанным далее.
[Метод анализа связанного инсулина]
0,5 мл или 1 мл каждого из вышеупомянутых образцов помещали в 1,5-мл микропробирки и центрифугировали (15000 об./мин (21900×g), 180 мин, 4°C). Собирали супернатант и определяли концентрацию инсулина в данном супернатанте с помощью набора для ИФА инсулина (Mercodia Bovine insulin ELISA) и буфера для разведения (Mercodia Diabetes sample buffer) или ВЭЖХ (концентрация инсулина принимается как A). В качестве контроля, 0,5 мл или 1 мл каждого из вышеуказанных образцов хранили в 1,5-мл микропробирке при 4°С в течение 180 мин, и концентрацию инсулина во всех образцах определяли тем же путем (концентрация инсулина принимается как B).
Степень нагрузки и нагрузочная способность расчитаны следующим образом:
Степень нагрузки (%) = 100×((среднее значение B)-A)/(среднее значение B));
Нагрузочная способность (%) = масса связанного инсулина к общей массе коровых частиц
=100×((среднее значение B)-A)/общая масса коровых частиц
(общая масса коровых частиц=
количество частиц×4/3×3,14×(радиус коровой частицы)3×плотность).
Результаты анализа нагрузки инсулина, полученные вышеуказанным способом, представлены в Таблице 9.
Экспериментальный Пример 3: Оценка стабильности инсулина, образующего комплекс на поверхности малых частиц
Малые частицы с поверхностным покрытием PLGA/хитозан/инсулин (1000/720/160 мкг/мл) в буфере, описанном в Таблице 8, которые использовались в Экспериментальном Примере 2, использовали в качестве образца в настоящем эксперименте. В качестве контроля использовали раствор инсулина с таким же сольвентным составом, как и у буфера, описанного в Таблице 8 (pH 6; концентрация инсулина: 160 мкг/мл).
Образец для применения в ферментативной реакции был приготовлен следующим образом.
α-химотрипсин, полученный из поджелудочной железы быка (Fluka Biochemika; код № 27270), разводили в 5 мМ буфере MES (pH 6,0) до концентрации 40 мкг/мл. 1 мл образца подогревали при 37°C в течение 15 мин и добавляли 0,6 мл 5 мМ буфера MES (рН 6,0), предварительно подогретого таким же способом, и 0,4 мл α-химотрипсина в 5 мМ буфере MES (рН 6,0; концентрация α-химотрипсина: 40 мкг/мл), предварительно подогретого таким же образом. Данную смесь инкубировали, перемешивая встряхиванием при 37°C в течение 30 мин. Ферментативная реакция была остановлена добавлением 1 мл охлажденной на льду ледяной уксусной кислоты. Реакционную смесь перемешивали с помощью мешалки в течение 1 мин, оставляли при комнатной температуре в течение не менее 1 часа и пропускали через фильтр с диаметром 0,1 мкм для получения образца для ВЭЖХ анализа.
Контрольный образец, не содержащий ферменты, получали следующим образом.
1 мл образца смешивали с 1 мл 5 мМ буфера MES (pH 6,0) и 1 мл ледяной уксусной кислоты. Затем данную смесь перемешивали с помощью мешалки в течение 1 мин, оставляли при комнатной температуре не менее чем на 1 час и пропускали через фильтр с диаметром 0,1 мкм для получения образца для ВЭЖХ анализа.
Стандартный образец для калибровочной кривой для количественного анализа инсулина был приготовлен следующим образом.
1 мл раствора инсулина (40-160 мкг/мл) смешивали с 1 мл 5 мМ буфера MES (pH 6,0) и 1 мл ледяной уксусной кислоты, и данную смесь перемешивали с помощью мешалки. Данную смесь использовали в качестве образца для калибровочной кривой для анализа ВЭЖХ.
ВЭЖХ-анализ образцов проводили при следующих условиях:
колонка C18 (Inertsil ODS-2, 5 мкм, 250 м×4,6 мм);
подвижная фаза A: 0,1% водный раствор TFA, подвижная фаза B: 0,1% TFA CH3CN раствор;
градиентные условия (концентрация подвижной фазы B): в 0 мин: 30%, на 10 мин: 40%, на 11 мин: 30%, на 16 мин: 30%;
температура печи колонки: 40°C, скорость потока: 1,0 мл/мин, вводимый объем: 20 мкл, детекция: UV 275 нм.
В результате анализа при вышеуказанных условиях, доля инсулина, оставшегося после ферментативной реакции, составляла 83,9%±2,3% в PLGA/хитозан/инсулин и 61,8%±2,0% в растворе инсулина. Другими словами, только 16,1% инсулина, находящегося в комплексе в поверхностном покрытии, разложилось во время эксперимента, по сравнению с 38,2% для раствора свободного инсулина (фиг.4).
Эти результаты свидетельствуют о значительном увеличении стабильности инсулина относительно ферментативной реакции.
Экспериментальный Пример 4: Оценка переноса инсулина через слизистую оболочку носа свиньи с использованием малой частицы с поверхностным покрытием
Инсулин (pI приблизительно 5,3) использовали в качестве белкового лекарственного средства и хитозан и поли-L-аргинин использовали в качестве положительно заряженных полимеров поверхностного покрытия. Малые частицы с поверхностным покрытием были получены таким же образом, как в Примере 4. В качестве контроля использовали раствор инсулина с таким же сольвентным составом, как буфер, описанный в Таблице 7 (pH 6; концентрация инсулина: 200 мкг/мл). Ткань дыхательной слизистой оболочки носа была выделена из полости носа свиньи (дыхательная область). Перед установкой в камеру горизонтальной диффузии выделенную ткань сохраняли в буфере с таким же составом, как у буфера, использованного в Примере 4 (насыщенный кислородом и охлажденный). Ткань разрезали на кусочки подходящего размера и помещали между донорским отсеком и рецепторным отсеком в камеру горизонтальной диффузии, как показано на Фиг.5 (эффективная поверхность слизистой: 0,79 см2). Свежий (вышеуказанный) буфер (насыщенный кислородом и охлажденный) вливали в донорский отсек и рецепторный отсек, и оба отсека инкубировали в циркулирующей воде, подогретой до 29±1°C, в течение 30 мин, и ткань была уравновешена. Буфер, влитый в донорский отсек и в рецепторный отсек обрабатывали кислородом во время исследования переноса и оба отсека были подогреты с помощью циркулирующей воды до 29±1°C. Жизнеспособность ткани до и после исследования переноса, и отсутствие повреждений было подтверждено посредством пробы с Alamar Blue и определения значения TEER данной ткани.
Исследование переноса было начато посредством замены всего буфера в донорском отсеке на такое же количество каждого образца. 200 мкл образца было взято из рецепторного отсека в выбранные моменты времени и замещено таким же количеством свежего буфера (оксигенированный и подогретый до 29±1°C). Образцы, взятые из рецепторного отсека, были подвергнуты анализу с использованием набора для ИФА инсулина и буфера для разбавления. Результаты анализа представлены на фиг.6. На фиг.6 показано, что более значительное количество инсулина было перенесено через изолированную дыхательную слизистую оболочку, когда были добавлены малые частицы PLGA с поверхностным покрытием хитозан/поли-L-аргинин/инсулин, по сравнению с добавлением контрольного раствора инсулина.
Экспериментальный Пример 5: Определение распределения по размерам малых частиц с поверхностным покрытием
Инсулин (pI около 5,3) использовали в качестве белкового лекарственного средства и хитозан использовали в качестве положительно заряженного полимера поверхностного покрытия.
1,5 мл бычьего инсулина (Sigma, 0,8 мг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) добавляли к 1,5 мл хитозана (Bioneer 143 кДа, 3,6 мг/мл) в 0,5 мМ растворе лимонной кислоты (pH 4,5) и данную смесь оставляли при комнатной температуре по меньшей мере на 30 мин. 3 мл суспензии малых частиц PLGA (диаметр приблизительно 100 нм; в дальнейшем также называемая «PLGA 100») в 0,5 мМ растворе лимонной кислоты (pH 4,5; концентрация малых частиц PLGA: 2,5 мг/мл), приготовленной как описано в Подготовительном Примере 1, или просто 0,5 мМ раствор лимонной кислоты (рН 4,5), добавляли к раствору хитозан/инсулин и данную смесь оставляли при комнатной температуре по меньшей мере на 1 час. Значение pH смеси повышали до 6,0 с помощью NaOH (0,1-2,5N) и добавляли в нее соли и дополнительные ингредиенты для обеспечения такого же сольвентного состава данной суспензии, как у буфера, описанного в Таблице 2. Размер частиц малых частиц с поверхностным покрытием или смеси инсулин/хитозан определяли с помощью DLS 802 (Viscotek).
Результаты представлены на фиг.7. На фиг.7(а) представлено распределение по размеру малых частиц с поверхностным покрытием, и на фиг.7(b) представлено распределение по размерам частиц смеси хитозан/инсулин. Кроме того, в Таблицах 10 и 11 представлены интенсивность в области максимума, процентное содержание, размер частиц и стандартное отклонение каждого из параметров.
Когда были добавлены частицы PLGA, был получен монодисперсный размер частиц. Когда частицы PLGA не добавляли, было получено мультидисперсное распределение частиц по размерам, в том числе частицы больших размеров. Данные результаты выявили, что присутствие коровых частиц обеспечивает малые частицы с поверхностным покрытием с однородным размером частиц.
Экспериментальный Пример 6: Подтверждение возможности разработки рецептуры суспензии малых частиц с поверхностным покрытием в виде сухого порошка
Малые частицы с поверхностным покрытием PLGA100/хитозан/инсулин (250/180/40 мкг/мл) (в буфере, описанном в Таблице 2) были получены способом из Примера 1. Эту суспензию лиофилизировали и ресуспендировали в объеме воды, эквивалентном объему перед лиофилизацией. Размер частиц перед лиофилизацией и размер частиц после лиофилизации и ресуспенидирования были измерены с помощью DLS 802 (Viscotek). Результаты определений размеров частиц представлены на фиг.8. На фиг.8(а) изображено распределение частиц по размеру до лиофилизации, а на фиг.8(b) представлено распределение частиц по размеру после лиофилизации и ресуспендирования. Кроме того, в Таблицах 12 и 13 представлены интенсивность в области максимума, процентное содержание, размер частиц и стандартное отклонение каждого из параметров.
Размер частиц до лиофилизации составлял 183,0±21,2 нм, а размер частиц после лиофилизации и ресуспендирования составлял 229,4±47,9 нм. Результаты демонстрируют, что размер частиц главного компонента не изменяется значительно в результате лиофилизации и ресуспендирования, и явные агрегаты не были образованы. На основании таких результатов очевидно, что малые частицы с поверхностным покрытием по настоящему изобретению можно использовать не только в виде суспензии, но также и в виде других лекарственных форм, таких как сухой порошок и тому подобное.
Экспериментальный Пример 7: Тест in vivo введения малых частиц с поверхностным покрытием в полости носа крыс
Для данного теста использовали крыс (линия: крыса SD, возраст 7 недель, самец, заводчик: Japan SLC). Перед тестом крысам не давали корм с вечера предыдущего дня. Тест проводили в условиях анестезии посредством внутримышечной инъекции и абдоминального вливания. После того как уровень глюкозы крови стабилизировался, образец был введен в носовую полость, и произведен забор образца крови из хвостовой вены через 10, 20, 30, 60, 90 и 120 минут. Уровень глюкозы крови измеряли с помощью набора для определения глюкозы крови (производство компании Terumo, Medisafe Mini).
В качестве образца, малые частицы с поверхностным покрытием, описанные в Примере 7, были введены в носовую полость крыс в дозе 20 мкл/300 г массы тела (400 мкг инсулина/кг массы тела). В качестве контроля, 10% вес/объем раствор мальтозы в 0,5 мМ лимонной кислоте (рН 6) (буферный раствор), раствор инсулина (рН 6: концентрация инсулина: 6 мг/мл, 10% вес/объем мальтоза в 0,5 мМ лимонной кислоте), смесь хитозан/инсулин (pH 6; концентрация хитозана: 27 мг/мл, концентрация инсулина: 6 мг/мл, 10% вес/объем мальтоза в 0,5 мМ лимонной кислоте), каждый имеет такой же сольвентный состав, как в Примере 7, так же были введены в носовую полость крыс.
Результаты теста представлены на фиг.9. На фиг.9 показано, что уровень глюкозы крови резко снижен по сравнению с введением контрольного буферного раствора и раствора инсулина, и изначальный уровень глюкозы крови снижался быстро, даже по сравнению со смесью хитозан/инсулин, и что Примеры по настоящему изобретению характеризуются высококачественным стимулирующим действием на чресслизистую доставку пептидных лекарственных средств.
Экспериментальный Пример 8: In vitro испытание при выпуске продукции с использованием малых частиц с поверхностным покрытием
0,5 мл образца из Примера 8 помещали в 1,5-мл пробирку Эппендорфа и центрифугировали (13600 об./мин (19400×G), 3 ч, 4°C) для получения осадков. В качестве жидкости для испытания при выпуске продукции был подготовлен водный раствор 152 мМ NaCl в 5 мМ MES (pH 6,0, физиологически изотоническая ионная сила 154 мМ).
0,5 мл жидкости для теста высвобождения добавляли к осадку и данный осадок ресуспендировали посредством пипетирования и в смесителе, и полученную дисперсионную систему помещали в стеклянную пробирку объемом 10 мл. Пробирку Эппендорфа споласкивали с помощью 0,5 мл свежей жидкости для теста высвобождения, и данный промывочный раствор также помещали в вышеуказанную стеклянную пробирку (общий объем суспензии 1 мл). Данную стеклянную пробирку, содержащую данную суспензию, встряхивали при 37°C, 75 об./мин для осуществления теста высвобождения. После заданного времени (0, 0,5 и 3 часа) суспензию пропускали через 0,1 мкм фильтр (Sartorius) для получения фильтрата. Данный фильтрат смешивали с 1/2 объема 5% фосфорной кислоты в смесителе для получения образца чистоты ВЭЖХ для анализа количества высвобожденного инсулина.
Для определения количества инсулина до высвобождения 1 мл дистиллированной воды и 0,5 мл 5% фосфорной кислоты добавляли к осадку, смешивали в смесителе и оставляли отстаиваться при 4°C в течение ночи. Данную смесь перемешивали еще раз в смесителе и пропускали через 0,1 мкм фильтр (Sartorius) для получения образца с чистотой ВЭЖХ для количественного определения содержания инсулина в данном осадке.
Количество инсулина было определено с использованием вышеуказанных условий ВЭЖХ-анализа инсулина.
Скорость высвобождения (%) = 100×(содержание инсулина в высвобожденной жидкости/содержание инсулина в осадке до высвобождения)
Результаты теста высвобождения представлены на фиг.10, где почти весь инсулин, содержавшийся в осадке, был высвобожден в течение 3 часов теста высвобождения.
Промышленная применимость
Использование композиции по настоящему изобретению обеспечивает возможность эффективного чресслизистого введения низкомолекулярных лекарственных средств и полимерных лекарственных средств, таких как пептиды и белки, которые до настоящего времени было трудно применять способом, отличным от инъекции. Лекарственное средство, содержащееся в композиции по настоящему изобретению, формирует комплекс с полимером поверхностного покрытия и малой частицей и в результате имеет более высокую стабильность (например, стабильность по отношению к ферментам, сохраняющая стабильность), чем когда содержится в форме растворов препаратов, а также более высокую допустимую нагрузку лекарственным средством по сравнению с препаратами малых частиц, в которых лекарственное средство инкапсулировано в матрикс малой частицы. Кроме того, возможно создать малые частицы с поверхностным покрытием, которые демонстрируют замедленное высвобождение или немедленное высвобождение лекарственного средства, и контролировать чресслизистое всасывание лекарственного средства в соответствии с типом полимера поверхностного покрытия, который образует комплекс с данным лекарственным средством на поверхности данной малой частицы.
Эта заявка основана на патентной заявке №2008-172669 (дата подачи: 1 июля 2008), поданной в Японии, содержание которой в полном объеме включено здесь.
Реферат
Группа изобретений относится к фармацевтике и заключается в обеспечении фармацевтической композиции, которую можно использовать для эффективного введения низкомолекулярных лекарственных веществ и полимерных соединений, таких как пептиды и белки, способом, отличным от инъекции, и способа производства данной композиции. Фармацевтическая композиция для чресслизистого введения включает (a) лекарственное вещество, имеющее положительный или отрицательный заряд при pH композиции после получения, (b) фармацевтически приемлемую малую частицу размером не менее 1 нм и не более 50 мкм и (c) фармацевтически приемлемый полимер поверхностного покрытия, имеющий заряд со знаком, противоположным заряду лекарственного вещества при указанном pH, при этом поверхность частицы покрыта полимером поверхностного покрытия, лекарственное вещество зафиксировано на поверхности данной частицы с помощью полимера поверхностного покрытия и комплекс образован в результате нековалентного взаимодействия между данной малой частицей и полимером поверхностного покрытия и конкурирующего электростатического взаимодействия между полимером поверхностного покрытия и лекарственным веществом. Группа изобретений обеспечивает более высокую стабильность, а также контроль чресслизистого всасывания данного лекарственного вещества. 4 н. и 13 з.п. ф-лы, 8 пр., 13 табл., 10 ил.
Формула
(a) лекарственное вещество, имеющее положительный или отрицательный заряд при pH композиции после получения,
(b) фармацевтически приемлемую частицу, средний размер которой составляет не менее 1 нм и не более 50 мкм, и
(c) фармацевтически приемлемый полимер поверхностного покрытия, имеющий заряд со знаком, противоположным заряду лекарственного вещества при указанном pH, где комплекс образован в результате нековалентного взаимодействия между частицей и полимером поверхностного покрытия и конкурирующего электростатического взаимодействия между полимером поверхностного покрытия и лекарственным веществом таким образом, что поверхность частицы покрыта полимером поверхностного покрытия, лекарственное вещество зафиксировано на поверхности данной частицы с помощью полимера поверхностного покрытия.
(a) смешивание лекарственного вещества, частицы и полимера поверхностного покрытия при значении pH, при котором полимер поверхностного покрытия является легко растворимым в воде, и
(b) доведение значения pH данной смеси до значения pH композиции после получения.
(a) смешивание лекарственного вещества, полимера поверхностного покрытия и частицы в условиях pH, при которых данное лекарственное вещество и данный полимер поверхностного покрытия имеют одинаковый знак заряда, и затем
(b) доведение значения pH данной смеси до pH, при котором знак заряда лекарственного вещества меняется на противоположный, и
где данное лекарственное вещество представляет собой амфотерное лекарственное вещество.
(a) добавление по каплям раствора органического растворителя вещества частицы в водный раствор полимера поверхностного покрытия,
(b) выпаривание данного органического растворителя,
(c) добавление лекарственного вещества и перемешивание смеси, и
(d) доведение значения pH смеси до значения pH композиции после получения.
Документы, цитированные в отчёте о поиске
Способ высокоэффективной доставки аэрозоля с большой терапевтической массой

Комментарии